Похідні бензаміду
Номер патенту: 107702
Опубліковано: 10.02.2015
Автори: Чхой Сун-Хо, Сохн Тхе-Кхьон, Чхо Кхан-Хун, Чхой Сун-Хак, Ім Вєон-Пін, Сун Хюн-Чун, Кхім Сон-Хвє, Кхім Мі-Йон, Сохн Чу-Хє
Формула / Реферат
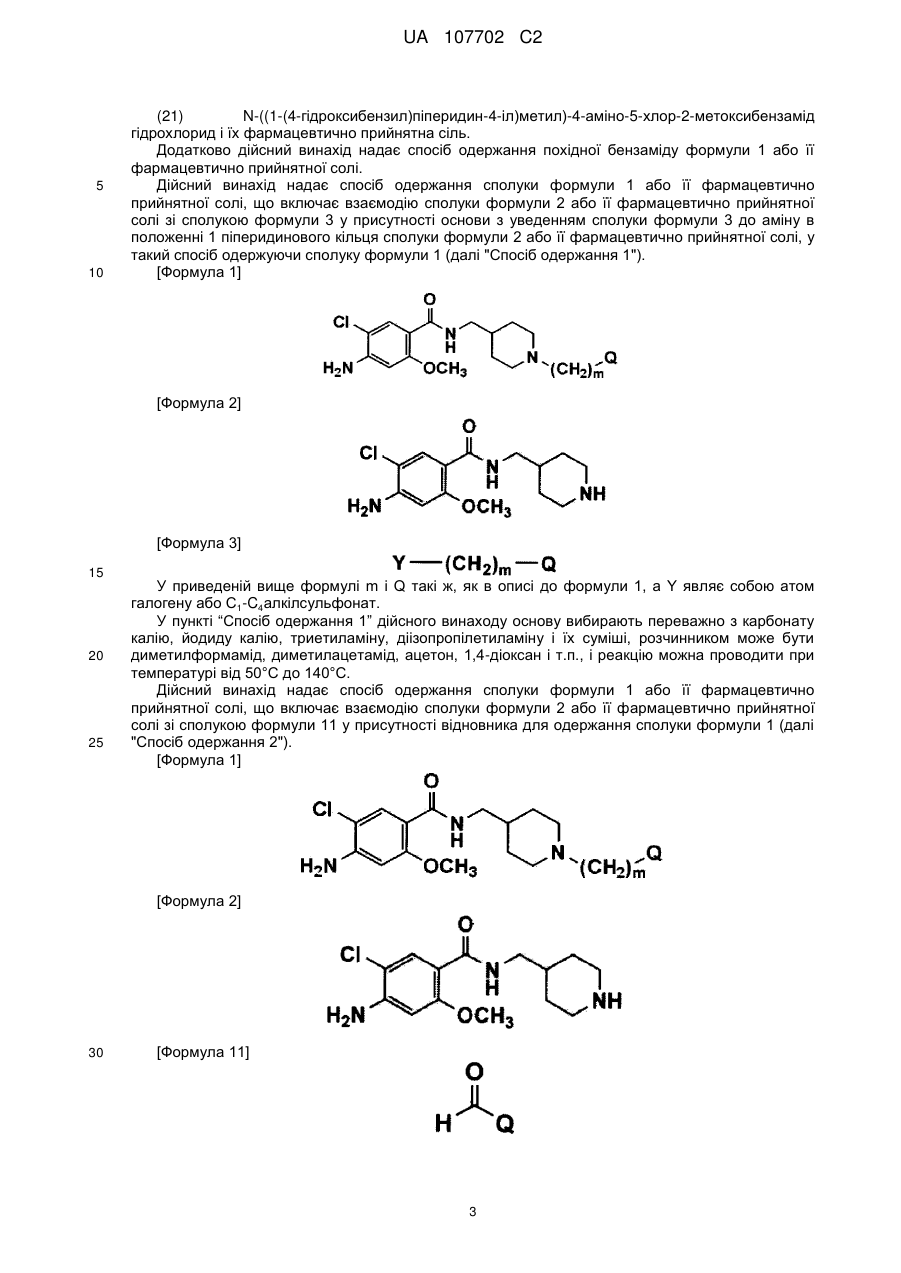
1. Сполука, представлена формулою 1:
[Формула 1]
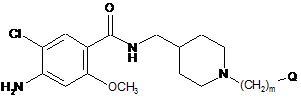 ,
,
де m - ціле число від 1 до 10; Q - моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, де моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, незалежно заміщений 0, 1, 2 або 3 замісниками, вибраними з С1-С4алкілу, С1-С4алкокси, гідрокси та галогену; або її фармацевтично прийнятна сіль.
2. Сполука формули 1 або її фармацевтично прийнятна сіль за п. 1, де сполука формули 1 або її фармацевтично прийнятна сіль є сполукою, вибраною з групи, що складається з наступних сполук:
(1) N-((1-(3-(1,2,4-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(2) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(3) N-((1-(3-(індол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(4) N-((1-(3-(2-метилімідазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(5) N-((1-(5-(індол-1-іл)-пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(6) N-((1-(5-(1,2,3-триазол-1-іл)-пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(7) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(8) N-((1-(3-(l,2,3-тpиaзoл-2-iл)пpoпiл)пiпepидин-4-iл)мeтил)-4-aмiнo-5-xлop-2-метоксибензамід,
(9) N-((1-(піридин-3-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(10) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(11) N-((1-(імідазол-2-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(12) N-((1-((1-метилпірол-2-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(13) N-((1-(2-(індол-3-іл)етил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(14) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид,
(15) N-((1-(5-(1,2,3-триазол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид,
(16) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид,
(17) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид.
3. Спосіб одержання сполуки формули 1 або її фармацевтично прийнятної солі, у якому вводять в реакцію сполуку формули 2 або її фармацевтично прийнятну сіль зі сполукою формули 3 у присутності основи з введенням сполуки формули 3 до аміну в положенні 1 піперидинового кільця сполуки формули 2 або її фармацевтично прийнятної солі, у такий спосіб одержуючи сполуку формули 1;
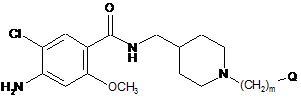 ,
,
[Формула 2]
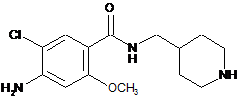 ,
,
[Формула 3]
![]() ,
,
де m і Q такі ж, як визначено в п. 1, a Y являє собою атом галогену або С1-С4алкілсульфонат.
4. Спосіб за п. 3, де основу вибирають з карбонату калію, йодиду калію, триетиламіну, діізопропілетиламіну і їх суміші.
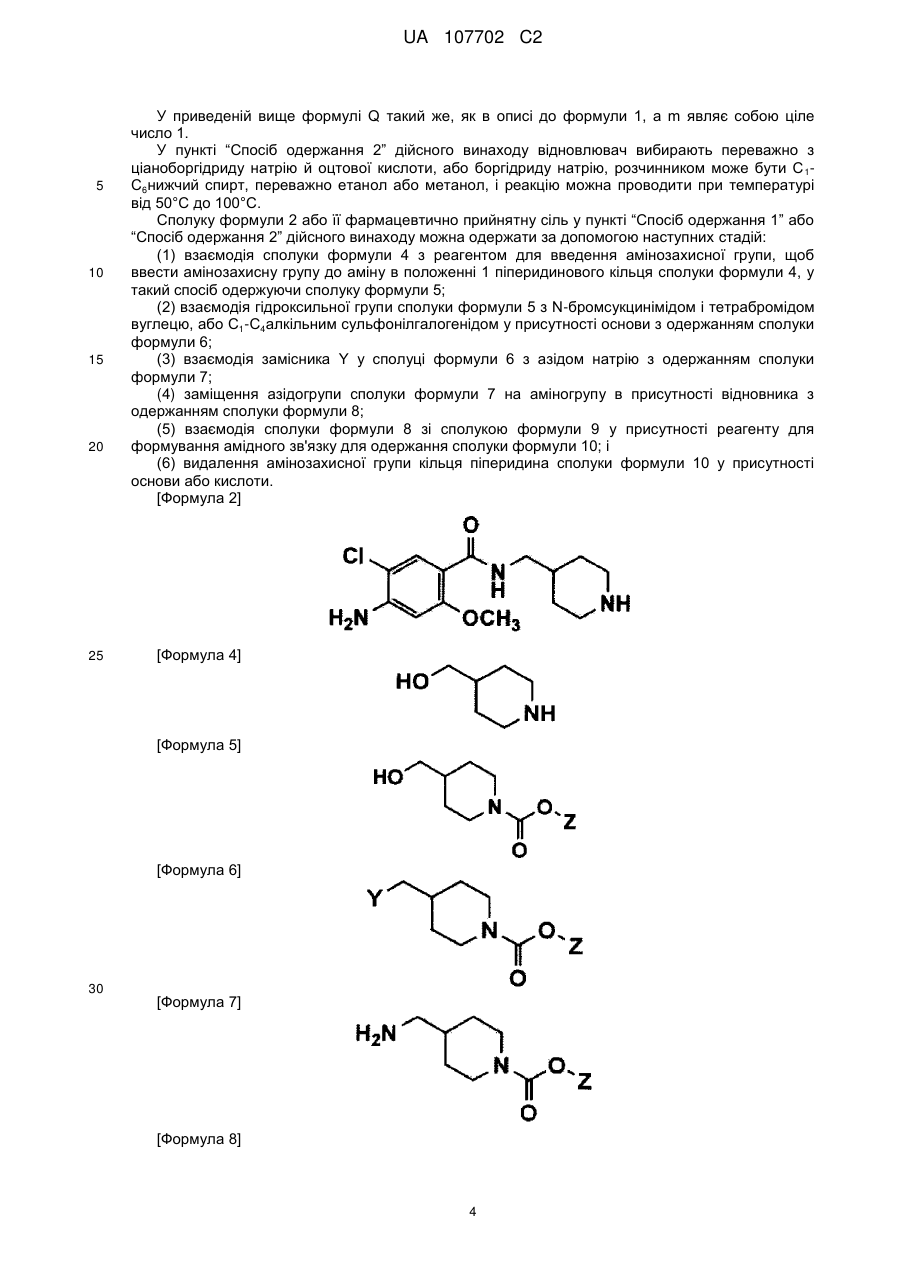
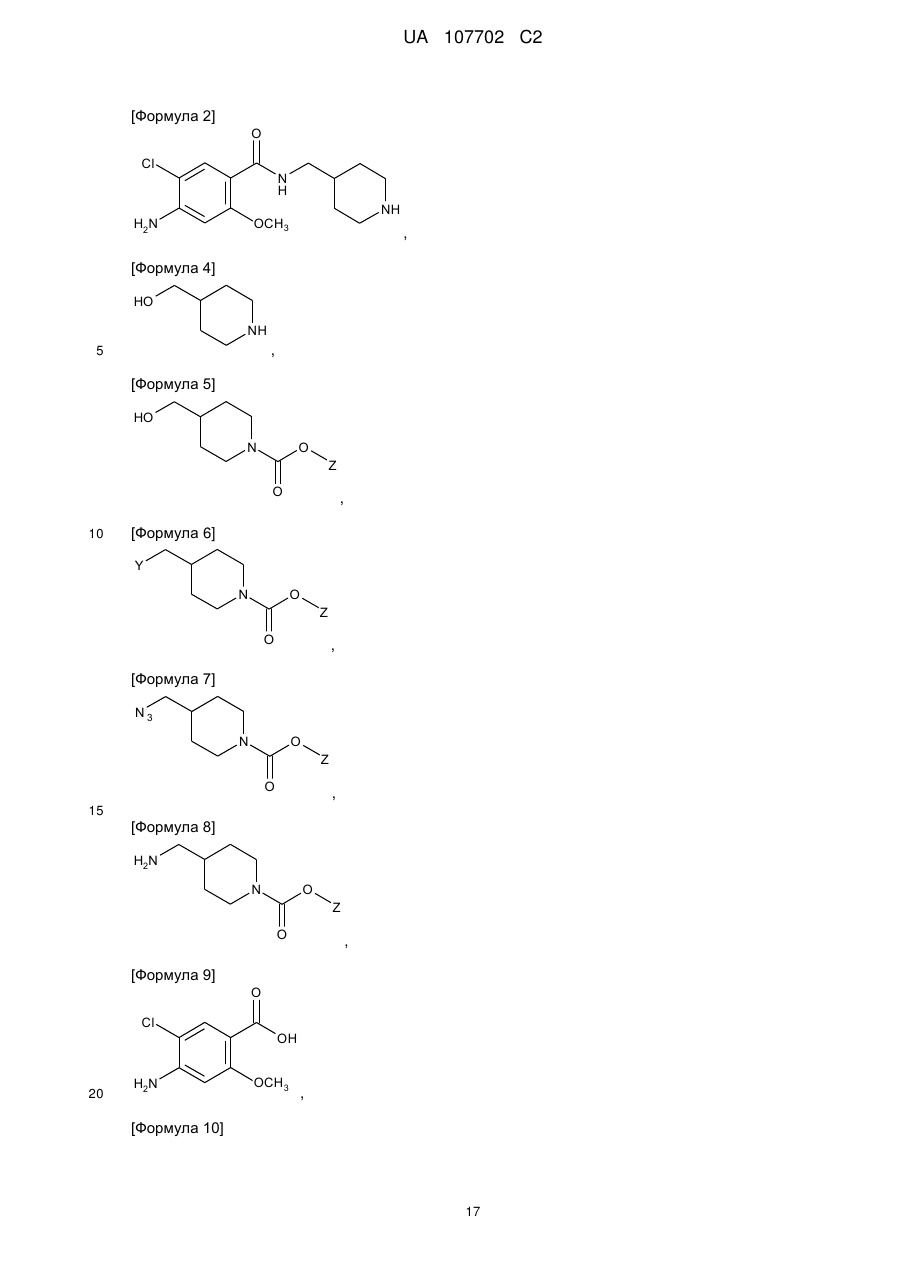
5. Спосіб за п. 3, де сполуку формули 2 або її фармацевтично прийнятну сіль одержують за допомогою таких стадій:
(1) вводять в реакцію сполуку формули 4 з реагентом для введення амінозахисної групи, щоб ввести амінозахисну групу до аміну в положенні 1 піперидинового кільця сполуки формули 4, у такий спосіб одержуючи сполуку формули 5;
(2) вводять в реакцію гідроксильну групу сполуки формули 5 з N-бромсукцинімідом і тетрабромідом вуглецю або С1-С4алкільним сульфонілгалогенідом у присутності основи з одержанням сполуки формули 6;
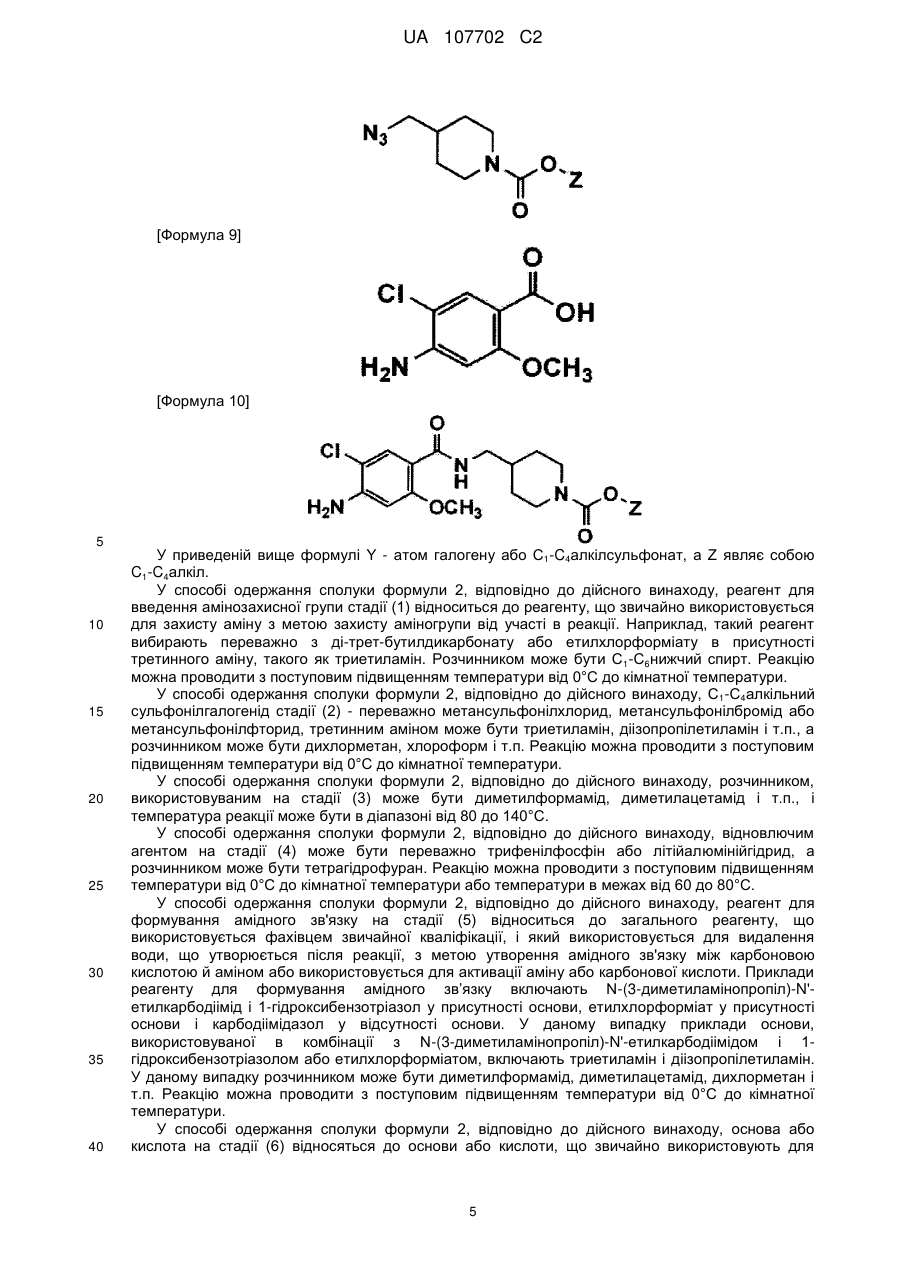
(3) вводять в реакцію замісник Y сполуки формули 6 з азидом натрію з одержанням сполуки формули 7;
(4) заміщають азидогрупу сполуки формули 7 на аміногрупу в присутності відновника з одержанням сполуки формули 8;
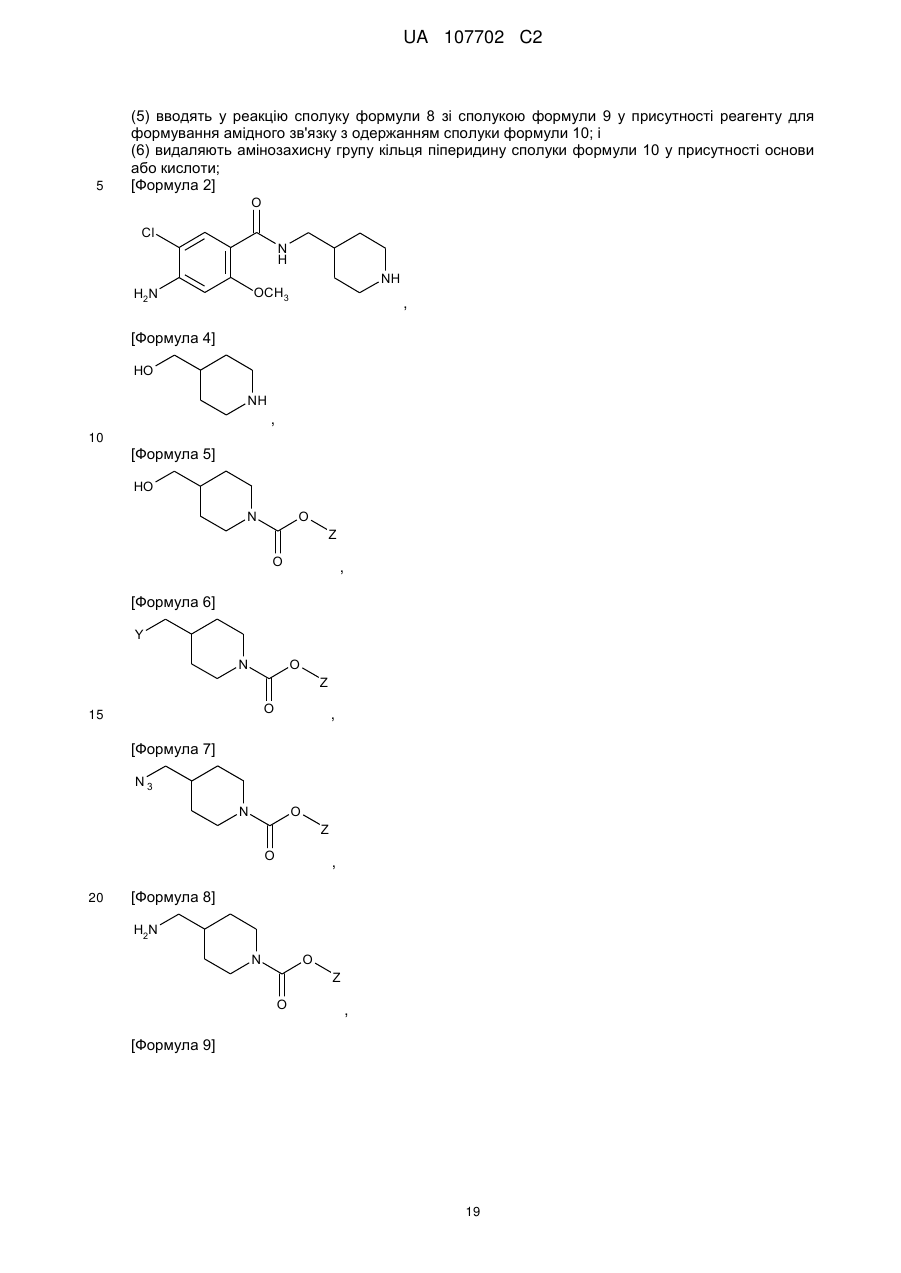
(5) вводять в реакцію сполуку формули 8 зі сполукою формули 9 у присутності реагенту для формування амідного зв'язку з одержанням сполуки формули 10; і
(6) видаляють амінозахисну групу кільця піперидину сполуки формули 10 у присутності основи або кислоти;
[Формула 2]
 ,
,
[Формула 4]
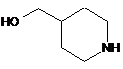 ,
,
[Формула 5]
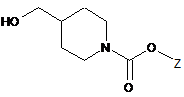 ,
,
[Формула 6]
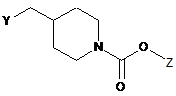 ,
,
[Формула 7]
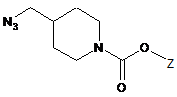 ,
,
[Формула 8]
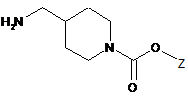 ,
,
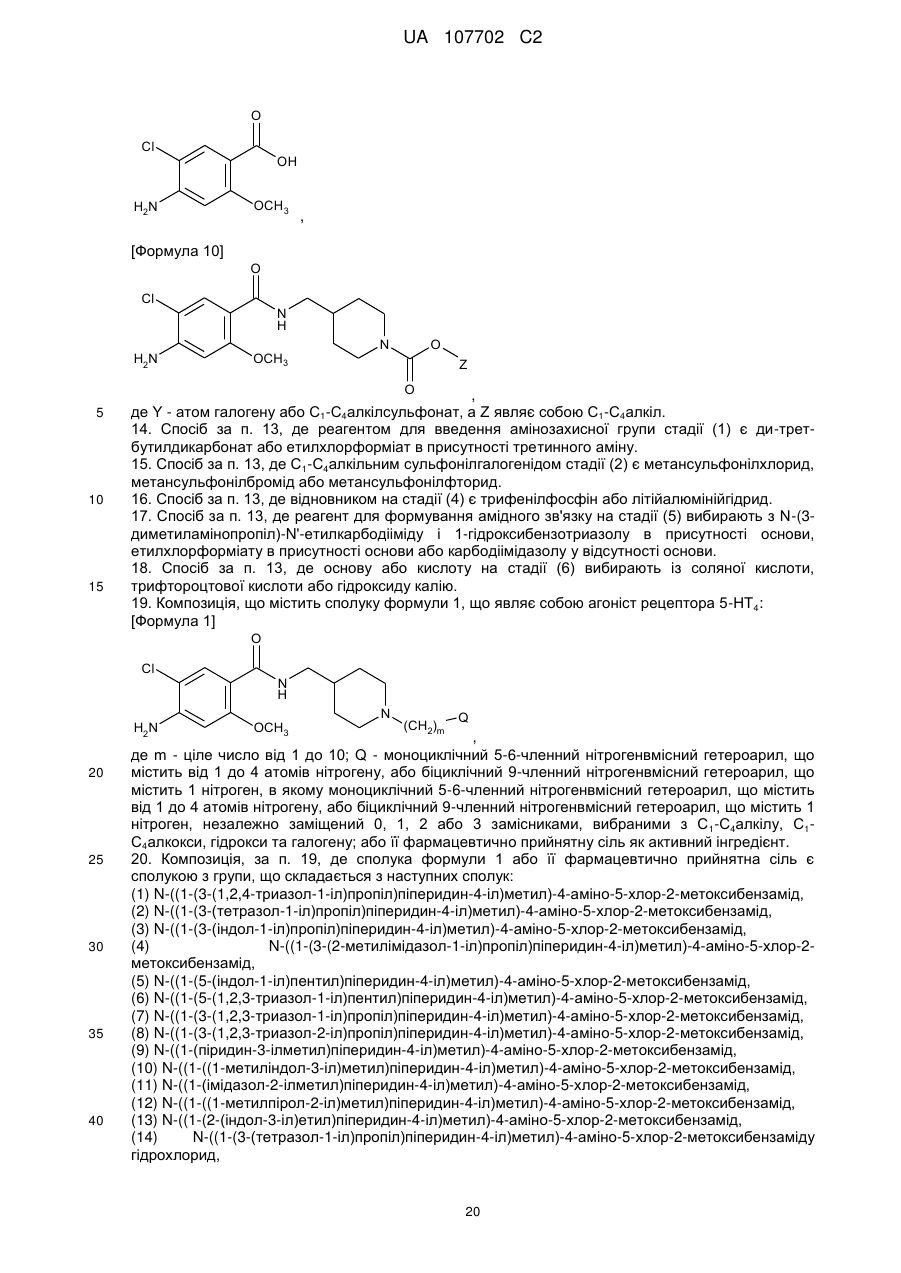
[Формула 9]
 ,
,
[Формула 10]
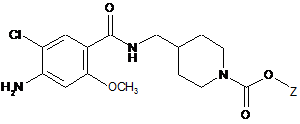 ,
,
де Y - атом галогену або С1-С4алкілсульфонат, a Z являє собою С1-С4алкіл.
6. Спосіб за п. 5, де реагентом для введення амінозахисної групи стадії (1) є ди-трет-бутилдикарбонат або етилхлорформіат в присутності третинного аміну.
7. Спосіб за п. 5, де С1-С4алкільним сульфонілгалогенідом стадії (2) є метансульфонілхлорид, метансульфонілбромід або метансульфонілфторид.
8. Спосіб за п. 5, де відновником на стадії (4) є трифенілфосфін або літійалюмінійгідрид.
9. Спосіб за п. 5, де реагент для формування амідного зв'язку на стадії (5) вибирають з N-(3-диметиламінопропіл)-N'-етилкарбодііміду і 1-гідроксибензотриазолу в присутності основи, етилхлорформіату в присутності основи або карбодіімідазолу у відсутності основи.
10. Спосіб за п. 5, де основу або кислоту на стадії (6) вибирають з соляної кислоти, трифтороцтової кислоти або гідроксиду калію.
11. Спосіб одержання сполуки формули 1 або її фармацевтично прийнятної солі, у якому вводять в реакцію сполуку формули 2 або її фармацевтично прийнятну сіль зі сполукою формули 11 у присутності відновника з одержанням сполуки формули 1;
[Формула 1]
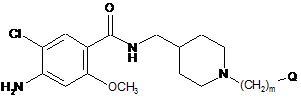 ,
,
[Формула 2]
 ,
,
[Формула 11]
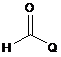 ,
,
де Q такий же, як визначено в п. 1, a m являє собою ціле число 1.
12. Спосіб за п. 11, де відновником є ціаноборгідрид натрію й оцтова кислота або боргідрид натрію.
13.Спосіб за п. 11, де сполуку формули 2 або її фармацевтично прийнятну сіль одержують за допомогою таких стадій:
(1) вводять в реакцію сполуку формули 4 з реагентом для введення амінозахисної групи, щоб ввести амінозахисну групу до аміну в положенні 1 піперидинового кільця сполуки формули 4, у такий спосіб одержуючи сполуку формули 5;
(2) вводять в реакцію гідроксильну групу сполуки формули 5 з N-бромсукцинімідом і тетрабромідом вуглецю або С1-С4алкільним сульфонілгалогенідом у присутності основи з одержанням сполуки формули 6;
(3) вводять в реакцію замісник Y сполуки формули 6 з азидом натрію з одержанням сполуки формули 7;
(4) заміщають азидогрупу сполуки формули 7 на аміногрупу в присутності відновника з одержанням сполуки формули 8;
(5) вводять у реакцію сполуку формули 8 зі сполукою формули 9 у присутності реагенту для формування амідного зв'язку з одержанням сполуки формули 10; і
(6) видаляють амінозахисну групу кільця піперидину сполуки формули 10 у присутності основи або кислоти;
[Формула 2]
 ,
,
[Формула 4]
 ,
,
[Формула 5]
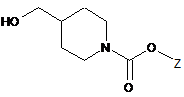 ,
,
[Формула 6]
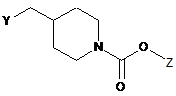 ,
,
[Формула 7]
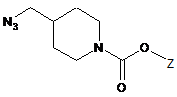 ,
,
[Формула 8]
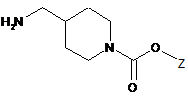 ,
,
[Формула 9]
 ,
,
[Формула 10]
 ,
,
де Y - атом галогену або С1-С4алкілсульфонат, a Z являє собою С1-С4алкіл.
14. Спосіб за п. 13, де реагентом для введення амінозахисної групи стадії (1) є ди-трет-бутилдикарбонат або етилхлорформіат в присутності третинного аміну.
15. Спосіб за п. 13, де С1-С4алкільним сульфонілгалогенідом стадії (2) є метансульфонілхлорид, метансульфонілбромід або метансульфонілфторид.
16. Спосіб за п. 13, де відновником на стадії (4) є трифенілфосфін або літійалюмінійгідрид.
17. Спосіб за п. 13, де реагент для формування амідного зв'язку на стадії (5) вибирають з N-(3-диметиламінопропіл)-N'-етилкарбодііміду і 1-гідроксибензотриазолу в присутності основи, етилхлорформіату в присутності основи або карбодіімідазолу у відсутності основи.
18. Спосіб за п. 13, де основу або кислоту на стадії (6) вибирають із соляної кислоти, трифтороцтової кислоти або гідроксиду калію.
19. Композиція, що містить сполуку формули 1, що являє собою агоніст рецептора 5-НТ4:
[Формула 1]
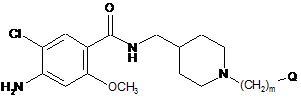 ,
,
де m - ціле число від 1 до 10; Q - моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, в якому моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, незалежно заміщений 0, 1, 2 або 3 замісниками, вибраними з С1-С4алкілу, С1-С4алкокси, гідрокси та галогену; або її фармацевтично прийнятну сіль як активний інгредієнт.
20. Композиція, за п. 19, де сполука формули 1 або її фармацевтично прийнятна сіль є сполукою з групи, що складається з наступних сполук:
(1) N-((1-(3-(1,2,4-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(2) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(3) N-((1-(3-(індол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(4) N-((1-(3-(2-метилімідазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(5) N-((1-(5-(індол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(6) N-((1-(5-(1,2,3-триазол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(7) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(8) N-((1-(3-(1,2,3-триазол-2-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(9) N-((1-(піридин-3-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(10) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(11) N-((1-(імідазол-2-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(12) N-((1-((1-метилпірол-2-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(13) N-((1-(2-(індол-3-іл)етил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід,
(14) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид,
(15) N-((1-(5-(1,2,3-триазол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид,
(16) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид,
(17) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид.
21. Композиція за будь-яким з пп. 19-20, де композиція є композицію для профілактики або лікування різних хворобливих станів, вибраних з гастроезофагеальної рефлюксної хвороби, шлунково-кишкового захворювання, розладу шлункової рухливості, невиразкової диспепсії, функціональної диспепсії, синдрому подразненого кишечнику (СПК), запору, диспепсії, езофагіту, гастроезофагеальної хвороби, нудоти, захворювання центральної нервової системи, хвороби Альцгеймера, когнітивного порушення, блювання, мігрені, неврологічного захворювання, болю, серцево-судинного розладу, серцевої недостатності, аритмії серця, діабету і синдрому апное.
22. Спосіб профілактики, лікування або полегшення захворювань, пов'язаних з ослабленою ефективністю рецептора 5-НТ4, у якому вводять композицію, що містить сполуку формули 1 за будь-яким з пунктів 1 або 2 або фармацевтично прийнятну сіль як активний інгредієнт, ссавцям, включаючи людей, що потребують агоністичної дії рецепторів 5-НТ4.
23. Спосіб за п. 22, де зазначені захворювання вибрані з гастроезофагеальної рефлюксної хвороби, шлунково-кишкового захворювання, розладу шлункової рухливості, невиразкової диспепсії, функціональної диспепсії, синдрому подразненого кишечнику (СПК), запору, диспепсії, езофагіту, гастроезофагеальної хвороби, нудоти, захворювань центральної нервової системи, хвороби Альцгеймера, когнітивного порушення, блювання, мігрені, неврологічного захворювання, болю, серцево-судинного розладу, серцевої недостатності, аритмії серця, діабету і синдрому апное.
Текст
Реферат: (72) Винахідник(и): Кхім Сон-Хвє (KR), Ім Вєон-Пін (KR), Чхой Сун-Хак (KR), Чхой Сун-Хо (KR), Сохн Чу-Хє (KR), Сун Хюн-Чун (KR), Кхім Мі-Йон (KR), Чхо Кхан-Хун (KR), Сохн Тхе-Кхьон (KR) (73) Власник(и): ДОНГ-А ФАРМ.КО., ЛТД., 252, Yongdu-dong, Dongdaemun-gu, Seoul 130-823, Republic of Korea (KR) (74) Представник: Михайлюк Ганна Валентинівна, реєстр. №184 (56) Перелік документів, взятих до уваги експертизою: US 20100093801 A1, 15.04.2010 US 05864039 A, 26.01.1999 WO 9902494 A1, 21.01.1999 WO 0031033 A1 02.06.200 KATSUHIKO ITOH ET AL.: 'Synthesis and pharmacological evaluation of carboxamide derivatives as selective serotoninergic 5-HT4 receptor agonists' EUROPEAN JOURNAL OF MEDICINAL CHEMISTRY vol. 34, no. 4, 1999, pages 977 - 989 SHUJI SONDA ET AL.: 'Design and synthesis of orally active benzamide derivatives as potent serotonin 4 receptor agonist' BIOORGANIC & MEDICINAL CHEMISTRY vol. 11, no. 19, 2003, pages 4225 - 4234 SHUJI SONDA ET AL.: 'Synthesis and pharmacological evaluation of benzamide derivatives as selective 5-HT4 receptor agonists' BIOORGANIC & MEDICINAL CHEMISTRY vol. 13, no. 9, 2005, pages 3295 - 3308 CLAEYSEN S. ET AL.: "Pharmacological properties of 5-hydroxytryptamine4 receptor antagonists on constitutively active wild-type and mutated receptors", MOLECULAR PHARMACOLOGY, AMERICAN SOCIETY FOR PHARMACOLOGY AND EXPERIMENTAL THERAPEUTICS, US, vol. 58, no. 1, 1 July 2000, pages 136-144 UA 107702 C2 (12) UA 107702 C2 Даний винахід стосується нової похідної бензаміду або її фармацевтично прийнятної солі, способу її отримання і агоніста рецептора 5-НТ4, що містить цю похідну як активний інгредієнт. Похідні бензаміду даного винаходу мають чудову афінність до рецепторів 5-НТ4, можливість скоротити час спорожнення шлунка і низьку токсичність і, отже, є терапевтично ефективними для лікування різних захворювань, пов'язаних з рецепторами 5-НТ4. UA 107702 C2 5 10 15 20 25 30 35 40 45 Галузь техніки Дійсний винахід відноситься до нової похідної бензаміду формули 1, що буде представлена далі або її фармацевтично прийнятної солі, способу її отримання і агоністу рецептора 5-HT4, що містить цю похідну в якості активного інгредієнта. Попередній рівень техніки Серотонін (5-HT) – нейромедіатор, широко розповсюджений по всьому організму. В даний час відомо сім підтипів серотоніна. Зокрема, велику увагу було зосереджено на вивченні рецептора 5-HT4 і підтвердженні його фармацевтичної дії. В основному агоністи рецептора 5-HT4 виявляють терапевтичну ефективність для лікування різних хворобливих станів, таких як гастроезофагеальна рефлюксна хвороба, шлунковокишкове захворювання, розлад шлункової рухливості, невиразкова диспепсія, функціональна диспепсія, синдром роздратованого кишечника (СРК), закріп, диспепсія, езофагіт, гастроезофагеальна хвороба, нудота, захворювання центральної нервової системи, хвороба Альцгеймера, когнітивне порушення, блювота, мігрень, неврологічне захворювання, біль, серцево-судинний розлад, серцева недостатність, аритмія серця, діабет і синдром апное (див. Tips, 1992, 13, 141; Ford A.P.D.W. et al., Med. Res. Rev., 1993, 13. 633; Gullikson G.W. et al., Drug Dev. Res., 1992, 26, 405; Richard M. Eglen et al., Tips, 1995, 16, 391; Bockaert J. et al., CNS Drugs, 1, 6; Romanelli M.N. et al., Arzheim Forsch./Drug Res., 1993, 43, 913; Kaumann A. et al., NaunynSchmiedeberg's. 1991, 344, 150; і Romanelli M.N. et al., Arzheim Forsch./Drug Res., 1993, 43, 913). Незважаючи на широке застосування агоністів рецептора 5-HT4, існує мало сполук агоністів рецептора 5-HT4, що застосовуються в даний час у клінічних цілях. Тому існує необхідність в агоністі рецептора 5-HT4, що здатний виявляти відмінний лікувальний ефект із мінімумом шкідливих побічних ефектів. Похідні бензаміду мають декілька відомих фармакологічних дій. Ці відмінні фармакологічні впливи похідних бензаміду пов'язані з їх ефектами на нервову систему, контрольовану серотоніном, що є нейромедіатором. Роль серотоніну, тобто фармакологічна дія похідних бензаміду, у широкому сенсі пов'язують з різними захворюваннями і станами протягом багатьох років. Крім того, безліч досліджень було зосереджено на вивченні місць синтезу і збереження серотоніну, а також розташування рецепторів серотоніну, щоб визначити зв'язок між розташуванням рецепторів серотоніну і різними формами і станами захворювань у людей. Цизаприд, типовий агоніст рецептора 5-HT4, є одним з похідних бензаміду. Патенти США № 4962115, 5057525 і 5137896 описують N-(3-гідрокси-4-піперидиніл)бензаміди, у тому числі цизаприд. Ці сполуки, як відомо, стимулюють рухливість шлунково-кишкового тракту. У патенті США № 5864039 розкриваються похідні бензаміду. Таким чином, автори дійсного винаходу досягли успіху в синтезі нових похідних бензаміду, що виявляють агоністичну активність за допомогою сильного зв'язування з рецептором 5-HT4 і гарне шлунково-кишкове всмоктування, і які здатні звести до мінімуму шкідливі побічні ефекти. Дійсний винахід був виконаний на основі цього відкриття. Розкриття винаходу Технічна задача Дійсний винахід призначений для забезпечення нової похідної бензаміду або її фармацевтично прийнятної солі і способу їхнього одержання. Крім того, даний винахід призначений для одержання агоніста рецептора 5-HT4, що містить нову похідну бензаміду або її фармацевтично прийнятну сіль або гідрат як активний інгредієнт. Рішення задачі Дійсний винахід надає нову похідну бензаміду, представлену формулою 1 (сполука, представлена формулою 1): [Формула 1] 50 55 де m - ціле число від 1 до 10; Q - гетероароматичне кільце або феніл, де гетероароматичне кільце або феніл незалежно заміщений 0, 1, 2 або 3 замісниками алкіл-, алкоксі-, ціано-, нітроабо галогенової групи; або фармацевтично прийнятна сіль. Якщо не зазначено інше, наступні терміни мають наступні значення в даному документі. Описуваний у даному документі термін "алкіл" відноситься до лінійного або розгалуженого моновалентного насиченого C1-C20вуглеводневого радикалу, що містить тільки атоми вуглецю і 1 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 водню. Приклади алкілу включають метил, етил, пропіл, ізопропіл, 2,2-диметилпропіл, бутил, ізобутил, втор-бутил, трет-бутил, 3-метилбутил, пентил, 3-метилпентил, 4-метилпентил, нгексил -2-етилгексил, октил і додецил. Описуваний у даному документі термін "алкоксі" відноситься до радикала –OR, де R являє собою алкіл, як описано вище. Приклади алкоксі включають метоксі, етоксі, ізопропоксі, бутоксі, ізобутоксі, втор-бутоксі, трет-бутоксі, пентоксі, 3-метилпентоксі, 4-метилпентоксі, н-гексоксі і 2етилгексоксі. Описуваний у даному документі термін "гетероароматичне кільце" відноситься до ароматичного кільця або біциклічного ароматичного кільця, що містить від 1 до 4 гетероатомів O, N або S. Приклади гетероароматичного кільця включають пірол, імідазол, тріазол, тетразол, піридин, піримідин, оксазол, оксадіазол, ізоксазол, індол, хінолін і бензофуран. Додатково дійсний винахід надає нову похідну бензаміду, представлену формулою 1, де m ціле число від 1 до 5, Q - гетероароматичне кільце або феніл, де гетероароматичне кільце або феніл незалежно заміщений 0, 1, 2 або 3 замісниками: C1-C4алкілом, C1-C4алкоксилом, гідроксилом і галогеном, де гетероароматичне кільце є C 1-C12ароматичним кільцем або C1C12біциклічним ароматичним кільцем, що містить від 1 до 4 гетероатомів N, О або S; або фармацевтично прийнятну сіль. У дійсному винаході фармацевтично прийнятна сіль може бути кислотно-адитивною сіллю з прийнятною вільною кислотою. Вільна кислота може бути неорганічною або органічною. Прикладами неорганічних кислот є соляна кислота, бромистоводнева кислота, сірчана кислота і фосфорна кислота. Приклади органічних кислот включають лимонну кислоту, оцтову кислоту, молочну кислоту, малеїнову кислоту, фумарову кислоту, глюконову кислоту, метансульфонову кислоту, гліколеву кислоту, бурштинову кислоту, 4-толуолсульфокислоту, трифтороцтову кислоту, галактуронову кислоту, ембонову кислоту, глутамінову кислоту й аспарагінову кислоту. Додатково сполука формули 1 або її фармацевтично прийнятна сіль може виявляти поліморфізм, а також може бути представлена у вигляді сольвату (наприклад, гідрату і т.д.). Додатково дійсний винахід відноситься до нової похідної бензаміду обраної з групи, що складається з наступних сполук: (1) N-((1-(3-(1,2,4-тріазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, (2) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (3) N-((1-(3-(індол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (4) N-((1-(3-(2-метилімідазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, (5) N-((1-(5-(індол-1-іл)-пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (6) N-((1-(5-(1,2,3-тріазол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, (7) N-((1-(3-(1,2,3-тріазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, (8) N-((1-(3-(1,2,3-тріазол-2-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, (9) N-((1-(піридин-3-іл-метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (10) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно--5-хлор-2метоксибензамід, (11) N-((1-(імідазол-2-іл-метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (12) N-((1-((1-метилпірол-2-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, (13) N-((1-(4-фторбензил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (14) N-((1-(4-гідроксибензил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (15) N-((1-(2-(індол-3-іл)етил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (16) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід гідрохлорид, (17) N-((1-(5-(1,2,3-тріазол-1-іл)-пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід гідрохлорид, (18) N-((1-(3-(1,2,3-тріазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід гідрохлорид, (19) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно--5-хлор-2метоксибензамід гідрохлорид, (20) N-((1-(4-фторбензил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід гідрохлорид, 2 UA 107702 C2 5 10 (21) N-((1-(4-гідроксибензил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід гідрохлорид і їх фармацевтично прийнятна сіль. Додатково дійсний винахід надає спосіб одержання похідної бензаміду формули 1 або її фармацевтично прийнятної солі. Дійсний винахід надає спосіб одержання сполуки формули 1 або її фармацевтично прийнятної солі, що включає взаємодію сполуки формули 2 або її фармацевтично прийнятної солі зі сполукою формули 3 у присутності основи з уведенням сполуки формули 3 до аміну в положенні 1 піперидинового кільця сполуки формули 2 або її фармацевтично прийнятної солі, у такий спосіб одержуючи сполуку формули 1 (далі "Спосіб одержання 1"). [Формула 1] [Формула 2] [Формула 3] 15 20 25 У приведеній вище формулі m і Q такі ж, як в описі до формули 1, а Y являє собою атом галогену або C1-C4алкілсульфонат. У пункті “Спосіб одержання 1” дійсного винаходу основу вибирають переважно з карбонату калію, йодиду калію, триетиламіну, діізопропілетиламіну і їх суміші, розчинником може бути диметилформамід, диметилацетамід, ацетон, 1,4-діоксан і т.п., і реакцію можна проводити при температурі від 50°С до 140°С. Дійсний винахід надає спосіб одержання сполуки формули 1 або її фармацевтично прийнятної солі, що включає взаємодію сполуки формули 2 або її фармацевтично прийнятної солі зі сполукою формули 11 у присутності відновника для одержання сполуки формули 1 (далі "Спосіб одержання 2"). [Формула 1] [Формула 2] 30 [Формула 11] 3 UA 107702 C2 5 10 15 20 25 У приведеній вище формулі Q такий же, як в описі до формули 1, а m являє собою ціле число 1. У пункті “Спосіб одержання 2” дійсного винаходу відновлювач вибирають переважно з ціаноборгідриду натрію й оцтової кислоти, або боргідриду натрію, розчинником може бути С 1С6нижчий спирт, переважно етанол або метанол, і реакцію можна проводити при температурі від 50°С до 100°С. Сполуку формули 2 або її фармацевтично прийнятну сіль у пункті “Спосіб одержання 1” або “Спосіб одержання 2” дійсного винаходу можна одержати за допомогою наступних стадій: (1) взаємодія сполуки формули 4 з реагентом для введення амінозахисної групи, щоб ввести амінозахисну групу до аміну в положенні 1 піперидинового кільця сполуки формули 4, у такий спосіб одержуючи сполуку формули 5; (2) взаємодія гідроксильної групи сполуки формули 5 з N-бромсукцинімідом і тетрабромідом вуглецю, або С1-С4алкільним сульфонілгалогенідом у присутності основи з одержанням сполуки формули 6; (3) взаємодія замісника Y у сполуці формули 6 з азідом натрію з одержанням сполуки формули 7; (4) заміщення азідогрупи сполуки формули 7 на аміногрупу в присутності відновника з одержанням сполуки формули 8; (5) взаємодія сполуки формули 8 зі сполукою формули 9 у присутності реагенту для формування амідного зв'язку для одержання сполуки формули 10; і (6) видалення амінозахисної групи кільця піперидина сполуки формули 10 у присутності основи або кислоти. [Формула 2] [Формула 4] [Формула 5] [Формула 6] 30 [Формула 7] [Формула 8] 4 UA 107702 C2 [Формула 9] [Формула 10] 5 10 15 20 25 30 35 40 У приведеній вище формулі Y - атом галогену або C1-C4алкілсульфонат, а Z являє собою C1-C4алкіл. У способі одержання сполуки формули 2, відповідно до дійсного винаходу, реагент для введення амінозахисної групи стадії (1) відноситься до реагенту, що звичайно використовується для захисту аміну з метою захисту аміногрупи від участі в реакції. Наприклад, такий реагент вибирають переважно з ді-трет-бутилдикарбонату або етилхлорформіату в присутності третинного аміну, такого як триетиламін. Розчинником може бути С 1-С6нижчий спирт. Реакцію можна проводити з поступовим підвищенням температури від 0°С до кімнатної температури. У способі одержання сполуки формули 2, відповідно до дійсного винаходу, С 1-С4алкільний сульфонілгалогенід стадії (2) - переважно метансульфонілхлорид, метансульфонілбромід або метансульфонілфторид, третинним аміном може бути триетиламін, діізопропілетиламін і т.п., а розчинником може бути дихлорметан, хлороформ і т.п. Реакцію можна проводити з поступовим підвищенням температури від 0°С до кімнатної температури. У способі одержання сполуки формули 2, відповідно до дійсного винаходу, розчинником, використовуваним на стадії (3) може бути диметилформамід, диметилацетамід і т.п., і температура реакції може бути в діапазоні від 80 до 140°С. У способі одержання сполуки формули 2, відповідно до дійсного винаходу, відновлючим агентом на стадії (4) може бути переважно трифенілфосфін або літійалюмінійгідрид, а розчинником може бути тетрагідрофуран. Реакцію можна проводити з поступовим підвищенням температури від 0°С до кімнатної температури або температури в межах від 60 до 80°С. У способі одержання сполуки формули 2, відповідно до дійсного винаходу, реагент для формування амідного зв'язку на стадії (5) відноситься до загального реагенту, що використовується фахівцем звичайної кваліфікації, і який використовується для видалення води, що утворюється після реакції, з метою утворення амідного зв'язку між карбоновою кислотою й аміном або використовується для активації аміну або карбонової кислоти. Приклади реагенту для формування амідного зв’язку включають N-(3-диметиламінопропіл)-N'етилкарбодіімід і 1-гідроксибензотріазол у присутності основи, етилхлорформіат у присутності основи і карбодіімідазол у відсутності основи. У даному випадку приклади основи, використовуваної в комбінації з N-(3-диметиламінопропіл)-N'-етилкарбодіімідом і 1гідроксибензотріазолом або етилхлорформіатом, включають триетиламін і діізопропілетиламін. У даному випадку розчинником може бути диметилформамід, диметилацетамід, дихлорметан і т.п. Реакцію можна проводити з поступовим підвищенням температури від 0°С до кімнатної температури. У способі одержання сполуки формули 2, відповідно до дійсного винаходу, основа або кислота на стадії (6) відносяться до основи або кислоти, що звичайно використовують для 5 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 зняття захисту з карбамата аміну, і їх приклади включають соляну кислоту, трифтороцтову кислоту і гідроксид калію. Розчинником може бути 1,4-діоксан, дихлорметан, С1-С6нижчий спирт і т.п. Реакцію можна проводити з поступовим підвищенням температури від 0°С до кімнатної температури. Сполуку формули 3 у дійсному винаході можна одержати у відповідності зі способом, представленим нижче в схемі реакції 1 або схемі реакції 2. [Схема реакції 1] У схемі реакції 1 замісники Q і m такі ж, як в описі до формули 1, а обоє Y і Y' являють собою атоми галогену, що переважно відрізняються один від одного, наприклад, один з Y і Y' являє собою хлор (Cl) а інший - бром (Br). Реакцію в схемі реакції 1 можна проводити в присутності сильної основи, такої як гідрид літію, гідрид натрію або гідрид калію, в органічному розчиннику, такому як диметилформамід, диметилацетамід або тетрагідрофуран, при температурі реакції від 0 до 40°С протягом 1-24 годин. [Схема реакції 2] Y” – (CH2)m – Y”’ + Q – H → Y” – (CH2)m – Q → Y – (CH2)m – Q У схемі реакції 2, замісники Q і m такі ж, як в описі до формули 1, а Y являє собою С 3С4алкільный сульфонілгалогенід або атом галогену, Y" являє собою гідроксильну групу, а Y"' являє собою атом галогену, обраний з Cl, Br або I. Першу стадію в схемі реакції 2 можна проводити в присутності основи, такого як карбонат калію і йодид калію, у розчиннику, такому як 1,4-діоксан або ацетон, при температурі від 60 до 120°С протягом 1-12 годин. Коли Y формули 3 являє собою С1-С4алкільный сульфонілгалогенід, можна проводити другу стадію схеми реакції 2 шляхом взаємодії Y” – (CH2)m – Q із С1-С4алкільным сульфонілгалогенідом (наприклад, метансульфонілхлорид, метансульфонілбромід або метансульфонілфторид) у присутності основи, такої як триетиламін або діізопропілетиламін, в органічному розчиннику, такому як дихлорметан або хлороформ, при температурі реакції від 0 до 40°С протягом 1-24 годин. Коли замісник Y формули 3 являє собою атом галогену, можна проводити другу стадію схеми реакції 2, відповідно до загальновідомих умов реакції заміщення гідроксильної групи Y” – (CH2)m – Q на галоген. Наприклад, коли замісник Y формули 3 являє собою бром (Br), реакцію можна проводити в присутності N-бромсукциніміду або тетраброміду вуглецю і трифенілфосфіну в органічному розчиннику, такому як дихлорметан, при температурі реакції від 0 до 40°С протягом 1- 24 годин. Кислотно-адитивну сіль вільної основи сполуки, представленої формулою 1, можна одержати за допомогою звичайного методу, відомого в даній області, наприклад, шляхом змішування вільної основи сполуки формули 1 з відповідною кислотою в придатному розчиннику, після чого відбудеться випаровування з утворенням солі або приєднання осаджувача для випадання солі. Наприклад, можна згадати спосіб, що полягає в обробці розчину або суспензії вільної основи бажаною кислотою в інертному розчиннику з наступною концентрацією при зниженому тиску або кристалізацією, або будь-якою стандартною хімічною маніпуляцією для одержання бажаної солі. В одному варіанті здійснення можна одержати гідрохлорид сполуки формули 1 шляхом розчинення вільної основи сполуки формули 1 у С 1С4спиртовому розчиннику, наприклад етанолі або метанолі, додавши соляну кислоту, а потім перемішавши суміш при кімнатній температурі. Додатково дійсний винахід надає агоніст рецептора 5-HT4, що містить сполуку формули 1 або її фармацевтично прийнятну сіль або гідрат як активний інгредієнт. У дійсному винаході агоніст рецептора 5-HT4 може виступати композицією для профілактики або лікування різних захворювань, таких як гастроезофагеальна рефлюксна хвороба, шлунково-кишкове захворювання, розлад шлункової рухливості, невиразкова диспепсія, функціональна диспепсія, синдром роздратованого кишечника (СРК), закріп, диспепсія, езофагіт, гастроезофагеальна хвороба, нудота, захворювання центральної нервової системи, хвороба Альцгеймера, когнітивне порушення, блювота, мігрень, неврологічне захворювання, біль, серцево-судинні розлади, серцева недостатність, аритмія серця, діабет і синдром апное. У дійсному винаході агоніст рецептора 5-HT4 даного винаходу може додатково містити один або більше активних інгредієнтів, що виконують тотожні або подібні функції на додаток до сполуки формули 1 відповідно до дійсного винаходу або їх фармацевтично прийнятну сіль. З метою бажаного застосування агоніст або композиція дійсного винаходу можуть бути складені в різних лікарських формах подальшим включенням одного або більше 6 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятних носіїв у сполученні з вищезгаданим активним інгредієнтом. Приклади фармацевтично прийнятного носія включають фізіологічний розчин, стерильну воду, розчин Рингера, буферний розчин, розчин глюкози, розчин мальтодекстрину, гліцерин і етанол. Ці матеріали можна використовувати окремо або в будь-якій їхній комбінації. У разі потреби можна додати інші звичайні добавки, такі як антиоксидант, буфер і бактеріостатичний агент. Крім того, додатково можна додати розчинник, диспергатор, поверхнево-активну речовину, зв'язний і мастильний матеріал для одержання ін'єкційної форми, наприклад водяного розчину або суспензії емульсії, або пероральної форми, наприклад пігулок, капсул, гранул або таблеток. Крім того, бажана лікарська форма може бути переважно виготовлена в залежності від захворювань, що підлягають лікуванню, й інгредієнтів, використовуючи будь-який придатний спосіб, відомий у даній області, як описано в "Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA. Додатково, коли агоніст рецептора 5-HT4 даного винаходу призначений для перорального прийому, вміст сполуки формули 1 відповідно до дійсного винаходу або її фармацевтично прийнятної солі у препараті може бути в діапазоні від 1 до 95% по вазі і переважно від 1 до 70% по вазі. Агоніст або композицію дійсного винаходу можна приймати парентерально (наприклад, внутрішньовенно, підшкірно, внутрішньочеревинно або локально) або в пероральній формі, у залежності від бажаного застосування. Доза активного інгредієнта може мінятися в залежності від різних факторів, таких як вага, вік, стать, стан здоров'я і харчування хворих, час і спосіб прийому, швидкість виведення і важкість захворювання. Похідну бензаміду даного винаходу можна приймати в дозі від 1 до 1000 мкг/кг, переважно від 10 до 500 мкг/кг і більш переважно приблизно від 83 до 167 мкг/кг, один або кілька разів у день. Додатково дійсний винахід надає спосіб профілактики, або лікування полегшення захворювань, пов'язаних з ослабленою ефективністю рецептора 5-HT4, у тому числі введення агоністу рецептора 5-HT4, що містить сполуку формули 1 відповідно до дійсного винаходу або фармацевтично прийнятну сіль в якості активного інгредієнта, ссавцям, включаючи людей, що потребують агоністичної дії рецептора 5-HT4. У даному випадку агоніст рецептора 5-HT4 може бути композицією для профілактики або лікування різних захворювань, таких як гастроезофагеальна рефлюксна хвороба, шлунково-кишкове захворювання, розлад шлункової рухливості, невиразкова диспепсія, функціональна диспепсія, синдром роздратованого кишечника (СРК), закріп, диспепсія, езофагіт, гастроезофагеальна хвороба, нудота, захворювання центральної нервової системи, хвороба Альцгеймера, когнітивне порушення, блювота, мігрень, неврологічне захворювання, біль, серцево-судинний розлад, серцева недостатність, аритмія серця, діабет і синдром апное. Для профілактики і лікування захворювань, пов'язаних з ослабленою ефективністю рецептора 5-HT4, агоніст рецептора 5-HT4 даного винаходу можна використовувати окремо або в поєднанні з використанням методів хірургічної операції, гормональній терапії, медикаментозній терапії і модифікаторів біологічних реакцій. Переваги винаходу Похідні бензаміду даного винаходу мають чудову афінність до рецепторів 5-HT4, можливість скоротити час спорожнення шлунка і низьку токсичністю і, отже, є терапевтично ефективними для лікування різних захворювань, пов'язаних з рецепторами 5-HT4. Докладний опис Надалі дійсний винахід буде описано більш докладно з посиланнями на наступні приклади. Однак наступні приклади наведені, щоб проілюструвати дійсний винахід і не повинні розглядатися як обмежуючі обсяг і сутність дійсного винаходу. Якщо не зазначено інше, використовувані реагенти були придбані в Aldrich Korea, Acros, 1 Lancaster, TCI, і т.д., і експерименти ЯМР Н проводилися за допомогою спектрометра Varian з частотою 400 МГц. Приклад 1: Одержання N-((1 - (3 - (1,2,4-тріазол-1-іл) пропіл) піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду 1-1. Одержання 4-аміно-5-хлор-2-метокси-(піперидин-4-іл-метил) бензаміду (сполука формули 2) гідрохлориду Стадія 1: Одержання трет-бутил-4-(гідроксиметил)піперидин-1-карбонової кислоти (сполука формули 5) 4-піперидинметанол (сполука формули 4) (20 г, 174 ммоль) розчиняють у метанолі (30 мл) і охолоджують розчин до 0°С. Потім до нього додають триетиламін (48,8 мл, 347 ммоль) і дитрет-бутилдикарбонат (56,8 г, 260 ммоль). Реакційну суміш нагрівають до кімнатної температури, перемішують протягом 2 годин і концентрують при зниженому тиску для 7 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 видалення розчинника. Після екстракції дихлорметаном і водою органічний шар промивають розчином лимонної кислоти, сушать над безводним сульфатом магнію і концентрують при зниженому тиску для одержання сполуки, зазначеної в заголовку (35,25 г, 94 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 4,18-4,04 (m, 2H), 3,47 (t, J = 5,6 Гц, 2Н), 2,70-2,64 (m, 2Н), 1,701,56 (m, 3H), 1,42 (s, 9Н), 1,16-1,09 (m, 2H). Стадія 2: Одержання трет-бутил -4-((метилсульфонілокси)метил) піперидин-1-карбонової кислоти (сполука формули 6) Трет-бутил-4-(гідроксиметил)піперидин-1-карбонову кислоту (35,25 г, 164 ммоль) розчиняють в дихлорметані (300 мл) і охолоджують розчин до 0°С. Потім до нього додають триетиламін (46,01 мл, 327 ммоль) і метансульфонілхлорид (19,14 мл, 246 ммоль). Реакційну суміш нагрівають до кімнатної температури, перемішують протягом 2 годин і екстрагують дихлорметаном і водою. Органічний шар промивають розчином лимонної кислоти, сушать над безводним сульфатом магнію і концентрують при зниженому тиску для одержання сполуки, зазначеної в заголовку (48 г, 100 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 4,18-4,06 (m, 2H), 4,04 (d, J = 6,4 Гц, 2H), 2,99 (s, 3H), 2,78-2,62 (m, 2Н), 1,92-1,85 (m, 1H), 1,73-1,70 (m, 2H), 1,43 (s, 9Н), 1,24-1,13 (m, 2H). Стадія 3: Одержання трет-бутил-4-(азідометил)піперидин-1-карбонової кислоти (сполука формули 7) Трет-бутил-4-((метилсульфонілокси)метил)піперидин-1-карбонову кислоту (48 г, 163,6 ммоль) розчиняють у диметилформаміді (500 мл) і додають азід натрію (19,15 г, 295 ммоль), потім перемішують при 120°С протягом 6 годин. Після завершення реакції реагенти охолоджують до кімнатної температури, екстрагують етилацетатом і водою, сушать над безводним сульфатом магнію і концентрують при зниженому тиску для одержання сполуки, зазначеної в заголовку (35 г, 89 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 4,18-4,00 (m, 2H), 3,16 (d, J = 6,0 Гц, 2Н), 2,72-2,58 (m, 2Н), 1,701,64 (m, 3H), 1,43 (s, 9Н), 1,20-1,08 (m, 2H). Стадія 4: Одержання трет-бутил-4-(амінометил)піперидин-1-карбонової кислоти (сполука формули 8) Трет-бутил-4-(азідометил)піперидин-1-карбонову кислоту (30 г, 124,8 ммоль) розчиняють у тетрагідрофурані (300 мл) і додають трифенілфосфін (39,3 г, 149,8 ммоль), потім перемішують при кип'ятінні протягом 2 годин. Після цього додають воду (120 мл), перемішують при кип'ятінні протягом ще 3 годин і концентрують при зниженому тиску. Отриманий осад екстрагують етилацетатом і 1 н. розчином гідрохлориду, водяний шар нейтралізують 2 н. розчином гідроксиду натрію, потім повторно екстрагують дихлорметаном. Отриманий органічний шар сушать над безводним сульфатом магнію і концентрують при зниженому тиску для одержання сполуки, зазначеної в заголовку (21,16 г, 79 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 4,16-3,98 (m, 2Н), 2,69-2,63 (m, 2H), 2,56 (d, J = 6,8 Гц, 2Н), 1,691,66 (m, 2H), 1,46-1,38 (m, 10H), 1,10-1,04 (m, 2H). Стадія 5: Одержання трет-бутил-4-((4-аміно-5-хлор-2-метоксибензамідо)метил)піперидин-1карбонової кислоти (сполука формули 10) 4-аміно-5-хлор-2-метоксибензойну кислоту (сполука формули 9) (16,6 г, 82,28 ммоль) розчиняють у диметилформаміді (166 мл) і охолоджують розчин до 0°С. Потім до нього додають трет-бутил-4-(амінометил)піперидин-1-карбонову кислоту (21,16 г, 98,74 ммоль), триетиламін (11,56 мл, 246,84 ммоль), N-(3-диметиламінопропіл)-N'-етилкарбодіімід (EDC, 20,51 г, 106,96 ммоль) і 1-гідроксибензотріазол (HOBT, 16,68 г, 123,42 ммоль). Реакційну суміш нагрівають до кімнатної температури, перемішують протягом 4 годин і екстрагують етилацетатом і водою. Органічний шар сушать над безводним сульфатом магнію і концентрують при зниженому тиску для одержання сполуки, зазначеної в заголовку (31,4 г, 96 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 8,08 (s, 1H), 7,76-7,70 (m, 1H), 6,27 (s, 1H), 4,37 (s, 2Н), 4,16-4,04 (m, 2H), 3,88 (s, 3H), 3,34-3,26 (m, 2Н), 2,74-2,60 (m, 2Н), 1,80-1,63 (m, 3H), 1,42 (s, 9Н), 1,20-1,10 (m, 2H). Стадія 6: Одержання 4-аміно-5-хлор-2-метокси-(піперидин-4-іл-метил)бензаміду (сполука формули 2) гідрохлориду Трет-бутил-4-((4-аміно-5-хлор-2-метоксибензамід)метил)піперидин-1-карбонову кислоту (30,7 г, 77,16 ммоль) розчиняють у 1,4-діоксані (300 мл) і додають 4М розчин гідрохлориду (220 мл) з 1,4-діоксаном. Суміш перемішують при кімнатній температурі протягом 2 годин і концентрують при зниженому тиску для одержання сполуки, зазначеної в заголовку (24 г, 93 %). 1 ЯМР Н (CD3OD, 400 MГц): δ 7,84 (s, 1H), 6,84 (s, 1H), 3,95 (s, 3H), 3,42-3,29 (m, 6H), 3,012,95 (m, 2H), 1,98- 1,93 (m, 3H), 1,54-1,42 (m, 2H). 1-2. Одержання 1-(3-хлорпропіл)-1,2,4-тріазола (сполука формули 3) 8 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 1,2,4-тріазола натрієву сіль (5 г, 54,91 ммоль) розчиняють у диметилформаміді (50 мл) і охолоджують розчин до 0°С. Потім до нього додають гідрид натрію (60 %, 2,86 г, 71,38 ммоль) і перемішують протягом 30 хвилин. Додають 1-бром-3-хлорпропан (6,5 мл, 65,89 ммоль) і перемішують при кімнатній температурі протягом 12 годин. Реакцію припиняють з додаванням насиченого розчину хлориду амонію. Після екстракції етилацетатом і водою органічний шар промивають насиченим розчином солі, сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (2,77 г, 35 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 8,08 (s, 1H), 7,94 (s, 1H), 4,36 (t, J = 6,4 Гц, 2H), 3,45 (t, J = 6 Гц, 2Н), 2,35-2,30 (m, 2H). 1-3: Одержання N-((1-(3-(1,2,4-тріазол-1-іл)пропіл)піперидин-4-іл) метил)-4-аміно-5-хлор-2метоксибензаміду (сполука формули 1) 4-аміно-5-хлор-2-метокси-(піперидин-4-іл-метил)бензаміду (сполука формули 2) гідрохлорид (500 мг, 1,5 ммоль) розчиняють у диметилформаміді (10 мл) і додають 1-(3-хлорпропіл)-1,2,4тріазол (сполука формули 3) (306 мг, 2,1 ммоль), карбонат калію (497 мг, 3,6 ммоль) і йодид калію (50 мг, 0,3 ммоль). Реагенти перемішують при 100°С протягом 8 годин і припиняють реакцію з додаванням води. Після екстракції етилацетатом і водою органічний шар промивають насиченим розчином солі, сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (55 мг, 9 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 8,09 (s, 1H), 8,04 (s, 1H), 7,91 (s, 1H), 7,78-7,70 (m, 1H), 6,27 (s, 1H), 4,35 (s, 2H), 4,22 (t, J = 6,4 Гц, 2H), 3,88 (s, 3Н), 3,30 (t, J = 6,4 Гц, 2Н), 2,85-2,81 (m, 2H), 2,24 (t, J = 6,4 Гц, 2Н), 2,06-2,00 (m, 2Н), 1,97-1,90 (m, 2Н), 1,78-1,50 (m, 3H), 1,39-1,28 (m, 2H). Приклад 2: Одержання N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл) метил)-4-аміно-5-хлор2-метоксибензаміду Одержують 1-(3-хлорпропіл)-тетразол, в якості вихідних матеріалів використовуючи 1Нтетразол і 1-бром-3-хлорпропан , а потім одержують сполуку, зазначену в заголовку (186 мг), в якості вихідних матеріалів використовуючи 1-(3-хлорпропіл)-тетразол і 4аміно-5-хлор-2-метоксі-(піперидин-4-іл-метил) бензаміду гідрохлорид . 1 ЯМР Н (CDCl3, 400 МГц): δ 8,60 (s, 1H), 8,07 (s, 1H), 7,75-7,68 (m, 1H), 6,28 (s, 1H), 4,49 (t, J = 6,8 Гц, 2H), 4,39 (s, 2H), 3,88 (s, 3Н), 3,30 (t, J = 6,4 Гц, 2Н), 2,79-2,76 (m, 2H), 2,23 (t, J = 6,8 Гц, 2H), 2,10-2,05 (m, 2Н), 1,92-1,86 (m, 2Н), 1,75-1,69 (m, 2Н), 1,62-1,50 (m, 1H), 1,35-1,23 (m, 2H). Приклад 3: Одержання N-((1-(3-(індол-1-іл)пропіл)піперидин-4-іл) метил)-4-аміно-5-хлор-2метоксибензаміду Одержують 1-(3-хлорпропіл)-індол, в якості вихідних матеріалів використовуючи індол і 1бром-3-хлорпропан , а потім одержують сполуку, зазначену в заголовку (26 мг), в якості вихідних матеріалів використовуючи 1-(3-хлорпропіл)-індол і 4-аміно-5-хлор-2-метокси(піперидин-4-ілметил) бензаміду гідрохлорид . 1 ЯМР Н (CDCl3, 400 МГц): δ 8,09 (s, 1H), 7,85-7,76 (m, 1H), 7,60 (d, J = 7,6 Гц, 1H), 7,34 (d, J = 8,0 Гц, 1H), 7,15 (t, J = 7,2 Гц, 1H), 7,10-7,07 (m, 2H), 6,45 (d, J = 3,2 Гц, 1H), 6,27 (s, 1H), 4,34 (s, 2H), 4,18 (t, J = 7,2 Гц, 2H), 3,88 (s, 3Н), 3,32 (t, J = 6,4 Гц, 2Н), 2,88-2,85 (m, 2H), 2,26 (t, J = 7,2 Гц, 2H), 2,03-1,97 (m, 2Н), 1,90-1,80 (m, 2Н), 1,73-1,60 (m, 3H), 1,40-1,32 (m, 2H). Приклад 4: Одержання N-((1-(3-(2-метилімідазол-1-іл)пропіл) піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду Одержують 1-(3-хлорпропіл)-2-метилімідазол, в якості вихідних матеріалів використовуючи 2-метилімідазол і 1-бром-3-хлорпропан , а потім одержують сполуку, зазначену в заголовку (226 мг), в якості вихідних матеріалів використовуючи 1-(3-хлорпропіл)-2метилімідазол і 4-аміно-5-хлор-2-метокси-(піперидин-4-ілметил) бензаміду гідрохлорид . 1 ЯМР Н (CDCl3, 400 МГц): δ 8,06 (s, 1H), 7,78-7,69 (m, 1H), 6,85 (s, 1H), 6,78 (s, 1H), 6,27 (s, 1H), 4,46 (s, 2Н), 3,87-3,83 (m, 5H), 3,29 (t, J = 6.0 Гц, 2Н), 2,85-2,79 (m, 2H), 2,34 (s, 3Н), 2,22 (t, J = 6,8 Гц, 2H), 1,90-1,83 (m, 4H), 1,72-1,67 (m, 2Н), 1,63-1,50 (m, 1H), 1,32-1,26 (m, 2H). Приклад 5: Одержання N-((1-(5-(індол-1-іл)-пентил)піперидин-4-іл) метил)-4-аміно-5-хлор-2метоксибензаміду Одержують 1-(5-хлорпентил)-індол, в якості вихідних матеріалів використовуючи індол і 1бром-5-хлорпентан , а потім одержують сполуку, зазначену в заголовку (250 мг), в якості вихідних матеріалів використовуючи 1-(5-хлорпентил)-індол і 4-аміно-5-хлор-2-метокси(піперидин-4-іл-метил) бензаміду гідрохлорид . 1 ЯМР Н (CDCl3, 400 МГц): δ 8,09 (s, 1H), 7,75-7,69 (m, 1H), 7,60 (d, J = 8,0 Гц, 1H), 7,31 (d, J = 7,6 Гц, 1H), 7,19-7,16 (m, 1H), 7,09-7,05 (m, 2Н), 6,47-6,44 (m, 1H), 6,26 (s, 1H), 4,34 (s, 2Н), 4,11 9 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 4,08 (m, 2H), 3,87 (s, 3Н), 3,30 (t, J = 6,0 Гц, 2Н), 2,92-2,86 (m, 2Н), 2,28-2,20 (m, 2Н), 1,91-1,80 (m, 4H), 1,72-1,48 (m , 5Н), 1,39-1,26 (m, 4H). Приклад 6: Одержання N-((1-(5-(1,2,3-тріазол-1-іл)-пентил) піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду Одержують 1-(5-хлорпентил)-1,2,3-тріазол, в якості вихідних матеріалів використовуючи 1,2,3-тріазол і 1-бром-5-хлорпентан , а потім одержують сполуку, зазначену в заголовку (225 мг), в якості вихідних матеріалів використовуючи 1-(5-хлорпентил)-1,2,3-тріазол і 4-аміно-5-хлор-2-метоксі-(піперидин-4-іл-метил) бензаміду гідрохлорид . 1 ЯМР Н (CDCl3, 400 МГц): δ 8,06 (s, 1H), 7,79-7,70 (m, 1H), 7,67 (s, 1H), 7,52 (s, 1H), 6,27 (s, 1H), 4,41 (s, 2H), 4,35 (t, J = 6,8 Гц, 2H), 3,86 (s, 3Н), 3,28 (t, J = 6,0 Гц, 2Н), 2,92-2,88 (m, 2H), 2,28 (t, J = 7,6 Гц, 2Н), 1,94-1,84 (m, 4H), 1,72-1,68 (m, 2Н), 1,66-1,46 (m, 3H), 1,34-1,21 (m, 4H). Приклад 7: Одержання N-((1-(3-(1,2,3-тріазол-1-іл) пропіл) піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду Стадія 1: Одержання 3-(1,2,3-тріазол-1-іл)-пропанола 1,2,3-тріазол (2 г, 28,96 ммоль) розчиняють у 1,4-діоксані (40 мл), додають карбонат калію (8 г, 57,92 ммоль), йодид калію (962 мг, 5,79 ммоль) і 3-бромпропанол (3,3 мл, 43,43 ммоль) і перемішують при 100°С протягом 3 годин. Після завершення реакції реагенти охолоджують до кімнатної температури і фільтрують. Фільтрат концентрують при зниженому тиску. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (2,5 г, 68 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 7,68 (s, 1H), 7,59 (s, 1H), 4,54 (t, J = 6,8 Гц, 2H), 3,62 (d, J = 5,6 Гц, 2H), 2,44 (t, J = 5,2 Гц, 1H), 2,15-2,10 (m, 2H). Стадія 2: Одержання 3-(1,2,3-тріазол-1-іл)пропілметансульфоната 3-(1,2,3-тріазол-1-іл)-пропанол (2,5 г, 19,66 ммоль) розчиняють у дихлорметані (50 мл) і охолоджують розчин до 0°С. Потім до нього додають триетиламін (5,53 мл, 39,32 ммоль) і сульфонілхлорид метану (2,3 мл, 29,5 ммоль). Реакційну суміш нагрівають до кімнатної температури, перемішують протягом 2 годин, екстрагують дихлорметаном і водою, сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (3,01 г, 75 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 7,72 (s, 1H), 7,63 (s, 1H), 4,55 (t, J = 6,8 Гц, 2H), 4,22 (t, J = 6 Гц, 2Н), 3,03 (s, 3Н), 2,40-2,36 (m, 2H). Стадія 3: Одержання N-((1-(3-(1,2,3-тріазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5хлор-2-метоксибензаміду 4-аміно-5-хлор-2-метокси-(піперидин-4-іл-метил)бензаміду (сполука формули 2) гідрохлорид (400 мг, 1,2 ммоль) розчиняють у диметилформаміді (10 мл), додають 3-(1,2,3-тріазол-1іл)пропілметансульфонат (сполука формули 3) (344 мг, 1,68 ммоль), триетиламін (0,5 мл, 3,591 ммоль), карбонат калію (232 мг, 1,68 ммоль) і йодид калію (40 мг, 0,24 ммоль) і перемішують при 120°С протягом 4 годин. Після завершення реакції реагенти охолоджують до кімнатної температури, екстрагують етилацетатом і водою, сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (185 мг, 38 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 8,09 (s, 1H), 7,74-7,70 (m, 1H), 7,67 (s, 1H), 7,54 (s, 1H), 6,27 (s, 1H), 4,43 (t, J = 6,8 Гц, 2H), 4,35 (s, 2H), 3,88 (s, 3Н), 3,31 (t, J = 6,4 Гц, 2Н), 2,85-2,82 (m, 2H), 2,27 (t, J = 6,8 Гц, 2Н), 2,07-2,04 (m, 2Н), 1,92-1,86 (m, 2Н), 1,73-1,69 (m, 2Н), 1,62-1,50 (m, 1H), 1,341,22 (m, 2H). Приклад 8: Одержання N-((1-(3-(1,2,3-тріазол-2-іл)пропіл) піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду Використовуючи 3-(1,2,3-тріазол-2-іл)пропанол, отриманий як побічний продукт на стадії 1 приклада 7, і 4-аміно-5-хлор-2-метоксі-(піперидин-4-іл-метил)бензаміду гідрохлорид в якості вихідних матеріалів, сполуку, зазначену в заголовку (250 мг), одержують у такий же спосіб, як і в прикладі 7. 1 ЯМР Н (CDCl3, 400 МГц): δ 8,03 (s, 1H), 7,83-7,75 (m, 1H), 7,53 (s, 2H), 6,25 (s, 1H), 4,50-4,42 (m, 4Н), 3,82 (s, 3Н), 3,26 (t, J = 6,0 Гц, 2Н), 2,86-2,83 (m, 2Н), 2,31-2,27 (m, 2Н), 2,12-2,05 (m, 2Н), 1,89-1,83 (m, 2Н), 1,67-1,64 (m, 2Н), 1,60-1,50 (m, 1H), 1,31-1,20 (m, 2H). Приклад 9: Одержання N-((1-(піридин-3-іл-метил)піперидин-4-іл) метил)-4-аміно-5-хлор-2метоксибензаміду 4-аміно-5-хлор-2-метокси-(піперидин-4-іл-метил)бензаміду гідрохлорид (1 г, 2,99 ммоль) розчиняють у метанолі (40 мл), додають 3-піридинкарбоксальдегід (0,42 мл, 4,49 ммоль), оцтову кислоту (1 мл) і ціаноборгідрид натрію (470 мг, 7,48 ммоль) і перемішують при 60°С протягом 5 10 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 годин. Після завершення реакції реакційну суміш концентрують при зниженому тиску, щоб видалити розчинник, екстрагують дихлорметаном і водою, а потім промивають розчином бікарбонату натрію. Органічний шар сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (355 мг, 30 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 8,07 (s, 1H), 7,74-7,69 (m, 1H), 7,65 (d, J = 7,6 Гц, 1H), 7,37 (s, 1H), 7,30 (d, J = 8,4 Гц, 1H), 7,25-7,22 (m, 1H), 7,19-7,15 (m, 1H), 6,26 (s, 1H), 4,42 (s, 2H), 3,83 (s, 3Н), 3,77 (s, 3H), 3,28 (t, J = 5,6 Гц, 2Н), 2,95-2,82 (m, 4H), 2,19-2,14 (m, 4H), 1,91-1,85 (m, 2Н), 1,80-1,72 (m, 2H), 1,69-1,63 (m, 2Н), 1,61-1,53 (m, 1H), 1,32-1,15 (m, 5Н). Приклад 10: Одержання N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5хлор-2-метоксибензаміду Використовуючи 1-метиліндол-3-карбоксальдегід і 4-аміно-5-хлор-2-метокси-(піперидин-4ілметил)бензаміду гідрохлорид в якості вихідних матеріалів, сполуку, зазначену в заголовку (60 мг), одержують у такий же спосіб, як і в прикладі 9. 1 ЯМР Н (CDCl3, 400 МГц): δ 8,02 (s, 1H), 7,82-7,75 (m, 1H), 7,56 (d, J = 8,4 Гц, 1H), 7,33-7,22 (m, 3H), 7,12 (t, J = 7,2 Гц, 1H), 6,27 (s, 1H), 4,38 (s, 2H), 4,01 (s, 2H), 3,87 (s, 3Н), 3,79 (s, 3H), 3,30-3,23 (m, 2H), 2,46-2,37 (m, 2Н), 1,88-1,75 (m, 3H), 1,59-1,50 (m, 2H). Приклад 11: Одержання N-((1-(імідазол-2-іл-метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензаміду Використовуючи 2-імідазолкарбоксальдегід і 4-аміно-5-хлор-2-метокси-(піперидин-4-ілметил)бензаміду гідрохлорид в якості вихідних матеріалів, сполуку, зазначену в заголовку (123 мг), одержують у такий же спосіб, як і в прикладі 9. 1 ЯМР Н (CDCl3, 400 МГц): δ 8,07 (s, 1H), 7,75-7,66 (m, 1H), 6,96 (s, 2H), 6,27 (s, 1H), 4,38 (s, 2H), 3,87 (s, 3Н), 3,61 (s, 2H), 3,31 (t, J = 6,8 Гц, 2Н), 2,85-2,80 (m, 2Н), 2,11-2,04 (m, 2Н), 1,741,69 (m, 2H), 1,63-1,53 (m, 1H), 1,34-1,23 (m, 2H). Приклад 12: Одержання N-((1-((1-метилпірол-2-іл) метил) піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду Використовуючи 1-метил-2-піролкарбоксальдегід і 4-аміно-5-хлор-2-метокси-(піперидин-4-ілметил)бензаміду гідрохлорид в якості вихідних матеріалів, сполуку, зазначену в заголовку (50 мг), одержують у такий же спосіб, як і в прикладі 9. 1 ЯМР Н (CDCl3, 400 МГц): δ 8,08 (s, 1H), 7,75-7,64 (m, 1H), 6,57-6,53 (m, 1H), 6,26 (s, 1H), 6,00-5,96 (m, 1H), 5,95-5,93 (m, 1H), 4,38 (s, 2H), 3,85 (s, 3Н), 3,60 (s, 2H), 3,28 (t, J = 6,8 Гц, 2Н), 2,86-2,82 (m, 2H), 1,92-1,84 (m, 2Н), 1,68-1,63 (m, 2Н), 1,61-1,53 (m, 1H), 1,30-1,19 (m, 2H). Приклад 13: Одержання N-((1-(4-фторбензил)піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду Використовуючи 4-фторбензальдегід і 4-аміно-5-хлор-2-метокси-(піперидин-4-ілметил)бензаміду гідрохлорид в якості вихідних матеріалів, сполуку, зазначену в заголовку (215 мг), одержують у такий же спосіб, як і в прикладі 9. 1 ЯМР Н (CDCl3, 400 МГц): δ 8,07 (s, 1H), 7,75-7,68 (m, 1H), 7,27-7,21 (m, 2Н), 7,00-6,94 (m, 2H), 6,26 (s, 1H), 4,36 (s, 2H), 3,86 (s, 3H), 3,46-3,43 (m, 2H), 3,28 (t, J = 6,4 Гц, 2Н), 2,87-2,84 (m, 2Н), 2,01-1,91 (m, 2Н), 1,70-1,56 (m, 3H), 1,36-1,20 (m, 2H). Приклад 14: Одержання N-((1-(4-гідроксибензил)піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду Використовуючи 4-гідроксібензальдегід і 4-аміно-5-хлор-2-метокси-(піперидин-4-ілметил)бензаміду гідрохлорид в якості вихідних матеріалів, сполуку, зазначену в заголовку (75 мг) одержують у такий же спосіб, як і в прикладі 9. 1 ЯМР Н (CDCl3, 400 МГц): δ 7,81 (s, 1H), 7,19 (d, J = 8,8 Гц, 2H), 6,75 (s, J = 8,8 Гц, 2H), 6,20 (s, 1H), 4,40 (з , 2Н), 3,76 (s, 2Н), 3,32-3,24 (m, 5Н), 3,12-3,05 (m, 2Н), 2,68-2,59 (m, 2Н), 1,80-1,72 (m, 3H), 1,27-1,12 (m, 2H). Приклад 15: Одержання N-((1-(2-(індол-3-іл)етил)піперидин-4-іл) метил)-4-аміно-5-хлор-2метоксибензаміду Стадія 1: Одержання 2-(індол-3-іл)етанолу Індол-3-оцтову кислоту (5 г, 28,54 ммоль) розчиняють у діетиловому ефірі (100 мл) і охолоджують розчин до 0°С. Додають алюмогідрид літію (1,19 г, 31,39 ммоль), потім перемішують протягом 4 годин. Реакцію припиняють додаванням води і 10%-го розчину гідроксиду натрію. Реакційну суміш фільтрують через целіт і концентрують при зниженому тиску. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (1,24 г, 27 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 8,10-7,96 (bs, 1H), 7,61 (d, J = 7,6 Гц, 1H), 7,36 (дд, J = 8 Гц, 0,8 Гц, 1H), 7,24-7,17 (m, 1H), 7,15-7,07 (m, 2Н), 3,92-3,87 (m, 2Н), 3,05-3,00 (m, 2H). 11 UA 107702 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 2: Одержання 3-(2-брометил)-індолу (сполука формули 3) 2-(індол-3-іл)етанол (623 мг, 3,86 ммоль) розчиняють у дихлорметані (20 мл) і охолоджують розчин до 0°С. Потім додають трифенілфосфін (1,12 г, 4,25 ммоль) і тетрабромметан (1,41 г, 4,25 ммоль) і перемішують протягом 1 години. Після завершення реакції реакційну суміш концентрують при зниженому тиску для видалення розчинника. Отриманий осад очищають за допомогою колонкової хроматографії для одержання сполуки, зазначеної в заголовку (765 мг, 88 %). 1 ЯМР Н (CDCl3, 400 МГц): δ 8,10-7,88 (bs, 1H), 7,58 (d, J = 8 Гц, 1Н), 7,38-7,34 (m, 1H), 7,247,20 (m, 1H), 7,19-7,08 (m, 2Н), 3,65-3,60 (m, 2Н), 3,35-3,30 (m, 2H). Стадія 3: Одержання N-((1-(2-(індол-3-іл)етил)піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду Використовуючи 3-(2-брометил)-індол і 4-аміно-5-хлор-2-метоксі-(піперидин-4-ілметил)бензаміду гідрохлорид в якості вихідних матеріалів, сполуку, зазначену в заголовку (190 мг), одержують у такий же спосіб, як і в прикладі 1-3. 1 ЯМР Н (CDCl3, 400 МГц): δ 8,09 (s, 1H), 8,05 (s, 1H), 7,81-7,75 (m, 1H), 7,59 (d, J = 7,6 Гц, 1H), 7,33 (d, J = 8,4 Гц, 1H), 7,16 (t, J = 7,2 Гц, 1H), 7,09 (t, J = 7,6 Гц, 1H), 7,00 (d, J = 1,6 Гц, 1H), 6,27 (s, 1H), 4,36 (s, 2H), 3,88 (s, 3Н), 3,32 (t, J = 6,4 Гц, 2Н), 3,12-3,07 (m, 2Н), 3,01-2,96 (m, 2Н), 2,73-2,69 (m, 2Н), 2,11-2,04 (m, 2Н), 1,79-1,75 (m, 2Н), 1,74-1,63 (m, 1H), 1,49-1,38 (m, 2H). Приклад 16: Одержання N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор2-метоксибензаміду гідрохлориду N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід (приклад 2) (517 мг, 1,27 ммоль) розчиняють в етанолі (10 мл) і додають до нього 12н. розчин гідрохлориду (0,16 мл, 1,90 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 12 годин і потім фільтрують з одержанням зазначеної в заголовку сполуки (417 мг, 74 %). 1 ЯМР Н (DMSO-d6, 400 МГц): δ 10,52 (s, 1H), 9,47 (s, 1H), 8,02-7,99 (m, 1H), 7,64 (s, 1H), 6,47 (s, 1H), 5,95 (s, 2Н), 4,59-4,56 (m, 2H), 3,81 (s, 3H), 3,45-3,42 (m, 2Н), 3,18-3,08 (m, 2Н), 3,04-2,98 (m, 2H), 2,87- 2,79 (m, 2Н), 2,35-2,31 (m, 2Н), 1,90-1,89 (m, 1H), 1,78-1,75 (m, 2Н), 1,58-1,52 (m, 2H). Приклад 17: Одержання N-((1-(5-(1,2,3-тріазол-1-іл)-пентил) піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлориду Використовуючи N-((1-(5-(1,2,3-тріазол-1-іл)-пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід (приклад 6) в якості вихідного матеріалу, сполуку, зазначену в заголовку (112 мг, 35 %), одержують у такий же спосіб, як і в прикладі 16. 1 ЯМР Н (DMSO-d6, 400 МГц): δ 10,06 (s, 1H), 8,14 (s, 1H), 8,02-7,99 (m, 1H), 7,71 (s, 1H), 7,64 (s, 1H), 6,47 (s, 1H), 5,95 (s, 2Н), 4,40-4,37 (m, 2H), 3,81 (s, 3H), 3,40-3,32 (m, 2Н), 3,18-3,12 (m, 2Н), 2,96-2,90 (m, 2Н), 2,84-2,75 (m, 2Н), 1,87-1,70 (m, 7H), 1,59-1,48 (m, 2Н), 1,25-1,17 (m, 2H). Приклад 18: Одержання N-((1-(3-(1,2,3-тріазол-1-іл)пропіл) піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід гідрохлориду Використовуючи N-((1-(3-(1,2,3-тріазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід (приклад 7) в якості вихідного матеріалу, сполуку, зазначену в заголовку (291 мг, 93 %), одержують у такий же спосіб, як і в прикладі 16. 1 ЯМР Н (DMSO-d6, 400 МГц): δ 10,67 (s, 1H), 8,19 (s, 1H), 8,02-7,99 (m, 1H), 7,74 (s, 1H), 7,64 (s, 1H), 6,48 (s, 1H), 5,93 (bs, 2Н), 4,51-4,47 (m, 2H), 3,81 (s, 3H), 3,44-3,41 (m, 2Н), 3,34-3,31 (m, 2Н), 2,98-2,96 (m, 2Н), 2,87-2,79 (m, 2Н), 2,34-2,29 (m, 2Н), 1,96-1,86 (m, 1H), 1,77-1,74 (m, 2Н), 1,60-1,54 (m, 2H). Приклад 19: Одержання N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл) метил)-4-аміно-5хлор-2-метоксибензаміду гідрохлориду Використовуючи N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід (приклад 10) в якості вихідного матеріалу, сполуку, зазначену в заголовку (237 мг, 44 %), одержують у такий же спосіб, як і в прикладі 16. 1 ЯМР Н (DMSO-d6, 400 МГц): δ 10,34 (s, 1H), 7,96-7,93 (m, 1H), 7,79 (d, J = 8 Гц, 1Н), 7,647,59 (m, 2H), 7,47 (d, J = 8 Гц, 1Н), 7,22-7,19 (m, 1H), 7,14-7,10 (m, 1H), 6,47 (s, 1H), 4,36 (d, J = 4,4 Гц, 2H), 3,81 (s, 3H), 3,79 (s, 3H), 3,40-3,37 (m, 2Н), 3,14-3,11 (m, 2Н), 2,90-2,82 (m, 2Н), 1,771,71 (m, 3H), 1,53-1,48 (m, 2H). Приклад 20: Одержання N-((1-(4-фторбензил)піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлориду Використовуючи N-((1-(4-фторбензил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід (приклад 13) в якості вихідного матеріалу, сполуку, зазначену в заголовку (569 мг, 87 %), одержують у такий же спосіб, як і в прикладі 16. 12 UA 107702 C2 1 5 10 15 20 25 ЯМР Н (DMSO-d6, 400 МГц): δ 10,78 (s, 1H), 7,98-7,96 (m, 1H), 7,73-7,63 (m, 3H), 7,30-7,25 (m, 2H), 6,47 (s, 1H ), 5,94 (s, 2H), 4,22 (d, J = 4,8 Гц, 2H), 3,80 (s, 3H), 3,29-3,26 (m, 2Н), 3,14-3,07 (m, 2Н), 2,86-2,78 ( г, 2Н), 1,89-1,85 (m, 1H), 1,77-1,74 (m, 2Н), 1,59-1,53 (m, 2H). Приклад 21: Одержання N-((1-(4-гідроксибензил)піперидин-4-іл) метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлориду Використовуючи N-((1-(4-гідроксибензил) піперидин-4-іл) метил)-4-аміно-5-хлор-2метоксибензамід (приклад 14) в якості вихідного матеріалу, сполуку, зазначену в заголовку (158 мг, 97 %), одержують у такий же спосіб, як і в прикладі 16. 1 ЯМР Н (DMSO-d6, 400 МГц): δ 10,25 (s, 1H), 7,98-7,96 (m, 1H), 7,63 (s, 1H), 7,34 (d, J = 6,4 Гц, 2H), 6,80 (d, J = 6,4 Гц, 2H), 6,47 (s, 1H), 4,08 (d, J = 3,6 Гц, 2H), 3,80 (s, 3H), 3,28-3,25 (m, 2Н), 3,15-3,12 (m, 2H ), 2,82-2,74 (m, 2Н), 1,77-1,62 (m, 3H), 1,54-1,48 (m, 2H). Експериментальний приклад 1: Зв’язуюча здатність сполук з рецептором 5-HT4 Зв’язуюча здатність сполук з людським рецептором 5-HT4 була досліджена відповідно до методу, описаного у літературі [Wyngaert et al., Journal of Neurochemistry, (1997) 69, 1810-1819]. З цією метою одержали і гомогенізували клітини COS-7, експресуючі людський рецептор 5-HT4, для одержання мембранних гомогенатів, що потім використовували в експериментах аналізу зв'язування. Для аналізу зв'язування мембранні гомогенати перемішували і інкубували з різними концентраціями тестуємих матеріалів і [H3]-GR113808 (Amersham Biosciences). Концентрації окремих тестуємих матеріалів складали 4 мкмоль, 1 мкмоль, 0,25 мкмоль і 0,0625 мкмоль, відповідно, і концентрація [H3]-GR113808 складала 0,595 нмоль. Після завершення інкубації продукти реакції зібрали в скловолоконні фільтри GF/B за допомогою приладу для збору клітин Packard і потім визначали радіоактивний зв'язок за допомогою рідинного сцинтиляційного лічильника клітин (Packard TopCount NXT ™, Perkin Elmer). Специфічне зв'язування радіоліганду з рецептором 5-HT4 розраховували шляхом вирахування неспецифічного зв'язування радіоліганду від загального зв'язування радіоліганду. IC 50 підраховували від відсотка інгібування специфічного зв'язування радіоліганду з рецептором 5-HT4, з огляду на різні концентрації досліджуваних матеріалів. Результати наведені в таблиці 1. Таблиця 1 Сполуки цисаприд Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 6 Приклад 7 Приклад 8 Приклад 9 Приклад 10 Приклад 11 Приклад 12 Приклад 13 Приклад 14 Приклад 15 30 35 40 IC50 (нМ) 0,362 0,226 0,164 0,039 0,229 0,005 0,103 0,067 0,182 0,267 0,076 0,454 0,421 0,134 0,375 0,002 Як видно з таблиці 1, сполуки дійсного винаходу інгібували специфічне зв'язування радіоліганду з рецептором 5-HT4 з концентрацією, аналогічною або нижче, ніж у цизаприду як контрольного зразка, у такий спосіб показуючи, що сполуки дійсного винаходу мають сильну зв’язуючу здатність до рецепторів 5-HT4. Експериментальний приклад 2: Оцінка спорожнення шлунка Оцінка спорожнення шлунка була проведена на основі методу, описаного в Iwanaga Y, et al., Jpn J Pharmacol. 1991, 56(3), 261-269. В якості експериментальних тварин використовували пацюків лінії SD (240-250 г), яких розділили на групи (n=5-6). За день до експерименту тварин не годували протягом 18 годин. Тестуємі матеріали приготували у вигляді суспензії в 0,5 % метилцелюлозі і перорально вводили тваринам дозами по 5 мг/кг. Через 1 годину після перорального введення тестуємих матеріалів тваринам перорально вводили 2 мл напівтвердої їжі. Напівтверда їжа була представлена у вигляді каші, подрібненої зі стандартної твердої каші з 13 UA 107702 C2 5 дистильованою водою в змішуючому апараті. Через 50 хвилин після введення напівтвердої їжі тварин умертвляли шляхом зсуву шийних хребців, розрізали черевну порожнину і витягали шлунок. Потім вимірювали вагу їжі, що залишилася в шлунку, тим самим визначаючи швидкість спорожнення шлунка (%). Швидкість спорожнення шлунка була розрахована у відповідності з наступним рівнянням. Результати наведені в таблиці 2. Швидкість спорожнення шлунка (%) = (1-X / Y)*100 X: вага їжі, що залишилася в шлунку, витягнутому через 50 хвилин після введення їжі Y: вага їжі, що залишилася в шлунку, витягнутому відразу після прийому їжі Таблиця 2 Сполуки Контроль (0,5% метилцелюлоза) Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 6 Приклад 7 Приклад 8 Приклад 9 Приклад 10 Приклад 11 Приклад 12 Приклад 13 Приклад 14 Приклад 15 Швидкість спустошення шлунка (%) 32,2 43,0 52,8 45,2 46,4 52,0 46,0 56,1 49,1 51,2 59,1 43,1 62,0 52,3 42,1 41,3 10 15 20 Як видно з таблиці 2, введення сполук дійсного винаходу привело до значного поліпшення спорожнення шлунка, у порівнянні з метилцелюлозним реагентом у якості контрольного, у такий спосіб показуючи, що сполуки дійсного винаходу сприяють рухливості шлунково-кишкового тракту. Експериментальний приклад 3: Гостра пероральна токсичність сполук у мишей З метою вивчення гострої токсичності сполук, відповідно до дійсного винаходу, був проведений наступний експеримент. 200 мг кожної зі сполук зразків розтирали в 1% гідроксипропілметилцелюлозі й отриману суміш перорально вводили самцям мишей лінії ICR віку 5 тижнів (20 г ± 2 г, n=5) у дозі 1 г/10 мл/кг. Мінімальну летальну дозу (МЛД, мг/кг) окремих сполук одержували спостереженням смертності, маси тіла, клінічних симптомів і подібного тварин протягом усього 2-тижневого періоду експерименту. Результати наведені в таблиці 3 нижче. Таблиця 3 Сполуки Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 6 Приклад 7 Приклад 8 Приклад 9 Приклад 10 Приклад 11 Приклад 12 Приклад 13 Приклад 14 Приклад 15 Мінімальна летальна доза (МЛД, мг/кг) >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 >1000 14 UA 107702 C2 5 10 15 Як видно з результатів тестів на гостру токсичність з таблиці 3, усі сполуки, використовувані в тесті, показують МЛД більше 1000 мг/кг, у такий спосіб підтверджуючи, що сполуки дійсного винаходу є безпечними для використання. Експериментальний приклад 4:Афінність лікарських сполук до рецепторів hERG Афінність сполук до гена специфічних калієвих каналів серця людини (hERG), що зв'язані з тривалістю інтервалу QT, проаналізували в MDS Pharma Service (Каталог № 265900). Мембранні гомогенати були отримані з кліток ссавців HEK-293, експресуючих калієві канали hERG і потім використані в експерименті аналізу зв'язування. Для експерименту аналізу зв'язування мембранні гомогенати перемішували й інкубували з 10 мкм тестуємих матеріалів і 1,5 нмоль [H3]-артемізолу (Perkin Elmer). Після завершення інкубації підраховували радіоактивний зв'язок з K+ каналами hERG. Афінність кожного тестуємого матеріалу до K+ каналів hERG розраховували від відсотка інгібування специфічного зв'язування радіоліганду з K+ каналом hERG, у результаті дії тестуэмого матеріалу. Результати приведені в таблиці 4. [Таблиця 4] Сполуки Приклад 1 Приклад 2 Приклад 4 Приклад 6 Приклад 7 Приклад 8 Приклад 9 Приклад 11 Приклад 12 Приклад 13 Приклад 14 20 Інгібування (% при 10 мкМ) 1 4 14 8 7 15 6 21 32 52 40 Захворюваність серцевою аритмією, що викликає фатальний негативний результат, пов'язана з тривалістю інтервалу QT, що виникає через надмірно високу афінність препарату до рецептора hERG. Сполуки дійсного винаходу показують швидкість гальмування менш ніж 50%, навіть у дозі 10 мкм і, отже, мають низьку афінність до рецептора hERG, у такий спосіб підтверджуючи, що сполуки даного винаходу мають значно низький ризик викликання аритмії. ФОРМУЛА ВИНАХОДУ 25 1. Сполука, представлена формулою 1: [Формула 1] O Cl H2N 30 35 40 N H OCH3 N (CH2)m Q , де m - ціле число від 1 до 10; Q - моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, де моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, незалежно заміщений 0, 1, 2 або 3 замісниками, вибраними з С 1-С4алкілу, С1С4алкокси, гідрокси та галогену; або її фармацевтично прийнятна сіль. 2. Сполука формули 1 або її фармацевтично прийнятна сіль за п. 1, де сполука формули 1 або її фармацевтично прийнятна сіль є сполукою, вибраною з групи, що складається з наступних сполук: (1) N-((1-(3-(1,2,4-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (2) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (3) N-((1-(3-(індол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (4) N-((1-(3-(2-метилімідазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, 15 UA 107702 C2 5 10 15 20 (5) N-((1-(5-(індол-1-іл)-пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (6) N-((1-(5-(1,2,3-триазол-1-іл)-пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (7) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (8) N-((1-(3-(l,2,3-тpиaзoл-2-iл)пpoпiл)пiпepидин-4-iл)мeтил)-4-aмiнo-5-xлop-2-метоксибензамід, (9) N-((1-(піридин-3-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (10) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (11) N-((1-(імідазол-2-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (12) N-((1-((1-метилпірол-2-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (13) N-((1-(2-(індол-3-іл)етил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (14) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид, (15) N-((1-(5-(1,2,3-триазол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензаміду гідрохлорид, (16) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензаміду гідрохлорид, (17) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид. 3. Спосіб одержання сполуки формули 1 або її фармацевтично прийнятної солі, у якому вводять в реакцію сполуку формули 2 або її фармацевтично прийнятну сіль зі сполукою формули 3 у присутності основи з введенням сполуки формули 3 до аміну в положенні 1 піперидинового кільця сполуки формули 2 або її фармацевтично прийнятної солі, у такий спосіб одержуючи сполуку формули 1; O Cl N H OCH3 H2N 25 N (CH2)m Q , [Формула 2] O Cl N H OCH3 H2N NH , [Формула 3] Y 30 35 40 45 (CH2)m Q , де m і Q такі ж, як визначено в п. 1, a Y являє собою атом галогену або С1-С4алкілсульфонат. 4. Спосіб за п. 3, де основу вибирають з карбонату калію, йодиду калію, триетиламіну, діізопропілетиламіну і їх суміші. 5. Спосіб за п. 3, де сполуку формули 2 або її фармацевтично прийнятну сіль одержують за допомогою таких стадій: (1) вводять в реакцію сполуку формули 4 з реагентом для введення амінозахисної групи, щоб ввести амінозахисну групу до аміну в положенні 1 піперидинового кільця сполуки формули 4, у такий спосіб одержуючи сполуку формули 5; (2) вводять в реакцію гідроксильну групу сполуки формули 5 з N-бромсукцинімідом і тетрабромідом вуглецю або С1-С4алкільним сульфонілгалогенідом у присутності основи з одержанням сполуки формули 6; (3) вводять в реакцію замісник Y сполуки формули 6 з азидом натрію з одержанням сполуки формули 7; (4) заміщають азидогрупу сполуки формули 7 на аміногрупу в присутності відновника з одержанням сполуки формули 8; (5) вводять в реакцію сполуку формули 8 зі сполукою формули 9 у присутності реагенту для формування амідного зв'язку з одержанням сполуки формули 10; і (6) видаляють амінозахисну групу кільця піперидину сполуки формули 10 у присутності основи або кислоти; 16 UA 107702 C2 [Формула 2] O Cl N H NH OCH3 H2N , [Формула 4] HO NH , 5 [Формула 5] HO N O Z O 10 , [Формула 6] Y N O Z O , [Формула 7] N3 N O Z O , 15 [Формула 8] H2N N O Z O , [Формула 9] O Cl 20 H2N OH OCH3 , [Формула 10] 17 UA 107702 C2 O Cl N H OCH3 H2N 5 10 15 N O Z O , де Y - атом галогену або С1-С4алкілсульфонат, a Z являє собою С1-С4алкіл. 6. Спосіб за п. 5, де реагентом для введення амінозахисної групи стадії (1) є ди-третбутилдикарбонат або етилхлорформіат в присутності третинного аміну. 7. Спосіб за п. 5, де С1-С4алкільним сульфонілгалогенідом стадії (2) є метансульфонілхлорид, метансульфонілбромід або метансульфонілфторид. 8. Спосіб за п. 5, де відновником на стадії (4) є трифенілфосфін або літійалюмінійгідрид. 9. Спосіб за п. 5, де реагент для формування амідного зв'язку на стадії (5) вибирають з N-(3диметиламінопропіл)-N'-етилкарбодііміду і 1-гідроксибензотриазолу в присутності основи, етилхлорформіату в присутності основи або карбодіімідазолу у відсутності основи. 10. Спосіб за п. 5, де основу або кислоту на стадії (6) вибирають з соляної кислоти, трифтороцтової кислоти або гідроксиду калію. 11. Спосіб одержання сполуки формули 1 або її фармацевтично прийнятної солі, у якому вводять в реакцію сполуку формули 2 або її фармацевтично прийнятну сіль зі сполукою формули 11 у присутності відновника з одержанням сполуки формули 1; [Формула 1] O Cl N H OCH3 H2N N (CH2)m Q , [Формула 2] O Cl 20 N H OCH3 H2N NH , [Формула 11] O H 25 30 35 Q, де Q такий же, як визначено в п. 1, a m являє собою ціле число 1. 12. Спосіб за п. 11, де відновником є ціаноборгідрид натрію й оцтова кислота або боргідрид натрію. 13. Спосіб за п. 11, де сполуку формули 2 або її фармацевтично прийнятну сіль одержують за допомогою таких стадій: (1) вводять в реакцію сполуку формули 4 з реагентом для введення амінозахисної групи, щоб ввести амінозахисну групу до аміну в положенні 1 піперидинового кільця сполуки формули 4, у такий спосіб одержуючи сполуку формули 5; (2) вводять в реакцію гідроксильну групу сполуки формули 5 з N-бромсукцинімідом і тетрабромідом вуглецю або С1-С4алкільним сульфонілгалогенідом у присутності основи з одержанням сполуки формули 6; (3) вводять в реакцію замісник Y сполуки формули 6 з азидом натрію з одержанням сполуки формули 7; (4) заміщають азидогрупу сполуки формули 7 на аміногрупу в присутності відновника з одержанням сполуки формули 8; 18 UA 107702 C2 5 (5) вводять у реакцію сполуку формули 8 зі сполукою формули 9 у присутності реагенту для формування амідного зв'язку з одержанням сполуки формули 10; і (6) видаляють амінозахисну групу кільця піперидину сполуки формули 10 у присутності основи або кислоти; [Формула 2] O Cl N H NH OCH3 H2N , [Формула 4] HO NH , 10 [Формула 5] HO N O Z O , [Формула 6] Y N O Z O 15 , [Формула 7] N3 N O Z O 20 , [Формула 8] H2N N O Z O , [Формула 9] 19 UA 107702 C2 O Cl H2N OH OCH3 , [Формула 10] O Cl H2N N H OCH3 N O Z O 5 10 15 , де Y - атом галогену або С1-С4алкілсульфонат, a Z являє собою С1-С4алкіл. 14. Спосіб за п. 13, де реагентом для введення амінозахисної групи стадії (1) є ди-третбутилдикарбонат або етилхлорформіат в присутності третинного аміну. 15. Спосіб за п. 13, де С1-С4алкільним сульфонілгалогенідом стадії (2) є метансульфонілхлорид, метансульфонілбромід або метансульфонілфторид. 16. Спосіб за п. 13, де відновником на стадії (4) є трифенілфосфін або літійалюмінійгідрид. 17. Спосіб за п. 13, де реагент для формування амідного зв'язку на стадії (5) вибирають з N-(3диметиламінопропіл)-N'-етилкарбодііміду і 1-гідроксибензотриазолу в присутності основи, етилхлорформіату в присутності основи або карбодіімідазолу у відсутності основи. 18. Спосіб за п. 13, де основу або кислоту на стадії (6) вибирають із соляної кислоти, трифтороцтової кислоти або гідроксиду калію. 19. Композиція, що містить сполуку формули 1, що являє собою агоніст рецептора 5-НТ4: [Формула 1] O Cl H2N 20 25 30 35 40 N H OCH3 N (CH2)m Q , де m - ціле число від 1 до 10; Q - моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, в якому моноциклічний 5-6-членний нітрогенвмісний гетероарил, що містить від 1 до 4 атомів нітрогену, або біциклічний 9-членний нітрогенвмісний гетероарил, що містить 1 нітроген, незалежно заміщений 0, 1, 2 або 3 замісниками, вибраними з С 1-С4алкілу, С1С4алкокси, гідрокси та галогену; або її фармацевтично прийнятну сіль як активний інгредієнт. 20. Композиція, за п. 19, де сполука формули 1 або її фармацевтично прийнятна сіль є сполукою з групи, що складається з наступних сполук: (1) N-((1-(3-(1,2,4-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (2) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (3) N-((1-(3-(індол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (4) N-((1-(3-(2-метилімідазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензамід, (5) N-((1-(5-(індол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (6) N-((1-(5-(1,2,3-триазол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (7) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (8) N-((1-(3-(1,2,3-триазол-2-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (9) N-((1-(піридин-3-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (10) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (11) N-((1-(імідазол-2-ілметил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (12) N-((1-((1-метилпірол-2-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (13) N-((1-(2-(індол-3-іл)етил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензамід, (14) N-((1-(3-(тетразол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид, 20 UA 107702 C2 5 10 15 20 25 (15) N-((1-(5-(1,2,3-триазол-1-іл)пентил)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензаміду гідрохлорид, (16) N-((1-(3-(1,2,3-триазол-1-іл)пропіл)піперидин-4-іл)метил)-4-аміно-5-хлор-2метоксибензаміду гідрохлорид, (17) N-((1-((1-метиліндол-3-іл)метил)піперидин-4-іл)метил)-4-аміно-5-хлор-2-метоксибензаміду гідрохлорид. 21. Композиція за будь-яким з пп. 19-20, де композиція є композицію для профілактики або лікування різних хворобливих станів, вибраних з гастроезофагеальної рефлюксної хвороби, шлунково-кишкового захворювання, розладу шлункової рухливості, невиразкової диспепсії, функціональної диспепсії, синдрому подразненого кишечнику (СПК), запору, диспепсії, езофагіту, гастроезофагеальної хвороби, нудоти, захворювання центральної нервової системи, хвороби Альцгеймера, когнітивного порушення, блювання, мігрені, неврологічного захворювання, болю, серцево-судинного розладу, серцевої недостатності, аритмії серця, діабету і синдрому апное. 22. Спосіб профілактики, лікування або полегшення захворювань, пов'язаних з ослабленою ефективністю рецептора 5-НТ4, у якому вводять композицію, що містить сполуку формули 1 за будь-яким з пунктів 1 або 2 або фармацевтично прийнятну сіль як активний інгредієнт, ссавцям, включаючи людей, що потребують агоністичної дії рецепторів 5-НТ4. 23. Спосіб за п. 22, де зазначені захворювання вибрані з гастроезофагеальної рефлюксної хвороби, шлунково-кишкового захворювання, розладу шлункової рухливості, невиразкової диспепсії, функціональної диспепсії, синдрому подразненого кишечнику (СПК), запору, диспепсії, езофагіту, гастроезофагеальної хвороби, нудоти, захворювань центральної нервової системи, хвороби Альцгеймера, когнітивного порушення, блювання, мігрені, неврологічного захворювання, болю, серцево-судинного розладу, серцевої недостатності, аритмії серця, діабету і синдрому апное. Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel benzamide derivatives
Автори англійськоюKim, Soon-Hoe, Im, Weon-Bin, Choi, Sung-Hak, Choi, Sun-Ho, Sohn, Ju-Hee, Sung, Hyun-Jung, Kim, Mi-Yeon, Cho, Kang-Hun, Sohn, Tae-Kyoung
Автори російськоюКхим Сон-Хве, Им Веон-Пин, Чхой Сун-Хак, Чхой Сун-Хо, Сохн Чу-Хе, Сун Хюн-Чун, Кхим Ми-Йон, Чхо Кхан-Хун, Сохн Тхе-Кхьон
МПК / Мітки
МПК: C07D 211/26, C07D 211/16, A61K 31/435
Код посилання
<a href="https://ua.patents.su/23-107702-pokhidni-benzamidu.html" target="_blank" rel="follow" title="База патентів України">Похідні бензаміду</a>
Попередній патент: Пристрій для прямого перетворення сонячної радіації в змінний багатофазний електричний струм за допомогою фотоелементів
Наступний патент: Блок паливних елементів, спрямовуючий елемент і застосування спрямовуючого елемента
Випадковий патент: Суміш суха для ентерального харчування хворих з нирковою недостатністю