4-феніламінохіназолін-6-іламіди
Номер патенту: 85706
Опубліковано: 25.02.2009
Автори: Рід Джессіка Елізабет, Секстон Карен Елейн, Шлоссер Кевін Меттью, Лі Хелен Ценвай, Тікл Хейл, Факхоурі Стівен Алан, Вінтерс Рой Томас
Формула / Реферат
1. Сполука формули:
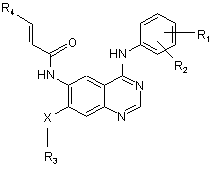 ,
,
в якій:
R1 вибраний з F, Вr, Сl або І;
R2 вибраний з Н, F, Вr, Сl або І;
R3 вибраний з:
a) С1-С3 лінійного або розгалуженого алкілу, необов'язково заміщеного одним або більшою кількістю атомів галогену; або
b) -(СН2)n-морфоліно, -(СН2)n-піперидину, -(СН2)n-піперазину, (СН2)n-піперазин-N(С1-С3алкіл), -(СН2)n-піролідину або -(СН2)n-імідазолу;
n є цілим числом від 1 до 4;
R4 є -(CH2)m-Het;
Het є гетероциклічним залишком вибраним з морфоліну, піперидину, піперазину, піперазин-N(C1-C3алкілу), імідазолу, піролідину, азепану, 3,4-дигідро-2Н-піридину або 3,6-дигідро-2Н-піридину, причому кожен гетероциклічний залишок є необов'язково заміщеним від 1 до 3 групами, вибраними з С1-С3алкілу, галогену, ОН, NH2, NH(С1-С3алкілу) або N(С1-С3алкілу)2;
m є цілим числом від 1 до 3; і
Х є О, S aбo NH;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1 формули:
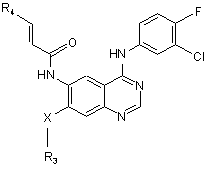 ,
,
в якій:
R3 вибраний з:
а) С1-С3 лінійного або розгалуженого алкілу, необов'язково заміщеного одним або більшою кількістю атомів галогену; або
b) -(СН2)q-морфоліно, -(СН2)q-піперидину, -(СН2)q-піперазину, -(СН2)q-піперазин-N(С1-С3алкілу), -(СН2)q-піролідину або -(СН2)q-імідазолу;
q є цілим числом від 1 до 2;
R4 є -(CH2)m-Het;
Het є піперидиновою, піперазиновою, піперазин-N(С1-С3алкільною), імідазольною, піролідиновою, азепановою або дигідропіридиновою групою, необов'язково заміщеною 1 або 2 групами, вибраними з галогену або С1-С3алкілу;
m є цілим числом від 1 до 3; і
Х є О, S aбo NH;
або її фармацевтично прийнятна сіль.
3. Сполука за будь-яким з попередніх пунктів формули:
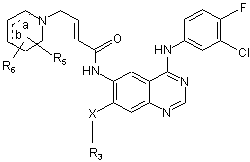 ,
,
в якій:
R3 є С1-С3 лінійним або розгалуженим алкілом, необов'язково заміщеним одним або більшою кількістю атомів галогену;
R5 і R6 незалежно вибрані з Н, С1-С3алкілу, F, Вr, І або Сl;
Х є О, S aбo NH; і
пунктирні лінії позначені а і b, кожна означає необов'язковий подвійний зв'язок, за умови що, тільки один подвійний зв'язок а або b існує в одній сполуці;
або її фармацевтично прийнятна сіль.
4. Сполука за будь-яким з попередніх пунктів, в якій X є О і R3 є С1-С3 лінійним або розгалуженим алкілом необов'язково заміщеним від 1 до 3 атомів галогену.
5. Сполука, вибрана з групи:
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метилсульфанілхіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метиламінохіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-ізопропоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-бромфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-етоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-пропоксихіназолін-6-іл]аміду;
4-(4-фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-(3-фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-(2-фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-морфолін-4-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-азепан-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-трифторметоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-фторметоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-фторетоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-(2-фторетилсульфаніл)хіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-трифторетоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-дифторетоксихіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-(3-морфолін-4-іл-пропокси)хіназолін-6-іл]аміду;
4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-(2-піперидин-1-іл-етокси)хіназолін-6-іл]аміду;
4-(3,4-дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-(3,6-дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-піперазин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-(4-метилпіперазин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-імідазол-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
4-піролідин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метилсульфанілхіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метиламінохіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-ізопропоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-бромфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-етоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-пропоксихіназолін-6-іл]аміду;
5-(4-фторпіперидин-1-іл)-пент-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-(3-фторпіперидин-1-іл)-пент-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-(2-фторпіперидин-1-іл)-пент-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-морфолін-4-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-азепан-1-іл-пент-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-трифторметоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-фторметоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-фторетоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-(2-фторетилсульфаніл)хіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-трифторетоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-дифторетоксихіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-(3-морфолін-4-іл-пропокси)хіназолін-6-іл]аміду;
5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-(2-піперидин-1-іл-етокси)хіназолін-6-іл]аміду;
6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду;
6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метилсульфанілхіназолін-6-іл]аміду;
6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метиламінохіназолін-6-іл]аміду;
6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-етоксихіназолін-6-іл]аміду; або
6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-фторетоксихіназолін-6-іл]аміду;
або її фармацевтично прийнятна сіль.
6. 4-Піперидин-1-ілбут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]амід або його фармацевтично прийнятна сіль.
7. Фармацевтична композиція, яка містить фармацевтично ефективну кількість сполуки згідно з пунктом 1 і фармацевтично прийнятний носій.
8. Фармацевтична композиція, яка містить фармацевтично ефективну кількість 4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду та фармацевтично прийнятний носій.
9. Спосіб лікування проліферативних розладів у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість сполуки згідно з пунктом 1 або її фармацевтично прийнятної солі, естеру або аміду.
10. Спосіб лікування проліферативних розладів у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду.
11. Спосіб лікування раку молочної залози у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду.
12. Спосіб лікування раку ободової кишки у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду.
13. Спосіб лікування недрібноклітинного раку легень у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду.
14. Сполука формули:
 ,
,
в якій R4 має значення, як наведено в пункті 1, і гало являє собою F, Сl, Вr або I.
15. Сполука формули:
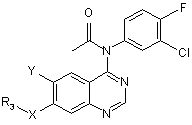 ,
,
в якій:
Y є NH2 NO2 або групою R4-(CH2)m-CH=CH-C(O)-NH2-; і
m є цілим числом від 1 до 3;
R3 вибраний з:
а) С1-С3 лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або
b) -(СН2)n-морфоліно, -(СН2)n-піперидину, -(СН2)n-піперазину, -(СН2)n-піперазин-N(С1-С3алкілу), -(СН2)n-піролідину або -(СН2)n-імідазолу;
n є цілим числом від 1 до 4;
R4 є -(CH2)m-Het;
Het є гетероциклічним залишком вибраним з групи морфоліну, піперидину, піперазину, піперазин-N(С1-С3алкілу), імідазолу, піролідину, азепану, 3,4-дигідро-2Н-піридину або 3,6-дигідро-2Н-піридину, причому кожен гетероциклічний залишок є необов'язково заміщеним від 1 до 3 групами, вибраними з С1-С3алкілу, галогену, ОН, NH2, NH(C1-C3алкілу) або N(С1-С3алкілу)2;
m є цілим числом від 1 до 3; і
Х є О, S aбo NH.
16. Сполука формули:
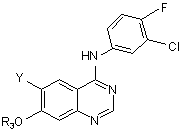 ,
,
в якій:
Y - NО2, NH2 або групою гало-(СН2)m-СН=СН-С(O)-NН2-;
гало є F, Сl, Вr або І;
m є цілим числом від 1 до 3;
R3 вибраний з:
a) моно-, ди- або три-галогенованої метильної групи;
b) С2-С3 лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або
c) -(СН2)n-морфоліно, -(СН2)n-піперидину, -(СН2)n-піперазину, -(СН2)n-піперазин-N(С1-С3алкіл), -(СН2)n-піролідину або -(СН2)n-імідазолу.
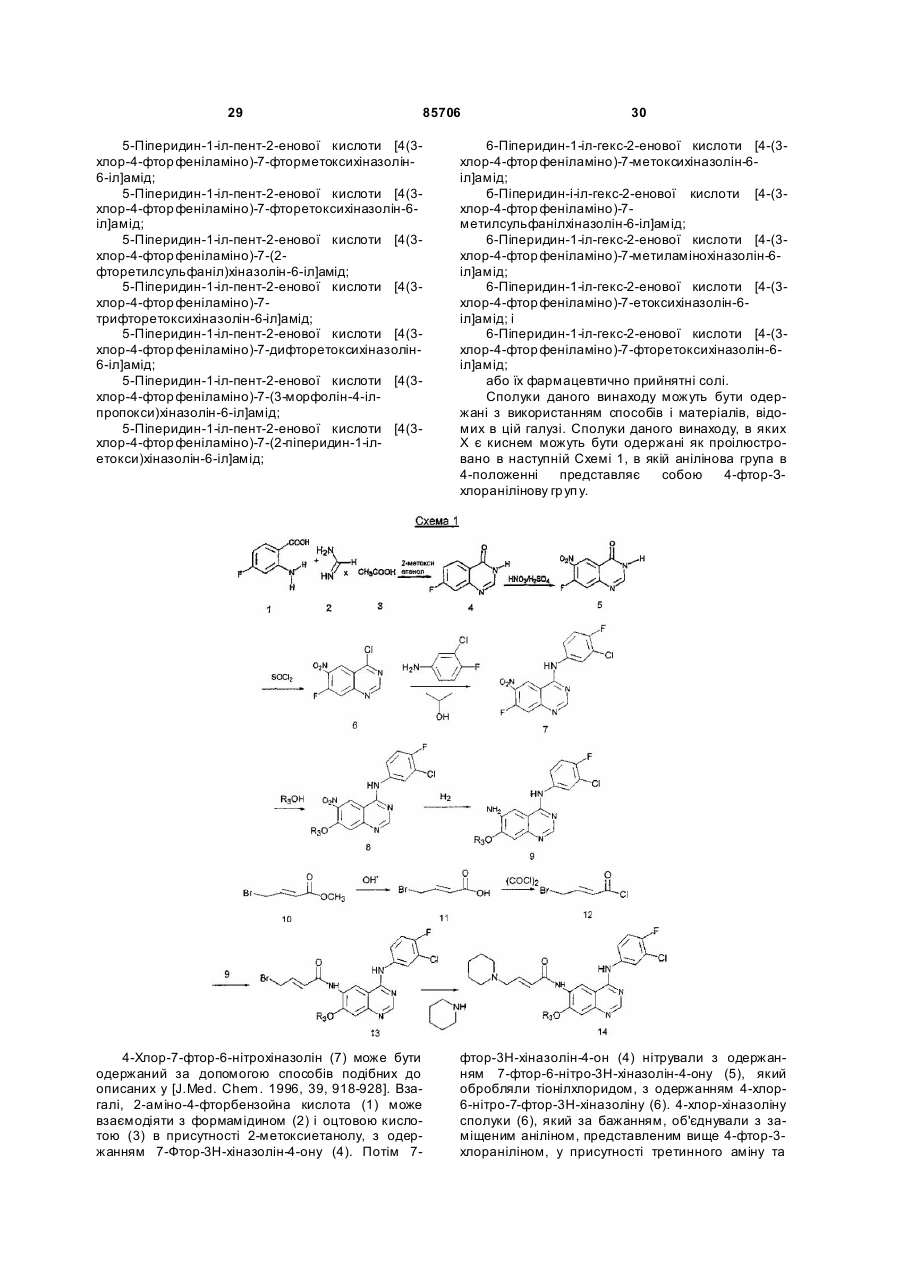
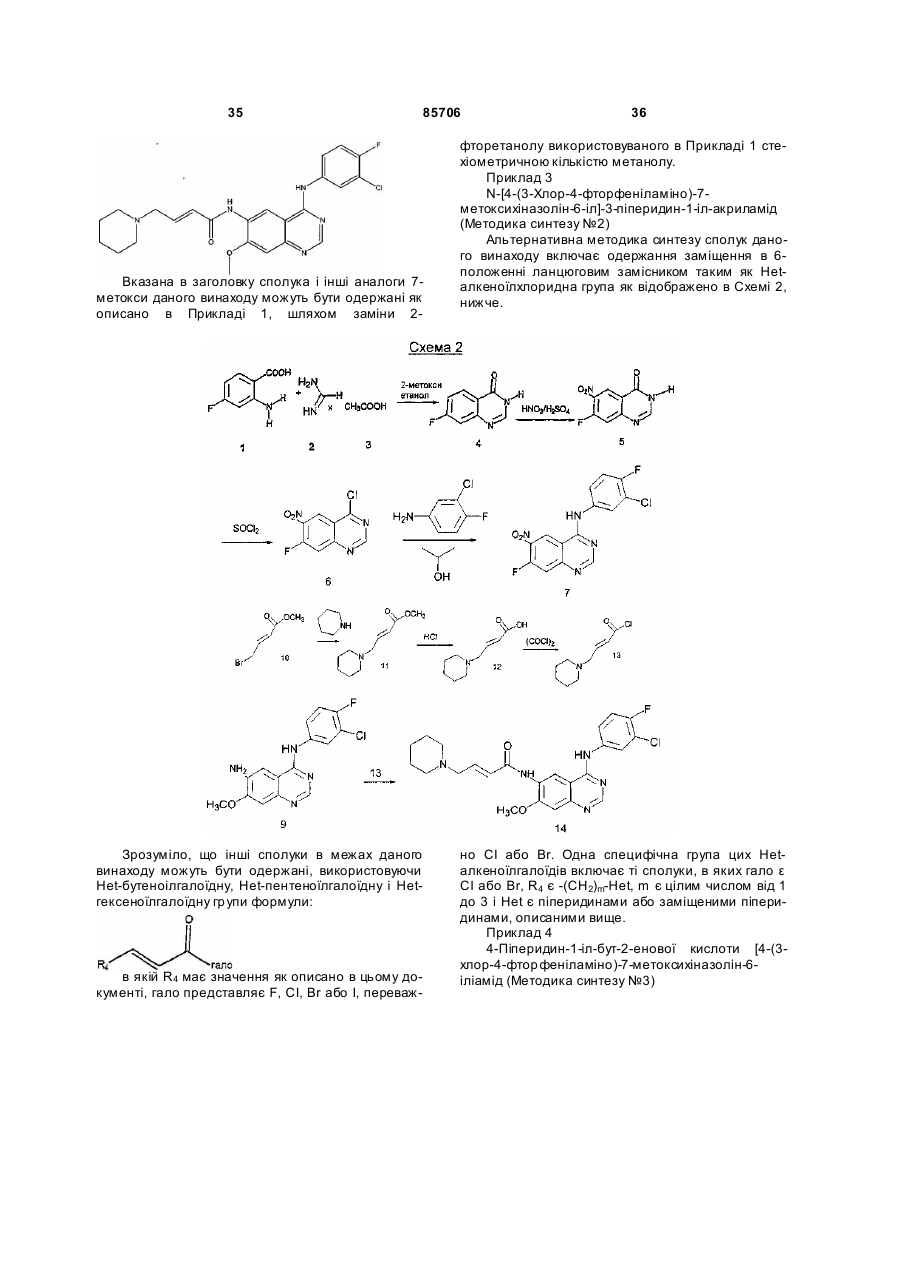
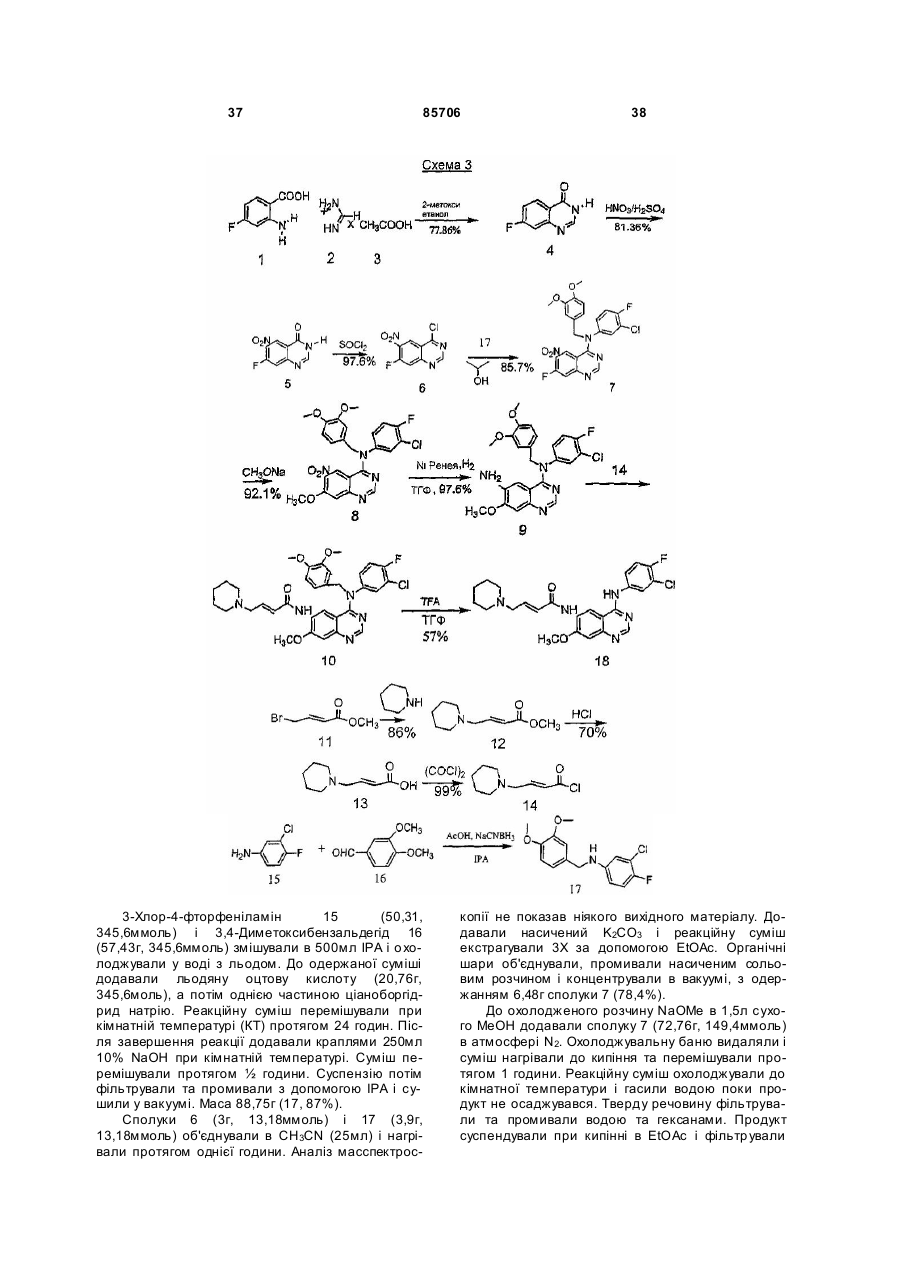
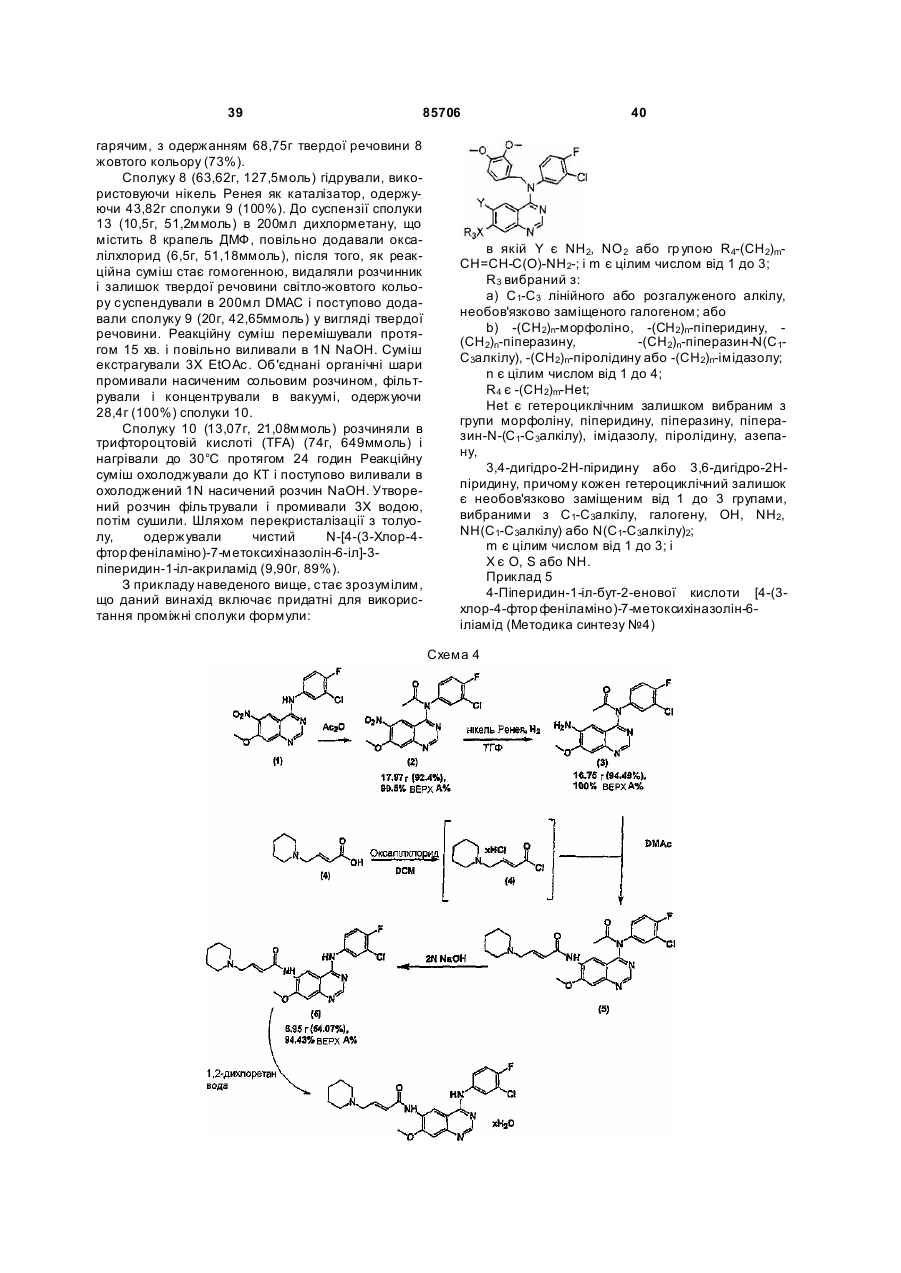
Текст
1. Сполука формули: 2 Cl N N , 3 85706 R3 є С1-С3 лінійним або розгалуженим алкілом, необов'язково заміщеним одним або більшою кількістю атомів галогену; R5 і R6 незалежно вибрані з Н, С1-С3алкілу, F, Вr, І або Сl; Х є О, S aбo NH; і пунктирні лінії позначені а і b, кожна означає необов'язковий подвійний зв'язок, за умови що, тільки один подвійний зв'язок а або b існує в одній сполуці; або її фармацевтично прийнятна сіль. 4. Сполука за будь-яким з попередніх пунктів, в якій X є О і R3 є С1-С3 лінійним або розгалуженим алкілом необов'язково заміщеним від 1 до 3 атомів галогену. 5. Сполука, вибрана з групи: 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метилсульфанілхіназолін-6іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метиламінохіназолін-6іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-ізопропоксихіназолін-6іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3бромфеніламіно)-7-метоксихіназолін-6-іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-етоксихіназолін-6-іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-пропоксихіназолін-6-іл]аміду; 4-(4-фторпіперидин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду; 4-(3-фторпіперидин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду; 4-(2-фторпіперидин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду; 4-морфолін-4-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 4-азепан-1-іл-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-трифторметоксихіназолін-6іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-фторметоксихіназолін-6іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-фторетоксихіназолін-6іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-(2фторетилсульфаніл)хіназолін-6-іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-трифторетоксихіназолін-6іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-дифторетоксихіназолін-6іл]аміду; 4 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-(3-морфолін-4-ілпропокси)хіназолін-6-іл]аміду; 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-(2-піперидин-1-ілетокси)хіназолін-6-іл]аміду; 4-(3,4-дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]аміду; 4-(3,6-дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]аміду; 4-піперазин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 4-(4-метилпіперазин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду; 4-імідазол-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 4-піролідин-1-іл-бут-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-метилсульфанілхіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-метиламінохіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-ізопропоксихіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3бромфеніламіно)-7-метоксихіназолін-6-іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-етоксихіназолін-6-іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-пропоксихіназолін-6-іл]аміду; 5-(4-фторпіперидин-1-іл)-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду; 5-(3-фторпіперидин-1-іл)-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду; 5-(2-фторпіперидин-1-іл)-пент-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду; 5-морфолін-4-іл-пент-2-енової кислоти [4(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 5-азепан-1-іл-пент-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-трифторметоксихіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-фторметоксихіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-фторетоксихіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-(2фторетилсульфаніл)хіназолін-6-іл]аміду; 5 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-трифторетоксихіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-дифторетоксихіназолін-6іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-(3-морфолін-4-ілпропокси)хіназолін-6-іл]аміду; 5-піперидин-1-іл-пент-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-(2-піперидин-1-ілетокси)хіназолін-6-іл]аміду; 6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор4-фторфеніламіно)-7-метоксихіназолін-6-іл]аміду; 6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор4-фторфеніламіно)-7-метилсульфанілхіназолін-6іл]аміду; 6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор4-фторфеніламіно)-7-метиламінохіназолін-6іл]аміду; 6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор4-фторфеніламіно)-7-етоксихіназолін-6-іл]аміду; або 6-піперидин-1-іл-гекс-2-енової кислоти [4-(3-хлор4-фторфеніламіно)-7-фторетоксихіназолін-6іл]аміду; або її фармацевтично прийнятна сіль. 6. 4-Піперидин-1-ілбут-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-метоксихіназолін-6-іл]амід або його фармацевтично прийнятна сіль. 7. Фармацевтична композиція, яка містить фармацевтично ефективну кількість сполуки згідно з пунктом 1 і фармацевтично прийнятний носій. 8. Фармацевтична композиція, яка містить фармацевтично ефективну кількість 4-піперидин-1-іл-бут2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду та фармацевтично прийнятний носій. 9. Спосіб лікування проліферативних розладів у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість сполуки згідно з пунктом 1 або її фармацевтично прийнятної солі, естеру або аміду. 10. Спосіб лікування проліферативних розладів у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4-піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду. 11. Спосіб лікування раку молочної залози у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду. 12. Спосіб лікування раку ободової кишки у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду або його фармацевтично прийнятної солі, естеру або аміду. 85706 6 13. Спосіб лікування недрібноклітинного раку легень у ссавця, при якому призначають ссавцеві, який цього потребує, фармацевтично ефективну кількість 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміду або його фармацевтично прийнятної солі, естеру або аміду. 14. Сполука формули: O R4 гало , в якій R4 має значення, як наведено в пункті 1, і гало являє собою F, Сl, Вr або I. 15. Сполука формули: F O N Y R3 Cl N N X , в якій: Y є NH2 NO2 або групою R4-(CH2)m-CH=CH-C(O)NH2-; і m є цілим числом від 1 до 3; R3 вибраний з: а) С1-С3 лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або b) -(СН2)n-морфоліно, -(СН2)n-піперидину, -(СН2)nпіперазину, -(СН2)n-піперазин-N(С1-С3алкілу), (СН2)n-піролідину або -(СН2)n-імідазолу; n є цілим числом від 1 до 4; R4 є -(CH2)m-Het; Het є гетероциклічним залишком вибраним з групи морфоліну, піперидину, піперазину, піперазинN(С1-С3алкілу), імідазолу, піролідину, азепану, 3,4дигідро-2Н-піридину або 3,6-дигідро-2Н-піридину, причому кожен гетероциклічний залишок є необов'язково заміщеним від 1 до 3 групами, вибраними з С1-С3алкілу, галогену, ОН, NH2, NH(C1-C3алкілу) або N(С1-С3алкілу)2; m є цілим числом від 1 до 3; і Х є О, S aбo NH. 16. Сполука формули: F Cl HN Y N N R3 O , в якій: Y - NО2 , NH2 або групою гало-(СН2)m-СН=СН-С(O)NН2-; гало є F, Сl, Вr або І; m є цілим числом від 1 до 3; R3 вибраний з: a) моно-, ди- або три-галогенованої метильної групи; b) С2-С3 лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або c) -(СН2)n-морфоліно, -(СН2)n-піперидину, -(СН2)nпіперазину, -(СН2)n-піперазин-N(С1-С3алкіл), (СН2)n-піролідину або -(СН2)n-імідазолу. 7 85706 Даний винахід стосується нових сполук, які діють як інгібітори тирозинкіназ і є придатними для використання в способах лікування, попередження або інгібування проліферативних захворювань, що включають рак, атеросклероз, рестеноз, ендометріоз і псоріаз. Особливо, даний винахід стосується нових 4-аніліно-6-заміщених алкеноїламінохіназолінів корисних для лікування таких розладів. Заміщені 4-феніламінохіназолін-6-іл-аміди, що придатні для використання для лікування раку були розкриті в цій галузі, включаючи ті, що розкриті в [патенті США 5.457.105 (Barker), патенті США 5.760.041 (Wissner і інші), патенті США 5.770.599 (Gibson), патенті США 5.929.080 (Frost), патенті США 5.955.464 (Barker), патенті США 6.251.912 (Wissner і інші), патенті США 6.344.455 (Bridges і інші), патенті США 6.344 459 (Bridges і інші), патенті США 6.414.148 (Thomas і інші), патенті США 5.770.599 (Gibson і інші), патентній заявці США 2002/0173509 (Himmelsbach і інші) і патенті США 6.323.209 (Frost)]. Всі ще існує потреба в нових і е фективних сполуках для лікування проліферативних розладів. Даний винахід включає хіназоліни Формули І: в якій: R1 вибраний з F, Вr, СІ або І; R2 вибраний з Н, F, Вr, СІ або І; R3 вибраний з: a) С1-C3лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або b) -(СН2)n-морфоліно, -(СН2)n-піперидину, (СН2)n-піперазину, -(СН2)n-піперазин-N(С1C3алкілу), -(СН2)п-піролідину або -(СН2)п-імідазолу; n є цілим числом від 1 до 4, R4 є -(CH2)m-Het; Het є гетероциклічним залишком, вибраним з групи, що включає морфолін, піперидин, піперазин, піперазин-N(С1-C3алкіл), імідазол, піролідин, азепан, 3,4-дигідро-2Н-піридин або 3,6-дигщро-2Нпіридин, причому кожен гетероциклічний залишок є необов'язково заміщеним від 1 до 3 групами, вибраними з С 1-C3алкілу, галогену, ОН, NH2, NH(С1-C3алкілу) або N(С1-C3алкілу)2; m є цілим числом від 1 до 3; і Х є О, S aбo NH, або їх фармацевтично прийнятну сіль. Даний винахід також включає способи застосування сполук даного винаходу для лікування, інгібування, попередження або контролю розвитку проліферативних захворювань, що включають рак, рестеноз, псоріаз, атеросклероз або ендометрюз, 8 за допомогою одного з способів, який включає призначення фармацевтично або терапевтично ефективної кількості наведеної в цьому документі сполуки ссавцеві, який цього потребує. Даний винахід надалі включає фармацевтичні композиції, що включають фармацевтично ефективну кількість сполуки даного винаходу та один або більше фармацевтично прийнятних ексціпієнтів і/або носіїв. Даний винахід також включає методики синтезу та проміжні сполуки, що є придатними для використання при одержанні сполук, наведених у цьому документі. Перша група сполук даного винаходу включає сполуки, що описані вище, в яких F^ є галогеном і R2 є воднем. Інша - включає сполуки, в яких R1 є фтором, a R2 є іншим галогеном. Наступна група включає сполуки, в яких R-, є 4-фтором і R2 є 3-хлором. Інша група сполук даного винаходу включає сполуки Формули II: в якій: R3 вибраний з: a) С1-C3лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або b) -(СН2)q -морфоліно, -(СН2)q -піперидину, (СН2)q -піперазину, -(СН2)q -піперазин-N(С1C3алкілу), -(СН2)q -піролідину або -(СН2)q -імідазолу; q є цілим числом від 1 до 2; R4 є -(CH2)m-Het; Het є піперидин-, піперазин-, піперазин-N(С1C3алкіл)-, імідазол-, піролідин-, азепан- або дигідропіридиновою групою, необов'язково заміщеною 1 або 2 групами, вибраними з галогену або С 1C3алкілу; m є цілим числом від 1 до 3; і Х є О, S aбo NH, або їх фармацевтично прийнятну сіль. Наступна група сполук даного винаходу включає сполуки Формули III: в якій: R3 є С1-C3лінійним або розгалуженим алкілом, необов'язково заміщеним галогеном; R5 і R6 незалежно вибрані з Н, С1-C3алкілу, F, Вr, І або СІ; 9 85706 Х є О, S aбo NH; і пунктирні лінії позначені а та b кожна означають необов'язковий подвійний зв'язок, за умови, що тільки один подвійний зв'язок а або b існує в одній сполуці; або їх фармацевтично прийнятну сіль. Підгрупа кожної з груп сполук описаних у цьому документі включає підгрупу, в якій Х є О. Ін ші підгрупи включають ті, в яких X є NH або S. Інша підгрупа кожної групи в цьому документі включає сполуки, в яких X є О і R3 є С1-C3лінійним або розгалуженим алкілом, необов'язково заміщеним від 1 до 3 атомів галогену. Інша підгрупа включає сполуки, в яких R3 є поліфторованим С 2-С3алкілом, таким як 1,1,2,2-тетрафторетильна або 2,2,3,3,3пентафторпропільна групи, або перфторована С2С3алкільна група, така як пентафторетильна або гептафторпропільна група. Фахівцю галузі буде зрозуміло, що С1-C3лінійні або розгалужені алкільні групи позначені як R3 в описаних тут гр упах можуть бути галогеновані одним або більше галогенами, включаючи пергалогеновані, тобто, що мають максимальну кількість галогенів, що досягається обмеженням валентності алкільної групи (тобто, R3 є трифторметилом, пентафторетилом, гептафторпропілом і т.д.). Сполуки даного винаходу можуть застосовуватися для інгібування активності тирозинкіназ, зокрема, включаючи еrbВ1, еrbВ2 і erbB4. Сполуки даного винаходу можуть використовуватися в способах лікування, інгібування, попередження або контролю розвитку проліферативних захворювань, що включають рак, рестеноз, псоріаз, атеросклероз або ендометрюз. Розлади, пов'язані з клітинною проліферацією, можуть лікуватися цими способами включають рак, скелетарні розлади, розлади пов'язані з анпогенезом або проліферацією кровоносних судин, фіброзні розлади та мезанпальні клітинні проліферативні розлади. Фіброзні проліферативні розлади, тобто анормальне утворення позаклітинного матриксу, що можуть лікуватися цими сполуками та способами, включають атеросклероз, цироз печінки та мезангіальні клітинні проліферативні розлади (включаючи ниркові захворювання у людини, такі як гломерулонефрит, діабетичну невропатію, злоякісний склероз нирок, тромбозні мікроангіопатичні синдроми, відторгнення трансплантату та гломерулопатію). Кожний з способів описаних у цьому документі включає призначення ссавцеві, який цього потребує, фармацевтично або терапевтично ефективної кількості сполуки даного винаходу, або її фармацевтично прийнятної солі. Даний винахід також забезпечує спосіб лікування або інгібування полікістозного захворювання нирок у ссавця, який включає призначення ссавцеві, що страждає на полікістозне захворювання нирок, фармацевтично ефективної кількості сполуки даного винаходу. Даний спосіб застосовують як при аутосомально-рецисивній так і при аутосомально-домінантній формах полікістозного захворювання нирок. Крім того, даний винахід також забезпечує спосіб лікування або інгібування поліпів ободової кишки у ссавця, який включає призначення ссав 10 цеві, що страждає на полікістозне захворювання нирок, фармацевтично ефективної кількості сполуки даного винаходу. Зрозуміло, що способи пригнічення полипів ободової кишки, включають способи, що знижують швидкість росту полипів ободової кишки. Способи лікування або пригнічення полипів ободової кишки у ссавців можуть також включати сумісне призначення або періодичне використання додаткових фармацевтично ефективних агентів, таких як СОХ-2 інгібітори, що включають целекоксиб; рофекоксиб; валдекоксиб; луміракоксиб (також відомий як СОХ-189); LAS-34475; UR-8880; 2(3,4-Дифторфеніл)-4-(3-гідрокси-3-метилбутокси)5-[4-метилсульфоніл)феніл]-3(2Н)-пірадазинон (АВТ-963); 3-[(3-хлорфеніл)[4(метилсульфоніл)феніл]метилен]дигідро-2(3Н)Фуранон (BMS-347070); Тілакоксиб; Сполуку 4-[5-(2,4-дифторфеніл)4,5-дигідро-3-(трифторметил)-1Н-піразол-1-іл]бензолсульфонамід (також відомий як Ε 6087); CS-502 [Chemical Abstracts Service Registry Number ("CAS Reg. No.") 176429-82-6]; (6aR,10aR)3-(1,1-диметилгептил)-6а,7,10,10а-тетрагідро-1гідрокси-6,6-диметил-6Н-дибензо[b,d]піран-9карбонову кислоту ("СТ-3"); C V-247; 2(5Н)Фуранон, 5,5-диметил-3-(1-метилетокси)-4-[4(метилсульфоніл)феніл]-("DFP"); карпрофен; деракоксиб; Еторикоксиб (торгова назва ARCOXIA® від MERCK & CO., Inc., Whitehouse Station, New Jersey); GW-406381; аспірин; Тіракоксиб; Мелоксикам; Німесулід; 2-(Ацетилокси)бензойну кислоту, 3-[(нітроокси)метил]феніловий естер ("NCX-4016"); Парекоксиб (подана заявка на реєстрацію DYNASTAT® як торгової назви від G. D. Searle & Co., Skokie, Illinois); N-Ацетил-L-треоніл-L-пролілL-аргініл-D-проліл-L-глутамініл-L-серил-L-гістиділL-аспарапніл-L-α-аспартилглщил-L-α-аспартил-Lфенілаланіл-L-α-лутаміл-L-α-глутаміл-L-ізолеуцилL-проліл-L-α-глутаміл-L-α-глутаміл-L-тирозил-Lлеуцил-L-глутамін [також відомий як Р54, CAS Reg. No.130996-28-0]; Рофекоксиб (торгова назва VIOXX® від MERCK & CO., Inc., Whitehouse Station, New Jersey); RevlMiD; 2,6-Біс(1,1диметилетил)-4-[(Е)-(2-етил-1,1-діоксо-5ізотіазолідиніліден)метил]фенол ("S-2474"); 5(Р)Тіо-6-сульфонамід-3(2Н)бензофуранон ("SVT2016"); і N-[3-(Форміламіно)-4-оксо-6-фенокси-4Н1-бензопіран-7-іл]метансульфонамід ("Т-614"); або їх фармацевтично прийнятну сіль. Даний винахід також стосується способу лікування анормального росту клітин у ссавця, включаючи людину, що включає призначення згаданому ссавцеві певної кількості сполуки формули 1, як визначено вище, або її фармацевтично прийнятної солі, сольвату або проліків, що є е фективної при лікуванні анормального росту клітин У першому втіленні даного способу, анормальним ростом клітин є рак, що включає, але не обмежується ними, рак легень, рак кісток, рак підшлункової залози, рак шкіри, рак голови і шиї, шкірну або внутрішньоокулярну меланому, рак матки, рак яєчника, ректальний рак, рак анальної області, рак шлунку, рак ободової кишки, рак молочної залози, карциному фаллопієвих труб, карциному ендометрію, цервікальну карциному, карциному піхви, карци 11 85706 ному вульви, хворобу Ходжкіна, рак стравоходу, рак тонкої кишки, рак залоз ендокринної системи, рак щитовидної залози, рак паращитовидних залоз, рак надниркових залоз, саркому м'яких тканин, рак уретри, рак пеніса, рак простати, хронічну або гостру лейкемію, лімфоцитну лімфому, рак міхура, рак нирок або сечоводу, нирково-клітинну карциному, ренопельвікальну карциному, неоплазми центральної нервової системи (ЦНС), первинну лімфому ЦНС, п ухлини спинальних аксонів, гліому стовбура мозку, аденому гіпофізу або комбінації одного або більшої кількості вищенаведених захворювань на рак. У першому втіленні спосіб включає призначення ссавцеві певної кількості сполуки формули 1, що є ефективною для лікування згаданої ракової солідної пухлини. У першому переважному втіленні солідною пухлиною є рак молочних залоз, легень, ободової кишки, мозку, простати, шлунку, підшлункової залози, яєчника, шкіри (меланома), ендокринної системи, матки, тестикулярний рак і рак міхура. В іншому втіленні згаданого способу, згаданий анормальний ріст клітин є доброякісним проліферативним захворюванням, що включає, але не обмежується ними, псоріаз, доброякісну гіпертрофію простати або рестеноз. Даний винахід також стосується способу лікування анормального росту клітин у ссавця, що включає призначення згаданому ссавцеві певної кількості сполуки формули 1 або її фармацевтично прийнятної солі, сольвату або проліків, що є ефективною при лікуванні анормального росту клітин в комбінації з протипухлинним агентом, що вибирають з групи, яка включає мітотичні інгібітори, алкілюючі агенти, антиметаболіти, інтеркалюючі антибіотики, інгібітори фактору росту, інгібітори клітинного циклу, ензими, інгібітори топоізомерази, модифікатори біологічної відповіді, антитіла, цитотоксичні агенти, антигормональні агенти та антиандрогени. Даний винахід також стосується фармацевтичної композиції для лікування анормального росту клітин у ссавця, включаючи людину, що містить певну кількість сполуки формули 1, як визначено вище, або її фармацевтично прийнятної солі, сольвату або проліків, що є е фективною при лікуванні анормального росту клітин і фармацевтично прийнятний носій. У першому втіленні згаданої композиції, згаданим анормальним ростом клітин є рак, що включає, але не обмежується ними, рак легень, рак кісток, рак підшлункової залози, рак шкіри, рак голови і шиї, шкірну або внутрішньоокулярну меланому, рак матки, рак яєчника, ректальний рак, рак анальної області, рак шлунку, рак ободової кишки, рак молочної залози, рак матки, карциному фаллопієвих тр уб, карциному ендометрію, цервікальну карциному, карциному піхви, карциному вульви, хворобу Ходжкіна, рак стравоходу, рак тонкої кишки, рак залоз ендокринної системи, рак щитовидної залози, рак паращитовидних залоз, рак надниркових залоз, саркому м'яких тканин, рак уретри, рак пеніса, рак простати, хронічну або гостру лейкемію, лімфоцитну лімфому, рак міхура, рак нирок або сечоводу, нирково-клітинну карциному, ренопельвікальну карциному, неопла 12 зми центральної нервової системи (ЦНС), первинну лімфому ЦНС, п ухлини спинальних аксонів, гліому стовбура мозку, аденому гіпофізу або комбінацію одного або більшої кількості згаданих захворювань на рак. В іншому втіленні згаданої фармацевтичної композиції, згаданий анормальний ріст клітин є доброякісним проліферативним захворюванням, що включає, але не обмежується ними, псоріаз, доброякісну гіпертрофію простати або рестеноз. Даний винахід також стосується способу лікування анормального росту клітин у ссавця, що включає призначення згаданому ссавцеві певної кількості сполуки формули 1, або її фармацевтично прийнятної солі, сольвату або проліків, що є ефективною при лікуванні анормального росту клітин в комбінації з іншим протипухлинним агентом, що вибирають з групи, яка включає мітотичні інгібітори, алкілюючі агенти, антиметаболіти, інтеркалюючі антибіотики, інгібітори фактору росту, інгібітори клітинного циклу, ензими, інгібітори топоізомерази, модифікатори біологічної відповіді, антитіла, цитотоксичні агенти, антигормональні агенти та антиандрогени. Винахід також стосується фармацевтичної композиції для лікування анормального росту клітин, яка містить сполуку формули 1, як визначено вище, або її фармацевтично прийнятну сіль, сольват або проліки, що є ефективною при лікуванні анормального росту клітин і, інший протипухлинний агент, який вибирають з групи, що включає мітотичні інгібітори, алкілюючі агенти, антиметаболіти, інтеркалюючі антибіотики, інгібітори фактору росту, інгібітори клітинного циклу, ензими, інгібітори топоізомерази, модифікатори біологічної відповіді, антитіла, цитотоксичні агенти, антигормональні агенти та антиандрогени. Даний винахід стосується також способу лікування розладу, пов'язаного з ангіогенезом у ссавця, в тому числі, людини, який включає введення згаданому ссавцеві певної кількості сполуки формули 1, як визначено вище, або її фармацевтично прийнятної солі, сольвату або проліків, що є ефективною при лікуванні згаданого розладу в комбінації з одним або більше протипухлинними агентами, наведеними вище Такі розлади включають ракові пухлини такі як меланома; офтальмологічні розлади такі як вікова макулярна дегенерація, презюмований синдром очного гістоплазмозу і ретинальна реваскуляризація при проліферативній діабетичній ретинопатії; ревматоїдний артрит, розлади, пов'язані з втратою кісткової маси такі як остеопороз, хвороба Педжета, гуморальна гіперкальцемія при злоякісній формі розвитку хвороби, гіперкальцемія при метастазах зі злоякісної пухлини до кісток та остеопороз, індукований глюкокортикоїдним лікуванням; коронарний рестеноз і деякі мікробні інфекційні хвороби, включаючи ті, які пов'язані з патогенними мікроорганізмами, вибраними з групи, що включає аденовірус, гантавіруси, Borrelia burgdorferi, різновиди Yersinia, Bordetella pertussis і груп у А Streptococcus. Даний винахід стосується також способу (і фармацевтичної композиції, призначеної для) лікування анормального росту клітин у ссавця, який включає використання певної кількості сполуки 13 85706 формули 1, або її фармацевтично прийнятної солі, сольвату або проліків, у комбінації з однією або більшою кількістю речовин, вибраних із групи, що включає антиангіогенні агенти, інгібітори трансдукції сигналів і антипроліферативні агенти, причому зазначені кількості, взяті разом, є ефективними при лікуванні згаданого анормального росту клітин. Антиангіогенні засоби, такі як, наприклад, інгібітори ММР-2 (матриксної металопротеїнази 2), інгібітори ММР-9 (матриксної металопротеїнази 9) і інгібітори СОХ-ІІ (циклооксигенази II), можуть використовуватися в поєднанні з сполукою формули 1 в способах та фармацевтичних композиціях, описаних в цьому документі. Приклади корисних інгібіторів СОХ-ІІ включають CELEBREX™ (целекоксиб), Bextra (валдекоксиб), паракоксиб, Vioxx (рофекоксиб) і Агсохіа (еторикоксиб). Приклади корисних інгібіторів матриксної металопротеїнази описані в [публікації міжнародної патентної заявки WO 96/33172 (опублікованій 24 жовтня 1996), публікації міжнародної патентної заявки WO 96/27583 (опублікованій 7 березня 1996), Європейській патентній заявці №97304971,1 (поданій 8 липня 1997), Європейській патентній заявці №99308617,2 (поданій 29 жовтня 1999), публікації міжнародної патентної заявки WO 98/07697 (опублікованій 26 лютого 1998), публікації міжнародної патентної заявки WO 98/03516 (опублікованій 29 січня 1998), публікації міжнародної патентної заявки WO 98/34918 (опублікованій 13 серпня 1998), публікації міжнародної патентної заявки WO 98/34915 (опублікованій 13 серпня 1998), публікації міжнародної патентної заявки WO 98/33768 (опублікованій 6 серпня 1998), публікації міжнародної патентної заявки WO 98/30566 (опублікованій 16 липня 1998), публікації Європейської патентної заявки 606.046 (опублікованій 13 липня 1994), публікації Європейської патентної заявки 931.788 (опублікованій 28 липня 1999), публікації міжнародної патентної заявки WO 90/05719 (опублікованій 31 травня, 1990), публікації міжнародної патентної заявки WO 99/52910 (опублікованій 21 жовтня 1999), публікації міжнародної патентної заявки WO 99/52889 (опублікованій 21 жовтня 1999), публікації міжнародної патентної заявки WO 99/29667 (опублікованій 17 червня 1999), міжнародній патентній заявці №РСТ/ІВ98/01113 (поданій 21 липня 1998), Європейській патентній заявці №99302232.1 (поданій 25 березня 1999), патентній заявці Великобританії №9912961,1 (поданій 3 червня 1999), тимчасовій патентній заявці США 60/148.464 (поданій 12 серпня 1999), патенті США №5.863.949 (виданому 26 січня 1999), патенті США №5.861.510 (виданому 19 січня 1999) і публікації Європейської патентної заявки 780.386 (опублікованій 25 червня 1997)], всі з яких включені в цьому документі посиланням в їх повноті. Переважними інгібіторами ММР-2 і ММР-9 є ті, які мають незначну або не мають ніякої інгібувальної дії відносно ММР-1. Більш переважними з них є ті, що селективно інгібують ММР-2 і/або ММР-9 по відношенню до інших матриксних металопротеїназ (тобто ММР-1, ММР-3, ММР-4, ММР5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР12 і ММР-13). 14 Деякими конкретними прикладами інгібіторів ММР, що доцільно використовувати в комбінації з сполуками даного винаходу, можуть служити AG3340, RO 32-3555, PS 13-0830 і сполуки наведені у наступному переліку: 3-[[4-(4фтор фенокси)бензолсульфоніл]-(1гідроксикарбамоїлциклопентил)аміно]пропіонова кислота; гідроксиамід 3-екзо-3-[4-(4фтор фенокси)бензолсульфоніламіно]-8оксабіцикло[3.2.1]октан-3-карбонової кислоти; гідроксиамід (2R,3R) 1-[4-(2-хлор-4фторбензилокси)бензолсульфоніл]-3-гідрокси-3метилпіперидин-2-карбонової кислоти; гідроксиамід 4-[4-(4фтор фенокси)бензолсульфоніламіно]тетрагідропіран-4карбонової кислоти; 3-[[4-(4фтор фенокси)бензолсульфоніл]-(1гідроксикарбамоїлциклобутил)аміно]пропіонова кислота; гідроксиамід 4-[4-(4хлорфенокси)бензолсульфоніламіно]тетрагідропіран-4карбонової кислоти; гідроксиамід 3-[4-(4хлорфенокси)бензолсульфоніламіно]тетрагідропіран-3карбонової кислоти; гідроксиамід (2R,3R) 1-[4-(4фтор-2-метил-бензилокси)бензолсульфоніл]-3гідрокси-3-метилпіперидин-2-карбонової кислоти; 3-[[4-(4-фторфенокси)бензолсульфоніл]-(1гідроксикарбамоїл-1-метилетил)аміно]пропіонова кислота; 3-[[4-(4-фторфенокси)бензолсульфоніл](4-гідроксикарбамоїлтетрагідропіран-4іл)аміно]пропіонова кислота; гідроксиамід 3-екзо-3[4-(4-хлорфенокси)бензолсульфоніламіно]-8оксабіцикло[3.2.1]октан-3-карбоновоі кислоти; гідроксиамід 3-ендо-3-[4-(4фтор фенокси)бензолсульфоніламіно]-8оксабіцикло[3.2.1]октан-3-карбонової кислоти; і гідроксиамід 3-[4-(4фтор фенокси)бензолсульфоніламіно]тетрагідрофуран-3карбонової кислоти; і фармацевтично прийнятні солі, сольвати та проліки згаданих сполук. Інгібітори VEGF, наприклад, SU-11248, SU5416 і SU-6668 (Sugen Inc. of South San Francisco, California, USA), можуть також бути поєднаними з сполукою формули 1 Інгібітори VEGF описані, наприклад, у [публікації міжнародної патентної заявки WO 99/24440 (опублікованій 20 травня 1999), міжнародній патентній заявці РСТ/ІВ99/00797 (поданій 3 травня 1999), у публікації міжнародної патентної заявки WO 95/21613 (опублікованій 17 серпня 1995), публікації міжнародної патентної заявки WO 99/61422 (опублікованій 2 грудня 1999), патенті США №5.834.504 (виданому 10 листопада 1998), публікації міжнародної патентної заявки WO 98/50356 (опублікованій 12 листопада 1998), патенті США №5.883.113 (виданому 16 березня 1999), патенті США №5 886 020 (виданому 23 березня 1999), патенті США №5.792.783 (виданому 11 серпня 1998), патенті США 6.653.308 (виданому 25 листопада 2003), публікації міжнародної патентної заявки WO 99/10349 (опублікованій 4 березня 1999), публікації міжнародної патентної заявки WO 97/32856 (опублікованій 12 вересня 1997), публі 15 85706 кації міжнародної патентної заявки WO 97/22596 (опублікованій 26 червня 1997), публікації міжнародної патентної заявки WO 98/54093 (опублікованій 3 грудня 1998), публікації міжнародної патентної заявки WO 98/02438 (опублікованій 22 січня 1998), публікації міжнародної патентної заявки WO 99/16755 (опублікованій 8 квітня 1999), і публікації міжнародної патентної заявки WO 98/02437 (опублікованій 22 січня 1998)], всі з яких включені в цьому документі посиланням в їх повноті. Іншими прикладами деяких конкретних інгібіторів VEGF є ІМ862 (Cytran Inc. Kirkland, Washington, USA); Авастин, анти-VEGF моноклональное антитіло, від Genentech, Inc. South San-Francisco, California; та ангіозим - синтетичний рибозим від Ribozyme (Boulder, Colorado) i Chiron (Emeryville, California). Інгібітори рецепторів erbB2, такі як GW-282974 (Glaxo Wellcome ріс), СР-724.714 (Pfizer Inc.) і моноклональні антитіла AR-209 (Aronex Pharmaceuticals Inc. of the Woodlands, Texas, USA) і 2В-1 (Chiron), можуть призначатися в комбінації зі сполукою формули 1. Такі інгібітори еrbВ2 також включають Герцептин, 2С4 і пертузумаб. Такі інгібітори еrbВ2 включають інгібітори описані в [публікації міжнародної патентної заявки WO 98/02434 (опублікованій 22 січня 1998), публікації міжнародної патентної заявки WO 99/35146 (опублікованій 15 липня 1999), публікації міжнародної патентної заявки WO 99/35132 (опублікованій 15 липня 1999), публікації міжнародної патентної заявки WO 98/02437 (опублікованій 22 січня 1998), публікації міжнародної патентної заявки WO 97/13760 (опублікованій 17 квітня 1997), публікації міжнародної патентної заявки WO 95/19970 (опублікованій 27 липня 1995), патенті США №5.587.458 (виданому 24 грудня 1996) та патенті США №5.877.305 (виданому 2 березня 1999)], кожний з яких включений в цьому документі посиланням у його повноті. Інгібітори рецепторів еrbВ2 придатні для використання в представленому винаході також описані в тимчасовій [патентній заявці США №60/117.341, поданій 27 січня 1999] і в тимчасовій [патентній заявці США №60/117.346, поданій 27 січня 1999], обидві з яких включені посиланням в цьому документі в їх повноті. Інші нгібітори рецепторів erbb2 включають ТАК-165 (Takeda) і GW-572016 (GlaxoWellcome). Численні інші сполуки такі як похідні стиролу, також продемонстрували, що мають інгібувальні властивості тирозинкіназ і деякі інгібітори тирозинкіназ були ідентифіковані як інгібітори рецепторів еrbВ2. До недавнього часу, п'ять публікацій європейських патентних заявок, а саме: [ЕР 0 566 226 А1 (опублікована 20 жовтня 1993), ЕР 0 602 851 А1 (опублікована 22 червня 1994), ЕР 0 635 507 А1 (опублікована 25 січня 1995), ЕР 0 635 498 А1 (опублікована 25 січня 1995) і ЕР 0 520 722 А1 (опублікована 30 грудня 1992)], посилаються на певні біциклічні похідні, зокрема, похідні хіназоліну, як ті, що мають протиракові властивості, як результат їх інгібувальних властивостей тирозинкіназ Також [публікація міжнародної патентної заявки WO 92/20642 (опублікована 26 листопада 1992)], посилається на певні біс-моно- та біциклічні арили і гетероарили як інгібітори тирозинкіназ, які 16 є корисними в інгібуванні проліферації анормальних клітин. [Публікація міжнародної патентної заявки WO 96/16960 (опублікована 6 червня 1996), публікація міжнародної патентної заявки 96/09294 (опублікована 6 березня 1996), публікація міжнародної патентної заявки WO 97/30034 (опублікована 21 серпня 1997), публікація міжнародної патентної заявки WO 98/02434 (опублікована 22 січня 1998), публікація міжнародної патентної заявки WO 98/02437 (опублікована 22 січня 1998) і публікація міжнародної патентної заявки WO 98/02438 (опублікована 22 січня 1998)], також посилаються на заміщені біциклічні гетероароматичні похідні як інгібіторів тирозинкіназ, які є корисними для тієї ж самої цілі. Іншими патентними заявками, що посилаються на протиракові сполуки є [публікація міжнародної патентної заявки WO 00/44728 (опублікована 3 серпня 2000), ЕР 1029853А1 (опублікований 23 серпня 2000) та публікація міжнародної патентної заявки WO 01/98277 (опублікована 12 грудня 2001)], всі з яких включені в цьому документі посиланням у їх повноті. Інші антипроліферативні засоби, що доцільно використовува ти з сполуками представленого винаходу, включають інгібітори ферментної фарнезилпротеїнтрансферази та інгібітори рецепторної тирозинкінази PDGFr, включаючи сполуки, розкриті або заявлені в наступних [патентних заявках США: 09/221946 (поданій 28 грудня 1998); 09/454058 (поданій 2 грудня 1999); 09/501163 (поданій 9 лютого 2000), 09/539930 (поданій 31 березня 2000); 09/202796 (поданій 22 травня 1997); 09/384339 (поданій 26 серпня 1999); і 09/383755 (поданій 26 серпня 1999)]; і сполуки, що розкриті та заявлені в наступних наступних тимчасових [патентних заявках США: 60/168207 (поданій 30 листопада 1999); 60/170119 (поданій 10 грудня 1999); 60/177718 (поданій 21 січня 2000); 60/168217 (поданій 30 листопада 1999) і 60/200834 (поданій 1 травня 2000)]. Кожна з попередніх патентних заявок і тимчасових патентних заявок включена в цьому документі посиланням у їх повноті. Сполука формули 1 може також використовуватися з іншими агентами, корисними в лікуванні анормального росту клітин або раку, включаючи, але не обмежуючись ними, агенти, що мають здатність посилювати імунну протипухлинну відповідь такими як CTLA4 (антиген-4 цитотоксичного лімфоцита) антитіла та інші агенти, здатні до блокування CTLA4; та антипроліферативні агенти такі як інші інгібітори фарнезилпротеїнтрансферази, наприклад, інгібітори фарнезилпротеїнтрансферази, описані в джерелах, на які зроблені посилання в розділі "Попередній рівень техніки", дивіться вище. Конкретні CTLA4 антитіла, які можуть використовуватися в представленому винаході, включають описані в тимчасовій [патентній заявці США 60/113,647 (поданій 23 грудня 1998)], що включена посиланням в цьому документі в її повноті. Сполука формули І може використовуватися як окремо, так і з одною або більшою кількістю інших протипухлинних речовин, вибраних, наприклад, з мітотичних інгібіторів, наприклад, вінбластину; алкілюючих агентів, наприклад, цис-платину, оксаліплатину, карбоплатину і циклофосфаміду; 17 85706 антиметаболітів, наприклад, 5-фтор урацилу, капецитабіну, цитозинарабінозиду і гідроксисечовини або, наприклад, одного з переважних антиметаболітів, описаних у [Європейській патентній заявці №239362], таких як N-(5-[N-(3,4-дигідро-2-метил-4оксохіназолін-6-ілметил)-N-метиламіно]-2-теноїл)L-глутамінова кислота; інгібіторів фактору росту; інгібіторів клітинного циклу; інтеркалюючих антибіотиків, наприклад, адріаміцину і блеоміцину; ензимів, наприклад, інтерферону; і антигормонів, наприклад, антиестрогенів таких як Nolvadex (тамоксифен) або, наприклад, антиандрогенів, таких як Casodex (4'-ціано-3-(4фтор фенілсульфоніл)-2-гідрокси-2-метил-3'(трифторметил)пропіонанілід). Сполуки представленого винаходу можуть використовуватися як окремо, так і з одним або більшою кількістю різноманітних протипухлинних агентів або агентів підтримуючої терапії. Наприклад, сполуки представленого винаходу можуть використовува тися із цитотоксичними агентами, наприклад, одним або більшою кількістю, вибраних з групи, що включає камптотецин, іринотекан НСІ (Камптосар), едотекарин, SU-11248, епірубіцин (ЕІІепсе), доцетаксель (Таксотер), паклітаксель, ритуксимаб (Ритуксан), бевацизумаб (Авастин), іматинібу мезилат (Глівак), Ербітукс, гефітиніб (Іресса) і їх комбінації. Винахід також стосується застосування сполук представленого винаходу разом з гормональною терапією, наприклад, ексеместаном (Аромазином), Лупроном, анастрозолом (Аримідексом), тамоксифена цитратом (Нолвадексом), Трелстаром і їх комбінаціями. Крім того, винахід забезпечує сполуку представленого винаходу окремо або в комбінації з одним або більшою кількістю продуктів підтримуючої терапії, наприклад, продуктом вибраним з групи, що включає Філграстім (Неупоген), ондансетрон (Зофран), Фрагмін, Прокрит, Алокси, Еменд або їх комбінації. Така комбінована терапія може здійснюватись шляхом одночасного, послідовного або окремого введення доз окремих терапевтичних компонентів. Сполуки винаходу можуть використовуватися з протипухлинними агентами, алкілюючими агентами, антиметаболітами, антибіотиками, протипухлинними агентами рослинного походження, похідними камптотецину, інгібіторами тирозинкінази, антитілами, інтерферонами і/або біологічними модифікаторами імунної відповіді. В цьому відношенні, наступні приклади є не обмеженим переліком прикладів вторинних агентів, які можуть використовува тися зі сполуками винаходу. Алкілюючі агенти включають, але не обмежуються ними, N-оксид азотистого іприту, циклофосфамід, іфосфамід, мелфалан, бусульфан, мітобронітол, карбоквон, тіотепа, ранімустин, німустин, темозоломід, AMD-473, альтретамін, АР-5280, апазиквон, бросталіцин, бендамустин, кармустин, естрамустин, фотемустин, глюфосфамід, іфосфамід, KW-2170, мафосфамід і мітолактол; алкілюючі сполуки із координованою платиною включають, але не обмежуються ними, цисплатин, карбоплатин, ептаплатин, лобаплатин, недаплатин, оксаліплатин або сатрплатин; 18 Антиметаболіти включають, але не обмежуються ними, метотрексат, 6-меркаптопуринрибозид, меркаптопурин, 5-фторурацил (5-ФУ) окремо або в комбінації з леуковорином, тегафуром, УФТ, доксифлуридином, кармофуром, цитарабіном, цитарабін окфосфатом, еноцитабіном, S1, гемцитабіном, флударабіном, 5-азацитидином, капецитабіном, кладрибіном, клофарабіном, децитабіном, ефлорнітином, етинілцитидином, цитозин-арабінозидом, гідроксисечовиною, TS-1, мелфаланом, неларабіном, нолатрекседом, окфосфатом, пеметрекседом динатрію, пентостатином, пелітрексолом, ралтітрексидом, триапіном, триметрексатом, відарабіном, вінкристіном, вінорельбіном; або, наприклад, одним із переважних антиметаболітів, розкритих у [Європейській патентній заявці №239362] таким як N-(5-[[N-(3,4дигідро-2-метил-4-оксохіназолін-6-ілметил)-Nметиламіно]-2-теноїл)-L-глутаміновою кислотою; Антибіотики включають, але не обмежуються ними: акларубіцин, актиноміцин D, амрубіцин, аннаміцин, блеоміцин, даунорубіцин, доксорубіцин, елсамітруцин, епірубіцин, галарубіцин, ідарубіцин, мітоміцин С, неморубіцин, неокарзиностатин, пепломіцин, пірарубіцин, ребеккаміцин, стімаламер, стрептозоцин, валрубіцин або зиностатин; Гормональні терапевтичні агенти, наприклад, ексеместан (Аромазин), Лупрон, анастрозол (Аримідекс), доксеркальціферол, фадрозол, форместан, антиестрогени такі як тамоксифена цитрат (Нолвадекс) і фулвестрант, Трелстар, тореміфен, ралоксифен, лазофоксифен, летрозол (Фемара) або антиандрогени такі як бікалутамід, флутамід, міфепристон, нілутамід, Казодекс® (4'-ціано-3-(4фтор фенілсульфоніл)-2-гідрокси-2-метил-З'(трифторметил)пропіонанілід) і їх комбінації; Протипухлинні речовини рослинного походження включають, наприклад, ті, що вибирають з мітотичних інгібіторів, наприклад, вінбластин, доцетаксель (Таксотер) і паклітаксель; Цитотоксичні агенти, що інгібують топоізомеразу, включають один або більше агентів, що вибирають з групи, що включає, акларубіцин, амонафід, белотекан, камптотецин, 10гідроксикамптотецин, 9-амінокамптотецин, дифломотекан, іринотекан НСІ (Камптосар), едотекарин, епірубіцин (Елленс), етопозид, ексатекан, гіматекан, луртотекан, мітоксантрон, пірарубіцин, піксантрон, рубітекан, собузоксан, SN-38, тафлупозид і топотекан і їх комбінації; Імуномодулятори включають інтерферони та численні інші агенти, що підвищують імунітет. Інтерферони включають інтерферон альфа, інтерферон альфа-2а, інтерферон альфа-2b, інтерферон бета, інтерферон гама-1а або інтерферон гама-n1. Інші агенти включають філграстим, лентінан, шизофілан, TheraCys, убенімекс, WF-10, алдеслейкін, алемтузумаб, ВАМ-002, дакарбазин, даклізумаб, денілейкін, гемтузумаба озогаміцин, ібритумомаб, іміквімод, ленограстим, лентінан, вакцина проти меланоми (Соrіха), молграмостин, вакцина проти раку OncoVAX-CL, сарграмостим, тазонермін, теклейкін, тималазин, тоситумомаб, Вірулізин, Z-100, епратузумаб, мітумомаб, ореговомаб, пемтумомаб, вакцина Provenge; 19 85706 Біологічні модифікатори імунної відповіді є агентами, які змінюють механізми захисту живих організмів або біологічні імунні відповіді, такі як виживання, ріст або диференціювання тканинних клітин, для їх спрямування на протипухлинну дію. Такі агенти включають крестін, лентінін, сізофіран, піцибаніл або убенімекс. Інші агенти проти раку включають алітретиноїн, ампліген, атрасентан, бексаротен, бортезоміб. Босентан, кальцітріол, ексисулінд, фінастерид, фотемустин, ібандронова кислота, мілтефозин, мітоксантрон, І-аспарагіназа, прокарбазин, дакарбазин, гідроксикарбамід, пегаспаргаза, пентостатин, тазаротен, TLK-286, Velcade, Tarceva, або третиноїн; Інші протиангіогенні сполуки включають ацитретин, фенретинід, талідомід, золендронова кислота, ангіостатин, аплідин, циленгтид, комбретастатин А-4, ендостатин, галофугінон, ребімастат, ремоваб, Ревлімід, скваламін, україн і Вітаксин; Сполуки із координованою платиною включають, але не обмежуються, цисплатин, карбоплатин, недаплатин або оксаліплатин; Похідні камптотецину включають, але не обмежуються ними, камптотецин, 10гідроксикамптотецин, 9-амінокамптотецин, іринотекан, SN-38, едотекарин і топотекан; Інгібіторами тирозинкінази є Іресса або SU5416; Антитіла включають Герцептин, Ербітукс, Авастин або Ритуксимаб; Інтерферони включають інтерферон альфа, інтерферон альфа-2а, інтерферон альфа-2b, інтерферон бета, інтерферон гама-1а або інтерферон гама-n1; Біологічні модифікатори відповіді є агентами, які змінюють механізми захисту живих організмів або біологічні відповіді, такий як виживання, ріст або диференціювання клітин тканини, для їх спрямування на протипухлинну дію. Такі агенти включають крестін, лентінін, сізофіран, піцибаніл або убенімекс; і Інші протипухлинні агенти включають мітоксантрон, І-аспарагіназу, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин або третиноїн. "Анормальний ріст клітин", в даному контексті, якщо не зазначено інакше, означає ріст клітин, що не залежить від нормальних регуляторних механізмів (наприклад, втрата механізму контактного пригнічення росту). До цього відноситься анормальний ріст: (1) пухлинних клітин (пухлин), що розростаються в результаті експресії мутованої тирозинкінази або надлишкової експресії рецепторної тирозинкінази; (2) доброякісних і злоякісних клітин інших проліферативних захворювань, при яких має місце аберантна активація тирозинкінази; (3) будьяких пухлин, що розростаються в силу рецепторних тирозинкіназ, (4) будь-яких пухлин, що розростаються в силу аберантної активації серин/треонінкінази і (5) доброякісних і злоякісних клітин інших проліферативних захворювань, при яких має місце аберантна активація серин/треонінкінази. Даний винахід також забезпечує способи інгібування тирозинкіназ у ссавця, спосіб включає 20 призначення ссавцеві, який цього потребує, фармацевтично або терапевтично ефективної кількості сполуки даного винаходу або її фармацевтично прийнятної солі Більш конкретно, даний винахід, крім того, забезпечує спосіб для незворотного інгібування тирозинкінази у ссавця. Наведені в цьому документі способи також включають способи незворотного інгібування тирозинкіназ, включаючи EGFR, PDGFR, c-src, erbB1, erbB2 і еrbВ4. Даний винахід може також бути характеризований як той, що включає спосіб інгібування секреції VEGF у ссавця Подальший спосіб включає інгібування фосфорилювання тирозину еrbВЗ у ссавця. Сполуки, описані в цьому документі, також корисні як інгібітори pan-erbB, тобто, які при кожному призначенні інгібують численні erbB кінази. Фахівці цієї галузі можуть легко ідентифікувати пацієнтів, які потребують описаних в цьому документі терапій. Наприклад, до пацієнтів з більш високим ризиком розвитку рестенозу відносяться індивідууми, яких піддавали ангіопластиці, процедурам шунтування або трансплантації, або реціпієнти, яких піддавали іншим васкулярним процедурам або, які перенесли травму. Індивідууми з підвищеним ризиком розвитку атеросклерозу включають тих, хто страждає на ожиріння, споживає продукти з високим вмістом жирів, має підвищені рівні холестерину або хворіє на гіпертензію. Наведені в цьому документі способи є корисними при лікуванні ссавців, включаючи людей, хатніх тварин таких як собаки та коти та свійських тварин таких як коні, вівці, свині, кози, велика рогата худоба і т.д. Термін "рак" включає, але не обмежується ними, захворювання на рак: молочної залози; яєчників; цервікальний рак; простати; тестикулярний рак; стравоходу; гліобластому; нейробластому; шлунку; шкіри, кератоакантому; легенів, епідермоїдальну карциному, великоклітинну карциному, аденокарциному, дрібноклітинний рак легень; недрібноклітинний рак легень; кісток; ободової кишки, аденокарциному, аденому; підшлункової залози, аденокарциному; щитовидної залози, фолікулярну карциному, недиференційовану карциному, папілярну карциному; семіному; меланому, саркому; карциному міхура; карциному печінки та жовчних протоків; карциному нирок; мієлоїдні розлади; лімфатичні розлади, хворобу Ходжкіна, волосаті клітини; рак порожнини рота та ротової частини глотки (оральний), губи рота, язика, рота, глотки; тонкої кишки; ободової та прямої кишки, товстої кишки, прямої кишки; мозку і центральної нервової системи; і лейкемію. Крім того, сполуки даного винаходу можуть використовуватися для лікування пацієнтів, які потребують інгібування секреції васкулярноендотеліального фактору росту (VEGF). До пацієнтів, які потребують інгібування секреції VEGF відносяться ті, які хворіють на рак, діабетичну ретинопатію, ревматоїдний артрит, псоріаз, рестеноз, атеросклероз, остеопороз, ендометріоз, особи, які піддавались ембріональній імплантації або особи, що мають інші захворювання, в яких відіграють роль ангіогенез або реваскуляризація. 21 85706 Сполуки представленого винаходу можуть використовуватися в способах інгібування фосфорилювання тирозину erbB1, erbB2 і еrbВ4. До пацієнтів, які потребують інгібування фосфорилювання тирозину еrbВ1, еrbВ2 і еrbВ4 відносяться пацієнти, що хворіють або ризикують на захворювання згаданими тут хворобами, що мають відношення до інгібування секреції EGFR і VEGF. Сполуки, наведені в цьому документі, можуть призначатися людям і тваринам будь-яким шляхом введення, пероральним, ректальним, парентеральним (внутрішньовенним, внутрішньом'язовим або підшкірним введенням), інтрацистернальним, інтравагінальним, інтраперітоніальним, інтравезикулярним, місцевим (порошки, мазі або краплі) або у вигляді букального або назального аерозолю. Сполука може призначатися окремо або як частина фармацевтично прийнятної композиції, яка містить фармацевтично прийнятні ексціпієнти. Композиції придатні для введення парентеральною ін'єкцією можуть містити фізіологічно прийнятні стерильні водні або неводні розчини, дисперсії, суспензії або емульсії, і стерильні порошки для відтворення в стерильні придатні для ін'єктування розчини або дисперсії. Приклади придатних водних і неводних носіїв, розріджувачів, розчинників або інертних розчинників включають воду, етанол, поліоли (пропіленгліколь, поліетиленгліколь, гліцерин і їм подібні), їх прийнятні суміші, рослинні масла (таке як оливкове масло) і придатні для ін'єктування органічні естери такі як етилолеат. Належна текучість може підтримуватися, наприклад, за допомогою покриття такого як лецитин, у випадку дисперсії шляхом підтримування необхідного розміру частинки та за допомогою поверхневоактивних речовин. Сполуки даного винаходу можуть бути легко адаптовані до водних рецептур. Наприклад, 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін6-іл]амід має водорозчинність приблизно 10мкг/мл при рН6,3 і розчинність підвищується при нижчих значеннях показника рН. Ці композиції можуть також містити ад'юванти такі як консерванти, зволожувачі, емульгатори і диспергувальні агенти. Попередження дії мікроорганізмів може забезпечуватися різноманітними антибактеріальними та протигрибковими засобами, наприклад, парабенами, хлорбутанолом, фенолом, сорбіновою кислотою і їм подібними. Може також бути бажаним включення ізотонічних агентів, наприклад цукрів, хлориду натрію і їм подібних. Пролонгована абсорбція придатної для ін'єктування фармацевтичної форми, може досягатися за допомогою агентів, що затримують абсорбцію, наприклад, алюмомоностеаратом і желатином. Тверді дозовані форми для перорального введення включають капсули, таблетки, пігулки, порошки та гранули. В таких твердих дозованих формах, до активної сполуки примішують принаймні один інертний стандартний ексціпієнт (або носій) такий як цитрат натрію або фосфат дикальцію або (а) наповнювачі або сухі розбавники, як наприклад, крохмалі, лактоза, сахароза, глюкоза, маніт і кремнієва кислота; (b) зв'язувальні агенти, як на 22 приклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролщон, сахарози і акація; (с) зволожувачі, як наприклад, гліцерин; (d) дезінтегруючі агенти, як наприклад, агар-агар, карбонат кальцію, картопляний або тапіоковий крохмаль, альгінова кислота, деякі комплексні силікати і карбонат натрію; (e) уповільнювачі розчинності, як наприклад, парафін; (f) акселератори абсорбції, як наприклад, четвертинні сполуки амонію; (g) змочувальні речовини, як наприклад, цетиловий спирт і моностеарат гліцерину; (h) адсорбенти, як наприклад, каолін і бентоніт; і (і) змащувальні агенти, як наприклад, тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію або їх суміші. У випадку капсул, таблеток і пігулок, дозовані форми можуть також включати буферуючі агенти. Тверді композиції подібного типу можуть також застосовуватися як наповнювачі у м'яких або твердих желатинових капсулах, в яких використовуються такі ексціпієнтиі, як лактоза або молочний цукор, а також поліетиленгліколі з високою млекулярною масою і подібні. Тверді дозовані лікарські форми, такі як таблетки, драже, капсули, пігулки і гранули можуть виготовлятися з покриттями і в оболонках, такими як ентеральні покриття та інші покриття, добре відомі у цій галузі. Вони також можуть містити забарвлюючі агенти і можуть бути також такою композицією, яка забезпечує уповільнене вивільнення активної сполуки в визначеній частині кишкового тракту. Приклади оболонкових композицій, які можуть використовуватися, включають полімерні речовини і воски. Активна сполука також може використовува тись у вигляді мікрокапсул, при необхідності, з одним або більше вищезгаданих ексціпієнтів. Рідкі дозовані форми для перорального введення містять фармацевтично прийнятні емульсії, розчини, суспензії, сиропи та еліксири. На додаток до активної сполуки, рідкі дозовані форми можуть містити містити інертні розбавники, які традиційно використовуються в цій галузі, такі як вода або інші розчинники, солюбілізуючі агенти і емульгатори, як наприклад, етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3бутиленгліколь, диметилформамід, олії, зокрема, бавовняна олія, олія земляного горіха, олія паростків пшениці, оливкова олія, касторова олія, сезамова олія, гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколі і естери жирних кислот сорбіту або суміші цих речовин і їм подібні. Окрім таких інертних розбавників, композиція також може містити ад'юванти, такі як змочувальні агенти, емульгатори і суспендуючі агенти, підсолоджуючі, смакові і ароматичні агенти. Суспензії, додатково до активної сполуки представленого винаходу, можуть містити суспендуючі агенти, наприклад, етоксильовані ізостеарилові спирти, поліоксиетиленсорбітолові і сорбітанові естери, мікрокристалічну целюлозу, метагідроксид алюмінію, бентоніт, агар-агар і трагакантову смолу або суміші ци х речовин і подібні. 23 85706 Композиції для ректального введення переважно включають супозиторії, які можуть бути одержані змішуванням сполук представленого винаходу з придатними неподразнюючими ексціпієнтами або носіями, такими як масло какао, поліетиленгліколь або віск для супозиторіїв, які при звичайній кімнатній температурі є твердими, але розріджуються при температурі тіла і плавляться у прямій кишці або вагіні, вивільняючи таким чином активний компонент. Дозовані лікарські форми для місцевого призначення включають мазі, порошки, спреї та засоби для інгаляції. До активного компонента, за стерильних умов, примішують фізіологічно прийнятний носій і будь-які консерванти, буфери або гази-носії, в яких може виникнути необхідність. Офтальмологічні рецептури, мазі для ока, порошки і розчини також знаходяться в межах даного винаходу. Даний винахід також включає фармацевтично або терапевтично прийнятні солі, естери, аміди та пролікарські форми сполук даного винаходу. Терміни "фармацевтично прийнятні солі, естери, аміди та проліки", в даному контексті, стосуються тих карбоксилатних солей, кислотно-адитивних солей аміну, естерів, амідів і проліків сполуки представленого винаходу, які є доцільними для медичного застосування з точки зору лікаря, придатними для використання в контакті з тканинами пацієнтів без надмірної токсичності, подразнення, алергійної реакції та т.п., які є співставними з прийнятним співвідношенням користь/ризик і ефективними при їх застосуванні, також як і цвітер-іонних форм сполук винаходу, де це можливо. Термін "солі" стосується відносно нетоксичних, неорганічних і органічних кислотно-адитивних солей представленого винаходу. Ці солі можуть бути одержані in situ під час кінцевого виділення та очищення сполуки або за допомогою окремого введення у взаємодію очищеної сполуки в формі її вільної основи з придатною органічною або неорганічною кислотою та виділення утвореної таким чином солі. Приклади солей включають гідробромідні, гідрохлоридні, сульфатні, бісульфа тні, нітратні, ацетатні, оксалатні, валератні, олеатні, пальмітатні, стеаратні, лауратні, боратні, бензоатні, лактатні, фосфатні, тозилатні, цитратні, малеатні, фумаратні, сукцинатні, тартратні, нафтилатні, мезилатні, глюкогептонатні, лактобіонатні і лаурилсульфонатні і їм подібні солі. Вони можуть включати катіони, на основі лужних і лужноземельних металів, таких як натрій, літій, калій, кальцій, магній і подібні, а також нетоксичний амоній, четвертинний амоній та катіони аміну, які включають, але не обмежуються цим переліком, амоній, тетраметиламоній, тетраетиламоній, метиламін, диметиламін, триметиламін, триетиламін, етиламін і подібні [дивіться, наприклад, S.M. Berge і інші, "Фармацевтичні Солі" ("Pharmaceutical Salts"), J. Pharm. Sci., 1977; 66: 1-19], що включена посиланням в цьому документі. Приклади фармацевтично прийнятних, нетоксичних естерів сполук даного винаходу включають С1-C6алкільні естери, в яких алкільна група є лінійним або розгалуженим ланцюгом. Прийнятні естери також включають С5-С7циклоалкільні естери 24 також як і арилалкільні естери такі як, але не обмежуючись ними, бензил. Перевага надається С 1С4алкільним естерам. Естери сполук представленого винаходу можуть бути одержані згідно з стандартними методиками. Приклади фармацевтично прийнятних, нетоксичних амідів сполуки даного винаходу включають аміди, що походять з аміаку, первинні С1C6алкіламіни та вторинні С 1-C6діалкіламіни, в яких алкільні групи є лінійним або розгалуженим ланцюгом. У випадку вторинних амінів, амін може також знаходитися у формі 5- або 6- членного гетероциклу, що містить один атом азоту. Перевага надається амідам, що походять з аміаку, С1C3алкілу первинних амінів і С 1-C2діалкілу вторинних амінів. Аміди сполуки згідно з винаходом можуть бути одержані згідно з стандартними методиками. Термін "проліки" стосується сполук, які швидко перетворюються in vivo, з одержанням спорідненої сполуки вищезгаданих формул, наприклад, через гідроліз у крові. Повний опис наведений в [Т. Higuchi і V. Stella, "Pro-drugs as Novel Delivery Systems", Vol.14 of the A.C.S. Symposium Series, and Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Assciation and Pergamon Press, 1987], обидва з цих документів включені тут посиланням. Сполука представленого винаходу може призначатися пацієнтові у фармацевтично або терапевтично ефективних рівнях дозування в діапазоні від приблизно 0,1 до приблизно 1.000мг на день. Для нормальної дорослої людини з вагою тіла приблизно 70кг достатньою є доза, що знаходиться в діапазоні, приблизно від 0,01 до приблизно 100мг на кілограм маси тіла на день. Конкретна використовувана доза, однак, може змінюватися. Наприклад, доза може залежати від ряду факторів, що включають вимоги пацієнта, серйозність стану, що лікують та фармакологічної дії використовуваної сполуки. Визначення оптимальних доз для конкретного пацієнта добре відомо фахівцям цієї галузі. Один з режимів дозування у людини включає призначення сполуки даного винаходу, такої як 4-піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7-метоксихіназолін-6іл]аміну або його фармацевтично прийнятної солі, естерної або амідної форми, в діапазоні дозування що знаходиться приблизно від 500мг до приблизно 1.000мг на день в одиничній або розподілених дозах. Фармацевтично придатні композиції для використання в цьому режимі можуть включати окрем дозовані форми, що містять 100мг, 200мг, 250мг, 500мг або 1.000мг активної сполуки та один або більше фармацевтично прийнятних носіїв або ексціпієнтів. Сполуки згідно з винаходом можуть бути одержані згідно з стандартними методиками для забезпечення дозованих форм придатних для доставки ссавцям різноманітними шляхами, включаючи пероральний, парентеральний (тобто, підшкірний, внутрішньовенний і внутрішньом'язовий), трансдермальний, наприклад, пластир для шкіри уповільненого вивільнення або крем, так само як для доставки пристроями уповільненого 25 85706 вивільнення такими як осмотичні насоси, супозиторії та букальні пластинки для аплікації ліків на слизову оболонку. Наступні приклади, але не обмежуючись ними, наведені далі ілюструють, як можна легко одержати сполуки даного винаходу. Рецептура 100мг таблетки На одну На 10.000 таблетку таблеток (г) (г) 0,10 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-71000 метоксихіназолін-6-іл]амід 0,080 Лактоза 800 0,010 Кукурудзяний крохмаль (для суміші) 100 0,008 Кукурудзяний крохмаль (для пасти) 80 0,148 1480 0,002 Стеарат магнію (1%) 20 0,150 1500 Активний агент даного винаходу, лактозу та кукурудзяний крохмаль (для суміші) перемішували до однорідності. Кукурудзяний крохмаль (для пасти) суспендували в 600мл води і нагрівали при перемішуванні, одержуючи пасту. Цю пасту використовували для гранулювання змішаних порошків. Вологі гранули пропускали через сито №8 та сушили при 80°С. Сухі гранули потім пропускали через сито №16. Суміш змащували за допомогою 1%-ого стеарату магнію та пресували в таблетки в звичайному механізмі для одержання таблеток. Таблетки придатні для лікування раку такого як рак молочної залози, простати, легень, яєчників, ободової кишки, підшлункової залози, меланома, рак стравоходу, мозку, саркома Капоши і лімфома. Одержання суспензії для перорального введення Компонент Кількість 4-Піперидин-1-іл-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7500мг метоксихіназолін-6-іл]амід Розчин сорбіту (70% N.F.) 40мл Бензоат натрію 150мг Сахарин 10мг Вишнев ий аромат 50мг Дистильов ана в ода до 100мл До 40мл дистильованої води додавали розчин сорбіту і в цій суміші суспендували піридопіримідин. Додавали та розчиняли сахарин, бензоат натрію та ароматизатор. Об'єм доводили дистильованою водою до 100мл. Кожний мілілітр сиропу містить 5мг сполуки згідно з винаходом. Одержання розчину для парентерального введення В розчині 700мл пропіленгліколю та 200мл води для ін'єкції суспендували при перемішуванні 20,0г 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]аміду. Після завершення утворення суспензії, за допомогою хлорводневої кислоти показник рН доводили до значення 5,5 та за допомогою води для ін'єкції об'єм доводили до 1000мл. Рецептур у стерилізували, наповнювали в 5,0мл ампули, кожна з яких містить по 2,0мл (що дорівнює 40мг сполуки, 26 згідно з винаходом) і герметизували в а тмосфері азоту. Супозиторії Суміш 400мг 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]аміду і 600мг масла теоброми перемішували при 60°С до однорідності. Суміш охолоджували та залишали затвердівати у конусоподібній формочці, для одержання супозиторію масою 1г. Рецептура уповільненого вивільнення П'ятсот міліграмів 4-Піперидин-1-іл-бут-2енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]аміду перетворювали на сіль хлорводневої кислоти та поміщали в осмотичний насос Орос для контрольованого вивільнення для лікування атеросклерозу. Рецептура пластиру для шкіри До ста міліграмів 4-Піперидин-1-іл-бут-2енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]аміду примішували 100мг пропіленгліколю монолаурату в полідиметилсилоксановому адгезиві. На еластичну плівку накладали шар суміші разом з адгезивним складом полібутен у, поліізобутилену і пропіленгліколю монолаурат. Шари поміщали між 2 шарами поліуретанової плівки. Шар, що знімається, приєднаний до адгезивної поверхні і видаляється перед застосуванням на поверхню шкіри. Пропіленгліколю монолаурат служить агентом, який поліпшує проникнення у шкіру лікарського засобу. Сполука представленого винаходу може існувати в несольватованій, а також сольватованій формах з фармацевтично прийнятними розчинниками, такими як вода, етанол і подібні. Взагалі, для цілей представленого винаходу, сольватовані форми вважаються еквівалентними несольватованим формам. Бажано, щоб дана сполука або одержувалась синтезом або біологічним способом, таким як через метаболізм. Зрозуміло, що фармацевтично або терапевтично ефективною кількостю сполуки, наведеної в цьому документі, буде кількість, якої достатньо, для інгібування дії білків і механізмів фосфорилювання, описаних в цьому документі, у ссавця до ступеню, що обмежує, інгібує або попереджує прогрес і розвиток проліферативного захворювання або іншого опосередкованого тирозинкіназою розглянутого захворювання. Зрозуміло також, що фармацевтично або терапевтично ефективна кількість по відношенню до лікування, інгібування, попередження або контролю розвитку розладу, обумовленного клітинною проліферацією буде кількість, якої достатньо, щоб викликати загибель клітин, інгібувати ріст клітин, що викликають розлад, полегшити дискомфорт спричинений розладом або продовжити життя пацієнта, що страждає на розлад. Приклади сполук, але не обмежуючись ними, які представлені в межах даного винаходу включають: 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; 27 85706 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7метилсульфанілхіназолін-6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метиламінохіназолін-6іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-ізопропоксихіназолін-6іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3бромфеніламіно)-7-метоксихіназолін-6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-етоксихіназолін-6іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-пропоксихіназолін-6іл]амід; 4-(4-Фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін6-іл]амід; 4-(3-Фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін6-іл]амід; 4-(2-Фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін6-іл]амід; 4-Морфолін-4-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; 4-Азепан-1-іл-бут-2-енової кислоти [4-(3-хлор4-фторфеніламіно)-7-метоксихіназолін-6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7трифторметоксихіназолін-6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-фторметоксихіназолін6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-фторетоксихіназолін-6іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-(2фторетилсульфаніл)хіназолін-6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7трифторетоксихіназолін-6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-дифторетоксихіназолін6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-(3-морфолін-4-ілпропокси)хіназолін-6-іл]амід; 4-Піперидин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-(2-піперидин-1-ілетокси)хіназолін-6-іл]амід; 4-(3,4-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]амід; 4-(3,4-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7етоксихіназолін-6-іл]амід; 4-(3,4-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7метилсульфанілхіназолін-6-іл]амід; 28 4-(3,4-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7фторетоксихіназолін-6-іл]амід; 4-(3,6-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]амід; 4-(3,6-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніл аміно)-7метоксихіназолін-6-іл]амід; 4-(3,6-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7фторетоксихіназолін-6-іл]амід; 4-(3,6-Дигідро-2Н-піридин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7метилсульфанілхіназолін-6-іл]амід; 4-Піперазин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; 4-(4-Метилпіперазин-1-іл)-бут-2-енової кислоти [4(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]амід; 4-Імідазол-1-іл-бут-2-енової кислоти [4(3-хлор4-фторфеніламіно)-7-метоксихіназолін-6-іл]амід; 4-Піролідин-1-іл-бут-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7метилсульфанілхіназолін-6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метиламінохіназолін-6іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7ізопропоксихіназолін-6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3бромфеніламіно)-7-метоксихіназолін-6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-етоксихіназолін-6іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-пропоксихіназолін-6іл]амід; 5-(4-Фторпіперидин-1-іл)-пент-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]амід; 5-(3-Фторпіперидин-1-іл)-пент-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]амід; 5-(2-Фторпіперидин-1-іл)-пент-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]амід; 5-Морфолін-4-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; 5-Азепан-1-іл-пент-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7трифторметоксихіназолін-6-іл]амід; 29 85706 30 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-фторметоксихіназолін6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-фторетоксихіназолін-6іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-(2фторетилсульфаніл)хіназолін-6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7трифторетоксихіназолін-6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-дифторетоксихіназолін6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-(3-морфолін-4-ілпропокси)хіназолін-6-іл]амід; 5-Піперидин-1-іл-пент-2-енової кислоти [4(3хлор-4-фтор феніламіно)-7-(2-піперидин-1-ілетокси)хіназолін-6-іл]амід; 6-Піперидин-1-іл-гекс-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]амід; б-Піперидин-і-іл-гекс-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7метилсульфанілхіназолін-6-іл]амід; 6-Піперидин-1-іл-гекс-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метиламінохіназолін-6іл]амід; 6-Піперидин-1-іл-гекс-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-етоксихіназолін-6іл]амід; і 6-Піперидин-1-іл-гекс-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-фторетоксихіназолін-6іл]амід; або їх фармацевтично прийнятні солі. Сполуки даного винаходу можуть бути одержані з використанням способів і матеріалів, відомих в цій галузі. Сполуки даного винаходу, в яких X є киснем можуть бути одержані як проілюстровано в наступній Схемі 1, в якій анілінова група в 4-положенні представляє собою 4-фтор-Зхлоранілінову гр уп у. 4-Хлор-7-фтор-6-нітрохіназолін (7) може бути одержаний за допомогою способів подібних до описаних у [J.Med. Chem. 1996, 39, 918-928]. Взагалі, 2-аміно-4-фторбензойна кислота (1) може взаємодіяти з формамідином (2) і оцтовою кислотою (3) в присутності 2-метоксиетанолу, з одержанням 7-Фтор-3Н-хіназолін-4-ону (4). Потім 7 фтор-3Н-хіназолін-4-он (4) нітрували з одержанням 7-фтор-6-нітро-3Н-хіназолін-4-ону (5), який обробляли тіонілхлоридом, з одержанням 4-хлор6-нітро-7-фтор-3Н-хіназоліну (6). 4-хлор-хіназоліну сполуки (6), який за бажанням, об'єднували з заміщеним аніліном, представленим вище 4-фтор-3хлораніліном, у присутності третинного аміну та 31 85706 ізопропанолом, з одержанням 4-аніліно-6-нітро-7фтор хіназоліну (7). 4-аніліно-6-нітро-7-фторхіназолін (7) піддавали взаємодії з спиртом формули R3OH, в якому R3 має значення як визначено вище, одержуючи 7алкоксильовану сполуку (8). Шляхом відновлення 6-нітро сполуки (8) одержували аналог 6-аміно (9). Сполуку (9) з аміногрупою, що знаходиться в 6-положенні, піддавали взаємодії з галоалкеноїлхлоридом (12), таким як 4-бромбут-2-еноілхлорид, 5-бромпент-2-ено'ілхлорид, 4-хлорбут-2еноїлхлорид або 5-хлор-пент-2-еноїлхлорид, одержуючи алкенової кислоти [4-аніліно]-7алкоксильований-хіназолін-6-іл-амід (13). Галоалкеноїлхлоридні агенти, що придатні для використання в цій схемі, можуть одержуватися за допомогою способів, відомих в цій галузі, таких як обробка відповідної галоалкенової кислоти, представленої естером бромалкенової кислоти (10), з первинним спиртом, одержуючи відповідну галоалкенову кислоту (11), яка може бути в свою чергу оброблена за допомогою оксалілхлориду, з одержанням цільового галоалкеноїлхлориду (12). Зрештою, хіназолін-6-алканова кислота сполуки (13) може бути оброблена циклічним аміном, таким як піперидин, піперазин і т.д., з одержанням цілевої кінцевої сполуки (14). Зрозуміло, що сполуки, наведені в цьому документі, які мають алкоксигрупи, що знаходяться в 7-положенні можуть бути одержані, як описано вище, з використанням спирту формули R3OH, в якій R3 є алкільною групою, як визначено в цьому документі, відомою в цій галузі, що включає, але не обмежується ними, метанол, етанол, пропанол, ізопропанол, фторметанол, хлорметанол, дифторметанол, дихлорметанол, трифторметанол, трихлорметанол, 1-фторетанол, 2-фторетанол, 2хлоретанол, 2-йодетанол, 2-брометанол, 1,1дифторетанол, 2,2-дифторетанол, 2,2дихлоретанол, 1,2,2-трифторетанол, 2,2,2трифторетанол, 1,1,2,2-тетрафторетанол, пентафторетанол, 3-фтор-1-пропанол, 2,3-дифтор-1пропанол, 3,3-дифтор-1-пропанол, 2,3,3-трифтор1-пропанол, 3,3,3-трифтор-1-пропанол, 1,1,3трифтор-1-пропанол, 1,2,2,3-тетрафтор-1пропанол, 2,3,3,3-тетрафторпропанол, 2,2,3,3,3пентафтор-1-пропанол, 1,2,3,3,3-пентафтор-1пропанол, 1,1,2,3,3,3-гексафтор-1-пропанол, гептафтор-1-пропанол, 2-фтор-2-пропанол, 1,1дифтор-2-пропанол, 1,3-дифтор-2-пропанол, 1фтор-2-пропанол, 1,1,1-трифтор-2-пропанол, 1,1,3,3-тетрафтор-2-пропанол, 1,1,3,3,3пентафтор-2-пропанол, 1,1,2,3,3-гексафтор-2пропанол, 1,1,1,3,3,3-гексафтор-2-пропанол, 1,1,1,2,3,3,3-гептафтор-2-пропанол і т.д. В межах даного винаходу придатними для використання є проміжні сполуки формули: в якій: 32 Υ є ΝΟ2, ΝΗ2 або групою гало-(СН2)m-СН= СНС(О)-NН2-; гало є F, СІ, Вr або І; m є цілим числом від 1 до 3; R3 вибраний з: a) моно-, ди- або три-галогенованої метильної групи; b) С2-С3 лінійної або розгалуженої алкільної групи, необов'язково заміщеної атомом галогену; або c) -(СН2)n-морфоліно, -(СН2)n-піперидину, (СН2)n-піперазину, -(СН2)n-піперазин-N(C1C3алкілу), -(СН2)n-піролідину або -(СН2)n-імідазолу. Ці сполуки особливо включають ті з наведених вище формул, в яких R3 є етан-, пропан-, ізопропан-, фторметан-, хлорметан-, дифтормета-, дихлорметан-, трифторметан-, трихлорметан-, 1фторетан-, 2-фторетан-, 2-хлоретан-, 2-йодетан-, 2-брометан-, 1,1-дифторетан-, 2,2-дифторетан-, 2,2-дихлоретан-, 1,2,2-трифторетан-, 2,2,2трифторетан-, 1,1,2,2-тетрафторетан-, пентафторетан-, 3-фтор-1-пропан-, 2,3-дифтор-1-пропан-, 3,3-дифтор-1-пропан-, 2,3,3-трифтор-1-пропан-, 3,3,3-трифтор-1-пропан-, 1,1,3-трифтор-1-пропан-, 1,2,2,3-тетрафтор-1-пропан-, 2,3,3,3тетрафторпропан-, 2,2,3,3,3-пентафтор-1-пропан-, 1,2,3,3,3-пентафтор-1-пропан-, 1,1,2,3,3,3гексафтор-1-пропан-, гептафтор-1-пропан-, 2фтор-2-пропан-, 1,1-дифтор-2-пропан-, 1,3дифтор-2-пропан-, 1-фтор-2-пропан-, 1,1,1трифтор-2-пропан-, 1,1,3,3-тетрафтор-2-пропан-, 1,1,3,3,3-пентафтор-2-пропан-, 1,1,2,3,3гексафтор-2-пропан-, 1,1,1,3,3,3-гексафтор-2пропан- або 1,1,1,2,3,3,3,-гептафтор-2-пропановою групою. Сполуки даного винаходу, в яких Χ ε сіркою можуть бути одержані як проілюстровано в наступній Схемі 1, шляхом заміни спирту R3 OH, який піддавали взаємодії з (3-Хлор-4-фторфеніл)-(7гало-6-нітро-3,4-дигідрохінолін-4-іл)аміном (Сполукою 7) з прийнятним алкілтіолом формули R3SH, в якій R3 має значення як наведено в цьому документі. Корисні алкілтіоли формули R3SH включають, але не обмежуються ними, метанетіол, етанетіол, 1-пропанетіол, 2-пропанетіол, фторметанетіол, 2фторетанетіол, 2,2-дифторетанетіол, 2,2,2трифторетанетіол і т.д. Подібно сполуки даного винаходу, в яких X є NH-, можуть бути одержані як проілюстровано в наступній Схемі 1, шляхом заміни спирту R3OH, який піддавали взаємодії з (3-Хлор-4-фторфеніл)(7-гало-6-нітро-3,4-дигідрохінолін-4-іл)аміном (Сполукою 7) з відповідним алкіламіном формули R3NH, в якій R3 має значення як наведено в цьому документі. Корисні алкіламіни включають, але не обмежуються ними, метиламін, етиламін, пропіламін, ізопропіламін, 1-фторметиламін, 1,1дифторметиламін, 1,1,1-трифторметиламін, 2фторетиламін, 2,2-дифторетиламін, 2,2,2трифторетиламін, 3-фторпропіламін, 3,3дифторпропіламін, 3,3,3-трифторпропіламін, 2,3,3тетрафторпропіламін, 2,2,3,3,3пентафторпропіламін, 1,1,2,2,3,3,3гептафторпропіламін і т.д. 33 85706 Піперидини придатні для використання при одержанні R4 груп у сполуках даного винаходу включають, але не обмежуються ними, піперидин, 2-Фторпіперидин, 3-Фторпіперидин, 4Фторпіперидин, 4-Бромпіперидин, 4Хлорпіперидин, 2-Гідроксипіперидин, 3Гідроксипіперидин, 2-Метил піперидин, 3Метилпіперидин, 4-Метилпіперидин, 4Етилпіперидин, 4-Пропілпіперидин, 2Амінопіперидин, 3-Амінопіперидин, 4Амінопіперидин, 2-Метилпіперидин, 2,3Диметилпіперидин, 3,3-Диметилпіперидин, 2,4Диметилпіперидин, 2,5-Диметилпіперидин, 2,6Диметилпіперидин, 3,5-Диметилпіперидин, 2Метил-5-етилпіперидин, 3-Метил-4гідроксипіперидин, 2,6-Диметил-4гідроксипіперидин, 2,5-Диметил-4гідроксипіперидин, 2,3-Диметил-4гідроксипіперидин, 3,3-Дифторпіперидин, 4,4Дифторпіперидин, 4,4-Дигідроксипіперидин, 2,4,6Триметилпіперидин і т.д. Приклад 1 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-(2фторетокси)хіназолін-6-іл]амід 7-фтор-6-нітро-4-хлорхіназолін (14,73г, 65ммоль) об'єднували з 3-хлор-4-фтораніліном (9,49г, 65ммоль) і триетиламіном (10мл, 72ммоль) в 150мл ізопропанолу. Реакційну суміш перемішували при кімнатній температурі протягом 1,5 годин, одержуючи жовту суспензію. Тверду речовину збирали фільтруванням, промиваючи ізопропанолом, а потім водою. Тверду речовину сушили при 40°С у вакуумній печі протягом ночі, одержуючи 19,83г (91%) продукту як твердої речовини оранжевого кольору. МС (ХІАТ, m/z, M+1): 337,0 До розчину 2-фторетанолу (5,19г, 80ммоль) в 200мл ТГФ додавали частинами NaH (60% у мінеральному маслі, 3,55г, 88ммоль). Реакційну суміш перемішували протягом 60 хвилин при кімнатній температурі. До реакційної суміші додавали 7фтор-6-нітро-4-(3-хлор-4-фторанілін)хіназолін (18,11г, 54ммоль) у вигляді твердої речовини, промиваючи за допомогою ТГФ. Реакційну суміш нагрівали до 65°С протягом 26 годин. Реакційну суміш охолоджували до кімнатної температури та гасили водою. ТГФ видаляли в вакуумі. Одержаний залишок швидко обробляли ультразуком в воді і потім тверду речовину збирали шляхом фільтрування. Тверду речовину розтирали з МеОН, фільтрували і сушили при 40°С в вакуумній печі 34 протягом ночі, одержуючи 12,63г продукту. Додатковий продукт одержували шляхом концентрування МеОН фільтрату до одержання сухого залишку та за допомогою хроматографії, елююючи з використанням 50% ЕtOАс/гекс. Виділений матеріал розтирали з МеОН (2Х), фільтрували і сушили 3,90г. Загальний вихід: 16,53г, 81% МС (ХІАТ, m/z, M+1): 381,0 7-(2-фторетокси)-6-нітро-4-(3-хлор-4фторанілін)хіназолін (0,845г, 2,2ммоль) в 50мл ТГФ гідрували в присутності нікелю Ренея (0,5г) як каталізатору протягом приблизно 15 годин. Каталізатор відфільтровували і фільтрат випаровували, з одержанням 0,77г продукту. (99%) МС (ХІАТ, m/z, M+1): 351,2 Метил 4-бромкротонат (85%, 20мл, 144ммоль) гідролізували за допомогою Ва(ОН)2 в ЕtOН/Н2О як описано в [J.Med. Chem. 2001, 44 (17), 27292734]. MC (XIAT, m/z, M-1): 163,0 До розчину 4-бромкротонової кислота (4,17г, 25ммоль) в СН2СІ2 (20мл) додавали оксалілхлорид (33мл, 38ммоль) і декілька крапель ДМФ. Реакційну суміш перемішували при кімнатній температурі протягом 1,5 годин. Розчинник і надлишок реагенту видаляли в вакуумі. Одержаний залишок розчиняли в 10мл ТГФ і додавали при 0°С до суміші 6аміно-7-(2-фторетокси)-4-(3-хлор-4фторанілін)хіназоліну (5,28г, 15ммоль) і триетиламіну (5,2мл, 37ммоль). Реакційну суміш перемішували при 0°С протягом 1 години. До реакційної суміші додавали воду і видаляли ТГФ у вакуумі. Продукт екстрагували в СН 2СІ2 (400мл). Органічний шар сушили над MgSO4, фільтрували та концентрували. Неочищений матеріал хроматографували на силікагелі, елююючи з використанням 04% МеОН/СН2СІ2. Виділяли золотисту піну. Вихід: 4,58г, 61% МС (ХІАТ, m/z, M-1): 497,1 До розчину вищезгаданої сполуки (3,35г, 6,7ммоль) і TEA (2,80мл, 20ммоль) у 10мл DMA при 0°С додавали піперидин (0,75мл, 6,7ммоль). Реакційну суміш перемішували при 0°С протягом 17 годин. До реакційної суміші додавали воду, поки не утворювався осад. Реакційну суміш обробляли ультразвуком протягом 40 хвилин і відфільтровували рідину. Залишок розчиняли в СН 2СІ2, сушили над MgSO4 , фільтрували та концентрували. Матеріал хроматографували на силікагелі, елююючи з використанням 4-10% МеОН/СН2СІ2. Виділений залишок розтирали з ацетонітрилом (2Х) і збирали фільтруванням. Знайдена домішка: продукт приєднання піперидину по Майклу (2,2% при першому розтиранні з ацетонітрилом). Додатковий матеріал може бути отриманий з фільтратів ацетонітрилу. Вихід: 0,95г, 27% МС (ХІАТ, m/z, M+1): 502,3 Приклад 2 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іліамід (Методика синтезу №1) 35 85706 Вказана в заголовку сполука і інші аналоги 7метокси даного винаходу можуть бути одержані як описано в Прикладі 1, шляхом заміни 2 Зрозуміло, що інші сполуки в межах даного винаходу можуть бути одержані, використовуючи Het-бутеноілгалоїдну, Het-пентеноїлгалоїдну і Hetгексеноїлгалоїдну гр упи формули: в якій R4 має значення як описано в цьому документі, гало представляє F, СІ, Вr або І, переваж 36 фторетанолу використовуваного в Прикладі 1 стехіометричною кількістю метанолу. Приклад 3 N-[4-(3-Хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]-3-піперидин-1-іл-акриламід (Методика синтезу №2) Альтернативна методика синтезу сполук даного винаходу включає одержання заміщення в 6положенні ланцюговим замісником таким як Hetалкеноїлхлоридна група як відображено в Схемі 2, нижче. но СІ або Вr. Одна специфічна група цих Hetалкеноїлгалоїдів включає ті сполуки, в яких гало ε СІ або Br, R4 є -(CH2)m-Het, m є цілим числом від 1 до 3 і Het є піперидинами або заміщеними піперидинами, описаними вище. Приклад 4 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іліамід (Методика синтезу №3) 37 85706 3-Хлор-4-фторфеніламін 15 (50,31, 345,6ммоль) і 3,4-Диметоксибензальдегід 16 (57,43г, 345,6ммоль) змішували в 500мл ІРА і о холоджували у воді з льодом. До одержаної суміші додавали льодяну оцтову кислоту (20,76г, 345,6моль), а потім однією частиною ціаноборгідрид натрію. Реакційну суміш перемішували при кімнатній температурі (КТ) протягом 24 годин. Після завершення реакції додавали краплями 250мл 10% NaOH при кімнатній температурі. Суміш перемішували протягом ½ години. Суспензію потім фільтрували та промивали з допомогою ІРА і сушили у вакуумі. Маса 88,75г (17, 87%). Сполуки 6 (3г, 13,18ммоль) і 17 (3,9г, 13,18ммоль) об'єднували в CH3CN (25мл) і нагрівали протягом однієї години. Аналіз масспектрос 38 копії не показав ніякого вихідного матеріалу. Додавали насичений K2СО3 і реакційну суміш екстрагували 3Х за допомогою ЕtOАс. Органічні шари об'єднували, промивали насиченим сольовим розчином і концентрували в вакуумі, з одержанням 6,48г сполуки 7 (78,4%). До охолодженого розчину NaOMe в 1,5л сухого МеОН додавали сполуку 7 (72,76г, 149,4ммоль) в атмосфері N2. Охолоджувальну баню видаляли і суміш нагрівали до кипіння та перемішували протягом 1 години. Реакційну суміш охолоджували до кімнатної температури і гасили водою поки продукт не осаджувався. Тверду речовину фільтрували та промивали водою та гексанами. Продукт суспендували при кипінні в ЕtOАс і фільтр ували 39 85706 гарячим, з одержанням 68,75г твердої речовини 8 жовтого кольору (73%). Сполуку 8 (63,62г, 127,5моль) гідрували, використовуючи нікель Ренея як каталізатор, одержуючи 43,82г сполуки 9 (100%). До суспензії сполуки 13 (10,5г, 51,2ммоль) в 200мл дихлорметану, що містить 8 крапель ДМФ, повільно додавали оксалілхлорид (6,5г, 51,18ммоль), після того, як реакційна суміш стає гомогенною, видаляли розчинник і залишок твердої речовини світло-жовтого кольору суспендували в 200мл DMAC і поступово додавали сполуку 9 (20г, 42,65ммоль) у вигляді твердої речовини. Реакційну суміш перемішували протягом 15 хв. і повільно виливали в 1Ν NaOH. Суміш екстрагували 3Х ЕtOАс. Об'єднані органічні шари промивали насиченим сольовим розчином, фільтрували і концентрували в вакуумі, одержуючи 28,4г (100%) сполуки 10. Сполуку 10 (13,07г, 21,08ммоль) розчиняли в трифтороцтовій кислоті (TFA) (74г, 649ммоль) і нагрівали до 30°С протягом 24 годин Реакційну суміш охолоджували до КТ і поступово виливали в охолоджений 1N насичений розчин NaOH. Утворений розчин фільтрували і промивали 3Х водою, потім сушили. Шляхом перекристалізації з толуолу, одержували чистий N-[4-(3-Хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]-3піперидин-1-іл-акриламід (9,90г, 89%). З прикладу наведеного вище, стає зрозумілим, що даний винахід включає придатні для використання проміжні сполуки формули: 40 в якій Υ є ΝΗ2, ΝΟ 2 або гр упою R4-(CH2)mCH=CH-C(O)-NH2-; і m є цілим числом від 1 до 3; R3 вибраний з: a) С1-С3 лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або b) -(СН2)n-морфоліно, -(СН2)n-піперидину, (СН2)n-піперазину, -(СН2)n-піперазин-N(C1C3алкілу), -(СН2)n-піролідину або -(СН2)n-імідазолу; n є цілим числом від 1 до 4; R4 є -(CH2)m-Het; Het є гетероциклічним залишком вибраним з групи морфоліну, піперидину, піперазину, піперазин-N-(С1-С3алкілу), імідазолу, піролідину, азепану, 3,4-дигідро-2Н-піридину або 3,6-дигідро-2Нпіридину, причому кожен гетероциклічний залишок є необов'язково заміщеним від 1 до 3 групами, вибраними з С 1-С3алкілу, галогену, ОН, NH2, NH(С1-С3алкілу) або N(С1-С3алкілу)2; m є цілим числом від 1 до 3; і Х є О, S aбo NH. Приклад 5 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іліамід (Методика синтезу №4) Схема 4 41 85706 (3-Хлор-4-фторфеніл-(7-метокси-6нітрохіназолін-4-іл)амін (1) (17,26г, 0,495ммоль) суспендували в 350мл ангідриду оцтової кислоти в атмосфері азоту і нагрівали, підтримуючи при 90°С протягом 24 годин і поступово охолоджували до кімнатної температури. Утворювалася бліда суспензія. Одержану суспензію охолоджували до 0°С протягом 1 години. Тверді речовини фільтрували і колбу та осад на фільтрі промивали за допомогою 2´50мл ІРА Продукт, N-(3-Хлор-4-фтор феніл)-N(7-метокси-6-нггрохіназолін-4-іл)ацетамід (2), сушили у вакуумній печі при 60°С протягом 24 годин. Маса 17,97г (92,4%) ВЕРХ 99,45%, час утриманням 3,705хв. Нікель Ренея (5,0г) суспендували в МеОН, потім за допомогою ТГФ видаляли воду N-(3-Хлор-4фтор феніл)-N-(7-метокси-6-нітрохіназолін-4іл)ацетамід (2) (19,2г, 49ммоль) суспендували в ТГФ (500мл) і завантажували в реактор. Реакційну суміш нагрівали до 60°С в атмосфері водню при тиску до 60псі. Майже через 17 годин, завантажували додаткові 10,0г каталізатора і завершували реакцію через 38 годин. Реакційну суміш фільтрували і промивали за допомогою ТГФ. Тверді речовини концентрували на ротарному випаровувачі і розчинник змінювали на гексани. Тверда речовина блідо-жовтого кольору після додавання гексанів осаджувалася. Розчинник видаляли під вакуумом для відгонки будь-якого залишку ТГФ. Фільтрували і промивали великою кількостю гексанів. Продукт, N-(6-Аміно-7-метоксихіназолін-4-іл)-N-(3-хлор-4фтор феніл)ацетамід (3) сушили у вакуумній печі при 70°С протягом 24 годин. Маса складала 16,75г (94,49%). ВЕРХ: (100%). До розчину ДМФ (60мг), 4-піперидин-1-іл-бут2-енової кислоти в 40мл DCM при кімнатній температурі додавали оксалілхлорид і реакційну суміш перемішували протягом однієї години. Розчинник випаровували під вакуумом і одержану тверду речовину суспендували в 150мл DMAC. До реакційної суміші додавали N-(6-аміно-7метоксихіназолін-4-іл)-N-(3-хлор-4фтор феніл)ацетамід (3) у вигляді твердої речовини. Реакцію завершували через 45 хвилин. Потім суміш краплями додавали до 300мл 2N NaOH і водний шар екстрагували в EtOAc. Об'єднаний органічний шар концентрували з одержанням 100мл і перемішували 2 дні при кімнатній температурі. Додавали 300мл етилового етеру і 100мл 2N NaOH і тверду речовину, що випала в осад збирали фільтруванням. Кінцевий продукт перекристалізовували з етиленхлориду, одержуючи 5,5г чистого продукту. Як наведено вище, каталізатор нікелю Ренея перед використанням обробляли спиртом, таким як метанол або етанол, потім перед використанням промивали за допомогою ТГФ. Додаткові каталізатори для використання в цій реакції включають платину на вугіллі або паладій на вугіллі, переважно в присутності 1-4 еквівалентів оцтової кислоти. Зрозуміло, що видалення ацетильної групи сполуки (5), з одержанням сполуки (6), як наведено вище, можна досягнути за допомогою способів, 42 відомих в цій галузі, включаючи як основні так і кислі умови. Видалення в умовах кислоти можна досягнути, використовуючи, серед інших кислот, відомих у цій галузі, оцтову або метансульфонову кислоту. В межах даного винаходу знаходяться придатні для використання проміжні сполуки формули: в якій Υ є ΝΗ2, ΝΟ 2 або гр упою R4-(CH2)mCH=CH-C(O)-NH2-; і m є цілим числом від 1 до 3; R3 вибраний з a) С1-C3 лінійного або розгалуженого алкілу, необов'язково заміщеного галогеном; або b) -(СН2)n-морфоліно, -(СН2)n-піперидину, (СН2)n-піперазину, -(СН2)n-піперазин-N(С1C3алкілу), -(СН2)n-піролідину або -(СН2)n-імідазолу; n є цілим числом від 1 до 4; R4 є -(CH2)m-Het; Het є гетероциклічним залишком вибраним з групи морфоліну, піперидину, піперазину, піперазин-N(С1-C3алкілу), імідазолу, піролідину, азепану, 3,4-дигідро-2Н-піридину або 3,6-дигідро-2Нпіридину, причому кожен гетероциклічний залишок є необов'язково заміщеним від 1 до 3 групами, вибраними з С 1-C3алкілу, галогену, ОН, NH2, NH(С1-C3алкілу) або N(С1-C3алкілу)2; m є цілим числом від 1 до 3; і X є О, S або NH. Приклади цих сполук включають N-(3-хлор-4фтор фенiл)-N-(7-метокси-6-нітрохіназолін-4іл)ацетамід, N-(6-аміно-7-метоксихіназолін-4-іл)-N(3-хлор-4-фторфеніл)ацетамід і N-{4-[ацетил(3хлор-4-фтор феніл)аміно]-7-метоксихіназолін-6-іл}3-піперидин-1-іл-акриламід. Приклад 6 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-(2,2дифторетокси)хіназолін-6-іл]амід До розчину 1,23г 2,2-дифторетанолу в 20мл ТГФ додавали частинами 0,6г 60% Na і перемішували при кімнатній температурі протягом 15 хвилин. Додавали 2,02г (3-Хлор-4-фторфеніл)-(7фтор-6-нітрохіназолін-4-іл)аміну у вигляді твердої речовини і суміш нагрівали до 65°С протягом 1 години, потім охолоджували до кімнатної температури. Додавали воду і видаляли ТГФ під вакуумом. Суміш обробляли ультразвуком і одержані тверді речовини збирали фільтруванням і сушили під вакуумом протягом ночі, з одержанням 2,93г неочищеного (3-Хлор-4-фторфеніл)-[7-(2,2дифторетокси)-6-нітрохіназолін-4-іл]аміну. 43 85706 Неочищений (3-Хлор-4-фторфеніл)-[7-(2,2дифторетокси)-6-нітрохіназолін-4-іл]амін розчиняли в ТГФ і відновлювали з використанням каталізатора нікелю Ренея, одержуючи N4-(3-Хлор-4фтор феніл)-7-(2,2-дифторетокси)хіназолін-4,6діамін. 0,45г Бромбут-2-енової кислоти розчиняли в 10мл СН 2СІ2 разом з 2 краплями ДМФ. Додавали 0,47мл оксалілхлориду при кімнатній температурі та перемішували протягом ночі. Суміш випаровували до сухого залишку, одержуючи 4-Бромбут-2еноїлхлорид. 0,5г N4-(3-Хлор-4-фторфеніл)-7-(2,2дифторетокси)хіназолін-4,6-діаміну розчиняли в 10мл ТГФ і 1,2мл Ν,Ν-Діізопропілетиламіну (DIEA) і додавали 0,48г 4-Бромбут-2-еноїлхлориду та суміш перемішували при кімнатній температурі протягом 2 годин Додавали 0,27мл піперидину та перемішували при кімнатній температурі протягом ночі. Додавали додаткові 0,7мл піперидину і суміш нагрівали до 70°С. Через 3 години реакційну суміш виливали у воду, тверді речовини екстрагували з допомогою етилацетату, промивали водою і насиченим сольовим розчином, сушили над NaSO4 і за допомогою флеш-хроматографії з використанням 0-4% метанолу в хлороформі одержували 0,2г 4Піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-(2,2-дифторетокси)хіназолін-6іл]аміду. МС (М+Н)+ @ 520 Приклад 7 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-(3-морфолін-4-ілпропокси)хіназолін-6-іл]амід Стадія 1: метиловий естер 4-піперидин-1-ілбут-2-енової кислоти Метил 4-бромкротонат (2г, 11,2ммоль) розчиняли в дихлорметані (20мл) і охолоджували до 0°С. Додавали повільно піперидин (1,11мл, 11,2ммоль). Суміш перемішували при 0°С протягом 1 години. Розчинник видаляли в вакуумі. Одержаний матеріал використовували без подальшого очищення. МС m/z 184 (М+1). Стадія 2: 4-Піперидин-1-іл-бут-2-енової кислоти-НСІ Метиловий естер 4-Піперидин-1-іл-бут-2енової кислоти (2,05г, 11,2ммоль) і концентровану хлорводневу кислоту (10мл) об'єднували в діоксанах (30мл) і нагрівали до кипіння протягом ночі. Суміш концентрували в вакуумі. Залишок кристалізували з ІРА, одержуючи цільовий продукт (390мг, 17%). 400МГЦ 1Н ЯМР (ДМСО-d6) δ 6,80 (дт, 1Н, J=15,6, 7,1Гц), 6,14 (д, 1Н, J=15,6Гц), 3,85 (д, 1Н, J=7,1Гц), 2,89 (м, 4Н), 1,54 (м, 6Н). МС m/z 170 (М+1). Стадія 3: 4-Піперидин-1-іл-бут-2-еноілхлорид 44 НСІ сіль 4-Піперидин-1-іл-бут-2-енової кислоти (250 мг, 1,48ммоль) розчиняли в дихлорметані (15мл). Додавали диметилформамід (3 краплі). Додавали повільно оксалілхлорид (155мкл, 1,77ммоль) і реакційну суміш перемішували при кімнатній температурі протягом 1 години. Суміш концентрували при пониженому тиску і одержаний залишок використовували без подальшого очищення. Стадія 4: 4-Піперидин-1-іл-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-(3-морфолін-4іл-пропокси)хіназолін-6-іл]амід N*4*-(3-Хлор-4-фторфеніл)-7-(3-морфолін-4-ілпропокси)хіназолін-4,6-діамін (510мг, 1,18ммоль) і DIPEA (620мкл, 3,55ммоль) об'єднували в тетрагідрофурані (10мл) і охолоджували до 0°С. Додавали 4-Піперидин-1-іл-бут-2-еноїлхлорид (278 мг, 1,48ммоль) і реакційну суміш перемішували при 0°С протягом 2 годин. Суміш гасили з допомогою етилацетату, сушили над MgSO4 і концентрували. Залишок очищували, використовуючи хроматографію на силікагелі, елююючи з використанням 15% - 20% МеОН в СН2СІ2, одержуючи цільовий продукт (20мг). 400МГЦ 1Н ЯМР (ДМСО-d6) δ 8,82 (с, 1Н), 8,50 (с, 1Н), 8,11 (дд, 1Н, J=6,9, 2,6Гц), 7,77 (м, 1Н), 7,40 (т, 1Н, J=9,0Гц), 7,25 (с, 1 Η), 6,76 (м, 1Н), 6,53 (м, 1Н), 4,23 (т, 2Н, J=6,0Гц), 3,55 (м, 4Н), 3,08 (м, 2Н), 2,40 (м, 10Н), 1,96 (м, 2Н), 1,29 (м, 6Н). МС m/z 584 (М+1). Пример 8 4-(3-Фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін6-іліамід 99мг Гідрохлориду 3-фторпіперидину, 300мг 4Хлор-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду і 0,37мл DIEA розчиняли в 5мл ТГФ і перемішували при 70°С протягом ночі. Потім суміш розводили етилацетатом, промивали водою та насиченим сольовим розчином і сушили над Na2SO4. Одержані тверді речовини піддавали флешхроматографії, з використанням 0-4% метанолу в хлорформі, з одержанням 275мг 4-(3Фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]аміду. МС (М+Н)+ @480 Приклад 9 4-(4-Фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7-метоксихіназолін6-іліамід 45 85706 До 300мг 4-Хлор-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]аміду та 0,37мл DIEA додавали 131мг гідроброміду 4-фторпіперидину, розчиняли в 5мл ТГФ, перемішували при 70°С протягом ночі. Потім суміш розводили етилацетатом, промивали водою та насиченим сольовим розчином і сушили над Na2SO4. Одержані тверді речовини піддавали флеш-хроматографії з використанням 0-4% метанолу в хлорформі, з одержанням 189,4мг 4-(4Фторпіперидин-1-іл)-бут-2-енової кислоти [4-(3хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]аміду. (М+Н)+ 488. Приклад 10 4-Азепан-1-іл-бут-2-енової кислоти [4-(3-хлор4-фторфеніламіно)-7-метоксихіназолін-6-іліамід (3-Хлор-4-фторфеніл)-(7-фтор-6нітрохіназолін-4-іл)амін суспендували у 100мл метанолу та додавали 2мл 50% NaOH у воді і суміш нагрівали при 70°С протягом 2 годин. Потім суміш виливали у воду та енергійно перемішували протягом 30 хвилин, потім фільтрували і промивали водою і сушили у вакуумі при 60°С протягом ночі, з одержанням 7,2г (3-Хлор-4-фторфеніл)-(7метокси-6-нітрохіназолін-4-іл)аміну. 7,1г (3-Хлор-4-фторфеніл)-(7-метокси-6нітрохіназолін-4-іл)аміну відновлювали, з використанням каталізатора нікелю Ренея в ТГФ, потім фільтрували і випаровували, з одержанням 6,4г N4-(3-Хлор-4-фторфеніл)-7-метоксихіназолін-4,6діаміну (з виходом 99%). Цей продукт піддавали взаємодії з 4-Хлор-бут-2-еноїлхлоридом як описано в Схемі 1, з одержанням 4-Хлор-бут-2-енової кислоти [4-(3-хлор-4-фторфеніламіно)-7метоксихіназолін-6-іл]аміду. 300г 4-Хлор-бут-2-енової кислоти [4-(3-хлор-4фтор феніламіно)-7-метоксихіназолін-6-іл]аміду і 78мг азепану розчиняли в 5мл ТГФ і очищали в атмосфері азоту. Додавали 0,25мл DIEA і суміш перемішували при 70°С протягом 2 днів. Суміш потім розводили за допомогою 20мл етилацетату, промивали водою і насиченим сольовим розчином і сушили над Na2SO4. Одержані тверді речовини піддавали флеш-хроматографії з використанням 0-4% метанолу в хлор формі. Продукт розчиняли в СН2СІ2 і обробляли надлишком НСІ і етером, потім випаровували до сухого залишку, з одержанням 115мг 4-Азепан-1-іл-бут-2-енової кислоти [4-(3 Комп’ютерна в ерстка Т. Чепелев а 46 хлор-4-фтор феніламіно)-7-метоксихіназолін-6іл]аміду (з виходом 33%). МС (М+Н)+ @484 Приклад 11 - дослідження erbB кінази на основі ELISA аналізу Erb1, erbB2 і еrbВ4 цитоплазматичні злиті білки одержували клонуванням еrbВ1 послідовності (від Met-668 до Ala1211), erbB2 (від IIе-675 до Val1256) і еrbВ4 послідовності (від Gly-259 до Gly-690) в бакуловірусний вектор pFastBac з використанням полімеразної ланцюгової реакції (PCR). Білки експресувалися у Sf9 клітинах комах інфікованих бакуловірусом, як злиті білки глутатіон-Sтрансферази (GST). Білки очищували за допомогою афінної хроматографії з використанням кульок глутатіонсефарози. Інгібування активності erbB тирозинкінази оцінювали, використовуючи дослідження рецептора тирозинкінази на основі ELISA-аналізу. Кіназні реакції (50мМ HEPES, рН7,4, 125мМ NaCI, 10мМ МgСІ2, 100мкМ ортованадату натрію, 2мМ дитіотреїтолу, 20мкМ АТР, контроль тестованої сполуки або інертного розчинника, 1-5нМ GST-erbB на 50мкл реакційної суміші) проводилися в 96 - лунковому планшеті, покритому 0,25мг/млpoly-Glu-Tyr (Sigma). Реакційні суміші інкубували протягом 6 хвилин при кімнатній температурі при струшуванні. Кіназні реакції зупиняли видаленням реакційної суміші, потім лунки промивали буфером, що містить 3% сироватку бичачого альбуміну і фосфатно-буферним розчином (PBS) з вмістом 0,1% Tween-20. Кількість фосфорильованих залишків тирозину виявляли, додаванням 0,2 мкг/мл антитіла проти фосфотирозину (Oncogene Ab-4; 50мкл/лунка) кон'югованим з пероксидазою хріну (HRP) протягом 25 хвилин при струшуванні при кімнатній температурі. Антитіло видаляли і планшет промивали (3% BSA і PBS з вмістом 0,1% Tween-20). Додавали субстрат HRP, 3,3',5,5тетраметилбензиден, (SureBlueTMB, Kirkegaard & Perry Labs) (50мкл на лунку) і інкубували протягом 10-20 хвилин при струшуванні при кімнатній температурі. ТМВ реакцію зупиняли додаванням 50мкл стоп-розчину (0,09 N H2SO4). Сигнал визначали кількісно, вимірюючи спектральну поглинальну здатність в 450нм. Значення ІС50 визначали для тестових сполук, використовуючи Microsoft Excel. Сполука Приклад № 1 Приклад № 2 Приклад № 6 Приклад № 7 Приклад № 8 Приклад № 9 Приклад № 10 Підписне ЕrbВ1 IС50 (нМ) 6,44 6,9 9,87 11,35 45,34 18,08 12,13 ЕrbВ2 IС50 (нМ) 16,7 244,39 84,05 212,11 247,12 85,98 ЕrbВ4 IС50 (нМ) 77,5 83,67 154 61,5 233,8 147 41,33 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-phenylaminoquinazolin-6-yl amides
Автори англійськоюFakhouri Steven Alain, Lee Helen Cenvai, Reed Jessica Elizabeth, Schlosser Kevin Matthew, Sexton Karen Helene, Teecle Hail, Winters Roy Thomas
Назва патенту російською4-фениламинохиназолин-6-иламиды
Автори російськоюФакхоури Стивен Алан, Ли Хелен Ценвай, Рид Джессика Элизабет, Шлоссер Кевин Меттью, Секстон Карен Элейн, Тикл Хейл, Винтерс Рой Томас
МПК / Мітки
МПК: A61P 43/00, A61K 31/505, A61P 35/00, C07D 239/94
Мітки: 4-феніламінохіназолін-6-іламіди
Код посилання
<a href="https://ua.patents.su/23-85706-4-fenilaminokhinazolin-6-ilamidi.html" target="_blank" rel="follow" title="База патентів України">4-феніламінохіназолін-6-іламіди</a>
Попередній патент: Газопальниковий пристрій
Наступний патент: Бензоксазини для лікування захворювань дихальних шляхів
Випадковий патент: Спосіб випробувань і оцінки зносу пар тертя з урахуванням температури