Ціанопіролсульфонамідні модулятори прогестеронового рецептора та їх застосування
Номер патенту: 92500
Опубліковано: 10.11.2010
Автори: Меленскі Едвард Джордж, Маккомас Кейсі Камерон, Фенсом Ендрю
Формула / Реферат
1. Сполука, що має структуру формули І, або її фармацевтично прийнятна сіль:
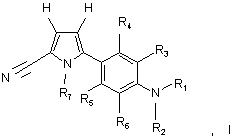
у якій:
R1 вибирають з групи, яка включає:
Н,
CN,
SO2-C1-C6алкіл, SO2-C3-C8циклоалкіл, SО2-заміщений C1-C6алкіл, SО2-арил, SO2-заміщений арил, SО2-гетероарил, SО2-гетероцикл, SO2-C3-C6алкеніл, SO2-C3-C6алкініл, SO2-C3-C6заміщений алкеніл, SO2-C3-C6заміщений алкініл,
С(О)-C1-C6алкіл, С(О)-C3-C8циклоалкіл, С(О)-заміщений C1-C6алкіл, С(О)-арил, С(О)-заміщений арил, С(О)-гетероарил, С(О)-гетероцикл, С(О)-C3-C6алкеніл, С(О)-C3-C6алкініл, С(О)-заміщений C3-C6алкеніл, С(О)-заміщений C3-C6алкініл,
С(О)О-C1-C6алкіл, C(O)O-C3-C8циклоалкіл, С(О)О-заміщений C1-C6алкіл, С(О)О-арил, С(О)О-заміщений арил, С(О)О-гетероарил, С(О)О-гетероцикл, С(О)О-С3-С6алкеніл, С(О)О-С3-С6алкініл, С(О)О-C3-C6заміщений алкеніл, С(О)О-C3-C6заміщений алкініл,
C(O)NH-C1-C6алкіл, C(O)NH-C3-C8циклоалкіл, С(О)N-ди-С3-С8циклоалкіл, С(О)N-ди-С1-С6алкіл, С(О)N-дизаміщений C1-C6алкіл, С(О)NH-заміщений C1-C6алкіл, С(О)NН-арил, С(О)N-діарил, С(О)NH-заміщений арил, С(О)N-діарил, С(О)NH-гетероарил, С(О)NH-гетероцикл, С(О)N-дигетероарил, С(О)N-дигетероцикл, C(O)NH-C3-C6алкеніл, С(О)NH-C3-C6алкініл, С(О)NH-заміщений C3-C6алкеніл та С(О)NН-заміщений C3-C6алкініл; або
R1 являє собою зв'язуючу групу до другої структури формули І з утворенням димеру формули І, зазначену зв'язуючу групу вибирають з С(О)- або S(O)2-,
R2 вибирають з таких як Н, C1-C6алкіл, заміщений C1-C6алкіл, C3-C6циклоалкіл, SО2-алкіл та SO2-заміщений алкіл;
за умови, що принаймні один з R1 або R2 містить групу, що має SO2-, прикріплену до N, або R1 являє собою S(O)2-зв'язуючу групу; або
R1 та R2 сполучені з утворенням -(C(R8)a(R9)b)c-SO2-(C(R8)d(R9)e)f-;
R8 та R9 незалежно являють собою Н, галоген або C1-C6алкіл;
а та b незалежно приймають значення 0-2, за умови, що а + b = 2;
d та e незалежно приймають значення 0-2, за умови, що а + b = 2;
с та f незалежно приймають значення 0-5, за умови, що один з с або f є більшим ніж 0;
R3, R4, R5 та R6 незалежно вибирають з таких як: Н, галоген, CN, C1-C6алкіл, заміщений C1-C6алкіл, -(CHmXn)zCHpXq, C3-C6циклоалкіл, О-C1-C6алкіл, О-C1-C6заміщений алкіл, О-(СНmХn)zСНрХq, арил, гетероарил, гетероцикл, заміщений арил, заміщений гетероарил та заміщений гетероцикл;
X являє собою галоген;
m та n незалежно приймають значення 0-2, за умови, що m + n = 2;
р та q незалежно приймають значення 0-3, за умови, що р + q = 3;
z приймає значення від 0 до 10;
R7 вибирають з групи, що включає Н, C1-C6алкіл, С(О)О-C1-C6алкіл, C2-C6алкеніл, C2-C6алкініл, заміщений C1-C6алкіл, C3-C6циклоалкіл та заміщений C3-C6циклоалкіл.
2. Сполука за п. 1, у якій:
R1 вибирають з групи, що включає SO2-C1-C6алкіл, SO2-C3-C8циклоалкіл, SО2-заміщений C1-C6алкіл, SО2-арил, SО2-заміщений арил, SO2-гетероарил, CN, SO2-C3-C6алкеніл, SO2-C3-C6алкініл, SO2-C3-C6заміщений алкеніл та SO2-C3-C6заміщений алкініл;
R2 являє собою Н або C1-C6алкіл;
R3, R4, R5 та R6 незалежно вибирають з групи, що включає Н, галоген, C1-C6алкіл, C3-C6циклоалкіл, О-C1-C6алкіл та О-C1-C6 заміщений алкіл; та
R7 являє собою Н або C1-C6алкіл.
3. Сполука за п. 1, у якій:
R1 вибирають з групи, що включає SO2-C1-C4алкіл, SO2-C3-C5циклоалкіл та CN;
R2 являє собою Н;
R3, R4, R5 та R6 незалежно вибирають з групи, що включає Н, галоген, C1-C6алкіл, О-C1-C6алкіл, -(CHmXn)zCHpXq та O-(CHmXn)zCHpXq; та
R7 являє собою Н або C1-C6алкіл.
4. Сполука за п. 1, у якій:
R1 являє собою SO2-C1-C4алкіл;
R2 являє собою Н;
кожен з R3, R4, R5 та R6 являє собою Н або F; та
R7 являє собою C1-C6алкіл.
5. Сполука за п. 1, у якій:
R1 являє собою SO2-C3-C5циклоалкіл;
R2 являє собою Н;
R3, R4, R5 та R6 незалежно являють собою Н або F; та
R7 являє собою C1алкіл.
6. Сполука за п. 1, у якій:
R1 являє собою SO2-C3-C6алкіл;
R2 являє собою Н;
R3, R4, R5 та R6 незалежно являють собою Н або F; та
R7 являє собою C1алкіл.
7. Сполука за п. 1, у якій:
R1 вибирають з групи, що включає SО2-заміщений C1-C6алкіл, де алкіл є заміщеним одним або більшою кількістю галогенів, та CF3.
8. Сполука за п. 1, у якій:
R1 являє собою С(О)-зв'язуючу групу до другої структури формули (І) з утворенням її димеру.
9. Сполука за п. 1, 7 або 8, у якій R2 вибирають з групи, що включає Н та SO2-C1-C4алкіл.
10. Сполука за п. 1, 7, 8 або 9, у якій R3 вибирають з групи, що включає Н, C1-C3алкіл, галоген, вибраний з групи, що включає F та Сl, та О-C1-C3алкіл.
11. Сполука за п. 1, 7, 8, 9 або 10, у якій R4 вибирають з групи, що включає Н та О-C1-C3алкіл.
12. Сполука за п. 1, 7, 8, 9, 10 або 11, у якій R5 вибирають з групи, що включає Н, C1-C3алкіл, галоген, вибраний з групи, що включає F та Сl, та О-C1-C3алкіл.
13. Сполука за п. 1, 7, 8, 9, 10, 11 або 12, у якій R6 вибирають з групи, що включає Н та галоген, де галоген являє собою F.
14. Сполука за будь-яким з пп. 1-4 та 7-13, у якій R7 являє собою С1алкіл.
15. Сполука за п. 1, де сполука вибрана з групи, що включає:
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]пропан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-N-(метилсульфоніл)метансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]бутан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-2,2,2-трифторетансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4-ізопропілбензолсульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]бензолсульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4-метилбензолсульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]пропан-2-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]етансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]метансульфонамід
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2-фторфеніл]метансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2-фторфеніл]етансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-фторфеніл]етансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-фторфеніл]пропан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-фторфеніл]бутан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-фторфеніл]пропан-2-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5-дифторфеніл]метансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5-дифторфеніл]етансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5-дифторфеніл]пропан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5-дифторфеніл]бутан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5-дифторфеніл]пропан-2-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-(трифторметил)феніл]метансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-(трифторметил)феніл]етансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-(трифторметил)феніл]пропан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-(трифторметил)феніл]бутан-1-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-(трифторметил)феніл]пропан-2-сульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2-(трифторметокси)феніл]метансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2-(трифторметокси)феніл]етансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2-(трифторметокси)феніл]пропан-1-сульфонамід;
N-(4-бромфеніл)етансульфонамід;
трет-бутил 2-ціано-5-{4-{(етилсульфоніл)аміно]феніл}-1Н-пірол-1-карбоксилат;
N-[4-(5-ціано-1Н-пірол-2-іл)феніл]етансульфонамід;
N-[4-(5-ціано-1-етил-1Н-пірол-2-іл)феніл]етансульфонамід;
N-[4-(5-ціано-1-пропіл-1Н-пірол-2-іл)феніл]етансульфонамід;
N-[4-(1-бутил-5-ціано-1Н-пірол-2-іл)феніл]етансульфонамід;
N-[4-(1-аліл-5-ціано-1Н-пірол-2-іл)феніл]етансульфонамід;
N-[4-(5-ціано-1-проп-2-ін-1-іл-1Н-пірол-2-іл)феніл]етансульфонамід;
N-{4-[5-ціано-1-(3-фенілпропіл)-1Н-пірол-2-іл]феніл}етансульфонамід;
N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]метансульфонамід;
N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]етансульфонамід;
N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]пропан-1-сульфонамід;
N-[2-ціано-4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]метансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5-дифторфеніл]метансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5-дифторфеніл]етансульфонамід;
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5-дифторфеніл]пропан-1-сульфонамід;
N-[4-(5-цiaнo-1-метил-1Н-пірол-2-іл)-3,5-дифторфеніл]бутан-1-сульфонамід та
N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3-фторфеніл]метансульфонамід.
16. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-15 та фармацевтично прийнятний носій.
17. Фармацевтична композиція за п. 16, де зазначена композиція являє собою пероральну лікарську одиницю.
18. Фармацевтична композиція за п. 16, де зазначена композиція являє собою тверду пероральну лікарську одиницю.
19. Фармацевтична композиція за будь-яким з пп. 16-18, де зазначена композиція додатково містить естроген.
20. Фармацевтична композиція за будь-яким з пп. 16-18, де зазначена композиція додатково містить прогестин.
Текст
1. Сполука, що має структуру формули І, або її фармацевтично прийнятна сіль: H H R4 C2 2 (19) 1 3 с та f незалежно приймають значення 0-5, за умови, що один з с або f є більшим ніж 0; R3, R4, R5 та R6 незалежно вибирають з таких як: Н, галоген, CN, C1-C6алкіл, заміщений C1-C6алкіл, (CHmXn)zCHpXq, C3-C6циклоалкіл, О-C1-C6алкіл, ОC1-C6заміщений алкіл, О-(СНmХn)zСНрХq, арил, гетероарил, гетероцикл, заміщений арил, заміщений гетероарил та заміщений гетероцикл; X являє собою галоген; m та n незалежно приймають значення 0-2, за умови, що m + n = 2; р та q незалежно приймають значення 0-3, за умови, що р + q = 3; z приймає значення від 0 до 10; R7 вибирають з групи, що включає Н, C1-C6алкіл, С(О)О-C1-C6алкіл, C2-C6алкеніл, C2-C6алкініл, заміщений C1-C6алкіл, C3-C6циклоалкіл та заміщений C3-C6циклоалкіл. 2. Сполука за п. 1, у якій: R1 вибирають з групи, що включає SO2-C1-C6алкіл, SO2-C3-C8циклоалкіл, SО2-заміщений C1-C6алкіл, SО2-арил, SО2-заміщений арил, SO2-гетероарил, CN, SO2-C3-C6алкеніл, SO2-C3-C6алкініл, SO2-C3C6заміщений алкеніл та SO2-C3-C6заміщений алкініл; R2 являє собою Н або C1-C6алкіл; R3, R4, R5 та R6 незалежно вибирають з групи, що включає Н, галоген, C1-C6алкіл, C3-C6циклоалкіл, О-C1-C6алкіл та О-C1-C6 заміщений алкіл; та R7 являє собою Н або C1-C6алкіл. 3. Сполука за п. 1, у якій: R1 вибирають з групи, що включає SO2-C1-C4алкіл, SO2-C3-C5циклоалкіл та CN; R2 являє собою Н; R3, R4, R5 та R6 незалежно вибирають з групи, що включає Н, галоген, C1-C6алкіл, О-C1-C6алкіл, (CHmXn)zCHpXq та O-(CHmXn)zCHpXq; та R7 являє собою Н або C1-C6алкіл. 4. Сполука за п. 1, у якій: R1 являє собою SO2-C1-C4алкіл; R2 являє собою Н; кожен з R3, R4, R5 та R6 являє собою Н або F; та R7 являє собою C1-C6алкіл. 5. Сполука за п. 1, у якій: R1 являє собою SO2-C3-C5циклоалкіл; R2 являє собою Н; R3, R4, R5 та R6 незалежно являють собою Н або F; та R7 являє собою C1алкіл. 6. Сполука за п. 1, у якій: R1 являє собою SO2-C3-C6алкіл; R2 являє собою Н; R3, R4, R5 та R6 незалежно являють собою Н або F; та R7 являє собою C1алкіл. 7. Сполука за п. 1, у якій: R1 вибирають з групи, що включає SО2-заміщений C1-C6алкіл, де алкіл є заміщеним одним або більшою кількістю галогенів, та CF3. 8. Сполука за п. 1, у якій: R1 являє собою С(О)-зв'язуючу групу до другої структури формули (І) з утворенням її димеру. 9. Сполука за п. 1, 7 або 8, у якій R2 вибирають з групи, що включає Н та SO2-C1-C4алкіл. 92500 4 10. Сполука за п. 1, 7, 8 або 9, у якій R3 вибирають з групи, що включає Н, C1-C3алкіл, галоген, вибраний з групи, що включає F та Сl, та О-C1-C3алкіл. 11. Сполука за п. 1, 7, 8, 9 або 10, у якій R4 вибирають з групи, що включає Н та О-C1-C3алкіл. 12. Сполука за п. 1, 7, 8, 9, 10 або 11, у якій R5 вибирають з групи, що включає Н, C1-C3алкіл, галоген, вибраний з групи, що включає F та Сl, та О-C1C3алкіл. 13. Сполука за п. 1, 7, 8, 9, 10, 11 або 12, у якій R6 вибирають з групи, що включає Н та галоген, де галоген являє собою F. 14. Сполука за будь-яким з пп. 1-4 та 7-13, у якій R7 являє собою С1алкіл. 15. Сполука за п. 1, де сполука вибрана з групи, що включає: N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]пропан1-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-N(метилсульфоніл)метансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]бутан-1сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-2,2,2трифторетансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4ізопропілбензолсульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]бензолсульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4метилбензолсульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]пропан2-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2фторфеніл]метансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2фторфеніл]етансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]етансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]пропан-1-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]бутан-1-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]пропан-2-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]метансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]етансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]пропан-1-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]бутан-1-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]пропан-2-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]метансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]етансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]пропан-1-сульфонамід; 5 92500 6 N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]бутан-1-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]пропан-2-сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]метансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]етансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]пропан-1-сульфонамід; N-(4-бромфеніл)етансульфонамід; трет-бутил 2-ціано-5-{4{(етилсульфоніл)аміно]феніл}-1Н-пірол-1карбоксилат; N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(5-ціано-1-етил-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(5-ціано-1-пропіл-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(1-бутил-5-ціано-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(1-аліл-5-ціано-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(5-ціано-1-проп-2-ін-1-іл-1Н-пірол-2іл)феніл]етансульфонамід; N-{4-[5-ціано-1-(3-фенілпропіл)-1Н-пірол-2іл]феніл}етансульфонамід; N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонамід; N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонамід; N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]пропан-1-сульфонамід; N-[2-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]метансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]етансульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]пропан-1-сульфонамід; N-[4-(5-цiaнo-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]бутан-1-сульфонамід та N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]метансульфонамід. 16. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-15 та фармацевтично прийнятний носій. 17. Фармацевтична композиція за п. 16, де зазначена композиція являє собою пероральну лікарську одиницю. 18. Фармацевтична композиція за п. 16, де зазначена композиція являє собою тверду пероральну лікарську одиницю. 19. Фармацевтична композиція за будь-яким з пп. 16-18, де зазначена композиція додатково містить естроген. 20. Фармацевтична композиція за будь-яким з пп. 16-18, де зазначена композиція додатково містить прогестин. Агоністи та антагоністи прогестеронового рецептору (PR), що також називають PR модуляторами, описані для застосування у контрацепції та цілому ряді інших показань. Існує необхідність у нових PR модуляторах, які є корисними як контрацептивні засоби. У одному аспекті забезпечені PR модулятори. У іншому аспекті забезпечене застосування сполук, розкритих у цьому описі, для контрацепції, гормоно-замісної терапії, включаючи аменорею, синхронізування еструсу у поголів'ї, та лікування та/або профілактики доброякісного та злоякісного новоутворення, маткових міометральних фіброїдів, ендометріозу, доброякісної гіпертрофії передміхурової залози, карцином та аденокарцином ендометрію, пухлин яєчнику, молочної залози, кишковику, передміхурової залози, гіпофізу, менінгіоми та інших гормоно-залежних пухлин, дисменореї, дисфункціональної кровотечі матки, пов'язаних з циклом симптомів, та симптомів передменструального синдрому та передменструального дисфоричного розладу. У іншому аспекті забезпечені фармацевтичні композиції, що містять PR модулятор. У додатковому аспекті забезпечені фармацевтичні композиції, які містять PR модулятор у комбінації з прогестином або естрогеном. Інші аспекти та переваги даного винаходу додатково описані у наступному детальному описі його кращих втілень. Забезпечені сполуки, корисні для контрацепції, гормоно-замісної терапії, синхронізування еструсу, лікування дисменореї, лікування дисфункціональної кровотечії матки, включаючи аменорею, лікування пов'язаних з циклом симптомів, або лікування симптомів передменструального синдрому та передменструального дисфоричного розладу. Модулятор прогестеронового рецептору, забезпечений у цьому описі, характеризується тим, що він має структуру формули І: у якій: R1 вибирають з таких як: Н, CN, SO2-C1-C6 алкіл, SO2-C3-С8циклоалкіл, SO2заміщений С1-С6 алкіл, SO2-арил, SO2-заміщений арил, SO2-гетероарил, SO2-гетероцикл, SO2-C3-C6 7 алкеніл, SO2-C3-C6 алкініл, SO2-C3-C6 заміщений алкеніл, SO2-C3-C6 заміщений алкініл, С(О)-С1-С6 алкіл, C(O)-C3-C8 циклоалкіл, С(О)заміщений С1-С6 алкіл, С(О)-арил, С(О)-заміщений арил, С(О)-гетероарил, С(О)-гетероцикл, С(О)-С3С6 алкеніл, С(О)-С3-С6 алкініл, С(О)-заміщений С3С6 алкеніл, С(О)-заміщений С3-С6 алкініл, С(О)О-С1-С6 алкіл, С(О)О-С3-С8 циклоалкіл, С(О)О-заміщений С1-С6 алкіл, С(О)О-арил, С(О)Озаміщений арил, С(О)О-гетероарил, С(О)Огетероцикл, С(О)О-С3-С6 алкеніл, С(О)О-С3-С6 алкініл, С(О)О-С3-С6 заміщений алкеніл, С(О)О-С1-С6 заміщений алкініл, C(O)NH-С1-С6 алкіл, C(O)NH-С3-С8 циклоалкіл, С(О)N-ди-С3-С8 циклоалкіл, С(О)N-ди-С1-С6 алкіл, С(О)N-ди-заміщений С1-С6 алкіл, С(О)NНзаміщений С1-С6 алкіл, С(О)NН-арил, С(О)N-диарил, С(О)NН-заміщений арил, С(О)N-дизамщений арил, С(О)NН-гетероарил, С(О)NНгетероцикл, С(О)N-дигетероарил, С(О)Nдигетероцикл, C(O)NH-C3-C6 алкеніл, C(O)NH-C3C6 алкініл, С(О)NH-заміщений С3-С6 алкеніл, та С(О)NН-заміщений С3-С6 алкініл; або R1 являє собою зв'язуючу групу до другої структури формули І з утворенням димеру формули І, зазначену зв'язуючу групу вибирають з С(О)- або S(O)2-, R2 вибирають з таких як: Н, С1-С6 алкіл, заміщений С1-С6 алкіл, С3-С6 циклоалкіл, SO2-алкіл, та SO2-заміщений алкіл; за умови, що принаймні один з R1 або R2 містить групу, що має SO2-, прикріплену до N, або R1 являє собою S(O)2- зв'язуючу групу; або R1 та R2 сполучають з утворенням (C(R8)a(R9)b)c-SO2-(C(R8)d(R9)e)f-; R8 та R9 незалежно являють собою Н, галоген, або С1-С6 алкіл; а та b незалежно являють собою 0 - 2, за умови, що а+b=2; d та e незалежно являють собою 0 - 2, за умови, що а+b=2; с та f незалежно являють собою 0 - 5, за умови, що один з с або f є більшим ніж 0; R3, R4, R5 та R6 незалежно вибирають з таких як: Н, галоген, CN, С1-С6 алкіл, заміщений С1-С6 алкіл, -(СНmХn)2СНрХq, С3-С6 циклоалкіл, О-С1-С6 алкіл, О-С1-С6 заміщений алкіл, O-(CHmXn)zCHpXq, арил, гетероарил, гетероцикл, заміщений арил, заміщений гетероарил, та заміщений гетероцикл; X являє собою галоген; m та n незалежно являють собою 0 - 2, за умови, що m+n=2; р та q незалежно являють собою 0 - 3, за умови, що р+q=3; z являє собою 0-10; R7 вибирають з групи, що включає Н, С1-С6 алкіл, С(О)О-С1-С6 алкіл, С2-С6 алкеніл, С2-С6 алкініл, заміщений С1-С6 алкіл, С3-С6 циклоалкіл, та заміщений С3-С6 циклоалкіл. У одному варіанті втілення, сполука має структуру формули І, у якій: R1 являє собою Н, SO2-С1-С6 (заміщений або незаміщений) алкіл, SO2-С3-С6 циклоалкіл, SO2 (заміщений або незаміщений) арил, SO2гетероарил або CN; 92500 8 R2 являє собою Н або С1-С6 (заміщений або незаміщений) алкіл; R3, R4, R5 та R6 незалежно вибирають з таких як: Н, галоген, С1-С6 (заміщений або незаміщений) алкіл, С3-С6 циклоалкіл, та О-С1-С6 (заміщений або незаміщений) алкіл; та R7 являє собою Н або С1-С6 алкіл. У іншому варіанті втілення, сполука має структуру формули І, у якій: R1 являє собою Н, SO2-C1-C4 алкіл або CN; R2 являє собою Н; R3, R4, R5 та R6 незалежно вибирають з таких як: Н, галоген, С1-С6 (заміщений або незаміщений) алкіл, та O-С1-С6 (заміщений або незаміщений) алкіл; та R7 являє собою Н або С1-С6 алкіл. У іншому варіанті втілення, сполука має структуру формули І, у якій: R1 являє собою SO2-C1-C4 алкіл; R2 являє собою Н; R3, R4, R5 та R6 являють собою Н; та R7 являє собою С1-С6 алкіл. Таким чином, у одному варіанті втілення забезпечені сполуки формули І, у яких R1 або R2 являє собою SO2-(заміщений або незаміщений) С1-С4 алкіл. У додатковому варіанті втілення, забезпечені сполуки, такі як: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]пропан-1-сульфонамід; N-[4-(5-ціано-1метил-1Н-пірол-2-іл)феніл]-N(метилсульфоніл)метан-сульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)феніл]бутан-1сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]-2,2,2-трифторетансульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)феніл]-4ізопропілбензолсульфонамід; N-[4-(5-ціано-1метил-1Н-пірол-2-іл)феніл]бензолсульфонамід; N[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4метилбензолсульфонамід; N-[4-(5-ціано-1-метил1Н-пірол-2-іл)феніл]пропан-2-сульфонамід; N-[4(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(5-ціано-1-метил1Н-пірол-2-іл)феніл]метансульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-2фторфеніл]метансульфонамід; N-[4-(5-ціано-1метил-1Н-пірол-2-іл)-2фторфеніл]етансульфонамід; N-[4-(5-ціано-1метил-1Н-пірол-2-іл)-3фторфеніл]етансульфонамід; N-[4-(5-ціано-1метил-1Н-пірол-2-іл)-3-фторфеныл]пропан-1сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)3-фторфеніл]бутан-1-сульфонамід; N-[4-(5-ціано-1метил-1Н-пірол-2-іл)-3-фторфеніл]пропан-2сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)2,5-дифторфеніл]-метан-сульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]етан-сульфонамід; N-[4-(5-ціано-1метил-1Н-пірол-2-іл)-2,5-дифторфеніл]пропан-1сульфонамід; N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)2,5-дифторфеніл]бутан-1-сульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]пропан-2-сульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]метан-сульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-3 9 (трифторметил)феніл]етан-сульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]пропан-1-сульфонамід; N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]бутан-1-сульфонамід; N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]пропан-2-сульфонамід; N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]метан-сульфонамід; N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]етан-сульфонамід; N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]пропан-1-сульфонамід; N(4-бромфеніл)етансульфонамід; трет-бутил 2ціано-5-{4-{(етилсульфоніл)аміно]феніл}-1Н-пірол1-карбоксилат; N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(5-ціано-1-етил1Н-пірол-2-іл)феніл]етансульфонамід; N-[4-(5ціано-1-пропіл-1Н-пірол-2іл)феніл]етансульфонамід; N-[4-(1-бутил-5-ціано1Н-пірол-2-іл)феніл]етансульфонамід; N-[4-(1 аліл5-ціано-1Н-пірол-2-іл)феніл]етансульфонамід; N[4-(5-ціано-1-проп-2-ін-1-іл-1Н-пірол-2іл)феніл]етансульфонамід; N-{4-[5-ціано-1-(3фенілпропіл)-1Н-пірол-2іл]феніл}етансульфонамід; N-[3-ціано-4-(5-ціано-1метил-1Н-пірол-2-іл)феніл]метансульфонамід; N[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонамід; N-[3-ціано-4-(5-ціано-1метил-1Н-пірол-2-іл)феніл]пропан-1-сульфонамід; N-[2-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонамід; N-[4-(5-ціано-1-метил1Н-пірол-2-іл)-3,5-дифторфеніл]метансульфонамід; N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-3,5-дифторфеніл]етан-сульфонамід; N[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]пропан-1-сульфонамід; N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]бутан-1-сульфонамід; N-[4-(5-ціано-1 метил-1Н-пірол-2-іл)-3фторфеніл]метансульфонамід, або їх фармацевтично прийнятна сіль, таутомер, метаболіт, або проліки. Сполуки можуть містити один або більше асиметричних центрів і, таким чином, можуть викликати появу оптичних ізомерів та діастереомерів. Хоча показано не приймаючи до уваги стереохімію, сполуки можуть включати оптичні ізомери та діастереомери; рацемічні та розділені енантіомерно чисті R та S стереоізомери; інші суміші R та S стереоізомерів; та їх фармацевтично прийнятні солі. Термін "алкіл" використовують у цьому описі для опису як лінійних, так і розгалуженоланцюгових насичених аліфатичних вуглеводневих груп. У одному варіанті втілення, алкільна група має від 1 до приблизно 8 атомів вуглецю (тобто С1, С2, С3, С4, C5, С6, С7 або С8). У іншому варіанті втілення, алкільна група має від 1 до приблизно 6 атомів вуглецю (тобто С1, С2, С3, С4, C5 або С6). У додатковому варіанті втілення, алкільна група має від 1 до приблизно 4 атомів вуглецю (тобто С1, С2, С3 або С4). Термін "циклоалкіл" використовують у цьому описі для опису циклічних, насичених аліфатичних вуглеводневих груп. У одному варіанті втілення, 92500 10 циклоалкільна група має від 3 до приблизно 8 атомів вуглецю (тобто С3, С4, C5, С6, С7 або C8). У іншому варіанті втілення, циклоалкільна група має від 3 до приблизно 6 атомів вуглецю (тобто С3, С4, С5 або С6). Термін "алкеніл" використовують у цьому описі для опису як лінійних, так і розгалуженоланцюгових алкільних груп, що мають один або більше подвійних зв'язків вуглець-вуглець. У одному варіанті втілення, алкенільна група містить від 3 до приблизно 8 атомів вуглецю (тобто С3, С4, C5, С6, С7 або C8). У іншому варіанті втілення, алкенільна група має 1 або 2 подвійні зв'язки вуглець-вуглець та від 3 до приблизно 6 атомів вуглецю (тобто С3, С4, С5 або С6). Термін "алкінільна" група використовують у цьому описі для опису як лінійних, так і розгалужено-ланцюгових алкільних груп, що мають один або більше потрійних зв'язків вуглець-вуглець. У одному варіанті втілення, алкінільна група має від 3 до приблизно 8 атомів вуглецю (тобто С3, С4, С5, С6, С7 або C8). У іншому варіанті втілення, алкінільна група містить 1 або 2 потрійних зв'язки вуглець-вуглець та від 3 до приблизно 6 атомів вуглецю (тобто С3, С4, C5 або С6). Терміни "заміщений алкіл", "заміщений алкеніл", "заміщений алкініл", та "заміщений циклоалкіл" відносяться до алкільних, алкенільних, алкінільних та циклоалкільних груп, відповідно, що мають один або більше замісників, включаючи, без обмеження, галоген, CN, OH, NO2, аміно групу, арил, гетероциклічні групи, арил, алкокси групу, арилокси групу, алкілокси групу, алкілкарбоніл, алкілкарбокси групу, аміно групу та арилтіо групу. Термін "арил", як використано у цьому описі, відноситься до ароматичної, карбоциклічної системи, що складається, наприклад, з приблизно 614 атомів вуглецю, яка може включати одне кільце або багато ароматичних кілець, сконденсованих або зв'язаних разом, де принаймні одна частина сконденсованого або зв'язаного кільця утворює кон'юговану ароматичну систему. Арильні групи включають, не обмежуючись наведеними, феніл, нафтил, біфеніл, антрил, тетрагідронафтил, фенантрил, інден, бензонафтил та флуореніл. Термін "заміщений арил" відноситься до арильної групи, яка є заміщеною одним або більше замісниками, включаючи галоген, CN, OH, NO2, аміно групу, алкіл, циклоалкіл, алкеніл, алкініл, алкокси групу, арилокси групу, алкілокси групу, алкілкарбоніл, алкілкарбокси групу, алкіламіно групу, та арилтіо групу, де ці групи можуть бути заміщеними. Бажано, щоб заміщена арильна група була заміщена за допомогою від 1 до приблизно 4 замісників. Терміни "гетероцикл" або "гетероциклічний", як використано у цьому описі, можуть застосовуватися взаємозамінно для позначення стабільного, насиченого або частково ненасиченого 3- - 9членного моноциклічного або поліциклічного гетероциклічного кільця. Гетероциклічне кільце має у його скелеті атоми вуглецю та один або більше гетероатомів, включаючи атоми азоту, кисню та сірки. У одному варіанті втілення, гетероциклічне кільце має від 1 до приблизно 4 гетероатомів у 11 скелеті кільця. Коли гетероциклічне кільце містить атоми азоту або сірки у скелеті кільця, атоми азоту або сірки можуть бути окисленими. Термін "гетероцикл" або "гетероциклічний" також відноситься до поліциклічних кілець, у яких гетероциклічне кільце сконденсоване до арильного кільця, що складається з приблизно 6 до приблизно 14 атомів вуглецю. Гетероциклічне кільце може бути прикріплене до арильного кільця через гетероатом або атом вуглецю, за умови, що отримана гетероциклічна кільцева структура є хімічно стабільною. У одному варіанті втілення, гетероциклічне кільце включає поліциклічні системи, що мають 1-5 кілець. Цілий ряд гетероциклічних груп відомий у даній галузі техніки та включає, без обмеження, кисень-вмісні кільця, азот-вмісні кільця, сірко-вмісні кільця, змішані гетероатом-вмісні кільця, сконденсовані гетероатом-вмісні кільця, та їх комбінації. Приклади гетероциклічних груп включають, без обмеження, тетрагідрофураніл, піперидиніл, 2оксопіперидиніл, піролідиніл, морфолініл, тіаморфолініл, тіаморфолініл сульфоксид, піраніл, піроніл, діоксиніл, піперазиніл, дитіоліл, оксатіоліл, діоксазоліл, оксатіазоліл, оксазиніл, оксатіазиніл, бензопіраніл, бензоксазиніл та ксантеніл. Термін "гетероарил", як використано у цьому описі, відноситься до стабільного, ароматичного 5- 14-членного моноциклічного або поліциклічного гетероатом-вмісного кільця. Гетероарильне кільце має у його скелеті атоми вуглецю та один або більше гетероатомів, включаючи атоми азоту, кисню та сірки. У одному варіанті втілення, гетероарильне кільце містить від 1 до приблизно 4 гетероатомів у скелеті кільця. Коли гетероарильне кільце містить атоми азоту або сірки у скелеті кільця, атоми азоту або сірки можуть бути окисленими. Термін "гетероарил" також відноситься до поліциклічних кілець, де гетероарильне кільце є сконденсованим до арильного кільця. Гетероарильне кільце може бути прикріплене до арильного кільця через гетероатом або атом вуглецю, за умови, що отримана гетероциклічна кільцева структура є хімічно стабільною. У одному варіанті втілення, гетероарильне кільце включає поліциклічні системи, що мають 1 - 5 кілець. Цілий ряд гетероарильних груп відомий у даній галузі техніки та включає, без обмеження, кисень-вмісні кільця, азот-вмісні кільця, сірко-вмісні кільця, змішані гетероатом-вмісні кільця, сконденсовані гетероатом-вмісні кільця, та їх комбінації. Приклади гетероарильних груп включають, без обмеження, фурил, піроліл, піразоліл, імідазоліл, триазоліл, піридил, піридазиніл, піримідиніл, піразиніл, триазиніл, азепініл, тієніл, дитіоліл, оксатіоліл, оксазоліл, тіазоліл, оксадіазоліл, оксатриазоліл, оксепініл, тієпініл, діазепініл, бензофураніл, тіонафтен, індоліл, бензазоліл, пуриндиніл, піранопіроліл, ізоіндазоліл, індоксазиніл, бензоксазоліл, хінолініл, ізохінолініл, бензодіазоніл, наптилридиніл, бензотієніл, піридопіридиніл, акридиніл, карбазоліл та пуринільні кільця. Термін "заміщений гетероцикл" та "заміщений гетероарил", як використано у цьому описі, відноситься до гетероциклу або гетероарильної групи, 92500 12 що має один або більше замісників, включаючи такі як: галоген, CN, OH, NO2, аміно група, алкіл, циклоалкіл, алкеніл, алкініл, алкокси група, арилокси група, алкілокси група, алкілкарбоніл, алкілкарбокси група, алкіламіно група та арилтіо група. Заміщений гетероцикл або гетероарильна група може мати 1, 2, 3 або 4 замісники. Термін "арилтіо", як використано у цьому описі, відноситься до групи S(арил), де точка прикріплення відбувається через атом сірки, та арильна група може бути заміщена як зазначено вище. Термін "алкокси", як використано у цьому описі, відноситься до групи О(алкіл), де точка прикріплення відбувається через атом кисню, та алкільна група може бути заміщена, як зазначено вище. Термін "арилокси", як використано у цьому описі, відноситься до групи О(арил), де точка прикріплення відбувається через атом кисню, та арильна група може бути заміщена, як зазначено вище. Термін "алкілкарбоніл", як використано у цьому описі, відноситься до групи С(О)(алкіл), де точка прикріплення відбувається через атом вуглецю карбонільного залишку та алкільна група може бути заміщена, як зазначено вище. Термін "алкілкарбокси", як використано у цьому описі, відноситься до групи С(О)О(алкіл), де точка прикріплення відбувається через атом вуглецю карбокси залишку та алкільна група може бути заміщена, як зазначено вище. Термін "алкіламіно", як використано у цьому описі, відноситься як до вторинних, так і третинних амінів, де точка прикріплення відбувається через атом азоту та алкільні групи можуть бути заміщені як зазначено вище. Алкільні групи можуть бути однаковими або різними. Термін "галоген", як використано у цьому описі, відноситься до СІ, Br, F або І груп. Сполуки включають таутомерні форми структур, забезпечених у цьому описі, що характеризуються біоактивністю намальованих структур. Додатково, сполуки можуть бути використані у формі солей, що одержують з фармацевтично або фізіологічно прийнятних основ, лужних металів та лужноземельних металів. Фармацевтично прийнятні солі можуть бути одержані з неорганічних основ, бажано солей лужних металів, наприклад, натрію, літію або калію, та органічних основ, таких як амоній, моно-, ди- та триметиламоній, моно-, ди- та триетиламоній, моно-, ди- та трипропіламоній (ізо та нормальний), етилдиметиламоній, бензилдиметиламоній, циклогексиламоній, бензиламоній, дибензиламоній, піперидиній, морфоліній, піролідиній, піперазиній, 1метилпіперидиній, 4-етилморфоліній, 1ізопропілпіролідиній, 1,4-диметилпіперизиній, 1-нбутил піперидиній, 2-метилпіперидиній, 1-етил-2метилпіперидиній, моно-, ди- та триетаноламоній, етил-диетаноламоній, н-бутилмоноетаноламоній, тріс(гідроксиметил)метил-амоній, фенілмоноетанол-амоній, та подібні. Фізіологічно прийнятні солі лужних металів та солі лужноземельних металів можуть включати, без обмеження, натрієві, калієві, кальцієві та магнієві солі у формі складних ефірів та карбаматів. 13 92500 14 Також можуть бути використані інші звичайні "пролікарські" форми, які, після доставки у такій формі, перетворюються у активний залишок in vivo. Такі інші сполуки можуть бути у формі складних ефірів, карбаматів та інших звичайних "пролікарських" форм, які, при застосуванні у такій формі, перетворюються у активний залишок in vivo. У одному варіанті втілення, проліки являють собою складні ефіри. Дивись, наприклад, В. Testa та J. Caldwell, "Prodrugs Revisited: The "Ad Hoc" Approach as a Complement to Ligand Design", Medicinal Research Reviews, 16(3): 233-241,ред., John Wiley & Sons (1996). Як розкрито у цьому описі, сполуки формули І та/або їх солі, проліки або таутомери, доставляють у режимі для контрацепції, з терапевтичними або профілактичними цілями, як розкрито у цьому описі. Сполуки, розкриті у цьому описі, також включають "метаболіти", які являють собою унікальні продукти, утворені шляхом обробки сполук клітиною або пацієнтом. Бажано, щоб метаболіти утворювалися in vivo. Сполуки можуть бути легко одержані спеціалістом, кваліфікованим у даній галузі техніки, відповідно до наступних схем, з комерційно доступних вихідних матеріалів або вихідних матеріалів, які можуть бути одержані, використовуючи процедури, описані у літературі. Ці схеми показують одержання типових сполук. Відхилення від цих способів, або інші способи, відомі у даній галузі техніки, можуть бути легко використані спеціалістом, кваліфікованим у даній галузі техніки, що дає інформацію, забезпечену у цьому описі. Відповідно до схеми 1, відповідно заміщений броманілін (1) перетворюють у сполуку 3 під дією паладієвого каталізатору та прийнятного сполучного члену, такого як борна кислота або похідна олова. Анілін також може являти собою похідну хлору, йоду, або сульфонату. Сполучний член може бути утворений in situ з піролу (7) та літію діізопропіламіду та триалкіл-борату або може являти собою попередньо утворену борну кислоту (2), як описано у співвласній Патентній Публікації Заявки США No. US-2005-0272702-А1, що включено у даний опис шляхом посилання. Джерелом паладію зазвичай є тетракіс(трифенілфосфін) паладій (0) або інше прийнятне джерело, таке як паладію дибензиліден-ацетон у присутності трибутилфосфіну (Fu, G. С. та інші, Journal of the American Chemical Society, 2000, 122, 4020). Альтернативні системи каталізаторів описані у Hartwig, та інші. Journal of Organic Chemistry, 2002, 67, 5553. У зазначеній реакції також необхідна основа; нормальними для вибору є карбонат натрію або калію, фторид цезію, фторид калію або фосфат калію. Вибір розчинників включає тетрагідрофуран (THF), диметоксиетан (DME), діоксан, етанол, вода та толуол. В залежності від реакційної здатності сполучних членів та реагентів, реакція може бути доведена до точки кипіння розчиннику, або насправді може бути прискорена при мікрохвильовому опроміненні, якщо необхідно. Сполуки 4, у яких R1 включає амід, можуть бути легко одержані зі сполук 3 шляхом реакції з широким рядом електрофільних реагентів, включаючи хлорангідриди кислоти та карбонові кислоти, об'єднані з активуючим реагентом, таким як дициклогексил-карбодіімід (DCC), N-(3диметиламінопропіл)-N'-етилкарбодіімід гідрохлорид (EDC), бензотриазол-1-ілокситрипіролідинофосфоній гексафторфосфат (РуВОР® реагент); або для додаткових прикладів дивись, наприклад, R.C. Larock, "Comprehensive Organic Transformations", друге видання, John Wiley & Sons (1999). Сполуки 4, у яких R1 включає карбамат, можуть бути легко одержані зі сполук 3 шляхом реакції з широким рядом електрофільних реагентів, включаючи хлорформіати або активовані карбонати. Сполуки 4, у яких R1 включає сульфонамід, можуть бути легко одержані зі сполук 3 шляхом реакції з широким рядом електрофільних реагентів, включаючи сульфоніл-хлориди або сильфонові кислоти, об'єднані з активуючим реагентом. Сполуки 4, у яких R1 включає ціанамід, можуть бути легко одержані зі сполук 3 шляхом реакції з електрофільними реагентами, такими як бромціан. Сполуки 4, у яких R1 включає сечовину, можуть бути легко одержані зі сполук 3 шляхом реакції з широким рядом електрофільних реагентів, включаючи фосген (що супроводжується реакцією з аміном), карбамоїл-хлориди та ізоціанати. 15 92500 16 Зазначені реакції проводять у прийнятному розчиннику, включаючи метилен-хлорид, THF, диметилформамід (DMF), або піридин у присутності амінної основи, такої як піридин, триетиламін або діізопропілетил-амін. Солі металів, включаючи карбонат натрію, карбонат цезію, карбонат калію, також є прийнятними основами для зазначеної реакції. Анілін 3 також може бути попередньо оброблений сильною основою, включаючи алкіллітієві основи, третинний бутоксид калію, натрію гексаметилдисилазид та подібні основи у апротонному розчиннику, такому як ефір або THF та потім вводять у реакцію з електрофільним агентом. Альтернативно, анілін 3 може бути безпосередньо розчинений у хлорангідриді кислоти, сульфоніл-хлориді, або хлорформіаті за відсутності розчиннику або основи для одержання сполуки 4. Сполуки 5 можуть бути легко одержані зі сполук 4 шляхом реакції з широким рядом електрофільних реагентів, таких як хлорангідриди кислоти, сульфоніл-хлориди, хлорформіати, бромціан, ізоціанати та алкілюючі агенти. Алкілюючі агенти зазвичай складаються з алкану, що має прийнятну відхідну групу, таку як бромід, йодид, хлорид, або сульфонат. Звичайні приклади алкілюючих агентів являють собою метил-йодид, бензил-бромід, пропіл-бромід, аліл-хлорид та пропаргіл-бромід. Відповідна похідна карбонової кислоти або сульфонової кислоти та прийнятний активуючий реагент також можуть бути введені у реакцію зі сполуками 4 з утворенням сполук 5. Зазначені реакції проводять у прийнятному розчиннику, включаючи метилен-хлорид, THF, DMF або піридин у присутності амінної основи, такої як піридин, триетиламін або діізопропілетил-амін. Металічні солі, включаючи карбонат натрію, карбонат цезію або карбонат калію, також являють собою прийнятні основи для зазначеної реакції. Похідна аніліну 4 також може бути попередньо оброблена сильною основою, включаючи алкіл-літієву основу, третинний бутоксид калію, гексаметилдисилазид натрію та подібні основи у апротонному розчиннику, такому як ефір або THF, та потім введена у реакцію з електрофільним агентом. Альтернативно, анілінова похідна 4 може бути безпосередньо розчинена у хлорангідриді кислоти, сульфоніл-хлориді або хлорформіаті за відсутності розчиннику або основи з одержанням сполук 5. Альтернативний спосіб одержання сполук 4 та 5 показаний у Схемі 2. Сполуки 8, у яких R1 включає амід, можуть бути легко одержані з аніліну 1 шляхом реакції з широким рядом електрофільних реагентів, включаючи хлорангідриди кислоти та карбонові кислоти, змішані з активуючим агентом. Сполуки 8, у яких R1 включає карбамат, можуть бути легко одержані з аніліну 1 шляхом реакції з широким рядом електрофільних реагентів, включаючи хлорформіати або активовані карбонати. Сполуки 8, у яких R1 включає сульфонамід, можуть бути легко одержані з аніліну 1 шляхом реак ції з широким рядом електрофільних реагентів, включаючи сульфоніл-хлориди або сильфонові кислоти, об'єднані з активуючим агентом, таким як РCl5, РОСl3, DCC, EDC, РуВОР® реагент, або для додаткових прикладів дивись, наприклад, R.C. Larock, "Comprehensive Organic Transformations", друге видання, John Wiley & Sons (1999). Сполуки 8, у яких R1 включає ціанамід, можуть бути легко одержані з аніліну 1 шляхом реакції з електрофільними агентами, такими як бромціан. Сполуки 8, у яких R1 включає сечовину, можуть бути легко одержані з аніліну 1 шляхом реакції з широким 17 рядом електрофільних реагентів, включаючи фосген, трифосген, дифосген, карбоніл-діімідазол, карбамоїл-хлориди, та ізоціанати. Зазначені реакції проводять у прийнятному розчиннику, включаючи метиленхлорид, THF, DMF, або піридин у присутності амінної основи, такої як піридин, триетиламін або діізопропілетил-амін. Металічні солі, включаючи карбонат натрію, карбонат цезію або карбонат калію, також можуть являти собою прийнятні основи для зазначеної реакції. Анілін 1 також може бути попередньо оброблений сильною основою, включаючи алкіл-літієві основи, третбутоксид калію, гексаметилдисилазид натрію та подібні основи, у апротонному розчиннику, такому як ефір або THF, та потім вводять у реакцію з електрофільним агентом. Альтернативно, анілін 1 може бути безпосередньо розчинений у хлорангідридах кислот, сульфоніл-хлоридах, або хлорформіаті за відсутності розчиннику або основи з одержанням сполук 8. Броманілінові сполуки 9 можуть бути легко одержані з заміщених броманілінових сполук 8 шляхом реакції з широким рядом електрофільних реагентів, таких як хлорангідриди кислоти, сульфоніл-хлориди, хлорформіати, бромціан, ізоціанати, та алкілюючі агенти. Алкілюючі агенти зазвичай складаються з алкану, що має прийнятну відхідну групу, таку як бромід, йодид, хлорид або сульфонат. Загальні приклади алкілюючих агентів являють собою метил-йодид, бензил-бромід, пропілбромід, аліл-хлорид та пропаргіл-бромід. Відповідна похідна карбонової кислоти або сульфонової кислоти та прийнятний активуючий реагент також можуть бути введені у реакцію зі сполуками 8 з одержанням сполук 9. Зазначені реакції проводять у прийнятному розчиннику, включаючи метиленхлорид, THF, DMF або піридин, у присутності амінної основи, такої як піридин, триетиламін або діізопропілетил-амін. Металічні солі, включаючи карбонат натрію, карбонат цезію або карбонат калію, також можуть являти собою прийнятні основи для зазначеної реакції. Похідна аніліну 8 також може бути попередньо оброблена сильною основою, включаючи алкіл-літієві основи, третбутоксид калію, натрію гексаметилдисилазид та подібні основи, у апротонному розчиннику, такому як ефір або THF, та потім вводять у реакцію з електрофільним агентом. Альтернативно, похідна аніліну 8 може бути безпосередньо розчинена у хлорангідриді кислоти, сульфоніл-хлориді або хлорформіаті за відсутності розчиннику або основи з одержанням сполук 9. Заміщений броманілін 8 або броманілін 9 перетворюють у сполуку 4 або сполуку 5 відповідно, під дією паладієвого каталізатору та прийнятного сполучного агенту, такого як борна кислота або похідна олова. Анілін також може являти собою похідну хлору, йоду або сульфонату. Сполучний агент може бути утворений in situ з піролу (7) (дивись схему 1) та діізопропіламіду літію та триалкілборату або може являти собою попередньо утворену борну кислоту (2). Джерело паладію, як правило, являє собою тетракіс(трифенілфосфін)паладій (0) або інше прийнятне джерело, таке як дибензиліден-ацетон 92500 18 паладію у присутності трибутилфосфіну (Fu, G. С. та інші, Journal of the American Chemical Society, 2000, 122, 4020, для альтернативних систем каталізаторів дивись також Hartwig, J. F. та інші, Journal of Organic Chemistry, 2002, 67, 5553). У зазначеній реакції також необхідна основа та нормальним вибором є карбонат натрію або калію, фторид цезію, фторид калію або фосфат калію. Кращий розчинник включає THF, диметоксиетан, діоксан, етанол, воду та толуол. В залежності від реакційної здатності сполучних членів та реагентів, реакція може бути доведена до точки кипіння розчиннику, або насправді може бути прискорена при мікрохвильовому опроміненні, якщо необхідно. Також описані фармацевтичні композиції, що містять одну або більше сполук, розкритих у цьому описі, та фармацевтично прийнятний носій або наповнювач. Зазначені сполуки та композиції можуть бути використані у способах лікування, які включають введення ссавцю фармацевтично ефективної кількості однієї або більше сполук, описаних вище, як модулятори прогестеронового рецептору. Сполуки можуть бути використані у способах контрацепції, гормоно-замісної терапії, та лікування та/або профілактики доброякісного та злоякісного новоутворення, маткових міометральних фіброїдів, ендометріозу, доброякісної гіпертрофії передміхурової залози, карцином та аденокарцином ендометрію, пухлин яєчнику, молочної залози, кишковику, передміхурової залози, гіпофізу, менінгіом та інших гормоно-залежних пухлин, дисменореї, дисфункціональної кровотечії матки, пов'язаних з циклом симптомів, та симптомів передменструального синдрому та передменструального дисфоричного розладу, та для спричинення аменореї. Додаткові застосування даних модуляторів прогестеронового рецептору включають синхронізування еструсу у поголів'ї. Термін "пов'язані з циклом симптоми" відноситься до психологічних та психічних симптомів, пов'язаних з жіночим менструальним циклом, що виникають у фазі лютеїнізації менструального циклу. Повідомлялося, що більшість жінок відчувають пов'язані з циклом симптоми. В основному симптоми зникають після початку менструації, та пацієнтка не має зазначених симптомів протягом фолікулярної фази, що залишилася. Циклічна природа зміни симптомів характеризує пов'язані з циклом симптоми. Пов'язані з циклом симптоми зустрічаються у приблизно 95% жінок, які відчувають деякі фізичні зміни або зміни настрою з їх менструальними циклами. Тільки приблизно одна третя цих жінок відчувають від помірних до сильних пов'язаних з циклом симптомів. Жінки відрізняються у кількості, типі, серйозності та моделі симптомів перед менструацією. Одна річ, загальна для всіх типів пов'язаних з циклом симптомів, полягає у зниженні або зникненні зазначених симптомів на два тижні після менструації до овуляції. Термін "пов'язані з циклом симптоми" відноситься до психологічних симптомів (наприклад, зміна настрою, дратівливість, неспокій, недостатність концентрування, або зниження у сексуаль 19 ному потязі) та фізичних симптомів (наприклад, дисменорея, болісність молочних залоз, метеоризм, втомленість або потяг до їжі), пов'язаних з менструальним циклом жінки. Пов'язані з циклом симптоми трапляються після овуляції, але перед менструацією та, як правило, закінчуються на початку менструального періоду або незабаром після нього. Пов'язані з циклом симптоми включають, не обмежуючись наведеними, дисменорею та від помірних до сильних пов'язаних з циклом симптомів. Відповідно, PR модулятори рецептують для доставки будь-яким прийнятним шляхом, включаючи, наприклад, крізьшкірний, мукозальний (інтраназальний, защічний, вагінальний), пероральний, парентеральний, тощо, будь-яким прийнятним пристроєм для доставки, включаючи, наприклад, трансдермальні пластирі, місцеві креми або гелі, вагінальне кільце, серед інших. Коли сполуки використовують для описаних вище цілей, вони можуть бути об'єднані з одним або більше фармацевтично прийнятними носіями або наповнювачами, наприклад, такими як розчинники, розріджувачі та подібні, та можуть бути введені перорально у таких формах як таблетки, капсули, дисперсивні порошки, гранули або суспензії, що містять, наприклад, від приблизно 0,05 до 5% суспендуючого агенту, сиропи, що містять, наприклад, від приблизно 10 до 50% цукру, та еліксири, що містять, наприклад, від приблизно 20 до 50% етанолу, та подібні, або парентерально у формі стерильних ін'єкційних розчинів або суспензій, що містять від приблизно 0,05 до 5% суспендуючого агенту у ізотонічному середовищі. Такі фармацевтичні препарати можуть містити, наприклад, від приблизно 25 до приблизно 90% активного інгредієнту у комбінації з носієм, звичайно від приблизно 5% до 60% за масою. Ефективна доза активного інгредієнту, що використовують, може змінюватися в залежності від певної сполуки, що використовують, способу введення та серйозності стану, що лікують. У одному варіанті втілення, задовільні результати отримують, коли сполуки вводять при добовій дозі від приблизно 0,5 до приблизно 500мг/кг маси тіла тварини, бажано даючи у розділених дозах від одного до чотирьох разів на день, або у формі уповільненого вивільнення. У іншому варіанті втілення, для більшості великих ссавців, загальна щоденна доза становить від приблизно 1 до 100мг. У іншому варіанті втілення, загальна щоденна доза становить від приблизно 2 до 80мг. Лікарські форми, прийнятні для внутрішнього застосування, включають від приблизно 0,5 до 500мг активної сполуки у гомогенній суміші з твердим або рідким фармацевтично прийнятним носієм. Цей режим доз може бути пристосований для забезпечення оптимальної терапевтичної відповіді. Наприклад, декілька розділених доз можуть бути введені щоденно або доза може бути пропорційно знижена, що визначають потребами терапевтичної ситуації. Сполуки можуть бути введені перорально, а також внутрішньовенним, внутрішньом'язовим або підшкірним шляхами. Тверді носії включають кро 92500 20 хмаль, лактозу, гідрофосфат кальцію, мікрокристалічну целюлозу, сахарозу та каолін, в той час як рідкі носії включають стерильну воду, поліетиленгліколі, неіонні поверхнево-активні речовини та харчові масла, такі як кукурудзяне, арахісове та кунжутне масла, які є прийнятними до природи активного інгредієнту та певної бажаної форми введення. Переважно можуть бути включені допоміжні речовини, що звичайно використовують у одержанні фармацевтичних композицій, такі як ароматизатори, барвники, консерванти, та антиоксиданти, наприклад, вітамін Е, аскорбінова кислота, бутильований гідрокситолуол (ВНТ) та бутильований гідроксианізол (ВНА). З точки зору легкості одержання та введення фармацевтичні композиції являють собою тверді композиції, особливо таблетки та капсули з твердим або рідким наповненням. Пероральне введення сполук є бажаним. Сполуки також можуть бути введені парентерально або внутрішньочеревинно. Розчини або суспензії сполук у вигляді вільної основи або фармакологічно прийнятної солі можуть бути одержані у воді, прийнятно змішаній з поверхнево-активною речовиною, такою як гідроксипропілцелюлоза. Дисперсії також можуть бути одержані у гліцерині, рідині, поліетиленгліколях та їх сумішах у маслах. При звичайних умовах зберігання та застосування, зазначені препарати містять консервант для попередження росту мікроорганізмів. Фармацевтичні форми, прийнятні для ін'єкційного введення, включають стерильні водні розчини або дисперсії та стерильні порошки для екстемпорального одержання стерильних ін'єкційних розчинів або дисперсій. У всіх випадках, форма повинна бути стерильною та повинна бути рідкою до того ступеню, що вона може легко набиратися у шприц. Вона повинна бути стабільною в умовах вироблення та зберігання та повинна бути захищена від забруднюючої дії мікроорганізмів, таких як бактерії та гриби. Носій може являти собою розчинник або дисперсне середовище, що містить, наприклад, воду, етанол (наприклад, гліцерин, пропіленгліколь та рідкий поліетиленгліколь), їх прийнятні суміші та рослинне масло. Ці активні сполуки також можуть вводитись через вагінальне кільце. Зазвичай застосування вагінального кільця розраховують у часі за 28денним циклом. В одному варіанті втілення кільце вставляють у піхву і залишають там на 3 тижні. Під час четвертого тижня вагінальне кільце виймають і відбувається менструація. Наступного тижня вставляють нове кільце ще на 3 тижні, доки не настає наступний період. В іншому варіанті втілення вагінальне кільце вставляють щотижня і замінюють протягом трьох послідовних тижнів. Потім, після одного тижня без кільця, вставляють нове кільце для початку нового режиму. У ще одному варіанті втілення вагінальне кільце вставляють на більш тривалі або більш короткі періоди часу. Для застосування у вагінальному кільці сполуку PR модулятору рецептують у спосіб, подібний до описаного для протизаплідних сполук, описаних раніше для введення через вагінальне кільце. 21 Див., наприклад, патенти США №№ 5,972,372; 6,126,958; та 6,125,850. У ще одному аспекті винаходу сполуку(и) PR модулятору доставляють через крізьшкірний пластир. Відповідно, застосування пластиру розраховують у часі за 28-денним циклом. В одному варіанті втілення пластир наносять через відповідний адгезив на шкіру, де він залишається протягом 1 тижня, і замінюють щотижня протягом загального періоду у три тижні. Під час четвертого тижня пластир не наносять, і відбувається менструація. Наступного тижня наносять новий пластир, який залишається до початку нового режиму. У ще одному варіанті втілення пластир залишається на місці протягом більш тривалих або більш коротких періодів часу. У одному варіанті втілення, PR модулятор(и) використовують у циклічних режимах, що включають введення тільки PR модулятору. У іншому варіанті втілення, циклічний режим включає введення PR модулятору у комбінації з естрогеном або прогестином або обома. Особливо бажані прогестини можуть бути вибрані з-поміж тих, що описані у Патентах США №№ 6,355,648; 6,521,657; 6,436,929; 6,540,710; та 6,562,857 та Публікації Патентної заявки США № 2004-0006060-А1. Інші прогестини відомі у даній галузі техніки та можуть бути легко вибрані. У одному варіанті втілення забезпечені комбінаційні режими з PR агоністом (тобто прогестином) танапрогет 5-(4,4-диметил-2тіоксо-1,4-дигідро-2Н-3,1-бензоксазин-6-іл)-1метил-1Н-пірол-2-карбонітрил. Додатково включені режими введення, що проводять протягом 28 календарних днів. Зазначені режими можуть бути безперервними або можуть включати кінцеву частину циклу, наприклад, 0-7 днів, що не включають введення прогестинів, естрогенів або антипрогестинів. Дивись, наприклад, режими, описані у Публікації Патентної заявки США № US-2006-0009509-A1, що включено у даний опис шляхом посилання. Описані авторами режими застосовують для контрацепції або для будь-якого з інших описаних авторами показань. Якщо введення призначається для контрацепції, композиції можуть бути рецептовані у дозованих одиницях для перорального введення. При застосуванні для контрацепції PR модулятори вводять жінці репродуктивного віку, окремо або у комбінації з естрогеном. Протягом перших 14-24 днів циклу прогестини вводять у діапазоні доз, які за прогестаційною активністю дорівнюють від приблизно 35мкг до приблизно 150мкг левоноргестрелу на день, в оптимальному варіанті - дорівнюють за активністю від приблизно 35мкг до приблизно 100мкг левоноргестрелу на день. PR модулятор в цьому разі може вводитись окремо або у комбінації з естрогеном протягом періоду від 1 до 11 днів, починаючи з будь-якого дня циклу між 14-м та 24-м днями. PR модулятор у цих комбінаціях може вводитися у дозі від приблизно 2мкг до приблизно 50мкг на день, а естроген може вводитися у дозі від приблизно 10мкг до приблизно 35мкг на день. Для перорального введення упаковка або комплект, що містить 28 таблетки, буде 92500 22 включати таблетки плацебо для днів, коли PR модулятор або прогестин або естроген не вводяться. До прогестаційних агентів, які застосовують згідно з цим винаходом, крім інших, належать танапрогет, левоноргестрел, норгестрел, дезогестрел, 3-кетодезогестрел, норетиндрон, гестоден, норетиндрон ацетат, норгестимат, озатерон, ципротерон ацетат, тримегестон, дієногест, дроспіренон, номегестрон, або (17-деацетил)норгестимат. До оптимальних прогестинів для застосування у комбінаціях згідно з цим винаходом належать левоноргестрел, гестоден та тримегестон. Прикладами режимів перорального введення протягом 28-денного циклу є введення лише прогестаційного агенту протягом перших 21 днів у денній дозі, яка за прогестаційною активністю дорівнює від приблизно 35 до приблизно 100мкг левоноргестрелу. Сполука PR модулятору може вводитись у денній дозі приблизно від 1 до 200мг з 22-го по 24-й дні, з наступним періодом без введення або з введенням плацебо протягом днів з 25-го по 28-й. У найкращому варіанті денні дози кожного відповідного активного інгредієнту, який має бути включений до комбінованої окремої денної дози, складають 28 денних доз на 28-денний цикл. В іншому режимі прогестаційний агент може співводитись протягом перших 21 днів у денній дозі, яка за прогестаційною активністю дорівнює від приблизно 35 до приблизно 150мкг левоноргестрелу, в оптимальному варіанті - дорівнює за активністю від приблизно 35 до приблизно 100мкг левоноргестрелу, разом з естрогеном, таким як етинілестрадіол, у діапазоні денної дози від приблизно 10 до приблизно 35мкг. Після цього, як було описано вище, може вводитись модулятор PR згідно з винаходом у денній дозі приблизно від 1 до 250мг з 22-го по 24-й дні, з наступним періодом без введення або з введенням плацебо протягом днів з 25-го по 28-й. Ще один режим включає комбіноване введення протягом днів з 1-го по 21-й прогестаційного агенту, наприклад, левоноргестрелу, який вводять у денній дозі, яка за прогестаційною активністю дорівнює від приблизно 35 до приблизно 100мкг левоноргестрелу, та естрогену, такого як етинілестрадіол, у діапазоні денної дози від приблизно 10 до приблизно 35мкг. Після цього протягом днів з 22-го по 24-й здійснюють комбіноване введення модулятору PR (від 1 до 250мг/день) та естрогену, такого як етинілестрадіол, у денній дозі приблизно від 10 до приблизно 35мкг. Протягом днів з 25-го по 28-й після цього періоду може йти наступний період без введення або з введенням плацебо. Сполуки та композиції можуть бути включені у комплекти або упаковки фармацевтичних композицій, призначених для застосування в описаних авторами режимах. Ці комплекти в оптимальному варіанті призначаються для щоденного перорального введення протягом 28-денного циклу, в оптимальному варіанті - для одного перорального введення на день, і складаються таким чином, щоб відміряти єдину композицію для перорального введення або комбінацію композицій для перорального введення, яку вводять щодня протягом 28 23 денного циклу. В оптимальному варіанті кожен комплект включає таблетки для перорального введення, які вводять у кожен із вказаних днів, в оптимальному варіанті одна таблетка для перорального введення містить кожну з вказаних комбінованих денних доз. Згідно з описаними вище режимами, один 28денний комплект може включати: а) початкову фазу від 14 до 21 денних одиничних доз прогестаційного агенту, які за прогестаційною активністю дорівнюють від приблизно 35 до приблизно 150мкг левоноргестрелу, в оптимальному варіанті - за прогестаційною активністю дорівнюють від приблизно 35 до приблизно 100мкг левоноргестрелу; б) другу фазу з введенням від 1 до 11 денних одиничних доз сполуки PR модулятору, причому кожна окрема денна доза містить сполуку PR модулятору у денній дозі приблизно від 1 до 250мг; та в) необов'язково, третю фазу з введенням перорального і фармацевтично прийнятного плацебо протягом решти днів циклу, коли PR модулятор (тобто антипрогестин або прогестин) або естроген не вводять. В одному варіанті втілення цього комплекту початкова фаза включає 21 денну одиничну дозу, як описано вище, другу фазу з введенням протягом днів з 22-го по 24-й 3-х щоденних доз сполуки PR модулятору та, необов'язково, третю фазу з 4х денних доз перорального і фармацевтично прийнятного плацебо у кожен з днів з 25-го по 28-й. В іншому варіанті втілення режим застосування, розрахований на 28-денний цикл упаковки або комплекту згідно з цим винаходом, включає першу фазу введення від 18 до 21 денних одиничних доз, більш бажано - протягом 21 дня, як описано вище, а також включає введення етинілестрадіолу як естрогену в діапазоні денної дози від приблизно 10 до приблизно 35мкг; другу фазу з введенням від 1 до 7 денних одиничних доз та, в оптимальному варіанті, 4 денні одиничні дози, як описано вище, та, необов'язково, плацебо на кожен з решти 0-9 днів або приблизно 4 днів у 28-денному циклі, в які прогестаційний агент, естроген або антипрогестин не вводять. Додатковий 28-денний режим застосування упаковки або комплекту включає: а) першу фазу введення від 18 до 21 денних одиничних доз, кожна з яких містить прогестаційний агент, у денній дозі, яка за прогестаційною активністю дорівнює від приблизно 35 до приблизно 150мкг левоноргестрелу, в оптимальному варіанті - дорівнює за активністю від приблизно 35 до приблизно 100мкг левоноргестрелу, та етинілестрадіол у діапазоні денної дози від приблизно 10 до приблизно 35мкг; б) другу фазу з введенням від 1 до 7 денних одиничних доз, причому кожна денна одинична доза містить антипрогестин згідно з цим винаходом у концентрації від 1 до 250мг; та етинілестрадіол у концентрації від приблизно 10 до приблизно 35мкг; та в) необов'язково, введення перорального і фармацевтично прийнятного плацебо на кожен з решти 0-9 днів у 28-денному циклі, в які прогестаційний агент, естроген або антипрогестин не вводять. В одному варіанті втілення щойно описані упаковка або комплект включають першу фазу з вве 92500 24 денням 21 денних одиничних доз; другу фазу з введенням 3-х денних одиничних доз протягом днів з 22-го по 24-й, причому кожна одинична доза містить антипрогестин згідно з цим винаходом у концентрації від 2 до 200мг; та етинілестрадіол у концентрації від приблизно 10 до приблизно 35мкг; і необов'язково, третю фазу з 4-х денних доз перорального і фармацевтично прийнятного плацебо у кожен з днів з 25-го по 28-й. У кожному з режимів щойно описані комплекти та упаковки в оптимальному варіанті денна доза кожного фармацевтично прийнятного активного компонента режиму залишається незмінною у кожній конкретній фазі, в якій її вводять. Також зрозуміло, що описані денні дози мають вводитися в описаному порядку, коли за першою фазою здійснюють по порядку другу та третю фази. Для забезпечення відповідності кожному режимові, комплекти в оптимальному варіанті також містять плацебо, яке було описано для останніх днів циклу. В оптимальному варіанті кожна упаковка або комплект також включає фармацевтично прийнятну упаковку, яка має позначення для кожного дня 28-денного циклу, наприклад, блістерну упаковку з позначеннями або дисковий розподільник, відомі спеціалістам у даній галузі. У цьому описі терміни антипрогестаційні агенти, антипрогестини та антагоністи рецептору прогестерону слід розуміти як синоніми. Подібним чином прогестини, прогестаційні агенти та агоністи рецептору прогестерону слід розуміти як такі, що стосуються сполук з такою самою активністю. Ці режими дозування можуть регулюватися для забезпечення оптимальної терапевтичної реакції. Наприклад, кілька окремих доз кожного компоненту можуть вводитися щоденно, або доза може пропорційно підвищуватись або знижуватись, згідно з потребами терапевтичної ситуації. У представлених авторами описах посилання на денну дозу також може включати окремі одиниці, які вводять протягом кожного дня даного циклу. Сполуки та композиції додатково можуть бути забезпечені у комплектах та пристроях для доставки для цілого ряду інших терапевтичних застосувань, як розкрито у цьому описі, включаючи, наприклад, гормоно-замісну терапію, лікування та/або профілактику доброякісного та злоякісного новоутворення. Такі комплекти, окрім зазначених сполук містять компоненти, включаючи, наприклад, серед інших речей, інструкції для доставки сполук, розріджувачі, склянки, шприци, упакування. Такі комплекти необов'язково можуть бути пристосовані для вибраного режиму застосування, наприклад, гормоно-замісної терапії, лікування та/або профілактики міометріальних фіброїдів матки, ендометріозу, доброякісної гіпертрофії передміхурової залози; карцином та аденокарцином ендометрію, пухлин яєчнику, молочної залози, товстого кишечника, передміхурової залози, гіпофізу, менінгіоми та інших залежних від гормонів пухлин, дисменореї, дисфункціональної кровотечії матки, пов'язаних з циклом симптомів, та симптомів передменструального синдрому та передменструального дисфоричного розладу; для спричи 25 нення аменореї; або синхронізування еструсу у поголів'ї. Наступні приклади забезпечені для ілюстрації даного винаходу та не обмежують його обсяг. Спеціалістові у даній галузі стане зрозуміло, що хоча у представлених нижче прикладах описано конкретні реагенти та умови, можливими також є модифікації, які охоплюються сутністю та обсягом винаходу. Приклад 1: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]пропан-1-сульфонамід Загальна процедура сульфонілювання 5-(4амінофеніл)-1-метил-1Н-пірол-2-карбонітрилу проводиться наступним чином. 5-(4-Амінофеніл)-1-метил-1H-пірол-2карбонітрил (98мг, 0,5ммоль) розчиняють у дихлорметані (2мл) та додають триетиламін (87мкл, 0,6ммоль). Додають пропан-сульфоніл хлорид (62мкл, 0,55ммоль) та суміш перемішують впродовж 16 годин. Суміш розбавляють за допомогою 50% ефіру у етилацетаті та промивають водою, насиченим NaHCO3, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Флеш хроматографія (0%-100% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)феніл]пропан-1-сульфонаміду (0,039г). HPLC чистота 97,8% при 210-370нм, 8,8хвил.; 97,7% при 284нм, 8,8хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання + 4хвил. HRMS: розраховано для C15H17N3O2S+Н , + 304,11142; знайдено (ESI-FTMS, [М+Н] ), 304,11165. Приклад 2: N- [4-(5-ціано-1 -метил-1 Н-пірол-2іл)феніл] - N-(метилсульфоніл)метан-сульфонамід Заголовну сполуку одержують відповідно до загальної процедури сульфонілювання 5-(4амінофеніл)-1-метил-1Н-пірол-2-карбонітрилу, використовуючи метан-сульфоніл-хлорид (43мкл, 0,55ммоль), що забезпечує одержання N-[4-(5ціано-1-метил-1Н-пірол-2-іл)феніл]-N(метилсульфоніл)метансульфонаміду (0,021г). HPLC чистота 95,3% при 210-370нм, 8,0хвил.; 95,3% при 290нм, 8,0хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10 хвил., утримання 4 хвил. HRMS: розраховано для C14H15N3O4S2+Н+, 354,05767; знайдено (ESI-FTMS, [М+Н]+), 354,05748. Приклад 3: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл] бутан-1-сульфонамід Заголовну сполуку одержують відповідно до загальної процедури сульфонілювання 5-(4амінофеніл)-1-метил-1Н-пірол-2-карбонітрилу, використовуючи бутан-сульфоніл-хлорид (72мкл, 0,55ммоль), що забезпечує одержання N-[4-(5ціано-1-метил-1Н-пірол-2-іл)феніл]бутан-1сульфонаміду (0,026г). HPLC чистота 98,9% при 210-370нм, 9,3хвил.; 98,9% при 284нм, 9,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 92500 26 4хвил. HRMS: розраховано для C16H19N3O2S+Н+, 318,12707; знайдено (ESI-FTMS, [М+Н]+), 318,12729. Приклад 4: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]-2,2,2-трифторетансульфонамід Заголовну сполуку одержують відповідно до загальної процедури сульфонілювання 5-(4амінофеніл)-1-метил-1Н-пірол-2-карбонітрилу, використовуючи 2,2,2-трифтор-етансульфонілхлорид (55мкл, 0,55ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]2,2,2-трифторетансульфонаміду (0,014 г). HPLC чистота 100% при 210-370нм, 9,0хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. Приклад 5: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]-4-ізопропілбензолсульфонамід Заголовну сполуку одержують відповідно до загальної процедури сульфонілювання 5-(4амінофеніл)-1-метил-1Н-пірол-2-карбонітрилу, використовуючи 4-ізопропіл-бензолсульфонілхлорид (120мг, 0,55ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]4-ізопропілбензолсульфонаміду (0,049г). HPLC чистота 97,2% при 210-370нм, 10,3хвил.; 97,2% при 286нм, 10,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання + 4хвил. HRMS: розраховано для C21H21N3O2S+Н , + 380,14272; знайдено (ESI-FTMS, [М+Н] ), 380,14319. Приклад 6: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]бензолсульфонамід Заголовну сполуку одержують відповідно до загальної процедури сульфонілювання 5-(4амінофеніл)-1-метил-1Н-пірол-2-карбонітрилу, використовуючи бензолсульфоніл-хлорид (70мкл, 0,55ммоль), що забезпечує одержання N-[4-(5ціано-1-метил-1Н-пірол-2-іл)феніл]бензолсульфонаміду (0,046г). HPLC чистота 93,0% при 210-370нм, 9,3хвил.; 94,8% при 286нм, 9,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. HRMS: розраховано для C18H15N3O2S+Н+, 338,09577; знайдено (ESI-FTMS, [М+Н]+), 338,09611. Приклад 7: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]-4-метилбензолсульфонамід Заголовну сполуку одержують відповідно до загальної процедури сульфонілювання 5-(4амінофеніл)-1-метил-1Н-пірол-2-карбонітрилу, використовуючи н-толуолсульфоніл-хлорид (105мг, 0,55ммоль), що забезпечує одержання N[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4-метилбензолсульфонаміду (0,036г). HPLC чистота 98,3% при 210-370нм, 9,7хвил.; 97,8% при 286нм, 9,7хвил.; Xterra™ RP18 інструмент, 3,5 ,, 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 27 4хвил. HRMS: розраховано для C19H17N3O2S+Н+, 352,11142; знайдено (ESI-FTMS, [М+Н]1+), 352,11183. Приклад 8: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]пропан-2-сульфонамід 5-(4-Амінофеніл)-1-метил-1Н-пірол-2карбонітрил (0,27г, 1,37ммоль) розчиняють у ізопропіл-сульфоніл-хлориді (0,50мл, 2,8ммоль) та нагрівають при 70 С впродовж 6 годин. Суміш охолоджують та розбавляють водою та екстрагують етилацетатом. Органічні фази об'єднують, промивають водою, сольовим розчином, сушать над MgSO4, та концентрують. Флеш хроматографія (0%-100% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]пропан-2-сульфонаміду (0,009г). HPLC чистота 94,7% при 210-370нм, 8,8хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. HRMS: розраховано для C15H17N3O2S+Н+, 304,1114; знайдено (ESI, [М+Н]+), 304,1132. Приклад 9: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонамід 5-(4-Амінофеніл)-1-метил-1Н-пірол-2карбонітрил (1,3г, 6ммоль) розчиняють у піридині (10мл), додають етан-сульфоніл-хлорид (0,54мл, 5,7ммоль), суміш перемішують впродовж 4 годин, та потім додають воду. Суміш розбавляють за допомогою етилацетату та промивають водою, насиченим CuSO4, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Флеш хроматографія (5%-50% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонаміду (1,33г). HPLC чистота 100% при 210-370нм, 8,3хвил.; Xterra™ RP18 інструмент, 3,5ц , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. HRMS: розраховано для C14H15N3O2S+Н+ , 290,09577; знайдено (ESI, [M+H]+), 290,0958. Приклад 10: N- 4-(5-ціано-1-метил-1 -пірол-2іл)феніл]метансульфонамід 5-(4-Амінофеніл)-1-метил-1Н-пірол-2карбонітрил (0,5г, 2,3ммоль) розчиняють у піридині (5мл), додають метан-сульфоніл-хлорид (0,16мл, 2,1ммоль), суміш перемішують впродовж 4 годин, та потім додають воду. Суміш розбавляють етилацетатом та суміш промивають водою, насиченим CuSO4, 2N НСl, сольовим розчином, сушать над MgSО4, та концентрують. Флеш хроматографія (5%-50% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонаміду (0,382г). MS (ES) m/z 276,1; HPLC чистота 100% при 210-370нм, 7,9хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. Приклад 11: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2-фторфеніл]метансульфонамід 5-(4-аміно-3-фторфеніл)-1-метил-1Н-пірол-2карбонітрил (0,15г, 0,70ммоль) розчиняють у піридині (1,5мл), додають метан-сульфоніл-хлорид 92500 28 (0,05мл, 0,63ммоль), суміш перемішують впродовж 4 годин, та потім додають воду. Суміш розбавляють етилацетатом та суміш промивають водою, насиченим CuSO4, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Флеш хроматографія (5%-50% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2-фторфеніл]метан-сульфонаміду (0,147г). HPLC чистота 98,3% при 210-370нм, 7,8хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. HRMS: розраховано для C13H12FN3O2S+Н+, 294,07070; знайдено (ESI, [М+Н]+), 294,0696. Приклад 12: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2-фторфеніл]етансульфонамід 5-(4-аміно-3-фторфеніл)-1-метил-1Н-пірол-2карбонітрил (0,31г, 1,44ммоль) розчиняють у піридині (3мл), додають етан-сульфоніл-хлорид (0,12мл, 1,3ммоль), суміш перемішують впродовж 4 годин, та потім додають воду. Суміш розбавляють етилацетатом та суміш промивають водою, насиченим CuSO4, 2N НСl, сольовим розчином, сушать над MgSО4, та концентрують. Флеш хроматографія (5%-50% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2-фторфеніл]етан-сульфонаміду (0,127г). HPLC чистота 100% при 210-370нм, 8,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. HRMS: розраховано для C14H14FN3O2S+Н+, 308,08635; знайдено (ESI, [М+Н]+), 308,0855. Приклад 13: 5-(4-аміно-2-фторфеніл)-1-метил1Н-пірол-2-карбонітрил 4-Бром-З-фторанілін (0,95г, 5,0ммоль), 1метил-5-ціано-2-піролборну кислоту (1,35г, 9,0ммоль), KF (0,96г, 16,5ммоль), та Рd2(dba)3 (120мг, 0,125ммоль) додають до 50мл круглодонної колби у атмосфері азоту. Колбу герметично закривають та барботують азотом впродовж 5 хвилин. Додають THF (12,5мл) та суміш барботують азотом впродовж ще 5 хвилин. Розчин тритрет-бутилфосфіну (10% мас. у гексанах) (0,74мл, 0,25ммоль) додають через шприц та суміш енергійно перемішують при 25 С впродовж 16 годин. Суміш розбавляють за допомогою 250мл ЕtOАс, фільтрують через фільтр з силікагелю, промивають за допомогою 200мл EtOAc та концентрують з одержанням сирої коричневої/чорної напівтвердої речовини. Очищення за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5%100% етилацетату у гексані) забезпечує одержання 5-(4-аміно-2-фторфеніл)-1-метил-1Н-пірол-2карбонітрилу у вигляді білої твердої речовини (1,05г, 98%). HPLC чистота 100,0% при 210-370нм, 8,4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 216,0. Приклад 14: N-[4-(5-ціано-1-метил-1H-пірол-2іл)-3-фторфеніл]метансульфонамід 29 5-(4-аміно-2-фторфеніл)-1-метил-1Н-пірол-2карбонітрил (0,20г, 0,93ммоль) розчиняють у піридині (2,0мл). Додають метансульфоніл-хлорид (0,07мл, 0,9ммоль) та суміш перемішують впродовж 16 годин, що супроводжують додаванням води. Суміш розбавляють за допомогою етилацетату та потім промивають водою, насиченим CuSO4, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Сирий продукт очищують за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-50% етилацетату у гексані), що забезпечує одержання 0,18г N-[4-(5ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]метансульфонаміду. HPLC чистота 100,0% при 210-370нм, 8,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 293,9. Приклад 15: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-фторфеніл]етансульфонамід Зазначену сполуку одержують відповідно до процедури, описаної у Прикладі 14, використовуючи етан-сульфоніл-хлорид (85мкл, 0,9ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-3-фторфеніл]етансульфонаміду (0,135г). HPLC чистота 100,0% при 210-370нм, 9,7хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. HRMS: розраховано для C14H14FN3O2S+Н+, 308,08635; знайдено (ESI, [М+Н]+), 308,0867. Приклад 16: N-[4-(5-ціано-1 -метил-1Н-пірол-2іл)-3-фторфеніл]пропан-1-сульфонамід Сульфонамід одержують відповідно до процедури, описаної у Прикладі 14, використовуючи пропан-сульфоніл-хлорид (50мкл, 0,45ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-3-фторфеніл]пропан-1-сульфонаміду (96мг). HPLC чистота 99,2% при 210-370нм, 9,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 321,9. Приклад 17: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-фторфеніл]бутан-1-сульфонамід Сульфонамід одержують відповідно до процедури, описаної у Прикладі 14, використовуючи бутан-сульфоніл-хлорид (58мкл, 0,45ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-3-фторфеніл]бутан-1-сульфонаміду (60мг). HPLC чистота 97,7% при 210-370нм, 9,8хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 335,9. Приклад 18: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-фторфеніл]пропан-2-сульфонамід 5-(4-аміно-2-фторфеніл)-1-метил-1Н-пірол-2карбонітрил (200мг, 0,93ммоль) розчиняють у ізопропіл-сульфоніл-хлориді (0,50мл, 2,8ммоль), до 92500 30 дають піридин (0,2мл) та суміш нагрівають при 100 С впродовж 6 годин. Потім суміш охолоджують та розбавляють водою та екстрагують етилацетатом. Органічні фази об'єднують, промивають водою, сольовим розчином, сушать над MgSО4, та концентрують. Флеш хроматографія (0%-100% етилацетату у гексані) забезпечує одержання N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]пропан-2-сульфонаміду (58мг). HPLC чистота 92,5% при 210-370нм, 9,2хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 321,9. Приклад 19: 5-(4-аміно-2,5-дифторфеніл)-1метил-1Н-пірол-2-карбонітрил 4-Бром-2,5-дифторанілін (0,1г, 4,85ммоль), 1метил-5-ціано-2-пірол-борну кислоту (1,3г, 8,7ммоль), KF (0,93г, 16ммоль), та Рd2(dba)3 (117мг, 0,12ммоль) додають до 50мл круглодонної колби у атмосфері азоту. Колбу герметично закривають та барботують азотом впродовж 5 хвилин. Додають THF (12,1мл) та суміш барботують азотом впродовж ще 5 хвилин. Розчин тритрет-бутилфосфіну (10% мас. у гексанах) (0,72мл, 0,24ммоль) додають через шприц та суміш енергійно перемішують при 25 С впродовж 16 годин. Суміш розбавляють за допомогою 250мл ЕtOАс, фільтрують через фільтр з силікагелю, промивають за допомогою 200мл EtOAc та концентрують з одержанням сирої коричневої/чорної напівтвердої речовини. Очищення за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5100% етилацетату у гексані) забезпечує одержання 5-(4-аміно-2,5-дифторфеніл)-1-метил-1Н-пірол2-карбонітрилу у вигляді білої твердої речовини (0,87г, 77%). HPLC чистота 100,0% при 210-370нм, 8,9хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 234,0. Приклад 20: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2,5-дифторфеніл]-метан-сульфонамід 5-(4-аміно-2,5-дифторфеніл)-1-метил-1Нпірол-2-карбонітрил (0,15г, 0,64ммоль) розчиняють у піридині (2,0мл). Додають метансульфонілхлорид (46мкл, 0,6ммоль) та суміш перемішують впродовж 16 годин, що супроводжують додаванням води. Суміш розбавляють за допомогою етилацетату, промивають водою, насиченим CuSO4, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Сирий продукт очищують за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-50% етилацетату у гексані), що забезпечує одержання 0,142г N-[4-(5-ціано-1метил-1Н-пірол-2-іл)-2,5-дифторфеніл]-метансульфонаміду. HPLC чистота 99,0% при 210-370нм, 8,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 311,8. Приклад 21: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2,5-дифторфеніл]етан-сульфонамід 31 Сульфонамід одержують відповідно до процедури, описаної у Прикладі 20, використовуючи етан-сульфоніл-хлорид (56мкл, 0,6ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-2,5-дифторфеніл]етан-сульфонаміду (46мг). HPLC чистота 100,0% при 210-370нм, 8,7хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 323,9. Приклад 22: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2,5-дифторфеніл]пропан-1-сульфонамід. Сульфонамід одержують відповідно до процедури, описаної у Прикладі 20, використовуючи пропан-сульфоніл-хлорид (67мкл, 0,6ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-2,5-дифторфеніл]пропан-1сульфонаміду (41мг). HPLC чистота 100,0% при 210-370нм, 9,2хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 339,9. Приклад 23: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2,5-дифторфеніл]бутан-1-сульфонамід Сульфонамід одержують відповідно до процедури, описаної у Прикладі 20, використовуючи бутан-сульфоніл-хлорид (77мкл, 0,6ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-2,5-дифторфеніл]бутан-1-сульфонаміду (28мг). HPLC чистота 84,8% при 210-370нм, 9,7хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 353,9. Приклад 24: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2,5-дифторфеніл]пропан-2-сульфонамід 5-(4-аміно-2,5-дифторфеніл)-1-метил-1Нпірол-2-карбонітрил (150мг, 0,64ммоль) розчиняють у ізопропіл-сульфоніл-хлориді (1,0мл, 9,0ммоль), додають піридин (0,2мл) та суміш нагрівають до 100 С впродовж 6 годин. Потім суміш охолоджують, розбавляють водою та екстрагують етилацетатом. Органічні фази об'єднують, промивають водою, сольовим розчином, сушать над MgSО4, та концентрують. Флеш хроматографія (0%-100% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]пропан-2-сульфонаміду (26мг). HPLC чистота 97,6% при 210-370нм, 9,1хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 339,9. Приклад 25: 5-[4-аміно-2(трифторметил)феніл]-1-метил-1Н-пірол-2карбонітрил 4-Бром-З-трифторметиланілін (1,77г, 7,4ммоль), 1-метил-5-ціано-2-пірол-борну кислоту (2,0г, 13,3ммоль), KF (1,42г, 24,4ммоль), та Рd2(dba)3 (179мг, 0,185ммоль) додають до 50мл кругло-донної колби у атмосфері азоту. Колбу герметично закривають та барботують азотом впро 92500 32 довж 5 хвилин. Додають THF (18,5мл) та суміш барботують азотом впродовж ще 5 хвилин. Розчин три-трет-бутилфосфіну (10% мас. у гексанах) (1,1мл, 0,37ммоль) додають через шприц та суміш енергійно перемішують при 25 С впродовж 16 годин. Суміш розбавляють за допомогою 250мл ЕtOАс, фільтрують через фільтр з силікагелю, промивають за допомогою 200мл EtOAc та концентрують з одержанням сирої коричневої/чорної напівтвердої речовини. Очищення за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-100% етилацетату у гексані) забезпечує одержання 5-[4-аміно-2-(трифторметил)феніл] 1метил-1Н-пірол-2-карбонітрилу у вигляді білої твердої речовини (1,8г, 92%). HPLCчистота 100,0% при 210-370нм, 9,1хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 266,1. Приклад 26: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-(трифторметил)феніл]метан-сульфонамід 5-[4-аміно-2-(трифторметил)феніл]-1-метил1H-пірол-2-карбонітрил (0,34г, 1,3ммоль) розчиняють у СН2СІ2 (5мл) та піридині (0,2мл). Додають метансульфоніл-хлорид (90мкл, 1,2ммоль) та суміш перемішують впродовж 16 годин, що супроводжують додаванням води. Потім суміш розбавляють етилацетатом, суміш промивають водою, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Сирий продукт очищують за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-50% етилацетату у гексані), що забезпечує одержання 0,29г N-[4-(5-ціано-1-метил1Н-пірол-2-іл)-3-(трифторметил)феніл]метансульфонаміду. HPLC чистота 98,2% при 210-370нм, 9,0хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 341,8. Приклад 27: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-(трифторметил)феніл]етан-сульфонамід Сульфонамід одержують відповідно до процедури, описаної у Прикладі 26, використовуючи етан-сульфоніл-хлорид (113мкл, 1,2ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-3-(трифторметил)феніл]етансульфонаміду (140мг). HPLC чистота 100,0% при 210-370нм, 9,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 355,8. Приклад 28: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-(трифторметил)феніл]пропан-1 сульфонамід Сульфонамід одержують відповідно до процедури, описаної у Прикладі 26, використовуючи пропіл-сульфоніл-хлорид (134мкл, 1,2ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-3-(трифторметил)феніл]пропан-1сульфонаміду (46мг). HPLC чистота 99,6% при 210-370нм, 9,7хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, бу 33 фер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 371,8. Приклад 29: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-(трифторметил)феніл]бутан-1-сульфонамід Сульфонамід одержують відповідно до процедури, описаної у Прикладі 26, використовуючи бутил-сульфоніл-хлорид (163мкл, 1,2ммоль), що забезпечує одержання N-[4-(5-ціано-1-метил-1Нпірол-2-іл)-3-(трифторметил)феніл]бутан-1сульфонаміду (340мг). HPLC чистота 99,0% при 210-370нм, 10,1хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 385,9. Приклад 30: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3-(трифторметил)феніл]пропан-2-сульфонамід 5-[4-аміно-2-(трифторметил)феніл]-1-метил1Н-пірол-2-карбонітрил (0,33г, 1,25ммоль) розчиняють у ізопропіл-сульфоніл-хлориді (1,0мл, 9,0ммоль), додають піридин (0,5мл), та суміш нагрівають при 100 С впродовж 6 годин. Суміш охолоджують та розбавляють водою та екстрагують етилацетатом. Органічні фази об'єднують, промивають водою, сольовим розчином, сушать над MgSO4, та концентрують. Флеш хроматографія (0%-100% етилацетату у гексані) забезпечує одержання N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]-пропан-2-сульфонаміду (50мг). HPLC чистота 95,4% при 210-370нм, 9,6хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 371,9. Приклад 31: 5-[4-(1,1-діоксидоізотіазолідин-2іл)феніл]-1-метил-1Н-пірол-2-карбонітрил Стадія 1: 4-Броманілін (0,86г, 5,0ммоль) розчиняють у СН2СІ2 (15мл), додають піридин (0,5мл), та додають 3-хлорпропансульфоніл-хлорид (0,6мл, 5,0ммоль). Суміш перемішують впродовж 4 годин, розбавляють етилацетатом, та потім промивають водою, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Сирий продукт очищують за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-60% етилацетату у гексані), що забезпечує одержання 1,2г (77%) N-(4бромфеніл)-3-хлорпропан-1-сульфонаміду. HPLC чистота 98,4% при 210-370нм, 9,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 311,6. Стадія 2: N-(4-Бромфеніл)-3-хлорпропан-1-сульфонамід (1,0г, 3,2ммоль) розчиняють у DMF, додають Cs2CO3 (1,56г, 4,8ммоль), та суміш перемішують впродовж 3 годин. Потім суміш розбавляють ефіром, промивають водою, 2N НСl, сольовим розчином, сушать над MgSO4, та концентрують. Сирий продукт очищують за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-60% етилацетату у гексані), що забезпечує одержання 92500 34 0,65 (74%) 2-(4-бромфеніл)ізотіазолідину 1,1діоксиду. HPLC чистота 100,0% при 210-370нм, 7,9хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 275,7. Стадія 3: 2-(4-Бромфеніл)ізотіазолідину 1,1-діоксид (0,56г, 2,0ммоль), 1-метил-5-ціано-2-піролборну кислоту (0,36г, 2,4ммоль), KF (0,38г, 6,6ммоль), та Рd2(dba)3 (48мг, 0,05ммоль) додають до 50мл кругло-донної колби у атмосфері азоту. Колбу герметично закривають та барботують азотом впродовж 5 хвилин. THF (5мл) додають та суміш барботують азотом. Розчин три-трет-бутилфосфіну (10% мас. у гексанах) (0,3мл, 0,1ммоль) додають через шприц та суміш енергійно перемішують при 25 С впродовж 16 годин. Суміш розбавляють за допомогою EtOAc, фільтрують через фільтр з силікагелю, промивають за допомогою 200мл EtOAc та концентрують з одержанням сирої коричневої/чорної напівтвердої речовини. Очищення за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5%-100% етилацетату у гексані) забезпечує одержання 5-[4-(1,1діоксидоізотіазолідин-2-іл)феніл]-1-метил-1Нпірол-2-карбонітрилу у вигляді білої твердої речовини (54мг). HPLC чистота 100,0% при 210-370нм, 8,3хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 301,8. Приклад 32: 5-[4-аміно-3(трифторметокси)феніл]-1-метил-1Н-пірол-2карбонітрил 4-Бром-2-(трифторметокси)анілін (1,3г, 5,0ммоль), 5-ціано-1-метил-1Н-пірол-2-іл-борну кислоту (0,9г, 6,0ммоль), фторид калію (0,96г, 16,5ммоль), та тріс(дибензиліденацетон)дипаладій (0,12г, 0,12ммоль) поміщають у висушену у печі колбу у атмосфері азоту та додають THF (12,5мл). Додають три-трет-бутилфосфін (10мас.% у гексані) (0,356мл, 0,24моль) та реакційну суміш перемішують впродовж 16 годин. Реакційну суміш фільтрують через силікагель, промивають етилацетатом, та концентрують. Сирий продукт перед-адсорбують на реагенті Celite™ та очищують за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-30% етилацетату у гексані), що забезпечує одержання 1,0г (71%) 5-[4аміно-3-(трифторметокси)феніл]-1-метил-1Нпірол-2-карбонітрилу. HPLC чистота 98,2% при 210-370нм, 9,6хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер PH=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 281. Приклад 33: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2-(трифторметокси)феніл]метан-сульфонамід Метансульфоніл-хлорид (0,05мл, 0,65ммоль) додають краплинним способом до розчину 5-[4аміно-3-(трифторметокси)феніл]-1-метил-1Нпірол-2-карбонітрилу (0,16г, 0,56ммоль) у сухому 35 піридині (2,0мл). Розчин нагрівають до 50 С впродовж ночі. Розчин охолоджують до кімнатної температури та перед-адсорбують на реагенті Celite™. Сирий продукт очищують за допомогою Isco хроматографії (Redisep® колонка, силікагель, градієнт 5-30% етилацетату у гексані), що забезпечує одержання 0,1г (50%) N-[4-(5-ціано-1-метил1Н-пірол-2-іл)-2(трифторметокси)феніл]метансульфонаміду. HPLC чистота 90,1% при 210-370нм, 9,0хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер PH=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 359. Приклад 34: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2-(трифторметокси)феніл]етан-сульфонамід Використовуючи процедуру Прикладу 33, N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-2-(трифторметокси)феніл]етансульфонамід одержують, використовуючи етансульфоніл-хлорид та 5-[4-аміно-3(трифторметокси)феніл]-1-метил-1Н-пірол-2карбонітрил. HPLC чистота 92,5% при 210-370нм, 9,4хвил. Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер PH=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 373. Приклад 35: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-2-(трифторметокси)феніл]пропан-1сульфонамід Використовуючи процедуру Прикладу 33, N-[4(5-ціано-1-метил-1Н-пірол-2-іл)-2-(трифторметокси)феніл]пропан-1-сульфонамід одержують з пропансульфоніл-хлориду та 5-[4-аміно-3(трифторметокси)феніл]-1-метил-1Н-пірол-2карбонітрилу. HPLC чистота 94,5% при 210-370нм, 9,8хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм колонка, 1,2мл/хвил., 85/15-5/95 (Амонійн. форм, буфер PH=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. MS (ES) m/z 387. Приклад 36: N-(4-бромфеніл)етансульфонамід Суміш етансульфоніл-хлориду (2,1мл, 22ммоль), та 4-броманіліну (3,44г, 20ммоль) у піридині (35мл) перемішують при кімнатній температурі впродовж 2 годин. Реакційну суміш підкислюють за допомогою 1N HCl розчину та екстрагують ефіром. Об'єднані органічні шари сушать над сульфатом магнію, та концентрують. Тверду речовину розтирають з гексаном, що забезпечує одержання заголовної сполуки (4,85г, 92%). HPLC чистота компоненту - 100% при 210370нм; RT=8,2хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 37: Трет-бутил 2-{4[(етилсульфоніл)аміно]феніл}-1Н-пірол-1карбоксилат Суміш N-(4-бромфеніл)етансульфонаміду (1,88г, 7,2ммоль), N-метилпірол-2-карбонітрил-5борної кислоти (2,11г, 10ммоль), тетракіс(трифенілфосфін)паладію(0) (0,42г, 0,36ммоль), та карбонату натрію (3,2г, 30ммоль у 60мл води)у диметоксиетані (200мл) нагрівають до зрошення 92500 36 впродовж 4 годин. Суміш охолоджують та розподіляють між насиченим хлоридом амонію та етилацетатом. Об'єднані органічні шари сушать над сульфатом магнію, та концентрують. Залишок очищують шляхом силікагелевої флеш хроматографії (гексан/етилацетат; 7:3), що забезпечує одержання заголовної сполуки (2,4г, 97%). HPLC чистота компоненту = 95,8% при 210370нм; RT=9,8хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph-3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 38: Трет-бутил 2-ціано-5-{4{(етилсульфоніл)аміно]феніл}-1Н-пірол-1карбоксилат mpem-Бутил 2-{4[(етилсульфоніл)аміно]феніл}-1Н-пірол-1карбоксилат (3,0г, 8,58ммоль) розчиняють у тетрагідрофурані (85мл) та охолоджують до -78 С, що супроводжують повільним додаванням хлорсульфоніл-ізоціанату. Після вичерпування mpem-бутил 2-{4-[(етилсульфоніл)аміно]феніл}-1Н-пірол-1карбоксилату, додають диметилформамід (6,86мл) та розчин залишають нагрітися до кімнатної температури. Через 2 години, суміш охолоджують та розподіляють між водою та діетиловим ефіром. Об'єднані органічні шари сушать над сульфатом магнію, та концентрують.. Залишок очищують шляхом силікагелевої флеш хроматографії (гексан/етилацетат; 7:3), що забезпечує одержання заголовної сполуки (1,84г, 57%). Заголовну сполуку відразу використовують у наступній стадії. Приклад 39: N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід трет-бутил-2-ціано-5-{4{(етилсульфоніл)аміно]феніл}-1Н-пірол-1карбоксилат (2,3г, 6,1ммоль) розчиняють у диметилацетаміді (60мл) та нагрівають до 170 С впродовж 30 хвилин. Суміш охолоджують та розподіляють між водою та етилацетатом. Органічні шари сушать над сульфатом магнію, та концентрують. Залишок очищують шляхом силікагелевої флеш хроматографії (гексан/етилацетат; 1:1), що забезпечує одержання заголовної сполуки (1,51г, 90%). HPLC чистота компоненту =100% при 210370нм; RT=8,9хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C13H13N3O2S+Н+, 275,3312; знайдено (ESI-FTMS, [М+Н]1+), 276,075. Приклад 40: N-[4-(5-ціано-1-етил-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід (0,160г, 0,58ммоль) розчиняють у тетрагідрофурані (10мл). Краплинним способом додають калію трет-бутоксид (1,25мл 1М розчину, 1,25ммоль) та суміш перемішують впродовж 15 хвилин. Краплинним способом додають етил-йодид (0,046мл, 0,58ммоль), а потім диметил-формамід (5мл) та суміш перемішують впродовж 4 годин. Суміш потім розподіляють між насиченим хлоридом амонію та етилацетатом. Об'єднані органічні шари сушать над сульфатом магнію, та концентрують. Залишок очищують шля 37 хом силікагелевої флеш хроматографії (гексан/етилацетат; 7:3), що забезпечує одержання заголовної сполуки (0,020г, 11%). HPLC чистота компоненту =100% при 210370нм; RT=8,9хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C15H17N3O2S+Н+, 303,10415; знайдено (ESI-FTMS, [М+Н]1+), 304,1109. Приклад 41: N-[4-(5-ціано-1-пропіл-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід (0,150г, 0,54ммоль) алкілюють відповідно до процедури, описаної у Прикладі 40, використовуючи трет-бутоксид калію (1,08мл 1М розчину, 1,08ммоль) та пропіл-йодид (0,056мл, 0,50ммоль), що забезпечує одержання заголовної сполуки (0,10г, 6,2%). HPLC чистота компоненту =100% при 210370нм; RT=9,3хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C16H19N3O2S+Н+, 317,1198; знайдено (ESI-FTMS, [M+H]1+), 318,1274. Приклад 42: N-[4-(1-бутил-5-ціано-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-щано-1Н-пірол-2іл)феніл]етансульфонамід (0,150г, 0,54ммоль) алкілюють відповідно до процедури, описаної у Прикладі 40, використовуючи трет-бутоксид калію (1,08мл 1М розчину, 1,08ммоль) та бутил-йодид (0,066мл, 0,50ммоль), що забезпечує одержання заголовної сполуки (0,10г, 6%). HPLC чистота компоненту =100% при 210370нм; RT=9,8хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C17H21N3O2S+Н+, 331,1354; знайдено (ESI-FTMS, [М+Н]1+), 332,1437. Приклад 43: N-[4-(1-аліл-5-ціано-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід (0,150г, 0,54ммоль) алкілюють відповідно до процедури, описаної у Прикладі 40, використовуючи трет-бутоксид калію (1,08мл 1М розчину, 1,08ммоль) та аліл-бромід (0,041мл, 0,50ммоль), що забезпечує одержання заголовної сполуки (0,10г, 6,3%). HPLC чистота компоненту =100% при 210370нм; RT=9,0хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C16H17N3O2S+Н+, 316,11142; знайдено (ESI, [М+Н]+), 316,1126. Приклад 44: N-[4-(5-ціано-1-проп-2-ін-1-іл-1Нпірол-2-іл)феніл]етансульфонамід N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід (0,150г, 0,54ммоль) алкілюють відповідно до процедури, описаної у Прикладі 40, використовуючи трет-бутоксид калію (1,08мл 1М розчину, 1,08ммоль) та пропаргіл 92500 38 бромід (80% у толуолі, 0,055мл, 0,50ммоль), що забезпечує одержання заголовної сполуки (0,10г, 6,3%). HPLC чистота компоненту =99% при 210370нм; RT=8,5хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C16H15N3O2S+Н+, 313,0885; знайдено (ESI-FTMS, [М+Н]1+), 314,0971. Приклад 45: N-{4-[5-ціано-1-(3-фенілпропіл)1Н-пірол-2-іл]феніл}етансульфонамід N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід (0,150г, 0,54ммоль) алкілюють відповідно до процедури, описаної у Прикладі 40, використовуючи трет-бутоксид калію (1,08мл 1М розчину, 1,08ммоль) та 1-йод-3фенілпропан (0,093мл, 0,60ммоль), що забезпечує одержання заголовної сполуки (0,020г, 10%). HPLC чистота компоненту =100% при 210370нм; RT=10,4хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C22H23N3O2S+Н+, 393,1511; знайдено (ESI-FTMS, [М+Н]1+), 394,1566. Приклад 46: 5-аміно-2-хлорбензонітрил Суміш 2-хлор-5-нітробензонітрилу (10г, 54,8ммоль) та дигідрату хлориду олова (56г, 248,6ммоль) у ізопропіловому спирті (125мл) та розчину концентрованої соляної кислоти (62,5мл) нагрівають до зрошення впродовж 1 години. Суміш потім охолоджують та нейтралізують розчином гідроксиду натрію (2N). Водний шар екстрагують метиленхлоридом. Об'єднані органічні шари сушать над сульфатом магнію та концентрують, що забезпечує одержання заголовної сполуки (8г, 96%). HPLC чистота компоненту =100% при 210370нм; RT=7,2хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 47: 5-(4-аміно-2-ціанофеніл)-1-метил1Н-пірол-2-карбонітрил Суміш 5-аміно-2-хлорбензонітрилу (1,3г, 8,58ммоль), тріс(дибензиліден-ацетон)дипаладію (0,192г, 0,209ммоль), N-метил-5-ціанопіролборної кислоти (2,55г, 17,16ммоль), та фториду калію (1,81г, 31,25ммоль) у тетрагідрофурані (20мл) перемішують у атмосфері азоту. До суміші додають три-трет-бутилфосфін (10% розчин у гексані, 1,23мл, 0,414ммоль) та залишають перемішуватися впродовж 3 годин при 50 С до вичерпування вихідного броміду. Потім суміш розбавляють за допомогою 1/1 суміші гексан/тетрагідрофуран та фільтрують через фільтр з силікагелю. Розчинник випарюють та залишок очищують шляхом силікагелевої флеш хроматографії (гексан/етилацетат, 90/10 до 50/50), що забезпечує одержання заголовної сполуки (1,77г, 92%). HPLC чистота компоненту =98% при 210370нм; RT=7,8хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., 39 утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 48: N-[3-ціано-4-(5-ціано-1-метил-1Нпірол-2-іл)феніл]метансульфонамід Суміш метансульфоніл-хлориду (0,074мл, 1ммоль) та 5-(4-аміно-2-ціанофеніл)-1-метил-1Нпірол-2-карбонітрилу (0,166г, 0,75ммоль) у піридині (1мл) нагрівають до 50 С впродовж 4 годин. Реакційну суміш підкислюють за допомогою 1N HCl розчину та екстрагують етилацетатом. Об'єднані органічні шари сушать над сульфатом магнію та концентрують. Залишок очищують шляхом силікагелевої колонкової хроматографії (гексан/етилацетат, 90/10 до 60/40), що забезпечує одержання заголовної сполуки (0,059г, 33%). HPLC чистота компоненту =98,1% при 210370нм; RT=9,1хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил. Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C14H12N4O2S+Н+, 300,341; знайдено (ESI-FTMS, [М+Н]1+), 301,0744. Приклад 49: N-[3-ціано-4-(5-ціано-1 -метил-1Нпірол-2-іл)феніл]етансульфонамід Зазначену сполуку одержують відповідно до процедури, описаної у Прикладі 48, використовуючи етансульфоніл-хлорид (0,094мл, 1ммоль), що забезпечує одержання заголовної сполуки (0,079г, 42%). HPLC чистота компоненту =95,9% при 210370нм; RT=9,6хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C15H14N4O2S+Н+, 314,3679; знайдено (ESI-FTMS, [М+Н]1+), 315,0908. Приклад 50: N-[3-ціано-4-(5-ціано-1-метил-1Нпірол-2-іл)феніл]пропан-1-сульфонамід Зазначену сполуку одержують відповідно до процедури, описаної у Прикладі 48, використовуючи пропансульфоніл-хлорид (0,115мл, 1ммоль), що забезпечує одержання заголовної сполуки (0,100г, 50%). HPLC чистота компоненту =96,6% при 210370нм; RT=10,3хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C16H16N4O2S+Н+, 328,3948; знайдено (ESI-FTMS, [M+H]1+), 329,1069. Приклад 51: N-[2-ціано-4-(5-ціано-1-метил-1Нпірол-2-іл)феніл]метансульфонамід Зазначену сполуку одержують відповідно до процедури, описаної у Прикладі 48, використовуючи метан-сульфоніл-хлорид (0,044мл, 0,6ммоль) та 5-(4-аміно-3-ціанофеніл)-1-метил-1Н-пірол-2карбонітрил (0,100г, 0,45ммоль), що забезпечує одержання заголовної сполуки (0,100г, 50%). HPLC чистота компоненту =96,6% при 210370нм; RT=10,3хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C14H12N4O2S+Н+, 300,0681; знайдено (ESI-FTMS, [M+H]1+), 301,10763. 92500 40 Приклад 52: 5-(4-аміно-2,6-дифторфеніл)-1метил-1Н-пірол-2-карбонітрил Суміш 4-бром-3,5-дифтораніліну (0,782г, 3,78ммоль), тріс(дибензиліден-ацетон)дипаладію (0,096г, 0,105ммоль), N-метил-5-ціанопіролборної кислоти (1,12г, 7,46ммоль), та фториду калію (0,789г, 13,6ммоль) у THF (10мл) перемішують у атмосфері азоту. До суміші додають три-третбутилфосфін (10% розчин у гексані, 0,621мл, 0,210ммоль) та залишають перемішуватися до вичерпування вихідного броміду. Потім суміш розбавляють за допомогою 1/1 суміші гексан/тетрагідрофуран, фільтрують через фільтр з силікагелю, розчинник випарюють та залишок очищують за допомогою силікагелевої колонкової хроматографії (гексан/етилацетат, 70/30), що забезпечує одержання заголовної сполуки (1,77г, 92%). HPLC чистота компоненту =100% при 210370нм; RT=8,8хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання4 хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. HRMS: розраховано для C12H9F2N3+Н+, 233,0764; знайдено (ESI-FTMS, [М+Н]1+), 234,0433. Приклад 53: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3,5-дифторфеніл]-метансульфонамід Суміш метансульфоніл-хлориду (0,046мл, 0,66ммоль) та 5-(4-аміно-2,6-дифторфеніл)-1метил-1Н-пірол-2-карбонітрилу (0,100г, 0,429ммоль) у піридині (1,5мл) нагрівають при 50 С впродовж 4 годин. Реакційну суміш підкислюють за допомогою 1N НСl розчину та екстрагують етилацетатом. Об'єднані органічні шари сушать над сульфатом магнію, та концентрують. Залишок очищують за допомогою силікагелевої колонкової хроматографії (дихлорметан/ацетон, 97/3), що забезпечує одержання заголовної сполуки (0,060г, 45%). HPLC чистота компоненту =100% при 210370нм; RT=8,7хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 54: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3,5-дифторфеніл]етан-сульфонамід Зазначену сполуку одержують відповідно до процедури, описаної у Прикладі 53, використовуючи етансульфоніл-хлорид (0,062мл, 0,66ммоль). Залишок очищують за допомогою силікагелевої колонкової хроматографії (дихлорметан/ацетон, 98/2), що забезпечує одержання заголовної сполуки (0,050г, 35%). HPLC чистота компоненту =100% при 210370нм; RT=9,1хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 55: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3,5-дифторфеніл]пропан-1-сульфонамід Зазначену сполуку одержують відповідно до процедури, описаної у Прикладі 53, використовуючи пропансульфоніл-хлорид (0,076мл, 0,66ммоль). Залишок очищують за допомогою силікагелевої колонкової хроматографії (дихлорметан/ацетон, 41 92500 99/1), що забезпечує одержання заголовної сполуки (0,025г, 17%). HPLC чистота компоненту =99,4% при 210370нм; RT=9,6хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 56: N-[4-(5-ціано-1-метил-1Н-пірол-2іл)-3,5-дифторфеніл]бутан-1-сульфонамід Зазначену сполуку одержують відповідно до процедури, описаної у Прикладі 53, використовуючи бутансульфоніл-хлорид (0,084мл, 0,66ммоль). Залишок очищують за допомогою силікагелевої колонкової хроматографії (дихлорметан/ацетон, 99/1), що забезпечує одержання заголовної сполуки (0,025г, 16%). HPLC чистота компоненту =100% при 210-37 нм; RT=10хвил.; 85/15-5/95 (Амонійн. форм, буфер Ph=3,5/ACN+MeOH) впродовж 10хвил., утримання 4хвил.; Xterra™ RP18 інструмент, 3,5 , 150 х 4,6мм, 1,2мл/хвил. Приклад 57: Фармакологія Дослідження проводять для визначення сполук, що мають активність модулятору прогестеронового рецептору. Дане дослідження визначає прогестини або антипрогестини шляхом визначення впливу сполук на активність лужної фосфатази у T47D клітинах. А. Реагенти: Культуральне середовище: DMEM:F12 (1:1) (GIBCO, BRL) з 5% (об'єм/об'єм) десорбованої активованим вугіллям ембріональної сироватки великої рогатої худоби (без інактивації нагріванням), 100U/мл пеніциліну, 100мкг/мл стрептоміцину та 2мм GlutaMax (GIBCO, BRL). Аналітичний буфер лужної фосфатази: I. 0,1М Tris-HCl, pH 9,8, який містить 0,2% Triton X-100 реагент II. 0,1М Tris-HCl, pH 9,8, який містить 4мМ пнітрофенілфосфату (Sigma). Б. Культура клітин та обробка: Заморожені клітини T47D розморожують у водяній ванні при 37 С і розводять до 280000клітин/мл у культуральному середовищі. У кожну лунку 96-лункового планшету (Falcon, Becton Dickinson Labware) додають 180мкл розведеної суспензії клітин. Приклад № 1 2 3 4 5 6 7 42 Потім у кожну лунку додають двадцять мкл контрольних або випробуваних сполук, розведених у культуральному середовищі. При випробуванні на активність антагоністу прогестину додають контрольні антипрогестини або випробувані сполуки у присутності 1нм прогестерону. Клітини інкубують при 37 С у зволоженій атмосфері 5% СО2 протягом 24 годин. Для високопродуктивного відбору випробують одну концентрацію кожної сполуки у кількості 0,3мкг/мл. На основі середньої молекулярної маси 300г/моль для сполук у бібліотеці концентрація становить приблизно 1мкМ. Потім активні сполуки випробують шляхом аналізів реакції на дозу для визначення ЕС50 та ІС50, В. Аналіз ферменту лужної фосфатази: Наприкінці експерименту середовище видаляють з планшету. У кожну лунку додають п'ятдесят мкл аналітичного буферу І. Планшети струшують у вібраційному пристрої для титрувальних планшетів протягом 15хв. Потім у кожну лунку додають 150мкл аналітичного буферу II. Вимірювання оптичної густини здійснюють з 5-хвилинними інтервалами протягом 30хв при випробувальній довжині хвилі 405нМ. Г. Аналіз результатів: Аналіз даних реакції на дозу. Для контрольних та випробуваних сполук будують криву реакції на дозу, яка показує залежність між дозою (х-вісь) та швидкістю ферментної реакції (нахил) (у-вісь). Перетворені дані квадратних коренів використовують для варіаційного аналізу та аналізу нелінійної кривої реакції на дозу, які є придатними для режимів з застосуванням як агоніста, так і антагоніста. Для зниження впливу крайніх значень застосовують оцінку Хубера. Значення ЕС50 або IC50 розраховують на основі ретрансформованих значень. Програму JMP (SAS Institute, Inc.) застосовують як для одностороннього варіаційного аналізу, так і для нелінійного аналізу реакції на дозу у дослідженнях окремих доз та реакції на дозу. Д. Контрольні сполуки: Прогестерон та тримегестон є контрольними прогестинами, a RU486 є контрольним антипрогестином. Для всіх контрольних сполук будують повні криві реакції на дозу і розраховують значення ЕС50 та ІС50. Назва сполуки N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл] пропан-1-сульфонамід N-[4-(5-ціано-1 метил-1Н-пірол-2-іл)феніл]- N(метилсульфоніл)метансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]бутан1-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-2,2,2трифторетансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4ізопропілбензолсульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]бензолсульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)феніл]-4метилбензолсульфонамід ІС50 (нМ) 9,8 ~300 ~300 58,4 ~3000 ~30 ~3000 Активна доза (нМ) Інгібування (%) 43 Приклад № 8 9 10 11 12 14 15 16 17 18 20 21 23 24 26 27 28 29 30 31 33 34 35 39 40 41 42 43 44 45 92500 Назва сполуки N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]пропан-2-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2фторфеніл]метансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2фторфеніл]етансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]метансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]етансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]пропан-1-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]бутан-1 сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3фторфеніл]пропан-2-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]-метан-сульфонамід N-[4-(5-ціано-1 метил-1Н-пірол-2-іл)-2,5дифторфеніл]етан-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]бутан-1-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2,5дифторфеніл]пропан-2-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]метан-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]етан-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]пропан-1-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3(трифторметил)феніл]бутан-1-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3 (трифторметил)феніл]пропан-2-сульфонамід 5-[4-(1,1-діоксидоізотіазолідин-2-іл)феніл]-1метил-1Н-пірол-2-карбонітрил N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]метан-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]етан-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-2(трифторметокси)феніл]пропан-1-сульфонамід N-[4-(5-ціано-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-ціано-1-етил-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-ціано-1-пропіл-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(1-бутил-5-ціано-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(1-аліл-5-ціано-1Н-пірол-2іл)феніл]етансульфонамід N-[4-(5-ціано-1 проп-2-ін-1-іл-1Н-пірол-2іл)феніл]етансульфонамід N-{4-[5-ціано-1-(3-фенілпропіл)-1Н-пірол-2іл]феніл}етансульфонамід 44 ІС50 (нМ) Активна доза (нМ) Інгібування (%) 1,5 10 8,2 28,9 29,9 18,3 10000 3,8 10000 3,5 6,6 9,3 10000 39,8 10000 22,1 266,6 230,8 13,4 10,2 9,4 53,7 25,2 179,5 32,2 35,8 40,7 68,6 84,1 721,4 545,6 600,1 796,5 3000 15 45 Приклад № 48 49 50 51 53 54 55 56 92500 ІС50 (нМ) N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонамід N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]етансульфонамід N-[3-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]пропан-1-сульфонамід N-[2-ціано-4-(5-ціано-1-метил-1Н-пірол-2іл)феніл]метансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]-метансульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]етан-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]пропан-1-сульфонамід N-[4-(5-ціано-1-метил-1Н-пірол-2-іл)-3,5дифторфеніл]бутан-1-сульфонамід У представленій вище таблиці, ІС50 значення показують відносну активність антагоністу прогестеронового рецептору у цьому дослідженні. Нижчі числа показують вищу активність, тобто більшу активність PR антагоністу. Зазначене дослідження має стандартне відхилення приблизно 6. Додатково, сполуки 45 та 51 забезпечують 15 та 50% інгібування, відповідно, при активній дозі 3000нМ. Активна доза (нМ) Інгібування (%) 3000 Назва сполуки Комп’ютерна верстка А. Крижанівський 46 50 198,4 123,8 86,8 16 19 6,2 8,6 Усі публікації, перелічені в цьому описі, включено авторами шляхом посилання. Хоча винахід було описано з посиланням на конкретний оптимальний варіант втілення, зрозуміло, що існує можливість модифікацій без відхилення від сутності винаходу. Ці модифікації охоплюються обсягом представленої нижче формули винаходу. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCyanopyrrole-sulfonamide progesterone receptor modulators and uses thereof
Автори англійськоюMccomas Casey Cameron, Fensome Andrew, Melenski Edward George
Назва патенту російськоюЦианопирролсульфонамидные модуляторы прогестеронового рецептора и их применение
Автори російськоюМаккомас Кейси Камерон, Фенсом Эндрю, Меленски Эдвард Джордж
МПК / Мітки
МПК: A61K 31/41, A61K 31/40, C07D 207/34, A61P 15/18, C07D 417/10
Мітки: модулятори, прогестеронового, застосування, ціанопіролсульфонамідні, рецептора
Код посилання
<a href="https://ua.patents.su/23-92500-cianopirolsulfonamidni-modulyatori-progesteronovogo-receptora-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Ціанопіролсульфонамідні модулятори прогестеронового рецептора та їх застосування</a>
Попередній патент: Водна інсектицидна композиція (варіанти) та спосіб захисту матеріалу для розмноження рослин
Випадковий патент: Спосіб очищення внутрішніх поверхонь залізничних вагонів












