Піримідини, що інгібують реплікацію віл
Номер патенту: 70966
Опубліковано: 15.11.2004
Автори: Каваш Роберт В., ван Акен Коен Жанна Альфонс, Янссен Поль Адріан Жан, Хо Чі Янг, Де Корте Барт, Херес Жан, Людовічі Дональд Вілліам, Коіманс Люс'єн Марія Хенрік, де Джонге Марк Рене, Кукла Майкл Джозеф
Формула / Реферат
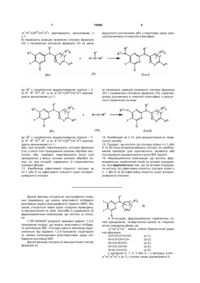
1. Похідне піримідину формули
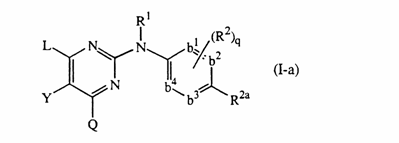
його N-оксид, фармацевтично прийнятна сіль приєднання, четвертинний амін або стереохімічно ізомерна форма, де
-b1=b2-С(R2a)=b3-b4= являє собою бівалентний радикал формули
-СН=СН-С(R2a)=СН-CH=
(b-1);
-N=CH-C(R2a)=СН-CH=
(b-2);
-CH=N-C(R2a)=СН-CH=
(b-3);
-N=CH-C(R2a)=N-CH=
(b-4);
-N=CH-C(R2a)=СН-N=
(b-5);
-CH=N-C(R2a)=N-СН=
(b-6);
-N=N-C(R2a)=СН-CH=
(b-7);
q дорівнює 0, 1, 2; або, де можливо, q дорівнює 3 або 4;
R1 являє собою водень, арил, форміл, С1-6 алкілкарбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 алкіл, заміщений формілом, С1-6 алкілкарбонілом, С1-6 алкілоксикарбонілом, С1-6 алкілкарбонілокси; С1-6 алкілоксі С1-6 алкілкарбоніл, заміщений С1-6 алкілоксикарбонілом;
R2a являє собою ціано, амінокарбоніл, моно- або ді(метил)амінокарбоніл, С1-6 алкіл, заміщений ціано, амінокарбонілом або моно- чи ді(метил)амінокарбонілом, С2-6 алкеніл, заміщений ціано, або С2-6 алкініл, заміщений ціано;
кожна R2 являє собою, незалежно, гідрокси, гало, С1-6 алкіл, заміщений, при потребі, ціано або -С(=O)R6, C3-7 циклоалкіл, С2-6 алкеніл, заміщений, при потребі, одним або більше атомами галогену або ціано, С2-6 алкініл, заміщений, при потребі, одним або більше атомами галогену або ціано, С1-6 алкілокси, С1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, аміно, моно- або ді(С1-6 алкіл)аміно, полігалометил, полігалометилокси, полігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 або радикал формули
 ,
,
де кожна А є, незалежно, N, CH або CR6;
B являє собою NH, O, S або NR6;
p дорівнює 1 або 2; та
R6 являє собою метил, аміно, моно- або диметиламіно чи полігалометил;
L являє собою С1-10 алкіл, С2-10 алкеніл, С1-10 алкініл, С3-7 циклоалкіл, де кожна зазначена аліфатична група може бути заміщена одним або двома замісниками, що вибирають незалежно із
С3-7 циклоалкілу;
індолілу або ізоіндолілу, кожен із яких є заміщеним, при потребі, одним, двома, трьома або чотирма замісниками, котрі вибирають незалежно із гало, С1-6 алкілу, гідрокси, С1-6 алкілокси, ціано, амінокарбонілу, нітро, аміно, полігалометилу, полігалометилокси та С1-6 алкілкарбонілу;
фенілу, піридинілу, піримідинілу, піразинілу або піридазинілу, де кожне із зазначених ароматичних кілець може бути заміщене, при потребі, одним, двома, трьома, чотирма або п’ятьма замісниками, котрі вибирають незалежно із замісників, що визначені як R2; або
L являє собою -X-R3, де
R3 являє собою феніл, піридиніл, піримідиніл, піразиніл або піридазиніл, де кожне із зазначених ароматичних кілець може бути заміщене, при потребі, одним, двома, трьома, чотирма або п’ятьма замісниками, котрі вибираються незалежно із замісників, що визначені як R2; та
Х являє собою -NR1-, -NH-NH-, -N=N-, -O-, -C(=O)-, -CHOH-, -S-, =S(=O)- або -S(=O)2-;
Q являє собою водень, С1-6 алкіл, гало, полігало С1-6 алкіл або -NR4R5; та
R4 та R5 вибирають незалежно із водню, гідрокси, С1-12 алкілу, С1-12 алкілокси, С1-12 алкілкарбонілу, С1-12 алкілоксикарбонілу, арилу, аміно, моно- або ді(С1-12 алкіл)аміно, моно- або ді(С1-12 алкіл)амінокарбонілу, де кожна із зазначених вище С1-12 алкільних груп може, при потребі та окремо, бути заміщеною одним або двома замісниками, що вибирають незалежно із гідрокси, С1-6 алкілокси, гідроксі С1-6 алкілокси, карбоксилу, С1-6 алкілоксикарбонілу, ціано, аміно, іміно, моно- або ді(С1-6 алкіл)аміно, полігалометилу, полігалометилокси, полігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6, арилу та Het; або
R4 та R5, сумісно, можуть утворювати піролідиніл, піперидиніл, морфолініл, азидо або моно- чи ді(С1-12 алкіл)аміноС1-4алкіліден;
Y являє собою гідрокси, гало, С3-7 циклоалкіл, С2-6 алкеніл, заміщений, при потребі, одним або більше атомами галогену, С2-6 алкініл, заміщений, при потребі, одним або більше атомами галогену, С1-6 алкіл, заміщений ціано або -С(=О)R6, С1-6 алкілокси, С1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, аміно, моно- або ді(С1-6 алкіл)аміно, полігалометил, полігалометилокси, полігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 або арил;
арил являє собою феніл або феніл, заміщений одним, двома, трьома, чотирма або п’ятьма замісниками, що вибирають незалежно із гало, С1-6 алкілу, С3-7 циклоалкілу, С1-6 алкілокси, ціано, нітро, полігалоС1-6 алкілу та полігало С1-6 алкілокси;
Het являє собою аліфатичний або ароматичний гетероциклічний радикал; зазначений аліфатичний гетероциклічний радикал вибирають із піролідинілу, піперидинілу, гомопіперидинілу, піперазинілу, морфолінілу, тетрагідрофуранілу та тетрагідротієнілу, де кожен із зазначених аліфатичних гетероциклічних радикалів може бути заміщений, при потребі, оксогрупою; та зазначений ароматичний гетероциклічний радикал вибирають із піролілу, фуранілу, тієнілу, піридинілу, піримідинілу, піразинілу та піридазинілу, де кожен із зазначених ароматичних гетероциклічних радикалів може бути заміщений, при потребі, гідрокси.
2. Сполука за п. 1, яка відрізняється тим, що R1 являє собою водень, арил, форміл, С1-6 алкілкарбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 алкіл, заміщений формілом, С1-6 алкілкарбонілом, С1-6 алкілоксикарбонілом.
3. Сполука за пп. 1 або 2, яка відрізняється тим, що L являє собою -X-R3, де R3 є 2,4,6-тризаміщеним фенілом.
4. Сполука за будь-яким із пп. 1-3, яка відрізняється тим, що Y являє собою ціано, -С(=О)NH2 або галоген.
5. Сполука за будь-яким із пп. 1-4, яка відрізняється тим, що Q являє собою водень або NR4R5.
6. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що являє собою 4-[[4-аміно-5-хлоро-6-[(2,4,6-триметилфеніл)аміно]-2-піримідиніл]аміно]бензонітрил;
4-[[5-хлоро-4-[(2,4,6-триметилфеніл)аміно]-2-піримідиніл]аміно]бензонітрил;
4-[[5-бромо-4-(4-ціано-2,6-диметилфенокси)-2-піримідиніл]аміно]бензонітрил;
4-[[4-аміно-5-хлоро-6-[(4-ціано-2,6-диметилфеніл)аміно]-2-піримідиніл]аміно]бензонітрил;
4-[[5-бромо-6-[(4-ціано-2,6-диметилфеніл)аміно]-2-піримідиніл]аміно]бензонітрил;
4-[[4-аміно-5-хлоро-6-(4-ціано-2,6-диметилфенілокси)-2-піримідиніл]аміно]бензонітрил або
4-[[4-аміно-5-бромо-6-(4-ціано-2,6-диметилфенілокси)-2-піримідиніл]аміно]бензонітрил; їх N-оксид, фармацевтично прийнятну сіль приєднання, четвертинний амін та стереохімічно ізомерну форму.
7. Сполука за будь-яким із пп. 1-6, для використання як лікарського засобу.
8. Сполука за будь-яким з пп. 1-6, де R1 являє собою водень, арил, форміл, С1-6 алкілкарбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 алкіл, заміщений формілом, С1-6 алкілкарбонілом, С1-6 алкілоксикарбонілом, для виробництва ліків, призначених для лікування суб’єктів, що страждають на ВІЛ-інфекції.
9. Сполука за будь-яким із пп.1-6, для виробництва ліків, призначених для лікування суб’єктів, що страждають на ВІЛ- інфекції.
10. Використання сполуки формули
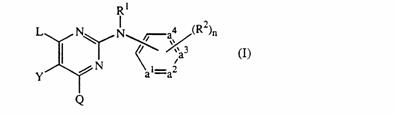
її N-оксиду, фармацевтично прийнятної солі приєднання, четвертинного аміну або стереохімічно ізомерної форми, де
-а1 = а2 - а3 = а4 - являє собою бівалентний радикал формули
-СН=СН-СН=СН-
(а-1);
-N=CH-CH=CH-
(a-2);
-N=CH-N=CH-
(a-3);
-N=CH-CH=N-
(a-4);
-N=N-CH=CH-
(a-5);
n дорівнює 0, 1, 2, 3 або 4; і у випадку, коли -а1 = а2 - а3 = а4 є (а-1), n може також дорівнювати 5;
R1 являє собою водень, арил, форміл, С1-6 алкілкарбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 алкіл, заміщений формілом, С1-6 алкілкарбонілом, С1-6 алкілоксикарбонілом, С1-6 алкілкарбонілокси; С1-6 алкілокси С1-6 алкілкарбоніл, заміщений С1-6 алкілоксикарбонілом; та
кожна R2 являє собою, незалежно, гідрокси, гало, С1-6 алкіл, заміщений, при потребі, ціано або -С(=О)R6, C3-7 циклоалкіл, С2-6 алкеніл, заміщений, при потребі, одним або більше атомами галогену або ціано, С2-6 алкініл, заміщений, при потребі, одним або більше атомами галогену або ціано, С1-6 алкілокси, С1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, аміно, моно- або ді(С1-6 алкіл)аміно, полігалометил, полігалометилокси, полігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 або радикал формули
 ,
,
де кожна А є, незалежно, N, CH або CR6;
B являє собою NH, O, S або NR6;
p дорівнює 1 або 2; та
R6 являє собою метил, аміно, моно- або диметиламіно чи полігалометил;
L являє собою С1-10 алкіл, С2-10 алкеніл, С2-10 алкініл, С3-7 циклоалкіл, де кожна зазначена аліфатична група може бути заміщена одним або двома замісниками, що вибирають незалежно із
С3-7 циклоалкілу;
індолілу або ізоіндолілу, кожен із яких є заміщеним, при потребі, одним, двома, трьома або чотирма замісниками, котрі вибирають незалежно із гало, С1-6 алкілу, гідрокси, С1-6 алкілокси, ціано, амінокарбонілу, нітро, аміно, полігалометилу, полігалометилокси та С1-6 алкілкарбонілу;
фенілу, піридинілу, піримідинілу, піразинілу або піридазинілу, де кожне із зазначених ароматичних кілець може бути заміщене, при потребі, одним, двома, трьома, чотирма або п’ятьма замісниками, котрі вибирають незалежно із замісників, що визначені як R2; або
L являє собою -X-R3, де
R3 являє собою феніл, піридиніл, піримідиніл, піразиніл або піридазиніл, де кожне із зазначених ароматичних кілець може бути заміщене, при потребі, одним, двома, трьома, чотирма або п’ятьма замісниками, котрі вибирають незалежно із замісників, що визначені як R2; та
Х являє собою -NR1-, -NH-NH-, -N=N-, -O-, -C(=O)-, -CHOH-, -S-, =S(=O)- або -S(=O)2-;
Q являє собою водень, С1-6 алкіл, гало, полігало С1-6 алкіл або -NR4R5; та
R4 та R5 вибираються незалежно із водню, гідрокси, С1-12 алкілу, С1-12 алкілокси, С1-12 алкілкарбонілу, С1-12 алкілоксикарбонілу, арилу, аміно, моно- або ді(С1-12 алкіл)аміно, моно- або ді(С1-12 алкіл)амінокарбонілу, де кожна із зазначених вище С1-12 алкільних груп може, при потребі та окремо, бути заміщеною одним або двома замісниками, що вибирають незалежно із гідрокси, С1-6 алкілокси, гідроксі С1-6 алкілокси, карбоксилу, С1-6 алкілоксикарбонілу, ціано, аміно, іміно, моно- або ді(С1-6 алкіл)аміно, полігалометилу, полігалометилокси, полігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6, арилу та Het; або
R4 та R5, сумісно, можуть утворювати піролідиніл, піперидиніл, морфолініл, азидо або моно- чи ді(С1-12 алкіл)аміноС1-4алкіліден;
Y являє собою гідрокси, гало, С3-7 циклоалкіл, С2-6 алкеніл, заміщений, при потребі, одним або більше атомами галогену, С2-6 алкініл, заміщений, при потребі, одним або більше атомами галогену, С1-6 алкіл, заміщений ціано або -С(=О)R6, С1-6 алкілокси, С1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, аміно, моно- або ді(С1-6 алкіл)аміно, полігалометил, полігалометилокси, полігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 або арил;
арил являє собою феніл або феніл, заміщений одним, двома, трьома, чотирма або п’ятьма замісниками, що вибирають незалежно із гало, С1-6 алкілу, С3-7 циклоалкілу, С1-6 алкілокси, ціано, нітро, полігалоС1-6 алкілу та полігало С1-6 алкілокси;
Het являє собою аліфатичний або ароматичний гетероциклічний радикал; зазначений аліфатичний гетероциклічний радикал вибирають із піролідинілу, піперидинілу, гомопіперидинілу, піперазинілу, морфолінілу, тетрагідрофуранілу та тетрагідротієнілу, де кожен із зазначених аліфатичних гетероциклічних радикалів може бути заміщений, при потребі, оксогрупою; та зазначений ароматичний гетероциклічний радикал вибирають із піролілу, фуранілу, тієнілу, піридинілу, піримідинілу, піразинілу та піридазинілу, де кожен із зазначених ароматичних гетероциклічних радикалів може бути заміщений, при потребі, гідрокси;
для виробництва ліків, призначених для лікування суб’єктів, що страждають на ВІЛ- інфекції.
11. Фармацевтична композиція, що містить фармацевтично прийнятний носій та активний інгредієнт, яка відрізняється тим, що як активний інгредієнт містить терапевтично ефективну кількість сполуки за будь-яким із пп. 1-6.
12. Спосіб одержання сполуки за п. 1, у якому
а) проводять реакцію проміжної сполуки формули (ІІ) з амінопохідною формули (ІІІ) за умов відсутності розчинника або у інертному щодо реакції розчиннику, в інертній атмосфері, де W1 є прийнятною відщеплюваною групою, і L, Q, R1, R2, R2a, q та
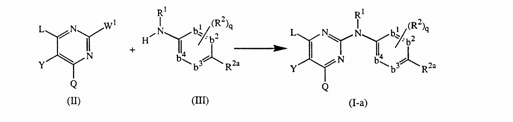
-b1=b2-C(R2a)=b3-b4= відповідають визначеним у п.1;
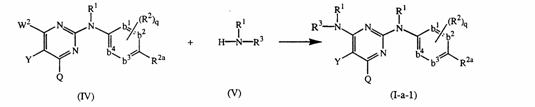
б) проводять реакцію проміжної сполуки формули (IV) з проміжною сполукою формули (V) за умов відсутності розчинника або у інертному щодо реакції розчиннику, в інертній атмосфері
 ,
,
де W2 є прийнятною відщеплюваною групою, і Y, Q, R1, R2, R2a, R3, q та -b1=b2-C(R2a)=b3-b4= відповідають визначеним у п.1;
в) проводять реакцію проміжної сполуки формули (IV) з проміжною сполукою формули (VІ) у відповідному розчиннику в інертній атмосфері у присутності прийнятної основи
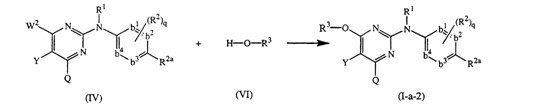 ,
,
де W2 є прийнятною відщеплюваною групою, і Y, Q, R1, R2, R2a, R3, q та -b1=b2-C(R2a)=b3-b4= відповідають визначеним у п.1;
або, при потребі, перетворюють сполуки формули (І-а) у кислі солі приєднання шляхом обробки кислотою, або, навпаки, перетворюють кислі солі приєднання у вільні основи шляхом обробки лугом; та, при потребі, одержують їх стереохімічно ізомерні форми.
13. Комбінація ефективної кількості сполуки за пп. 1 або 8 та ефективної кількості іншої антиретровірусної сполуки.
14. Комбінація за п. 14, для використання як лікарського засобу.
15. Продукт, що містить (а) сполуку згідно з п. 1 або 8 та (б) іншу антиретровірусну сполуку як комбінований препарат для одночасного, окремого або послідовного використання в анти-ВІЛ терапії.
16. Фармацевтична композиція, що містить фармацевтично прийнятний носій та активні інгредієнти, яка відрізняється тим, що як активні інгредієнти містить (а) ефективну кількість сполуки згідно з п. 1 або 8 та (б) ефективну кількість іншої антиретровірусної сполуки.
Текст
1. Похідне піримідину формули 3 70966 4 R3 являє собою феніл, піридиніл, піримідиніл, пі5. Сполука за будь-яким із пп.1-4, яка відрізняразиніл або піридазиніл, де кожне із зазначених ється тим, що Q являє собою водень або NR4R5. ароматичних кілець може бути заміщене, при по6. Сполука за будь-яким із пп.1-5, яка відрізнятребі, одним, двома, трьома, чотирма або п’ятьма ється тим, що являє собою 4-[[4-аміно-5-хлоро-6замісниками, котрі вибираються незалежно із замі[(2,4,6-триметилфеніл)аміно]-2сників, що визначені як R2; та піримідиніл]аміно]бензонітрил; Х являє собою -NR1-, -NH-NH-, -N=N-, -O-, -C(=O)-, 4-[[5-хлоро-4-[(2,4,6-триметилфеніл)аміно]-2-CHOH-, -S-, =S(=O)- або -S(=O) 2-; піримідиніл]аміно]бензонітрил; Q являє собою водень, С1-6 алкіл, гало, полігало 4-[[5-бромо-4-(4-ціано-2,6-диметилфенокси)-2С1-6 алкіл або -NR4R5; та піримідиніл]аміно]бензонітрил; R4 та R5 вибирають незалежно із водню, гідрокси, 4-[[4-аміно-5-хлоро-6-[(4-ціано-2,6С1-12 алкілу, С1-12 алкілокси, С1-12 алкілкарбонілу, диметилфеніл)аміно]-2С1-12 алкілоксикарбонілу, арилу, аміно, моно- або піримідиніл]аміно]бензонітрил; ді(С1-12 алкіл)аміно, моно- або ді(С1-12 ал4-[[5-бромо-6-[(4-ціано-2,6-диметилфеніл)аміно]-2кіл)амінокарбонілу, де кожна із зазначених ви ще піримідиніл]аміно]бензонітрил; С1-12 алкільних груп може, при потребі та окремо, 4-[[4-аміно-5-хлоро-6-(4-ціано-2,6бути заміщеною одним або двома замісниками, що диметилфенілокси)-2вибирають незалежно із гідрокси, С1-6 алкілокси, піримідиніл]аміно]бензонітрил або гідроксі С1-6 алкілокси, карбоксилу, С1-6 алкілокси4-[[4-аміно-5-бромо-6-(4-ціано-2,6карбонілу, ціано, аміно, іміно, моно- або ді(С1-6 диметилфенілокси)-2алкіл)аміно, полігалометилу, полігалометилокси, піримідиніл]аміно]бензонітрил; їх N-оксид, фармаполігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, цевтично прийнятну сіль приєднання, четвертинC(=O)R6, -NHC(=O)H, -C(=O)NHNH 2, -NHC(=O)R 6, ний амін та стереохімічно ізомерну форму. C(=NH)R 6, арилу та Het; або 7. Сполука за будь-яким із пп.1-6, для використанR4 та R5, сумісно, можуть утворювати піролідиніл, ня як лікарського засобу. піперидиніл, морфолініл, азидо або моно- чи ді(С18. Сполука за будь-яким з пп.1-6, де R 1 являє собою водень, арил, форміл, С1-6 алкілкарбоніл, С1-6 12 алкіл)аміноС 1-4алкіліден; Y являє собою гідрокси, гало, С3-7 циклоалкіл, С2-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 алкіл, заміщений алкеніл, заміщений, при потребі, одним або більформілом, С1-6 алкілкарбонілом, С1-6 алкілоксикарше атомами галогену, С2-6 алкініл, заміщений, при бонілом, для виробництва ліків, призначених для потребі, одним або більше атомами галогену, С1-6 лікування суб’єктів, що страждають на ВІЛалкіл, заміщений ціано або -С(=О)R6, С1-6 алкілокінфекції. си, С1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, 9. Сполука за будь-яким із пп.1-6, для виробництва аміно, моно- або ді(С1-6 алкіл)аміно, полігаломеліків, призначених для лікування суб’єктів, що тил, полігалометилокси, полігалометилтіо, страждають на ВІЛ- інфекції. S(=O)pR6, -NH-S(=O)pR6 , -C(=O)R6, -NHC(=O)H, 10. Використання сполуки формули C(=O)NHNH2, -NHC(=O)R 6, -C(=NH)R 6 або арил; арил являє собою феніл або феніл, заміщений одним, двома, трьома, чотирма або п’ятьма замісниками, що вибирають незалежно із гало, С1-6 алкілу, С3-7 циклоалкілу, С1-6 алкілокси, ціано, нітро, полігалоС 1-6 алкілу та полігало С1-6 алкілокси; Het являє собою аліфатичний або ароматичний гетероциклічний радикал; зазначений аліфатичний гетероциклічний радикал вибирають із піролідиніїї N-оксиду, фармацевтично прийнятної солі прилу, піперидинілу, гомопіперидинілу, піперазинілу, єднання, четвертинного аміну або стереохімічно морфолінілу, тетрагідрофуранілу та тетрагідротієізомерної форми, де нілу, де кожен із зазначених аліфатичних гетеро-а1 = а2 - а3 = а4 - являє собою бівалентний радициклічних радикалів може бути заміщений, при кал формули потребі, оксогрупою; та зазначений ароматичний -СН=СН-СН=СН(а-1); гетероциклічний радикал вибирають із піролілу, -N=CH-CH=CH(a-2); фуранілу, тієнілу, піридинілу, піримідинілу, пірази-N=CH-N=CH(a-3); нілу та піридазинілу, де кожен із зазначених аро-N=CH-CH=N(a-4); матичних гетероциклічних радикалів може бути -N=N-CH=CH(a-5); заміщений, при потребі, гідрокси. n дорівнює 0, 1, 2, 3 або 4; і у випадку, коли -а1 = а2 1 2. Сполука за п.1, яка відрізняється тим, що R - а3 = а4 є (а-1), n може також дорівнювати 5; являє собою водень, арил, форміл, С1-6 алкілкарR1 являє собою водень, арил, форміл, С1-6 алкілбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 алкіл, карбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 заміщений формілом, С1-6 алкілкарбонілом, С1-6 алкіл, заміщений формілом, С1-6 алкілкарбонілом, алкілоксикарбонілом. С1-6 алкілоксикарбонілом, С1-6 алкілкарбонілокси; 3. Сполука за пп.1 або 2, яка відрізняється тим, С1-6 алкілокси С 1-6 алкілкарбоніл, заміщений С1-6 3 3 що L являє собою -X-R , де R є 2,4,6алкілоксикарбонілом; та тризаміщеним фенілом. кожна R2 являє собою, незалежно, гідрокси, гало, 4. Сполука за будь-яким із пп.1-3, яка відрізняС1-6 алкіл, заміщений, при потребі, ціано або ється тим, що Y являє собою ціано, -С(=О)NH2 С(=О)R6, C3-7 циклоалкіл, С2-6 алкеніл, заміщений, або галоген. при потребі, одним або більше атомами галогену 5 70966 6 або ціано, С2-6 алкініл, заміщений, при потребі, вибирають незалежно із гідрокси, С1-6 алкілокси, одним або більше атомами галогену або ціано, С1гідроксі С1-6 алкілокси, карбоксилу, С1-6 алкілоксикарбонілу, ціано, аміно, іміно, моно- або ді(С1-6 6 алкілокси, С 1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, аміно, моно- або ді(С1-6 алкіл)аміно, алкіл)аміно, полігалометилу, полігалометилокси, полігалометил, полігалометилокси, полігалометиполігалометилтіо, -S(=O)pR6, -NH-S(=O)pR6, 6 6 6 лтіо, -S(=O)pR , -NH-S(=O)pR , -C(=O)R , C(=O)R6, -NHC(=O)H, -C(=O)NHNH 2, -NHC(=O)R 6, 6 6 NHC(=O)H, -C(=O)NHNH 2, -NHC(=O)R , -C(=NH)R C(=NH)R 6, арилу та Het; або або радикал формули R4 та R5, сумісно, можуть утворювати піролідиніл, піперидиніл, морфолініл, азидо або моно- чи ді(С112 алкіл)аміноС 1-4алкіліден; Y являє собою гідрокси, гало, С3-7 циклоалкіл, С2-6 алкеніл, заміщений, при потребі, одним або біль, ше атомами галогену, С2-6 алкініл, заміщений, при потребі, одним або більше атомами галогену, С1-6 де кожна А є, незалежно, N, CH або CR6; алкіл, заміщений ціано або -С(=О)R6, С1-6 алкілокB являє собою NH, O, S або NR6; си, С1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, p дорівнює 1 або 2; та R6 являє собою метил, аміно, моно- або диметиаміно, моно- або ді(С1-6 алкіл)аміно, полігаломеламіно чи полігалометил; тил, полігалометилокси, полігалометилтіо, S(=O)pR6, -NH-S(=O)pR6 , -C(=O)R6, -NHC(=O)H, L являє собою С1-10 алкіл, С2-10 алкеніл, С2-10 алкіC(=O)NHNH2, -NHC(=O)R 6, -C(=NH)R 6 або арил; ніл, С3-7 циклоалкіл, де кожна зазначена аліфатичарил являє собою феніл або феніл, заміщений на група може бути заміщена одним або двома замісниками, що вибирають незалежно із одним, двома, трьома, чотирма або п’ятьма замісС3-7 циклоалкілу; никами, що вибирають незалежно із гало, С1-6 алкілу, С3-7 циклоалкілу, С1-6 алкілокси, ціано, нітро, індолілу або ізоіндолілу, кожен із яких є заміщеполігалоС 1-6 алкілу та полігало С1-6 алкілокси; ним, при потребі, одним, двома, трьома або чотиHet являє собою аліфатичний або ароматичний рма замісниками, котрі вибирають незалежно із гало, С1-6 алкілу, гідрокси, С1-6 алкілокси, ціано, гетероциклічний радикал; зазначений аліфатичний амінокарбонілу, нітро, аміно, полігалометилу, полігетероциклічний радикал вибирають із піролідинілу, піперидинілу, гомопіперидинілу, піперазинілу, галометилокси та С1-6 алкілкарбонілу; морфолінілу, тетрагідрофуранілу та тетрагідротієфенілу, піридинілу, піримідинілу, піразинілу або нілу, де кожен із зазначених аліфатичних гетеропіридазинілу, де кожне із зазначених ароматичних кілець може бути заміщене, при потребі, одним, циклічних радикалів може бути заміщений, при двома, трьома, чотирма або п’ятьма замісниками, потребі, оксогрупою; та зазначений ароматичний гетероциклічний радикал вибирають із піролілу, котрі вибирають незалежно із замісників, що вифуранілу, тієнілу, піридинілу, піримідинілу, піразизначені як R2; або нілу та піридазинілу, де кожен із зазначених ароL являє собою -X-R3, де R3 являє собою феніл, піридиніл, піримідиніл, піматичних гетероциклічних радикалів може бути разиніл або піридазиніл, де кожне із зазначених заміщений, при потребі, гідрокси; для виробництва ліків, призначених для лікування ароматичних кілець може бути заміщене, при посуб’єктів, що страждають на ВІЛ- інфекції. требі, одним, двома, трьома, чотирма або п’ятьма 11. Фармацевтична композиція, що містить фарзамісниками, котрі вибирають незалежно із замісників, що визначені як R2; та мацевтично прийнятний носій та активний інгредіХ являє собою -NR1-, -NH-NH-, -N=N-, -O-, -C(=O)-, єнт, яка відрізняє ться тим, що як активний інгредієнт містить терапевтично ефективну кількість -CHOH-, -S-, =S(=O)- або -S(=O) 2-; сполуки за будь-яким із пп.1-6. Q являє собою водень, С1-6 алкіл, гало, полігало 12. Спосіб одержання сполуки за п.1, у якому С1-6 алкіл або -NR4R5; та R4 та R5 вибираються незалежно із водню, гідроа) проводять реакцію проміжної сполуки формули кси, С1-12 алкілу, С1-12 алкілокси, С1-12 алкілкарбоні(ІІ) з амінопохідною формули (ІІІ) за умов відсутності розчинника або у інертному щодо реакції розлу, С1-12 алкілоксикарбонілу, арилу, аміно, моночиннику, в інертній атмосфері, де W1 є прийнятною або ді(С1-12 алкіл)аміно, моно- або ді(С1-12 алвідщеплюваною групою, і L, Q, R 1 , R2, R2a , q та кіл)амінокарбонілу, де кожна із зазначених ви ще С1-12 алкільних груп може, при потребі та окремо, бутизаміщеною одним або двома замісниками, що 7 70966 -b1=b2-C(R2a)=b3-b4= відповідають визначеним у п.1; б) проводять реакцію проміжної сполуки формули (IV) з проміжною сполукою формули (V) за умов , де W2 є прийнятною відщеплюваною групою, і Y, Q, R1, R2, R 2a, R3 , q та -b1=b2-C(R2a)=b3-b4= відповідають визначеним у п.1; , де W2 є прийнятною відщеплюваною групою, і Y, Q, R1, R2, R 2a, R3 , q та -b1=b2-C(R2a)=b3-b4= відповідають визначеним у п.1; або, при потребі, перетворюють сполуки формули (І-а) у кислі солі приєднання шляхом обробки кислотою, або, навпаки, перетворюють кислі солі приєднання у вільні основи шляхом обробки лугом; та, при потребі, одержують їх стереохімічно ізомерні форми. 13. Комбінація ефективної кількості сполуки за пп.1 або 8 та ефективної кількості іншої антиретровірусної сполуки. Даний винахід стосується застосування похідних піримідину, що мають властивості інгібувати реплікацію вірусу імунодефіциту людини (ВІЛ). Він також стосується нової групи похідних піримідину, їх використання як ліків, способів їх одержання та фармацевтичних композицій, що містять ці сполуки. У ЕР-0834507 розкрито заміщені діаміно 1,3,5триазинові похідні, що мають властивості інгібувати реплікацію ВІЛ. Сполуки даного винаходу відрізняються від відомих 1,3,5-триазинів структурою та своїми поліпшеними властивостями щодо інгібування реплікації ВІЛ. Даний винахід стосується використання сполук формули (І) 8 відсутності розчинника або у інертному щодо реакції розчиннику, в інертній атмосфері в) проводять реакцію проміжної сполуки формули (IV) з проміжною сполукою формули (VІ) у відповідному розчиннику в інертній атмосфері у присутності прийнятної основи 14. Комбінація за п.13, для використання як лікарського засобу. 15. Продукт, що містить (а) сполуку згідно з п.1 або 8 та (б) іншу антиретровірусну сполуку як комбінований препарат для одночасного, окремого або послідовного використання в анти-ВІЛ терапії. 16. Фармацевтична композиція, що містить фармацевтично прийнятний носій та активні інгредієнти, яка відрізняється тим, що як активні інгредієнти містить (а) ефективну кількість сполуки згідно з п. 1 або 8 та (б) ефективну кількість іншої антиретровірусної сполуки. їх N-оксидів, фармацевтично прийнятних солей приєднання, четвертинних амінів та стереохімічно ізомерних форм, де -а1=а2-а3=а4 - являє собою бівалентний радикал формули -СН=СН-СН=СН(а-1); -N=CH-CH=CH(а-2); -N=CH-N=CH(а-3); -N=CH-CH=N(а-4); -N=N-CH=CH(а-5); n дорівнює 0, 1, 2, 3 або 4; і у випадку, коли а1=а2-а3=а4 є (а-1), n може також дорівнювати 5; 9 70966 10 R1 являє собою водень, арил, форміл, С1-6 алC(=O)R6, -NHC(=O)H, -C(=O)NHNH 2, -NHC(O)R6, кілкарбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 C(-NH)R 6, арилу та Het; або алкіл, заміщений формілом, С1-6 алкілкарбонілом, R4 та R5, сумісно, можуть утворювати піроліС1-6 алкілоксикарбонілом, С1-6 алкілкарбонілокси; диніл, піперидиніл, морфолініл, азидо або моноС1-6 алкілокси С 1-6 алкілкарбоніл, заміщений С1-6 чи ді(С1-12 алкіл)аміноС 1-4алкіліден; алкілоксикарбонілом; та кожна R2 являє собою, Υ являє собою гідрокси, гало, С3-7 циклоалкіл, незалежно, гідрокси, гало, С1-6 алкіл, заміщений, С2-6 алкеніл, заміщений, при потребі, одним або при потребі, ціано або -C(=O)R6, C3-7 циклоалкіл, більше атомами галогену, С2-6 алкініл, заміщений, С2-6 алкеніл, заміщений, при потребі, одним або при потребі, одним або більше атомами галогену, більше атомами галогену або ціано, С2-6 алкініл, С1-6 алкіл, заміщений ціано або -C(=O)R 6, С1-6 алкізаміщений, при потребі, одним або більше атомалокси, С1-6 алкілоксикарбоніл, карбоксил, ціано, ми галогену або ціано, С1-6 алкілокси, С1-6 алкілокнітро, аміно, моно- або ді(С1-6 алкіл)аміно, полігасикарбоніл, карбоксил, ціано, нітро, аміно, монолометил, полігалометилокси, полігалометилтіо, або ді(С 1-6 алкіл)аміно, полігалометил, полігалоS(=O)pR6, -NH-S(=O)pR6 , -C(=O)R6, -NHC(=O)H, метилокси, полігалометилтіо, -S(=O)pR6, -NHC(=O)NHNH2, -NHC(=O)R 6, -C(=NH)R 6 або арил; 6 6 S(=O)pR , -C(O)R , -NHC(=O)H, -C(=O)NHNH 2, арил являє собою феніл або феніл, заміщений NHC(=O)R 6, -C(=NH)R 6 або радикал формули одним, двома, трьома, чотирма або п'ятьма замісниками, що вибираються незалежно із гало, С1-6 алкілу, С3-7 циклоалкілу, С1-6 алкілокси, ціано, нітро, полігалоС1-6алкілу та полігалоС1-6алкілокси; Het являє собою аліфатичний або ароматичде кожна А є, незалежно, N, СН або CR6; ний гетероциклічний радикал; зазначений аліфаВ являє собою NH, О, S або NR6; тичний гетероциклічний радикал вибирається із p дорівнює 1 або 2; та піролідинілу, піперидинілу, гомопіперидинілу, піпеR6 являє собою метил, аміно, моно- або димеразинілу, морфолінілу, тетрагідрофуранілу та теттиламіно чи полігалометил; рагідротієнілу, де кожен із зазначених аліфатичних L являє собою С1-10 алкіл, С2-10 алкеніл, С2-10 гетероциклічних радикалів може бути заміщений, алкініл, С3-7 циклоалкіл, де кожна зазначена аліпри потребі, оксогрупою; і зазначений ароматичфатична група може бути заміщена одним або ний гетероциклічний радикал вибирається із піродвома замісниками, що вибираються незалежно із лілу, фуранілу, тієнілу, піридинілу, піримідинілу, - С3-7 циклоалкілу, піразинілу та піридазинілу, де кожен із зазначених - індолілу або ізоіндолілу, кожен із яких є заароматичних гетероциклічних радикалів може бути міщеним, при потребі, одним, двома, трьома або заміщений, при потребі, гідрокси; чотирма замісниками, котрі вибираються незалеждля виробництва ліків, призначених для лікуно із гало, С1-6 алкілу, гідрокси, С1-6 алкілокси, ціавання суб'єктів, що потерпають від ВІЛ (вірус імуно, амінокарбонілу, нітро, аміно, полігалометилу, нодефіциту людини)- інфекції. полігалометилокси та С1-6 алкілкарбонілу, Даний винахід стосується також способу ліку- фенілу, піридинілу, піримідинілу, піразинілу вання теплокровних тварин, що потерпають від або піридазинілу, де кожне із зазначених ароматиВІЛ (вірус імунодефіциту людини)-інфекції. Зазначних кілець може бути заміщене, при потребі, одчений спосіб включає призначення терапевтично ним, двома, трьома, чотирма або п'ятьма замісниефективної кількості сполуки формули (І) або її Nками, котрі вибираються незалежно із замісників, оксидної форми, фармацевтично прийнятної солі 2 що визначені як R ; або приєднання або стереохімічно ізомерної форми у L являє собою -X-R3, де суміші з фармацевтичним носієм. R3 являє собою феніл, піридиніл, піримідиніл, Даний винахід також стосується нових сполук піразиніл або піридазиніл, де кожне із зазначених формули ароматичних кілець може бути заміщене, при потребі, одним, двома, трьома, чотирма або п'ятьма замісниками, котрі вибираються незалежно із замісників, що визначені як R2; та X являє собою -NR1-, -NH-NH-, -N=N-, -О-, C(=O)-, -CHOH-, -S-, =S(=O)- або -S(=O)2-; Q являє собою водень, С1-6 алкіл, гало, полігало С 1-6 алкіл або -NR4R5; та їх N-оксидів, фармацевтично прийнятних соR4 та R5 вибираються незалежно із водню, гідлей приєднання, четвертинних амінів та стереохірокси, С1-12 алкілу, С1-12 алкілокси, С1-12 алкілкармічно ізомерних форм, де бонілу, С1-12 алкілоксикарбонілу, арилу, аміно, мо-b1=b2-C(R2a)=b3-b4= являє собою бівалентний но- або ді(С 1-12 алкіл)аміно, моно- або ді(С 1-12 радикал формули алкіл)амінокарбонілу, де кожна із зазначених вище -CH=CH-C(R2a)=CH-CH= (b-1); С1-12 алкільних груп може, при потребі та окремо, -N=CH-C(R2a)=CH-CH= (b-2); бути заміщеною одним або двома замісниками, що -CH=N-C(R2a)=CH-CH= (b-3); вибираються незалежно із гідрокси, С1-6 алкілокси, -N=CH-C(R2a)=N-CH(b-4); гідрокси С1-6 алкілокси, карбоксилу, С1-6 алкілокси-N=CH-C(R2a)=CH-N(b-5); карбонілу, ціано, аміно, іміно, моно- або ді(С1-6 -CH=N-C(R2a)=N-CH= (b-6); алкіл)аміно, полігалометилу, полігалометилокси, -N=N-C(R 2a)=CH-CH= (b-7); 6 6 полігалометилтіо, -S(=O)pR , -NH-S(=O)pR , q дорівнює 0, 1, 2; або, де можливо, q дорів 11 70966 12 нює 3 або 4; С1-12 алкільних груп може, при потребі та окремо, R1 являє собою водень, арил, форміл, С1-6 албути заміщеною одним або двома замісниками, що кілкарбоніл, С1-6 алкіл, С1-6 алкілоксикарбоніл, С1-6 вибираються незалежно із гідрокси, С1-6 алкілокси, алкіл, заміщений формілом, С1-6 алкілкарбонілом, гідрокси С1-6 алкілокси, карбоксилу, С1-6 алкілоксиС1-6 алкілоксикарбонілом, С1-6 алкілкарбонілокси; карбонілу, ціано, аміно, іміно, моно- або ді(С1-6 С1-6 алкілокси С 1-6 алкілкарбоніл, заміщений С1-6 алкіл)аміно, полігалометилу, полігалометилокси, алкілоксикарбонілом; полігалометилтіо, -S(=O)pR6, -NH-S(-O)pR6, R2a являє собою ціано, амінокарбоніл, моноC(=O)R6, -NHC(=O)H, -C(=O)NHNH 2, -NHC(=O)R 6, або ді(метил)амінокарбоніл, С1-6 алкіл, заміщений C(=NH)R 6, арилу та Het; або ціано, амінокарбонілом або моночи R4 та R5, сумісно, можуть утворювати піроліді(метил)амінокарбонілом, С2-6 алкеніл, заміщений диніл, піперидиніл, морфолініл, азидо або моноціано, або С2-6 алкініл, заміщений ціано; чи ді(С1-12 алкіл)аміноС 1-4алкіліден; кожна R2 являє собою, незалежно, гідрокси, Υ являє собою гідрокси, гало, С3-7 циклоалкіл, гало, С1-6 алкіл, заміщений, при потребі, ціано або С2-6 алкеніл, заміщений, при потребі, одним або -C(=O)R6, C3-7 циклоалкіл, С2-6 алкеніл, заміщений, більше атомами галогену, С2-6 алкініл, заміщений, при потребі, одним або більше атомами галогену при потребі, одним або більше атомами галогену, або ціано, С2-6 алкініл, заміщений, при потребі, С1-6 алкіл, заміщений ціано або -C(=O)R 6, С1-6 алкіодним або більше атомами галогену або ціано, С1локси, С1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, аміно, моно- або ді(С1-6 алкіл)аміно, поліга6 алкілокси, С 1-6 алкілоксикарбоніл, карбоксил, ціано, нітро, аміно, моно- або ді(С1-6 алкіл)аміно, лометил, полігалометилокси, полігалометилтіо, полігалометил, полігалометилокси, полігалометиS(=O)pR6, -NH-S(=O)pR6 , -C(=O)R6, -NHC(=O)H, 6 6 6 лтіо, -S(=O)pR , -NH-S(=O)pR , -C(=O)R , C(=O)NHNH2, -NHC(O)R6, -C(=NH)R 6 або арил; 6 6 NHC(=O)H, -C(=O)NHNH 2, -NHC(-O)R , -C(=NH)R арил являє собою феніл або феніл, заміщений або радикал формули одним, двома, трьома, чотирма або п'ятьма замісниками, що вибираються незалежно із гало, С1-6 алкілу, С3-7 циклоалкілу, С1-6 алкілокси, ціано, нітро, полігалоС1-6алкілу та полігалоС1-6алкілокси; Het являє собою аліфатичний або ароматич6 де кожна А є, незалежно, N, СН або CR ; ний гетероциклічний радикал; зазначений аліфа6 В являє собою NH, О, S або NR ; тичний гетероциклічний радикал вибирається із p дорівнює 1 або 2; та піролідинілу, піперидинілу, гомопіперидинілу, піпеR6 являє собою метил, аміно, моно- або димеразинілу, морфолінілу, тетрагідрофуранілу та теттиламіно чи полігалометил; рагідротієнілу, де кожен із зазначених аліфатичних L являє собою С1-10 алкіл, С2-10 алкеніл, С1-10 гетероциклічних радикалів може бути заміщений, алкініл, С3-7 циклоалкіл, де кожна зазначена аліпри потребі, оксогрупою; та зазначений ароматичфатична група може бути заміщена одним або ний гетероциклічний радикал вибирається із піродвома замісниками, що вибираються незалежно із лілу, фуранілу, тієнілу, піридиншу, піримідинілу, - С3-7 циклоалкілу, піразинілу та піридазинілу, де кожен із зазначених - індолілу або ізоіндолілу, кожен із яких є заароматичних гетероциклічних радикалів може бути міщеним, при потребі, одним, двома, трьома або заміщений, при потребі, гідрокси. чотирма замісниками, котрі вибираються незалежЯк застосовується у даному тексті, С1-6 алкіл, но із гало, С1-6 алкілу, гідрокси, С1-6 алкілокси, ціаяк група або частина групи визначає насичені вугно, амінокарбонілу, нітро, аміно, полігалометилу, леводневі радикали з прямими або розгалуженими полігалометилокси та С1-6 алкілкарбонілу, ланцюгами, що мають від 1 до 6 вуглецевих а то- фенілу, піридинілу, піримідинілу, піразинілу мів, такі як метил, етил, пропіл, 1-метилетил, буабо піридазинілу, де кожне із зазначених ароматитил, пентил, гексил, 2-метилпропіл, 2-метилбутил і чних кілець може бути заміщене, при потребі, одтаке подібне; ним, двома, трьома, чотирма або п'ятьма замісниС1-10 алкіл, як група або частина групи визнаками, котрі вибираються незалежно із замісників, чає насичені вуглеводневі радикали з прямими 2 що визначені як R ; або або розгалуженими ланцюгами, що мають від 1 до L являє собою -X-R3, де 10 вуглецевих а томів, такі як групи, визначені для 3 R являє собою феніл, піридиніл, піримідиніл, С1-6 алкілу, та гептил, октил, ноніл, децил і таке піразиніл або піридазиніл, де кожне із зазначених подібне; С1-12 алкіл, як група або частина групи ароматичних кілець може бути заміщене, при повизначає насичені вуглеводневі радикали з прятребі, одним, двома, трьома, чотирма або п'ятьма мими або розгалуженими ланцюгами, що мають замісниками, котрі вибираються незалежно із замівід 1 до 12 вуглецевих атомів, такі як групи, визна2 сників, що визначені як R ; та чені для С1-10 алкілу, та ундецил, додецил і таке 1 X являє собою -NR -, -ΝΗ-ΝΗ-, -Ν=Ν -, -О-, подібне; С1-4 алкіліден визначає насичені біваленС(=О)-, -СНОН-, -S-, =S(=O)- або -S(=O)2-; тні вуглеводневі радикали з прямими або розгалуQ являє собою водень, С1-6 алкіл, гало, полігаженими ланцюгами, що мають від 1 до 4 вуглецелоС1-6алкіл або -NR4R5; та вих атомів, такі як метилен, 1,2-етандіїл або 1,24 5 R та R вибираються незалежно із водню, гідетиліден, 1,3-пропандіїл або 1,3-пропіліден, 1,4рокси, С1-12 алкілу, С1-12 алкілокси, С1-12 алкілкарбутандіїл або 1,4-бутиліден і таке подібне; С3-7 бонілу, С1-12 алкілоксикарбонілу, арилу, аміно, моциклоалкіл є спорідненим до циклопропілу, циклоно- або ді(С 1-12 алкіл)аміно, моно- або ді(С 1-12 бутилу, циклопентилу, циклогексилу та циклогепалкіл)амінокарбонілу, де кожна із зазначених вище тилу; С2-6 алкеніл визначає вуглеводневі радикали 13 70966 14 з прямими та розгалуженими ланцюгами, що маформули (І) або (I-а) та їх N-оксиди, солі приєдють від 2 до 6 вуглецевих атомів, котрі містять нання, четвертинні аміни або фізіологічно функцітакий подвійний зв'язок як етеніл, пропеніл, бутеональні похідні. Якщо окремо не зазначено або не ніл, пентеніл, гексеніл і таке подібне; С2-10 алкеніл вказано, хімічні позначення даних сполук відповівизначає вуглеводневі радикали з прямими та дають суміші всіх можливих стереохімічно ізомеррозгалуженими ланцюгами, що мають від 2 до 10 них форм, зазначені суміші містять всі діастереовуглецевих атомів, котрі містять такий подвійний мери та енантіомери базової молекулярної зв'язок як групи, визначені для С2-6 алкенілу, та структури, так само як і кожну індивідуальну ізомегептеніл, октеніл, ноненіл, деценіл і таке подібне; рну форму формули (І) або (I-а) та їх N-оксидів, С2-6 алкініл визначає вуглеводневі радикали з солей, сольватів або четвертинних амінів у суттєпрямими та розгалуженими ланцюгами, що мають во вільному вигляді, тобто коли ступінь асоціації з від 2 до 6 вуглецевих атомів, котрі містять такий іншими ізомерами складає менше 10%, краще, потрійний зв'язок як етиніл, пропініл, бутиніл, пенменше 5%, зокрема, менше 2%, та найкраще, метиніл, гексиніл і таке подібне; С2-10 алкініл визначає нше 1%. Зокрема, стереогенні центри можуть мати вуглеводневі радикали з прямими та розгалужеR- або S-конфігурацію; замісники на бівалентних ними ланцюгами, що мають від 2 до 10 вуглецевих циклічних (частково) насичених радикалах можуть атомів, котрі містять такий потрійний зв'язок як мати як цис-, так і траноконфігурацію. Сполуки, що групи, визначені для С2-6 алкінілу, та гептиніл, окмістять подвійні зв'язки, можуть мати Ε або Zтиніл, нонініл, дециніл і таке подібне. конфігурацію при зазначеному подвійному зв'язку. Як застосовувалось у даному тексті раніше, Як мається на думці, стереохімічно ізомерні форпозначення (=O) відповідає карбонільній складовій ми сполук формули (І) або (I-а) о хоплюються дау випадку приєднання до вуглецевого атому, суним винаходом. льфоксидній групі у випадку одноразового приєдДля терапевтичного використання солі сполук нання до атому сірки та сульфонілгрупі у випадку формули (І) або (I-а) є такими, де протиіон є фардвохразового приєднанні до атому сірки. мацевтично прийнятним. Проте, солі кислот та Термін гало є спорідненим до фторо, хлоро, основ, що не є фармацевтично прийнятними, табромо та йодо. Як застосовувалось у попередньокож можуть знайти застосування, наприклад, у му тексті та буде застосовано у наступному, полівиготовленні або очистці фармацевтично прийнягалометил, як група або частина групи визначатної сполуки. Усі солі, незалежно від того, чи є ється як моно- або полігалозаміщений метил, вони фармацевтично прийнятними, включені в зокрема, як метил з одним або більшою кількістю обсяг даного винаходу. атомів фтору, наприклад, дифторометил або триЯк мається на думці, фармацевтично прийняфторометил; полігалоС1-6алкіл, як група або частні кислі та основні солі приєднання включають тина групи визначається як моно- або полігалозатерапевтично активні нетоксичні кислотні та осноміщений С 1-6 алкіл, наприклад, групи, що вні форми солей приєднання, котрі можуть утворивизначаються як галометил, 1,1-дифторо-етил і ти сполуки формули (І) або (I-а). Фармацевтично таке подібне. У випадку, коли до алкільної групи прийнятні кислі солі приєднання можуть звичайно приєднано більше одного атому галогену, у межах одержуватись шляхом обробки даної основної наведеного визначення полігалометилу або поліформи відповідною кислотою. Відповідні кислоти галоС1-6алкілу вони можуть бути однаковими або включають, наприклад, неорганічні кислоти, такі як різними. галогеноводневі кислоти, наприклад, хлористовоПід терміном Het мається на думці, що він днева або бромистоводнева кислота, сірчана, азовключає всі можливі ізомерні форми гетероциклів, тна, фосфорна і подібні кислоти; або органічні кищо згадуються у визначенні Het, наприклад, пірослоти, такі як, наприклад, оцтова, пропанова, ліл включає також 2Н-піроліл. оксиоцтова, молочна, піровиноградна, щавлева Het радикал може бути приєднаний до залиш(тобто етандикислота), малонова, бурштинова ку молекули формули (І) або (I-а) через будь-який (тобто бутандикислота) малеїнова, фумарова, відповідний кільцевий вуглець або гетероатом. яблучна, винна, лимонна, метансульфонова, етаТак, наприклад, коли даний гетероцикл являє сонсульфонова, бензолсульфонова, рбою піридиніл, він може бути 2-піридинілом, 3толуолсульфонова, цикламінова, саліцилова, рпіридинілом або 4-піридинілом. аміносаліцилова, памова і подібні кислоти. Коли будь-яка змінна (наприклад, арил, R2, R6 І навпаки, зазначені сольові форми можуть буі т.д.) зустрічається у будь-якій складовій більше ти перетворені у форму вільної основи обробкою одного разу, кожне визначення є незалежним. відповідною основою. Лінії, проведені у кільцеві системи від замісниСполуки формули (І) або (I-а), що містять кисків, вказують, що даний зв'язок може бути приєдлотний протон, можуть бути також перетворені в їх наним до будь-якого прийнятного кільцевого атонетоксичні металічні або амінні солі приєднання ма. шляхом обробки відповідними органічними або Слід зазначити, що деякі сполуки формули (І) неорганічними основами. Відповідні основні соабо (I-а) та їх N-оксиди, солі приєднання, четверльові форми включають, наприклад, амонієві солі, тинні аміни та стереохімічно ізмерні форми можуть солі лужних та лужноземельних металів, напримістити один або більше хіральних центрів та існуклад, літію, натрію, калію, магнію, кальцію і подібні, вати як стереохімічно ізомерні форми. солі з органічними основами, наприклад, бензатиВикористаний у даному тексті вираз "стереоном, N-метил-D-глюкаміном, гідрабамінові солі та хімічно ізомерні форми" визначає всі можливі стесолі з амінокислотами, такими, наприклад, як аргіреоізомерні форми, котрі можуть мати сполуки нін, лізин і подібними. 15 70966 16 Вираз сіль приєднання, що використовується у логен та ціано. даному тексті, включає також сольвати, котрі здаВикликає інтерес група тих сполук формули (І) тні утворювати сполуки формули (І) або (I-а) та їх або (l-а), де L являє собою -X-R3, де R3 є 2,4,6солі. Таким сольватами є, наприклад, гідрати, алтризаміщеним фенілом, кожен замісник вибиракоголяти і подібне. ється незалежно із хлоро, бромо, фторо, ціано або Деякі сполуки формули (І) або (I-а) можуть таСмалкілу. кож існувати у таутомерній формі. Мається на дуТакож інтересними є ті сполуки формули (І) мці, що такі форми, хоча вони й не зазначені в або (l-а), де Υ являє собою хлоро або бромо, і Q явному вигляді у вищенаведених формулах, також являє собою водень чи аміно. включені в обсяг даного винаходу. Особливими сполуками є ті сполуки формули Під виразами "сполуки формули (І)" або "спо(І) або (l-а), де складова у 2 положенні піримідинолуки формули (I-а)" у даному тексті мається на вого кільця являє собою 4-ціано-анілінову гр упу. думці, що вони включають також N-оксиди, фарСполуки, яким віддається перевага, є тими мацевтично прийнятні кислі солі приєднання, четсполуками формули (І) або (l-а), де складова у вертинні аміни та всі стереоізомерні форми. положенні 2 піримідинового кільця являє собою 4Спеціальна група сполук містить такі сполуки ціано-анілінову гр упу, L являє собою -X-R3, де R3 є 1 формули (І), де R являє собою водень, арил, фо2,4,6-тризаміщеним фенілом, Υ являє собою галорміл, С1-6алкілкарбоніл, С1-6алкіл, С1ген і Q являє собою водень або ΝΗ 2. Найбільша перевага віддається сполукам: 6алкілоксикарбоніл, С 1-6алкіл, заміщений формілом, С1-6алкілкарбонілом, С14-[[4-аміно-5-хлоро-6-[(2,4,6триметилфеніл)аміно]-26алкілоксикарбонілом. Інша спеціальна група сполук містить такі спопіримідиніл]аміно]бензонітрил; луки формули (І), де застосовується одне або бі4-[[5-хлоро-4-[(2,4,6-триметилфеніл)аміно]-2льше з наступних обмежень: піримідиніл]аміно]бензонітрил; і) -а1=а2-а3=а4 - являє собою радикал формули 4-[[5-бромо-4-(4-ціано-2,6-димєтилфенокси)-2(а-1); піримідиніл]аміно]бензонітрил; iі) R1 являє собою водень; 4-[[4-аміно-5-хлоро-6-[(4-ціано-2,6ііі) n дорівнює 1; диметилфеніл)аміно]-22 iv) R являє собою ціано, краще, у парапіримідиніл]аміно]бензонітрил; положенні по відношенню до -NR1- групи; 4-[[5-бромо-6-[(4-ціано-2,6ν) Υ являє собою ціано, -C(=O)NH 2 або галодиметилфеніл)аміно]-2ген, краще, галоген; піримідиніл]аміно]бензонітрил; vi) Q являє собою водень або -NR4R5, де R4 та 4-[[4-аміно-5-хлоро-6-(4-ціано-2,6R5 є, краще, воднем; диметилфенілокси)-2vii) L являє собою -X-R3, де X є, краще, NR1, О піримідиніл]аміно]бензонітрил; та або S, найкраще, коли X є NH, і R3 є заміщеним 4-[[4-аміно-5-бромо-6-(4-ціано-2,6фенілом, де кращими замісниками є С 1-6алил, гадиметилфенілокси)-2логен та ціано. піримідиніл]аміно]бензонітрил; їх N-оксиди, фарЩе одна спеціальна група сполук містить такі мацевтично прийнятні солі приєднання, четверсполуки формули (l-а), де R1 являє собою водень, тинні аміни та стереохімічні ізомерні форми. арил, форміл, С1-6алкілкарбоніл, С1-6алкіл, С1Загалом, сполуки формули (l-а) можуть бути одержані шляхом реакції проміжної сполуки фор6алкілоксикарбоніл, С 1-6алкіл, заміщений формілом, С1-6алкілкарбонілом, С1мули (II), де W1 є прийнятною відщеплюваною груалкілоксикарбонілом. пою, такою, наприклад, як галоген, гідрокси, триф6 Інша спеціальна група сполук містить також лат, тозилат, тіометил, метилсульфоніл, такі сполуки формули (І-а), де застосовується одне трифторометилсульфоніл і подібною, з амінопохіабо більше з наступних обмежень: дною формули (III), при потребі, за умов відсутноі) -b1=b2-C(R2a)=b3-b4= являє собою радикал сті розчинника або у інертному щодо реакції розформули (b-1); чиннику, такому як, наприклад, етанол, 1-метил-2іі) q дорівнює 0; піролідинон, Ν,Ν-диметилформамід, 1,4-діоксан, ііі) R2a являє собою ціано або -C(=O)NH 2, кратетрагідрофуран, диметилсульфоксид, тетралін, ще, коли R2a є ціано; сульфолан, ацетонітрил і подібному, у інертній iv) Y являє собою ціано, -C(=O)NH 2 або галоатмосфері, такій як, наприклад, аргон або азот, що ген, краще, галоген; не містить кисню, і при потребі, у присутності кисv) Q являє собою водень або -NR4R5, де R4 та лоти, такої як, наприклад, 1N хлороводнева кислоR5 є, краще, воднем; та у діетиловому ефірі або подібної. Дана реакція vi) L являє собою -X-R3, де X є, краще, NR1, О може здійснюватись у температурних межах від 50 або S, найкраще, коли X є NH, і R3 є заміщеним до 250°С. фенілом, де кращими замісниками є С 1-6алкіл, га 17 70966 18 У цьому і наступних способах одержання реакційні продукти можуть бути виділені з даного реакційного середовища, і, при потребі, піддані додатковому очищенню згідно з методиками, що загалом відомі у даній галузі, такими як, наприклад, екстракція, кристалізація, перегонка, розтирання та хроматографія. Сполуки формули (l-а), де L являє собою радикал формули -NR1-R3, зазначені сполуки подані формулою (І-а-1), можуть бути одержані шляхом реакції проміжної сполуки формули (IV), де W2 є прийнятною відщеплюваною групою, такою, наприклад, як галоген або трифлат, з проміжною сполукою формули (V), за умов відсутності розчинника або у відповідному розчиннику, такому як, наприклад, етанол, 1-метил-2-піролідинон, Ν,Νдиметилформамід, 1,4-діоксан, тетрагідрофуран, диметилсульфоксид, тетралін, сульфолан, ацетонітрил і подібному, у інертній атмосфері, такій як, наприклад, аргон або азот, що не містить кисню, і при потребі, у присутності кислоти, такої як, наприклад, 1N хлороводнева кислота у діетиловому ефірі. Дана реакція може здійснюватись у температурних межах від 50 до 250°С. Сполуки формули (l-а), де L являє собою радикал формули -O-R3, зазначені сполуки подані формулою (І-а-2), можуть бути одержані шляхом реакції проміжної сполуки формули (IV), де W2 є прийнятною відщеплюваною групою, такою, наприклад, як галоген або трифлат, з проміжною сполукою формули (VI), у відповідному розчиннику, такому як, наприклад, 1,4-діоксан, диметилсу льфоксид, тетралін, сульфолан і подібному, у інертній атмосфері, такій як, наприклад, аргон або азот, що не містить кисню, і у присутності основи, такої як, наприклад, гідрид натрію, гідрид калію, гідроксид натрію або подібної. Дана реакція може здійснюватись у температурних межах від 50 до 250°С. Сполуки формули (l-а) можуть бути також одержані шляхом перетворення сполук формули (l-а) одна в іншу згідно з відомими у даній галузі реакціями перегрупування. Сполуки формули (l-а) можуть бути перетворені у відповідні N-оксидні форми у відповідності з відомими у даній галузі процедурами перетворення тривалентного азоту у його N-оксидну форму. Зазначена реакція N-окиснення може, загалом, здійснюватись шляхом реакції вихідного матеріалу формули (l-а) з відповідним органічним або неорганічним пероксидом. Відповідні неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних або лужноземельних металів, наприклад, пероксид натрію, пероксид калію; відповідні органічні пероксиди можуть включати над кислоти, такі як, наприклад, надбензойна кислота або галоїдозаміщена надбензойна кислота, наприклад, 3-хлоронадбензойна кислота, пероксиалканові кислоти, наприклад, надоцтова кислота, алкілгідропероксиди, наприклад, t.бутил гідропероксид. Придатними розчинниками є, наприклад, вода, нижчі спирти, наприклад, етанол і подібні, вуглеводні, наприклад, толуол, кетони, наприклад, 2-бутанон, галогеновані вуглеводні, наприклад, дихлорометан та суміші таких розчинників. Наприклад, сполуки формули (l-а), де Q являє собою галоген, можуть бути перетворені у відповідні сполуки, де Q являє собою -NR4H, з використанням NH2R4 як реагенту у реакційно інертному розчиннику, такому як, наприклад, 1,4-діоксан і 19 70966 20 подібному, при потребі, у присутності придатної ної хроматографії і подібних методів; і нарешті, основи, такої як, наприклад, триетиламін або Ν,Νперетворенням зазначених розділених діастереодіізопропілетиламін або подібної. У випадку, коли мерних солей або сполук у відповідні енантіомери. R4 містить гідрокси-складову, здійснити вищезаЧисті стереохімічно ізомерні форми можуть бути значену реакцію у зручний спосіб можна за допотакож одержані з чистих стереохімічно ізомерних могою захищеної форми NH2R4, де дана гідроксиформ відповідних проміжних продуктів та вихідних складова має придатну захисну гр упу Р, що є, наматеріалів за умови, що реакції, котрі відбуваютьприклад, триалкілсилільною групою, з наступним ся, здійснюються у стереоспецифічний спосіб. вилученням даної захисної групи згідно з відомими Альтернативний спосіб розділення енантіомеу даній галузі способами. рних форм сполук формули (l-а) та проміжних Деякі сполуки формули (l-а) та деякі проміжні продуктів включає рідинну хроматографію, зокрепродукти даного винаходу можуть містити асиметма, рідинну хроматографію з використанням хіраричний вуглецевий атом. Чисті стереохімічно ізольної стаціонарної фази. мерні форми зазначених сполук та зазначених Деякі з проміжних сполук та ви хідних матеріапроміжних продуктів можуть бути о тримані за долів є відомими сполуками, і вони є у продажу, або помогою застосування відомих у даній галузі споможуть бути одержані з використанням відомих у собів. Наприклад, діастереоізомери можуть бути даній галузі способів. розділені за допомогою фізичних методів, таких як Проміжні сполуки формули (II), де L являє соселективна кристалізація або хроматографічні бою -X-R3, зазначені проміжні сполуки подані фометоди, наприклад, протиточним розподілом, рірмулою (II-1), можуть бути одержані шляхом реакдинною хроматографією і подібними методами. ції піримідинової похідної формули (VII), де кожна Енантіомери можуть бути одержані із рацемічних W1 відповідає поданому вище визначенню, з HXR3 сумішей шляхом, по-перше, перетворення зазна(VIII) у інертному щодо реакції розчиннику, такому чених рацемічних сумішей за допомогою придатяк, наприклад, 1,4-діоксан, 2-пропанол або подібних агентів розщеплення, таких як, наприклад, ному, та у присутності такої основи як, наприклад, хіральні кислоти, у суміші діастереомерних солей триетиламін або Ν,Ν-діізопропілетиламін або поабо сполук; потім фізичного розділення зазначедібної. Можуть утворюватись різні регіоспецифічні них сумішей діастереомерних солей або сполук за ізомери, котрі можуть бути відокремлені один від допомогою, наприклад, селективної кристалізації одного з використанням відповідних методів розабо хроматографічних методів, наприклад, рідинділення, таких як, наприклад, хроматографія. Проміжні сполуки формули (IV) можуть бути одержані шляхом реакції проміжної сполуки формули (VII-а), де W2 є придатною відщеплюваною групою, такою як, наприклад, галоген, з проміжною сполукою формули (IX) у прийнятному розчиннику, такому як, наприклад, 1-метил-2-піролідинон, 1,4діоксан або подібному, у присутності кислоти, такої як, наприклад, 1N хлороводнева кислота у діетиловому ефірі. Дана реакція може проводитись у температурних межах від 50 до 250°С. Як альтернатива, проміжні сполуки формули (IV) можуть бути одержані шляхом реакції проміжної сполуки формули (X) з оксихлоридом фосфору, трифліновим ангідридом або його функціо нальною похідною в інертній атмосфері, такій як, наприклад, аргон або азот, що не містять кисню. Дана реакція може проводитись у температурних межах від 20 до 150°С. 21 70966 22 Проміжні сполуки формули (X) можуть бути одержані шляхом реакції проміжної сполуки формули (XI) або її функціональної похідної з проміжною сполукою формули (IX). Дана реакція може проводитись за умов відсутності розчинника або у такому відповідному розчиннику як, наприклад, диглім, тетралін або подібному в інерт ній атмосфері, такій як, наприклад, аргон або азот, що не містять кисню, та, при потребі, у присутності основи, такої як, наприклад, гідрид натрію, гідрид калію або подібної. Дана реакція може проводитись у температурних межах від 100 до 250°С. Проміжні сполуки формули (X) можуть бути також одержані шляхом реакції проміжної сполуки формули (XII), де W 2 є придатною відщеплюваною групою, a Y та Q відповідають визначенням для сполуки формули (l-а), з проміжною сполукою формули (XIII) у відповідному розчин нику, такому як, наприклад, етанол або подібному та у присутності основи, такої як, наприклад, етилат натрію або подібної, в інертній атмосфері, такій як, наприклад, аргон або азот, що не містять кисню. Дана реакція може проводитись у температурних межах від 20 до 125°С. Зручний спосіб одержання проміжної сполуки (IV), де Υ є атомом брому або хлору, зазначені проміжні продукти подані формулою (IV-1), включає уведення атому брому або хлору у проміжну сполуку формули (XIV), де W2 відповідає наведеному вище визначенню, з використанням N бромосукциніміду або N-хлоросукциніміду у такому інертному розчиннику як, наприклад, хлороформ, тетрахлорид вуглецю або подібному. Дана реакція може здійснюватись у температурних межах від 20 до 125°С. 23 70966 Подібно до перетворення сполук формули (lа), де Q являє собою галоген, у сполуки формули (l-а), де Q являє собою -NHR4, можна також перетворити й проміжні сполуки формул (II), (IV) та (VII). Сполуки формули (l-а), одержані за допомогою описаних вище способів, можуть бути синтезовані як суміш стереоізомерних форм, зокрема, у формі рацемічних сумішей енантіомерів, котрі можуть бути відокремлені один від одного з використанням відомих у даній галузі способів розщеплення. Рацемічні сполуки формули (l-а) можуть бути перетворені у відповідні діастереомерні сольові форми шляхом реакції з придатною хіральною кислотою. Потім зазначені діастереомерні сольові форми розділяють, наприклад, селективною або фракціонною кристалізацією, і зазначені енантіомери виділяють з них лугом. Альтернативний спосіб розділення енантіомерих форм сполук формули (l-а) включає рідинну хроматографію з використанням хіральної стаціонарної фази. Зазначені чисті стереохімічно ізомерні форми можуть бути також одержані з відповідних чистих стереохімічно ізомерних форм відповідних вихідних матеріалів, за умови, що дана реакція є стереоспецифічиою. Якщо потрібен специфічний стереоізомер, то краще, коли зазначену сполуку синтезують за допомогою стереоспецифічних методів приготування. У цих методах використовують, переважно, енантіомерно чисті вихідні матеріали. Як зрозуміло для фахівців у даній галузі, у процесах, що описані вище, може виникнути потреба блокування функціональних груп проміжних сполук за допомогою захисних груп. Функціональні групи, які бажано захистити, включають гідрокси, аміно та карбонову кислоту. Придатні захисні групи для гідрокси включають триалкілсилільні групи (наприклад, третбутилдиметилсиліл, трет-бутилди фенілсиліл або триметилсиліл), бензил та тетрагідропіраніл. Придатні захисні групи для аміно включають третбутилоксикарбоніл або бензилоксикарбоніл. Придатні захисні групи для карбонової кислоти включають С1-6алкіловий або бензиловий складні ефіри. Протектування та денротектування функціональних груп може проводитись до або після реакційної стадії. Застосування захисних гр уп детально викладено у роботах "Protective Groups in Organic Chemistry", ed. by J W F McOmie, Plenum Press (1973), та "Protective Groups in Organic Synthesis", 2nd edition, Τ W Green & Ρ G Μ Wutz, Wiley Interscience (1991). Сполуки формули (І) та (І-а) виявляють антиретровірусні властивості, зокрема, проти вірусу імунодефіциту людини (ВІЛ), що є етіологічним агентом синдрому набутого імунодефіциту (СНІД) у людей. ВІЛ-вірус переважно інфікує Т-4 клітини людини та руйнує їх або змінює їх нормальну функцію, зокрема, координацію імунної системи. В результаті, інфікований пацієнт має постійне зниження кількості Т-4 клітин, які все у більшій мірі виявляють аномальне функціонування. Таким чи 24 ном, імунологічна захисна система нездатна протистояти інфекціям та пухлинам, і ВІЛ-інфікований суб'єкт звичайно вмирає від умовно-патогенних інфекцій, таких як пневмонія, або від раку. Інші захворювання, пов'язані з ВІЛ-інфекцією, включають тромбоцитопенію, саркому Капоші та інфекцію центральної нервової системи, що характеризується прогресуючою демієлінізацією, котра призводить до деменції та таких симптомів як прогресуюча дизартрія, атаксія та дезорієнтування. Крім того, ВІЛ-інфекція асоціюється також з периферичною невропатією, прогресуючою поширеною лімфаденопатією та комплексом, пов'язаним зі СНІД. Сполуки даного винаходу виявляють також активність проти ВІЛ-1 штамів, що набули резистентність до відомих у даній галузі ненуклеозидних інгібіторів зворотної транскриптази. Вони також мають низьку зв'язувальну спорідненість або її відсутність щодо a-1 кислотного глікопротеїду людини. Завдяки своїм антиретровірусним властивостям, зокрема анти-ВІЛ властивостям, особливо своїй анти-ВІЛ-1-активності, сполуки формули (І) або (І-а), їх N-оксиди, фармацевтично прийнятні солі приєднання, четвертинні аміни та стереохімічно ізомерні форми придатні для лікування суб'єктів, інфікованих ВІЛ, та для профілактики даних інфекцій. Загалом, сполуки даного винаходу можуть бути корисними у лікуванні теплокровних тварин, що інфіковані вірусами, існування яких опосередковане або залежить від ферментної зворотної транскриптази. Захворювання, яким можна запобігти або які можна лікувати за допомогою сполук даного винаходу, особливо стани, що пов'язані з ВІЛ та іншими патогенними ретровірусами, включають СНІД, комплекс, пов'язаний зі СНІД, прогесуючу поширену лімфаденопатію, так само як і хронічні захворювання центральної нервової системи, зумовлені ретровірусами, такі як, наприклад, опосередкована ВІЛ деменція та розсіяний склероз. Таким чином, сполуки даного винаходу або будь-якого його варіанту можуть використовуватись як ліки для лікування вищезазначених станів. Таке використання даних сполук як ліків або способу лікування включає систематичне призначення ВІЛ-інфікованим суб'єктам ефективної кількості ліків для протистояння захворюванням, що пов'язані з ВІЛ та іншими патогенними ретровірусами, особливо ВІЛ-1. Сполуки даного винаходу або будь-якого його варіанту можуть бути скомпоновані у різноманітні фармацевтичні форми терапевтичного призначення. Придатними композиціями можуть слугува ти всі композиції, що звичайно використовуються для систематично призначаємих ліків. Для приготування фармацевтичних композицій даного винаходу ефективн у кількість даної сполуки, як активний інгредієнт, при потребі у формі солі приєднання, комбінують у суміш з фармацевтично прийнятним носієм, де зазначений носій може мати широкий різновид форм, у залежності від форми препарату, що потрібна для застосування. Ці фармацевтичні композиції бажано мати у вигляді 25 70966 26 уніфікованих доз, що придатні, зокрема, для орадві циклодекстринові гідроксигрупи є етерифіковального, ректального, підшкірного призначення або ні різними групами, такими як, наприклад, гідродля введення шляхом парентеральної ін'єкції. Наксипропіл та гідроксиетил. приклад, при приготуванні композицій у формі Мірою середнього числа молей алкокси одиоральних доз може застосовуватись будь-яке звиниць на моль ангідроглюкози слугує середнє мочайне фармацевтичне середовище, таке як, налярне заміщення (M.S.). Середній ступінь заміприклад, вода, гліколі, олії, спирти і подібне, у вищення (D.S.) стосується середнього числа падку таких рідких оральних препаратів як суспезії, заміщених гідроксилів на ангідроглюкозну одинисиропи, еліксири, емульсії та розчини; або тверді цю. Величини M.S. та D.S. можуть бути визначені носії, такі як крохмалі, цукри, каолін, розріджувачі, за допомогою різних аналітичних методів, таких як мастила, зв'язуючі речовини, дезінтегратори і таке ядерний магнітний резонанс (ЯМР), масподібне у випадку порошків, пілюль, капсул та спектроскопія (МС) та інфрачервона спектроскопія таблеток. Завдяки легкості уживання, таблетки та (ІЧ-спектроскопія). У залежності від застосованого капсули є найбільш придатними формами уніфікометоду, для даної циклодекстринової похідної мованих доз орального застосування, де використожуть бути отримані у деякій мірі відмінні значення. вуються тверді фармацевтичні носії. Для парентеЗа даними мас-спектроскопії M.S. варіює, переваральних композицій даний носій звичайно включає жно, від 0,125 до 10 a D.S. від 0,125 до 3. стерильну воду, принаймні у значній своїй частині, Інші композиції, придатні для орального або хоча можуть бути включені й інші інгредієнти, наректального застосування, включають частинки, приклад, для поліпшення розчинності. Розчини що одержують екструзією із розплаву суміші, котра для ін'єкцій можуть бути виготовлені, наприклад, у включає сполуку формули (I-а) та відповідний розтакий спосіб, що вони містять фізіологічний розчинний у воді полімер, з наступним розмелюванчин, розчин глюкози або суміш фізіологічного розням зазначеної екструдованої з розплаву суміші. чину та розчину глюкози. Суспензії для ін'єкцій Потім дані частинки можуть бути скомпоновані за можуть готуватись також з використанням відповідопомогою звичайних способів у фармацевтичні дних рідких носіїв, суспендуючи х агентів і подібнодозові форми, такі як таблетки та капсули. го. Сюди включені також препарати у вигляді твеЗазначені частинки складаються із твердої дирдих форм, котрі, як мається на думці, сперсії, що містить сполуку формули (І-а) та один безпосередньо перед уживанням переводять у або більше фармацевтично прийнятних розчинних рідкі препарати. У композиціях, котрі призначені у воді полімерів. Спосіб для приготування твердих для підшкірного введення, даний носій, при потредисперсій, якому віддається перевага, являє собі, включає агент, що поліпшує проникнення пребою екструзію із розплаву, що включає наступні парату, та/або прийнятний змочувальний агент, стадії: поєднані, при потребі, з прийнятними добавками а) змішування сполуки формули (І-а) та відпобудь-якої природи у незначних пропорціях, які не відного розчинного у воді полімеру, завдають значної шкоди шкірі. Такі добавки моб) при потребі, введення добавок та їх змішужуть полегшити введення препарату та/або бути вання з одержаною у такий спосіб сумішшю, корисними для приготування потрібних композив) нагрівання отриманої у такий спосіб суміші цій. Дані композиції можуть уводитись різними до одержання гомогенного розплаву, способами, наприклад, як трансдермальні бляшки, г) продавлювання одержаного у такий спосіб у вигляді плями, як мазь. розплаву через одну або кілька філь'єр; та З метою поліпшення розчинності сполук форд) охолодження даного розплаву до його твемули (І-а) у дані композиції можуть бути включені рдіння. придатні інгредієнти, наприклад, циклодекстрини. Отриманий твердий дисперсний продукт розмелюють або подрібнюють на частинки, розмір Такими циклодекстринами є a-, b-, gяких складає менше 1500мкм, краще, менше циклодекстрини або їх прості ефіри та змішані 400мкм, ще краще, менше 250мкм, і найкраще, ефіри, де одна або більше гідроксигруп ангідроглюкозних одиниць даного циклодекстрину заміщеменше 125мкм. Розчинні у воді полімери у даних частинках є ні С1-6алкілом, зокрема, метилом, етилом або ізополімерами з уявною в'язкістю при розчиненні при пропілом, наприклад, довільно метильований b20°С у водному розчині при 2% (вага/об'єм) 1-5000 циклодекстрин; гідроксиС 1-6алкілом, зокрема, гідмПа.с, краще, 1-700мПа.с, і найкраще, 1-100мПа.с. роксиетилом, гідроксипропілом або гідроксибутиНаприклад, придатні розчинні у воді полімери лом; карбоксиС1-6алкілом, зокрема, карбоксиметивключають алкілцелюлози, гідроксиалкілцелюлолом або карбоксиетилом; С1-6алкілкарбонілом, зи, гідроксиалкіл алкілцелюлози, карбоксиалкілцезокрема, ацетилом. Особливо помітними як комлюлози, солі лужних металів карбоксиалкілцелюплексоутворювачі та/або солюбілізатори є bлоз, карбоксиалкілалкілцелюлози, циклодекстрин, довільно метильований bкарбоксиалкілцелюлозні ефіри, крохмалі, пектини, циклодекстрин, 2,6-диметил-b-циклодекстрин, 2хітинові похідні, полісахариди, поліакрилові кислогідроксиетил-b-циклодекстрин, 2-гідроксиетил-gти та їх солі, поліметакрилові кислоти та їх солі і циклодекстрин, 2-гідроксипропіл-g-циклодекстрин ефіри, метакрилат-сополімери, полівініловий та (2-карбоксиметокси)пропіл-b-циклодекстрин, і, спирт, поліалкіленові оксиди та сополімери етилезокрема, 2-гідроксипропіл-b-циклодекстрин (2-НРноксиду та пропіленоксиду. Водорозчинними поліb-циклодекстрин). мерами, яким віддається перевага, є Eudargit ΕÒ Під виразом змішаний простий ефір маються (Rohm Gmbh, Germany) та гідроксипропілметилцена думці похідні циклодекстрину, у яких принаймні люлози. 27 70966 28 Крім того, при приготуванні вищезазначених чну композицію, де сполуки формули (І-а) уведені частинок як водорозчинні полімери можуть виков гідрофільні полімери, і цю суміш наносять як ристовуватись один або більше циклодекстринів, плівку покриття на множину невеликих гранул, що як це розкрито у WO 97/18839. Зазначені циклодедає композицію, котру зручно виготовляти, і котра кстрини включають фармацевтично прийнятні непридатна для приготування фармацевтичних дозаміщені та заміщені циклодекстрини, що відомі у зових форм для орального застосування. Зазначені гранули включають центральне, даній галузі, більш конкретно, a-, b- або gциклодекстрини, або їх фармацевтично прийнятні скруглене або сферичне ядро, плівку покриття із гідрофільного полімеру, сполук у формули (І-а) та похідні. захисне покриття з полімерного шару. Заміщені циклодекстрини, що можуть викорисМатеріалом ядра у цих гранулах можуть бути товуватись, включають поліефіри, описані у патерізноманітні матеріали, за умови, що вони є фарнті США №3459731. Циклодекстрини з подальшим ступенем заміщення являють собою прості ефіри, мацевтично прийнятними і мають відповідні розміри та твердість. Прикладами таких матеріалів слуде водень однієї або більше циклодекстринових гують полімери, неорганічні речовини, органічні гідроксигруп заміщений С 1-6алкілом, гідроксиС1речовини, сахариди та їх по хідні. карбоксиС1-6алкілом або С 16алкілом, Особливі переваги надає складання вищеза6алкілоксикарбонілС 1-6алкілом, або їх змішаними ефірами. Зокрема, такі заміщені циклодекстрини значених фармацевтичних композицій у вигляді уніфікованих дозових форм для полегшення їх являють собою прості ефіри, де водень однієї або застосування та однорідності дозування. Уніфікобільше циклодекстринових гідроксигруп заміщений вана дозова форма, як мається на думці в даному С1-3алкілом, гідроксиС 2-4алкілом або карбоксиС 1тексті, стосується фізично дискретних одиниць, що 2алкілом, або, зокрема, метилом, етилом, гідроксиетилом, гідроксипропілом, гідроксибутилом, придатні як одиничні дози, кожна одиниця містить попередньо визначену кількість активного інгредікарбоксиметилом або карбоксиетилом. єнта, розраховану на отримання бажаного терапеОсобливо корисними є b-циклодекстринові втичного ефекту, та необхідний фармацевтичний ефіри, наприклад, дим етил-b-циклодекстрин, як носій. Прикладами таких уніфікованих дозових це описано у роботі Drugs of the Future, Vol.9, №8, форм слугують таблетки (включаючи шорсткі табp.577-578 by M. Nogradi (1984), та поліефіри, налетки або таблетки з покриттям), капсули, пілюлі, приклад, гідроксипропіл b-циклодекстрин та гідропорошкові упаковки, облатки, супозиторії, розчини ксиетил b-циклодекстрин, наведені як приклади. для ін'єкцій і подібне, та кратні їм форми. Такий алкіловий ефір може бути метиловим ефіФахівці у галузі лікування ВІЛ-інфекції можуть ром зі ступенем заміщення приблизно від 0,125 до визначити ефективну добову кількість за резуль3, наприклад, від приблизно 0,3 до 2. Такий гідротатами тестів, що подані у даному тексті. Загалом, ксипропіл циклодекстрин може бути утворений, припускають, що ефективна добова кількість може наприклад, за реакцією між b-циклодекстрином та варіювати від 0,01мг/кг до 50мг/кг ваги тіла, краще, пропіленоксидом, і може мати значення M.S. у від 0,1мг/кг до 10мг/кг ваги тіла. Може виникнути межах 0,125-10, наприклад, 0,3-3. необхідність застосування потрібної дози у вигляді Більш новим типом заміщених циклодекстридвох, трьох, чотирьох або більше субдоз, що ужинів є суль фобутилциклодекстрини. ваються через відповідні проміжки часу протягом Співвідношення сполуки формули (І-а) та цикдоби. Зазначені субдози можуть складатись як лодекстрину може варіювати у широких межах. уніфіковані дозові форми, що містять, наприклад, Наприклад, придатними є співвідношення від від 1 до 1000мг, і зокрема, від 5 до 200мг активно1/100 до 100/1. Інтерес являють співвідношення го інгредієнта на таку уніфіковану дозову форму. активного інгредієнта та циклодекстрину у межах Точна схема дозування залежить від конкретприблизно 1/10 - 10/1. Більший інтерес являють ної сполуки формули (І) або (І-а), що застосовуспіввідношення активного інгредієнта та циклодекється, особливості та серйозності того стану, що стрину у межах приблизно 1/5 - 5/1. піддається лікуванню, віку, ваги та загального фіДодатковий інтерес викликає можливість комзичного стану конкретного пацієнта, так само як і понування сполук формули (І-а) у формі наночасвід інших лікарських препаратів, що може уживати тинок, котрі містять адсорбований на своїх поверданий пацієнт, як це добре відомо фахівцям у дахнях модифікатор поверхні у кількості, що ній галузі. Крім того, очевидно, що зазначена ефедостатня для збереження ефективного середнього ктивна добова кількість може бути знижена або розміру частинок на рівні нижче 1000нм. Як ввапідвищена, у залежності від реакції суб'єкта, що жають, придатні модифікатори поверхні включапіддається лікуванню, та/або рішення лікаря, який ють такі речовини, що фізично прилипають до попризначає сполуки даного винаходу. Тому зазнаверхні сполуки формули (І-а), але хімічно не чені вище інтервали ефективних добових кількосзв'язуються з даною сполукою. тей слугують лише орієнтиром, і як мається на Придатні модифікатори поверхні можуть видумці, ні в якій мірі не обмежують обсяг або застобиратись, переважно, з відомих органічних та несування даного винаходу. органічних фармацевтичних носіїв. Такі носії Крім того, як ліки може застосовуватись комбівключають різноманітні полімери, низькомолекунація будь-якої антиретровірусної сполуки та сполярні олігомери, природні продукти та поверхневолуки формули (І) або (І-а). Так, даний винахід таактивні речовини. Перевага віддається неіонним кож стосується продукту, що містить (а) сполуку та аніонним поверхневим модифікаторам. формули (І) або (І-а) та (б) іншу антиретровірусну Ще один спосіб компонування сполук формули сполуку як комбінований препарат для одночасно(І-а), який викликає інтерес, включає фармацевти 29 70966 30 го, роздільного або послідовного застосування при (3) (0,0028моль). Колбу, що обладнана конденсаанти-ВІЛ терапії. Різні ліки можуть бути скомбінотором, нагрівають до 80°С протягом 35 хвилин. вані у єдиний препарат разом з фармацевтично Даний матеріал швидко охолоджують на льоду, і прийнятними носіями. Зазначені інші антиретровіпісля витримки утворений в результаті осад збирусні сполуки можуть бути відомими антиретровірають та промивають водою (50мл). Зразок висурусними сполуками, такими як інгібітори нуклеозишують. Потім його частину піддають додатковому дної зворотної транскриптази, наприклад, очищенню методом колонкової хроматографії. зидовудін (3'-азидо-3'-деокситимідин, AZT), дидаЧисті фракції збирають, і розчинник випарюють, нозін (дидеокси інозин; ddl), залцитабін (дидеоксищо дає 4-[(4,5-ди хлоро-2цитидин, ddC) або ламівудін (3'-тіа-2'-3'піримідиніл)аміно]бензонітрил (проміжна сполука дидеоксицитидин, ЗТС) і подібні; інгібітори ненук4). леозидної зворотної транскриптази, такі як сурав) Суміш проміжної сполуки (4) (0,0132моль) у мін, пентамідин, тимопентин, кастаноспермін, дектетрагідрофурані (75мл) та СН2СI2 (10мл) перемістран (декстран сульфат), натрій-фоскарнет шують протягом 15 хвилин. Повільно додають со(тринатрій фосфоно форміат), невірапін (11ляну кислоту у діетиловому ефірі, і суміш переміциклопропіл-5,11-дигідро-4-метил-6Н-дипіридо[3,2шують протягом 5 хвилин. Після вилучення b : 2',3'-е][1,4]діазепін-6-он), такрин (тетрагідроамірозчинника під зниженим тиском одержують 3,98г ноакридин) і подібні; сполуки ТІВО (тетрагідро4-[(4,5-дихлоро-2-піримідиніл)аміно]бензонітрил імідазо[4,5,1-jk][1,4]-бензодіазепін-2(1H)-он та тімоногідрохлориду (проміжна сполука 5). он)-типу, наприклад, (S)-8-хлоро-4,5,6,7Приклад A3 тетрагідро-5-метил-6-(3-метил-2-бутеніл)імідазоа) 2,4,5,6-тетрахлоропіримідин (0,0134моль), 1,4-діоксан (30мл), 2,4,6-триметил анілін [4,5,1-jк][1,4]бензодіазепін-2(1Н)-тіон; сполуки a(0,0134моль) та N,N-біс(1-метилетил)етанамін АРА (a-анілінофеніл ацетамід) типу, наприклад, a(0,0136 моль) вводять у колбу під аргоном та пе[(2-нітрофеніл)аміно]-2,6-дихлоробензол-ацетамід ремішують при 55°С протягом 16 годин. Розчинник і подібні; ТАТ-інгібітори, наприклад, RO-5-3335 і випарюють, і залишок розчиняють у СН 2СI2, потім подібні; інгібітори протеази, наприклад, індинавір, очищають методом колонкової хроматографії на ритановір, сакиновір і подібні; або імуномодулюючі силікагелі (елюент: СН2СI2/гексан 1/4, та 1/2). Поагенти, наприклад, левамізол і подібні. Сполука трібні фракції збирають, і їх розчинник випарюють, формули (І) або (I-а) може також комбінуватись з що дає 0,15г 4,5,6-трихлоро-N-(2,4,6іншою сполукою формули (І) або (I-а). Наступні триметилфеніл)-2-піримідинаміну (проміжна споприклади мають на меті проілюструвати даний лука 6) та 3,15г 2,5,6-трихлоро-N-(2,4,6винахід. триметилфеніл)-4-піримідинаміну (проміжна споЕкспериментальна частина лука 7). А. Одержання проміжних сполук б) Суміш проміжної сполуки (7) (0,00474моль) Приклад А1 у NH3, (2,0 Μ у 2-пропанолі; 20мл) нагрівають в Реакція проводиться в атмосфері аргону. Розавтоклаві при 75-80°С протягом 40 годин. Темпечин 2,4,6-триметилбензоламіну (0,00461моль) у ратур у підвищують до 110-115°С. Розчинник випа1,4-діоксані (5мл) додають до розчину 5-броморюють з одержанням 1,85г залишку. Даний зразок 2,4-дихлоропіримідину (0,00439моль) у 1,4-діоксані нагрівають з ΝΗ 3 (0,5Μ у 1,4-діоксані; 20мл) при (5мл). Додають N,N-біс(1-метилетил)етанамін 125°С протягом 18 годин. Розчинник випарюють, (0,00548моль). Реакційну суміш перемішують та що дає 1,7г суміші двох ізомерів, тобто 2,5нагрівають із оберненим холодильником протягом дихлоро-N4-(2,4,6-триметилфеніл)-4,620 годин. Розчинник випарюють. Залишок розчипіримідиндіаміну (проміжна сполука 8) та 5,6няють в етилацетаті, промивають насиченим воддихлоро-N4-(2,4,6-триметилфеніл)-2,4ним розчином бікарбонату натрію, водою та розпіримідиндіаміну (проміжна сполука 9). солом, осушують суль фатом натрію, фільтрують, і Приклад А4 розчинник випарюють. Залишок очищають метоа) Суміш 4-[(1,4-дигідро-4-оксо-2дом колонкової хроматографії на силікагелі (елюпіримідиніл)аміно]бензонітрилу, (0,12моль) у РОент: 1:5, 1:2 та 1:1 СН2СI2:гексан). Дві чисті фракСІ3 (90мл) перемішують та нагрівають із обернеційні групи збирають, і їх розчинник випарюють, що ним холодильником під аргоном протягом 20 хвидає 0,35г (24%) 5-бромо-4-хлоро-N-(2,4,6лин. Дану реакційну суміш повільно виливають на триметилфеніл)-2-піримідинаміну (проміжна спо750мл лід/вода, і тверду речовину відокремлюють лука 1) та 0,93г (65%) 5-бромо-2-хлоро-N-(2,4,6шляхом фільтрації. Дану тверду речовину суспентриметилфеніл)-4-піримідинаміну (проміжна сподують у 500мл води, і шля хом додавання 20% лука 2). розчину NaOH pH даної суспензії доводять до Приклад А2 нейтрального рівня. Дану тверду речовину знову а) 4-гідрокси-5-хлоро-2-метилтіопіримідин відокремлюють шляхом фільтрації, суспендують у (0,0156моль) та 4-амінобензонітрил (0,078моль) 200мл 2-пропанону і додають 1000мл СН2СI2. Дану поєднують у вигляді розплаву та перемішують при суміш нагрівають до повного розчинення всієї тве180-200°С протягом 6 годин. Реакційну суміш о хордої речовини. Після охолодження до кімнатної лоджують та розтирають послідовно з киплячим температури водний шар відокремлюють, і органіСН2СI2 та CH3CN для одержання сполуки 95% чичний шар висушують. У процесі вилучення осушустоти, котру висушують, що дає 1,27г (33%) 4-[(5вального агента шляхом фільтрації у фільтраті хлоро-4-гідрокси-2-піримідиніл)аміно]бензонітрилу утворилась біла тверда речовина. В результаті (проміжна сполука 3; Тпл.>300°С). подальшого охолодження даного фільтрату у моб) РОСІ3 (10мл) додають до проміжної сполуки 31 70966 32 розилці з наступною фільтрацією одержують ного розчину додають НСІ у діетиловому ефірі 21,38г (77,2%) 4-[(4-хлоро-2(1М; 0 ,00855моль). Даний розчин випарюють, і піримідиніл)аміно]бензонітрилу (проміжна сполука додають 1,4-діоксан (20мл). Нарешті, додають 410). амінобензонітрил (0,00291моль) та 1,4-діоксан б) Проміжну сполуку (10) (0,005моль), 1(15мл), і дану реакційну суміш перемішують та бромо-2,5-піролідиндіон (0,006моль) та трихлоронагрівають із оберненим холодильником протягом метан (10мл) поєднують у герметизованій пробірці семи днів. Розчинник випарюють, залишок розчита нагрівають при 100°С протягом ночі. Дану реакняють у СН 2СI2, промивають 1М NaOH, і розчинник ційну суміш охолоджують до кімнатної температувипарюють. Даний залишок розчиняють у СН 2СI2 ри. Додають силікагель (2г), і розчинник випарю(10мл), і осад відфільтровують та висушують, що ють. Залишок очищають методом колонкової дає 0,15г (13%) 4-[(5-бромо-4-[(2,4,6флеш-хроматографії на силікагелі (елюент: триметилфеніл)аміно]-2СН2СI2/гексани 9/1). Чисті фракції збирають, і розпіримідиніл]аміно]бензонітрилу (сполука 3). чинник випарюють, що дає 1,31г (84,5%) 4-[(5Приклад В2 бромо-4-хлоро-2-піримідиніл)аміно]бензонітрилу а) 3:1 суміш проміжної сполуки (8) та проміж(проміжна сполука 11). ної сполуки (9) (одержаної як у прикладі А3б) і 4Приклад А5 амінобензонітрилу (0,01422моль) нагрівають у У колбу під аргоном уводять 4-аміно-2,5,6автоклаві при 180°С протягом 5 годин. Даний зратрихлоропіримідин (0,08564моль), 4-амінозок розподіляють між СН2СI2 та розведеним бензонітрил (0,1071моль), 1-метил-2-піролідинон NaHCО3, осушують над К2СО3, фільтрують та ви(17мл) та соляну кислоту у діетиловому ефірі (1М; парюють. Додають при перемішуванні CH3CN, і 85,6мл). Дану суміш помішують на масляну баню утворений в результаті осад вилучають фільтраціпри 130°С під струменем азоту до випарювання єю. Фільтрат додатково очищають методом висоефіру. Додають додаткові 10мл 1-метил-2коефективної рідинної хроматографії з оберненою піролідинону. Дану суміш нагрівають при 145°С фазою. Чисті фракції збирають, і розчинник випапротягом 16 годин під аргоном. Додають 1,4рюють, що дає 0,17г 4-[(4-аміно-5-хлоро-6-[(2,4,6діоксан. Суміш нагрівають із оберненим холодильтриметилфеніл)аміно]-2ником, охолоджують, потім відфільтровують. Фільпіримідиніл]аміно]бензонітрил трифтороацетату трат випарюють. Залишок розчиняють у СН 2СI2, (1:1) (сполука 4). промивають 1N NaOH, потім фільтрують. Тверду Приклад В3 речовину розчиняють у 2-пропаноні, випарюють на НСІ у діетиловому ефірі (1М; 0,0045моль) досилікагель та піддають хроматографії з викорисдають до суспензії проміжної сполуки (4) танням 1-3% 2-пропанону у гексані як елюенту. (0,003моль) у 1,4-діоксані (5мл), перемішують під Чисті фракції збирають, і розчинник випарюють, аргоном у пробірці, що може бути герметизована. що дає 1,63г (6,8%) 4-[(4-аміно-5,6-дихлоро-2Дану суміш підігрівають для випаровування діетипіримідиніл)аміно]бензонітрилу (проміжна сполука лового ефіру, і додають 2,4,6-триметилбензоламін 12). (0,009моль). Пробірку герметизують, і реакційну В. Одержання кінцевих сполук суміш нагрівають до 150°С протягом 12 годин. ДаПриклад В1 ну реакційну суміш охолоджують до кімнатної тема) У колбу під аргоном, що містить проміжну ператури. Послідовно додають силікагель (2,2г) та сполуку (1) (0,00107моль), додають ефір. До даноСН3ОН (50мл). Після випаровування розчинника го гомогенного розчину додають НСІ/діетиловий залишок очищають методом флеш-хроматографії ефір (1М; 0,00109моль). Даний розчин випарюють, (градієнт елюювання: СН2СI2:СН3ОН:NH4OH і додають 1,4-діоксан (35мл) та 4-амінобензонітрил 99,5:0,45:0,05 до 99:0,9:0,1). Чисті фракції збира(0,00322моль). Залишок розчиняють у СН 2СI2, ють, і розчинник випарюють. Залишок висушують, промивають насиченим розчином бікарбонату нащо дає 0,80г (73,4%) 4-[(5-хлоро-4-[(2,4,6трію, висушують, фільтрують, і розчинник випатриметилфеніл)аміно]-2рюють з утворенням 0,79г масла бурштинового піримідиніл]аміно]бензонітрилу (сполука 5). кольору. Дане масло піддають очищенню методом Приклад В4 високоефективної рідинної хроматографії з оберСуміш проміжної сполуки (5) (0,0025моль) та неною фазою. Потрібні фракції збирають, і роз2,6-дибромо-4-метилбензоламіну (0,0075моль) у чинник випарюють з утворенням залишків 1 та 2. 1,3-діоксаиі (5,0мл) у загерметизованій пробірці в Залишок 1 очищають методом колонкової хромаатмосфері аргону нагрівають та перемішують при тографії на силікагелі (елюент: 0 та 2% 160°С протягом 16 годин. Дану реакційну суміш СН3ОН:СН2СI2). Чисті фракції збирають, і розчинконцентрують шляхом роторного випарювання на ник випарюють, що дає 0,0079г (2,0%) 4-[(5-хлоросилікагель (2,0г). Одержаний матеріал очищають 2-[(2,4,6-триметилфеніл)аміно]-4методом флеш-хроматографії (елюент: 1:1 гексапіримідиніл]аміно]бензонітрилу (сполука 1). ни:СН2СI2; чистий СН 2СI2; 0,5%, 1% (10% NH4OH у Залишок 2 очищають методом колонкової СН3ОН) у СН2СI2 до 90% чистоти. В результаті хроматографії на силікагелі (елюент: 0 та 2% перекристалізації одержали 0,15г (12,2%) 4-[(5СН3ОН:СН2СI2). Чисті фракції збирають, і розчинхлоро-4-[(2,6-дибромо-4-метилфеніл)аміно]-2ник випарюють, що дає 0,0044г (1,0%) 4-[(5-бромопіримідиніл]аміно]бензонітрилу (сполука 10; 95% 2-](2,4,6-триметилфеніл)аміно]-4чистоти). піримідиніл]аміно]бензонітрилу (сполука 2). Приклад В5 б) У колбу, що містить проміжну сполуку (2) У пробірці, що може бути герметизована, в (0,00285моль), додають ефір. До даного гомогенатмосфері аргону до суспензії 2,4,6 33 70966 34 триметилфенолу (0,0075моль) у 1,4-діоксані (5мл) вали у вакуумі при 65°С протягом 18 годин. Вихід: додають NaH (0,0075моль; 60% суспензія у маслі). 0,33г (13%, біла тверда речовина); Тпл. 185-190°С Дану суміш перемішують протягом 15 хвилин, і (сполука 59). додають проміжну сполуку (4) (0,0025моль). Пробірку герметизують, і реакційну суміш нагрівають до 150°С протягом 15 годин. Дану реакційну суміш охолоджують до кімнатної температури. Після додання силікагелю (2,0г) розчинник випарюють. Залишок очищають методом флеш-хроматографії на силікагелі (градієнт елюювання: СН2СI2:гексани 9:1 до 100:0; потім СН 2СI2:СН3ОН:NH4OH 100:0:0 до 97:2,7:0,3). Чисті фракції збирають, і розчинник в) Реакція під струменем аргону. NaH 60% випарюють. Залишок висушують, що дає 0,73г (0,00600моль) розмішують у тетрагідрофурані (80,2%) 4-[(5-хлоро-4-[(2,4,6-триметилфенокси)-2(20мл). Додають сполуку (17) (0,00476моль), і супіримідиніл]аміно]бензонітрилу (сполука 6). міш перемішують протягом 15 хвилин. Додають Приклад В6 хлорометил-2,2-диметилпропаноат (0,00600моль), а) У пробірці, що може бути герметизована, в і дану реакційну суміш перемішують протягом 16 атмосфері аргону до суспензії 4-гідрокси-3,5годин при кімнатній температурі, потім перемішудиметилбензонітрилу (0,003моль) у 1,4-діоксані ють та нагрівають із оберненим холодильником (3мл) додають NaH, 60% суспензія у маслі протягом 4,5 годин, потім охолоджують. Додають (0,003моль), та 1-метил-2-піролідинон (3мл). Після тетрагідрофуран (20мл). Додають NaH 60% виділення Н 2 додають проміжну сполуку (11) (0,00600моль) та хлорометил-2,2(0,001моль). Пробірку герметизують, і реакційну диметилпропаноат (0,00600 моль), і утворену в суміш нагрівають до 160°С протягом 16 годин. Дарезультаті реакційну суміш перемішують протягом ну суміш о холоджують до кімнатної температури, 24 годин. Розчинник випарюють. Залишок розчипереносять у хімічний стакан та розводять метаняють у СН2СI2, промивають водою, і розчинник нолом (20мл). По краплях додають воду (200мл). випарюють. Залишок очищають методом колонкоДану водну суміш екстрагують СН 2СI2 /СН3ОН вої хроматографії на силікагелі (елюент: 90/10 (3х300мл). Органічний шар відокремлюють, СН2СI2/СН3ОН 100/0 та 99,5/0,5). Потрібні фракції висушують, фільтрують та адсорбують на силіказбирають, і розчинник випарюють. Залишок очигель (1г). Розчинник випарюють, і залишок очищащають на Gilson. Дану фракцію кристалізують із 2ють методом колонкової флеш-хроматографії на пропанолу, відфільтровують та висушують. Вихід: силікагелі (елюент: СН2СI2/CH3OH/NH4OH від 0,60г (23,6%., біла тверда речовина) (сполука 60). 100/0/0 до 98,1/1,8/0,2). Потрібні фракції збирають, і розчинник випарюють. Залишок розтирають з гарячим CH3CN, відфільтровують, потім висушують, що дає 0,20г (47,6%) 4-[[5-бромо-4-(4-ціано2,6-диметилфенокси)-2піримідиніл]аміно]бензонітрилу (сполука 17). б) n-бутиллітій (0,010моль) додають до розчину N-(1-метилетил)-2-пропанаміну (0,010моль) у тетрагідрофурані (250мл) та перемішують при 0°С. Після перемішування при зазначеній температурі протягом 30 хвилин додають сполуку (17) (0,005моль). Утворену в результаті суміш переміг) Суспензію сполуки (17) (0,0020моль) у те тшують при цій температурі протягом 15 хвилин, і у рагідрофурані (40мл) обробляють однією порцією цей момент додають етил 2-бромоетаноат 0,24г NaH. Пінливу суміш перемішують протягом 2 (0,015моль), і температур у підвищують до кімнатгодин до утворення яскраво-жовтої суспензії. Гоної. Дану реакційну суміш перемішують протягом тують розчин 2,2'-оксибісацетил хлориду 16 годин, що забезпечує 50% завершення реакції. (0,020моль) у тетрагідрофурані (10мл) та охолоСуміш піддають гасінню 0,5мл Η2Ο та концентруджують на льодяній бані. Утворену в результаті ють шляхом роторного випарювання на силікаА/В суспензію переносять через канюлю по крапгель, і очищають методом флеш-хроматографії лях у холодний розчин 2,2'-оксибісацетил хлориду (Biotage Flash 40M, елюювання 0, 0,5, 1% (10% на протязі 10 хвилин. Дан у суміш підігрівають до NH4OH у СН3ОН) у СН2СI2) з утворенням білої кімнатної температури та перемішують на протязі твердої речовини, що являє собою 1:1 вихідний 3 днів. Додають ще одну порцію 0,24г NaH, і через матеріал А:продукт. Кінцева очистка досягалась 2 дні дану реакційну суміш охолоджують на льометодом препаративної високоефективної рідиндяній бані та обробляють по краплях сумішшю ної хроматографії шляхом елюювання у пробірки, метанолу (0,150моль) та Ν,Ν-діетилетанаміну що містили 1ммоль NaHCО3. Ліофілізований ма(0,150моль) протягом 30 хвилин. Дану реакційну теріал розчиняли у суміші вода/СН 2СI2 (1:1 (загасуміш підігрівають до кімнатної температури і челом, 50мл) та розділяли. Водну фазу екстрагували рез 16 годин виливають у ефір та екстрагують наще 2 рази 25мл СН 2СI2. Органічні шари поєднувасиченим NaHCО3. Водну фракцію екстрагують 2 х ли та осушували над сульфатом натрію, фільтруефіром, і об'єднані ефірні екстракти промивають вали та піддавали роторному випарюванню до зворотним струменем 3 х води та осушують над утворення білої твердої речовини, котру висушу 35 70966 36 MgSO4 . В результаті концентрування одержали 155-160°С при перемішуванні протягом 1,5 днів. 2,91г маслянистого залишку, котрий піддавали Суміш охолоджують до кімнатної температури, очищенню методом препаративної високоефектипотім обробляють методом колонкової флешвної рідинної хроматографії з оберненою фазою. В хроматографії на силікагелі (елюент: СН2СI2). результаті ліофілізації відповідях фракцій одержаОчистку завершують методом препаративної вили 0,16г речовини у вигляді бежевого порошку сокоефективної рідинної хроматографії, що дає (вихід очи щеного продукту 14,5%) (сполука 61). 0,05г 4-[[(5-бромо-4,6-хлоро-6-[(4-ціано-2,6диметилфеніл)аміно]-2піримідиніл]аміно]бензонітрилу (5,0%); Тпл. 259260°С (сполука 42). Приклад В10 До розчину 4-[[(5-бромо-4,6-дихлоро)-2піримідиніл]аміно]бензонітрилу (0,00218моль) у 1,4-діоксані (10мл) послідовно додають 2,4,6триметилбензоламін (0,0022моль) та Ν,Νді(метилетил)етанамін (0,0024моль). Пробірку герметизують, і дану суспензію нагрівають до 120130°С на масляній бані при перемішуванні протяПриклад В7 гом 90 годин. Суміш охолоджують до кімнатної В автоклав в атмосфері аргону вводять промітемператури. Додають ще одну порцію N,Nжну сполуку 12 (0,00286моль), 4-ціано-2,6ді(метилетил)етанаміну (15мл), і суміш знову надиметиламін (0,00571моль), 1М НСІ у діетиловому грівають до 120-130°С протягом 64 годин. Реакцію ефірі (0,00140моль) та 1,4-діоксан (8мл). Реакційпідтримують при 150°С протягом 6 днів. Суміш ну суміш нагрівають на масляній бані під струмеохолоджують до кімнатної температури. Розводять нем азоту до випаровування всіх розчинників. Доетилацетатом та екстрагують холодним 1М NaOH. дають 1-метил-2-піролідинон (3мл), і реакційну Водну фаз у промивають зворотним струменем суміш нагрівають при 220-240°С протягом 3 годин. етилацетатом. Об'єднані органічні фази висушуНагрівання продовжують при 210-220°С протягом ють та концентрують. Проводять колонкове флеш6 годин. Залишок розчиняють у 1,4-діоксані, випахроматографування на силікагелі (елюент: рюють, розподіляють між СН 2СI2 та 1N NaOH, фіСН2СI2). Зразок додатково очищають методом льтрують, осушують органічні шари за допомогою препаративної високоефективної рідинної хромакарбонату калію та випарюють. Потрібну сполуку тографії з виходом 0,53г 4-[[5-бромо-4-хлоро-6виділяють та очищають методом препаративної [(2,4,6-триметилфеніл)аміно]-2хроматографії з оберненою фазою. Чисті фракції піримідиніл]аміно]бензонітрилу (54,9%); Тпл. 220збирають, і розчинник випарюють, що дає 0,0165г 221°С (сполука 41). (1,1% після ліофілізації) 4-[[4-аміно-5-хлоро-6-[(4Приклад 11 ціано-2,6-диметилфеніл)аміно]-2Суміш 4-амінобензоиітрилу (0,0043моль) та піримідиніл]аміно]бензонітрил трифтороацетату (1:1) (сполука 19). Приклад В8 Суміш проміжної сполуки (11) (0,0011моль), 2,6-димстил-4-(2-пропіл)бензоламиіну (0,0011моль), N,N,N’,N’-тетраметил-1,8нафталіндіаміну (0,0022моль) та 1М НСІ у ефірі (2,3мл) (0,0023моль) у 1,4-діоксані (25мл) перемішують та нагрівають до 95°С протягом 16 годин. (0,0021моль) у 1,4-діоксані (30мл) перемішуРозчинник вилучають шляхом роторного випарюють при 100°С протягом 16 годин. Розчинник вивання, і залишок очищають методом препаративлучають шляхом роторного випарювання. Твердий ної високоефективної рідинної хроматографії з залишок розтирають, і даний залишок висушують у оберненою фазою. Об'єднані фракції, що містять вакуумі при 40°С протягом 16 годин, що дає 0,452г потрібний матеріал, ліофілізують, що дає 0,23г продукту (55%); Тпл.>300°С (сполука 43). (48%) продукту; Тпл. 198-201°С (сполука 40). Приклад В9 N,N-ді(метилетил)етанамін (0,0024моль) додають до 4-аміно-2,5-диметил-3,4-бензонітрилу (0,00219моль) та 4-[[(5-бромо-4.6-дихлоро)-2піримідиніл]аміно]бензонітрилу (0,00218моль). Реакційну склянку герметизують та нагрівають до Приклад В12 В автоклав уводять 37 70966 38 охолоджують на льоду. В результаті фільтрації одержали 0,19г 4-[[5-бромо-4-(4-ціано-2,6диметилфенокси)-6-[(1-піролідиніл)етиламіно]-2піримідиніл]аміно]бензонітрил гідрохлориду (1:1) (50,6%); Тпл. 208-210°С (сполука 47). Приклад В16 В автоклав уводять 4-[[5-бромо-4-(4-ціано-2,6диметилфенокси)-6-хлоро-2(0,00567моль), 4-амінобензонітрил піримідиніл]аміно]бензонітрил (0,00064моль), тет(0,01163моль) та 1-метил-2-піролідинон (20мл). рагідрофуран (3мл), О-метилгідроксиламін (0,06г), Реакційну суміш нагрівають при 140°С протягом 16 тетрагідрофуран та NaOH IN (0,00067моль). Реакгодин. Потім охолоджують дану суміш до кімнатної ційну суміш перемішують протягом 3 днів при кімтемператури і додають ацетонітрил та воду. Утвонатній температурі, потім 1 день при 75°С, 1 день рений в результаті осад фільтрують, і після перепри 90°С та протягом 2 днів при 110°С. До Окристалізації твердої речовини із ацетонітрилу метилгідроксиламіну (0,60г) додають тетрагідроодержують 1,27г 4-[[5-бромо-4-(4-ціано-2,6фуран (4мл) та NaOH 50% (0,00719моль). Дану диметилфенокси)-6-метил-2рідину декантують у реакційну колбу, і реакційну піримідиніл]аміно]бензонітрилу (52); Тпл. 260суміш нагрівають при 110°С протягом 3 днів. Роз262°С (сполука 44). чинник випарюють. Залишок розчиняють у СН 2СI2, Приклад В13 промивають насиченим розчином NaHCO3 та воПроміжну сполуку (11) (0,001моль) та 2,6дою, осушують (Na2SO4), фільтрують, і розчинник диметил-4-амінобензонітрил (0,00473моль) об'єдвипарюють. Залишок очищають методом колонконують та нагрівають до 150°С при перемішуванні вої хроматографії на силікагелі (елюент: протягом 16 годин. Суміш розчиняють у СН 3ОН та СН2СI2/СН3ОН 98/2). Чисті фракції збирають, і розвипаровують на силікагель (1г), і піддають елюючинник випарюють. Залишок кристалізують із ванню 1:1 гексани:СН2СI2, 4:1 СН2СI2:гексани, та CH3CN, відфільтровують та висушують, що дає чистим СН2СI2 (2л). Потрібні фракції випарюють, і 0,15г 4-[[5-бромо-4-(4-ціано-2,6-диметилфенокси)залишок висушують у вакуумі протягом 16 годин 6-(метоксиаміно)-2-піримідиніл]аміно]бензонітрилу при 45°С. Одержаний у такий спосіб продукт пере(51%); Тпл. 185-186°С. Даний зразок висушують носять у 4мл склянку в СН2СI2, і розчинник випа(0,2мм Hg, 80°С, 16 годин) (сполука 48). рюють, що дає 0,120г 4-[[5-бромо-6-[(4-ціано-2,6Приклад В17 диметилфеніл)аміно]-2а) n-бутиллітій (2,01, 0,005моль) додають до піримідиніл]аміно]бензонітрилу (28,6%); Тпл. 277охолодженого до 0°С розчину, що перемішується, 280°С (сполука 45). 1-(метилетил)-2-пропаиаміну (0,70мл, 0,005моль) Приклад В14 та тетрагідрофурану (300мл). Після перемішуван4-[[5-бромо-4-(4-ціано-2,6-диметилфенокси)-6ня у холодному стані протягом 30 хвилин додають хлоро-2-піримідиніл]аміно]бензонітрил сполуку (17) (0,005моль). Утворену в результаті (0,00250моль) та NН3/1,4-діоксан 0,5Μ (0,015моль) суміш перемішують у холодному стані протягом 30 нагрівають в автоклаві при 150°С протягом 4 днів. хвилин і додають 1,1-диметилетил бромоацетат Потім зразок витримують в умовах оточуючого (1,5мл, 10ммоль), і температуру підвищують до середовища протягом 2 днів. До даної суміші покімнатної. Реакційну суміш перемішують протягом волі додають воду до утворення осаду. Дану суміш 3 годин. В окремій колбі до охолодженого до 0°С перемішують протягом 2 годин та фільтрують. розчину, що перемішується, 1-(метилетил)-2- проТверду речовину піддають перекристалізації із панаміну (0,70мл, 5ммоль) у тетрагідрофурані CH3CN з одержанням 0,58г (фракція 1). Фільтрат (50мл) додають п-бутиллітій (2,0мл, 5ммоль), і випарюють (фракція 2). Обидві фракції об'єднують реакцію проводять протягом 30 хвилин, після чого та очищають методом колонкової хроматографії з дану реакцію здійснюють при кімнатній температуелююванням СН 2СI2. Утворений в результаті зарі. Цю процедуру повторюють. Після гасіння даної лишок потрібної фракції піддають перекристалізасуміші 0,5мл води зразок концентрують шляхом ції із CH3CN, що дає 0,44г 4-[[4-аміно-5-бромо-6(4роторного випарювання на силікагель та очищаціано-2,6-диметилфенілокси)-2ють методом флеш-хроматографії (елюювання 0, піримідиніл]аміно]бензонітрилу (40,5%). Даний 10, 20% етилацетату у гексанах) з одержанням зразок висушують при 80°С під тиском 0,2мм Hg білої твердої речовини з Тпл. 195-197°С (сполука (сполука 46). 56). Приклад В15 В автоклав уводять 4-[[5-бромо-4-(4-ціано-2,6диметилфенокси)-6-хлоро-2піримідиніл]аміно]бензонітрил (0,000660моль), тетрагідрофуран (1мл) та 1-піролідинетанамін (0,00198моль). Дану суміш нагрівають при 75°С протягом 16 годин. Додають СН 2СI2, і суміш промивають водою, висушують, фільтрують, і фільтрат випарюють. В результаті очистки методом колонкової флеш-хроматографії з елююванням 1:9 метанол:метиленхлорид одержують тверду речоб) Суспензію сполуки (17) у 40мл Ν,Νвину, котру повторно розчиняють у CH3CN. Додадиметилформаміду обробляють 0,24г NaH. Пінлиють НСІ/діетиловий ефір 1,0М (0,48моль), і суміш ву суміш перемішують протягом 90 годин. Готують 39 70966 40 розчин 1,4-дихлоро-1,4-бутандіону у 10мл Ν,Νдиметилформаміду і охолоджують на льодяній бані. Суміш, що була одержана зі сполуки (17), переносять до холодного розчину 1 (мeтилетил)-1пропанаміну та підігрівають до кімнатної температури при перемішуванні протягом 42 годин. Додають ще 0,24г NaH, реакційну суміш перемішують протягом 3 днів, розводять ефіром та виливають на лід. Осад вилучають фільтрацією. Дво хфазовий фільтрат розділюють, і кислотну водну фракцію ще два рази екстрагують ефіром. Об'єднані ефірні Приклад В18 фракції промивають невеликими об'ємами дистиСуміш 4-[[4-(4-ціано-2,6-диметилфенокси)-5льованої води та висушують. Розчинник випарюнітро-2-піримідиніл]аміно]бензонітрилу ють, і залишок піддають колонковому хроматогра(0,0005моль) у тетрагідрофурані (20мл) гідрують фуваиню на силікагелі. В результаті очистки протягом ночі з Pd/C 10% (0,100г) як каталізатометодом препаративної високоефективної рідинром. Після поглинання Н 2 (3еквівал.; 0,0015моль) ної хроматографії з оберненою фазою та миттєвокаталізатор відфільтровують, і фільтрат концентго охолодження для ліофілізації відповідних фракрують шляхом роторного випарювання та висуцій одержали 0,07г продукту (7,8%); Тпл. 232шують у вакуумі протягом 16 годин при 40°С, що 233°С (сполука 57). дає 0,15г 4-[[5-аміно-4-(4-ціано-2,6диметилфенокси)-2піримідиніл]аміно]бензонітрилу (84%); Тпл.>300°С (сполука 50). Приклад В19 4-[[4-[2,4,6-триметилфеніл)аміно]-5-нітро-2піримідиніл]аміно]бензонітрил (0,001моль), Pd/C 10% (0,025г), етанол (20мл) та гідразин (0,030моль) поєднують для утворення суспензії та перемішують при кімнатній температурі протягом в) В колбу в а тмосфері аргону вводять NaH 16 годин. Розчинник вилучають шляхом роторного 60% та тeтрагідрофуран. Реакційну суміш перемівипарювання. Залишок розчиняють у те трагідрошують при кімнатній температурі протягом 10 хвифурані (20мл) та метанолі (1мл). Додають другу лин, і додають сполуку (17). Після перемішування порцію гідразину (0,5г), і реакційну суміш переміпротягом 1 години додають етил карбохлоридат. шують протягом 16 годин при кімнатній темпераРеакційну суміш перемішують при кімнатній темтурі. Додають третю порцію гідразину (0,5мл), і пературі ще на протязі 16 годин, і розчинник випареакційну суміш перемішують ще протягом 16 горюють. Залишок частково розчиняють у диметилдин при кімнатній температурі. Зразок концентрусульфоксиді та фільтрують. Фільтрат очищають ють шляхом роторного випарювання на силікагель методом хроматографії з оберненою фазою та (1г) та очищають методом флеш-хроматографії ліофілізують з одержанням 0,47г (18%) продукту (елюент: 0,5, 1, 2% 10% (NH4OH у СН3ОН) в (сполука 58). СН2СI2). Потрібні фракції очищають методом препаративної високоефективної рідинної хроматографії з одержанням 0,24г 4-[[5-аміно-4-[(2,4,6триметилфеніл)аміно]-2піримідиніл]аміно]бензонітрилу (70%); Тпл. 224225°С (сполука 51). Приклад B20 Сполуку (3) (0,001моль), триметил силанкарбонітрил (0,0012моль), Pd(PPh3)2Cl2 (0,020г), Cul (0,010г) та CF3COOH/H 2O (3мл) вводять у герметизовану пробірку та нагрівають до 110°С протяг) Суміш 4-[[5-аміно-4-(4-ціано-2,6гом 10 годин. Додають другі порції каталізаторів диметилфеиокси)-2Рd(РРh3)2СІ2 (0,020г), Cul (0,010г) та піримідиніл]аміно]бензонітрилу (0,00147моль) в CF3COOH/H 2O (3мл), і реакційну суміш перемішуоцтовому ангідриді (10мл) та 2-пропанон (10мл) ють протягом 10 годин при 110°С. Матеріал конперемішують при кімнатній температурі протягом центрують методом роторного випарювання. За16 годин. Потім дану суміш нагрівають до темпелишок очищають методом препаративної ратури 55°С, і знову додають оцтовий ангідрид високоефективної рідинної хроматографії з обер(3мл). Через 18 годин нагрівання припиняють, і неною фазою. Потрібні фракції концентрують та суміш перемішують протягом 6 днів при кімнатній очищають методом препаративної високоефектитемпературі. Дану суміш концентрують шляхом вної рідинної хроматографії з оберненою фазою, і роторного випарювання до твердої речовини. Пісвисушують струменем N2, потім у вакуумі при 40°С ля очистки методом колонкової хроматографії протягом 16 годин. Вихід: 0,011г 4-[[5-етиніл-4(елюювання 0, 0,5, 1, 1,5, 2% (10% NH4OH у [(2,4,6-триметилфеніл)аміно]-2СН3ОН) у метиленхлориді) одержали продукт з піримідиніл]аміно]бензонітрилу; Тпл. 165-167°С Тпл. 290-295°С. Дану тверду речовину висушували (сполука 52). у вакуумі протягом 16 годин при 60°С (сполука 49). 41 70966 42 Приклад В21 (сполука 54). Сполуку (3) (0,000906моль), трибутилфеніл Приклад В23 станат (0,000906моль), Pd(PPh3)4 (0,002718моль) Сполуку (3) (0,001225моль), CuCN та 1,4-діоксан (3мл) вводять в атмосфері азоту в (0,001470моль) та Ν,Ν-диметилформамід (2мл) герметизовану пробірку та нагрівають до 110°С вводять в герметизовану пробірку в атмосфері протягом 16 годин. Реакційну суміш охолоджують аргону, потім перемішують та нагрівають до 160°С та концентрують шляхом роторного випарювання. протягом 16 годин. Залишок очищають методом Зразок очищають методом препаративної висококолонкової хроматографії (елюент: СН2СI2/гексан ефективної рідинної хроматографії з оберненою 1/1, потім чистий СН 2СI2). Потрібні фракції збирафазою, потім висушують стр уменем Аr. Після виють, і розчинник випарюють. Залишок розтирають сушування у вакуумі одержали 0,0845г 4-[[5-фенілу СН2СI2 при кімнатній температурі. Тверду речо4-[(2,4,6-триметилфеніл)аміно]-2вину висушують (вакуум, 40°С, 24 години); вихід піримідиніл]аміно]бензонітрилу; Тпл. 209-214°С 0,0864г продукту (24%); Тпл. 254-259°С (сполука (сполука 53). 55). Приклад В22 Сполуку (3) (0,001моль), тетраетилстанат (0,22мл), 1,4-діоксан (2мл) та Pd(PPh3)4 (0,112г) вводять у герметизовану пробірку в а тмосфері аргону. Суміш перемішують та нагрівають до 100°С протягом 16 годин. Додають додатково тетраетилстанат та Pd(PPh3)4. Реакційну суміш перемішують та нагрівають в атмосфері аргону. Реакційну суміш концентрують шляхом роторного випарювання та очищають методом препаративної високоефективної рідинної хроматографії. МаУ Таблицях 1, 2, 3 та 4 перелічені сполуки фотеріал висушують стр уменем азоту, потім у вакуурмули (І-а), котрі були одержані аналогічно до одмі протягом 4 годин при 60°С і одержують 0,422г 4ного з вищенаведених прикладів. [[5-етеніл-4-[(2,4,6-триметилфеніл)аміно]-2піримідиніл]аміно]бензонітрилу; Тпл. 237-242°С Таблиця 1 Сполука № 1 2 22 Приклад № В1а В1а В11 Υ СІ Вr ΝΟ2 Фізичні дані Тпл. 227-228°С Тпл. 224-226°С Таблиця 2 1 2 Сп. № Пр. № 3 B1b 3 Ra СН3 4 Rb СН3 5 Rc СН3 6 X NH 7 Υ Вr 8 Q Η 4 В2 СН3 СН3 СН3 NH СІ ΝΗ2 5 6 7 8 9 10 11 12 В3 В5 В5 В5 В3 В4 В4 В4 СН3 СН3 СН3 СН3 СН3 Br Br СН3 СН3 СН3 СН3 СН3 Вr СН3 Вг С(СН3)3 СН3 СН3 СН3 СН3 СН3 Br F СН3 NH O S O NH NH NH NH СІ СІ СІ СІ СІ СІ СІ СІ Η Η Η Η Η H Н Η 9 Тпл./сіль Тпл. 227-228°С Тпл. 241-242°С; трифтороацетат(1:1) Тпл. 224-226°С Тпл. 218-219°С Тпл. 264-266°С Тпл. 237-238°С Тпл. 217-219°С Тпл. 262-263°С -“- 200-202°С -“- 214-215°С 43 70966 44 Продовження таблиці 2 1 13 14 15 16 17 18 2 В4 В4 В5 В5 В6 В5 3 СН3 СІ СІ СН3 СН3 СН3 4 CN СІ Br СІ CN CN 5 СН3 СН3 СН3 СН3 СН3 СН3 6 NH NH O O O O 7 СІ СІ СІ СІ Br СІ 8 Η Η Η Η Η Η 19 В7 СН3 CN СН3 NH СІ ΝΗ2 20 21 В3 В3 СІ СН3 СІ Br СН3 СН3 NH ΝH Br Br Η Η 23 В23 СН3 CN СН3 NH CN Η 24 25 26 27 28 29 30 31 32 33 34 35 36 37 В23 В14 В14 В14 В14 В14 В14 В14 В11 В5 В5 В5 В6 В5 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 Br CN CN СН3 СН3 CN CN СН3 СН3 СН3 СН3 CN CN СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 СН3 NH O O O O O O O NH O O O O O CN Br Br Br Br Br СІ СІ ΝΟ2 Br СІ СІ СІ СІ Η NH-СН3 ΝΗ2 ΝΗ2 NH-СН3 NH-C2H5 ΝΗ2 ΝΗ2 Η Η CI CI Br Br 40 В8 СН3 СН(СН3)2 СН3 NH Br Η 41 42 43 44 45 46 В10 В9 В11 В12 В13 B14 СН3 СН3 СН3 СН3 СН3 СН3 СН3 CN CN CN CN CN СН3 СН3 СН3 СН3 СН3 СН3 NH NH O O NH O Br Br ΝΟ2 Br Br Br СІ СІ Η СН3 Η NH2 47 B15 СН3 CN СН3 O Br 48 49 50 B16 B17d B18 СН3 СН3 СН3 CN CN CN СН3 СН3 СН3 O О О Br -NH-СОСН3 -ΝΗ2 -ΝΗ-O-СН3 Η Η 51 B18 СН3 СН3 СН3 NH -ΝΗ2 Η 52 53 B20 B21 СН3 СН3 СН3 СН3 СН3 СН3 NH NH CN феніл Η Η 54 B22 СН3 СН3 СН3 NH -СH=СH2 Η 55 B23 СН3 СН3 СН3 NH -СH=СH2 Η 9 -"- 281-283°С -"- 243-245°С -"- 244-247°С -"- 232-235°С -"- 288-289°С -"- 283-284°С -"- 266-268°С; трифтороацетат(1:1) -"- 253-254°С -"- 243-245°С -"- 275-290°С; трифтороацетат(1:1) -"- 291-299°С -"- 248-250°С -"- 255-256°С -"- 213-214°С -"- 263-264°С -"- 272-274°С -"- 199-202°С -"- >300°C -"- 207-215°С -"- 225-226°С -"- 273-276°С -"- 281-282°С -"- 214-215°С -"- 198°С; трифтороацетат(1:2) -"- 220°С -"- 259°С -"- >300°С -"- 260°С -"- 277°С Тпл. 255°С -"- 208°С; НСІ(1:1) -"- 185-186°С -"- 290-295°С -"- >300°C -"- 224-225°С; трифтороацетат(1:1) -"- 165-175°С -"- 209-214°С -"- 237-242°С; трифтороацетат(1:1) Тпл. 254-259°С 45 70966 46 Таблиця 3 Сп. № 38 56 57 58 59 60 61 Пр. № В17С В17а В17b В17с В6b В6с B6d Ζ -С(=О)-СН3 -СН2-СООС(СН3)3 -СН=О -СООС 2Н5 -СН2-СООС 2Н5 -СН2-СООС(СН3)2 -СО-СН2-ОСН2-СО-ОСН3 Тпл. 194-196°С -"- 195-197°С -"- 232-233°С -"- 209-210°С -"- 185-190°С -"- 168-169°С -"- 184-185°С Таблиця 4 Сп. № 39 Пр. № В5 Ra СІ Rb СІ C. Фармакологічний приклад Приклад С.1 Для in vitro оцінки анти-ВІЛ агентів був застосований швидкий, чутливий автоматичний метод аналізу. Клітинною лінією-мішенню слугувала трансформована ВІЛ-1 Т4-клітинна лінія, котра, як було показано раніше (Koyanagi et al., Int. J. Cancer, 36, 445-451, 1985), є високочутливою та схильною до ВІЛ-інфекції. Кінцевою точкою було інгібування індукованого ВІЛ цитопатичного ефекту. Життєздатність ВІЛ- та умовно-інфікованих клітин оцінювали спектрофотометричним методом через in situ відновлення 3-(4,5диметилтіазол-2-іл)-2,5-дифенілтетразолій броміду (МТТ). 50% цитотоксичну концентрацію (СС50 у мкМ) визначали як таку концентрацію сполуки, котра знижувала оптичну густину умовно-інфікованого контрольного зразка на 50%. Ступінь захисту у відсотках, що забезпечувала дана сполука відносно ВІЛ-інфікованих клітин, обчислювали за наступною формулою: X S Υ Br Q Η Тпл. 198-200°С (ODT )HIV - (ODC )HIV (%) (ODC )MOCK - (ODC )HIV де (ODТ)HIV відповідає оптичній густині, що вимірювалась при даній концентрації випробуємої сполуки для ВІЛ-інфікованих клітин; (ODC)HIV відповідає оптичній густині, що вимірювалась для контрольних необроблених ВІЛ-інфікованих клітин; (ODC)MOCK відповідає оптичній густині, що вимірювалась для контрольних необроблених умовно-інфікованих клітин; всі значення оптичної густини визначались при 540нм. Дозу, що згідно з вищенаведеною формулою забезпечувала 50% захист, визначали як 50% інгібіторну концентрацію (ІС50 У мкМ). Відношення СС50 до ІС50 визначали як показник селективності (SI). Було встановлено, що сполуки формули (І) ефективно інгібують ВІЛ-1. Характерні значення ІС50, CC50 та SI перелічені у наведеній нижче Таблиці 5. Таблиця 5 Сп. № 1 2 3 1 4 5 6 7 8 9 46 ІС50 (мкМ) 2 0,030 0,006 0,004 0,002 0,002 0,009 0,084 0,012 0,003 0,002 СС50 (мкМ) 3 82,6 4,4 10,9 10,0 0,4 >100 >100 >100 1,2 >200 SI 4 2730 738 2787 5555 178 >11049 >1182 >8298 376 >71428 47 1 61 10 11 12 13 14 15 16 17 18 60 70966 2 0,002 0,005 0,002 0,020 0,0005 0,002 0,010 0,010 0,002 0,001 0,002 Комп’ютерна в ерстка О. Гапоненко 48 Продовження таблиці 5 3 >100 0,4 0,4 48,5 0,4 0,4 >100 >100 >10 >10 74,52 Підписне 4 >52631 92 183 2393 860 191 >9661 >10416 >6451 >7142 39223 Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPirimidines inhibiting hiv replication
Автори англійськоюDe Corte Bart, Kavash Robert W.
Назва патенту російськоюПиримидины, которые ингибируют репликацию вич
Автори російськоюДе Корте Барт, Каваш Роберт В.
МПК / Мітки
МПК: C07D 401/12, C07D 239/47, C07D 403/12, A61K 31/505, C07D 239/46, A61P 31/18, C07D 239/48, C07D 239/50
Мітки: віл, піримідини, інгібують, реплікацію
Код посилання
<a href="https://ua.patents.su/24-70966-pirimidini-shho-ingibuyut-replikaciyu-vil.html" target="_blank" rel="follow" title="База патентів України">Піримідини, що інгібують реплікацію віл</a>
Попередній патент: Безводний концентрат суспензії для боротьби зі шкідниками та спосіб його одержання
Наступний патент: Ламінувальний пристрій
Випадковий патент: Спосіб прогнозування поліорганної недостатності і летального наслідку у пацієнтів у критичному стані