Конденсовані гетероциклічні сполуки та їх застосування як метаботропних антагоністів рецепторів глутамату, фармацевтична композиція на їх основі
Номер патенту: 82435
Опубліковано: 10.04.2008
Автори: Айзек Метвін, Едвардс Луіз, Маклеод Доналд, Слессі Абделмалік, Стааф Карін, Венсбо Дейвід, Сінь Тао, Керс Анніка, Йохансон Мартін, Мінідіс Александер, Стефанак Томіслав
Формула / Реферат
1. Сполука формули І:
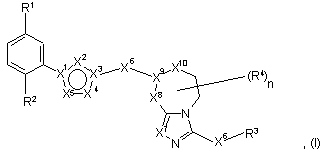
де
X1, X2, X3, X4 та X5 незалежно вибрані з групи: С, CR5, N, О та S, де принаймні один з X1, X2, X3, X4 та X5 не є N;
X6 вибрано з групи: зв'язок та CR5R6;
X7- CR5 чи N;
X8 вибрано з групи: зв'язок, CR5R6, NR5, О, S, SO та SO2;
X9- CR5 чи N;
X10 вибрано з групи: зв'язок, CR5R6, (CR5R6)2, О, S та NR5;
R1 вибрано з групи: гідроксил, галоген, нітро, С1-6алкілгалоген, OС1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкілС3-6циклоалкіл, ОС0-6алкілС3-6циклоалкіл, С0-6алкіларил, ОС0-6алкіларил, СНО, (CO)R5, O(CO)R5, O(CO)OR5, O(CN)OR5, С1-6алкілОR5, OC2-6алкілOR5, С1-6алкіл(СО)R5, ОС1-6алкіл(СО)R5, С0-6алкілСO2R5, ОС1-6алкілСО2R5, С0-6алкілціано, ОС2-6алкілціано, С0-6алкілNR5R6, OC2-6алкілNR5R6, С1-6алкіл(CO)NR5R6, ОС1-6алкіл(СО)NR5R6, С0-6алкілNR5(CO)R6, OC2-6алкілNR5(CO)R6, С0-6алкілNR5(СО)NR5R6, С0-6алкілSR5, ОС2-6алкілSR5, C0-6алкіл(SO)R5, ОС2-6алкіл(SО)R5, C0-6алкілSO2R5, OC2-6алкілSO2R5, C0-6алкіл(SO2)NR5R6, ОС2-6алкіл(SО2)NR5R6, C0-6алкілNR5(SO2)R6, OC2-6алкілNR5(SO2)R6, C0-6алкілNR5(SO2)NR5R6, OC2-6алкілNR5(SO2)NR5R6, (CO)NR5R6, O(CO)NR5R6, NR5OR6, C0-6алкілNR5(СО)ОR6, ОС2-6алкілNR5(СО)ОR6, SO3R5 та 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи: С, N, О та S, де вказане кільце може бути заміщеним одним або більше А;
R2 вибрано з групи: гідроген, гідроксил, галоген, нітро, С1-6алкілгалоген, OС1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкілС3-6циклоалкіл, ОС0-6алкілС3-6циклоалкіл, С0-6алкіларил, ОС0-6алкіларил, СНО, (CO)R5, O(CO)R5, O(CO)OR5, O(CN)OR5, С1-6алкілOR5, ОС2-6алкілОR5, С1-6алкіл(СО)R5, OС1-6алкіл(CO)R5, С0-6алкілCO2R5, OС1-6алкілCO2R5, С0-6алкілціано, ОС2-6алкілціано, С0-6алкілNR5R6, OС2-6алкілNR5R6, С1-6алкіл(CO)NR5R6, OС1-6алкіл(CO)NR5R6, С0-6алкілNR5(CO)R6, OС2-6алкілNR5(CO)R6, С0-6алкілNR5(CO)NR5R6, С0-6алкілSR5, OC2-6алкілSR5, С0-6алкіл(SO)R5, OC2-6алкіл(SO)R5, С0-6алкілSO2R5, OC2-6алкілSO2R5, С0-6алкіл(SO2)NR5R6, OС2-6алкіл(SO2)NR5R6, С0-6алкілNR5(SO2)R6, OC2-6алкілNR5(SO2)R6, С0-6алкілNR5(SО2)NR5R6, OС2-6алкілNR5(SO2)NR5R6, (CO)NR5R6, O(CO)NR5R6, NR5OR6, С0-6алкілNR5(СО)ОR6, OС2-6алкілNR5(CO)OR6, SO3R5 та 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи: С, N, О та S, де вказане кільце може бути заміщеним одним або більше А;
R3 - 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи: С, N, О та S, де вказане кільце може бути заміщеним одним або більше А;
R4 вибрано з групи: гідроксил, галоген, нітро, С1-6алкілгалоген, OС1-6алкілгалоген, С1-6алкіл, OС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкілС3-6циклоалкіл, ОС0-6алкілС3-6циклоалкіл, С0-6алкіларил, ОС0-6алкіларил, СНО, (CO)R5, O(CO)R5, O(CO)OR5, O(CN)OR5, С1-6алкілОR5, ОС2-6алкілОR5, С1-6алкіл(СО)R5, OС1-6алкіл(CO)R5, С0-6алкілСO2R5, ОС1-6алкілСО2R5, С0-6алкілціано, ОС2-6алкілціано, С0-6алкілNR5R6, OС2-6алкілNR5R6, С1-6алкіл(CO)NR5R6, OС1-6алкіл(CO)NR5R6, С0-6алкілNR5(СО)R6, OС2-6алкілNR5(CO)R6, С0-6алкілNR5(CO)NR5R6, С0-6алкілSR5, OС2-6алкілSR5, С0-6алкіл(SO)R5, OС2-6алкіл(SO)R5, С0-6алкілSO2R5, OС2-6алкілSO2R5, C0-6алкіл(SО2)NR5R6, OС2-6алкіл(SO2)NR5R6, С0-6алкілNR5(SO2)R6, OС2-6алкілNR5(SO2)R6, С0-6алкілNR5(SО2)NR5R6, OС2-6алкілNR5(SO2)NR5R6, (CO)NR5R6, O(CO)NR5R6, NR5OR6, С0-6алкілNR5(CO)OR6, OС2-6алкілNR5(CO)OR6, SO3R5 та 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи: С, N, О та S, де вказане кільце може бути заміщеним одним або більше А;
R5 та R6 незалежно вибрані з групи: гідроген, С1-6алкіл, С3-7циклоалкіл та арил;
А вибрано з групи: гідроген, гідроксил, галоген, нітро, С1-6алкілгалоген, OС1-6алкілгалоген, С1-6алкіл, OС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкіл С3-6циклоалкіл, ОС0-6алкілС3-6циклоалкіл, С0-6алкіларил, ОС0-6алкіларил, СНО, (CO)R5, O(CO)R5, O(CO)OR5, O(CN)OR5, С1-6алкілОR5, ОС2-6алкілОR5, С1-6алкіл(СО)R5, OС1-6алкіл(CO)R5, С0-6алкілСO2R5, OС1-6алкілCO2R5, С0-6алкілціано, ОС2-6алкілціано, С0-6алкілNR5R8, OС2-6алкілNR5R8, С1-6алкіл(СО)NR5R8, ОС1-6алкіл(СО)NR5R8, С0-6алкілNR5(CO)R8, OC2-6алкілNR5(CO)R8, С0-6алкілNR5(CO)NR5R8, С0-6алкілSR5, OС2-6алкілSR5, С0-6алкіл(SO)R5, OC2-6алкіл(SO)R5, С0-6алкілSO2R5, OС2-6алкілSO2R5, С0-6алкіл(SO2)NR5R8, OС2-6алкіл(SO2)NR5R8, С0-6алкілNR5(SO2)R8, OС2-6алкілNR5(SO2)R8, С0-6алкілNR5(SO2)NR5R8, OС2-6алкілNR5(SO2)NR5R8, (CO)NR5R8, O(CO)NR5R8, NR5OR8, С0-6алкілNR5(CO)OR8, OС2-6алкілNR5(CO)OR8, SO3R5 та 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи: С, N, О та S;
n = 0, 1, 2, 3, або 4; або
її фармацевтично прийнятна сіль або гідрат;
за умови, що:
a) коли X2 = X4 = X5 = N, а будь-який з X8 або X10 є зв'язком, тоді X9 не є N,
b) коли X7 - N, принаймні два з X1, X2, X3, X4 та X5 не є N,
c) X1 та X3 не є О;
та за умови, що сполукою не є:
8-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піридин,
8-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-тіофен-2-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піридин,
8-[5-(5-хлор-2-флуорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піридин,
8-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
8-[5-(5-хлор-2-флуорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
8-[5-(3-хлорфеніл)-[1,3,4]оксадіазол-2-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
8-{1-[5-(3-хлорфеніл)-[1,3,4]оксадіазол-2-іл]-етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
8-[5-(5-хлор-2-флуорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-фуран-2-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
8-{1-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-іл]-етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
3-піридин-4-іл-8-[1-(5-м-толіл-[1,2,4]оксадіазол-3-іл)-етил]-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
(+)-8-{(1S)-1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]етил}-3-піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
(-)-8-{(1R)-1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]етил}-3-піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
3-[5-(3-піридин-4-іл-6,7-дигідро-5Н-[1,2,4]триазоло[4,3-а]піримідин-8-ілметил)[1,3,4]оксадіазол-2-іл]бензонітрил,
3-{5-[3-(2-метоксипіридин-4-іл)-6,7-дигідро-5Н-[1,2,4]триазоло[4,3-а]піримідин-8-ілметил][1,3,4]оксадіазол-2-іл}бензонітрил,
3-{5-[3-(2-метоксипіридин-4-іл)-6,7-дигідро-5Н-[1,2,4]триазоло[4,3-а]піримідин-8-ілметил][1,2,4]оксадіазол-3-іл}бензонітрил,
3-{3-[(3-піридин-4-іл-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл)метил]-1,2,4-оксадіазол-5-іл}бензонітрил,
3-(3-{[3-(2-метоксипіридин-4-іл)-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл]метил}-1,2,4-оксадіазол-5-іл)бензонітрил,
3-{5-[(3-піридин-4-іл)-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл)метил]-1,2,4-оксадіазол-3-іл}бензонітрил та
3-{5-[3-(2-гідроксипіридин-4-іл)-6,7-дигідро-5Н-[1,2,4]триазоло[4,3-а]піримідин-8-ілметил]-[1,2,4]оксадіазол-3-іл}бензонітрил.
2. Сполука за п. 1, за умови, що нею не є 8-[5-(5-хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-фуран-2-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
3. Сполука за п. 1, де R1 - галоген, С1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл або С0-6алкілціано.
4. Сполука за п. 1, де R2 - гідроген або галоген.
5. Сполука за п. 1, де R2 - флуор.
6. Сполука за п. 1, яка має формулу II:
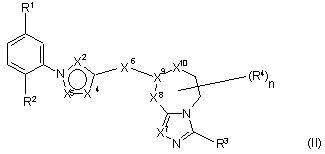 .
.
7. Сполука за п. 6, де X7 - N.
8. Сполука за п. 1, яка має формулу III:
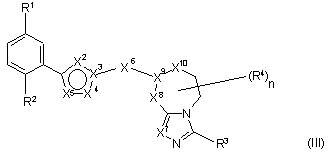 .
.
9. Сполука за п. 8, де X3 - С.
10. Сполука за п. 8, де X3 - N.
11. Сполука за п. 1, де кільце, що містить X1, X2, X3, X4 та X5, вибрано з групи:
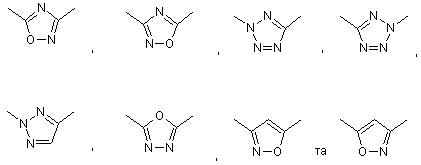 .
.
12. Сполука за п. 11, де кільце вибрано з групи:
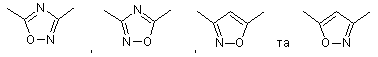 .
.
13. Сполука за п. 11, де X7 - N.
14. Сполука за п. 13, де X8 є зв'язком.
15. Сполука за п. 13, де X8 - S.
16. Сполука за п. 14, де X9 - CR5.
17. Сполука за п. 16, де X10 - NR5.
18. Сполука за п. 16, де X10 - О.
19. Сполука за п. 16, де X10 - CR5R6.
20. Сполука за п. 16, де X10 - (CR5R6)2.
21. Сполука за п. 16, де X10 є зв'язком.
22. Сполука за п. 15, де X9 - CR5.
23. Сполука за п. 22, де X10 є зв'язком.
24. Сполука за п. 14, де X9 - N.
25. Сполука за п. 11, де конденсоване кільце, що містить X7, X8, X9 та X10, вибрано з групи:
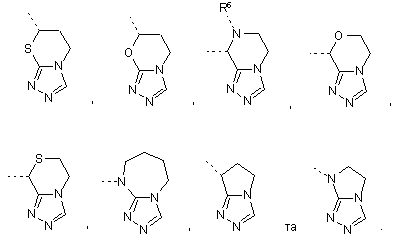
26. Сполука за п. 1, яку вибрано з групи:
7-[5-(5-хлор-2-флуорфеніл)-1,2,4-оксадіазол-3-іл]-3-(2-тієніл)-6,7-дигідро-5Н-[1,2,4]триазоло [3,4-b][1,3]тіазин,
9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
9-{1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]етил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
7-{[5-(3-хлорфеніл)-1,2)4-оксадіазол-3-іл]метил}-3-піридин-4-іл-6,7-дигідро-5Н-піроло[2,1-с][1,2,4]триазол,
9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3-(трифлуорметил)-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
8-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-3-(4-метоксифеніл)-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піразин,
8-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-3-(4-метоксифеніл)-7-метил-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піразин,
9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-(3,5-дифлуорфеніл)-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-(4-метоксифеніл)-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
9-{[5-(5-хлор-2-флуорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3-(3,5-дифлуорфеніл)-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін,
9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3-(4-метоксифеніл)-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін та їх фармацевтично прийнятні солі.
27. Фармацевтична композиція, яка містить як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-26 та один або більше фармацевтично прийнятних розріджувачів, наповнювачів та/або інертних носіїв.
28. Фармацевтична композиція за п. 27 для застосування у лікуванні опосередкованих mGluR5 розладів.
29. Сполука за будь-яким з пп. 1-26 для застосування у терапії.
30. Сполука за будь-яким з пп. 1-26 для застосування у лікуванні опосередкованих mGluR5 розладів.
31. Застосування сполуки за будь-яким з пп. 1-26 у виробництві медикаменту для лікування опосередкованих mGluR5 розладів.
32. Спосіб лікування опосередкованих mGluR5 розладів, в якому вводять ссавцю терапевтично ефективну кількість сполуки за будь-яким з пп. 1-26.
33. Спосіб за п. 32, де ссавцем є людина.
34.Спосіб за п. 32, де розладом є неврологічний розлад.
35. Спосіб за п. 32, де розладом є психіатричний розлад.
36. Спосіб за п. 32, де розлади вибрані з гострих та хронічних больових розладів.
37. Спосіб за п. 32, де розладом є шлунково-кишковий розлад.
38. Спосіб інгібування активації рецепторів mGluR5, в якому обробляють клітини, що містять вказані рецептори, ефективною кількістю сполуки за будь-яким з пп. 1-26.
Текст
1. Сполука формули І: 3 82435 4 R4 вибрано з групи: гідроксил, галоген, нітро, С18-[5-(5-хлор-2-флуор феніл)-[1,2,4]оксадіазол-3ілметил]-3-піридин-4-іл-5,6,7,86алкілгалоген, OС 1-6алкілгалоген, С 1-6алкіл, OС 1тетрагідро[1,2,4]триазоло[4,3-а]піридин, 6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2-6алкініл, ОС 2С0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 38-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-36алкініл, піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,36циклоалкіл, С 0-6алкіларил, ОС 0-6алкіларил, СНО, (CO)R5, O(CO)R 5, O(CO)OR 5, O(CN)OR 5, С1а]піримідин, 5 5 5 8-[5-(5-хлор-2-флуор феніл)-[1,2,4]оксадіазол-36алкілОR , ОС 2-6алкілОR , С 1-6алкіл(СО)R , OС 15 5 5 ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро6алкіл(CO)R , С 0-6алкілСO2R , ОС 1-6алкілСО2R , С 05 6 [1,2,4]триазоло[4,3-а]піримідин, 6алкілціано, ОС 2-6алкілціано, С 0-6алкілNR R , OС 25 6 С1-6алкіл(CO)NR5R6, OС18-[5-(3-хлорфеніл)-[1,3,4]оксадіазол-2-ілметил]-36алкілNR R , 5 6 С0-6алкілNR5(СО)R6, OС2піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,36алкіл(CO)NR R , 5 6 С0-6алкілNR5(CO)NR5R6, С0а]піримідин, 6алкілNR (CO)R , 5 5 5 8-{1-[5-(3-хлорфеніл)-[1,3,4]оксадіазол-2-іл]-етил}6алкілSR , OС 2-6алкілSR , С 0-6алкіл(SO)R , OС 25 5 5 3-піридин-4-іл-5,6,7,8-тетрагідро6алкіл(SO)R , С 0-6алкілSO2R , OС 2-6алкілSO2R , C 05 6 OС2-6алкіл(SO2)NR5R6, С0[1,2,4]триазоло[4,3-а]піримідин, 6алкіл(SО2)NR R , 5 6 OС2-6алкілNR5(SO2)R6, С08-[5-(5-хлор-2-флуор феніл)-[1,2,4]оксадіазол-36алкілNR (SO2)R , 5 5 6 OС2- 6алкілNR5(SO2)NR5R6, ілметил]-3-фуран-2-іл-5,6,7,8-тетрагідро6алкілNR (SО2)NR R , (CO)NR5R6, O(CO)NR 5R6, NR5OR6, С0[1,2,4]триазоло[4,3-а]піримідин, 5 6 5 6 5 8-{1-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-іл]-етил}6алкілNR (CO)OR , OС 2-6алкілNR (CO)OR , SO3R та 5- або 6-членне кільце, що містить атоми, неза3-піридин-4-іл-5,6,7,8-тетрагідролежно вибрані з групи: С, N, О та S, де вказане [1,2,4]триазоло[4,3-а]піримідин, кільце може бути заміщеним одним або більше А; 3-піридин-4-іл-8-[1-(5-м-толіл-[1,2,4]оксадіазол-3R5 та R6 незалежно вибрані з групи: гідроген, С1іл)-етил]-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3а]піримідин, 6алкіл, С 3-7циклоалкіл та арил; А вибрано з групи: гідроген, гідроксил, галоген, (+)-8-{(1S)-1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-3нітро, С1-6алкілгалоген, OС1-6алкілгалоген, С1іл]етил}-3-піридин-4-іл-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 6алкіл, OС 1-6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2(-)-8-{(1R)-1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-36алкініл, ОС 2-6алкініл, С 0-6алкіл С 3-6циклоалкіл, ОС0-6алкілС 3-6циклоалкіл, С0-6алкіларил, ОС0іл]етил}-3-піридин-4-іл-5,6,7,85 5 5 тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 6алкіларил, СНО, (CO)R , O(CO)R , O(CO)OR , O(CN)OR 5, С1-6алкілОR5, ОС 2-6алкілОR5, С13-[5-(3-піридин-4-іл-6,7-дигідро-5Н5 5 5 [1,2,4]триазоло[4,3-а]піримідин-86алкіл(СО)R , OС 1-6алкіл(CO)R , С 0-6алкілСO2R , OС1-6алкілCO2R5, С0-6алкілціано, ОС2-6алкілціано, ілметил)[1,3,4]оксадіазол-2-іл]бензонітрил, С0-6алкілNR5R8, OС2-6алкілNR5R8, С13-{5-[3-(2-метоксипіридин-4-іл)-6,7-дигідро-5Н5 8 ОС1-6алкіл(СО)NR5R8, С0[1,2,4]триазоло[4,3-а]піримідин-86алкіл(СО)NR R , 5 8 OC2-6алкілNR5(CO)R8, С0ілметил][1,3,4]оксадіазол-2-іл}бензонітрил, 6алкілNR (CO)R , 5 5 8 5 5 3-{5-[3-(2-метоксипіридин-4-іл)-6,7-дигідро-5Н6алкілNR (CO)NR R , С 0-6алкілSR , OС 2-6алкілSR , С0-6алкіл(SO)R5, OC2-6алкіл(SO)R5, С0-6алкілSO2R5, [1,2,4]триазоло[4,3-а]піримідин-8OС2-6алкілSO2R5, С0-6алкіл(SO2)NR5R8, OС2ілметил][1,2,4]оксадіазол-3-іл}бензонітрил, 5 8 С0-6алкілNR5(SO2)R8, OС23-{3-[(3-піридин-4-іл-6,7-дигідро[1,2,4]триазоло[4,36алкіл(SO2)NR R , 5 8 5 5 8 а]піримідин-8(5Н)-іл)метил]-1,2,4-оксадіазол-56алкілNR (SO2)R , С 0-6алкілNR (SO2)NR R , OС 25 5 8 (CO)NR5R8, O(CO)NR 5R8, іл}бензонітрил, 6алкілNR (SO2)NR R , NR5OR8, С0-6алкілNR5(CO)OR 8, OС23-(3-{[3-(2-метоксипіридин-4-іл)-6,75 8 5 дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)6алкілNR (CO)OR , SO 3R та 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи: іл]метил}-1,2,4-оксадіазол-5-іл)бензонітрил, С, N, О та S; 3-{5-[(3-піридин-4-іл)-6,7n = 0, 1, 2, 3, або 4; або дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)її фармацевтично прийнятна сіль або гідрат; іл)метил]-1,2,4-оксадіазол-3-іл}бензонітрил та за умови, що: 3-{5-[3-(2-гідроксипіридин-4-іл)-6,7-дигідро-5Нa) коли X2 = X4 = X5 = N, а будь-який з X8 або X10 є [1,2,4]триазоло[4,3-а]піримідин-8-ілметил]зв'язком, тоді X9 не є N, [1,2,4]оксадіазол-3-іл}бензонітрил. b) коли X7 - N, принаймні два з X1, X2 , X3 , X4 та X5 2. Сполука за п. 1, за умови, що нею не є 8-[5-(5не є N, хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-3-фуранc) X1 та X3 не є О; 2-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3та за умови, що сполукою не є: а]піримідин, 8-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-33. Сполука за п. 1, де R1 - галоген, С1піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3С1-6алкіл, ОС1-6алкіл або С06алкілгалоген, а]піридин, 6алкілціано. 8-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-ілметил]-34. Сполука за п. 1, де R 2 - гідроген або галоген. тіофен-2-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,35. Сполука за п. 1, де R 2 - флуор. а]піридин, 6. Сполука за п. 1, яка має формулу II: 5 82435 6 7-[5-(5-хлор-2-флуор феніл)-1,2,4-оксадіазол-3-іл]3-(2-тієніл)-6,7-дигідро-5Н-[1,2,4]триазоло [3,4b][1,3]тіазин, 2 6 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-310 X X 9 X N (R4) піридин-4-іл-6,7,8,9-тетрагідро-5НX n 4 X5 X [1,2,4]триазоло[4,3-а][1,3]діазепін, X8 R2 9-{1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]етил}-3N піридин-4-іл-6,7,8,9-тетрагідро-5НX7 (II) N R3 [1,2,4]триазоло[4,3-а][1,3]діазепін, . 7-{[5-(3-хлорфеніл)-1,2)4-оксадіазол-3-іл]метил}-37. Сполука за п. 6, де X7 - N. піридин-4-іл-6,7-дигідро-5Н-піроло[2,18. Сполука за п. 1, яка має формулу III: с][1,2,4]триазол, R1 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3(трифлуорметил)-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін, 2 6 10 X 3 X 9 X 8-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-3-(44) X (R X n 4 метоксифеніл)-5,6,7,8-тетрагідро5 X X X8 R2 [1,2,4]триазоло[4,3-а]піразин, N 8-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-3-(4X7 метоксифеніл)-7-метил-5,6,7,8-тетрагідро3 (III) N R . [1,2,4]триазоло[4,3-а]піразин, 9. Сполука за п. 8, де X3 - С. 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-(3,510. Сполука за п. 8, де X3 - N. дифлуорфеніл)-6,7,8,9-тетрагідро-5Н1 2 11. Сполука за п. 1, де кільце, що містить X , X , [1,2,4]триазоло[4,3-а][1,3]діазепін, X3 , X4 та X5, вибрано з групи: 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-(4N N N N метоксифеніл)-6,7,8,9-тетрагідро-5НN N [1,2,4]триазоло[4,3-а][1,3]діазепін, O N N O , , N N N N , , 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-піридин4-іл-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3а][1,3]діазепін, N O 9-{[5-(5-хлор-2-флуор феніл)-1,2,4-оксадіазол-3N іл]метил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5НN , N N та N O O N , . [1,2,4]триазоло[4,3-а][1,3]діазепін, 12. Сполука за п. 11, де кільце вибрано з групи: 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3N N (3,5-дифлуор феніл)-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін, O N N O N O та O N , , . 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-313. Сполука за п. 11, де X7 - N. (4-метоксифеніл)-6,7,8,9-тетрагідро-5Н14. Сполука за п. 13, де X8 є зв'язком. [1,2,4]триазоло[4,3-а][1,3]діазепін та їх фармацев15. Сполука за п. 13, де X8 - S. тично прийнятні солі. 16. Сполука за п. 14, де X9 - CR 5. 27. Фармацевтична композиція, яка містить як ак17. Сполука за п. 16, де X10 - NR 5 . тивний інгредієнт терапевтично ефективну кіль10 18. Сполука за п. 16, де X - О. кість сполуки за будь-яким з пп. 1-26 та один або 19. Сполука за п. 16, де X10 - CR 5R6 . більше фармацевтично прийнятних розріджувачів, 20. Сполука за п. 16, де X10 - (CR5R6) 2. наповнювачів та/або інертних носіїв. 21. Сполука за п. 16, де X10 є зв'язком. 28. Фармацевтична композиція за п. 27 для засто22. Сполука за п. 15, де X9 - CR 5. сування у лікуванні опосередкованих mGluR5 роз10 23. Сполука за п. 22, де X є зв'язком. ладів. 24. Сполука за п. 14, де X9 - N. 29. Сполука за будь-яким з пп. 1-26 для застосу25. Сполука за п. 11, де конденсоване кільце, що вання у терапії. містить X7, X8, X9 та X10, вибрано з групи: 30. Сполука за будь-яким з пп. 1-26 для застосуR6 вання у лікуванні опосередкованих mGluR5 розладів. N O S 31. Застосування сполуки за будь-яким з пп. 1-26 у O N виробництві медикаменту для лікування опосереN N N N дкованих mGluR5 розладів. N N N N , , N , N , N 32. Спосіб лікування опосередкованих mGluR5 розладів, в якому вводять ссавцю терапевтично ефективну кількість сполуки за будь-яким з пп. 1S 26. N N 33. Спосіб за п. 32, де ссавцем є людина. N N N N 34. Спосіб за п. 32, де розладом є неврологічний N N N N розлад. , , N . N та N N 35. Спосіб за п. 32, де розладом є психіатричний 26. Сполука за п. 1, яку вибрано з групи: розлад. R1 7 82435 8 36. Спосіб за п. 32, де розлади вибрані з гострих 38. Спосіб інгібування активації рецепторів та хронічних больових розладів. mGluR5, в якому обробляють клітини, що містять 37. Спосіб за п. 32, де розладом є шлункововказані рецептори, ефективною кількістю сполуки кишковий розлад. за будь-яким з пп. 1-26. Заявлений винахід стосується нового класу сполук, фармацевтичних композицій, що містять вказані сполуки, та застосування вказаних сполук у терапіях, що стосуються опосередкованих метаботропічним рецептором глутамату станів. Заявлений винахід крім того стосується способу отримання вказаних сполук та нових інтермедіатів, застосовувааних при їх отриманні. Глутамат є головним збуджувальним нейротрансмітером у центральній нервовій системі (ЦНС) ссавців. Глутамат діє на центральні нейрони зв'язуванням з рецепторами поверхні клітин та тим їх активуванням. Ці рецептори поділено на два головних класи, іонотропічні та метаботропічні рецептори глутамату, на основі структурних особливостей рецепторних білків, засобів, якими рецептори перетворюють сигнали у клітині, та фармакологічних профілів. Метаботропічні рецептори глутамату (mGluR) є сполученими з білком G рецепторами, що активують кілька внутрішньоклітинних вторинних месенджерних систем після зв'язування глутамату. Активація mGluR у інтактних нейронах ссавців викликає один або більше з наступних відгуків: активація фосфоліпази С; збільшення гідролізу фосфоінозитиду (РІ); вивільнення внутрішньоклітинного кальцію; активація фосфоліпази D; активація або інгібування аденіл-циклази; збільшення або зменшення утворення циклічного аденозин-монофосфату (цАМФ); активація гуаніліл-циклази; збільшення утворення циклічного гуанозин-монофосфату (цГ МФ); активація фосфоліпази А2; збільшення вивільнення арахідонової кислоти; та збільшення або зменшення активності керованих потенціалом та лігандами іонних каналів. [Schoepp et al., Trends Pharmacol. Sci. 14:13 (1993), Schoepp, Neurochem. Int. 24:439 (1994), Pin et al., Neuropharmacology 34:1 (1995), Bordi та Ugolini, Prog. Neurobiol. 59:55 (1999)]. Молекулярним клонуванням ідентифіковано вісім відмінних підтипів mGluR, під назвами mGluR1-mGluR8. [Nakanishi, Neuron 13:1031 (1994), Pin et al., Neuropharmacology 34:1 (1995), Knopfel et al., J. Med. Chem. 38:1417 (1995)]. Наступна різноманітність рецепторів відбувається експресією альтернативно сплайсованих форм деяких підтипів mGluR. [Pin et al., PNAS 89:10331 (1992), Minakami et al., BBRC 199:1136 (1994), Joly et al., J. Neurosci. 15:3970 (1995)]. Підтипи метаботропічних рецепторів глутамату можна підрозділити на три групи, гр упу І, гр упу II та гр упу III mGluR, на основі гомології амінокислотних послідовностей, вторинних месенджерних систем, використовуваних рецепторами, та за їх фармакологічними характеристиками. Група І mGluR охоплює mGluR1, mGluR5 та їх альтернативно сплайсовані варіанти. Приєднання агоністів до цих рецепторів призводить до активації фосфоліпази С та наступної мобілізації внутрішньоклітинного кальцію. Неврологічні, психіатричні та больові розлади Спроби пояснити фізіологічну роль mGluR групи І наводять на думку, що активація цих рецепторів викликає нейронне збудження. Різні дослідження продемонстрували, що гр упа І агоністів mGluR може продукувати постсинаптичне збудження при дії на нейрони у гіпокампі, корі головного мозку, мозжечку та зоровому бугрі, а також інших регіонах ЦНС. Є дані, що це збудження є наслідком безпосередньої активації постсинаптичних mGluR, але також припускають, що активація пресинаптичного mGluR відбувається, призводячи до збільшеного вивільнення нейротрансмітеру. [Baskys, Trends Pharmacol. Sci. 15:92 (1992), Schoepp, Neurochem. Int. 24:439 (1994), Pin et al., Neuropharmacology 34:1(1995), Watkins et al., Trends Pharmacol. Sci. 15:33 (1994)]. Метаботропічні рецептори глутамату залучені у ряд нормальних процесів у ЦНС ссавців. Активація mGluR, як показано, є потрібною для індукування гіпокампального довготермінового потенціювання та мозжечкової довготермінової депресії. [Bashir et al., Nature 363:347 (1993), Bortolotto et al., Nature 368:740 (1994), Aiba et al., Cell 79:365 (1994), Aiba et al., Cell 79:377 (1994)]. Роль активації mGluR у ноцицепції та аналгезії також продемонстровано, [Meller et al., Neuroreport 4: 879 (1993), Bordi та Ugolini, Brain Res. 871:223 (1999)]. На додаток, активація mGluR, як припускають, грає модулятивну роль у багатьох інши х нормальних процесів, охоплюючи синаптичну передачу, розвиток нейронів, апоптотичну загибель нейронів, синаптичну пластичність, просторове навчання, нюхову пам'ять, центральне регулювання серцевої активності, свідомість, моторний контроль та контроль вемтибулярно-окулярного рефлексу. [Nakanishi, Neuron 13: 1031 (1994), Pin et al., Neuropharmacology 34:1, Knopfel et al., J. Med. Chem. 38:1417 (1995)]. Крім того, група І метаботропічних рецепторів глутамату та зокрема mGluR5, як припускають, грає роль у багатьох патофізіологічних процесах та розладах, що уражують ЦНС. Це охоплює інсульт, травму голови, аноксичні та ішемічні поранення, гіпоглікемію, епілепсяю, нейродегенеративні розлади, як-то хвороба Альцгеймера, та біль. [Schoepp et al., Trends Pharmacol. Sci. 14:13 (1993), Cunningham et al., Life Sci. 54:135 (1994), Hollman et al., Ann. Rev. Neurosci. 17:31 (1994), Pin et al., Neuropharmacology 34:1 (1995), Knopfel et al., J. Med. Chem. 38:1417 (1995), Spooren et al., Trends Pharmacol. Sci. 22:331 (2001), Gasparini et al. Curr. Opin. Pharmacol. 2:43 (2002), Neugebauer Pain 98:1 (2002)]. Багато патологій у цих станах, можна ду 9 82435 10 мати, обумовлені надлишковим індукованим глувисоку селективність стосовно підтипів mGluR, таматом збудженням нейронів ЦНС. Оскільки груособливо підтипу рецепторів групи І, підтверджує па І mGluR виявляє збільшення опосередкованого необхідність у нових агоністах та антагоністах. глутаматом нейтронного збудження за постсинапЗаявлений винахід стосується сполуки фортичними механізмами та посилює пресинаптичне мули І: вивільнення глутамат, їх активація ймовірно робить внесок у патологію. Відповідно, селективн антагоністи рецепторів групи І mGluR могли б бути терапевтично корисними, особливо як нейрозахисні агенти, аналгетики або антиконвульсанти. Сучасні досягнення у поясненні нейрофізіологічної ролі метаботропічних рецепторів глутамату загалом та група І зокрема, встановили ці рецептори як багатообіцяючі цілі для ліків у терапії гострих та хронічних неврологічних та психіатричних розладів та гострих та хронічних больових розладів. Внаслідок їх фізіологічного та патофізіологічного значення, є необхідність у нових потужних У формулі І X1, X2 , X3, X4 та X5 незалежно вибагоністах та антагоністах mGluR, що виявляють рано з групи: С, CR5, Ν, Ο та S, де щонайменше високу селективність стосовно підтипів mGluR, один з X1, X2 , X3, X4 та X5 не є N, X6 вибрано з груособливо підтипу рецепторів групи І, найособлипи: зв'язок та CR5Re; X7 - CR5 або Ν; X8 вибрано з віше підтипу mGluR5. групи: зв'язок, CR5R6, NR5, О, S, SO, та SO2 ; X9 Шлунково-кишкові розлади CR5 або Ν; а X10 вибрано з групи: зв'язок, Нижчий стравохідний сфінктер (НСС) схильCR5R65(CR5R6)2, O, S, та NR5. ний до періодичної релаксації. Як наслідок, рідина R1 вибрано з групи: гідроксил, галоген, нітро, зі шлунку може проходити у страво хід, оскільки С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1механічний бар'єр є тимчасово відсутнім у цей час, 6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2-6алкініл, ОС 2цей випадок тут далі позначено як "Ш.-С. рефС0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 36алкініл, люкс". 6циклоалкіл, С 0-6алкіларил, ОС 0-6алкіларил, СНО, Хвороба шлунково-стравохідний рефлюкс (CO)R5, O(CO)R 5, O(CO)OR 5, O(CN)OR 5, С1(ХШСР) є найпоширенішою хворобою верхнього 5 5 5 6алкілСR , ОС 2-6алкілOR , С 1-6алкіл(СО)R , OC 1шлунково-кишкового тракту. Сучасна фармакоте5 5 5 6алкіл(CO)R , С 0-6алкілСО2R , ОС 1-6алкілСО2R , С 0рапія спрямована на зменшення секреції шлунко5 6 6алкілціано, ОС 2-6алкілціано, С 0-6алкілNR R , OC 2вої кислоти, або на нейтралізацію кислоти у стра5 6 C1-6алкіл(CO)NR5R6, OC16aлкiлNR R , воході. The головний механізм Ш.-С. рефлюксу, як алкіл(CO)NR5R6, С0-6алкілNR5(CO)R6, OC26 вважають, залежить від гіпотонічного нижчого 5 6 С0-6алкілNR5(CO)NR5Re, C06алкілNR (CO)R , стравохідного сфінктера. Однак, наприклад, 5 5 5 6алкілSR , OC 2-6алкілSR , С 0-6aлкiл(SO)R , OC 2[Holloway & Dent (1990) Gastroenterol. Clin. N. 5 5 5 6алкіл(SO)R , C 0-6алкілSO2R , OC 2-6алкілSO2R , C 0Amer. 19, pp.517-535], показано, що більшість епі5 6 5 6 OC2-6aлкiл(SO2)NR R , C06алкіл(SO2)NR R , зодів рефлюксу відбуваються при тимчасовій ре5 6 OC2-6aлкiлNR5(SO2)R6, C06алкілNR (SO2)R , лаксації нижчого стравохідного сфінктера 5 5 6 OC2-6алкілNR5(SO2)NR5N6, 6алкілNR (SO2)NR R , (ТРНСС), тобто релаксацію не ініційовано ковтка(CO)NR5R6, O(CO)NR 5R6, NR5OR6, С0ми. Також показано, що секреція шлункової кисло5 6 5 6 5 6aлкiлNR (CO)OR , OC 2-6aлкiлNR (CO)OR , SO3R ти звичайно є нормальною у пацієнтів з ХШСР. та 5- або 6-членне кільце, що містить атоми, незаНові сполуки згідно з заявленим винаходом, як лежно вибрані з групи: С, Ν, Ο та S, де вказане вважають, будуть корисними для інгібування тимкільце може бути заміщеним одним або більше А, часової релаксації нижчого стравохідного сфінктеяк визначено нижче. ра (ТРНСС), а тим для лікування розладу шлункоR2 вибрано з групи: гідроген, гідроксил, галово-стравохідний рефлюкс (ХШСР). ген, нітро, С1-6алктгалоген, ОС1-6алкілгалоген, С1Вираз "ТРНСС", тимчасова релаксація нижчо6алкіл, ОС 1-6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2го стравохідного сфінктера, тут визначено згідно з 6алкініл, ОС 2-6алкініл, С 0-6алкілС 3-6циклоалкіл, ОС 0[Mittal, R.K., Holloway, R.H., Penagini, R., С0-6алкіларил, ОС06алкілС 3-6циклоалкіл, Blackshaw, L.A., Dent, J., 1995; Transient lower 5 5 5 6алкіларил, СНО, (CO)R , O(CO)R , O(CO)OR , esophageal sphincter relaxation. Gastroenterology 5 5 5 O(CN)OR , C1-6алкілOR , OC 2-6алкілOR , C1109, pp.601-610]. 5 5 5 6алкіл(CO)R , OC 1-6алкіл(CO)R , С 0-6алкілСО2R , Вираз "Ш.-С. рефлюкс" тут визначено як мож5 OC1-6алкілCO2R , С0-6алкілціано, ОС2-6алкілціано, ливість рідині зі шлунку проходити у стравохід, C0-6алкілNR5R6, OC2-6алкілNR5R6, C1оскільки механічний бар'єр є тимчасово відсутнім у 5 6 OC1-6алкіл(CO)NR6R6, C06алкіл(СО)NR R , цей час. 5 6 OC2-6алкілNR5(CO)R6, C06алкілNR (CO)R , Вираз "ХШСР", хвороба шлунково5 5 6 5 5 6алкілNR (CO)NR R , C 0-6алкілSR , OC 2-6алкілSR , стравохідний рефлюкс, тут визначено згідно з [van 5 5 C0-6алкіл (SO)R , OC2-6алкіл (SO)R , C0Heerwarden, M.A., Smout A.J.P.M., 2000; Diagnosis 5 OC2-6алкілSO2R5, C06алкілSO2R , of reflux disease. Baillière's Clin. Gastroenterol. 14, 5 5 OC2-6алкіл(SO2)NR5R6, C06алкіл(SO2)NR R , pp.759-774]. 5 6 OC2-6алкілNR5(SO2)R6, C06алкілNR (SO2)R , Фізіологічні та патофізіологічні властивості 5 5 6 OC2-6алкілNR5(SO2)NR5N6, 6алкілNR (SO2)NR R , агоністів та антагоністів mGluR, що виявляють 11 82435 12 (CO)NR5R6, O(CO)NR 5R6, NR5OR6, C0психіатричних розладів, шлунково-кишкових роз5 6 5 6 5 ладів та больових розладів. 6алкілNR (CO)OR , OC 2-6алкілNR (CO)OR , SO3R та 5- або 6-членне кільце, що містить атоми, незаУ наступному аспекті винаходу запропоновано лежно вибрані з групи: С, Ν, Ο та S, де вказане сполуку формули І для застосування у терапії, кільце може бути заміщеним одним або більше А. особливо для лікування опосередкованих рецепR3 - 5- або 6-членне кільце, що містить атоми, тором mGluR5 розладів та для лікування невролонезалежно вибрані з групи: С, N, О та S, де вказагічних розладів, психіатричних розладів, шлунковоне кільце може бути заміщеним одним або більше кишкових розладів та больових розладів. А. Наступним аспектом винаходу є застосування R4 вибрано з групи: гідроксил, галоген, нітро, сполуки формули для виробництва медикаменту С1-6алктгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1для лікування або попередження ожиріння та споріднених з ожирінням станів, а також лікування 6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2-6алкініл, ОС 2С0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 3розладів харчування інгібуванням надлишкового 6алкініл, поглинання їжі, а в результаті ожиріння та асоці6циклоалкіл, С 0-6алкіларил, ОС 0-6алкіларил, СНО, (CO)R5, O(CO)R 5, O(CO)OR 5, O(CN)OR 5, C1йованих з ним ускладнень. 5 5 5 У ще одному аспекті винаходу запропоновано 6алкілOR , ОС 2-6алкілOR , C 1-6алкіл(CO)R , OC 15 5 5 способи отримання сполук формули І та інтерме6алкіл(CO)R , C 0-6алкілCO2R , OC 1-6алкілCO2R , С 05 6 діатів, застосованих у їх о триманні. 6алкілціано, ОС 2-6алкілціано, C 0-6алкілNR R , OC 25 6 5 6 C1-6алкіл(CO)NR R , OC1Ці та інші аспекти заявленого винаходу дета6алкілNR R , 5 6 C0-6алкілNR5(CO)R6, OC2льніше описані нижче. 6алкіл(CO)NR R , 5 6 C0-6алкілNR5(CO)NR5R6; C0Метою заявленого винаходу є сполуки, що ви6алкілNR (CO)R , 5 5 5 являють активність стосовно метаботропічних ре6алкілSR , ОC 2-6алкілSR , C 0-6алкіл(SO)R , OC 25 5 5 цепторів глутамату (mGluR), особливо стосовно 6aлкiл(SO)R , C 0-6алкілSO2R , OC 2-6алкілSO2R , C 05 6 5 6 OC2-6алкіл(SO2)NR R , C0рецептору mGluR5. 6алкіл(SO2)NR R , 5 6 OC2-6алкілNR5(SO2)R6, C0Нижче наведені визначення різних термінів, 6алкілNR (SO2)R , 5 5 6 OC2-6алкілNR5(SO2)NR5R6, застосованих в описі та формулі винаходу для 6алкілNR (SO2)NR R , (CO)NR5R6, O(CO)NR 5R6, NR5OR6, C0опису заявленого винаходу. 5 6 5 6 5 Для запобігання невизначеності слід розуміти, 6алкілNR (CO)OR , OC 2-6алкілNR (CO)OR , SO3R та 5- або 6-членне кільце, що містить атоми, незащо де у цьому описі групу 'визначено вище', вкалежно вибрані з групи: С, Ν, Ο та S, де вказане зана груп охоплює першу появу та ширше визнакільце може бути заміщеним одним або більше А. чення а також кожне та усі з інших визначень для R5 та R6 незалежно вибрані з групи: гідроген, цієї групи. С1-6алкіл, С3-7циклоалкіл та арил. Для запобігання невизначеності слід розуміти, А вибрано з групи: гідроген, гідроксил, галоген, що у цьому описі 'С1-6' означає карбонову гр упу, нітро, С1-6алкілгалоген, ОС1-6алкілгалоген, С1що має 1, 2, 3,4, 5 або 6 атоми карбону. Подібним чином 'С1-3' означає карбонову гр упу, що має 1,2, 6алкіл, ОС 1-6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2або 3 атоми карбону 6алкініл, ОС 2-6алкініл, С 0-6алкілС 3-6циклоалкіл, ОС 0С0-6алкіларил, ОС0У випадку, де нижній індекс дорівнює 0 (нуль), 6алкілС 3-6циклоалкіл, 5 5 5 група, якої стосується нижній індекс, відсутня. 6алкіларил, СНО, (CO)R , O(CO)R , O(CO)OR , O(CN)OR 5, C1-6алкілOR5, OC 2-6алкілOR5, C1У цьому описі, якщо не визначене інше, термін 5 5 5 "алкіл" охоплює алкіли з лінійними та розгалуже6алкіл(CO)R , OC 1-6алкіл(CO)R , C 0-6алкілCO2R , OC1-6алкілCO2R5, С0-6алкілціано, ОС2-6алкілціано, ними ланцюгами та може представляти, але без С0-6алкілN5R8, OC2-6алкілNR5R8, C1-6алкіл обмеження, метил, етил, н-пропіл, ізопропіл, н(CO)NR5R8, OC1-6алкіл(CO)N RSR8, C0бутил, ізобутил, втор-бутил, т-бутил, н-пентил, 5 8 OC2-6алкілNR5(CO)R8, C0ізопентил, т-пентил, нео-пентил, н-гексил або ізо6алкілN (CO)R , 5 5 8 5 5 гексил, т-гексил. Термін Смалкій означає 1-3 ато6алкілNR (CO)N R R , C 0-6алкілSR , OC 2-6алкілSR , C0-6алкіл(SO)R5, OC2-6алкіл(SO)R5, C0-6алкілSO2R5, ми карбону та може представляти метил, етил, нОС2-6алкілSО2R5, C0-6алкіл(SO2)NR5R8, OC2пропіл або ізопропіл. 5 8 C0-6алкілNR5(SO2)R8, OC2У цьому описі, якщо не визначене інше, термін 6алкіл(SO2)NR R , 5 8 5 5 8 "циклоалкіл" стосується, як варіант, заміщеної, 6алкілNR (SO2)R , C 0- 6алкілNR (SO2)NR R , OC 25 5 8 8 5 8 насиченої циклічної вуглеводневої кільцевої сис6алкілNR (SO2)NR R , (CO)NR,5R , O(CO)NR R , 5 8 5 8 NR OR , C0-6алкілNR (CO)OR , ОС2теми. Термін "С3-7циклоалкіл" може представляти 5 8 5 циклопропіл, циклобутил, циклопентил, циклогек6алкілNR (СО)OR , SO 3R та 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи: сил або циклогептил. С, Ν, Ο та S. У цьому описі, якщо не визначене інше, термін Змінна n = 0, 1, 2, 3, або 4. "алкокси" охоплює алкоксили з лінійними та розгаУ наступному аспекті винаходу запропоновано луженими ланцюгами. С1-3алкоксил може предстафармацевтичні композиції, що містять терапевтивляти, але без обмеження, метоксил, етоксил, нчно ефективну кількість сполуки формули І та фапропоксил або ізопропоксил. рмацевтично прийнятний розріджувач, наповнюУ цьому описі, якщо не визначене інше, термін вач та/або інертний носій. "зв'язок" може представляти насичений або ненаУ ще одному аспекті винаходу запропоновано сичений зв'язок. фармацевтичну композицію, що містить сполуку У цьому описі, якщо не визначене інше, термін формули І, для застосування у лікуванні опосере"галоген" може представляти флуор, хлор, бром дкованих рецептором mGluR5 розладів та для або йод. застосування у лікуванні неврологічних розладів, 13 82435 14 У цьому описі, якщо не визначене інше, термін карбоцикпічні та гетероциклічні кільця, які можуть "алкілгалоген" означає алкіл, який визначено вибути насиченими, частково насиченими або ненаще, який заміщено галогеном, як описано вище. сиченими. Приклади таких кілець можуть предстаТермін "С1-6алкілгалоген" охоплює, але без обмевляти, але без обмеження, фурил, ізоксазоліл, ження, флуорметил, дифлуорметил, трифлуормеізотіазоліл, оксазоліл, піразиніл, піразоліл, піридатил, флуоретил, дифлуоретил або бромпропіл. зиніл, піридил, піримідил, піроліл, тіазоліл, тієніл, Термін "ОС1-6алкілгалоген" охоплює, але без обімідазоліл, імідазолідиніл, імідазолініл, триазоліл, меження, флуорметоксил, дифлуорметоксил, морфолініл, піперазиніл, піперидил, піперидонілтрифлуорметоксил, флуоретоксил або дифлуореніл, піразолідиніл, піразолініл, піролідиніл, піролітоксил. ніл, тетрагідропіраніл, тіоморфолініл, феніл, цикУ цьому описі, якщо не визначене інше, термін логексил, циклопентил та циклогексеніл. "алкеніл" охоплює алкеніли з лінійними та розгаУ цьому описі, якщо не визначене інше, термін луженими ланцюгами. Термін "С2-6алкеніл" стосу"=NR5" та "-NOR5" о хоплюють іміно- та оксимснрується алкенілу, що має 2-6 атомів карбону та один пи із замісником R5 та можуть представляти, або або два подвійні зв'язки, та може представляти, бути частиною груп, о хоплюючих, але без обмеале без обмеження, вініл, аліл, пропеніл, ізопроження, іміноалкіл, іміногідроксил, іміноалкоксил, пеніл, бутеніл, ізобутеніл, кротил, пентеніл, ізопенамідин, гідроксіамідин та алкоксіамідин. теніл та гексеніл. У випадку, де нижній індекс дорівнює 0 (нуль), У цьому описі, якщо не визначене інше, термін група, якої стосується нижній індекс, відсутня, тоб"алкініл" охоплює алкініли з лінійними та розгалуто є безпосередній зв'язок між групами. женими ланцюгами. Термін С2-6алкініл стосується У цьому описі, якщо не визначене інше, термін алкінілу, що має 2-6 атомів карбону та один або "конденсовані кільця" стосується двох кілець, які два потрійні зв'язки, та може представляти, але мають 2 спільних атоми. без обмеження, етиніл, пропаргіл, бутиніл, ізобуУ цьому описі, якщо не визначене інше, термін тиніл, пентиніл, ізопентиніл та гексиніл. "місток" означає молекулярний фрагмент, що місУ цьому описі, якщо не визначене інше, термін тить один або більше атомів, або зв'язок, який "арил" стосується, як варіант, заміщеної моноцикз'єднує два віддалених атоми у кільці, утворюючи лічної або дициклічної вуглеводневої кільцевої цим ди- або трициклічні системи. системи, що містить принаймні одне ненасичене Одне втілення винаходу стосується сполук ароматичне кільце. Прикладами та придатними формули І та їх фармацевтично прийнятних солей значеннями терміну "арил" є феніл, нафтил, та гідратів: 1,2,3,4-тетрагідронафтил, індил та інденіл. У цьому описі, якщо не визначене інше, термін "гетероарил" стосується, як варіант, заміщеної моноциклічної або дициклічної ненасиченої кільцевої системи, що містить принаймні один гетероатом, незалежно вибранийі з групи: Ν, Ο або S. Приклади "гетероарилу" можуть представляти, але без обмеження, тіофен-, тієніл, піридил, тіазоліл, фурил, піроліл, триазоліл, імідазоліл, оксадіазоліл, оксазоліл, ізоксазоліл, піразоліл, імідазолоніл, оксазолоніл, тіазолоніл, тетразоліл та тіадіазоліл, бензоімідазоліл, бензооксазоліл, тетрагідротриазолопіридил, тетрагідротриазолопіриУ формулі І X1, X2 , X3, X4 та X5 незалежно вибмідиніл, бензофурил, індоліл, ізоіндоліл, піридоніл, рано з групи: С, CR5, Ν, Ο та S, де щонайменше піридазиніл, піримідиніл, імідазопіридил, оксазоодин з X1, X2 , X3, X4 та X5 не є N, X6 вибрано з грулопіридил, тіазолопіридил, піридил, імщазопіридапи: зв'язок та CR5R6; X7 - CR5 або Ν; X8 вибрано з зиніл, оксазолопіридазиніл, тіазолопіридазиніл та групи: зв'язок, CR5R6, NR5, О, S, SO, та SO2 ; X9 пуриніл. CR5 або Ν; а X10 вибрано з групи: зв'язок, У цьому описі, якщо не визначене інше, термін CR5R65(CR5R6)2,O, S, та NR5. "алкіларил", "алкілгетероарил" та "алкілциклоалR1 вибрано з групи: гідроксил, галоген, нітро, кіл" стосуються заміснику, що приєднаний через С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1алкіл до арилу, гетероарилу та цикпоалкілу. 6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2-6алкініл, ОС 2У цьому описі, якщо не визначене інше, термін С0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 36алкініл, "гетероциклоалкіл" стосується, як варіант, заміще6циклоалкіл, С 0-6алкіларил, ОС 0-6алкіларил, СНО, ної насиченої циклічної вуглеводневої кільцевої (CO)R5, O(CO)R 5, O(CO)OR 5, O(CN)OR 5, С15 5 5 системи, де один або більше атомів карбону замі6алкілСR , ОС 2-6алкілOR , С 1-6алкіл(СО)R , OC 15 5 5 щені гетероатомом. Термін "гетероциклоалкіл" 6алкіл(CO)R , С 0-6алкілСО2R , ОС 1-6алкілСО2R , С 05 6 охоплює але без обмеження, піролідин, тетрагід6алкілціано, ОС 2-6алкілціано, С 0-6алкілNR R , OC 25 6 рофуран, тетрагідротіофен, піперидин, піперазин, C1-6алкіл(CO)NR5R6, OC16aлкiлNR R , морфолін, тіоморфолін, тетрагідропіран, тетрагідалкіл(CO)NR5R6, С0-6алкілNR5(CO)R6, OC26 5 6 ротіопіран. С0-6алкілNR5(CO)NR5Re, C06алкілNR (CO)R , 5 5 5 У цьому описі, якщо не визначене інше, термін 6алкілSR , OC 2-6алкілSR , С 0-6aлкiл(SO)R , OC 25 5 5 "5- або 6-членне кільце, що містить атоми, неза6алкіл(SO)R , C 0-6алкілSO2R , OC 2-6алкілSO2R , C 05 6 5 6 лежно вибрані з групи: С, N, О або S", охоплює OC2-6aлкiл(SO2)NR R , C06алкіл(SO2)NR R , 5 6 ароматичні та гетероароматичні кільця, а також OC2-6aлкiлNR5(SO2)R6, C06алкілNR (SO2)R , 15 82435 16 OC2-6алкілNR5(SO2)NR5N6, OC1-6алкілCO2R5, С0-6алкілціано, ОС2-6алкілціано, (CO)NR R , O(CO)NR 5R6, NR5OR6, С0С0-6алкілN5R8, OC2-6алкілNR5R8, C1-6алкіл aлкiлNR5(CO)OR 6, OC2-6aлкiлNR5(CO)OR 6, SO3R5 (CO)NR5R8, OC1-6алкіл(CO)N RSR8, C06 5 8 та 5- або 6-членне кільце, що містить атоми, незаOC2-6алкілNR5(CO)R8, C06алкілN (CO)R , 5 5 8 5 5 лежно вибрані з групи: С, Ν, Ο та S, де вказане 6алкілNR (CO)N R R , C 0-6алкілSR , OC 2-6алкілSR , 5 5 5 кільце може бути заміщеним одним або більше А, C0-6алкіл(SO)R , OC2-6алкіл(SO)R , C0-6алкілSO2R , як визначено нижче. ОС2-6алкілSО2R5, C0-6алкіл(SO2)NR5R8, OC2R2 вибрано з групи: гідроген, гідроксил, галоалкіл(SO2)NR5R8, C0-6алкілNR5(SO2)R8, OC26 5 8 5 5 8 ген, нітро, С1-6алктгалоген, ОС1-6алкілгалоген, С16алкілNR (SO2)R , C 0- 6алкілNR (SO2)NR R , OC 25 5 8 (CO)NR5R8, O(CO)NR5R8, 6алкіл, ОС 1-6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 26алкілNR (SO2)NR R , 5 8 NR OR , C0-6алкілNR5(CO)OR 8, ОС26алкініл, ОС 2-6алкініл, С 0-6алкілС 3-6циклоалкіл, ОС 05 8 5 С0-6алкіларил, ОС06алкілС 3-6циклоалкіл, 6алкілNR (СО)OR , SO 3R та 5- або 6-членне кіль5 5 5 це, що містить атоми, незалежно вибрані з групи: 6алкіларил, СНО, (CO)R , O(CO)R , O(CO)OR , 5 5 5 O(CN)OR , C1-6алкілOR , OC 2-6алкілOR , C1С, Ν, Ο та S. 5 5 5 Змінна n = 0, 1, 2, 3, або 4. 6алкіл(CO)R , OC 1-6алкіл(CO)R , С 0-6алкілСО2R , OC1-6алкілCO2R5, С0-6алкілціано, ОС2-6алкілціано, Слід розуміти, що а) коли Х2=Х4=Х5=Ν, а C0-6алкілNR5R6, OC2-6алкілNR5R6, C1будь-який з Х8 або Х10 є зв'язком, тоді Х9 не є Ν, 5 6 OC1-6алкіл(CO)NR6R6, C0b) коли X7 - Ν, принаймні два з X1, X2 , X3 , X4 та X5 6алкіл(СО)NR R , 5 6 5 6 OC2-6алкілNR (CO)R , C0не є Ν, та с) X1 та X3 не є О. 6алкілNR (CO)R , алкілNR5(CO)NR5R6, C0-6алкілSR5, OC2-6алкілSR5, Слід також розуміти, що винахід не охоплює 6 C0-6алкіл (SO)R5, OC2-6алкіл (SO)R5, C0наступні сполуки: 5 OC2-6алкілSO2R5, C08-[5-(3-хлор-феніл)-[1,2,4]оксадіазол-36алкілSO2R , 5 5 OC2-6алкіл(SO2)NR5R6, C0ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро6алкіл(SO2)NR R , 5 6 OC2-6алкілNR5(SO2)R6, C0[1,2,4]триазоло[4,3-а]піридин, 6алкілNR (SO2)R , 5 5 6 OC2-6алкілNR5(SO2)NR5N6, 8-[5-(3-хлор-феніл)-[1,2,4]оксадіазол-36алкілNR (SO2)NR R , (CO)NR5R6, O(CO)NR 5R6, NR5OR6, C0ілметилі-3-тіофен-2-іл-5,6,7,8-тетрагідро5 6 5 6 5 [1,2,4]триазоло[4,3-а]піридин, 6алкілNR (CO)OR , OC 2-6алкілNR (CO)OR , SO3R та 5- або 6-членне кільце, що містить атоми, неза8-[5-(5-Хлор-2-флуор-феніл)-[1,2,4]оксадіазоллежно вибрані з групи: С, Ν, Ο та S, де вказане 3-ілметил]-3-піридин-4-іл-5,6,7,8кільце може бути заміщеним одним або більше А. тетрагідро[1,2,4]триазоло[4,3-а]піридин, R3 - 5- або 6-членне кільце, що містить атоми, 8-[5-(3-Хлор-феніл)-[1,2,4]окcадіазол-3незалежно вибрані з групи: С, N, О та S, де вказаілметил]-3-піридин-4-іл-5,6,7,8-тетрагідроне кільце може бути заміщеним одним або більше [1,2,4]триазоло[4,3-а]піримідин, А. 8-[5-(5-Хлор-2-флуор-феніл)-[1,2,4]оксадіазслR4 вибрано з групи: гідроксил, галоген, нітро, 3-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідроС1-6алктгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1[1,2,4]триазоло[4,3-а]піримідин, 8-[5-(3-Хлор-феніл)-[1,3,4]оксадіазол-26алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2-6алкініл, ОС 2С0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 3ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро6алкініл, [1,2,4]триазоло[4,3-а]піримідин, 6циклоалкіл, С 0-6алкіларил, ОС 0-6алкіларил, СНО, (CO)R5, O(CO)R 5, O(CO)OR 5, O(CN)OR 5, C18-{1-[5-(3-Хлор-феніл)-[1,3,4]оксадіазол-2-іл]5 5 5 етил}-3-піридин-4-іл-5,6,7,8-тетрагідро6алкілOR , ОС 2-6алкілOR , C 1-6алкіл(CO)R , OC 15 5 5 [1,2,4]триазоло[4,3-а]піримідин, 6алкіл(CO)R , C 0-6алкілCO2R , OC 1-6алкілCO2R , С 05 6 8-[5-(5-Хлор-феніл)-[1,2,4]оксадіазол-36алкілціано, ОС 2-6алкілціано, C 0-6алкілNR R , OC 25 6 C1-6алкіл(CO)NR5R6, OC1ілметил]-3-фуран-2-іл-5,6,7,8-тетрагідро6алкілNR R , 5 6 C0-6алкілNR5(CO)R6, OC2[1,2,4]триазоло[4,3-а]піримідин, 6алкіл(CO)NR R , 5 6 C0-6алкілNR5(CO)NR5R6; C08-{1-[5-(3-Хлор-феніл)-[1,2,4]оксадіазол-3-іл]6алкілNR (CO)R , 5 5 5 етил}-3-піридин-4-іл-5,6,7,8-тетрагідро6алкілSR , ОC 2-6алкілSR , C 0-6алкіл(SO)R , OC 25 5 5 [1,2,4]триазоло[4,3-а]піримідин, 6aлкiл(SO)R , C 0-6алкілSO2R , OC 2-6алкілSO2R , C 0алкіл(SO2)NR5R6, OC2-6алкіл(SO2)NR5R6, C03-Піридин-4-іл-8-[1-(5-м-толіл6 5 6 OC2-6алкілNR5(SO2)R6, C0[1,2,4]оксадіазол-3-іл)-етил]-5,6,7,8-тетрагідро6алкілNR (SO2)R , 5 5 6 OC2-6алкілNR5(SO2)NR5R6, [1,2,4]триазоло[4,3-а]піримідин. 6алкілNR (SO2)NR R , 5 6 (CO)NR R , O(CO)NR 5R6, NR5OR6, C0(+)-8-{(1S)-1-[5-(3-хлорфеніл)-1,2,4-оксадіазол5 6 5 6 5 3-іл]етил}-3-піридин-4-іл-5,6,7,8-тетрагідро6алкілNR (CO)OR , OC 2-6алкілNR (CO)OR , SO3R та 5- або 6-членне кільце, що містить атоми, неза[1,2,4]триазоло[4,3-а]піримідин, лежно вибрані з групи: С, Ν, Ο та S, де вказане (-)-8-{(1R)-1-[5-(3-хлорфеніл)-1,2,4-оксадіазолкільце може бути заміщеним одним або більше А. 3-іл]етил}-3-піридин-4-іл-5,6,7,8R5 та R6 незалежно вибрані з групи: гідроген, тeтрагідро[1,2,4]триазоло[4,3-а]піримідин, С1-6алкіл, С3-7циклоалкіл та арил. 3-[5-(3-Піридин-4-іл-6,7-дигідро-5НА вибрано з групи: гідроген, гідроксил, галоген, [1,2,4]триазоло[4,3-а]піримідин-8нітро, С1-6алкілгалоген, ОС1-6алкілгалоген, С1ілметил)[1,3,4]оксадіазол-2-іл]бензонгтрил, 3-{5-[3-(2-Метоксипіридин-4-іл)-6,7-дигiдро-5Н6алкіл, ОС 1-6алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2[1,2,4]триазоло[4,3-а]піримідин-86алкініл, ОС 2-6алкініл, С 0-6алкілС 3-6циклоалкіл, ОС 0С0-6алкіларил, ОС0ілметил][1,3,4]оксадіазол-2-іл}бензонітрил, 6алкілС 3-6циклоалкіл, 5 5 5 3-{5-[3-(2-Метокси-піридин-4-іл)-6,7-дигідро6алкіларил, СНО, (CO)R , O(CO)R , O(CO)OR , O(CN)OR 5, C1-6алкілOR5, OC 2-6алкілOR5, C15Н-[1,2,4]триазоло[4,3-а]піримідин-8-ілметил]5 5 5 [1,2,4]оксадіазол-3-іл}-бензонітрил, 6алкіл(CO)R , OC 1-6алкіл(CO)R , C 0-6алкілCO2R , 5 5 6 6алкілNR (SO2)NR R , 5 6 17 3-{3-[(3-піридин-4-іл-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл)метил]-1,2,4-оксадіазол-5-іл}бензонітрил, 3-(3-{[3-(2-метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]метил}-1,2,4-оксадіазол-5-іл)бензонітрил, 3-{5-[(3-(піридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8-ілметл][1,2,4]оксадіазол-3-іл)-бензонітрил, та 3-{5-[3-(2-Гідрокси-піридин-4-іл)-6,7-дигідро5Н-[1,2,4]триазоло[4,3-а]піримідин-8-ілметил][1,2,4]оксадіазол-3-іл}-бензонітрил. Підмножина переважних сполук формули II: 82435 18 У цих втіленнях X7 переважно, - N, а X8 переважно, - зв'язок. В одній підмножині сполук, X9 CR5 та X10 - NR 5, 0, CR 5R6, або (CR 5R6)2. У ще одній підмножині сполук, X8 переважно, S. У цьому сценарії X9 переважно, - CR5, а X10 є зв'язком. В інших втіленнях, X9 - N. У ще одному втіленні винаходу, конденсоване кільце, що містить X7, X8, X9 та X10 вибране з групи: , , , У формулі II структурні змінні визначені у формулі І. У цьому контексті X переважно - N. ще одна підмножина переважних сполук формули III: У формулі III, стр уктурні змінні визначені у формулі І. Переважно, X3 - С або N. В інших втіленнях винаходу, кільце, що містить X1, X2 , X3 , X4 та X5 вибране з групи: , , , , , , та Переважно, кільцем є: , , та Деякі інші втілення винаходу представлені наступними сполуками: 7-[5-(5-Хлор-2-флуор феніл)-1,2,4-оксадіазол3-іл]-3-(2-тієніл)-6,7-дигідро-5Н-[1,2,4]триазоло[3,4b][1,3]тіазин, 9-{[5-(3-хлорфеніл)-1,2,4-oксадіазал-3іл]метил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін, 9-{1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-3іл]етил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін, 7-{[5-{3-хлорфеніл)-1,2,4-оксадіазол-3іл]метил}-3-піридин-4-іл-6,7-дигідро-5Н-піроло[2,1с][1,2,4]триазол, 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3іл]метил}-3-(трифлуорметил)-6,7,8,9-тетрагідро5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін, 8-[3-(3-Хлор-феніл)-[1,2,4]оксадіазол-5-іл]-3-(4метокси-феніл)-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піразин, 8-[3-(3-Хлор-феніл)-[1,2,4]оксадіазол-5-іл]-3-(4метокси-феніл)-7-метил-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піразин, 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-(3,5дифлуорсреніл)-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін, 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3-(4метоксифеніл)-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3] діазепін, 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін, 9-{[5-(5-хлор-2-флуор феніл)-1,2,4-оксадіазол3-іл]метил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін, 9-{[5-(3-хлорфеніл)-1,2,4-oксадіазол-3іл]метил}-3-(3,5-дифлуорфеніл)-6,7,8,9-тетрагідро5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін, 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3іл]метил}-3-(4-метоксифеніл)-6,7,8,9-тетрагідро5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін та їх фармацевтично прийнятні солі. Втілення винаходу о хоплюють сольові форми сполук формули І. Солі для застосування у фармацевтичних композиціях повинні бути фармацевтично прийнятними солями, але інші солі можуть 19 82435 20 представляти користь в отриманні сполук формукування інгібувальної дії mGluR5 у ссавців, охопли І. Придатною фармацевтично прийнятною сіллюючи людину. лю сполуки винаходу є, наприклад, кислотноГрупа І рецепторів mGluR, охоплюючи адитивна сіль, наприклад, з неорганічною або орmGluR5, є високо експресованою у центральній та ганічною кислотою. На додаток, придатною фарпериферійній нервовій системі та в інших тканимацевтично прийнятною сіллю сполуки винаходу є нах. Отже, можна очікувати, що сполуки винаходу сіль лужного металу, сіль лужноземельного метає добре придатними для лікування опосередковалу або сіль з органічною основою. Інші фармацевних mGluR5 розладів, як-то гострі та хронічні нетично прийнятні солі та способи отримання цих врологічні та психіатричні розлади, шлунковосолей можна знайти, наприклад, у [Remington's кишкові розлади, та хронічні та гострі больові розPharmaceutical Sciences (18th Edition, Mack лади. Publishing C0,) 1990]. Винахід стосується сполук формули І, які виДеякі сполуки формули І можуть мати хіральні значено вище, для застосування у терапії. центри та/або центри геометричної ізомери (Е- та Винахід стосується сполук формули І, які виZ- ізомери), та слід розуміти, що винахід охоплює значено вище, для застосування у лікуванні опоусі так оптичні, діастереоізомерні та геометричні середкованих mGluR5 розладів. ізомери. Винахід стосується сполук формули І, які виВинахід також стосується будь-яких та усіх тазначено вище, для застосування у лікуванні сеніутомерних форм сполуки формули І. льної деменції при хворобі Альцпеймера, індукоВинахід крім того стосується гідратів та сольваної СНІД деменції, хвороби Паркінсона, бічного ватів сполуки формули І. аміотрофічного склерозу, хореї Хантингтона, мігФармацевтична композиція рені, епілепсії, шизофренії, депресії, тривожності, Згідно з одним аспектом заявленого винаходу гострої тривожності, офтальмологічних розладів, запропоновано фармацевтичну композицію, що як-то ретинопатії, діабетичної ретинопатії, глаукомістить як активний інгредієнт терапевтично ефекми, слухови х невропатичних розладів, як-то дзеньтивну кількість сполуки формули І, або її солі, сокіт у вуха х, індукованої хемотерапією невропатії, львату або сольватованої солі, в асоціації з одним постгерпетичної невралгії та тригемінальної неабо більше фармацевтично прийнятним розріджувралгії, толерантності, залежності, крихкості X, вачем, наповнювачем та/або інертним носієм. аутизму, затримки психічного розвитку, шизофреКомпозицію можна представляти у формі, нії та синдрому Да уна. придатній для перорального застосування, наприВинахід стосується сполук формули І, які виклад, як таблетку, пілюлю, сироп, порошок, гранузначено вище, для застосування у лікуванні болю лу чи капсулу, для парентеральної ін'єкції (охоппри мігрені, болю при запаленні, невропатичних люючи внутрішньовенну, підшкірну, больових розладів, як-то діабетичної невропатії, внутрішньом'язову, внутрішньосудинну або інфуартриту та ревматоїдних хвороб, поперекового зію) як стерильний розчин, суспензію або емульболю, постоперативного болю та болю, асоційовасію, для місцевого застосування наприклад, як ного з різними станами, охоплюючими стенокармазь, пластир чи крем або для ректального застодію, ниркові та біліарні кольки, менструацію, мігсування наприклад, як супозиторій. рень та подагру. Взагалі вищенаведені композиції можна отриВинахід стосується сполук формули І як вимувати у звичайними способами з одним або бізначено вище, для застосування у лікуванні інсульше звичайними наповнювачами, фармацевтичльту, травми голови, аноксичних та ішемічних поно прийнятними розріджувачами, та/або інертними ранень, гіпоглікемії, серцево-судинних хвороб та носіями. епілепсії. Придатними добовими дозами сполук формуНаступним аспектом винаходу є застосування ли І у лікуванні ссавця, охоплюючи людину, є присполуки формули для виробництва медикаменту близно 0,01-250мг/кг мас тіла при пероральному для лікування або попередження ожиріння та спозастосуванні та приблизно 0,001-250мг/кг мас тіла ріднених з ожирінням станів, а також лікування при парентеральному застосуванні. Типова доборозладів харчування інгібуванням надлишкового ва доза активних інгредієнтів варіює у широких поглинання їжі, а в результаті ожиріння та асоцімежах та залежатиме від різних факторів, як-то йованих з ним ускладнень. доречні показання, суворість хвороби, яку лікують, Заявлений винахід також стосується застосушлях застосування, вік, маса та стать пацієнта та вання сполук формули І, які визначено вище, у конкретна застосована сполука, та може бути вивиробництві медикаменту для лікування опосерезначена лікарем. дкованих групою І рецепторів mGluR5 розладів та Медичне застосування будь-якого розладу, наведеного вище. Одне втіВиявлено, що сполуки згідно з заявленим вилення винаходу стосується застосування сполуки находом, виявляють високий ступінь потужності та формули у лікуванні шлунково-кишкових розладів. селективності стосовно індивідуальних підтипів Ще одне втілення винаходу стосується застометаботропічного рецептору глутамату (mGluR). сування сполуки формули для виробництва медиВідповідно, сполуки заявленого винаходу, як можкаменту для інгібування тимчасової релаксації на очікувати, будуть корисними у лікуванні станів нижчого стравохідного сфінктера, для лікування асоційованих зі збуджувальною активацією ХШСР, для попередження Ш.-С. рефлюксу, для mGluR5, та для інгібування нейронних пошколікування регіргутації, лікування астми, лікування джень, викликаних збуджувальною активацією ларингіту, лікування хвороби легень та для терапії mGluR5. Сполуки можна застосовувати для продупоганої додачі ваги. Наступне втілення винаходу 21 82435 22 стосується застосування сполуки формули для ду проведенням прийнятних перетворень та етапів виробництва медикаменту для лікування або посинтезу у придатному порядку, зрозуміє фахівець передження функціональних шлунково-кишкових з органічного синтезу. Приклади перетворень нарозладів, як-то функціональна диспепсія (ФД). Ще дані нижче, і слід розуміти, що описані перетвоодним аспектом винаходу є застосування сполуки рення не обмежені тільки загальними групами або формули для виробництва медикаменту для лікузамісниками, для яких показані перетворення. Повання або попередження синдрому подразненої силання на інші придатні перетворення надані у товстої кишки (СПТК), як-то СПТК з перевагою ["Comprehensive Organic Transformations - A Guide запору, СПТК з перевагою діареї або СПТК з пеto Functional Group Preparations" R. C. Larock, VHC ревагою змінного випорожнення. Publishers, Inc. (1989)]. Посилання та описи інших Винахід також стосується способу лікування придатних реакцій описані у підручниках органічопосередкованих mGluR5 розладів та будь-якого ної хімії, наприклад, ["Ad vanced Organic Chemistry", розладу, наведеного вище, у пацієнта, який потерMarch, 4th ed. McGrawHill (1992) чи "Organic пає від вказаного стану чи має його ризик, який Synthesis", Smith, McGrawHill, (1994)]. Способи полягає у застосуванні до пацієнта ефективної очистки інтермедіатів та кінцевих продуктів охопкількості сполуки формули І, яку визначено вище. люють, наприклад, пряму та зворотно-фазову Доза, потрібна для терапевтичного або попехроматографію на колонці або обертовому планреджувального лікування конкретного розладу шеті, перекристалізацію, перегонку та екстракцію обов'язково варіюватиме залежно від особи, яку рідина-рідина або тверда фаза-рідина, які зрозуміє лікують, шляху застосування та суворості хвороби, фа хівець. Визначення замісників та груп є такими, яку лікують. яку формулі І, за винятком визначених окремо. У контексті представленого опису, термін "теТермін "кімнатна температура" та "зовнішня темрапія" та "лікування" охоплює попередження чи пература" означає, якщо не визначене інше, темпрофілактику, якщо не визначене інше. Терміни пературу між 16 та 25°С. "терапевтичний" та "терапевтично" слід розуміти Термін "рефлюкс" означає, якщо не визначене відповідно. інше, посилання на температур у кипіння або вище У цьому описі, якщо не визначене інше, термін застосовуваного розчиннику. "антагоніст" та "інгібітор" означає сполуку, що Скорочення будь-яким чином, частково або повністю, блокує BINAP 2,2'Біс(дифенілфосфіно)-1,1 '-динафтил шлях переносу, що призводить до реакції з ліганВсю, ВОС трет-бутоксикарбоніл дом. CDI Ν,Ν'-Карбонілдіімідазол Термін "розлад", якщо не визначене інше, dba Дибензиліденацетон означає будь-які стан та хворобу, асоційовані з DСС Ν,Ν-Дициклогексилкарбодіімід активністю метаботропічних рецепторів глутамату. ДХМ Дихлорметан Немедичне застосування DEA Ν,Ν-Діізопропілетиламін На додаток до їх застосування у терапевтичній DIBAL-H Діізобутилалюмогідрид медицині, сполуки формули І, їх солі та гідрати, є DIC Ν,Ν'-Діізопропілкарбодіімід також корисними як фармакологічні засоби у розDMAP N,N-Диметил-4-амінопіридин робці та стандартизації тест-систем in vitro та in ДМФ Диметилформамід vi vo для оцінки дії інгібіторів mGluR стосовно актиДМСО Диметилсульфоксид вності у лабораторних тваринах, як-то кішки, собаDPPF 1,1'-Біс(дифенілфосфіно)фероцен ки, кролі, мавпи, щури та миші, як частини досліЕА або EtOAc Етилацетат дження нових терапевтичних агентів. EDC, EDC1 N-[3-(диметиламіно)пропіл]-N'Способи отримання етилкарбодіімід гідрохлорид Ще один аспект заявленого винаходу стосуEt Етил ється способів отримання сполук формули І або їх Et2O Діетиловий етер солей та гідратів. Способи отримання сполук у Etl Йодетан заявленому винаході описані тут. EtOH Етанол У наступному описі таких способів слід розуміEt3N Триетиламін ти, що там, де прийнятно, придатні захисні групи Fmoc, FMOC 9-Флуоренілметоксикарбоніл слід додавати до різних реактивів та інтермедіатів, НBTU О-СБензотриазол-1-іл-N,N,Ν',Ν'а потім видаляти з них, таким чином, як розуміє тетраметилуроній гексафлуорфосфат фа хівець з органічного синтезу. Звичайні способи HetAr Гетероарил застосування таких захисних груп, а також приклаHOBt N-Гідроксибензотриазол ди придатних захисних груп описані, наприклад, у ВЕРХ високоефективна рідинна хроматогра["Protective Groups in Organic Synthesis", T.W. фія Green, RGM. Wuts, Wiley-lnterscience, New York, LAH літій алюмогідрид (1999)]. Слід також розуміти, що перетворення РХ/МС ВЕРХ мас-спектроскопія групи або заміснику в іншу гр упу або замісник хіміМХПБК м-хлорбензойна кислота чним перетворенням можна проводити на будьMe Метил якому інтермедіаті або кінцевому продукті на шляMeCN Ацетонітрил ху синтезу кінцевого продукту, у якому можливий Mel Йодметан тип перетворення обмежено тільки несумісністю з Ме МgСІ метилмагній хлорид іншими функціональними групами у молекулі на МеОН Метанол цьому етапі умов або реагентів застосовуваних у NaOAc натрій ацетат перетворенні. Такі несумісності, та шляхи їх обхоnBu нормальний бутил 23 82435 24 nBuLi, н-BuLi 1-бутиллггій че, у ДМФ, ТГФ, ДХМ то що при -20-120°С, а потім NCS N-хлорсукцинімід замиканням кільця утвореного спочатку ациклічноЯМР ядерний магнітний резонанс го інтермедіату спонтанно в умовах ацилування, ОАс ацетат або нагріванням при 50-150°С у піридині або у OMs мезилат або метансульфонат водних розчинниках у присутності основи, як-то OTs тозилат, толуолсульфонат або 4натрій гідрокарбонат чи карбонат, зі співрозчинниметилбензолсульфонат ками або без них, як-то діоксан, ТГФ, МеОН, EtOH PPTS піридиій п-толуолсульфонат або ДМФ. Цей ациклічний інтермедіат можна таpTsOH п-толуолсульфонова кислота кож утворювати обробкою підхожого ацилгідразиТФЕ твердо-фазна екстракція ду придатним ізотіоціанатом, наприклад, у 2TBAF тетрабутиламоній флуорид пропанолі, ДХМ, ТГФ то що при -20-120°С. tBu, т-Bu трет-бутил [1,2,4]оксадіазоли tBuOH, т-BuOH трет-бутанол TEA Триетиламін ТГФ Тетрагідрофуран Отримання інтермедіатів Сполуки та відповідні інтермедіати, необмежувальні шляхи синтезу яких надані нижче, є корисними для наступного отримання сполук формули І або можуть бути ними. Інші вихідні матеріали є комерційно доступними або їх можна отримувати способами, описаними у літературі. На схемі 2, [1,2,4]оксадіазоли з альфа[1,2,4]триазолтіони та алкілсульфокарбоном стосовно гетероциклу, де G1, G 2 та G3 ніл[1,2,4]триазоли визначені, як описано у схемі 2, утворюють циклізацією G1- та С2-заміщених ацилоксіімідамідів у розчинниках, як-то піридин, ДМФ, або вода, що містить їх суміші, при 40-140°С, альтернативно у водно-спиртових розчинниках у присутності натрій ацетату при температурах 40-140°С, останній спосіб є переважним, якщо одна група G1 або G2 містить хіральний стереоцентр. Ацилоксіімідаміди утворюють сполученням з підхожим засобом ацилування, що несе відщеплювану груп у LG з С1На схемі Іа, алкілсульфоніл[1,2,4]триазоли заміщеним гідроксамідином. Відщеплюваною груможна отримувати з відповідних пою LG може бути хлор або будь-яка інша придат[1,2,4]триазолтіонів спочатку алкілуванням атому на відщеплювана група як, наприклад, створена сульфур у первинними алкілгалогенідами, як-то обробкою на місці відповідної кислоти (LG - ОН) Mel та Etl (алкілом є Me та Et, відповідно) у МеОН, стандартними активувальними реагентами, як EtOH, ТГФ, ацетоні тощо при -30-100°С, а потім описано тут нижче. G-заміщені гідроксамщини окисненням атому сульфур у, наприклад, КМnО4 у утворюють реакцією відповідного нітрилу з вільсуміші води та оцтової кислоти, або мХПБК у ДХМ, ною основою гідроксиламіну, або гідроксиламін при -20-120°С, або застосуванням будь-якого інгідрохлориду у присутності основи, як-то триетишого придатного окиснику. ламін, піридин або натрій карбонат, у розчинниках, як-то етанол, вода або піридин, при температурах -20-120°С Циклічні аміно[1,2,4]триазоли На схемі Іb, [1,2,4]триазолтіони, де R' є придатним бічним ланцюгом, який може бути або не бути захищеним, є, наприклад, отриманими Nацилуванням тіосемікарбазиду, будь-яким придатним засобом ацилування, як-то хлорангідридами, бромангідридами або флуорангідридами (LG - СІ, Br або F), наприклад, у піридині, або кислотами (LG - ОН), що активовані обробкою стандартними активувальними реагентами, які описано тут ниж На схемі 3, циклічні аміно[1,2,4]триазоли, де R - X6-R3, як визначено у формулі І, отримують обробкою циклічних карбоно-2-он-гідразонів (наприклад, 1,3-діазепан-2-он-гідразон для n=3 або подібний) з підхожим засобом ацилування, що несе відщеплювану гр упу LG, у придатному розчиннику, як-то ТГФ, піридин або ДМФ при -20-100°С. Реакція спочатку призводить до відкритого інтермедіату, що утворює триазол кільце спонтанно, або можна зробити так звичайним або мікрохвильовим нагріванням при 50-200°С, наприклад, у піридині 25 82435 26 або ДМФ. Відщеплюваною групою LG може бути хлор, бром або флуор (LG - СІ, Br або F), відповідний ангідрид (LG - O-C(=O)R) або будь-яка інша придатна відщеплювана група як, наприклад, створена обробкою на місці відповідної кислоти (LG - ОН) стандартними активувальними реагентами, як описано тут вище. Циклічні карбоно-2-онНа схемі 5, де Аг - 5-R1, 2-R 2-феніл, як визнагідразони можна створювати з ізотіосечовин, у чено у формулі І, [1,2,3]триазол-4-карбальдегіди яких S-алкіл (наприклад, S-Me або S-Et) діє, як можна отримувати з арил-глюкозатриазоли оксивідщеплювана група при обробці гідразином у роздативним розщепленням, застосовуючи, напричинниках, як-то піридин, метанол, етанол, 2клад, перйодатну кислоту уводних сумішах діокпропанол, ТГФ тощо при -20-180°С. Відкритий інсану або ТГФ при -20-120°С. Арилтермедіат можна також безпосередньо створюваглюкозатриазоли можна отримувати циклізацією ти обробкою ізотіосечовин ацилгідразидами у тих інтермедіату арил-глюкозазону у присутності купже умовах, як описано для реакції з гідразином. рум(ІІ) сульфату у водни х сумішах, наприклад, Циклічні ізотіосечовини отримують S-алкілованих діоксану або ТГФ при -20-120°С. Арил гпюкозазон відповідних тіосечовин, як є комерційно доступниу свою чергу отримують сполученням арилгідрами або отримані стандартними способами, відозинів з фруктозою в оцтовій кислоті та воді при мими фахівцю, наприклад, з Mel або Etl в ацетоні, 20-120°С. [Buckler,R.;Hartzler, Η.; Kurchacova, Ε.; EtOH, ТГФ, ДХМ тощо при -100-100°С. Nichols, G; Phillips, В.; J. Med. Chem.; 1978; 21(12); Карбоциклічні [1,2,4]триазоли 1254-1260, та Riebsomer, J.; Sumrell, G; J. Org. Chem.; 1948; 13(6); 807-814]. Ізоксазол-5-карбонової кислоти естери На схемі 4, де R - Η або алкіл (Me, Et), a R1 X -R 3, як визначено у формулі І, карбоциклічні [1,2,4]триазоли отримують обробкою циклічних лактам-гідразонів підхожим засобом ацилування для отримання інтермедіату з відфитим ланцюгом, який утворює триазольне кільце спонтанно або нафіванням, як описано тут ви ще. Такі циклічні лактам-гідразони створюють з циклічного енольного етеру, у, якому О-алкіл (алкіл - Me) діє, як відщеплювана група при обробці гідразином, як описано тут вище. Такі інтермедіати з відкритим ланцюгом можна також утворювати безпосередньо обробкою лактам-енольних етерів обробкою ацилгідразидами, як описано тут ви ще. Лактаменольні етери отримують з їх відповідних лактамів обробкою Me3OBF4 або диметилсульфатом [Org.Prep.Proced.lnt;24, 1992, pp.147-158 або Tetrahedron Lett. 42, 2001, pp.173-1776]. Rзаміщені лактами є комерційно доступними або їх можна отримувати алкілуванням в альфа позиції обробкою 2 еквівалентами сильної основи, як-то нBuLi, а потім додаванням 1 еквіваленту алкілувального засобу, як-то алкілгалогенід, мезилат або трифлат, в апротонних розчинниках, як-то ТГФ [J.Org. Chem. 64,1999, pp.6041-6048] або, альтернативно, N-захищеним лактамом, наприклад, триметилсиліл-валеролактамом, де тільки один еквівалент основи необхідний для створення аніону для алкілування [J.Org. Chem. 65, 2000, pp.26842695]. Алкілування призводить до утворення рацемічного продукту, який можна розділяти на енантіочисті форми, або на останньому етапі шляху синтезу, наприклад, хіральною хроматографією. 2-Арил-2Н-[1,2,3]триазол-4-карбальдегіди 6 На схемі 6 ізоксазоли утворюють реакцією та циклізацією на місці похідних діоксобутиратних естерів з гідроксиламін гідрохлоридом у розчинниках, як-то етанол, 2-пропанол або ДМФ при температурах 40-140°С. Діоксобутиратні естери утворюють реакцією ацетофенонів з діалкілоксолатами (алкілом є, наприклад, Me або Et) у присутності сильної основи, як-то натрій гідрид, у розчинниках, як-то ДМФ або толуол, при -20-120°С. [1,3,4]оксадіазоли На схемі 7, де R - Η або алкіл (Me, Et), починаючи з гідразидів кислот, сполучення з аліфатичним хлорангідридним похідним у ТГФ, ДМФ, толуол тощо, як варіант, у присутності основи, як-то триетиламін або карбонат, призводить до утворення похідного ацилбензогідразиду, який циклізують при підвищених температурах у присутності засобу дегідратування, як-то фосфор пентоксид у розчинниках, як-то толуол або ДМФ або їх суміші, з отриманням [1,3,4]оксадіазол продукт. Альтернативно, [1,3,4]оксадіазоли можна отримувати безпосередньо з гідразиду кислоти, застосовуючи триалкіл-ортоестери чистими або у розчинниках, 27 82435 28 як-то толуол або ксилоли при підвищених темпеотримувати 1,3-диполярним циклододаванням ратурах. солі діазонію до арил-сульфоніл-гідразону, а потім Триазолові етери елімінацією арилсульфінової кислоти для створення тетразольного кільця, у протонних розчинниках, як-то вода, та спирт або їх суміші, в основних апротонних розчинниках, як-то піридин, або сумішах цих розчинників з протонними розчинниками, застосованими для створення солі діазонію. [J. Med. Chem. 2000, 43, 953-970]. Солі діазонію у свою чергу є доступними з відповідно заміщеного арил- або гетероарил-аміну добре відомими споНа схемі 8, де R - Η або алкіл (Me, Et), R' є собами, діазотуванням, застосовуючи нітрит, як-то придатним бічним ланцюгом, який може бути або натрій нітрит або ізоаміл нітрит у присутності прине бути захищеним, як треба, a R" - X6-R3 , як видатного джерела кислоти, як-то хлоридна кислота значено у формулі І, зв'язані з оксигеном триазоли або тетрафлуорборна кислота у розчиннику, як-то можна отримувати утворенням зв'язку нуклеофівода, при температурі -10-0°С. У випадку, де є льним заміщенням відщеплюваної групи (LG), у застосовуваним менш розчинний протиіон X", якякому спирт діє, як О-нуклеофіл в основних умото тетрафлуорборат, так утворену сіль діазонію вах. Застосованою основою є, наприклад, NaH або можна збирати осадженням та застосовувати у цезій карбонат, при температурах 0-80°С у полярнаступних реакціях у неводних умовах. Розчинні них апротонних некислотних розчинниках, як-то солі діазонію, утворені застосовуючи інші джерела ДМФ або ацетонітрил. Прикладами придатних кислот, можна осаджувати додаванням придатновідщеплюваних гр уп є алкілсульфоніли, як-то мего реагенту, як-то тетрафлуорборна кислота або тансульфоніл та етансульфоніл, та галогени, як-то натрій тетрафлуорборат. хлор. Арилгідразони та Арилсульфонілгідразони На схемі 9, арилсульфонілгідразони отримують конденсацією між альдегіди, наприклад, коричним альдегідом або гліоксапевою кислотою, з арилсульфонілпдразинами, як-то 4толуолсульфонілгідразин, у придатному розчиннику, наприклад метанол, етанол, ДМФ або діалкілтери, при температурі між 0-100°С, альтернативно без розчиннику під мікрохвильовим опромінюванням. Подібним чином, арилгідразони можна утворювати реакцією арилгідразинів, з альдегіди. [J. Med. Chem,1980, 23, 631-634; Monatshefte fuer Chemie 2001,403-406; J. Med. Chem. 2000,43, 953 970; J. Med Chem. 1978, 21, 1254-60] Утворення тетразолів На схемі 10а, тетразоли, де G - електрофільна група, як-то олефін, карбоніл або арил, можна На схемі 10и, тетразоли можна також отримувати реакцією арилгідразону, де G є визначено у схемі 9 та 10, з арилазидом у придатному розчиннику, як-то етанол або піридин. [J. Med. Chem. 1978, 21, 1254-60]. Арилазиди можна утворювати, наприклад, застосуванням натрій азиду з сіллю арилдіазонію, яку можна, у свою чергу, отримувати, як описано вище з ариламіну, наприклад, аніліну або 2,4,6-триброманіліну. Арилазид можна вважати реагентом переносу нітрогену, оскільки циклододавання до гідразону супроводжується елімінацією для регенерації' ариламінового попереднику до солі діазонію. Отримання 2-арил-тетразол-5-карбонілів Звичайно, G, як на схемі 10а та 10b, є групою, яка може бути застосовуваною як попередник групи X6 у сполуках формули І, як-то олефін або карбонова кислота або похідне кислоти. На схемі 11, коли G - арилолефін, похідний, наприклад, від коричного альдегіду, де R - Н, олефін можна розщепити з утворенням альдегіду безпосередньо в одній посудині, застосовуючи реагент, як-то озон або через діол, застосовуючи реагент дигідроксилування, як-то осмій тетроксид, як відомо фахівцю, а потім наступним розщепленням, застосовуючи 29 82435 реагент, як-то плюмбум(І\/) ацетат. Коли є застосовуваним заміщений коричний альдегід, як-то αметилкоричний альдегід, де R - метил, результатом розщеплення олефіну є кетон. [J. Med. Chem. 2000, 43, 953-970]. Перетворення функціональних груп На схемі 12, аліфатичні спирти можна, наприклад, перетворити стандартними способами у відповідні галогеніди застосуванням, наприклад, трифенілфосфіну у комбінації з йодом, Nбромсукцинімідом або N-хлорсукцинііиідом, або альтернативно обробкою трибромфосфіном або тіонілхлоридом. Спирти можна перетворити в інші відщеплювані групи, як-то мезилати або тозилати, застосуванням прийнятного сульфонілгалогеніду або сульфонілангідриду у присутності ненуклеофільної основи разом зі спиртом для отримання відповідних сульфоналів. Хлориди або сульфонати можна перетворити у відповідні броміди або йодиди обробкою бромідом, наприклад, LiВr, або йодидом, як-то Lil. Наступні стандартні способи отримання спиртів охоплюють відновлення відповідної групи з карбонілом, як-то метиловий або етиловий естери, альдегіди або кетони, застосуванням звичайних відновників, як-то борани, літій борогідрид, літій алюмогідрид або водень у присутності каталізатору перехідного металу, як-то комплекси, наприклад, рутенію або іридію, або альтернативно паладію на вугіллі. Ке тони та вторинні спирти можна отримувати обробкою естерів карбонової кислоти та альдегідів, відповідно, прийнятним карбон-нуклеофілом, як-то алкіл-реагенти Гриньяра або алкіл-літій стандартними способами. Гетероароматичні альдегіди можна отримувати з відповідних первинних спиртів способами окислення, добре відомими фахівцю, як-то застосуванням МnО2, як окиснику, або окисленням Свема. Отримання кінцевих сполук Наступні описані необмежувальні способи отримання кінцевих сполук ілюстровані та показані на схемах, у яких загальні групи, або інші структурні елементи інтермедіатів відповідні формулі І. Слід розуміти, що інтермедіат, що містить будь-які інші загальні групи або структурні елемент, ніж у формулі І, можна застосовувати у показаній реакції, за умови, що ця група або елемент не заважає реакції та, що її можна хімічно перетворити у відповідну груп у або елемент формули І на останньому етапі, як це відомо фахівцю. Нуклеофільним внутрішньомолекулярним заміщенням 30 На схемі 13, де R" - Η або алкіл (Me, Et), R - Η або алкіл (Me, Et) та R1 є X6-R3 , як визначено у формулі І, сполуки формули І можна, наприклад, отримувати утворенням зв'язку нуклеофільним заміщенням відщеплюваної групи (LG), у якій нуклеофільний атом може бути атомом амінонітрогену гетероциклічного аміну, альфа-карбоном заміщеного алкілом гетероароматичного кільця. Атоми аміно-нітрогену гетероциклічних амінів, та альфа-карбони заміщених алкілом гетероароматичних кілець, загалом не є реакційними у нейтральній протонованій формі та тому переважно повністю або частково перетворюються у більш нуклеофільні аніонні форми обробкою основи у придатних розчинниках, як-то LDA, HMDS-лужний, або н-BuLi у ТГФ, діетиловому етері або толуолі, або NaH, наприклад, у ДМФ, або калій карбонат або цезій карбонаті в ацетонітрилірилі або кетонах, як-то 2-бутанон, на місці або безпосередньо перед реакцією з придатним електрофілом, що несе відщеплювану гр упу, при температурі -100150°С. Атоми нітрогену вторинних аліфатичних амінів є загалом достатньо нуклеофільними для заміщення відщеплюваної групи у відповідних нейтральних формах, але переважно для полегшення реакції додають основу, як-то калій карбонат, цезій карбонат, TEA, DEA то що, у розчинниках, як-то ацетонітрил, ДМФ або ДХМ при 0-150°С. Для карбонових нуклеофілів відщеплювана група, переважно, - бром, для нітрогенових нуклеофілів приклади придатних відщеплюваних гр уп LG охоплюють хлор, бром, OMs та OTs. Як варіант, каталітичні або стехіометричні кількості йодиду лужного металу, як-то Lil можуть бути присутніми у реакції для її полегшення нуклеофільним заміщенням на місці відщеплюваної групи на йод. Нуклеофільним внутрішньомолекулярним заміщенням На схемі 14, де R - Η або алкіл (Me, Et), a X - S або О, сполуки формули І можна, наприклад, отримувати утворенням внутрішньомолекулярного зв'язку нуклеофільним заміщенням відщеплюваної групи (LG), у якій нуклеофільний атом може бути a-карбоном заміщеного алкілом гетероароматичного кільця в умовах, які описано тут ви ще для 31 82435 внутрішньомолекулярних заміщень, де переважними основами є, наприклад, LDA, FDVIDSлужний, або NaH, як описано тут ви ще. Отримання конденсованих піперазинтриазолів 32 Ізоксазольні сполуки винаходу можна отримувати, як показано у схемі 16, нижче. Одна груп А та В представляє заміщений феніл, а інша представляє дициклічну кільцеву систему сполук формули І; альтернативно, А та В представляють попередники цих груп: На схемі 15а, триазолопіперазини можна отримувати з похідних піперазинону спочатку Nзахистом для отримання інтермедіату II. Інтермедіат можна тоді гідролізувати до кислоти III. Відповідний 1,2,4-оксадіазол IV можна тоді створювати, як описано вище. Триазолопіперазиновий інтермедіат VI можна тоді отримувати спершу перетворенням IV у циклічний імідоат реагентом, як-то Me3O+BF 4- або диметилсульфат [(ref: a) Sheu, Jennline; Smith, Michael В.; Oeschger, Thomas R.; Satchell, Jacqueline; Org.Prep.Proced.ini; 24; 2; 1992; 147-158; b) Hutchinson, Ian S.; Matlin, Stephen Α.; Mete, Antonio, Tetrahedron Lett.; 42; 9; 2001; 1773-1776). Алкоксил можна тоді заміщати ацилгідразидом (або гідразином із засобом ацилування, як описано у схемі 4), а потім конденсувати із замиканням кільця для утворення триазолгетероциклу. Це можна робити в етанолі, толуолі, ДМФ або піридині при нагріванні або під мікрохвильовим опромінюванням [ref: Lawson, Edward С; Hoekstra, William I; Addo, Michael R; AndradeGordon, Patricia; Damiano, Bruce P.; Kauffman, Jack Α.; Mitchell, John Α.; Maryanoff, Bruce E.; Bioorg. Med. Chem. Lett; EN; 11; 19; 2001; 2619-2622]. Захисну гр упу можна тоді видаляти, отримуючи сполуки формули А. Сполук А можна тоді піддавати відновному алкілуванню для вивільнення сполуки формули В. Альтернативно, сполуки формули А та В також можна отримувати згідно з послідовністю реакцій, ілюстрованою у схемі 15b, як показано нижче. Детальніше, сполуки формули 16е можна отримувати 1,3-диполярним циклододаванням між сполуками формул 16а та 16Ь в основних умовах, застосовуючи придатну основу, як-то натрій гідрокарбонат або триетиламін, при придатній температурі (0°С-100°С) у розчинниках, як-то толуол. Синтез сполуки типу 16а раніше описано у літературі, наприклад, [Kim, Jae Nyoung; Ryu, Eung K; J. Org. Chem. (1992), 57, 6649-50].1,3-Диполярне циклододавання з ацетиленами типу 16b можна також виконати, застосовуючи заміщені нітрометани типу 16с активацією з електрофільним реагентом, як-то PhNCO, у присутності основи, як-то триетиламін при підвищених температурах (50-100°С). [Li, C-S.; Lacasse, E.; Tetrahedron Lett. (2002) 43; 3565-3568]. Деякі сполуки типу 16с є комерційно доступними, або їх можна синтезувати стандартними способами, відомими фахівцю. Альтернативно, сполуки формули 16d, які є доступними конденсацією Клаузена метилкетону та естеру, застосовуючи основні умови, застосо 33 82435 34 вуючи так основи, як натрій гідрид або калій трет1 [3-(2-Тієніл)-5-тіоксо-1,5-дигідро-4Н-1,2,4бутоксид, можуть давати сполуки формули 16е триазол-4-іл]оцтова кислота конденсацією та наступною циклізацією, застосоМетил N-(тіоксометилен)гліцинат (2,06г) та вуючи гідроксиламін, наприклад, у формі хлориду, тіофен-2-карбогідразид (2,57г) в ізопропанолі при підвищених температурах (60-120°С). (50мл) нагрівали при 70°С при перемішуванні проСлід розуміти, що для обох способів може бутягом 16 годин. Суміші давали досягти кімнатної ти необхідним захист інтермедіатів та/або наступтемператури та утворений осад збирали та нагріне перетворення функціональних гр уп, як зрозумівали при кипінні під зворотним холодильником в ло фахівцям. У випадку естерних груп, ці 1,0Μ водн натрій гідрокарбонат розчин протягом 2 перетворення можуть охоплювати, але без обмегодин. Після охолодження до кімнатної температуження, будь-який з наступних трьох способів: а) ри та підкислення концентрованою НСІ (водн.) Повне відновлення, застосовуючи придатний відпродукт екстрагували етилацетатом, який проминовник, як-то LAH у розчинниках, як-то ТГФ. b) вали розсолом та тоді сушили безводним магній Часткове відновлення, застосовуючи придатний сульфатом та концентрували до сухого стан у з селективний відновник, як-то DIBAL, а потім алкіотриманням сирої заголовної сполуки, яку застолування алкілгалогенідом. с) Алкілування, застосовували безпосередньо на наступному етапі. совуючи алкілметалевий реагент, як-то алкілПриклад 2 магній галогенід у розчинниках, як-то толуол або 4-(2-Гідроксіетил)-5-(2-тієніл)-2,4-дигідро-3НТГФ, а потім відновлення, наприклад, натрій боро1,2,4-триазол-3-тіон гідридом у метанол. Сиру [3-(2-тієніл)-5-тіоксо-1,5-дигідро-4Н-1,2,4Винахід далі ілюстровано наступними необтриазол-4-іл]оцтову кислоту з попереднього етапу межувальними прикладами. розчиняли у ТГФ (20мл). Цей розчин додавали Загальні способи краплями при 0°С до кашки літій алюмогідриду (2г) Усі вихідні матеріали є комерційно доступними у ТГФ (80мл) при перемішуванні і давали досягти або описані у літературі. 1Н та 13С спектри ЯМР кімнатної температури протягом 2 годин. Реакційреєстрували на спектрометрах Bruker 300, Bruker ну суміш тоді гасили насиченим водним натрій DPX400 або Varian +400 при 300, 400 та 400МГц сульфатом при 0°С та рН доводили до 3-4 перед для 1Н ЯМР відповідно, застосовуючи сигнал ТМС фільтрування через броунмілерит. ТГФ видаляли або залишкового розчиннику як внутрішній станз фільтрату концентруванням та продукт екстрагударт, у дейтерованому хлороформі як розчиннику, вали етилацетатом із залишкової водної суміші. якщо не визначене інше. Усі хімічні зсуви наведеЕтилацетатну фазу тоді промивали розсолом та но у млн -1 на дельта-шкалі, та розщеплення сигсушили безводним магній сульфатом та концентналів позначено як s: синглет, br s: широкий сингрували до сухого стан у з отриманням сирого малет, d: дублет, t: триплет, q: квартет, m: теріалу, що перекристалізовували з МеОН з утвомультиплет. Аналітичне розділення рідинною хроренням 485мг заголовної сполуки. 1Н ЯМР (ДМСОматографією, а потім мас-спектроскопією, реєстd6): 13,94 (br.s, 1H), 7,86 (d, 1H), 7,81 (d, 1H), 7,24 рували на РХ/МС Waters з Alliance 2795 (РХ) та (dd, 1H), 5,09 (t, 1H), 4,16 (t, 2H), 3 ,76 (q, 2H) одинично-квадрупольному мас-спектрометрі ZQ. Приклад 3 Мас-спектрометр було опоряджено джерелом 2-[3-({[5-(5-Хлор-2-флуор феніл)-1,2,4електророзпилення іонів з позитивним та негативоксадіазол-3-іл]метил}тіо)-5-(2-тієніл)-4Н-1,2,4ним режимом. Потенціал розпилення іонів був триазол-4-іл]етанол ±3кВ та мас-спектрометр сканував m/z 100-700 при 4-(2-Гідроксіетил)-5-(2-тієніл)-2,4-дигідро-3Нчасі сканування 0,8с. До колонки X-TerraMS, 1,2,4-триазол-3-тіон (101мг), 5-(5-хлор-2Waters, С8, 2,1x50мм, 3,5мм, застосовували лінійфлуорфеніл)-3-(хлорметил)-1,2,4-оксадіазол ний градієнт від 5% до 100% ацетонітрилу у 10мМ (116мг) та калій карбонат (86мг) перемішували у амоній ацетаті (водн.), або у 0,1% ТФОК (водн.). суміші ДМФ (2мл) та MeCN (15мл) при кімнатній Препаративну зворотно-фазову хроматогратемпературі протягом 3 годин та концентрували до фію проводили автопрепаративною ВЕРХ на сухого стану та промивали залишок водою, а тоді Gilson з детектором з сукупності діодів, застосоEtOAc, з утворенням 122мг заголовної сполуки, як вуючи ХТеrrа MS C8, 19x300мм, 7мм, як колонку. білого твердого матеріалу. 1Н ЯМР (ДМСО-d6): Очистку хроматографією проводили на покритих 8,04 (dd, 1H), 7,83 (m, 1H), 7,78 (d, 1H), 7,66 (d, 1H), силікагелем/гипсом (Merck, 60 PF-254 з кальцій 7,58 (t, 1H), 7,22 (dd, 1H), 5,16 (t, 1H), 4,59 (s,2H), сульфатом) скляних пластинах, з шаром покриття 4,18 (t,2H), 3,64 (q,2H) 1, 2 або 4мм, застосовуючи хроматотрон ТС Приклад 4 Research 7924T. Очистку продуктів також робили, 2-[3-({[5-(5-Хлор-2-флуор феніл)-1,2,4застосовуючи екстракційні ТФЕ-колонки Chem Elut оксадіазол-3-іл]метил}тіо)-5-(2-тіеніл)-4Н-1,2,4(Varian, cat #1219-8002), Mega BE-SI (Bond Elut триазол-4-іл]етил метансульфонат Silica) (Varian, cat # 12256018; 12256026; У розчин 2-[3-({[5-(5-хлор-2-флуорфеніл)-1,2,412256034), або флеш-хроматографією у заповнеоксадіазол-3-іл]метил}тіо)-5-(2-тієніл)-4Н-1,2,4них силікагелем скляних колонках. Мікрохвильове тіазол-4-іл]етанол у суміші ДМФ (1мл) та піридину нагрівання проводили у мікрохвильовому резона(0,5мл) додавали метансульфонілхлорид (20мкл). торі Smith Synthesizer, що дає постійне опромінюСуміш перемішували при кімнатній температурі вання при 2450МГц (Personal Chemistry AB, протягом 24 годин і виливали у воду (10мл). Сирий Uppsala, Sweden). продукт відфільтровували та очищали хроматогОтримання інтермедіатів рафією на силікагелі, застосовуючи 0-5% МеОН у Приклад ДХМ як елюент для отримання 43мг заголовної 35 82435 36 сполуки, яку, застосовували безпосередньо на ної сполуки, яку застосовували безпосередньо на наступному етапі. наступному етапі. Приклад 5 Приклад 9 а) 3-піридин-4-іл-6,7,8,9-тетрагідро-5Н3-піридин-4-іл-6,7-дигідро-5Н-піроло[2,1[1,2,4]триазоло[4,3-а][1,3]діазепін с][1,2,4]триазол Суміш 1,3-діазепан-2-он-гідразон гідройодиMe3OBF4 (2,66г, 18ммоль) додавали у розчин ду(1,00г, 3,9ммоль) та ізонікотиноїлхлорид гідро2-піролідинону у ДХМ (150мл) та реакційну суміш хлориду (695мг, 3,9ммоль) нагрівали у мікрохвиперемішували протягом 24 годин. Реакційну суміш льовому реакторі при 160°С протягом 10 хвилин. промивали водним насиченим натрій гідрокарбоРеакційну суміш виливали у насичений розчин натом, сушили та концентрували. Залишок розчинатрій карбонату та екстрагували ДХМ. Органічну няли у EtOH (4мл) та додавали ізонікотиновий гідфазу сушили та концентрували. Флешразид (1,37г, 10ммоль). Суміш нагрівали у хроматографія (ДХМ/МеОН 20:1) дала 1,74г сирої мікрохвильовому реакторі протягом 1 години при заголовної сполуки, яку, застосовували безпосе120°С. Летючі домішки видаляли та сирий продукт редньо на наступному етапі. 1Н ЯМР: 1,89 (s, 4Η), очищали колонковою хроматографією (ДХМ/МеОН 3,15 (m, 2Η), 3,86 (m, 2Η), 7,44 (d, 2Η), 8,66 (d, 2Η). 20:1) для отримання 319мг (11%) заголовної споНаступні сполуки отримували аналогічним чилуки. 1Н ЯМР: 2,87 (m, 2Н), 3,05 (t, 2Η), 4,28 (t, 2Η), ном: 7,72 (d, 2Η), 8,72 (d, 2Η). b) 3-(3,5-дифлуорфеніл)-6,7,8,9-тетрагідро-5НПриклад 10 [1,2,4]триазоло[4,3-а][1,3]діазепін; 180мг (20%) 3-(Хлорметил)-5-(3-хлор-феніл)-1,2,4жовто-коричневий твердий матеріал; 1Н ЯМР оксадіазол CDCI3: 1,88-1,99 (m, 4Η), 3,22-3,25 (m, 2Η), 3,90 (m, Етап А. Ациклічний інтермедіат отримували з 2Η), 5,76 (bs, 1H) 6,95 (m, 1Η), 7,10 (m, 2Η). 3-хлорбензойної кислоти (2,82г, 18ммоль), EDCI с) 3-(4-метоксифеніл)-6,7,8,9-тетрагідро-5Н(3,46г, 18ммоль), HOBt (2,76г, 18ммоль) та 2-хлор[1,2,4]триазоло[4,3-а][1,3]діазепін; 300мг (34%) N-гідрокси-ацетамідин (1,75г, 16,2ммоль) [Chem. білий твердий матеріал; 1Н ЯМР CDCI3: 2,03 (m, Ber. 1907, 40, 1639] у ДМФ (40мл). Етап В: Цикліч4Η), 3,48 (m, 4Η), 5,33 (s, 3Н), 6,96 (d, 2Η), 7,87 (d, ну сполук у отримували нагріванням у ДМФ (40мл) 2Η). та очищали ТФЕ-хроматографією на силікагелі, Приклад 6 застосовуючи 2% ацетон у гексанах, отримуючи 3-(трисрлуорметил)-6,7,8,9-тетрагідро-5Нзаголовну сполуку (1,46г, 39% виходу за 2 етапи). 1 [1,2,4]триазоло[4,3-а][1,3]дiазепiн Н ЯМР: 8,17 (m, 1Н), 8,07 (dd, 1Н), 7,60 (m, 1Н), Трифлуороцтової кислоти ангідрид (0,24мл, 7,55 (t, 1H), 4,69 (s, 2H). 1,71ммоль) додавали у розчин 1,3-діазепан-2-он Приклад 11 гідразон гідройодиду у ДХМ (10мл). Реакційну су3-(Бромметил)-5-(3-хлор-феніл)-1,2,4міш перемішували протягом 24 годин при кімнатній oсадіазол температурі Летючі домішки видаляли та залишок 3-(хлорметил)-5-(3-хлорфеніл)-1,2,4гріли при кипінні під зворотним холодильником у оксадіазол (1,38г, 6,0ммоль) та LiBr (0,90г, водному насиченому натрій гідрокарбонаті протя10,3ммоль) у ТГФ (50мл) нагрівали до кипіння під гом 2 годин. Після охолодження до кімнатної темзворотним холодильником в атмосфері азоту проператури продукт збирали фільтруванням, промитягом ночі Після охолодження до кімнатної темпевали водою та сушили, отримуючи 101мг (31%) ратури ЕА додавали та органічну фаз у промивали заголовної сполуки. 1Н ЯМР: 1,85-1,96 (m, 4Н), водою та розсолом, сушили та випарювали для 3,17 (m, 2Н), 3,99 (m, 2Н), 5,04 (s, 1Η). отримання заголовної сполуки (1,40г, 85%). МС Приклад 7 (М+1 275 1,3-діазепан-2-он гідразон гідройодид Приклад 12 Гідразин гідрат (0,44мл, 7,23ммоль) додавали 3-(1-хлоретил)-5-(3-хлорфеніл)-1,2,4у розчин 2-(метилтіо)-4,5,6,7-тетрагідро-1Н-1,3оксадіазол діазепін гідройодиду (1,79г, 6,58ммоль) у EtOH 5 крапель ДМФ додавали до 1-[5-(3(12мл). Реакційну суміш гріли при кипінні під звохлорфеніл)-1,2,4-оксадіазол-3-іл]етанол (12,3г, ротним холодильником протягом 5 годин та охо54,9ммоль) у SOCI2 (150мл) та реакційну суміш лоджували до кімнатної температури. Додавали нагрівали при 70 °С протягом 5 годин. Надлишок етер та продукт збирали фільтруванням, промиSOCI2 випарювали та залишок очищали колонковали етером та сушили у вакуумі для отримання вою хроматографією (гептан®гептан-ЕА 5:1) для 1,46г (100%) сирої заголовної сполуки, яку застоотримання 12,4г (93%) заголовної сполуки. 1Н совували безпосередньо на наступному етапі. ЯМР: 1,96 (d, 3H) 5,20 (q, 1Н) 7,46 (t, 1Н) 7,59 (m, Приклад 8 1Н) 8,04 (m, 1H) 8,17 (t, 1H) 2-(метилтіо)-4,5,6,7-тетрагідро-1,3-1,3-діазепін Приклад 13 Метил йодид (0,55мл, 1,15ммоль) додавали у 1-[5-(3-хлорфеніл)-1,2,4-oксaдіазол-3розчин 1,3-діазепан-2-тіону (1,00г, 7,68ммоль) в іл]етилметансульфонат ацетоні (8мл). Реакційну суміш гріли при кипінні під Метан сульфонілхлорид (40мкл, 0,49ммоль) зворотним холодильником протягом 15 хвилин. додавали до суміші TEA (95мкл, 0,67ммоль) та 1EtOH додавали до гарячого розчину для розчи[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]етанол нення твердих продуктів. Після охолодження до (100мг, 0,45ммоль) у ДХМ (5мл). Після перемішукімнатної температури додавали гексан та осад вання протягом 15 хвилин суміш промивали водою збирали фільтруванням, промивали гексаном та та розсолом, сушили та концентрували та заголосушили для отримання 1,79г (86%) сирої заголоввну сполуку о тримували з 135мг виходу. 1Н ЯМР: 37 82435 38 1,9 (d, 3Н), 3,1 (s, 3Н), 5,9 (q, 1Η), 7,5 (t, 1Η), 7,6 (m, 2-Карбоксиметил-3-оксо-піперазин-11Η), 8,0 (m, 1Η), 8,1 (t, 1Η) карбонової кислоти трет-бутиловий естер Приклад 14 1Η Натрій гідроксид (11,4мл, 11,4ммоль) до1-[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]етанол давали до 2-етоксикарбонілметил-3-оксо27,2г сирого N'-[(3-хлорбензоїл)окси]-2піперазин-1-карбонової кислоти трет-бутилового гідроксипропанімідаміду розчиняли в етанолі естеру (2,5г, 8,73ммоль) у метанолі (20мл) при (250мл) та гріли при кипінні під зворотним холодикімнатній температурі та тоді перемішували протяльником протягом 1 години, а потім додавали гом 2,5 годин. Реакційну суміш концентрували, 14,0г (170ммоль) натрій ацетату у воді (40мл). Напідкислювали 2Η НСІ до рН-2 та екстрагували дигрівання при кипінні під зворотним холодильником хлорметаном (3 рази). Органічний шар промивали протягом ночі, охолодження до кімнатної темперарозсолом, сушили безводним натрій сульфатом, тури та додавання води (250мл) концентрування фільтрували та концентрували, отримуючи загосуміші у вакуумі до приблизно половини її об'єму, ловну сполуку (1,87г, 83%, як білу тверду піну). 1Н дали осад, який відфільтровували та перекристаЯМР (CDCL3) d (млн -1): 7,68 (bs, 1H), 4,78 (m, 1H), лізовували з суміші етилацетат/гептан з отриман4,19 (m, 1H), 3,45 (m, 1H), 3,34 (m, 2H), 2,97 (m, ням 6,45г (25%) заголовної сполуки. 1Н ЯМР: 8,14 2H), 1,49 (s, 9H). (s, 1Η), 8,02 (d, 1Η), 7,57 (d, 1Η), 7,47 (t, 1Η), 5,04Приклад 19 5,14 (m, 1Η), 2,51 (d, 1Η), 1,67 (d, 3Η) 2-[3-(3-Хлор-феніл)-[1,2,4]оксадіазол-5-іл]-3Приклад 15 оксо-піперазин-1-карбонової кислоти третN'-[(3-хлорбензоїл)окси]-2бутиловий естер гідроксипропанімідамід 2-Карбоксиметил-3-оксо-піперазин-16,45г сирого N',2-дигідроксипропанімідаміду карбонової кислоти трет-бутиловий естер (1,87г, охолоджували на льодяній бані з 23,5мл DEA у 7,25ммоль), 3-хлор-N-гідрокси-бензамідин (1,36г, ТГФ (200мл). До цієї кашки додавали 21,94г 37,98ммоль), HOBt (1,08г, 7,98ммоль) та EDCI хлорбензоїлхлориду. Суміш нагрівали до кімнатної (1,53г, 7,98ммоль) у ДМФ (20мл) перемішували температури та перемішували протягом 2 годин. при кімнатній температурі протягом ночі. РеакційДодавання етеру (200мл), промивка водним насину суміш розбавляли етилацетатом, промивали ченим розчином амоній хлориду та реекстракція водою (3 рази), насиченим натрій гідрокарбонатом водного шару дали після комбінування та концен(2 рази) та розсолом, сушили безводним натрій трування органічних шарів, а потім сушки у вакуумі сульфатом, фільтрували та концентрували. Зали27,24г сирої заголовної сполуки, яку безпосередшок розчиняли у ДМФ (20мл) та тоді нагрівали при ньо застосовували на наступному етапі. РХ/МС 135°С протягом 4 годин. Після охолодження реак(М++1):243. ційну суміш розбавляли етилацетатом, промивали Приклад 16 водою (3 рази) та розсолом, сушили безводним N',2-дигідроксипропанімідамід натрій сульфатом, фільтрували та концентрували. 44,2г (0,64моль) гідроксиламіну гідрохлорид та Очистку проводили флеш-хроматографією на си25,5г (0,64моль) натрій гідроксид розчиняли в еталікагелі, застосовуючи гексани:дихлорметан (1:1), нолі (500мл) при кімнатній температурі та переміотримуючи заголовну сполуку (1,48г, 52%, як білу шували протягом 3 годин. Після фільтрування, тверду піну). 1Н ЯМР (CDCI3) d (млн -1): 8,08 (m, 8,11г (0,11моль) 2-гідроксипропаннітрил додавали 1Н), 7,97 (m, 1Н), 7,46(m, 2Н), 6,35 (m, 1Н), 5,04 до фільтрат, а потім перемішували протягом 4 (m, 1H), 4,31 (m, 1Н), 3,68 (m,1H), 3,50 (m, 2H), 3,27 годин. Після концентрування до сухого стану (m, 2H), 1,35 (bs, 9H). отримували заголовну сполуку, яку безпосередньо Приклад 20 1 застосовували на наступному етапі. Н ЯМР 6-[3-(3-Хлор-феніл)-[1,2,4]оксадіазол-5-іл]-5(ДМСО-D6): 8,88 (s, 1Н), 5,15 (s, 1Η), 5,02 (s, 1Η), метокcи-3,6-дигідро-2Н-піразин-1-карбонової кис4,00 (q, 1Η), 1,19 (d, 3Η). лоти трет-бутиловий естер Приклад 17 Триметилоксоній тетрафлуорборат (169,4мг, 2-Етоксикарбонілметил-3-оксо-піперазин-11,15ммоль) додавали до 2-[3-(3-хлор-феніл)карбонової кислоти трет-бутиловий естер [1,2,4]оксадіазол-5-іл]-3-оксо-піперазин-1Триетиламін (9,0мл, 64,4ммоль) та ді-треткарбонової кислоти трет-бутилового естеру бутил-дикарбонат (7,0г, 32,2ммоль) додавали до (450мг, 1,15ммоль) у ди хлорметані (3мл) під арго(3-оксо-піперазин-2-іл)-оцтової кислоти етилов ном при кімнатній температурі та тоді перемішуестер (4,0г, 21,5ммоль) у 1,4-діоксан (4,0мл) та вод вали протягом ночі. Реакційну суміш безпосеред(2мл) при кімнатній температурі та перемішували ньо очищали флеш-хроматографією на основному протягом ночі. Реакційну суміш концентрували та алюміній оксиді, застосовуючи 30% етилацетат у тоді залишок розбавляли дихлорметаном. Органігексанах, отримуючи заголовну сполуку (284,6мг, чний шар промивали водою та розсолом, сушили 61%). 1Н ЯМР (CDCI3) d (млн-1): 8,09 (m, 1H), 7,97 безводним натрій сульфатом, фільтрували та кон(m, 1H), 7,46 (m, 2H), 4,88 (m, 1H), 4,01 (m, 1H), центрували. Залишок розтирали з гексанами, фі3,72 (s, ЗН), 3,51 (m, ЗН), 3,35 (m, 1H), 2,90 (m, льтрували, та сушили, отримуючи заголовну спо1H), 1,34 (m, 9H). 1 луку (5,66г, 92% як білий твердий матеріал). Н Приклад 21 ЯМР (CDCI3) d (млн -1): 6,29 (bs, 1H), 4,78 (m, 1H), 8-[3-Хлоp-феніл)-[1,2,4]оксадіазол-5-іл]-3-(44,16 (m, ЗН), 3,40 (m, 3H), 2,99 (m, 1H), 2,90 (m, метокси-феніл)-5,6-дигідро-8Н-[1,2,4]триазоло[4,31H), 1,50 (s, 9H), 1,28 (t, 3H). а]піразин-7-карбонової кислоти трет-бутиловий Приклад 18 естер 39 82435 40 6-[3-(3-Хлор-феніл)-[1,2,4]оксадіазол-5-іл]-5жовтий твердий матеріал). 1Н ЯМР (CDCI3) d (млн.1 метокси-3,6-дигідро-2Н-піразин-1-карбонової кис): 7,78 (s, 1H), 7,68 (m, 1H), 7,43 (m, 2H), 6,63 (s, лоти трет-бутиловий естер (284,6мг, 0,70ммоль) та 1H), 4,84 (d, 2H), 2,23 (t, 1H). 4-метокси-бензойної кислоти гідразид (116,2мг, Приклад 23 0,70ммоль) під аргоном у метанолі (10мл) нагріваМетансуль фонової кислоти 5-(3-хлор-феніл)ли при кипінні під зворотним холодильником проізоксазол-3-ілметиловий естер тягом 3 діб. Після охолодження реакційну суміш Триетиламін (965мг, 9,5ммоль) та метансульрозбавляли етилацетатом та тоді промивали вофонілхлорид (820мг, 7,2ммоль) додавали у розчин дою (3 рази) та розсолом, сушили безводним на[5-(3-хлор-феніл)-ізоксазол-3-іл]-метанолу (1,0г, трій сульфатом, фільтрували та концентрували. 4,8ммоль) у дихлорметані (50мл) при 0°С. Після 1 Очистка флеш-хроматографією на силікагелі, загодини реакційну суміш гасили холодним насичестосовуючи 40-85% етилацетат у гексанах дала ним натрій гідрокарбонатом та тоді органічний шар промивали насиченим розсолом, сушили безводзаголовну сполуку (72,5мг, 20%). 1Н ЯМР (CDCI3) d (млн -1): 8,07 (m, 1H), 7,96 (m, 1H), 7,64 (m, 2H), 7,47 ним натрій сульфатом, фільтрували, та концент(m, 2H), 7,05 (m, 2H), 6,04 (m, 1H), 4,11 (m, 2H), рували, отримуючи метансульфонової кислоти 53,89 (s, ЗН), 3,86 (m, 2H), 3,55 (m, 1H), 3,31 (m, 1H), (3-хлор-феніл)-ізоксазол-3-ілметиловий естер 1,28(bs,9H). (1,4г, 100%, світло-коричневий твердий матеріал). 1 Приклад 22 Н ЯМР (CDCL3) d (млн.-1): 7,80 (s, 1H), 7,70 (m, [5-(3-Хлор-феніл)-ізоксазол-3-іл]-метанол 1H), 7,45 (m, 2H), 6,73 (s, 1H), 5,37 (β, 2Η), 3,16 (s, а) 4-(3-Хлор-феніл)-2,4-діоксо-масляної кисло3H). ти етиловий естер: Приклад 24 Натрій гідрид (60% дисперсія у маслі, 1,24г, 5-(5-Хлор-2-флуор-феніл)-3-хлорметил31,1ммоль) додавали порціями у розчин 3[1,2,4]оксадіазол хлорацетофенону (4,0г, 25,9ммоль) та діетилоксаАциклічний інтермедіат отримували з 2-флуорлату (4,54г, 31,1ммоль) у ДМФ (32мл) при 0°С. 5-хлорбензойної кислоти (550мг, 3,15ммоль), EDCI Суміш перемішували при кімнатній температурі (665мг, 3,47ммоль), НОВТ (469мг, 3,47ммоль) та 2протягом 1 години та тоді нагрівали при 80°С прохлор-N-гідрокси-ацетамідин (377мг, 3,47ммоль) у тягом півгодини. Після охолодження суміш обробДМФ (10мл). Для виконання циклізації до оксадіаляли 3Η НСІ та тоді розбавляли етилацетатом. зол, ДМФ (15мл) додавали до проміжного залишку Органічний шар промивали водою (3Х) та насичета суміш нагрівали протягом 1 години. Продукт ним розсолом, сушили безводним натрій сульфаочищали колонковою флеш-хроматографією, затом, фільтрували та концентрували. Утворений стосовуючи 10% етилацетат у гексані дала загозалишок тоді очищали колонковою флешловну сполуку (438мг, 56% виходу за 2 етапи, біхроматографією на силікагелі, застосовуючи 0лий твердий матеріал). 1Н ЯМР (CDCL3) d (млн.-1): 10% етилацетат у гексанах, отримуючи 4-(3-хлор8,16 (m, 1H), 7,58 (m, 1H), 7,29 (m, 1H), 4,72 (s, 3Н). феніл)-2,4-діоксо-масляної кислоти етиловий есОтримання кінцевих сполук 1 тер (4,43г, 67%, жовтий твердий матеріал). Н Приклад 25 ЯМР (CDCL3) d (млн -1): 15,12 (br s, 1H), 7,98 (s, 7-[5-(5-Хлор-2-флуор феніл)-1,2,4-оксадіазол1H), 7,88 (d, 1H), 7,58 (d, 1H), 7,47 (t, 1H), 7,05 (s, 3-іл]-3-(2-тієніл)-6,7-дигідро-5Н-[1,2,4]триазоло[3,41H), 4,39 (m, 2H), 1,41 (m, 3H). b][1,3]тіазин b) 5-(3-хлор-феніл)-ізоксазол-3-карбонової киУ розчин 2-[3-({[5-(5-хлор-2-флуорфеніл)-1,2,4слоти етиловий естер: оксадіазол-3-іл]метил}тіо)-5-(2-тієніл)-4Н-1,2,4Розчин 4-(3-хлор-феніл)-2,4-діоксо-масляної триазол-4-іл]етилметансульфонат (43мг) у ДМФ кислоти етилового естеру (3,0г, 11,8ммоль) та гід(2мл) додавали натрій гідрид (10мг) при -78°С при роксиламін гідрохлориду (2,46г, 35,4ммоль) у меперемішуванні. Суміші давали досягти кімнатної танолі (60мл) нагрівали при 80°С протягом 4 готемператури та перемішували протягом ще 3 годин. Після охолодження суміш фільтрували та дин перед додавання МеОН (1мл) та концентрупромивали холодним метанолом, отримуючи 5-(3вання на силікагелі. Очистка хроматографією на хлор-феніл)-ізоксазол-3-карбонової кислоти етисилікагелі, застосовуючи ДХМ:ЕА:МеОН 70:30:2 як ловий естер (2,0г, 71%, білий твердий матеріал). елюент дала 2,8мг заголовної сполуки. 1Н ЯМР: 1 -1 Н ЯМР (CDCL3) d (млн ): 7,82 (s, 1H), 7,72 (m, 1H), 8,07 (dd, 1H), 7,56 (m, 1H), 7,51 (dd, 1H), 7,47 (dd, 7,47 (m, 2H), 4,03 (s, 3Н). Суміш метилового та 1Н), 7,17-7,23 (m, 2Н), 4,86 (dd, 1Н), 4,60 (m, 1Н), етилового естерів (головним чином метилового). 4,38 (m, 1Н), 2,82 (m, 2Н) [5-(3-хлор-феніл)-ізоксазол-3-іл]-метанол; Приклад 26 Літій алюмогідрид (320мг; 8,4ммоль) повільно а) 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3додавали у розчин 5-(3-хлор-феніл)-ізоксазол-3іл]метил}-3-піридин-4-іл-6,7,8,9-тетрагідро-5Нкарбонової кислоти етилового естеру (2,0г, 8,4) у [1,2,4]триазоло[4,3-а][1,3]діазепін ТГФ (100мл) при кімнатній температурі. Після 1 NaH (65мг, 0,28ммоль) додавали у розчин 3години реакційну суміш гасили водою та тоді екстпіридин-4-іл-6,7,8,9-тетрагідро-5Нрагували етилацетатом. Органічний шар промива[1,2,4]триазоло[4,3-а][1,3]діазепіну (54мг, ли водою та насиченим розсолом, сушили безвод0,25ммоль) у ДМФ (5мл). Після 10 хвилин 3ним натрій сульфатом, фільтрували, та (хлорметил)-5-(3-хлорфеніл)-1,2,4-оксадіазол концентрували. Утворений залишок тоді очищали (65мг, 0,28ммоль) додавали при кімнатній темпеколонковою флеш-хроматографією, застосовуючи ратурі. Перемішували протягом ночі та Додавали 15-40% етилацетат у гексані, отримуючи [5-(3водний насичений розчин амоній хлориду та суміш хлор-феніл)-ізоксазол-3-іл]-метанол (1,32г, 75%, екстрагували етилацетатом. Органічну фазу су 41 82435 42 шили та концентрували. Флеш-хроматографія Приклад 28 (ДХМ/МеОН 20:1) дала 56мг (54%) заголовної спо7-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3луки. 1Н Я МР: 1,89-2,01 (m, 4Н), 3,33-3,42 (m, 2Н), іл]метил}-3-піридин-4-іл-6,7-дигідро-5Н-піроло[2,13,90-3,98 (m, 2Н), 4,88 (s, 2Η), 7,42-7,49 (m, 3Н), с][1,2,4]триазол 7,53 (m, 1Н), 7,98 (m, 1Н), 8,09 (m, 1Н), 8,71 (d, 2Η). n-BuLi (2,5Μ, гексан, 600мкп) додавали у розНаступні сполуки отримували аналогічним чичин 3-піридин-4-іл-6,7-дигідро-5Н-піроло[2,1ном: с][1,2,4]триазол (250мг, 1,33ммоль) у ТГФ (13мл) b) 9-{[5-(3-хлорфеніл)ізоксазсю-3-іл]метил}-3при 0°С. Після 10 хвилин реакційну суміш охоло(3,5-дифлуорсреніл)-6,7,8,9-тетрагідро-5Нджували до -78°С та додавали 3-(бромметил)-5-(3[1,2,4]триазоло[4,3-а][1,3]діазепін; вихід 31,8мг хлорфеніл)-1,2,4-оксадіазол (400мг, 1,46ммоль) у (61%) жовтий твердий матеріал; 1Н ЯМР CDCI3: ТГФ (10мл). Після перемішування при -78°С протя7,95 (s, 1Н), 7,68 (m, 1Н), 7,41 (m, 2Н), 7,13 (m, 2Н), гом 30 хвилин перемішували при 0°С і давали до6,95 (m, 2Н), 4,77 (s, 2H), 3,91 (m, 2Н), 3,22 (m, 2Н), сягти кімнатної температури протягом ночі. Дода1,93 (br, 4H) вали водний насичений амоній хлорид та суміш c) 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-3екстрагували етилацетатом. Органічну фазу про(4-мегоксифеніл)-6,7,8,9-тетрагідро-5Нмивали водою та розсолом, сушили та концентру[1,2,4]триазоло[4,3-а][1,3]діазепін; вихід 17,2мг вали. Флеш-хроматографія (ДХМ/МеОН 40:1), а (45%) жовтий твердий матеріал; 1Н ЯМР CDCI3: потім препаративна ВЕРХ дали 6,5мг (1%) заголо7,52 (br, 1Н), 7,49 (m, 1Н), 7,41 (d, 2Н), 7,28 (m, вної сполуки. 1Н ЯМР: 2,72 (m, 1Н), 3,13 (m, 2Н), 2Н), 7,01 (d, 2Н), 4,77 (s, 2Н), 3,89 (s, 4Н), 3,2 (m, 3,62 (m, 1Н), 3,93 (m, 1Н), 4,31 (m, 2Н), 7,47 (t, 1Η), 2H), 2,32 (s, 2H), 2,01 (m, 4H) 7,56 (m, 1Η), 7,74 (d, 2Η), 7,98 (m, 1Η), 8,08 (m, 1Η), d) 9-{[5-(3-хлорфеніл)ізоксазол-3-іл]метил}-38,74 (m, 2H). піридин-4-іл-6,7,8,9-тетрагідро-5НПриклад 29 [1,2,4]триазоло[4,3-а][1,3]діазепін; 47,4мг (65%) 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3жовтий твердий матеріал; 1Н ЯМР CDCL3: 8,79 (br, іл]метил}-3-(трифлуорметил)-6,7,8,9-тетрагідро2Н), 7,79 (m, 1Н), 7,68 (d, 1Н), 7,53 (m, 2Н), 7,51 (d, 5Н-[1,2,4}триазоло [4,3-а][1,3]діазепін 2Н), 6,99 (s, 1Н), 4,79 (s, 2Н), 3,96 (m, 2Н), 3,22 (s, Заголовну сполуку отримували аналогічно 92Н), 1,94 (m, 4Н) {[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3e) 9-{[5-(5-хлор-2-флуорфеніл)-1,2,4піридин-4-іп-67,8,9-тeтрагідро-5Ноксадіазол-3-іл]метил}-3-піридин-4-іл-6,7,8,9[1,2,4]триазоло[4,3-а][1,3]діазепіну з 3тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін; (хлорметил)-5-(3-хлорфеніл)-1,2,4-оксадіазолу 28мг (33%) білий твердий матеріал; 1Н ЯМР (89мг, 0,39ммоль), 3-(трифлуорметил)-6,7,8,9CDCL3: 1,90-2,01 (m, 4Н), 3,37-3,41 (m, 2Н), 3,95тетрагідро-5Н-[1,2,4-]триазоло[4,3-а][1,3]діазепіну 3,998 (m, 2Н), 4,94 (s, 2Η), 7,22 (t, 1Η), 7,49-7,59 (73мг, 0,35ммоль. Колонкова хроматофафія (геп(m, 3Η), 8,11 (q, 1Η), 8,76 (q, 2Η). тан/етилацетат 1:1) дала 85мг (61%) заголовної f) 9-{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3сполуки. 1Н ЯМР: 1,88 (m, 2Н), 1,94 (m, 2Н), 3,26іл]метил}-3-(3,5-дифлуорфеніл)-6,7,8,9-тетрагідро3,35 (m, 2Н), 3,98-4,07 (m, 2Н), 4,83 (s, 2Η), 7,46 5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін; 10мг (10%) (m, 1Η), 7,50-7,57 (m, 1Η), 7,98 (m, 1Η), 8,09 (m, білий твердий матеріал; 1Н ЯМР CDCI3:1,89-2,01 1Η) (m, 4Η), 3,38-3,46 (m, 2Η), 3,90-3,98 (m, 2Η), 4,90 Приклад 30 (s, 2Η), 6,85-6,95 (m, 1H) 7,08-7,15 (m, 2Η), 7,49 (t, 8-[3-(3-хлор-феніл)-[1,2,4]оксадіазол-5-іл]-3-(41Η), 7,58 (d, 1Η), 8,03 (d, 1H), 8,14 (m, 1Η). метокси-феніл)-5,6,7,8-тетрагідроg) 9-{[5-(3-хлорфеніл)-1,2,4-окодіазол-3[1,2,4]триазоло[4,3-а]піразин іл]метил}-3-(4-метоксифеніл)-6,7,8,9-тетрагідроТрифлуороцтову кислоту (0,5мл) додавали у 5Н-[1,2,4]триазоло[4,3-а][1,3]діазепін; 8мг (6%) розчин 8-[3-(3-хлор-феніл)-[1,2,4]оксадіазол-5-іл]жовто-коричневий твердий матеріал; 1Н ЯМР 3-(4-метокси-феніл)-5,6-дигідро-8НCDCL3: 1,64 (bs, 4Η), 3,18 (m, 2Η), 3,60 (m, 5Η), [1,2,4]триазоло[4,3-а]піразин-7-карбонової кислоти 4,56 (s, 2Η), 6,87 (d, 2H) 7,26 (d, 2Η), 7,48 (m, 1Η), трет-бутилового естеру (72,5мг, 0,14ммоль) у дих7,55 (m, 1Η), 7,88 (m, 1Η). лорметані (1мл) при 0°С. Реакційну суміш тоді Приклад 27 розбавляли дихлорметаном. Через 15 хвилин, 9-{1-[5-(3-)-1,2,4-оксадіазол-3-іл]етил}-3реакційну суміш гріли до кімнатної температури та піридин-4-іл-6,7,8,9-тетрагідро-5Нперемішували ще годину, промивали насиченим [1,2,4]триазоло[4,3-а][1,3]діазепін натрій гідрокарбонатом, сушили безводним натрій Заголовну сполуку отримували аналогічно 9сульфатом, фільтрували та концентрували. Очис{[5-(3-хлорфеніл)-1,2,4-оксадіазол-3-іл]метил}-3тку проводили колонковою флеш-хроматографією піридин-4-іл-6,7,8,9-теграгідро-5Нна силікагелі, застосовуючи 85-90% етилацетат у [1,2,4]триазоло[4,3-а][1,3]діазепіну з 1-[5-(3гексанах до 2% аміаку у метанолі у дихлорметані, хлорфеніл)-1,2,4-оксадіазол-3-іл]етил метансульа потім розтиранням з діетиловим етером, отрифонату (186мг, 0,61ммоль), 3-піридин-4-іл-6,7,8,9муючи заголовну сполуку (40,6мг, 69%). 1Н ЯМР тетрагідро-5Н-[1,2,4]триазоло[4,3-а][1,3]діазепіну (CDCI3) d (млн.-1): 8,10 (m, 1H), 8,00 (m, 1H), 7,67 (200мг, 0,56ммоль) для отримання 8,1мг (4%) за(m, 2H), 7,48 (m, 2H), 7,05 (m, 2H), 7,86 (m, 1H), головної сполуки. 1Н ЯМР: 1,83 (d, 3Н), 1,86-1,95 4,09 (m, 3Н), 3,89 (s, ЗН), 3,47 (m, 2H), 3,24 (m, 1H), (m, 4Н), 3,16-3,27 (m, 1Н), 3,43-3,53 (m, 1Н), 3,752,83 (bs, 1H). 3,87 (m, 1Н), 3,95-4,07 (m, 1Н), 5,54 (q, 1Η), 7,41Приклад 31 7,52 (m, 3 Н), 7,52-7,58 (m, 1Н), 8,01 (m, 1Н), 8,12 (m, 1Н), 8,73 (m, 2Н). 43 82435 44 8-[3-(3-Хлор-феніл)-[1,2,4]оксадіазол-5-іл]-3-(4ГЕПЕСом фізіологічному розчині та попередньо метокси-феніл)-7-метил-5,6,7,8-тетрагідроінкубували протягом 10 хвилин з 10мМ LiСІ. Спо[1,2,4]триазоло[4,3-а]піразин луки (агоністи) додавали та інкубували протягом Мурашину кислоту (0,1мл), формальдегід 30 хвилин при 37°С. Активність антагоністів визна(37мас.% розчин у воді, 0,1мл) та натрій ціанобочали попереднім інкубуванням тест-сполуки протярогідрид (1,0Μ у ТГФ, 0,1мл) додавали у розчин 8гом 15 хвилин, тоді інкубуванням у присутності [3-(3-хлор-феніл)-[1,2,4]оксадіазол-5-іл]-3-(4глутамату (80мкМ) або DHPG (30мкМ) протягом 30 метокси-феніл)-5,6,7,8-тетрагідрохвилин. Реакції зупиняли додаванням хлорної кис[1,2,4]триазоло[4,3-а]піразину (30мг, 0,071ммоль) у лоти (5%). Зразки збирали та нейтралізували, та метанолі (0,8мл) при кімнатній температурі. Після інозитол-фосфати розділяли, застосовуючи іоноперемішування протягом 30 хвилин реакційну суобмінні колонки Gravity-Fed. міш розбавляли водою та тоді екстрагували хлоДетальніший протокол для тестування сполуки роформом (4 рази), сушили безводним натрій сувинаходу запропоновано у випробуванні нижче. льфатом, фільтрували та концентрували. Очистка Випробування активності антагоністів рецепфлеш-хроматографією на силікагелі, застосовуюторів групи І чи 50% етилацетат у гексанах, етилацетат та 4% Для FLIPR-аналізу клітини, експресуючі 2М аміак у метанолі у дихлорметані дала заголовmGluR5d людини, як описано у [WO97/05252] засівали на покриті колагеном 96-коміркові планшети з ну сполуку (23,8мг, 77 %), 1Н Я МР (CDCl3) d (млн.1 прозорим дном з чорними стінками та аналіз мобі): 8,04 (m, 1H), 7,93 (m, 1H), 7,68 (m, 2H), 7,42 (m, лізації [Са2+] проводили через 24 години після за2H), 7,03 (m, 2H), 4,37 (m, 1H), 4,07 (m, 2H), 3,89 сівання. Культури клітин у 96-коміркових планше(m, 3Н), 3,82 (m, 2H), 3,11 (m, 1H), 2,88 (m, 1H), тах завантажували з 4мкМ розчином 2,56 (s, 3Н). Фармакологія ацетоксиметилової естерної форми флуоресцентного індикатору кальцію fluo-3 (Molecular Probes, Фармакологічні властивості сполук винаходу Eugene, Oregon) у 0,01% плюроніку. Усі випробуможна аналізувати, застосовуючи стандартні вивання проводили у буфері, що містить 127мМ пробування функціональної активності. Приклади NaCI, 5мМ КСІ, 2мМ МgСІ2, 0,7мМ NaH2PO4, 2мМ випробувань рецепторів глутамату добре відомі у рівні техніки, як описано, наприклад, [Aramori et al, СаСІ2, 0,422мг/мл натрій гідрокарбонату, 2,4мг/мл ГЕПЕС, 1,8мг/мл глюкози та 1мг/мл фракції IV биNeuron 8:757 (1992), Tanabe et at., Neuron 8:169 чачого сироваточного альбуміну (БСА)(рН 7,4). (1992), Miller et al, J. Neuroscience 15: 6103 (1995), FLIPR-експерименти робили, застосовуючи лазерBalazs, et al, J. Neurochemistry 69:151 (1997)]. Мене обладнання 0,800W та швидкістю дії затвора тодологія, описана у цих публікаціях, уведена тут як посилання. Зручно можна досліджувати сполуки камери 0,4с CCD з довжинами хвиль збудження та емісії 488нм та 562нм, відповідно. Кожний FLIPRвинаходу вимірюванням мобілізації внутрішньокліексперимент починали з 160мкл буфер у у кожній тинного кальцію, [Са2+]; у клітинах, експресуючих комірці клітинного планшету. 40мкл добавки з mGluR5. Для аналізу FLIPR клітини, експресуючі планшету антагоністів супроводжували 50мкл доmGluR5d людини, як описано у [WO97/05252], засівали на покриті колагеном 96-коміркові планшети бавки планшету агоністів. Після кожного додавання сигнал флуоресценції отримували 50 разів з з прозорим дном з чорними стінками та аналіз моінтервалами 1с, а потім 3 зразками з інтервалами білізації [Са2+]; робили через 24 годин після засі5сю Реакції вимірювали, як висоту піка реакції у вання. період зразку. FLIPR-експерименти робили, застосовуючи лазерне обладнання 0,800W та швидкістю дії заВизначення ЕК50/ІК50 отримували з даних 8точкових кривих концентрація - реакція (ККР), твора камери CCD 0,4с. Кожний FLIPRотриманих у подвоєнні. ККР агоністу створювали експеримент починали з 160мкл буфер у у кожній перерахунком усіх реакцій відносно максимальної комірці клітинного планшету. Після кожного додареакції, спостереженої для планшета. Блокування вання сполуки, сигнал флуоресценції отримували 50 разів з інтервалами 1с, а потім 3 зразками з антагоністом провокаційної проби агоністу нормалізували до середньої реакції провокаційної проби інтервалами 5сю Реакції вимірювали, як висоту агоністу у 14 контрольних комірках на одному піка реакції у період зразку. планшеті. Визначення ЕК50 та IK50 отримували з даних 8Вимір обороту інозитол-фосфату в інтактних точкових кривих концентрація - реакція (ККР), отриманих у подвоєнні. ККР агоністу створювали цілих клітинах GHEK, стабільно експресуючі рецептор перерахунком усіх реакцій відносно максимальної mGluRSd людини, засівали у 24-коміркові покриті реакції, спостереженої для планшета. Блокування полі-L-лізином планшети при антагоністом провокаційної проби агоністу норма40x104клітини/комірку у середовищі, що містить лізували до середньої реакції провокаційної проби агоністу у 14 контрольних комірках на одному 1нКі/комірку [3Н] міо-інозитолу. Клітини інкубували протягом ночі (16 годин), тоді промивали 3 рази та планшеті. Ми підтвердили вторинні функціональні інкубували протягом 1 години при 37°С у буферовипробування для mGluR5d, як описано у ваному ГЕПЕСом фізіологічному розчині (146мМ [WO97/05252] на основі обороту інозитол-фосфату NaCI, 4,2мМ КСІ, 0,5мМ МgСІ2 , 0,1% глюкози, (ІФ3). Ак умуляцію ІФ3 вимірюють, як індекс опосередкованого рецептором обороту фосфоліпази С. 20мМ ГЕПЕС, рН 7,4) доповненому 1од./мл гпутамат-піруват-трансамінази та 2мМ пірувату. Клітини Клітини GHEK, стабільно експресуючі рецептори промивали один раз у буферованому ГЕПЕСом mGluR5d людини інкубували з [3Н] міо-інозитолом фізіологічному розчині та попередньо інкубували протягом ночі, промивали 3 рази у буферованому 45 82435 46 протягом 10 хвилин у буферованому ГЕПЕСом дять у шлунок через центральний просвіт набору фізіологічному розчині, що містить 10мМ LiCI. при 100мл/хвилин до кінцевого об'єму 30мл/кг. Сполуки (агоністи) додавали та інкубували при Уведення харчового борошна супроводжують уве37°С протягом 30 хвилин. Активність антагоністів денням повітря при швидкості 500мл/хвилин доки визначали попереднім інкубуванням тест-сполуки не отримують внутрішньошлунковий тиск 10±1мм протягом 15 хвилин, тоді інкубуванням у присутноHg. Тиск тоді тримають на цьому рівні протягом сті глутамату (80мкМ) або DHPG (30мкМ) протягом експерименту, застосовуючи інфузійний насос для 30 хвилин. Реакцію припиняли додаванням 0,5мл наступного уведення повітря або для випуску повіхлорної кислоти (5%) на льоді, з інкубуванням при тря зі шлунку. Час експерименту від початку уве4°С протягом принаймні 30 хвилин. Зразки збирадення харчового борошна до кінця вдування повіли у 15мл Фалкон-туби та інозитол-фосфати розтря складає 45 хвилин. Спосіб підтверджено як діляли, застосовуючи колонки Dowex, як описано надійний засіб ініціювання ТРНСС. нижче. ТРНСС визначено, як зменшення тиску у нижВипробування стосовно інозитол-фосфатів, чомустравохідному сфінктері (з посиланням на застосовуючи іонообмінні колонки Gravity-Fed внутрішньошлунковий тиск) при швидкості більше Отримання іонообмінних колонок 1ммНg/с. Релаксація повинна не бути попереджеІон-іонообмінну смолу (Dowex AG1-X8 у формі ною фарингеальним сигнал за 2с перед її початформіату, 200-400меш, BIOR AD) промивали 3 раком, у цьому випадку релаксацію класифікують, як зи дистильованою водою та зберігали при 4°С. індуковану ковтками. Різниця тиску між НСС та 1,6мл смоли додавали до кожної колонки, та прошлунком повинна бути менше 2мм Нg, а тривамивали 3мл 2,5мМ ГЕПЕС, 0,5мМ ЕДТА, рН 7,4. лість повної релаксації довше 1с. a) Обробка зразків Скорочення Зразки збирали у 15мл Фалкон-туби та нейтВОС трет-бутоксикарбоніл ралізували 0,375Μ ГЕПЕС, 0,75Μ КΟΗ. 4мл ГЕBu нормальний бутил ПЕС/EDTA (2,5/0,5мМ, рН 7,4) додавали до осаду МХПБК мета-хлорпероксибензойна кислота калій перхлорату. Надосадковий шар додавали до ККР Крива концентрація - реакція отриманої колонки Dowex. ДХМ ди хлорметан b) Розділення інозитол-фосфатів DEAD діетил азодикарбоксилат Елюють гліцеро-фосфатидил-інозитоли 8мл DHPG 3,5-дигідроксифенілгліцин 30мМ амоній форміату. DMAP 4(N,N-диметиламіно)піридин Елюють загальні інозитол-фосфати 8мл ДМФ Ν,Ν-диметилформамід 700мМ амоній форміату/100мМ мурашиної кислот ЕА е тилацетат та збирають елюат у сцинтиляційні склянки. Для EDC 1-Етил-3-(3підрахунку елюат змішували з 8мл сцинтилянту. диметиламінопропіл)карбодіімід Один аспект винаходу стосується способу інгіЕДТА Етилендіамін тетраоцтова кислота бування активації mGluR5, що полягає в обробці FLIPR Планшетний зчитувач флуорометричклітин, що містять вказаний рецептор ефективною ного відображення кількістю сполуки формули І. GHEK Нирки ембріону з вмістом транспортеру Скринування сполук, активних проти tlesr глутамату/аспартату Застосовували дорослих лабрадорів обох стаGLAST транспортер глутамату/аспартату тей, привчених до петлі Павлова. Утворюють езоHBTU О-бензотриазол-1-іл-Ν,Ν,Ν',Ν'фагостомію слизова-до-шкіри та собакам дають тетраметилуроній гексафлуорфосфат повністю прийти до себе перед будь-якими експеГЕПЕС4-(2-гідроксіетил)-1риментами. піперазинетансульфонова кислота (буфер) Вимір рухомості ІФ3 інозитап три фосфат Коротенько, після голодування протягом приLAH літій алюмогідрид близно 17 годин з вільною подачею води, багатоNovozyme 435Ò Полімер, доповнений ліпазою канальний набір рукав/відгалуження (Dentsleeve, Candida Antartica (Novozymes, Bagsvaerd, Adelaide, South Australia) уводять через езофагосDenmark) томію для вимірювання тисків у шлунку, нижчому PCC піридиній хлорхромат стравохідному сфінктері (НСС) та стравоході. НаPPTS піридиній п-толуолсульфонат бір обприскують водою, застосовуючи манометриTBAF тетрабутиламоній флуорид чний перфузійний насос з низькою піддатливістю ТГФ тетрагідрофуран (Dentsleeve, Adelaide, South Australia). Продуту nTsOH п-толуолсульфонова кислота повітрям трубку пропускають в оральному напрямі Результати для вимірювання ковтків, а стибієвий електрод Типові значення, які вимірювали у випробуконтролює рН, 3см вище НСС. Усі сигнали посиваннях, описаних вище є 10мкМ або менш. В одлюють та подають на персональний комп'ютер при ному аспекті винаходу IK 5 нижче 2мкМ. У ще од10Гц. ному аспекті винаходу IK5 нижче 0,2мкМ. У Коли вихідний вимір вільний від моторної акнаступному аспекті винаходу IK5 нижче 0,05мкМ. тивності шлункової/НСС фази III, отриманої при Приклади значень IK5 для індивідуальних споголодуванні, плацебо (0,9% NaCI) або тестлук надані нижче: сполуку уводять внутрішньовенно (0,5мл/кг) у вену Сполука FLIPRI передньої лапи. Через 10 хвилин після внутріш7-{[5-(3-хлорфеніл)-1,2,4-oксадіазол-3ньовенного уведення харчове борошно (10% пеп49нМ іл]метил)-3-піридин-4-іл-6,7-дигідро-5Нтону, 5% D-глюкози, 5% інтраліпіду, рН 3,0) увопіроло[2,1-с][1,2,4]триазол 47 Комп’ютерна в ерстка О. Гапоненко 82435 Підписне 48 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFused hetrocyclic compounds and their use as metabotropic receptor antagonists for the treatment of gastrointestinal disorders, pharmaceutical composition based thereon
Автори англійськоюJohansson Martin, Wensbo David, Minidis Alexander, Staaf Karin, KERS ANNIKA, Kers, Annika, Edwards Louise, ISAAC METHVIN, Stefanac Tomislav, Slassi Abdelmalik, Mcleod Donald, Xin Tao
Назва патенту російськоюКонденсированные гетероцикличиские соединения и их применение как метаботропных антагонистов рецепторов глутамата, фармацевтическая композиция на их основе
Автори російськоюЙохансон Мартин, Венсбо Дейвид, Минидис Александер, Стааф Карин, Керс Анника, Эдвардс Луиз, Айзек Метвин, Стефанак Томислав, Слесси Абдельмалик, Маклеод Доналд, Синь Тао
МПК / Мітки
МПК: A61K 31/4188, A61P 1/00, C07D 487/00
Мітки: композиція, гетероциклічні, глутамату, конденсовані, основі, метаботропних, сполуки, рецепторів, антагоністів, застосування, фармацевтична
Код посилання
<a href="https://ua.patents.su/24-82435-kondensovani-geterociklichni-spoluki-ta-kh-zastosuvannya-yak-metabotropnikh-antagonistiv-receptoriv-glutamatu-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Конденсовані гетероциклічні сполуки та їх застосування як метаботропних антагоністів рецепторів глутамату, фармацевтична композиція на їх основі</a>
Попередній патент: Полігетероциклічні сполуки і їх застосування як антагоністів метаботропного рецептора глютамату, фармацевтична композиція на їх основі
Наступний патент: Композиція для одержання біопалива
Випадковий патент: Пристрій для зрізання оголовків залізобетонних паль












