Похідні піразоліну, спосіб їх одержання (варіанти), фармацевтична композиція та активний інгредієнт
Номер патенту: 61137
Опубліковано: 17.11.2003
Автори: Беррокал-Ромеро Хуана Марія, Куберес-Альтісент Марія Роза, Конті-Хоч-Йобет Марія Монтсеррат, ФРІГОЛА КОНСТАНСА Хорді
Формула / Реферат
1. Похідні піразоліну загальної формули (I)
,
де
R1 - атом водню, метил, фторметил, дифторметил, трифтометил, карбонова кислота, нижчий карбоксилат, до складу якого входить від 1 атома до 4 атомів вуглецю, карбоксамід або ціаногрупа;
R2 - водень або метильна група;
R3, R4, R7 та R8, однакові або різні, - атом водню, хлору, фтору, метильна, трифторметильна або метоксильна група;
один із R5 та R6 - атом водню, хлору або фтору, метильна, трифторметильна, метоксильна або трифторметоксильна група, та інший із R5 та R6 - метилсульфонільна, аміносульфонільна або ацетиламіносульфонільна група;
за умови, що у разі, коли R1 - метильна група, то:
R2 - атом водню або метильна група,
R3 та R8, однакові або різні, - атом водню, хлору або фтору, метильна або трифторметильна група;
R4 - атом водню або фтору, метильна, трифторметильна або метоксильна група;
R5 - атом фтору, трифторметильна, трифторметоксильна, метилсульфонільна або аміносульфонільна група;
R6 - атом водню, хлору, фтору, метильна, трифторметильна, метоксильна, трифторметоксильна, метилсульфонільна або аміносульфонільна група;
причому R5 або R6 є метилсульфонільною або аміносульфонільною групою; та
R7 - атом водню, хлору або фтору, метильна, трифторметильна або метоксильна група;
та їхні фізіологічно прийнятні солі.
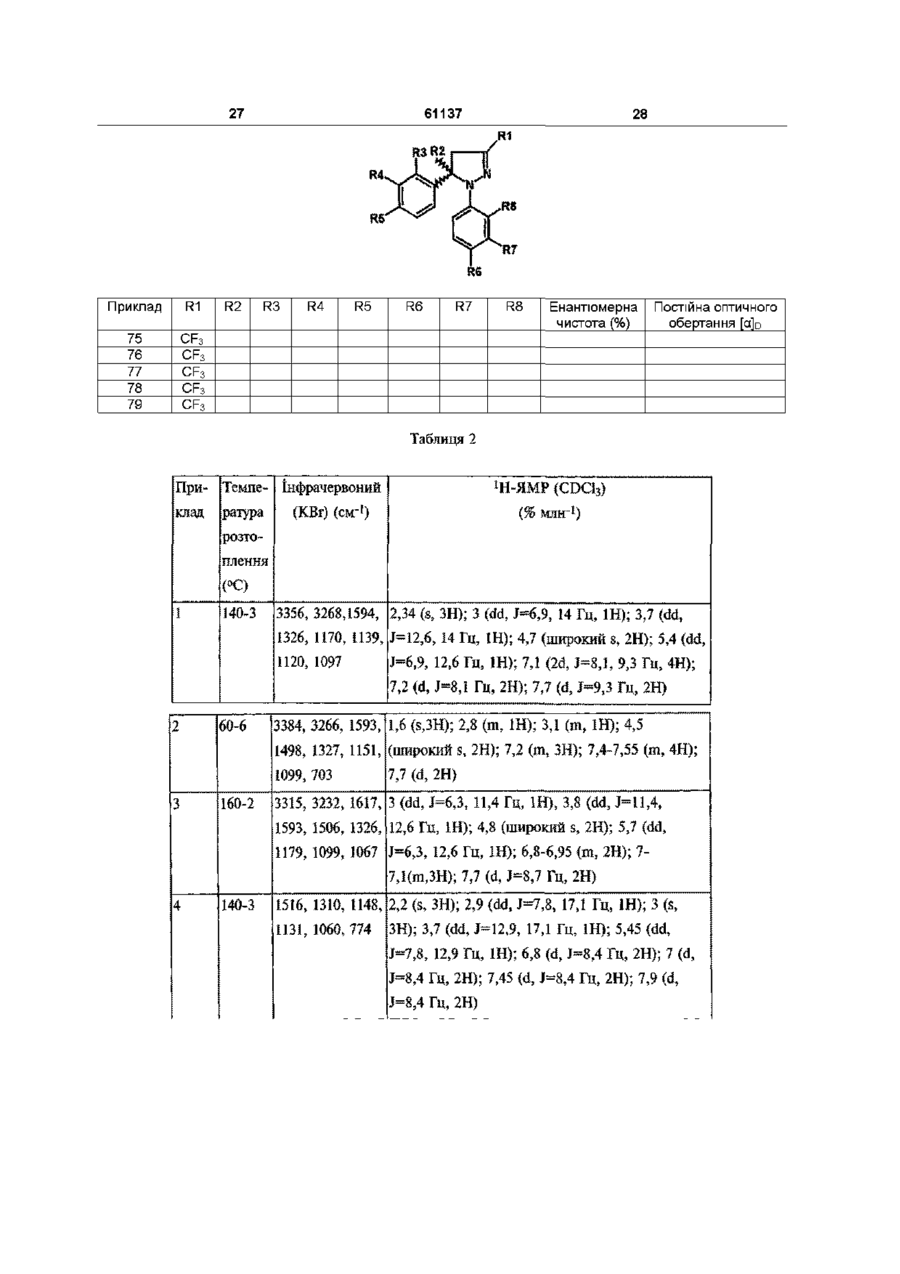
2. Сполука за п. 1, вибрана з наведеної нижче групи:
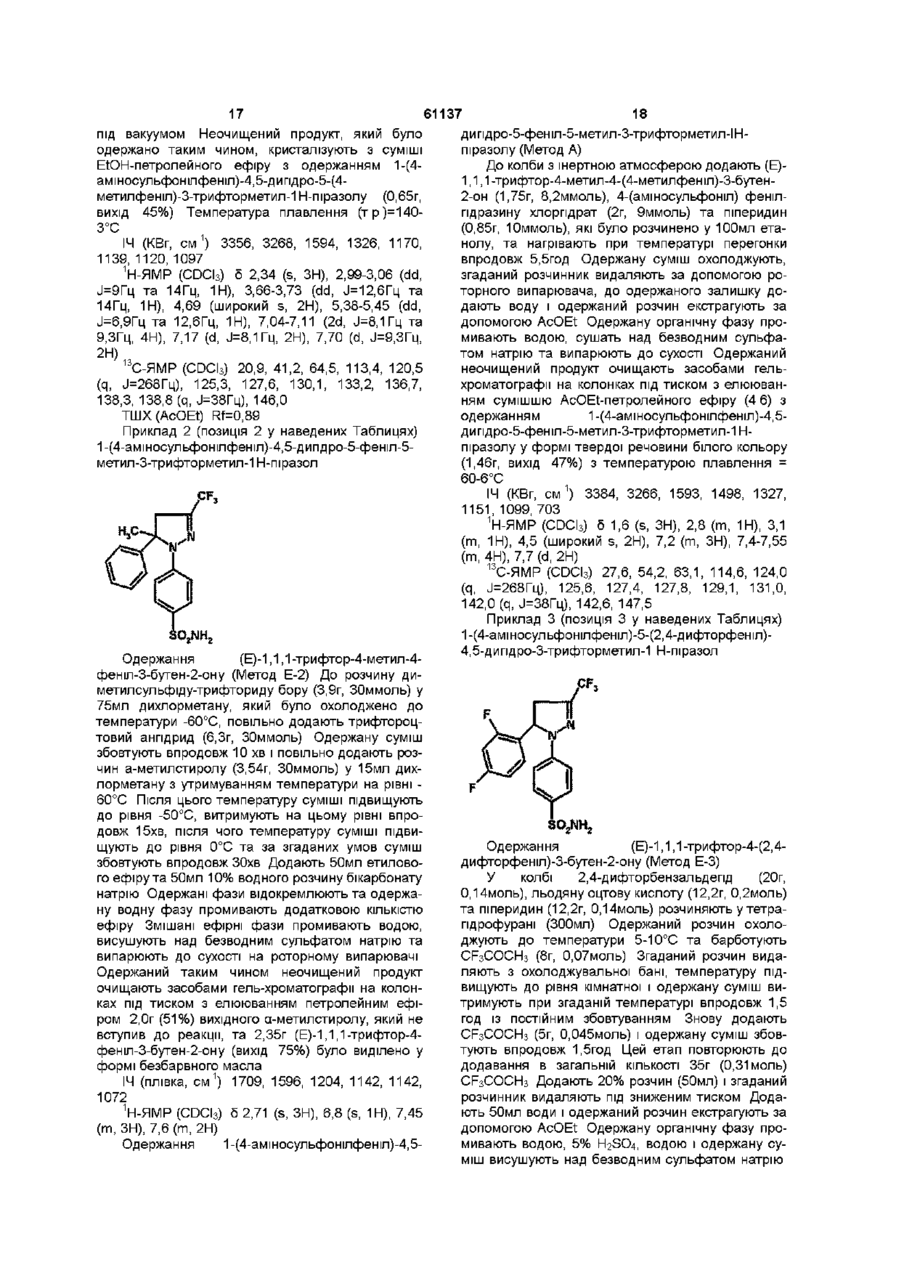
[1] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-метилфеніл)-3-трифторметил-1H-піразол,
[2] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-метил-5-(4-метилфеніл)-3-трифторметил-1H-піразол,
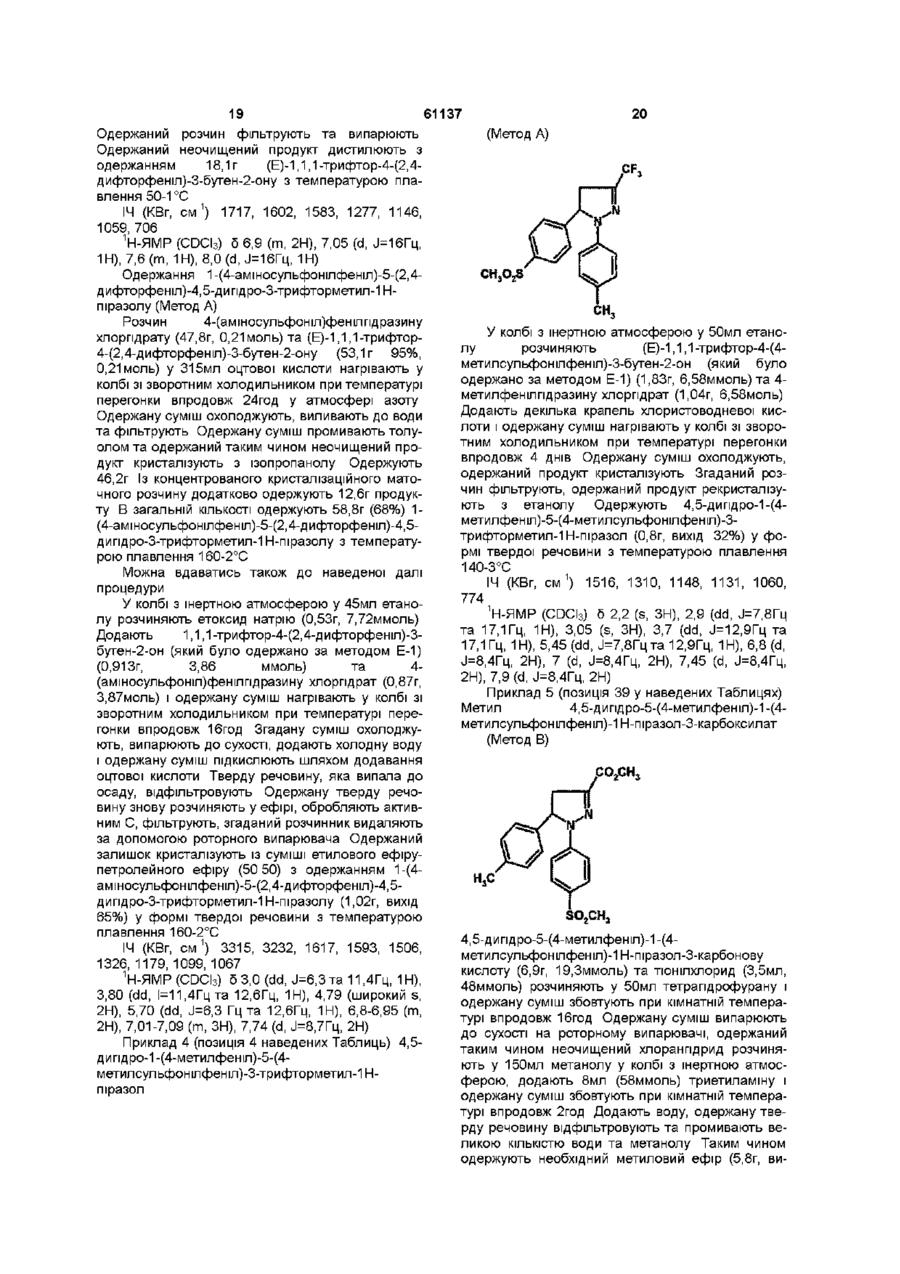
[3] 1-(4-аміносульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
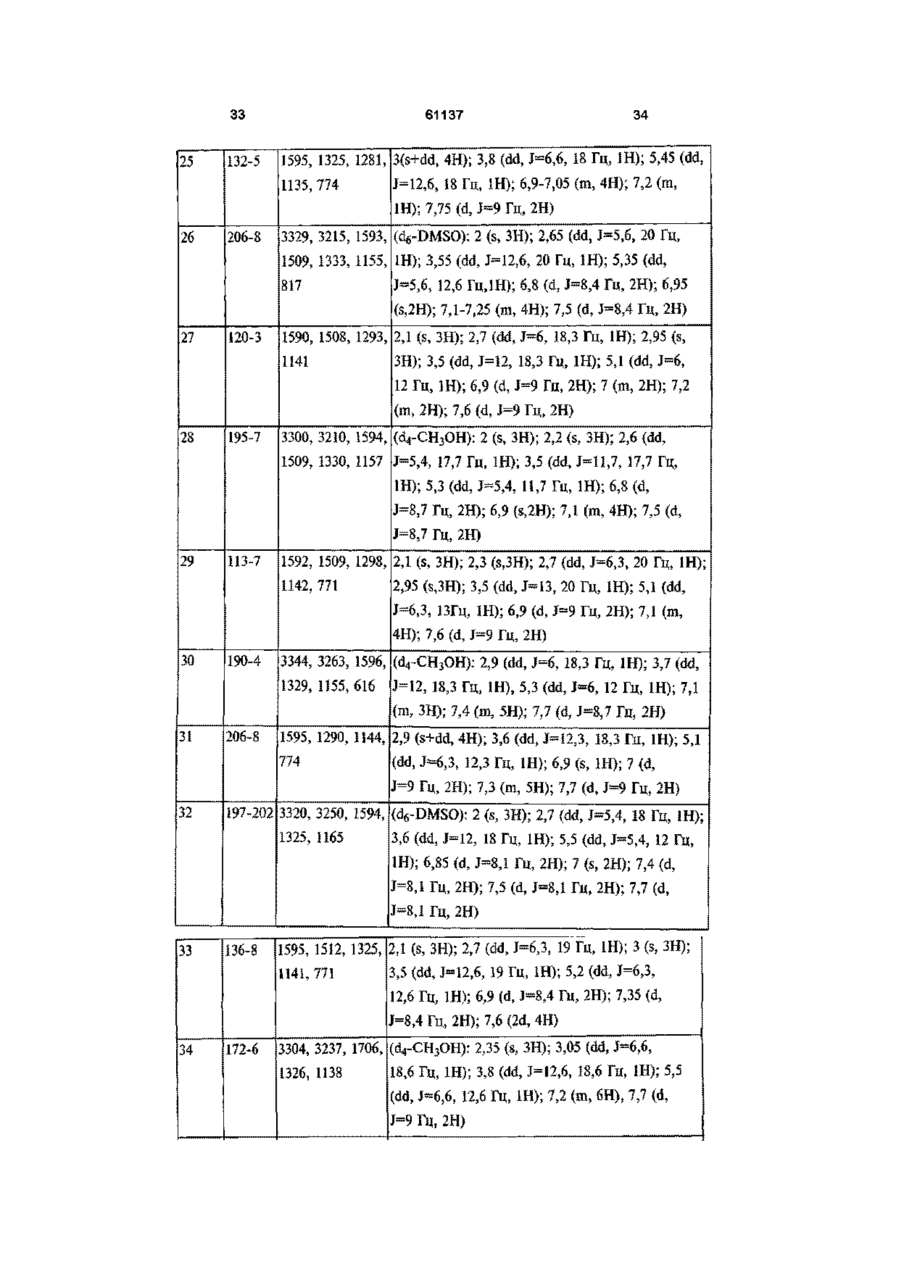
[4] 4,5-дигідро-1-(4-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[5] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-феніл-3-трифторметил-1H-піразол,
[6] 4,5-дигідро-5-феніл-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[7] 4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[8] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-фторфеніл)-3-трифторметил-1H-піразол,
[9] 4,5-дигідро-5-(4-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[10] 4,5-дигідро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[11] 1-(4-аміносульфонілфеніл)-5-(3,4-дифторфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
[12] 5-(2,4-дихлорфеніл)-4,5-дигідро-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[13] 1-(4-аміносульфонілфеніл)-5-(2,4-дихлорфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
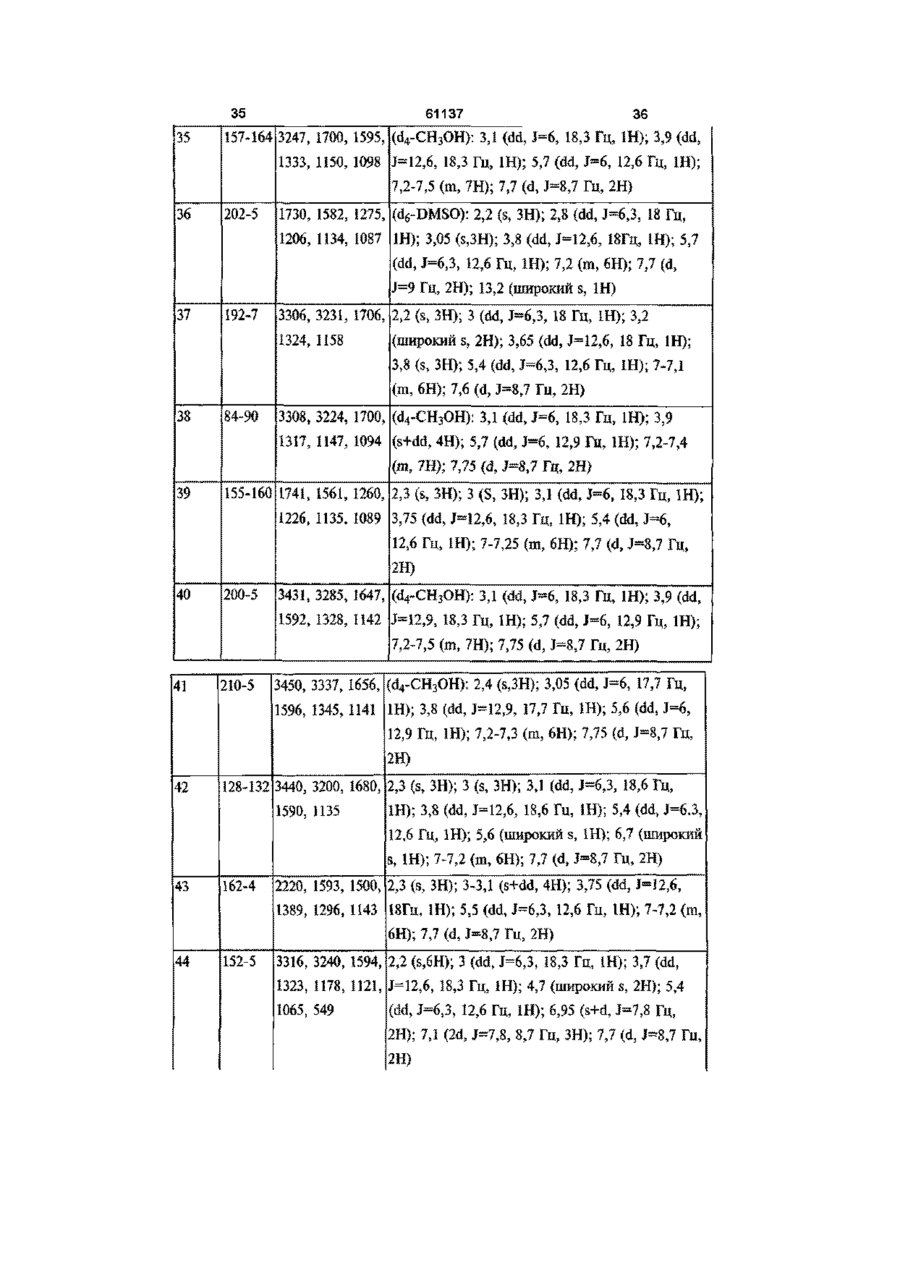
[14] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2-метилфеніл)-3-трифторметил-1H-піразол,
[15] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(3-метилфеніл)-3-трифторметил-1H-піразол,
[16] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2-фторфеніл)-3-трифторметил-1H-піразол,
[17] 4,5-дигідро-5-(2-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[18] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(3-фторфеніл)-3-трифторметил-1H-піразол,
[19] 4,5-дигідро-5-(3-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[20] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-метоксифеніл)-3-трифторметил-1H-піразол,
[21] 1-(4-аміносульфонілфеніл)-5-(3-хлор-4-фторфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
[22] 1-(4-аміносульфонілфеніл)-4,5-дигідро-3-трифторметил-5-(4-трифторметоксифеніл)-1H-піразол,
[23] 1-(4-аміносульфонілфеніл)-5-(2,3-дифторфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
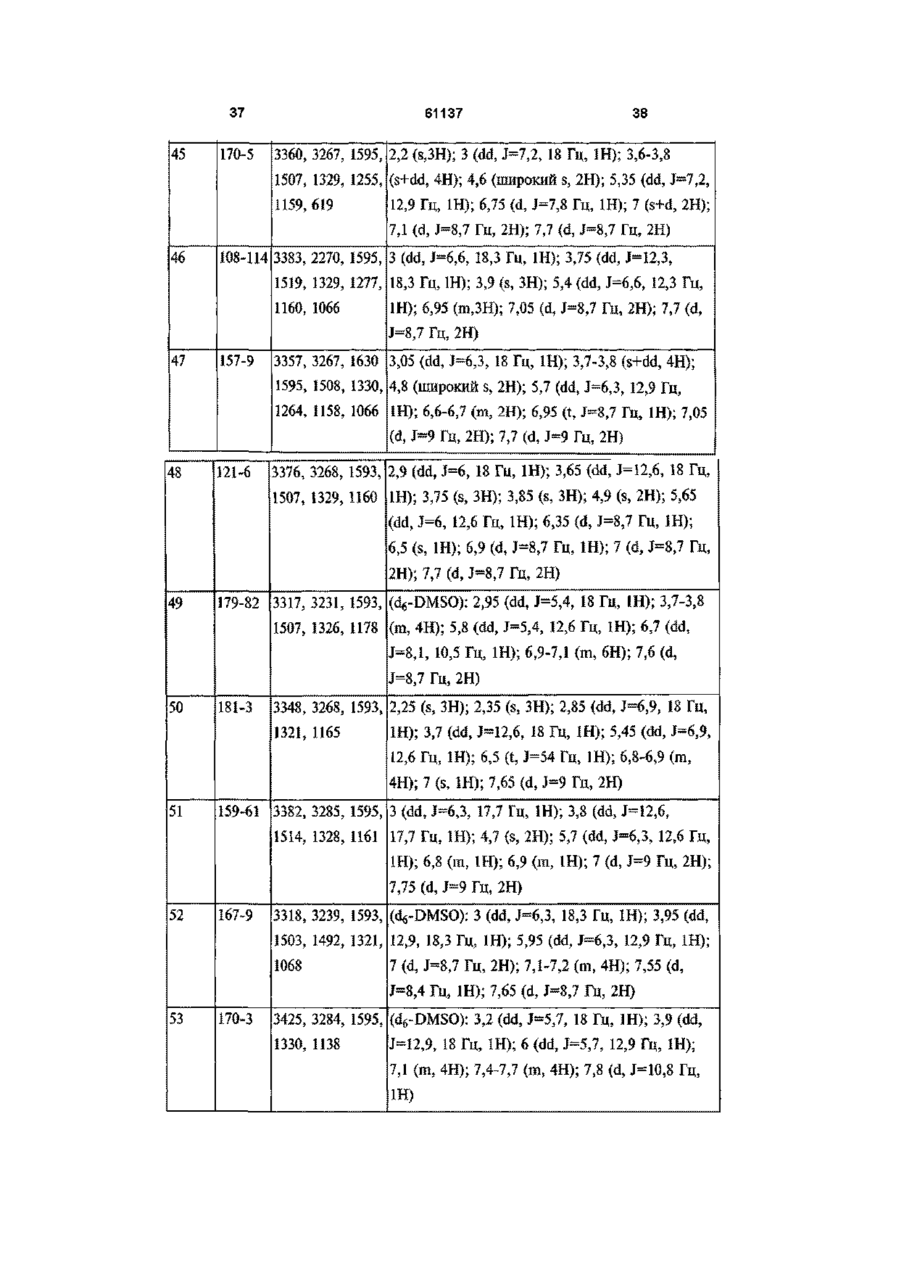
[24] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2,4-диметилфеніл)-3-трифторметил-1H-піразол,
[25] 5-(3,4-дифторфеніл)-4,5-дигідро-1-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол,
[26] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-фторфеніл)-3-метил-1H-піразол,
[27] 4,5-дигідро-5-(4-фторфеніл)-3-метил-1-(4-метилсульфонілфеніл)-1H-піразол,
[28] 1-(4-аміносульфонілфеніл)-4,5-дигідро-3-метил-5-(4-метилфеніл)-1H-піразол,
[29] 4,5-дигідро-3-метил-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол,
[30] 1-(4-аміносульфонілфеніл)-4,5-дигідро-3-метил-5-(4-трифторметилфеніл)-1H-піразол,
[31] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-феніл-1H-піразол,
[32] 4,5-дигідро-5-феніл-1-(4-метилсульфонілфеніл)-1H-піразол,
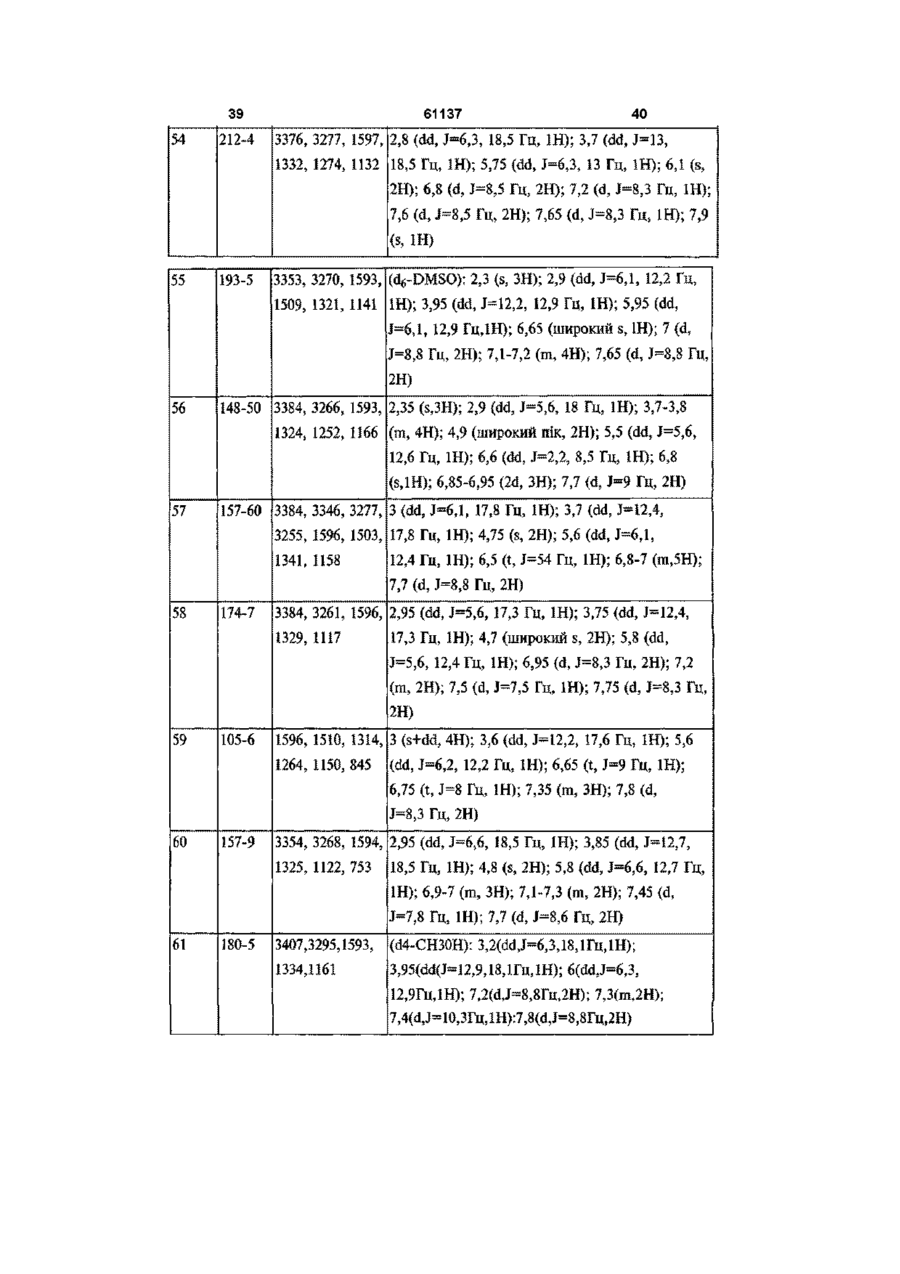
[33] 4,5-дигідро-3-метил-1-(4-метилсульфонілфеніл)-5-(4-трифторметилфеніл)-1H-піразол,
[34] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-метилфеніл)-1H-піразол-3-карбонова кислота,
[35] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-феніл-1H-піразол-3-карбонова кислота,
[36] 4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол-3-карбонова кислота,
[37] метил 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-метилфеніл)-1H-піразол-3-карбоксилат,
[38] метил 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-феніл-1H-піразол-3-карбоксилат,
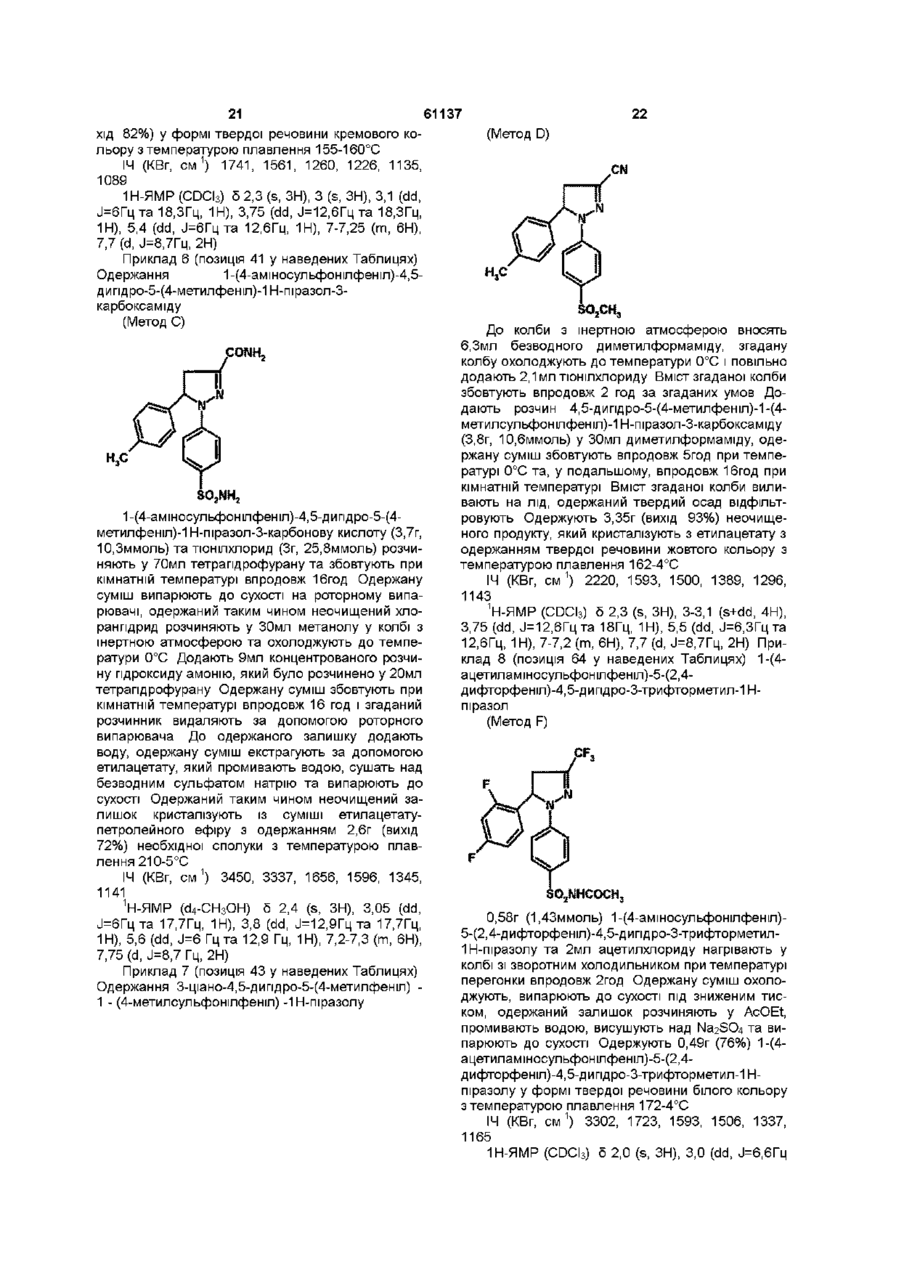
[39] метил 4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол-3-карбоксилат,
[40] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-феніл-1H-піразол-3-карбоксамід,
[41] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-метилфеніл)-1H-піразол-3-карбоксамід,
[42] 4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол-3-карбоксамід,
[43] 3-ціано-4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол,
[44] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(3,4-диметилфеніл)-3-трифторметил-1H-піразол,
[45] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(3-метил-4-метоксифеніл)-3-трифторметил-1H-піразол,
[46] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(3-фтор-4-метоксифеніл)-3-трифторметил-1H-піразол,
[47] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2-фтор-4-метоксифеніл)-3-трифторметил-1H-піразол,
[48] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2,4-диметоксифеніл)-3-трифторметил-1H-піразол,
[49] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-фтор-2-метоксифеніл)-3-трифторметил-1H-піразол,
[50] 1-(4-аміносульфонілфеніл)-3-дифторметил-4,5-дигідро-5-(2,4-диметилфеніл)-1H-піразол,
[51] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2,3,4-трифторфеніл)-3-трифторметил-1H-піразол,
[52] 1-(4-аміносульфонілфеніл)-5-(2-хлор-4-фторфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
[53] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2-фтор-4-трифторметилфеніл)-3-трифторметил-1H-піразол,
[54] 1-(4-аміносульфонілфеніл)-5-[2,4-(бістрифторметил)феніл]-4,5-дигідро-3-трифторметил-1H-піразол,
[55] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2-метил-3-фторфеніл)-3-трифторметил-1H-піразол,
[56] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2-метил-4-метоксифеніл)-3-трифторметил-1H-піразол,
[57] 1-(4-аміносульфонілфеніл)-5-(2,4-дифторфеніл)-3-дифторметил-4,5-дигідро-1H-піразол,
[58] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-фтор-2-трифторметилфеніл]-3-трифторметил-1H-піразол,
[59] 1-(2,4-дифторфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[60] 1-(4-аміносульфонілфеніл)-5-(2-хлорфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
[61] 1-(4-аміносульфонілфеніл)-5-(4-хлор-2-фторфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
[62] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(4-фтор-2-метилфеніл]-3-трифторметил-1H-піразол,
[63] 1-(4-аміносульфонілфеніл)-4,5-дигідро-5-(2-фтор-4-метилфеніл]-3-трифторметил-1H-піразол,
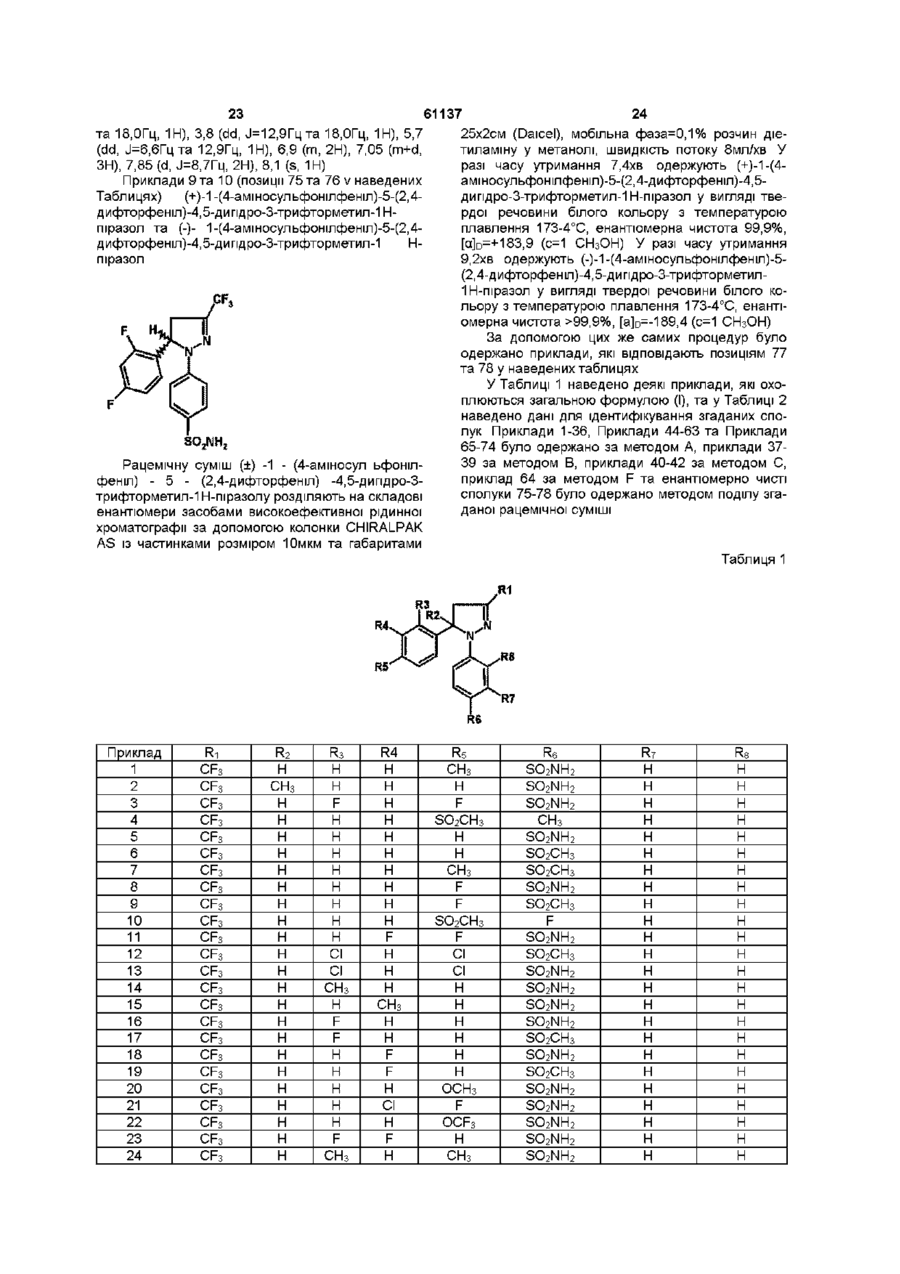
[64] 1-(4-ацетиламіносульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дигідро-3-трифторметил-1H-піразол,
[65] 1-(4-хлорфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[66] 4,5-дигідро-1-феніл-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[67] 4,5-дигідро-1-(2-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[68] 1-(4-хлор-2-метилфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[69] 4,5-дигідро-1-(3-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[70] 4,5-дигідро-1-(3-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[71] 4,5-дигідро-1-(2,4-диметилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[72] 1-(2-хлорфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[73] 4,5-дигідро-1-(2-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[74] 1-(2,4-дихлорфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
[75] (+)-1-(4-аміносульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дигідро-3-трифторметил-1Н-піразол,
[76] (-)-1-(4-аміносульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дигідро-3-трифторметил-1Н-піразол,
[77] (+)-4,5-дигідро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол,
[78] (-)-4,5-дигідро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол,
[79] 4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1-(2-трифторметилфеніл)-1H-піразол
та її фізіологічно прийнятні солі.
3. Спосіб одержання похідних піразоліну загальної формули (I) за п. 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (II)
,
де R1 - атом водню, метильна, фторметильна, дифторметильна, трифторметильна або карбоксильна група, та R2, R3, R4 та R5 мають значення, визначені у п. 1, із фенілгідразином у формі основи або солі загальної формули (III)
,
де R6, R7 та R8 мають значення, визначені у п. 1.
4. Спосіб одержання похідних піразоліну загальної формули (I) за п. 1, де R1 - карбоксилат нижчого алкілу з 1-4 атомами вуглецю, та R2, R3, R4, R5, R6, R7 та R8 мають значення, визначені у п. 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (I), де R1 - карбоксильна група (COOH) та R2, R3, R4, R5, R6, R7 та R8 мають значення, визначені у п. 1, із придатним реагентом для утворення хлорангідриду, наприклад, тіонілхлоридом або оксалілхлоридом, і після цього проводять реакцію естерифікації з аліфатичним спиртом, до складу якого входить від 1 до 4 атомів вуглецю, у присутності органічної основи, такої як триетиламін або піридин, або з безпосереднім проведенням реакції карбонової кислоти з відповідним безводним спиртом, насиченим газоподібним хлоридом водню.
5. Спосіб одержання похідних піразоліну загальної формули (I) за п. 1, де R1 - карбоксамідна група та R2, R3, R4, R5, R6, R7 та R8 мають значення, визначені у п. 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (I), де R1 - карбоксильна група (COOH) та R2, R3, R4, R5, R6, R7 та R8 мають значення, визначені у п. 1, з придатним реагентом для утворення хлорангідриду, наприклад, тіонілхлоридом або оксалілхлоридом, після чого проводять реакцію з аміаком.
6. Спосіб одержання похідних піразоліну загальної формули (I) за п. 1, де R1 - ціаногрупа, та R2, R3, R4, R5, R6, R7 та R8 мають значення, визначені у п. 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (I), де R1 - карбоксамідна група та R2, R3, R4, R5, R6, R7 та R8 мають значення, визначені у п. 1, з придатним реагентом, наприклад, комплексом диметилформамідутіонілхлориду або метансульфонілхлоридом.
7. Спосіб одержання похідних піразоліну загальної формули (I) за п. 1, де R1, R2, R3, R4, R5, R7 та R8 мають значення, визначені у п. 1, та R6 - ацетиламіносульфонільна група, або R1, R2, R3, R4, R6, R7 та R8 мають значення, визначені у п. 1, та R5 - ацетиламіносульфонільна група, який відрізняється тим, що проводять реакцію сполуки загальної формули (I), де R1, R2, R3, R4, R5, R7 та R8 мають значення, визначені у п. 1, та R6 - аміносульфонільна група, або R1, R2, R3, R4, R6, R7 та R8 мають значення, визначені у п. 1, та R5 - аміносульфонільна група, із придатним реагентом, таким як, наприклад, ацетилхлорид або ацетилангідрид.
8. Спосіб одержання похідної піразоліну загальної формули (I) за п. 1, енантіомерночистої, який відрізняється тим, що здійснюють розділення рацемічної суміші згаданої сполуки загальної формули (I) засобами хроматографії з хіральною стаціонарною фазою або шляхом утворення солі з енантіомерночистою кислотою.
9. Спосіб одержання фізіологічно прийнятної солі похідних піразоліну загальної формули (I) за п. 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (I) із неорганічною кислотою або з органічною кислотою у присутності придатного розчинника.
10. Фармацевтична композиція, яка відрізняється тим, що вона містить, принаймні, похідну сполуку піразоліну загальної формули (I) або її фізіологічно прийнятну сіль за пп. 1 або 2 та фармацевтично прийнятні наповнювачі.
11. Активний інгредієнт лікарського засобу для лікування у ссавців, у тому числі людини, запалення або інших розладів, пов’язаних з запаленням та іншими процесами, які опосередковуються циклооксигеназою-2, або процесами, у яких завдяки пригніченню циклооксигенази-2 досягається певний позитивний ефект, який відрізняється тим, що він є похідною сполукою піразоліну загальної формули (I) за п. 1 або 2, або її фізіологічно прийнятною сіллю.
12. Активний інгредієнт лікарського засобу за п. 11 для лікування запалення у ссавців, у тому числі у людини.
13. Активний інгредієнт лікарського засобу за п. 11 для лікування розладів, пов’язаних із запаленням, у ссавців, у тому числі у людини.
14. Активний інгредієнт лікарського засобу за п. 11 для лікування артриту у ссавців, у тому числі у людини.
15. Активний інгредієнт лікарського засобу за п. 11 для лікування болю у ссавців, у тому числі у людини.
16. Активний інгредієнт лікарського засобу за п. 11 для лікування гарячки у ссавців, у тому числі у людини.
Текст
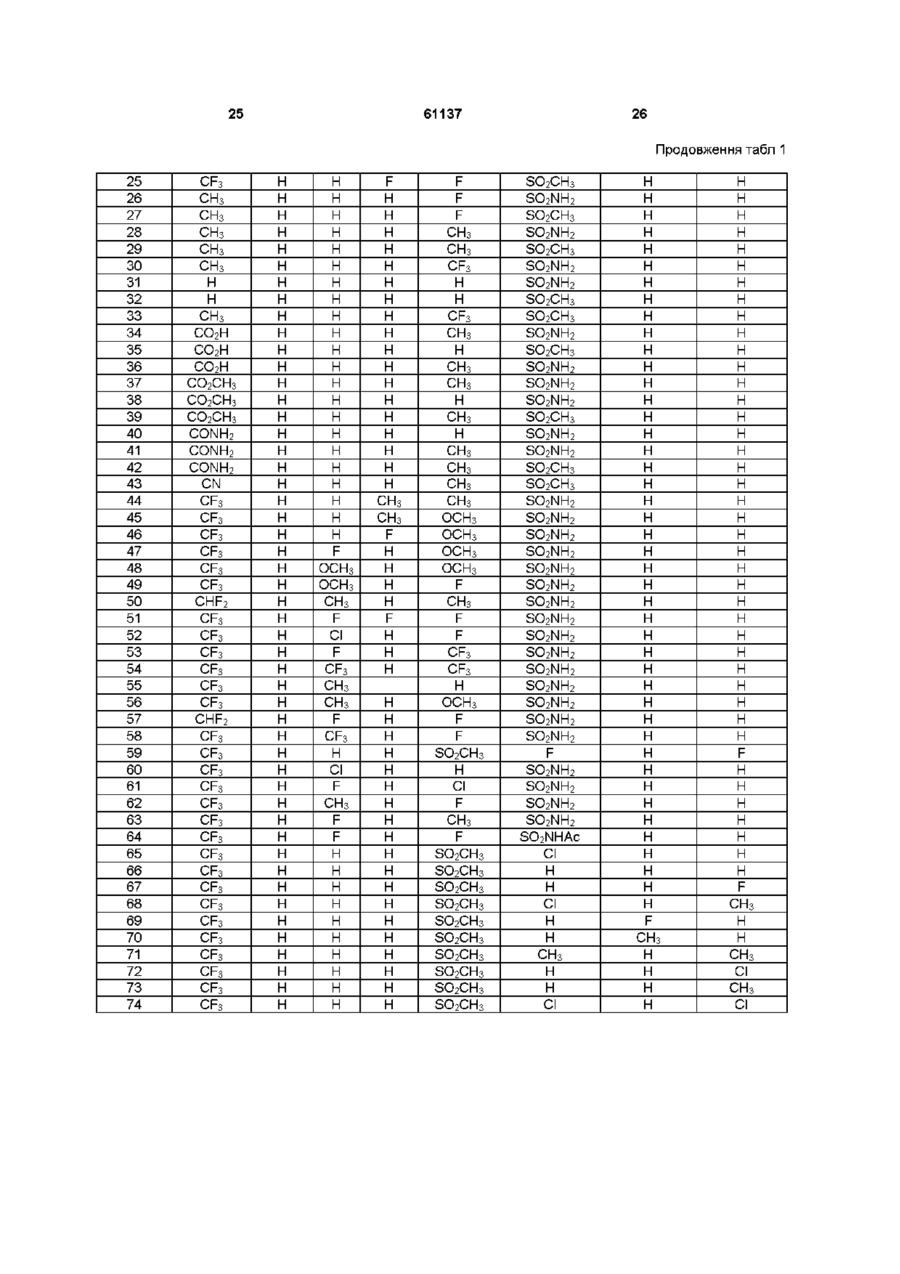
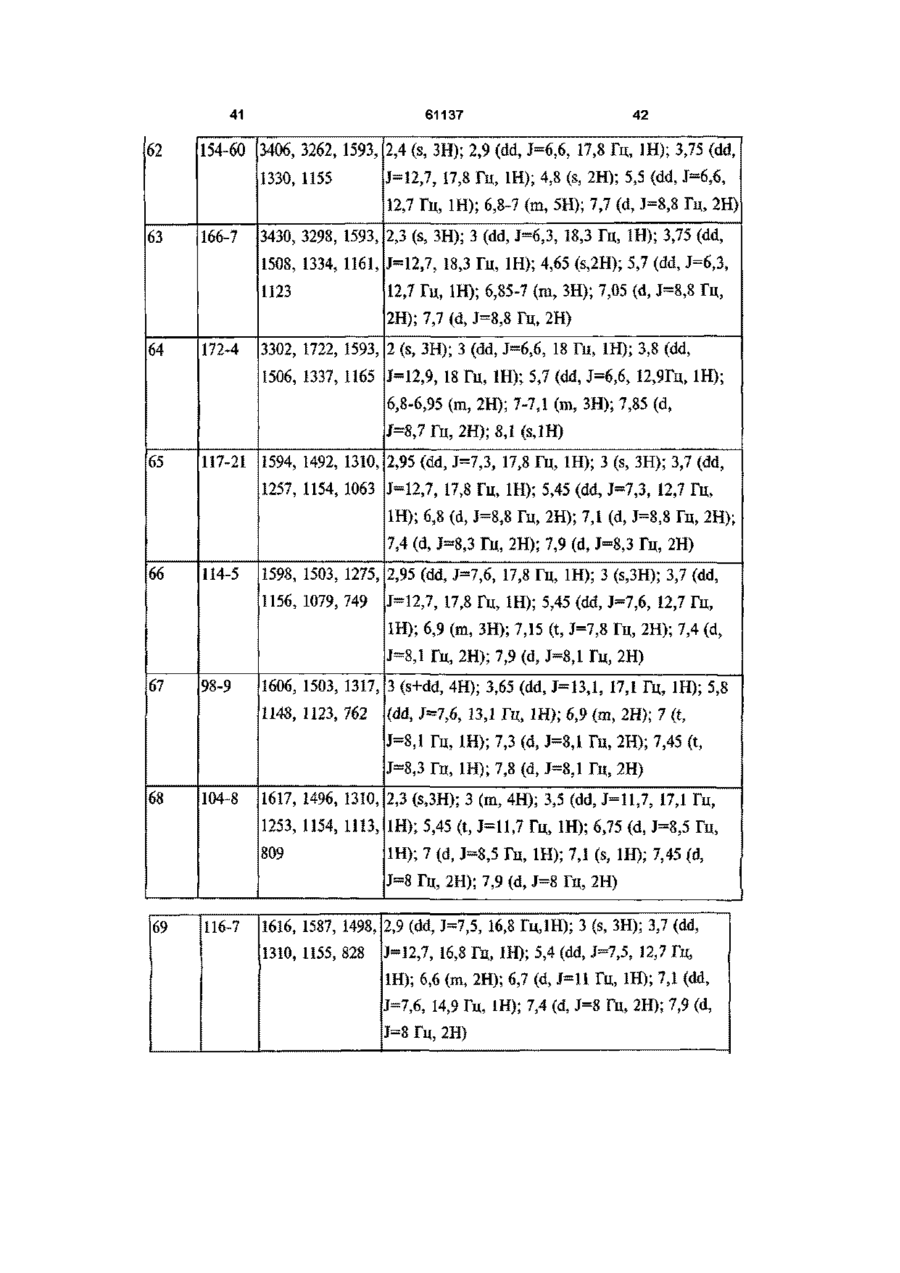
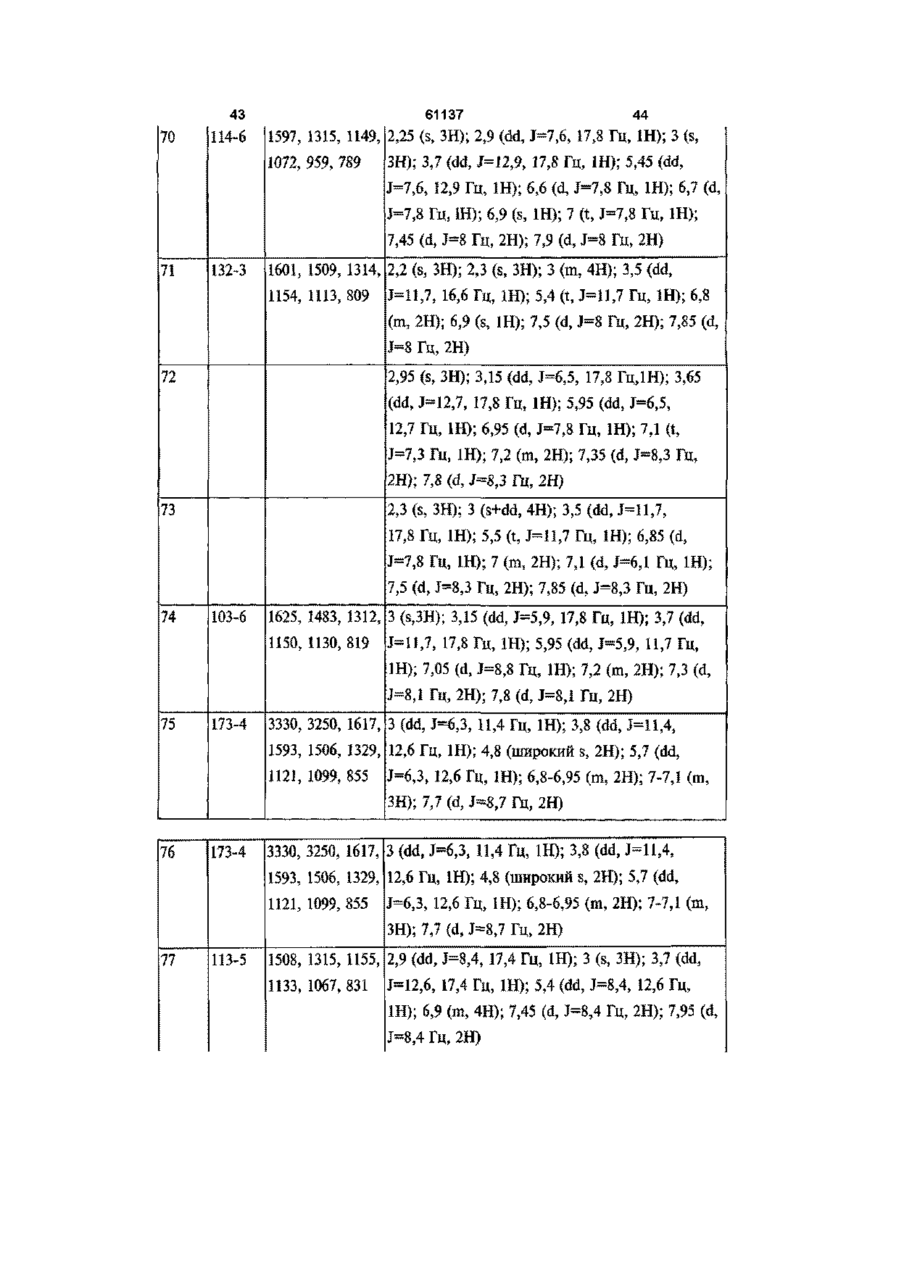
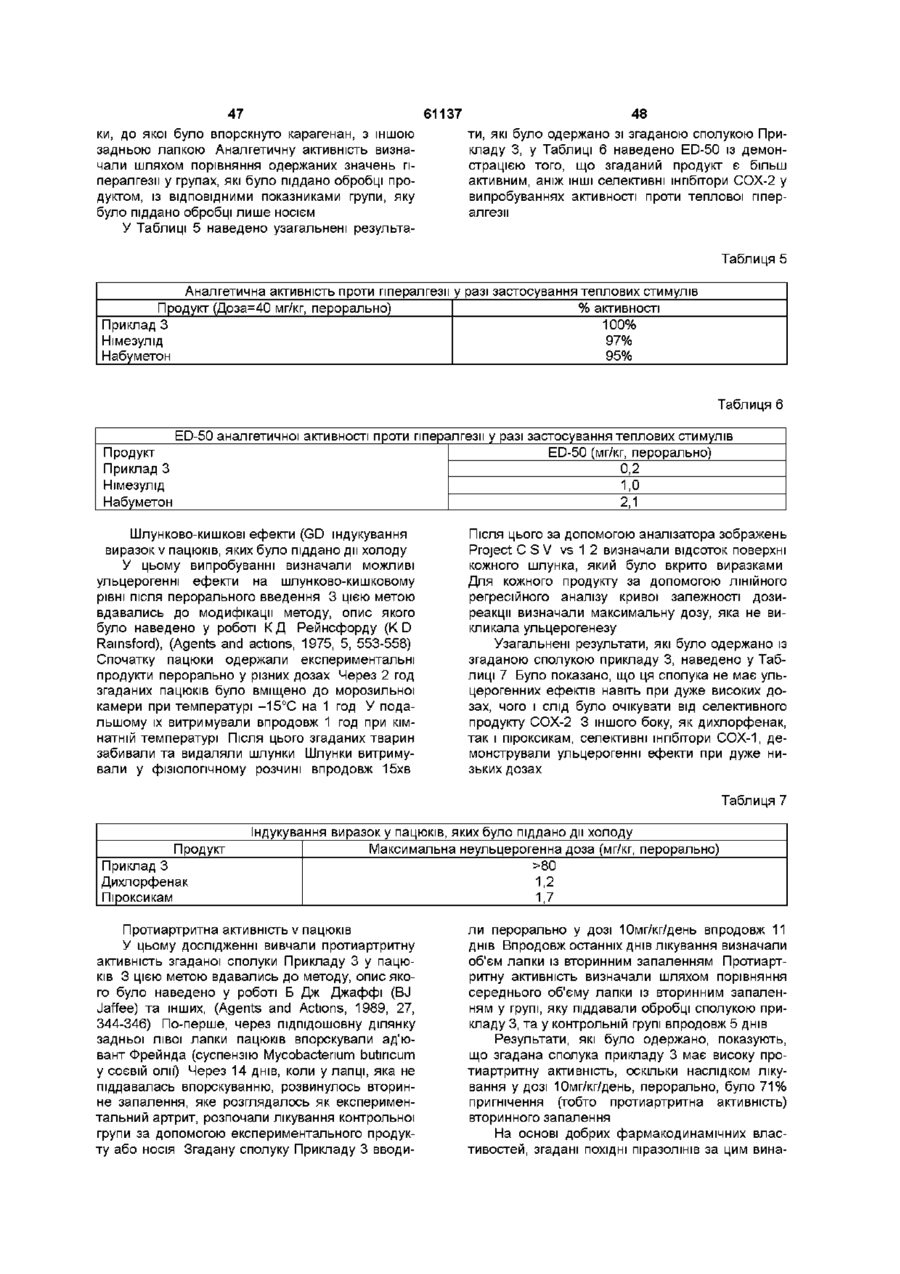
1 ПОХІДНІ піразолшу загальної формули (І) .R1 R3 - атом водню, метил, фторметил, дифторметил, трифтометил, карбонова кислота, нижчий карбоксилат, до складу якого входить від 1 атома до 4 атомів вуглецю, карбоксамід або ціаногрупа, F 2 - водень або метильна група, ? R3, R4, R7 та Rs, однакові або різні, - атом водню, хлору, фтору, метильна, трифторметильна або метоксильна група, один із Rs та R6 - атом водню, хлору або фтору, метильна, трифторметильна, метоксильна або трифторметоксильна група, та інший із Rs та R6 метилсульфонільна, аміносульфонільна або ацетиламшосульфонільна група, за умови, що у разі, коли Ri - метильна група, то R2 - атом водню або метильна група, R3 та Rs, однакові або різні, - атом водню, хлору або фтору, метильна або трифторметильна група, R4 - атом водню або фтору, метильна, трифторметильна або метоксильна група, Rs - атом фтору, трифторметильна, трифторметоксильна, метилсульфонільна або аміносульфоні льна група, R6 - атом водню, хлору, фтору, метильна, трифторметильна, метоксильна, трифторметоксильна, метилсульфонільна або аміносульфонільна група, причому Rs або R6 є метилсульфонільною або аміносульфонільною групою, та R7 - атом водню, хлору або фтору, метильна, трифторметильна або метоксильна група, та їхні фізіологічно прийнятні солі 2 Сполука за п 1, вибрана з наведеної нижче групи [I] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4-метилфеніл)-3-трифторметил-1Н-піразол, [2] 1 -(4-амшосульфонілфеніл)-4,5-дипдро-5-метил5-(4-метилфеніл)-3-трифторметил-1Н-піразол, [3] 1-(4-амшосульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [4] 4,5-дипдро-1-(4-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [5] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-фенілЗ-трифторметил-1 Н-піразол, [6] 4,5-дипдро-5-феніл-1-(4-метилсульфонілфеніл)-3-трифторметил-1 Н-піразол, [7] 4,5-дипдро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [8] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4фторфеніл)-3-трифторметил-1Н-піразол, [9] 4,5-дипдро-5-(4-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [10] 4,5-дипдро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [II] 1-(4-амшосульфонілфеніл)-5-(3,4-дифторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [12] 5-(2,4-дихлорфеніл)-4,5-дипдро-1 -(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [13] 1 -(4-амшосульфонілфеніл)-5-(2,4-дихлорфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [14] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2метилфеніл)-3-трифторметил-1Н-піразол, [15] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(3метилфеніл)-3-трифторметил-1Н-піразол, [16] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2фторфеніл)-3-трифторметил-1Н-піразол, [17] 4,5-дипдро-5-(2-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [18] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(3фторфеніл)-3-трифторметил-1Н-піразол, О го (О 61137 [19] 4,5-дипдро-5-(3-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [20] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4метоксифеніл)-3-трифторметил-1Н-піразол, [21] 1-(4-амшосульфонілфеніл)-5-(3-хлор-4-фторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [22] 1-(4-амшосульфонілфеніл)-4,5-дипдро-3-трифторметил-5-(4-трифторметоксифеніл)-1Н-піразол, [23] 1-(4-амшосульфонілфеніл)-5-(2,3-дифторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [24] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2,4диметилфеніл)-3-трифторметил-1Н-піразол, [25] 5-(3,4-дифторфеніл)-4,5-дипдро-1-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [26] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4фторфеніл)-3-метил-1 Н-піразол, [27] 4,5-дипдро-5-(4-фторфеніл)-3-метил-1-(4-метилсульфонілфеніл)-1 Н-піразол, [28] 1-(4-амшосульфонілфеніл)-4,5-дипдро-3-метил-5-(4-метилфеніл)-1Н-піразол, [29] 4,5-дипдро-3-метил-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1 Н-піразол, [ЗО] 1-(4-амшосульфонілфеніл)-4,5-дипдро-3-метил-5-(4-трифторметилфеніл)-1Н-піразол, [31] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-феніл-1Н-піразол, [32] 4,5-дипдро-5-феніл-1-(4-метилсульфонілфеніл)-1Н-піразол, [33] 4,5-дипдро-3-метил-1-(4-метилсульфонілфеніл)-5-(4-трифторметилфеніл)-1Н-піразол, [34] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4метилфеніл)-1 Н-піразол-3-карбонова кислота, [35] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-феніл-1 Н-піразол-3-карбонова кислота, [36] 4,5-дипдро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1 Н-піразол-3-карбонова кислота, [37] метил 1-(4-амшосульфонілфеніл)-4,5-дипдро5-(4-метилфеніл)-1Н-піразол-3-карбоксилат, [38] метил 1-(4-амшосульфонілфеніл)-4,5-дипдро5-феніл-1Н-піразол-3-карбоксилат, [39] метил 4,5-дипдро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1Н-піразол-3-карбоксилат, [40] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-феніл-1 Н-піразол-3-карбоксамід, [41] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4метилфеніл)-1Н-піразол-3-карбоксамід, [42] 4,5-дипдро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1Н-піразол-3-карбоксамід, [43] 3-ціано-4,5-дипдро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1 Н-піразол, [44] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(3,4диметилфеніл)-3-трифторметил-1Н-піразол, [45] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(3метил-4-метоксифеніл)-3-трифторметил-1Н-піразол, [46] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(3фтор-4-метоксифеніл)-3-трифторметил-1Н-піразол, [47] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2фтор-4-метоксифеніл)-3-трифторметил-1Н-піразол, [48] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2,4диметоксифеніл)-3-трифторметил-1Н-піразол, [49] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4фтор-2-метоксифеніл)-3-трифторметил-1Н-піра зол, [50] 1-(4-аміносульфонілфеніл)-3-дифторметил4,5-дипдро-5-(2,4-диметилфеніл)-1Н-піразол, [51] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5(2,3,4-трифторфеніл)-3-трифторметил-1Н-піразол, [52] 1-(4-аміносульфонілфеніл)-5-(2-хлор-4-фторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [53] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2фтор-4-трифторметилфеніл)-3-трифторметил-1Нпіразол, [54] 1-(4-аміносульфонілфеніл)-5-[2,4-(бістрифторметил)феніл]-4,5-дипдро-3-трифторметил-1Нпіразол, [55] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2метил-3-фторфеніл)-3-трифторметил-1Н-піразол, [56] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2метил-4-метоксифеніл)-3-трифторметил-1Н-піразол, [57] 1-(4-аміносульфонілфеніл)-5-(2,4-дифторфеніл)-3-дифторметил-4,5-дипдро-1Н-піразол, [58] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4фтор-2-трифторметилфеніл]-3-трифторметил-1Нпіразол, [59] 1-(2,4-дифторфеніл)-4,5-дипдро-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [60] 1-(4-аміносульфонілфеніл)-5-(2-хлорфеніл)4,5-дипдро-3-трифторметил-1Н-піразол, [61] 1-(4-аміносульфонілфеніл)-5-(4-хлор-2-фторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [62] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4фтор-2-метилфеніл]-3-трифторметил-1Н-піразол, [63] 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(2фтор-4-метилфеніл]-3-трифторметил-1Н-піразол, [64] 1-(4-ацетиламшосульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [65] 1-(4-хлорфеніл)-4,5-дипдро-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [66] 4,5-дипдро-1-феніл-5-(4-метилсульфонілфеніл)-3-трифторметил-1 Н-піразол, [67] 4,5-дипдро-1-(2-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [68] 1-(4-хлор-2-метилфеніл)-4,5-дипдро-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [69] 4,5-дипдро-1-(3-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [70] 4,5-дипдро-1-(3-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [71] 4,5-дипдро-1-(2,4-диметилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [72] 1-(2-хлорфеніл)-4,5-дипдро-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [73] 4,5-дипдро-1-(2-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [74] 1-(2,4-дихлорфеніл)-4,5-дипдро-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [75] (+)-1-(4-амшосульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [76] (-)-1-(4-амшосульфонілфеніл)-5-(2,4-дифторфеніл)-4,5-дипдро-3-трифторметил-1Н-піразол, [77] (+)-4,5-дипдро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [78] (-)-4,5-дипдро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1Н-піразол, [79] 4,5-дипдро-5-(4-метилсульфонілфеніл)-3-трифторметил-1-(2-трифторметилфеніл)-1Н-піразол та и фізіологічно прийнятні солі 61137 З Спосіб одержання похідних піразоліну загальної формули (І) за п 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (II) О R4 (if) де Ri - атом водню, метильна, фторметильна, дифторметильна, трифторметильна або карбоксильна група, та R2, R3, R4 та Rs мають значення, визначені у п 1, із фенілпдразином у формі основи або солі загальної формули (III) R7 ("І) де F?6, R7 та Rs мають значення, визначені у п 1 4 Спосіб одержання похідних піразоліну загальної формули (І) за п 1, де R-і - карбоксилат нижчого алкілу з 1-4 атомами вуглецю, та R2, R3, R4, R5, R6, R7 та Rs мають значення, визначені у п 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (І), де Ri - карбоксильна група (СООН) та R2, R3, R4, R5, Re, R7 та R8 мають значення, визначені у п 1, із придатним реагентом для утворення хлорангідриду, наприклад, тюнілхлоридом або оксалілхлоридом, і після цього проводять реакцію естерифікацм з аліфатичним спиртом, до складу якого входить від 1 до 4 атомів вуглецю, у присутності органічної основи, такої як триетиламш або піридин, або з безпосереднім проведенням реакції карбонової кислоти з ВІДПОВІДНИМ безводним спиртом, насиченим газоподібним хлоридом водню 5 Спосіб одержання похідних піразоліну загальної формули (І) за п 1, де R-і - карбоксамідна група та R2, R3, R4, R5, R6, R7 та Rs мають значення, визначені у п 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (І), де Ri карбоксильна група (СООН) та R2, R3, R4, R5, R6, R7 та Rs мають значення, визначені у п 1, з придатним реагентом для утворення хлорангідриду, наприклад, тюнілхлоридом або оксалілхлоридом, після чого проводять реакцію з аміаком 6 Спосіб одержання похідних піразоліну загальної формули (І) за п 1, де R-і - ціаногрупа, та R2, R3, R4, R5, R6, R7 та Rs мають значення, визначені у п 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (І), де Ri - карбоксамі дна група та R2, R3, R4, R5, R6, R7 та Rs мають значення, визначені у п 1, з придатним реагентом, наприклад, комплексом диметилформамідутюнілхлориду або метансульфонілхлоридом 7 Спосіб одержання похідних піразоліну загальної формули (І) за п 1, де Ri, R2, R3, R4, R5, R7 та Rs мають значення, визначені у п 1, та R6 - ацетиламіносульфонільна група, або Ri, R2, R3, R4, R6, R7 та Rs мають значення, визначені у п 1, та Rs ацетиламшосульфонільна група, який відрізняється тим, що проводять реакцію сполуки загальної формули (І), де R-і, R2, R3, R4, Rs, R7 та Rs мають значення, визначені у п 1, та R6 аміносульфонільна група, або Ri, R2, R3, R4, R6, R7 та Rs мають значення, визначені у п 1, та Rs - аміносульфонільна група, із придатним реагентом, таким як, наприклад, ацетилхлорид або ацетиланпдрид 8 Спосіб одержання похідної піразоліну загальної формули (І) за п 1, енантюмерночистої, який відрізняється тим, що здійснюють розділення рацемічної суміші згаданої сполуки загальної формули (І) засобами хроматографії з хіральною стаціонарною фазою або шляхом утворення солі з енантюмерночистою кислотою 9 Спосіб одержання фізіологічно прийнятної солі похідних піразоліну загальної формули (І) за п 1, який відрізняється тим, що проводять реакцію сполуки загальної формули (І) із неорганічною кислотою або з органічною кислотою у присутності придатного розчинника 10 Фармацевтична композиція, яка відрізняється тим, що вона містить, принаймні, похідну сполуку піразоліну загальної формули (І) або и фізіологічно прийнятну сіль за пп 1 або 2 та фармацевтично прийнятні наповнювачі 11 Активний інгредієнт лікарського засобу для лікування у ссавців, у тому числі людини, запалення або інших розладів, пов'язаних з запаленням та іншими процесами, які опосередковуються циклооксигеназою-2, або процесами, у яких завдяки пригніченню циклооксигенази-2 досягається певний позитивний ефект, який відрізняється тим, що він є похідною сполукою піразоліну загальної формули (І) за п 1 або 2, або и фізіологічно прийнятною сіллю 12 Активний інгредієнт лікарського засобу за п 11 для лікування запалення у ссавців, у тому числі у людини 13 Активний інгредієнт лікарського засобу за п 11 для лікування розладів, пов'язаних із запаленням, у ссавців, утому числі у людини 14 Активний інгредієнт лікарського засобу за п 11 для лікування артриту у ссавців, у тому числі у людини 15 Активний інгредієнт лікарського засобу за п 11 для лікування болю у ссавців, у тому числі у людини 16 Активний інгредієнт лікарського засобу за п 11 для лікування гарячки у ссавців, у тому числі у людини 61137 Цей винахід має відношення до нових похідних піразоліну, які мають загальну формулу (І), та до їхніх фізіологічно прийнятних солей, до способів їх одержання, до їх застосування як лікарських засобів у медицині та/або ветеринари, а також до фармацевтичних композицій, до складу яких вони входять R3 R7 (І} Нові сполуки, запропоновані цим винаходом, можуть використовуватись у фармацевтичній промисловості як проміжні продукти та для одержання лікарських засобів Рівень техніки Нестероідні протизапальні лікарські препарати (NSAIDS) традиційно класифікуються як протизапальні, антипіретичні та аналгетичні агенти для симптоматичного полегшення запалення, гарячки та болю у межах від легкого до помірного Головними показниками для застосування згаданих лікарських препаратів є остеоартрит, ревматоїдний артрит та ІНШІ запальні захворювання суглобів, вони призначені також для лікування запалень, пов'язаних із невеликими пошкодженнями та для застосування як аналгетиків широкого спектру дії Згадані NSAIDS є переважно інгібіторами гострої запальної реакції, однак під час ревматоїдних захворювань вони мають незначний вплив на дегенеративні зміни, які відбуваються у тканині та лежать у основі згаданих захворювань Відкриття головного механізму дії згаданих NSAIDS, який полягає у пригніченні циклооксигенази (СОХ) [ДжР Вейн (J R Vane), Nature, 1971, 231, 232], забезпечило задовільне пояснення їхньої терапевтичної дії та встановило значення, яке відіграють певні простагландини як посередники, під час запального захворювання [Р Дж Флауер (RJ Flower), Дж Р Вейн (J R Vane), Biochem Pharm , 1974, 23, 1439, ДжР Вейн (J R Vane), P M Боттинг (R M Botting), Postgrad Med J , 1990, 66 (Suppl 4), S2] Шлункову токсичність класичних NSAIDS, а також їхні ЦІЛЮЩІ ефекти, обумовлено пригніченням синтезу простагландинів шляхом пригнічення ферменту циклооксигенази (СОХ) Незважаючи на декілька прийнятих стратегій (ентеросолюбільне покриття для запобігання адсорбування у шлунку, парентеральне введення, одержання проліків тощо) для зменшення пошкоджень шлунково-кишкового тракту, які викликаються NSAIDS, жодна зі згаданих модифікацій не забезпечила одержання суттєвого впливу на КІЛЬКІСТЬ виникнення серйозних несприятливих реакцій, наприклад, перфорації та кровотечі Відкриття індукованої простагландинсинтетази, яка одержала назву циклооксигенази-2 8 (СОХ-2), яка відрізняється від конститутивного ферменту, який зараз називають циклооксигеназою-1 (СОХ-1) [Дж Сіруа (J Sirois), ДжР Річардс (J R Richards), / BioL Chem , 1992, 267, 6382], відновило інтерес до розробки нових протизапальних лікарських засобів Унаслідок ідентифікування ізоформи СОХ-2 виникла гіпотеза, що вона може нести відповідальність за продукування простагландинів у місцях, де відбувається запалення Як наслідок, селективне пригнічення згаданого ізоферменту може зменшити запалення без виникнення побічних ефектів шлункової та ниркової токсичності Згаданий ізофермент СОХ-1 експресується по суті у більшості тканин із функцією синтезування простагландинів, що регулює нормальну активність клітин 3 іншого боку, згаданий ізофермент СОХ-2 є відсутнім у клітинах за нормальних умов, однак під час хронічного запалення рівні згаданого білку СОХ-2 зростають паралельно з надпродукуванням простагландинів [Дж Р Вейн (J R Vane), Р М Боттинг (RM Botting), Inflamm Res, 1995, 44, 1] Таким чином, селективний інгібітор СОХ-2 має такі ж самі протизапальні, антипіретичні та анальгетичні властивості, що і традиційний нестероідний протизапальний лікарський засіб, а також пригнічує скорочення матки, які було викликано гормонами, та демонструє потенційні антиканцерогенні ефекти та ЦІЛЮЩІ ефекти щодо запобігання розвитку хвороби Альцгеймеру 3 іншого боку, селективний інгібітор СОХ-2 зменшує потенційну шлунково-кишкову токсичність, зменшує потенційні ниркові побічні ефекти та скорочує час кровотечі Об'ємну структуру СОХ-1 було визначено засобами рентгенографії [Д Пікот (D Picot), П Дж Лолл (PJ Loll), Р М Гаравіто (R М Garavito), Nature, 1994, 367, 243] Три із згаданих структурних спіралей утворюють вхід до циклооксигеназного каналу, включення якого до складу мембрани забезпечує доступ арахідонової кислоти до активного центру із внутрішнього боку подвійного шару Згаданим активним центром циклооксигенази є великий гідрофобний канал і згадані автори наводять докази того, що NSAIDS пригнічують СОХ-1 шляхом виключення арахідонової кислоти з верхньої частини згаданого каналу Нещодавно [Р С Сервіс (RS Service), Science, 1996, 273, 1660] було наведено опис об'ємної структури СОХ-2, що надає можливість порівняння подібностей та розбіжностей між двома згаданими ізоформами, та, завдяки цьому, дослідження нових лікарських засобів, які селективно пригнічують СОХ-2 Структури СОХ-1 та СОХ-2 демонструють, що центри зв'язування згаданих протизапальних лікарських засобів зі згаданими ферментами є дуже подібними, однак існує і різниця, яка полягає у як мінімум одній важливій амінокислоті Значну КІЛЬКІСТЬ ізолейцину, яка є присутньою на згаданому активному центрі СОХ-1, у СОХ-2 замінено на валін Ізолейцин блокує бокову порожнину, яку є відокремлено від головного зв'язку обох ізоферментів Згадана блокована порожнина СОХ-1 не перешкоджає зв'язуванню класичних NSAIDS, однак інгібітор, який потребує додаткової точки підтримки, яка забезпечується згаданою боковою порожниною, 61137 буде зв'язуватись з СОХ-2 з більшою легкістю, аніж з СОХ-1 Як наслідок, моделлю нового покоління протизапальних лікарських засобів є така, де згадані інгібітори циклооксигенази віддають значну перевагу згаданій боковій порожнині СОХ-2 У ХІМІЧНІЙ літературі було наведено опис похідних п'яти азотовмісних гетероциклічних ароматичних сполук, які мають пригнічувальну активність СОХ-2 До згаданих азолових похідних входять піроли [В В Вілкерсон (WW Wilkerson) та ІНШІ, І Med Chem , 1994, 37, 988, В В Вілкерсон (WW Wilkerson) та ІНШІ, І Med Chem, 1995, 38, 3895, І К Ханна (І К Khanna) та ІНШІ, І Med Chem , 1997, 40, 1619], піразоли [ГД Пеннінг (Т D Penning) та ІНШІ, І Med Chem , 1997, 40, 1347, К Цуджі (К TSUJI) та ІНШІ, Chem Pharm Bull, 1997, 45, 987, К Цуджі (К TSUJI) та ІНШІ, Chem Pharm Bull, 1997, 45, 1475] або імідазоли [Ханна (Khanna) та І Н Ш І , I M e d C h e m , 1 9 9 7 , 4 0 , 1 6 3 4 ] Автори цього винаходу відкрили, що нові сполуки, які було одержано з піразолінів загальної формули (І), демонструють цікаві біологічні властивості, що робить їх особливопридатними для застосування у галузі медицини та ветеринарії Сполуки, які надані цим винаходом, є придатними як засоби із протизапальною активністю та для лікування інших захворювань, у яких відіграє роль циклооксигеназа-2, і не мають шлункової та ниркової токсичності класичних NSAIDS Докладний опис винаходу Цей винахід надає нові піразоліни, які пригнічують згаданий фермент циклооксигеназу-2, з застосуванням у медицині та ветеринарії як протизапальні лікарські засоби, та для лікування інших захворювань, у яких відіграє роль циклооксигеназа-2, та які зовсім не мають або мають незначну шлункову та ниркову токсичність Таким чином, згадані протизапальні лікарські засоби мають кращий профіль безпеки Згадані нові сполуки, які представляють собою мету цього винаходу, є похідними Д2-піразолшів, відомих також як 4,5дипдро-1Н-піразоли Таким чином, вони представляють собою неароматичні азотовмісні гетероциклічні сполуки Як наслідок, піразолінові кільця, у протилежність до азолів, опис яких було наведено перед тим, не є плоскими Згадані сполуки, запропоновані цим винаходом, мають загальну формулу (І) Ri представляє собою атом водню, метил, фторметил, дифторметил, трифтометил, карбонову кислоту, нижчий карбоксилат, до складу якого 10 входить від 1 атому до 4 атомів вуглецю, карбоксамід або ціаногрупу, F 2 представляє собою водень або метильну ? групу, R3, R4, R7 та Rs, однакові або різні, представляють собою атом водню, хлору, фтору, метальну, трифторметильну або метоксильну групу, один із Rs та R6 представляє собою атом водню, хлору або фтору, метильну, трифторметильну, метоксильну або трифторметоксильну групу, та інший із та Rs та R6 представляє собою метилсульфонільну, аміносульфонільну або ацетиламшосульфонільну групу, за умови, що у разі, коли Ri представляє собою метильну групу, R2 представляє собою атом водню або метильну групу, R3 та Rs, однакові або різні, представляють собою атом водню, хлору або фтору, метильну або трифторметильну групу, R4 представляє собою атом водню або фтору, метильну, трифторметильну або метоксильну групу, Rs представляє собою атом фтору, трифторметильну, трифторметоксильну, метилсульфонільну або аміносульфонільну групу, R6 представляє собою атом водню, хлору, фтору, метильну, трифторметильну, метоксильну, трифторметоксильну, метилсульфонільну або аміносульфонільну групу, за умови, що один або обидва RS та RA представляють собою метилсульфонільну або аміносульфонільну групу, та R7 представляє собою атом водню, хлору або фтору, метильну, трифторметильну або метоксильну групу Згадані нові сполуки загальної формули (І) мають асиметричний атом вуглецю, завдяки чому їх можна одержати енантюмерно чистими або у формі рацематів Згадані рацемати сполук (І) можна розділити на їхні оптичні ізомери за допомогою традиційних методів, наприклад, шляхом відокремлення засобами хроматографії з хіральною стаціонарною фазою або шляхом фракціонованої кристалізації їхніх діастереоізомерних солей, які можна одержати шляхом реагування згаданих сполук (І) з енантюмерно чистими кислотами Подібним же чином, їх можна також одержати шляхом енантюселективного синтезу з використанням енантюмерно чистих хіральних попередників Цей винахід має також відношення до фізіологічно прийнятних солей згаданих сполук загальної формули (І), зокрема до солей, які одержують шляхом додавання мінеральних кислот, наприклад, хлористоводневої, бромистоводневої, фосфорної, сірчаної, азотної кислоти тощо, та органічних кислот, наприклад, лимонної, малеїнової, фумарової кислоти, винних кислот або їхніх похідних, р-толуолсульфонової, метансульфонової, камфорсульфонової кислоти тощо Згадані нові ПОХІДНІ загальної формули (І) можна застосовувати до ссавців, утому числі до людини, як протизапальні лікарські засоби для лікування запалення та для лікування інших розладів, пов'язаних з запаленням, наприклад, як аналгетики для лікування болю та мігрені, а також як анти 12 11 61137 піретики для лікування гарячки Наприклад, згадаразин, гідроксид натрію, гідроксид калію, метоксид ні нові ПОХІДНІ загальної формули (І) можна застонатрію або етоксид натрію, або їх суміші Згадане совувати для лікування артриту, із включенням, кислотне або основне середовище само по собі але не обмежуючись, лікування ревматоїдного може відігравати роль розчинника Найпридатніші артриту, спондилоартропатій, подагричного артритемператури змінюються у межах від кімнатної ту, системного червоного вовчака, остеоартритута температури до температури перегонки згаданого хвороби Стілла-Шоффара Згадані нові ПОХІДНІ розчинника, тривалість реакції може становити від загальної формули (І) можна застосовувати для декількох годин до декількох днів лікування астми, бронхіту, розладів менструальноМетод В го циклу, тендиніту, бурситу та різноманітних стаОдержання згаданих сполук загальної формунів, які уражують шкіру, наприклад, псоріазу, екзели (І), де Ri представляє собою карбоксилат нижми, ОПІКІВ та дерматиту Згадані нові ПОХІДНІ чого алкілу з 1-4 атомами вуглецю, та R2, R3, R4, загальної формули (І) можна застосовувати також R5, F?6, R7 та Rs мають ті ж самі значення, які були для лікування захворювань шлунково-кишкового наведені перед тим, здійснюють шляхом реагутракту, наприклад, синдрому запалення кишечнивання сполуки загальної формули (І), де Ri предку, гранулематозної хвороби, гастриту, синдрому ставляє собою карбоксильну групу (СООН) та R2, подразненої товстої кишки та неспецифічного виR3, R4, R5, F?6, R7 та Rs мають ті ж самі значення, разкового коліту які були наведені перед тим, з придатним реагентом з утворенням хлорангідриду, наприклад, такоЗгадані нові ПОХІДНІ загальної формули (І) мого як тюнілхлорид або оксалілхлорид, із подальжна одержати ВІДПОВІДНО до цього винаходу за шим здійсненням реакції естерифікацм з допомогою методів, які наведено далі аліфатичним спиртом, до складу якого входить від Метод А 1 атому до 4 атомів вуглецю, у присутності органіОдержання згаданих сполук загальної формучної основи, такої яктриетиламш або піридин, або ли (І) здійснюють шляхом реагування сполуки заз безпосереднім проведенням реакції карбонової гальної формули кислоти з ВІДПОВІДНИМ безводним спиртом, насиченим газоподібним хлоридом водню Згадану R: реакцію здійснюють у згаданому реагенті, який виступає як власний розчинник, або у інших придатних розчинниках, таких як галогеновані вуглеводні, як наприклад, дихлорметан, хлороформ або тетрахлорид вуглецю, прості ефіри, такі як діоксан, тетрапдрофуран, етиловий ефір або диметоксіетан Найпридатніші температури змінюються у межах від 0°С до температури перегонки згаданого розчинника, тривалість реакції може становити від 10 хв до 24 год де Ri представляє собою атом водню, метилМетод С ьну, фторметильну, дифторметильну, трифтормеОдержання згаданих сполук загальної формутильну або карбоксильну групу, та R2, R3, R4 та Rs ли (І), де Ri представляє собою карбоксамідну мають ті ж самі значення, які були наведені для групу та R2, R3, R4, R5, R6, R7 та Rs мають ті ж самі загальної формули (І), із фенілпдразином загальзначення, які були наведені перед тим, здійснюють ної формули (III) у формі основи або солі шляхом реагування сполуки загальної формули (І), де Ri представляє собою карбоксильну групу (СООН) та R2, R3, R4, R5, Re, R7 та R8 мають ті ж самі значення, які були наведені перед тим, із придатним реагентом для утворення хлорангідриду, наприклад, тюнілхлоридом або оксалілхлоридом, з подальшим реагуванням з аміаком, який R7 може бути у формі концентрованого водного розчину або розчиненим у придатному розчиннику Згадану реакцію здійснюють у придатному розчиннику, такому як, наприклад, ефіри, такі як діоксан, (111) тетрапдрофуран, етиловий ефір або диметоксіетан Найпридатніші температури змінюються у де F?6, R7 та Rs мають ті ж самі значення, які межах від 0°С до температури перегонки згаданобули наведені перед тим для загальної формули І го розчинника, тривалість реакції може становити Згадану реакцію здійснюють у присутності від 1 год до 24 год придатного розчинника, наприклад, спиртів, таких Метод D як метанол, етанол, простих ефірів, таких як діокОдержання згаданих сполук загальної формусан, тетрапдрофуран, або їх сумішей, або інших ли (І), де Ri представляє собою ціаногрупу, та R2, розчинників Згадана реакція відбувається у кисR3, R4, R5, R6, R7 та Rs мають ті ж самі значення, лотному середовищі, яке може бути органічним, які були наведені перед тим, здійснюють шляхом наприклад, таким як оцтова кислота, або неорганіреагування сполуки загальної формули (І), де Ri чним, наприклад, таким як хлористоводнева киспредставляє собою карбоксамідну групу та R2, R3, лота, або суміші згаданих обох, або у основному R4, R5, R6, R7 та Rs мають ті ж самі значення, які середовищі, наприклад, такому як піперидин, піпе 14 13 61137 були наведені перед тим, із придатним реагентом, наприклад, комплексом диметилформамідутюнілхлориду або метансульфонілхлоридом Згадану реакцію здійснюють у придатному розчиннику, такому як, наприклад, диметилформамід або піридин Найпридатніші температури змінюються у R4 межах від 0°С до температури перегонки згаданого розчинника, тривалість реакції може становити від 15хв до 24 год Метод Е (V) Згадані сполуки загальної формули (II), які є ' де R2 представляє собою метилпроміжними продуктами одержання згаданих споьну групу та R3, R4 та Rs мають ті ж самі значення, лук загальної формули (І), є комерційно доступниякі були наведені перед тим для згаданих сполук ми або їх можна одержати за допомогою різномазагальної формули (І), з моно-, ди- або трифторонітних відомих методів, до яких належать методи, цтовим ангідридом у присутності комплексу димеякі наведено далі тилсульфіду-трифториду бору Згадану реакцію Метод Е-1 здійснюють у придатному розчиннику, такому як, Одержання згаданих сполук загальної формунаприклад, галогеновані вуглеводні, такі як дихлоли (II), де Ri представляє собою моно-, ди- або рметан, хлороформ або тетрахлорид вуглецю, або трифторметильну групу, F 2 представляє собою ? прості ефіри, такі як діоксан, тетрапдрофуран, атом водню та R3, F?4 та Rs мають ті ж самі значенетиловий ефір або диметоксіетан Найпридатніші ня, які були наведені перед тим для згаданих спотемператури змінюються у межах від -70°С до телук загальної формули (І), здійснюють шляхом мператури перегонки згаданого розчинника, триреагування бензальдегіду загальної формули (IV) валість реакції може становити від 20 хв до 20 год Метод Е-3 СНО Одержання сполук загальної формули (II), де Ri представляє собою метильну або трифторметильну групу, R2 представляє собою атом водню та R3, R4 та Rs мають ті ж самі значення, які були наведені перед тим для згаданих сполук загальної формули (І), здійснюють за допомогою різноманітних процедур, серед яких можна знайти, наприклад, реакцію Кпяйзена-Шмідта між бензальдегідом загальної формули (IV) та ацетоном або 1,1,1(IV) трифторацетоном у присутності водного розчину гідроксиду лужного металу, наприклад, гідроксиду де R3, R4 та Rs мають ті ж самі значення, які натрію або гідроксиду калію, або оцтової кислоти були наведені перед тим для загальної формули та піперидину, реакцію Віттіга-Хорнера між бенза(І), з N-феніл (моно, ди або трильдегідом загальної формули (IV) та 2-оксофтор)ацетимідоілхлоридом у присутності діалкілалкілфосфонатом у присутності водного розчину фосфонату, такого як діетилметилфосфонат, та основи, такої як, наприклад, карбонат калію або сильної органічної основи, такої як LDA (дизопробікарбонат калію, реакцію бензальдегіду загальної піламід ЛІТІЮ), або шляхом реакції Віттіга з моно-, формули (IV) з а,а-біс(триметилсиліл)-1:диабо трифторацетилметилентрифенілбутилкетиміном у присутності ЛЬЮІСОВОІ кислоти, фосфораном та основою, такою як карбонат нанаприклад, диброміду цинку, або реакцію сполуки трію або карбонат калію Згадану реакцію здійсзагальної формули (VI) нюють у придатному розчиннику, такому як, наприклад, дихлорметан, хлороформ або бензол, або простий ефір, такий як тетрапдрофуран, етиловий ефір, диметоксіетан або діоксан Найпридатніші температури змінюються у межах від -70°С до температури перегонки згаданого розчинника, тривалість реакції може становити від 15хв до 20 R4' год Метод Е-2 Одержання згаданих сполук загальної формули (II), де Ri представляє собою метальну або трифторметильну групу, R2 представляє собою метальну групу та R3, R4 та Rs мають ті ж самі значення, які були наведені перед тим для згаданих сполук загальної формули (І), здійснюють шляхом реагування сполуки загальної формули (V) (VI) де R3, R4 та Rs мають ті ж самі значення, які були наведені перед тим для загальної формули (І), з триметилалюмінієм у присутності трихлориду алюмінію Згадану реакцію здійснюють у придатному розчиннику, такому як, наприклад, спирт, такий як метанол або етанол, галогенований вуглеводень, такий як тетрахлорид вуглецю, хлороформ або дихлорметан, простий ефір, такий як тетрапдрофуран, етиловий ефір, діоксан або диметоксіетан, вода або їх суміші Температура реакції може змі 16 15 61137 нюватись у межах від -60°С до температури перегонки згаданого розчинника, тривалість реакції може становити від 2 год до декількох днів Метод Е-4 Одержання сполук загальної формули (II), де Ri та F 2 представляють собою атом водню, та R3, ? F 4 та R5 мають ті ж самі значення, які були наве? дені перед тим для згаданих сполук загальної формули (І), здійснюють за допомогою різноманітних методів, серед яких можна знайти, наприклад, реакцію Віттіга-Хорнера з бензальдегідом загальної формули IV з подальшим відновленням ненасиченого а, р-складного ефіру за допомогою гідОдержання (Е)-1,1,1 -трифтор-4-(4риду металу, наприклад, гідриду метилфеніл)-3-бутен-2-ону (Метод Е-1) дмзобутилалюмінію (Дибалю), за допомогою реакДо колби з сухою інертною атмосферою вноції бензальдегіду загальної формули IV з а,асять 15мл безводного тетрапдрофурану і згадану біс(триметилсиліл)-1:-бутилацетальдиміном у приколбу охолоджують до температури -70°С Додасутності ЛЬЮІСОВОІ кислоти, наприклад, диброміду ють розчин 2М LDA у суміші тетрапдрофурануцинку, або шляхом конденсування бензальдегіду гексану (5мл, Юммоль) та діетилметилфосфонат загальної формули IV з ацетальдепдом у присут(0,75мл, 5ммоль), який було розчинено у 5мл тетності гідроксиду лужного металу, такого як гідрорапдрофурану, і вміст згаданої колби збовтують ксид натрію або гідроксид калію впродовж ЗОхв Після ЦЬОГО додають крапля за краплею N-фенілтрифторацетимідошшюрид Метод F (1,04г, 5ммоль) (який було одержано за описом, Одержання згаданих сполук загальної формуякий було наведено у роботі Тамура К (Tamura К), ли (І), де R-і, R2, R3, R4, R7 та Rs мають ті ж самі Міцукамі Г (Mizukami H) та інших, I Org Chem , значення, які було наведено перед тим, та один із 1993, 58, 32-35) із продовженням збовтування за Rs та R6 представляє собою атом водню, хлору тих же самих умов впродовж 1 год Додають пабо фтору, метальну, трифторметильну, метокситолуїяовий альдегід (0,6г, 5ммоль), видаляють льну або трифторметоксильну групу, та інший з Rs охолоджувальну баню і вміст згаданої колби прота R6 є ацетиламшосульфонільною групою, здійсдовжують збовтувати при кімнатній температурі нюють шляхом реагування сполуки загальної фовпродовж 16год Додають Юмл 2N НСІ зі збовтурмули (І), де R-і, R2, R3, R4, R7Ta Rs мають ті ж самі ванням впродовж подальших 4год Тетрапдрофузначення, які були наведені перед тим, та один із ран видаляють на роторному випарювачі, одержаRs та R6 представляє собою атом водню, хлору ну суміш екстрагують за допомогою етилового або фтору, метильну, трифторметильну, метоксиефіру (Зх20мл), одержані змішані органічні екстральну або трифторметоксильну групу, та інший із Rs кти промивають 5% розчином бікарбонату натрію та R6 є ацетиламшосульфонільною групою, із прита насиченим розчином хлориду натрію до одердатним реагентом, таким як, наприклад, ацетилжання рН приблизно 6 Одержану суміш висушухлорид або ацетиланпдрид Згадану реакцію здійють над безводним сульфатом натрію та випарюснюють за відсутності розчинника або у ють Одержане неочищене масло очищають придатному розчиннику, такому як, наприклад, засобами гель-хроматографм на колонках під тисдиметилформамід або піридин Найпридатніші ком (з елююванням сумішшю AcOEt петролейного температури змінюються у межах від 0°С до темефіру 1 9) з одержанням (Е)-1,1,1-трифтор-4-(4ператури перегонки, тривалість реакції може стаметилфеніл)-3-бутен-2-ону (0,8г, вихід 75%) у фоновити від 15хв до 14год рмі прозорого масла Цей винахід надає фармацевтичні композиції, Інфрачервоний (ІЧ) (плівка, см 1) 1715, 1601, до складу яких, разом із фармацевтичне прийнят1201, 1183, 1145, 1056, 811,703 ним наповнювачем, входить як мінімум одна спо1 Н-ЯМР (CDCI3) 5 2,4 (s, ЗН), 6,97 (d, J=18I~4, лука загальної формули (І) або и фізіологічно при1Н), 7,25 (d, J=9I~4, 2H), 7,54 (d, 3=9Гц, 2Н), 7,95 (d, йнятна сіль Цей винахід має також відношення до J=18I~4, 1H) застосування сполуки загальної формули (І) або и фізіологічне прийнятних солей для виготовлення Тонкошарова хроматографія (ТШХ) (Петролікарського засобу для лікування запалення та/або лейний ефір) Rf=0,16 лікування інших захворювань, пов'язаних із запаОдержання 1 -(4-амшосульфонілфеніл)-4,5ленням У прикладах, які наведено далі, предстадипдро-5-(4-метилфеніл)-3-трифторметил-1Нвлено одержання нових сполук за цим винаходом піразолу (Метод А) Розкрито також деякі типові форми використання Розчин 4-(амшосульфоніл) фенілпдразинхлордля різних галузей застосування, а також фармапдрату (0,82г, 3,69ммоль) та (Е)-1,1,1-трифтор-4цевтичні прописи, придатні для згаданих сполук, (4-метилфеніл)-3-бутен-2-ону (0,79г, 3,69ммоль) у які представляють собою мету цього винаходу 15мл оцтової кислоти нагрівають у колбі зі зворотПриклади, які наведено далі, представлено з ілюсним холодильником при температурі перегонки тративною метою і вони ні у якому разі не повинні впродовж Згод у атмосфері азоту Згаданий розобмежувати обсяг цього винаходу чин охолоджують, виливають до води та екстрагують за допомогою AcOEt Одержаний органічний Приклад 1 (позиція 1 наведених Таблиць) 1розчин промивають водою, висушують над безво(4-амшосульфонілфеніл)-4,5-дипдро5(4дним сульфатом натрію та випарюють до сухості метилфеніл) -З-трифторметил-1 Н-піразол 18 17 61137 під вакуумом Неочищений продукт, який було дипдро-5-феніл-5-метил-3-трифторметил-ІНодержано таким чином, кристалізують з суміші піразолу (Метод А) ЕЮН-петролейного ефіру з одержанням 1-(4До колби з інертною атмосферою додають (Е)амшосульфонілфеніл)-4,5-дипдро-5-(41,1,1-трифтор-4-метил-4-(4-метилфеніл)-3-бутенметилфеніл)-3-трифторметил-1Н-піразолу (0,65г, 2-он (1,75г, 8,2ммоль), 4-(амшосульфоніл) фенілвихід 45%) Температура плавлення (т р )=140пдразину хлорпдрат (2г, 9ммоль) та піперидин 3°С (0,85г, Юммоль), які було розчинено у ЮОмл етанолу, та нагрівають при температурі перегонки ІЧ (КВг, см 1 ) 3356, 3268, 1594, 1326, 1170, впродовж 5,5год Одержану суміш охолоджують, 1139, 1120, 1097 1 згаданий розчинник видаляють за допомогою роН-ЯМР (CDCI3) 5 2,34 (s, ЗН), 2,99-3,06 (dd, торного випарювача, до одержаного залишку доJ=9rq та 14Гц, 1Н), 3,66-3,73 (dd, J=12,6I~4 та дають воду і одержаний розчин екстрагують за 14Гц, 1Н), 4,69 (широкий s, 2H), 5,38-5,45 (dd, допомогою AcOEt Одержану органічну фазу прои=6,9Гц та 12,6Гц, 1Н), 7,04-7,11 (2d, J=8,1I~4 та мивають водою, сушать над безводним сульфа9,3Гц, 4Н), 7,17 (d, J=8,1I~4, 2H), 7,70 (d, и=9,ЗГц, том натрію та випарюють до сухості Одержаний 2Н) 13 неочищений продукт очищають засобами гельС-ЯМР (CDCI3) 20,9, 41,2, 64,5, 113,4, 120,5 хроматографм на колонках під тиском з елююван(q, и=268Гц), 125,3, 127,6, 130,1, 133,2, 136,7, ням сумішшю AcOEt-петролейного ефіру (4 6) з 138,3, 138,8 (q, J=38I~4), 146,0 одержанням 1-(4-амшосульфонілфеніл)-4,5ТШХ (AcOEt) Rf=0,89 дипдро-5-феніл-5-метил-3-трифторметил-1НПриклад 2 (позиція 2 у наведених Таблицях) піразолу у формі твердої речовини білого кольору 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-феніл-5(1,46г, вихід 47%) з температурою плавлення = метил-З-трифторметил-1 Н-піразол 60-6°С Н3С Одержання (Е)-1,1,1 -трифтор-4-метил-4феніл-З-бутен-2-ону (Метод Е-2) До розчину диметилсульфіду-трифториду бору (3,9г, ЗОммоль) у 75мл дихлорметану, який було охолоджено до температури -60°С, повільно додають трифтороцтовий ангідрид (6,3г, ЗОммоль) Одержану суміш збовтують впродовж 10 хв і повільно додають розчин а-метилстиролу (3,54г, ЗОммоль) у 15мл дихлорметану з утримуванням температури на рівні 60°С Після ЦЬОГО температуру суміші підвищують до рівня -50°С, витримують на цьому рівні впродовж 15хв, після чого температуру суміші підвищують до рівня 0°С та за згаданих умов суміш збовтують впродовж ЗОхв Додають 50мл етилового ефіру та 50мл 10% водного розчину бікарбонату натрію Одержані фази відокремлюють та одержану водну фазу промивають додатковою КІЛЬКІСТЮ ефіру Змішані ефірні фази промивають водою, висушують над безводним сульфатом натрію та випарюють до сухості на роторному випарювачі Одержаний таким чином неочищений продукт очищають засобами гель-хроматографм на колонках під тиском з елююванням петролейним ефіром 2,0г (51%) вихідного а-метилстиролу, який не вступив до реакції, та 2,35г (Е)-1,1,1-трифтор-4феніл-З-бутен-2-ону (вихід 75%) було виділено у формі безбарвного масла 1 ІЧ (плівка, см ) 1709, 1596, 1204, 1142, 1142, 1072 1 Н-ЯМР (CDCI3) 5 2,71 (s, ЗН), 6,8 (s, 1H), 7,45 (m, ЗН), 7,6 (m, 2H) Одержання 1-(4-амшосульфонілфеніл)-4,5 ІЧ (КВг, см 1 ) 3384, 3266, 1593, 1498, 1327, 1151, 1099, 703 1 Н-ЯМР (CDCI3) 5 1,6 (s, ЗН), 2,8 (m, 1H), 3,1 (m, 1Н), 4,5 (широкий s, 2Н), 7,2 (т, ЗН), 7,4-7,55 (т, 4Н), 7,7 (d, 2H) 13 С-ЯМР (CDCI3) 27,6, 54,2, 63,1, 114,6, 124,0 (q, J=268I~4), 125,6, 127,4, 127,8, 129,1, 131,0, 142,0 (q, J=38I~4), 142,6, 147,5 Приклад 3 (позиція 3 у наведених Таблицях) 1-(4-амшосульфонілфеніл)-5-(2,4-дифторфеніл)4,5-дипдро-3-трифторметил-1 Н-піразол OaNH2 Одержання (Е)-1,1,1-трифтор-4-(2,4дифторфеніл)-3-бутен-2-ону (Метод Е-3) У колбі 2,4-дифторбензальдепд (20г, 0,14моль), льодяну оцтову кислоту (12,2г, 0,2моль) та піперидин (12,2г, 0,14моль) розчиняють у тетрапдрофурані (ЗООмл) Одержаний розчин охолоджують до температури 5-10°С та барботують CF3COCH3 (8г, 0,07моль) Згаданий розчин видаляють з охолоджувальної бані, температуру підвищують до рівня кімнатної і одержану суміш витримують при згаданій температурі впродовж 1,5 год із постійним збовтуванням Знову додають CF3COCH3 (5г, 0,045моль) і одержану суміш збовтують впродовж 1,5год Цей етап повторюють до додавання в загальній КІЛЬКОСТІ 35Г (0,31 МОЛЬ) CF3COCH3 Додають 20% розчин (50мл) і згаданий розчинник видаляють під зниженим тиском Додають 50мл води і одержаний розчин екстрагують за допомогою AcOEt Одержану органічну фазу промивають водою, 5% H2SO4, водою і одержану суміш висушують над безводним сульфатом натрію 20 19 61137 Одержаний розчин фільтрують та випарюють (Метод А) Одержаний неочищений продую" дистилюють з одержанням 18,1г (Е)-1,1,1-трифтор-4-(2,4дифторфеніл)-3-бутен-2-ону з температурою плавлення 50-1 °С 1 ІЧ (КВг, см ) 1717, 1602, 1583, 1277, 1146, 1059, 706 1 Н-ЯМР (CDCI3) 5 6,9 (m, 2Н), 7,05 (d, и=16Гц, 1Н), 7,6 ( т , 1Н), 8,0 (d, и=16Гц, 1Н) Одержання 1-(4-амшосульфонілфеніл)-5-(2,4дифторфеніл)-4,5-дипдро-3-трифторметил-1Нпіразолу (Метод А) Розчин 4-(амшосульфоніл)феніл гід разину У колбі з інертною атмосферою у 50мл етанохлорпдрату (47,8г, 0,21 моль) та (Е)-1,1,1-трифторлу розчиняють (Е)-1,1,1-трифтор-4-(44-(2,4-дифторфеніл)-3-бутен-2-ону (53,1г 95%, метилсульфонілфеніл)-3-бутен-2-он (який було 0,21 моль) у 315мл оцтової кислоти нагрівають у одержано за методом Е-1) (1,83г, 6,58ммоль) та 4колбі зі зворотним холодильником при температурі метилфенілпдразину хлорпдрат (1,04г, 6,58моль) перегонки впродовж 24год у атмосфері азоту Додають декілька крапель хлористоводневої кисОдержану суміш охолоджують, виливають до води лоти і одержану суміш нагрівають у колбі зі зворота фільтрують Одержану суміш промивають толутним холодильником при температурі перегонки олом та одержаний таким чином неочищений провпродовж 4 днів Одержану суміш охолоджують, дукт кристалізують з ізопропанолу Одержують одержаний продукт кристалізують Згаданий роз46,2г Із концентрованого кристалізаційного маточин фільтрують, одержаний продукт рекристалізучного розчину додатково одержують 12,6г продукють з етанолу Одержують 4,5-дипдро-1-(4ту В загальній КІЛЬКОСТІ одержують 58,8г (68%) 1метилфеніл)-5-(4-метилсульфонілфеніл)-3(4-амшосульфонілфеніл)-5-(2,4-дифторфеніл)-4,5трифторметил-1Н-піразол (0,8г, вихід 32%) у фодипдро-3-трифторметил-1Н-піразолу з температурмі твердої речовини з температурою плавлення рою плавлення 160-2°С 140-3°С Можна вдаватись також до наведеної далі ІЧ (КВг, см 1 ) 1516, 1310, 1148, 1131, 1060, процедури 774 У колбі з інертною атмосферою у 45мл етано1 Н-ЯМР (CDCI3) 5 2,2 (s, ЗН), 2,9 (dd, и=7,8Гц лу розчиняють етоксид натрію (0,53г, 7,72ммоль) та 17,1 Гц, 1Н), 3,05 (s, ЗН), 3,7 (dd, и=12,9Гц та Додають 1,1,1-трифтор-4-(2,4-дифторфеніл)-317,1 Гц, 1Н), 5,45 (dd, и=7,8Гцта 12,9Гц, 1Н), 6,8 (d, бутен-2-он (який було одержано за методом Е-1) и=8,4Гц, 2Н), 7 (d, и=8,4Гц, 2Н), 7,45 (d, и=8,4Гц, (0,913г, 3,86 ммоль) та 42Н), 7,9 (d, и=8,4Гц, 2Н) (амшосульфоніл)фенілпдразину хлорпдрат (0,87г, Приклад 5 (позиція 39 у наведених Таблицях) 3,87моль) і одержану суміш нагрівають у колбі зі Метил 4,5-дипдро-5-(4-метилфеніл)-1-(4зворотним холодильником при температурі переметилсульфонілфеніл)-1Н-піразол-3-карбоксилат гонки впродовж 16год Згадану суміш охолоджу(Метод В) ють, випарюють до сухості, додають холодну воду і одержану суміш підкислюють шляхом додавання оцтової кислоти Тверду речовину, яка випала до осаду, відфільтровують Одержану тверду речовину знову розчиняють у ефірі, обробляють активним С, фільтрують, згаданий розчинник видаляють за допомогою роторного випарювача Одержаний залишок кристалізують із суміші етилового ефірупетролейного ефіру (50 50) з одержанням 1-(4амшосульфонілфеніл)-5-(2,4-дифторфеніл)-4,5дипдро-3-трифторметил-1Н-піразолу (1,02г, вихід 65%) у формі твердої речовини з температурою плавлення 160-2°С 4,5-дипдро-5-(4-метилфеніл)-1-(4ІЧ (КВг, см 1 ) 3315, 3232, 1617, 1593, 1506, метилсульфонілфеніл)-1Н-піразол-3-карбонову 1326, 1179, 1099, 1067 кислоту (6,9г, 19,3ммоль) та тюнілхлорид (3,5мл, 1 Н-ЯМР(СОСІ3) 5 3,0 (dd, J=6,3Ta 11,4ГЦ, 1Н), 48ммоль) розчиняють у 50мл тетрапдрофурану і 3,80 (dd, І=11,4Гцта 12,6Гц, 1Н), 4,79 (широкий s, одержану суміш збовтують при кімнатній темпера2Н), 5,70 (dd, J=6,3 Гц та 12,6Гц, 1Н), 6,8-6,95 (т, турі впродовж 16год Одержану суміш випарюють 2Н), 7,01-7,09 ( т , ЗН), 7,74 (d, и=8,7Гц, 2Н) до сухості на роторному випарювачі, одержаний Приклад 4 (позиція 4 наведених Таблиць) 4,5таким чином неочищений хлорангідрид розчинядипдро-1-(4-метилфеніл)-5-(4ють у 150мл метанолу у колбі з інертною атмосметилсульфонілфеніл)-3-трифторметил-1Нферою, додають 8мл (58ммоль) триетиламшу і піразол одержану суміш збовтують при кімнатній температурі впродовж 2год Додають воду, одержану тверду речовину відфільтровують та промивають великою КІЛЬКІСТЮ води та метанолу Таким чином одержують необхідний метиловий ефір (5,8г, ви 21 61137 хід 82%) у формі твердої речовини кремового кольору з температурою плавлення 155-160°С ІЧ (КВг, см 1 ) 1741, 1561, 1260, 1226, 1135, 1089 ІН-ЯМР(СОСІз) 6 2,3(5, ЗН), 3 (s, 3H), 3,1 (dd, J=6l~4Ta 18,3Гц, 1Н), 3,75 (dd, и=12,6Гцта 18,3Гц, 1Н), 5,4 (dd, и=6Гцта 12,6Гц, 1Н), 7-7,25 (m, 6H), 7,7 (d, и=8,7Гц, 2Н) Приклад 6 (позиція 41 у наведених Таблицях) Одержання 1-(4-амшосульфонілфеніл)-4,5дипдро-5-(4-метилфеніл)-1Н-піразол-3карбоксаміду (Метод С) CONH, 1-(4-амшосульфонілфеніл)-4,5-дипдро-5-(4метилфеніл)-1Н-піразол-3-карбонову кислоту (3,7г, Ю.Зммоль) та тюнілхлорид (Зг, 25,8ммоль) розчиняють у 70мл тетрапдрофурану та збовтують при кімнатній температурі впродовж 16год Одержану суміш випарюють до сухості на роторному випарювачі, одержаний таким чином неочищений хлорангідрид розчиняють у ЗОмл метанолу у колбі з інертною атмосферою та охолоджують до температури 0°С Додають 9мл концентрованого розчину гідроксиду амонію, який було розчинено у 20мл тетрапдрофурану Одержану суміш збовтують при кімнатній температурі впродовж 16 год і згаданий розчинник видаляють за допомогою роторного випарювача До одержаного залишку додають воду, одержану суміш екстрагують за допомогою етилацетату, який промивають водою, сушать над безводним сульфатом натрію та випарюють до сухості Одержаний таким чином неочищений залишок кристалізують із суміші етилацетатупетролейного ефіру з одержанням 2,6г (вихід 72%) необхідної сполуки з температурою плавлення 210-5°С ІЧ (КВг, см 1 ) 3450, 3337, 1656, 1596, 1345, 1141 1 Н-ЯМР (d4-CH3OH) 5 2,4 (s, ЗН), 3,05 (dd, и=6Гцта 17,7Гц, 1Н), 3,8 (dd, и=12,9Гцта 17,7Гц, 1Н), 5,6 (dd, J=6 Гцта 12,9 Гц, 1Н), 7,2-7,3 (m, 6H), 7,75 (d, J=8,7 Гц, 2Н) Приклад 7 (позиція 43 у наведених Таблицях) Одержання 3-ціано-4,5-дипдро-5-(4-метилфеніл) 1 - (4-метилсульфонілфеніл) -1Н-піразолу 22 (Метод D) До колби з інертною атмосферою вносять 6,3мл безводного диметилформаміду, згадану колбу охолоджують до температури 0°С і повільно додають 2,1мл тюнілхлориду Вміст згаданої колби збовтують впродовж 2 год за згаданих умов Додають розчин 4,5-дипдро-5-(4-метилфеніл)-1-(4метилсульфонілфеніл)-1Н-піразол-3-карбоксаміду (3,8г, 10,6ммоль) у ЗОмл диметилформаміду, одержану суміш збовтують впродовж 5год при температурі 0°С та, у подальшому, впродовж 16год при кімнатній температурі Вміст згаданої колби виливають на лід, одержаний твердий осад відфільтровують Одержують 3,35г (вихід 93%) неочищеного продукту, який кристалізують з етилацетату з одержанням твердої речовини жовтого кольору з температурою плавлення 162-4°С ІЧ (КВг, см 1 ) 2220, 1593, 1500, 1389, 1296, 1143 1 Н-ЯМР (CDCI3) 5 2,3 (s, ЗН), 3-3,1 (s+dd, 4H), 3,75 (dd, и=12,6Гцта 18Гц, 1Н), 5,5 (dd, и=6,ЗГцта 12,6Гц, 1Н), 7-7,2 (ш, 6Н), 7,7 (d, и=8,7Гц, 2Н) Приклад 8 (позиція 64 у наведених Таблицях) 1-(4ацетиламшосульфонілфеніл)-5-(2,4дифторфеніл)-4,5-дипдро-3-трифторметил-1Нпіразол (Метод F) SO2NHCOCH3 0,58г (1,43ммоль) 1-(4-амшосульфонілфеніл)5-(2,4-дифторфеніл)-4,5-дипдро-3-трифторметил1Н-піразолу та 2мл ацетилхлориду нагрівають у колбі зі зворотним холодильником при температурі перегонки впродовж 2год Одержану суміш охолоджують, випарюють до сухості під зниженим тиском, одержаний залишок розчиняють у AcOEt, промивають водою, висушують над Na2SO4 та випарюють до сухості Одержують 0,49г (76%) 1-(4ацетиламшосульфонілфеніл)-5-(2,4дифторфеніл)-4,5-дипдро-3-трифторметил-1Нпіразолу у формі твердої речовини білого кольору з температурою плавлення 172-4°С ІЧ (КВг, см 1 ) 3302, 1723, 1593, 1506, 1337, 1165 1Н-ЯМР (CDCI3) 5 2,0 (s, ЗН), 3,0 (dd, и=6,6Гц 24 23 61137 та 18,0Гц, 1Н), 3,8 (dd, и=12,9Гцта 18,0Гц, 1Н), 5,7 25х2см (Daicel), мобільна фаза=0,1% розчин діе(dd, и=6,6Гцта 12,9Гц, 1Н), 6,9 (m, 2H), 7,05 (m+d, тиламіну у метанолі, швидкість потоку 8мл/хв У ЗН), 7,85 (d, и=8,7Гц, 2Н), 8,1 (s, 1H) разі часу утримання 7,4хв одержують (+)-1 -(4амшосульфонілфеніл)-5-(2,4-дифторфеніл)-4,5Приклади Эта 10 (позиції 75та 76 v наведених дипдро-3-трифторметил-1Н-піразол у вигляді твеТаблицях) (+)-1-(4-амшосульфонілфеніл)-5-(2,4рдої речовини білого кольору з температурою дифторфеніл)-4,5-дипдро-3-трифторметил-1Нплавлення 173-4°С, енантюмерна чистота 99,9%, піразол та (-)- 1-(4-амшосульфонілфеніл)-5-(2,4[a]D=+183,9 (с=1 СНзОН) У разі часу утримання дифторфеніл)-4,5-дипдро-3-трифторметил-1 Н9,2хв одержують (-)-1-(4-амшосульфонілфеніл)-5піразол (2,4-дифторфеніл)-4,5-дипдро-3-трифторметил1Н-піразол у вигляді твердої речовини білого кольору з температурою плавлення 173-4°С, енантіомерна чистота >99,9%, [a]D=-189,4 (c=1 СН3ОН) SO,NH, Рацемічну суміш (±) -1 - (4-амшосул ьфонілфеніл) - 5 - (2,4-дифторфеніл) -4,5-дипдро-Зтрифторметил-1Н-піразолу розділяють на складові енантюмери засобами високоефективної рідинної хроматографії за допомогою колонки CHIRALPAK AS із частинками розміром Юмкм та габаритами За допомогою цих же самих процедур було одержано приклади, які відповідають позиціям 77 та 78 у наведених таблицях У Таблиці 1 наведено деякі приклади, які охоплюються загальною формулою (І), та у Таблиці 2 наведено дані для ідентифікування згаданих сполук Приклади 1-36, Приклади 44-63 та Приклади 65-74 було одержано за методом А, приклади 3739 за методом В, приклади 40-42 за методом С, приклад 64 за методом F та енантюмерно чисті сполуки 75-78 було одержано методом поділу згаданої рацемічної суміші Таблиця 1 Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 Ri CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 R2 H СНз H H H H H H H H H H H H H H H H H H H H H H R3 H H F H H H H H H H H Cl Cl СНз H F F H H H H H F СНз R4 H H H H H H H H H H F H H H СНз H H F F H Cl H F H Rs СНз H F SO2CH3 H H СНз F F SO2CH3 F Cl Cl H H H H H H OCH3 F OCF3 H СНз R6 SO2NH2 SO2NH2 SO2NH2 СНз SO2NH2 SO2CH3 SO2CH3 SO2NH2 SO2CH3 F SO2NH2 SO2CH3 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2CH3 SO2NH2 SO2CH3 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 RT H H H H H H H H H H H H H H H H H H H H H H H H Rs H H H H H H H H H H H H H H H H H H H H H H H H 25 61137 26 Продовження табл 1 25 26 27 28 29 ЗО 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 CF3 СНз СНз СНз СНз СНз Н Н СНз СО2Н СО2Н СО2Н СО2СН3 СО2СН3 СО2СН3 CONH2 CONH2 CONH2 CN CF3 CF3 CF3 CF3 CF3 CF3 CHF2 CF3 CF3 CF3 CF3 CF3 CF3 CHF2 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H F ОСНз ОСНз СНз F СІ F CF3 СНз СНз F CF3 H Cl F СНз F F H H H H H H H H H H F H H H H H H H H H H H H H H H H H H СНз СНз F H H H H F H H H H H H H H H H H H H H H H H H H H H H F F F СНз СНз CF3 H H CF3 СНз H СНз СНз H СНз Н СНз СНз СНз СНз ОСНз ОСНз ОСНз ОСНз F СНз F F CF3 CF3 Н ОСНз F F SO2CH3 Н СІ F СНз F SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2CH3 SO2NH2 SO2CH3 SO2NH2 SO2CH3 SO2NH2 SO2NH2 SO2CH3 SO2CH3 SO2NH2 SO2CH3 SO2NH2 SO2NH2 SO2NH2 SO2CH3 SO2NH2 SO2NH2 SO2CH3 SO2CH3 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NH2 F SO2NH2 SO2NH2 SO2NH2 SO2NH2 SO2NHAc СІ Н н СІ н н СНз н н СІ н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н F СНз н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н н F н н н н н н н F СНз н н СНз СІ СНз СІ 27 28 61137 R3R2 R5 Приклад R1 75 76 77 78 79 R2 R3 R4 R5 R6 R7 R8 CF3 CF3 CF3 CF3 CF3 Енантюмерна чистота (%) Постійна оптичного обертання [а]о Таблиця 2 При- Темпе- Інфрачервоний клад ратура 1 Н-ЯМР (СГХЛз) 1 (КВг) (см- ) (% МЛН"1) розтоплення (°С) 1 140-3 3356,3268,1594, 2,34 (ss ЗН); 3 (dd, J=6,9, 14 Гц, Ш); 3,7 (dd, 1326, 1170, 1139, J-12,6, 14 Гц, Ш); 4,7 (широкий s, 2Н); 5,4 (dd, 1120, 1097 J=6,9, 12,6 Гц, Ш); 7,1 (2d, J-8,1, 9,3 Гц, 4Н); 7,2 (d, J=8,l Гц, 2H); 7,7 (d, 1=9,3 Гц, 2Н) 2 60-6 3384, 3266, 1593, 1,6 (s,3H); 2,8 (m, IH); 3,1 (m, IH); 4,5 1498, 1327, 1151, (широкий s, 2H); 7,2 (m, 3H); 7,4-7,55 (m, 4H); 1099, 703 3 160-2 7,7 (d, 2H) 3315, 3232, 1617, 3 (dd, J=6,3, 11,4 Гц, Щ), 3,8 (dd, J=U,4, 1593, 1506, 1326, 12,6 Гц, Ш); 4,8 (широкий s, 2H); 5,7 (dd, 1179, 1099, 1067 J=6,3, 12,6 Гц, IH); 6,8-6,95 (m, 2H); 77,l(m,3H); 7,7 (d, J-8,7 Гц, 2Н) 4 140-3 1516, 1310, 1148, 2,2 (s, 3H); 2,9 (dd, J=7,8, 17,1 Гц, IH); 3 (s, 1131, 1060,774 3H); 3,7 (dd, JH2,9, 17,1 Гц, Ш); 5,45 (dd, J=7,8, 12,9 Гц, Ш); 6,8 (d, J=8,4 Гц, 2Н); 7 (d, J=8,4 Гц, 2Н); 7,45 (d, J=8,4 Гц, 2Н); 7,9 (d, J=8,4 Гц, 2Н) 29 61137 ЗО 3,04 (dd, J=6,6, 18 Гц, IH); 3,7 (dd, J=12,9, 18 Гц, IH); 4,8 (s, 2H); 5,45 (dd, 5=6,6, 12,9 Гц, 1101 156-7 3350, 3269, 1596, 1315, 1188, 1142, 5 IH); 7,0 (d, J-9 Гц, 2Н); 7,2 (d, J-6,6 Гц, 2Н); 7,3 (m, 3H); 7,7 (d, J-9 Гц, 2Н) 137-40 1595, 1333, 1297, 3,0 (s, 3H); 3,06 (dd, J=6,6, 18 Гц, IH); 3,75 (dds 1282, 1148,771 6 1=12,8, 18,1 H); 5,45 (dd, J=6,6, 12,6 Гц, 1Н); 7,05 (d, J=9 Гц, 2Н); 7,2 (d, J=7,8 Гц, 2Н); 7,4 (m, 3H); 7,7 (d, J=9 Гц, 2Ш 115-19 1592, 1332, 1148, 2,3 (s, 3H); 3,0 (S, 3H); 3,05 (dd, J=6,6, 19 Гц, 1133,825,775 7 Ш); 3,7 (dd, J-12,6, 19 Гц,Ш); 5,4 (dd, J=6,6, 12,6 Гц, 1Н); 7,1 (2d, J=8,l, 8,7 Гц, 4Н); 7,2 (d, J-8,I Гц, 2Н); 7,7 (d, J=8,7 Гц, 2Н) 121-22 IH); 4,8 (s,2H); 5,4 (dd, J=6,6, 12,6 Гц, 1Н); 7,1 (m, 4H); 7,2 (m, 2H); 7,7 (d, J=9 Гц, 2Н) 1592, 1509, 1148, 3,0 (s,3H); 3,05 (dd, J=6,6, 17,4 Гц, 1Н); 3,7 (dd, 1120, 774 9 3,0 (dd, J=6,6, 18 Гц, Ш); 3,7 (dd, J=12,6, 18 Гц, 740 154-6 3337, 3254, 1594, 1510, 1324, 1158, 8 J=12,6, 17,4 Гц, Ш); 5,4 (dd, J=6,6 та 12,6 Гц, 1H); 7,0
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazoline derivatives, a process for preparing thereof (variants), a pharmaceutical composition and an active ingredient
Назва патенту російськоюПроизводные пиразолина, способ их получения (варианты), фармацевтическая композиция и активный ингредиент
Автори російськоюFRIGOLA CONSTANSA JORDI
МПК / Мітки
МПК: C07D 231/06, A61K 31/415, A61P 29/00, A61P 43/00
Мітки: активний, одержання, спосіб, композиція, інгредієнт, варіанти, фармацевтична, похідні, піразоліну
Код посилання
<a href="https://ua.patents.su/25-61137-pokhidni-pirazolinu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-ta-aktivnijj-ingrediehnt.html" target="_blank" rel="follow" title="База патентів України">Похідні піразоліну, спосіб їх одержання (варіанти), фармацевтична композиція та активний інгредієнт</a>
Попередній патент: Спосіб дегазації гірських масивів і установка для його виконання
Наступний патент: Гетероциклічні похідні, які інгібують фактор ха та фармацевтична композиція на їх основі
Випадковий патент: Пристрій для кріплення циліндричного вантажу на транспортному засобі