Ліпідзнижуючі біфенілкарбоксаміди, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі та спосіб її одержання
Формула / Реферат
1. Сполука формули (I)
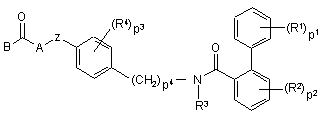 , (I)
, (I)
її N-оксиди, фармацевтично прийнятні кислотно-адитивні солі та стереохімічно ізомерні форми, де
p1, p2 та p3 кожне незалежно є цілими числами від 1 до 3;
p4 є цілим числом 0 або 1;
кожний R1 є незалежно вибраним з водню, C1- 4-алкілу, C1- 4-алкілоксигрупи, галогену, гідроксигрупи, меркаптогрупи, ціаногрупи, нітрогрупи, C1- 4алкілтіогрупи або полігалоCl- 6-алкілу, аміногрупи, C1- 4-алкіламіногрупи та ді(C1- 4-алкіл)аміногрупи;
кожний R2 є незалежно вибраним з водню, C1- 4алкілу, C1- 4алкілоксигрупи, галогену або трифторметилу;
R3 є воднем або C1- 4-алкілом;
кожний R4 є незалежно вибраним з C1- 4-алкілу, C1- 4-алкілоксигрупи, галогену або трифторметилу;
Z є бівалентним радикалом формули
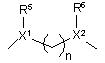
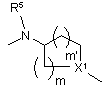

(a-1)
(a-2)
(a-3)
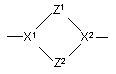
(a-4)
(a-5) ,
де
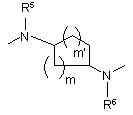
n є цілим числом від 2 до 4;
m та m’ є цілими числами від 1 до 3;
R5 та R6 є кожний незалежно вибраним з водню, C1- 6алкілу або арилу;
X1 та X2 є кожний незалежно вибраним з CH, N або sp2 гібридизованого атома вуглецю та
у радикалі (a-1) принаймні один з X1 або X2 є N;
Z1 вибрано з CH2, CH2CH2, CH2CH2CH2, CH2CH2О та OCH2CH2;
Z2 є CH2 або CH2CH2 ;
A є зв’язком, C1-6-алкандіїлом, необов’язково заміщеним однією або двома групами вибраними з арилу, гетероарилу та C3-6циклоалкілу;
за умови, що коли бівалентний радикал Z має формулу (a-5), тоді A є C1-6алкандіїлом заміщеним однією або двома групами вибраними з арилу, гетероарилу та C3-6-циклоалкілу;
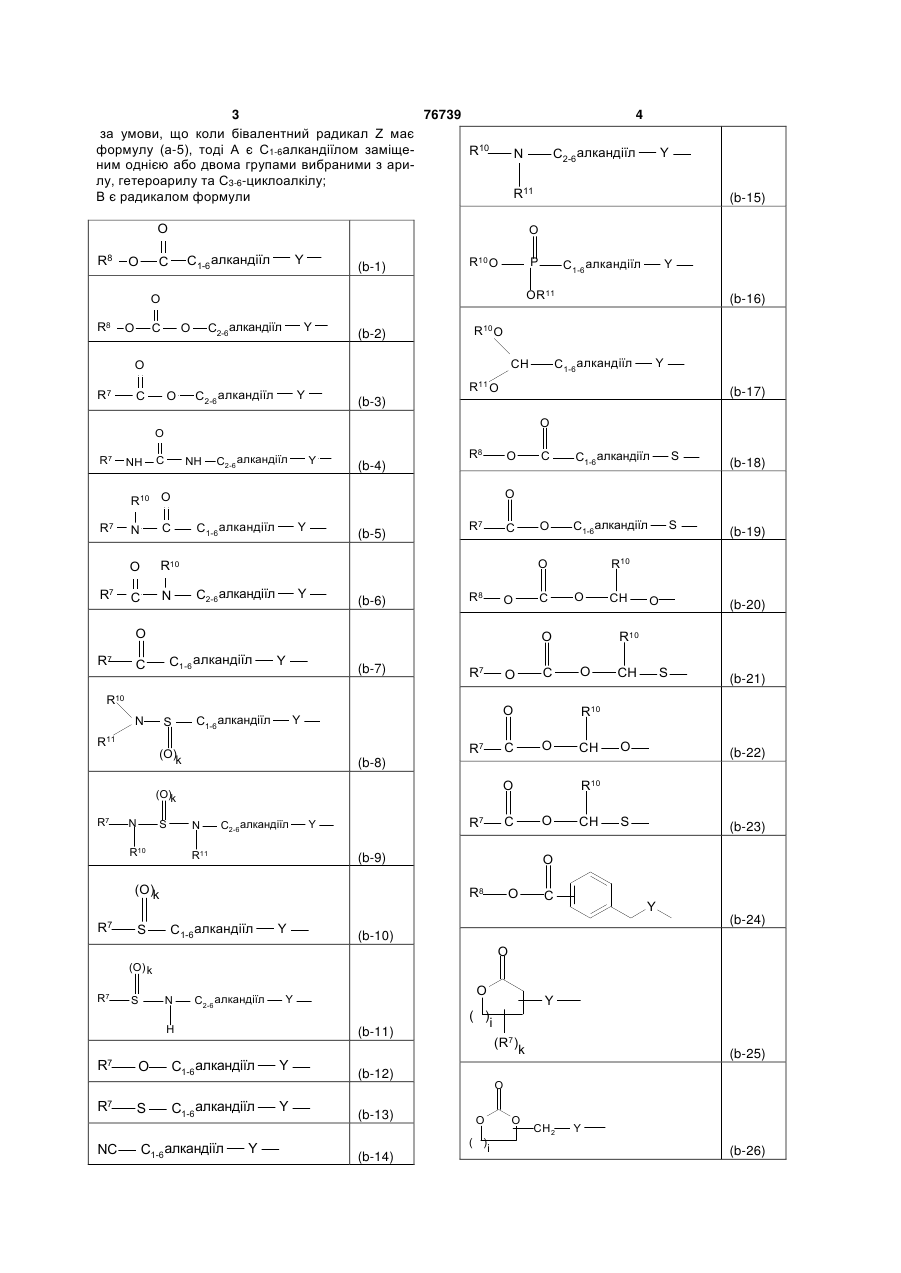
B є радикалом формули
![]()
(b-1)
![]()
(b-2)
![]()
(b-3)
![]()
(b-4)
![]()
(b-5)
![]()
(b-6)
![]()
(b-7)
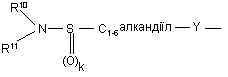
(b-8)
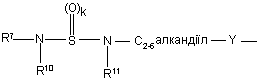
(b-9)
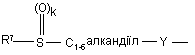
(b-10)
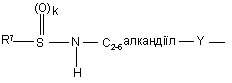
(b-11)
![]()
(b-12)
![]()
(b-13)
![]()
(b-14)
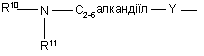
(b-15)
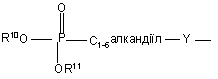
(b-16)
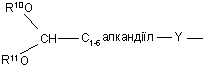
(b-17)
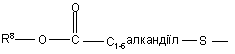
(b-18)
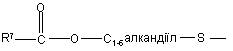
(b-19)
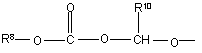
(b-20)
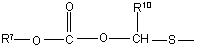
(b-21)
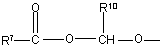
(b-22)
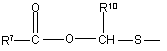
(b-23)
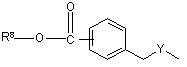
(b-24)
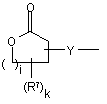
(b-25)
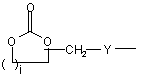
(b-26)
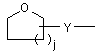
(b-27)
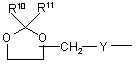
(b-28)
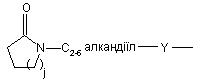
(b-29)
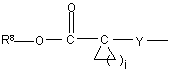
(b-30)
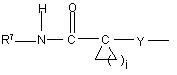
(b-31)
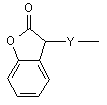
(b-32)
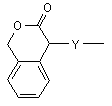
(b-33)
![]()
(b-34)
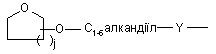
(b-35)
![]()
(b-36)
![]()
(b-36)
де
i є цілим числом від 1 до 4;
j є цілим числом від 1 до 4;
k є цілим числом від 1 або 2;
Y є О або NR9, де R9 є воднем, C1- 6алкілом або C1- 4алкіламінокарбонілом;
R7 є воднем, C1-6-алкілом, C2-6-алкенілом, C2-6-алкінілом, фенілом або фенілом, заміщеним C1-4-алкілом, галогеном, гідроксигрупою або трифторметилом;
R8 є C1-6-алкілом, C2-6-алкенілом, C2-6-алкінілом, фенілом або фенілом, заміщеним C1- 4-алкілом, галогеном, гідроксигрупою або трифторметилом;
R10 та R11 кожний незалежно є воднем або C1-6-алкілом;
необов’язково R7 та R9 можуть бути узяті разом для утворення бівалентного радикала формули -(CH2)3 -, -(CH2)4 -, -(CH2)5 -, або -(CH2)6 -;
R12 є радикалом формули
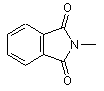 ,
,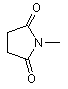 ,
, 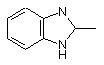 ,
, 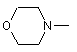 ;
;
та необов’язково у радикалі (b-1) C1-6-алкандіїлова складова може бути додатково заміщена фенілом, фенілC1-4-алкілом, гідроксифенілC1-4-алкілом, C1-4-алкілоксикарбонілом, C1-4-алкілоксіC1-4-алкілом, C1-4-алкілтіоC1- 4алкілом, фенілC1- 4-алкілтіоC1-4-алкілом, гідроксиC1-4-алкілом, тіоC1-4-алкілом, C3-6-циклоалкілом, C3-6циклоалкілC1-4-алкілом або радикалом формули
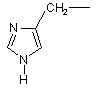 ,
, 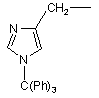 або
або 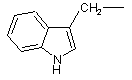 .
.
2. Сполука за п. 1, яка відрізняється тим, що R1 є воднем, трет-бутилом або трифторметилом, R2, R3 та R4 є воднем.
3. Cполука за п. 1 або 2, яка відрізняється тим, що бівалентний радикал A є метиленовою групою, заміщеною фенілом.
4. Сполука за будь-яким з пп. 1–3, яка відрізняється тим, що Z є бівалентним радикалом формули (a-5), де z1 та Z2 є CH2CH2, та X1 є N, та X2 є CH.
5. Сполука за будь-яким з пп. 1–3, яка відрізняється тим, що Z є бівалентним радикалом формули (a-5), де Z1 та Z2 є CH2CH2, та X1 є CH, та X2 є N.
6. Сполука за будь-яким з пп. 1–3, яка відрізняється тим, що Z є бівалентним радикалом формули (a-5), де Z1 та Z2 є CH2CH2, та X1, та X2 є N.
7. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та терапевтично активну кількість сполуки за будь-яким з пп. 1-6.
8. Спосіб одержання фармацевтичної композиції за п. 7, у якому терапевтично активну кількість сполуки за будь-яким з пп. 1-6 ретельно перемішують з фармацевтично прийнятним носієм.
9. Сполука за будь-яким з пп. 1-6 для застосування як лікарського засобу.
10. Спосіб одержання сполуки формули (I), у якому
a) проміжну сполуку формули (II), де B, A, Z, R4, p3 та p4 мають значення, визначені у п.1,
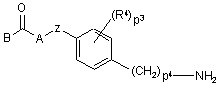 , (II)
, (II)
піддають реакції з біфенілкарбоновою кислотою або галогенідом формули (ІІІ),
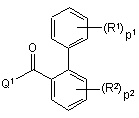 , (III)
, (III)
де R1, R2, p1 та p2 мають значення, визначені у формулі (I), та Q1 вибрано з гідроксигрупи та галогену, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності придатної основи,
b) або перетворюють сполуки формули (I) одна на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, сполуку формули (I) перетворюють у кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (I) перетворюють у форму вільної основи за допомогою лугу, та, якщо бажано, одержують їх стереохімічно ізомерні форми.
11. Спосіб одержання сполуки формули (I), у якому
a) проміжну сполуку формули (IV)
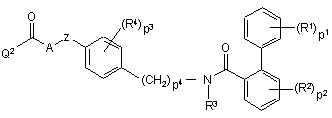 , (IV)
, (IV)
де R1, R2, R3, R4, A, Z, p1, p2, p3 та p4 мають значення, визначені у п. 1, та Q2 вибрано з галогену та гідроксигрупи,
піддають реакції з проміжною сполукою (V) формули B-H, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності принаймні одного прийнятного сполучального реагенту та/або придатної основи,
b) або перетворюють сполуки формули (I) одна на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, сполуку формули (I) перетворюють у кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (I) перетворюють у форму вільної основи за допомогою лугу, та, якщо бажано, одержують їх стереохімічно ізомерні форми.
12. Спосіб одержання сполуки формули (I) у якому
a) проміжну сполуку формули (VI), де R1, R2, R3, R4, p1, p2, p3 та p4 мають значення, визначені у п. 1, та Q3 вибрано з галогену, B(OH)2, алкілборонатів та їх циклічних аналогів,
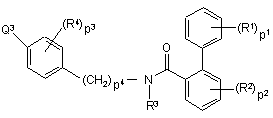 , (VI)
, (VI)
піддають реакції з реагентом формули (VII),
![]() , (VII)
, (VII)
де B, A та Z мають значення, визначені у п. 1, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду,
b) або перетворюють сполуки формули (I) одна на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, сполуку формули (I) перетворюють у кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (I) перетворюють у форму вільної основи за допомогою лугу, та, якщо бажано, одержують їх стереохімічно ізомерні форми.
Текст
1. Сполука формули (I) 3 76739 за умови, що коли бівалентний радикал Z має формулу (a-5), тоді A є C1-6алкандіїлом заміщеR10 ним однією або двома групами вибраними з арилу, гетероарилу та C3-6-циклоалкілу; B є радикалом формули 4 C1-6 алкандіїл Y (b-1) R10 O P C O C2-6 алкандіїл O Y (b-2) C O C2-6 алкандіїл NH (b-17) (b-3) O C NH C2-6 алкандіїл Y (b-4) R8 C N C N Y R7 C R10 C C1-6 алкандіїл (b-5) C2-6 алкандіїл Y (b-6) R8 C1-6 алкандіїл N Y (b-7) S C1-6 алкандіїл R7 O O CH O R11 O R10 O CH S R8 Y (b-21) CH O (b-22) CH S (b-23) O (b-9) C1-6 алкандіїл (b-20) R10 C R7 Y (O)k S O O C2-6 алкандіїл (b-19) R10 C R7 N R10 R7 (b-18) R10 (b-8) (O)k S C O Y (O)k N S C O R10 R7 C1-6 алкандіїл O C R11 S O O R7 C1-6 алкандіїл O O O O R7 Y R11 O Y R10 O R7 (b-16) C1-6 алкандіїл CH O R7 Y R10 O O R7 C1-6 алкандіїл OR11 O R8 (b-15) O C O Y R11 O R8 C2-6 алкандіїл N O C Y (b-24) (b-10) O (O) k R7 N S C2-6 алкандіїл ( ) H R7 O Y (b-11) O C1-6 алкандіїл Y R7 S C1-6 алкандіїл Y NC C1-6 алкандіїл Y Y i (R7) (b-12) (b-13) (b-25) O O ( ) (b-14) k O i CH2 Y (b-26) 5 76739 6 O O ( ) O Y j Y (b-27) R10 R11 O O CH2 O Y (b-28) O Y O C2-6 алкандіїл N ( ) j Y (b-33) (b-29) R12-C1-6алкандіїл -Y (b-34) O O R8 C O C Y ( )i H C C O O N N N , O C1-6алкандіїл O (b-36) C1-6алкандіїл Y (b-36) (b-31) (b-32) де i є цілим числом від 1 до 4; j є цілим числом від 1 до 4; k є цілим числом від 1 або 2; Y є О або NR9, де R9 є воднем, C1- 6алкілом або C1- 4алкіламінокарбонілом; R7 є воднем, C1-6-алкілом, C2-6-алкенілом, C2-6алкінілом, фенілом або фенілом, заміщеним C1-4алкілом, галогеном, гідроксигрупою або трифторметилом; R8 є C1-6-алкілом, C2-6-алкенілом, C2-6-алкінілом, фенілом або фенілом, заміщеним C1- 4-алкілом, галогеном, гідроксигрупою або трифторметилом; R10 та R11 кожний незалежно є воднем або C1-6алкілом; необов’язково R7 та R9 можуть бути узяті разом для утворення бівалентного радикала формули (CH2)3 -, -(CH2)4 -, -(CH2)5 -, або -(CH2)6 -; R12 є радикалом формули O (b-35) Y ( )i O Y R7---амінокислота---R8 R7 C1-6 алкандіїл (b-30) O N O ( )j O , N H , N ; та необов’язково у радикалі (b-1) C1-6алкандіїлова складова може бути додатково заміщена фенілом, фенілC1-4-алкілом, гідроксифенілC1-4-алкілом, C1-4-алкілоксикарбонілом, C1-4алкілоксіC1-4-алкілом, C1-4-алкілтіоC1-4алкілом, фенілC1гідроксіC1-44-алкілтіоC1-4-алкілом, алкілом, тіоC1-4-алкілом, C3-6-циклоалкілом, C36циклоалкілC1-4-алкілом або радикалом формули CH2 CH2 N N N N H C(Ph)3 , або CH2 N H . 2. Сполука за п. 1, яка відрізняється тим, що R1 є воднем, трет-бутилом або трифторметилом, R2, R3 та R4 є воднем. 3. Cполука за п. 1 або 2, яка відрізняється тим, що бівалентний радикал A є метиленовою групою, заміщеною фенілом. 4. Сполука за будь-яким з пп. 1–3, яка відрізняється тим, що Z є бівалентним радикалом формули (a-5), де Z1 та Z2 є CH2CH2, та X1 є N, та X2 є CH. 5. Сполука за будь-яким з пп. 1–3, яка відрізняється тим, що Z є бівалентним радикалом формули (a-5), де Z1 та Z2 є CH2CH2, та X1 є CH, та X2 є N. 6. Сполука за будь-яким з пп. 1–3, яка відрізняється тим, що Z є бівалентним радикалом формули (a-5), де Z1 та Z2 є CH2CH2, та X1, та X2 є N. 7. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та терапевтично активну кількість сполуки за будь-яким з пп. 1-6. 7 76739 8. Спосіб одержання фармацевтичної композиції за п. 7, у якому терапевтично активну кількість сполуки за будь-яким з пп. 1-6 ретельно перемішують з фармацевтично прийнятним носієм. 9. Сполука за будь-яким з пп. 1-6 для застосування як лікарського засобу. 10. Спосіб одержання сполуки формули (I), у якому a) проміжну сполуку формули (II), де B, A, Z, R4, p3 та p4 мають значення, визначені у п.1, O (R4) p3 z B A (II) (CH2) p4 NH2 , піддають реакції з біфенілкарбоновою кислотою або галогенідом формули (ІІІ), (R1) O p1 (III) Q1 (R2) Q2 A z Q3 (R4) p3 (R1) O p2 (R4) p3 (R1) O p1 (IV) (CH2) p4 p1 (VI) , де R1, R2, p1 та p2 мають значення, визначені у формулі (I), та Q1 вибрано з гідроксигрупи та галогену, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності придатної основи, b) або перетворюють сполуки формули (I) одна на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, сполуку формули (I) перетворюють у кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (I) перетворюють у форму вільної основи за допомогою лугу, та, якщо бажано, одержують їх стереохімічно ізомерні форми. 11. Спосіб одержання сполуки формули (I), у якому a) проміжну сполуку формули (IV) O 8 де R1, R2, R3, R4, A, Z, p1, p2, p3 та p4 мають значення, визначені у п. 1, та Q2 вибрано з галогену та гідроксигрупи, піддають реакції з проміжною сполукою (V) формули B-H, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності принаймні одного прийнятного сполучального реагенту та/або придатної основи, b) або перетворюють сполуки формули (I) одна на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, сполуку формули (I) перетворюють у кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (I) перетворюють у форму вільної основи за допомогою лугу, та, якщо бажано, одержують їх стереохімічно ізомерні форми. 12. Спосіб одержання сполуки формули (I) у якому a) проміжну сполуку формули (VI), де R1, R2, R3, R4, p1, p2, p3 та p4 мають значення, визначені у п. 1, та Q3 вибрано з галогену, B(OH)2, алкілборонатів та їх циклічних аналогів, N R3 (R2) (CH2) p4 N R3 (R2) p2 , піддають реакції з реагентом формули (VII), O Z H B A , (VII) де B, A та Z мають значення, визначені у п. 1, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду, b) або перетворюють сполуки формули (I) одна на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, сполуку формули (I) перетворюють у кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (I) перетворюють у форму вільної основи за допомогою лугу, та, якщо бажано, одержують їх стереохімічно ізомерні форми. p2 , Даний винахід стосується нових біфенілкарбоксамідів, які виявляють інгібуючу активність щодо аполіпопротеїну В та супутню ліпідзнижувальну активність. Винахід далі стосується способів одержання таких сполук, фармацевтичних композицій, що містять зазначені сполуки, а також використання зазначених сполук як лікарського засобу для лікування гіперліпідемії, ожиріння та діабету типу II. Ожиріння є причиною численних серйозних медичних проблем, таких як розвиток діабету та серцевих захворювань у дорослих. Крім того, скидання ваги стає нав'язливою ідеєю серед дедалі більшої частини населення. Причинний зв'язок між гіперхолестеринемією, особливо, асоційованою з підвищеною концентрацією у плазмі ліпопротеїдів низької густини (LDL) (тут та надалі - ЛНГ) і ліпопротеїдів дуже низької густини (VLDL) (тут та надалі - ЛДНГ), та передчасним атеросклерозом та/або серцево-судинними захворюваннями є зараз загальновизнаним. Однак, зараз існує обмежена кількість лікарських за 9 76739 10 собів для лікування гіперліпідемії. Лікарські засохолестерин у сироватці, спричинений надлишкоби, що переважно застосовуються для лікування вим синтезом чи зниженим метаболізмом, є пригіперліпідемії, включають смоли, що утворюють чинно зв'язаним із атеросклерозом. На відміну від комплекси з жовчною кислотою, такі як холестиних, ліпопротеїди високої густини (тут та надалі рамін та колестипол, похідні фібринової кислоти, ЛВГ), які містять аполіпопротеїн А1, виявляють такі як безафібрат, клофібрат, фенофібрат, ципзахисний ефект і мають зворотну кореляцію з рирофібрат та гемфіброзил, інгібітори синтезу нікозиком ішемічної хвороби серця. Таким чином, співтинової кислоти та холестерину, такі як інгібітори відношення ЛВГ/ЛНГ є зручним методом оцінки ферменту 3-гідрокси-3-метилглутарилуатерогенного потенціалу ліпідного профілю плазкоферменту A (HMG-CoA) редуктази. Незручність ми пацієнта. введення (гранульована форма, яка має бути дисДві ізоформи аполіпопротеїну (аро) В - ароВпергована у воді чи апельсиновому соку) та сильні 48 та ароВ-100 - є важливими протеїнами у метапобічні ефекти (шлунково-кишковий дискомфорт болізмі ліпопротеїдів людини. АроВ-48, названий та запор) смол, що зв'язують жовчну кислоту, є так тому, що він дає розмір плями близько 48% від великими недоліками. Похідні фібринової кислоти ароВ-100 на поліакриламідних гелях з домішкою індукують помірне зниження (на 5-25%) холестедодецилсульфату натрію, синтезується у кишечрину ЛНГ (за винятком гіпертригліцеридемічних нику людини. АроВ-48 є необхідним компонентом пацієнтів, у яких початково низькі рівні мають тендля складання хіломікронів і тому відіграє обов'язденцію до зростання) і, хоч звичайно добре перекову роль у кишковому всмоктуванні харчових жиносяться, мають небажані побічні ефекти, вклюрів. АроВ-100, який продукується печінкою людичаючи потенціювання варфарину, прурит, відчуття ни, потрібен для синтезу та секреції ЛДНГ. ЛНГ, втоми, головний біль, безсоння, болючу реверсивщо містять приблизно 2/3 холестерину у плазмі ну міопатію та заклякання великих груп м'язів, імлюдини, є продуктами метаболізму ЛДНГ. АроВпотенцію та порушення ниркової функції. Нікоти100 є практично єдиним протеїновим компонентом нова кислота є потужним ліпідзнижувальним ЛНГ. Підвищені концентрації ароВ-100 та холестеагентом, який приводить до зниження холестерину рину ЛНГ у плазмі є визнаними факторами ризику ЛНГ на 15-40% (і навіть 45-60% у комбінації зі для розвитку атеросклеротичної ішемічної хвороби смолою, що зв'язує жовчну кислоту), але має весерця. лику частоту випадків тяжких побічних ефектів, Велика кількість генетичних та набутих хвороб зв'язаних з властивою цьому засобу вазодилатаможуть призвести до гіперліпідемії. Вони можуть торною дією, таких як головний біль, еритема, себути класифіковані на первинні та вторинні гіперрцебиття, тахікардія та періодичні непритомності, ліпідемічні стани. Найпоширенішими причинами а також інші побічні ефекти, такі як шлункововторинних гіперліпідемій є цукровий діабет, зловкишковий дискомфорт, гіперурикемія та порушенживання алкоголем, наркотиками, гіпотиреоз, хроня толерантності до глюкози. З сімейства інгібітонічна ниркова недостатність, нефротичний синдрів ферменту 3-гідрокси-3-метилглутарилуром, холестаз та булімія. Первинні гіперліпідемії коферменту А редуктази, ловастатин та симвастатакож були класифіковані на звичайну гіперхолестин є обидва неактивними проліками, що містять теринемію, сімейну комбіновану гіперліпідемію, лактонове кільце, яке гідролізується у печінці з сімейну гіперхолестеринемію, залишкову гіперліпіутворенням відповідного активного похідного оксидемію, хіломікронемічний синдром та сімейну гіпекислоти. Індукуючи зниження холестерину ЛНГ на ртригліцеридемію. 35-45%, вони звичайно добре переносяться і маВідомо, що мікросомальний протеїн перенеють низьку частоту випадків незначних побічних сення тригліцеридів (тут та надалі МПТ) каталізує ефектів. Однак, залишається потреба у нових ліпітранспорт тригліцериду та складного холестеридзнижувальних агентах з поліпшеною ефективніслового ефіру переважно до фосфоліпідів, таких як тю та/або таких, що діють за іншими механізмами, фосфатидилхолін. У роботі [D. Sharp et al., Nature відмінними від тих, що описані для вищезгаданих (1993) 365:65] було продемонстровано, що делікарських засобів. фект, який спричинює абеталіпопротеїнемію, знаЛіпопротеїни плазми є водорозчинними висоходиться у гені МПТ. Це вказує на те, що МПТ покомолекулярними комплексами, утвореними з літрібен для синтезу АроВ-вмисних ліпопротеїдів, підів (холестерин, тригліцерид, фосфоліпіди) та таких як ЛДНГ, що є прекурсором ЛНГ. Звідси виаполіпопротеїнів. П'ять основних класів ліпопротепливає, що інгібітор МПТ повинен інгібувати синїдів, що відрізняються часткою ліпідів та типом тез ЛДНГ та ЛНГ, тим самим знижуючи рівні ЛДНГ, аполіпопротеїну, які усі утворюються у печінці ЛНГ, холестерину та тригліцеридів у людини. Інгіта/або кишечнику, були визначені відповідно до бітори МПТ були описані у Канадській патентній їхньої густини (виміряної ультрацентрифугуванзаявці №2091102 та у WO 96/26205. Інгібітори ням). Вони включають ЛНГ, ЛДНГ, ліпопротеїди МПТ, що належать до класу біфенілкарбоксамідів, проміжної густини (тут та надалі ЛПГ), ліпопротеїбули також описані у патенті США №5760246, а ди високої густини (тут та надалі ЛВГ) та хіломіктакож у WO-96/40640 та WO-98/27979. рони. Було ідентифіковано десять основних типів Однією з цілей даного винаходу є створення аполіпопротеїнів плазми людини. ЛДНГ, що секреудосконаленого способу лікування пацієнтів, що туються печінкою та містять аполіпопротеїн В (тут страждають від ожиріння чи атеросклерозу, особта надалі Аро-В), зазнає деградації до ЛНГ, які ливо коронарного атеросклерозу, і загалом від транспортують від 60 до 70% загального холестерозладів, зв'язаних з атеросклерозом, таких як рину сироватки. Аро-В є також головним протеїноішемічна хвороба серця, захворювання периферивим компонентом ЛНГ. Підвищений ЛНГчних судин та захворювання мозкових судин. Ін 11 76739 12 шою метою даного винаходу є викликання регресії або sp2 гібридизованого атому вуглецю та у радиатеросклерозу та інгібування його клінічних наскалі (а-1) принаймні один з X1 або X2 є N; лідків, особливо захворюваності та смертності. Z1 обрано з СН2, СН2СН2, СН2СН2СН2, Даний винахід оснований на несподіваному СН2СН2О та ОСН2СН2; відкритті, що клас нових біфенілкарбоксамідних Z2 є СН2 або СН2СН2; сполук діє як селективні інгібітори МПТ, тобто, воА являє собою зв'язок, С1-6алкандиїл необов'яни є здатними селективно блокувати МПТ на рівні зково заміщений однією або двома групами обрастінок кишечнику у ссавців, і тому є перспективниними з арилу, гетероарилу та С3-6циклоалкілу; при ми кандидатами на лікарський засіб, зокрема, для умові, що коли бівалентний радикал Ζ має формулікування гіперліпідемії. Даний винахід додатково лу (а-5), тоді А являє собою С1-6алкандиїл заміщепропонує кілька методів одержання таких біфенілний однією або двома групами обраними з арилу, карбоксамідних сполук, а також фармацевтичні гетероарилу та С3-6циклоалкілу; В являє собою композиції, що містять такі сполуки. Крім того, вирадикал формули нахід пропонує певну кількість нових сполук, що є придатними як проміжні речовини для одержання терапевтично активних біфенілкарбоксамідних сполук, а також способи одержання таких проміжних речовин. Зрештою, винахід пропонує спосіб лікування стану, обраного з атеросклерозу, панкреатиту, ожиріння, гіперхолестеринемії, гіпертригліцеридемії, гіперліпідемії, діабету та діабету типу II, який включає введення ссавцю терапевтично активної біфенілкарбоксамідної сполуки. Даний винахід стосується сімейства нових сполук формули (І) їх N-оксидів, фармацевтично прийнятних кислотно адитивних солей та стереохімічно ізомерних форм, де р1, р2 та р3 є цілими числами кожне незалежно від 1 до 3; р4 є цілим числом 0 або 1; кожний R1 є незалежно обраним з водню, С1-4алкілу, С14алкілокси, гало, гідрокси, меркапто, ціано, нітро, С1-4алкілтіо або полігалоС1-6алкілу, аміно, С12 4алкіламіно та ді(С1-4алкіл)аміно; кожний R є незалежно обраним з водню, С1-4алкілу, С13 4алкілокси, гало, або трифторметилу; R є воднем або С1-4алкілом; кожний R4 є незалежно обраним з С1-4алкілу, С1-4алкілокси, гало, або трифторметилу; Ζ є бівалентним радикалом формули де n є цілим числом від 2 до 4; m та m' є цілими числами від 1 до 3; R5Ta R6 є кожний незалежно обраним з водню, С1-6алкілу або арилу; X1 та X2 є кожний незалежно обраним з СН, N де і є цілим числом від 1 до 4; j є цілим числом від 1 до 4; k є цілим числом від 1 або 2; Υ є О або NR9 де R9 є воднем, С1-6алкілом або С1-4алкіламінокарбонілом; R7 є воднем, С1-6алкілом, С2-6алкенілом, С26алкінілом, фенілом, або фенілом заміщеним С14алкілом, гало, гідрокси або трифторметилом; R8 є С1-6алкілом, С2-6алкенілом, С2-6алкінілом, фенілом, або фенілом заміщеним С1-4алкілом, 13 76739 14 гало, гідрокси або трифторметилом; ди(С1-6алкіл)аміно; R10 та R11 є кожний незалежно воднем або С1- гетероарил визначається як моно- та поліге7 9 тероароматичні групи, такі, що включають один 6алкілом ; необов'язково R та R можуть бути взяти разом для утворення бівалентного радикалу або більше гетероатомів обраних з азоту, кисню, формули - (СН2)3-, -(СН2)4-, - (CH2)5-, або сірки та фосфору, зокрема піридиніл, піразиніл, -(СН2)6-; піримідиніл, піридазиніл, триазиніл, триазоліл, R12 є радикалом формули імідазоліл, піразоліл, тіазоліл, ізотіазоліл, оксазоліл, пірроліл, фураніл, тіеніл та т.п., включаючи усі їх можливі ізомерні форми, та необов'язково заміщені одним або більше замісниками кожний незалежно обраний з нітро, азідо, ціано, гало, гідрокси, С1-6алкілу, С3-6циклоалкілу, С1-4алкілокси, полігалоС1-6алкілу, аміно, моно- або ди (С1-6алкіл) аміно; та необов'язково у радикалі (b-1) С1- С1-4алкіламіно означає первинні аміно радикали, що мають від 1 до 6 атомів вуглецю такі як, 6алкандиїлова складова може бути додатково заміщена фенілом, фенілС1-4алкілом, гідроксифенаприклад, метиламіно, етиламіно, пропіламіно, нілС1-4алкілом, С1-4алкілоксикарбонілом, С1ізопропіламіно, бутиламіно, ізобутиламіно та т.п.; - ди(С1-6алкіл) аміно означає вторинні аміно 4алкілоксиС1-4алкілом, С1-4алкілтіоС1-4алкілом, фенілС1-4алкілтіоС1-4алкілом, гідроксиС1-4алкілом, радикали, що мають від 1 до 6 атомів вуглецю, такі тіоС1-4алкілом, С3-6циклоалкілом, С3-6циклоалкілС1як, наприклад, диметиламіно, диетиламіно, дипропіламіно, диізопропіламіно, N-метил-N'-етиламіно, 4алкілом, або радикалом формули N-етил-N'-пропіламіно та т.п.; - С1-4алкілтіо означає С1-4алкілову групу приєднану до атому сірки, таку як метилтіо, етилтіо, пропілтіо, ізопропілтіо, бутилтіо та т.п.; - як використовується тут, термін "амінокислота" використовується у його найширшому значенні для визначення природно отриманих амінокислот Якщо невизначено інше, при використанні у загальної формули R-СН(СООН)-NH2 (i.e. гліцин, попередніх визначеннях та надалі: аланіл, валін, лейцин, ізолейцин, метіонін, пролін, - гало є родовою назвою фтору, хлору, брому феніланалін, триптофан, серін, треонін, цистеїн, та йоду; тирозин, аспарагін, глутамін, аспарагінова кисло- С1-4-алкіл позначає насичені вуглеводневі та, складні ефіри аспарагінової кислоти, глутамірадикали з прямим чи розгалуженим ланцюгом, які нова кислота, складні ефіри глутамінової кислоти, містять від 1 до 4 атомів вуглецю, такі як, наприлізин, аргінін, та гістидін), так само штучно отриклад, метил, етил, пропіл, н-бутил, 1-метилетил, 2маних амінокислот, включаючи аналоги амінокисметилпропіл, 1,1-диметилетил і т.п. лот. Таким чином, посилання на амінокислоту - С1-6-алкіл має включати С1-4-алкіл (як визнавключає, наприклад, природно отримані протеочено вище) та його вищі гомологи, що мають 5 чи генні (L) - амінокислоти, так само як (D) - амінокис6 атомів вуглецю, такі як, наприклад, 2лоти, хімічно модіфіковані амінокислоти, такі як, метилбутил, н-пентил, диметилпропіл, н-гексил, 2аналоги амінокислот, природно отримані не прометилпентил, 3-метилпентил і т.п.; теогенні амінокислоти, такі як норлейцин, лантіо- С2-6алкеніл позначає позначає насичені вугнин або т.п., та хімічно синтезовані сполуки, що леводневі радикали з прямим чи розгалуженим мають властивості відомі у галузі як характерні ланцюгом, які містять від 2 до 6 атомів вуглецю, для аміно, можуть бути включені у протеїн у клітитакі як, етеніл, пропеніл, бутеніл, пентеніл або гекні через метаболічний шлях. сеніл; Згадані "амінокислоти" зв'язані через їх карбо- С2-6алкініл позначає позначає насичені вугнілокси групу з радикалом R та через атом азоту з леводневі радикали з прямим чи розгалуженим іншою частиною молекули (тобто R7-ООС-CRHланцюгом, які містять від 2 до 6 атомів вуглецю, NH-). такі як, етиніл, пропиніл, бутиніл, пентиніл або гекПрикладами бівалентного радикалу Ζ формусиніл; ли (а-1), де один з X1 або X2 являє собою sp2 гіб- С3-6-циклоалкіл є родовою назвою для цикридизований атом вуглецю є: лопропілу, циклобутилу, циклопентилу та циклогексилу; - полігалоС1-6алкіл визначається як полігалозаміщенийС1-6алкіл, зокрема С1-6алкіл (як визначено вище) заміщений атомами галогену у кількості від 2 до 13 такий як дифторметил, трифторметил, Прикладами бівалентного радикалу Ζ формутрифторетил, октафторпентил та т.п.; ли (а-5) є: - арил визначається як моно- та поліароматичні групи, такі як, феніл необов'язково заміщений замісниками у кількості від одного до трьох, кожний незалежно є обраним з нітро, азідо, ціано, гало, гідрокси, С1-6алкілу, С3-6циклоалкілу, С14алкілокси, полігалоС1-6алкілу, аміно, моно- або Фармацевтично прийнятні кислотно адитивні 15 76739 16 солі, що згадувались вище, мають включати тералук формули (І), для яких застосовні одно чи більпевтично активні нетоксичні форми кислотно адише з таких обмежень: тивних солей, які можуть бути утворені сполуками a) R1 є воднем, терт-бутилом або трифтормеформули (І). Фармацевтично прийнятні кислотно тилом; адитивні солі можуть бути зручно одержані шляb) R2 є воднем; 3 хом обробки основної форми такою придатною c) R є воднем; кислотою. Придатні кислоти включають, наприd) R4 є воднем; клад, неорганічні кислоти, наприклад, хлористовоe) р1 дорівнює 1; дневу чи бромистоводневу кислоту, сірчану, азотf) p2 дорівнює 1; ну, фосфорну і т.п. кислоти, або органічні кислоти, g) p3 дорівнює 1; такі як, наприклад, оцтову, пропанову, оксиоцтову, h) Ζ є бівалентним радикалом формули (а-1) молочну, піровиноградну, щавлеву (тобто, етандиде X1 та X2 є кожний азотом; кислоту), малонову, бурштинову (тобто, бутандиі) Ζ є бівалентним радикалом формули (а-2) де кислоту), малеїнову, фумарову, яблучну, винну, X1 є азотом та m та m' є цілим числом 1; лимонну, метансульфонову, етансульфонову, беj) Z є бівалентним радикалом формули (а-2) де нзолсульфонову, п-толуолсульфонову, цикламову, X1 є азотом, m є цілим числом 2 та m' є цілим чиссаліцилову, п-аміносаліцилову, памоєву та подібні лом 1; кислоти. k) Ζ є бівалентним радикалом формули (а-3) Навпаки згадані форми солі можуть бути педе X1 є азотом та m та m' є цілим числом 1; ретворені за допомогою обробки відповідною осl) Ζ є бівалентним радикалом формули (а-3) де новою у форму вільної основи. X1 є азотом, m є цілим числом 2 та m' є цілим чисТермін адитивна сіль, як використовується лом 1; вище, також включає сольвати які сполуки формуm) Z є бівалентним радикалом формули (а-4) ли (І), так само як їх солі, здатні утворювати. Такі де m є цілим числом 2 та m' є цілим числом 1; сольвати є, наприклад, гідратами, алкоголятами n) Ζ є бівалентним радикалом формули (а-5) та т.п. де Ζ1 та Ζ2 являють собою СН2СН2; N-оксидні форми сполук формули (І), які моо) R5 та R6 є кожний незалежно воднем або жуть бути одержані загальновідомими способами, метилом; мають включати ті сполуки формули (І), де атом р) двовалентний радикал А є С1-6азоту окислено до N-оксиду. алкандиїлом, заміщеним однією арильною групою, Термін «стереохімічно ізомерні форми» у тому зокрема, А є метиленовою групою, заміщеною значенні, що використовується тут, позначає усі фенілом; можливі ізомерні форми, які можуть мати сполуки q) В є радикалом формули (b-1). формули (І). Якщо не згадано чи вказано інше, Особливою групою сполук є сполуки формули хімічна назва сполуки позначає суміш усіх можли(І), де бівалентний радикал А являє собою метивих стереохімічно ізомерних форм, причому вкаленову групу заміщену фенілом. зані суміші містять усі діастереомери та енантіоІншою особливою групою сполук є сполуки мери базової молекулярної структури. Більш формули (І), де Ζ є бівалентним радикалом форконкретно, стереогенні центри можуть мати R- чи мули (а-5), де Ζ1 та Ζ2 представляють СН2СН2 та S-конфігурацію, замісники на бівалентних циклічX1 є N та X2 є СН. них (частково) заміщених радикалах можуть мати Ще іншою особливою групою сполук є сполуки цис- чи транс-конфігурацію. Якщо не згадано або формули (І), де Ζ є бівалентним радикалом форвказано інше, хімічне позначення сполуки означає мули (а-5), де Ζ1 та Ζ2 представляє СН2СН2 та X1 є суміш усіх можливих стереоізомерних форм, згаСН та X2 є N. дані суміші включають усі діастереомери- та енанТакож іншою особливою групою сполук є спотіомери основної молекулярної структури. Теж луки формули (І), де Ζ є бівалентним радикалом саме стосується проміжних сполук, що описано формули (а-5), де Ζ1 та Ζ2 представляють СН2СН2 тут, та які використовують для одержання кінцевих та X1 та X2 є N. продуктів формули (І). Першим способом одержання біфенілкарбокТерміни цис та транс використовуються тут самідної сполуки за даним винаходом є спосіб, у згідно з номенклатурою Chemical Abstracts і познаякому проміжний феніленамін формули чають положення замісників на кільцевому фрагменту. Абсолютна стереохімічна конфігурація сполук формули (І) та проміжних сполук, що використовуються для їхнього одержання, може бути легко визначена фахівцями в цій області з використанням добре відомих методів, таких як, наприклад, де В, Α, Ζ та R4 мають значення, визначені у рентгенівська дифракція. формулі (І), вводять у реакцію з біфенілполіарилКрім того, деякі сполуки формули (І) та деякі з карбоновою кислотою чи галідом формули (lll), проміжних сполук, що використовуються для їхнього одержання, можуть виявляти поліморфізм. Передбачається, що даний винахід охоплює будьякі поліморфні форми, які мають властивості, придатні для лікування згаданих вище станів. Група цікавих сполук складається з таких спо 17 76739 18 ним реагентом без енантіомеризації продукта може бути проведена у додатковій присутності ефективної кількості сполуки, такої як гідроксибензотриазол, бензотриазолілокситрис(диметиламіно)фосфонійгексафторфосфат, гексафторфосфат тетрапіролідинофосфонію, гексафторфосфат бромтрипіролідинофосфонію чи їхнього функціонального похідного, так як описано [D. Hudson, J. 1 2 де R та R мають значення, визначені у форOrg. Chem., (1988), 53:617]. мулі (І) та Q1 обрано з гідрокси та гало, у щонайТретім способом одержання біфенілкарбоксаменше одному інертному щодо реакції розчиннику мідної сполуки відповідно до даного винаходу є і, необов'язково, у присутності придатної основи, спосіб, у якому проміжну сполуку формули (VI) причому вказаний спосіб далі необов'язково включає перетворення сполуки формули (І) на її адитивну сіль та/або одержання її стереохімічно ізомерних форм. У тому випадку, коли Q1 є гідрокси, може бути зручним проведення активації біфенілкарбонової кислоти формули (lll) шляхом додання ефективної кількості промотора реакції. Не обмежуючі приклади таких промоторів реакції включають карбонілдіімідазол, дііміди, такі як Ν,Ν'де R1, R2, R3, та R4 мають значення, визначені дициклогексилкарбодіімід чи 1-(3у формулі (І) та Q3 обрано з гало, В(OН)2, алкілбодиметиламінопропіл)-3-етилкарбодіімід, та їхні ронатів та їхніх циклічних аналогів, вводять у реафункціональні похідні. Для цього типу процедури кцію з реагентом формули (VII) ацилювання краще використовується полярний апротонний розчинник, такий як, наприклад, метиленхлорид. Придатні основи для здійснення цього першого методу включають третинні аміни, такі як триетиламін, триізопропіламін і т.п. Придатні температури для проведення першого способу за виде В, А та Ζ мають значення, визначені у фонаходом типово знаходяться в інтервалі від близьрмулі (І), у щонайменше одному інертному щодо ко 20°С до близько 140°С, у залежності від реакції розчиннику і необов'язково у присутності конкретного розчинника, що використовується, і щонайменше одного сполучального реагенту на найчастіше будуть температурою кипіння вказанооснові перехідного металу та/або щонайменше го розчинника. одного придатного ліганду, причому вказаний споДругий спосіб одержання біфенілкарбоксамідсіб далі необов'язково включає перетворення споної сполуки за даним винаходом є спосіб, де пролуки формули (І) на її адитивну сіль, та/або одерміжна сполука формули (IV) жання її стереохімічно ізомерних форм. Цей тип де R1, R2, R3, R4, А та Ζ мають значення, визначені у формулі (І) та Q2 обрано з гало та гідрокси, вводять в реакцію з реагентом (V) формули ВН у щонайменше одному інертному щодо реакції розчиннику і, необов'язково, у присутності принаймні одного прийнятного сполучального реагенту та/або придатної основи, причому вказаний спосіб далі необов'язково включає перетворення сполуки формули (І) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. У тому випадку, коли Q2 є гідрокси, може бути зручним активувати карбонову кислоту формули (VI) шляхом додання ефективної кількості промотора реакції. Необмежуючі приклади таких промоторів реакції включають карбонілдіімідазол, дііміди, такі як Ν,Ν'дициклогексилкарбодіімід чи 1-(3диметиламінопропіл)-3-етилкарбодіімід, та їхні функціональні похідні. У випадку використання хірально чистого реагенту формули (V), швидка реакція проміжної сполуки формули (VI) із вказа реакції відомий як реакція Бухвальта (Buchwaldt), а посилання на застосовні металеві сполучальні реагенти та/або придатні ліганди, наприклад, сполуки паладію, такі як паладійтетра(трифенілфосфін), трис(дибензиліденацетон)дипаладій, 2,2'біс(дифенілфосфіно)-1,1'-бінафтил (БІНАФ) і т.п., можна знайти, наприклад, у [Tempahedron Letters, (1996), 37(40), 7181-7184 та J. Am. Chem. Soc, (1996), 118:7216]. Якщо Q3 позначає В(ОН)2, алкілборонат чи їхній циклічний аналог, то як сполучальний реагент, у відповідности до [Tempahedron Letters, (1998), 39:2933-6]. Сполуки формули (І) можуть бути також зручно одержані з використанням методу твердофазового синтезу показаному нижче на Схемі 1. Загалом, твердофазовий синтез включає проведення реакції проміжної сполуки, що використовується у синтезі, з полімерним носієм. Ця проміжна сполука на полімерному носії може бути потім проведена через ряд стадій синтезу. Після кожної стадії домішки видаляють шляхом фільтрування смоли та багаторазового промивання її різними розчинниками. На кожній стадії смола може бути відщеплена для проведення реакції з різними проміжними сполуками на наступній стадії, що дозволяє проводити синтез великої кількості сполук. Після останньої стадії методу смолу обробляють реаге 19 76739 20 нтом чи певним методом відщеплюють смолу від хіральної стаціонарної фази. Згадані чисті стереозразка сполуки. Більш детальне пояснення метохімічно ізомерні форми можуть також бути отридик, що використовуються у твердофазовій хімії, мані з відповідних чистих стереохімічно ізомерних наведене, наприклад, у ["The Combinatorial Index" форм відповідних вихідних матеріалів, при умові, (B.Bunin, Academic Press) та Novabiochem's 1999 що реакція проходить стереоспецифічно. Бажано, Catalogue & Peptide Synthesis Handbook якщо потрібен специфічний стереоізомер, згадана (Novabiochem AG, Switzerland), які обидві включені сполука буде синтезована за допомогою стерео сюди за посиланням]. специфічних способів одержання. Ці способи буСхема 1: дуть переважно використовувати енантіомерно чисті вихідні матеріали. Біфенілкарбоксамідні сполуки формули (І), їхні N-оксидні форми, фармацевтично прийнятні солі та стереоізомерні форми виявляють корисну активність з інгібування аполіпопротеїну В та супутню ліпідзнижувальну активність. Тому сполуки за даним винаходом є придатними для застосування як лікарський засіб, особливо у способі лікування пацієнтів, що страждають від гіперліпідемії, ожиріння, атеросклерозу чи діабету типу П. Зокрема, сполуки за даним винаходом можуть бути використані для виробництва лікарського засобу для лікування розладів, спричинених надлишком ліпопротеїдів дуже низької густини (ЛДНГ) чи ліпопротеїдів низької густини (ЛНГ), і особливо розладів, спричинених холестерином, асоційованим з вказаними ЛДНГ та ЛНГ. Причинний зв'язок між гіперхолестеринемією особливо асоційованою з підвищеними концентраціями у плазмі ліпопротеїдів низької густини (ЛНГ) та ліпопротеїдів дуже низької густини (ЛДНГ) - та передчасним атеросклерозом і серцевосудинними захворюваннями є напевне встановленим. ЛДНГ секретується печінкою і містить аполіпопротеїн В (аро-В); ці частинки зазнають деградації у кровотоці до ЛНГ, які транспортують близько 60-70% загального холестерину сироватки. Аро-В є також основним протеїновим компонентом ЛНГ. Підвищення ЛНГ-холестерину у сироватці внаслідок надлишкового синтезу чи зниження метаболізму, є причинно зв'язаним з атеросклерозом. На відміну від нього, ліпопротеїди високої густини (ЛВГ), що містять аполіпопротеїн А1, виявляють захисну дію і мають зворотну кореляцію з ризиком ішемічної хвороби серця. Таким чином, співвідношення ЛВГ/ЛНГ є зручним способом оцінСкорочення використані у Схемі 1 пояснені у ки атерогенного потенціалу ліпідного профілю Експериментальній Частині. Замісникі R1, R2, R3, плазми пацієнта. 4 R , А, В, та Ζ мають значення, визначені для споОсновний механізм дії сполук формули (І), полук формули (І). PG являє собою захисну групу видимому, включає інгібування активності МПТ таку як, наприклад т-бутоксикарбоніл, С1(мікросомальний протеїн перенесення тригліцерифенілметилоксикарбоніл, 6алкілоксикарбоніл, дів) у гепатоцитах та епітеліальних клітинах кишеFmoc та т.п. чнику, що приводить до зниження ЛДНГ та продуСполуки формули (І) отримані за вищеописакування хіломікронів, відповідно. Це новий та ними способами можуть бути синтезовані у формі перспективний підхід до гіперліпідемії, що, як очірацемічних сумішей енантіомерів, які можуть бути кується, знижатиме рівні холестерину ЛНГ та трирозділені один від одного за допомогою відомих з гліцеридів за рахунок зниження продукування галузі методами розділення. Рацемічні сполуки ЛДНГ у печінці та кишкового продукування хіломіформули (І) можуть бути перетворені у відповідні кронів. діастереомерні форми солі за допомогою реакції з Велика кількість генетичних та набутих хвороб прийнятною хоральною кислотою. Згадані діастеможе спричинювати гіперліпідемію. Вони можуть реомерні форми солі згодом розділяють, наприбути класифіковані на первинні та вторинні гіперклад, за допомогою вибіркової або фракційної криліпідемічні стани. Найпоширенішими причинами сталізації та енантіомери виділяються з них за вторинних гіперліпідемій є цукровий діабет, зловдопомогою лугу. Альтернативний спосіб розділенживання алкоголем, наркотиками, гіпотиреоз, хроня енантіомерних форм сполуки формули (І) нічна ниркова недостатність, нефротичний синдвключає рідинну хроматографію з використання ром, холестаз та булімія. Первинними 21 76739 22 гіперліпідеміями є звичайна гіперхолестеринемія, ін'єкцій, фармацевтичний носій буде переважно сімейна комбінована гіперліпідемія, сімейна гіпервключати стерильну воду, хоч інші інгредієнти мохолестеринемія, залишкова гіперліпідемія, хіломіжуть бути включені для поліпшення розчинності кронемічний синдром, сімейна гіпертригліцеридиактивного інгредієнта. Розчини для ін'єкцій можуть мія. Сполуки за даним винаходом можуть бути бути виготовлені, наприклад, шляхом використантакож використані для профілактики чи лікування ня фармацевтичного носія, який включає сольовий пацієнтів, що страждають від ожиріння чи атеророзчин, розчин глюкози чи їхню суміш. Можуть склерозу, особливо, коронарного атеросклерозу бути також виготовлені суспензії для ін'єкцій шлята, більш узагальнено, розладів, зв'язаних з атехом використання відповідних рідких носіїв, суросклерозом, таких як ішемічна хвороба серця, спендувальних агентів і т.п. В композиціях, придазахворювання периферичних судин, захворювання тних для черезшкірного введення, судин мозку. Сполуки за даним винаходом можуть фармацевтичний носій може необов'язково вклюспричинити регресію атеросклерозу та інгібувати чати агент посилення проникності та/або придатклінічні наслідки атеросклерозу, особливо захвоний змочувальний агент, необов'язково у комбінарюваність та смертність. ції з невеликою кількістю придатних домішок, які Враховуючи корисність сполук формули (І), не виявляють значної шкідливої дії на шкіру. Вкаслід вважати, що даний винахід також пропонує зані домішки можуть бути обрані для сприяння спосіб лікування теплокровних тварин, включаючи проникненню активного інгредієнта до шкіри людей (які тут загалом називаються пацієнтами), та/або для допомоги при виготовленні бажаних що страждають від розладів, спричинених надликомпозицій. Ці композиції для місцевого застосушком ліпопротеїдів дуже низької густини (ЛДНГ) чи вання можуть вводитись різними шляхами, наприліпопротеїдів низької густини (ЛНГ), і особливо клад, у вигляді трансдермального пластиру, місрозладів, спричинених холестерином, асоційовацевого пластиру чи мазі. Адитивні солі сполук ним з вказаними ЛДНГ та ЛНГ. Отже, пропонуєтьформули (І), завдяки їхній підвищеній водорозчинся спосіб лікування для полегшення стану пацієнності порівняно з відповідною основною формою, є тів, що страждають від хвороб, таких як, очевидно більш придатними для виготовлення наприклад, гіперліпідемія, ожиріння, атеросклероз водних композицій. чи діабет типу II. Особливо зручно виготовляти фармацевтичні АроВ-48, що синтезується кишечником, є поткомпозиції за винаходом у дозованих лікарських рібним для складання хіломікронів і тому відіграє формах для простоти введення та постійності доз. обов'язкову роль у кишковому всмоктуванні харчо"Дозована лікарська форма" у тому значенні, що вих жирів. Даний винахід пропонує біфенілкарбоквикористовується тут, стосується фізично дискресамідні сполуки, що діють як селективні інгібітори тних одиниць, придатних для використання як раМПТ на рівні стінки кишечнику. зові дози, причому кожна одиниця містить попереДодатково даний винахід пропонує фармацевдньо визначену кількість активного інгредієнта, тичні композиції, які включають щонайменше один розраховану на те, щоб викликати бажаний терафармацевтично прийнятний носій та терапевтично певтичний ефект, у поєднанні з потрібним фармаефективну кількість біфенілкарбоксамідної сполуцевтичним носієм. Прикладами таких дозованих ки формули (І). лікарських форм є таблетки (включаючи таблетки Для виготовлення фармацевтичної композиції з надрізом чи таблетки з покриттям), капсули, піза даним винаходом, ефективну кількість конкретлюлі, порошки у пакетиках, облатки, розчини чи ної сполуки, у формі основи чи адитивної солі, що суспензії для ін'єкцій, суспензії для орального ввевикористовується як активний інгредієнт, ретельно дення, дозовані по 5мл (teaspoonfuls) чи 15мл змішують з щонайменше одним фармацевтично (tablespoonfuls) і т.п., та упаковки з кратними доприйнятним носієм, який може мати різноманітні зами. форми в залежності від форми препарату, потрібДля орального введення фармацевтичні комної для введення. Ці фармацевтичні композиції позиції за даним винаходом можуть мати форму бажано є дозованими лікарськими формами, притвердих дозованих форм, наприклад, таблеток (як датними, краще, для орального введення, ректадля ковтання, так і для жування), капсули чи желального введення, черезшкірного введення чи патинові капсули, виготовлені звичайними засобами рентерального введення. з фармацевтично прийнятними ексципієнтами та Наприклад, для виготовлення композиції у виносіями, такими як зв'язуючі агенти (наприклад, гляді дозованої форми для орального введення, прежелатинований кукурудзяний крохмаль, полівіможе бути використаний будь-який звичайний ріднілпіролідон, гідроксипропілметилцелюлоза і т.п.), кий фармацевтичний носій, такий як, наприклад, наповнювачами (наприклад, лактоза, мікрокриставода, гліколі, масла, спирти і т.п. у випадку рідких лічна целюлоза, фосфат кальцію і т.п.), змащуваоральних препаратів, таких як суспензії, сиропи, льні речовини (наприклад, стеарат магнію, тальк, еліксири та розчини; чи тверді фармацевтичні нооксид силіцію і т.п.), розпушувальні агенти (наприсії, такі як крохмалі, цукри, каолін, змащувальні клад, картопляний крохмаль, натрієва сіль крохречовини, зв'язуючи, розпушувальні агенти і т.п. у мальгліколяту і т.п.), змочувальні агенти (напривипадку порошків, пілюль, капсул та таблеток. клад, лаурилсульфат натрію) і т.п. На такі Таблетки та капсули, завдяки простоті їхнього таблетки може бути нанесене покриття методами, введення, є найкращими дозованими лікарськими відомими фахівцям. формами для орального введення, для яких, очеРідкі препарати для орального введення мовидно, використовуються тверді фармацевтичні жуть мати форму, наприклад, розчинів, сиропів чи носії. У випадку композицій для парентеральних суспензій, або вони можуть бути виготовлені у 23 76739 24 вигляді сухого продукту для змішування з водою і можуть містити агенти для утворення композиції, та/або іншим придатним рідким носієм перед затакі як агенти регулювання осмотичного тиску, стосуванням. Такі рідкі препарати можуть бути суспендувальні агенти, стабілізатори та/або дисвиготовлені звичайними способами, необов'язково пергатори. За іншим варіантом, активний інгредіз іншими фармацевтично прийнятними домішками, єнт може знаходитись у формі порошку, призначетакими як суспендувальні агенти (наприклад, сорного для змішування з придатним носієм, бітовий сироп, метилцелюлоза, гідроксипропілменаприклад, стерильною апірогенною водою, перед тилцелюлоза чи гідрогеновані їстивні жири), емузастосуванням. льгувальні агенти (наприклад, лецитин чи Біфенілкарбоксамідні сполуки за даним винагуміарабік), неводні носії (наприклад, мигдалева ходом можуть бути також введені у ректальні комолія, складні ефіри жирних кислот чи етиловий позиції, такі як супозиторії чи затримуючі клізми, спирт), підсолоджувачі, смакові речовини, агенти наприклад, такі, що містять звичайні супозиторні для маскування неприємного смаку та консерваноснови, такі як какаова олія та/або інші гліцериди. ти (наприклад, метилчи пропіл-пБіфенілкарбоксамідні сполуки за даним винагідроксибензоатів чи сорбінова кислота). ходом можуть бути використані у сполученні з інФармацевтично прийнятні підсолоджувані, зашими фармацевтичними агентами, зокрема, фарстосовні у фармацевтичних композиціях за винамацевтичні композиції за даним винаходом можуть ходом, включають, краще, щонайменше один сидодатково включати щонайменше один додаткольний підсолоджувач, такий як аспартам, вий ліпідзнижувальний агент, забезпечуючи таким ацесульфам-калій, цикламат натрію, алітат, дигідчином так звану комбіновану ліпідзнижувальну рохальконовий підсолоджувач, монелін, стевіозид терапію. Вказаний додатковий ліпідзнижувальний сукралоза (4,1',6'-трихлор-4,1',6'агент може бути, наприклад, відомим лікарським тридезоксигалактосахароза) чи, краще, сахарин, засобом, що звичайно використовується для лікунатрієва чи кальцієва сіль сахарину, і необов'язковання гіперліпідемії, таким як, наприклад, смолаво, щонайменше один фоновий підсолоджувач, комплексоутворювач для зв'язування жовчної кистакий як сорбіт, маніт, фруктоза, сахароза, мальлоти, похідне фібринової кислоти чи нікотинова тоза, ізомальт, глюкоза, гідрогенований глюкозний кислота, як було описано вище у відомому рівні сироп, ксиліт, карамель чи мед. Сильні підсолотехніки за винаходом. Придатні додаткові ліпідзджувачі зручно використовуються у низьких коннижувальні агенти також включають інші інгібітори центраціях. Наприклад, у випадку натрієвої солі біосинтезу холестерину та інгібітори всмоктування сахарину, вказана концентрація може знаходитись холестерину, особливо інгібітори 3-гідрокси-3у межах від близько 0,04% до 0,1% (мас./об.) від метилглутарилу-коферменту A (HMG-CoA) редукготової композиції. Фоновий підсолоджувач може тази та інгібітори HMG-CoA-синтази, інгібітори ексбути ефективно використаний у більших концентпресії гена HMG-CoA-редуктази, інгібітори СЕТР, раціях, що знаходяться у межах від близько 10% інгібітори ацетил-СоА-ацилтрансферази (АСАТ), до близько 35%, краще, від близько 10% до 15% інгібітори скваленсинтетази і т.п. (мас./об.). Будь-який інгібітор НМГ-СоА-редуктази може Фармацевтично прийнятними смаковими ребути використаний як друга сполука у варіанті човинами, які можуть маскувати інгредієнти з гіркомбінованої терапії за даним винаходом. Термін ким смаком у композиціях з низькими дозами є, "інгібітор НМГ-СоА-редуктази" у тому значенні, що краще, фруктові смакові речовини, такі як вишневикористовується тут, якщо не вказано інше, стова, малинова, чорносмородинова чи полунична сується сполуки, яка інгібує біотрансформацію смакова речовина. Дуже добрі результати може гідроксиметилглутарил-коферменту А на мевалодати комбінація двох смакових речовин. У компонову кислоту, що каталізується ферментом НМГзиціях з високими дозами можуть знадобитися СоА-редуктазою. Таке інгібування може бути легко сильніші фармацевтично прийнятні смакові речовизначене фахівцем в цій області за допомогою вини, такі як Caramel Chocolate, Хвилинї Cool, стандартних методів аналізу, тобто, ]Methods of Fantasy і т.п. Кожна смакова речовина може вхоЕпгумольо£у (1981) 71:455-509]. Приклади сполук дити до кінцевої композиції у концентрації в інтерописані, наприклад, у патенті США №4231938 (що валі від близько 0,05% до 1% (мас./об.). Краще включає ловастатин), патенті США №4444784 (що використовуються комбінації вказаних сильних включає симвастатин), патенті США №4739073 смакових речовин. Краще використовується сма(що включає флувастатин), патенті США кова речовина, яка не зазнає ніяких змін чи втрати №4346227 (що включає правастатин), ЕР-Асмаку та/або кольору в умовах виготовлення ком491226 (що включає ривастатин) та патенті США позиції. №4647576 (що включає аторвастатин). Біфенілкарбоксамідні сполуки за даним винаБудь-який інгібітор НМГ-СоА-синтази може буходом можуть бути виготовлені у формі композити використаний як друга сполука у варіанті комбіцій для парентерального введення шляхом ін'єкції, нованої терапії за даним винаходом. Термін "інгібізручно, внутрішньовенної, внутрішньом'язової чи тор НМГ-СоА-синтази" у тому значенні, що підшкірної ін'єкції, наприклад, шляхом болісної використовується тут, якщо не вказано інше, стоін'єкції чи безперервної внутрішньовенної інфузії. сується сполуки, яка інгібує біосинтез гідроксимеКомпозиції для ін'єкції можуть бути представлені у тилглутарил-коферменту А з ацетил-коферменту дозованій лікарській формі, наприклад, в ампулах А та ацетоацетил-коферменту А, що каталізується чи багатодозових ємностях, включаючи доданий ферментом НМГ-СоА-синтазою. Таке інгібування консервант. Вони можуть мати форму суспензій, може бути легко визначене фахівцем в цій області розчинів чи емульсій у водних чи масляних носіях, за допомогою стандартних методів аналізу, тобто, 25 76739 26 [Methods of Еnzумольоgу (1985) 110:19-26]. Типові Фахівці з лікування гіперліпідемії легко визнасполуки описані, наприклад, у патенті США чать терапевтично ефективну кількість біфенілка№5120729, який стосується похідних бетарбоксамідної сполуки за даним винаходом за релактаму, патенті США №5064856, що стосується зультатами тестів, описаних далі. Загалом похідних спіролактону, та патенті США №4847271, вважається, що терапевтично ефективна доза що стосується оксетанових сполук. складатиме від близько 0,001мг/кг до близько Будь-який інгібітор експресії гена НМГ-СоА5мг/кг ваги тіла, краще, від близько 0,01мг/кг до редуктази може бути використаний як друга сполублизько 0,5мг/кг ваги тіла пацієнта, що отримувака у варіанті комбінованої терапії за даним винатиме курс лікування. Може виявитися зручним ходом. Ці агенти можуть бути інгібіторами трансквведення терапевтично ефективної дози у формі рипції НМГ-СоА-редуктази, що блокують двох чи більше субдоз з відповідними інтервалами транскрипцію DNA, чи інгібіторами трансляції, що часу протягом дня. Вказані субдози можуть бути перешкоджають трансляції мРНК, яка кодує НМГвиготовлені як дозовані лікарські форми, кожна з СоА-редуктазу, у протеїн. Такі інгібітори можуть яких містить, наприклад, від близько 0,1мг до бливпливати на транскрипцію чи трансляцію безпосезько 350мг, краще, від близько 1 до близько 200мг, редньо чи можуть зазнавати біотрансформації у активного інгредієнта на дозовану лікарську форсполуки, що мають вищезгадані властивості, за му. допомогою одного чи кількох ферментів у шляху Точне дозування та частота введення залебіосинтезу холестерину, чи можуть приводити до жить від виду біфенілкарбоксамідної сполуки фонакопичення метаболіту, що виявляє вищезгадану рмули (І), що використовується, конкретного стану, активність. Таке регулювання може бути легко що лікується, тяжкості стану, що лікується, віку, визначене фахівцем в цій області з використанням ваги та загального фізичного стану певного пацієстандартних методів аналізу, тобто, [Methods of нта, а також інших лікарських засобів (включаючи Еnzумольоgy (1985) 110:9-19]. Типові сполуки опивищезгадані додаткові ліпідзнижувальні агенти), сані, наприклад, у патенті США №5041432 та у які може приймати пацієнт, як добре відомо фахів[E.I.Mercer, Prog. Lip. Res., (1993) 32:357-416]. цям в цій області. Крім того, вказана ефективна Будь-який інгібітор СЕТР може бути викорисдобова доза може бути знижена чи збільшена у таний як друга сполука у варіанті комбінованої залежності від реакції пацієнта, лікування якого терапії за даним винаходом. Термін "інгібітор проводиться, та/або у залежності від оцінки лікаря, СЕТР" у тому значенні, що використовується тут, що призначив біфенілкарбоксамідну сполуку за якщо не вказано інше, стосується сполуки, яка даним винаходом. Таким чином, вказані вище межі інгібує транспорт різних холестерилових складних величини ефективної добової кількості є лише ефірів та тригліцеридів, що медіюється протеїном орієнтовними. перенесення холестерилових складних ефірів Експериментальна частина (СЕТР), від ЛВГ до ЛНГ та ЛДНГ. Типові сполуки В описаних далі методиках використовувалися описані, наприклад, у патенті США №5512548, у [J. такі скорочення: "АЦН" позначає ацетонітрил; Antibiot., (1996) 49(8) 815-816 та Bioorg. Med. "ТГФ" позначає тетрагідрофуран; "ДХМ" позначає Chem. Lett., (1996) 6:1951-1954]. дихлорметан; "ДІПЕ" позначає діізопропіловий Будь-який інгібітор АСАТ може бути викорисефір; "ДМФ" позначає Ν,Ν-диметилформамід; таний як друга сполука у варіанті комбінованої "РуВОР"позачає комплекс (Т-4)терапії за даним винаходом. Термін "інгібітор гексафторфосфат(1-)(1-гідрокси-1НАСАТ" у тому значенні, що використовується тут, бензотриазолато-О)три-1-пірролідинілякщо не вказано інше, стосується сполуки, яка фосфору(1+); та "ДІПЕА" позначає діізопропілетиінгібує внутрішньоклітинну етерифікацію харчового ламін. холестерину ферментом ацил-СоА:холестеринАбсолютна стереохімічна конфігурація деяких ацилтрансферазою. Таке інгібування може бути сполук формули (І) не була експериментальна легко визначене фахівцем в цій області з викорисвизначена. У цих випадках стереохімічно ізомерні танням стандартних методів аналізу, тобто, метоформи які виділені першими позначені як "А" та ду [Heider et al., Journal of Lipid Research, (1983) другими позначені як "В", без додаткового поси24:1127]. Типові сполуки описані, наприклад, у лання на фактичну стереохімічну конфігурацію. патенті США №5510379, у WO 96/26948 та WO А. Синтез проміжних сполук 96/10559. Приклад А. 1 Будь-який інгібітор скваленсинтетази може буa) Суміш 4-[4-(фенілметил)-1-піперазиніл]ти використаний як друга сполука у варіанті комбібензоламіну (0,3моль) та триетиламіну (0,36моль) нованої терапії за даним винаходом. Термін "інгібіу ДХМ (1500мл) перемішували при кімнатній темтор скваленсинтетази" у тому значенні, що пературі протягом 15 хвилин. 4'-(трифторметил)використовується тут, якщо не вказане інше, сто[1,1'-біфеніл]-2-карбоніл хлорид (0,36моль) додасується сполуки, яка інгібує конденсацію двох мовали по краплях протягом 30 хвилин. Суміш перелекул фарнезилпірофосфату з утворенням сквамішували при кімнатній температурі протягом 3 лену, що каталізується ферментом годин та потім промили двічі водою, потім промили скваленсинтетазою. Такий інігібітор може бути насиченим розчином NaCl. Органічний шар виділегко визначений фахівцем в цій області з викорилили, висушили, відфільтрували та розчинник вистанням стандартних методів аналізу, тобто, паровували. Залишок перемішували у ДІПЕ [Methods of Enzyмoльogy (1985) 110:359-373]. Ти(800мл). Осад відфільтрували , промили двічі ДІпові сполуки описані, наприклад, у ЕР-А-567026, у ПЕ та висушили у вакуумі при температурі 50°С, ЕР-А-645378 та у ЕР-А-645377. що дало 140,2г Ν-[4-[4-(фенілметил)-1 27 76739 28 піперазиніл]феніл]-4'-(трифторметил)-[1,1'(0,024моль) у ТГФ (250мл) та триетиламіну (50мл). біфеніл]-2-карбоксамід (проміжна сполука 1, точка 4'-(трифторметил)-[1,1'-біфеніл]-2-карбоніл хлорид плавлення 180°С). (0,026моль) додавали по краплях. Суміш переміb) Суміш проміжної сполуки (1) (0,19моль) у шували протягом ночі. Розчинник випаровували. метанолі (600мл) та ТГФ (600мл) була гідрогенізоЗалишок очистили за допомогою колонкової хрована протягом ночі паладієм на вугіллі (10%; 3г) як матографії на силікагелі (елюент: СН2СІ2/СН3ОН каталізатором. Після поглинення водню (1 еквіва99/1). Чисті фракції зібрали та розчинник випаролент), каталізатор відфільтрували та фільтрат вували. Залишок тритурували у ДІПЕ. Осад відфівипарювали. Залишок тритурували у ДІПЕ. Осад льтрували та висушили, що дало 7,7г 1відфільтрували та розчинили у воді. Суміш підлупіперазиноцтової кислоти, -феніл-4 -[4-[[[[4'жили Na2СО3 та потім екстрагували ДХМ. Органіч(трифторметил)[1,1'-біфеніл]-2ний шар виділили, висушили, відфільтрували та іл]карбоніл]аміно]метил]феніл]-, складного ефіру розчинник випаровували. Залишок тритурували у метилу (проміжна сполука 7). ДІПЕ. Осад відфільтрували та висушили, що дало d) Суміш проміжної сполуки (7) (0,012моль) у N-[4-(1-піперазиніл)феніл]-4'-(трифторметил)-[1,1'НСI (36%; 100мл) перемішували та нагрівали з біфеніл]-2-карбоксамід (проміжна сполука 2). оберненим холодильником протягом ночі, потім c) Суміш проміжної сполуки (2) (0,007моль) та охолодили, зцідили та залишок розчинили у метаNa2СО3 (0,007моль) у ДМФ (50мл) піддали перенолі. Розчинник випаровували. Залишок тритурумішуванню. Метил 2-бромо-2-фенілацетат вали під ДІПЕ, відфільтрували та висушили, що (0,007моль) додали по краплях. Суміш перемішудало 6,2г 1-піперазиноцтової кислоти, -феніл-4вали протягом 4 годин. Розчинник випаровували. [4-[[[[4'-(трифторметил)[1,1'-біфеніл]-2Залишок розчинили у ДХМ. Органічний шар видііл]карбоніл]аміно]метил]феніл]-гідрохлориду (1:1) лили, промили, висушили, відфільтрували та роз(проміжна сполука 8). чинник випаровували. Залишок тритурували у 2Приклад А. 3 пропанолі. Осад відфільтрували та висушили, що а) Суміш 4'-(трифторметил)-[1,1'-біфеніл]-2дало 3,34г метил -феніл-4-[4-[[[4'карбонової кислоти (0,09моль) у ДХМ (500мл) та (трифторметил)[1,1'-біфеніл]-2ДМФ (5мл) піддали перемішуванню. Етандіоіл диіл]карбоніл]аміно]феніл]-1-піперазинацетату (прохлорид (0,09моль) додали по краплях. Суміш пеміжна сполука 3). ремішували протягом 1 години, що дало суміш (А). d) Суміш проміжної сполуки (3) (0,19моль) у Суміш 4-[1-(фенілметил)-4-піперидиніл]НСl (36% ; 100мл) перемішували та нагрівали з бензоламіну (0,046моль) у ДХМ (500мл) та триеоберненим холодильником протягом 5 годин, потиламін (20мл) перемішували на льодовій бані. тім перемішували протягом ночі при кімнатній теСуміш (А) додали по краплях. Суміш перемішувампературі. Осад відфільтрували та тритурували ли та нагрівали з оберненим холодильником пропід 2-пропанолом, відфільтрували та висушили, тягом ночі, потім охолодили та промили водою. що дало 5г моногідрохлориду -феніл-4-[4-[[[4'Органічний шар виділили, висушили, відфільтру(трифторметил)[1,1'-біфеніл]-2вали та розчинник випаровували. Залишок очисіл]карбоніл]аміно]феніл]-1-піперазиноцтової кислотили за допомогою колонкової хроматографії на ти (проміжна сполука 4). силікагелі (елюент: СН2СІ2/СН3ОН 98/2). Чисті Приклад А. 2 фракції зібрали та розчинник випаровували. Заa) Метил 2-бромо-2-фенілацетат (0,1моль) лишок тритурували у ДІПЕ. Осад відфільтрували додавали по краплях до суміші 4-(1та висушили, що дало 5,6г N-[4-[1-(фенілметил)-4піперазиніл)бензонітрилу (0,1моль) та Na2CO3 піперидиніл]феніл]-4'-(трифторметил)-[1,1'(90,15моль) у ДМФ (250мл), перемішували при біфеніл]-2-карбоксаміду (проміжна сполука 9, точкімнатній температурі. Реакційну суміш перемішука плавлення 134°С). вали протягом ночі. Розчинник випаровували. Заb) Суміш проміжна сполука (9) (0,025моль) у лишок розчинили у ДХМ, промили, висушили, відметанолі (250мл) була гідрогенізована при темпефільтрували та розчинник випарували. Залишок ратурі 50°С протягом ночі за допомогою паладію тритурували під ДІПЕ, відфільтрували та висушина вугіллі (10%; 2г) як каталізатором. Після поглили, що дало 26,5г 1-піперазиноцтової кислоти, 4нення водню (1 еквівалент), каталізатор відфільтрували та фільтрат випарювали. Залишок триту(4-ціанофеніл)- -феніл-, складний метиловий ефір рували у ДІПЕ. Осад відфільтрували та висушили, (проміжна сполука 5). що дало 7,7г N-[4-(4-піперидиніл)феніл]-4'b) Суміш проміжної сполуки (5) (0,079моль) у (трифторметил)-[1,1'-біфеніл]-2-карбоксаміду суміші метанолу насиченого NН3 (600мл) була (проміжна сполука 10). гідрогенізована при температурі 14°С протягом c) Суміш проміжної сполуки (10) (0,007моль) та ночі нікелем Ренея (1г) як каталізатором. Після Na2CO3 (0,007моль) у ДМФ (50мл) перемішували поглинення водню (2 еквіваленти), каталізатор при кімнатній температурі. Метил 2-бромо-2відфільтрували та фільтрат випарювали. Залишок фенілацетат (0,007моль) додали по краплях. Сурозчинили у 2-пропанолі. Суміш підкислили суміміш перемішували протягом 3 годин. Розчинник шшю НСI/2-пропанолу та потім перемішували провипаровували. Залишок тритурували під гексаном, тягом ночі. Осад відфільтрували та висушили, що відфільтрували та висушили, що дало 3,37г метил дало 26,7г 1-піперазиноцтовоїкислоти,4-[4-феніл-4-[4-[[[4'-(трифторметил)[1,1'-біфеніл]-2(амінометил)феніл]- -феніл-, гідрохлориду складіл]карбоніл]аміно]-феніл]-1-піперидинацетат (проного метилового ефіру (1:3) 2-пропанолат (1:1) міжна сполука 11, точка плавлення 138°С). (проміжна сполука 6). d) Суміш проміжної сполуки (11) (0,012моль) у c) Перемішували суміш проміжної сполуки (6) 29 76739 30 НСI (36%, 100мл) перемішували та нагрівали з плавлення 124°С). оберненим холодильником протягом 6 годин, поd) Суміш проміжної сполуки (17) (0,0022моль) тім перемішували протягом ночі при кімнатній теу метанолі (100мл) була гідрогенізована при теммпературі. Осад відфільтрували та тритурували пературі 50°С паладій на вугіллі (10%; 0,1г) як капід 2-пропанолом. Осад відфільтрували та висуталізатором у присутності розчину тіофену (4%; 0,1мл). Після поглинення водню (3 еквіваленти), шили, що дало 6,2г -феніл-4-[4-[[[4'каталізатор відфільтрували та фільтрат випарю(трифторметил)[1,1'-біфеніл]-2-іл]карбоніл]вали. Залишок тритурували у гексані. Осад відфіаміно]феніл]-1-піперидиноцтової кислоти моногідльтрували та висушили, що дало 0,7г (±)-метил1рохлориду (проміжна сполука 12). Приклад А. 4 (4-амінофеніл)- -феніл-4-піперидинацетату (проа) Суміш 4-[4-(фенілметил)-1-піперазиніл]міжна сполука 18, точка плавлення 125°С). бензоламіну (0,12моль) у ТГФ (300мл) та триетиe) Суміш 2-(4-терт-бутилфеніл)бензойної кисламіну (50мл) піддали перемішуванню. [1,1'лоти (0,02моль) та тіоніл хлориду (0,04моль) та біфеніл]-2-карбоніл хлорид (0,12моль) додали по ДМФ (5 крапель) у ДХМ (50мл) перемішували та краплях. Суміш перемішували протягом ночі. Рознагрівали з оберненим холодильником протягом 1 чинник випаровували. Залишок розчинили у ДХМ. години. Розчинник випаровували та додали ДХМ Органічний шар виділили, промили, висушили, (2 50мл) та знову розчинник випаровували. Заливідфільтрували та розчинник випаровували. Зашок розчинили у ДХМ (50мл) та додали до розчилишок тритурували у ДІПЕ/2-пропанол. Осад відни проміжної сполуки (18) (0,02моль) та ДІПЕА фільтрували та висушили, що дало 46,5г Ν-[4-[4(0,04моль) у ДХМ (50мл). Реакційну суміш перемі(фенілметил)-1-піперазиніл]феніл]-[1,1'-біфеніл]-2шували при кімнатній температурі протягом 4 гокарбоксамід (проміжна сполука 13, точка плавлендин. Залишок очистили за допомогою колонкової ня 162°С). хроматографії на силікагелі (елюент: b) Суміш проміжної сполуки (13) (0,1моль) у СН2СІ2/СН3ОН 99,5/0,5). Фракції продукту зібрали метанолі (500мл) піддали гідрогенізуванню протята розчинник випаровували. Залишок розчинили у гом 2 годин паладієм на вугіллі (10%; 10г) як ката2-пропанолі та ДІПЕ та перетворили у сіль соляної лізатором. Після поглинення водню (1 еквівалент), кислоти (1:1) НСl/2-пропанолом. Залишок відфількаталізатор відфільтрували та фільтрат випарютрували та висушили, що дало 8,7г 4вали. Залишок тритурували у 2-пропанолі. Осад піперидиноцтової кислоти, 1-[4-[[[4'-(1,1відфільтрували та висушили, що дало 29г Ν-[4-(1диметилетил)[1,1'-біфеніл]-2піперазиніл)феніл]-[1,1'-біфеніл]-2-карбоксаміду іл]карбоніл]аміно]феніл]- -феніл-, гідрохлориду (проміжна сполука 14, точка плавлення 176°С). складного метилового ефіру (1:1) 2-пропанолат Приклад А. 5 (1:1) (проміжна сполука 19). a) Суміш -феніл-4-піперидинацетонітрила f) Проміжна сполука (19) (0,0097моль) у конмоногідрохлорид (0,05моль), 1-фтор-4-нітробензол центрованому розчині НСl (30мл) та діоксан (40мл) (0,06моль) та К2СО3 (0,15моль) у ДМФ (200мл) перемішували та нагрівали з оберненим холодиперемішували при температурі 50°С протягом 4 льником протягом 5 годин, потім охолодили. Осад годин, охолодили, вилили у воду та екстрагували відфільтрували, промили водою та невелику кільДХМ. Органічний шар виділили, промили водою, кість 2-пропанол та висушили, що дало 5г 4висушили, відфільтрували та розчинник випаровупіперидиноцтової кислота, 1-[4-[[[4'-(1,1вали. Залишок кристалізували з ДІПЕ. Осад відфідиметилетил)[1,1'-біфеніл]-2льтрували та висушили, що дало 10,7г (±)-1-(4іл]карбоніл]аміно]феніл]- -феніл-гідрохлориду нітрофеніл)- -феніл-4-піперидинацетонітрил (про(1:1) (проміжна сполука 20). міжна сполука 15, точка плавлення 118°С). Приклад А. 6 b) Суміш проміжної сполуки (15) (0,036моль) у a) ДМФ (0,5мл) додали до розчину 2НВr (48%; 100мл) перемішували та нагрівали з біфенілкарбонової кислоти (0,077моль) у ДХМ оберненим холодильником протягом 3 годин, охо(250мл). Додали тіоніл хлорид (0,154моль). Суміш лодили, вилили у воду та екстрагували двічі ДХМ. перемішували та нагрівали з оберненим холодиОрганічний шар виділили, промили водою, висульником протягом 1 години. Розчинник випаровушили, відфільтрували та розчинник випаровували. вали та потім випаровували двічі ДХМ (100мл). Залишок тритурували 2-пропанолом. Осад відфіЗалишок розчинили у ДХМ (100мл) що дало розльтрували та висушили, що дало 9,5г (±)-1-(4чин (А). Проміжну сполука (18) (0,077моль) та ДІнітрофеніл)- -феніл-4-піперидиноцтової кислоти ПЕА (0,154моль) перемішували у ДХМ (400мл). (проміжна сполука 16, точка плавлення 216°С). Додали розчин (А). Суміш перемішували при кімc) Тіонілхлорид (0,01моль) додали до суміші натній температурі протягом 3 годин та потім пропроміжної сполука (16) (0,0029моль) у ДХМ (10мл). мили водою. Органічний шар виділили, висушили, Суміш перемішували протягом ночі та потім розвідфільтрували та розчинник випаровували, що чинник випаровували. Залишок розчинили у ДХМ дало 44г 4-піперидиноцтовою кислоти, 1-[4-[([1,1'(10мл). Додали метанол (10мл). Суміші витримубіфеніл]-2-ілкарбоніл)аміно]феніл]- -феніл-, склавали протягом 4 годин, потім вилили у розчин дного метилового ефіру (проміжна сполука 21). NaHCO3 та екстрагували ДХМ. Органічний шар b) Суміш проміжної сполуки (21) (0,013моль) у виділили, висушили, відфільтрували та розчинник НСl (36%; 200мл) та діоксан (150мл) перемішували випаровували. Залишок тритурували у гексата нагрівали з оберненим холодильником протяні/ДІПЕ. Осад відфільтрували та висушили, що гом ночі. Реакційну суміш охолодили та додали дало 0,9г (±)-метил1-(4-нітрофеніл)- -феніл-4воду (300мл). Суміш перемішували протягом 1 піперидинацетату (проміжна сполука 17, точка години та відфільтрували. Залишок розчинили у 31 76739 32 ДХМ та МеОН та розчинник випаровували. Залиb) Використовуючи процедуру за Прикладом шок тритурували у ДІПЕ та 2-пропанолі, що дало А. 7 b) проміжну сполуку (25) перетворили у (А)- 3,5г 4-піперидиноцтової кислоти, 1-[4-[([1,1'феніл-1-[4-[[[4'-(трифторметил)[1,1'-біфеніл]-2біфеніл]-2-ілкарбоніл)аміно]феніл]- -феніліл]карбоніл]аміно]-феніл]-4-піперидиноцтової кисгідрохлорид (1:1) (проміжна сполука 22). лоти моногідрохлорид (проміжна сполука 27, точка Приклад А.7 20 17,06 (с=9,67мг/5мл у плавлення 140°С, D a) Тіоніл хлорид (3,6мл) додали до чистого роСН3ОН)). зчину 4'-(трифторметил)-[1,1'-біфеніл]-2c) Використовуючи процедуру за Прикладом карбонової кислоти (0,025моль) у ДМФ (1мл) та ДХМ (100мл). Суміш перемішували та нагрівали з А. 7 b) проміжну сполуку (26) перетворили у (В)- оберненим холодильником протягом однієї години. феніл-1-[4-[[[4'-(трифторметил)[1,1'-біфеніл]-2Розчинник випаровували. ДХМ (50мл) додали до іл]карбоніл]аміно]-феніл]-4-піперидиноцтової кисзалишку, потім випарували. Залишок розчинили у лоти моногідрохлорид (проміжна сполука 28, точка ДХМ (50мл) та розчин додали по краплях до роз20 27,10 (с=11,07мг/5мл у плавлення 135°С, D чину проміжної сполуки (18) (0,025моль) у ДХМ СН3ОН)) (150мл) та ДІПЕА (0,049моль). Реакційну суміш Приклад А. 9 перемішували протягом 2 годин при кімнатній темa) Суміш проміжна сполука (10) (0,019моль) та пературі. Додали воду та цю суміш екстрагували Na2CO3 (0,019моль) у ДМФ (125мл) перемішували двічі. Виділений органічний шар висушили, відфіпри кімнатній температурі. Метил 2-бромо-2льтрували та розчинник випарували. Залишок пефенілацетат (0,01907моль) додали по краплях. ремішували у ДІПЕ, відфільтрували, висушили, та Суміш перемішували протягом 3 годин. Розчинник кристалізували з 2-пропанолу (150мл; пізніше, довипаровували. Залишок поглинули у воді та ДХМ. дали 300мл). Суміш перемішували протягом 2 гоВиділений органічний шар висушили, відфільтрудин при кімнатній температурі. Осад відфільтрували та розчинник випаровували. Залишок очисвали , промили 2-пропанолом та висушили, що тили за допомогою колонкової хроматографії на дало 8,58г метил -феніл-1-[4-[[[4'силікагелі (елюент: СН2СІ2/СН3ОН 100/0; 99,5/0,5) (трифторметил)[1,1'-біфеніл]-2та розділили за допомогою високоефективної рііл]карбоніл]аміно]феніл]-4-піперидинацетат (продинної хроматографії на Chiralpak AD (елюміжна сполука 23). ент:гексан/етанол 70/30) у його енантіомери. Баb) Суміш проміжної сполуки (23) (0,0014моль) жані фракції зібрали та розчинник випаровували, у концентрованій НСl (25мл) та діоксан (20мл) пещо дало 1-піперидиноцтової кислоти, -феніл-4-[4ремішували та нагрівали з оберненим холодиль[[[4'-(трифторметил)[1,1'-біфеніл]-2ником протягом 4 годин, охолодили та вилили у іл]карбоніл]аміно]феніл]-, складний метиловий воду. Суміш екстрагували ДХМ. Органічний шар ефір, (а1А)- (проміжна сполука 29, точка плавленвиділили, висушили, відфільтрували та розчинник випаровували. Залишок тритурували у ДІПЕ. Осад 20 28,86 (с=124,95мг/5мл у ня 158°С, D відфільтрували та висушили, що дало 0,48г СН3ОН)) після кристалізації з 2-пропанолу та 1феніл-1-[4-[[[4'-(трифторметил)[1,1'-біфеніл]-2піперидиноцтової кислоти, -феніл-4-[4-[[[4'іл]карбоніл]аміно]феніл]-4-піперидиноцтової кис(трифторметил)[1,1'-біфеніл]-2лоти моногідрохлорид (проміжна сполука 24, точка іл]карбоніл]аміно]феніл]-, складного метилового плавлення 196°С). Приклад А. 8 ефіру, ( 1В)- (проміжна сполука 30, точка плава) Проміжну сполуку (23) розділили (та очис20 27,69 (с=24,38мг/5мл у лення 160°С, D тили) у її енантіомери хоральної колонкової хроСН3ОН)) після кристалізації з 2-пропанолу. матографії на Chiralcel OD (1000Å, 20мкм, Daicel; b) Використовуючи процедуру за Прикладом елюент: (80/13/7) гексан/етанол/метанол). А. 7 b) проміжна сполуку (29) перетворили у 1Першу фракцію далі очистили за допомогою високоефективної рідинної хроматографії на RP піперидиноцтової кислоти, -феніл-4-[4-[[[4'BDS (Hyperprep C18 (100Å, 8мкм ; елюент:[(0,5% (трифторметил)[1,1'-біфеніл]-2NH4OAc у H2O)/CH3CN 90/10)]/CH3OH/CH3CN (0 іл]карбоніл]аміно]феніл]-, ( 1А) - (проміжна сполухвилин) 30/70/0, (24 хвилини) 0/100/0, (24,01 хви20 35,90 ка 31, точка плавлення 180°С, лин) 0/0/100, (32 хвилини) 30/70/0) та кристалізації D з 2-пропанолу, що дало (Α)- -феніл-1-[4-[[[4'(с=25,21мг/5мл у СН3ОН)). (трифторметил)[1,1'-біфеніл]-2c) Використовуючи процедуру за Прикладом іл]карбоніл]аміно]феніл]-4-піперидинацетат (проА. 7 b) проміжну сполуку (30) перетворили у 1міжна сполука 25). піперидиноцтової кислоти, - феніл-4-[4-[[[4'Другу фракцію далі очистили за допомогою (трифторметил)[1,1'-біфеніл]-2високоефективної рідинної хроматографії на RP іл]карбоніл]аміно]феніл]-, ( 1В)- (проміжна сполука BDS (Hyperprep C18 (100Å, 8мкм ; елюент:[(0,5% 20 35,30 32, точка плавлення 135°С, NHrOAc у H2O)/CH3CN 90/10)]/CH3OH/CH3CN (0 D хвилин) 30/70/0, (24 хвилини) 0/100/0, (24,01 хви(с=23,94мг/5мл у СН3ОН)). лини) 0/0/100, (32 хвилини) 30/70/0) та кристалізаПриклад А. 10 ції з 2-пропанолу, що дало (В)- -феніл-1-[4-[[[4'a) Суміш проміжної сполуки (2) (0,019моль) та (трифторметил)[1,1'-біфеніл]-2Na2CO3 (0,019моль) у ДМФ (125мл) перемішували. іл]карбоніл]аміно]феніл]-4-піперидинацетат (проДодали по краплях метил 2-бромо-2-фенілацетат міжна сполука 26). (0,019моль). Суміш перемішували при кімнатній 33 76739 34 температурі протягом 3 годин. Розчинник випарометилетил)-2-пропанаміну (0,75моль) у ДХМ вували. Залишок перемішували у ДХМ та промили (800мл). Суміш довели до кімнатної температури водою. Виділений органічний шар висушили, відта потім перемішували при кімнатній температурі фільтрували та розчинник випаровували. Залишок протягом ночі під потоком азоту. Суміш тричі проперемішували у ДІПЕ. Осад відфільтрували, вимили водою (800мл). Органічний шар виділили, сушили та розділили за допомогою високоефективисушили, відфільтрували та розчинник випаровувної рідинної хроматографії на Chiralcel OD (елювали, що дало 125г [1,1’-біфеніл]-2-карбоксаміду, ент:гексан/ЕtOН 70/30) її енантіомери. Бажані N-[4-[1-(фенілметил)-4-піперидиніл]феніл] - (профракції зібрали та розчинник випаровували, що міжна сполука 39). b) Суміш проміжної сполуки (39) (0,145моль) у дало 1-піперазиноцтової кислоти, -феніл-4-[4метанолі(500мл) була гідрогенізована при темпе[[[4'-(трифторметил)[1,1'-біфеніл]-2ратурі 50°С протягом двох днів паладієм на вугіллі іл]карбоніл]аміно]феніл]-, складний метиловий (10%; 3г) як каталізатором. Після поглинення водефір, ( 1А)- (проміжна сполука 33) після кристаліню (1 еквівалент), каталізатор відфільтрували та зації з 2-пропанолу, та 1-піперазиноцтової кислоти, фільтрат випарювали. Залишок тритурували у -феніл-4-[4-[[[4'-(трифторметил)[1,1'-біфеніл]-2ДІПЕ. Осад відфільтрували та висушили, що дало іл]карбоніл]аміно]феніл-, складний метиловий 49г [1,1’-біфеніл]-2-карбоксаміду, N-[4-(4ефір, ( 1В)- (проміжна сполука 34) після кристаліпіперидиніл)феніл] - (проміжна сполука 40). зації з 2-пропанолу. c) Перемішували суміш проміжної сполуки (40) b) Використовуючи процедуру за Прикладом (0,0084моль) та Na2СО3 (0,01моль) у ДМФ (150мл). А. 7 b) проміжну сполуку (33) перетворили у 1Метил 2-бромо-2-фенілацетат (0,01моль) додали піперазиноцтової кислоти, -феніл-4-[4-[[[4'по краплях. Суміш перемішували протягом ночі. (трифторметил)[1,1'-біфеніл]-2Розчинник випаровували. Залишок розчинили у іл]карбоніл]аміно]феніл]-, ( 1A) - (проміжна сполуДХМ. Органічний шар виділили, промили, висуши20 60,15 ка 35, точка плавлення 230°С, ли, відфільтрували та розчинник випаровували. D Залишок очистили за допомогою колонкової хро(с=24,52мг/5мл у СН3ОН)). матографії на силікагелі (елюент:ДХМ 100%). Чисc) Використовуючи процедуру за Прикладом ті фракції зібрали та розчинник випаровували. ЗаА. 7 b) проміжну сполуку (34) перетворили у 1лишок тритурували у ДІПЕ. Осад відфільтрували піперазиноцтової кислоти, -феніл-4-[4-[[[4'та висушили, що дало 2,79г 1-піперидиноцтової (трифторметил)[1,1'-біфеніл]-2кислоти, 4-[4-[([1,1’-біфеніл]-21 іл]карбоніл]аміно]феніл]-, ( В)- (проміжна сполука ілкарбоніл)аміно]феніл]- -феніл-, складний мети20 66,37 36, точка плавлення 232°С, ловий ефір (проміжна сполука 41). D d) Проміжну сполуку (41) (0,003моль) у НСl (с=26,52мг/5мл у СН3ОН)). (36%; 25мл) та діоксан (10мл) перемішували та Приклад А. 11 нагрівали з оберненим холодильником протягом а) Метил 2-бромо-2-фенілацетат (0,1моль) ночі. Розчинник випаровували. Залишок тритурудодали по краплях до суміші проміжної сполуки, вали у ДІПЕ та 2-пропанолі; потім рекристалізуващо перемішували (14) (0,07моль) та Na2CO3 (13г) у ли з АЦН. Осад відфільтрували, висушили та очиДМФ (300мл). Суміш перемішували протягом ночі. стили за допомогою високо-ефективної рідинної Розчинник випаровували. Залишок кристалізували хроматографії на RP BDS СІ8 (елюент:(0,5 % з метанолу. Осад відфільтрували та висушили, що NH4OAc у H2O/CH3CN 90/10)/MeOH/CH3CN 75/25/0; дало 30,2г метил 4-[4-[([1,1'-біфеніл]-20/50/50; 0/0/100). Чисті фракції зібрали та розчинілкарбоніл)аміно]феніл]- -феніл-1ник випаровували. Залишок тритурували у ДІПЕ, піперазинацетату (проміжна сполука 37, точка що дало 0,5г 1-піперидиноцтової кислоти, '4-[4плавлення 125°С). [([1,1’-біфеніл]-2-ілкарбоніл)аміно]феніл]- -феніл b) Суміш проміжної сполуки (37) (0,053моль) у (проміжна сполука 42). НСl (36%; 300мл) перемішували та нагрівали з Оцтової кислоти, [[феніл[1-[4-[[[4'оберненим холодильником протягом 2 днів, охо(трифторметил)[1,1’-біфеніл]-2-іл]карбоніл]лодили, відфільтрували та висушили. Залишок аміно]феніл]-4-піперидиніл]ацетил]аміно] - (промітритурували у 2-пропаноні. Осад відфільтрували жна сполука 45) одержали аналогічно за допомота висушили, що дало 21,5г гідрохлориду -фенілгою гідролізування сполуки (18) відповідно до про4-[4-[([1,1’-біфеніл]-2-ілкарбоніл)аміно]феніл]-1цедури описаної вище. піперазиноцтової кислоти (1:2) 2-пропанолат (1:1) Оцтової кислоти, [[феніл[4-[4-[[[4'(проміжна сполука 38). (трифторметил)[1,1'-біфеніл]-2Приклад А. 12 іл]карбоніл]аміно]феніл]-1a) 2-біфенілкарбонову кислоту (0,25моль) розпіперазиніл]ацетил]аміно] - (проміжна сполука 46) чинили у ДХМ (500мл) та ДМФ (0,5мл). Додали по одержали аналогічно за допомогою гідролізування краплях тіоніл хлорид (0,51моль). Суміш перемісполуки (12) відповідно до процедури описаної шували та нагрівали з оберненим холодильником вище. протягом 1 години під потоком азоту. Розчинник Приклад А. 13 випаровували. Двічі додали ДХМ (500мл). РозчинСуміш метил 2-гідроксиацетату (0,2моль) у ник двічі випаровували. Залишок розчинили у ДХМ ТГФ (100мл) перемішували у льодовій бані. 2(200мл) та потім додали по краплях при темперахлоро-2-фенілацетил хлорид (0,132моль) додали турі 0°С до суміші 4-[1-(фенілметил)-4по краплях. Суміш перемішували протягом ночі, піперидиніл]-бензоламіну (0,25моль) та N-(1вилили у воду та потім перемішували протягом 20 35 76739 36 хвилин. Суміш екстрагували ДІПЕ. Органічний шар рненим холодильником до повного розчинення виділили, висушили, відфільтрували та розчинник (приблизно 3 години). Розчинник випаровували. випаровували, що дало 30г бензолоцтової кислоЗалишок розчинили у ДХМ (200мл). Додали метанол (50мл). Суміш перемішували протягом 1 годити, -хлоро-, 2-метокси-2-оксоетиловий складний ни, нейтралізували за допомогою розчину ефір (проміжна сполука 43). NaHCO3. Виділений органічний шар висушили, Приклад А. 14 відфільтрували та розчинник випаровували. ЗаСуміш -бромофенілоцтову кислоту (0,1моль) лишок розчинили у СН3ОН/ДІПЕ та перетворили у та тіоніл хлорид (0,1моль) у ДХМ (100мл) та ДМФ сіль соляної кислоти (1:1) за допомогою НСl/2(5крапель) перемішували та нагрівали з обернепропанол. Утворений осад відфільтрували, висуним холодильником протягом 1 години. Розчинник шили, перетворили назад у вільну основу за довипаровували. Три рази додали ДХМ (100мл). Ропомогою розчину NaHCO3 та розділили у енантіозчинник випаровували. Залишок розчинили у ДХМ мери на Chiralcel OJ (елюент:метанол). Бажані (100мл). Суміш охолодили на льоді. Додали гідро фракції зібрали та розчинник випаровували. Кожна хлорид метил гліцинату (0,1моль). Суміш переміз цих фракцій поглинули у СН3ОН/ДІПЕ та перетшували при кімнатній температурі протягом 2 говорили у сіль соляної кислоти за допомогою НСl/2дин. Додали насичений розчин NаНСО3. Суміш пропаноле, що дало 16,9г (А)- -феніл-1перемішували при кімнатній температурі протягом (фенілметил)-4-піперидиноцтової кислоти, гідрохдвох днів. Органічний шар виділили, висушили, лорид складного метилового ефіру (1:1) (проміжна відфільтрували та розчинник випаровували. Засполука 50); точка плавлення 189,9-190,0°С та лишок тритурували у ДІПЕ. Осад відфільтрували 12,2г (В)- -феніл-1-(фенілметил)-4та висушили, що дало 17,8г оцтової кислоти, [(бромофенілацетил) аміно]-, складний метиловий піперидиноцтової кислоти, гідрохлорид складного ефір (проміжна сполука 44). метилового ефіру (1:1) (проміжна сполука 51); точПриклад А. 15 ка плавлення 192,3-193°С. a) Суміш 1-бензил-4-(p-бромофеніл)-4b) Суміш проміжної сполуки (50) (0,047моль) у піперидинол гідрохлориду (0,23моль) та Cu2O (2г) метанолі (250мл) була гідрогенізована при кімнату ΝΗ4ΟΗ (500мл) перемішували при 180°С протяній температурі за допомогою паладію на вугіллі гом 12 годин. Суміш охолодили, екстрагували ДХМ (10%, 2г) як каталізатором (2г). Після поглинення та промили водою. Органічний шар висушили, водню (1 еквівалент), каталізатор відфільтрували відфільтрували та випарили, що дало 60г 4та фільтрат випарювали. Залишок тритурували під [1,2,3,6-тетрагідро-1-(фенілметил)-42-пропанолом, відфільтрували та висушили, що піридиніл]бензоламіну (проміжна сполука 47). дало 11,5г (90 %) продукту. Фільтрат випарювали, b) 4'-(трифторметил)-[1,1'-біфеніл]-2-карбоніл що дало 1,1г (А)- -феніл-4-піперидиноцтової кисхлорид (0,12моль) додавали по краплях до суміші лоти, гідрохлорид складного метилового ефіру проміжної сполуки (47) (0,095моль), що перемішу(1:1) (проміжна сполука 52). вали у ДХМ (300мл) та триетиламіну (50мл). Суc) Суміш проміжної сполуки (52) (0,046моль), міш перемішували протягом ночі, вилили у воду та 1-фтор-4-нітробензол (0,05моль) та гідрокарбонат потям перемішували протягом 30 хвилин. Органічнатрію (0,15моль) у Ν,Ν-диметилформаміді ний шар виділили, промили, висушили, відфільт(100мл) перемішували протягом 4 годин при темрували та розчинник випаровували. Залишок трипературі 50°С, потім охолодили та додали воду. турували у ДІПЕ. Осад відфільтрували та Цю суміш екстрагували СН2СІ2. Об'єднані органічні висушили, що дало N-[4-[1,2,3,6-тетрагідро-1шари промили водою, висушили, відфільтрували (фенілметил)-4-піридиніл]феніл]-4'та розчинник випарували. Залишок тритурували (трифторметил)-[1,1'-біфеніл]-2-карбоксамід (пропід ДІПЕ/гексаном, відфільтрували та висушили, міжна сполука 48). що дало 14г (86%) (А)-1-(4-нітрофеніл)- -феніл-4c) 1-хлороетил хлорформіат (0,078моль) допіперидиноцтової кислоти, складний метиловий дали по краплях до перемішаної суміші проміжної ефір (проміжна сполука 53); точка плавлення сполуки (48) (0,039моль) у 1,2-дихлоретані 105,2-105,3°С. (500мл). Суміш перемішували протягом 30 хвилин d) Суміш проміжної сполуки (53) (0,025моль) у та потім перемішували та нагрівали з оберненим соляній кислоті (концентрованої) (100мл) переміхолодильником протягом ночі. Розчинник випарошували та нагрівали з оберненим холодильником вували. Додали метанол (500мл). Суміш переміпротягом 16 годин, потім охолодили та отриманий шували та нагрівали з оберненим холодильником осад відфільтрували, промили водою (3 рази) та протягом ночі. Розчинник випаровували. Залишок висушили, що дало 8,77г (91%) гідрохлорид (А)-1тритурували у ДІПЕ. Осад відфільтрували та ви(4-нітрофеніл)- -феніл-4-піперидиноцтової кислосушили, що дало 20,8г N-[4-(1,2,3,6-тетрагідро-4ти (1:1) (проміжна сполука 54); точка плавлення піридиніл)феніл]-4'-(трифторметил)-[1,1'-біфеніл]196,4-196,5°С. 2-карбоксаміду (проміжна сполука 49). e) Суміш проміжної сполуки (54) (0,013моль), Приклад А. 16 гідрохлорид складного метилового ефіру амінооца) -феніл-1-(фенілметил)-4-піперидиноцтової тової кислоти (1:1) (98%) (0,026моль), 1кислоти гідробромід (1:1) (0,13моль) перемішували гідроксибензотриазол (0,015моль) та 2,6у ДХМ (300мл). Додали тіоніл хлорид (0,15моль). диметилпіридин (0,052моль) у СН2СІ2 (100мл) підРеакційну суміш перемішували та нагрівали з обедали перемішуванню. Додали Ν,Ν'рненим холодильником протягом 1 години. Додали метантетраілбіс-2-пропанамін (0,026моль). Реакдодаткову кількість тіоніл хлориду (0,15моль) та ційну суміш перемішували протягом 48 годин при реакційну суміш перемішували та нагрівали з обекімнатній температурі. Суміш промили Н2О. Виді 37 76739 38 лений органічний шар висушили, відфільтрували метил гідрохлорид гліцинату (0,008моль) та триета розчинник випаровували. Залишок тритурували тиламіну (0,025моль) у ДХМ (50мл) піддали перепід 2-пропанолом. Осад відфільтрували та висумішуванню та охолоджували при температурі шили, що дало 4,37г (80%) (В)-N-[[1-(425°С. Додали РуВОР (0,005моль) та реакційну нітрофеніл)-4суміш перемішували протягом 4 годин при темпепіперидиніл]фенілацетил]амінооцтової кислоти ратурі -25°С. Суміші дозволили нагрітися до кімнаскладний метиловий ефір (проміжна сполука 55); тної температури. Залишок очистили за допомоточка плавлення 165,4-165,5°С. гою колонкової хроматографії на силікагелі f) Суміш проміжної сполуки (55) (0,01моль) у (елюент:СН2СІ2/СН2ОН 100/0; 99/1). Фракції продуметанолі (250мл) була гідрогенізована при темпекту зібрали та розчинник випаровували. Залишок ратурі 14°С за лопомогою паладію на вугіллі (10% тритурували під ДІПЕ, відфільтрували, промили 22г) як каталізатором у присутності тіофену (4%) пропанолом/Н2О (50/50; три рази) та висушили, що (2мл). Після поглинення водню (3 еквівалента), дало 2,1г оцтової кислоти, [[[1-[4-[[[4'-(1,1каталізатор відфільтрували та фільтрат випарюдиметилетил)[1,1'-біфеніл]-2вали, що дало 3,81г (кількісний вихід) (В)-N-[[1-(4іл]карбоніл]аміно]феніл]амінофеніл)-44піперидиніл]фенілацетил]аміно]-, гідрату складпіперидиніл]фенілацетил]амінооцтової кислоти ного метилового ефіру (1:1) 2 пропанолат (1:1) складний метиловий ефір (проміжна сполука 56); (сполука 22). Приклад В. 3 20 31,37 (с=10,20мг/5мл у ДМФ). D Суміш сполуки (22) (0,00072моль) у концентВ. Синтез кінцевих сполук рованій НСI (20мл) та діоксан (30мл) перемішуваПриклад В. 1 ли та нагрівали з оберненим холодильником. РозСуміш проміжної сполуки (2) (0,0117моль) та чинник випаровували та додали 2-пропанол та Na2CO3 (0,0141моль) у ДМФ (100мл) перемішувазнову розчинник випаровували. Процедуру повтоли при кімнатній температурі. Додали по краплях рили, реакційну суміш перемішували та нагрівали розчин проміжної сполуки (43) (0,0141моль) у ДМФ з оберненим холодильником протягом 2 годин, (80мл). Суміш перемішували при кімнатній темпеохолодили та екстрагували двічі ДХМ. Виділені ратурі протягом 20 годин. Розчинник випаровуваорганічні шари висушили, розчинник випаровували ли. Залишок перемішували у ДХМ (150мл). Оргата залишок тритурували під етил ацетатом, відфінічний шар промили водою, промили насиченим льтрували та висушили, що дало 0,22г оцтової розчином NaHCO3 та промили водою. Об'єднаний кислоти, [[[1-[4-[[[4'-(1,1-диметилетил)[1,1'-біфеніл]органічний шар висушили, відфільтрували та роз2-іл]карбоніл]аміно]феніл]-4чинник випаровували. Залишок очистили за допопіперидиніл]фенілацетил]аміно]-гідрохлорид (1:1) могою колонкової хроматографії на силікагелі гідрат (1:1) (сполука 25). (елюент: СН2СІ2/СН3ОН 99/1). Бажані фракції зібСполука (23) була одержана аналогічно почирали та розчинник випаровували. Залишок перенаючи з сполуки (15) використовуючи спосіб як мішували у ДІПЕ (150мл). Суміш нагріли для нагріописано вище. вання з оберненим холодильником та додали 2Приклад В. 4 пропанол (30мл) та ДХМ (5мл). Суміш перемішуСуміш проміжної сполуки (20) (0,0034моль), вали та нагрівали з оберненим холодильником до етиламін (0,07моль; 2М у ТГФ), Ν,Ν-диметил-4повного розчинення, потім довели до кімнатної піридинамін (0,001моль) та триетиламін температури. Суміш перемішували при кімнатній (0,0034моль) у ДХМ (100мл) перемішували при температурі протягом 60 годин. Осад відфільтрукімнатній температурі. Додали гідрохлорид 1-етилвали та висушили у вакуумі при температурі 50°С, 3-(3-диметиламінопропіл)карбодііміду (ЕДАП) що дало 3,32г 2-метокси-2-оксоетилα-феніл-4-[4(0,007моль) та суміш перемішували при кімнатній [[[4'-(трифторметил)[1,1'-біфеніл]-2температурі протягом 6 годин, потім промили воіл]карбоніл]аміно]феніл]-1-піперазинацетат (сполудою. Виділений органічний шар висушили, відфіка 14, точка плавлення 106°С). льтрували та розчинник випаровували. Залишок Сполука (12, точка плавлення 132°С) була очистили за допомогою колонкової хроматографії одержана аналогічно, за допомогою реакції проміна силікагелі (елюент: СН2СІ2/СН3OН, градіжної сполуки (2) з проміжною сполукою (44) викоєнт:100/0; 99/1; 98/2) що дало4'-(1,1-диметилетил)ристовуючи спосіб як описано вище. N-[4-[4-[2-(етиламіно)-2-оксо-1-фенілетил]-1Сполука (13) була одержана аналогічно, за піперидиніл]феніл]-[1,1'-біфеніл]-2-карбоксамід, та допомогою реакції проміжної сполуки (14) з промі4-фтор-N-[4-(1-піперидиніл)феніл]-бензамід (спожною сполукою (44) використовуючи спосіб як лука 24). описано вище. Приклад В. 5 Сполука (15) була одержана аналогічно, за Суміш проміжної сполуки (4) (0,00016моль), допомогою реакції проміжної сполуки (10) з проміРуВОР (0,00032моль) та триетиламін (0,1мл) у жною сполукою (44) використовуючи спосіб як ДХМ (5мл) перемішували протягом 30 хвилин. Доописано вище. дали етаноламін (0,0005моль) та реакційну суміш Сполука (16) була одержана аналогічно, за перемішували протягом ночі при температурі допомогою реакції проміжної сполуки (14) з промі40°С. Реакційну суміш охолодили. Додали воду жною сполукою (43) використовуючи спосіб як (2мл) та суміш перемішували протягом 15 хвилин, описано вище. потім відфільтрували крізь Extrelut , та бажану Приклад В. 2 сполуку виділили за допомогою рідинної хроматоСуміш проміжної сполука (20) (0,0041моль), графії високого тиску, що дало сполуку (1). 39 76739 40 Приклад В. 6 хвилин) 10/90, (16 хвилин) 0/100, (18,10-20,00 хвиСуміш проміжної сполуки (4) (0,000079моль), лин) 85/15), що дало 1-піперидиноцтової кислоти, 1,1'-карбонілбіс-1Н-імідазолу (0,00024моль) та -феніл-4-[4-[[[4'-(трифторметил)[1,1'-біфеніл]-2триетиламіну (0,00032моль) у ДХМ (5мл) перемііл]карбоніл]аміно]феніл]-,2-стокси-1-метил-2шували протягом 30 хвилин. Цей розчин додали оксоетиловий складний ефір (сполука 111). до (S)-лейциновий гідрохлорид складного метилоПриклад В. 9 вого ефіру (0,00016моль). Реакційну суміш трясли 2-бромоетанол (1,2 еквівалента, 0,00010моль) протягом 20 годин при кімнатній температурі, пододали до суміші проміжної сполуки (24) тім протягом 5 годин при температурі 40°С. Дода(0,000084моль) у ДМФ (5мл) та CsCO3 ли додаткову кількість (S)-лейцинового гідрохло(0,00018моль) та реакційну суміш перемішували риду складного метилового ефіру (0,00008моль) у протягом 3 годин при температурі 70°С. Розчинник ДХМ (1мл, на кількість) та реакційну суміш трясли випаровували. Залишок розділили між водою та протягом 5 годин при температурі 40°С. Реакційній ДХМ. Розчинники екстрагування випарили. Залисуміші дозволили охолодитися до кімнатної темшок очистили за допомогою рідинної хроматограператури, відфільтрували та фільтрат зібрали, фії високого тиску (Водяна колонка, with Xterra MS потім промили водою (2мл). Цю суміш відфільтруC18; елюент:[(0,5% NH4OAc у H2O)/CH3CN вали крізь Extrelut та Extrelut -фільтри були 90/10)]/CH3CN (0 хвилин) 85/15, (10 хвилин) 10/90, (16 хвилин) 0/100, (18,10-20,00 хвилин) 85/15). промиті ДХМ (2 3мл). Фільтрати були очищені Фракції продукту зібрали та органічний розчинник рідинною хроматографією високого тиску (елюент: випарили. Водні концентрати були екстраговані та СН2СІ2/СН3ОН 90/100). Фракції продукту зібрали та розчинники екстрагування випарили, що дало 4розчинник випаровували, що дало 0,041г пентанової кислоти, 4-метил-2-[[феніл[4-[4-[[[4'піперидиноцтової кислоти, -феніл-1-[4-[([4'(трифторметил)[1,1'-біфеніл]-2(трифторметил)[1,1'-біфеніл]-2іл]карбоніл]аміно]феніл]-1іл]карбоніл]аміно]феніл]-, 2-гідроксиетиловий піперазиніл]ацетил]аміно]-, складний метиловий складний ефір (сполука 134). ефір, (2S)- (сполука 26). Приклад В. 10 Приклад В. 7 Суміш проміжної сполуки (40) (0,00014моль), Суміш проміжної сполуки (12) (0,000084моль), проміжної сполуки (44) (0,00016моль) та Na2CO3 РуВОР (0,00034моль) та триетиламін (0,00016моль) у ДМФ (5мл) перемішували протя(0,00034моль) у ДХМ (5мл) перемішували протягом ночі при температурі 60°С. Розчинник випарогом 30 хвилин при кімнатній температурі. Цей чисвували. Залишок розчинили у ДХМ (10мл), промитий розчин додали до (S)-лейцинового гідрохлоли водою (2мл), відфільтрували крізь Extreme та риду складного метилового ефіру (0,00017моль). фільтрат випарювали. Залишок очистили за допоРеакційна суміш трясли протягом 24 годин при могою рідинної хроматографії високого тиску. температурі 40°С. Реакційну суміш відфільтрували Фракції продукту зібрали та розчинник випаровута залишок зібраний на фільтрі промили один раз вали, що дало 0,052г оцтової кислоти, [[[4-[4-[([1,1'4мл ДХМ. До фільтрату, додали воду (2мл) та субіфеніл]-2-ілкарбоніл)аміно]феніл]-1міш перемішували протягом 30 хвилин. Суміш віпіперидиніл]фенілацетил]аміно]-, складний метиловий ефір (сполука 17). дфільтрували крізь Extrelut та залишок зібраний Сполуку (142) було одержано аналогічно, за на фільтрі промили 2 рази ДХМ (3мл). Фільтрат допомогою реакції проміжної сполуки (44) з промівипарювали та залишок очистили за допомогою жної сполуки (49) використовуючи спосіб як описарідинної хроматографії високого тиску (Водяна но вище. колонка, з Xterra MS С18; елюент:[(0,5 % NH4OAc у Приклад В. 11 Н2О)/CH3CN 90/10)]/CH3OH/CH3CN (0 хвилин) Суміш проміжної сполуки (24) (0,000084моль), 75/25/0, (10 хвилин) 0/50/50, (16 хвилин) 0/0/100, РуВОР (0,00017моль) та триетиламін (0,5мл) у (18,10-20,00 хвилин) 75/25/0), що дало пентанової ДХМ (5мл) перемішували протягом 60 хвилин при кислоти, 4-метил-2-[[феніл[4-[4-[[[4'кімнатній температурі. Додали метил гідроксиаце(трифторметил)[1,1'-біфеніл]-2тат (0,0001моль) та реакційну суміш перемішували іл]карбоніл]аміно]феніл]-1протягом 3 годин при температурі 40°С, потім пропіперидиніл]ацетил]аміно]-, складний метиловий тягом двох днів при кімнатній температурі. Додали ефір, (25)- (сполука 64). воду (2мл). Суміш перемішували протягом 15 хвиПриклад В. 8 лин, потім відфільтрували крізь Extrelut та оргаЕтил 2-бромпропіонат (0,0001моль) додали до суміші проміжної сполуки (12) (0,000084моль) та нічний фільтрат випарили. Залишок очистили за три-н-бутилтіосечовини (ТБТС) (0,000168моль) у допомогою рідинної хроматографії високого тиску. ДІПЕА (4мл). Реакційна суміш трясли протягом 2 Фракції продукту зібрали та розчинник випаровугодин при температурі 70°С. Реакційну суміш оховали, що дало 4-піперидиноцтової кислоти, лодили до кімнатної температури, відфільтрували феніл-1-[4-[[[4'-(трифторметил)[1,1'-біфеніл]-2та фільтрат випарювали. Залишок розчинили у іл]карбоніл]аміно]-феніл]-, 2-метокси-2-оксоетил ДХМ (4мл), потім промили водою (2мл). Суміш складний ефір (сполука 20). відфільтрували крізь Extrelut та залишок зібраПриклад В. 12 Суміш сполуки (97) (0,00081моль), ДХМ (15мл) ний на фільтрі промили ДХМ (2 3мл). Фільтрат та трифтороцтової кислоти (5мл) перемішували випарювали. Залишок очистили за допомогою при кімнатній температурі протягом 2 годин. Розрідинної хроматографії високого тиску (Водяна чинник випаровували. Додали ДХМ та випарювали колонка, з Xterra MS C18; елюент:[(0,5% NH4OAc у (тричі). Залишок перемішували у ДІПЕ. Осад відH2O)/CH3CN 90/10)]/CH3CN (0 хвилин) 85/15, (10 41 76739 фільтрували, висушили та очистили за допомогою високоефективної рідинної хроматографії на гіперприготовленому С18 BDS (елюент:(0,5% NH4OAc у H2O/CH3CN 90/10)/CH3OH/CH3CN 45/35/20; 8/47/45; 0/0/100). Бажані фракції зібрали та розчинник випаровували. Залишок перемішували у ДІПЕ. Осад відфільтрували, промили ДІПЕ та висушили, що дало сполуку (143). Приклад В. 13 4'-(1,1-диметилетил)-[1,1'-біфеніл]-2-карбонову кислоту, (0,011моль) перемішували у ДХМ (100мл). Додали тіоніл хлорид (0,022моль). Додали ДМФ (3 краплі) та реакційну суміш перемішували та нагрівали з оберненим холодильником протягом однієї години. Реакційну суміш охолодили та розчинник випаровували. Додали ДХМ (100мл) та розчинник знову випаровували. Залишок розчинили у ДХМ (50мл) та цей розчин додали до розчину проміжної сполуки (56) (0,0097моль) у ДХМ (50мл). Суміш перемішували. Додали гідрокарбонат натрію (насичений водний розчин) (50мл) та суміш перемішували протягом 2 годин при кімнатній температурі. Шари розділили. Органічний шар висушили, відфільтрували та розчинник випарували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3OН 98/2). Фракції продукту зібрали та розчинник випаровували. Залишок кристалізували з 2пропанолу/ДІПЕ, відфільтрували та висушили (вакуум, 50°С), що дало 5,27г продукту. Цю фракцію висушили (вакуум, 80°С, протягом двох днів), що дало 4,95г (В)-N-[[1-[4-[[[4'-(1,1-диметилетил)[1,1'біфеніл]-2-іл]карбоніл]аміно]феніл]-4піперидиніл]фенілацетил]-амінооцтової кислоти складний метиловий ефір (сполука 145); точка плавлення 119,9-120°С. У Таблиці F-1 показані сполуки одержані відповідно до одного з вищезгаданих Прикладів. Наступні скорочення використовувалися у таблицях : -С3Н8О позначає сіль 2-пропанолату. 42 43 76739 44 45 76739 46 47 76739 48 С. Фармакологічні приклади С. 1. Кількісне визначення секреції АроВ Клітини HepG2 культувують на 24-лункових планшетах у мінімальному суттєвому середовищі Rega 3, що містить 10% сироватки плоду корови. При показнику злиття клітин 70% середовище заміняють і додають досліджувану сполуку чи носій (диметилсульфоксид, кінцева концентрація 0,4%). Після 24 годин інкубування середовище переносять до пробірок Епендорфа та очищають центрифугуванням. До надосадної рідини додають антитіло вівці, спрямоване проти будь-якого ароВ, і суміш тримають при 8°С протягом 24 годин. По 49 76739 50 тім додають анти-овече антитіло кроля і імунному C.2. Аналіз на МПТ комплексу дають випасти до осаду протягом 24 Активність МПТ вимірювали з використанням годин при 8°С. Імунопреципітат збирають центриметоду аналізу, аналогічного до описаного [J.R. фугуванням протягом 25 хвилин при 1320g та Wetterau and D.B. Zilversmit y Chemistry and промивають двічі буфером, що містить 40мМ 4Physics of Lipids (1985) 38, 205-222]. Для вигоювморфолінпропансульфонової кислоти, 40мМ лення донорних та акцепторних везикул відповідні NaH2PO4, 100мМ NaF, 0,2мМ дитіотреїту, 5мМ ліпіди у хлороформі поміщають у скляну пробірку етилендіамінтетраоцтової кислоти, 5мМ етиленга висушують у потоці азоту. До висушеного ліпіду біс(оксиетиленнітрило)тетраоцтової кислоти, 1% додають буфер, який містить 15мМ Трис-НСІ рН Triton-X-100, 0,5% дезоксихолату натрію, 0,1% 7,5. 1мМ етилендіамінтетраоцтової кислоти, 40мМ додецилсульфату натрію, 0,2мкМ лейпептину та NaCl, 0,02% NaN3 (буфер для аналізу). Суміш не0,2мкМ фенілметилсульфонілфториду. Радіоактидовго перемішували вихровим змішувачем і ліпіди вність осаду вимірюють кількісно за допомогою залишали для гідратації протягом 20 хвилин на рідинного сцинтиляційного лічильника. льоді. Після цього готувати везикули шляхом Одержані значення ІС50 приведені у Таблиці озвучування бані (за допомогою пристрою Branson С1. 2200) при кімнатній температурі протягом не більш ніж 15 хвилин. Всі препарати везикул включають бутилований гідрокситолуол в концентрації 0,1%. Суміш для аналізу перенесення ліпідів містить донорні везикули (40нмоль фосфатидилхоліну, 7,5мол.% кардіоліпіну та 0,25мол.% гліцерин три[1-14С]-олеату), акцепторні везикули (240нмоль фосфатидилхоліну) та 5мг бичачого сироваточного альбуміну у загальному об'ємі 675мкл у пробірці мікроцентрифуги на 1,5мл. Дослідні сполуки додають розчиненими у диметилсульфоксиді (кінцева концентрація 0,13%). Після 5 хвилин попереднього інкубування при 37°С, реакцію починають додаванням МПТ у 100мкл буфера для діалізу. Реакцію припиняють додаванням 400мкл діетиламіноалкіл (БЕАЕ)-52-целюлози (Sephadex), попередньо видержаної у 15мМ Трис-НСІ (рН 7,5), 1мМ етилендіамінтетраоцтовій кислоті та 0,02% NaN3, (1:1 об./об.). Суміш перемішують протягом 4 хвилин та центрифугують протягом 2 хвилин на максимальній швидкості у центрифузі Eppendorf (4°С), збираючи осад донорних везикул. зв'язаних з DEAE-52. Здійснюють виміри [14С]-радіоактивності для аліквоти надосадної рідини, що містить акцепторні ліпосоми, і результати використовують для обчислення частки тригліцериду, перенесеного від донорних везикул до акцепторних. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюLipid-decreasing biphenylcarboxamide compounds, methods for their synthesis (variants), pharmaceutical compositions and methods for their manufacture
Автори англійськоюMeerpoel Lieven
Назва патенту російськоюБифенилкарбоксамиды, снижающие содержание липидов, способ их получения (варианты), фармацевтическая композиция на их основе и способы ее получения
Автори російськоюМеерпоель Ливен
МПК / Мітки
МПК: A61K 31/495, A61P 1/18, A61P 3/06, C07D 401/12, A61P 3/04, A61K 31/454, C07K 5/06, A61K 31/445, C07D 405/12, A61K 31/5377, A61K 31/4525, C07D 295/14, C07D 211/70, C07D 295/15, C07D 211/34, C07D 211/26, A61P 9/10, A61P 3/10
Мітки: фармацевтична, композиція, спосіб, ліпідзнижуючі, варіанти, основі, біфенілкарбоксаміди, одержання
Код посилання
<a href="https://ua.patents.su/25-76739-lipidznizhuyuchi-bifenilkarboksamidi-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Ліпідзнижуючі біфенілкарбоксаміди, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі та спосіб її одержання</a>
Попередній патент: Водна композиція концентрату у вигляді суспензії та гербіцидна композиція на її основі
Наступний патент: Спицефіксатор жеребного
Випадковий патент: Синтетико-металевий антифрикційний композит