Похідні піроло[3,2-d]-піримідин-4-ону та їх застосування у терапії
Номер патенту: 89968
Опубліковано: 25.03.2010
Автори: Ло-Альфредссон Івонн, Беґевіґ Андерс, Тіден Анна-Карін, Півонка Доналд
Формула / Реферат
1. Сполука формули (І)
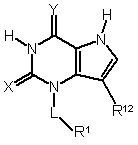 , (I)
, (I)
де:
принаймні один з Х та Y - S, а інший - О або S;
L - безпосередній зв'язок або С1-7алкілен, вказаний алкілен, як варіант, містить гетероатом, вибраний з О, S(O)n та NR6, вказаний алкілен, як варіант, містить один або два подвійні зв'язки карбон-карбон, і вказаний алкілен, як варіант, заміщено одним або більше замісниками, незалежно вибраними із групи: ОН, галоген, CN та NR4R5, C1-6алкіл та C1-6алкоксил, вказаний алкоксил, як варіант, містить поруч з оксигеном карбоніл;
n - ціле число 0,1 або 2;
R1 - гідроген або
і) насичене або частково ненасичене 3-7-членне кільце, яке, як варіант, містить один або два гетероатоми, вибрані незалежно з О, N та S, яке, як варіант, містить карбоніл, та, як варіант, заміщене одним або більше замісниками, незалежно вибраними із групи: галоген, SO2R9, SO2NR9R10, ОН, С1-7алкіл, С1-7алкоксил, CN, CONR2R3, NR2СOR3 та COR3, вказаний алкоксил, як варіант, крім того заміщено C1-6алкоксилом, а вказаний алкоксил, як варіант, містить поруч з оксигеном карбоніл, і вказаний алкіл, як варіант, крім того заміщено гідроксилом або C1-6алкоксилом, а вказаний алкіл або алкоксил, як варіант, містить карбоніл поруч з оксигеном або на будь-якій позиції в алкілі;
або
іі) ароматична кільцева система, вибрана з фенілу, біфенілу, нафтилу або моноциклічної або біциклічної гетероароматичної кільцевої структури з вмістом 1-3 гетероатомів, незалежно вибраних з О, N та S, вказану ароматичну кільцеву систему, як варіант, заміщено одним або більше замісниками, незалежно вибраними із групи: галоген, SO2R9, SO2NR9R10, ОН, С1-7алкіл, С1-7алкоксил, CN, CONR2R3, NR2СOR3 та COR3;
вказаний алкоксил, як варіант, крім того заміщено C1-6алкоксилом, а вказаний алкоксил, як варіант, містить поруч з оксигеном карбоніл та, як варіант, крім того заміщений гідроксилом або С1-6алкоксилом, а вказаний алкіл або алкоксил, як варіант, містить карбоніл поруч з оксигеном або на будь-якій позиції в алкілі;
R12 - гідроген, галоген або карбон, як варіант, заміщений одним-трьома атомами галогену;
у кожному випадку R2, R3, R4, R5, R6, R9 та R10, незалежно, - гідроген, С1-6алкіл або С1-6алкоксил, вказаний алкоксил, як варіант, містить поруч із оксигеном карбоніл, вказаний алкіл, як варіант, крім того заміщено галогеном, С1-6алкоксилом, СНО, С2-6алканоїлом, ОН, CONR7R8 та NR7COR8;
або групи NR2R3, NR4R5 та NR9R10, кожна незалежно, - 5-7-членне насичене азациклічне кільце, яке, як варіант, містить один додатковий гетероатом, вибраний з О, S та NR11, вказане кільце, як варіант, крім того заміщено галогеном, С1-6алкоксилом, СНО, С2-6алканоїлом, ОН, CONR7R8 та NR7COR8;
у кожному випадку R7, R8 та R11, незалежно, - гідроген чи С1-6алкіл, або група NR7R8 - 5-7-членне насичене азациклічне кільце, яке, як варіант, містить один додатковий гетероатом, вибраний з О, S та NR11;
та її фармацевтично прийнятні солі;
за умови, що виключені сполуки 1-b-D-рибофуранозил-2-оксопіроло[3,2-d]піримідин-4(3Н,5Н)-тіон, 1-(2,3,5-три-О-бензоїл-1-b-D-рибофуранозил)-2-оксопіроло[3,2-d]піримідин-4(3Н,5Н)-тіон та 5,7-димеркапто-1,4,6-триазаінден.
2. Сполука за п. 1, де R1 - гідроген.
3. Сполука за п. 1 або 2, де Х - S, a Y - О.
4. Сполука за п. 1 або 2, де Y - S, а Х - О.
5. Сполука за будь-яким із пп. 1-4, де L - безпосередній зв'язок або -С1-7алкілен; вказаний алкілен, як варіант, заміщено одним або більше С1-6алкоксилами.
6. Сполука за будь-яким із пп. 1-4, де L - С1-3алкілен, вказаний алкілен, як варіант, заміщено одним або більше С1-6алкоксилами.
7. Сполука за будь-яким із пп. 1-6, де R1 - насичене або частково ненасичене 3-7-членне кільце, яке, як варіант, містить один або два гетероатоми, незалежно вибрані з О, N та S, та яке, як варіант, містить карбоніл; вказане кільце, як варіант, заміщено одним або більше замісниками, незалежно вибраними із групи: галоген, С1-6алкіл та С1-6алкоксил, вказаний алкоксил, як варіант, крім того заміщено С1-6алкоксилом.
8. Сполука за будь-яким із пп. 1-6, де R1 - ароматична кільцева система, вибрана з фенілу, біфенілу, нафтилу або п'яти- або шестичленного гетероароматичного кільця з вмістом 1-3 гетероатомів, незалежно вибраних з О, N та S, вказане ароматичне кільце, як варіант, заміщено одним, або більше замісниками, незалежно вибраними із групи: галоген, С1-6алкіл та С1-6алкоксил, вказаний алкоксил, як варіант, крім того заміщено С1-6алкоксилом.
9. Сполука за п. 1, де L - як варіант, заміщений С1-3алкілен, а R1 - насичене або частково ненасичене 3-7-членне кільце, яке, як варіант, містить один або два гетероатоми, вибрані незалежно з О, N та S та, як варіант, містить карбоніл, вказане кільце, як варіант, заміщено одним або більше замісниками, незалежно вибраними із групи: галоген, С1-6алкіл та С1-6алкоксил, вказаний алкоксил, як варіант, крім того заміщено С1-6алкоксилом.
10. Сполука за п. 1, де L - як варіант, заміщений С1-3алкілен, а R1 - ароматична кільцева система, вибрана з фенілу, біфенілу, нафтилу або п'яти- або шестичленного гетероароматичного кільця з вмістом 1-3 гетероатомів, незалежно вибраних з О, N та S, вказане ароматичне кільце, як варіант, заміщено одним або більше замісниками, незалежно вибраними із групи: галоген, С1-6алкіл та С1-6алкоксил, вказаний алкоксил, як варіант, крім того заміщено С1-6алкоксилом.
11. Сполука за п. 1, де Х - S, Y - О, L - як варіант, заміщений С1-3алкілен, а R1 - як варіант, заміщений феніл.
12. Сполука за п. 1, де Х - S, Y - О, L - як варіант, заміщений С1-3алкілен, а R1 - як варіант, заміщений піридил.
13. Сполука за п. 1, де Х - S, Y - О, L - С1-3алкілен, заміщений С1-6алкоксил, а R1 - гідроген.
14. Сполука, де вказана сполука вибрана з:
1-бутил-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-ізобутил-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(піридин-2-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(2-флуоробензил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[2-(2-метоксіетокси)-3-пропоксибензил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(6-етоксипіридин-2-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-піперидин-3-ілметил-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-бутил-4-тіоксо-1,3,4,5-тетрагідро-2Н-піроло[3,2-d]піримідин-2-он;
1-(2-ізопропоксіетил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(2-метокси-2-метилпропіл)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(2-етокси-2-метилпропіл)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(піперидин-4-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(1-метилпіперидин-3-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[2-гідрокси-2-(4-метоксифеніл)етил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(2-метоксибензил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(3-метоксибензил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(2,4-диметоксибензил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(3-хлорпіридин-2-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-{[3-(2-етоксіетокси)піридин-2-іл]метил}-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(6-оксо-1,6-дигідропіридин-2-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(1Н-індол-3-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(1Н-бензимідазол-2-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(5-хлоро-1Н-індол-2-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(5-флуоро-1Н-індол-2-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(1Н-індол-6-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(1Н-індол-5-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(5-флуоро-1Н-індол-3-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(1Н-імідазол-5-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-(1Н-імідазол-2-ілметил)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(5-хлоро-1Н-бензимідазол-2-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
1-[(4,5-диметил-1Н-бензимідазол-2-іл)метил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он;
7-бромо-1-ізобутил-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он та
1-(3-хлорфеніл)-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он.
та її фармацевтично прийнятні солі.
15. Сполука формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятна сіль для застосування як медикаменту.
16. Фармацевтична композиція, що містить сполуку формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятну сіль, як варіант, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
17. Спосіб лікування або зменшення ризику хвороб або станів, де є корисним інгібування ферменту МПО, в якому вводять особі, що потерпає від вказаної хвороби або стану або має ризик цього, терапевтично ефективну кількість сполуки формули (І) за будь-яким з пп. 1-14 або її фармацевтично прийнятної солі.
18. Спосіб лікування або зменшення ризику нейрозапальних розладів, в якому вводять особі, що потерпає від вказаної хвороби або стану або має ризик цього, терапевтично ефективну кількість сполуки формули (І) за будь-яким з пп. 1-14 або її фармацевтично прийнятної солі.
19. Спосіб за п. 18, де вказаний нейрозапальний розлад є розсіяним склерозом.
20. Спосіб за п. 17, де вказана хвороба або стан є атеросклерозом.
21. Спосіб за п. 17, де вказана хвороба або стан є ХОХР.
22. Застосування сполуки формули (І) за будь-яким з пп. 1-14 або її фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики хвороб або станів, де є корисним інгібування ферменту МПО.
23. Застосування сполуки формули (І) за будь-яким з пп. 1-14 або її фармацевтично прийнятної солі, у виробництві медикаменту для лікування або профілактики нейрозапальних розладів.
24. Застосування за п. 23, де вказаний нейрозапальний розлад є розсіяним склерозом.
25. Застосування за п. 22, де вказана хвороба або стан є атеросклерозом.
26. Застосування за п. 22, де вказана хвороба або стан - ХОХР.
27. Спосіб отримання сполуки формули (І) за будь-яким з пп. 1-14 або її фармацевтично прийнятної солі, енантіомера, діастереомеру або рацемату, в якому здійснюють реакцію сполуки формули (II)
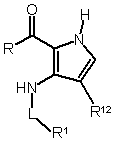 , (II)
, (II)
де R1 та L визначено в п. 1, а R - С1-6алкоксил або NН2;
з С1-6алкоксилкарбонілізотіоціанатом або з фенілкарбонілізотіоціанатом;
а, коли необхідно, перетворення утвореної сполуки формули (І) або іншої її солі у її фармацевтично прийнятну сіль; або перетворення утвореної сполуки формули (І) у іншу сполуку формули (І); і, коли потрібно, перетворення утвореної сполуки формули (І) у її оптичний ізомер.
Текст
1. Сполука формули (І) Y H C2 2 (19) 1 3 89968 4 7 8 11 у кожному випадку R , R та R , незалежно, - гід13. Сполука за п. 1, де Х - S, Y - О, L - С1-3алкілен, 7 8 1 роген чи С1-6алкіл, або група NR R - 5-7-членне заміщений С1-6алкоксил, а R - гідроген. насичене азациклічне кільце, яке, як варіант, міс14. Сполука, де вказана сполука вибрана з: тить один додатковий гетероатом, вибраний з О, S 1-бутил-2-тіоксо-1,2,3,5-тетрагідропіроло[3,211 та NR ; d]піримідин-4-он; та її фармацевтично прийнятні солі; 1-ізобутил-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2d]піримідин-4-он; за умови, що виключені сполуки 1- -D1-(піридин-2-ілметил)-2-тіоксо-1,2,3,5рибофуранозил-2-оксопіроло[3,2-d]піримідинтетрагідропіроло[3,2-d]піримідин-4-он; 4(3Н,5Н)-тіон, 1-(2,3,5-три-О-бензоїл-1- -D1-(2-флуоробензил)-2-тіоксо-1,2,3,5рибофуранозил)-2-оксопіроло[3,2-d]піримідинтетрагідропіроло[3,2-d]піримідин-4-он; 4(3Н,5Н)-тіон та 5,7-димеркапто-1,4,6-триазаінден. 1 1-[2-(2-метоксіетокси)-3-пропоксибензил]-2-тіоксо2. Сполука за п. 1, де R - гідроген. 1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он; 3. Сполука за п. 1 або 2, де Х - S, a Y - О. 1-(6-етоксипіридин-2-ілметил)-2-тіоксо-1,2,3,54. Сполука за п. 1 або 2, де Y - S, а Х - О. тетрагідропіроло[3,2-d]піримідин-4-он; 5. Сполука за будь-яким із пп. 1-4, де L - безпосе1-піперидин-3-ілметил-2-тіоксо-1,2,3,5редній зв'язок або -С1-7алкілен; вказаний алкілен, тетрагідропіроло[3,2-d]піримідин-4-он; як варіант, заміщено одним або більше С11-бутил-4-тіоксо-1,3,4,5-тетрагідро-2Н-піроло[3,26алкоксилами. d]піримідин-2-он; 6. Сполука за будь-яким із пп. 1-4, де L - С11-(2-ізопропоксіетил)-2-тіоксо-1,2,3,53алкілен, вказаний алкілен, як варіант, заміщено тетрагідропіроло[3,2-d]піримідин-4-он; одним або більше С1-6алкоксилами. 1 1-(2-метокси-2-метилпропіл)-2-тіоксо-1,2,3,57. Сполука за будь-яким із пп. 1-6, де R - насичететрагідропіроло[3,2-d]піримідин-4-он; не або частково ненасичене 3-7-членне кільце, 1-(2-етокси-2-метилпропіл)-2-тіоксо-1,2,3,5яке, як варіант, містить один або два гетероатоми, тетрагідропіроло[3,2-d]піримідин-4-он; незалежно вибрані з О, N та S, та яке, як варіант, 1-(піперидин-4-ілметил)-2-тіоксо-1,2,3,5містить карбоніл; вказане кільце, як варіант, замітетрагідропіроло[3,2-d]піримідин-4-он; щено одним або більше замісниками, незалежно 1-[(1-метилпіперидин-3-іл)метил]-2-тіоксо-1,2,3,5вибраними із групи: галоген, С1-6алкіл та С1тетрагідропіроло[3,2-d]піримідин-4-он; 6алкоксил, вказаний алкоксил, як варіант, крім 1-[2-гідрокси-2-(4-метоксифеніл)етил]-2-тіоксотого заміщено С1-6алкоксилом. 1 1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он; 8. Сполука за будь-яким із пп. 1-6, де R - арома1-(2-метоксибензил)-2-тіоксо-1,2,3,5тична кільцева система, вибрана з фенілу, біфенітетрагідропіроло[3,2-d]піримідин-4-он; лу, нафтилу або п'яти- або шестичленного гетеро1-(3-метоксибензил)-2-тіоксо-1,2,3,5ароматичного кільця з вмістом 1-3 гетероатомів, тетрагідропіроло[3,2-d]піримідин-4-он; незалежно вибраних з О, N та S, вказане арома1-(2,4-диметоксибензил)-2-тіоксо-1,2,3,5тичне кільце, як варіант, заміщено одним, або бітетрагідропіроло[3,2-d]піримідин-4-он; льше замісниками, незалежно вибраними із групи: 1-[(3-хлорпіридин-2-іл)метил]-2-тіоксо-1,2,3,5галоген, С1-6алкіл та С1-6алкоксил, вказаний алтетрагідропіроло[3,2-d]піримідин-4-он; коксил, як варіант, крім того заміщено С11-{[3-(2-етоксіетокси)піридин-2-іл]метил}-2-тіоксо6алкоксилом. 1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он; 9. Сполука за п. 1, де L - як варіант, заміщений С11 1-[(6-оксо-1,6-дигідропіридин-2-іл)метил]-2-тіоксо3алкілен, а R - насичене або частково ненасичене 1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он; 3-7-членне кільце, яке, як варіант, містить один 1-(1Н-індол-3-ілметил)-2-тіоксо-1,2,3,5або два гетероатоми, вибрані незалежно з О, N та тетрагідропіроло[3,2-d]піримідин-4-он; S та, як варіант, містить карбоніл, вказане кільце, 1-(1Н-бензимідазол-2-ілметил)-2-тіоксо-1,2,3,5як варіант, заміщено одним або більше замісникатетрагідропіроло[3,2-d]піримідин-4-он; ми, незалежно вибраними із групи: галоген, С11-[(5-хлоро-1Н-індол-2-іл)метил]-2-тіоксо-1,2,3,56алкіл та С1-6алкоксил, вказаний алкоксил, як тетрагідропіроло[3,2-d]піримідин-4-он; варіант, крім того заміщено С1-6алкоксилом. 1-[(5-флуоро-1Н-індол-2-іл)метил]-2-тіоксо-1,2,3,510. Сполука за п. 1, де L - як варіант, заміщений 1 тетрагідропіроло[3,2-d]піримідин-4-он; С1-3алкілен, а R - ароматична кільцева система, 1-(1Н-індол-6-ілметил)-2-тіоксо-1,2,3,5вибрана з фенілу, біфенілу, нафтилу або п'ятитетрагідропіроло[3,2-d]піримідин-4-он; або шестичленного гетероароматичного кільця з 1-(1Н-індол-5-ілметил)-2-тіоксо-1,2,3,5вмістом 1-3 гетероатомів, незалежно вибраних з тетрагідропіроло[3,2-d]піримідин-4-он; О, N та S, вказане ароматичне кільце, як варіант, 1-[(5-флуоро-1Н-індол-3-іл)метил]-2-тіоксо-1,2,3,5заміщено одним або більше замісниками, незалететрагідропіроло[3,2-d]піримідин-4-он; жно вибраними із групи: галоген, С1-6алкіл та С11-(1Н-імідазол-5-ілметил)-2-тіоксо-1,2,3,56алкоксил, вказаний алкоксил, як варіант, крім тетрагідропіроло[3,2-d]піримідин-4-он; того заміщено С1-6алкоксилом. 1-(1Н-імідазол-2-ілметил)-2-тіоксо-1,2,3,511. Сполука за п. 1, де Х - S, Y - О, L - як варіант, 1 тетрагідропіроло[3,2-d]піримідин-4-он; заміщений С1-3алкілен, а R - як варіант, заміще1-[(5-хлоро-1Н-бензимідазол-2-іл)метил]-2-тіоксоний феніл. 1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он; 12. Сполука за п. 1, де Х - S, Y - О, L - як варіант, 1 1-[(4,5-диметил-1Н-бензимідазол-2-іл)метил]-2заміщений С1-3алкілен, а R - як варіант, заміщетіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4ний піридил. он; 5 89968 6 7-бромо-1-ізобутил-2-тіоксо-1,2,3,5профілактики хвороб або станів, де є корисним тетрагідропіроло[3,2-d]піримідин-4-он та інгібування ферменту МПО. 1-(3-хлорфеніл)-2-тіоксо-1,2,3,523. Застосування сполуки формули (І) за будьтетрагідропіроло[3,2-d]піримідин-4-он. яким з пп. 1-14 або її фармацевтично прийнятної та її фармацевтично прийнятні солі. солі, у виробництві медикаменту для лікування 15. Сполука формули (І) за будь-яким із пп. 1-14 або профілактики нейрозапальних розладів. або її фармацевтично прийнятна сіль для застосу24. Застосування за п. 23, де вказаний нейрозапавання як медикаменту. льний розлад є розсіяним склерозом. 16. Фармацевтична композиція, що містить сполу25. Застосування за п. 22, де вказана хвороба або ку формули (І) за будь-яким із пп. 1-14 або її фарстан є атеросклерозом. мацевтично прийнятну сіль, як варіант, у суміші з 26. Застосування за п. 22, де вказана хвороба або фармацевтично прийнятним ад'ювантом, розрістан - ХОХР. джувачем або носієм. 27. Спосіб отримання сполуки формули (І) за будь17. Спосіб лікування або зменшення ризику хвояким з пп. 1-14 або її фармацевтично прийнятної роб або станів, де є корисним інгібування ферменсолі, енантіомера, діастереомеру або рацемату, в ту МПО, в якому вводять особі, що потерпає від якому здійснюють реакцію сполуки формули (II) вказаної хвороби або стану або має ризик цього, O H терапевтично ефективну кількість сполуки формуN ли (І) за будь-яким з пп. 1-14 або її фармацевтично R прийнятної солі. (II) 18. Спосіб лікування або зменшення ризику нейроHN запальних розладів, в якому вводять особі, що R12 потерпає від вказаної хвороби або стану або має L ризик цього, терапевтично ефективну кількість R1 , сполуки формули (І) за будь-яким з пп. 1-14 або її 1 де R та L визначено в п. 1, а R - С1-6алкоксил або фармацевтично прийнятної солі. NН2; 19. Спосіб за п. 18, де вказаний нейрозапальний з С1-6алкоксилкарбонілізотіоціанатом або з фенірозлад є розсіяним склерозом. лкарбонілізотіоціанатом; 20. Спосіб за п. 17, де вказана хвороба або стан є а, коли необхідно, перетворення утвореної сполуатеросклерозом. ки формули (І) або іншої її солі у її фармацевтично 21. Спосіб за п. 17, де вказана хвороба або стан є прийнятну сіль; або перетворення утвореної споХОХР. луки формули (І) у іншу сполуку формули (І); і, 22. Застосування сполуки формули (І) за будьколи потрібно, перетворення утвореної сполуки яким з пп. 1-14 або її фармацевтично прийнятної формули (І) у її оптичний ізомер. солі у виробництві медикаменту для лікування або Заявлений винахід стосується нових похідних піроло[3,2-d]піримідин-4-ону, способів їх отримання, композицій з їх вмістом та їх застосування в терапії. Мієлопероксидаза (МПО) є гемовмісним ферментом, знайденим переважно у поліморфонуклеарних лейкоцитах (ПМН). МПО є одним членом білкової родини різноманітних пероксидаз ссавця, що також охоплює еозинофіл-пероксидазу, тироїдин-пероксидазу, слинну пероксидазу, лактопероксидазу, простагландин-Н-синтазу та інші. Стиглий фермент - димер з ідентичних половин. Кожна половина молекули містить ковалентно зв'язаний гем, що виявляє незвичайні спектральні властивості, що відповідають за зелений колір МПО. Розщеплення дисульфідного містка, що зв'язує дві половини МПО, дає гемі-фермент, що виявляє спектральні та каталітичні властивості, що не відрізняються від властивостей цілого ферменту. Фермент використовує гідроген пероксид для окиснення хлориду до гіпохлоритної кислоти. Інші галогеніди та псевдогалогеніди (типу тіоціанату) також є фізіологічними субстратами для МПО. ПМН мають особливу важливість для боротьби з інфекціями. Ці клітини містять МПО із добре задокументованою мікробіологічною дією. ПМН неспецифічно діє фагоцитозом на поглинання мік роорганізмів, уведення їх у вакуолі, названі фагосомами, котрі зливаються із гранулами з вмістом мієлопероксидази для утворення фаголізосом. У фаголізосомах ферментна активність мієлопероксидази призводить до утворення гіпохлоритної кислоти, потужної бактерицидної сполуки. Сама гіпохлоритна кислота окиснюється та найбільш активно реагує з тіолами та тіоетерами, але також перетворює аміни в хлораміни та хлорує ароматичні амінокислоти. Макрофаги є великими фагоцитарними клітинами, котрі подібно ПМН є здатними до фагоцитозу мікроорганізмів. Макрофаги можуть генерувати гідроген пероксид, а при активації також продукують мієлопероксидазу. МПО та гідроген пероксид також можуть бути вивільненими назовні із клітини, де реакція із хлоридом може індукувати пошкодження сусідньої тканини. Зв'язок активності мієлопероксидази із хворобою є причетним до неврологічних хвороб із нейрозапальною реакцією, охоплюючи розсіяний склероз, хворобу Альцгеймера, хворобу Паркінсона та інсульт, а також інших запальних хвороб або станів типу астми, хронічної обструктивної хвороби легень, кистозного фіброзу, атеросклерозу, запальної хвороби кишківника, гломерулярного пошкодження нирок та ревматоїдного артриту. Рак 7 89968 8 легень також наводить на думку про зв'язок із виPC-патології, або застосуванням фармакологічних сокими рівнями МПО. підходів. Розсіяний склероз (PC) Припускають, що демієлінізація залежить від Надзвичайно багато клітин із позитивною МПО цитотоксичних Т-клітин та токсичних продуктів, присутні у циркуляції та у тканині, що зазнає запагенерованих активованими фагоцитами (Lassmann лення. Зокрема, МПО з вмістом макрофагів та Η. J Neurol Neurosurg Psychiatry 2003; 74(6):695-7). мікроглій задокументовано у ЦНС протягом хвоТаким чином, аксональні втрати знаходяться під роб: розсіяного склерозу (Nagra RM, et al. Journal впливом протеаз та інтермедіатів реакційноздатof Neuroimmunology; 78(1-2):97-107), хвороби Парного оксигену та нітрогену. Коли є наявними МПО, кінсона (Choi D-K. et al. Neuroimmunology. 2005; вони, звичайно, мають здатність активувати про25(28):6594-600) та хвороби Альцгеймера (Green теази (безпосередньо, а також через розгальмуPS. et al. Journal of Neurochemistry. 2004; вання, впливаючи на інгібітори протеаз), а ство90(3):724-33). Припускають, що деякі аспекти хрорювати реакційноздатні різновиди. нічного запалення призводять до переважаючого Хронічна обструктивна хвороба легень (ХОХР) руйнування, де агенти від реакцій МПО грають Хронічна обструктивна хвороба легень (ХОХР) важливу роль. є хворобливим станом, що характеризується обФермент вивільнюється зовнішньоклітинно, а меженням потоку повітря, що не є повністю оборотакож у фаголізосомах у нейтрофілах (Hampton тним. Обмеження потоку повітря звичайно є посMB, Kettle AJ, Winterbourn CC. Blood 1998; туповим та асоційованим з аномальною 92(9):3007-17). Передумовою для активності МПО запальною реакцією легень на шкідливі частинки є присутність гідроген пероксиду, генерованого або гази. ХОХР є головною громадською проблеNADPH-оксидазою та наступною дисмутацією сумою здоров'я. Вона є четвертою головною причипероксиду. Окиснений фермент є здатним діяти на ною хронічної захворюваності та смертності у величезну кількість різних субстратів, з котрих Сполучених Штатах Америки 1, та проектують, що хлорид є найбільш визнаним. У цій реакції утворюзайме п'яте місце у 2020 як поширена в усьому ється сильний нерадикальний окисник - гіпохлорисвіті хвороба. В Сполученому Королівстві поширетна кислота (НОСІ). НОСІ дуже ефективно окисність ХОХР дорівнює 1,7% у чоловіків та 1,4% у нює амінокислоти з вмістом сульфуру типу жінок. ХОХР охоплює межи суворості від слабкої цистеїну та метіоніну (Peskin AV, Winterbourn CC. до дуже суворої, з вартістю лікування, що швидко Free Radical Biology and Medicine 2001; 30(5):572збільшується і зростанням суворості. 9). Вона також утворює хлораміни з аміногрупами Рівні МПО у мокротинні та BAL є набагато біу білках та інших біомолекулах (Peskin AV. et al. льшими у пацієнтів з ХОХР щодо нормальних конFree Radical Biology and Medicine 2004; тролів, що не палять (Keatings V.M., Barnes P.J. 37(10):1622-30). Вона хлорує феноли (типу тироAm J Respir Crit Care Med 1997; 155:449-453; Pesci, зину) (Hazen SL et al. Mass Free Radical Biology A. et al. Eur Respir J 1998; 12:380-386). Рівні МПО and Medicine 1997; 23(6):909-16) та ненасичені подалі підвищуються протягом загострень хвороби зв'язки в ліпідах (Albert CJ. et al. J. Biol. Chem. (Fiorini G. et al. Biomedicine & Pharmacotherapy 2001; 276(26):23733-41), окиснює ферум-центри 2000; 54:274-278; Crooks S.W. et al. European (Rosen H, Klebanoff SJ. Journal of Biological Respiratory Journal. 15(2):274-80, 2000). Роль МПО Chemistry 1982; 257(22):13731-354) та зшиває білімовірно є більш важливою при загостреннях ки (Fu X, Mueller DM, Heinecke JW. Biochemistry ХОХР (Sharon S.D. et al. Am J Respir Crit Care Med. 2002; 41(4):1293-301). 2001; 163:349-355). Протеолітичні каскади приймають участь у інНа додаток до деструктивних властивостей фільтруванні клітин через ВВВ, а також руйнуванні МПО існує стійкий клінічний зв'язок з хворобою ВВВ, мієліну та нервових клітин (Cuzner ML, судин (Baldus S. et al. Circulation 2003; 108:1440-5). Opdenakker G. Journal of Neuroimmunology 1999; Дисфункціональні поліморфізми МПО асоціюються 94(1-2):1-14; Yong VW. et al. Nature Reviews зі зменшеним ризиком смертності від коронарної Neuroscience 2001; 2(7):502-11.). Активація матриартеріальної хвороби (Nikpoor В. et al. Am Heart J ксної металопротеїнази (ММП) можна досягти дією 2001; 142:336), а пацієнти з високими рівнями сирозташованої у каскаді вище протеази, а також роватки МПО мають збільшений ризик гострого через окиснення дисульфідного містка (Fu X. et al. коронарного синдрому. Дія МПО на судинну хвоJ. Biol. Chem. 2001; 276(44):41279-87; Gu Z. et al. робу може простиратися на ХОХР, оскільки існує Science 2002; 297(5584):1186-90). Це окиснення вагомий доказ, що легенева судинна система є може бути нітрозилуванням або окисненням, опоодною з початкових ділянок залучення у легені середкованим НОСІ. Обидва можуть бути наслідкурців. Описано разючі зміни у інтимі легеневих ком активності МПО. У кількох повідомленнях приартерій, що показує залежність дози від паління пускають роль загалом ММП та зокрема ММП-9 як (Hale K.A., Niewoehner D.E., Cosio M.G. Am Rev вплив на інфільтрування клітин, а також на пошкоResp Dis 1980; 122:273-8). Фізіологічні функції дження тканин (розклад та демієлінізація ВВВ), у МПО асоційовані з притаманним хазяїну захистом. PC та ЕАЕ (дивись Yong VW. et al., вище). ВажлиЦя роль, однак, не є критичною, бо у найбільшості вість цих конкретних видів механізмів у PC отривипадків дефіциту МПО пацієнти мають відносно мують із досліджень, де ідентифіковано збільшену доброякісні симптоми (Parry M.F. et al. Ann Int Med. активність та присутність протеази у PC тканин 1981; 95:293-301, Yang, K.D., Hill, H.R. Pediatr Infect мозку та CSF. Підтримку даних також створюють Dis J. 2001 ;20:889-900). У підсумку, існує важливе виконанням досліджень ЕАЕ мишей, дефектних свідчення, що підвищені рівні МПО у ХОХР можуть відносно деякої з протеаз, залучених до участі у сприяти хворобі через кілька механізмів. Тому мо 9 89968 10 жна очікувати, що селективний інгібітор МПО пота R. Stacker (1993) Biochem J 290 (Pt 1):165-72). легшуватиме гострі та хронічні запалення ХОХР та Модифікація хлортирозином ароА1, головного може зменшувати розвиток емфіземи. аполіпопротеїну холестерину ЛПВГ, призводить до Атеросклероз порушення функції акцептору холестерину (Bergt, Інгібітор МПО повинен був би зменшувати С., S. et al. (2004) Proc Natl Acad Sci U S A; Zheng, атеросклеротичну важкість та/або уразливість ісL. et al. (2004) J Clin Invest 114(4):529-41). Систенуючих атеросклеротичних ушкоджень і, таким матичні дослідження цих механізмів показали, що чином, зменшувати ризик гострого інфаркту міокаМПО зв'язується та переміщується з ароА1 у пларду, нестабільної стенокардії або інсульту. Кілька змі. Більш того, МПО специфічно націлюється на ті серій даних підтримують роль МПО у атеросклезалишки тирозину в ароА1, що фізично взаємодірозі. МПО експресується у плечових регіонах та ють з транспортером касети макрофагу АВСА1 некротичній серцевині атеросклеротичних ушкопротягом витоку холестерину із макрофагу (Bergt, джень людини, та активний фермент виділяють із С. et al. (2004) J Biol Chem 279(9):7856-66; Shao, B. розтинів зразків ушкоджень людини (Daugherty, A. et al. (2005) J Biol Chem 280(7):5983-93; Zheng et et al. (1994) J Clin Invest 94(1):437-44). В еродоваal. (2005) J Biol Chem 280(1):38-47). Таким чином, них та розірваних ушкодженнях людини продемоздається, що МПО мають двоїсту погіршувальну нстровано збільшене число макрофагів, експрероль у атеросклеротичних ушкодженнях, збільшусуючих МПО, у порівнянні з прожилками жиру, що ючи накопичення ліпіду через агрегацію частинок вказує на особливу роль МПО у гострих коронарЛПНГ та зменшуючи реверс транспорту холестених синдромах (Sugiyama, S. et al. (2001) Am J рину атакою на ЛПВГ-білок ароА1. Pathol 158(3):879-91). Пацієнти з встановленою 1- -D-рибофуранозил-2-оксопіроло[3,2коронарною артеріальною хворобою мають вищі d]піримідин-4(3H,5Н)-тіон та 1-(2,3,5-три-Орівні МПО у плазмі та лейкоцитах, ніж здорові конбензоїл-1- -D-рибофуранозил)-2-оксопіроло[3,2тролі (Zhang, R. et al. (2001) Jama 286(17):2136d]піримідин-4(3H,5Н)-тіон 42). Більш того, у двох великих наступних дослідженнях рівнів МПО у плазмі прогнозовано ризик майбутніх коронарних випадків або реваскуляризації (Baldus, S. et al. (2003) Circulation 108(12):1440-5; Brennan, Μ. et al. (2003) N_Engl J Med 349(17):1595-604). Загальний дефіцит МПО у людей превалює у 1 з 2000-4000 осіб. Ці особи виглядають в основному здоровими, але повідомлено про небагату кількість випадків суворої кандида-інфекції. Цікаво, що МПО-дефіцитні люди є менш ураженими серцево-судинною хворобою, ніж контролі з нормальними рівнями МПО (Kutter, D. et al. (2000) Acta Haematol 104(1)). Поліморфізм у промоторі МПО вражає експресію, що призводить розкрито у J. Heterocyclic Chemistry, 1992, 29, до високо та низько експресуючих МПО осіб. У 343-354. Жодної фармакологічної активності не трьох відмінних дослідженнях генотип з високою приписано цим сполукам. експресією асоційовано із збільшеним ризиком 5,7-Димеркапто-1,4,6-триазаїнден серцево-судинної хвороби (Nikpoor, В. et al. (2001) Am Heart J 142(2):336-9; Makela, R., P. J. Karhunen, et al. (2003) Lab Invest 83(7):919-25; Asselbergs, F. W., et al. (2004) Am J Med 116(6):429-30). Дані, нагромаджені протягом останніх десяти років, вказують, що проатерогенні дії МПО охоплюють окиснення ліпопротеїнів, індукування ендотеліальної дисфункції через поглинання нітроген оксиду та дестабілізацію атеросклеротичних ушкоджень акрозкрито у Chem. Pharm. Bull., 1964, 12, 1030тивацією протеази (Nicholls, S. J. та S. L. Hazen 1042 та у патенті Японії JP 02160235 А2. Жодної (2005) Arterioscler Thromb Vase Biol 25(6):1102-11). фармакологічної активності не приписано цій споНещодавно кілька досліджень зосереджено на луці. нітро- та хлортирозиновій модифікації ліпопротеїЗаявлений винахід охоплює нові похідні піронів ЛПНГ та ЛПВГ. Оскільки модифікації хлортироло[3,2-d]піримідин-4-ону, що несподівано виявлязину можна генерувати in vivo тільки гіпохлоритють корисні властивості як інгібітори ферменту ною кислотою, продукованою МПО, ці модифікації МПО. Ці сполуки також виявляють селективність вважають специфічними маркерами активності проти споріднених ферментів, наприклад, лактоМПО (Hazen, S. L. та J. W. Heinecke (1997) J Clin пероксидази (LPO), а тироїдинпероксидази (ТРО). Invest 99(9):2075-81). Частинки ЛПНГ, відкриті до Заявлений винахід стосується сполуки форМПО in vitro, стають сукупними, що призводить до мули (І) полегшення поглинання через рецептори збирача макрофагу та утворення пінних клітин (Hazell, L. J. 11 89968 12 7 8 алкоксилом, СНО, С2-6 алканоїлом, ОН, CONR R 7 8 та NR COR ; 7 8 11 у кожному випадку R , R та R , незалежно, 7 8 гідроген або С1-6 алкіл, або група NR R - 5-7членне насичене азациклічне кільце, що як варіант, містить один додатковий гетероатом, вибра11 ний з О, S та NR ; та її фармацевтично прийнятних солей; за умови, що виключені сполуки 1- -Dде: рибофуранозил-2-оксопіроло[3,2-d]піримідинпринаймні один з X та Υ - S, а інший - О або S; 4(3H,5Н)-тіон, 1-(2,3,5-три-O-бензоїл-1- -DL - безпосередній зв'язок або С1-7 алкілен, рибофуранозил)-2-оксопіроло[3,2-d]піримідинвказаний алкілен, як варіант, містить гетероатом, 4(3H,5Н)-тіон та 5,7-димеркапто-1,4,6-триазаінден. 6 вибраний з О, S(O)n та NR , вказаний алкілен, як Сполуки формули (І) можуть існувати у енантіваріант, містить один або два подвійні зв'язки каромерних формах. Слід розуміти, що усі енантіомебон-карбон та вказаний алкілен, як варіант, заміри, діастереомери, рацемати, таутомери та їх сущено одним або більше замісниками, незалежно міші охоплено рамками винаходу. 4 5 вибраними з групи: ОН, галоген, CN та NR R , C1Сполуки формули (І) можуть існувати у тауто6 алкіл та С1-6 алкоксил, вказаний алкоксил, як мерних формах. Усі такі таутомери та суміші тауваріант, містить поруч з оксигеном карбоніл; томерів охоплено рамками заявленого винаходу. n - ціле число 0, 1 або 2; Якщо не вказане інше, термін "С1-6 алкіл", як 1 R - гідроген, або тут позначено, означає алкіл з лінійним або розгаі) насичене або частково ненасичене 3-7 луженим ланцюгом, що має 1-6 атомів карбону. членне кільце, що як варіант, містить один або два Приклади таких груп охоплюють, але без обмегетероатоми, вибрані незалежно з О, N та S, та ження: метил, етил, 1-пропіл, н-бутил, ізо-бутил, яке, як варіант, має в собі карбоніл, як варіант, трет-бутил, пентил та гексил. Термін "С1-7 алкіл" заміщене одним або більше замісниками, незалеінтерпретовано аналогічно. 9 жно вибраними з групи: галоген, SO2R , Якщо не вказане інше, термін "С1-7 алкілен", 9 10 SO2NR R , ОН, С1-7 алкіл, С1-7 алкоксил, CN, як тут позначено, означає алкіл з лінійним або роз2 3 2 3 3 CONR R , NR COR та COR , вказаний алкоксил, галуженим ланцюгом, що має 1-7 атомів карбону і як варіант, крім того заміщено С1-6 алкоксилом, а має дві вільні валентності. Приклади таких груп вказаний алкоксил, як варіант, містить поруч з окохоплюють, але без обмеження: метилен, етилен, сигеном карбоніл та, як варіант, крім того заміщепропілен, гексаметилен та етилетилен. Термін ний гідроксилом або С1-6 алкоксилом, а вказаний "С1-3 алкілен" інтерпретовано аналогічно. алкіл або алкоксил, як варіант, містить карбоніл Якщо не вказане інше, термін "С1-6 алкоксил", поруч з оксигеном або на будь-якій позиції в алкілі; як тут позначено, означає алкоксил з лінійним або або розгалуженим ланцюгом, що має 1-6 атомів каріі) ароматична кільцева система, вибрана з бону. Приклади таких груп охоплюють, але без фенілу, біфенілу, нафтилу або моно-циклічної або обмеження: метоксил, етоксил, 1-етоксил, 2біциклічної гетероароматичної кільцевої структури пропоксил (ізо-етоксил), трет-бутоксил та пентокз вмістом 1-3 гетероатомів, незалежно вибраних з сил. Термін "С1-7 алкоксил" інтерпретовано анаО, N та S, вказану ароматичну кільцеву систему, логічно. як варіант, заміщено одним або більше замісникаЯкщо не вказане інше, термін "С2-6 алканоїл", 9 ми, незалежно вибраними з групи: галоген, SO2R , як тут позначено, означає алкіл з лінійним або роз9 10 SO2NR R , ОН, С1-7 алкіл, С1-7 алкоксил, CN, галуженим ланцюгом, що має 1-5 атоми карбону з 2 3 2 3 3 CONR R , NR COR та COR ; вказаний алкоксил, довільною позицію карбонілу на алкілі. Приклади як варіант, крім того заміщено С1-6 алкоксилом, а таких груп охоплюють, але без обмеження: ацевказаний алкоксил, як варіант, містить поруч з октил, пропіоніл та півалоїл. сигеном карбоніл та, як варіант, крім того заміщеЯкщо не вказане інше, термін "галоген", як тут ний гідроксилом або С1-6 алкоксилом, а вказаний позначено, означає флуор, хлор, бром та йод. алкіл або алкоксил, як варіант, містить карбоніл Приклади моноциклічних або біциклічних гетепоруч з оксигеном або на будь-якій позиції в алкілі; роароматичних кільцевих структур з вмістом 1-3 12 R - гідроген або галоген або карбон, як варігетероатомів, незалежно вибраних з О, N та S, ант, заміщений одним - трьома атомами галогену; охоплюють, але без обмеження, фуран, тіофен, 2 3 4 5 6 9 10 у кожному випадку, R , R , R , R , R , R та R , пірол, оксазол, ізоксазол, тіазол, імідазол, піразол, незалежно, - гідроген, С1-6 алкіл або С1-6 алкоктриазол, тетразол, піридин, піразин, піримідин, сил, вказаний алкоксил, як варіант, містить поруч з піридазин, бензофуран, індол, ізоіндол та бензиміоксигеном карбоніл, вказаний алкіл, як варіант, дазол. крім того заміщено галогеном, С1-6 алкоксилом, Приклади 5-7-членного насиченого азацикліч7 8 7 8 СНО, С2-6 алканоїлом, ОН, CONR R та NR COR ; ного кільця, що містить, як варіант, один додатко2 3 4 5 9 10 або групи NR R , NR R та NR R кожна, не11 вий гетероатом, вибраний з О, S та NR , охоплюзалежно, - 5-7-членне насичене азациклічне кільють, але без обмеження, піролідин, піперидин, це, що як варіант, містить один додатковий гетепіперазин, морфолін та тіоморфолін. 11 роатом, вибраний з О, S та NR , вказане кільце, У визначенні L, "C1-7 алкілен; вказаний алкіяк варіант, крім того заміщено галогеном, С1-6 лен, як варіант, містить гетероатом, вибраний з О, 6 S(O)n та NR ; вказаний алкілен, як варіант, містить 13 89968 14 один або два подвійні зв'язки карбон-карбон" має кільцевої структури з вмістом 1-3 гетероатомів, насичений або ненасичений, лінійний або розганезалежно вибраних з О, N та S, вказане аромалужений ланцюг з 1-7 атомами карбону, що має тичне кільце, як варіант, заміщено одним або бідві вільні валентності, та де будь-які два окремо льше замісниками, незалежно вибраними з групи: 9 9 10 зв'язані атоми карбону, як варіант, є розділеними галоген, SO2R , SO2NR R , ОН, С1-6 алкіл, С1-6 6 2 3 2 3 3 О, S або NR . Таким чином, визначення, наприалкоксил, CN, CONR R , NR COR та COR , вкаклад, охоплює метилен, етилен, пропілен, гексазаний алкоксил, як варіант, крім того заміщено С1метилен, етилетилен, 6 алкоксилом, а вказаний алкіл, як варіант, крім -СН2=СН2-, -СН2СН=СН-СН2-, -СН(СН3)=СН2-, того заміщено гідроксилом або С1-6 алкоксилом. 1 СН2=СН2-СН2О-, -СН2О-, У ще одному втіленні R - ароматична кільцева -СН2СН2О-СН2-, -СН2СН2О-СН2-СН2-, система, вибрана з фенілу, біфенілу, нафтилу або 6 CH2CH2S- та -CH2CH2NR -. п'яти або шестичленного гетероароматичного кі1 В одному втіленні R - гідроген. льця з вмістом 1-3 гетероатомів, незалежно вибУ ще одному втіленні Χ - S, a Y - О. раних з О, N та S, вказане ароматичне кільце, як У ще одному втіленні Υ - S, а Χ - О. варіант, заміщено одним або більше замісниками, У ще одному втіленні L - безпосередній зв'язок незалежно вибраними з групи: галоген, С1-6 алкіл або - С1-7 алкілен, вказаний алкілен, як варіант, та С1-6 алкоксил, вказаний алкоксил, як варіант, 6 містить гетероатом, вибраний з О, S(O)n та NR , крім того заміщено С1-6 алкоксилом. 1 вказаний алкілен, як варіант, містить один або два У ще одному втіленні R - як варіант, заміщеподвійні зв'язки карбон-карбон, та вказаний алкіний феніл. 1 лен, як варіант, заміщено одним або більше замісУ ще одному втіленні R - як варіант, заміщениками, незалежно вибраними з групи: ОН, С1-6 ний піридил. 4 5 1 алкоксил, галоген, CN та NR R . У ще одному втіленні L - С1-7 алкілен, a R - Н. У ще одному втіленні L - безпосередній зв'язок У ще одному втіленні L - як варіант, заміщений 1 або - С1-7 алкілен; вказаний алкілен, як варіант, С1-3 алкілен, a R - насичене або частково неназаміщено одним або більше замісниками, незалесичене 3-7-членне кільце, яке, як варіант, містить жно вибраними з групи: ОН, С1-6 алкоксил, галоодин або два гетероатоми, вибрані незалежно з О, 4 5 ген, CN та NR R . N та S, та яке, як варіант, містить карбоніл, вказаУ ще одному втіленні L - безпосередній зв'язок не кільце, як варіант, заміщено одним або більше або - С1-7 алкілен; вказаний алкілен, як варіант, замісниками, незалежно вибраними з групи: гало9 9 10 заміщено одним або більше С1-6 алкоксилами. ген, SO2R , SO2NR R , ОН, С1-6 алкіл, С1-6 алко2 3 2 3 3 У ще одному втіленні L - безпосередній зв'язок ксил, CN, CONR R , NR COR та COR , вказаний або - С1-3 алкілен; вказаний алкілен, як варіант, алкоксил, як варіант, крім того заміщено С1-6 алзаміщено одним або більше замісниками, незалекоксилом, а вказаний алкіл, як варіант, крім того жно вибраними з групи: ОН, С1-6 алкоксил, галозаміщено гідроксилом або С1-6 алкоксилом. 4 5 ген, CN та NR R . У ще одному втіленні L - як варіант, заміщений 1 У ще одному втіленні L - С1-3 алкілен; вказаС1-3 алкілен, a R - насичене або частково ненаний алкілен, як варіант, заміщено одним або більсичене 3-7-членне кільце, яке, як варіант, містить ше С1-6 алкоксилами. один або два гетероатоми, вибрані незалежно з О, У ще одному втіленні L - безпосередній зв'яN та S, та яке, як варіант, містить карбоніл, вказазок, або як варіант, заміщений метилен (-СН2-). не кільце, як варіант, заміщено одним або більше У ще одному втіленні L - безпосередній зв'язамісниками, незалежно вибраними з групи: галозок, або як варіант, заміщений етилен (-СН2СН2-). ген, С1-6 алкіл та С1-6 алкоксил, вказаний алкок1 У ще одному втіленні R - насичене або частсил, як варіант, крім того заміщено С1-6 алкоксиково ненасичене 3-7 членне кільце, яке, як варіант, лом. містить один або два гетероатоми, вибрані незаУ ще одному втіленні L - як варіант, заміщений 1 лежно з О, N та S, та яке, як варіант, містить карС1-3 алкілен, a R - ароматична кільцева система, боніл, вказане кільце, як варіант, заміщено одним вибрана з фенілу, біфенілу, нафтилу або п'ятиабо більше замісниками, незалежно вибраними з або шестичленного гетероароматичного кільця з 9 9 10 групи: галоген, SO2R , SO2NR R , ОН, С1-6 алкіл, вмістом 1-3 гетероатомів, незалежно вибраних з 2 3 2 3 3 С1-6 алкоксил, CN, CONR R , NR COR та COR , О, N та S; вказане ароматичне кільце, як варіант, вказаний алкоксил, як варіант, крім того заміщено заміщено одним або більше замісниками, незале9 С1-6 алкоксилом; а вказаний алкіл, як варіант, крім жно вибраними з групи: галоген, SO2R , 9 10 того заміщено гідроксилом або С1-6 алкоксилом. SO2NR R , ОН, С1-6 алкіл, С1-6 алкоксил, CN, 1 2 3 2 3 3 У ще одному втіленні R - насичене або частCONR R , NR COR та COR , вказаний алкоксил, ково ненасичене 3-7 членне кільце, яке, як варіант, як варіант, крім того заміщено С1-6 алкоксилом, а містить один або два гетероатоми, вибрані незавказаний алкіл, як варіант, крім того заміщено гідлежно з О, N та S, та яке, як варіант, містить карроксилом або С1-6 алкоксилом. боніл; вказане кільце, як варіант, заміщено одним У ще одному втіленні L - як варіант, заміщений 1 або більше замісниками, незалежно вибраними з С1-3 алкілен, a R - ароматична кільцева система, групи: галоген, С1-6 алкіл та С1-6 алкоксил, вказавибрана з фенілу, біфенілу, нафтилу або п'ятиний алкоксил, як варіант, крім того заміщено С1-6 або шестичленного гетероароматичного кільця з алкоксилом. вмістом 1-3 гетероатомів, незалежно вибраних з 1 У ще одному втіленні R - ароматична кільцева О, N та S, вказане ароматичне кільце, як варіант, система, вибрана з фенілу, біфенілу, нафтилу, або заміщено одним або більше замісниками, незалемоноциклічної або біциклічної гетероароматичної жно вибраними з групи: галоген, С1-6 алкіл та С1-6 15 89968 16 алкоксил, вказаний алкоксил, як варіант, крім того 1-[(5-флуоро-1Н-індол-3-іл)метил]-2-тіоксозаміщено С1-6 алкоксилом. 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он; У ще одному втіленні X - S, Υ - О, L - як варі1-(1Н-імідазол-5-ілметил)-2-тіоксо-1,2,3,51 ант, заміщений С1-3 алкілен, a R - як варіант, затетрагідро-піроло[3,2-d]піримідин-4-он; міщений феніл. 1-(1Н-імідазол-2-ілметил)-2-тіоксо-1,2,3,5У ще одному втіленні X - S, Υ - О, L - як варітетрагідро-піроло[3,2-d]піримідин-4-он; 1 ант, заміщений С1-3 алкілен, a R - як варіант, за1-[(5-хлоро-1Н-бензимідазол-2-іл)метил]-2міщений піридил. тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4У ще одному втіленні X - S, Υ - О, L - С1-3 алон; 1 кілен, заміщений С1-6 алкоксил, a R - гідроген. 1-[(4,5-диметил-1Н-бензимідазол-2-іл)метил]Особливі сполуки винаходу охоплюють: 2-тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин1-бутил-2-тіоксо-1,2,3,5-тетрагідро-піроло[3,24-он; d]піримідин-4-он; 7-бромо-1-ізобутил-2-тіоксо-1,2,3,5-тетрагідро1-ізобутил-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он; та піроло[3,2-d]піримідин-4-он; 1-(3-хлорфеніл)-2-тіоксо-1,2,3,5-тетрагідро1-(піридин-2-ілметил)-2-тіоксо-1,2,3,5піроло[3,2-d]піримідин-4-он. тетрагідро-піроло[3,2-d]піримідин-4-он; а їх фармацевтично прийнятних солей. 1-(2-флуоро-бензил)-2-тіоксо-1,2,3,5Наступним підходом винаходу є застосування тетрагідро-піроло[3,2-d]піримідин-4-он; нової сполуки формули (І) як медикаменту. 1-[2-(2-метоксіетокси)-3-пропоксибензил]-2Наступним підходом винаходу є застосування тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4сполуки формули (І) або її фармацевтично прийнон; ятної солі у виробництві медикаменту, для ліку1-(6-етокси-піридин-2-ілметил)-2-тіоксо-1,2,3,5вання або профілактики хвороб або станів, де є тетрагідро-піроло[3,2-d]піримідин-4-он; корисним інгібування ферменту МПО. 1-піперидин-3-ілметил-2-тіоксо-1,2,3,5Наступним підходом винаходу є застосування тетрагідро-піроло[3,2-d]піримідин-4-он; сполуки формули (І) або її фармацевтично прийн1-бутил-4-тіоксо-1,3,4,5-тетрагідро-2Нятної солі у виробництві медикаменту, для лікупіроло[3,2-d]піримідин-2-он; вання або профілактики нейрозапальних розладів, 1-(2-ізопропоксіетил)-2-тіоксо-1,2,3,5кардіо- та церебрально-васкулярних атеросклеротетрагідро-піроло[3,2-d]піримідин-4-он; тичних розладів, хвороби периферійних артерій та 1-(2-метокси-2-метилпропіл)-2-тіоксо-1,2,3,5респіраторних розладів, як-то хронічної обструктитетрагідро-піроло[3,2-d]піримідин-4-он; вної хвороби легень. 1-(2-етокси-2-метилпропіл)-2-тіоксо-1,2,3,5Ще одним підходом винаходу є застосування тетрагідро-піроло[3,2-d]піримідин-4-он; сполуки формули (І) або її фармацевтично прийн1-(піперидин-4-ілметил)-2-тіоксо-1,2,3,5ятної солі у виробництві медикаменту для лікувантетрагідро-піроло[3,2-d]піримідин-4-он; ня або профілактики розсіяного склерозу. Лікуван1-[(1-метилпіперидин-3-іл)метил]-2-тіоксоня може охоплювати уповільнення прогресування 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он; хвороби. 1-[2-гідрокси-2-(4-метоксифеніл)етил]-2-тіоксоЩе один підхід заявленого винаходу стосуєть1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он; ся застосування сполуки формули (І) або її фар1-(2-метоксибензил)-2-тіоксо-1,2,3,5мацевтично прийнятної солі у виробництві медитетрагідро-піроло[3,2-d]піримідин-4-он; каменту для лікування або профілактики 1-(3-метоксибензил)-2-тіоксо-1,2,3,5атеросклерозу попередженням та/або зменшентетрагідро-піроло[3,2-d]піримідин-4-он; ням утворення нових атеросклеротичних ушко1-(2,4-диметоксибензил)-2-тіоксо-1,2,3,5джень або бляшок та/або попередженням або тетрагідро-піроло[3,2-d]піримідин-4-он; уповільненням прогресування існуючих ушкоджень 1-[(3-хлорпіридин-2-іл)метил]-2-тіоксо-1,2,3,5та бляшок. тетрагідро-піроло[3,2-d]піримідин-4-он; Ще один підхід заявленого винаходу стосуєть1-{[3-(2-етоксіетокси)піридин-2-іл]метил}-2ся застосування сполуки формули (І) або її фартіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4мацевтично прийнятної солі у виробництві медион; каменту для лікування або профілактики 1-[(6-оксо-1,6-дигідропіридин-2-іл)метил]-2атеросклерозу зміною складу бляшок для зментіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4шення ризику розриву бляшок та атеротромботичон; них явищ. 1-(1Н-індол-3-ілметил)-2-тіоксо-1,2,3,5Ще один підхід заявленого винаходу стосуєтьтетрагідро-піроло[3,2-d]піримідин-4-он; ся застосування сполуки формули (І) або її фар1-(1Н-бензимідазол-2-ілметил)-2-тіоксомацевтично прийнятної солі у виробництві меди1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он; каменту для лікування або профілактики 1-[(5-хлоро-1Н-індол-2-іл)метил]-2-тіоксореспіраторних розладів, як-то хронічної обструкти1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он; вної хвороби легень. Лікування може охоплювати 1-[(5-флуоро-1Н-індол-2-іл)метил]-2-тіоксоуповільнення прогресування хвороби. 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он; Згідно з винаходом, тут також запропоновано 1-(1Н-індол-6-ілметил)-2-тіоксо-1,2,3,5спосіб лікування або зменшення ризику хвороб тетрагідро-піроло[3,2-d]піримідин-4-он; або станів, є корисним де інгібування ферменту 1-(1Н-індол-5-ілметил)-2-тіоксо-1,2,3,5МПО, котрий полягає у застосуванні особою, що тетрагідро-піроло[3,2-d]піримідин-4-он; потерпає від вказаної хвороби або стану або при 17 89968 18 ризику цього, терапевтично ефективної кількості Згідно з ще одним підходом заявлений винахід сполуки формули (І) або її фармацевтично прийнстосується фармацевтичної композиції, що містить ятної солі. терапевтично ефективну кількість сполуки формуКрім того, тут також запропоновано спосіб ліли (І) або її фармацевтично прийнятної солі у сукування або зменшення ризику нейрозапальних міші з фармацевтично прийнятним ад'ювантом, розладів, кардіо- та церебрально-васкулярних розріджувачем або носієм для застосування у ліатеросклеротичних розладів або хвороби перифекуванні або профілактиці атеросклерозу поперерійних артерій або респіраторних розладів, як-то дженням та зменшенням утворення нових атерохронічна обструктивна хвороба легень, у особи, склеротичних ушкоджень та/або бляшок та/або що потерпає від вказаної хвороби або стану або попередженням або уповільненням прогресування при ризику цього, цей спосіб полягає у застосуіснуючих ушкоджень та бляшок. ванні особою терапевтично ефективної кількості Згідно з ще одним підходом заявлений винахід сполуки формули (І) або її фармацевтично прийнстосується фармацевтичної композиції, що містить ятної солі. терапевтично ефективну кількість сполуки формуКрім того, тут також запропоновано спосіб ліли (І) або її фармацевтично прийнятної солі у сукування або зменшення ризику розсіяного склероміші з фармацевтично прийнятним ад'ювантом, зу у особи, що потерпає від вказаної хвороби або розріджувачем або носієм для застосування у лістану або при ризику цього, цей спосіб полягає у куванні або профілактиці атеросклерозу зміною застосуванні особою терапевтично ефективної складу бляшок як-то для зменшення ризику розрикількості сполуки формули (І) або її фармацевтичву бляшок та атеротромботичних явищ. но прийнятної солі. Згідно з винаходом, тут також запропоновано Тут також запропоновано спосіб лікування або спосіб отримання нових сполук формули (І), або їх зменшення ризику атеросклерозу попередженням фармацевтично прийнятної солі, таутомеру, енанта/або зменшенням утворення нових атеросклеротіомеру, діастереомеру або рацемату, котрий потичних ушкоджень або бляшок та /або поперелягає у реакції сполуки формули (II), дженням або уповільненням прогресування існуючих ушкоджень та бляшок у особи, що потерпає від вказаної хвороби або стану або при ризику цього, цей спосіб полягає у застосуванні особою терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Тут також запропоновано спосіб лікування або зменшення ризику атеросклерозу зміною складу бляшок як-то для зменшення ризику розриву бляшок та атеротромботичних явищ у особи, що по1 12 де R , R та L визначено у формулі (І), a R терпає від вказаної хвороби або стану або при С1-6 алкоксил з оксигеном у безпосередньому ризику цього, цей спосіб полягає у застосуванні зв'язку з карбонілом у формулі (II), з алкоксилом, особою терапевтично ефективної кількості сполуки який визначено вище, або NH2; формули (І) або її фармацевтично прийнятної солі. з С1-6 алкоксилкарбонілізотіоціанатом або з Згідно з ще одним підходом винахід стосуєтьфенілкарбонілізотіоціанатом, де феніл, як варіант, ся фармацевтичної композиції, що містить терапезаміщено одною або більше групами, вибраними втично ефективну кількість сполуки формули (І) незалежно із С1-6 алкілу, галогену С1-6 алкоксилу, або її фармацевтично прийнятної солі у суміші з NO2, OH, CN, C1-6 алкіламіно або NH2; а де необфармацевтично прийнятним ад'ювантом, розріхідно, перетворення утвореної сполуки формули джувачем або носієм для застосування у лікуванні (І) або іншої її солі у її фармацевтично прийнятну або профілактиці хвороб або станів, де є корисним сіль; або перетворення утвореної сполуки формуінгібування ферменту МПО. ли (І) у наступну сполуку формули (І); а за потреЗгідно з наступним підходом винахід стосуєтьбою перетворення утвореної сполуки формули (І) ся фармацевтичної композиції, що містить терапеу її оптичний ізомер. втично ефективну кількість сполуки формули (І) У способі сполука формули (II) та алкоксилкаабо її фармацевтично прийнятної солі у суміші з рбонілізотіоціанат або фенілкарбонілізотіоціанат фармацевтично прийнятним ад'ювантом, розрірозчиняють або суспендують у придатному сухому джувачем або носієм для застосування у лікуванні органічному розчиннику, як-то дихлорметан, та або профілактиці нейрозапальних розладів. перемішують при 0-30 градусах, наприклад, при Згідно з наступним підходом винахід стосуєтьзовнішній температурі, до закінчення реакції, звися фармацевтичної композиції, що містить терапечайно у межах 5-60хвил., але якщо необхідно, втично ефективну кількість сполуки формули (І) протягом ночі. Переважно алкоксилкарбонілізотіоабо її фармацевтично прийнятної солі у суміші з ціанат є етоксикарбонілізотіоціанатом, а фенілкафармацевтично прийнятним ад'ювантом, розрірбонілізотіоціанат переважно є бензоїлізотіоціанаджувачем або носієм для застосування у лікуванні том. Після стандартної обробки проміжний або профілактиці розсіяного склерозу, кардіо- та продукт, як варіант, далі очищають перед обробцеребрально-васкулярних атеросклеротичних рокою основою, як-то натрій етоксидом в етанолі, зладів та хвороби периферійних артерій та респіводним натрій гідроксидом або аміаком у розчині, раторних розладів, як-то хронічна обструктивна аміаком у метанолі, що дає потрібну сполуку форхвороба легень. мули (І). Циклізацію проводять при підвищеній температурі у масляній бані або у мікрохвильово 19 89968 20 му реакторі. Дивись, наприклад, Norman et al., J. діоксані або толуолі можна застосовувати придатMed. Chem, 2000, 43, 4288-4312. Коли застосовуну основу, як-то цезій карбонат. Дивись наприють аміак у метанолі, переважно застосовують клад, J.P. Wolfe, S.L. Buchwald J. Org. Chem. 2000, посудину для високого тиску. 65, 1144-1157. Сполуки формули (II) є відомими у літературі або їх можна отримати, застосовуючи, відомі способи, що зрозуміло фахівцям. Дивись, наприклад, Suzuki et al., Chem. Pharm. Bull. 2002, 50, 11631168, або Furneaux, R.H., Tyler, P.C., J. Org. Chem. 1999,64,8411-8412. Сполуки формули (IV), (V), a (VI) є комерційно доступними або їх можна отримати, застосовуючи способи, добре відомі у літературі. Сполуки формули (II) можна отримати реакціЗаявлений винахід охоплює сполуки формули єю сполуки формули (III), 12 (І) у формі солей. Придатні солі охоплюють солі, де R визначено у формулі І, R визначено у утворені з органічних та неорганічних кислот або формулі II (дивись наприклад Furneaux et al., J. органічних та неорганічних основ. Таким солям, Org. Chem. 1999, 64, 8411-8412), це можна провозвичайно, слід бути фармацевтично прийнятними, дити, застосовуючи хоча солі фармацевтично неприйнятних кислот або основ можуть бути корисними в отриманні та очищенні розглянутої сполуки. Таким чином, переважні кислотно-адитивні солі охоплюють солі, утворені з хлоридної, бромідної, сульфатної, фоса) відновне амінування. У способі сполуку фофатної, лимонної, винної, молочної, піровиногрдрмули (III) можна змішувати з альдегідом формули ної, оцтової, бурштинової, фумарової, малеїнової, 1 (IV), де R визначено як у формулі І, у присутності метансульфонової та бензолсульфонової кислот. відновнику, як-то натрій ціаноборгідриду або наПереважні основно-адитивні солі охоплюють такі, трій триацетоксиборгідриду. Для каталізу реакції де катіон - натрій, калій, кальцій, алюміній, літій, можна додавати кислоту, переважно оцтову кисмагній, цинк, холін, етаноламін або діетиламін. лоту. Реакцію можна проводити у розчиннику, якСолі сполук формули (І) можна отримувати то метанолі, між зовнішньою температурою та реакцією сполуки або солі, її енантіомеру або ра50°С, переважно при зовнішній температурі. Після цемату з одним або більше еквівалентами прийнястандартної обробки продукт, як варіант, очищатної кислоти або основи. Реакцію можна проводиють флеш-хроматографією на колонці. Дивись ти у розчиннику або середовищі, де сіль є наприклад Suzuki et al., Chem. Pharm. Bull. 2002, нерозчинною, або у розчиннику, де сіль є розчин50, 1163-1168, або Furneaux, R.H., Tyler, P.C., J. ною, наприклад, воді, діоксані, етанолі, тетрагідOrg. Chem. 1999, 64, 8411-8412. рофурані або діетилетері, або суміші розчинників, котрі можна видаляти у вакуумі або сублімаційною сушкою. Реакція також може бути обмінним процесом або її можна проводити на іонообмінній смолі. Сполуки винаходу та інтермедіати, крім того, b) алкілування. У способі мезилат формули можна виділити з їх реакційної суміші та, якщо 1 (V), де R визначено вище, можна додавати при необхідно, наступним очищенням стандартними перемішуванні до розчину сполуки формули (III), способами. калій йодиду та основи, переважно калій карбонаСполуки формули (І) можуть існувати у енантіту. Реакцію можна проводити у розчиннику, як-то омерних формах. Тому, усі енантіомери, діастереΝ,Ν-диметилформаміді, при підвищеній темпераомери, рацемати, таутомери та їх суміші охоплено турі, переважно при 85°С. Реакційну суміш можна рамками винаходу. Різні оптичні ізомери можна обробляти екстракцією і тоді очищати флешвиділяти розділенням рацемічної суміші сполук, хроматографією на колонці для отримання сполузастосовуючи звичайні способи, наприклад, фракки формули (II). ційну кристалізацію, або ВЕРХ. Альтернативно, різні оптичні ізомери можна отримати безпосередньо, застосовуючи оптично активні вихідні матеріали. Проміжні сполуки можуть також існувати у енантіомерних формах та їх можна застосовувати як очищені енантіомери, діастереомери, рацемати c) перехресне сполучення сполуки формули 1 або суміші. (III) з придатним арилом сполуки (VI), де R визнаСполуки формули (І) можуть існувати у тауточено вище, a Halo є галогеном, переважно бромерних формах. Усі такі таутомери та суміші таумом, для отримання сполуки формули (II). Реакцію томерів охоплено рамками винаходу. можна проводити, застосовуючи, придатний палаПроміжні сполуки можуть також існувати у таудієвий каталізатор, як-то Pd2(dba)3 або Pd(OAc)2 томерних формах та їх можна застосовувати як разом з придатним лігандом, як-то BINAP. У реакочищені таутомери або суміші. ції, котру проводять при температурі 80°С-100°С у придатному розчиннику, як-то тетрагідрофурані, 21 89968 22 Сполуки формули (І), а їх фармацевтично пошкодженням, пошкодження спинного мозку та прийнятні солі є корисними, оскільки вони мають пошкодження/рубцювання/адгезія/відторгнення фармакологічну активність як інгібітори ферменту тканин. Рак легень також припускають асоційоваМПО. ним з високими рівнями МПО. Очікується, що споСполуки формули (І), а їх фармацевтично луки також є корисними у лікуванні болю. прийнятні солі показані для застосування у лікуОчікують, що профілактика є особливо важливанні або профілактиці хвороб або станів, де є вою для лікування осіб, які зазнали попереднього бажаною модуляція активності ферменту мієлопевипадку хвороби, інакше кажучи, при збільшеному роксидази (МПО). Зокрема, взаємозв'язок МПО ризику розглянутої хвороби або стану. Особи з активності з хворобою залучено у нейрозапальні ризиком розвитку особливої хвороби або стану хвороби. Тому сполуки заявленого винаходу є загалом охоплюють тих, хто має родинну історію особливо показаними для застосування у лікуванні хвороби або стану, або тих, кого ідентифіковано нейрозапальних станів або розладів у ссавців, генетичним тестуванням або скринінгом як особохоплюючи людину. Також показано, що сполуки є ливо чутливих до розвитку хвороби або стану. корисними у лікуванні кардіо- та церебральноДля вищезгаданих терапевтичних показань васкулярних атеросклеротичних розладів або хвозастосовувані дозування, безсумнівно, слід варіюроб периферійних артерій. Також показано, що вати згідно з застосованою сполукою, режимом сполуки є корисними у лікуванні респіраторних застосування та потребою лікування. розладів, як-то розладів респіраторного тракту з Однак, загалом, відповідні результати отригрупи: обструктивні хвороби дихальних шляхів, мують, коли сполуки застосовують при дозі тверохоплюючи: астму, як-то бронхіальна, алергічна, дої форми 1-2000мг на добу. інфекційно-алергічна, зовнішня, викликана фізичСполуки формули (І) та їхні фармацевтично ними навантаженнями, індукована ліками (охопприйнятні похідні можна застосовувати як такі або люючи аспірин та нестероїдні протизапальні засоу формі прийнятної фармацевтичної композиції, би), та астма, індукована пилом, як періодична, так де сполука або похідне є у суміші з фармацевтичі стійка усіх ступенів тяжкості, та іншими причинано прийнятним ад'ювантом, розріджувачем або ми гіперчутливість дихальних шляхів; хронічна носієм. Таким чином, ще один підхід винаходу стообструктивна хвороба легень (ХОХР); бронхіт, сується фармацевтичної композиції, що містить охоплюючи інфекційний та еозинофільний бронхіт; нову сполуку формули (І) або її фармацевтично емфізема; бронхоектаз; кистозний фіброз; саркоїприйнятні солі у суміші з фармацевтично прийнятдоз; легені фермера та пов'язані з цим хвороби; ним ад'ювантом, розріджувачем або носієм. Загіперчутливий пневмоніт; фіброз легень, охоплююстосування може бути, але без обмеження, ентечи криптогенний фіброзуючий альвеоліт, ідіопатиральним (охоплюючи пероральне, під'язикове або чні інтерстиціальні пневмонії, антинеопластична ректальне), інтраназальним, інгаляційним, внутрітерапія фіброзного ускладнення та хронічна інфешньовенним, місцевим або іншими парентералькція, охоплюючи туберкульоз та аспергілез та інші ними шляхами. Звичайні способи вибору та отригрибкові інфекції; ускладнення від легеневої транмання придатних фармацевтичних композицій сплантації; васкулітні та тромботичні розлади леописано, наприклад, у "Pharmaceuticals - The геневої судинної системи та легенева гіпертензія; Science of Dosage Form Designs", Μ. Ε. Aulton, активність проти кашлю, охоплюючи лікування Churchill Livingstone, 1988. Фармацевтична компохронічного кашлю, асоційованого з запальними та зиція переважно містить менше 80%. а більш песекреторними станами дихальних шляхів, та ятрореважно менше 50% сполуки формули (І) або її генний кашель; гострий та хронічний риніт, охопфармацевтично прийнятної солі. люючи риніт медикаментозний та вазомоторний Тут також запропоновано спосіб отримання риніт; багаторічний та сезонний алергічний риніт, такої фармацевтичної композиції, котрий полягає у охоплюючи риніт нервоза (сінна лихоманка); назазмішуванні компонентів. льний поліпоз; гостра вірусна інфекція, охоплюючи Приклади фармацевтичної композиції застуду та інфекцію, обумовлену респіраторним Наступні дані ілюструють репрезентативні фасинцитіальним вірусом, інфлюенцею, коронавірурмацевтичні форми дозування, що містять сполуки сом (охоплюючи SARS), а аденовірусом. Так стани формули І, або їхні солі, сольвати або сольватоабо розлади є зрозумілими фахівцям у рівні технівані солі, (далі - сполука X), для попереджувальки. ного або терапевтичного застосування ссавцями: Стани або розлади, які можна конкретно привести, охоплюють розсіяний склероз, хворобу (а): Таблетка мг/таблетку Альцгеймера, хворобу Паркінсона, бічний аміотСполука X 100 рофічний склероз та інсульт, а також інші запальні Лактоза 182,75 хвороби або стани, як-то астма, хронічна обструкНатрій-кроскармелоза 12,0 тивна хвороба легень, кистозний фіброз, ідіопатиПаста кукурудзяного крохмалю 2,25 чний легеневий фіброз, гострий респіраторний (5мас./об.% паста) дистресивний синдром, синусит, риніт, псоріаз, Магній стеарат 3,0 дерматит, увеїт, гінгівіт, атеросклероз, інфаркт міокарду, інсульт, коронарна хвороба серця, іше(b): Капсула мг/капсула мічна серцева хвороба, рестеноз, запальна хвороСполука X 10 ба кишківника, гломерулярне пошкодження нирок, Лактоза 488,5 фіброз печінки, сепсис, проктит, ревматоїдний Магній стеарат 1,5 артрит та запалення, асоційовані з реперфузійним 23 (с): Ін'єкція Сполука X 1М Розчин натрій гідроксиду 0,1Μ Хлоридна кислота Поліетиленгліколь 400 Вода для ін'єкції 89968 (50 мг/мл) 5,0мас./об.% 15,0% за об'ємом (для підгонки рН до 7,6) 4,5мас./об.% до 100% Вищенаведені композиції можна отримати звичайними способами, добре відомими у фармацевтичній техніці. Винахід подалі стосується комбінованого лікування, де сполуку формули (І) або її фармацевтично прийнятну сіль, або фармацевтичну композицію або рецептуру, що містить сполуку формули (І), застосовують одночасно або послідовно з терапією та/або агентом для лікування будь-якого з кардіо- та церебрально-васкулярних атеросклеротичних розладів та хвороб периферійних артерій. Зокрема, сполуку формули (І) або її фармацевтично прийнятні солі можна застосовувати в асоціації зі сполуками з одної або більше наступних груп: 1) антизапальні агенти, наприклад, a) нестероїдні протизапальні засоби (наприклад, ацетилсаліцилова кислота, ібупрофен, напроксен, флубіпрофен, диклофенак, індометацин); b) інгібітори синтезу лейкотриєну (5-LОінгібітори, наприклад, AZD4407, зилеутон, лікофелон, CJ13610, CJ13454; FLAP-інгібітори, наприклад, BAY-Y-1015, DG-031, MK591, МК886, А81834; інгібітори LТА4-гідролази, наприклад, SC56938, SC57461A); c) антагоністи рецептору лейкотриєну (наприклад, СР195543, амелубант, LY293111, аколат, МК571); 2) протигіпертензивні агенти, наприклад a) бета-блокатори (наприклад, метопролол, атенолол, соталол); b) інгібітори ферменту перетворення ангіотензину (наприклад, каптоприл, раміприл, хінаприл, еналаприл); c) блокатори каналів кальцію (наприклад, верапаміл, дилтіазем, фелодипін, амлодипін); d) антагоністи рецептору ангіотензину II (наприклад, ібесартан, кандесартан, телемісартан, лосартан); 3) антикоагулянти, наприклад a) інгібітори тромбіну (наприклад, ксимелагатран), гепарини, інгібітори фактору Ха; b) інгібітори агрегації тромбоцитів (наприклад, клопідрогель, тиклопідин, празугель, AZ4160); 4) модулятори метаболізму ліпіду, наприклад a) сенсибілізатори інсуліну, як-то агоністи PPAR (наприклад, піоглітазон, росиглітазон, галіда, мураглітазар, гефемрозил, фенофібрат); b) інгібітори HMG-CoA-редуктази, статини (наприклад, симвастатин, правастатин, аторвастатин, розувастатин, флувастатин); c) інгібітори поглинання холестерину (наприклад, езетиміб); d) інгібітори ІВАТ (наприклад, AZD-7806); e) агоністи LXR (наприклад, GW-683965A, Т0901317); 24 f) модулятори рецептору FXR; g) інгібітори фосфоліпази; 5) антистенокардіальні агенти, наприклад, нітрати та нітрити; 6) модулятори оксидативного стресу, наприклад, антиоксиданти (пробукол). Загальні способи Усі застосовані розчинники були аналітичної марки, а для реакцій застосовували комерційно доступні безводні розчинники. Звичайно, реакції перебігали в інертній атмосфері азоту або аргону. 1 13 Н та С ЯМР-спектри реєстрували при 400МГц для протону та 100МГц для карбону-13, на ЯМР-спектрометрі Varian Unity+ 400 з вимірювальною головкою 5мм ВВО з Z-градієнтами або ЯМР-спектрометрі Bruker Avance 400 з вимірювальною головкою з 60мкл двоїстим інверсним потоком з Z-градіентами, або ЯМР-спектрометрі Bruker DPX400 з 4-центровою вимірювальною головкою з Z-градієнтами. Якщо не вказано конкретно у прикладах, спектри реєстрували при 400МГц для протону та 100МГц для карбону-13. Застосовували наступні опорні сигнали: центральна лінія ДМСО1 13 d6 2,50 ( Н), 39,51 ( С); центральна лінія 1 13 CD3OD 3,31 ( Н) або 49,15 ( С); ацетон-d6 2,04 1 13 1 ( Н), 206,5 ( С); та CDCI3 7,26 ( Н), центральна 13 лінія CDCI3 77,16 ( С) (якщо не вказане інше). Мас-спектри реєстрували на Waters РХМС, що складається з Alliance 2795 (РХ), Waters PDA 2996 та детектора ELS (Sedex 75) та одиночного квадрупольного мас-спектрометра ZMD. Масспектрометр був з джерелом іонізації електророзпилюванням (ES), керований у режимі позитивного або негативного іону. Вольтаж капіляру - 3кВ та вольтаж конусу - 30В. Мас-спектрометр сканував m/z 100-600 з часом сканування 0,7сек. Ступінь нагрівання встановлено до 40°С. Детектор Diode Array сканував від 200-400нм. Температуру детектора ELS доводили до 40°С та тиск встановлено, до 1,9бар. Лінійний градієнт для РХ-розділення наносили, починаючи з 100% А (А: 10мМ NH4OAc у 5% MeCN) та закінчуючи при 100% В (В: MeCN) через чотири хвилини. Застосовували колонку ХTerra МС С8, 3,0 50; 3,5мкм (Waters), перебіг 1,0мл/хвил. Альтернативно, мас-спектри робили на ГХ-МС (ГХ 6890, 5973N MSD), постаченому Agilent Technologies. Застосовували колонку VF-5 МС, ID 0,25мм 30m, 0,25мкм (Varian Inc.). Лінійний градієнт температури наносили, починаючи з 40°С (утримання -1 хвилина) та закінчуючи при 300°С (утримання - 1 хвилина), 25°С/хвилина. МС був з іонним джерелом СІ, газом-реагентом був метан. МС сканував m/z 50-500 та швидкість сканування встановлено до 3,25сканувань/сек. МС був з іонним джерелом ЕІ. МС сканував m/z 50-500, швидкість сканування встановлено до 3,25сканувань/сек. Електронний вольтаж встановлено до 70еВ. ВЕРХ-аналізи проводили на системі Agilent HP1100, що складається з мікровакуумного дегазатору G1379A, подвійного насосу G1312A, коміркового планшету з автоматичним пробовідбірником G1367A, G1316A відділом термостатованої колонки та G1315B детектором діодної матриці. Колонка: X-Terra MS, Waters, 3,0 100мм, 3,5мкм. 25 89968 26 Температуру колонки встановлено до 40°С та 15мл/хвил. Альтернативно, очистку виконували швидкість потоку до 1,0мл/хвил. Детектор з діоднапівпрепаративною ВЕРХ Shimadzu PX-8A з УФною матрицею сканував 210-300нм, шаг та ширину віз.-детектором Shimadzu SPD-10A, з колонкою піку встановлено 2нм та 0,05 хвилин, відповідно. Waters Symmetry - (C18, 5мм, 100мм 19мм). ЗаЛінійний градієнт наносили, починаючи з 100% А стосовували вузькі градієнти MeCN/0,1% трифлу(А: 10мМ NH4OAc у 5% MeCN) та закінчуючи при ороцтова кислота у MilliQ Water при швидкості по100% В (В: MeCN) за 6 хвилин. току 10мл/хвил. Мікрохвильове нагрівання проводили у ініціаЗвичайно, перекристалізацію проводили у роторі або СВЧ-резонаторі одномодово-го синтезазчинниках або суміші розчинників, як-то етер, етитору Сміта, що дає безперервне опромінення при лацетат/гептан та метанол/вода. 2450МГц. Застосовано наступні скорочення: Типовий спосіб обробки після реакції складавBINAP 2,2'біс(дифенілфосфіно)-1,1'бінафтил ся з екстракції продукту розчинником, як-то етилаДМФ Ν,Ν-диметилформамід; цетатом, промивання водою, а потім сушки органіДМСО диметилсульфоксид; чної фази над MgSO4 або Na2SO4, фільтрування DIBAL діізобутилалюмогідрид; та концентрування розчину у вакуумі. Et3N триетиламін; Тонкошарову хроматографію (ТШХ) проводиНОАс оцтова кислота; ли на Merck ТШХ-планшетах (силікагель 60 F254) з NaBH4 натрій боргідрид; УФ-візуалізацією плям. Флеш-хроматографію на NaCNBH3 натрій ціаноборгідрид; колонці виконували на Combi Flash Companion , Рd2(dbа)3 трис(дибензиліденацетон)дипаладій; застосовуючи нормально-фазові флеш-колонки Pd(OAc)2 паладій діацетат; RediSep™. Типові розчинники, застосовані для TBDMSCl трет-бутилдиметилсилілхлорид; флеш-хроматографії на колонці, - суміші хлороTEMPO 2,2,6,6-тетраметил-1-піперидинілоксил форм/метанол, дихлорметан/метанол та гепТГФ тетрагідрофуран. тан/етилацетат. Застосовані вихідні матеріали були доступниПрепаративну хроматографію проводили на ми з комерційних джерел або їх отримували згідно ВЕРХ з автооочисткою Waters, з детектором з діоз літературними способами та мали експеримендною матрицею. Колонка: ХTerra МС С8, тальні дані згідно з цими повідомленнями. Наступний приклад - приклад отримання вихідного мате19 300мм, 10мкм. Застосовували точні градієнти ріалу: MeCN/(95:5 0,1Μ NH4OAc:MeCN) при швидкості Естер 3-аміно-1Н-пірол-2-карбонової кислоти: потоку 20мл/хвил. Альтернативно, застосовували Furneaux, R.H., Tyler, Р.С., J. Org. Chem. 1999, 64, ще одну колонку; колонка Atlantis С18 19 100мм, 8411-8412. 5мкм. Градієнт - ацетонітрил/0,1М амоній ацетат у Загальний спосіб А 5% ацетонітрилі у MilliQ Water, перебіг 0% - 3550% ацетонiтрилу, у 15хвил. Швидкість потоку: Реакційну суміш амінопірол-естеру А1 (1,0еквів.), альдегіду А2 (1,0-2,0екв.) та NaCNBH3 (1,0екв.) у метанолі перемішували при кімнатній температурі протягом 24 годин. У деяких прикладах для каталізу реакції додавали оцтову кислоту (1-2екв.). Якщо реакція не завершилася після 24 годин (перевіряли ТШХ або РХ-МС), додавали більше альдегіду А2 та суміш перемішували при кімнатній температурі до завершення реакції. Тоді суміш випарювали на силікагелі та очищали флеш-хроматографією на колонці. Загальний спосіб В Етоксикарбонілізотіоціанат В2 (1,0-1,2екв.) додавали до амінопірол-естеру В1 (1,0екв.) у СН2СІ2 та суміш перемішували при кімнатній температурі протягом 5-60хвил. або протягом ночі. Додавали воду та водну фазу екстрагували СН2СІ2. Органіч ну фазу комбінували, сушили (MgSO4) та концентрували. Сирий інтермедіат з відкритим кільцем очищали флеш-хроматографією на колонці. Інтермедіат розчиняли у 1Μ NaOEt у EtOH (1,1-1,5екв.) та гріли у мікрохвильовому реакторі протягом 27 89968 28 13 -1 10хвил. при 120°С. Доводили рН до нейтрального С ЯМР (ДМСО-d6) млн 172,8, 152,4, 137,3, рН за допомогою 2М НСІ; твердий продукт збира127,7, 113,6, 97,1, 56,2, 26,4, 19,7; ли фільтруванням та промивали водою. Сирий МС (ΙΕΡ) m/z 224 (Μ+1). продукт очищали, застосовуючи препаративну Приклад 3 ВЕРХ, або флеш-хроматографію на колонці або 1-(Піридин-2-ілметил)-2-тіоксо-1,2,3,5перекристалізацією. тетрагідро-піроло[3,2-d]піримідин-4-он Винахід далі ілюстровано прикладами, але без (a) 3-[(Піридин-2-ілметил)аміно]-1Н-пірол-2обмеження. Окрім того, де вказане інше, сполуки карбонової кислоти етил-естеру прикладів 1а-4а та 5с та 7b отримували, застосоЗаголовну сполуку отримували як масло з 54% вуючи загальний спосіб А, сполуки прикладів 1b-4b виходу, починаючи з 3-аміно-1Н-пірол-2та 5d та 7с отримували, застосовуючи загальний карбонової кислоти етил-естеру (0,40г, 2,59ммоль) спосіб В. та 2-піридинкарбоксальдегіду (0,27+0,07мл, Приклад 1 3,55ммоль). 1 -1 1-Бутил-2-тіоксо-1,2,3,5-тетрагідро-піроло[3,2Н ЯМР (ДМСО-d6) млн 10,77 (1Н, br s), 8,52 d]піримідин-4-он (1Н, d, J=4,0Гц), 7,80-7,67 (1H, m), 7,35 (1Н, d, (a) 3-(Бутиламіно)-1Н-пірол-2-карбонової кисJ=7,8Гц), 7,25 (1H, dd, J=7,3, 5,0Гц), 6,71 (1H, t, лоти етил-естер J=3,0Гц), 6,10 (1H, br s), 5,57 (1H, t, J=2,4Гц), 4,37 Заголовну сполуку отримували як масло з 60% (2H, d, J=5,8Гц), 4,21 (2H, q, J=7,2Гц), 1,29 (3H, t, виходом, починаючи з 3-аміно-1Н-пірол-2J=7,1Гц); карбонової кислоти етил-естеру (0,81г, 5,26ммоль) MC (ΙΕΡ) m/z 246 (Μ+1). та бутиральдегіду (0,47+0,55мл, 11,4ммоль). (b) 1-(Піридин-2-ілметил)-2-тіоксо-1,2,3,51 -1 Н ЯМР (ДМСО-d6) млн 10,71 (1Н, br s), 6,74 тетрагідро-піроло[3,2-d]піримідин-4-он (1Н, t, J=3,1Гц), 5,62 (1H, t, J=2,6Гц) 5,19 (1H, s), Заголовну сполуку отримували як твердий ма4,17 (2Н, q, J=7,0Гц), 3,04 (2H, q, J=6,6Гц), 1,50 теріал з 14% виходу, починаючи з 3-[(піридин-2(2H, m), 1,34 (2Н, m), 1,25 (3H, t, J=7,0Гц), 0,90 (3H, ілметил)аміно]-1Н-пірол-2-карбонової кислоти t, J=7,3Гц); етил-естеру (0,34г, 1,39ммоль) та етоксикарбоніліMC (IEP) m/z 211 (M+1). зотіоціанату (0,19мл, 1,66ммоль). 1 -1 (b) 1-Бутил-2-тіоксо-1,2,3,5-тетрагідроН ЯМР (ДМСО-d6) млн 12,34 (2Н, brs), 8,49 піроло[3,2-d]піримідин-4-он (1Н, d, J=4,5Гц), 7,73 (1Н, m), 7,29 (1Н, d, J=2,8Гц), Заголовну сполуку отримували як твердий ма7,27 (1Н, m), 7,21 (1Н, d, J=7,8Гц), 6,09 (1Н, d, теріал з 44% виходу, починаючи з 3-(бутиламіно)J=2,8Гц), 5,75 (2Н, s); 13 -1 1Н-пірол-2-карбонової кислоти етил-естеру (0,10г, С ЯМР (ДМСО-d6) млн 173,4, 155,2, 152,6, 0,48ммоль) та етоксикарбонілізотіоціанату 149,1, 137,1, 136,8, 127,9, 122,4, 121,2, 113,6, 96,9, (0,06мл, 0,58ммоль). 54,2; 1 -1 Н ЯМР (ДМСО-d6) млн 12,38 (1Н, s), 12,10 MC (IEP) m/z 259 (M+1). (1Н, s), 7,37 (1Н, d, J=2,9), 6,31 (1Н, d, J=2,6Гц), Приклад 4 4,36 (2Н, m), 1,69 (2Н, m), 1,38 (2Н, m), 0,92 (3H, t, 1-(2-флуоро-бензил)-2-тіоксо-1,2,3,5J=7,5Гц); тетрагідро-піроло[3,2-d]піримідин-4-он MC (IEP) m/z 224 (M+1). (a) 3-(2-флуоро-бензиламіно)-1Н-пірол-2Приклад 2 карбонової кислоти етил-естеру 1-ізобутил-2-тіоксо-1,2,3,5-тетрагідроЗаголовну сполуку отримували як масло з кіпіроло[3,2-d]піримідин-4-он лькісним виходом, починаючи з 3-аміно-1Н-пірол(а) 3-(ізобутиламіно)-1Н-пірол-2-карбонової 2-карбонової кислоти етил-естеру (0,50г, кислоти етил-естеру 3,2ммоль) та 2-флуорбензальдегіду (0,34мл, Заголовну сполуку отримували як масло з 71% 3,2ммоль), застосовуючи загальний спосіб А, але з виходу, починаючи з 3-аміно-1Н-пірол-2наступними модифікаціями. Через 5 годин додакарбонової кислоти етил-естеру (0,40г, 2,59ммоль) вали більше NaCNBH3 (100мг, 1,6ммоль) та потім та ізобутиральдегіду (0,26+0,07мл, 3,61ммоль). більше 2-флуорбензальдегіду (120мг, 1ммоль) і 1 -1 Н ЯМР (ДМСО-d6) млн 10,68 (1Н, s), 6,74 тоді реакційну суміш перемішували протягом ночі. 1 -1 (1Н, t, J=3,0Гц), 5,62 (1Н. t, J=2,4Гц), 5,30 (1Н, brs), Н ЯМР (ДМСО-d6) млн 10,76 (1Н, br s), 7,47 4,18 (2Н, q, J=7,2Гц), 2,88 (2Н, t, J=6,4Гц), 1,79 (1Н, (1Н, m), 7,38 (1Н, m), 7,28 (2Н, m), 6,70 (1Н, m), m), 1,26 (3H, t, J=7,1Гц), 0,90 (3H, s), 0,89 (3H, s); 5,74 (1Н, br s), 5,61 (1H, m), 4,34 (2H, m), 4,18 (2H, 13 -1 С ЯМР (ДМСО-d6) млн 160,9, 124,2, 95,0, q, J=7,1Гц), 1,25 (3H, t, J=7,1Гц); 58,2, 52,4, 27,9, 20,0, 14,7; MC (ES) m/z 263 (M+1). MC (IEP) m/z 211 (M+1). (b) 1-(2-флуоро-бензил)-2-тіоксо-1,2,3,5(b) 1-ізобутил-2-тіоксо-1,2,3,5-тетрагідротетрагідро-піроло[3,2-d]піримідин-4-он піроло[3,2-d]піримідин-4-он Заголовну сполуку отримували як твердий маЗаголовну сполуку отримували як твердий матеріал з 45% виходу, починаючи з 3-(2-флуоротеріал з 24% виходу, починаючи з 3бензиламіно)-1Н-пірол-2-карбонової кислоти етил(ізобутиламіно)-1Н-пірол-2-карбонової кислоти естеру (0,85г, 3,2ммоль) та етоксикарбонілізотіоціетил-естеру (0,38г, 1,79ммоль) та етоксикарбоніліанату (0,44мл, 3,9ммоль). 1 -1 зотіоціанату (0,24мл, 2,15ммоль). Н ЯМР (ДМСО-d6) млн 12,41 (2Н, br s), 7,33 1 -1 Н ЯМР (ДМСО-d6) млн 12,36 (1Н, br s), (2Н, m), 7,24 (1Н, m), 7,10 (1Н, m, J=7,5, 7,5Гц), 12,13 (1Η, br s), 7,35 (1H, d, J=2,8Гц), 6,34 (1H, d, 7,01 (1H, m, J=7,1Гц, 7,1 Гц), 6,12 (1Н, d, J=2,8Гц), J=2,8Гц), 4,21 (2H, d, J=7,33Гц), 2,44 (1H, m), 0,91 5,72 (2Н, s); (3H, s), 0,90 (3H, s); 29 89968 30 m), 4,05 (2Н, m), 3,92 (2Н, t, J=6,4Гц), 3,59 (2H, m), С ЯМР (ДМСО-d6) 173,9, 161,4, 159,0, 3,32 (3H, s), 1,76 (2Н, m), 1,26 (3H, t, J=7,1Гц), 1,00 152,9, 137,1, 129,6, 129,5, 128,5, 128,1, 128,1, (3Н, m); 125,0, 124,9, 123,2, 123,0, 115,8, 115,6, 114,1, 96,9, MC (IEP) m/z 377 (M+1). 47,1, 47,1; (d) 1-[2-(2-Метоксіетокси)-3-пропоксибензил]-2MC (IEP) m/z 276 (M+1). тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4Приклад 5 он 1-[2-(2-Метоксіетокси)-3-пропоксибензил]-2Заголовну сполуку отримували як твердий матіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4теріал з 13% виходом, починаючи з 3-{[2-(2он метоксіетокси)-3-пропоксибензил]аміно}-1Н-пірол(а) 3-Гідрокси-2-(2-метоксіетокси)бензальдегід 2-карбонової кислоти етил-естеру (0,87г, 2-Хлоретилметил-етер (4,63мл, 50,7ммоль) 2,31ммоль) та етоксикарбонілізотіоціанату додавали краплями до суміші 2,3(0,26мл, 2,31ммоль). дигідроксибензальдегіду (7,0г, 50,7ммоль), калій 1 -1 Н ЯМР (ДМСО-d6) млн 12,43 (1Н, br s), йодиду (8,41г, 50,69ммоль) та калій карбонату (7,71г, 55,8ммоль) у ДМФ (80мл). Утворену суміш 12,31 (1Н, br s), 7,29 (1H, d, J=3,0Гц), 6,96-6,85 (2H, перемішували при кімнатній температурі під атмоm), 6,41 (1H, dd, J=7,3, 1,5Гц), 6,02 (1H, d, J=2,8Гц), сферою азоту протягом 2 діб та при 70°С протягом 5,71 (2H, s), 4,23 (2H, m), 3,95 (2H, t, J=6,3Гц), 3,65 2 діб. Реакційну суміш розподіляли між насиченим (2H, m), 3,33 (3H, s), 1,82-1,72 (2H, m), 1,02 (3H, t, амоній хлоридом (водн.) та СН2СІ2. Водну фазу J=7,4Гц); реекстрагували СН2СІ2 та комбіновані органічні MC (IEP) m/z 390 (M+1). фази промивали розсолом, сушили (Na2SO4) та Приклад 6 випарювали на силікагелі. Очищення флеш1-(6-Етокси-піридин-2-ілметил)-2-тіоксохроматографією на колонці (градієнт геп1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он тан/етилацетат; 0-30% етилацетат) дало сире ма(a) 6-Етокси-піридин-2-карбонової кислоти сло, котре потім очищали флеш-хроматографією етил-естер на колонці (градієнт гептан/етилацетат; 0-40% Етил йодид (2,3мл, 28,8ммоль) додавали до етилацетат) з отриманням заголовної сполуки суспензії 6-гідрокси-піридин-2-карбонової кислоти (3,13г, 31%) як масла. (1,0г, 7,2ммоль) та аргентум(І) карбонату (4,0г, 1 -1 14,4ммоль) у СНСІ3 (70мл). Суспензію перемішуН ЯМР (ДМСО-d6) млн 10,34 (1Н, br s), 9,88 вали при зовнішній температурі протягом 3 діб. (1Н, br s), 7,16 (2H, m), 7,05 (1H, m), 4,25 (2H, m), Нерозчинний матеріал видаляли фільтруванням 3,60 (2H, m), 3,26 (3H, m); 13 -1 та промивали СНСІ3. Фільтрат концентрували для C ЯМР (ДМСО-d6) млн 190,5, 150,7, 149,6, отримання заголовного продукту з кількісним ви129,9, 124,1, 122,6, 116,9, 72,1, 70,9, 57,9; ходом (1,5г) як масла. Цей матеріал застосовуваMC (IEP) m/z 197 (M+1). ли на наступному етапі без наступної очистки. (b)2-(2-Метоксіетокси)-3-пропоксибензальдегід 1 -1 Н ЯМР (CDCI3) млн 7,65 (2Н, m), 6,88 (1Н, 1-Йодпропан (3,09мл, 31,60ммоль) додавали m), 4,45 (2Н, q, J=7,0Гц), 4,41 (2H, q, J=7,3Гц), 1,40 до розчину 3-гідрокси-2-(2(6H, m); метоксіетокси)бензальдегіду (3,1г, 15,8ммоль) та MC (IEP) m/z 196 (M+1). калій карбонату (4,37г, 31,60ммоль) у ДМФ (80мл) і (b) (6-Етокси-піридин-2-іл)-метанол суміш перемішували при 100°С протягом ночі під NaBH4 (5,7г, 151ммоль) додавали порціями атмосферою азоту. Реакційну суміш розподіляли протягом 35хвил. до 6-етокси-піридин-2між насиченим амоній хлоридом (водн.) та СН2СІ2. карбонової кислоти етил-естеру (1,5г, 7,5ммоль) у Органічну фазу промивали розсолом, сушили EtOH (75мл). Утворену суміш перемішували при (Na2SO4) та концентрували для отримання заголозовнішній температурі протягом 2 діб. Додавали вної сполуки з кількісним виходом (3,8г) як масла. воду та суміш екстрагували СН2СІ2. Органічну фаЦе матеріал застосовували на наступному етапі зу сушили (Na2SO4), фільтрували і тоді концентрубез наступної очистки. 1 -1 вали для отримання заголовного продукту (0,85г) з Н ЯМР (ДМСО-d6) млн 10,37 (1Н, s), 7,36 74% виходу як масла. Цей матеріал застосовували (1Н, m, J=8,0Гц), 7,26 (1Н, m), 7,17 (1Н, t, J=7,8Гц), на наступному етапі без наступної очистки. 4,28 (2Н, m), 4,02 (2Н, t, J=6,3Гц), 3,62 (2Н, m), 3,26 1 -1 Н ЯМР (CDCI3) млн 7,55 (1Н, m), 6,77 (1Н, (3H, s), 1,80 (2Н, m), 1,02 (3H, t, J=7,3Гц); 13 -1 d, J=7,4Гц), 6,61 (1Н, d, J=8,1Гц), 4,66 (2Н, d, С ЯМР (ДМСО-d6) млн 190,3, 152,1, 150,9, J=5,3Гц), 4,38 (2Н, q, J=7,1Гц), 3,46 (1Н, t, J=5,2Гц), 129,6, 124,4, 119,4, 117,8, 72,5, 70,9, 70,0, 57,9, 1,41 (3H, t, J=7,1Гц). 22,1,10,4; (с) 6-Етокси-піридин-2-карбальдегід MC (IEP) m/z 239 (M+1). ДМСО (0,50мл, 6,4ммоль) у СН2СІ2 (10мл) до(с) 3-{[2-(2-Метоксіетокси)-3давали краплями до розчину оксалілхлориду (2М у пропоксибензил]аміно}-1Н-пірол-2-карбонової кисСН2СІ2, 3,1мл, 6,1ммоль) у СН2СІ2 (20мл) при лоти етил-естеру 60°С. Утворену суміш перемішували при -60°С Заголовну сполуку отримували як масло з кіпротягом 10хвил. Додавали краплями (6-Етоксилькісним виходом, починаючи з 3-аміно-1Н-піролпіридин-2-іл)-метанол (0,85г, 5,6ммоль) у СН2СІ2 2-карбонової кислоти етил-естеру (0,35г, (5мл) та ДМСО (4мл). Суміш перемішували при 2,27ммоль) та 2-(2-метоксіетокси)-360°С протягом 3 годин і тоді давали нагрітися до пропоксибензальдегіду (0,47+0,08г, 3,06ммоль). 1 -1 20°С та додавали Et3N (6мл). Утворений розчин Н ЯМР (ДМСО-d6) млн 10,69 (1Н, br s), 7,13 перемішували при зовнішній температурі протягом (1Н, s), 7,6,99 (2Н, m), 6,70 (1Н, m), 5,63 (1Н, m), 40хвил. Додавали воду та суміш екстрагували 4,92 (1Н, t, J=5,7Гц), 4,52 (2H, d, J=5,8Гц), 4,19 (2H, 13 31 89968 32 СН2СІ2. Органічну фазу промивали розсолом, суДМСО (0,18мл, 2,6ммоль) у СН2СІ2 (5мл) дошили (Na2SO4) та концентрували. До залишку додавали краплями до розчину оксалілхлориду (2М у давали діетилетер та нерозчинний матеріал видаСН2СІ2, 0,65мл, 1,3ммоль) у СН2СІ2 (4мл) при ляли фільтруванням. Фільтрат концентрували з 78°С. Утворену суміш перемішували при -68°С отриманням заголовної сполуки (0,60г) з 70% випротягом 15хвил. Додавали краплями 3ходу як твердого матеріалу. Цей сирий продукт гідроксиметил-піперидин-1-карбонової кислоти застосовували на наступному етапі без наступної трет-бутил-естер (Dean A. Wacker et al. Bioorganic очистки. & Medicinal Chemistry Letters 2002, 12, 1785-1789) 1 -1 (0,22г, 1,0ммоль) у СН2СІ2 (4мл) та протягом 15 Н ЯМР (CDCI3) млн 9,93 (1Н, s), 7,71 (1Н, хвилин перемішування при -78°С додавали Et3N m), 7,53 (1Н, d, J=7,1Гц), 6,94 (1H, d, J=8,3Гц), 4,46 (6мл). Утворений розчин перемішували при зовні(2H, d, J=7,1Гц), 1,42 (3H, t, J=7,1Гц). шній температурі протягом 16 годин. Додавали (d) 3-[(6-Етокси-піридин-2-ілметил)-аміно]-1Нводу та суміш екстрагували діетилетером, органіпірол-2-карбонової кислоти етил-естеру чний прошарок сушили (Na2SO4) та концентрували Оцтову кислоту (0,3мл) додавали до 6-етоксидля отримання продукту як жовтого масла (0,20г, піридин-2-карбальдегіду (0,59г, 3,9ммоль) та 392% виходу). Цей сирий продукт застосовували на аміно-1Н-пірол-2-карбонової кислоти етил-естеру наступному етапі без наступної очистки. (0,30г, 1,9ммоль) в етанолі (10мл). Через 1,5 годиMC (IEP) m/z 214 (M+1). ни додавали NaCNBH3 (0,24г, 3,9ммоль) та утво(b) 3-[(2-Етоксикарбоніл-1Н-пірол-3-іламіно)рену суміш перемішували при зовнішній темпераметил]-піперидин-1-карбонової кислоти треттурі протягом 19 годин. Розчинник видаляли у бутил-естер вакуумі, до залишку додавали етилацетат та неЗаголовну сполуку отримували як масло з 30% розчинний матеріал видаляли фільтруванням. виходу, починаючи з 3-аміно-1Н-пірол-2Фільтрат концентрували та сирий продукт очищакарбонової кислоти етил-естеру (0,14г, 0,92ммоль) ли флеш-хроматографією на колонці (градієнт та 3-форміл-піперидин-1-карбонової кислоти третгептан/етилацетат; 0-35% етилацетат), отримуючи бутил-естеру (0,20г, 0,92ммоль). 0,25г (45%) заголовного продукту як твердого ма1 -1 Н ЯМР (CDCI3) млн 8,29 (1Н, br s), 6,70 теріалу. 1 -1 (1Н, s), 5,67 (1Н, m), 4,27 (2Н, m), 3,93 (1Н, br s), Н ЯМР (CDCI3) млн 8,16 (1Н, br s), 7,50 3,85 (1H, d, J=13,2Гц), 3,10-2,94 (2H, m), 2,83 (1H, (1H, m), 6,89 (1H, d, J=7,3Гц), 6,70 (1H, br s), 6,57 m), 2,65 (1H, br s), 1,85 (1H, m), 1,76 (1H, m), 1,64 (1H, d, J=8,1Гц), 4,45 (2H, q, J=7,0Гц), 5,71 (1H, m), (1H, m), 1,42 (9H, s), 1,31 (3H, t, J=6,8Гц), 1,22 (1H, 4,38 (5H, m), 1,37 (6H, m); m); MC (IEP) m/z 290 (M+1). MC (IEP) m/z 352 (M+1). (e) 1-(6-Етокси-піридин-2-ілметил)-2-тіоксо(c) 1-Піперидин-3-ілметил-2-тіоксо-1,2,3,51,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он тетрагідро-піроло[3,2-d]піримідин-4-он Етоксикарбонілізотіоціанат (0,12г, 0,90ммоль) Заголовну сполуку отримували як твердий мадодавали до 3-[(6-Етокси-піридин-2-ілметил)теріал з 20% виходу, застосовуючи 3-[(2аміно]-1Н-пірол-2-карбонової кислоти етил-естеру етоксикарбоніл-1Н-пірол-3-іламіно)-метил](0,24г, 0,82ммоль) у СН2СІ2 (5мл) та розчин перепіперидин-1-карбонової кислоти трет-бутил-естер мішували при зовнішній температурі протягом (97мг, 0,27ммоль) та етоксикарбонілізотіоціанат 35хвил. Розчинник випарювали та до залишку до(36мг, 0,27ммоль), застосовуючи загальний спосіб давали 0,4М NaOEt в етанолі (3мл, 1,2ммоль) і В, з наступною модифікацією. Після опосередкосуміш гріли при кипінні під зворотним холодильниваної основою реакції циклізації до реакційної суком протягом 1 години, додавали більше NaOEt міші додавали 6Μ НСІ (0,3мл) та потім нагрівали у (0,4М в етанолі, 1,5мл, 0,6ммоль) і розчин гріли мікрохвильовому реакторі протягом 4хвил. при при кипінні під зворотним холодильником ще 1,5 100°С. Розчинник видаляли у вакуумі та твердий години. Розчинник випарювали, залишок розчинязалишок очищали препаративною ВЕРХ, застосоли у воді та рН доводили до нейтрального рН 1Μ НСІ. Утворену тверду речовину збирали, промивуючи колонку Atlantis С1819 100мм, 5мкм. Градівали та сушили для отримання сирого продукту. єнт - ацетонітрил/0,1М амоній ацетат у 5% ацетоЦей матеріал очищали препаративною ВЕРХ з нітрилі у MilliQ Water, перебіг 0%-50% ацетонітрил отриманням заголовної сполуки (38мг, 15%) як за 15хвил. Швидкість потоку: 15мл/хвил. 1 -1 твердого матеріалу. Н ЯМР (Метанол-d4) млн 7,23 (1Н, d, 1 -1 Н ЯМР (ДМСО-d6) млн 12,32 (2Н, br s), 7,62 J=3,2Гц), 6,21 (1Н, d, J=3,2Гц), 4,46 (1Н, m), 4,23 (1Н, m), 7,29 (1Н, d, J=3,0Гц), 6,78 (1H, d, J=7,3Гц), (1Н, m), 3,22 (2Н, m), 2,86 (2Н, m), 2,58 (1Н, m), 6,64 (1H, d, J=8,3Гц), 6,13 (1H, d, J=2,8Гц), 5,65 1,83 (2Н, m), 1,62 (1Н, m), 1,42 (1H, m); 13 (2H, s), 4,17 (2Н, q, J=7,1Гц), 1,19 (3H, 7, J=7,0Гц); С ЯМР (Метанол-d4) 178,8, 154,7, 139,3, 13 С ЯМР (ДМСО-d6) 173,5, 162,7, 152,8, 129,5, 115,3, 97,8, 53,7, 48,0, 45,2, 34,5, 27,6, 23,2; 152,5, 139,6, 137,2, 127,8, 113,9, 113,6, 109,0, 97,0, MC (IEP) m/z 265 (M+1). 61,0, 53,8, 14,3; Приклад 8 MC (IEP) m/z 303 (M+1). 1-Бутил-4-тіоксо-1,3,4,5-тетрагідро-2НПриклад 7 піроло[3,2-d]піримідин-2-он 1-Піперидин-3-ілметил-2-тіоксо-1,2,3,5Етоксикарбонілізотіоціанат (0,13мл, 1,1ммоль) тетрагідро-піроло[3,2-d]піримідин-4-он додавали до 3-(бутиламіно)-1Н-пірол-2-карбонової (a) 3-Форміл-піперидин-1-карбонової кислоти кислоти етил-естеру (0,23г, 1,1ммоль) у толуолі трет-бутил-естер (5мл) та суміш гріли при 90°С протягом 1 години. Осад відфільтровували та промивали гексаном. 33 89968 34 Продукт інтермедіату обробляли калій гідроксидом льний спосіб А але з наступними модифікаціями. (0,55г, 9,9ммоль) у воді (9мл) та гріли при кипінні Через 6 годин додавали ще 2-метокси-2під зворотним холодильником протягом 15 годин. метилпропаналь (0,165г, 1,62ммоль) і тоді реакПісля охолодження до зовнішньої температури ційну суміш перемішували протягом ночі. 1 -1 доводили рН до 5 за допомогою 12Μ НСІ. УтвореН ЯМР (ДМСО-d6) млн 10,69 (1Н, br s), 6,74 ний осад збирали фільтруванням та промивали (1Н, t, J=3,0Гц), 5,64 (1H, t, J=2,6Гц), 5,33 (1H, br s), водою. Сирий продукт очищали, застосовуючи 4,17 (2H, q, J=7,1Гц), 3,11 (3H, s), 3,03 (2H, d, препаративну ВЕРХ для отримання заголовної J=5,8Гц), 1,26 (3H, t, J=7,1Гц), 1,13 (6H, s); сполуки (16мг, 6%) як твердого матеріалу. MC (IEP) m/z 241 (M+1). 1 -1 Н ЯМР (ДМСО-d6) млн 12,04 (1H, brs), (b) 1-(2-метокси-2-метилпропіл)-2-тіоксо11,95 (1H, br s), 7,40 (1H, s), 6,23 (1H, d, J=2,7Гц), 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он 3,84 (2Η, t, J=7,2Гц), 1,66-1,56 (2Η, m), 1,32 (2Η, m), Заголовну сполуку отримували як твердий ма0,89 (3Η, t, J=7,3Гц); теріал з 3% виходу, починаючи з 3-[(2-етокси-2MC (IEP) m/z 224 (M+1). метилпропіл)аміно]-1Н-пірол-2-карбонової кислоти Приклад 9 етил-естеру (0,283г, 1,18ммоль) та етоксикарбоні1-(2-ізопропоксіетил)-2-тіоксо-1,2,3,5лізотіоціанату (0,13мл, 1,18ммоль), застосовуючи тетрагідро-піроло[3,2-d]піримідин-4-он загальний спосіб В, але з наступною модифікаці(a) 3-[(2-ізопропоксіетил)аміно]-1Н-пірол-2єю. Реакцію проводили у мікрохвильовому реактокарбонової кислоти етил-естер рі повні 35хвил. 1 -1 Трихлорціанурову кислоту (1,84г, 7,93ммоль) Н ЯМР (ДМСО-d6) млн 12,29 (1Н, brs), додавали до розчину 2-ізопропоксіетанолу (0,75г, 12,17 (1Н, brs), 7,30 (1Н, d, J=2,76), 6,29 (1Н, d, 7,21ммоль) у СН2СІ2 (3мл). Реакційну суміш охоJ=2,76), 4,58 (2H, brs), 3,12 (3H, s), 1,21 (6H, s); лоджували до 0°С та невеликими порціями обереMC (IEP) m/z 254 (M+1). жно додавали TEMPO (0,022г, 0,14ммоль). Суміш Приклад 11 перемішували при кімнатній температурі протягом 1-(2-Етокси-2-метилпропіл)-2-тіоксо-1,2,3,520хвил., тоді фільтрували через целіт та промиватетрагідро-піроло[3,2-d]піримідин-4-он ли СН2СІ2. Фільтрат протягом фільтрування три(а) 2-Бромо-1,1-діетокси-2-метилпропан мали холодним при 0°С. До перемішуваної суміші Продукт синтезували згідно з модифікованим 3-аміно-1Н-пірол-2-карбонової кислоти естеру способом, описаним у США 3,652,579. Бромну (0,83г, 5,41ммоль) та НОАс (0,62мл, 10,8ммоль) у воду (2,95мл, 57,6ммоль) додавали краплями до метанолі (5мл) при 0°С додавали розчин альдегіізобутиральдегіду (4,82г, 66,8ммоль) в етанолі ду. Суміш перемішували протягом 20хвил., тоді (22мл) та утворену суміш перемішували при кімнадодавали NaCNBH3 (0,34г, 5,41ммоль). Після петній температурі протягом 40хвил. Додавали біремішування при кімнатній температурі протягом 2 льше бромної води (0,3мл, 5,86ммоль). Реакційну годин розчин випарювали на силікагелі та очищасуміш нейтралізували додаванням кальцій карболи флеш-хроматографією на колонці (градієнт нату (3,5г, 25,3ммоль). Залишковий кальцій карбогептан/етилацетат; 0-100% етилацетат) з отринат відфільтровували та фільтрат виливали у суманням заголовної сполуки (0,75г, 58%) як масла. міш лід-вода. Водну фазу екстрагували СН2СІ2, 1 -1 Н ЯМР (ДМСО-d6) млн 10,72 (1Н, br s), сушили (Na2SO4), фільтрували та концентрували. 6,76-6,74 (1Н, m), 5,66-5,65 (1Н, m), 5,34(1H, br s), Після вакуумної перегонки отримано заголовний 4,17 (2H, q, J=7,0Гц), 3,59-3,49 (3H, m), 3,15 (2H, q, продукт (10,10г, 67%). 1 -1 J=5,6Гц), 1,26 (3H, t, J=7,0Гц), 1,10 (3H, s), 1,08 Н ЯМР (ДМСО-d6) млн 4,43 (1Н, s), 3,80(3H, s); 3,73 (2Н, m), 1,64 (6Н, s), 1,15 (6Н, t, J=7,1Гц). MC (IEP) m/z 241 (M+1). (b) 2-Етокси-2-метилпропаналь (b) 1-(2-ізопропоксіетил)-2-тіоксо-1,2,3,5Продукт синтезували способом, описаним у тетрагідро-піроло[3,2-d]піримідин-4-он США 3,652,579. Заголовну сполуку (0,17г, 23%) отримували 2-Етокси-2-метилпропаналь (5,63г, 25ммоль) згідно із загальним способом В, застосовуючи 3додавали краплями до калій гідротартрату (2,35г, [(2-ізопропоксіетил)аміно]-1Н-пірол-2-карбонової 12,5ммоль) у киплячій деіонізованій воді (22,5мл) кислоти етил-естер (0,7г, 2,91ммоль) та етоксикапротягом 50хвил. Утворену суміш гріли при кипінні рбонілізотіоціанат (0,40мл, 3,50ммоль). під зворотним холодильником протягом 70хвил. 1 -1 Н ЯМР (ДМСО-d6) млн 12,74 (2Н, br s), 7,35 Розчинник та продукт відганяли. До суміші продук(1Н, d, J=2,8Гц), 6,29 (1H, d, J=3,0Гц), 4,49 (2H, t, ту у розчиннику додавали амоній сульфат (повні J=6,3Гц), 3,72 (2H, t, J=6,3Гц), 3,60-3,58 (1H, m), 8,5г) Суміш перемішували і тоді дві фази розділя1,02 (3H, s), 1,01 (3H, s); ли, верхню фазу відганяли від кальцій хлориду, MC (IEP) m/z 254 (M+1). отримуючи заголовний продукт (1,60г, 55%). Приклад 10 MC (CI) m/z 117 (M+1). 1-(2-метокси-2-метилпропіл)-2-тіоксо-1,2,3,5(c) 3-[(2-Етокси-2-метилпропіл)аміно]-1Н-піролтетрагідро-піроло[3,2-d]піримідин-4-он 2-карбонової кислоти етил-естеру (a) 3-[(2-метокси-2-метилпропіл)аміно]-1НЗаголовну сполуку отримували як масло з 63% пірол-2-карбонової кислоти естер виходу, починаючи з 3-аміно-1Н-пірол-2Заголовну сполуку отримували як масло з 75% карбонової кислоти етил-естеру (0,200г, виходу, починаючи з 3-аміно-1Н-пірол-21,30ммоль) та 2-етокси-2-метил пропіональдегід карбонової кислоти етил-естеру (0,250г, (0,292г, 2,86ммоль), застосовуючи загальний спо1,62ммоль) та 2-метокси-2-метилпропаналю (США сіб А, але з наступною модифікацією. Реакційну 3,652,579) (0,331г, 3,24ммоль), застосовуючи зага 35 89968 36 1 -1 суміш перемішували при кімнатній температурі Н ЯМР (ДМСО-d6) млн 7,36 (1Н, d, протягом 48 годин. J=2,8Гц), 6,33 (1Н, d, J=2,8Гц), 4,27 (2Н, br s), 2,95 1 -1 Н ЯМР (CDCI3) млн 6,74 (1Н, br s), 5,70 (2Н, d, J=12,0Гц), 2,40 (2H, t, J=10,4Гц), 2,25-2,15 (1H, br s), 4,32 (2H, q, J=7,4Гц), 3,54-3,47 (2H, m), (1H, m), 1,50 (2Н, d, J=10,8Гц), 1,37-1,20 (2H, m); 13 -1 3,44 (2H, q, J=7,6Гц), 3,12 (2H, d, J=4Гц), 1,25 (6H, C ЯМР (ДМСО-d6) млн 173,2, 152,9, 137,6, s), 1,20 (3H, t, J=7,4Гц), 1,19 (3H, J=7,6Гц); 128,1, 114,0, 97,5, 55,2, 45,5, 34,7, 30,0; MC (IEP) m/z 255 (M+1). MC (IEP) m/z 265 (M+1). (d) 1-(2-Етокси-2-метилпропіл)-2-тіоксо-1,2,3,5Приклад 13 тетрагідро-піроло[3,2-d]піримідин-4-он 1-[(1-Метилпіперидин-3-іл)метил]-2-тіоксо3-(2-метокси-2-метил)-пропіламіно-1Н-пірол-2 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он карбонової кислоти етил-естер (0,200г, 0,79ммоль) 1-Піперидин-3-ілметил-2-тіоксо-1,2,3,5розчиняли у СН2СІ2 (2мл) при кімнатній температетрагідро-піроло[3,2-d]піримідин-4-он (Приклад 7) турі під атмосферою азоту. Додавали краплями (0,092г, 0,35ммоль) розчиняли у метанолі (2мл) та етоксикарбонілізотіоціанат (0,12мл, 1,02ммоль) та додавали мурашину кислоту (37% водн., 0,059мл, реакційну суміш перемішували при кімнатній тем0,7ммоль). Через 5хвил. перемішування при кімпературі протягом ночі. Розчинник випарювали, натній температурі утворено осад. Додавали додавали натрій етоксид (1Mb етанолі, 0,94мл, NaCNBH3 (0,026г, 0,42ммоль) та суміш перемішу0,94ммоль) та реакційну суміш гріли до 40°С провали при кімнатній температурі протягом 1 години. тягом 48 годин. Додавали воду (2мл) та рН довоРозчинник видаляли у вакуумі та залишкову твердили до нейтрального за допомогою 2М НСІ. Осад ду речовину очищали препаративною ВЕРХ, збирали фільтруванням та очищали препаративотримуючи заголовну сполуку (0,022г, 22%) як біною ВЕРХ для отримання заголовної сполуки з 6% лий твердий продукт. 1 -1 виходу (0,12г). Н ЯМР (ДМСО-d6) млн 12,22 (1Н, br s), 7,36 1 -1 Н ЯМР (ДМСО-d6) млн 12,22 (1Н, br s), 7,30 (1Н, d, J=2,8Гц), 6,33 (1H, s), 4,27 (2Н, br s), 2,61(1Н, d, J=2,8Гц), 6,35 (1H, d, J=3Гц), 4,60 (2H, br s), 2,5 (1H, m), 2,36-2,30 (1H, m), 2,09 (3H, s), 1,933,40-3,34 (3H, m), 1,22 (6H, s), 1,04 (3H, t, J=7,0Гц); 1,82 (3Η, m), 1,65-1,52 (2H, m), 1,44-1,32 (1H, m), MC (IEP) m/z 267 (M+1). 1,16-1,07 (1H, m); 13 -1 Приклад 12 C ЯМР (ДМСО-d6) млн 173,2, 152,9, 137,6, 1-(Піперидин-4-ілметил)-2-тіоксо-1,2,3,5128,1, 114,0, 97,3, 59,2, 56,0, 53,3, 46,7, 34,9, 27,7, тетрагідро-піроло[3,2-d]піримідин-4-он 24,7; (a) 4-[(2-(Етоксикарбоніл)-1Н-пірол-3-іламіно)MC (IEP) m/z 279 (M+1). метил]піперидин-1-карбонової кислоти трет-бутилПриклад 14 естер 1-[2-Гідрокси-2-(4-метоксифеніл)етил]-2-тіоксоЗаголовну сполуку (0,156г, 10%) отримували 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он згідно із загальним способом А, починаючи з 3(а) Метил {[трет-бутил(диметил)силіл]окси}(4аміно-1Н-пірол-2-карбонової кислоти етил-естеру метоксифеніл)ацетат (0,68г, 4,4ммоль) та 4-формілпіперидин-1TBDMSCI (1,5г, 9,94ммоль) та імідазол (1,0г, карбонової кислоти трет-бутил-естеру (P. C. Ting 14,6ммоль) додавали до розчину метилгідроксиet at., Bioorganic & Medicinal Chemistry Letters, (4-метоксифеніл)ацетату (Teodozyj Kolasa et al., J. 2001, 11, 491-494) (0,98r, 4,6ммоль). Org. Chem., 1987, 22, 4978-4984) (1,3r, 6,62ммоль) 1 -1 H ЯМР (ДМСО-d6) млн 10,70 (1H, br s), 6,74 у ДМФ (8мл), суміш перемішували при кімнатній (1H, br s), 5,65 (1H, br s), 4,19 (2H, q, J=7,2Гц), 3,95 температурі протягом 2 годин. Додавали воду та (2H, d, J=12,0Гц), 2,97 (2H, t, J=6,0Гц), 2,65 (2H, br суміш екстрагували діетилетером. Органічний s), 1,66 (2H, d, J=12,0Гц), 1,39 (9H, s), 1,26 (3H, t, прошарок промивали розсолом, сушили (MgSO4), J=7,2Гц), 1,07-0,95 (2H, m); фільтрували та концентрували для отримання MC (IEP) m/z 352 (M+1). заголовної сполуки (2,0г, 97%). 1 -1 (b) 1-(Піперидин-4-ілметил)-2-тіоксо-1,2,3,5Н ЯМР (CDCI3) млн 7,39 (2Н, d, J=8,8Гц), тетрагідро-піроло[3,2-d]піримідин-4-он 6,88 (2H, d, J=8,8Гц), 5,19 (1H, s), 3,81 (3H, s), 3,69 Етоксикарбонілізотіоціанат (0,058г, 0,44ммоль) (3H, s), 0,92 (9Н, s), 0,11 (3H, s), 0,03 (3H, s). додавали при перемішуванні до розчину 4-[(2(b) {[трет-Бутил(диметил)силіл]окси}(4(етоксикарбоніл)-1Н-пірол-3-іламіно)метоксифеніл)ацетальдегід метил]піперидин-1-карбонової кислоти трет-бутилМетил {[трет-бутил(диметил)силіл]окси}(4естеру (0,156г, 0,44ммоль) у СН2СІ2 (2мл) та суміш метоксифеніл)ацетат (0,5г, 1,61ммоль) розчиняли перемішували при кімнатній температурі протягом у толуолі (10мл) та охолоджували до -78°С під 1 години. Розчинник видаляли у вакуумі та залиатмосферою азоту. Додавали повільно DIBAL шок переносили в етанол (1мл) з вмістом натрію (1,0М у толуолі, 1,9мл, 1,93ммоль) та суміш пере(0,015г, 0,66ммоль). Утворену суміш гріли у мікромішували при -78°С протягом 1 години. Реакційну хвильовому реакторі при 120°С протягом 10хвил. суміш виливали у суміш льоду (20г) та СНСІ3 Додавали 6Μ НСІ (0,5мл) та реакційну суміш знов (20мл). Суміш перемішували при кімнатній темпегріли у мікрохвильовому реакторі при 100°С протяратурі протягом 30хвил. Прошарки розділяли та гом 3хвил. Доводили рН до нейтрального за доповодну фазу екстрагували СНСІ3. Органічну фазу могою 2М НСІ та розчин концентрували у вакуумі. промивали розсолом, сушили (MgSO4), фільтруСирий продукт очищали препаративною ВЕРХ для вали та концентрували, отримуючи 99% (0,45г) отримання заголовної сполуки (0,038г, 14%) як заголовної сполуки. Продукт застосовували безпобілого твердого продукту. середньо на наступному етапі без наступної очистки. 37 1 89968 -1 Н ЯМР (CDCI3) млн 7,40-7,38 (2Н, m), 6,896,87 (2Н, m), 5,19 (1Н, s), 3,81 (3H, s), 0,92 (9Н, s), 0,11 (3H, s), 0,03 (3H, s). (c) 3-{[2-{[трет-Бутил(диметил)силіл]окси}-2-(4метоксифеніл)етил]аміно}-1Н-пірол-2-карбонової кислоти етил-естер Заголовну сполуку (0,13г, 19%) отримували згідно із загальним способом А, застосовуючи 3аміно-1Н-пірол-2-карбонової кислоти етил-естер (0,16г, 1,07ммоль) та {[третбутил(диметил)силіл]окси}(4метоксифеніл)ацетальдегід (0,3г, 1,07ммоль). МС (ІЕР) m/z 417 (Μ-1). (d) 1-[2-{[трет-Бутил(диметил)силіл]окси}-2-(4метоксифеніл)етил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-он Заголовну сполуку (0,07г, 90%) отримували згідно із загальним способом В, застосовуючи 3{[2-{[трет-бутил(диметил)силіл]окси}-2-(4метоксифеніл)етил]аміно}-1Н-пірол-2-карбонової кислоти етил-естер (0,13г, 0,31ммоль) та етоксикарбонілізотіоціанат (0,042мл, 0,37ммоль). 1 -1 Н ЯМР (ДМСО-d6) млн 12,28-12,23 (2Н, m), 7,42 (2Н, d, J=8,6Гц), 7,34-7,33 (1Н, m), 6,96 (2Н, d, J=8,6Гц), 6,33 (1Н, br s), 5,53-5,50 (1Н, m), 4,57 (1Н, br s), 4,15 (1H, br s), 3,76 (3H, s), 0,61 (9H, s), 0,31 (3H, s), 0,39 (3H, s); MC (IEP) m/z 432 (M+1). (e) 1-[2-Гідрокси-2-(4-метоксифеніл)етил]-2тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4он Тетра-н-бутиламоній флуорид (1М у ТГФ, 1,27мл, 1,27ммоль) додавали до 1-[2-{[третбутил(диметил)силіл]окси}-2-(4метоксифеніл)етил]-2-тіоксо-1,2,3,5-тетрагідропіроло[3,2-d]піримідин-4-ону (0,065г, 0,152ммоль) у ТГФ (8мл). Суміш перемішували при 50°С протягом ночі. Етилацетат додавали та органічну фазу промивали водою та розсолом, сушили (MgSO4), фільтрували та концентрували. Цей сирий матеріал очищали препаративною ВЕРХ з отриманням заголовної сполуки (0,018г, 37%) як твердого матеріалу. 1 -1 Н ЯМР (ДМСО-d6) млн 12,20 (2Н, br s), 7,40 (2Н, d, J=8,5Гц), 7,29 (1H, d, J=2,8Гц), 6,91 (2H, d, J=8,8Гц), 6,27 (1H, d, J=2,8Гц), 5,42-5,41 (1H, m), 5,28-5,24 (1Н, m), 4,62458 (1Н, m), 4,19-4,16 (1Н, m), 3,74 (3H, s); MC (IEP) m/z 316 (M-1). Приклад 15 1-(2-Метоксибензил)-2-тіоксо-1,2,3,5тетрагідро-піроло[3,2-d]піримідин-4-он (a) 3-[(2-Метоксибензил)аміно]-1Н-пірол-2карбонової кислоти етил-естер Заголовну сполуку отримували як білий твердий продукт з кількісним виходом, починаючи з 3аміно-1Н-пірол-2-карбонової кислоти етил-естеру (0,350г, 2,27ммоль) та орто-анісальдегіду (0,37г, 2,71ммоль), застосовуючи загальний спосіб А, але з наступними модифікаціями. Після перемішування протягом ночі, реакційну суміш випарювали. Сирий твердий продукт переносили СНСІ3, фільтрували та розчинник випарювали у вакуумі, та цей сирий продукт застосовували на наступному етапі без наступної очистки. MC (IEP) m/z 275 (M+1). 38 (b) 1-(2-Метоксибензил)-2-тіоксо-1,2,3,5тетрагідро-піроло[3,2-d]піримідин-4-он Заголовну сполуку отримували як твердий матеріал з 16% виходу, починаючи з 3-[(2метоксибензил)аміно]-1Н-пірол-2-карбонової кислоти етил-естеру (0,622г, 2,27ммоль) та етоксикарбонілізотіоціанату (0,26мл, 2,27ммоль), застосовуючи загальний спосіб В, але з наступною модифікацією. Розчин сирого інтермедіату розчиняли у 1М NaOEt (2,27мл, 2,27ммоль) та перемішували при 80°С протягом 3 годин. 1 -1 Н ЯМР (ДМСО-d6) млн 12,36 (2Н, br s), 7,27 (1Н, d, J=2,8Гц), 7,27-7,21 (1H, m), 7,06 (1Н, d, J=8,1Гц), 6,82 (1H, t, J=7,3Гц), 6,79-6,75 (1H, m), 5,96 (1Н, d, J=2,8Гц), 5,61 (2H, s), 3,89 (3H, s); MC (IEP) m/z 288 (M+1). Приклад 16 1-(3-Метоксибензил)-2-тіоксо-1,2,3,5тетрагідро-піроло[3,2-d]піримідин-4-он (а) 3-[(3-Метоксибензил)аміно]-1Н-пірол-2карбонової кислоти етил-естер Заголовну сполуку отримували як масло з 57% (0,508г) виходом та отримували згідно із загальним способом А, застосовуючи 3-аміно-1Н-пірол-2карбонової кислоти етил-естер (0,50г, 3,24ммоль) та м-анісовий альдегід (0,47мл, 3,89ммоль). 1 -1 Н ЯМР (ДМСО-d6) млн 10,73 (1Н, br s), 7,24-7,20 (1Н, m), 6,90-6,86 (1Н, m), 6,80-6,77 (1Н, m), 6,71-6,69 (1Н, m), 5,75 (1Н, br s), 5,59-5,58 (1H, m), 4,46 (1H, d, J=5,8Гц), 4,25 (2H, d, J=6,3Гц), 4,19 (2H, q,J=7,1Гц), 3,72 (3H, s), 1,26 (3H, t, J=7,1Гц); MC (IEP) m/z 275 (M+1). (b) 1-(3-Метоксибензил)-2-тіоксо-1,2,3,5тетрагідро-піроло[3,2-d]піримідин-4-он Заголовну сполуку отримували як твердий матеріал з 3% (0,014г) виходом згідно із загальним способом В, застосовуючи 3-[(3метоксибензил)аміно]-1Н-пірол-2-карбонової кислоти етил-естер (0,494г, 1,80ммоль) та етоксикарбонілізотіоціанат (0,20мл, 1,18ммоль). 1 -1 Н ЯМР (ДМСО-d6) млн 12,41-12,34 (2Н, m), 7,29 (1Н, d, J=2,7Гц), 7,23 (1Н, t, J=8,0Гц), 6,93-6,91 (1Н, m), 6,86 (1Н, d, J=7,8Гц), 6,83 (1Н, dd, J=8,2, 2,4Гц), 6,14 (1Н, d, J=2,8Гц), 5,67 (2H, s), 3,71 (3H, s); MC (IEP) m/z 288 (M+1). Приклад 17 1-(2,4-Диметоксибензил)-2-тіоксо-1,2,3,5тетрагідро-піроло[3,2-d]піримідин-4-он (a) 3-[(2,4-Диметоксибензил)аміно]-1Н-пірол-2карбонової кислоти етил-естер Заголовну сполуку отримували як масло з 85% (0,838г) виходом згідно із загальним способом А, застосовуючи 3-аміно-1Н-пірол-2-карбонової кислоти етил-естер (0,50г, 3,24ммоль) та 2,4диметоксибензальдегід (0,647г, 3,89ммоль). 1 -1 Н ЯМР (ДМСО-d6) δ млн 10,69 (1Н, br s), 7,14 (1Н, d, J=8,3Гц), 6,71 (1Н, t, J=3,0Гц), 6,54 (1H, d, J=2,3Гц), 6,44 (1H, dd, J=8,3Гц), 5,66 (1H, t, J=2,5Гц), 5,59 (1H, br s), 4,20-4,13 (4H, m), 3,80 (3H, s), 3,73 (3H, s), 1,25 (3H, t, J=7,1Гц); 13 -1 C ЯМР (ДМСО-d6) млн 160,9, 159,6, 158,0, 129,2, 124,0, 120,0, 104,2, 98,3, 95,5, 58,3, 55,4, 55,1, 43,6, 14,7; MC (IEP) m/z 303 (M-1). 39 89968 40 (b) 1-(2,4-Диметоксибензил)-2-тіоксо-1,2,3,5m), 3,73-3,71 (2Н, m), 3,52 (2Н, q, J=7,0Гц), 2,35 тетрагідро-піроло[3,2-d]піримідин-4-он (3H, s), 1,12 (3H, t, J=6,9Гц); Заголовну сполуку отримували як твердий маМС (IEP) m/z 182 (Μ+1). теріал з 14% (0,118г) виходом та отримували згід(b) 3-(2-Етоксіетокси)піридин-2-карбальдегід но із загальним способом В, застосовуючи 3-[(2,4Суміш 3-(2-етоксіетокси)-2-метилпіридину диметоксибензил)аміно]-1Н-пірол-2-карбонової (0,506г, 2,79ммоль) та селен діоксиду (0,31г, кислоти етил-естеру (0,828г, 2,72ммоль) та еток2,79ммоль) у 1,4-діоксані (10мл) гріли при 75°С сикарбонілізотіоціанату (0,31мл, 2,72ммоль). протягом ночі. Після охолодження до кімнатної 1 -1 температури суміш фільтрували та твердий проН ЯМР (ДМСО-d6) млн 12,41 (1Н, br s), дукти промивали етилацетатом. Розчинник вида12,27 (1Н, s), 7,27 (1Н, t, J=2,9Гц), 6,77 (1H, d, ляли у вакуумі. Реакція не завершилася і твердий J=8,3Гц), 6,61 (1H, d, J=2,3Гц), 6,41 (1H, dd, J=8,5, продукт розчиняли у 1,4-діоксані (15мл) та дода2,4Гц), 5,95 (1H, t, J=2,3Гц), 5,54 (2H, s), 3,88 (3H, вали селен діоксид (0,31г, 2,79ммоль). Суміш гріли s), 3,72 (3H, s); при 110°С протягом ночі. Додавали етилацетат MC (IEP) m/z 318 (M+1). (10мл) і суміш фільтрували. Чорну тверду речовиПриклад 18 ну промивали етилацетатом та фільтрат випарю1-[(3-Хлорпiридин-2-iл)метил]-2-тіоксо-1,2,3,5вали у вакуумі. Сирий продукт очищали флештетрагідро-пiроло[3,2-d]піримідин-4-он хроматографією на колонці (градієнт геп(a) 3-{[(3-хлорпіридин-2-іл)метил]аміно}-1Нтан/етилацетат; 0-100% етилацетат), отримуючи пірол-2-карбонової кислоти етил-естер 0,21г (39%) заголовної сполуки. Заголовну сполуку отримували як твердий ма1 -1 теріал з 91% (0,225г) виходом згідно із загальним Н ЯМР (ДМСО-d6) млн 10,23 (1Н, s), 8,35 способом А, застосовуючи 3-аміно-1Н-пірол-2(1Н, d, J=4,3Гц), 7,77 (1Н, d, J=8,6Гц), 7,66-7,62 карбонової кислоти етил-естер (0,231г, 1,50ммоль) (1Н, m), 4,29 (2Н, m), 3,75 (2Н, m), 3,55-3,49 (2Н, та 3-хлорпіридин-2-карбальдегід (Nadeem Iqbal et m), 1,14-1,09 (3H, m). al., J. Med. Chem. 1998, 41, 1827-1837) (0,212г, (c) 3-({[3-(2-Етоксіетокси)піридин-21,50ммоль). іл]метил}аміно)-1Н-пірол-2-карбонової кислоти 1 -1 етил-естер H ЯМР (ДМСО-d6) млн 10,81 (1Н, br s), Заголовну сполуку (0,17г, 73%) отримували 8,53-8,51 (1Н, m), 7,94-7,92 (1Н, m), 7,40-7,36 (1Н, згідно із загальним способом А, застосовуючи 3-(2m), 6,77-6,76 (1Н, m), 5,74-5,73 (1Н, m), 4,43 (1Н, d, етоксіетокси)піридин-2-карбальдегід (0,21г, J=5,5Гц), 4,20-4,15 (2Н, m), 1,30-1,27 (3H, m); 1,08ммоль) та 3-аміно-1Н-пірол-2-карбонової кисMC (IEP) m/z 280 (M+1). лоти етил-естер (0,11г, 0,717ммоль). (b) 1-[(3-Хлорпіридин-2-іл)метил]-2-тіоксо1 -1 Н ЯМР (ДМСО-d6) млн 10,76 (1Н, s), 8,131,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он Заголовну сполуку отримували як твердий ма8,12 (1Н, m), 7,46-7,44 (1Н, m), 7,30-7,28 (1Н, m), теріал з 5% (0,011г) виходом згідно із загальним 6,76-6,75 (1Н, m), 6,29 (1Н, br s), 5,71-5,70 (1Н, m), способом В, застосовуючи 3-{[(3-хлорпіридин-24,32-4,31 (2Н, m), 4,22-4,17 (4Н, m), 3,77-3,74 (2Н, іл)метил]аміно}-1Н-пірол-2-карбонової кислоти m), 3,57-3,51 (2Н, m), 1,30 (3H, t, J=7,0Гц), 1,15етил-естер (0,215г, 0,77ммоль) та етоксикарбонілі1,12 (3H, m); зотіоціанат (0,09мл, 0,77ммоль). МС (IEP) m/z 334 (Μ+1). 1 -1 (d) 1-{[3-(2-Етоксіетокси)піридин-2-іл]метил}-2Н ЯМР (ДМСО-d6) млн 12,26 (1Н, br s), тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-48,32-8,30 (1Н, m), 7,96-7,93 (1Н, m), 7,34-7,30 (1Н, он m), 7,28 (1Н, d, J=3,0Гц), 6,16 (1H, d, J=2,8Гц), 5,80 Заголовну сполуку (0,051г, 28%) отримували (2H, s); згідно із загальним способом В, застосовуючи 3MC (IEP) m/z 293 (M+1). ({[3-(2-етоксіетокси)піридин-2-іл]метил}аміно)-1НПриклад 19 пірол-2-карбонової кислоти етил-естер (0,17г, 1-{[3-(2-Етоксіетокси)піридин-2-іл]метил}-20,52ммоль) та етоксикарбонілізотіоціанат (0,07мл, тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-40,62ммоль). он 1 -1 (а) 3-(2-Етоксіетокси)-2-метилпіридин Н ЯМР (ДМСО-d6) млн 12,32-12,19 (2Н, m), Калій карбонат (2,20г, 15,9ммоль) додавали 7,92 (1Н, d, J=4,0Гц), 7,47 (1Н, d, J=7,8Гц), 7,32при перемішуванні до розчину 3-гідрокси-27,14 (2Н, m), 5,98 (1Н, d, J=2,8Гц), 5,73 (2Н, s), метилпіридину (1,45г, 13,3ммоль) та 2-хлоретил4,26-4,23 (2Н, m), 3,78-3,76 (2Н, m), 3,55 (2Н, q, етил-етеру (1,75мл, 15,9ммоль) у ДМФ (7мл) та J=7,1Гц), 1,14 (3H, t, J=6,9Гц); 13 суміш перемішували при 70°С протягом ночі. РеаС ЯМР (ДМСО-d6) 173,5, 152,7, 152,4, кція не завершилася і додавали додатково 2143,7, 140,3, 137,8, 127,7, 123,0, 119,0, 113,5, 96,8, хлоретил-етил-етер (1екв.) та калій карбонат 68,2, 65,8, 49,8, 15,1; (1екв.), суміш перемішували при 85°С протягом 8 MC (IEP) m/z 347 (M+1). годин. Додавали воду та етилацетат, водний проПриклад 20 шарок екстрагували етилацетатом. Органічний 1-[(6-Оксо-1,6-дигідропіридин-2-іл)метил]-2прошарок сушили (MgSO4), фільтрували та концетіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4нтрували. Сирий продукт очищали флешон хроматографією на колонці (градієнт геп(a) 3-{[(6-Оксо-1,6-дигідропіридин-2тан/етилацетат; 0-50% етилацетат), отримуючи іл)метил]аміно}-1Н-пірол-2-карбонової кислоти 1,80г (75%) заголовної сполуки. етил-естер 1 -1 Н ЯМР (ДМСО-d6) млн 8,03-7,99 (1Н, m), 6-Оксо-1,6-дигідропіридин-2-карбальдегід (WO 7,33-7,31 (1Н, m), 7,18-7,14 (1Н, m), 4,13411 (2Н, 2002/006272) (0,31г, 2,5ммоль) розчиняли у EtOH 41 89968 42 (10мл). Додавали 3-аміно-1Н-пірол-2-карбонової 3мл) та суміш гріли при 80°С протягом 2 годин. кислоти етил-естер (0,19г, 1,3ммоль) та потім НОСуміш концентрували та очищали препаративною Ас (0,14мл, 2,5ммоль). Суміш перемішували проВЕРХ, отримуючи заголовну сполуку (0,030г, 21%) тягом 75хвил. при кімнатній температурі і тоді дояк твердий матеріал. 1 -1 давали NaCNBH3 (0,16г, 2,5ммоль). Реакційну Н ЯМР (ДМСО-d6) млн 12,13 (2Н, br s), суміш перемішували при кімнатній температурі 11,08 (1Н, s), 7,87 (1Н, d, J=8,1Гц), 7,54-747 (1H, протягом ночі. Розчинник випарювали у вакуумі та m), 7,38-7,30 (1Н, m), 7,29-7,25 (1Н, m), 7,10-7,03 сирий продукт очищали флеш-хроматографією на (1Н, m), 7,01-6,93 (1Н, m), 6,33 (1Н, d, J=2,8Гц), колонці (градієнт СН2СІ2/метанол; 0-10% метанол), 5,88 (2H, s); 13 -1 отримуючи 0,288г (85%) заголовного продукту як С ЯМР (ДМСО-d6) млн 173,14, 152,86, масла, що кристалізувалося після стояння. 136,71, 136,42, 128,02, 126,45, 125,83, 121,61, 1 -1 Н ЯМР (ДМСО-d6) млн 11,57 (1Н, br s), 119,67, 119,16, 114,36, 111,95, 109,51, 97,74, 46,31; 10,77 (1Н, br s), 7,34-7,30 (1H, m), 6,71-6,70 (1H, MC (IEP) m/z 295 (M-1). m), 6,16-6,13 (2H, m), 5,98 (1H, br s), 5,75 (1H, s), Приклад 22 5,64-5,63 (1H, m), 4,20 (2H, q, J=7,1Гц), 4,09-4,08 1-(1Н-Бензимідазол-2-ілметил)-2-тіоксо(2H, m), 1,27 (3H, t, J=7,1Гц); 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он MC (IEP) m/z 262 (M+1). (а) Етил 3-[(1Н-бензимідазол-2-ілметил)аміно](b) 1-[(6-Оксо-1,6-дигідропіридин-2-іл)метил]-21Н-пірол-2-карбоксилат тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4Реакційну суміш 3-аміно-1Н-пірол-2он карбонової кислоти етил-естеру (0,77г, Бензоїлізотіоціанат (0,27г, 1,6ммоль) розчине4,99ммоль), 1Н-бензоімідазол-2-карбоксальдегіду ний у СН2СІ2 (3мл) додавали до 3-{[(6-оксо-1,6(0,88г, 5,99ммоль), NaCNBH3 (0,31г, 4,99ммоль) та дигідропіридин-2-іл)метил]аміно}-1Н-пірол-2НОАс (0,57мл, 9,99ммоль) у метанолі (15мл) пекарбонової кислоти етил-естеру (0,25г, 0,96ммоль) ремішували при кімнатній температурі протягом у СН2СІ2 (7мл). Утворену суміш перемішували при ночі. Тоді суміш гріли при 50°С протягом 5 годин. кімнатній температурі протягом ночі. Розчинник Охолоджували до кімнатної температури та випавидаляли у вакуумі та залишок розчиняли у метарювали у вакуумі. Залишок розчиняли в етилаценолі (15мл) та додавали калій карбонат (0,50г, таті та промивали водою. Водну фазу екстрагува3,6ммоль). Реакційну суміш перемішували при ли етилацетатом (двічі). Комбіновані органічні 50°С протягом 6,5 годин. Після охолодження до прошарки сушили (MgSO4) та концентрували. Сикімнатної температури краплями додавали 1М НСІ рий продукт очищали флеш-хроматографією на до отримання нейтрального рН. Утворений осад колонці (гептан/етилацетат (1:0-0:1), отримуючи збирали, промивали метанолом та очищали пре1,15г (81%) заголовної сполуки. 1 -1 паративною ВЕРХ для отримання заголовної споН ЯМР (ДМСО-d6) млн 12,27 (1Н, s), 10,85 луки (0,097г, 37%) як твердого матеріалу. (1Н, s), 7,63-7,37 (2Н, m), 7,17-7,08 (2Н, m), 6,71 1 -1 Н ЯМР (ДМСО-d6) млн 12,46-12,38 (2Н, m), (1Н, t, J=3,0Гц), 5,99 (1Н, br s), 5,60 (1Н, t, J=2,7Гц), 11,69 (1Н, br s), 7,34-7,29 (2Н, m), 6,23 (2Н, s), 5,75 4,48 (2H, d, J=5,8Гц), 4,22 (2H, q, J=7,1Гц), 1,29 (1Н, br s), 5,49 (2Н, s); (3H, t, J=7,1Гц); 13 С ЯМР (ДМСО-d6) 173,6,162,7, 152,5, 140,6, MC (IEP) m/z 285 (M+1). 136,7,128,0, 113,6, 96,6; (b) 1-(1Н-Бензимідазол-2-ілметил)-2-тіоксоMC (IEP) m/z 275 (M+1). 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он Приклад 21 Етил 3-[(1Н-бензимідазол-2-ілметил)аміно]-1Н1-(1Н-Індол-3-ілметил)-2-тіоксо-1,2,3,5пірол-2-карбоксилат (0,33г, 1,16ммоль) додавали тетрагідро-піроло[3,2-d]піримідин-4-он до СН2СІ2 (3 л) та додавали метанол до отриман(a) Етил 3-[(1Н-індол-3-ілметил)аміно]-1Ння прозорого розчину. Розчин перемішували при пірол-2-карбоксилат кімнатній температурі протягом 1 години. ДодаваРеакційну суміш 3-аміно-1Н-пірол-2ли бензоїлізотіоціанат (0,73мл, 0,46ммоль) та піскарбонової кислоти етил-естеру (0,075г, ля перемішування при кімнатній температурі про0,49ммоль), індол-3-карбоксальдегіду (0,085г, тягом 30хвил. суміш концентрували. Залишок 0,58ммоль), NaCNBH3 (0,031г, 0,49ммоль) та НОрозчиняли у аміаку (7N у метанолі, 7мл) та суміш Ас (0,056мл, 0,97ммоль) у метанолі (3мл) перемігріли при 80°С у закритому сталевому контейнері шували при кімнатній температурі протягом ночі. протягом 2 годин. Після охолодження до кімнатної Суміш концентрували у вакуумі та сирий продукттемператури осаджений продукт фільтрували та суміш застосовували на наступному етапі без напромивали метанолом, діетилетером та етилацеступної очистки. татом, отримуючи 0,23г (66%) заголовної сполуки MC (IEP) m/z 284 (M+1). як білого твердого продукту. 1 -1 (b) 1-(1Н-Індол-3-ілметил)-2-тіоксо-1,2,3,5Н ЯМР (ДМСО-d6) млн 12,27 (3H, br s), тетрагідро-піроло[3,2-d]піримідин-4-он 7,61-7,37 (2Н, m), 7,43-7,27 (1Н, m), 7,18-7,07 (2Н, Суміш сирого етил 3-[(1Н-індол-3m), 6,19 (1Н, d, J=2,8Гц), 5,89 (2H, s); ілметил)аміно]-1Н-пірол-2-карбоксилату (максиMC (IEP) m/z 298 (M+1). мум 0,49ммоль) додавали до СН2СІ2 (5мл). ДодаПриклад 23 вали кілька крапель метанолу для збільшення ро1-[(5-хлоро-1Н-індол-2-іл)метил]-2-тіоксозчинності. Додавали бензоїлізотіоціанат (0,072г, 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он 0,53ммоль) та суміш перемішували при кімнатній 5-хлоро-1Н-індол-2-карбальдегід (0,15г, температурі протягом 1 години. Суміш концентру0,76ммоль), NaCNBH3 (0,040г, 0,63ммоль) та Et3N вали у вакуумі. Додавали аміак (7N у метанолі, (0,088мл, 0,63ммоль) додавали при перемішуванні 43 89968 44 до розчину 3-аміно-1Н-пірол-2-карбонової кислоти 1-(1Н-індол-5-ілмєтил)-2-тіоксо-1,2,3,5етил-естер хлориду (0,12г, 0,63ммоль) у метанолі тетрагідро-піроло[3,2-d]піримідин-4-он (3мл). Утворену суміш перемішували при кімнатній Заголовну сполуку отримували як твердий матемпературі протягом ночі. Реакційну суміш гріли теріал з 39% (0,073г) виходом згідно із загальним до 50°С. Додатковo додавали NaCNBH3 (0,5екв.) способом прикладу 23, застосовуючи 3-аміно-1Нта суміш перемішували при 50°С протягом 3 годин. пірол-2-карбонової кислоти етил-естер хлорид Додавали кілька крапель НОАс та через 1 годину (0,12г, 0,63ммоль), 5-форміліндол (0,11г, реакційну суміш охолоджували до кімнатної тем0,76ммоль), MaCNBH3 (0,040г, 0,63ммоль, ператури та концентрували у вакуумі. Залишок +0,5екв.), Et3N (0,088мл, 0,63ммоль) та бензоїлізорозчиняли у СН2СІ2 (2мл) та метанолі (2мл). Додатіоціанат (0,093мл, 0,69ммоль). 1 -1 вали бензоїлізотіоціанат (0,093мл, 0,69ммоль) та Н ЯМР (ДМСО-d6) млн 12,33 (2Н, br s), після перемішування при кімнатній температурі 11,07 (1Н, s), 7,52 (1Н, s), 7,36-7,29 (2Н, m), 7,29протягом 1 години суміш концентрували у вакуумі. 7,25 (1Н, m), 7,21-7,12 (1Н, m), 6,39-6,34 (1Н, m), Залишок розчиняли у аміаку (7N у метанолі, 3мл) 6,21-6,16 (1Н, m), 5,77 (2Н, s); 13 -1 та гріли при 80°С протягом 2 годин. Осаджений С ЯМР (ДМСО-d6) млн 173,32, 152,51, продукт фільтрували та промивали метанолом та 136,63, 135,20, 127,83, 127,50, 126,15, 125,81, діетилетером, а потім очищали препаративною 120,54, 118,81, 113,82, 111,40, 101,00, 97,28, 52,99; ВЕРХ, отримуючи 0,063г (30%) заголовної сполуки MC (IEP) m/z 297 (M+1). як твердого матеріалу. Приклад 27 1 -1 Н ЯМР (ДМСО-d6) млн 12,41 (2Н, brs), 1-[(5-флуоро-1Н-індол-3-іл)метил]-2-тіоксо11,51-11,04 (1Н, m), 7,51-7,46 (1Н, m), 7,40-7,33 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он (1Н, m), 7,33-7,30 (1Н, m), 7,07-6,99 (1Н, m), 6,343-Аміно-1Н-пірол-2-карбонової кислоти етил6,27 (2Н, m), 5,87-5,80 (2Н, m); естер хлорид (0,10г, 0,52ммоль) розчиняли у ме13 -1 С ЯМР (ДМСО-d6) млн 173,65, 153,05, танолі (4мл) та додавали 5-флуоро-1Н-індол-3136,84, 135,98, 134,74, 129,28, 128,27, 123,97, карбоксальдегід (0,10г, 0,63ммоль), NaCNBH3 121,26, 119,19, 114,24, 113,25, 100,33, 97,17, 47,31; (0,033г, 0,52ммоль) та Et3N (0,073г, 0,52ммоль). МС (ІЕР) m/z 331 (М+1). Утворену суміш перемішували при кімнатній темПриклад 24 пературі протягом ночі. Додатково додавали 1-[(5-флуоро-1Н-індол-2-іл)мeтил]-2-тіоксоNaCNBH3 (0,01г) та суміш гріли при 50°С протягом 1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4-он 5 годин. Реакційну суміш охолоджували до кімнатЗаголовну сполуку отримували як твердий маної температури та концентрували у вакуумі. Ситеріал з 19% (0,038г) виходом згідно із загальним рий інтермедіат розчиняли у СН2СІ2 (3мл) та метаспособом прикладу 23, застосовуючи 3-аміно-1Ннолі (1мл). Бензоїлізотіоціанат (0,078мл, пірол-2-карбонової кислоти етил-естер хлорид 0,58ммоль) додавали та після перемішування при (0,12г, 0,63ммоль), 5-флуоро-1Н-індол-2кімнатній температурі протягом 1 години суміш карбальдегід (0,12г, 0,76ммоль), NaCNBH3 (0,040г, концентрували у вакуумі. Залишок розчиняли у 0,63ммоль, +0,5екв.), Et3N (0,088мл, 0,63ммоль) та аміаку (7N у метанолі, 3мл) та гріли при 80°С пробензоїлізотіоціанат (0,093мл, 0,69ммоль). тягом 2 годин. Розчинник видаляли у вакуумі та 1 -1 після очищення препаративною ВЕРХ, отримували Н ЯМР (ДМСО-d6) млн 12,38 (2Н, br s), заголовну сполуку (0,035г, 21%) як твердий мате11,10 (1Н, s), 7,41-7,26 (2Н, m), 7,25-7,11 (1Н, m), ріал. 6,96-6,79 (1Н, m), 6,37-6,24 (2Н, m), 5,83 (2Н, s); 1 -1 13 -1 Н ЯМР (ДМСО-d6) млн 12,29 (2Н, s), 11,38С ЯМР (ДМСО-d6) млн 173,61, 173,81, 11,08 (1Н, m), 7,76-7,68 (1Н, m), 7,65-7,59 (1Н, m), 158,46, 156,17, 152,94, 136,85, 136,10, 132,94, 7,37-7,30 (1Н, m), 7,30-7,27 (1Н, m), 6,96-6,86 (1Н, 128,39, 128,30, 114,19, 112,71, 112,61, 109,54, m), 6,37 (1Н, d, J=2,8Гц), 5,84 (2Н, s); 109,28, 104,75, 104,51, 100,82, 100,78, 97,23, 47,35; 13 -1 МС (ІЕР) m/z 315 (М+1). С ЯМР (ДМСО-d6) млн 173,09, 158,27, Приклад 25 155,97, 152,81, 136,59, 133,11, 128,14, 128,09, 1-(1Н-Індол-6-ілметил)-2-тіоксо-1,2,3,5126,70, 126,59, 114,37, 113,01, 112,91, 109,95, тетрагідро-піроло[3,2-d]піримідин-4-он 109,91, 109,86, 109,68, 104,70, 104,46, 97,74, 46,10; Заголовну сполуку отримували як твердий маMC (IEP) m/z 315 (M+1). теріал з 19% (0,035г) виходом згідно із загальним Приклад 28 способом прикладу 23, застосовуючи 3-аміно-1Н1-(1Н-Імідазол-5-ілметил)-2-тіоксо-1,2,3,5пірол-2-карбонової кислоти етил-естер хлорид тетрагідро-піроло[3,2-d]піримідин-4-он (0,12г, 0,63ммоль), 6-форміліндол (0,11г, 3-Аміно-1Н-пірол-2-карбонової кислоти етил0,76ммоль), NaCNBH3 (0,040г, 0,63ммоль, естер хлорид (0,10г, 0,52ммоль) розчиняли у ме+0,5екв.), Et3N (0,088мл, 0,63ммоль) та бензоїлізотанолі (4мл) та додавали 4-формілімідазол тіоціанат (0,093мл, 0,69ммоль). (0,060г, 0,63ммоль), NaCNBH3 (0,033г, 0,52ммоль) 1 -1 та Et3N (0,073г, 0,52ммоль). Утворену суміш переН ЯМР (ДМСО-d6) млн 12,37 (2Н, br в), мішували при кімнатній температурі протягом ночі. 11,01 (1Н, s), 7,53-7,43 (1Н, m), 7,33 (1Н, s), 7,32Розчинник видаляли у вакуумі та залишок розчи7,25 (2Н, m), 7,09-7,03 (1Н, m), 6,41-6,34 (1Н, m), няли у СН2СІ2 (3мл) та метанолі (1мл). Додавали 6,17 (1Н, d, J=2,8Гц), 5,79 (2Н, s); 13 -1 бензоїлізотіоціанат (0,078мл, 0,58ммоль) та після С ЯМР (ДМСО-d6) млн 173,76, 152,91, перемішування при кімнатній температурі протя137,06, 136,21, 128,88, 128,27, 127,31, 125,99, гом 30хвил. суміш концентрували у вакуумі. Зали120,35, 118,91, 114,16, 110,24, 101,28, 97,63, 53,32; шок розчиняли у аміаку (7N у метанолі, 3мл) та MC (IEP) m/z 297 (M+1). гріли при 80°С протягом 1 години. Осаджений Приклад 26 45 89968 46 продукт фільтрували та промивали метанолом, а хлоро-1Н-бензимідазол-2-карбальдегід (0,030г) та потім діетилетером. Сирий продукт очищали преNaCNBH3 (0,015г) та реакційну суміш перемішувапаративною ВЕРХ, отримуючи 0,017г (13%) заголи протягом 4 годин. Реакційну суміш нейтралізуловної сполуки як твердого матеріалу. вали 2М NaOH та розбавляли етилацетатом. ЕксОС 710/07 трагували водою та органічний прошарок сушили 1 -1 (Na2SO4) та концентрували. Сирий продукт очиН ЯМР (ДМСО-d6) млн 12,49-11,78 (3H, m), щали флеш-хроматографією на колонці (градієнт 7,53 (1Н, s), 7,30 (1Н, d, J=2,8Гц), 7,05 (1Н, s), 6,36 гептан/етилацетат; 0-100% етилацетат), отримую(1Н, d, J=3,0Гц), 5,54 (2Н, s); чи 0,074г (46%) заголовного продукту· MC (IEP) m/z 335 (M+1). 1 -1 Н ЯМР (CDCI3) млн 8,28 (1Н, br s), 7,52 Приклад 29 1-(1Н-Імідазол-2-ілметил)-2-тіоксо-1,2,3,5(1Н, s), 7,44 (1Н, d, J=2,0Гц), 7,22 (1H, d, J=2,0Гц), тетрагідро-піроло[3,2-d]піримідин-4-он 6,66 (1H, s), 5,61 (1Н, t, J=2,4Гц), 4,67 (2H, s), 4,27 (а) Етил 3-[(1Н-імідазол-2-ілметил)аміно]-1Н(2Н, m), 1,33 (3H, t, J=6,8Гц); пірол-2-карбоксилат MC (IEP) m/z 319 (M+1). Реакційну суміш з 3-аміно-1Н-пірол-2(b) 1-[(5-хлоро-1Н-бензимідазол-2-іл)метил]-2карбонової кислоти етил-естером (0,2г, тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-41,30ммоль), 2-імідазолкарбоксальдегідом (0,15г, он 1,53ммоль), NaCNBH3 (0,082г, 1,30ммоль) та Розчин етил 3-{[(5-хлоро-1Н-бензимідазол-2ОНАс (0,15мл, 2,60ммоль) у метанолі (5мл) переіл)метил]аміно}-1Н-пірол-2-карбоксилату (0,074г, мішували при кімнатній температурі протягом 2 0,23ммоль) у СН2СІ2 перемішували протягом годин. Розчинник випарювали у вакуумі та зали5хвил. Для підвищення розчинності додавали ДМФ шок розчиняли в етилацетаті. Промивали водою (0,2мл). Додавали бензоїлізотіоціанат (0,045г, та водний прошарок екстрагували двічі етилацета0,28ммоль) та суміш перемішували протягом 1 том. Комбіновані органічні прошарки сушили години тоді концентрували у вакуумі. Сирий інтер(MgSO4), фільтрували та концентрували. Сирий медіат переносили у аміак (7N у метанолі, 2мл) та продукт очищали флеш-хроматографією на колоперемішували при 70°С протягом 1,5 годин у занці (градієнт СН2СІ2/метанол; 0 до 20% метанол), критій посудині. Після охолодження до кімнатної отримуючи 0,30г (99%) заголовної сполуки. температури осаджений продукт збирали за допо1 -1 могою вакуумного фільтрування, промивали діеН ЯМР (ДМСО-d6) млн 10,84 (1Н, br s), 7,03 тилетер та сушили, отримуючи 0,033г (43%) заго(2Н, s), 6,79-6,64 (1Н, m), 5,76 (1Н, br s), 5,68-5,57 ловного продукту як білий твердий продукт. (1Н, m), 4,29 (2Н, d, J=5,8Гц), 4,19 (2Н, q, J=7,1Гц), 1 -1 Н ЯМР (ДМСО-d6) млн 12,33 (3H, br s), 7,48 3,16 (1H, s), 1,26 (3H, t, J=7,1Гц); MC (IEP) m/z 235 (M+1). (2Н, m), 7,32 (1Н, s), 7,17 (1Н, d, J=8,0Гц), 6,21 (1H, (b) 1-(1Н-Імідазол-2-ілметил)-2-тіоксо-1,2,3,5s), 5,88 (2H, s); тетрагідро-піроло[3,2-d]піримідин-4-он MC (IEP) m/z 332 (M+1). Бензоїлізотіоціанат (0,19мл, 1,41ммоль) додаПриклад 31 вали при перемішуванні до розчину етил 3-[(1Н1-[(4,5-Диметил-1Н-бензимідазол-2-іл)метил]імідазол-2-ілметил)аміно]-1Н-пірол-2-карбоксилату 2-тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин(0,3г, 1,28ммоль) у СН2СІ2 (4мл) та метанолі (2мл) 4-он та суміш перемішували при кімнатній температурі (a) 4,5-Диметил-1Н-бензимідазол-2протягом 1 години. Розчинник випарювали у вакукарбальдегід умі, залишок розчиняли у аміаку (7N у метанолі, 3,4-Диметилбензол-1,2-діамін (0,409г, 7мл) та гріли при 80°С протягом 1 години. Сирий 3,0ммоль) та дихлороцтову кислоту (0,768г, продукт фільтрували та очищали препаративною 6,0ммоль) у 4Η НСІ (10мл) гріли при 100°С протяВЕРХ, отримуючи 0,110г, (35%) заголовної сполугом 2 діб. Після охолодження до кімнатної темпеки як білого твердого продукту. ратури суміш фільтрували та маточний розчин 1 -1 екстрагували хлороформом (4 рази). ВстановлюН ЯМР (ДМСО-d6) млн 12,46-12,14 (2Н, m), вали рН 12, застосовуючи 2М NaOH, та утворений 11,81 (1Н, brs), 7,28 (1Н, d, J=2,5Гц), 6,99 (1Н, s), білий осад збирали фільтруванням. Сирий продукт 6,79 (1Н, s), 6,13 (1Н, d, J=2,8Гц), 5,67 (2H, s); застосовували на наступному етапі без наступної MC (IEP) m/z 248 (M+1). очистки. Приклад 30 MC (IEP) m/z 175 (M+1). 1-[(5-хлоро-1Н-бензимідазол-2-іл)метил]-2(b) Етил 3-{[(4,5-диметил-1Н-бензимідазол-2тіоксо-1,2,3,5-тетрагідро-піроло[3,2-d]піримідин-4іл)метил]аміно}-1Н-пірол-2-карбоксилат он 3-Аміно-1Н-пірол-2-карбонової кислоти етил(а) Етил 3-{[(5-хлоро-1Н-бензимідазол-2естер (0,077г, 0,5ммоль), 4,5-диметил-1Ніл)метил]аміно}-1Н-пірол-2-карбоксилат бензимідазол-2-карбальдегід (0,130г, 0,75ммоль) Реакційну суміш 3-аміно-1Н-пірол-2та НОАс (0,045г, 0,75ммоль) перемішували у мекарбонової кислоти етил-естеру (0,077г, танолі (4мл) та потім додавали NaCNBH3. Утворе0,5ммоль), NaCNBH3 (0,057г, 0,9ммоль) та НОАс ну суміш перемішували при кімнатній температурі (0,030г, 0,5ммоль) у метанолі (4мл) перемішували протягом 16 годин. Реакційну суміш нейтралізувапри кімнатній температурі протягом 5хвил. перед ли 2М NaOH та розчинник видаляли у вакуумі. додаванням 5-хлоро-1Н-бензимідазол-2Залишок розчиняли в етилацетаті та екстрагували карбальдегіду (0,144г, 0,8ммоль) а потім - СН2СІ2 водою. Органічний прошарок сушили (Na2SO4) та (1мл) та ДМФ (0,4мл). Утворену суміш перемішуконцентрували. Сирий продукт очищали флешвали протягом 16 годин при кімнатній температурі хроматографією на колонці (градієнт геппід атмосферою азоту. Додатково додавали 5 47 89968 48 тан/етилацетат; 0-100% етилацетат), отримуючи ли. Сирий продукт очищали флешбілий твердий продукт 0,043г (27%) заголовної хроматографією (градієнт гептан/етилацетат, 0сполуки як таутомерної суміші (1:1). 30% етилацетат), отримуючи заголовну сполуку 1 -1 (0,040г, 24%) як білий твердий продукт. Н ЯМР (ДМСО-d6) млн 12,15 (1H, s), 12,04 1 -1 (1H, s), 10,81 (2H, s), 7,26 (1H, d, J=8,4Гц), 7,12 Н ЯМР (CDCI3) млн 6,75 (1Н, s), 4,32 (2Н, (1H, d=8,0Гц), 6,94 (2H, d, J=8,4Гц), 6,72 (2H, s), q, J=7,2Гц), 3,28 (2H, d, J=6,8Гц), 1,85 (1H, m), 1,35 5,93 (2Н, s), 5,70 (1Н, s), 5,61 (1Н, s), 4,44 (4Н, dd, (3H, t, J=7,2Гц), 0,97 (3H, d, J=6,8Гц); J=9,2, 6,0Гц), 4,22 (4H, m), 2,44 (3H, s), 2,37 (3H, s), MC (IEP) m/z 289 (M+1). 2,29 (6Н, s), 1,30 (6H, m); (с) 7-Бромо-1-ізобутил-2-тіоксо-1,2,3,5MC (IEP) m/z 313 (M+1). тетрагідро-піроло[3,2-d]піримідин-4-он (с) 1-[(4,5-Диметил-1Н-бензимідазол-2Бензоїлізотіоціанат (0,034г, 0,2ммоль) додаіл)метил]-2-тіоксо-1,2,3,5-тетрагідро-піроло[3,2вали до розчину 4-бромо-3-(ізобутиламіно)-1Нd]піримідин-4-он пірол-2-карбонової кислоти етил-естеру (0,050г, Етил 3-{[(4,5-диметил-1Н-бензимідазол-20,17ммоль) у СН2СІ2 та утворену суміш перемішуіл)метил]аміно}-1Н-пірол-2-карбоксилат (0,043г, вали при кімнатній температурі протягом 1 години 0,14ммоль) розчиняли у СН2СІ2 (1,5мл) та бензоїперед концентруванням у вакуумі. Залишок розчилізотіоціанат (0,026г, 0,16ммоль) додавали. Після няли у аміаку (7М у метанолі, 1,5мл) та перемішуперемішування при кімнатній температурі протявали при 70°С протягом 4 годин. Додатково додагом 1 години розчинник видаляли у вакуумі. Заливали аміак (7М у метанолі, 1мл) та суміш шок розчиняли у аміаку (7N у метанолі) та гріли до перемішували при 80°С протягом 5 годин. Суміш 70°С протягом 2 годин у закритій посудині. Розохолоджували до кімнатної температури та осачинник видаляли у вакуумі та залишок очищали джений продукт фільтрували та промивали діетипрепаративною ВЕРХ, отримуючи білий твердий летером. Після перекристалізації з метанолу загопродукт, 0,008г (18%) заголовної сполуки як тауловну сполуку (0,028г, 55%) отримували як білий томерної суміші (1:1). твердий продукт. 1 -1 1 -1 Н ЯМР (ДМСО-d6) млн 12,18 (2Н, s), 11,98 Н ЯМР (ДМСО-d6) млн 12 57 (2Н, br s), 7,58 (2Н, s), 7,28 (2Н, t, J=2,4Гц), 7,19 (1Н, d, J=8,0Гц), (1Н, s), 4,92 (1Н, br s), 4,42 (1H, br s), 2,39 (1H, m), 7,08 (1Н, d, J=8,0Гц), 6,92 (2Н, t, J=8,0Гц), 6,14 (2Н, 0,94 (6H, d, J=6,4Гц); dd, J=8,0, 2,8Гц), 5,89 (2Н, s), 5,86 (2Н, s), 2,41 (3H, MC (IEP) m/z 303 (M+1). s), 2,37 (3H, s), 2,29 (3H, s), 2,28 (3H, s); Приклад 33 MC (IEP) m/z 326 (M+1). 1-(3-Хлорфеніл)-2-тіоксо-1,2,3,5-тетрагідроПриклад 32 піроло[3,2-d]піримідин-4-он 7-бромо-1-ізобутил-2-тіоксо-1,2,3,5-тетрагідро(a) Етил 3-[(3-хлорфеніл)аміно]-1Н-пірол-2піроло[3,2-d]піримідин-4-он карбоксилат (а) 3-Аміно-4-бромо-1Н-пірол-2-карбонової киСуміш 3-аміно-1Н-пірол-2-карбонової кислоти слоти етил-естер етил-естеру (0,20г, 1,3ммоль), 3-бромхлорбензолу 3-Аміно-1Н-пірол-2-карбонової кислоти етил(0,30г, 1,6ммоль), Pd2(dba)3 (0,048г, 0,052ммоль), естер (0,92г, 0,6ммоль) розчиняли у НОАс (1мл) та рац-BINAP (0,048г, 0,078ммоль) та цезій карбонату додавали бромну воду (0,96г, 0,6ммоль). Суміш (0,59г, 1,8ммоль) гріли при 100°С у закритій мікроперемішували протягом 1 години при кімнатній хвильовій ампулі під атмосферою азоту протягом температурі та отриманий білий осад збирали фіночі. Додатково додавали Pd2(dba)3 (0,10г, льтруванням та промивали діетилетером. Заголо0,11ммоль) та R,S-BINAP (0,11г, 0,18ммоль) і реавну сполуку (0,136г, 97%) отримували як білий кцію продовжували перемішувати при 100°С протвердий продукт та застосовували у наступному тягом ночі. Додатково додавали 3етапі без наступної очистки. бромхлорбензол (0,15г), Pd2(dba)3 (0,098г) та R,S1 -1 BINAP (0,098г) і реакційну суміш продовжували Н ЯМР (ДМСО-d6) млн 11,67 (1Н, s), 7,05 перемішувати при 100°С протягом більше 3 діб. (1Н, s), 6,02 (2Н, br s), 4,25 (2Н, q, J=7,2Гц), 1,28 Реакційну суміш виливали у етанол та утворений (3H, J=7,2Гц); розчин фільтрували. Фільтрат випарювали у вакуMC (IEP) m/z 233 (M+1). умі та залишок очищали флеш-хроматографією на (b) 4-Бромо-3-(ізобутиламіно)-1Н-пірол-2колонці (градієнт гептан/етилацетат; 0-30% етилакарбонової кислоти етил-естер цетату), отримуючи 0,052г (15%) заголовної сполу3-Аміно-4-бромо-1Н-пірол-2-карбонової кислоки. ти етил-естер (0,136г, 0,58ммоль) та ізобутираль1 -1 Н ЯМР (CDCI3) млн 8,42 (1Н, br s), 7,17 дегід (0,067г, 0,93ммоль) перемішували у СН2СІ2/МеOН (1:1, 3мл) при кімнатній температурі (1H, t, J=8,0Гц), 7,14 (1H, t, J=2,0Гц), 6,96-6,94 (1H, протягом 2 годин. Додавали NaCNBH3 (0,065г, m), 6,87-6,84 (1H, m), 6,82 (1H, t, J=3,0Гц), 6,32 (1H, 1,04ммоль) та НОАс (0,035г, 0,58ммоль) та суміш t, J=3,0Гц), 4,35 (2H, q, J=7,2Гц), 1,38 (3H, J=7,1Гц); перемішували при кімнатній температурі протягом MC (IEP) m/z 263 (M-1). 2 годин, і тоді перемішували при 50°С протягом 16 (b) 1-(3-Хлорфеніл)-2-тіоксо-1,2,3,5-тетрагідрогодин. Додавали додатково ізобутиральдегід піроло[3,2-d]піримідин-4-он (1екв.) та NaCNBH3 (0,5екв.) та суміш продовжуБензоїлізотіоціанат (0,035г, 0,22ммоль) у вали перемішувати при 50°С протягом ночі. РеакСН2СІ2 (0,5мл) додавали до етил 3-[(3ційну суміш нейтралізували розчином 2Μ NaOH та хлорфеніл)аміно]-1Н-пірол-2-карбоксилату (0,052г, розчинники видаляли у вакуумі. Залишок перено0,20ммоль) у СН2СІ2 (0,5мл). Суміш перемішували сили в етилацетат та екстрагували водою. Органіпри кімнатній температурі протягом ночі. Додаткочний прошарок сушили (Na2SO4) та концентруваво через 6 годин додавали бензоїлізотіоціанат 49 89968 50 (0,035г+0,035г+0,035г) та реакцію продовжували концентрація 2,5нМ) з або без 20мкМ тирозину перемішувати при 50°С протягом 3 діб. Розчинник (кінцева концентрація, якщо присутній, 8мкМ), та видаляли у вакуумі та залишок розчиняли у аміаку суміш інкубували протягом 10хвил. при зовнішній (7N у метанолі, 4мл). Реакційну суміш гріли при температурі. Тоді додавали 50мкл Н2О2 (кінцева 50°С протягом 2 годин. Сирий продукт очищали концентрація 100мкМ) або аналітичний буфер попрепаративною хроматографію, отримуючи 0,009г одинці, як контроль. Після інкубування протягом (15%) заголовної сполуки як твердого матеріалу. 10хвил. при зовнішній температурі реакцію зупи1 -1 нили додаванням 10мкл 0,2мг/мл каталази (кінцеН ЯМР (ДМСО-d6) млн 12,41 (2Н, br s), ва концентрація 18мкг/мл). Реакційну суміш зали7,60-7,57 (3H, m), 7,41-7,37 (1Н, m), 7,25 (1Н, d, шали протягом ще 5хвил. перед додаванням J=2,8Гц), 5,36 (1H, d, J=2,8Гц); 13 -1 100мкл проявлювального реагенту ТМВ. Тоді кільC ЯМР (ДМСО-d6) млн 173,8, 152,8, 141,5, кість утвореного окисненого 3,3',5,5'137,9, 133,5, 131,3 129,0, 128,6, 127,7, 127,3, 113,3, тетраметилбензидину вимірювали приблизно че96,7; рез 5хвил., застосовуючи абсорбційну спектроскоMC (IEP) m/z 278 (M+1). пію приблизно при 650нМ. Тоді стандартними споСкринінг собами визначали величини ІК50. Способи визначення інгібувальної активності При тестуванні принаймні, у одній версій виМПО розкрито у заявці на патент WO 02/090575. щезгаданої перевірки, сполуки прикладів 1-32 даФармакологічну активність сполук згідно з винахоли величини ІК50 менше 60мкМ, вказуючи на те, дом тестували далі у скринінгу, де сполуки тестощо вони показують очікувану корисну терапевтичвано поодинці або у присутності доданого тирозину активність. Характерні результати показані у ну: наступній Таблиці. Аналітичний буфер: 20мМ натрій/калій фосфатний буфер, рН 6,5 з вмістом 10мМ таурину та Інгібування МПО (у присутності ти100мМ NaCI. Сполука розину) ІК50 мкМ Проявлювальний реагент: 2мМ 3,3',5,5'тетраметилбензидин (ТМВ), 200мкМ КІ, 200мМ Приклад 2 0,26 ацетатний буфер рН 5,4 з 20 % ДМФ. Приклад 5 0,22 До 10мкл розбавлених у аналітичному буфері сполук, додавали 40мкл МПО людини (кінцева Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel pyrrolo [3, 2-d]pyrimidin-4-one derivatives and their use in therapy
Автори англійськоюBoegevig Anders, Lo-Alfredsson Yvonne, Pivonka Donald, Tiden Anna-Karin
Назва патенту російськоюПроизводные пирроло[3,2-d]-пиримидин-4-она и их применение в терапии
Автори російськоюБегевиг Андерс, Ло-Альфредссон Ивонн, Пивонка Доналд, Тиден Анна-Карин
МПК / Мітки
МПК: A61P 9/10, C07D 487/04, A61K 31/519
Мітки: похідні, застосування, піроло[3,2-d]-піримідин-4-ону, терапії
Код посилання
<a href="https://ua.patents.su/25-89968-pokhidni-pirolo32-d-pirimidin-4-onu-ta-kh-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні піроло[3,2-d]-піримідин-4-ону та їх застосування у терапії</a>
Попередній патент: Пристрій та спосіб горизонтального стикування проміжного об’єкта з попереднім і наступним об’єктами
Наступний патент: Захисний пристрій та документ, плівка і ярлик, що його містить
Випадковий патент: Спосіб безконтактної дефектоскопії металевих конструкцій





























