Антагоністи рецептора cgrp
Номер патенту: 82877
Опубліковано: 26.05.2008
Автори: Ден Чжену Цз, Шо Ентоні У., Уілльямс Тереза М., Пеуан Деніел В., Нгуйєн Дім Н., Бергі Крістофер С.
Формула / Реферат
1. Сполука формули І:
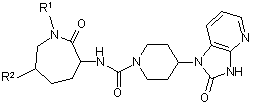 , І
, І
де
R1 вибраний з:
С1-С6-алкілу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з: С1-С6-алкілу, С3-С6-циклоалкілу, фенілу, гетероарилу, гетероциклу, (F)рС1-С3-алкілу, галогену, OR4, O(CH2)sOR4, CO2R4, CN, NR10R11, O(CO)R4,
R2 вибраний з:
арилу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з:
С1-С6-алкілу, С3-С6-циклоалкілу, (F)рС1-С3-алкілу, галогену, OR4, СО2R4, (CO)NR10R11, SO2NR10R11, N(R10)SO2R11, S(O)mR4, CN, NR10R11 і O(CO)R4;
R10 і R11 незалежно один від одного вибрані з: Н, С1-С6-алкілу, (F)рС1-С6-алкілу, С3-С6-циклоалкілу, арилу, гетероарилу і бензилу, незаміщеного або заміщеного галогеном, гідрокси або С1-С6-алкокси, де R10 і R11 можуть бути об'єднані разом з утворенням циклу, вибраного з: азетидинілу, піролідинілу, піперидинілу, піперазинілу і морфолінілу, який є незаміщеним або заміщений 1-5 замісниками, де замісники незалежно один від одного вибрані з R4;
R4 незалежно один від одного вибрані з: Н, С1-С6-алкілу, (F)рС1-С6-алкілу, С3-С6-циклоалкілу, арилу, гетероарилу і фенілу, незаміщеного або заміщеного гідрокси або С1-С6-алкокси;
р приймає значення від 0 до 2q+1, для замісників з q атомами вуглецю;
m приймає значення 0, 1 або 2;
s приймає значення 1, 2 або 3;
і її фармацевтично прийнятні солі та індивідуальні діастереомери.
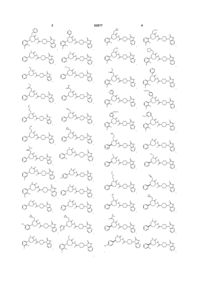
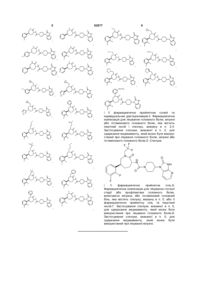
2. Сполука, вибрана з:
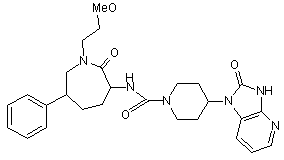 ,
,
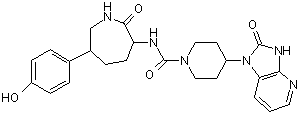 ,
,
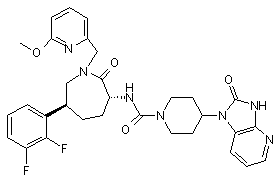 ,
,
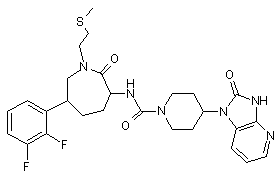 ,
,
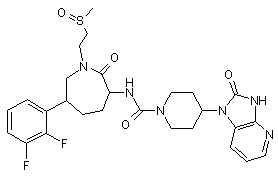 ,
,
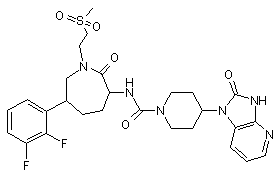 ,
,
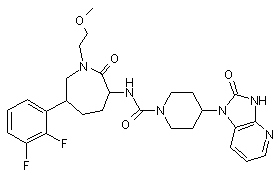 ,
,
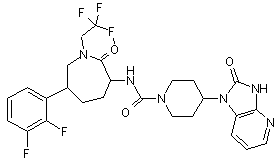 ,
,
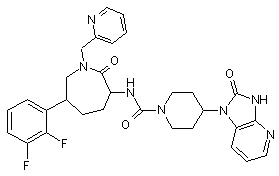 ,
,
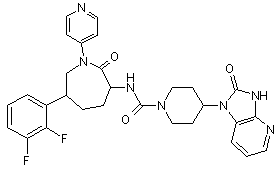 ,
,
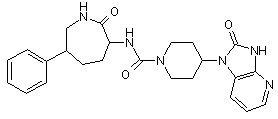 ,
,
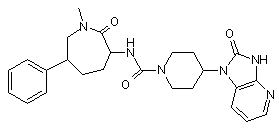 ,
,
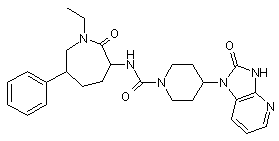 ,
,
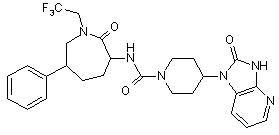 ,
,
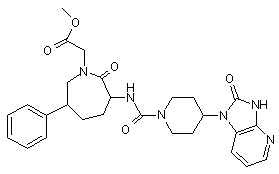 ,
,
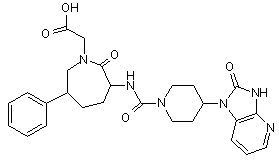 ,
,
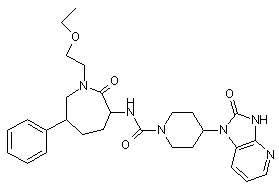 ,
,
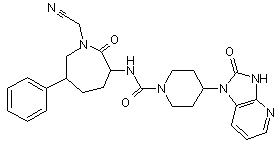 ,
,
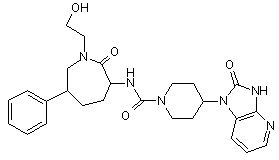 ,
,
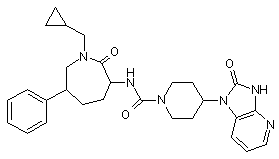 ,
,
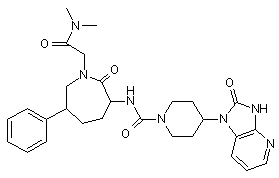 ,
,
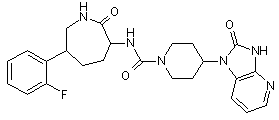 ,
,
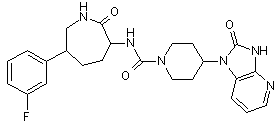 ,
,
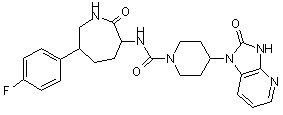 ,
,
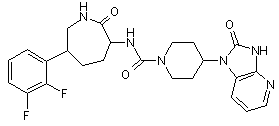 ,
,
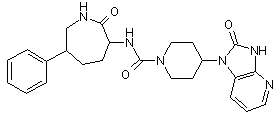 ,
,
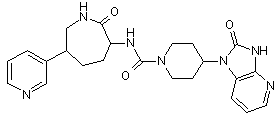 ,
,
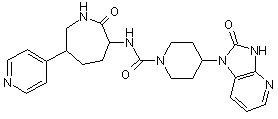 ,
,
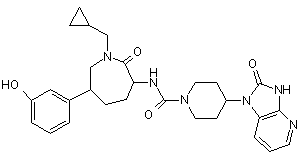 ,
,
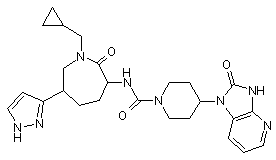 ,
,
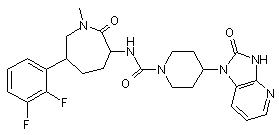 ,
,
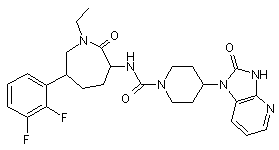 ,
,
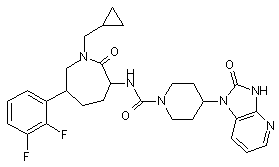 ,
,
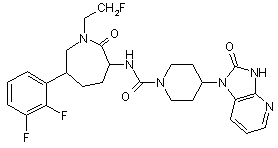 ,
,
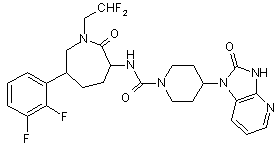 ,
,
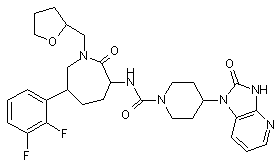 ,
,
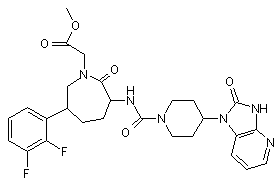 ,
,
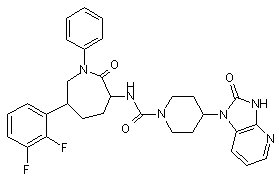 ,
,
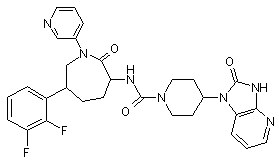 ,
,
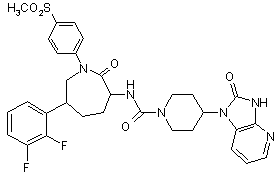 ,
,
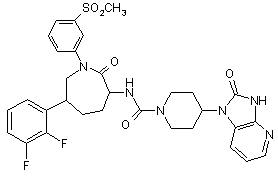 ,
,
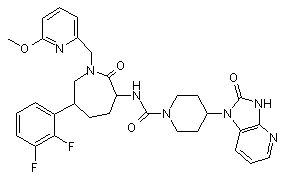 ,
,
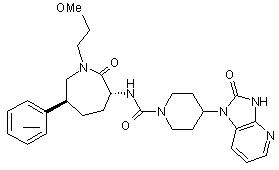 ,
,
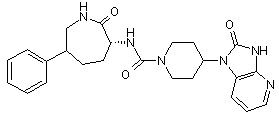 ,
,
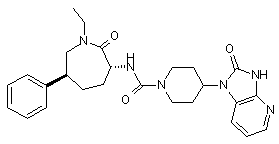 ,
,
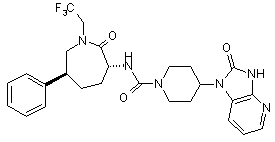 ,
,
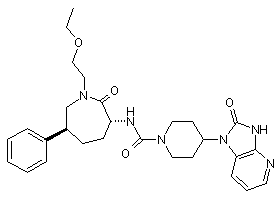 ,
,
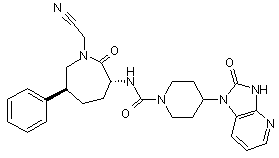 ,
,
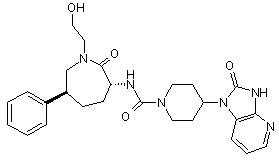 ,
,
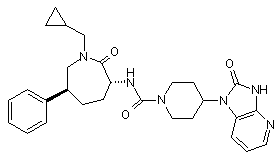 ,
,
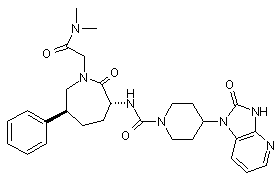 ,
,
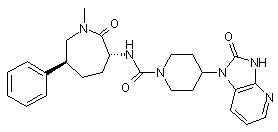 ,
,
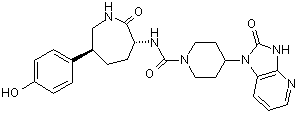 ,
,
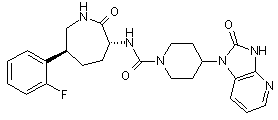 ,
,
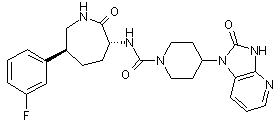 ,
,
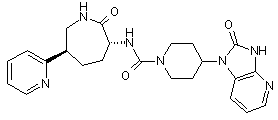 ,
,
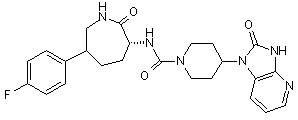 ,
,
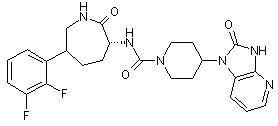 ,
,
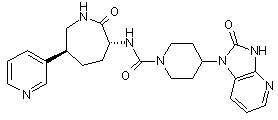 ,
,
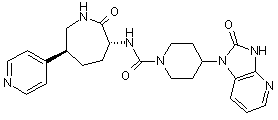 ,
,
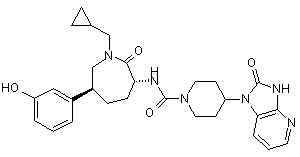 ,
,
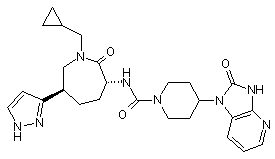 ,
,
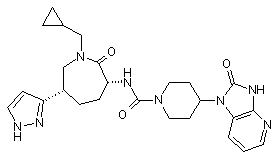 ,
,
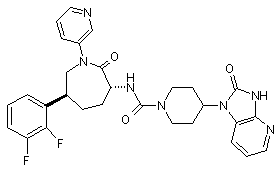 ,
,
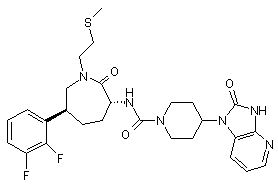 ,
,
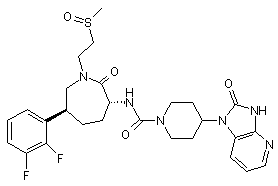 ,
,
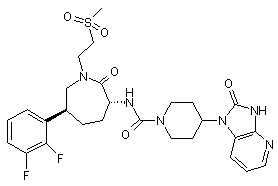 ,
,
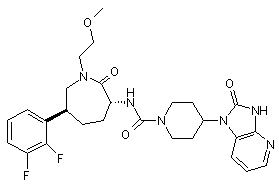 ,
,
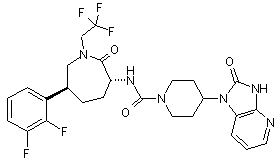 ,
,
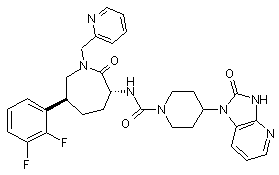 ,
,
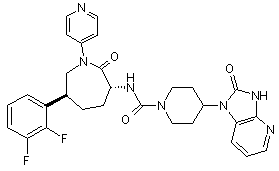 ,
,
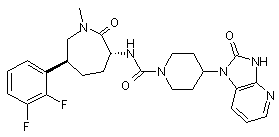 ,
,
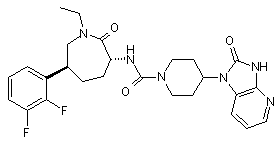 ,
,
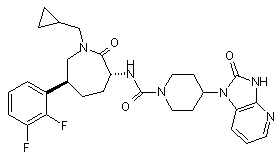 ,
,
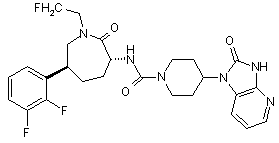 ,
,
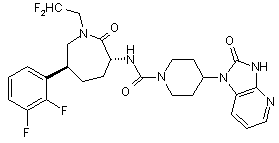 ,
,
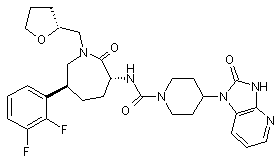 ,
,
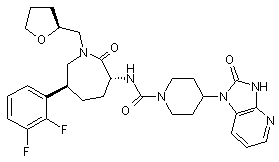 ,
,
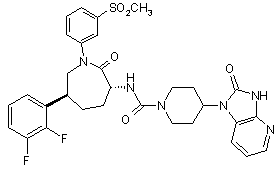
і її фармацевтично прийнятних солей та індивідуальних діастереомерів.
3. Фармацевтична композиція для лікування головного болю, мігрені або гістамінового головного болю, яка містить інертний носій і сполуку, вказану в п. 2.
4. Застосування сполуки, вказаної в п. 2, для одержання медикаменту, який може бути використаний при лікуванні головного болю, мігрені або гістамінового головного болю.
5. Сполука

і її фармацевтично прийнятна сіль.
6. Фармацевтична композиція для лікування гострої стадії або профілактики головного болю, включаючи мігрень або гістаміновий головний біль, яка містить сполуку, вказану в п. 5, або її фармацевтично прийнятну сіль та інертний носій.
7. Застосування сполуки, вказаної в п. 5, для одержання медикаменту, який може бути використаний при лікуванні головного болю.
8. Застосування сполуки, вказаної в п. 5, для одержання медикаменту, який може бути використаний при лікуванні мігрені.
Текст
1. Сполука формули R1 O N N H N N N NH R2 O O , І: 1 ІдеR вибраний з:С1-С6-алкілу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з: С1-С6алкілу, С3-С6-циклоалкілу, фенілу, гетероарилу, гетероциклу, (F)рС1-С3-алкілу, галогену, OR4, O(CH2)sOR4, CO2R4, CN, NR10R11, O(CO)R4,R2 вибраний з:арилу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з:С1-С6-алкілу, С3-С6циклоалкілу, (F)рС1-С3-алкілу, галогену, OR4, СО2R4, (CO)NR10R11, SO2NR10R11, N(R10)SO2R11, S(O)mR4, CN, NR10R11 і O(CO)R4;R10 і R11 незалежно один від одного вибрані з: Н, С1-С6алкілу, (F)рС1-С6-алкілу, С3-С6-циклоалкілу, 2 (13) 1 NH N , 3 82877 N CH 2F N N O N O H N N N O O N N NH N N O O N NH N F , F O O H N N N O N O H N N N O , F , O NH N F N , N O N O NH N N CHF2 O H N O H N , O N O NH F , F O H N O N F , F N F O N N NH N N O H N O H N NH N O O N F H N 4 NH N F , F F3C O N O H N N O N O O H N NH N N O NH N N O N O , N O N O N O H N N N O O N O N N , N O N O H N N N O N N N O N N N N N O N O N N O N N F O N O H N N N O N N O N O H N N N O N NH N , N O N O N O N N O N O NH N , N O H N N N O O N O N NH N O H N OH N N O NH , O H N N N O NH NH N O NH NH , , H N , N NH N O N O O N O H N O N , , F N N O N O H N N H N NH O N O NH F3C , H N O H N N O F , F H N O H N , F , , NH N O H N N H N H N NH N F O H N N F O H N H N O N , H N N O NH O NH N O O H N O O H N O NH N O O H N O N N N , H N N OMe , N , NH O N N F , O H N NH O NH F O H N F O N O O O F N N , N , OH O H N N F NH N O N O O H N NH N N NH SO 2CH 3 O O H N N F N O O N N N O H N , , F H3CO 2 S N , NH N F , NH N O N N O N O H N NH N O N F O O O H N NH N F OH O N O N O H N , O N O N O N N O N N O H N NH NH N , , , N O N HO N O H N N N N N , N O N N O N N NH O N N O , F N O O NH HO , N O NH N , , O N F N N H N N O H N , O H N O NH , O N F N N O H N H N O H N F O NH O N N H N O H N NH O N O O N H N NH O O H N N N O F N NH N , 5 H N O 82877 H N O H N N O O H N NH N N O N , F N O H N O H N N N O O N N O O , F2HC O N N N N O H N N O N N H N N O N N , N H N N N , N N N N F , F O S O N O H N N O N O H N NH N O NH N F , F N O N F , F O O N NH N O O H N N O N O N N F N N NH O , F і її фармацевтично прийнятних солей та індивідуальних діастереомерів.3. Фармацевтична композиція для лікування головного болю, мігрені або гістамінового головного болю, яка містить інертний носій і сполуку, вказану в п. 2.4. Застосування сполуки, вказаної в п. 2, для одержання медикаменту, який може бути використаний при лікуванні головного болю, мігрені або гістамінового головного болю.5. Сполука F F O H N NH N N F NH N O F O F N , N O N F O O H N N N O N O H N NH N N F N O , F F O NH N F , F N N N O N O F F N O H N O H N O N NH O F N , N NH N F , O H N N F F F , O F O N N S O S O H N , N O N NH O N N O N F F O H N N H O N H N N O NH N SO2CH3 NH O N O N , O H N NH N O H N NH F HO N O H N F O N , F O O N N F , O NH N O F , O N NH N O H N N F O O NH N O O N F F , , N NH N O FH2C O H N N N N F , N O H N N F N F NH N O NH F O H N N O H N O N NH O N , H N O H N N F N N NH O H N , H N O N NH O N 6 N NH N F і її фармацевтично прийнятна сіль.6. Фармацевтична композиція для лікування гострої стадії або профілактики головного болю, включаючи мігрень або гістаміновий головний біль, яка містить сполуку, вказану в п. 5, або її фармацевтично прийнятну сіль та інертний носій.7. Застосування сполуки, вказаної в п. 5, для одержання медикаменту, який може бути використаний при лікуванні головного болю.8. Застосування сполуки, вказаної в п. 5, для одержання медикаменту, який може бути використаний при лікуванні мігрені. 7 CGRP (Calcitonin Gene-Related Peptide; пептид, пов'язаний з геном кальцитоніну) являє собою існуючий у природі 37-амінокислотний пептид, який генерується тканино-специфічною обробкою, що чергується, PHK кальцитонінового месенджера і широко поширений у центральному і периферичному відділах нервової системи. CGRP локалізований переважно у сенсорних аферентних і центральних нейронах, і опосередковує деякі біологічні дії, включаючи вазодилатацію. CGRP експресує в альфаі бета-формах, які відрізняються однією або трьома амінокислотами, у щурів і людини відповідно. CGRP-альфа і CGRPбета виявляють подібні біологічні властивості. При вивільненні з клітини CGRP ініціює її біологічні реакції шляхом зв'язування з рецепторами визначених клітинних поверхонь, що переважно зв'язано з активацією аденілілциклази. Рецептори CGRP ідентифіковані і фармакологічно оцінені у деяких тканинах і клітинах, включаючи тканини і клітини головного мозку, тканини і клітини серцевосудинного і ендотеліального походження і тканини і клітини гладких м'язів. Опосередковувана CGRP вазодилатація середньої артерії мозкової оболонки щура, як показано, сенсибілізує нейрони тригемінальних ядерних caudalis [Williamson et al., The CGRP Family: Calcitonin Gene-Related Peptide (CGRP), Amylin and Adrenomedullin, Landes Bioscience, 2000, 245-247]. Аналогічно, розтягнення дуральних кровоносних судин при головному болю у випадку мігрені може активувати тригемінальні нейрони. Деякі пов'язані симптоми, у тому числі, екстракраніальний більі лицьова allodynia, можуть бути результатом сенсибілізованих тригемінальних нейронів [Burstein et al., Ann. Neurol. 2000, 47, 614624]. Антагоністи CGRP можуть дати позитивний результат при пом'якшенні, попередженні або реверсуванні ефектів нейронної сенсибілізації. Здатність сполук даного винаходу діяти як антагоністи CGRP робить їх корисними фармакологічними агентами у випадку захворювань, які уражають CGRP у людини і тварин, але особливо у людини. Такі захворювання включають мігрень і гістаміновий головний біль [Doods, Curr Opin Inves Drugs, 2001, 2(9), 1261-1268; Edvinsson et al., Cephalalgia, 1994, 14, 320-327]; головний біль при хронічному тиску (Ashina et al, Neurology, 2000, 14, 1335-1340); біль [Yu et al., Eur. J. Pharm., 1998, 347, 275-282]; хронічний біль [Hulsebosch et al., Pain, 2000, 86, 136-175]; нейрогенне запалення і запальний біль [Holzer, Neurosci., 1988, 24, 739-768; Delay-Goyet et al., Acta Physiol. Scanda., 1992, 146, 537-538; Salmon et al., Nature Neurosci., 2001, 4(4), 357-358]; біль очей [May et al, Cephalalgia, 2002, 22, 195196], зубний біль [Awawdeh et al, Int. Endocrin. J, 2002, 35, 30-36], інсулін незалежний цукровий діабет [Molina et al, Diabetes, 1990, 39, 260-265]; судинні захворювання, запалення [Zhang et al, Pain, 2001, 89, 265], артрит, астму [Foster et al, Ann. NY Acad. Sci, 1992, 657, 397-404; Schini et al, Am. J. Physiol, 1994, 267, Н2483-Н24290; Zheng et al, J. Virol, 1993, 67, 5786-5791]; шок, сепсис [Beer et al, Grit. Care Med, 2002, 30(8), 1794-1798]; синдром залежності від опіуму [Salmon et al, Nature Neurosci, 2001, 4(4), 357-358], толерантність до морфіну [Menard et al, J. Neurosci, 1996, 16(7), 2342-2351]; припливи крові у чоловіків і жінок [Chen et al, Lancet, 1993, 342, 49; Spetz et al, J. Urology, 2001, 166, 1720-1723]; алергічний дерматит 82877 8 [Wallengren, Contact Dermatitis, 2000, 43(3), 137143]; енцефаліт, травму головного мозку, ішемію, шок, епілепсію і нейродегенеративні захворювання [Rohrenbeck et al, Neurobiol. of Disease 1999, 6, 1534]; захворювання шкіри [Geppetti and Holzer, Eds, Neurogenic Inflammation, 1996, CRC Press, Boca Raton, FL], нейрогенне шкірне почервоніння, рожевість шкіри і еритему. Особливу важливість має гостре або профілактичне лікування головного болю, включаючи мігрень і гістаміновий головний біль. Даний винахід відноситься до сполук, які можуть бути корисні як ліганди для рецепторів CGRP, особливо як антагоністи для рецепторів CGRP, до способів їх одержання, їх застосування при лікуванні, до фармацевтичних композицій, що містять їх, і до способів лікування з їх застосуванням. Даний винахід відноситьсядо сполук формули І: (де змінні R1, R2, R3 мають визначені в описі значення), які можуть бути використані як антагоністи рецепторів CGRP і можуть бути використані для лікування або профілактики захворювань, при яких уражаються CGRP, таких як головний біль, мігрень і гістаміновий головний біль. Винахід також відноситься до фармацевтичних композицій, що містять такі сполуки, і до застосування таких сполук і композицій для лікування або профілактики таких захворювань, при яких уражаються відноситься до антагоністів Даний винахід CGRP. CGRP, які включають сполуки формули І: де: R1 вибраний з: H, С1-С6-алкілу, С3-С6-циклоалкілу і гетероциклу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з: С1-С6-алкілу, С3-С6-циклоалкілу, фенілу, гетероарилу, гетероциклу, (F)pC1-C3-алкілу, галогену, OR4, O(CH2)sOR4, CO2R4. CN, NR10R11, O(CO)R4, де вказаний феніл, вказаний гетероарил і вказаний гетероцикл кожний незалежно один від одного є незаміщеним або заміщений 1-5 замісниками, де замісники незалежно один від одного вибрані з R4, де вказаний гетероарил вибраний з: імідазолу, ізоксазолу, оксазолу, піразину, піразолу, піридазину, піридину, піримідину і тіазолу; де вказаний гетероцикл вибраний з: азетидину, діоксану, діоксолану, морфоліну, оксетану, піперазину, піперидину, піролідину, тетрагідрофурану і тетрагідропірану; 9 арил або гетероарил вибрані з: фенілу, імідазолу, ізоксазолу, оксазолу, піразину, піразолу, піридазину, піридину, піримідину і тіазолу, де вказаний арил і вказаний гетероарил кожний незалежно один від одного є незаміщеним або заміщений одним або декількома замісниками, незалежно один від одного вибраними з: С1-С6алкілу, С3-С6-циклоалкілу, (F)рС1-С3-алкілу, галогену, OR4, CO2R4, (CO)NR10R11, SO2NR10R11, N(R10)SO2R11, S(O)mR4, CN, NR10R11 i O(CO)R4; R2 вибраний з: H, С0-С6-алкілу, С3-С6-циклоалкілу і гетероциклу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з: С1-С6-алкілу, С3-С6-циклоалкілу, фенілу, гетероарилу, гетероциклу, (F)pC1-C3-алкілу, галогену, OR4, O(CH2)sOR4, CO2R4, CN, NR10R11 і O(CO)R4; де вказаний феніл, вказаний гетероарил і вказаний гетероцикл кожний незалежно один від одного є незаміщеним або заміщений 1-5 замісниками, незалежно один від одного вибраними з R4, де вказаний гетероарил вибраний з: бензімідазолу, бензотіофену, фурану, імідазолу, індолу, ізоксазолу, оксазолу, піразину, піразолу, піридазину, піридину, піримідину, піролу, тіазолу, тіофену і триазолу; де вказаний гетероцикл вибраний з: азетидину, імідазолідину, імідазоліну, ізоксазоліну, ізоксазолідину, морфоліну, оксазоліну, оксазолідину, оксетану, піразолідину, піразоліну, піроліну, тетрагідрофурану, тетрагідропірану, тіазоліну і тіазолідину; арил або гетероарил вибрані з: фенілу, бензимідазолу, бензотіофену, фурану, імідазолу, індолу, ізоксазолу, оксазолу, піразину, піразолу, піридазину, піридину, піримідину, піролу, тіазолу, тіофену і триазолу; де вказаний арил і вказаний гетероарил кожний незалежно один від одного є незаміщеним або заміщений одним або декількома замісниками, незалежно один від одного вибраними з: С1-С6алкілу, С3-С6-циклоалкілу, (F)рС1-С3-алкілу, галогену, OR4, CO2R4, (CO)NR10R11, SO2NR10R11, N(R10)SO2R11, S(O)mR4, CN, NR10R11 і O(CO)R4, R10 і R11 незалежно один від одного вибрані з: H, С1-С6-алкілу, (F)pC1-C6-алкілу, С3-С6циклоалкілу, арилу, гетероарилу і бензилу, незаміщеного або заміщеного галогеном, гідрокси або С1-С6-алкокси, де R10 і R11 можуть бути об'єднані разом з утворенням циклу, вибраного з: азетидинілу, піролідинілу, піперидинілу, піперазинілу і морфолінілу, який є незаміщеним або заміщений 1-5 замісниками, де замісники незалежно один від одного вибрані з R4; R4 незалежно один від одного вибрані з: H, С1С6-алкілу, (F)рС1-С6-алкілу, C3-С6-циклоалкілу, арилу, гетероарилу і фенілу, незаміщеного або заміщеного гідрокси або C1-С6-алкокси; R3 незалежно один від одного вибрані з: H, заміщеного або незаміщеного C1-С6-алкілу, CN і CO2R4; р приймає значення від 0 до 2q+1, для замісників з q атомами вуглецю; m приймає значення 0,1 або 2; s приймає значення 1, 2 або 3; і їх фармацевтично прийнятні солі та індивідуальні діастереомери. В одному з варіантів даний винахід відноситься до сполук формули: 82877 10 де: R1 вибраний з: С1-С6-алкілу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з: C1-С6-алкілу, C3-C6циклоалкілу, фенілу, гетероарилу, гетероциклу, (F)рC3-C6-алкілу, галогену, OR4, O(CH2)sOR4, CO2R4, CN, NR10R11 і O(CO)R4, R2 вибраний з: арилу, незаміщеного або заміщеного одним або декількома замісниками, незалежно один від одного вибраними з: С1-С6-алкілу, С3-С6циклоалкілу, (F)pC1-С3-алкілу, галогену, OR4, CO2R4, (CO)NR10R11, SO2NR10R11, N(R10)SO2R11, S(O)mR4, CN, NR10R11 і O(CO)R4; R10 і R11 незалежно один від одного вибрані з: H, С1-С6-алкілу, (F)pС1-С6-алкілу, С3-С6циклоалкілу, арилу, гетероарилу і бензилу, незаміщеного або заміщеного галогеном, гідрокси або С1-С6-алкокси, де R10 і R11 можуть бути об'єднані разом з утворенням циклу, вибраного з: азетидинілу, піролідинілу, піперидинілу, піперазинілу і морфолінілу, який є незаміщеним або заміщений 1-5 замісниками, де замісники незалежно один від одного вибрані з R4; R4 незалежно один від одного вибраний з: H, С1-С6-алкілу, (F)рС1-С6-алкілу, С3-С6-циклоалкілу, арилу, гетероарилу і фенілу, незаміщеного або заміщеного гідрокси або С1-С6-алкокси; р приймає значення від 0 до 2q+1, для замісників з q атомами вуглецю; m приймає значення 0,1 або 2; s приймає значення 1, 2 або 3; і їх фармацевтично прийнятних солей або індивідуальних діастереомерів. Потрібно розуміти, що, коли одна або декілька з наведених вище структур або підструктур багато разів повторює замісники, що мають одне і те ж позначення, то кожна з таких змінних може мати однакове значення або відрізнятися від аналогічної вказаної змінної. Наприклад, замісник R2 перерахований чотири рази у формулі І, і кожний із замісників R2 у формулі І може незалежно один від одного являти собою будь-яку підструктуру, визначену під позначенням R2. Винахід не обмежений структурами і підструктурами, в яких кожний із замісників R2 повинен бути однаковим для даної структури. Те ж саме справедливо відносно будь-якої змінної, що з'являється множину разів у структурі або підструктурі. даного винаходу можуть містити один Сполуки або декілька асиметричних центрів і, отже, можуть існувати у вигляді рацемічних сумішей, одиничних енантіомерів, діастереомерних сумішей та індивідуальних діастереомерів. Можуть бути присутніми додаткові асиметричні центри в залежності від природи різних замісників у молекулі. Кожний такий асиметричний центр буде незалежно один від одного утворювати два оптичних ізомери, і мається на увазі, що всі можливі оптичні ізомери і діастереомери у сумішах і у вигляді чистих або частково очищених сполук входять в об'єм даного винаходу. Даний винахід, 11 винаходу. Даний винахід, як мається на увазі, охоплює всі такі ізомерні форми вказаних сполук. Деякі сполуки, описані у даному винаході, містять олефінові подвійні зв'язки і, якщо не обумовлено особливо, мається на увазі, що вони включають як E, так і Z геометричні ізомери. Незалежні синтези таких діастереомерів або їх хроматографічний розподіл можуть бути здійснені так, як відомо у даній галузі техніки, шляхом відповідної модифікації методології, описаної у роботі. Абсолютна стереохімія сполук може бути визначена за допомогою рентгенівської кристалографії кристалічних продуктів або кристалічних проміжних сполук, які були дериватизовані, якщо це необхідно, за допомогою реагенту, що містить асиметричний центр відомої абсолютноїбажано, то рацемічні суміші сполук Якщо конфігурації. можуть бути розділені так, щоб виділити індивідуальні енантіомери. Розділення може бути проведене з використанням способів, добре відомих у даній галузі, таких як реакція поєднання рацемічної суміші сполук з енантіомерно чистою сполукою з утворенням діастереомерної суміші, після чого йде розділення індивідуальних діастереомерів стандартними способами, такими як дробна кристалізація або хроматографія. Реакція поєднання часто являє собою утворення солей з використанням енантіомерно чистої кислоти або енантіомерно чистої основи. Діастереомерні похідні потім можуть бути перетворені у чисті енантіомери шляхом розщеплення введеного хірального залишку. Рацемічна суміш сполук також може бути розділена безпосередньо хроматографічними способами з використанням хіральних стаціонарних фаз, і такі способи добре відомі у даній галузі. З іншого боку, будь-який енантіомер сполуки може бути одержаний шляхом стереоселективного синтезу з використанням оптично чистих вихідних матеріалів або реагентів відомої конфігурації способами, які добре відомі у даній галузі. Як очевидно фахівцям у даній галузі, не всі замісники R10 і R11 здатні утворювати циклічну структуру. Більш того, навіть ті замісники, які здатні до утворення циклу, можуть утворювати або можуть не утворювати циклічну структуру. Також очевидно для фахівця у даній галузі, що термін «галоген» або «атом галогену», який використовується у даному описі, включає хлор, фтор, бром і йод. Використовуваний у даному описі термін «алкіл», як мається на увазі, означає лінійну, розгалужену або циклічну структури, що не містять подвійний або потрійний зв'язок. Отже, С1-6-алкіл визначає групу, яка містить 1, 2, 3, 4, 5 або 6 атомів вуглецю у лінійному або розгалуженому розташуванні, тобто, С1-6-алкіл конкретно включає метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, пентил і гексил. «Циклоалкіл» являє собою алкіл, який частково або повністю утворює кільце з трьох або більше атомів. C0 або С0-алкіл призначений для визначення наявності прямого ковалентного зв'язку. Термін «алкеніл» означає лінійну або розгалужену структури і їх комбінації з вказаного числа атомів вуглецю, що містить, щонайменше, один подвійний зв'язок вуглець-вуглець, де водень може бути заміщений додатковим вуглецьвуглецевим подвійним зв'язком. С2-6-алкеніл, наприклад, включає етеніл, пропеніл, 1метилетеніл, бутеніл і т.п. 82877 12 Термін «алкініл» означає лінійну або розгалужену структури і їх комбінації з вказаного числа атомів вуглецю, що містять, щонайменше, один потрійний зв'язок вуглець-вуглець. Таким чином, С2-6-алкініл означає групу, що містить 2, 3, 4, 5 або 6 атомів вуглецю у лінійному або розгалуженому розташуванні, тобто, С2-6-алкініл конкретно включає 2-гексиніл і 2-пентиніл. Використовуваний у даному описі термін «арил», як мається на увазі, означає будь-яке стабільне моноциклічне або біциклічне вуглецеве кільце, що містить до 7 елементів у коленому кільці, де, щонайменше, одне кільце є ароматичним. Приклади таких арильних елементів включають феніл, нафтил, тетрагідронафтил, інданіл або біфеніл. Термін «гетероцикл» або «гетероциклічний», який використовується в описі, за винятком вказаних випадків, являє собою стабільну 5-7членну моноциклічну або стабільну 8-11-членну біциклічну гетероциклічну кільцеву систему, яка є або насиченою або ненасиченою і яка складається з атомів вуглецю і одного-чотирьох гетероатомів, вибраних з групи, що включає N, O і S, і де гетероатоми азоту і сірки можуть бути необов'язково окиснені, а азотний гетероатом може бути необов'язково кватернізований, і включають будь-яку біциклічну групу, в якій будьяке з визначених вище гетероциклічних кілець конденсоване з бензольним кільцем. Гетероциклічне кільце може бути приєднане по будьякому гетероатому або атому вуглецю, який приводить до створення стабільної структури. Приклади таких гетероциклічних груп включають, але без обмеження, азетидин, хроман, дигідрофуран, дигідропіран, діоксан, діоксолан, гексагідроазепін, імідазолідин, імідазолідинон, імідазолін, імідазолінон, індолін, ізохроман, ізоіндолін, ізотіазолін, ізотіазолідин, ізоксазолін, ізоксазолідин, морфолін, морфолінон, оксазолін, оксазолідин, оксазолідинон, оксетан, 2оксогексагідроазепін, 2-оксопіперазин, 2оксопіперидин, 2-оксопіролідин, піперазин, піперидин, піран, піразолідин, піразолін, піролідин, піролін, хінуклідин, тетрагідрофуран, тетрагідропіран, тіаморфолін, тіазолін, тіазолідин, тіоморфолін«гетероарил», що використовується в Термін і їх N-оксиди. описі, за винятком зазначених випадків, визначає стабільну 5-7-членну моноциклічну або стабільну 9-10-членну конденсовану біциклічну гетероциклічну кільцеву систему, яка містить ароматичне кільце, будь-яке кільце якої може бути насиченим, таку як піперидиніл, частково насиченим або ненасиченим, таку як піридиніл, і яке складається з атомів вуглецю і одногочотирьох гетероатомів, вибраних з групи, що складається з N, O і S, і де гетероатоми азоту і сірки можуть бути необов'язково окиснені, а азотний гетероатом може бути необов'язково кватернізований, і включають будь-яку біциклічну групу, в якій будь-яке з визначених вище гетероциклічних кілець конденсоване з бензольним кільцем. Гетероциклічне кільце може бути приєднане по будь-якому гетероатому або атому вуглецю, що приводить до створення стабільної структури. Приклади таких гетероарильних груп включають, але без обмеження, бензимідазол, бензизотіазол, бензизоксазол, бензофуран, бензотіазол, бензотіофен, бензотриазол, бензоксазол, карболін, цинолін, фуран, фуразан, імідазол, індазол, індол, індолізин, ізохінолін, ізотіазол, ізоксазол, нафтиридин, оксадіазол, оксазол, фталазин, 13 птеридин, пурин, піран, піразин, піразол, піридазин, піридин, піримідин, пірол, хіназолін, хінолін, хіноксалін, тетразол, тіадіазол, тіазол, тіофен, триазин, триазол і їх N-оксиди. Термін «алкокси», як в С1-С6-алкокси, відноситься до алкоксигруп, що містять від 1 до 6 атомів вуглецю, у лінійній, розгалуженій і циклічній конфігурації. Приклади включають метокси, етокси, пропокси, ізопропокси, циклопропілокси, циклогексилокси і т.п. Вираз «фармацевтично прийнятні» використовується у цьому випадку для визначення сполук, матеріалів, композицій і/або дозованих лікарських форм, які у межах затвердженого медичного законодавства підходять для застосування у контакті з тканинами тіла людини або тварини без надмірної токсичності, подразнення, алергічної реакції та інших проблем або ускладнень, порівнянних з розумним співвідношенням позитивний ефект/ризик. Використовуване у даному описі визначення «фармацевтично прийнятні солі» відноситься до похідних, в яких вихідна сполука модифікована шляхом одержання її кислотних або основних солей. Приклади фармацевтично прийнятних солей включають, але без обмеження, мінеральні або органічні кислотні солі основних залишків, таких як аміни; лужні або органічні солі кислотних залишків, таких як карбонові кислоти; і т.п. Фармацевтично прийнятні солі включають звичайні нетоксичні солі або четвертинні амонійні солі вихідної сполуки, одержані, наприклад, з нетоксичних неорганічних або органічних кислот. Наприклад, такі звичайні нетоксичні солі являють собою солі, одержані з неорганічних кислот, таких як соляна, бромисто-воднева, сірчана, сульфамінова, фосфорна, азотна кислота і тому подібне; і солі, одержані з органічних кислот, таких як оцтова, пропіонова, бурштинова, гліколева, стеаринова, молочна, малеїнова, винна, лимонна, аскорбінова, памова, малеїнова, гідроксималеїнова, фенілоцтова, глутамінова, бензойна, саліцилова, сульфанілова, 2ацетоксибензойна, фумарова, толуолсульфонова, метансульфонова, етандисульфонова, щавлева, ізетіонова кислота і т.п.змінних, присутніх у деяких Число визначених випадках, визначається за числом присутніх атомів вуглецю. Наприклад, змінну «р» іноді визначають наступним чином: «р приймає значення від 0 до 2q+1, для замісників з q атомами вуглецю». Коли замісник являє собою (F)рС1-3-алкіл, це означає, що, коли присутній один атом вуглецю, можуть бути присутніми 2(1)+1=3 атоми фтору. Коли присутні два атоми вуглецю, можуть бути присутніми 2(2)+1=5 атомів фтору, і, коли присутні три атоми вуглецю, можуть бути присутніми 2(3)+1=7 атомів фтору. Коли сполука даного винаходу є основною, солі можуть бути одержані з фармацевтично прийнятних нетоксичних кислот, включаючи неорганічні і органічні кислоти. Такі кислоти включають оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, етансульфонову, фумарову, глюконову, глутамінову, бромистоводневу, соляну, ізетіонову, молочну, малеїнову, яблучну, мигдалеву, метансульфонову, слизову, азотну, памову, пантотенову, фосфорну, бурштинову, сірчану, винну, п-толуолсульфонову кислоту і т.п. В одному з аспектів даного винаходу солі являють собою солі лимонної, бромистоводневої, соляної, малеїнової, фосфорної, сірчаної, фумарової і винної кислот. 82877 14 Потрібно розуміти, що при використанні у даному випадку мається на увазі, що посилання на сполуки формули І також включають і фармацевтично прийнятні солі. Прикладом винаходу є застосування сполук, описаних у прикладах і в описі. Конкретними сполуками у межах даного винаходу є сполуки, які вибрані з групи, що включає сполуки, описані у наведених нижче прикладах, і їх фармацевтично прийнятні солі та індивідуальні діастереомери. Сполуки можуть бути використані у способі придушення рецепторів CGRP у пацієнта, такого як ссавець, який потребує такого придушення, що включає введення ефективної кількості сполуки. Даний винахід відноситься до застосування сполук, описаних у винаході, як антагоністів рецепторів CGRP. Крім приматів, особливо людей, ряд інших ссавців може піддаватися лікуванню відповідно до способу даного винаходу. Інший варіант здійснення даного винаходу відноситься до способу лікування, регуляції, ослаблення або зниження ризику захворювання або розладу, при якому у хворого уражаються рецептори CGRP, і цей спосіб включає введення хворому терапевтично ефективної кількості сполуки, яка являє собою антагоніст рецепторів CGRP. Даний винахід також відноситься до способу виробництва медикаменту для придушення активності рецепторів CGRP у людини і тварин, що включає змішування сполуки даного винаходу з фармацевтично прийнятним наповнювачем або розріджувачем. Суб'єкт, який піддається лікуванню способами даного винаходу, звичайно є ссавцем, наприклад, людиною, чоловіком або жінкою, якій необхідне придушення активності рецепторів CGRP. Термін «терапевтично ефективна кількість» означає кількість сполуки, яка буде викликати біологічну або медичну реакцію тканини, системи, тварини або людини, яка передбачається дослідником, ветеринаром, лікуючим лікарем або іншим клініцистом. Використовуване у даному описі поняття «лікування» відноситься як до лікування, так і до попередження або профілактичного лікування згаданих вище станів, особливо у хворого, який має схильність до такого захворювання або розладу.що використовується у Термін «композиція», даному описі, як мається на увазі, охоплює продукт, що містить визначені інгредієнти у визначених кількостях, а також продукт, який утвориться, безпосередньо або опосередковано, з поєднання визначених інгредієнтів у визначених кількостях. Такий термін відносно фармацевтичної композиції, як мається на увазі, включає продукт, що містить активний(і) інгредієнт(и) та інертний(і) інгредієнт(и), який(і) являє(ють) собою носій, а також продукт, який утвориться, безпосередньо або опосередковано, з поєднання, комплексоутворення або агрегації будь-яких двох або декількох інгредієнтів або з дисоціації одного або декількох інгредієнтів, або з інших типів реакцій або взаємодій одного або декількох інгредієнтів. Таким чином, фармацевтичні композиції даного винаходу включають будь-яку композицію, одержану змішуванням сполуки даного винаходу і фармацевтично прийнятного носія. Під «фармацевтично прийнятним» розуміється, що носій, розріджувач або ексципієнт повинен бути сумісним з іншими інгредієнтами рецептури і не повинен бути шкідливим для реципієнта. 15 Термін «введення» і/або «призначення» сполуки потрібно розуміти як доставку сполуки даного винаходу або проліків сполуки даного винаходу індивідууму, який потребує лікування. Застосовність сполук відповідно до даного винаходу як антагоніста активності рецептора CGRP може бути показана за допомогою методології, відомої у даній галузі. Інгібування 125 зв'язування I-CGRP з рецепторами і функціональний антагонізм рецепторів CGRP визначають зв'язування: Зв'язування 125I-CGRP з Оцінка наступним чином. рецепторами у мембранах клітин SK-N-MC проводять по суті так, як описано у публікації Edvinsson et al. (2001), [Ew. J.Pharmacol., 415, 3944]. Якщо говорити коротко, то мембрани (25мкг) інкубують в 1мл зв'язувального буфера (10мМ HEPES, рН 7,4, 5мМ MgCl2 і 0,2% альбуміну бичачої сироватки (BSA)), що містить 10пМ 125ICGRP та інгібітор. Після витримування при кімнатній температурі протягом 3 годин дослід переривають шляхом фільтрування через фільтрувальні пластини зі скловолокна GFB (Millipore), які були блоковані 0,5% поліетиленіміном протягом 3 годин. Фільтри промивають три рази буфером для аналізу, охолодженим льодом, потім пластини сушать на повітрі. Додають сцинтиляційну рідину (50мкл) і підраховують радіоактивність на приладі Topcount (Packard Instrument). Дані аналізу обробляють з використанням Prism, і Kj визначають з використанням рівняння Cheng-Prusoff [Cheng & Prusoff (1973), Biochem. Pharmacol. 22, 3099-3108]. Функціональна оцінка: Клітини SK-N-MC вирощують у мінімальному підтримуючому середовищі (MEM), доповненому 10% фетальної бичачої сироватки, 2мМ L-глутаміну, 0,1мМ не основних амінокислот, 5мМ пірувату натрію, 100од./мл пеніциліну і 100мкг/мл стрептоміцину, при 37°C, 95% вологості і 5% CO2. У випадку аналізу цАМФ клітини наносять з розрахунку 5x105 клітина/ямка на 96-ямковий покритий полі-Блізином планшет (Becton-Dickinson) і культивуть протягом 18 годин до проведення аналізу. Клітини промивають фізіологічним розчином з фосфатним буфером (PBS, Sigma), потім заздалегідь витримують з 300мкМ ізобутилметилксантину у безсироватковому MEM протягом 30хв. при 37°C. Додають CGRP (8-37мкл) і клітини витримують протягом 10хв. до додавання CGRP. Інкубацію продовжують ще 15хв., потім клітини промивають PBS і обробляють для визначення цАМФ відповідно до рекомендацій виробника. Максимальну стимуляцію у порівнянні з базовим рівнем визначають з використанням 100нМ CGRP. Криві доза-реакція одержують за допомогою Prism. Розраховують залежність доза-співвідношення (DR) і використовують для створення завершених Schild-графіків [Arunlakshana & Schild (1959), Br. J. Pharmacol. 14, сполуки наведених далі прикладів Зокрема, 48-58]. мають активність як антагоністи рецепторів CGRP у згаданих вище методах оцінки звичайно зі значеннями Ki або IC50 менш ніж приблизно 50мкМ. Такі результати вказують на значну активність сполук при застосуванні як антагоністів рецепторів CGRP. Здатність сполук даного винаходу діяти як антагоністи CGRP робить їх корисними фармакологічними агентами у випадку захворювань, які уражають CGRP у людини і тварин, але особливо у людини. 82877 16 Сполуки даного винаходу знаходять застосування при лікуванні, профілактиці, ослабленні, регулюванні або зниженні ризику одного або декількох з наступних станів або захворювань: головний біль; мігрень; гістаміновий головний біль; головний біль при хронічному тиску; біль; хронічний біль; нейрогенне запалення і запальний біль; біль очей; зубний біль; діабет; інсулін незалежний цукровий діабет; судинні захворювання; запалення; артрит; астма; шок, сепсис; синдром відмови від опіатів; толерантність до морфіну; припливи крові у чоловіків і жінок; алергічний дерматит; енцефаліт; травма головного мозку; епілепсія; нейродегенеративні захворювання; захворювання шкіри; нейрогенне шкірне почервоніння; рожевість шкіри і еритеми; та інші стани, які можна лікувати або попереджувати шляхом придушення рецепторів CGRP. Особливо важливим є гостре або профілактичне лікування головного болю, включаючи мігрень і гістаміновий головний біль.також можуть бути використані у Сполуки способі профілактики, лікування, регуляції, ослаблення або зменшення ризику захворювань, розладів і станів, вказаних в описі. Сполуки також можуть бути використані у способі профілактики, лікування, регуляції, ослаблення або зменшення ризику захворювань, розладів і станів у комбінації з іншими агентами. Сполуки даного винаходу можуть бути використані у комбінації з одним або декількома іншими ліками при лікуванні, профілактиці, регуляції, ослабленні або зменшенні ризику захворювань або станів, для яких сполуки винаходу або інші ліки можуть знаходити застосування, де комбінація ліків разом є безпечнішою або більш ефективною, ніж будь-які ліки окремо. Такі інші ліки можуть бути введені способом і у звичайно використовуваній кількості одночасно або послідовно зі сполуками, що заявляються. Коли сполуку, що заявляється, використовують одночасно з одним або декількома іншими ліками, може бути використана фармацевтична композиція у стандартній лікарській формі, що містить такі інші ліки і сполуку, що заявляється. Однак комбінована терапія також може включати лікування, при якому сполуки, що заявляються, і один або декілька інших лікарських засобів вводять за різними схемами, що перекриваються. Також мається на увазі, що при використанні у комбінації з одним або декількома іншими активними інгредієнтами сполуки даного винаходу й інші активні інгредієнти можуть бути використані у більш низьких дозах, ніж при використанні кожного лікарського засобу окремо. Таким чином, фармацевтичні композиції даного винаходу включають композиції, які містять один або декілька активних інгредієнтів, крім сполуки або сполук, що заявляються. Наприклад, сполуки даного винаходу можуть бути використані у комбінації з протизапальним або знеболюючим агентом або засобом проти мігрені, таким як, наприклад, ерготамін або агоністи 5-HT1, особливо агоніст 5-HT1в/1D, наприклад, суматриптан, наратриптан, золмітриптан, елетриптан, алмотриптан, фловатриптан, донітриптан і ризатриптан; інгібітором циклооксигенази, таким як селективний інгібітор циклооксигенази-2, наприклад, рофекоксиб, еторикоксиб, целекоксиб, валдекоксиб або паракоксиб; нестероїдним протизапальним агентом або протизапальним агентом, що придушує цитокін, наприклад, з такою сполукою, як аспірин, ібупрофен, кетопрофен, 17 аспірин, ібупрофен, кетопрофен, фенопрофен, напроксен, індометацин, суліндак, мелоксикам, піроксикам, теноксикам, лорноксикам, кеторолак, етодолак, мефенамінова кислота, меклофенамінова кислота, флуфенамінова кислота, толфенамінова кислота, диклофенак, оксапрозин, апазон, німесулід, набуметон, тенідап, етанерцепт, толметин, фенілбутазон, оксифенбутазон, дифлунізал, салсалат, олсалазин або сулфазалазин і т.п.; або зі стероїдним анальгетиком. Аналогічно, сполуки даного винаходу можуть бути введені з болезаспокійливим засобом, таким як ацетамінофен, фенацетин, кодеїн, фентаніл, суфентаніл, метадон, ацетилметадол, бупренорфін або морфін. Крім того, сполуки даного винаходу можуть бути використані у поєднанні з інгібітором інтерлейкіну, таким як інгібітор інтерлейкіну-1; антагоністом рецептора NK-1, наприклад, апрепітантом; антагоністом NMDA; антагоністом NR2B; антагоністом рецептора брадикініну-1; агоністом рецептора аденозину A1; блокатором натрієвого каналу, наприклад, ламотригіном; опіатним агоністом, таким як левометадил-ацетат або метадил-ацетат; інгібітором ліпоксигенази, таким як інгібітор 5-ліпоксигенази; антагоністом альфа-рецептора, наприклад, індораміном; агоністом альфа-рецептора; антагоністом ванілоїдного рецептора; агоністом, антагоністом або потенціюючим засобом mGluR5; модулятором рецептора GABA А, наприклад, акампросаткальцієм; нікотиновими антагоністами або агоністами, включаючи нікотин; мускариновими агоністами або антагоністами; селективними інгібіторами повторного поглинання серотоніну, наприклад, флуоксетином, пароксетином, сертраліном, дулоксетином, есциталопрамом або циталопрамом; трициклічним антидепресантом, наприклад, амітриптиліном, доксепіном, протриптиліном, дезипраміном, триміпраміном або іміпраміном; антагоністами лейкотриєну, наприклад, монтелукастом або зафірлукастом; інгібіторами оксиду азоту або інгібіторами синтезу оксиду азоту. сполуки даного винаходу можуть Крім того, бути використані у поєднанні з алкалоїдами ріжків, такими як, наприклад, ерготамін, ергоновін, метилергоновін, метерголін, ерголоїдні мезилати, дигідроерготамін, дигідроергокорнін, дигідроергокристин, дигідроергокриптин, дигідро-Іергокриптин, дигідро-f-ергокриптин, ерготоксин, ергокорнін, ергокристин, ергокриптин, Іергокриптин, f-ергокриптин, ергозин, ергостан, бромкриптин або метисергід. Крім того, сполуки даного винаходу можуть бути використані у поєднанні з бета-адренергічним антагоністом, таким як тимолол, пропанолол, атенолол або надолол і т.п.; інгібітором МАО, наприклад, фенелзином; блокатором кальцієвого каналу, наприклад, таким як флунаризин, німодипін, ломеризин, верапаміл, ніфедипін, прохлорперазин або габапентин; з нейролептиками, такими як оланзапін і кветіапін; з антиконвульсантом, таким як топірамат, зонізамід, тонаберсат, караберсат або дивалроекс-натрій; антагоністом ангіотензину II, наприклад, таким як лозартан і кандесартан-цилексетил; інгібітором ферменту, що перетворює ангіотензин, таким як лізиноприл; або токсином ботулізму типу А. 82877 18 Сполуки даного винаходу можуть бути використані у поєднанні зі стимулюючим засобом, таким як кофеїн, Н2-антагоніст, симетикон, гідроксид алюмінію або магнію; із засобом проти набряку, таким як фенілефрин, фенілпропаноламін, псевдоефедрин, оксиметазолін, епінефрин, нафазолін, ксилометазолін, пропілгекседрин або леводезокси-ефедрин; з протикашльовим засобом, таким як кодеїн, гідрокодон, караміфен, карбетапентан або декстрометорфан; з діуретиком; прокінетичним засобом, таким як метоклопрамід або домперидон, і з седативним або В одному з варіантів сполуки даного винаходу неседативним антигістаміном. використовуються у поєднанні із засобами проти мігрені, такими як: ерготамін; агоніст 5-НТ1 особливо агоніст 5-НТ1в/1D, зокрема, суматриптан, наратриптан, золмітриптан, елетриптан, алмотриптан, фловатриптан, донітриптан і ризатриптан; та інгібітором циклооксигенази, таким як селективний інгібітор циклооксигенази-2, зокрема, рофекоксиб, еторикоксиб, целекоксиб, мелоксикам, валдекоксиб або паракоксиб. Наведені вище комбінації включають комбінації сполуки даного винаходу не тільки з однією іншою активною сполукою, але також з двома або декількома іншими активними сполуками. Аналогічно, сполуки даного винаходу можуть бути використані у комбінації з іншими лікарськими засобами, які використовуються для профілактики, лікування, регуляції, ослаблення або зниження ризику захворювань або станів, для яких можуть бути використані сполуки даного винаходу. Такі інші ліки можуть бути введені за допомогою способу і у звичайно використовуваній кількості одночасно або послідовно зі сполукою даного винаходу. Коли сполука даного винаходу використовується одночасно з одним або декількома іншими ліками, можлива фармацевтична композиція, що містить крім сполуки даного винаходу такі інші ліки. Таким чином, фармацевтичні композиції даного винаходу включають композиції, які також містять один або декілька інших активних інгредієнтів, крім сполуки даного винаходу. Масове співвідношення сполуки даного винаходу до іншого(их) активного(их) інгредієнта(ів) може змінюватися і буде залежати від ефективної дози кожного інгредієнта. Звичайно використовують ефективну дозу кожного інгредієнта. Отже, наприклад, коли сполука даного винаходу змішана з іншим агентом, масове співвідношення сполуки даного винаходу до іншого агента буде звичайно знаходитися в інтервалі приблизно від 1000:1 до 1:1000, або приблизно від 200:1 до 1:200. Комбінації сполуки даного винаходу та інших активних інгредієнтів звичайно будуть знаходитися у межах згаданого вище інтервалу, але у кожному випадку повинна бути використана ефективна доза кожного активного інгредієнта. композиціях сполука даного винаходу У таких та інші активні агенти можуть бути введені окремо або у поєднанні. Крім того, введення одного елемента може бути проведене до, паралельно або послідовно з введенням іншого(их) агента(ів), і через такі ж або інші шляхи введення. Сполуки даного винаходу можуть бути введені перорально, парентерально (наприклад, внутрішньом'язовою, внутрішночеревною, внутрішньовенною, інтрацеребровентикулярною (ICV), інтрацистернальною ін'єкцією або вливанням, підшкірною ін'єкцією, або за 19 підшкірною ін'єкцією, або за допомогою імплантату), за допомогою інгаляційного спрею, назальними, вагінальними, ректальними, під'язиковими або місцевими способами введення, і можуть бути приготовані, окремо або разом, у вигляді відповідних дозованих стандартних лікарських рецептур, що містять звичайні нетоксичні фармацевтично прийнятні носії, ад'юванти і розчинники, відповідні для кожного способу введення. Крім лікування теплокровних тварин сполуки даного винаходу ефективні при використанні людиною. Фармацевтичні композиції для введення сполуки даного винаходу звичайно присутні у стандартній лікарській формі і можуть бути приготовані будь-якими способами, які добре відомі у галузі фармації. Всі способи включають стадію проведення об'єднання активного інгредієнта з носієм, який включає один або декілька допоміжних активних інгредієнтів. У загальному випадку фармацевтичні композиції готують шляхом однорідного і близького об'єднання активного інгредієнта з рідким носієм або тонкоподрібненим твердим носієм або з обома, і потім, якщо необхідно, шляхом формування продукту у бажаний препарат. У фармацевтичній композиції активна сполука знаходиться у кількості, достатній для одержання бажаного впливу на протікання або стан захворювання. Використовуваний у даному описі термін «композиція», як мається на увазі, охоплює продукт, що містить визначені інгредієнти у визначених кількостях, а також будь-який продукт, який утворюється, безпосередньо або опосередковано, Фармацевтичні з композиції, поєднання щовизначених містять інгредієнтів у визначених кількостях. активний інгредієнт, можуть знаходитися у формі, придатній для перорального застосування, наприклад, у вигляді таблеток, коржиків, водних або масляних суспензій, таких, що диспергуються, порошків або гранул, емульсій, твердих або м'яких капсул, або сиропів або еліксирів. Композиції, призначені для перорального застосування, можуть бути приготовані способами, відомими у даній галузі техніки для виробництва фармацевтичних композицій, і такі композиції можуть містити один або декілька агентів, вибраних з групи, що включає підсолоджуючі агенти, агенти, що коригують смак і запах, барвні агенти і консерванти, щоб одержати фармацевтично відмінні і приємні препарати. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними ексципієнтами, які підходять для виробництва таблеток. Такі ексципієнти можуть являти собою, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючий і дезінтегруючий агент, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язувальні агенти, наприклад, крохмаль, желатин або аравійська камедь; і змащувальні агенти, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки можуть бути без покриття або на них може бути нанесене покриття за допомогою відомих технологій, щоб затримати дезінтеграцію і абсорбцію у шлунково-кишковому тракті і, таким чином, забезпечити постійну дію протягом більш тривалого періоду. Наприклад, може бути використаний матеріал, що затримує час вивільнення, такий як моностеарат або дистеарат гліцерину. Таблетки також можуть бути покриті за допомогою методик, описаних у патентах США 82877 20 США 4256108, 4166452 і 4265874, з одержанням осмотичних терапевтичних таблеток для контрольованого вивільнення. Пероральні таблетки можуть бути приготовані для негайного вивільнення, наприклад, такі, що швидко плавляться, таблетки або облатки, швидкорозчинні таблетки або швидкорозчинні плівки. Препарати для перорального застосування також можуть бути одержані у вигляді твердих желатинових капсул, де активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, з карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, де активний інгредієнт змішаний з водою або масляним середовищем, наприклад, з кокосовою олією, рідким вазеліном або Водні суспензії містять активні матеріали у оливковою олією. суміші з ексципієнтами, придатними для виробництва водних суспензій. Такі ексципієнти являють собою суспендуючі агенти, наприклад, натрій-карбоксиметилцелюлозу, метилцелюлозу, гідроксипропілметилцелюлозу, альгінат натрію, полівінілпіролідон, трагакант і аравійську камедь; диспергуючі або змочувальні агенти можуть являти собою існуючий у природі фосфатид, наприклад, лецитин, або продукти конденсації алкіленоксиду з жирними кислотами, наприклад, поліоксіетиленстеарат, або продукти конденсації етиленоксиду з довголанцюжковими аліфатичними спиртами, наприклад, гептадекаетиленоксицетанол, або продукти конденсації етиленоксиду з неповним ефіром, одержаним з жирних кислот і гекситу, таких як поліоксіетиленсорбітмоноолеат, або продукти конденсації етиленоксиду з неповним ефіром, одержаним з жирних кислот і ангідридів гекситу, наприклад, поліетиленсорбітанмоноолеат. Водні суспензії також можуть містити один або декілька консервантів, наприклад, етил- або н-пропіл-п-і ідроксибетол, один або декілька барвних агентів, один або декілька агентів, що коригують смак або запах, і один або декілька підсолоджуючих агентів, таких як сахароза або сахарин.можуть знаходитися Фармацевтичні композиції у формі стерильної, такої, що ін'єктується, водної або масляної суспензії. Така суспензія може бути приготована за відомими у даній галузі методиками з використанням відповідних диспергуючих або змочувальних агентів і суспендуючих агентів, які були згадані вище. Стерильні препарати, що ін'єктуються, також можуть являти собою стерильний розчин, що ін'єктується, або стерильну суспензію, що ін'єктується, у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, у вигляді розчину в 1,3-бутандіолі. Серед прийнятних носіїв і розчинників, які можуть бути використані, знаходяться вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, стерильні, нелеткі масла звичайно використовують як розчинник або суспендуюче середовище. Для цих цілей може бути використане будь-яке нетоксичне нелетке масло, у тому числі, синтетичні моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, знаходять застосування при композиція і спосіб даного Фармацевтична приготуванні засобів, що винаходу ін'єктуються. можуть додатково включати терапевтично активні сполуки, згадані вище, які звичайно застосовують для лікування описаних вище патологічних станів. 21 При лікуванні, профілактиці, регуляції, ослабленні або зниженні ризику станів, які потребують придушення активності рецептора CGRP, відповідний рівень доз буде складати звичайно від 0,01 до 500мг на кг маси тіла пацієнта на день, і ці дози можуть бути введені у разових або розділених дозах. Відповідний рівень доз може складати приблизно від 0,01 до 250мг/кг на день, приблизно від 0,05 до 100мг/кг на день, або приблизно від 0,1 до 50мг/кг на день. У межах вказаного інтервалу доза може складати від 0,05 до 0,5, від 0,5 до 5 або від 5 до 50мг/кг на день. У випадку перорального введення композиції можуть бути приготовані у формі таблеток, що містять від 1,0 до 1000мг активного інгредієнта, зокрема, 1,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0 і 1000,0мг активного інгредієнта, для регулювання дози за симптомами для пацієнта, який піддається лікуванню. Сполуки можуть бути введені за схемою від 1 до 4 разів на день, або можуть бути введені один або два рази на день. При лікуванні, профілактиці, регуляції, ослабленні або зниженні ризику головного болю, мігрені, гістамінового головного болю або інших захворювань, для яких призначені сполуки даного винаходу, звичайно задовільні результати одержують, коли сполуки даного винаходу вводять при щоденній дозі приблизно від 0,1мг до 100мг на кг маси тіла тварини, що дається у вигляді разової щоденної дози або у вигляді розділених доз від двох до шести разів на день, або у формі з поступовим вивільненням. Для більшості великих ссавців сумарна денна доза складає приблизно від 1,0 до 1000мг, або приблизно від 1 до 50мг. У випадку дорослої людини масою 70кг сумарна денна доза звичайно буде складати приблизно від 7 до 350мг. Такий режим дозування може бути адаптований з метою досягнення оптимальної терапевтичної реакції. Однак потрібно розуміти, що визначений рівень доз і частота введення для будь-якого конкретного пацієнта можуть змінюватися і будуть залежати від різних факторів, у тому числі, від активності конкретної використовуваної сполуки, метаболічної стабільності і тривалості дії даної сполуки, віку, маси тіла, загального стану здоров'я, статі, харчування, способу і часу введення, швидкості виведення, лікарської комбінації, серйозності конкретного стану і реципієнта, який піддається лікуванню. Деякі способи одержання сполук даного винаходу представлені у наступних схемах і прикладах. Вихідні матеріали приготовані за методиками, відомими у даній галузі або представленими в описі. Сполуки даного винаходу можуть бути легко одержані відповідно до наведених нижче схем і конкретних прикладів або їх модифікацій з використанням легко доступних вихідних матеріалів, реагентів і звичайних методик синтезу. У цих реакціях також можливі зміни, які самі по собі відомі фахівцям у даній галузі, але не згадуються при докладному описі. Загальні методики одержання сполук, заявлених у даному винаході, можуть бути легко зрозумілі та сприйняті фахівцем у даній галузі при розгляді наступних схем. Синтез капролактам-азабензимідазолонових проміжних сполук може бути здійснений так, як описано на схемах 1-6. Реакційні схеми 82877 22 Одержання кінцевих сполук протікає через проміжні сполуки, які являють собою сполуки формули III і формули IV, і синтез кожної проміжної сполуки описаний. У загальному випадку проміжні сполуки формул III і IV можуть бути з'єднані через сечовинний місток, як показано на схемі І. Амінна проміжна сполука І може бути перетворена у реакційноздатний карбамат, наприклад, пнітрофенілкарбамат 2, який потім взаємодіє з аміном, подібним до проміжної сполуки 3, з одержанням сечовини 4. Інші активні проміжні сполуки, відомі фахівцям у даній галузі, можуть бути використані для одержання сполук типу сполуки 4. Наприклад, амін 1 може бути відразу ж ацилований відповідним карбамоїлхлоридом. Синтез сполук, представлених проміжною сполукою II, може бути здійснений за допомогою методик, аналогічних методикам, описаним у публікаціях [Henning et al., J. Med. Chem., 1987, 30, 814-819; Carpino et al., WO 96/35713; Brown et al., J. Chem. Soc, 1957, 682-686; Barlin et al., Aust. J. Chem., 1982, 35(11), 2299-2306]; і у наведених в них посиланнях. Крім того, синтез сполук, представлених проміжною сполукою II, може бути виконаний відповідно до схеми 2. Наприклад, діаміногетероцикл, такий як 2,3-діамінопіридин 5, може бути підданий відновному алкілуванню кетонами, такими як сполука 6, з одержанням моноалкілованого продукту 7. Замикання кільця карбонілдіімідазолом дає імідазолон 8. Остаточне зняття захисту у стандартних умовах дає кінцевий продукт 9. 23 Капролактами можуть бути одержані за стратегією олефінової реакції обміну, яка показана на схемі 3. Гідрохлорид 2,4-диметоксибензиламіну алкілують 2,3-дибромпропеном у м'яких основних умовах з одержанням аміну 11. (2R)-2{[(Бензилокси)карбоніл]аміно}пент-4-енова кислота 12, одержана на одній стадії з комерційно доступного D-алілгліцину відповідно до відомих методик [J. Chem. Soc, 1962, 3963-3968], може бути зв'язана з аміном 11 у різних умовах з одержанням аміду 13. Ряд перехресних спряжень, що каталізуються перехідним металом, може бути здійснений на вінілброміді, наприклад, опосередковувані паладієм арилування фенілбороновою кислотою і карбонатом натрію, з одержанням похідного стиролу 14. Реакція обміну із замиканням циклу, що проводиться у присутності рутенієвого каталізатора Грубса другого покоління у дихлорметані при м'якому нагріванні, дає лактам 15. Видалення диметоксибензильної групи і гідрування із захистом in situ первинного аміну дає відповідний насичений лактам 17. Після селективного алкілування амідного азоту різними електрофілами, такими як алкілброміди, зняття захисту у кислих умовах дає сполуки загальної формули 19. Змінні у положенні 6 капролактамів можуть бути введені з використанням аналогічної стратегії (схема 4). Реакція обміну із замиканням кільця може бути проведена безпосередньо на вінілброміді 13 з використанням рутенієвого каталізатора Грубса другого покоління з одержанням циклічного вінілброміду 20. Видалення диметоксибензильної групи і опосередковуване паладієм перехресне спряження, у даному випадку з бороновою кислотою, дає сполуки загальної формули 22. Перетворення від сполуки 21 до сполуки 22 не обмежене похідними боронової кислоти. Після стандартного гідрування амідний азот може бути селективно алкілований різними електрофілами, наприклад, алкілбромідами, з використанням 82877 24 ми, з використанням гідриду натрію як основи. Зняття захисту дає лактами загальної формули 25. У деяких випадках кінцевий продукт може бути додатково модифікований, наприклад, шляхом маніпуляції із замісниками. Такі маніпуляції можуть включати, але не обмежуються тільки ними, реакції відновлення, окиснення, алкілування, ацилювання і гідролізу, які загалом відомі фахівцям у даній галузі. Приклади У деяких випадках порядок проведення наведених вище реакційних схем може змінюватися для прискорення реакції або для виключення утворення небажаних продуктів реакції. Наступні приклади запропоновані для того, щоб винахід міг бути зрозумілий більш повно. Дані приклади є тільки ілюстративними, і їх не треба розглядати як такі, що обмежують винахід. Дигідрохлорид 2-оксо-1-(4-піперидиніл)-2,3дигідро-1Н-імідазо[4,5-b]піридину Стадія А. 2-Аміно-3-[(1-третбутоксикарбонілпіперидин-4-іл)аміно]піридин До розчину 2,3-діамінопіридину (5,00г, 45,8ммоль) і N-(трет-бутоксикарбоніл)-4піперидону (9,58г, 48,1ммоль) у дихлоретані (75мл) при кімнатній температурі додають триацетоксиборгідрид натрію (14,5г, 68,7ммоль). Через 5 годин додають ще триацетоксиборгідрид натрію (1,8г) і знову ще через 2,5 години. Реакційну суміш перемішують протягом ночі і реакцію гасять 5% водним розчином гідроксиду натрію. Реакційну масу екстрагують метиленхлоридом і промивають 5% водним розчином гідроксиду натрію, водою і насиченим розчином хлориду натрію. Після сушіння над сульфатом натрію розчин фільтрують і упарюють, одержуючи сирий продукт. Одержаний продукт очищають хроматографією (силікагель, елюювання з градієнтом від 3 до 5% метанолу у метиленхлориді), одержуючи вказану у заголовку сполуку (4,44г). MC 293 (М+1). 1Н-ЯМР (500МГц, 25 (4,44г). MC 293 (М+1). 1Н-ЯМР (500МГц, CD3OD) d 7,32 (дд, J=1, 5 Гц, 1H), 6,85 (дд, J=1, 8 Гц, 1H), 6,59 (дд, J=5, 8 Гц, IH), 4,04 (д, J=13 Гц, 2Н), 3,46 (м, 1H), 2,98 (шир.с, 2Н), 2,01 (дд, J=2, 12 Гц, 2Н), 1,46 (с, 9Н), 1,37 (квд, J=4, 12 Гц, 2Н). Стадія В. 2-Оксо-1-(1-третбутоксикарбонілпіперидин-4-іл)-2,3-дигідро-1Hімідазо[4,5-b]піридин Карбонілдіімідазол (0,70г, 4,33ммоль) додають до розчину 2-аміно-3-[(1-третбутоксикарбонілпіперидин-4-іл)аміно]піридину (1,15г, 3,93ммоль) в ацетонітрилі (150мл) при кімнатній температурі. Через декілька годин додають додаткову кількість карбонілдіімідазолу (0,81г) і реакційну суміш перемішують протягом ночі. Ацетонітрил випарюють у вакуумі, залишок розподіляють між водою і хлороформом, органічну фазу промивають насиченим розчином солі і сушать над сульфатом магнію. Сирий продукт очищають хроматографією (силікагель, елюювання з градієнтом від 1,2 до 2,5% метанолу у метиленхлориді), одержуючи вказану у заголовку сполуку (1,09г). 1Н-ЯМР (500МГц, COCl3) d 9,39 (шир.с, 1H), 8,04 (дд, J=1, 5 Гц, 1H), 7,33 (дд, J=1, 8 Гц, 1H), 6,99 (дд, J=5, 8 Гц, 1H), 4,50 (м, 1H), 4,32 (шир.с, 2Н), 2,86 (шир.с, 2Н), 2,20 (м, 2Н), 1,86 (д, J=12 Гц, 2Н), 1,50 (с, 9Н). Стадія C. Дигідрохлорид 2-оксо-1-(4піперидиніл)-2,3-дигідро-1Н-імідазол[4,5-b]піридин 2-Оксо-1-(1-трет-бутоксикарбонілпіперидин-4іл)-2,3-дигідро-1H-імідазо[4,5-b]піридин (1,03г, 3,23ммоль) розчиняють у метаночі (25мл) і при кімнатній температурі додають 2н. розчин соляної кислоти в ефірі (8мл). Через 2 години леткі компоненти видаляють у вакуумі, одержуючи вказану у заголовку сполуку (0,92г). MC 219 (М+1). 1 Н-ЯМР (500МГц, CD3OD) 6 8,01 (дд, J=1, 6 Гц, 1H), 7,83 (д, J=8 Гц, 1H), 7,28 (дд, J=6, 8 Гц, 1H), 4,60 (м, 1H), 3,59 (д, J=12 Гц, 2Н), 3,21 (т, J=12 Гц, 2H), 2,70 (дкв, J=4, 13 Гц, 2H), 2,12 (д, J=13 Гц, 2H). (3R,6S)-3-Аміно-1-(2-метоксіетил)-6фенілазепан-2-он Стадія А: 2-бром-N-(2,4диметоксибензил)проп-2-ен-1-амін Триетиламін (16,0мл, 114ммоль) додають до розчину гідрохлориду 2,4-диметоксибензиламіну (11,1г, 54,5ммоль) і 2,3-дибромпропену (10,9г, 54,5ммоль) у дихлорметані (200мл). Через 18 годин додають воду і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [100% дихлорметан ® 95% дихлорметан/5% (10% гідроксид амонію/метанол)] дає вказану у заголовку сполуку (7,85г). Стадія В: бензил (1R)-1-{[(2-бромпроп-2еніл)(2,4-диметокси-бензил)аміно]карбоніл}бут-3енілкарбамат 82877 26 Гідрохлорид 1-[3-(диметиламіно)пропіл]-3етилкарбодііміду (55мг, 0,285ммоль) додають до розчину 2-бром-N-(2,4-диметоксибензил)проп-2ен-1-аміну (73мг, 0,256ммоль) і (2R)-2{[(бензилокси)карбоніл]аміно}пент-4-енової кислоти (71мг, 0,285ммоль) у дихлорметані (5мл). Через 18 годин суміш концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 30% етилацетат/гексани] дає вказану у заголовку сполуку (77мг). MC 517 (M+1). Стадія С: бензил (1R)-1-{[(2,4диметоксибензил)(2-фенілпроп-2енил)аміно]карбоніл}бут-3-енілкарбамат Тетракіс(трифенілфосфін)паладій(0) (1,11г, 0,962ммоль) додають до розчину бензил (1R)-1{[(2-бромпроп-2-еніл)(2,4диметоксибензил)аміно]карбоніл}бут-3енілкарбамату (2,49г, 4,81ммоль), фенілборонової кислоти (0,65г, 5,29ммоль) і карбонату натрію (2М у воді, 4,81мл, 9,63ммоль) у тетрагідрофурані (54мл) і воді (20мл) і суміш нагрівають до 60°C. Через 1 годину суміші дають охолонути до кімнатної температури і екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікателі [5% етилацетат/гексани ® 30% етилацетат/гексани] дає вказану у заголовку сполуку (2,02г). MC 515 (М+1). Стадія D: бензил (3R)-1-(2,4диметоксибензил)-2-оксо-6-феніл-2,3,4,7тетрагідро-1Н-азепін-3-ілкарбамат [1,3-біс-(2,4,6-Триметилфеніл-2імідазолідиніліден)дихлор(фенілметилен)(трициклогексилфосфін)рутеній] (каталізатор Грубса другого покоління) (0,68г, 0,79ммоль) додають до розчину бензил (1R)-1-{[(2,4диметоксибензил)(2-фенілпроп-2еніл)аміно]карбоніл} бут-3-енілкарбамату (2,02г, 3,93ммоль) у дихлорметані (395мл) і нагрівають до 40°C. Через 40 годин суміші дають охолонути до кімнатної температури і концентрують Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 30% етилацетат/гексани] дає вказану у заголовку сполуку (1,00г). MC 487 (М+1). 1H-ЯMP (500МГц, CDCl3) d 7,39-7,31 (м, 5Н), 7,26-7,19 (м, 3H), 7,17 (д, J=8,3 Гц, 1H), 6,99 (д, J=7,1 Гц, 2H), 6,41 (дд, J=8,3, 2,0 Гц, 1H), 6,33 (с, 1H), 6,22 (д, J=6,4 Гц, 1H), 5,77-5,76 (м, 1H), 5,165,09 (м, 3H), 4,82 (д, J=14,7 Гц, 1H), 4,65 (дд, J=17,6,2,7 Гц, 1H), 4,54 (д, J=14,4 Гц, 1H), 3,93 (д, J=17,6 Гц, 1H), 3,77 (с, 3H), 3,64 (с, 3H), 2,91-2,86 (м, 1H), 2,42-2,36 (м, 1H). Стадія E: бензил (3R)-2-оксо-6-феніл-2,3,4,7тетрагідро-1Н-азепін-3-ілкарбамат Розчин L-метіоніну (2,56г, 17,2ммоль) у трифтороцтовій кислоті (15мл) додають до розчину бензил (3R)-1-(2,4-диметоксибензил)-2-оксо-6феніл-2,3,4,7-тетрагідро-1H-азепін-3-ілкарбамату (0,84г, 1,72ммоль) у дихлорметані (20мл). Через 18 годин суміш концентрують і додають воду. Суміш екстрагують етилацетатом, промивають водою (2х), насиченим водним розчином бікарбонату натрію (2х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 50% етилацетат/гексани] дає вказану у заголовку сполуку (0,44г). MC 337 (M+1). 27 Стадія F: трет-бутил (3R,6S)-2-оксо-6фенілазепан-3-ілкарбамат 10% Паладій на вугіллі (75мг) додають до розчину бензил (3R)-2-оксо-6-феніл-2,3,4,7тетрагідро-1Н-азепін-3-ілкарбамату (596мг, 1,77ммоль) і ди-трет-бутилдикарбонату (773мг, 3,54ммоль) в етилацетаті (30мл). Реакційну посудину вакуумують і заповнюють у зворотному напрямі азотом (3х), потім заповнюють у зворотному напрямі воднем (1атм). Через 2 години суміш фільтрують і концентрують. Очищення хроматографією на силікагелі [30% етилацетат/гексани ® 50% етилацетат/гексани] дає вказану у заголовку сполуку (289мг). Стадія G: трет-бутил (3R,6S)-1-(2-метоксіетил)2-оксо-6-фенілазепан-3-ілкарбамат Гідрид натрію (60% дисперсія у мінеральному маслі; 6,2мг, 0,158ммоль) додають до розчину трет-бутил (3R,6S)-2-оксо-6-фенілазепан-3ілкарбамату (40мг, 0,131ммоль) і 2брометилметилового ефіру (0,013мл, 0,138ммоль) в N,N-диметилформаміді (2мл) при 0°C. Після додавання суміші дають нагрітися до кімнатної температури. Через 4 години реакцію гасять водою і суміш екстрагують етилацетатом. Органічний шар промивають водою (3х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і 82877 28 концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 30% етилацетат/гексани] дає вказану у заголовку сполуку (41мг). MC 363 (M+1). Стадія H: (3R,6S)-3-аміно-1-(2-метоксіетил)-6фенілазепан-2-он Трифтороцтову кислоту (2,5мл) додають до розчину трет-бутил (3R,6S)-1-(2-метоксіетил)-2оксо-6-фенілазепан-3-ілкарбамату (41мг, 0,113ммоль) у дихлорметані (5мл). Через 1 годину розчин концентрують. Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. MC 263 (М+1). 1Н-ЯМР (500МГц, CDCl3) d 7,32 (т, J=7,3 Гц, 2Н), 7,25-7,22 (м, 1H), 7,18 (д, J=8,3 Гц, 2Н), 3,83-3,76 (м, 3H), 3,56-3,49 (м, 3H)5 3,35 (с, 3H), 3,34-3,30 (м, 1H), 2,77-2,72 (м, 1H), 2,13-2,10 (м, 1H), 2,03-1,94 (м, 2Н), 1,74-1,68 (м, 1H). Дотримуючись фактично методик, описаних для одержання проміжної сполуки 2, одержують проміжні сполуки, представлені у таблиці l-1. 29 (3R)-3-Аміно-6-(4-гідроксифеніл)азепан-2-он Стадія А: бензил (3R-6-бром-1-(2,4диметоксибензил)-2-оксо-2,3,4,7-тетрагідро-1Hазепін-3-ілкарбамат [1,3-біс-(2,4,6-Триметилфеніл-2імідазолідиніліден)дихлор(фенілметилен)(трициклогексилфосфін)рутеній] (каталізатор Грубса другого покоління) (1,78г, 2,05ммоль) додають до розчину бензил (1R)-1-{[(2-бромпроп2-еніл)(2,4-диметоксибензил)аміно]карбоніл}бут-3енілкарбамату (5,29г, 10,2ммоль) у дихлорметані (1000мл) і нагрівають до 40°C. Через 18 годин суміші дають охолонути до кімнатної температури і концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 30% етилацетат/гексани] дає вказану у заголовку сполуку (0,79г). MC 489 (М+1). 1Н-ЯМР (500МГц, CDCl3) d 7,36-7,35 (м, 4Н), 7,33-7,30 (м, 1H), 7,177,15 (м, 1H), 6,46-6,43 (м, 2Н), 6,13 (д, J=6,1 Гц, 1H), 6,04-6,03 (м, 1H), 5,13-5,07 (м, 2Н), 4,93-4,88 (м, 1H), 4,75 (д, J=14,4 Гц, 1H), 4,64-4,60 (м, 1H), 4,47 (д, J=14,4 Гц, 1H), 3,86 (д, J=18,3 Гц, 1H), 3,81 (с, 3Н), 3,80 (с, 3H), 2,68-2,63 (м, 1H), 2,24-2,05 (м, 1H).Стадія В: бензил (3R)-6-бром-2-оксо-2,3,4,7тетрагідро-1H-азепін-3-ілкарбамат Розчин L-метіоніну (274мг, 1,84ммоль) у трифтороцтовій кислоті (5мл) додають до розчину бензил (3R)-6-бром-1-(2,4-диметоксибензил)-2оксо-2,3,4,7-тетрагідро-1Н-азепін-3-ілкарбамату 82877 30 (90мг, 0,184ммоль) у дихлорметані (5мл). Через 18 годин суміш концентрують. Очищення ВЕРХ з оберненою фазою [C-18, 95% вода/ацетонітрил ® 5% вода/ацетонітрил з 0,1% трифтороцтової кислоти] дає вказану у заголовку сполуку (17мг). MC 339 (М+1). Стадія С: бензил (3R)-6-(4-гідроксифеніл)-2оксо-2,3,4,7-тетрагідро-1Н-азепін-3-ілкарбамат Ацетат паладію (1мг, 0,003ммоль) додають до розчину бензил (3R)-6-бром-2-оксо-2,3,4,7тетрагідро-1Н-азепін-3-ілкарбамату (18мг, 0,053ммоль), 4-гідроксифенілборонової кислоти (9мг, 0,064ммоль), карбонату натрію (2М у воді, 0,066мл, 0,133ммоль) і тринатрій-3-[біс(3сульфонатофеніл)фосфіно]бензол-сульфонату (5мг, 0,088ммоль) в N,N-диметилформаміді (0,45мл) і воді (0,15мл) і нагрівають до 80°C. Через 1,5 години суміші дають охолонути до кімнатної температури і фільтрують. Очищення ВЕРХ з оберненою фазою [C-18, 95% вода/ацетонітрил ® 5% вода/ацетонітрил з 0,1% трифтороцтової кислоти] дає вказану у заголовку сполуку (15мг). MC 353 (M+1). Стадія D: (3R)-3-аміно-6-(4гідроксифеніл)азепан-2-он 10% Паладій на вугіллі (10мг) додають до розчину бензил (3R)-6-(4-гідроксифеніл)-2-оксо2,3,4,7-тетрагідро-1Н-азепін-3-ілкарбамату (15мг, 0,043ммоль) у толуолі (5мл) і метанолі (1мл). Реакційну посудину вакуумують і заповнюють у зворотному напрямі азотом (3х), потім заповнюють у зворотному напрямі воднем (1атм). Через 18 годин суміш фільтрують і концентрують. MC 221 (M+1). Дотримуючись фактично методик, описаних для одержання проміжної сполуки 12, одержують проміжні сполуки, представлені у таблиці l-2. 31 (3R,6S)-3-Аміно-6-(2,3-дифторфеніл)азепан-2он Стадія А: 2-N-(2,4-диметоксибензил)проп-2-ен1-амін Триетиламін (16,0мл, 114ммоль) додають до розчину гідрохлориду 2,4-диметоксибензиламіну (11,1г, 54,5ммоль) і 2,3-дибромпропену (10,9г, 54,5ммоль) у дихлорметані (200мл). Через 18 годин додають воду і суміш екстрагують 82877 32 дин додають воду і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [100% дихлорметан ® 95% дихлорметан/5% (10% гідроксид амонію/метанол)] дає вказану у заголовку сполуку (7,85г). Стадія В: бензил (1R)-1-{[(2-бромпроп-2еніл)(2,4-диметокси-бензил)аміно]карбоніл}бут-3енілкарбамат Гідрохлорид 1-[3-(диметиламіно)пропіл]-3етилкарбодііміду (55мг, 0,285ммоль) додають до розчину 2-бром-N-(2,4-диметоксибензил)проп-2ен-1-аміну (73мг, 0,256ммоль) і (2R)-2{[(бензилокси)карбоніл]аміно}пент-4-енової кислоти (71мг, 0,285ммоль) у дихлорметані (5мл). Через 18 годин суміш концентрують. Очищення 33 18 годин суміш концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 30% етилацетат/гексани] дає вказану у заголовку сполуку (77мг). MC 517 (M+1). Стадія С: бензил (1R)-1-{[[2-(2,3дифторфеніл)проп-2-еніл](2,4диметоксибензил)аміно]карбоніл}бут-3енілкарбамат Аддукт дихлор[1,1¢біс(дифенілфосфіно)фероцен]паладію і дихлорметану (0,726г, 0,889ммоль) додають до розчину бензил (1R)-1-{[(2-бромпроп-2-еніл)(2,4диметоксибензил)аміно]карбоніл}бут-3енілкарбамату (9,2г, 17,8ммоль), 2,3дифторфенілборонової кислоти (2,95г, 18,7 ммоль) і карбонату натрію (2М у воді; 19,6мл, 39,1ммоль) в N,N-диметилформаміді (60мл) і суміш нагрівають до 75°C. Через 2 години суміші дають охолонути до кімнатної температури і екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 55% етилацетат/гексани] дає вказану у заголовку сполуку (6,8г). MC 551,2 (М+1). Стадія D: бензил (3R)-6-(2,3-дифторфеніл)-1(2,4-диметоксибензил)-2-оксо-2,3,4,7-тетрагідро1Н-азепін-3-ілкарбамат [1,3-біс-(2,4,6-Триметилфеніл-2імідазолідиніліден)дихлор(фенілметилен)(трициклогексилфосфін)рутеній] (каталізатор Грубса другого покоління) (2,62г, 3,09ммоль) додають до розчину бензил (1R)-1-{[[2-(2,3Дифторфеніл)проп-2-еніл](2,4диметоксибензил)аміно]карбоніл}бут-3енілкарбамату (6,8г, 12,35ммоль) у дихлорметані (1800мл) і розчин нагрівають до 40°C. Через 48 годин додають додаткову кількість каталізатора (0,52г, 0,61ммоль) і реакційну суміш продовжують нагрівати при 40°C ще 48 годин. Суміші дають охолонути до кімнатної температури і концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 55% етилацетат/гексани] дає вказану у заголовку сполуку (3,71г). MC 523,1 (M+1). Стадія E: бензил (3R)-6-(2,3-дифторфеніл)-2оксо-2,3,4,7-тетрагідро-1Н-азепін-3-ілкарбамат Трифтороцтову кислоту (60мл) додають до розчину бензил (3R)-6-(2,3-дифторфеніл)-1-(2,4диметоксибензил)-2-оксо-2,3,4,7-тетрагідро-1Hазепін-3-ілкарбамату (3,70г, 7,08ммоль) у дихлорметані (40мл). Через 18 годин суміш концентрують при 25°C, додають метанол (150мл) і осад відфільтровують. Фільтрат концентрують, розбавляють дихлорметаном (100мл), промивають водою (2х), насиченим водним розчином бікарбонату натрію (2х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [5% етилацетат/гексани ® 65% етилацетат/гексани] дає вказану у заголовку сполуку (1,75г). MC 373,1 (M+1). Стадія F: трет-бутил (3R,6S)-6-(2,3дифторфеніл)-2-оксоазепан-3-ілкарбамат 10% Паладій на вугіллі (700мг) додають до розчину бензил (3R)-6-(2,3-дифторфеніл)-2-оксо-2,3,4,7тетрагідро-1Н-азепін-3-ілкарбамату (2,6г, 6,98ммоль) і ди-трет-бутилдикарбонату (5,03г, 82877 34 23,0ммоль) у толуолі (200мл). Реакційну посудину вакуумують і заповнюють у зворотному напрямі азотом (3х), потім заповнюють у зворотному напрямі воднем (1атм). Через 24 години суміш фільтрують і концентрують. Очищення препаративною хроматографією з оберненою фазою (DeltaPak C18, 15мкм, 47x300мм, 70мл/хв.: 80% Н2О/NH4ОАс:від 20% CH3CN до 100% CH3CN протягом 60хв.) дає чистий транс-ізомер вказаної у заголовку сполуки (1,2г). MC 341,2 (М+1). 1Н-ЯМР (500МГц, CDCl3) d 7,07-7,04 (м, 2Н), 6,91-6,89 (м, 1H), 6,04 (шир.с, 1H), 5,93 (д, J=5,6 Гц, 1H), 4,46 (дд, J=10,5, 4,6 Гц, 1H), 3,65-3,59 (м, 1H), 3,21 (дд, J=15,1, 7,3 Гц, 1H), 3,05-3,00 (м, 1H), 2,25-2,20 (м, 1H), 2,17-2,10 (м, 2Н), 1,79-1,71 (м, 1H), 1,46 (с, 9Н). Стадія G: (3R,6S)-3-аміно-6-(2,3дифторфеніл)азепан-2-он Трифтороцтову кислоту (4мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-2оксоазепан-3-ілкарбамату (82мг, 0,241ммоль) у дихлорметані (4мл). Через 1 годину розчин концентрують. Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. MC 241,0 (M+1). (3R,6S)-3-Аміно-6-(2,3-дифторфеніл)-1-[2(метилтіо)етил]азепан-2-он Стадія А: трет-бутил (3R,6S)-6-(2,3дифторфеніл)-1-[2-(метилтіо)етил]-2-оксоазепан-3ілкарбамат Гідрид натрію (60% дисперсія у мінеральному маслі; 40мг, 0,600ммоль) додають до розчину третбутил-(3R,6S)-6-(2,3-дифторфеніл)-2-оксоазепан3-ілкарбамату (170мг, 0,500ммоль) в N,Nдиметилформаміді (4мл) при 0°C. Через 5хв. суміш охолоджують до -30°C і додають 1-йод-2(метилтіо)етан [одержаний за відомою методикою: J. Org. Chem., 1987, 52, 2299-2301 (158мг, 0,782ммоль)]. Додають додаткову кількість гідриду натрію (33мг, 0,50ммоль) і через 4 години додають надлишок гідриду натрію (33мг, 0,50ммоль) і 1-йод2-(метилтіо)етану (75,6мг, 0,374ммоль). Через 3 години додають кінцеві порції гідриду натрію (33мг, 0,50ммоль) і 1-йод-2-(метилтіо)етану (75,6мг, 0,374ммоль) і суміш перемішують при -20°C протягом ночі. Реакцію гасять водою і суміш концентрують етилацетатом. Органічний шар промивають водою (3х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [0% етилацетат/гексани ® 50% етилацетат/гексани] дає вказану у заголовку сполуку (77мг). MC 415 (M+1). Стадія В: (3R,6S)-3-аміно-6-(2,3-дифторфеніл)1-[2-(метилтіо)етил]азепан-2-он Трифтороцтову кислоту (2мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-1[2-(метилтіо)етил]-2-оксоазепан-3-ілкарбамату 35 (метилтіо)етил]-2-оксоазепан-3-ілкарбамату (77мг, 0,186ммоль) у дихлорметані (10мл). Через 30хв. розчин концентрують і сушать азеотропною відгонкою з толуолом (2х). Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. MC 315,2 (M+1). (3R,6S)-3-Аміно-6-(2,3-дифторфетл)-1-[2(метилсульфініл)етил]азепан-2-он Стадія А: трет-бутил (3R,6S)-6-(2,3дифторфеніл)-1-[2-(метилсульфініл)етил]-2оксоазепан-3-ілкарбамат Періодат натрію (11,3мг, 0,053ммоль) додають до розчину трет-бутил (3R,6S)-6-(2,3дифторфеніл)-1-[2-(метилтіо)етил]-2-оксоазепан-3ілкарбамату (22мг, 0,053ммоль) у метанолі (2мл) і воді (2мл). Через 30хв. додають періодат натрію (22мг, 0,11ммоль). Через 18 годин додають насичений водний розчин карбонату натрію і суміш екстрагують етилацетатом. Органічний шар промивають насиченим водним розчином карбонату натрію (3х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку. MC 431 (М+1). Стадія B: (3R,6S)-3-аміно-6-(2,3-дифторфеніл)1-[2-(метилсульфініл)етил]азепан-2-он Трифтороцтову кислоту (1мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-1[2-(метилсульфініл)етил]-2-оксоазепан-3ілкарбамату (23мг, 0,053ммоль) у дихлорметані (2мл). Через 3 години розчин концентрують. Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку. MC 331 (М+1). (3R,6S)-3-Аміно-6-(2,3-дифторфеніл)-1-[2(метилсульфоніл)етил]азепан-2-он Стадія А: трет-бутил (3R,6S)-6-(2,3дифторфеніл)-1-[2-(метилсульфоніл)етил]-2оксоазепан-3-ілкарбамат Оксон (16,1мг, 0,11ммоль) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-1-[2(метилтіо)етил]-2-оксоазепан-3-ілкарбамату (22мг, 82877 36 0,053ммоль) у метанолі (2мл) і воді (2мл). Через 6 годин додають надлишок оксону (32мг, 0,22ммоль). Через 18 годин реакцію гасять водним розчином сульфіту натрію і суміш екстрагують етилацетатом. Органічний шар промивають насиченим водним розчином карбонату натрію (3х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку. MC 447 (М+1). Стадія B: (3R,6S)-3-аміно-6-(2,3-дифторфеніл)1-[2-(метилсульфоніл)етил]азепан-2-он Трифтороцтову кислоту (1мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-1[2-(метилсульфоніл)етил]-2-оксоазепан-3ілкарбамату (23,7мг, 0,053ммоль) у дихлорметані (2мл). Через 4 години розчин концентрують. Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку. MC 347 (М+1). (3R,6S)-3-Аміно-6-(2,3-дифторфеніл)1-(2метоксіетил)азепан-2-он Стадія А: трет-бутил (3R,6S)-6-(23дифторфеніл)-1-(2-метоксіетил)-2-оксоазепан-3ілкарбамат Гідрид натрію (60% дисперсія у мінеральному маслі; 17,6мг, 0,264ммоль) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-2оксоазепан-3-ілкарбамату (75мг, 0,220ммоль) в N,N-диметилформаміді (2мл) при 0°C. Через 5хв. додають 2-брометилметиловий ефір (0,025мл, 0,264ммоль) і суміші дають нагрітися до кімнатної температури. Через 3 години реакцію гасять водою і суміш екстрагують етилацетатом. Органічний шар промивають водою (2х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку. MC 421 (M+Na). Стадія В: (3R,6S)-3-аміно-6-(2,3-дифторфеніл)1-(2-метоксіетил)азепан-2-он Трифтороцтову кислоту (2,5мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-1(2-метоксіетил)-2-оксоазепан-3-ілкарбамату (99мг, 0,248ммоль) у дихлорметані (5мл). Через 1 годину розчин концентрують і сушать азеотропною відгонкою з толуолом (2х). Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушатьнад сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку. MC 299,2 (М+1). 37 (3R,6S)-3-Аміно-6-(2,3-дифторфеніл)-1-(2,2,2трифторетил)азепан-2-он Стадія А: трет-бутил (3R,6S)-6-(2,3дифторфеніл)-2-оксо-1-(2,2,2-трифторетил)азепан3-ілкарбамат Гідрид натрію (60% дисперсія у мінеральному маслі; 70,7мг, 1,06ммоль) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-2оксоазепан-3-ілкарбамату (301мг, 0,884ммоль) в N,N-диметилформаміді (7мл) при -35°С. Через 15хв. додають 2,2,2трифторетилтрихлорметансульфонат (0,314мл, 1,91ммоль) і реакційну суміш перемішують при 35°C. Через 30хв. додають додаткову кількість гідриду натрію (27мг, 0,40ммоль) і 2,2,2трифторетилтрихлорметансульфонату (0,140мл, 0,85ммоль). Через 2 години реакцію гасять водою і суміш екстрагують етилацетатом. Органічний шар промивають водою (3х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі (0% етилацетат/гексани ® 30% етилацетат/гексани) дає вказану у заголовку сполуку (306мг). MC 423 (M+1). Стадія В: (3R,6S)-3-аміно-6-(2,3-дифторфеніл)1-(2,2,2-трифторетил)азепан-2-он Трифтороцтову кислоту (2,5мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-2оксо-1-(2,2,2-трифторетил)азепан-3-ілкарбамату (135мг, 0,320ммоль) у дихлорметані (5мл). Через 30хв. розчин концентрують і сушать азеотропною відгонкою з толуолом (2х). Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. MC 323,1 (М+1). 1HЯMP (500МГц, CDCl3) d 7,11-7,03 (м, 2Н), 6,93-6,89 (м, 1H), 4,21-4,13 (м, 1H), 4,10-3,98 (м, 2Н), 3,85 (д, J=11,0 Гц, 1H), 3,35 (д, J=15,4 Гц, 1H), 3,04-2,99 (м, 1H), 2,13-2,09 (м, 2Н), 2,08-2,02 (м, 1H), 1,78-1,70 (м, 3H). (3R,6S)-6-Aмінo-6-(2,3-дифтopфeніл)-1(піpидин-2-iлмeтил)aзeпaн-2-oн Стадія А: трет-бутил (3R,6S)-6-(2,3дифторфеніл)-2-оксо-1-(піридин-2-ілметил)азепан3-ілкарбамат Гідрид натрію (60% дисперсія у мінеральному маслі; 30мг, 1,175ммоль) додають до розчину трет 82877 38 бутил (3R6S)-6-(2,3-дифторфеніл)-2-оксоазепан-3ілкарбамату (160мг, 0,470ммоль) в N,Nдиметилформаміді (6мл) при 0°C. Через 30хв. додають 2-бромметилпіридин (0,125мг, 0,494ммоль). Через 1 годину реакцію гасять водою і суміш екстрагують етилацетатом. Органічний шар промивають водою (2х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку (202мг). MC 432,2 (М+1). Стадія В: (3R,6S)-3-аміно-6-(2,3-дифторфеніл)1-(піридин-2-ілметил)азепан-2-он Трифтороцтову кислоту (3мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-2оксо-1-(піридин-2-ілметил)азепан-3-ілкарбамату (202мг, 0,468ммоль) у дихлорметані (4мл). Через 18 годин розчин концентрують. Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. MC 332,2 (М+1). (3R,6S)-3-Аміно-6-(2,3-дифторфеніл)-1піридин-4-ілазепан-2-он Стадія А: трет-бутил (3R,6S)-6-(2,3дифторфеніл)-2-оксо-1-піридин-4-ілазепан-3ілкарбамат 4-Бромпіридин (286мг, 1,47ммоль) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-2оксоазепан-3-ілкарбамату (200мг, 0,588ммоль), 4,5-біс(дифенілфосфіно)-9,9-диметилксантену (20мг, 0,035ммоль), трис(дибензиліденацетон)дипаладію(0) (22мг, 0,024ммоль) і карбонату цезію (268мг, 0,823ммоль) у діоксані (6мл) і суміш нагрівають при 150°C у мікрохвильовому реакторі Personal Chemistry Smith Creator. Через 30хв. додають додаткову кількість 4,5-біс(дифенілфосфіно)-9,9-диметилксантену (20мг, 0,035ммоль) і трис(дибензилїденацетон)дипаладію(0) (22мг, 0,024ммоль). Через 30хв. суміш розподіляють між етилацетатом і водою. Органічний шар промивають водою (2х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують, одержуючи вказану у заголовку сполуку (55мг). MC 418,2 (М+1). Стадія В: (3R,6S)-3-аміно-6-(2,3-дифторфеніл)1-піридин-4-ілазепан-2-он Трифтороцтову кислоту (2мл) додають до розчину трет-бутил (3R,6S)-6-(2,3-дифторфеніл)-2оксо-1-піридин-2-ілазепан-3-ілкарбамату (55мг, 0,132ммоль) у дихлорметані (2мл). Через 1 годину розчин концентрують. Додають насичений водний розчин бікарбонату натрію і суміш екстрагують дихлорметаном (3х). Об'єднані органічні екстракти промивають насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. MC 318,2 (М+1). 39 Дотримуючись по суті методик, описаних для одержання проміжних сполук 23-28, одержують 82877 40 проміжні сполуки, представлені у таблиці 1-3. 41 N-[(3R,6S)-1-(2-Метоксіетіл)-2-оксо-6фенілазепан-3-іл]-1-4-(2-оксо-2,3-дигідро-1Німідазо[4,5-b]піридин-1-іл)піперидин-1-карбоксамід Триетиламін (0,015мл, 0,107ммоль) додають до розчину (3R,6S)-3-аміно-1-(2-метоксіетил)-6фенілазепан-2-ону (28мг, 0,107ммоль) і 4 82877 42 нітрофеніл-хлорформіату (22мг, 0,107ммоль) у тетрагідрофурані (2мл) при 0°C. Через 30хв. додають 2-оксо-1-піперидиній-4-іл-2,3-дигідро-1Німідазо[4,5-b]піридин-4-ійдихлорид (37мг, 0,128ммоль), діізопропілетиламін (0,074мл, 0,427ммоль) і дихлорметан (2,5мл) і суміші дають нагрітися до кімнатної температури. Через 18 годин додають насичений водний розчин карбонату натрію і суміш екстрагують етилацетатом. Органічний шар промивають насиченим водним розчином карбонату натрію (3х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі (100% дихлорметан ® 93% дихлорметан/метанол) дає вказану у заголовку сполуку (45мг). MC 507,2737 (М+1). Дотримуючись по суті методик, описаних для одержання сполуки прикладу 1, одержують сполуки, приклади яких представлені у таблиці E1. 43 N-[(3R)-6-(4-Гідроксифеніл)-2-оксоазепан-3-іл]4-(2-оксо-2,3-дигідро-1Н-імідазо[4,5-b]піридин-1іл)піперидин-1-карбоксамід Триетиламін (0,009мл, 0,091ммоль) додають до розчину (3R)-3-аміно-6-(4-гідроксифеніл)азепан2-ону (10мг, 0,045ммоль) і 4нітрофенілхлорформіату (18мг, 0,091ммоль) в N,N 82877 44 диметилформаміді (0,2мл) і тетрагідрофурані (0,2мл) при 0°C. Через 1 годину додають 2-оксо-1піперидиній-4-іл-2,3-дигідро-1Н-імідазо[4,5b]піридин-4-ійдихлорид (26мг, 0,091ммоль) і діізопропілетиламін (0,032мл, 0,182ммоль) і суміші дають нагрітися до кімнатної температури. Через 18 годин суміш очищають ВЕРХ з оберненою фазою (C-18, 95% вода/ацетонітрил ® 5% вода/ацетонітрил з 0,1% трифтороцтової кислоти), одержуючи вказану у заголовку сполуку (7мг). MC 465,2243 (М+1). Дотримуючись по суті методик, описаних для одержання сполуки прикладу 14, одержують сполуки, приклади яких представлені у таблиці Е2. 45 82877 46 Очищення ВЕРХ з оберненою фазою (C-18, 95% вода/ацетонітрил ® 5% вода/ацетонітрил з 0,1% трифтороцтової кислоти), дає вказану у заголовку сполуку. MC 575 (M+1). N-{(3R,6S)-6-(2,3-Дифторфеніл)-1-[2(метилтіо)етил1-2-оксоазепан-3-ілІ-4-(2-оксо-2,3дигідро-1Н-імідазо[4,5-b]піридин-1-іл)піперидин-1карбоксамід Триетиламін (0,020мл, 0,143ммоль) додають до розчину (3R,6S)-3-аміно-6-(2,3-дифторфеніл)-1[2-(метилтіо)етил]азепан-2-ону (45мг, 0,143ммоль) і 4-нітрофенілхлорформіату (29мг, 0,143ммоль) у тетрагідрофурані (3мл) при 0°C. Через 15хв. додають 2-оксо-1-піперидиній-4-іл-2,3-дигідро-1Німідазо-[4,5-b]піридин-4-ійдихлорид (46мг, 0,157ммоль), триетиламін (0,080мл, 0,572ммоль) і дихлорметан (5мл) і суміш нагрівають до 50°C. Через 30хв. суміші дають охолонути до кімнатної температури і концентрують. Очищення хроматографією на силікагелі (100% дихлорметан ® 95% дихлорметан/метанол (10% гідроксид амонію/метанол)] дає вказану у заголовку сполуку (60мг). Вказану у заголовку сполуку перетворюють в НСІ-сіль за допомогою 2М розчину HCl в ефірі. MC 559,2 (М+1). 1Н-ЯМР (500МГц, CD3OD) d 8,11 (дд, J=7,8 Гц, 1,0 Гц, 1H), 7,99 (дд, J=6,1 Гц, 1,0 Гц, 1H), 7,38-7,35 (м, 1H), 7,18-7,14 (м, 3H), 4,76 (д, J=10,7 Гц, 1H), 4,61-4,54 (м, 1H), 4,31-4,26 (м, 2H), 4,15-4,09 (м, 1H), 3,85-3,80 (м, 1H), 3,67-3,58 (м, 1H), 3,37 (д, J=15,4 Гц, 1H), 3,20-3,16 (м, 1H), 3,082,96 (м, 2H), 2,75-2,70 (м, 2H), 2,49-2,41 (м, 1H), 2,34-2,26 (м, 1H), 2,21-2,16 (м, 1H), 2,14 (с, 3H), 2,11-2,07 (м, 2H), 1,90-1,85 (м, 3H). N-{(3R,6S)-6-(2,3-Дифторфеніл)-1-[2(метилсульфініл)етил1-2-оксоазепан-3-іл1-4-(2оксо-2,3-дигідро-1H-імідазо[4,5-b]піридин-1іл)піперидин-1-карбоксамід Триетиламін (0,010мл, 0,027ммоль) додають до розчину (3R,6S)-3-aміно-6-(2,3-дифторфеніл)-1[2-(метилсульфініл)етил]азепан-2-ону (8,9мг, 0,027ммоль) і 4-нітрофенілхлорформіату (5,4мг, 0,027ммоль) у тетрагідрофурані (0,700мл) при 0°C. Через 45хв. додають 2-оксо-1-піперидиній-4-іл-2,3дигідро-1Н-імідазо[4,5-b]піридин-4-ійдихлорид (7,9мг, 0,027ммоль) і триетиламін (0,040мл, 0,108ммоль) і суміші дають нагрітися до кімнатної температури. Через 16 годин суміш концентрують. N-{(3R,6S)-6-(2,3-Дифторфеніл)-1-[2(метилсульфоніл)етил]-2-оксоазепан-3-іл}-4-(2оксо-2,3-дигідро-1H-імідазо[4,5-b]піридин-1іл)піперидин-1-карбоксамід Триетиламін (0,010мл, 0,023ммоль) додають до розчину (3R,6S)-3-аміно-6-(2,3-дифторфеніл)-1[2-(метилсульфоніл)етил]азепан-2-ону (8мг, 0,023ммоль) і 4-нітрофенілхлорформіату (4,6мг, 0,023ммоль) у тетрагідрофурані (0,700мл) при 0°C. Через 15хв. додають 2-оксо-1-піперидиній-4-іл-2,3дигідро-1Н-імідазо[4,5-b]піридин-4-ійдихлорид (6,7мг, 0,023ммоль) і триетиламін (0,040мл, 0,092ммоль) і суміші дають нагрітися до кімнатної температури. Через 16 годин суміш концентрують. Очищення ВЕРХ з оберненою фазою (C-18, 95% вода/ацетонітрил ® 5% вода/ацетонітрил з 0,1% трифтороцтової кислоти), дає вказану у заголовку сполуку. MC 591 (М+1). N-[(3R,6S)-6-(2,3-Дифторфеніл)-1-(2метоксіетил)-2-оксоазепан-3-іл]-4-(2-оксо-2,3дигідро-1H-імідазо[4,5-b]піридин-1-іл)піперидин-1карбоксамід Триетиламін (0,030мл, 0,218ммоль) додають до розчину (3R,6S)-3-аміно-6-(2,3-дифторфеніл)-1(2-метоксіетил)азепан-2-ону (65мг, 0,218ммоль) і 4-нітрофенілхлорформіату (44мг, 0,218ммоль) у тетрагідрофурані (3мл) при 0°C. Через 30хв. додають 2-оксо-1-піперидиній-4-іл-2,3-дигідро-1Німідазо[4,5-b]піридин-4-ійдихлорид (70мг, 0,240ммоль), триетиламін (0,120мл, 0,872ммоль) і дихлорметан (5мл) і суміші дають нагрітися до кімнатної температури. Через 4,5 години суміш концентрують. Очищення хроматографією на силікагелі [100% дихлорметан ® 95% дихлорметан/метанол (10% гідроксид амонію/метанол)] дає вказану у заголовку сполуку (88мг). Вказану у заголовку сполуку перетворюють в НСІ-сіль за допомогою 2М розчину HCl в ефірі. 47 могою 2М розчину HCl в ефірі. MC 543,3 (М+1). 1НЯМР (500МГц, CD3OD) d 8,09 (дд, J=7,8 Гц, 1,0 Гц, 1H), 7,99 (дд, J=6,1 Гц, 1,0 Гц, 1H), 7,36 (м, 1H), 7,17-7,10 (м, 3H), 4,78 (д, J=11,0 Гц, 1H), 4,61-4,54 (м, 1H), 4,31-4,24 (м, 2H), 4,18-4,13 (м, 1H), 3,943,89 (м, 1H), 3,57-3,53 (м, 2H), 3,48-3,43 (м, 1H), 3,39 (д, J=15,1 Гц, 1H), 3,34 (с, 3H), 3,19-3,15 (м, 1H), 3,07-2,96 (м, 2H), 2,49-2,41 (м, 1H), 2,35-2,26 (м, 1H), 2,19-2,06 (м, 3H), 1,90-1,76 (м, 3H). N-[(3R,6S)-6-(2,3-Дифторфеніл)-2-оксо-1(2,2,2-трифторетил)азепан-3-іл1-4-(2-оксо-2,3дигідро-1H-імідазо[4,5-b]піридин-1-іл)піперидин-1карбоксамід Триетиламін (0,038мл, 0,276ммоль) додають до розчину (3R,6S)-3-аміно-6-(2,3-дифторфеніл)-1(2,2,2-трифторетил)азепан-2-ону (89мг, 0,276ммоль) і 4-нітрофенілхлорформіату (56мг, 0,276ммоль) у тетрагідрофурані (3мл) при 0°C. Через 30хв. додають 2-оксо-1-піперидиній-4-іл-2,3дигідро-1Н-імідазо[4,5-b]піридин-4-ійдихлорид (88мг, 0,304ммоль), триетиламін (0,152мл, 1,104ммоль) і дихлорметан (5мл) і суміші дають нагрітися до кімнатної температури. Через 48 годин суміш концентрують. Очищення хроматографією на силікагелі [100% дихлорметан ® 95% дихлорметан/метанол (10% гідроксид амонію/метанол)] дає вказану у заголовку сполуку (98мг). Вказану у заголовку сполуку перетворюють в НСІ-сіль за допомогою 2М розчину HCl в ефірі. MC 567,2 (М+1). 1H-ЯMP (500МГц, CD3OD) d 8,11 (дд, J=7,8 Гц, 1,0 Гц, 1H), 8,00 (дд, J=5,9 Гц, 1,0 Гц, 1H), 7,34-7,31 (м, 1H), 7,19-7,13 (м, 3H), 4,86-4,83 (м, 1H), 4,62-4,57 (м, 1H), 4,49-4,41 (м, 1H), 4,334,25 (м, 3H), 4,12-4,04 (м, 1H), 3,51-3,46 (м, 1H), 3,18-3,14 (м, 1H), 3,09-2,96 (м, 2H), 2,51-2,44 (м, 1H), 2,33-2,25 (м, 1H), 2,22-2,10 (м, 3H), 1,90-1,81 (м, 3H). N-[(3R,6S)-6-(2,3-Дифторфеніл)-2-оксо-1(піридин-2-ілметил)азепан-3-іл]-4-(2-оксо-2,3дигідро-1Н-імідазо[4,5-b]піридин-1-іл)піперидин-1карбоксамід Триетиламін (0,065мл, 0,468ммоль) додають до розчину (3R,6S)-3-aмінo-6-(2,3-дифторфеніл)-1(піридин-2-ілметил)азепан-2-ону (180мг, 0,417ммоль) і 4-нітрофенілхлорформіату (94мг, 0,468ммоль) у тетрагідрофурані (3мл) при 0°C. Через 1 годину додають 2-оксо-1-піперидиній-4-іл 82877 48 2,3-дигідро-1Н-імідазо[4,5-b]піридин-4-ійдихлорид (136мг, 0,468ммоль) і триетиламін (0,195мл, 1,404ммоль) і суміші дають нагрітися до кімнатної температури. Через 18 годин суміш розподіляють між етилацетатом і водою. Органічний шар промивають водою (2х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [100% дихлорметан ® 95% дихлорметан/метанол (10% гідроксид амонію/метанол)] дає вказану у заголовку сполуку (240мг). Вказану у заголовку сполуку перетворюють в НСІ-сіль за допомогою 2М розчину HCl в ефірі. MC 576,3 (М+1). 1H-ЯMP (500МГц, CD3OD) d 8,78 (д, J=5,9 Гц, 1H), 8,62-8,59 (м, 1H), 8,07 (д, J=8,3 Гц, 1H), 8,03-7,98 (м, 3H), 7,32 (дд, J=8,1 Гц, 6,1 Гц, 1H), 7,18-7,15 (м, 3H), 5,43 (д, J=16,9 Гц, 1H), 4,75 (д, J=17,1 Гц, 1H), 4,564,51 (м, 1H), 4,36-4,28 (м, 3H), 3,51 (д, J=15,1 Гц, 1H), 3,48 (с, 1H), 3,22-3,17 (м, 1H), 3,05-2,98 (м, 2H), 2,44-2,40 (м, 1H), 2,34-2,23 (м, 2H), 2,18-2,14 (м, 2H), 1,97-1,92 (м, 1H), 1,89-1,88 (м, 2H). N-[(3R,6S)-6-(2,3-Дифторфеніл)-2-оксо-1піридин-4-ілазепан-3-іл]-4-(2-оксо-2,3-дигідро-1Німідазо[4,5-b]піридин-1-іл)піперидин-1-карбоксамід Триетиламін (0,018мл, 0,132ммоль) додають до розчину (3R,6S)-3-aміно-6-(2,3-дифторфеніл)-1піридин-4-ілазепан-2-ону (42мг, 0,132ммоль) і Aнітрофенілхлорформіату (27мг, 0,132ммоль) у тетрагідрофурані (2мл) при 0°C. Через 1 годину додають 2-оксо-1-піперидиній-4-іл-2,3-дигідро-1Німідазо[4,5-b]піридин-4-ійдихлорид (38мг, 0,132ммоль) і триетиламін (0,054мл, 0,396ммоль) і суміші дають нагрітися до кімнатної температури. Через 18 годин суміш розподіляють між етилацетатом і водою. Органічний шар промивають водою (2х), насиченим розчином солі, сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі [100% дихлорметан ® 95% дихлорметан/метанол (10% гідроксид амонію/метанол)] дає вказану у заголовку сполуку (53мг). Вказану у заголовку сполуку перетворюють в НСІ-сіль за допомогою 2М розчину HCl в ефірі. MC 562,2 (М+1). 1H-ЯMP (500МГц, CD3OD) d 8,76 (д, J=7,6 Гц, 2Н), 8,11 (д, J=7,3 Гц, 2Н), 8,00 (д, J=6,4 Гц, 2Н), 7,30 (т, J=7,0 Гц, 1H), 7,27-7,21 (м, 3H), 5,11 (д, J=11,5 Гц, 1H), 4,72-4,65 (м, 1H), 4,604,55 (м, 1H), 4,35-4,33 (м, 2H), 4,14 (д, J=16,1 Гц, 1H), 3,42-3,39 (м, 1H), 3,09-3,02 (м, 2H), 2,47-2,44 (м, 1H), 2,37-2,30 (м, 2H), 2,24-2,18 (м, 2H), 2,062,03Дотримуючись по суті методик, описаних для (м, 1H), 1,91 (шир.с, 2H). одержання сполук прикладів 34-40, одержують сполуки, приклади яких представлені у таблиці Е4. 49 Хоча даний винахід описаний і проілюстрований за допомогою деяких конкретних варіантів здійснення, фахівцеві у даній галузі буде очевидно, що можуть бути проведені різні вдосконалення, зміни, модифікації, заміщення, деталізації або додавання методик і протоколів 82877 50 без відступу від суті і об'єму винаходу. Наприклад, ефективні дози, відмінні від конкретних встановлених доз, можуть бути застосовні внаслідок різної чутливості ссавців, які піддаються лікуванню у випадку будь-яких симптомів за 51 допомогою описаних 82877 вище Комп’ютерна верстка Л. Купенко сполук даного 52 винаходу. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCgrp receptor antagonists
Автори англійськоюBurgey Christopher S., Deng Zhengwu J., Nguyen Diem N., Paone Daniel V., Shaw Anthony W., Williams Theresa M.
Назва патенту російськоюАнтагонисты рецептора cgrp
Автори російськоюБерги Кристофер С., Ден Чжену Цз, Нгуйен Дим Н., Пеуан Дениэл В., Шо Энтони У., Уилльямс Тереза М.
МПК / Мітки
МПК: A61K 31/4188, C07D 471/04, C07D 471/00, A61P 25/06
Мітки: антагоністи, рецептора
Код посилання
<a href="https://ua.patents.su/26-82877-antagonisti-receptora-cgrp.html" target="_blank" rel="follow" title="База патентів України">Антагоністи рецептора cgrp</a>
Попередній патент: Гідроксамати, фармацевтична композиція та спосіб лікування раку (варіанти)
Наступний патент: Пристрій для лікування ротової порожнини, що включає тонкий, гнучкий бар’єрний шар і лікувальну або адгезивну композицію внутрішнього каркаса
Випадковий патент: Спосіб одержання 1,3,5-трифенілпіразолону-2