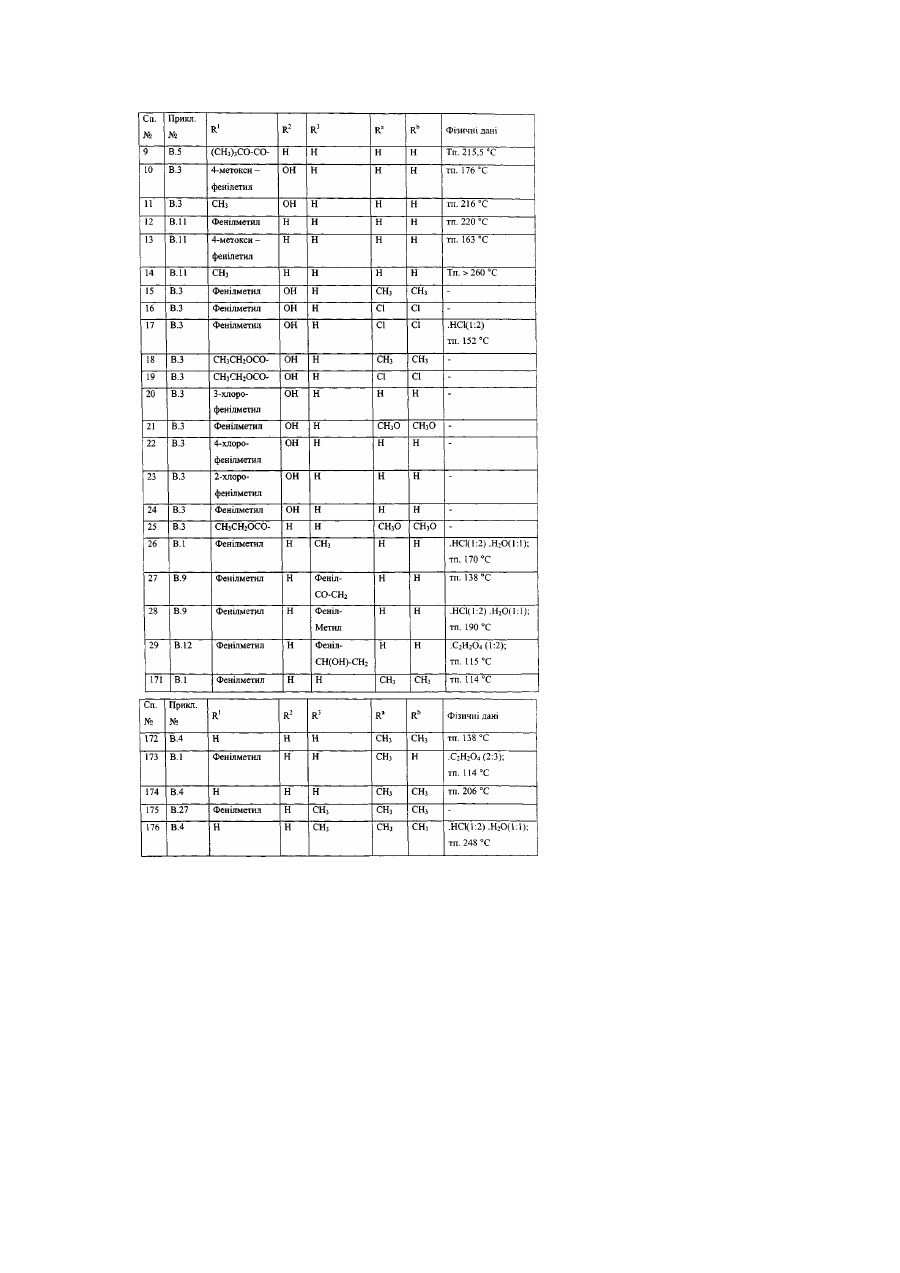
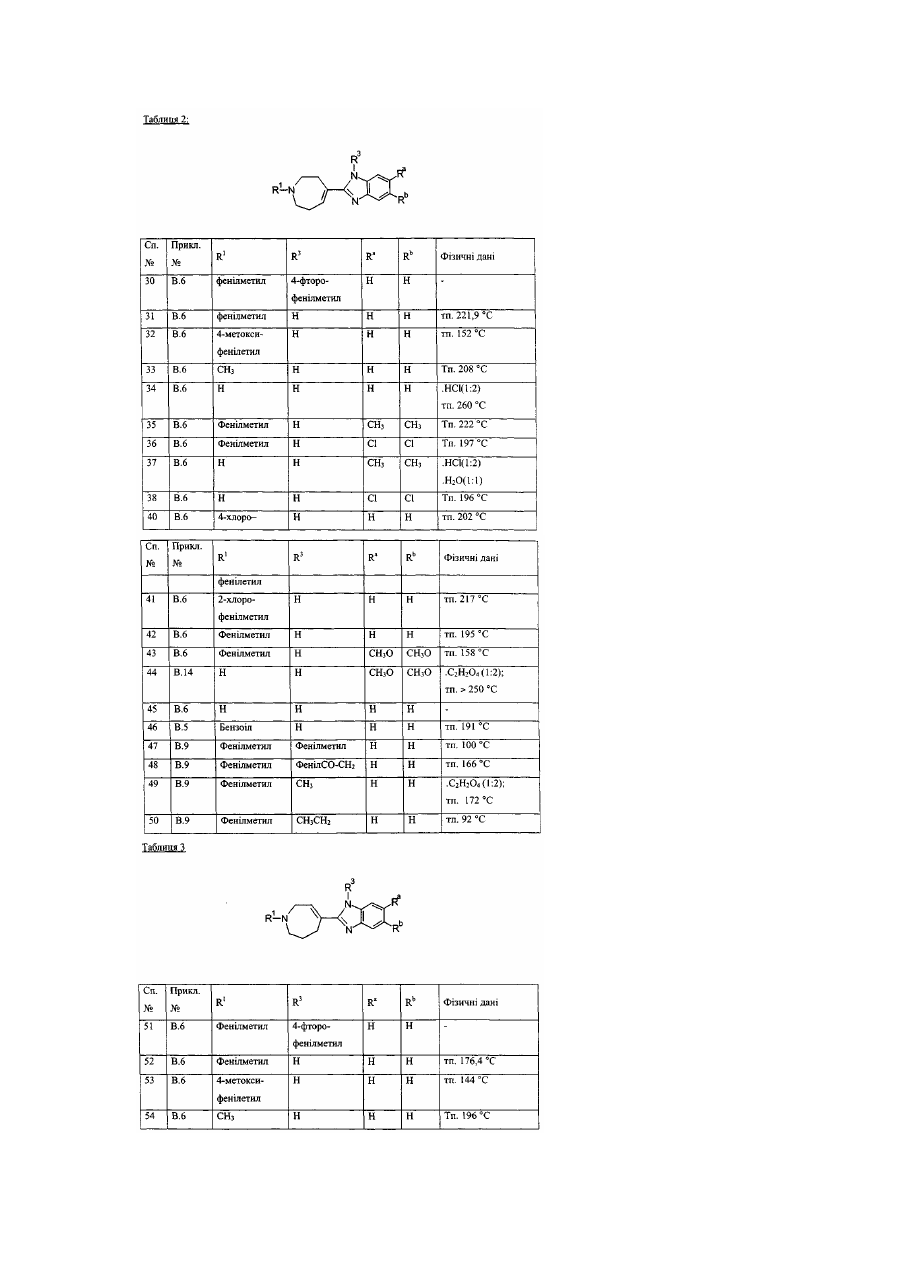
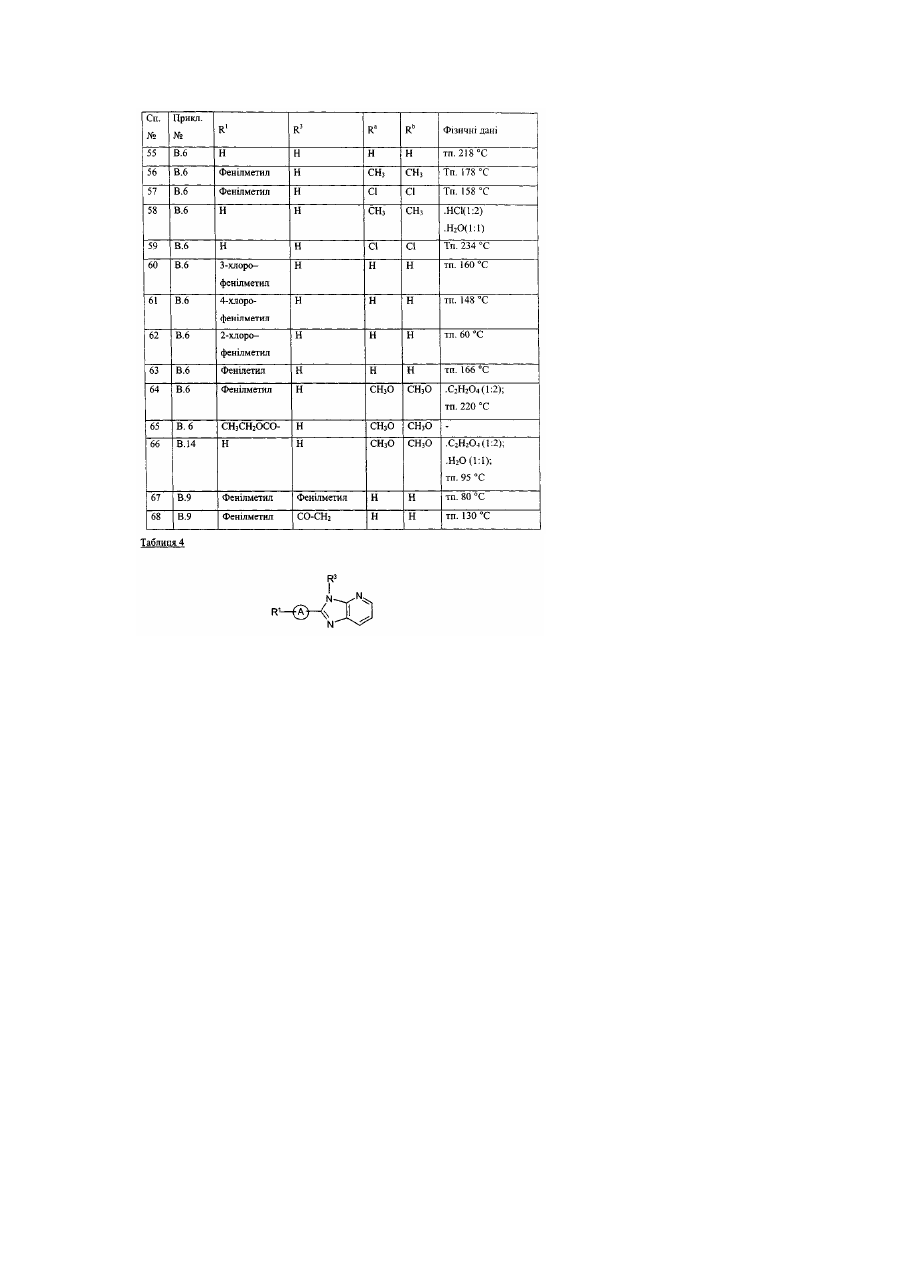
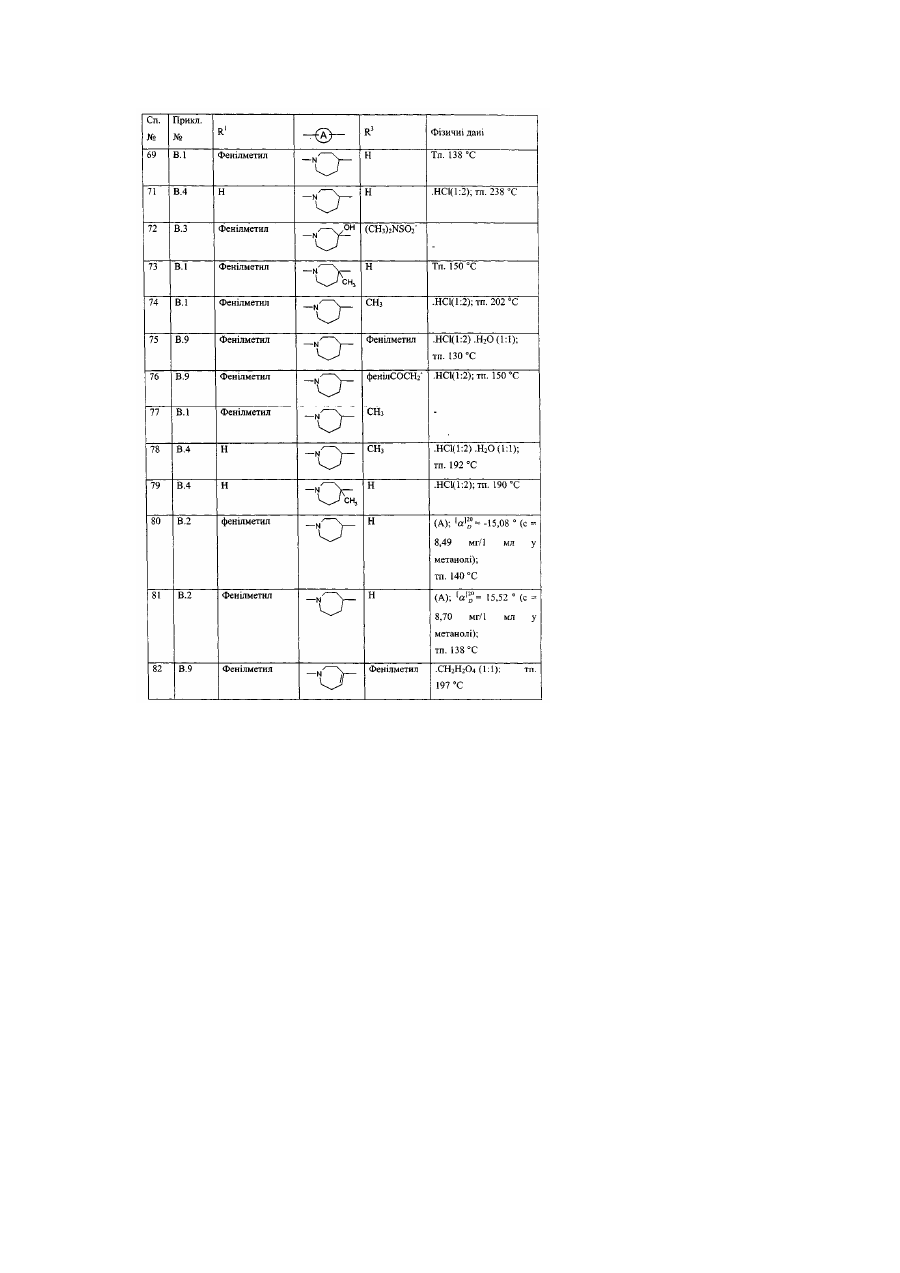
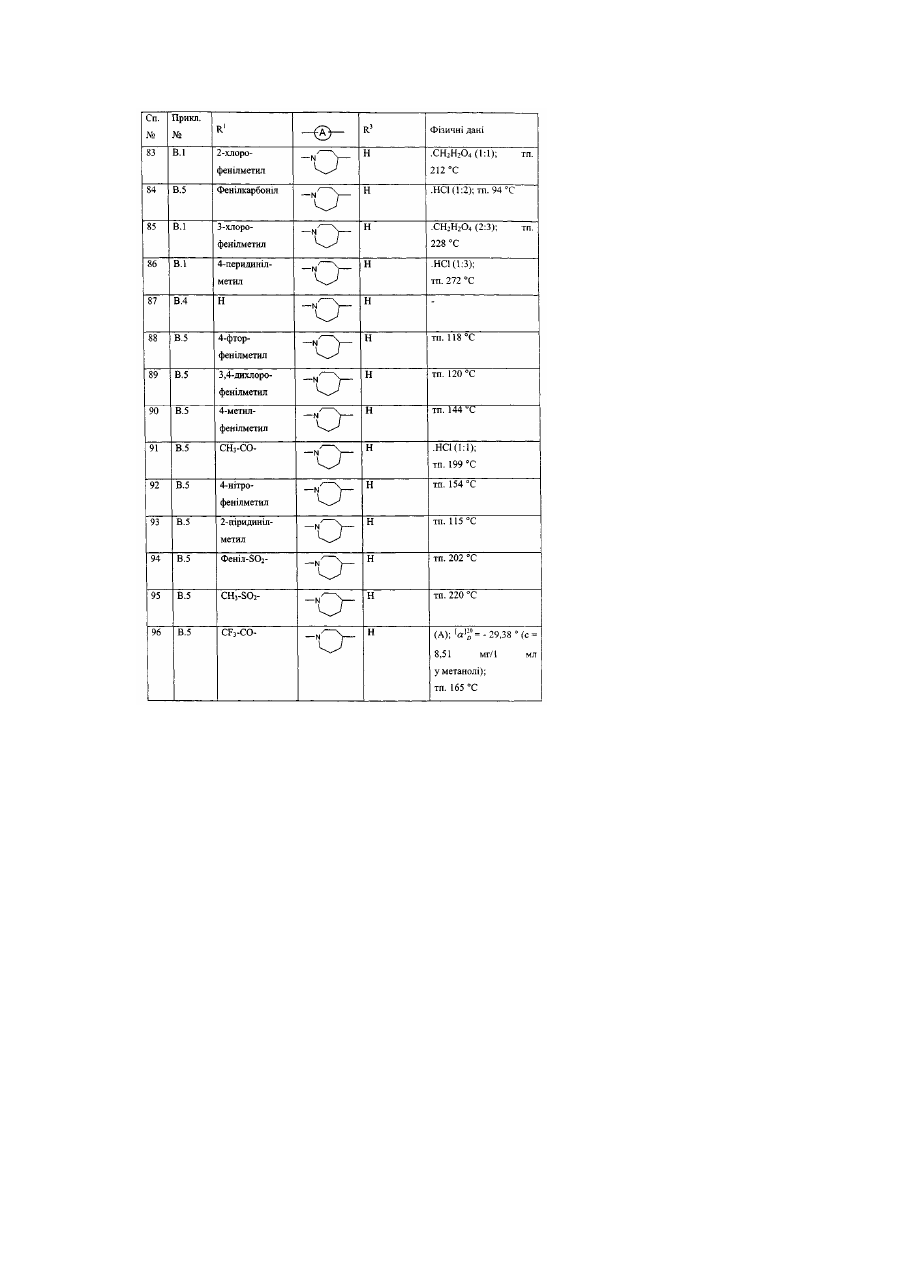
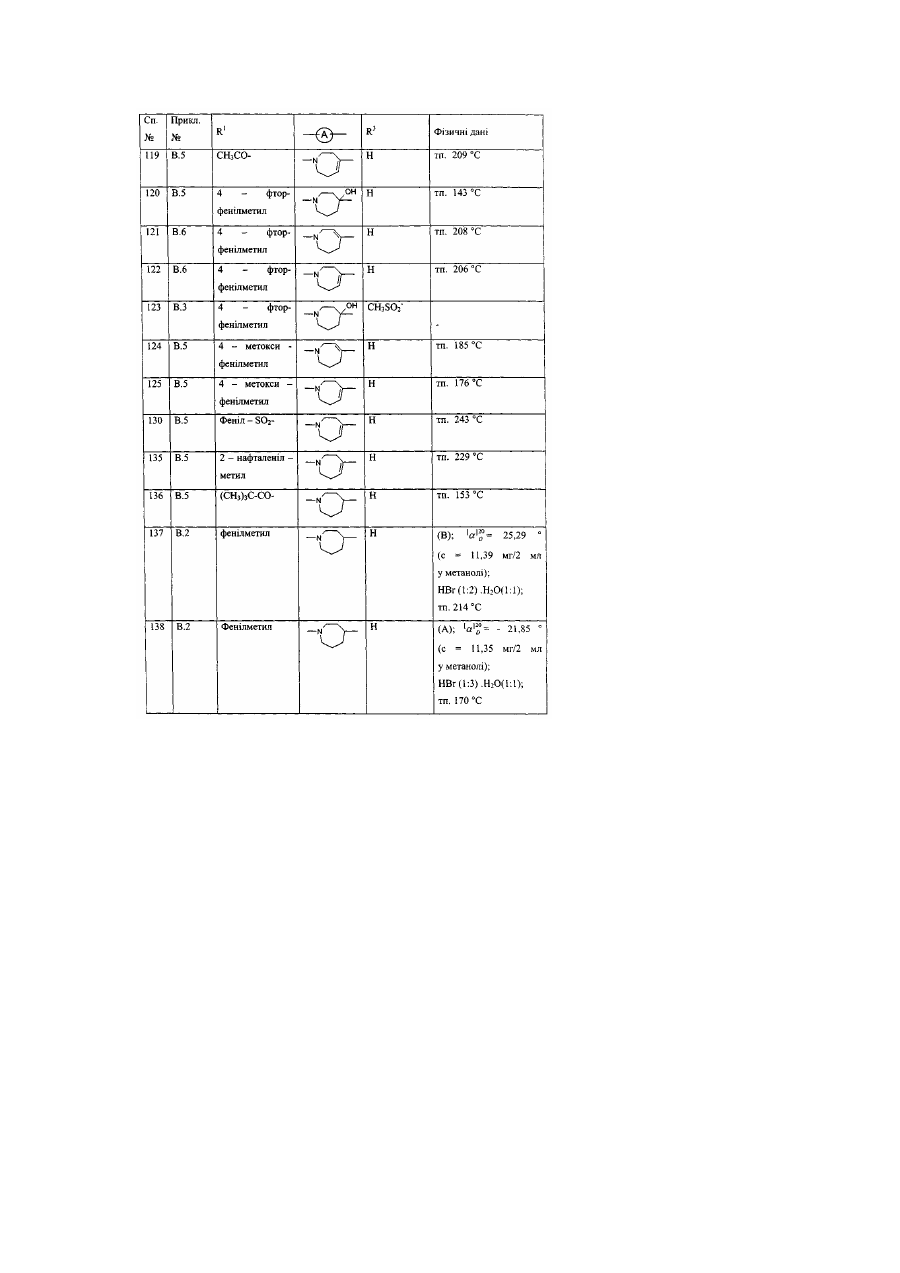
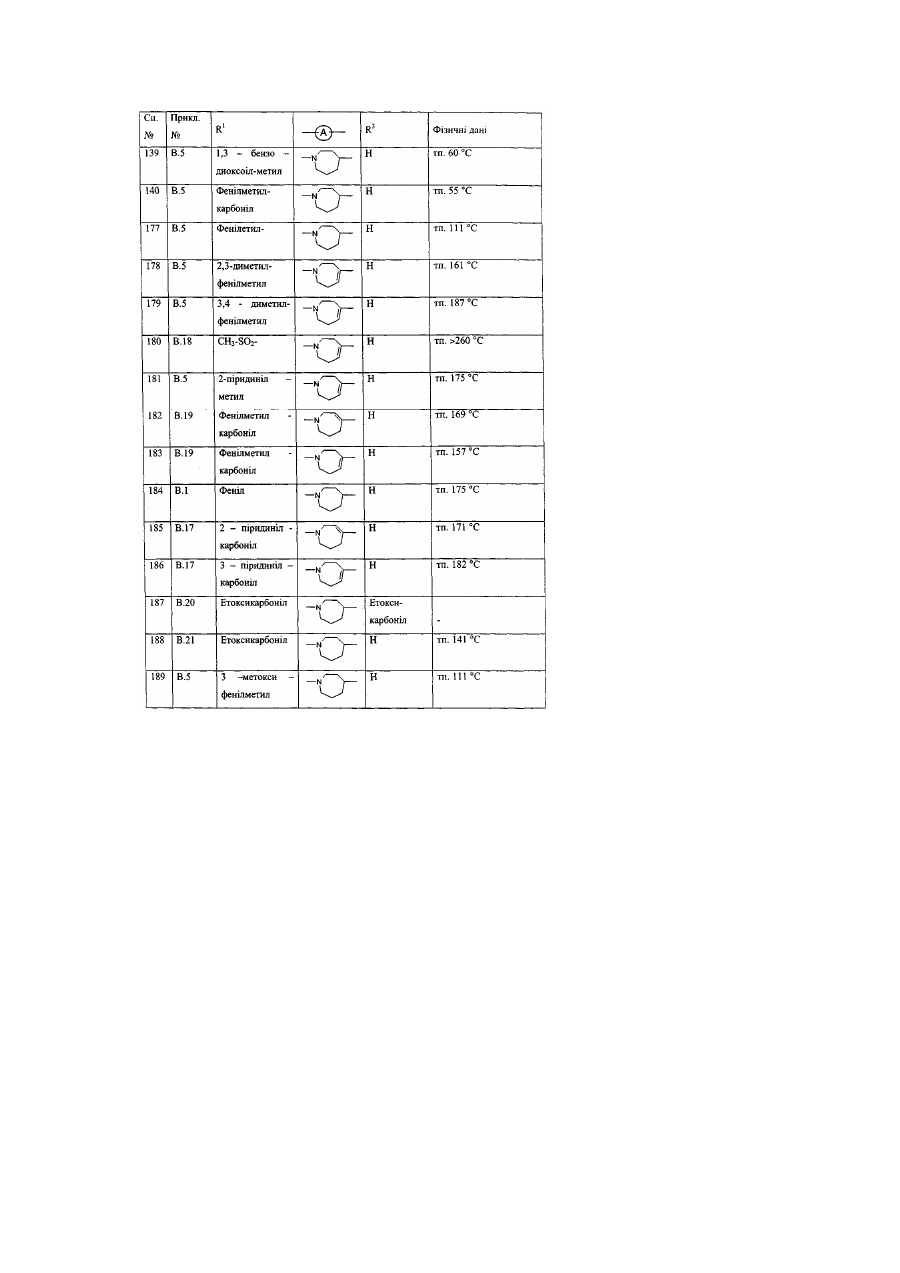
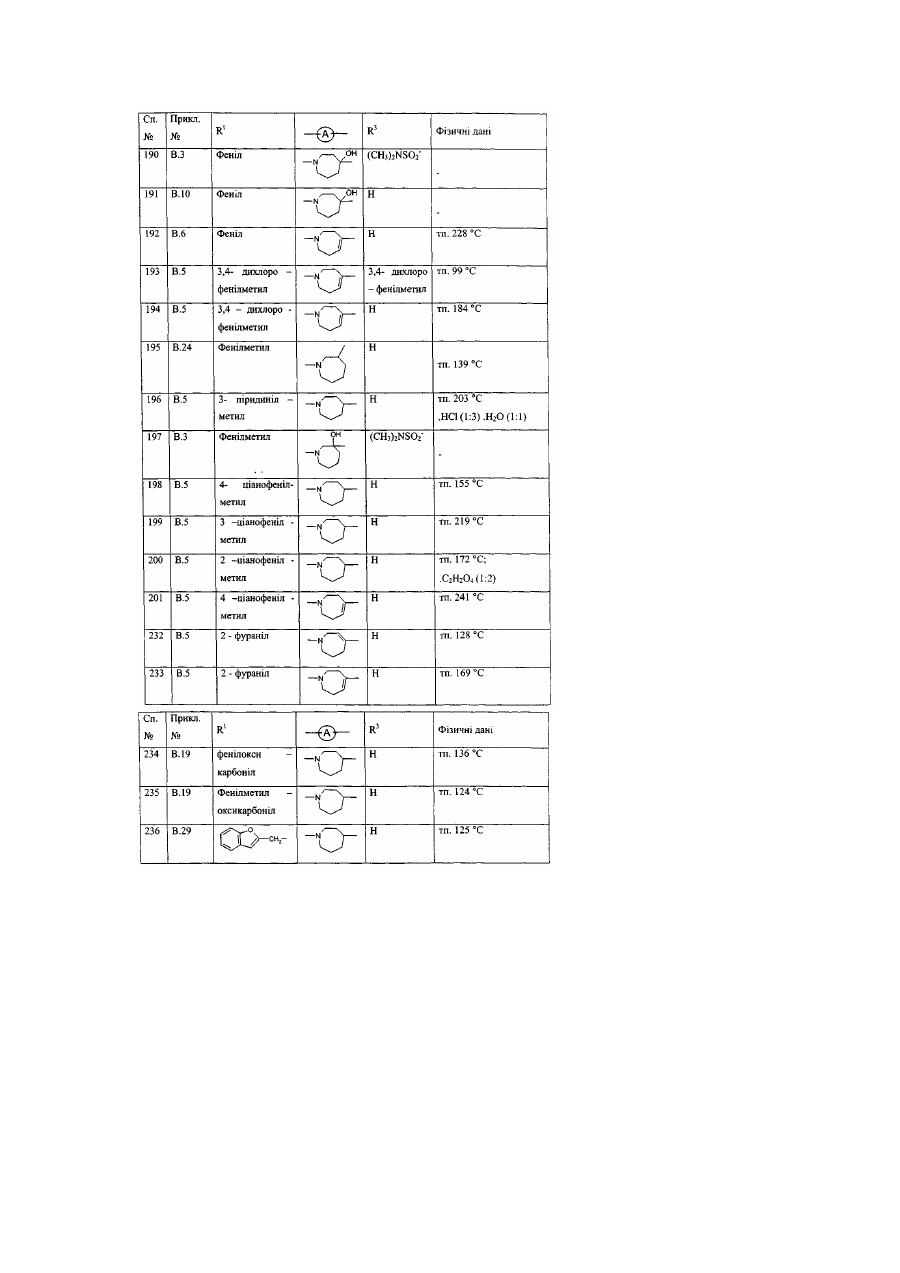
Заміщені гомопіперидинілом похідні бензімідазолу як релаксанти дна шлунка, спосіб їх отримання (варіанти)
Номер патенту: 73963
Опубліковано: 17.10.2005
Автори: Соммен Франсуа Марія, Гюіллемонт Джером Еміль Джордж, Янссенс Франс Едуард
Формула / Реферат
1. Заміщені гомопіперидинілом похідні бензімідазолу формули (I)
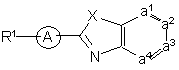 , (I)
, (I)
їх проліки, N-оксиди, адитивні солі, четвертинні аміни та стереохімічно ізомерні форми, де
![]() є
є
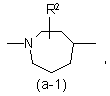
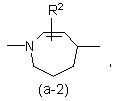
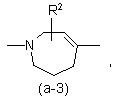
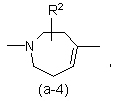
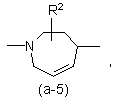
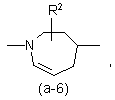
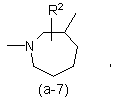
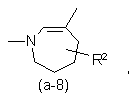
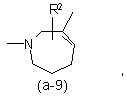
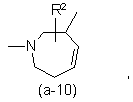
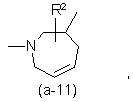
або 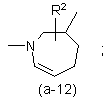
де R2 є воднем, гідрокси, C1-4алкілом або C1-4алкілокси, та коли R2 є
гідрокси або C1-4алкілокси, тоді згаданий R2 приєднаний у іншому положенні, ніж a-положення атома азоту в гетероциклі, або коли R2 є гідрокси, тоді згаданий R2 приєднаний у іншому положеннях ніж вінілове положення радикала (a-2), (a-3), (a-4), (a-5), (a-6), (a-8), (a-9), (a-10), (a-11) або (a-12);
-a'=a2-a3=a4- є бівалентним радикалом формули
-CH=CH-CH=CH-
-N=CH-CH=CH-
-CH=N-CH=CH-
-CH=CH-N=CH-
-CH=CH-CH=N-
-CH=CH-N=N-
(b-1),
(b-2),
(b-3),
(b-4),
(b-5),
(b-6),
-N=CH-CH=N-
-N=CH-N=CH-
-N=N-CH=CH-
-CH=N-CH=N-
-CH=N-N=CH-
(b-7),
(b-8),
(b-9),
(b-10) або
(b-11),
де кожний атом водню у радикалах з (b-1) до (b-11) може необов’язково бути заміщений гало, C1-6алкілом, нітро, аміно, гідрокси, C1-6алкілокси, полігалоC1-6алкілом, карбоксилом, аміноC1-6алкілом, гідроксіC1-6алкілом, моно- або ді(C1-4алкіл)аміноC1-6алкілом, C1-6алкілоксикарбонілом;
або де два атоми водню, розташовані на суміжних атомах вуглецю в радикалах з (b-1) до (b-11), можуть необов’язково бути заміщені -(CH2)4-;
R1 є воднем, C1-6алкілом, арилом1, C1-6алкілом, заміщеним арилом1,
C1-4алкіл1оксикарбонілом, арил1карбонілом, арил1C1-6алкілкарбонілом, арил1карбонілC1-6алкілом, арил1оксикарбонілом, арил1C1-4алкілоксикарбонілом, C1-4алкілкарбонілом, трифторметилом, трифторметилкарбонілом, C1-6алкілсульфонілом, арил1сульфонілом, метансульфонілом, бензолсульфонілом, трифторометансульфонілом або диметилсульфамоїлом;
X є O, S або NR3, де R3 є воднем; C1-6алкілом; метансульфонілом; бензолсульфонілом; трифторометансульфонілом; диметилсульфамоїлом; арил2карбонілC1-4алкілом; C1-4алкілоксикарбонілом; C1-4алкілом, заміщеним арилом2, та необов’язково гідрокси або C1-4алкілкарбонілC1-4алкілом, заміщеним арилом2;
арил1 є фенілом; фенілом, заміщеним 1, 2 або 3 замісниками, кожний незалежно вибрано з гало, гідрокси, C1-6алкілу, C1-6алкілокси, нітро, аміно, ціано, та трифторметилом; піридинілом; піридинілом, заміщеним 1, 2 або 3 замісниками, кожний незалежно вибрано з гало, гідрокси, C1-6алкілу, аміно та діC1-4алкіламіно; нафтилу; хінолінілу; 1, 3-бензодіоксолілу; фуранілу; тієнілу; або бензофуранілу; та
арил2 є фенілом або фенілом, заміщеним 1, 2 або 3 замісниками, кожний незалежно вибрано з гало, гідрокси, C1-6алкілу, C1-6алкілокси, нітро, аміно, ціано та трифторметилу.
2. Сполука за п.1, яка відрізняється тим, що бівалентний радикал ![]() є радикалом формули (a-1), (a-3) або (a-4), де R2 є воднем або гідрокси.
є радикалом формули (a-1), (a-3) або (a-4), де R2 є воднем або гідрокси.
3. Сполука за п. 1, яка відрізняється тим, що бівалентний радикал –a1=a2-a3=a4- має формулу (b-1), де кожний атом водню у згаданих радикалах (b-1) необов’язково може бути заміщений гало, C1-6алкілом, гідрокси або C1-6алкілокси.
4. Сполука за п.1, яка відрізняється тим, що бівалентний радикал –a1=a2-a3=a4- має формулу (b-2), де кожний атом водню у згаданих радикалах (b-2) необов’язково може бути заміщений гало, C1-6алкілом, гідрокси або C1-6алкілокси.
5. Сполука за будь-яким з пунктів 1-4, яка відрізняється тим, що R1 є воднем, C1-6алкілом, фенілметилом або фуранілметилом.
6. Сполука за будь-яким з пунктів 1-5, яка відрізняється тим, що X є NR3, де R3 є воднем, диметилсульфамоїлом або C1-4алкілом, заміщеним арилом2.
7. Сполука за будь-яким з пунктів 1-6 для використання як лікарського засобу.
8. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та терапевтично активну кількість сполуки за будь-яким з пунктів 1 - 6.
9. Спосіб отримання фармацевтичної композиції за п. 7, який відрізняється тим, що терапевтично активну кількість сполуки за будь-яким з пунктів 1-6
ретельно перемішують з фармацевтично прийнятним носієм.
10. Спосіб отримання сполуки формули (I), який відрізняється тим, що
a) проводять реакцію між проміжною сполукою формули (II) або її функціональною похідною та проміжною сполукою формули (III) у присутності поліфосфорної кислоти (ПФК) або оксихлориду фосфору (POCl3), при температурі у межах від кімнатної температури до температури флегми реакційної суміші, необов’язково згадану реакцію проводять у реакційно-інертному розчиннику
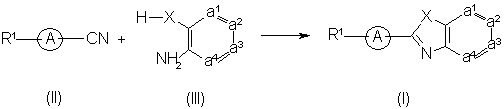 , або
, або
b) сполуки формули (І) перетворюють одну в іншу, використовуючи відомі з рівня техніки перетворення; або, якщо бажано, сполуку формули (І) перетворюють в кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (І) перетворюють у форму вільної основи обробкою лугом; та, якщо бажано, отримують її стереохімічно ізомерні форми.
11. Спосіб отримання сполуки формули (I), який відрізняється тим, що
а) проводять реакцію між проміжною сполукою формули (IV), яка визначається як похідна проміжної сполуки формули ![]() , де два гемінальні атоми водню заміщені карбонільною групою, та проміжною сполукою формули (V), таким чином отримують сполуки формули (I-a), які визначаються як сполуки формули (I), де R2 є гідрокси,
, де два гемінальні атоми водню заміщені карбонільною групою, та проміжною сполукою формули (V), таким чином отримують сполуки формули (I-a), які визначаються як сполуки формули (I), де R2 є гідрокси,
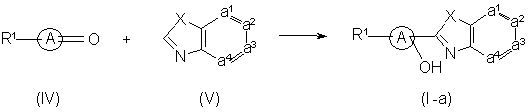 , або
, або
b) сполуки формули (І) перетворюють одну в іншу, використовуючи відомі з рівня техніки перетворення; або, якщо бажано, сполуку формули (І) перетворюють в кислотно-адитивну сіль, або навпаки, кислотно-адитивну сіль сполуки формули (І) перетворюють у форму вільної основи обробкою лугом; та, якщо бажано, отримують її стереохімічно ізомерні форми.
Текст
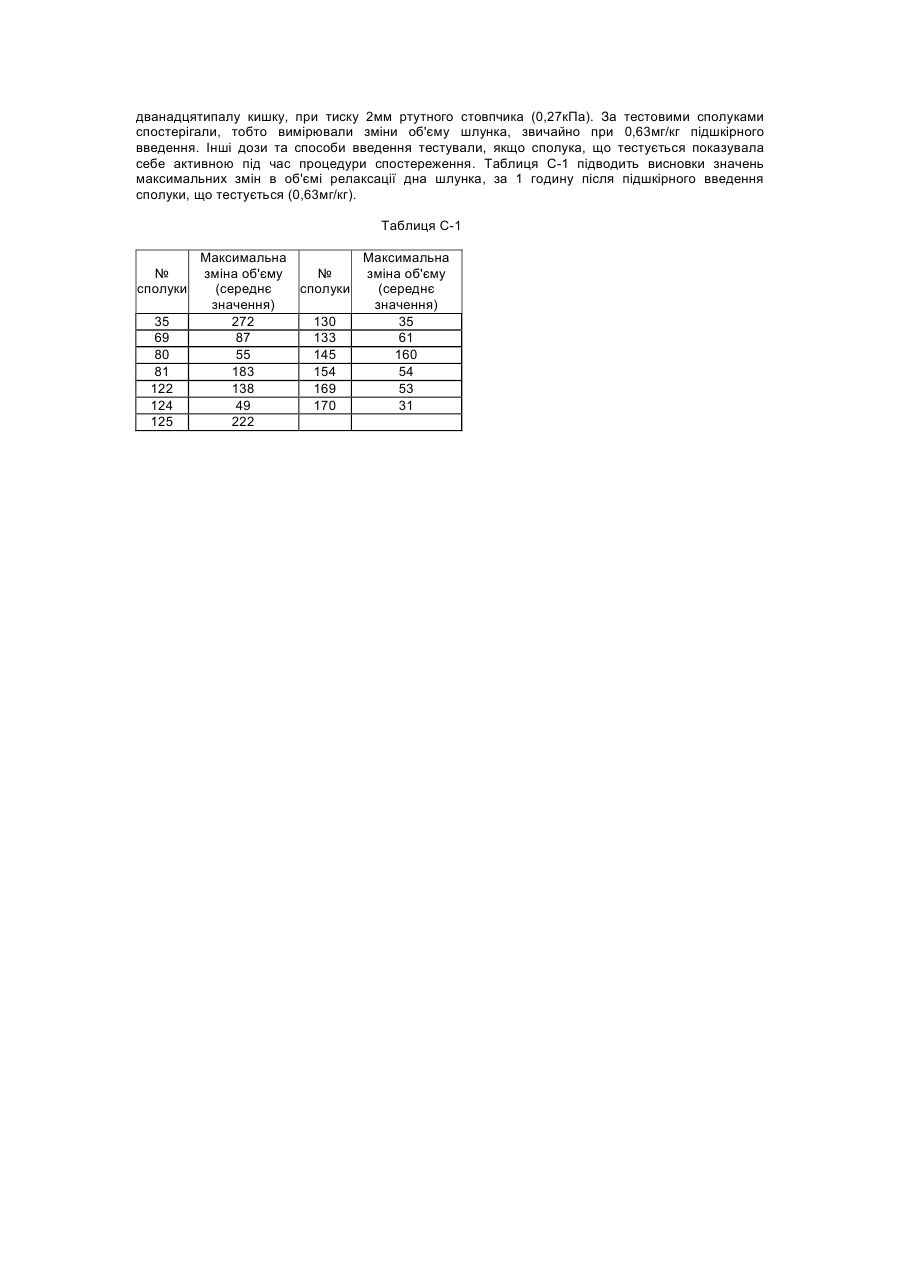
Даний винахід стосується нових сполук формули (І), які мають активність релаксації дна шлунка. Надалі даний винахід стосується способів отримання таких сполук, фармацевтичних композицій, які містять вищевказані сполуки, а також використання вищевказаних сполук як медикаментів. ЕР-А-0, 079, 545 описує заміщені піперазинілом похідні бензимідазолу з протигістамінною активністю. Непередбачено, було знайдено, що дані нові сполуки формули (І) мають властивості релаксації дна шлунка та, таким чином, є корисними для полегшення симптомів, які є наслідком зниження розслаблення дна шлунка під час споживання їжі. Даний винахід стосується сполук формули (І) їх проліків, N-оксидів, адитивних солей, четвертинних амінів та стереохімічних ізомерних форм, де або де R2 є воднем, гідрокси, С1-4алкілом, або С1-4алкілокси та коли R2 є гідрокси або С1алкілокси, тоді згаданий R2 приєднаний в іншому положенні, ніж a-положення атому азоту в 4 гетероциклі, або коли R2 є гідрокси, тоді згаданий R2 приєднаний в іншому положенні, ніж вінілове положення радикала (а-2), (а-3), (а-4), (а-5), (а-6), (а-8), (а-9), (а-10), (а-11), або (а-12); -а1=а2=а3=а4- є бівалентним радикалом формули де кожний атом водню у радикалах із (b-1) до (b-11) може необов'язково бути заміщений гало, С1-6алкілом, нітро, аміно, гідрокси, С1-6алкілокси, полігалоС1-6алкілом, карбоксилом, аміноС16алкілом, гідроксиС1-6алкілом, моно- або ди(С1-6алкіл)аміноС1-6алкілом, С1-6алкілоксикарбонілом; або, де два атоми водню, що розташовані на суміжних атомах вуглецю в радикалах з (b-1) по (b-11), можуть необов'язково бути заміщені -(СН2)4-; R1 є воднем, С1-6алкілом, арилом1, С11 6алкілом заміщеним арилом , С1-4алкілоксикарбонілом, арил1карбонілом, арил1С1-6алкілкарбонілом, арил1карбонілС1арил1оксикарбонілом, арил1С1-4алкілоксикарбонілом, С1-4алкілкарбонілом, 6алкілом, трифторметилом, трифторметилкарбонілом, С1-6алкілсульфонілом, арил1сульфонілом, метансульфонілом, бензолсульфонілом, трифторометансульфонілом, або диметилсульфамоїлом; X є О, S або NR3, де R3 є воднем; С1-6алкілом; метансульфонілом; бензолсульфонілом; трифторометансульфонілом; диметилсульфамоїлом; арил2карбонілС1-4алкілом; С1лкілоксикарбонілом ; С1-4алкілом заміщеним арилом2 та необов'язково гідрокси; або С14 2 4алкілкарбонілС1-4алкілом заміщеним арилом ; 1 арил є фенілом; фенілом заміщеним 1, 2 або 3 замісниками кожний незалежно обрано з гало, гідрокси, С1-6алкілу, С1-6алкілокси, нітро, аміно, ціано, та трифторметилу; піридинілом ; піридинілом заміщеним 1, 2 або 3 замісниками кожний незалежно обрано з гало, гідрокси, С1аміно, та диС1-4алкіламіно; нафтилу; хінолінілу; 1, 3-бензодиоксолілу; фуранілу; тіенілу; або бензофуранілу; та арил2 є фенілом, або фенілом заміщеним 1, 2 або 3 замісниками кожний незалежно обрано з гало, гідрокси С1-6алкілу, С1-6алкілокси, нітро, аміно, ціано, та трифторметилу. В усіх сполуках формули (1) замісник R1 приєднаний до атому азоту у гетеро циклі 6алкілу, бівалентним радикалом. Термін "проліки" у тому значенні, що використовується у даному тексті, позначає такі фармакологічно прийнятні похідні як, наприклад, складні ефіри та аміди, для яких кінцевий продукт біотрансформації похідної буде активним лікарським засобом, що підпадає під визначення сполуки формули (І). Загальний опис проліків включено сюди з посиланням на Goodman та Gilman [The Pharmacological Basis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, «Biotransformation of Drugs», p.13-15]. Термін "гало", який використовується у попередніх визначеннях, є родовим позначенням для фтору, хлору, брому та йоду; С1-4алкіл позначає прямий та розгалужений ланцюг насичених вуглеводневих радикалів, які мають від 1 до 4 атомів вуглецю, такі як, наприклад, метил, етил, пропіл, бутил, 1-метилетил, 2-метилпропіл та їм подібні; C1-6-алкіл, як передбачається, включає С1-4алкіл та його вищі гомологи, які мають 5 або 6 атомів вуглецю, такі як, наприклад, 2метилбутил, пентил, гексил та їм подібні; та полігалоС1-6алкіл позначає полігалозаміщений С16алкіл, який має від одного до шести атомів галогену таких, як, наприклад, дифтор- або трифторметил. ГідроксиС1-6алкіл відноситься до С1-6алкілу, заміщеного гідроксильною групою. АміноС1-6алкіл відноситься до С1-6алкілу, заміщеного аміно групою. Термін "сульфоніл" означає SO2- групу, та "диметилсульфамоіл" означає (CH3)2N-SO2-групу. Для терапевтичного використання солі сполуки формули (І) є такими, де протиіон є фармацевтично прийнятним. Проте солі кислот та основ, що є фармацевтично неприйнятними, можуть, також, знаходити застосування, наприклад, при приготуванні або очищенні фармацевтично прийнятної сполуки. Усі солі, як фармацевтично прийнятні, так і фармацевтично неприйнятні, включені в межі даного винаходу. Передбачається, що до складу фармацевтично прийнятних кислотно-адитивних солей входять форми активних нетоксичних кислотно-адитивних солей, які можуть утворювати сполуки формули (І). Фармацевтично прийнятні кислотно-адитивні солі можна легко отримати за допомогою обробки основи відповідними кислотами. Відповідні кислоти включають, наприклад, неорганічні кислоти такі, як галоводневі кислоти, наприклад, хлористоводнева або бромистоводнева; сірчана, азотна, фосфорна та їм подібні кислоти; або органічні кислоти, наприклад, оцтова, пропанова, гідроксиоцтова, молочна, піровиноградна, щавелева (тобто, етандіонова), малонова, сукцинова (тобто, бутандіонова кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, п-толуолсульфонова кислота, цикламінова, саліцилова, n-аміносаліцилова, памова та інші їм подібні кислоти. І навпаки, вказані форми солі можуть бути перетвореними у вільну форму основи, шляхом обробки відповідною основою. Термін "адитивна сіль", який використовується вище, також включає сольвати, які здатні утворювати сполуки формули (І), а також їх солі. Такими сольватами є, наприклад, гідрати, алкоголяти та інші їм подібні. Четвертинні аміни сполуки формули (І), які використовуються тут, означають, що сполуки формули (І) можна утворювати за допомогою реакції між азотистою основою сполуки формули (І) та відповідним четвертинним агентом таким як, наприклад, необов'язково заміщений С16алкілгалід, фенілметилгалід, наприклад, метилйодид або бензилйодид. Інші реагенти з групами, які легко відщеплюються, також можуть використовуватись, наприклад такі, як алкіл трифторметансульфонати, алкіл метансульфонати та алкіл п-толуолсульфонати. Четвертинний амін має позитивно заряджений іон азоту. Фармацевтично прийнятні протиіони включають хлор, бром, йод, трифлуороацетат та ацетат. Отримати протиіон можна, наприклад, використовуючи колонки іонообмінної смоли. N-оксидні форми сполук формули (І), які можна отримати, використовуючи відомі у цій галузі способи, як передбачається, включають такі сполуки формули (І), де атом азоту окислюється до N-оксиду. Термін "стереохімічні ізомерні форми", який використовується вище, означає всі можливі стереоізомерні форми, в яких можуть існувати сполуки формули (І). Якщо іншого не було обумовлено, хімічні позначення сполук означають суміші всіх можливих стереоізомерних форм, при цьому вказані суміші складають всі діастереомери та енантіомери основних молекулярних структур. Більш того, стереогенні центри можуть мати R- або S-конфігурацію; замінники на двовалентних циклічних (частково) насичених радикалах можуть мати або цис- або трансконфігурацію. Якщо інше не було згадано або зазначено, хімічні позначення сполук означають суміші всіх можливих стереоізомерних форм, при цьому вказані суміші охоплюють всі діастеріомери та енантіомери основних молекулярних структур. Теж саме відноситься до проміжних сполук, що описуються тут, та використовуються для приготування продуктів формули (І). Терміни "цис" та "транс", які використовуються тут у відповідності з хімічною реферативною номенклатурою, та стосуються положення замісників на кільцевій складовій, більш особливо, на гомопіперидиніловому кільці у сполуках формули (І). Абсолютна стереохімічна конфігурація деяких сполук формули (І) та проміжних сполук, що використовуються при їх приготуванні, не була експериментально визначена. В цих випадках стереохімічні ізомерні форми, що були виділені першими, позначають "А" та виделені другими "В", без наступного посилання на фактичну стереохімічну конфігурацію. Проте, згадані ізомерні форми "А" та "В" можуть бути однозначно охарактеризовані, наприклад їх обертанням площини поляризації світла у випадку коли "А" та "В" мають енантіомерний зв'язок. Спеціаліст у даній галузі здатен визначити абсолютну конфігурацію подібної сполуки, використовуючи відомі у даній галузі методи, наприклад, дифракцію рентгенівських променів. Першою групою сполук є такі сполуки формули (І), де - R1 є воднем, С1-6алкілом, арилом1, С1-6алкілом заміщеним арилом1, С1-4 алкілоксикарбонілом, арил1карбонілом, арил1С1-6алкілкарбонілом, С1-4алкілкарбонілом, трифторметилом, трифторметилкарбонілом, С1-6 алкілсульфонілом, арил1сульфонілом, метансульфонілом, бензолсульфонілом, трифторометансульфонілом, або диметилсульфамоілом; R3 воднем, С1-6алкілом, метансульфонілом, бензолсульфонілом, трифторометансульфонілом, диметилсульфамоілом, С1-4алкілом заміщеним арилом2 та необов'язково гідрокси, С1-4алкілкарбонілС1-4алкілом заміщеним арилом2; та - арил1 є фенілом; фенілом заміщеним 1, 2 або 3 замісниками, кожний з яких незалежно обраний з гало, гідрокси, С1-6алкілу, С1-6алкілокси, нітро, аміно, ціано, або з трифторметилу; піридинілом; піридинілом, заміщеним 1, 2 або 3 замісниками, кожний з яких незалежно обрано з гало, гідрокси, С1-6алкілу, аміно, диС1-4алкіламіно; нафтилом; хінолінілом ; або 1, 3бензодиоксолілом. Цікавими сполуками є такі сполуки формули (І), де X є NR3, де R3 є воднем, диметилсульфамоілом, або С1-4алкілом заміщеним арилом2. Іншими цікавими сполуками є такі сполуки формули (І), де бівалентний радикал є радикалом формули (а-1), (а-3) або (а-4), де R2 є воднем або гідрокси. Особливими сполуками є такі сполуки формули (І), де бівалентний радикал –а1=а2-а3=а4- має формулу (b-1), де кожний атом водню у згаданих радикалах (b-1) може необов'язково бути заміщений гало, С1-6алкілом, гідрокси, або C1-6алкілокси. Іншими особливими сполуками є такі сполуки формули (І), де бівалентний радикал -а1=а23= 4 а а - має формулу (b-2), де кожний атом водню у згаданих радикалах (b-2) може бути необов'язково заміщеним гало, С1-6алкілом, гідрокси, або С1-6алкілокси. Ще одними особливими сполуками є такі сполуки формули (І), де бівалентний радикал -а1=а23= 4 а а - має формулу (b-4) де кожний атом водню у згаданих радикалах (b-4) може бути необов'язково заміщений гало, С1-6алкілом, гідрокси, або С1-6алкілокси. Крім того особливими сполуками є такі сполуки формули (І), де бівалентний радикал -а1=а2а3=а4- має формулу (b-5), де кожний атом водню у згаданих радикалах (Ь-5) може бути необов'язково заміщеним гало, С1-6алкілом, гідрокси, або С1-6алкілокси. Найкращими сполуками формули (І) є такі сполуки формули (І), де радикал R1 є воднем, С16алкілом, фенілметилом, або фуранілметилом. Сполуки за даним винаходом можуть бути отримані за допомогою реакції проміжної сполуки формули (II), або її функціональної похідної, такої як карбонова кислота, з проміжною сполукою формули (III) у присутності поліфосфорної кислоти (ПФК) або оксихлориду фосфору (РОСl3), при температурі реакційної суміші в межах між кімнатною температурою та температурою нагрівання із зворотнім охолодженням, при потребі згадана реакція може бути проведена у реакційноінертному розчиннику. Сполуки формули (I-а), визначені як сполуки формули (І), де R2 є гідрокси, можуть бути отримані за допомогою реакції проміжної сполуки формули (IV) з проміжною сполукою формули (V). Згадана проміжна сполука формули (IV) визначена як похідна проміжної сполуки формули де два гемінальні атоми водню заміщені карбонільною групою. Сполуки формули (І) можуть також бути перетворені одна в іншу, з використанням відомих з цієї галузі реакцій або реакції трансформації функціональних груп. Наприклад, сполуки формули (І), де R1 є фенілметилом, можна перетворювати у відповідні сполуки формули (І), де R1 є воднем, за допомогою відомих у цій галузі процедур дебензилювання. Вказане дебензилювання може бути виконано за допомогою відомих у цій галузі процедур, таких як, каталітична гідрогенізація, з використанням відповідних каталізаторів, наприклад, платини на вугіллі, паладію на вугіллі, у присутності прийнятного розчинника, такого як, метанол, етанол, 2-пропанол, діетиловий простий ефір, тетрагідрофуран та їм подібні. Сполуки формули (І), де R1 є іншим ніж водень, згаданий R1 представлено R1 та згадані сполуки формули (I-c) можуть бути отримані за допомогою N-алкілування сполуки формули (І) алкілувальним реагентом формули (VI), де R1 є воднем, згадана сполука представлена (І-b). У формулі (VI) та далі, W представлена відповідною відхідною групою такою як, наприклад, гало, наприклад, хлоро, бромо та їм подібні; або сульфонілокси-групою, наприклад, метансульфонілокси, 4-метилбензолсульфонілокси та їм подібні. Згадана реакція N-алкілування може бути легко проведена у реакційно-інертному розчиннику такому як, наприклад, ароматичний вуглеводень, наприклад, бензол, метилбензол, диметилбензол та їм подібні; алканол, наприклад, метанол, етанол, 1 –бутанол та їм подібні; кетон, наприклад, 2-пропанон, 4-метил-2-пентанон та їм подібні; ефір, наприклад, тетрагідрофуран, 1, 4-диоксан, 1, 1’-оксибізетан та їм подібні; биполярний апротонний розчинник, наприклад, N, N-диметилформамід, N, N-диметилацетамід, диметил сульфоксид, нітробензол, 1метил-2-піролідон та їм подібні; або суміш таких розчинників. Для збирання кислоти, що вивільняється протягом реакції, може бути додана прийнятна основа така як, наприклад, карбонат лужного або лужноземельного металу, карбонат водню, металоалкоголят, гідрид, амід, гідроксид або оксид, наприклад, карбонат натрію, гідрокарбонат натрію, карбонат калію, метилат натрію, етилат натрію, терт, бутилат калію, гідрид натрію, амід натрію, гідроксид натрію, карбонат кальцію, гідроксид кальцію, оксид кальцію та їм подібні; або органічна основа, така як, наприклад, амін, наприклад, N, N-диетилетанамін, N-(1-метилетил)- 2- пропанамін, 4-етилморфолін, піридин, та їм подібні. У деяких випадках додавання йодистої солі є більш переважним, ніж додавання йодиду лужного металу. До деякої міри підвищені температури та перемішування може збільшити швидкість реакції. Альтернативно, згадане N-алкілування може бути проведено шляхом застосування відомих у цій галузі режимів реакцій міжфазного каталізу. Більш того, сполуки формули (І), де R1 є воднем, визначені як сполуки формули (I-b), можуть бути алкіловані використовуючи відомі процедури, такі як, наприклад відновлювальне Nалкілування прийнятним альдегідом або кетоном, або може бути проведена реакція між сполукою формули (І), де R1 є воднем, та ацилгалідом або кислотним ангідридом. Також, сполуки формули (І) де X є NR3 та де R3 є метансульфонілом, бензолсульфонілом, трифторометансульфонілом, диметилсульфамоілом можуть бути перетворені в сполуки формули (І), де X є NH за допомогою відомих у цій галузі методик гідролізу, наприклад обробкою водяною кислотою, такою як НСІ. Ті сполуки формули (І), де R2 є гідрокси можуть бути перетворені у сполуки формули (І), де R2 є С1-6алкілокси, використовуючи прийнятні умови алкілування, такі як, наприклад, обробка гідридом натрію у тетрагідрофурані та додавання С1-6алкілйодиду. Сполуки формули (І), де бівалентний радикал є радикалом формули (а-1) або (а-7), де 2 R є гідрокси, можуть бути перетворені у сполуки формули (І), де бівалентний радикал є радикалом формули (а-3), (а-4), (а-8) або (а-9), де R2 є воднем, з використанням відомих у цій галузі процедур дегідратації, таких як обробка метансульфонілхлоридом у реакційно-інертному розчиннику, такому як СН2СІ2, або обробка поліфосфорною кислотою (ПФК), при температурах в межах між кімнатною температурою та температурою флегми реакційної суміші, необов'язково, згадана реакція може бути проведена у реакційно-інертному розчиннику. Навпаки, сполуки формули (І), де бівалентний радикал є радикалом формули (а-2), (а3), (а-4), (а-5), (а-6), (а-8) або (а-9), де R2 є воднем, може бути перетворені у сполуки формули (І), де бівалентний радикал є радикалом формули (а-1) або (а-7), де R2 є воднем, з використанням відомих в цієї галузі процедур гідрогенізації, таких як обробка водневим газом у комбінації з прийнятним каталізатором, таким як, наприклад, паладій на вугіллі, родій на вугіллі або платина на вугіллі. Вихідні матеріали та деякі з проміжних сполук є відомими сполуками та комерційно доступними або можуть бути отриманими у відповідності з загальноприйнятими процедурами, що добре відомі у цій галузі. Наприклад, комерційно доступними є гексагідро- 4Н- азепін -4-он , який є проміжною сполукою формули (IV), 1Н- бензимідазол та 1Н- імідазо[4, 5-b]піридин, який є проміжною сполукою формули (V). Сполуки формули (І), які отримують за допомогою описаних вище способів, можуть бути синтезованими у вигляді рацемічної суміші енантіомерів, які можуть бути відділені один від одного за допомогою відомих у цій галузі процедур розкладання. Рацемічні сполуки формули (І) можуть бути перетворені у відповідні форми діастереомерних солей за допомогою реакції із прийнятною хіральною кислотою. Вказані форми діастереомерних солей надалі розділюють, наприклад, за допомогою відбірної або фракційної кристалізації, та енантіомери вивільняють за допомогою лугу. Альтернативний спосіб розділення енантіомерних сполук формули (І) включає рідинну хроматографію, з використанням стаціонарну хіральну фазу. Вказані чисті стереохімічно ізомерні форми можуть також бути отримані як похідні відповідних чистих стереохімічно ізомерних форм прийнятних вихідних матеріалів, за умовою, що реакцію проводять стереоспецифічно. Переважно, якщо специфічний стереоізомер є бажаним, вказана сполука може бути синтезованою за допомогою стереоспецифічних способів отримання. У цих способах переважно застосовуються енантіомерно чисті вихідні матеріали. Завдяки можливості сполук даного винаходу розслабляти дно шлунка, вказані сполуки є корисними для лікування станів, пов'язаних із утрудненою або порушеною релаксацією дна шлунка, такими як, наприклад, шлунково-стравохідний рефлюкс, печія (включаючи епізодичну печію, нічну печію, та викликану їжею печію), диспепсія, відчуття швидкого насичення, вздуття та анорексія. Диспепсію описують як порушення моторної функції. Симптоми можуть викликатися затриманням звільнення шлунка від їжі або порушенням релаксації дна шлунка у відповідь на надходження їжі, або алергії на шлункове розслаблення. Симптомами диспепсії є, наприклад, відсутність апетиту, відчуття ситості, відчуття швидкого насичення, нудота, блювота, здуття та газова відрижка. Теплокровні тварини, включаючи людей (яких взагалі називають тут пацієнтами), що страждають від диспепсичних симптомів у результаті затримання звільнення шлунка, звичайно мають нормальну релаксацію дна шлунка та можуть послаблювати свої диспепсичні симптоми за допомогою введення прокінетичного агенту, такого як, наприклад, цисаприд. Пацієнти можуть мати диспепсичні симптоми, навіть якщо їх не турбує затримання звільнення шлунка. Їх диспепсичні симптоми можуть бути результатом надмірного скорочення дна шлунка, що проявляється у зменшеної піддатливості та порушеннями адаптивної релаксації дна шлунка. Також, диспепсичні симптоми можуть бути результатом гіперчутливості шлунку до розслаблення. Надмірне скорочення дна шлунка проявляється у зменшеної піддатливості шлунка. "Піддатливість шлунка" може виражатися як співвідношення об'єму шлунка до тиску, який справляють стінки шлунка. Піддатливість шлунка пов'язана із тонусом шлунка, який є результатом тонічного скорочення м'язових волокон проксимальної частини шлунка. Ця проксимальна частина шлунка, проявляючи регульоване тонічне скорочення (шлунковий тонус), виконує резервуарну функцію шлунка. Пацієнти, які страждають від відчуття швидкого насичення, не можуть споживати нормальні об'єми їжі, тому що вони відчувають насичення до того, як вони здатні спожити вказаний нормальний об'єм їжі. Звичайно, коли суб'єкт починає їсти, шлунок рефлекторно релаксується, тобто шлунок розслаблюється для того, щоб прийняти їжу, яку ковтає суб'єкт. Проте ця адаптивна релаксація стає неможливою, коли піддатливість шлунка утруднена, що проявляється у порушенні релаксації дна шлунка. Через корисність сполук формули (І), виявляється, що даний винахід також забезпечує спосіб лікування теплокровних тварин, включаючи людей (яких взагалі називають тут пацієнтами), які страждають від порушеної релаксації дна шлунка при ковтанні їжі. Як наслідок, спосіб лікування забезпечує полегшення пацієнтам, які страждають від станів, таких як, наприклад, шлунковостравохідний рефлюкс, печія (включаючи епізодичну печію, нічну печію, та викликану їжею печія), диспепсія, відчуття швидкого насичення, вздуття та анорексія. Тому забезпечується застосування сполуки формули (І) як медичного препарату, та, принаймні, застосування сполуки формули (І) для виробництва медикаментів, призначених для лікування станів, що включають порушену релаксацію дна шлунка при прийнятті їжі. Передбачаються обидва лікування - профілактичне та терапевтичне. Симптоми порушеної релаксації дна шлунка можуть також виникати внаслідок споживання хімічних речовин, наприклад, Селективних Інгібіторів Поглинання Серетоніну (СІПС), таких як, флуоксетин, пароксетин, флувоксамін, циталопрам та сертралін; або еритроміцин та еритроміцин-подібні антибіотики з макроциклічним лактоним кільцем, такі як, наприклад ЕМ-523, ЕМ-574, АВТ-229, GM-611, (8R) - 4"- дезокси - 6, 9 -епоксиеритороміцин A, (8S)-4"- дезокси - 6, 9 епоксиеритороміцин А, А-81648, А-173508, А-182061,таКС-11458. Іншим шлунково-кишковим розладом є синдром підвищеної подразливості кишки (СППК), однією з його особливостей є гіперчутливість кишки до розтягнення. Тому вважають, що модуляція згаданої гіперчутливості за допомогою сполуки за даним винаходом, що має властивості розслаблення дна шлунка, приводить до зменшення симптомів у суб'єктів, що потерпають від СППК. Відповідно забезпечується використання сполук формули (І) для виробництва медикаменту для лікування СППК (синдром підвищеної подразливості кишки). Більш того сполуки формули (І), також здатні зменшувати біль пов'язану із шлунково-кишковою гіперчутливістю. Для отримання фармацевтичних композицій даного винаходу, ефективну кількість окремої сполуки у вигляді основи або кислотно-адитивної солі, як активного інгредієнту, поєднують у ретельно перемішаній суміші із фармацевтично прийнятним носієм, причому носій може бути вибраним у дуже широкому діапазоні в залежності від форми препарату, бажаної для введення. Ці фармацевтичні композиції є бажаними у формі одиниць дозування, прийнятної, переважно для введення перорально, ректально або шляхом парентеральної ін'єкції. Наприклад, при отриманні композицій у формі пероральної дози, може використовуватися будь-яке звичайне середовище, таке як, наприклад, вода, гліколі, олії, спирти та інші їм подібні, у випадку рідких пероральних препаратів, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукрі, каолін, мастила, агенти, що зв'язують, агенти, що розщеплюють, та їм подібні, у випадку порошків, пілюль, капсул та таблеток. У зв'язку з тим, що таблетки та капсули дуже легко приймати, вони є дуже вигідною пероральною формою одиниць дозування у випадку очевидного застосування твердих фармацевтичних носіїв. Для парентеральних композицій носій звичайно містить стерильну воду, принаймні, вона складає більшу частину, хоч можуть включатися і інші інгредієнти, наприклад, для полегшення розчинності. Розчини, призначені для ін'єкцій, наприклад, можуть бути отримані так, що носій містить розчин солі, розчин глюкози або суміш розчинів солі та глюкози. Суспензії, призначені для ін'єкцій, можуть бути також отримані так, що в них можуть застосовуватися прийнятні рідкі носії, суспендувальні агенти та інші їм подібні. У композиціях, призначених для підшкірного введення, носій, необов'язково, містить агент, який поліпшує проникнення, та/або прийнятний агент, що зволожує, при необхідності пов'язаний з прийнятними добавками будь-якого характеру у незначній кількості, при цьому додатки не повинні мати значний шкідливий вплив на шкіру. Вказані додатки можуть полегшувати введення через шкіру та/або допомагати при отриманні бажаних композицій. Ці композиції можуть вводитися різними шляхами, наприклад, як трансдермальний пластир, як мазь. Кислотно-адитивні солі формули (І) завдяки підвищеної розчинності у воді у порівнянні із відповідною формою основи є очевидно більш прийнятними для отримання водних композицій. Особливо вигідно формувати вищезазначені фармацевтичні композиції у формі одиниць дозування для легкого введення та однорідності дозувань. Форми одиниць дозування, які використовуються у цьому опису та у формулі стосуються фізично дискретних одиниць, прийнятних для одиниць дозування, кожна одиниця яких містить заздалегідь визначену кількість активного інгредієнту, розрахованого для отримання бажаного терапевтичного ефекту у зв'язку із потрібним фармацевтичним носієм. Прикладами таких форм одиниць дозування є таблетки (включаючи жорсткі таблетки та таблетки з покриттям), капсули, пігулки, пакетики з порошком, облатки, розчини або суспензії для ін'єкцій, лікарські форми із дозуванням у чайних або столових ложках та їм подібні, та однотипні комбінації їх. Фармацевтичні композиції для перорального введення можуть приймати форми твердих форм дозування, наприклад, таблеток (обидві форми - таблетки тільки для ковтання та таблетки, які можна жувати), капсули або желейні капсули, виготовлені звичайними засобами із фармацевтично прийнятними наповнювачами, такими як, зв'язуючи агенти (наприклад, пептизований кукурудзяний крохмаль, полівінілпіролідон або гідроксипропилметилцелюлоза), наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза або кальцію фосфат), змащувальні агенти (наприклад, магнію стеарат, тальк або двооксид кремнію, розщеплювальні агенти (наприклад, картопляний крохмаль або натрію крохмалю гліколят), зволожувальні агенти (наприклад, натрію лаурил фосфат). Таблетки можуть бути покритими за допомогою способів добре відомих у цій галузі. Рідкі препарати для перорального введення можуть приймати форми, наприклад, розчинів, сиропів або суспензій, або вони можуть бути у вигляді сухого порошку, який розчиняють водою або іншим прийнятним розчинником перед застосуванням. Такі рідкі препарати можна отримувати за допомогою загальних способів, при необхідності із фармацевтично прийнятними додатками такими, як суспендуючи агенти (наприклад, сироп сорбитолу, метилцелюлоза, гідроксипропил метилцелюлоза або гідрогеновані харчові жири), емульгуючи агенти (наприклад, лецитин або гуміарабік), неводні розчинники (наприклад, мигдалева олія, масляні складні ефіри або етиловий спирт), та консерванти (наприклад, метил або пропил п-гідроксибензоати або сорбинова кислота). Фармацевтично прийнятні підсолоджувачи переважно містять принаймні один сильний підсолоджувач, такий як сахарин натрію або кальцію, аспартам, ацесульфам калію, натрію цикламат, алітам, дигідроалконовий підсолоджувач, монелін, стевіозид, цукролоза (4,1’,6’трихлоро-4,1’,6’-тридеоксигалактоцукроза), переважно сахарин, натрію або кальцію сахарин, та, необов'язково, велику кількість підсолоджувачів, таких як, сорбитол, манітол, фруктоза, цукроза, мальтоза, ізомальтоза, глюкоза, сироп гідрогенованої глюкози, ксилітол, карамель або мед. Сильні підсолоджувачі зручно застосовують у малих концентраціях. Наприклад, у випадку застосування натрію сахарину, концентрація може бути у діапазоні від 0,04% до 0,1% (за масою), розраховуючи від загального об'єму кінцевої композиції, та переважно складає приблизно 0,06% у складах з малими дозами та приблизно 0,08% у складах з великими дозами його. Більшість підсолоджувачів може ефективно використовуватися у великої кількості у діапазоні від приблизно 10% до приблизно 35%, переважно приблизно від 10% до 15% (за масою). Фармацевтично прийнятними ароматизаторами, які можуть маскувати неприємний смак інгредієнтів у складах з малими дозами, є переважно фруктові ароматизатори, такі як, вишневий, малиновий, чорної смородини та полуничний ароматизатор. Комбінація двох ароматизаторів може на виході дати дуже хороші результати. У складах з великими дозами можуть бути потрібні сильні ароматизатори, такі як, "Карамельно-Шоколадний" ароматизатор, "Сильний М'ятний" ароматизатор, ароматизатор "Фантазія" або інші їм подібні фармацевтично прийнятні сильні ароматизатори. Кожний ароматизатор може бути присутнім у кінцевої композиції з концентрацією у діапазоні від 0,05% до 1% (за масою). Переважно використовують комбінації вказаних сильних ароматизаторів. Переважно ароматизатор використовують так, щоб не піддавати будь-яким змінам або не втратити смак або колір в умовах кислого середовища складу. Сполуки даного винаходу можуть бути сформованими для парентерального введення шляхом ін'єкції, зручно за допомогою внутрішньовенної, внутрішньом'язової або підшкірної ін'єкції, наприклад, шляхом внутрішньошкірної ін'єкції або безперервної внутрішньовенної ін'єкції. Склади для ін'єкції можуть бути представленими у формі одиниць дозування, наприклад, у ампулах або у багатодозових контейнерах, з доданими консервантами. Композиції можуть приймати такі форми, як суспензії, розчини або емульсії у олійному або водному розчиннику та можуть містити складні агенти, такі як агенти, які ізотонують, суспендують, стабілізують та/або диспергують. Альтернативно, активний інгредієнт може бути у вигляді порошку для змішування перед використанням з прийнятним розчинником, наприклад, зі стерильною, вільною від пірогену, водою. Сполуки даного винаходу можуть бути сформовані у ректальних композиціях, таких як, супозиторії або утримуючи клізми, наприклад, такі, що містять загальні супозиторні основи, такі як масло какао або інші гліцериди. Особи, які мають достатню кваліфікацію для лікування станів, пов'язаних із утрудненою або порушеною релаксацією дна шлунка можуть легко визначити ефективну щоденну кількість, беручи до уваги результати випробувань, що наведені нижче. Взагалі розраховують так, що терапевтично ефективна кількість буде від приблизно 0,001мг/кг до приблизно 5мг/кг ваги тіла, переважно від приблизно 0,01мг/кг до приблизно 0,5мг/кг ваги тіла. Прийнятно вводити терапевтично ефективну дозу як одну, дві, три, чотири або більше субдоз протягом відповідних інтервалів протягом дня. Вказані субдози можуть бути приготовані як дозовані одиничні форми, наприклад, дози, що містять від 0,1 до 350мг, та зокрема від 1 до 200мг активного інгредієнту на дозовану одиничну форму. Точне дозування та частота призначення залежать від індивідуальної сполуки формули (І), яка використовується, специфічних станів, які лікуються, серйозності станів, які лікуються, віку, ваги і загального фізичного стану індивідуального пацієнта, а також може бути проведено інше лікування індивідууму за допомогою методів, які відомі із рівня техніки. Крім того, очевидно, що вказана ефективна щоденна кількість ліків може бути зменшена або збільшена у залежності від реакції суб'єкта, якого лікують, та/або в залежності від оцінки лікаря, що призначає сполуки даного винаходу. Ефективні щоденні кількісні діапазони згадані вище та, таким чином, є тільки нормами. Експериментальна частина У нижчеописаних процедурах використовують такі скорочення: "АЦН" для позначення ацетонітрилу; "ТГФ", для позначення тетрагідрофурану; "ДХМ" для позначення дихлорметану; "ДІПЕ" для позначення диізопропілового ефіру; та "ДМФ" означає N,N-диметилформамід. Для позначення деяких хімічних з'єднань використовують хімічну формулу, наприклад, Н2 для водневого газу, N2 для азотного газу, СН2Сl2 для дихлорметану, СН3ОН для метанолу, NH3 для аміаку, НСl для соляної кислоти та NaOH для гідроксиду натрію. Стереохімічну ізомерну форму, у тих випадках, коли її виділяють першою, позначають як "А", другу позначають як "В", без подальшого посилання на фактичну стереохімічну формулу. А. Приготування проміжних сполук Приклад А. 1 Суміш гексагідро-1-(фенілметил)-4Н-азепін-4-ону (0,2 моль) та 4-толуолсульфонілметил ізоцианіду (0,25 моль) у ДМФ (200мл) перемішували при температурі 0°С. Додавали по краплях розчин mepm-бутоксида калію (0,4 моль) у суміші 2-метил-2-пропанолу (200мл) та 1, 2диметоксиетану (200мл) при температурі 0°С. Суміші дозволили нагрітися до кімнатної температури та перемішування продовжували протягом 1 години. Суміш перемішували у воді та потім отриману суміш екстрагували ДХМ. Виділений органічний шар висушили, відфільтрували та розчинник випаровували, що дало 48г (±)-гексагідро-1-(фенілметил)-1Н-азепін-4- карбонітрилу (проміжна сполука 1). Приклад А. 2 Диметил сульфамоіл хлорид (0,39 моль) додавали до суміші 1Н-імідазо [4, 5-b]піридину (0,26 моль) та триетиламіну (0,65 моль) у толуолі (500мл). Суміш перемішували при 100°С протягом 24 годин. Розчинник випаровували. Залишок було розчиняють у ДХМ. Органічний розчин промили водою та К2СО3 (10%), висушили, відфільтрували та розчинник випаровували, що дало 45,4г (77%) суміші Ν,Ν- диметил-1Н-імідазо [4, 5-b] піридин-1-сульфонаміду (проміжна сполука 2) та Ν, N-диметил-3Н-імідазо [4, 5-b] піридин-3-сульфонаміду (проміжна сполука 3). Приклад А. 3 a) Суміш етил гексагідро-4-оксоазепін-1 - карбоксалату (0,585 моль ), 1, 2-етандиол (0,585 моль) та п-толуолсульфонової кислоти (0,0058 моль) у толуолі (800мл) перемішували та нагрівали зі зворотнім охолодженням протягом ночі, використовуючи водовіддільник (10,5мл відділено). Розчинник випаровували, що дало 142,5г етил 1,4-диокса - 8 - азаспіро [4,6] ундекан 8-карбоксалату (проміжна сполука 4). b) Суміш проміжної сполуки (4) (0,585 моль) та КОН (5,85 моль ) у 2-пропанолі (1200мл) перемішували та нагрівали зі зворотним охолодженням протягом ночі. Розчинник випаровували. Залишок перемішували у воді та цю суміш екстрагували ДХМ. Виділений органічний шар висушили, відфільтрували, та розчинник випаровували, що дало 57,7г 1,4-диокса-8-азаспіро [4, 6]ундекалу (проміжна сполука 5). c) Суміш проміжної сполуки (5) (0,114 моль), 1-(2-бромоетил)-4-метокси- бензолу (0,172 моль) та К2СО3 (0,219 моль) у АЦН (200мл) перемішували при температурі 80°С протягом 2 годин. Додали воду та суміш екстрагували ДХМ. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 95/5/0,2). Чисті фракції були зібрані та розчинник випаровували, що дало 28,5г 8-[2-(4-метоксифеніл) етил]-1,4-диокса-8-азаспіро [4. 6] ундекану (проміжна сполука 6). d) Суміш проміжної сполуки (6) (0,098 моль) у НСl (3N, 300мл) та ТГФ (300мл) перемішували при температурі 60°С протягом однієї години. Суміш перетворена у основу твердим К2СО3 та екстрагована етилацетатом. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували, що дало 22,6г гексагідро-1-[2-(4-метоксифеніл) етил]- 4Н - азепін-4-ону (проміжна сполука 7). Приклад А. 4 a) 5, 6, 7, 8- тетрагідро-2(1Н)- хінолінон (0,134 моль) додавали порціями при температурі 5°С до сірчаної кислоти (200мл). Потім додавали порціями HNO3 (0,235 моль) то тих пір доки температура утримувалася нижче 10°С. Суміш перемішували при температурі 5°С протягом 1 години, обережно вилили у невелику кількість льодяної води та перемішували при температурі 0°С протягом 10 хвилин. Осад відфільтрували та висушили, що дало 14,2г (55%) 5, 6, 7, 8 тетрагідро - 3-нітро-2(1Н) - хінолінону (проміжна сполука 8). b) Розчин проміжної сполуки (8) (0,072 моль) та ВТЕАС (0,0362 моль) у АЦН (150мл) перемішували при кімнатній температурі. Фосфорний трихлорид (0,222 моль) додавали по краплям. Суміш перемішували та нагрівали зі зворотним охолодженням протягом 8 годин. Розчинник випаровували до висушування. Залишок вилили у воду та NH4OH. Суміш екстрагували ДХМ. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували, що дало 15г 2 - хлоро - 5, 6, 7, 8 - тетрагідро - 3 -нітрохінолін (проміжна сполука 9). c) Суміш проміжної сполуки (9) (0,0658 моль) у NH3/CH3OH 7N (60мл) перемішували при температурі 120°С протягом 12 годин у автоклаві. Розчинник випаровували до висушування. Залишок розчиняють у 2-пропаноні. Осад відфільтрували та висушили, що дало 8,6г 5,6,7,8 тетрагідро - 3-нітро-2-хінолінаміну ( проміжна сполука 10). d) Суміш проміжної сполуки (10) (0,031 моль) у метанолі (100мл) гідрогенізована при кімнатній температурі під тиском у 3,105Па (3 бар) протягом 30 хвилин у апараті Парра. Після поглинення водню (3 еквіваленти), каталізатор відфільтрували крізь целіт, зібрали метанолом та фільтрат випаровували до висушування. Отриманий продукт було використано з додатковим очищенням, що дало 5,07г 5,6,7,8 - тетрагідро -2,3-хіноліндиаміну (проміжна сполука 11). В. Отримання кінцевих сполук Приклад В. 1 Поліфосфорну кислоту (ПФК) (100г) нагріли до температури у 160°С. Додали проміжну сполуку (1) (0,0467 моль) та 2, 3-диамінопіридин (0,0513 моль). Суміш перемішували при температурі 180°С протягом 1 години, вилили на твердий К2СО3 та лід, промили К2СО3 10% та екстрагували ДХМ. Водний шар промили ДХМ. Органічний шар висушили, відфільтрували та розчинник випаровували. Цю фракцію очистили за допомогою колонкової хроматографії на силікагелі (елюент : CH2CI2/CH3OH/NH4OH 94/6/0,5). Чисті фракції були зібрані та розчинник випаровували. Частину цієї фракції (6г) кристалізували ДІПЕ та 2-пропаноном. Осад відфільтрували та висушили, що дало 3,16г(±)-2-[гексагідро-1-(фенілметил)-1Н-азепін-4-іл]-1Німідазо [4, 5-b] піридин (сполука 69). По аналогії, отримали сполуку (207) за допомогою реакції між проміжною сполукою (1) та 2амінобензолтіолом. Приклад В. 2 Сполуку (69) (0,0653 моль) виділили у її енантіомери за допомогою хіральної колонкової хроматографії (елюент:гексан/етанол/Еt3N 95/5/0.1; колонка : CHIRALPAK AD 20мкм). Фракції, що розпалия були зібрані та їх розчинники були випаровувані, та кристалізовані ДІПЕ або 2пропаноном, що дало 4,64г (23%) (-) - 2 - [гексагідро - 1 -(фенілметил)-1Н-азепін - 4-іл]-1Н - імідазо [4, 5-b] піридину (сполука 80) [a]D20=-15,08° (с=8,49мг/мл у СН3ОН); та 6,19г (31%)(+)-2-[гексагідро - 1 - (фенілметил) - 1Н - азепін - 4 - іл] - 1Н- імідазо [4,5b]піридину (сполука 81), [a]D20=+15,52° (с=8,70мг/5мл у СН3ОН). Приклад В. 3 n-Бутиллітій (1,6Μ у гексанах, 0,164 моль ) додавали по краплям при температурі -30°С під потоком N2 до суміші Ν-(1-метилетил)-2-prораnаміну (0,164 моль) у ТГФ (70мл). Суміш охолодили до -70°С. Додавали по краплям суміш 1- метил- 1Н- імідазо [4, 5-b] піридину (0,0751 моль ) у ТГФ (70мл). Суміш перемішували протягом 1 години. Додали суміш гексагідро -1- (фенілметил)- 4Н азепін-4-ону (0,0787 моль) у ТГФ (60мл) при температурі -70°С. Суміш перемішували при температурі -70°С протягом 2 годин, довели до 0°С, вилили у воду та NH4CI та екстрагували ДХМ та невеликою кількістю метанола. Органічний шар виділили, висушили, відфільтрували та випаровували до висушування. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент : СН2Сl2/СН3ОН/ΝΗ4ΟΗ 97/3/0,5). Бажані фракції зібрали та розчинник випаровували, що дало 8,8г (±)-гексагідро-4-(1-метил-1Н-імідазо [4, 5-b] піридин - 2-іл)-1(фенілметил) 1Н -азепін-4-олу (сполука 152). Приклад В. 4 Суміш сполуки (81) (0,0068 моль) у метанолі (20мл) гідрогенізували при температурі 40°С під тиском 3,105Па (3 бар) паладієм на вугіллі (1г) як каталізатором. Після поглинення водня (1 еквівалент), каталізатор відфільтрували на целіті та фільтрат випаровували. Залишок кристалізували з АЦН. Осад відфільтрували та висушили, що дало 0,95г (А)-2-(гексагідро-1Назипін-4-іл)-1Н - імідазо [4, 5-b] піридину (сполука 102). Приклад В. 5 Додали К2СО3 (0,011 моль) та потім додали 1 - (хлорометил) - 4 - метоксибензол (0,011 моль) до суміші сполуки (87) (0,011 моль) у АЦН (80мл). Суміш перемішували при кімнатній температурі протягом ночі. Розчинник випаровували до висушування. Залишок розподіляють між ДХМ та водою. Органічний шар виділили, висушили відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2Сl2/СН3ОН/NH4ОН 93/7/0,5). Чисті фракції були зібрані та розчинник випаровували. Залишок кристалізували з АЦН. Осад відфільтрували, висушили, що дало 1,2г (±)-2- [гексагідро-1-[(4-метокси- феніл) метил]-1Назепін-4-іл]-1Н - імідазо [4, 5-b] піридину (сполука 101). Приклад В. 6 Поліфосфорна кислота (РРА) (10г) нагріли до температури 160°С. Додали сполука (155) (0,0043 моль). Суміш перемішували протягом 20 хвилин, охолодили, вилили у льодяну воду, насинили К2СО3 (порошок), та екстрагували СН2СІ2/СН3ОН (95/5). Органічний шар виділили, висушили, відфільтрували та розчинник випаровували до висушування. Залишок розчиняють у CH3OH/CH3CN. Осад відфільтрували, зібрали на фільтрі та висушили, що дало 1,55г (20,9%)2-(2, 3, 6, 7 - тетрагідро -1Н-азепін-4-іл)-1Н-імідазо [4, 5-b] піридин (сполука 116). Вихідний шар випаровували до висушування, що дало 5,5г суміші сполуки (116) та 2-(2, 5, 6, 7 -тетрагідро-1Н-азепін - 4-іл) - 1Н- імідазо [4, 5-b] піридин (сполука 115). Приклад В. 7 Суміш сполуки (136) (0,0276 моль) у ДХМ (80мл) охолодили до температури 5°С. Додали 3Хлоробензолкарбопероксонову кислоту (0,044 моль). Суміш витримували при температурі 5°С протягом однієї години, потім температуру довели до кімнатної температури протягом ночі. Додали К2СО3 10%. Суміш насичили К2СО3 (порошок) та екстрагували СН2Сl2/СН3OН. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували до висушування. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 92/8/0.5). Чисті фракції були зібрані та розчинник випаровували, що дало 6,5г (74,7%) (±)-1-(2, 2 диметил - 1-оксопропіл) - 4 - (1Н - імідазо [4, 5-b] піридин-2-іл) - 1Н - азепіну, N4-оксид (сполука 161). Приклад В. 8 По порціям додали 3- хлоробензолкарбопероксонову кислоту (0,0157 моль) при кімнатній температурі до суміш сполуки (69) (0,013 моль) у ДХМ (80мл). Суміш перемішували при кімнатній температурі протягом 4 годин. Додали насичений розчин NaHCO3- Суміш екстрагували ДХМ, насичили К2СО3 та знову екстрагували СН2Сl2/2 -пропанолом. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували при температура нижче 40°С. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 88/12/1). Дві чисті фракції зібрали та їх розчинники випаровували, що дало 2,3г (А)-2 [гексагідро 1- (фенілметил)-1Н - азепін - 4-іл] - 1Н - імідазо [4, 5-b] піридину, N-оксиду (сполука 113) та 1,6г (В) - 2 -[гексагідро - 1 (фенілметил) - 1Н - азепін - 4 - іл] - 1Н- імідазо [4, 5-b] піридину, N - оксид (сполука 114). Приклад В. 9 По порціям додали NaH 80% (0,0195 моль) при температурі 5°С до суміші сполуки (±)-2[гексагідро - 1 - (фенілметил) - 1Н - азепін - 4 - іл] - 1Н - імідазо [4, 5-b] піридин (0,0195 моль) у ДМФ (100мл). Суміш перемішували протягом 15 хвилин. Додали 2 -бромо - 1 -фенілетанон (0,0214 моль). Суміш перемішували протягом 30 хвилин. Додали воду та суміш екстрагували етилацетатом. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент : CH2CI2/CH3OH/NH4OH 97/3/0,1). Три чисті фракції зібрали, їх розчинникі випаровували, перетворили у сіль хлорводневої кислоти (1:2) НС1/2-пропанолом, та крисалізували з 2пропанолу, що дало 3,3г (±)-2-[2-[гексагідро - 1 -(фенілметил)- 1Н - азепін - 4 - іл] - 3Н - імідазо [4, 5-b] піридин - 3-іл] - 1 - фенілетанон гідрохлорид (1:2) (сполука 76). Приклад В. 10 Розчин сполука (143) (0,00838 моль) у НСl 3N (35мл) та ТГФ (35 моль) перемішували при кімнатній температурі протягом ночі, нейтралізували твердим К2СО3 та екстрагували етилацетатом. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент : CHCI2/CH3OH/NH4OH 90/10/0.5). Чисті фракції були зібрані та розчинник випаровували. Залишок кристалізували з 2-пропанону. Осад відфільтрували та висушили, що дало 1,54г (+)-гексагідро -4(1Н-імідазо [4, 5-b] піридин - 2-іл)-1-(фенілметил)-1Η- азепін-4-ол (сполука 149). Приклад В. 11 Суміш сполуки (54) та сполуки (55) у метанолі (50мл) була гідрогенізована при температурі 40°С під тиском у 5,105 Па (5 бар) протягом 8 годин паладієм на вугіллі (0,45г) як каталізатором. Після поглинення водню (1 еквівалент), каталізатор відфільтрували крізь целіт, промили метанолом та фільтрат випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 90/10/1). Чисті фракції зібрали та розчинник випаровували. Залишок кристалізували з диетил ефіром. Осад відфільтрували та висушили, що дало 1,8г сполуку (14). Приклад В. 12 Суміш сполуки (27) (0,0059 моль) у метанолі (100мл) перемішували при температурі 5°С. Додали по порціям борогідрид натрію (0,0059 моль) під потоком N2. Суміш перемішували при кімнатній температурі протягом 2 годин та гідролізували водою. Метанол випаровували. Залишок розчиняють у ДХМ та суміш випаровували. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок перетворили у сіль етандіонової кислоти (1:2). Суміш кристалізували з 2-пропанону. Осад відфільтрували та висушили, що дало 2,37г сполуки (29). Приклад В. 13 Суміш сполуки (31) (0,00659 моль) та метил йодиду (0,00923 моль) у 2-пропаноні (80мл) перемішували при кімнатній температурі протягом 12 годин. Осад відфільтрували, промили 2пропаноном та висушили, що дало 2,45г сполуки (154). Приклад В. 14 Суміш сполука (161) у НСl 12N (50мл) перемішували та нагрівали зі зворотним охолодженням протягом ночі. Розчинник випаровували до висушування. Залишок розчиняють у К2СО3 10% та насичують порошком К2СО3 . Суміш екстрагували СН2СІ2/СН3ОН 90/10. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували до висушування. Залишок кристалізували із СН3ОН/СН3СN/ДІПЕ. Осад відфільтрували та висушили, що дало 1,2г сполуки (162). Приклад В. 15 Суміш сполуки (126) (0,00594 моль) у НВr 48% у воді (60мл) перемішували при температурі 90°С протягом 12 годин. Розчинник випаровували. Залишок промили розчином К2СО3 та екстрагували етилацетатом та ДХМ. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок було розчиняють у етилацетаті. Суміші дозволили кристалізуватися. Осад відфільтрували та висушили, що дало 0,8г сполуки (127). Приклад В. 16 Суміш сполуки (92) (0,006 моль) у метанолі (20мл) гідрогенізували при кімнатній температурі під тиском 3,105Па (3 бар) протягом 2 годин нікелем Ренея (2г) як каталізатором. Після поглинення водню (3 еквіваленти), каталізатор відфільтрували крізь целіт та фільтрат випаровували, що дало 2,1г сполуки (105). Приклад В. 17 Суміш сполуки (87) (0,0139 моль) у триетиламіну (2,9мл) та ДХМ (30мл) перемішували при кімнатній температурі протягом 15 хвилин. Додали 3 -піридинкарбонову кислоту (0,0209 моль). Додали суміш 1-гідрокси - 1Н - бензотриазол (0,0209 моль) у ДХМ (30мл) при температурі 5°С під потоком N2. Суміш Ν, Ν -метантетраіл - біцикло - гексанамін (0,0209 моль) у ДХМ (30мл) по краплям. Суміш перемішували при кімнатній температурі протягом 6 годин. Осад відфільтрували. Фільтрат промили водою. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент : CH2CI2/CH3OH/NH4OH 92/8/0.5). Дві фракції зібрали та їх розчинники випаровували. Обидві фракції поєднали та кристалізували із ДХМ та ДІПЕ, що дало 2,3г сполука (118). Приклад В. 18 Триетиламін (0,0111 моль) додали до суміші сполук (115) та (116), що отримані у Прикладі В.6, у ДМФ (40мл). Суміш охолодили у льодяній бані. Додали метансульфоніл хлорид (0,01 моль). Суміш перемішували при температурі 5°С протягом 1 години та потім перемішували при кімнатній температурі протягом ночі. Розчинник випаровували до висушування. Залишок розподіляють між сумішшю ДХМ та води. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували до висушування. Залишок очистили за допомогою колонкової хроматографії (елюент: СН2Сl2/CH3OH/NH4OH 95/5/0.1) на силікагелі, та кристалізували з 2-пропанону та ДІПЕ. Осад відфільтрували та висушили, що дало 1,25г сполуки (180) (тп.>260°С). Приклад В. 19 Триетиламін (0,0168 моль) додали до суміші сполуки (115) (0,007 моль) та (116) (0,007 моль), що отримані у Прикладі В.6, у ДМФ (60мл). Суміш охолодили при температурі 5°С та додали 2 фенілацетил хлорид (0,0154 моль). Суміш перемішували при температурі 5°С протягом 1 години, потім при кімнатній температурі протягом ночі, випаровували до висушування та розподіляють між сумішшю ДХМ та води. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували до висушування. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 95/5/0.2). Дві фракції зібрали та розчинник випаровували. Одну фракцію кристалізували з CH3CN/ДІПЕ. Осад відфільтрували та висушили, що дало 0,25г сполуки (182) (тп.169°С). Другу фракцію кристалізували з СН3СN/ДІПЕ. Осад відфільтрували та висушили, що дало : 1,55г сполука (183) (тп.157°С). Приклад В. 20 Триетиламін (0,037 моль), та потім етилхлороформат (0,074 моль) додали по краплям при кімнатній температурі до суміші сполуки (87) (0,0185 моль) у толуолі (60мл). Суміш перемішували при температурі 95°С протягом 2 годин, вилили у льодяну вода та екстрагували етилацетатом. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 97/3/0,5). Одну фракцію зібрали та розчинник випаровували, що дало 3,7г сполуки (187). Приклад В. 21 Суміш сполуки (187) (0,0083 моль) та гідроксиду калію (0,053 моль) у 2 -пропанолі (30мл) перемішували та нагрівали зі зворотним охолодженням протягом ночі, вилили у льодяну воду, екстрагували ДХМ та промили водою. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували до висушування. Суміш була розчиняють у диетиловому ефірі/ДІПЕ. Осад відфільтрували, промили та висушили, що дало 1,45г сполуки (188) (тп.141°С). Приклад В. 22 Суміш метил 5, 6- диамінонікотинат (0,0104 моль) та гексагідро- 1-(фенілметил)-1Н-азепін-4карбонової кислоти (0,0087 моль) у фосфороксихлориді (50мл) перемішували при температурі 110°С протягом 8 годин. Розчинник випаровували. Залишок перетворили у основу К2СО3/Н2О. Суміш насичили К2СО3 та екстрагували сумішшю етилацетату та ізопропанолу. Органічний шар виділили, висушили, відфільтрували, та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH; 95/5/0,5) та кристалізували з СН3СN/ДІПЕ, що дало 1,02г сполуки (217) (тп.150°С). Приклад В. 23 а) Суміш 3 - аміно - 2 - піридинолу (0,018 моль) у ДХМ (40мл) охолодили до температури 5°С. Додали триетиламін (0,0216 моль ). Додали суміш гексагідро - 1-(фенілметил)-ІН-азепін-4карбоніл хлориду (0,018 моль) у АЦН (40мл). Суміш перемішували при температурі 5°С протягом 1 години, потім перемішували при кімнатній температурі протягом ночі та вилили у воду. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували до висушування. Залишок використали без додаткового очищення, що дало проміжну сполуку (12). b) Суміш проміжної сполуки (12) (0,018 моль) у фосфороксихлориді (80мл) перемішували та нагрівали зі зворотним охолодженням протягом ночі. Фосфороксихлорид випаровували до висушування. Залишок було розчинено у КСО3 10% та екстраговано ДХМ. Органічний шар виділили, висушили, відфільтрували, та розчинник випаровували до висушування. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент : CH2CI2/CH3OH/NH4OH; 90/10/0,1), кристалізували з АЦН та перетворили у сіль етандіонової кислоти, що дало 0,8г сполуки (213) (тп.102°С). Приклад В. 24 Суміш N - (2-аміно-3-піридиніл) гексагідро - 1 - (фенілметил) - 1Н - азепін-3-карбоксамід (0,0151 моль) та APTS (ОДг) у ксилолі (150 моль) перемішували та нагрівали зі зворотним охолодженням протягом 12 годин, випаровували та потім її було розчинено у К2СО3 10%/СН2Сl2. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент : CH2CI2/CH3OH/NH4OH 96/4/0,5 до 90/10/0,5). Чисті фракції зібрали та кристалізували з СН3СN/ДІПЕ, що дало 2,57г сполуки (195) (тп.139°С). Приклад В. 25 Суміш N-(2-хлоро-3-піридиніл) гексагідро - 1- (фенілметил) - 1Н - азепін-4-карбоксаміду (0,096 моль), реактива Лавесона (0,0096 моль) у НМРТ (33мл) перемішували при температурі 150°С протягом ночі. Суміш вилили у К3СО3/лід та екстрагували етилацетатом. Органічний шар виділили, висушили, відфільтрували, та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH; 97,5/2,5/0,1). Чисті фракції зібрали та розчинник випаровували. Залишок розчинили у 2 - пропаноні та перетворили у сіль етандіонової кислоти. Осад відфільтрували та висушили, що дало 0,52г сполуки (218) (тп.163°С). Приклад В. 26 Додали по краплям суміш 1-хлороетил хлороформату (0,0188 моль) у 1, 2-дихлороетані (20мл) при температурі 0°С до суміші сполуки (206) (0,0172 моль) 1, 2 - дихлороетані (100мл). Температуру суміші довели до кімнатної, потім перемішували при температурі 80 °С протягом 1 години. Розчинник випаровували до висушування. Додали метанол (60мл). Суміш витримували при кімнатній температурі протягом 12 годин потім перемішували та нагрівали зі зворотним охолодженням протягом 30 хвилин. Розчинник випаровували. Додали К2СО3 (10%)/СН2Сl3. Органічний шар виділили, висушили, відфільтрували, та розчинник випаровували. Залишок кристалізували з АЦН, що дало 0,9г сполуки (220). Приклад В. 27 Суміш сполуки (171) (0,015 моль) у ТГФ (30мл) охолодили до 0°С. Додали по порціям гідрид натрію (60% у олії) (0,015 моль). По краплям додали диметил сульфат (0,0165 моль). Суміш перемішували при температурі від 0°С до кімнатної температури протягом 4 годин, вилили у воду та екстрагували ДХМ. Органічний шар виділили, висушили, відфільтрували, та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH; 95/5/0,1), що дало 4,5г сполуки (175). Приклад В. 28 Суміш диетил складного ефіра карбанодитіонової кислоти 4 - [[[гексагідро-1-(фенілметил) - 1Н - азепін-4-іл]карбоніл]аміно] - 3 - піридинілу (0,00876 моль) у мурашиній кислоті (50мл) перемішували при температурі 100°С протягом 3 годин. Розчинник випаровували. Залишок вилили у лід, перетворили у основу за допомогою К2СО3 (порошок) та екстрагували етилацетатом. Органічний шар виділили, висушили, відфільтрували та розчинник випаровували. Залишок розчинили у 2 - пропаноні та перетворили у сіль соляної кислоти. Осад відфільтрували та висушили, що дало: 1,16г сполуки (215) (тп.184°С). Приклад В. 29 2-Бензофуранкарбоксальдегіду (0,00915 моль), та потім NaBH3CN (0,001 моль) додали при кімнатній температурі до суміші сполуки (87) (0,0083 моль) у АЦН (100мл). Додали оцтову кислоту (1,8мл) при кімнатній температурі. Суміш перемішували при кімнатній температурі протягом 2 годин, вилили К2СО3 (10%) та екстрагували етилацетатом. Органічний шар виділили, висушили, відфільтрували, та розчинник випаровували до висушування. Залишок було розчинено у метанолі у 10мл 2-пропанол/НСІ (5N). Суміш перемішували та нагрівали зі зворотним охолодженням протягом ночі. Розчинник випаровували до висушування. Залишок було розчинено у К2СО3 (10%). Суміш екстрагували ДХМ. Органічний шар виділили, висушили, відфільтрували, та розчинник випаровували до висушування. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH; 95/5/0,2; 2 -пропанон/СН3СN. Осад відфільтрували та висушили, що дало 0,9г сполуки (236) (тп.125°С). Таблиці F-1 до F-6 показують сполуки, що були отримані згідно з одним з вищенаведених Прикладів. Наступні скорочення були використані у таблицях: С2Н2О4 позначає сіль етандіоату. С.Фармакологічні приклади С.1. "Вимірювання шлункового тонусу за допомогою електронного баростату у собак при свідомості". Шлунковий тонус неможливо вимірювати за допомогою манометричних методів. Тому використовують електронний баростат. Він дозволяє вивчати фізіологічну модель та регулювання шлункового тонусу у собак при свідомості та вплив сполук, що тестуються, на цей тонус. Баростат складається з повітряної системи введення, яка з'єднана за допомогою двохпросвітної інтубаційної полівінілової трубки (14-French) із ультратонкою м'якою поліетиленовою сумкою (максимальний об'єм: ±700мл). Різні значення шлункового тонусу вимірювали за допомогою запису змін об'єму повітря у шлунковій сумці, при підтримуванні постійного тиску. Баростат підтримує постійний тиск (попередньо вибраний) усередині м'якої заповненої повітрям сумці, введеної у шлунок, змінюючи об'єм повітря усередині сумки за допомогою електронної системи зі зворотнім зв'язком. Таким чином, баростат вимірює моторику шлунка (скорочення або розслаблення) як зміни у шлунковому об'ємі (відповідно зменшення або збільшення) при постійному шлунковому тиску. Баростат містить тензометричний датчик, зв'язаний за допомогою електронного реле з системою упорскування-аспірації повітря. Обидва тензометричний датчик та система упорскування з'єднані за допомогою двохпросвітної інтубаційної полівінілової трубки із ультратонкою поліетиленовою сумкою. Цифровий диск баростату дозволяє вибирати рівень тиску усередині шлункової сумки. Самок собак породи "бігль", вагою 7-17кг, навчили стояти спокійно у станках Павлова. їм під загальною анестезією та з дотриманням правил асептики імплантували шлункову канюлю. Після серединної лапаротомії було зроблено розріз стінки шлунка у поздовжньому напрямку поміж великою та малою кривизною шлунка, 2см вище за нерви Latarjet. Канюлю закріпили на стінці шлунка подвійним кисетним швом та вивели крізь операційну рану у лівому квадранті підребер'я. Собакам дали можливість відпочити протягом двох тижнів. На початку експерименту канюлю відкрили для вилучення будь-якого шлункового соку та залишків їжі. Якщо це було необхідно, шлунок очищували теплою водою (від 40 до 50 мілілітрів). Ультратонку сумку баростату крізь шлункову канюлю розташували на дні шлунка. Щоб гарантувати легке розгортання шлункової сумки під час експерименту, в неї двічі вводили місткість 150-200 мілілітрів шляхом підвищення тиску до максимального значення 14мм ртутного стовпчика (приблизно 1,87кПа) на дуже недовгий час. Цю процедуру повторили двічі. Після періоду стабілізації протягом 60 хвилин при внутрішньошлунковому тиску 6 мм ртутного стовпчика (приблизно 0,81кПа), сполука, що тестується була введена підшкірно, або крізь дванадцятипалу кишку, при тиску 2мм ртутного стовпчика (0,27кПа). За тестовими сполуками спостерігали, тобто вимірювали зміни об'єму шлунка, звичайно при 0,63мг/кг підшкірного введення. Інші дози та способи введення тестували, якщо сполука, що тестується показувала себе активною під час процедури спостереження. Таблиця С-1 підводить висновки значень максимальних змін в об'ємі релаксації дна шлунка, за 1 годину після підшкірного введення сполуки, що тестується (0,63мг/кг). Таблиця С-1 № сполуки 35 69 80 81 122 124 125 Максимальна Максимальна зміна об'єму зміна об'єму № (середнє (середнє сполуки значення) значення) 272 130 35 87 133 61 55 145 160 183 154 54 138 169 53 49 170 31 222
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole derivatives substituted by homopyperidinyl as relaxants of gastric fundus, a method for the preparation thereof (variants)
Автори англійськоюJanssens, Frans, Eduard, Sommen Francois Maria
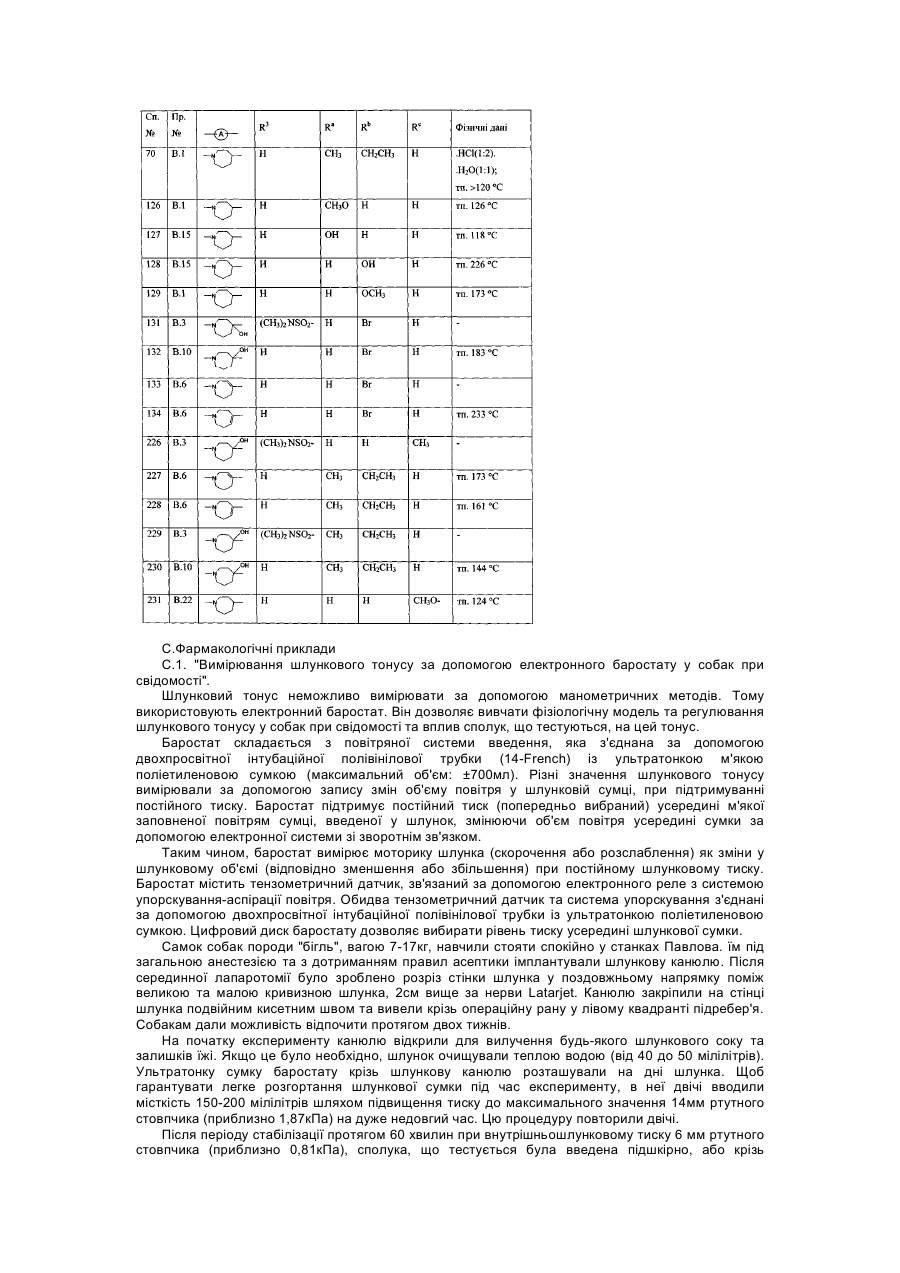
Назва патенту російськоюЗамещенные гомопиперидинилом производные бензимидазола как релаксанты дна желудка, способ их получения (варианты)
Автори російськоюЯнссенс Франс Эдуард, Соммен Франсуа Мария
МПК / Мітки
МПК: C07D 403/04, C07D 405/14, A61P 1/04, C07D 417/04, A61P 43/00, C07D 413/04, C07D 513/04, C07D 498/04, A61K 31/55, C07D 487/04, C07D 471/04
Мітки: релаксанти, спосіб, варіанти, дна, гомопіперидинілом, бензимідазолу, шлунка, отримання, заміщені, похідні
Код посилання
<a href="https://ua.patents.su/27-73963-zamishheni-gomopiperidinilom-pokhidni-benzimidazolu-yak-relaksanti-dna-shlunka-sposib-kh-otrimannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Заміщені гомопіперидинілом похідні бензімідазолу як релаксанти дна шлунка, спосіб їх отримання (варіанти)</a>
Попередній патент: Гра
Наступний патент: Спосіб хімічної обробки виробів з титану
Випадковий патент: Пристрій для встановлення шарнірів