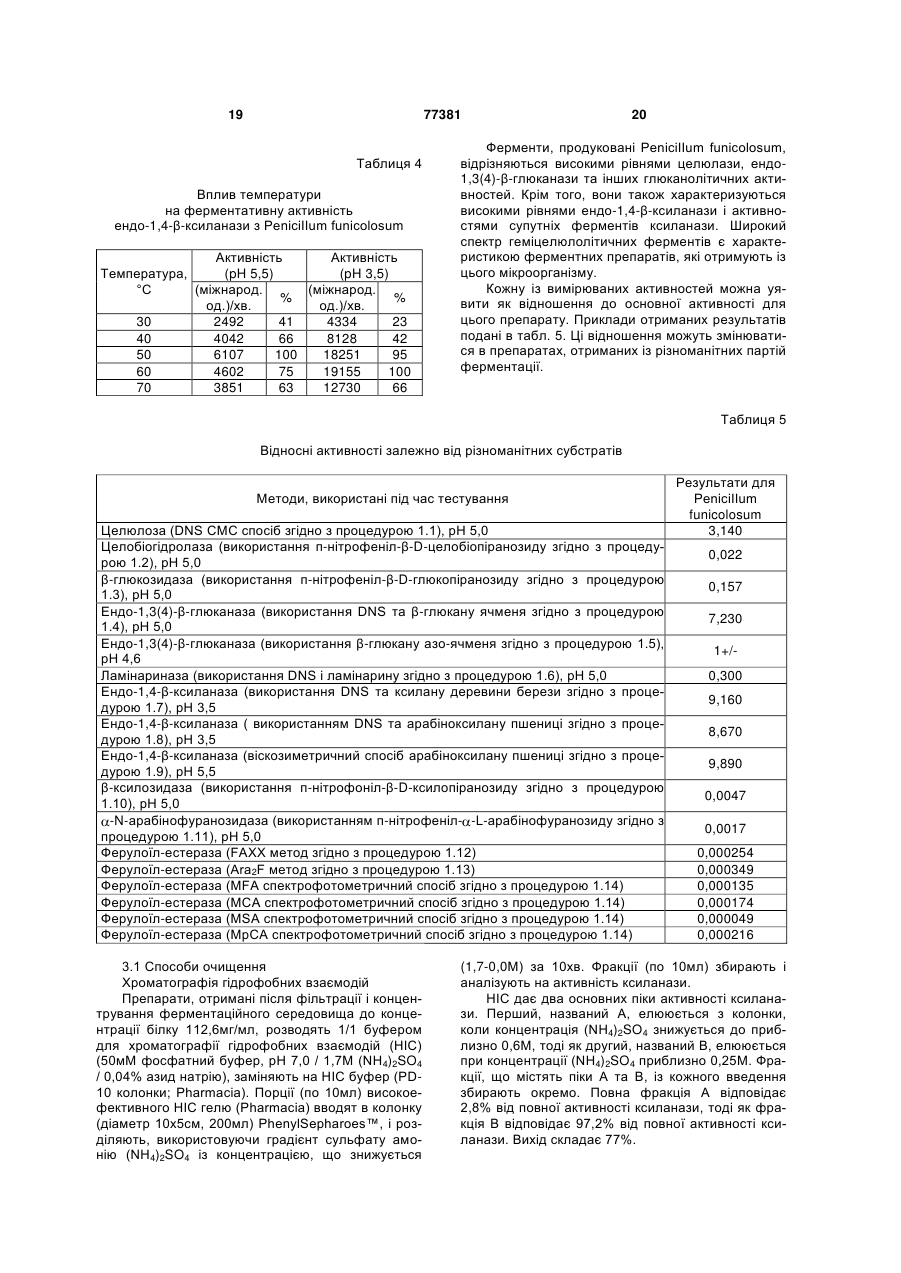
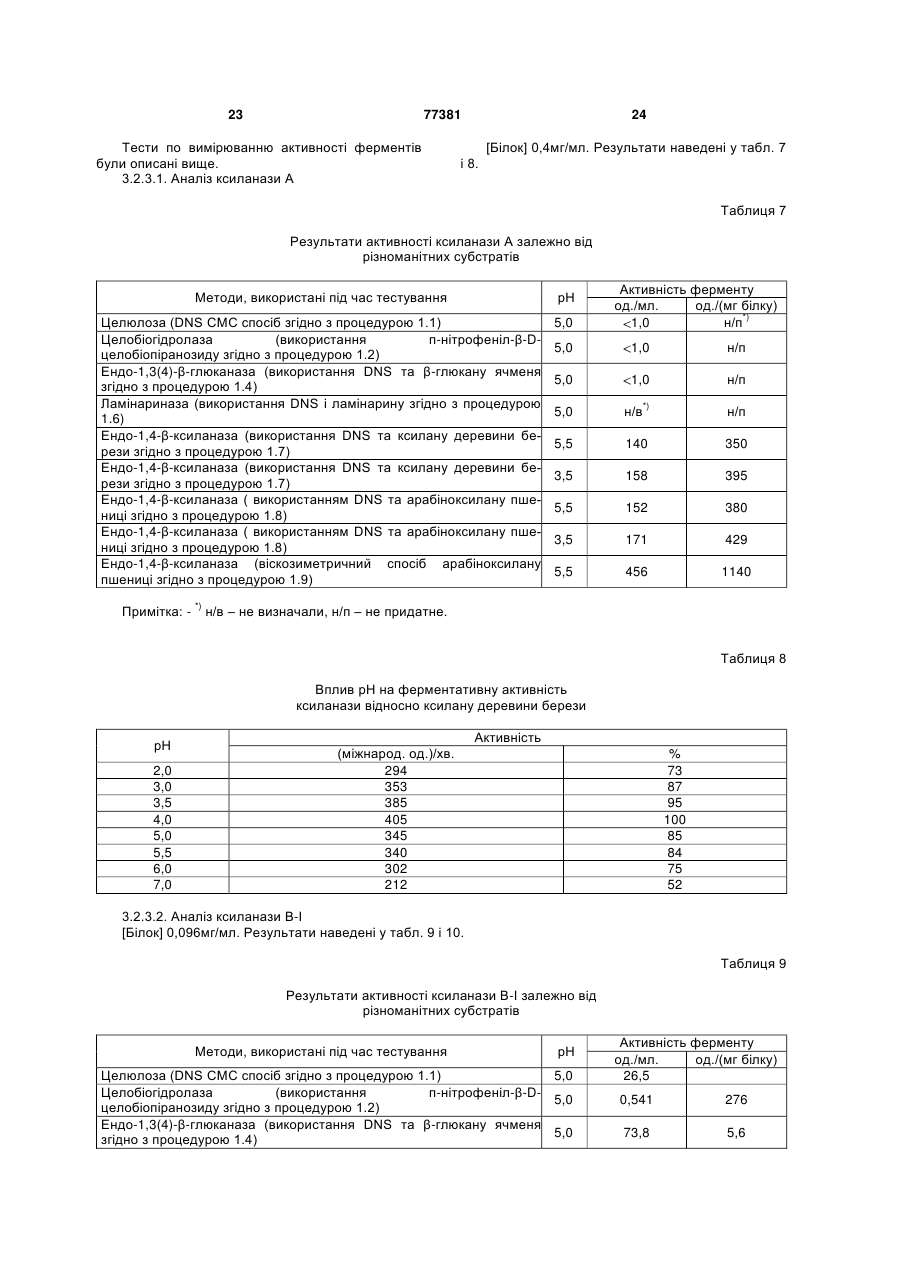
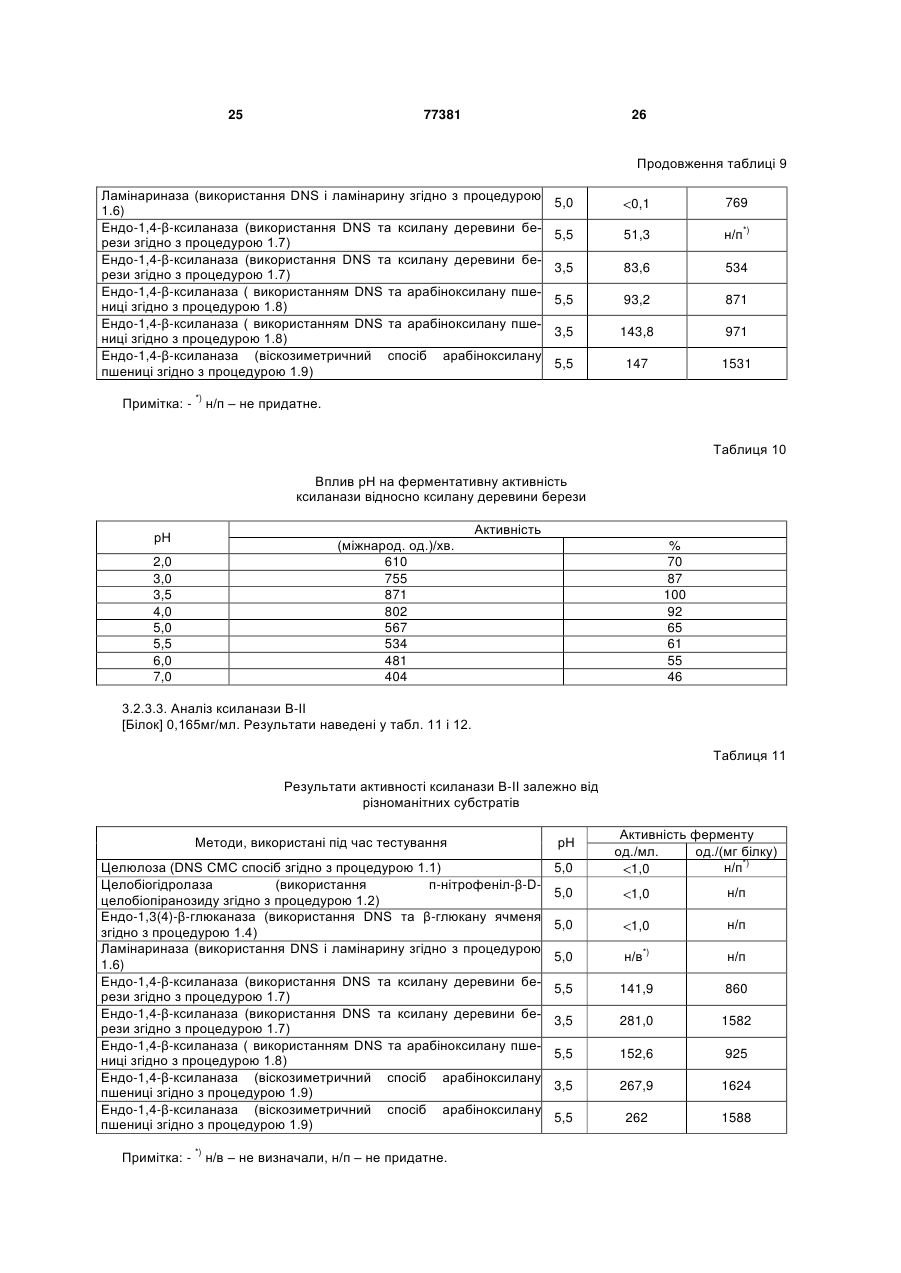
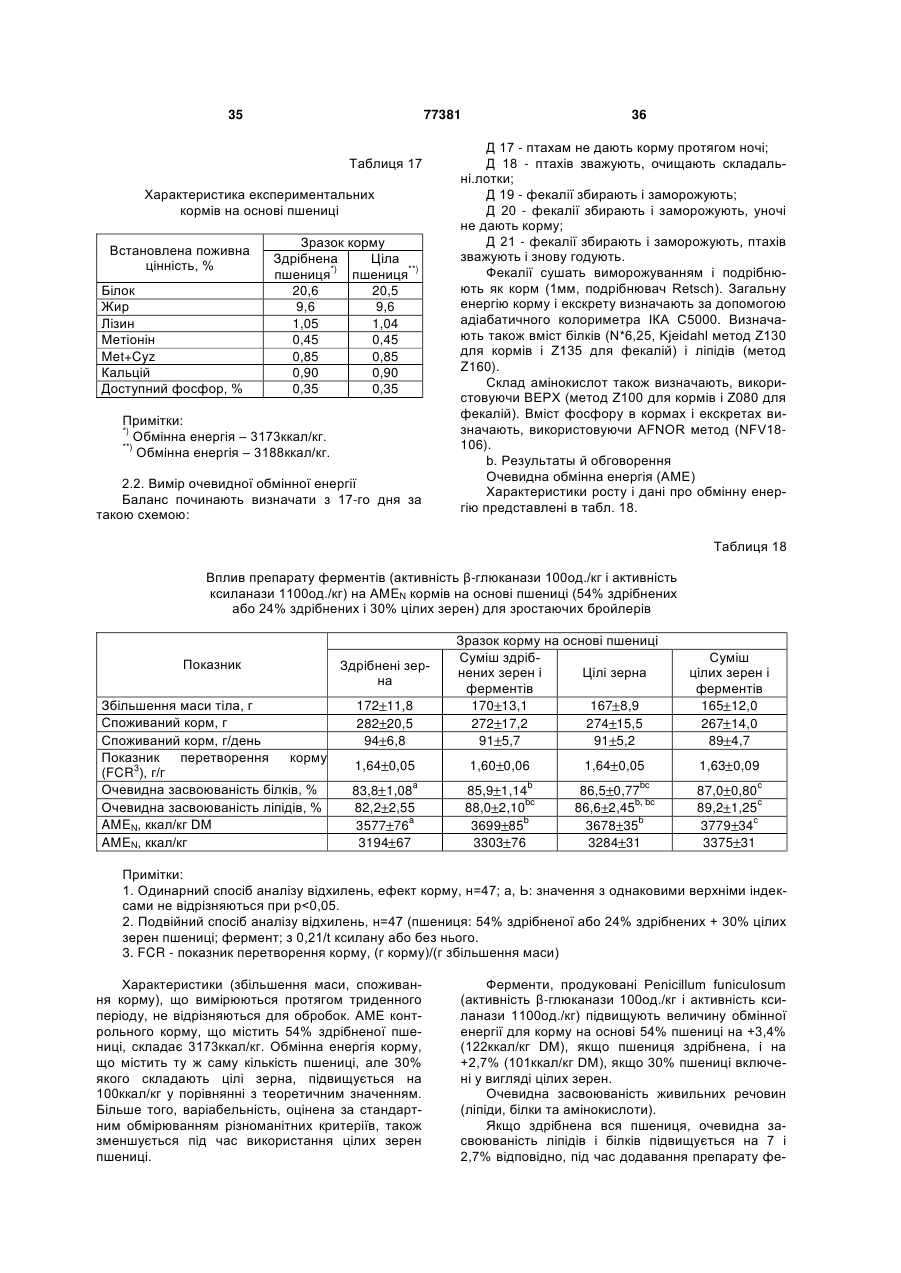
Штам penicillium funiculosum, суміш ферментів, одержуваних з цього штаму, та композиції, що містять суміш ферментів для годівлі тварин
Номер патенту: 77381
Опубліковано: 15.12.2006
Автори: Сабатьє Ален, Фіш Невіл Маршал, Ег Нігель Патерсон
Формула / Реферат
1. Штам Penicillium funiculosum, депонований відповідно до Будапештської угоди у Міжнародному інституті Мікології під № ІМІ № 378536, що застосовується для одержання суміші ферментів для годівлі тварин.
2. Суміш ферментів, одержуваних з Penicillium funiculosum за п. 1.
3. Суміш ферментів за п. 2, що містить принаймні активність ксиланази та активність глюканази.
4. Суміш ферментів за п. 3, що містить принаймні активності ендо-1,3(4)-![]() -глюканази та ендо-1,4-
-глюканази та ендо-1,4-![]() -ксиланази.
-ксиланази.
5. Суміш ферментів за будь-яким з пунктів 2-4, що застосовується для годівлі утримуваних на фермах тварин, таких як птиці, свині і жуйні.
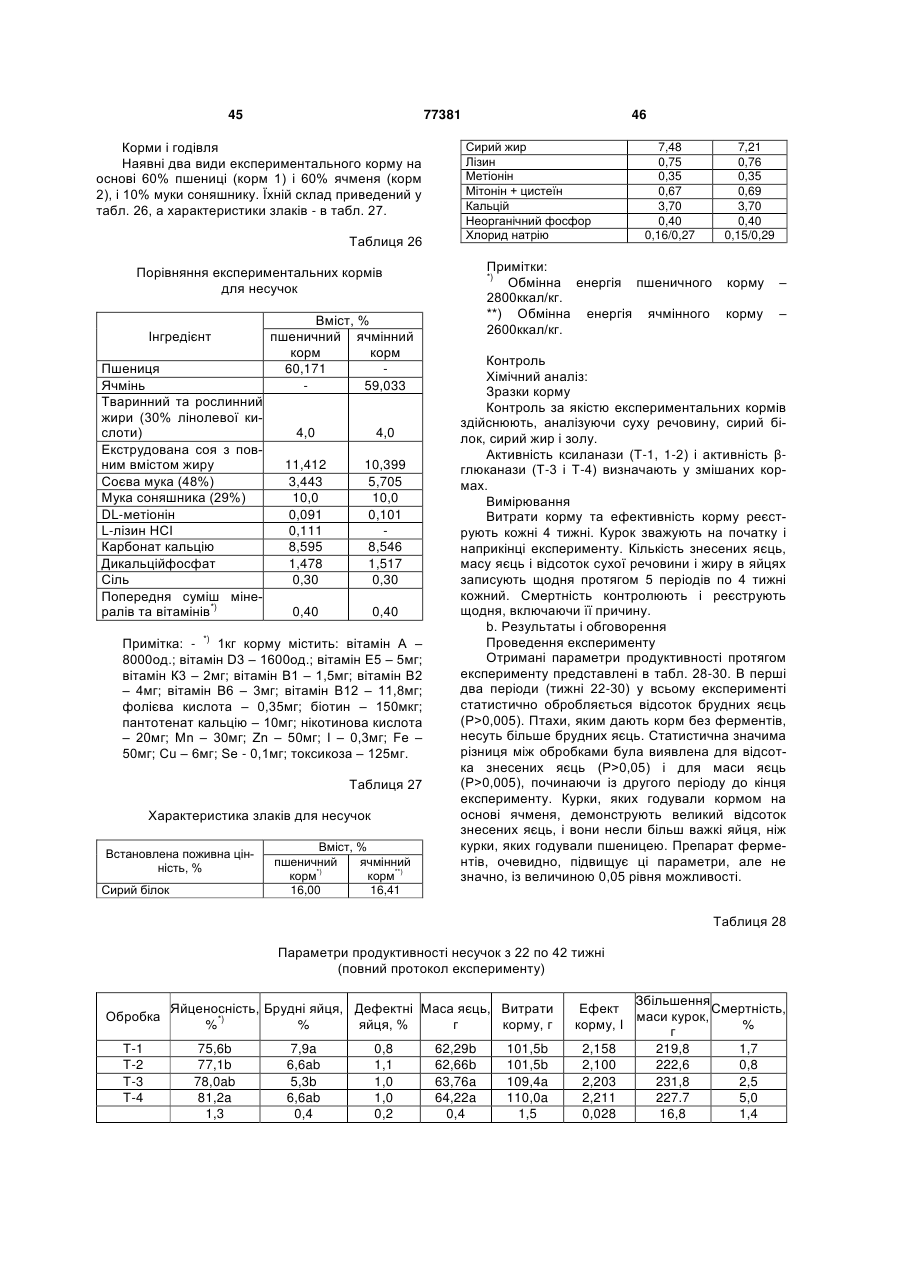
6. Суміш ферментів за пунктом 5, що застосовується для підвищення засвоюваності злакових, таких як пшениця, ячмінь, жито, тритикале, овес, рис, насіння таких олійних як соя, соняшник, рапс; і побічних продуктів обробки зернових, таких як пшеничні висівки.
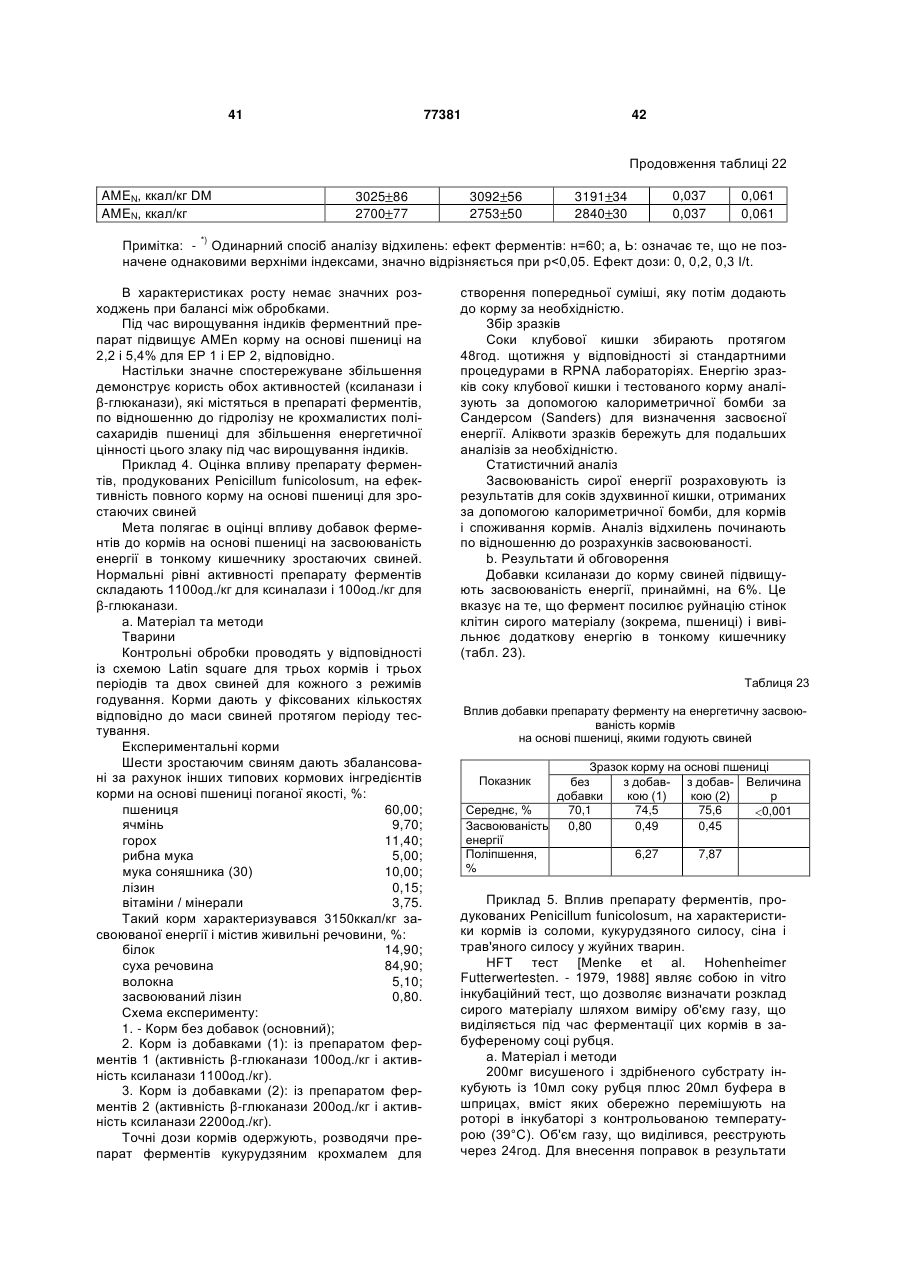
7. Суміш ферментів за будь-яким з пунктів 2-4, що застосовується для зниження екскреції фосфору.
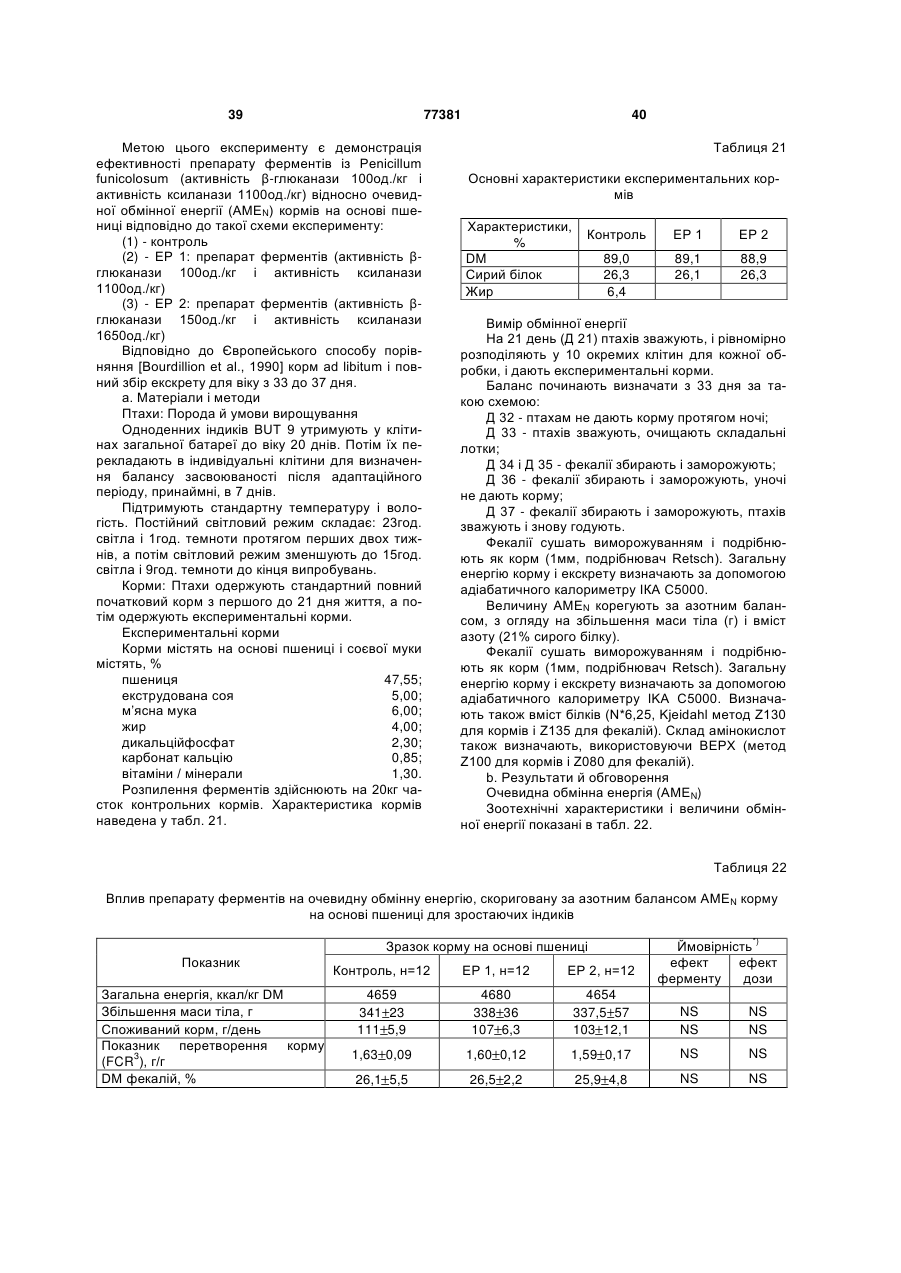
8. Суміш ферментів за будь-яким з пунктів 2-4, що застосовується для підвищення засвоюваності фосфору.
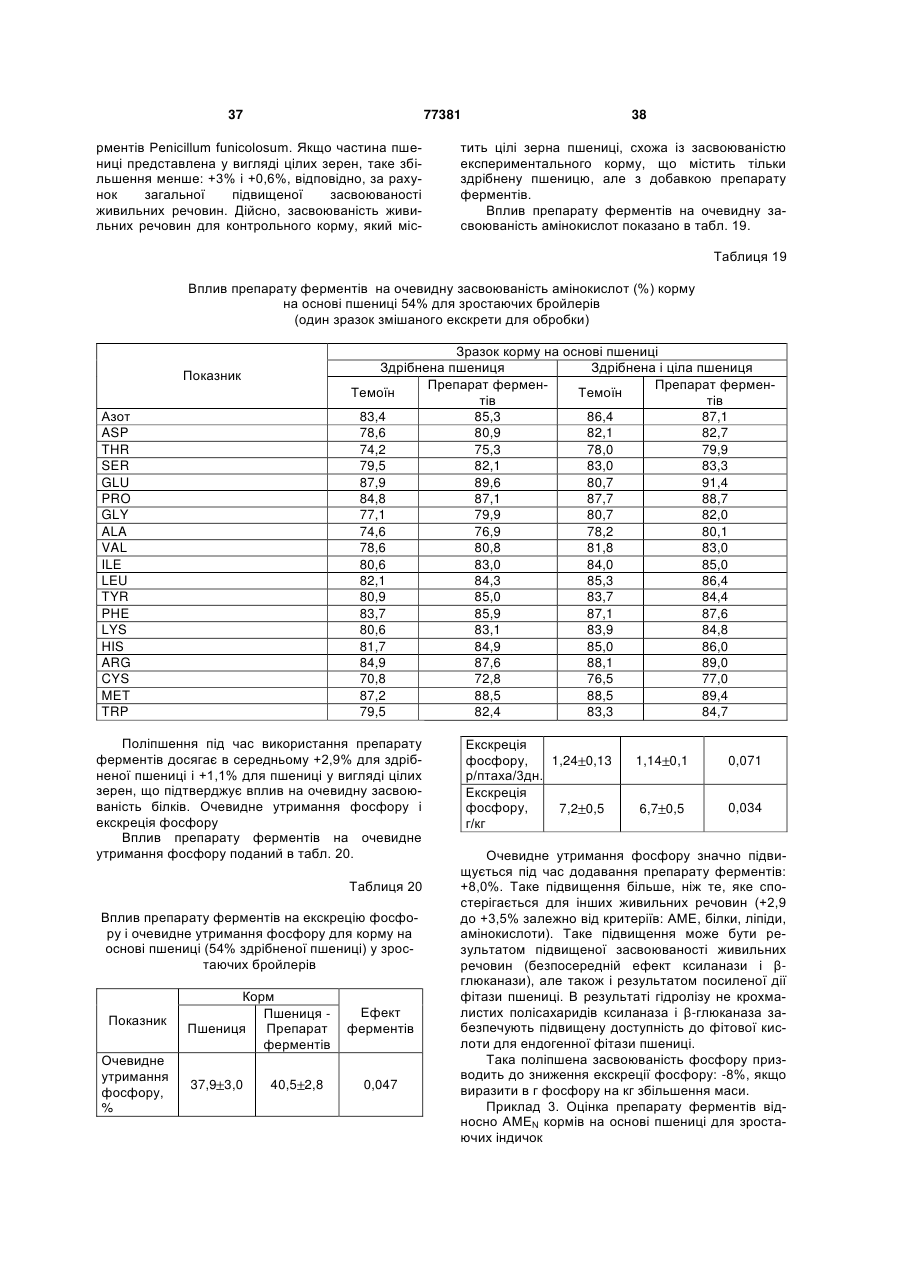
9. Суміш ферментів за будь-яким з пунктів 2-4, що застосовується для підвищення засвоюваності амінокислот.
10. Суміш ферментів за будь-яким з пунктів 2-4, що застосовується для зменшення вмісту аміаку в повітрі батареї клітин.
11. Рідка композиція, що містить:
мікробні продукти як повний вміст органічних твердих речовин з Penicillium funiculosum IMI 378536
4 %-10 %
протимікробний агент
0,005 %-0,35 %
сорбіт
20 %-50 %
концентрований відфільтрований ферментаційний бульйон з Penicillium funiculosum IMI 378536
0,3 до 76 %
забуферена й доведена до рН 3 - 5 композиція.
12. Рідка композиція, за п.11, яка додатково містить антифриз до 40 мас. % композиції.
13. Рідка композиція за п. 12, де антифриз складає 15-40 мас. % композиції.
14. Рідка композиція за пп. 11, 12, де згаданий протимікробний агент складає 0,01-0,25 мас. % композиції.
15. Рідка композиція за пп. 11, 12, де протигрибкові і/або протибактеріальні агенти вибирають із сорбінової кислоти та її солей, бензойної кислоти та її солей, метил-4-гідроксибензоату, н-пропіл-4-гідроксибензоату, фумарової кислоти, солей та естерів.
16. Рідка композиція за п. 15, де згадані солі являють собою хлорид натрію або хлорид калію.
17. Рідка композиція за п. 15 або 16, де антифризи вибирають з групи, що складається з 1,2-пропандіолу, етиленгліколю та гліцерину.
18. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для годівлі утримуваних на фермах тварин, таких як птиці, свині і жуйні.
19. Рідка композиція, за п. 18, що застосовується для підвищення засвоюваності злакових, таких, як пшениця, ячмінь, жито, тритикале, овес, рис, насіння таких олійних як соя, соняшник, рапс; і побічних продуктів обробки зернових, таких як пшеничні висівки.
20. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для зниження екскреції фосфору.
21. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для підвищення засвоюваності фосфору.
22. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для підвищення засвоюваності амінокислот.
23 Рідка композиція за будь-яким з пунктів 11-17, що застосовується для зменшення вмісту аміаку в повітрі батареї клітин.
24. Порошкова композиція, що має такий склад:
мікробні продукти як повний вміст твердих органічних речовин з ферментаційного бульйону Penicillium funiculosum IMI 378536
16 %-40 %
носій
59 %-83 %
інші висушені компоненти ферментаційного бульйону з ферментаційного бульйону Penicillium funiculosum IMI 378536
1 %.
25. Порошкова композиція за п. 24, де носії вибирають з групи, що складається зі пшеничної муки, крохмалю, гіпсу, мальтодекстрину, твердих продуктів обробки кукурудзи, побічних продуктів обробки олійних, таких як соя, соняшник, насіння рапсу; і побічних продуктів обробки зернових, таких як пшеничні висівки.
26. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для годівлі утримуваних на фермах тварин, таких як птиці, свині і жуйні.
27. Порошкова композиція за п. 26, що застосовується для підвищення засвоюваності злакових, таких як пшениця, ячмінь, жито, тритикале, овес, рис, насіння таких олійних як соя, соняшник, рапс; і побічних продуктів обробки зернових, таких як пшеничні висівки.
28. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для зниження екскреції фосфору.
29. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для підвищення засвоюваності фосфору.
30. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для підвищення засвоюваності амінокислот.
31. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для зменшення вмісту аміаку в повітрі батареї клітин.
32. Спосіб одержання суміші ферментів для годівлі тварин, що включає наступні етапи:
(a) ферментацію Penicillium funiculosum за п. 1,
(b) видалення твердих речовин шляхом поділу на тверду та рідку фази,
(c) збирання рідкої фази, та
(d) концентрацію рідкої фази, що містить суміш ферментів.
33. Поліпептид, що має активність ксиланази С, послідовність якого представлена як послідовність з ідент. № 1 і на Фіг. 1, одержаний зі штаму Penicillium funiculosum IMI № 378536.
34. Поліпептид або його варіант, що має активність ксиланази С та кодується нуклеїновою кислотою, виділеною зі штаму Penicillium funiculosum IMI № 378536, що включає послідовність нуклеїнових кислот, представлену як послідовність з ідент. № 1.
35. Поліпептид, що має активність ксиланази ВІ, послідовність якого представлена як послідовність з ідент. № 4 і на Фіг. 2, одержаний зі штаму Penicillium funiculosum IMI № 378536.
36. Поліпептид або його варіант, що має активність ксиланази ВІ та кодується нуклеїновою кислотою, виділеною зі штаму Penicillium funiculosum IMI № 378536, що включає послідовність нуклеїнових кислот, представлену як послідовність з ідент. № 4.
37. Поліпептид, що має активність ферулоїлестерази А, послідовність якого представлена як послідовність з ідент. № 5 і на Фіг. 3, одержаний зі штаму Penicillium funiculosum IMI № 378536.
38. Поліпептид або його варіант, що має активність ферулоїлестерази А та кодується нуклеїновою кислотою, виділеною зі штаму Penicillium funiculosum IMI № 378536, що включає послідовність нуклеїнових кислот, представлену як послідовність з ідент. № 5.
39. Поліпептид, що має активність ферулоїлестерази В, послідовність якого представлена як послідовність з ідент. № 6 та на Фіг. 4, одержаний зі штаму Penicillium funiculosum IMI № 378536.
40. Поліпептид, що має активність ксиланази А, внутрішня амінокислотна послідовність якого представлена як AEAINYNQDY, одержаний зі штаму Penicillium funiculosum IMI № 378536.
Текст
1. Штам Penicillium funiculosum, депонований відповідно до Будапештської угоди у Міжнародному інституті Мікології під №ІМІ №378536, що застосовується для одержання суміші ферментів для годівлі тварин. 2 (19) 1 3 мікробні продукти як повний вміст органічних твердих речовин з Penicillium funiculosum IMI 378536 4%-10% протимікробний агент 0,005%-0,35% сорбіт 20%-50% концентрований відфільтрований ферментаційний бульйон з Penicillium funiculosum IMI 378536 0,3 до 76% забуферена й доведена до рН 3-5 композиція. 12. Рідка композиція, за п.11, яка додатково містить антифриз до 40 мас. % композиції. 13. Рідка композиція за п.12, де антифриз складає 15-40 мас. % композиції. 14. Рідка композиція за пп.11, 12, де згаданий протимікробний агент складає 0,01-0,25 мас. % композиції. 15. Рідка композиція за пп.11, 12, де протигрибкові і/або протибактеріальні агенти вибирають із сорбінової кислоти та її солей, бензойної кислоти та її солей, метил-4-гідроксибензоату, н-пропіл-4гідроксибензоату, фумарової кислоти, солей та естерів. 16. Рідка композиція за п.15, де згадані солі являють собою хлорид натрію або хлорид калію. 17. Рідка композиція за п.15 або 16, де антифризи вибирають з групи, що складається з 1,2пропандіолу, етиленгліколю та гліцерину. 18. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для годівлі утримуваних на фермах тварин, таких як птиці, свині і жуйні. 19. Рідка композиція за п.18, що застосовується для підвищення засвоюваності злакових, таких як пшениця, ячмінь, жито, тритикале, овес, рис, насіння таких олійних як соя, соняшник, рапс; і побічних продуктів обробки зернових, таких як пшеничні висівки. 20. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для зниження екскреції фосфору. 21. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для підвищення засвоюваності фосфору. 22. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для підвищення засвоюваності амінокислот. 23. Рідка композиція за будь-яким з пунктів 11-17, що застосовується для зменшення вмісту аміаку в повітрі батареї клітин. 24. Порошкова композиція, що має такий склад: мікробні продукти як повний вміст твердих органічних речовин з ферментаційного бульйону Penicillium funiculosum IMI 378536 16%-40% носій 59%-83% інші висушені компоненти ферментаційного бульйону з ферментаційного бульйону Penicillium funiculosum IMI 378536 1%. 77381 4 25. Порошкова композиція за п.24, де носії вибирають з групи, що складається зі пшеничної муки, крохмалю, гіпсу, мальтодекстрину, твердих продуктів обробки кукурудзи, побічних продуктів обробки олійних, таких як соя, соняшник, насіння рапсу; і побічних продуктів обробки зернових, таких як пшеничні висівки. 26. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для годівлі утримуваних на фермах тварин, таких як птиці, свині і жуйні. 27. Порошкова композиція за п.26, що застосовується для підвищення засвоюваності злакових, таких як пшениця, ячмінь, жито, тритикале, овес, рис, насіння таких олійних як соя, соняшник, рапс; і побічних продуктів обробки зернових, таких як пшеничні висівки. 28. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для зниження екскреції фосфору. 29. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для підвищення засвоюваності фосфору. 30. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для підвищення засвоюваності амінокислот. 31. Порошкова композиція за будь-яким з пунктів 24, 25, що застосовується для зменшення вмісту аміаку в повітрі батареї клітин. 32. Спосіб одержання суміші ферментів для годівлі тварин, що включає наступні етапи: (a) ферментацію Penicillium funiculosum за п.1, (b) видалення твердих речовин шляхом поділу на тверду та рідку фази, (c) збирання рідкої фази, та (d) концентрацію рідкої фази, що містить суміш ферментів. 33. Поліпептид, що має активність ксиланази С, послідовність якого представлена як послідовність з ідент. №1 і на Фіг.1, одержаний зі штаму Penicillium funiculosum IMI №378536. 34. Поліпептид або його варіант, що має активність ксиланази С та кодується нуклеїновою кислотою, виділеною зі штаму Penicillium funiculosum IMI №378536, що включає послідовність нуклеїнових кислот, представлену як послідовність з ідент. № 1. 35. Поліпептид, що має активність ксиланази ВІ, послідовність якого представлена як послідовність з ідент. №4 і на Фіг.2, одержаний зі штаму Penicillium funiculosum IMI №378536. 36. Поліпептид або його варіант, що має активність ксиланази ВІ та кодується нуклеїновою кислотою, виділеною зі штаму Penicillium funiculosum IMI №378536, що включає послідовність нуклеїнових кислот, представлену як послідовність з ідент. №4. 37. Поліпептид, що має активність ферулоїлестерази А, послідовність якого представлена як послідовність з ідент. №5 і на Фіг.3, одержаний зі штаму Penicillium funiculosum IMI №378536. 38. Поліпептид або його варіант, що має активність ферулоїлестерази А та кодується нуклеїновою кислотою, виділеною зі штаму Penicillium funiculosum IMI №378536, що включає послідов 5 77381 6 ність нуклеїнових кислот, представлену як послідовність з ідент. №5. 39. Поліпептид, що має активність ферулоїлестерази В, послідовність якого представлена як послідовність з ідент. №6 та на Фіг.4, одержаний зі штаму Penicillium funiculosum IMI №378536. 40. Поліпептид, що має активність ксиланази А, внутрішня амінокислотна послідовність якого представлена як AEAINYNQDY, одержаний зі штаму Penicillium funiculosum IMI №378536. Даний винахід відноситься до нового мікроорганізму, нових ферментів і нової суміші ферментів. Крім того, цей винахід відноситься до композиції суміші ферментів, до її одержання і використання в харчовій промисловості, у виробництві кормів та в інших галузях промисловості, включаючи (але не обмежуючись ними) паперову і текстильну промисловість. Протягом тривалого часу ферменти використовували для широкого кола різноманітних промислових застосувань. Відомими є приклади з хлібопекарської промисловості, виноробства і виробництва фруктових соків (де ферменти використовують для руйнування пектинів і β-глюканів), текстильної промисловості (де целюлази використовують для одержання м'яких і гладеньких целюлозних тканин) і також, що аж ніяк не є останнім застосуванням, для приготування кормів для тварин. У цьому випадку ферменти покращують перетравлення кормів із рослинних джерел. Останнє застосування забезпечує більш ефективне перетравлення корму тваринами. Цінність корму можна визначити за FCR (Feed Conversion Ratio або витрати корму на одиницю продукції), живильною цінністю, кількістю корму, який витрачають, по відношенню до збільшення маси тварини. Зниження величини FCR для корму вказує на пропорційне збільшення маси тварини, тобто на те, що тварина здатна використовувати корм більш ефективно. Погана засвоюваність компонентів корму (крохмаль, жир, білок/амінокислоти) є відмінною особливістю кормів на основі злакових і, наприклад, особливо тих, в яких вміст ячменю або пшениці є високим. В цих випадках може виявитися необхідним підготовляти корми так, щоб вони містили більш високі рівні енергії з інших джерел та таких інших добавок, як амінокислоти. Ці ферменти підвищують величину очевидної обмінної енергії (Apparent Metabolizabie Energy) включених в корм злакових. Іншим підходом до розв'язання цієї проблеми було уведення ферментних добавок, целюлаз, ендо-1,3(4)-β-глюканаз(β-глюканази), ендо-1,4-βксиланаз (ксиланази) і т.д., або сумішей ферментних активностей до таких кормів на основі злакових. Ферментні добавки можуть мати специфічне застосування для гідролізу β-глюканів або для гідролізу арабі-ноксиланів, які перебувають в злакових (звичайно в ячмені і пшениці). Додавання ферментів переслідує різноманітні цілі. Однією з переваг, яка, безумовно, забезпечує ефективність ферментних добавок до кормів, є зниження в'язкості матеріалів у травному тракті тварин, що одер жують корм на основі злакових, який містить відповідну ферментну добавку. Вища в'язкість обумовлена, частково, присутністю β-глюканів і арабіноксиланів у ячмені та пшениці. Нижча в'язкість, що є результатом дії ферментів, забезпечує більш легку абсорбцію живильних компонентів у травному тракті тварин. Іншою перевагою є виділення живильних речовин, що містяться в стінках клітин злакових, що знижує необхідність в інших дорогих кормових добавках. Загальним результатом є значне зниження вартості кормів з аналогічним або більш високим ефектом за вимірами FCR. Було розкрито, що ферментні препарати, отримані із широкого кола різноманітних мікроорганізмів, підвищують засвоюваність кормів. З урахуванням відомого рівня, пов'язаного з використанням ферментів в кормах для тварин, автори вказують європейську патентну заявку [EP, 0699762], в якій розкрито використання виділеної з Schwanniomyces occidentalis фітази. Ця фітаза являє собою фітазу, отриману з генетично модифікованого організму, отриманого шляхом вбудовування клонованого гену, чого автори хотіли б уникнути в даному винаході. Що стосується патентної заявки [WO, 95/26398], там модифіковану целюлазу також одержують шляхом вбудовування чужорідної послідовності ДНК в клітину-хазяїна, яка модифікує природу вихідного штаму, що обраний із такого переліку мікроорганізмів: Bacillus, Streptomyces, Saccharomyces, Schizosacch aromyces, Aspergillus. Основною метою авторів даного винаходу було уникнути вбудовування чужорідного гена в мікроорганізм, який продукує фермент. В патентній заявці [WO, 96/05739] суміш ферментів (ксиланази, протеази і необов'язково βглюканази) одержують із різноманітних мікроорганізмів. Автори наводять приклад (суміші ферментів з відношенням ксилазної активності до βглюканазноі активності порядку 1:5. Було виявлено, що коли ксилаза включена в раціон на основі злакових в оптимальній дозі або близько до цього, спільна присутність ферментів, які виявляють βглюканазну активність, підвищує FCR корму, що, природно, невигідно. Відповідно, автори виступають проти присутності β-глюканази, вони рекомендують максимальне відношення ксиланазної активності до β-глюканазної активності як 1:(0-0,25). В деяких випадках, для того, щоб забезпечити всі ферментні активності, пов'язані із застосуванням кормів, доводиться одержувати препарати з препаратів, отриманих більш ніж з одного мікроорганізму. В ряді випадків ферментні препарати були отримані з мікроорганізмів, які піддавалися гене 7 тичним модифікаціям із використанням методик рекомбінантних ДНК. Автори виявили новий мікроорганізм, що належить до класу РеnісіІІum funicolosum, який містить нові ферменти, і розробили суміш ферментних активностей, яку з успіхом можна використовувати для підвищення, головним чином, засвоюваності кормів для тварин на основі злакових. Відповідно, даний винахід відноситься до нового мікроорганізму, отриманого з РеnісіІІum funicolosum, та до способу культивування цього мікроорганізму і виділення ферментів, які продукує цей мікроорганізм. Крім того, згідно із даним винаходом, запропоновані нові ферменти, виділені з цього мікроорганізму, їх послідовності нуклеїнових кислот і нові композиції, що містять ці ферменти. Далі, відповідно до цього винаходу, запропоновано спосіб підвищення засвоюваності амінокислот і кормів для тварин на основі амінокислот і злакових. Іншою метою даного винаходу є зменшення виділення фосфору і виділення аміаку з клітинної батареї, де годують тварин. А. Новий штам РеnісіІІum funicolosum Цей новий штам грибків РеnісіІІum funicolosum депонований під реєстраційним номером ІМІ378536 в ізмасатному Міжнародному Депозитарії у відповідності із Будапешською Угодою (1977р.), Міжнародним Інститутом Мікології (International Mycological Institute (ІМІ), Bakeham Lane, Engiefield Green, Egham, Surrey, TW209TY, UK). Походження Новий штам отримано із РеnісіІІum funicolosum ІМІ 134756 після успішного УФ опромінення і βопромінення спор, включно із скринуванням на селективному середовищі. Ніяких генетичних модифікацій не було отримано за допомогою методик рекомбінантних ДНК із використанням вбудовування чужорідних ДНК або РНК. Ідентифікація і типування РеnісіІІum funicolosum ІМІ 134756 було охарактеризовано шляхом вирощування на Czapek Dox агарі при 25°С. Характеристики колонії і мікроморфологія є типовими для РеnісіІІum funicolosum. Ідентифікація мікроорганізму як РеnісіІІum funicolosum була підтверджена в Міжнародному Інституті Мікології (International Mycological Institute (ІМІ), Bakeham Lane, Engiefield Green, Egham, Surrey, TW209TY, UK). Ріст схожий на щільно базальну повстину, з аеральним ростом, у вигляді ниток або вузликів гіфів (funiculose), міцелій білого кольору з основою червоного кольору в субстраті, поля, навпаки, бліді, але пофарбовані червоним у напрямку до центрів, можуть ставати темночервоними. Це типовий пеніцилін, він демонструє короткий кондіофорез, що виникає, головним чином, із funicles, biverticillate, голчастих, конідіогенних клітин, конідії еліптичні та гладенькі. Мікроорганізм, використаний для одержання препарату ферментів даного винаходу, вирощують в аеробних умовах в середовищі, яке містить це 77381 8 люлозу, сироп від замочування кукурудзи, карбонат кальцію і сульфат амонію. В. Процес ферментації Ці нові грибки одержують шляхом ферментації депонованого штаму спочатку на засіяному середовищі, яке переважно складається з, мас. %: розчин від замочування кукурудзи 1-4; агент, що перешкоджає пінощоб уникнути утворенню утворення піни; води до 100; NaOH (перед стерилізацією середовища) до рН 3,0-6,0. Температура інкубування 27-36°С. Ферментаційне середовище переважно має такий склад, мас. %: розчин від замочування кукурудзи 0-4; целюлоза (занурюють та подають) 0,8-14,0; сіль кальцію 0-0,8; сульфат амонію 0-1,0; агент, що перешкоджає пінощоб уникнути утворенню утворення піни; вода до 100; NaOH (перед стерилізацією середовища) до рН 3,0-6,0; H2SO4 для підтримання рН 3,0-6,0; аміак для підтримання рН 3,0-6,0. Температура інкубування 27-36°С. Для ферментації у ферментер завантажують достатню кількість води, додають інгредієнти до води в прийнятному контейнері із пристосуванням для перемішування, перемішують доти, поки інгредієнти не розчиняться. Стерилізують, герметизуючи ферментер і підвищуючи температуру вмісту звичайно до 121°С. Вміст ферментера інокулюють за-травним ферментаційним середовищем. Основним джерелом вуглецю, який додають в процесі ферментації, є целюлоза; із різноманітних джерел целюлози автори надають перевагу використанню ARBOCEL, SOLKAFLOC CLAROCEL, ALPHACEL, FIBRACEL різноманітних ступенів чистоти. Величину рН в процесі ферментації переважно контролюють, додаючи сірчану кислоту або іншу кислоту й аміак у газоподібному або рідкому вигляді, чи іншу основу. У кінці ферментації тверді речовини видаляють фільтруванням або центрифугуванням, збирають і концентрують рідку фазу, наприклад, ультрафільтрацією або на органічних або мінеральних мембранах. Ці ферменти можна також одержати за допомогою методик рекомбінантних ДНК, і таким чином вони будуть продукуватися рекомбінантними гомологічними або гетерологічними видами. Хазяїна для переносу гена, що кодує фермент, можна вибрати з видів грибків, бактеріальних клітин або рослинних клітин. Для вбудовування гену, кодуючого потрібний фермент, в такі клітини-хазяїни як плазміди (інтегративно або ні), вектори фагів та 9 77381 вектори вірусів, можна використовувати будь-які зручні способи. РеnісіІІum funicolosum, що включає вставку гетерологічних генів або модифікацію геному гомологічними генами за рахунок вставок, делецій або модифікацій зазначеного гомологічного гену, також є частиною даного винаходу. Відповідно до даного винаходу, можна одержати фермент у вигляді виділеного чистого препарату ферменту або у вигляді неочищеного препарату, такого, як культуральне середовище, в якому вирощували РеnісіІІum funicolosum. Можна також включити цей фермент або ці ферменти в композиції, які містять ще один фермент, тип якого залежить від передбачуваного використання композиції. Добавлені ферменти можна вибрати, наприклад, серед карбогідраз, ліпаз та протеаз. С. Композиції, що складаються з "суміші ферментних активностей" 1. Рідка композиція Для рідкої композиції після додавання протимікробних агентів здійснюють вимір концентрації ферментів і розведення до потрібної концентрації. Кращим складом рідкого розчину є такий: мікробні продукти у вигляді всіх органічних твердих речовин 4-10% протимікробний агент 0-0,35% сорбіт 20-50% антифріз (необов’язково) 0-40% концентрований відфільтро***) ваний бульйон 0,3-76% забуферений з доведенням рН 3-5. Протимікробний агент вибирають із таких продуктів, як сорбінова кислота та її солі, бензойна кислота та її солі, метил-4-гідроксибензоат та нпропіл-4-гідроксибензоат, фумарова кислота, солі та естери. Можна також використовувати такі солі, як хлорид натрію або хлорид калію. Найкращими антифрізами є 1,2-пропандіол, етиленгліколь, гліцерин. 2. Порошкова композиція Для одержання порошкових препаратів отриманий концентрований розчин сушать необов'язково у присутності носія. Порошок, отриманий в результаті сушіння концентрованого розчину без присутності носія, можна згодом змішати з придатним носієм. Кращим складом порошкової форми композиції є такий, %: мікробні продукти у вигляді всіх органічних твердих речовин 16%-40% носій 59%-83% інші висушені компоненти ферментаційного бульйону 1% Кращі носії обирають з пшеничної муки, крохмалю, гіпсу, мальтодекстрину, твердих продуктів кукурудзи, таких побічних продуктів, отриманих під час обробки злакових культур, як кукурудзяна крупа, другосортна пшениця, пшеничні висівки, відходи під час обробки рису, суміш мінералів. Fr Tсубстрату Т води Т тест Т води Fr Tсубстрату Т води Т тест Т води 10 D. Характеристики ферментів Отримано нову суміш ферментів, продукованих РеnісіІІum funicolosum. Ця суміш ферментів містить такі нові ферменти, як целюлази, βглюканази, ксиланази, такі супутні ксиланазні ферменти, як арабінофуранозидази та ферулоїлестерази. 1. Процедура Ферментний препарат охарактеризовано в різноманітних аналізах, що включають аналізи активностей целюлази, целобіогідролази, βглюкозидази, ендо-1,3 (4)-β-глюканази, ламінариназо-ендо-1,4-р-ксиланази (із використанням різноманітних субстратів), (β-ксилозидази, арабінофуранозидази і ферулоїлестерази (із використанням різноманітних субстратів). 1.1. DNS CMC спосіб аналізу целюлази Аналіз активності целюлази базується на ферментному гідролізі глікозидних зв'язків у карбоксиметилцелюлозі (CMC), β-1,4-глюкані. Продукти реакції, олігосахариди β-1,4-глюкану, визначають за збільшенням рівня відновлення (як глюкозу). Розчин, що містить 1мл (1%, мас./об.) розчину CMC у 0,1Μ натрій-ацетатному буфері, рН 5,0 (або інші значення рН); 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 10хв. Ферментну реакцію зупиняють, додаючи 2мл DNS розчину (1%, мас./об. 3,5динітросаліцилової кислоти, 16% мас./об. гідроксиду натрію, 30% мас./об. калій-натрій (+)-тартрату в дистильованій воді). Цей розчин перемішують і поміщають в баню з киплячою водою (мінімум 95°С) на 5хв., потім охолоджують до 25°С. До розчину додають 10мл дистильованої води, і поглинання вимірюють при 540нм, використовуючи скляну кювету товщиною 2см. Отриманий результат перетворюють в мкмоль відновленого цукру (як глюкоза), порівнюючи зі стандартною кривою для 2мл 0,00-0,04% (мас./об.) розчинів глюкози, оброблених аналогічним способом розчином DNS. У спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій DNS розчин добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності целюлази визначають як кількість ферменту, яке продукує 1мкмоль глюкозного еквіваленту в 1хв. в умовах аналізу (50°С і рН 5,0 або при інших значеннях рН). 1.2. Аналіз целобіогідролази з використанням п-нітрофеніл-β-D-целобіопіранозиду Аналіз целобіогідролази базується на ферментному гідролізі п-нітрофеніл-β-Dцелобіопіранозиду. Продукт реакції, п-нітрофенол, визначають колориметрично. Розчин, що містить 1моль 0,1% (мас./об.) пнітрофеніл-β-D-целобіопіранозиду в дистильованій воді; 1мл дистильованої води; 1мл 0,2Μ натрійацетатного буферу, рН 5,0; 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 30хв. Ферментну реакцію зупиняють, додаючи 4мл 0,4Μ розчину гліцину. Цей розчин перемішують і охолоджують до 20°С. Погли 11 нання вимірюють на 400нм, використовуючи скляну кювету товщиною 1см. Отриманий результат перетворюють у мкмоль п-нітрофенолу, порівнюючи з коефіцієнтом молярної екстинкції п-нітрофенолу в цих же умовах. У спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій розчин гліцину добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності целобіогідролази визначають як кількість ферменту, що продукує 1мкмоль п-нітрофенолу з п-нітрофеніл-β-D-целобіопіранозиду в 1хв. в умовах аналізу (50°С і рН 5,0). 1.3. Аналіз β-глюкозидази з використанням пнітрофеніл-β-D-глюкопіранозиду Аналіз р-глюкозидази базується на ферментному гідролізі п-нітрофеніл-β-D-глюкопіранозиду. Продукт реакції, п-нітрофенол, визначають колориметрично. Розчин, що містить 1мл 0,1% (мас./об.) пнітрофеніл-β-D-глюкопіранозиду в дистильованій воді; 1мл дистильованої води; 1мл 0,2Μ натрійацетатного буферу, рН 5,0; 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 30хв. Ферментну реакцію зупиняють, додаючи 4мл 0,4Μ розчину гліцину. Цей розчин перемішують і охолоджують до 20°С. Поглинання вимірюють на 400нм, використовуючи скляну кювету товщиною 1см. Отриманий результат перетворюють у мкмоль п-нітрофенолу, порівнюючи з коефіцієнтом молярної екстинкції п-нітрофенолу в цих же умовах. В спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій розчин гліцину добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності р-глюкозидази визначають як кількість ферменту, що продукує 1мкмоль п-нітрофенолу з п-нітрофеніл-β-D-глюкопіранозиду в 1хв. в умовах аналізу (50°С та рН 5,0). 1.4. Аналіз ендо-1,3(4)-β-глюканази із використанням DNS та β-глюкану ячменя Аналіз активності ендо-1,3(4)-β-глюканази базується на ферментному гідролізі глікозидних зв'язків у β-глюкані ячменя, β-1,3(4)-глюканази. Продукти реакції, олігосахариди β-1,3(4)-глюкану, визначають за кінцевим збільшенням рівня відновлення (як глюкози). Розчин, що містить 1мл 1% (мас./об.) розчину β-глюкану ячменя в 0,1Μ натрій-ацетатному буфері, рН 5,0 (або при інших значеннях рН); 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 10хв. Ферментну реакцію зупиняють, додаючи 2мл DNS розчину (1%, мас./об.) 3,5-динітросаліцилової кислоти, 1,6% (мас./об.) гідроксиду натрію, 30% (мас./об. ) калій-натрій (+)-тартрату в дистильованій воді). Цей розчин перемішують і поміщають в баню з киплячою водою (мінімум 95°С) на 5хв., потім охолоджують до 25°С. До розчину добавляють 10мл дистильованої води, і поглинання вимірюють при 540нм, використовуючи скляну кювету товщиною 2см. 77381 12 Отриманий результат перетворюють в мкмоль відновленого цукру (як глюкози), порівнюючи із стандартною кривою для 2мл 0,00-0,04% (мас./об.) розчинів глюкози, оброблених аналогічним способом розчином DNS. В спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій DNS розчин добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності ендо-1,3(4)-β-глюканази визначають як кількість ферменту, що продукує 1мкмоль глюкозного еквіваленту в 1хв. в умовах аналізу (50°С та рН 5,0 або при інших значеннях рН). 1.5. Аналіз ендо-1,3(4)-β-глюканази із використанням β-глюкану азо-ячменя Аналіз активності ендо-1,3(4)-β-глюканази базується на ферментному гідролізі β-глюкану ячменя, в якого є зв'язаний хромофор (β-глюкан азоячменя). Продукти реакції, олігомери, які розчиняються після осадження етанолом, визначають за спостережуваним збільшенням поглинання при 590нм. Розчин, що містить 0,5мл субстрату β-глюкану азо-ячменя (в формі, що готова для використання) та 0,2мл розведення ферменту (який містить від 0,15 до 0,60од/мл у CMC в 0,01Μ натрійацетатному буфері, рН 4,6), інкубують при 30°С точно протягом 20хв. Ферментну реакцію зупиняють, додаючи 2,5мл осаджуючого розчину (що містить 18,1г ацетату натрію і 3,0г цинкової суміші, перемішаних в 300мл стакані з дистильованою водою, рН доводять до 5,0 соляною кислотою, переносять вміст у 1л мірну колбу і доводять до потрібного об'єму 96% (об./об.) етанолом). Розчин перемішують і залишають при кімнатній температурі на 10хв. Розчин переносять у центрифужну ампулу центрифугують при 1000г протягом 10хв. у лабораторній центрифузі. Поглинання рідини над осадом вимірюють при 590нм, використовуючи скляну кювету товщиною 1см. В спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій осаджуючий розчин добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності ендо-1,3(4)-β-глюканази визначають як кількість ферменту, що гідролізує субстрат, забезпечуючи величину поглинання 0,820од. при 590нм, використовуючи стандартний субстрат в умовах аналізу (30°С і рН 4,6). 1.6. Аналіз ламінаринази (ендо-1,3-βглюканази) із використанням DNS і ламінарину Аналіз активності ламінаринази (ендо-1,3-βглюканази) базується на ферментному гідролізі глікозидних зв'язків у ламінарині, β-1,3-глюкані. Продукти реакції, олігосахариди β-1,3-глюкану, визначають за кінцевим збільшенням рівня відновлення (як глюкози). Розчин, що містить 1мл 1% (мас./об.) розчину ламінарину в 0,1Μ натрій-ацетатному буфері, рН 5,0; 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 10хв. Ферментну реакцію зупиняють, додаючи 2мл DNS розчину (1%, мас./об.) 3,5-динітро-саліцилової 13 кислоти, 1,6% (мас./об.) гідроксиду натрію, 30% (мас./об.) калій-натрій (+)-тартрату в дистильованій воді). Цей розчин перемішують і поміщають в баню з киплячою водою (мінімум 95°С) на 5хв., потім охолоджують до 25°С. До розчину добавляють 10мл дистильованої води, і поглинання вимірюють при 540нм, використовуючи скляну кювету товщиною 2см. Отриманий результат перетворюють у мкмолі відновленого цукру (як глюкози), порівнюючи зі стандартною кривою для 2мл 0,00-0,04% (мас./об.) розчинів глюкози, оброблених аналогічним способом розчином DNS. В спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій DNS розчин добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності ламінаринази визначають як кількість ферменту, що продукує 1мкмоль глюкозного еквіваленту в 1хв. в умовах аналізу (50°С і рН 5,0). 1.7. Аналіз ендо-1,4-β-ксиланази із використанням DNS та ксилану деревини берези Аналіз активності ендо-1,4-β-ксиланази базується на ферментному гідролізі ксилозидних зв'язків в ксилані деревини берези, β-1,4 ксилані. Продукти реакції, олігосахариди β-1,4-ксилану, визначають за кінцевим збільшенням рівня відновлення (як ксилози). Розчин, що містить 1мл 1% (мас./об.) розчину ксилану деревини берези в 0,1Μ натрійацетатному буфері, рН 5,0 (або при інших значеннях рН); 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 10хв. Ферментну реакцію зупиняють, додаючи 2мл DNS розчину (1%, мас./об.) 3,5-динітросаліцилової кислоти, 1,6% (мас./об.) гідроксиду натрію, 30% (мас./об.) калій-натрій (+)-тартрату в дистильованій воді). Цей розчин перемішують і поміщають в баню з киплячою водою (мінімум 95°С) на 5хв., потім охолоджують до 25°С. До розчину добавляють 10мл дистильованої води, і поглинання вимірюють при 540нм, використовуючи скляну кювету товщиною 2см. Отриманий результат перетворюють в мкмоль відновленого цукру (як ксилози), порівнюючи зі стандартною кривою для 2мл 0,00 - 0,03 % (мас./об.) розчинів ксилози, оброблених аналогічним способом розчином DNS. В спостережуване поглинання для розчинів ферментних реакції вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій DNS розчин добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності ендо-1,4-β-ксиланази визначають як кількість ферменту, що продукує 1мкмоль ксилозного еквіваленту в 1хв. в умовах аналізу (50°С і рН 5,0 або при інших значеннях рН). 1.8. Аналіз ендо-1,4-β-ксиланази із використанням DNS та арабіноксилану пшениці Аналіз активності ендо-1,4-β-ксиланази базується на ферментному гідролізі ксилозидних зв'язків в арабіноксилані пшениці, заміщеному арабінозою β-1,4-ксилані. Продукти реакції, олігосахариди 77381 14 арабіно-β-1,4-ксилану, визначають за кінцевим збільшенням рівня відновлення (як ксилози). Розчин, що містить 1мл 1% (мас./об.) розчину арабіноксилану в 0,1Μ натрій-ацетатному буфері, рН 5,0 (або при інших значеннях рН); 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 10хв. Ферментну реакцію зупиняють, додаючи 2мл DNS розчину (1%, мас./об.) 3,5-динітро-саліцилової кислоти, 1,6% (мас./об.) гідроксиду натрію, 30% (мас./об.) калійнатрій (+)-тартрату в дистильованій воді). Цей розчин перемішують і поміщають в баню з киплячою водою (мінімум 95°С) на 5хв., потім охолоджують до 25°С. До розчину добавляють 10мл дистильованої води, і поглинання вимірюють при 540нм, використовуючи скляну кювету товщиною 2см. Отриманий результат перетворюють у мкмоль відновленого цукру (як ксилоза), порівнюючи зі стандартної кривою для 2мл 0,00-0,03% (мас./об.) розчинів ксилози, оброблених аналогічним способом розчином DNS. В спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій DNS розчин добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності ендо-1,4-β-ксиланази визначають як кількість ферменту, що продукує 1мкмоль ксилозного еквіваленту в 1хв. в умовах аналізу (50°С та рН 5,0; або при інших значеннях рН). 1.9. Аналіз ендо-1,4-β-ксиланази віскозиметричним способом із використанням арабіноксилану пшениці Аналіз активності ендо-1,4-β-ксиланази базується на ферментному гідролізі стандартного розчину арабіноксилану пшениці. Причому активність визначають за зменшенням відносної в'язкості залежно від часу. Розчин, що містить 1мл 1% (мас./об.) розчину арабіноксилану пшениці в 0,1Μ натрій-ацетатному буфері, рН 5,5 (або при інших значеннях рН); 3мл дистильованої води і 1мл відповідним чином розведеного ферментного розчину вводять у мікровіскозиметр Haake (використовуючи золоту кульку, калібровану до 0,1-2,0мПа.с), та вимірюють час падіння кульки (Ттест) (в мс щодо визначеної висоти падіння) кожні 30с протягом 15-20хв. при 30°С. Середні часи падіння кульки вимірюють для води (5мл дистильованої води) і субстратного (1мл, 1% (мас./об.) розчину арабіноксилану пшениці в 0,1Μ натрій-ацетатному буфері, рН 5,5 та 4мл дистильованої води) як Твода і Тсубстракт відповідно. Проводять контрольні виміри аналогічним способом. Відносну текучість Fг розраховують для кожного значення Т тест у такий спосіб: Fг Тсубстракт Т тест Т тест Твода Нахил кривої Fг залежно від часу (минулий час, під час якого проведено кожний вимір Т тест ), розраховують як зміну відносної в'язкості в хвили 15 ну ( Fг / хв. ), і воно є пропорційним концентрації ферменту. Одну одиницю активності ендо-1,4-βксиланази визначають як кількість ферменту, що гідролізує субстрат, зменшуючи в'язкість розчину, забезпечуючи зміну відносної текучості в 1 (безвимірна одиниця) в 1хв. в умовах аналізу (30°С і рН 5,5 або при інших значеннях рН). 1.10. Аналіз β-ксилозидази з використанням пнітрофоніл-β-D-ксилопіранозиду Анализ β-ксилозидази базується на ферментному гідролізі п-нітрофоніл-β-D-ксилопіранозиду. Продукт реакції, п-нітрофенол, визначають колометрично. Розчин, що містить 1мл 0,1% (мас./об.) пнітрофоніл-β-D-ксилопіранозиду в дистильованій воді; 1мл дистильованої води; 1мл 0,2Μ натрійацетатного буферу, рН 5,0; 1мл відповідним чином розведеного ферментного розчину інкубують при 50°С протягом 30хв. Ферментну реакцію зупиняють, додаючи 4мл 0,4М розчину гліцину. Цей розчин перемішують і охолоджують до 20°С. Поглинання вимірюють при 400нм, використовуючи скляну кювету товщиною 1см. Отриманий результат перетворюють у мкмоль п-нітрофенолу, порівнюючи із коефіцієнтом молярної екстинкції п-нітрофенолу в цих же умовах. В спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій розчин гліцину добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності ксилозидази визначають як кількість ферменту, що продукує 1мкмоль п-нітрофенолу з пнітрофеніл-β-D-ксилопіранозиду в хвилину в умовах аналізу (50°С і рН 5,0). 1.11. Аналіз -N-арабінофуранозидази з використанням п-нітрофеніл- -L-арабінофуранозиду Аналіз α-Ν-арабінофуранозидази (арабінофуранозиду) базується на ферментному гідролізі пнітрофеніл- -L-арабінофуранозиду. Продукт реакції, п-нітрофенол, визначають колориметрично. Розчин, що містить 1мл 0,1% (мас./об.) пнітрофеніл- -L-арабінофуранозиду в дистильованій воді; 1мл дистильованої води; 1мл 0,2Μ натрійацетатного буферу, рН 5,0; 1мл відповідним чином розведеного ферментного розчину інкубують при 50 °С протягом 30хв. Ферментну реакцію зупиняють, додаючи 4мл 0,4Μ розчину гліцину. Цей розчин перемішують і охолоджують до 20°С. Поглинання вимірюють на 400нм, використовуючи скляну кювету товщиною 1см. Отриманий результат перетворюють у мкмоль п-нітрофенолу, порівнюючи з коефіцієнтом молярної екстинкції п-нітрофенолу в цих же умовах. В спостережуване поглинання для розчинів ферментних реакцій вносять поправку на неспецифічне поглинання, здійснюючи реакцію, в якій розчин гліцину добавляють до суміші перед додаванням ферментного розчину. Одну одиницю активності арабінофу-ранозидази визначають як кількість ферменту, що продукує 1мкмоль пнітрофенола з п-нітрофеніл- -L-арабінофуранозиду в 1хв. в умовах аналізу (50°С і рН 5,0). 77381 16 1.12. Аналіз ферулоїл-естерази FAXX методом Аналіз ферулоїл-естерази (естерази ферулової кислоти) базується на ферментному гідролізі О-[5-О-(транс-ферулоїл)-L-арабінофуранозил](1 3)-О-β-О-ксилопіранозил-(1 4)-Оксилопіранози (FAXX). FAXX одержують із ферментативно гідролізованих пшеничних висівок, очищують і характеризують за допомогою ЯМР. FAXX гідроліз визначають спектрофотометрично. Ферментативну реакцію підтримують при довжині хвилі 325нм, використовуючи кювету товщиною 1см, у розчині, що містить 0,050Μ FAXX в 0,1Μ MOPS буфері, рН 6,0 при 37°С. Одну одиницю активності ферулоїл-естерази на FAXX визначають як кількість ферменту, що перетворює 1мкмоль субстрату в продукт в 1хв. в умовах аналізу (37°С і рН 6,0). 1.13. Аналіз ферулоїл-естерази за допомогою Ara2F Аналіз ферулоїл-естерази (естерази ферулової кислоти) базується на ферментативному гідролізі Ara2F (ферулова кислота, зв'язана по 1,2 з арабінозою). Ara2F одержують із ферментативно гідролізованої пульпи цукрового буряка, очищують і характеризують за допомогою ЯМР. Гідроліз Ara2F визначають спектрофотометрично. Ферментативну реакцію спостерігають при довжині хвилі 325нм, використовуючи кювету товщиною 1см, у розчині, що містить 0,050Μ Ara2F у 0,1Μ MOPS буфері, рН 6,0 при 37°С. Одну одиницю активності ферулоїл-естерази на Ara2F визначають як кількість ферменту, що перетворює 1мкмоль субстрату в продукт в 1хв. в умовах аналізу (37°С і рН 6,0). 1.14. Аналіз ферулоїл-естерази з використанням гідролізу метилових естерів: метил-ферулової кислоти (MFA); метилкофеїнової кислоти (МСА); метилсинаповой кислоти (MSА); метил-ркумарової кислоти (МрСА) Аналіз ферулоїл-естерази (естерази ферулової кислоти) базується на ферментативному гідролізі метилових естерів ферулової кислоти (MFA); кофеїнової кислоти (МСА); синапової кислоти (MSA); і п-кумарової кислоти (МрСА). Гідроліз метилових естерів визначають у 0,1Μ MOPS буфері, рН 6,0 при 37°С. Аналіз базується на двох різноманітних методиках. У спектрофотометричному способі концентрація субстрату метилових естерів складає 0,10мМ, і за гідролізом естерів спостерігають при довжині хвилі 325нм, використовуючи кювету товщиною 1см. У цьому способі початкова концентрація субстрату обмежена. У способі з використанням ВЕРХ концентрація субстрату метилових естерів складає 1,0мМ, і за гідролізом естерів спостерігають, вимірюючи виділення вільної кислоти за допомогою ВЕРХ із 1030хв. інтервалами. У цьому способі немає обмеження за концентрацією субстрату, і вимірювані активності є значно вищими, ніж концентрації, які визначають спектрофотометрично. Одну одиницю активності ферулоїл-естерази визначають як кількість ферменту, що перетворює 1мкмоль субстрату в продукт за 1хв. в умовах аналізу (37°С і рН 6,0). 17 77381 1.15. Визначення концентрації білку за допомогою модифікованого аналізу Bradford зв'язування білку з Coomassie blue Аналіз концентрації білку базується на модифікованому аналізі Bradford зв'язування білку з Coomassie blue із використанням Brilliant Blue G (кумассі-діамантовий блакитний), що вимірюється спектрофотометрично при довжині хвилі 595нм, використовуючи кювету товщиною 1см. Цей спосіб (Sigma В 6916) стандартизований із використанням альбуміну бичачої сироватки (Sigma P094). 1.16. Визначення ізоелектричної точки за допомогою ізоелектричного фокусування Ізоелектричні точки білків визначають стандартними способами, використовуючи такі попередньо відлиті вертикальні 5% поліакриламидні гелі, як гелі від NOVEX® для інтервалу рН 3-10 (р1 інтервал 3,5-8,5) або рН 3-7 (р1 інтервал 3,0-6,5) у кюветі NOVEX® ХСеІІ II™ Mini-Cell. Використовують NOVEX® катод, анод і IFE зразкові буфери для рН 3-10 або рН 3-7. Використовують NOVEX® стандартний протокол для ізоелектричного фокусування, фіксування, фарбування барвником Coomassie R-250 Blue і знесолення. 1.17. SDS-PAGE (гель-електрофорез в натрійдодецилсульфат-поліакриламідномугелі) Аналітичний поділ і визначення молекулярної маси білків здійснюють стандартними SDS-PAGE методами. Попередньо відлиті NOVEX® NuPAGE гелі (NuPAGE™ Bis-Tris гелі або NuPAGE™ Trisацетатні гелі з NOVEX® рекомендованими робо® чими буферами використовують у NOVEX ХСеІІ II™ Mini-Cell. Використовують NOVEX® зразкові препаративні і робочі буфери і стандарти молекулярних мас. Використовують NOVEX® стандартні протоколи для SDS-PAGE, фіксування, фарбування барвником Coomassie R-250 Blue і знесолення. 2. Результати аналізу суміші ферментів 2.1. Оптимальні значення рН 2.1.1. Активність ендо-1,3(4)-β-глюканази Аналіз ендо-1,3(4)-β-глюканази з РеnісіІІum funicolosum здійснюють у стандартних умовах при 50°С, за допомогою способу із використанням DNS і β-глюкану ячменя. Ферментативну активність вимірюють при значеннях рН між 3,0 та 7,0. Оптимальні значення рН для активності ферменту складають 4,0-5,0 (табл. 1). Таблиця 1 Вплив рН на ферментативну активність ендо-1,3(4)-β-глюканази з РеnісіІІum funicolosum рН 3,0 4,0 5,0 6,0 7,0 Активність (міжнарод. од.)/хв. 325 761 775 507 152 % 42 98 100 66 20 2.1.2. Активність ендо-1,4-β-ксиланази 18 Аналіз ендо-1,4-β-ксиланази з РепісіІІит funicolosum здійснюють у стандартних умовах при 50°С, за допомогою способу з використанням DNS і ксилану деревини берези (табл. 2). Таблиця 2 Вплив рН на ферментативну активність ендо-1,4-β-ксиланази з РеnісіІІum funicolosum Активність (міжнарод. од.)/хв. 3559 6700 8411 8113 9582 8523 8510 5544 3522 2190 1103 рН 2,0 2,6 3,0 3,0 3,5 4,0 4,0 5,0 5,5 6,0 7,0 % 37 70 88 85 100 89 89 58 37 23 12 2.2. Оптимальна температура 2.2.1. Активність ендо-1,3(4)-β-глюканази Аналіз ендо-1,3(4)-β-глюканази з РепісіІІит funicolosum здійснюють у стандартних умовах при рН 5,0 (оптимальне значення рН для цього ферменту) за допомогою способу з використанням DNS та β-глюкану ячменя. Ферментативну активність вимірюють при значеннях температури між 30-70°С. Значення оптимальних температур знаходяться між 50-60°С, причому найвища активність спостерігається при 60°С. Результати досліджень приведені в табл. 3. Таблиця 3 Вплив температури на ферментативну активність ендо-1,3(4)-β-глюканази з РеnісіІІum funicolosum Температура, °С 30 40 50 60 70 Активність (міжнарод. од.)/хв. 247 541 775 1082 774 % 32 70 100 140 96 2.2.2. Активність ендо-1,4-β-ксиланази Аналіз ендо-1,4-β-ксиланази з РеnісіІІum funicolosum здійснюють у стандартних умовах при рН 5,5 і 3,5 за допомогою способу з використанням DNS і ксилану деревини берези. Ферментативну активність вимірюють при значеннях температури між 30- 70°С. Значення оптимальних температур знаходяться між 50-60°С, причому найвища активність спостерігається при 50°С для рН 5,5 і при 60°С для рН 3,5. Результати досліджень приведені в табл. 4. 19 77381 Таблиця 4 Вплив температури на ферментативну активність ендо-1,4-β-ксиланази з РеnісіІІum funicolosum Активність Активність (pH 5,5) (pH 3,5) Температура, °С (міжнарод. (міжнарод. % % од.)/хв. од.)/хв. 30 2492 41 4334 23 40 4042 66 8128 42 50 6107 100 18251 95 60 4602 75 19155 100 70 3851 63 12730 66 20 Ферменти, продуковані РеnісіІІum funicolosum, відрізняються високими рівнями целюлази, ендо1,3(4)-β-глюканази та інших глюканолітичних активностей. Крім того, вони також характеризуються високими рівнями ендо-1,4-β-ксиланази і активностями супутніх ферментів ксиланази. Широкий спектр геміцелюлолітичних ферментів є характеристикою ферментних препаратів, які отримують із цього мікроорганізму. Кожну із вимірюваних активностей можна уявити як відношення до основної активності для цього препарату. Приклади отриманих результатів подані в табл. 5. Ці відношення можуть змінюватися в препаратах, отриманих із різноманітних партій ферментації. Таблиця 5 Відносні активності залежно від різноманітних субстратів Методи, використані під час тестування Целюлоза (DNS CMC спосіб згідно з процедурою 1.1), рН 5,0 Целобіогідролаза (використання п-нітрофеніл-β-D-целобіопіранозиду згідно з процедурою 1.2), рН 5,0 β-глюкозидаза (використання п-нітрофеніл-β-D-глюкопіранозиду згідно з процедурою 1.3), рН 5,0 Ендо-1,3(4)-β-глюканаза (використання DNS та β-глюкану ячменя згідно з процедурою 1.4), рН 5,0 Ендо-1,3(4)-β-глюканаза (використання β-глюкану азо-ячменя згідно з процедурою 1.5), рН 4,6 Ламінариназа (використання DNS і ламінарину згідно з процедурою 1.6), рН 5,0 Ендо-1,4-β-ксиланаза (використання DNS та ксилану деревини берези згідно з процедурою 1.7), рН 3,5 Ендо-1,4-β-ксиланаза ( використанням DNS та арабіноксилану пшениці згідно з процедурою 1.8), рН 3,5 Ендо-1,4-β-ксиланаза (віскозиметричний спосіб арабіноксилану пшениці згідно з процедурою 1.9), рН 5,5 β-ксилозидаза (використання п-нітрофоніл-β-D-ксилопіранозиду згідно з процедурою 1.10), рН 5,0 -N-арабінофуранозидаза (використанням п-нітрофеніл- -L-арабінофуранозиду згідно з процедурою 1.11), рН 5,0 Ферулоїл-естераза (FAXX метод згідно з процедурою 1.12) Ферулоїл-естераза (Аra2F метод згідно з процедурою 1.13) Ферулоїл-естераза (MFA спектрофотометричний спосіб згідно з процедурою 1.14) Ферулоїл-естераза (MСA спектрофотометричний спосіб згідно з процедурою 1.14) Ферулоїл-естераза (MSА спектрофотометричний спосіб згідно з процедурою 1.14) Ферулоїл-естераза (MрСA спектрофотометричний спосіб згідно з процедурою 1.14) 3.1 Способи очищення Хроматографія гідрофобних взаємодій Препарати, отримані після фільтрації і концентрування ферментаційного середовища до концентрації білку 112,6мг/мл, розводять 1/1 буфером для хроматографії гідрофобних взаємодій (НІС) (50мМ фосфатний буфер, рН 7,0 / 1,7Μ (NH4)2SO4 / 0,04% азид натрію), заміняють на НІС буфер (PD10 колонки; Pharmacia). Порції (по 10мл) високоефективного НІС гелю (Pharmacia) вводят в колонку (діаметр 10х5см, 200мл) PhenylSepharoes™, і розділяють, використовуючи градієнт сульфату амонію (NH4)2SO4 із концентрацією, що знижується Результати для РеnісіІІum funicolosum 3,140 0,022 0,157 7,230 1+/0,300 9,160 8,670 9,890 0,0047 0,0017 0,000254 0,000349 0,000135 0,000174 0,000049 0,000216 (1,7-0,0М) за 10хв. Фракції (по 10мл) збирають і аналізують на активність ксиланази. НІС дає два основних піки активності ксиланази. Перший, названий А, елююється з колонки, коли концентрація (NH4)2SO4 знижується до приблизно 0,6М, тоді як другий, названий В, елююється при концентрації (NH4)2SO4 приблизно 0,25М. Фракції, що містять піки А та В, із кожного введення збирають окремо. Повна фракція А відповідає 2,8% від повної активності ксиланази, тоді як фракція В відповідає 97,2% від повної активності ксиланази. Вихід складає 77%. 21 Іонообмінна хроматографія Об'єднані фракції піків А и В із НІС осаджують, підвищуючи концентрацію (NH4)2SO4 до 100% насичення з наступним центрифугуванням (10000хg протягом 30 хв.). Осади знову розчиняють у суміші 20мл Tris-HCI буфера, рН 8,0 / 0,04% азид натрію та знесолюють до того ж самого буфера, використовуючи PD-10 колонку. Зразки (5мл) вводять у MonoQ™ HR 10/10 аніонообмінну колонку (Pharmacia), попередньо урівноважену сумішшю 20мМ Tris-HCI буферу рН 8,0 / 0,04% азид натрію, і елююють із швидкістю 2мл/хв. із концентрацією хлориду натрію NaCI (0-1М), що підвищується в тому ж самому буфері. Фракції (2мл) збирають і аналізують на активність ксиланази. Пік А Виділення піка А за допомогою аніонообмінної хроматографії призводить до одержання одного піку активності ксиланази, який елююють при приблизно 0,3Μ NaCI. Найбільш активні фракції збирають і аналізують за допомогою SDS-PAGE (гельелектрофорез у натрійдодецилсульфатполіакриламіді). Одержують одну основну смугу з молекулярною масою 48кДа. Виділення активності ксиланази після IEF (ізоелектричне фокусування підтверджує, що ця основна Coomassieпофарбована смуга є ксиланазою. Пік В Виділення піку В за допомогою аніонообмінної хроматографії дає два основних піки активності ксиланази, один із яких елююється в піці матеріалу, що не сорбується (незв'язаний матеріал; пік ВІ), а інший - при 0,1Μ NaCI (пік В-ІІ). Присутні також два невеликих піки, що елюються при 0,13M і 0,19Μ NaCI. Активні фракції, що відповідають кожному піку, збирають і аналізують за допомогою SDS-PAGE, але жодний із зразків не є чистим. Гель-фільтраційна хроматографія Об'єднані фракції, що містять В-І і В-ІІ, сушать виморожуванням, знову розчиняють у воді й знесолюють (використовуючи PD-10 колонки). Зразки (0,2мл) вводять у Superdex™ 75HR колонку (Pharmacia) і елююють при швидкості 0,4мл/хв. буфером 20мМ Bis-Tris, рН 6,0/0,2Μ NaCI/0,04% азид натрію. Фракції (0,4мл) збирають і аналізують на ксиланазну активність. 3.2. Характеристики ксиланаз 3.2.1. Визначення ізоелектричної точки за допомогою ізоелектричного фокусування Ізоелектричні точки білків визначають стандартними способами, використовуючи попередньо відлиті вертикальні 5% поліакриламідні гелі від NOVEX® для рН 3-10 і рН 3-7. Використовують NOVEX® катод, анод і IEF зразкові буфери, і стандартні протоколи для ізоелектричного фокусування, фіксації, фарбування Coomassie R-250 Blue барвником, і знебарвлення. Для ксиланази А використовують зразок після MonoQ. Для ксиланаз В-І і В-ІІ використовують зразок після НІС, ксиланазу В. Для кожного з А і В невеликий зразок (10мкл) поміщають в окрему комірку, 77381 22 і великий зразок (50мкл) поміщають у потрійну комірку. Після фокусування зразків гель розрізають на дві частини так, що одна частина містить два невеликих зразки (А+В) і маркери молекулярної ваги (ця половина пофарбована Coomassie), тоді як інша частина містить два великих зразки. Частину гелю, що містить великі зразки, розрізають так, щоб розділити смуги двох зразків, а потім кожну зі смуг розділяють на ділянки по 2мм. Кожну із 2мм ділянок вимочують окремо протягом ночі в 100мМ MOPS буфері, рН 6,0 / 0,04% азид натрію. Фракції аналізують на активність ксиланази. Для зразка А ксиланази пофарбований IEF гель демонструє одну основну смугу рI 3,55 маркера і декілька невеликих примісних смуг. Ксиланазна активність виявлена тільки у фракції, що відповідає цій смузі, підтверджуючи, що основний пік відповідає ксиланазі. Для зразка В пофарбований IEF гель демонструє декілька смуг в інтервалі значень рI. Ксиланазна активність мала місце в двох розділених фракціях непофарбованого гелю і відповідає білкам із рI 4,2 і 4,8. 3.2.2. Визначення молекулярної маси за допомогою SDS-PAGE Для підтвердження молекулярних мас ксиланаз у піку В з НІС фракції з ксиланазною активністю, елюйованої з IEF гелю, знесолюють, сушать виморожуванням і розділяють за допомогою SDSPAGE. Денатурування PAGE здійснюють, використовуючи 10% Tris-гліциновий гель (NOVEX®) із дітіотреїтолом (DTT 50 мМ), включеним в зразковий буфер як відновлювальний агент. Пофарбований гель показує, що обидві ксиланази виявилися чистими, з молекулярними масами 36кДа і 15кДа для ксиланази В-І і В-ІІ, відповідно. Усі три очищені ксиланази аналізують за допомогою SDS-PAGE: фракцію ксиланази А після аніонообмінної хроматографічної обробки, фракції ксиланази В-І і В-ІІ після гельфільтраційної хроматографічної обробки. Ксиланаза А дає одну смугу з молекулярною масою 48кДа. Ксиланаза В-І дає одну основну і чотири невеликі смуги після фарбування Coomassie. Підтверджується, що основна смуга відповідає ксиланазі, тому що її молекулярна маса дорівнює 36кДа. Ступінь чистоти оцінюють як 90%. Ксиланаза В-ІІ дає основну смугу з молекулярною масою 15кДа і 2-3 невеликі смуги. Ступінь чистоти цієї ксиланази приблизно 95%. Результати представлені у табл. 6. Таблиця 6 Результати визначення молекулярної маси ксиланази за допомогою SDS-PAGE Зразок Ксиланаза А Ксиланаза В-І Ксиланаза В-ІІ Молекулярна маса, кДа 48 36 15 рІ 3,55 4,20 4,80 23 77381 Тести по вимірюванню активності ферментів були описані вище. 3.2.3.1. Аналіз ксиланази А 24 [Білок] 0,4мг/мл. Результати наведені у табл. 7 і 8. Таблиця 7 Результати активності ксиланази А залежно від різноманітних субстратів Методи, використані під час тестування рН Целюлоза (DNS CMC спосіб згідно з процедурою 1.1) Целобіогідролаза (використання п-нітрофеніл-β-Dцелобіопіранозиду згідно з процедурою 1.2) Ендо-1,3(4)-β-глюканаза (використання DNS та β-глюкану ячменя згідно з процедурою 1.4) Ламінариназа (використання DNS і ламінарину згідно з процедурою 1.6) Ендо-1,4-β-ксиланаза (використання DNS та ксилану деревини берези згідно з процедурою 1.7) Ендо-1,4-β-ксиланаза (використання DNS та ксилану деревини берези згідно з процедурою 1.7) Ендо-1,4-β-ксиланаза ( використанням DNS та арабіноксилану пшениці згідно з процедурою 1.8) Ендо-1,4-β-ксиланаза ( використанням DNS та арабіноксилану пшениці згідно з процедурою 1.8) Ендо-1,4-β-ксиланаза (віскозиметричний спосіб арабіноксилану пшениці згідно з процедурою 1.9) 5,0 Активність ферменту од./мл. од./(мг білку) н/п*) 1,0 5,0 1,0 н/п 5,0 1,0 н/п 5,0 н/в*) н/п 5,5 140 350 3,5 158 395 5,5 152 380 3,5 171 429 5,5 456 1140 Примітка: - *) н/в – не визначали, н/п – не придатне. Таблиця 8 Вплив рН на ферментативну активність ксиланази відносно ксилану деревини берези рН 2,0 3,0 3,5 4,0 5,0 5,5 6,0 7,0 Активність (міжнарод. од.)/хв. 294 353 385 405 345 340 302 212 % 73 87 95 100 85 84 75 52 3.2.3.2. Аналіз ксиланази В-І [Білок] 0,096мг/мл. Результати наведені у табл. 9 і 10. Таблиця 9 Результати активності ксиланази В-І залежно від різноманітних субстратів Методи, використані під час тестування рН Целюлоза (DNS CMC спосіб згідно з процедурою 1.1) 5,0 Целобіогідролаза (використання п-нітрофеніл-β-D5,0 целобіопіранозиду згідно з процедурою 1.2) Ендо-1,3(4)-β-глюканаза (використання DNS та β-глюкану ячменя 5,0 згідно з процедурою 1.4) Активність ферменту од./мл. од./(мг білку) 26,5 0,541 276 73,8 5,6 25 77381 26 Продовження таблиці 9 Ламінариназа (використання DNS і ламінарину згідно з процедурою 1.6) Ендо-1,4-β-ксиланаза (використання DNS та ксилану деревини берези згідно з процедурою 1.7) Ендо-1,4-β-ксиланаза (використання DNS та ксилану деревини берези згідно з процедурою 1.7) Ендо-1,4-β-ксиланаза ( використанням DNS та арабіноксилану пшениці згідно з процедурою 1.8) Ендо-1,4-β-ксиланаза ( використанням DNS та арабіноксилану пшениці згідно з процедурою 1.8) Ендо-1,4-β-ксиланаза (віскозиметричний спосіб арабіноксилану пшениці згідно з процедурою 1.9) 5,0 0,1 769 5,5 51,3 н/п*) 3,5 83,6 534 5,5 93,2 871 3,5 143,8 971 5,5 147 1531 Примітка: - *) н/п – не придатне. Таблиця 10 Вплив рН на ферментативну активність ксиланази відносно ксилану деревини берези рН 2,0 3,0 3,5 4,0 5,0 5,5 6,0 7,0 Активність (міжнарод. од.)/хв. 610 755 871 802 567 534 481 404 % 70 87 100 92 65 61 55 46 3.2.3.3. Аналіз ксиланази В-ІІ [Білок] 0,165мг/мл. Результати наведені у табл. 11 і 12. Таблиця 11 Результати активності ксиланази В-ІІ залежно від різноманітних субстратів Методи, використані під час тестування рН Целюлоза (DNS CMC спосіб згідно з процедурою 1.1) Целобіогідролаза (використання п-нітрофеніл-β-Dцелобіопіранозиду згідно з процедурою 1.2) Ендо-1,3(4)-β-глюканаза (використання DNS та β-глюкану ячменя згідно з процедурою 1.4) Ламінариназа (використання DNS і ламінарину згідно з процедурою 1.6) Ендо-1,4-β-ксиланаза (використання DNS та ксилану деревини берези згідно з процедурою 1.7) Ендо-1,4-β-ксиланаза (використання DNS та ксилану деревини берези згідно з процедурою 1.7) Ендо-1,4-β-ксиланаза ( використанням DNS та арабіноксилану пшениці згідно з процедурою 1.8) Ендо-1,4-β-ксиланаза (віскозиметричний спосіб арабіноксилану пшениці згідно з процедурою 1.9) Ендо-1,4-β-ксиланаза (віскозиметричний спосіб арабіноксилану пшениці згідно з процедурою 1.9) 5,0 Примітка: - *) н/в – не визначали, н/п – не придатне. Активність ферменту од./мл. од./(мг білку) н/п*) 1,0 5,0 1,0 н/п 5,0 1,0 н/п 5,0 н/в*) н/п 5,5 141,9 860 3,5 281,0 1582 5,5 152,6 925 3,5 267,9 1624 5,5 262 1588 27 77381 Таблиця 12 Вплив рН на ферментативну активність ксиланази відносно ксилану деревини берези рН 2,0 3,0 3,5 4,0 5,0 5,5 6,0 7,0 Активність (міжнарод. од.)/хв. 1374 1523 1582 1630 1093 860 443 156 % 84 93 97 100 67 53 27 10 3.2.4. Послідовності Один із варіантів даного винаходу відноситься до послідовностей амінокислот і нуклеїнових кислот для описаних вище білків або їхніх варіантів. Для цієї мети послідовності ксиланаз ідентифікують за амінокислотними послідовностями очищених білків (ксиланаза А, ксиланаза В-І і ксиланаза В-ІІ) і при порівнянні послідовностей амінокислот і нуклеотидів із послідовностями відомих грибкових ксиланаз. Слід розуміти, що в рамках даного винаходу термін «варіанти» відноситься до будь-якого поліпептиду або будь-якого аналогу білку фрагменту білку, похідного або білку-мутанту з нативного білку або поліпептиду і який має ті ж самі біологічні функції, що і зазначений нативний білок або поліпептид. У природному стані можуть існувати різноманітні варіанти. Такими варіантами можуть бути, наприклад, алельні варіанти, що характеризуються відмінностями в послідовності генів, які кодують зазначений білок, або можуть бути результатом диференційного сплайсінгу або посттрансдукціних модифікацій. Варіанти можна одержати шляхом заміщення, делеції, додавання і/або модифікації однієї або більше з амінокислот. Всі модифікації добре відомі і їх можна здійснити будь-якими відомими спеціалістам способами. Варіантами є молекули, що мають, наприклад, велику спорідненість до їх субстрату; або які мають нові біологічні властивості. Іншою метою даного винаходу є також застосування послідовностей для експресії описаних білків або поліпептидів у клітинах-хазяїнах одноклітинних або багатоклітинних організмів. Для цієї мети зазначені послідовності можуть бути введені в геном вектору. Зазначеним вектором може бути плазміда. фаг або вірус. Тому іншим варіантом даного винаходу є клітина-хазяїн, виділена з одноклітинного або багатоклітинного організму, трансфікована або інфікована вектором, як описано вище. У кращому варіанті клітиною-хазяїном є бактерія. Іншим варіантом даного винаходу є застосування зазначених векторів, що включають послідовність нуклеїнових кислот описаних вище білків для експресії зазначеного білку в будь-яку клітинухазяїна. 3.2.4.1 Послідовності ксиланази С 28 Створення зондів базується на порівняннях амінокислотних і нуклеотидних послідовностей відомих грибкових ксиланаз. Визначають консервативні ділянки і використовують для створення ПЛР праймерів, продукти яких можна було б використовувати для скринування геномної бібліотеки Penicillum funicolosum. Створюють дві пари дегенерованих праймерів. Першу пару створюють для ампліфікації 200п.о. (приблизно) продукту з гену ксилазы типу В (або типу 2). Другу пару створюють для ампліфікації 250п.о. продукту з гену ксиланази типу А (тип 1). Полосу 258п.о. одержують с праймерами 3 і 4. Після клонування в pGEMT і секвенування було виявлено, що наявна значна схожість послідовності з послідовністю грибкової ксиланази типу А/1. Плазміду, що містить клонований продукт, називають pPFXYLA. Повна послідовність ксиланази С представлена на Фіг.1 і в послідовності з ідентифікаційним № 1 (послідовність з ідент. №1). 3.2.4.2 Послідовності ксиланази В-І Для конструювання дегенеративних ПЛР праймерів (послідовність з ідент. №2 і №3) використовують внутрішню амінокислотну послідовність поряд із порівняннями послідовностей інших грибкових целобіогідролаз. Продукт 290п.о. (послідовність з ідент. №4) ампліфікують і клонують в pGEMT (Promega) для створення pGEMTCB2, і секвенують. На Фіг.2 видно, що праймерні послідовності підкреслені. Цей продукт ПЛР в даний час застосовують як зонд для скринування геномної бібліотеки Penicillum funicolosum ІМІ134756. 3.2.4.3. Послідовність ксиланази В-ІІ Вся послідовність гену ксиланази В-ІІ включає 1,3кп.о. 5' нетрансльованої і розташованої у зворотному напрямку ділянки і 0,85кп.о. З' нетрансльованої ділянки, 54п.о. інтрон і 669п.о., які кодують білок з 223 амінокислот. Для доказу існування 54п.о. інтрону використовують ПЛР із зворотною транскриптазою (RTPCR). Повну РНК виділяють із міцелію культур Penicillum funicolosum IMI134756, зібраних після 4 днів вирощування на 1% (мас./об. ) ксилані вівса. Конструюють праймери для ампліфікації аж до 195п.о. фрагменту з інформаційної РНК (249п.о. з геномної ДНК) і до 433п.о. (487п.о. з геномної ДНК). Секвенування 3кп.о. із 3'кінця плазміди (pPFXYNC2) виявило ген (позначений per А), що містить два передбачуваних інтрони, і кодує поліпептид, який складається приблизно з 570 амінокислот. Цей поліпептид демонструє значну схожість послідовності із амінокислотними пермеазами грибків. 3.2.4.4. Послідовність ксиланази А Була отримана внутрішня послідовність ксиланази А, вона представлена такою послідовністю амінокислот: AEAINYNQDY 3.3 Властивості ферулоїл-естераз 3.3.1. Очищення Здійснюють таким же способом, що і для ксиланаз. Суміш ферментів містить, принаймні, дві різні ферулоїл-естерази. У однієї з них (FaeB) молеку 29 лярна маса за даними мас-спектрометрії складає 38945-41051Да (35450Да з первинної амінокислотної послідовності та 37кДа за даними SDSPAGE). FaeB має значення рІ 4,2, що відповідає ферулоїл-естеразі типу В и є специфічним для МрСА, і Ara2F субстратів (активність по відношенню до МрСА, MCA, MFA і Ara2F; але не по відношенню до MSA і FAXX). У іншої ферулоїл-естерази (FaeA) молекулярна маса складає 29кДа (за даними SDS-PAGE). FaeA має значення рІ 4,65, що відповідає ферулоїл-естеразі типу А, і є специфічним для FAXX і MSA субстратів (активності по відношенню до MSA, MCA, MFA і FAXX, але не по відношенню до МрСА Ara2F). 3.3.2. Визначення ізоелектричної точки за допомогою ізоелектричного фокусування Ізоелектричні точки білків визначають стандартними способами. Суміш ферментів наносять у вигляді широкої смужки (коло 20мм) в IEF гель та здійснюють електрофорез при зниженій температурі (5°С). Після фокусування і звуження смуги гель розрізають по середині смуги зразка. Одну частину смуги зразка і IEF стандарти фіксують, забарвлюють і знесолюють, використовуючи стандартний протокол. Іншу частину смуги нарізають на ділянки шириною 2мм в і кожну ділянку вимочують протягом ночі в 1мл 100мМ МОРБбуферу, рН 6,0. Активність ферулоїл-естерази визначають для кожної ділянки гелю, використовуючи MFA, МрСА і MSA як субстрати. Пофарбований IEF гель демонструє наявність дуже багатьох білків у целюлазі, рІ значення для який варіюються в інтервалі від дуже кислотних (рІ 2,4) до приблизно рІ 7. Більшість білків є кислотними (інтервал рІ 2,4-5). Два піки ферулоїлестеразної активності виявляють у фракціях, вирізаних із гелю. Один, що відповідає FaeB, має значення рІ 4,2 і активність тільки по відношенню до MFA і МрСА (але не MSA). Інший, що відповідає FaeA, має значення рІ 4,65 і активність відносно всіх трьох тестованих субстратів. 3.3.3 Молекулярна маса, визначена за допомогою SDS-PAGE Молекулярні маси визначають за допомогою SDS-PAGE, використовуючи 10% Tris-гліцинові гелі. Одержують SDS-PAGE гелі, фіксують, забарвлюють Coomassie Blue барвником і знесолюють, використовуючи стандартний протокол. Суміш ферментів містить, принаймні, дві різноманітні ферулоїл-естерази. В однієї з них, що відповідає FaeB (pІ 4,2), молекулярна маса складає 37кДа. В іншій, що відповідає FaeA (pІ 4,65), молекулярна маса складає 29кДа. Молекулярну масу FaeB оцінюють як 34450Да з первинної амінокислотної послідовностіі як 38945-41051Да за даними мас-спектрометрії. 3.3.4. Активність ферулоїл-естерази Аналіз на активність ферулоїл-естераз здійснюють на суміші ферментів (табл. 13), використовуючи спектрофотометричний метод. 77381 30 Таблиця 13 Результати активності ферулоїл-естераз залежно від різноманітних субстратів Активність од./(г білод./мл. ку) Метил фурулат MFA (0,1м) 0,086 7,9 Метил кофеат MCA (0,1м) 0,111 10,3 Метил синапат MSA (0,1м) 0,031 2,9 Метил р-кумарат MpCA 0,138 12,7 (0,1м) FAXX (0,05м) 0,162 15,0 Ara2F (0,05м) 0,222 20,6 Методи, використані під час тестування Суміш ферментів містить активності проти всіх тестованих субстратів. Для метилес-тераз найвищою активністю є активність відносно МрСА, а самою низькою - відносно MSA. Активності відносно АгагР і FAXX вище, ніж відносно метилестераз, що є показником того, що активності естераз зв'язані з істинними ферулоїлестеразами, а не із загальними естеразами або побічними активностями інших руйнуючих стінки клітин естераз (наприклад, ацетил-ксиланестераза, пектин-естераза). 3.3.5. Послідовності 3.3.5.1 Послідовність FEA-A Відповідно до розщеплення очищених білків одержують внутрішні амінокислотні послідовності як: Послідовність 1 QYTLTLPSNYNPNK Послідовність 2 AVAVMSGANL Послідовність З TEYSG (С/А) DSEHPVWWIAFDGP Послідовність 4 DTFVKDDHCTPTNPPAPAAGSGTHIKYV Конструюють декілька дегенеративних ПЛР праймерів з амінокислотних послідовностей, отриманих з очищеного білку. Багато з продуктів були клоновані в pGEMT (Promega) і секвеновані. За допомогою ПЛР було виявлено, що плазміда, названа pGEMTD19 (180п.о.) (Фіг.3 містить послідовність, що розпізнається як пептидна послідовність 4, представлена вище. Я показано на Фіг.З, праймерні послідовності підкреслені двічі, а раніше відома послідовність підкреслена ще один раз. Послідовності нуклеїнової кислоти і амінокислот FAE-A подані в послідовності з ідент. №5. 3.3.5.2. Послідовність FEA-B Праймери, сконструйовані із пептидної послідовності FAE-B, використовують для посилення зонду, який потім використовують для скринування геномної бібліотеки РепісіІІum funicolosum. Клон 229п.о. виділяють і секвенують (послідовність з ідент. №6). Ген, що кодує поліпептид із 304 аміно 31 кислот, має один передбачуваний інтрон. Передбачена амінокислотна послідовність представлена на Фіг.4, де зрілий білок (довжина зрілого білку =338) зображений жирним шрифтом. Цей білок включає два різних домени, розділені в сильному ступені глікозилірованим лінкером. Як показано на Фіг.4, каталітичний домен зображений жирним шрифтом, тоді як зв'язуючий домен зображений жирним шрифтом і підкреслений двічі, а лінкер представлений точечною жирною лінією. Білок також відрізняється передбачуваним фрагментом активного сайта (серин=нуклеофіл), що показано підкресленням на Фіг.4, із такими передбаченими каталітичними тріадами: (1) S136/D174/H216 (2) S136/D220/H276. FAE-B білок включає також послідовність секреції (353) і 10 цистеїнів. 3.4 Властивості глюканаз Суміш ферментів обробляють за допомогою 2D гель-електрофорезу. IEF здійснюють, використовуючи попередньо відлиті вертикальні 5% поліакриламідні гели від NOVEX® для рН 3-7 (інтервал рІ 3,0-6,5) у міні-комірці NOVEX® ХСеІІ II™ MiniCell. Використовують NOVEX® катод, анод і IEF зразкові буфери для рН 3-7, а також стандартний протокол NOVEX® для ізоелектричного фокусування. Одну смугу відрізають, і обробляють електрофоретично в другому напрямку, використовуючи 10% Laemmli SDS-PAGE гель. З гелю виділяють другу смугу, розрізають на 35 фракцій, смужки гелю вимочують у буфері, і фракції аналізують на активність ферменту. Третю смугу лишають на гелі, фіксують, фарбують Coomassie R-250 Blue барвником і знесолюють, використовуючи NOVEX® стандартний протокол. Значні активності ендо-1,3(4)-β-глюканази (спосіб DNS і β-глюкану ячменя) і целюлази (спосіб DNS і CMC) виявлені у фракціях, що відповідають білкам із рІ 4,2, молекулярною масою 36кДа і pІ 5,4, молекулярною масою 27кДа. Для видалення ксиланази 6-1, що перебуває в одній з фракцій, фракції тестують на активність, використовуючи спосіб DNS і ксилану деревини берези. У фракціях, що відповідають активностям β-глюканази або целюлази, активність ксиланази не виявлена. Список малюнків Фіг.1 - амінокислотна послідовність білку ксиланази С Penicillum funiculosum. Фіг.2 - нуклеотидна і амінокислотна послідовності продукту ПЛР ксиланази В-І (ХуnВІ). Фіг.3 - нуклеотидна і амінокислотна послідовності ПЛР продукту ферулоїл-естерази A (faeA). Фіг.4 - Амінокислотна послідовність білку (FAE-V. або FAE-I) ферулоїл-естерази В (fae) Penicillum funiculosum. Ε. Застосування суміші ферментів у кормах для тварин Приклад 1: Оцінка ефективності препарату ферментів, продукованих Penicillum funiculosum відносно енергетичної цінності (AMEN) корму із суміші пшениці і ячменя для бройлерів Метою було продемонструвати ефективність ферментів (активність β-глюканази: 100од./кг і активність ксиланази: 1100од./кг) на гадану обмінну 77381 32 енергію, скориговану за азотним балансом (AMEN) корму, що містить 50% пшениці і 22% ячменя. Експерименти проводили за допомогою контрольних і ферментних препаратів (активність βглюканази: 100од./кг і активність ксиланази: 1100од./кг), використовуючи Європейський метод порівняння [Bourdillon et al. European reference method for the in vivo determination of metabolizable energy with adult cockerels: reproductibility, effect of age, comparison with predicted values // British Poultry Science. – 1990. – 31. – P. - 567-576] під час годівлі досхочу і повному зборі екскрету для віку між 18 і 21 днем. a. Матеріали і методи Птахи: Порода й умови вирощування Одноденних півників бройлерів Ross утримують в клітинах колективної батареї до віку 12 днів. їм дають стандартний початковий корм. На 12-й день птахів зважують і рівномірно розподіляють на 10 окремих клітин для кожної обробки, а потім їм дають експериментальний корм протягом періоду адаптації (мінімум 5 днів ). Підтримують стандартну температуру і вологість. Постійний світловий режим складає: 23 години світла і 1 годину темноти до кінця випробувань. Корми: Птахи одержують початковий корм з одного дня життя до 12 днів, а потім одержують експериментальний корм. Експериментальні корми Корми містять пшеницю і ячмінь у співвідношенні, % пшениця 50; ячмінь 22; мука канола 8; пташина мука 5; соєва мука 5; м’ясна мука 5; жир 3; вітаміни / мінерали 2. Ферментний препарат розпорошують на 20кг зерна. Характеристики експериментальних кормів наведені у табл. 14. Таблиця 14 Характеристики експериментальних кормів Зразок Контроль Ферменти Характеристики кормів, % DM сирий білок жир 89,7 20,8 5,4 89,6 20,7 5,6 Відновлення ферментів в кормах вимірюють віскозиметрично [Sabatier A.M., Fish N.M. Method of analysis for feed enzymes: methodological problems // Journal of Applied Poultry Research. - 1996. – 5. – P. 408-413]. Вимір обмінної енергії Баланс починають визначати з 18 дня (Д 18) у такий спосіб: Д 17 - птахам не дають корму протягом ночі; Д 18 - птахів зважують, очищають складальні лотки; Д 19 - фекалії збирають і заморожують; 33 77381 Д 20 - фекалії збирають і заморожують, уночі не дають корму; Д 21 - фекалії збирають і заморожують, птахів зважують і знову годують. Фекалії сушать виморожуванням і подрібнюють як корм (1мм, подрібнювач Retsch). Загальну енергію корму і екскрету визначають за допомогою адіабатичного колориметра ІКА С5000. Також визначають вміст білків (N*6,25, Kjeldahl метод Z130) і ліпідів (метод Z160). Коригування за азотним балансом вводять, використовуючи 18% білок у збільшенні маси. b. Результати та обговорення Очевидна обмінна енергія, скоригована за азотним балансом (AMEN) Зоотехнічні характеристики і величини обмінної енергії представлені в табл. 15 Таблиця 15 Вплив препарату ферментів, продукованих Penicillum funiculosum, на характеристики росту і очевидну обмінну енергію для бройлерів, що одержують експериментальний корм на основі пшениці і ячменя Показник Зразок контроль ферменти Повна енергія корму, 4609 ккал/кг DM Збільшення маси тіла, г 156 19,8 Споживаний корм, 104 15,8 г/день FCR, г/г 1,99 0,11 Фекалії DM, % 34,7 3,7 AMEN, ккал/кг DM 3252 80 AMEN, ккал/кг DM 2913a 71,9 4651 154 22,3 99,7 10,1 1,95 0,17 35,6 8,3 3456 62 30951b 55 Між обробками немає розходжень у зоотехнічних характеристиках. При вирощуванні бройлерів ферментний препарат підвищує (AMEN) корму на основі 50% пшениці і 22% ячменя на 6,2% (+204ккал/кг DM (Сухої Речовини)). Більш того, варіабельність енергетичної засвоюваності була знижена з 80 до 62ккал/кг DM. Настільки значне збільшення демонструє користь обох активностей (ксиланази і β-глюканази), продукованих Penicillum funicolosum відносно гідролізу розчинних не крохмалистих полісахаридів пшениці і ячменя. Приклад 2: Вплив препарату ферментів, продукованих Penicillum funiculosum, на засвоюваність корму бройлерами, що одержують як корм пшеницю. Проводять випробування з метою визначити вплив препарату ферментів, продукованих Penicillum funiculosum (активність β-глюканази; 100од./кг і активність ксиланази: 1100од./кг) на очевидну обмінну енергію (ΑΜΕ), на засвоюваність білків і ліпідів бройлерами, що одержують корм, 34 який містить 54% пшениці. Досліджують також залежність від ступеню здрібнювання корму. (1) Контроль 1 (54% здрібненої пшениці). (2) Контроль 1 + Препарат ферментів (активність β-глюканази 100од./кг і активність ксиланази 1100од./кг). (3) Контроль 2 (30% цілих зерен пшениці, 24% здрібнених зерен пшениці). (4) Контроль 2 + Препарат ферментів (активність β-глюканази 100од./кг і активність ксиланази 1100од./кг). Відповідно до Європейського способу порівняння (корм ad libitum і повний збір екскрету для віку з 18 до 21 дня) [Bourdillon Α. et al. European reference method for the in vivo determination of metabolizable energy with adult cockerels: reproductibility, effect of age, comparison with predicted values // British Poultry Science. – 1990. – 31. P. - 567-576]. а. Матеріали і методи Птиця: Порода й умови вирощування Одноденних півників бройлерів Ross утримують у клітинах колективної батареї до віку 12 днів. Потім їх переводять в індивідуальні клітини для визначення балансу засвоюваності. Підтримують стандартну температуру і вологість. Постійний світловий режим складає: 23год. світла і 1год. темноти до 8-денного віку. Потім світловий режим змінюють на 15год. 30хв. світла і 8год. 30хв. темноти через випробування, які проводяться в тому ж приміщенні. Корми: Птахи одержують стандартний початковий корм до 12-денного віку, а потім одержують експериментальні корми. Експериментальні корми Корми містять 54% пшениці, що характеризується, %: суха речовина 86,2; сирий білок 10,87; ліпіди 1,65; β-глюкани 0,77; пентозани 6,8; відносна в’язкість при рН 4,5, мПа.с 1,34; відносна в’язкість при рН 1,5, мПа.с 1,29. Склад корму поданий у табл. 16, а його характеристики у табл. 17. Таблиця 16 Склад експериментальних кормів на основі пшениці Інгредієнт Здрібнена пшениця Ціла пшениця Тваринні жири Соєва мука (48%) М’ясна і кісткова мука Горох Ціле зерно рапсу Вітаміни /мінерали Вміст, % Здрібнена Ціла пшениця пшениця 53,84 23,84 30,0 3,52 3,52 18,26 18,26 5,64 5,64 7,0 7,0 10,0 10,0 1,74 1,74 35 77381 Таблиця 17 Характеристика експериментальних кормів на основі пшениці Встановлена поживна цінність, % Білок Жир Лізин Метіонін Met+Cyz Кальцій Доступний фосфор, % Зразок корму Здрібнена Ціла пшениця*) пшениця**) 20,6 20,5 9,6 9,6 1,05 1,04 0,45 0,45 0,85 0,85 0,90 0,90 0,35 0,35 Примітки: *) Обмінна енергія – 3173ккал/кг. **) Обмінна енергія – 3188ккал/кг. 2.2. Вимір очевидної обмінної енергії Баланс починають визначати з 17-го дня за такою схемою: 36 Д 17 - птахам не дають корму протягом ночі; Д 18 - птахів зважують, очищають складальні.лотки; Д 19 - фекалії збирають і заморожують; Д 20 - фекалії збирають і заморожують, уночі не дають корму; Д 21 - фекалії збирають і заморожують, птахів зважують і знову годують. Фекалії сушать виморожуванням і подрібнюють як корм (1мм, подрібнювач Retsch). Загальну енергію корму і екскрету визначають за допомогою адіабатичного колориметра ІКА С5000. Визначають також вміст білків (N*6,25, Kjeidahl метод Z130 для кормів і Z135 для фекалій) і ліпідів (метод Z160). Склад амінокислот також визначають, використовуючи ВЕРХ (метод Z100 для кормів і Z080 для фекалій). Вміст фосфору в кормах і екскретах визначають, використовуючи AFNOR метод (NFV18106). b. Результаты й обговорення Очевидна обмінна енергія (ΑΜΕ) Характеристики росту і дані про обмінну енергію представлені в табл. 18. Таблиця 18 Вплив препарату ферментів (активність β-глюканази 100од./кг і активність ксиланази 1100од./кг) на AMEN кормів на основі пшениці (54% здрібнених або 24% здрібнених і 30% цілих зерен) для зростаючих бройлерів Показник Здрібнені зерна Збільшення маси тіла, г Споживаний корм, г Споживаний корм, г/день Показник перетворення корму 3 (FCR ), г/г Очевидна засвоюваність білків, % Очевидна засвоюваність ліпідів, % AMEN, ккал/кг DM AMEN, ккал/кг 172 11,8 282 20,5 94 6,8 Зразок корму на основі пшениці Суміш здрібнених зерен і Цілі зерна ферментів 170 13,1 167 8,9 272 17,2 274 15,5 91 5,7 91 5,2 1,64 0,05 1,60 0,06 a b 83,8 1,08 82,2 2,55 3577 76a 3194 67 85,9 1,14 88,0 2,10bc 3699 85b 3303 76 1,64 0,05 bc 86,5 0,77 86,6 2,45b, bc 3678 35b 3284 31 Суміш цілих зерен і ферментів 165 12,0 267 14,0 89 4,7 1,63 0,09 87,0 0,80c 89,2 1,25c 3779 34c 3375 31 Примітки: 1. Одинарний спосіб аналізу відхилень, ефект корму, н=47; а, Ь: значення з однаковими верхніми індексами не відрізняються при р0,05) і для маси яєць (Р>0,005), починаючи із другого періоду до кінця експерименту. Курки, яких годували кормом на основі ячменя, демонструють великий відсоток знесених яєць, і вони несли більш важкі яйця, ніж курки, яких годували пшеницею. Препарат ферментів, очевидно, підвищує ці параметри, але не значно, із величиною 0,05 рівня можливості. Таблиця 28 Параметри продуктивності несучок з 22 по 42 тижні (повний протокол експерименту) Обробка Т-1 Т-2 Т-3 Т-4 Яйценосність, Брудні яйця, Дефектні Маса яєць, Витрати %*) % яйця, % г корму, г 75,6b 77,1b 78,0ab 81,2a 1,3 7,9a 6,6ab 5,3b 6,6ab 0,4 0,8 1,1 1,0 1,0 0,2 62,29b 62,66b 63,76a 64,22a 0,4 101,5b 101,5b 109,4a 110,0a 1,5 Збільшення Ефект Смертність, маси курок, корму, І % г 2,158 219,8 1,7 2,100 222,6 0,8 2,203 231,8 2,5 2,211 227.7 5,0 0,028 16,8 1,4 47 77381 48 Продовження таблиці 28 Ефект обробки, Р 0,0402 0,0039 0,7796 0,0036 0,0003 0,0659 0,9586 0,2645 Примітка: - *) Порівняння з генетично досконалими курками (дані представлені постачальником курок). Величини є середніми з 8 повторів для 15 курок. Всередині колонок значення з наступними різноманітними індексами значно відрізняються. У всіх експериментальних періодах споживання корму птахами для Т-3 і Т-4 обробок (ячмінний корм) було вище, ніж споживання птахами, яким давали пшеницю, через енергетичні рівні обох кормів (ячмінний корм відповідає 2600ккал/кг енергії, тоді як пшеничний корм відповідає 2800ккал/кг). Враховуючи різні енергії кормів обох типів і споживання птахами корму, у весь період для всіх птахів щоденне споживання енергії було однаковим. Ефективність корму (виражена як (г корму)/(г яєць) для експериментальних кормів протягом першого періоду була дуже висока через малу кількість яєць для кожної курки протягом цього відрізка часу. У перші два періоди ефективність корму з пшениці була вище ефективності корму з ячменя; але в третьому періоді, коли був зареєст рований більш високий відсоток знесених яєць, обидва типи кормів надали подібної ефективності. Починаючи з 34 тижня до кінця експерименту, ячмінні корми демонстрували більш високу кормову ефективність, ніж пшеничні корми. Ферменти виявили тенденцію поліпшити кормову ефективність (Р>0,05). У всі періоди β-глюканаза підвищувала кормову ефективність ячмінного корму (с=0,066). В табл. 29 показано, що несучки, яких годували пшеницею з добавкою препарату ферментів, мали тенденцію до демонстрації більш високих значень яйценосності (+1,5 абс. точок) в середньому більш важких яєць (+0,37г) і більш низький показник перетворення корму (-2,7%) у порівнянні з кормами без добавок. Таблиця 29 Вплив препарату ферменту на параметри продуктивності несучок, яких годували пшеничним кормом Період, тижні Рівень яйценосності, % Маса яєць, г 22-26 26-30 30-34 34-38 38-42 Всього, %*) +1,0 +1,1 +1,4 +2,1 +2,3 (+1,5)-(+2,0) -0,3 +0,7 +0,8 +0,6 -0,5 (+0,37)-(+0,6) Показник перетворення корму, % 1 2 +0,067 -1,9 -0,098 -4,7 -0,039 -2,0 -0,039 -2,0 -0,042 -2,2 -0,058 -2,7 Примітка: - *) Для періоду 22-42 тижні. Табл. 30 демонструє, що додавання препарату ферментів до ячмінного корму для несучок підвищує яйценосність (+4%) середню масу яєць (+0,7%) і показник перетворення корму (-5,7%) у порівнянні із контрольними ячмінними кормами. Таблиця 30 Вплив препарату ферменту на параметри продуктивності несучок, яких годували ячмінним кормом Період, тижні Рівень яйценосності, % Маса яєць, г 22-26 26-30 30-34 34-38 38-42 Всього, %*) +3,7 +3,0 +1,9 +3,3 +0,9 (-3,2)-(+4,0) +1,0 +0,5 +0,5 +0,6 +0,3 (+0,37)-(+0,6) Примітка: - *) Для періоду 22-42 тижні. Показник перетворення корму, % 1 2 -0,381 -9,0 -0,137 -6,3 -0,015 -0,8 -0,067 -3,5 -0,082 -4,2 -0,092 -5,7 49 77381 50 51 77381 52 53 Комп’ютерна верстка В. Сердюк 77381 Підписне 54 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;penicillium funiculosum strain, enzymes mixture obtained therefrom and compositions containing enzymes mixture for animal feeding
Назва патенту російськоюШтамм penicillum funicolosum, смесь ферментов, получаемых из этого штамма, и композиции, которые содержат смесь ферментов для кормления животных
МПК / Мітки
МПК: C12N 9/18, C12N 15/09, A23K 1/165, A23K 1/18, C12N 9/42, C12N 1/14, C12N 9/24, C12N 5/10, C12N 1/21, C12N 9/16, C12N 1/19, C12N 11/00, C12N 1/15, A23K 3/03
Мітки: тварин, містять, штаму, годівлі, штам, композиції, funiculosum, penicillium, суміш, одержуваних, цього, ферментів
Код посилання
<a href="https://ua.patents.su/27-77381-shtam-penicillium-funiculosum-sumish-fermentiv-oderzhuvanikh-z-cogo-shtamu-ta-kompozici-shho-mistyat-sumish-fermentiv-dlya-godivli-tvarin.html" target="_blank" rel="follow" title="База патентів України">Штам penicillium funiculosum, суміш ферментів, одержуваних з цього штаму, та композиції, що містять суміш ферментів для годівлі тварин</a>
Попередній патент: Ванна для нанесення покриття на прокат
Випадковий патент: Спосіб диференційної діагностики функціональної печії та гастроезофагеальної рефлюксної хвороби