Спосіб сульфінілування похідної піразолу
Номер патенту: 98474
Опубліковано: 25.05.2012
Автори: Кайл Міхаель, Грьонінг Карстен, Зукопп Мартін, Лонглет Джон Дж., Кун Олівер
Формула / Реферат
1. Спосіб сульфінілування похідної піразолу, який характеризується тим, що 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрил (II) піддають реакції із сульфінілувальним агентом, вибраним із трифторметилсульфінової кислоти, ангідриду трифторметилсульфінової кислоти, солі трифторметилсульфінату лужного або лужноземельного металу й сумішей кислоти та/або солі(ей), у присутності принаймні одного аміно/кислотного комплексу, де амін(и) вибраний(і) з третинних амінів, а кислота(и) вибрана(і) із фтористоводневої, хлористоводневої, п-толуолсульфонової кислоти, бензолсульфонової кислоти, ксиленсульфонової кислоти, метансульфонової кислоти й трифторметилсульфонової кислоти, з додаванням галогенувального агента.
2. Спосіб відповідно до пункту 1, де галогенувальний агент вибирають з тіонілхлориду, тіонілброміду, фосфороксихлориду, оксалілхлориду, фосгену, трифосгену ((ССl3)2С(=О)), хлорформіатів, фосфорпентахлориду, фосфортрихлориду, трихлорметилхлорметаноату й хлориду ксиленсульфонової кислоти.
3. Спосіб відповідно до пунктів 1 або 2, де галогенувальний агент являє собою хлорувальний агент, вибраний з тіонілхлориду й фосфороксихлориду.
4. Спосіб відповідно до будь-якого з пунктів 1-3, де амін аміно/кислотного комплексу вибирають з алкіламінів триметиламіну, триетиламіну, трипропіламіну, триізопропіламіну, трибутиламіну, диметилетиламіну, діетилметиламіну, диметил-н-пропіламіну, діізопропілетиламіну, DBU (1,8-діазобіцикло[5.4.0]ундец-7-ену), DBN (1,5-діазобіцикло[4.3.0]нон-5-ену), метилморфоліну, етилморфоліну, N,N-диметиланіліну, метилпіперидину, метилпіролідину або метилдіабензиламіну; і ароматичних амінів піридину, DMAP (диметиламінопіридину), колідину, лутидину, піримідину, піразину й піперазину.
5. Спосіб відповідно до будь-якого з пунктів 1-4, де амін аміно/кислотного комплексу вибирають із триметиламіну, триетиламіну, диметилетиламіну, диметил-н-пропіламіну або піридину, переважно із триметиламіну, триетиламіну й піридину.
6. Спосіб відповідно до будь-якого з пунктів 1-5, де принаймні одна з алкільних груп, приєднаних до атома азоту аміну, являє собою метильну групу.
7. Спосіб відповідно до будь-якого з пунктів 1-6, де атом азоту групи аміну є sр3-гібридизованим i не утворює подвійного зв'язку із сусіднім атомом.
8. Спосіб відповідно до будь-якого з пунктів 1-7, де кислоту аміно/кислотного комплексу вибирають із хлористоводневої кислоти й п-толуолсульфонової кислоти.
9. Спосіб відповідно до будь-якого з пунктів 1-8, де сульфінілувальний агент вибирають із трифторметилсульфінової кислоти, солі трифторметилсульфінату натрію, солі трифторметилсульфінату калію і їх сумішей.
10. Спосіб відповідно до будь-якого з пунктів 1-9, де реакцію проводять в органічному розчиннику, який вибирають з толуолу, бензолу, ксилену, трифторметилбензолу, монохлорбензолу, дихлорбензолу й етилбензолу.
11. Спосіб відповідно до будь-якого з пунктів 1-10, де 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрил з'єднують із реакційною сумішшю сульфінілувального агента, аміно/кислотного комплексу й галогенувального агента.
12. Спосіб відповідно до будь-якого з пунктів 1-11, де використовують від 1,4 до 2,2 молярних еквівалентів аміно/кислотного комплексу по відношенню до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу.
13. Спосіб відповідно до будь-якого з пунктів 1-12, де використовують від 1,15 до 1,35 молярних еквівалентів галогенувального агента по відношенню до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу.
14. Спосіб відповідно до будь-якого з пунктів 1-13, де використовують від 1,0 до 1,35 молярних еквівалентів сульфінілувального агента по відношенню до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу.
15. Спосіб відповідно до будь-якого з пунктів 1-14, де після комбінації 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу, сульфінілувального агента, аміно/кислотного комплексу й галогенувального агента температуру підвищують до 30-55 °С, переважно до 30-39 °С, протягом 5-60 хвилин.
16. Спосіб відповідно до будь-якого з пунктів 1-15, де продукт реакції 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил викристалізовують з розчину монохлорбензолу, дихлорбензолу, етилбензолу або толуолу.
17. Спосіб відповідно до будь-якого з пунктів 1-16, де на додатковому етапі 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил рецептують у вигляді пестицидної композиції.
18. Спосіб відповідно до будь-якого з пунктів 1-16, де на додатковому етапі 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил рецептують у вигляді ветеринарно прийнятної паразитицидної композиції.
19. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 1-16.
20. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 3-16, що містить менше 20 част. на млн. брому.
21. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 1-16, або відповідно до пункту 20, що містить менше 10 част. на млн. сполуки D
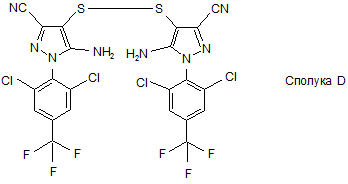 .
.
22. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 1-16, або відповідно до пунктів 20 або 21, і в атмосфері інертного газу, що містить менше 200 част. на млн. сполук, що містять сірку в окисленому стані (IV).
23. Пестицидна або паразитицидна композиція, що містить 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил, як визначено в будь-якому з пунктів 19-22.
24. Застосування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, для боротьби зі шкідниками.
25. Застосування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, для боротьби зі шкідниками й паразитами тварин.
26. Спосіб контролю комах, кліщів або нематод шляхом контакту комах, кліщів або нематод або їх кормових ресурсів, середовища перебування, місця розмноження або їх вогнища з пестицидно ефективною кількістю 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22.
27. Спосіб захисту зростаючих рослин від нападу або інвазії комахами, кліщами або нематодами шляхом застосування до листя або насіння рослин, до ґрунту або до води, у якій вони ростуть, пестицидно ефективної кількості 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22.
28. Спосіб, як заявлено в пунктах 26 або 27, де 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил застосовують у кількості від 5 до 2000 г/га.
29. Спосіб лікування, контролю, запобігання або захисту тварин від інвазії або інфекції паразитами, що включає пероральне, місцеве або парентеральне введення або застосування до тварин або середовища їх перебування паразитицидно ефективної кількості 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, або його ветеринарно прийнятних енантіомерів або солей.
30. Спосіб одержання композиції для лікування, контролю, запобігання або захисту тварин від інвазії або інфекції паразитами, що включає змішування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, або його ветеринарно прийнятних енантіомерів або солей з ветеринарно прийнятним носієм.
31. Спосіб відповідно до пункту 30, де 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил або його ветеринарно прийнятний енантіомер або сіль присутні в паразитицидно ефективній кількості.
Текст
Реферат: Даний винахід стосується нового способу сульфінілування похідної піразолу, в якому 5-аміно-1[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрил (II) піддають реакції із сульфінілувальним агентом, вибраним із трифторметилсульфінової кислоти, ангідриду трифторметилсульфінової кислоти, солі трифторметилсульфінату лужного або лужноземельного металу й сумішей кислоти та/або солі(ей), у присутності принаймні одного аміно/кислотного комплексу, де амін(и) вибраний(і) з третинних амінів, а кислота(и) вибрана(і) із фтористоводневої, хлористоводневої, бромистоводневої, йодистоводневої кислот й похідних сульфонової кислоти, з додаванням галогенувального агента. UA 98474 C2 (12) UA 98474 C2 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується нового способу сульфінілування похідної піразолу, який характеризується тим, що 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрил (II) піддають реакції із сульфінілувальним агентом, вибраним із трифторметилсульфінової кислоти, ангідриду трифторметилсульфінової кислоти, солі трифторметилсульфінату лужного або лужноземельного металу й сумішей кислоти та/або солі(ей), у присутності, принаймні, одного аміно/кислотного комплексу, де амін(и) вибраний(і) із третинних амінів, а кислота(и) вибрана(і) із фтористоводневої, хлористоводневої, бромистоводневої і йодистоводневої кислоти й похідних сульфонової кислоти, і з додаванням галогенувального агента. Сульфінілування сполуки піразольного типу стосується заміщення атома водню на атомі вуглецю піразольного гетероциклу RS(=O)-гpyпою. Безпосереднє сульфінілування різних органічних молекул (не включаючи похідні піразолу) при використанні суміші Р(О)СІ3 і CF3S(O)ONa було описано в Т. Billard, A. Greiner, В.R. Langlois, Tetrahedron 55 (1999), стор. 7243 - 7250. Крім того, С. Wakselman, M. Tordeux, C. Freslon, L. Saint-Jalmes, Synlett 2001, стор. 550-552, показали, що безпосереднє сульфінілування ароматичних сполук відбувається за допомогою CF 3S(O)ONa або CF3S(O)OK у присутності трифлатної кислоти (CF3S(O)2OH). Способи для безпосереднього сульфінілування 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу (II) були описані в ЕР-А 668 269, ЕР-А 1 331 222, CN-A 1374298, і в Y.Huilong, M. Zengeng, W. Shujuan, J. Hebei University of Science of Technology, том 25(2), Sum 69 (2004), cep. № 1008-1542 (2004)02-0018-03. В ЕР 668 269 було описано сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]1Н-піразол-3-карбонітрилу (II) за допомогою трифторметилсульфінової кислоти CF3S(O)OH і її похідних CF3S(O)CI, CF3S(O)ONa, CF3S(O)N(CH3)2 або CF3S(O)N(CH2CH3)2. Як хлорувальний реагент згадуються фосген, хлорформіати, РСІ 5 і SOCI2. Описується, що реагент ("сполука С"), яка вибрана із групи, яка складається з тозилатів, гідрохлоридів і мезилатів первинного, вторинного або третинного аміну, переважно з диметиламіну, піридину, триметиламіну, діетиламіну або ізопропіламіну або газоподібного хлористого водню, необов'язково в присутності еквімолярної кількості паратолуолсульфонової кислоти, може додаватися для завершення реакції. Наводяться приклади для наступних комбінацій реагентів: CF3S(O)CI, диметиламін п-тозилат; CF3S(O)CI, піридин гідрохлоридна сіль; CF3S(O)N(CH3)2, п-толуолсульфонова кислота, хлористоводнева кислота; CF3S(O)CI, диметиламін п-тозилат, хлористоводнева кислота; і CF3S(O)ONa, диметиламін п-тозилат, SOCI2. Реакції, які здійснюють при використанні CF3S(O)CI як сульфінілувальний агент, дають найвищий вихід кінцевого продукту. Спосіб, описаний в CN-A 1374298, був удосконалений для подолання деяких недоліків процесу, описаного в ЕР 668 269. CN-A 1374298 посилається на те, що CF3S(O)CI є вкрай нестабільною сполукою, CF3S(O)N(CH3)2 і CF3SOOH є відносно складними для одержання, а реактивність CF3S(O)ONa невисока, а також що вихід реакції сульфінілування є відповідно низьким. CN-A 1374298 описує сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]1Н-піразол-3-карбонітрилу (II) при використанні калієвої солі трифторметилсульфінової кислоти, CF3S(O)OK або сумішей калієвої й натрієвої солі трифторметилсульфінової кислоти, CF 3S(O)OK з CF3S(O)ONa, де сульфінілувальний агент з'єднують із РОСІ3, РСІ3, SOCI2, COCI2 або трихлорметилхлорметаноатом. Необов'язково, аміно/кислотний комплекс диметиламін птозилат може додаватися для завершення реакції. Наводяться приклади для наступних комбінацій реагентів: CF3S(O)OK; диметиламін п-тозилат; РОСІ3; і CF3S(O)OK/Na; диметиламін п-тозилат; SOCI2. Huilong і ін. описує реакцію 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу (II) з натрієвою сіллю трифторметилсульфінової кислоти (CF 3S(O)ONa), диметиламін п-тозилатом і SOCI2, з додаванням каталітичних кількостей ДМФ (диметилформаміду). В ЕР-А 1 331 222, 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрил (II) піддають сульфінілуванню при використанні N-трифторметилсульфінілсукциніміду як сульфінілувального агента в присутності триетиламіну й без додавання хлорувального реагенту. Ізолюють проміжну сполуку N-трифторметилсульфініламінопіразол і в умовах 1 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 60 перестановки Тіа-Фріса перетворюють його в заключний продукт 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил. Таким чином, сульфінілуванню 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу (II) до заключного продукту 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрилу (звичайна назва: фіпроніл)) була приділена значна увага в літературі, при цьому центр уваги був спрямований на оптимізацію сульфінілувального агента. Однак, а також відповідно до того, що вказано в недавній оглядовій статті "Дослідницький прогрес у синтезі фіпронілу і його основні проміжні сполуки", Chinese Journal of Pesticides, 2004, том 43, №.12, 529-531, сульфінілування піразольної проміжної сполуки усе ще є в загальному випадку неприйнятним для промислового одержання в більших кількостях. Продуктом реакції даного процесу сульфінілування є фіпроніл, який являє собою ринковий інсектицид значного інтересу. У загальному випадку процеси технічного виробництва пестицидів повинні відповідати високим вимогам відносно виходу й чистоти продукту із причин рентабельності, а також, що є більш важливим, для того, щоб уникнути присутності потенційно токсичних побічних продуктів. Це особливо стосується фіпронілу, оскільки він також використовується в продуктах для захисту тварин і, таким чином, контактує зі свійськими тваринами. Крім того, узаконеною вимогою до процесу технічного виробництва є запобігання впливу на працівників фабрики, а також на навколишнє середовище реагентів, які можуть мати шкідливий вплив на здоров'я працівників або навколишнє середовище. Таким чином, є бажаним мати процес технічного виробництва, що дозволяє уникнути застосування токсичних реагентів, таких, як CF3S(O)CI. Крім того, при переведенні процесу від лабораторних масштабів до технічних масштабів можуть виникати проблеми, яких не існувало як таких або які до певного ступеня не можна було передбачити в лабораторії. - Наприклад, завантаження та/або розчинення об'ємних вихідних матеріалів може зайняти набагато більше часу при більших масштабах, ніж у маленькій колбі, з тим ефектом, що кінетика реакції істотно змінюються й, таким чином, змінюється процес перетворення й спектр одержуваних продуктів. - Інший приклад, який може бути згаданий, являє собою появу побічних продуктів, які завдяки їх розчинності або структурі складно відокремити від бажаного основного продукту в більших масштабах. Можуть виникати проблеми з екстракцією, фільтруванням і засміченням фільтра. Нерозчинні вихідні матеріали або побічні продукти реакції можуть також потребувати перемішування, нагрівання при розчиненні або прокачування за допомогою помпи, що, таким чином, приводить до утворення негомогенних реакційних сумішей. - Ще однією проблемою є контроль температури реакції при великомасштабних процесах. Температурні режими в загальному випадку є більш низькими, що може впливати на спектр побічних продуктів. Оскільки високі значення температури реакції та/або агресивне реакційне середовище можуть викликати корозію, а також з економічних причин, помірні умови реакції (низькі температури) є переважними. - Гігроскопічні властивості твердих речовин можуть ускладнювати реакції, які сприятливо проходять в умовах при істотній відсутності води. Наприклад, коли процес, як визначено вище, проводять із використанням аміно/кислотного комплексу, де кислота являє собою H 2SO4, а не кислоти, як визначено для процесу відповідно до винаходу, вихід продукту реакції може бути вкрай низьким. - У процесі відповідно до винаходу переважно використовуються нереакційноздатні каталізатори, такі, як третинні аміни, наприклад, кислоти триетиламіну, для того, щоб уникнути утворення побічних продуктів реакції. Вторинні або первинні аміни можуть реагувати із сульфінілувальним агентом. - З метою поліпшення процесу обробки переважно використовують реагенти, які можуть бути вилучені при використанні процесу дистиляції. Тверді речовини видаляють шляхом промивання кислотними або лужними розчинниками. Не є переважним використовувати реагенти, які мають властивості міжфазних каталізаторів і можуть перешкоджати розділенню фаз у процесі обробки. У цьому контексті й з урахуванням того факту, що одним з основних вихідних матеріалів для сучасного промислового одержання фіпронілу є CF3Br (дивися, наприклад, WO 01/30760), що демонструє високу токсичність для навколишнього середовища й передбачається як такий, який підлягає вилученню із процесу виробництва відповідно до Монреальського Протоколу з речовин, які виснажують озоновий шар (він може використовуватися тільки як вихідний матеріал 2 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 60 для продукції), задачею даного винаходу є розробка нового великомасштабного промислового способу виробництва фіпронілу, що забезпечує одержання фіпронілу з високим ступенем чистоти й високим виходом, дозволяючи в той же час уникнути застосування небезпечних реагентів і уникнути проблем, пов'язаних з технічним контролем реакції. Таким чином, був відкритий спосіб, визначений на початку. Отриманий продукт фіпроніл є прийнятним для застосування як пестицид для сільськогосподарських цілей, а також для несільськогосподарського застосування для боротьби зі шкідниками. Крім того, отриманий фіпроніл є прийнятним для використання в галузі ветеринарії для боротьби зі шкідниками й паразитами тварин, зокрема, для тривалого захисту від бліх і кліщів у ссавців. Таким чином, даний винахід також стосується пестицидної або паразитицидної композиції, що містить 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3карбонітрил, отриманий при використанні способу відповідно до винаходу. Крім того, даний винахід стосується способу контролю комах, кліщів або нематод шляхом контакту комах, кліщів або нематод або їх кормових ресурсів, середовища перебування, місця розмноження або їх вогнища, з пестицидно ефективною кількістю 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу відповідно до винаходу, а також способу захисту зростаючих рослин від нападу або інвазії комахами, кліщами або нематодами шляхом застосування до листя або насіння рослин, до ґрунту або до води, у якій вони ростуть, пестицидно ефективної кількості 5аміно-1 -[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3карбонітрилу, отриманого за допомогою способу відповідно до винаходу. Відповідно до цих способів 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3карбонітрил звичайно застосовують у кількості від 5 г/га до 2000 г/га. Разом з тим, даний винахід стосується способу лікування, контролю, запобігання або захисту тварин від інвазії або інфекції паразитами, що включає пероральне, місцеве або парентеральне введення або застосування до тварин або до їх середовища перебування паразитицидно ефективної кількості 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу відповідно до винаходу, або його ветеринарно прийнятних енантіомерів або солей. Даний винахід також стосується способу одержання композиції для лікування, контролю, запобігання або захисту тварин від інвазії або інфекції паразитами, що включає змішування 5аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу відповідно до винаходу, або його ветеринарно прийнятних енантіомерів або солей, з ветеринарно прийнятним носієм. Композиція може бути або у вигляді концентрату, або містити 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрил у паразитицидно ефективній кількості. Незважаючи на те, що приклади наведені для певних аміно/кислотних комплексів, які додаються спочатку або в процесі реакції сульфінілування, не існує догм щодо критичної важливості специфічної природи аміно/кислотного комплексу відносно контролю реакції або відносно виходу та/або чистоти заключного продукту фіпронілу. У жодному з документів рівня техніки не згадується про сприятливу комбінацію ключових ознак даного винаходу, зокрема, при використанні a) трифторметилсульфінової кислоти, ангідриду трифторметилсульфінової кислоти або солі трифторметилсульфінату лужного або лужноземельного металу й сумішей кислоти та/або солі(ей) як сульфінілувальних агентів, і b) принаймні, одного аміно/кислотного комплексу, де амін(и) вибраний(і) із третинних амінів, а кислота(и) вибрана(і) із фтористоводневої, хлористоводневої, бромистоводневої і йодистоводневої кислоти й похідних сульфонової кислоти. В ЕР-А1 668 269 сульфінілувальні агенти CF3S(O)CI, CF3S(O)N(CH3)2, CF3S(O)N(CH2CH3)2, CF3S(O)OH i CF3S(O)ONa, разом з фосгеном або SOCI2, або СІСО2С2Н5, описані як еквівалентні альтернативи в способах, що приводять до одержання фіпронілу і його близького аналога 5аміно-1-[2,6-дихлор-4-(пентафторсульфанил)феніл]-4-(трифтометилсульфініл)піразол-3карбонітрилу. Один приклад наведений для застосування CF3S(O)ONa, але не разом із третинними амінами як частиною аміно/кислотного комплексу. В ЕР-А1 668 269 наведений наступний список переважних амінів: тозилати, гідрохлориди або мезилати диметиламіну, піридину, триметиламіну, діетиламіну, ізопропіламіну. Наведено приклади для гідрохлориду піридину як аміно/кислотний комплекс, що однак використовується разом з CF3S(O)CI як сульфінілувальний агент. Новим об'єктом даного винаходу, таким чином, є сульфінілування 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу (II) при використанні сульфінілувального 3 UA 98474 C2 5 10 15 20 25 30 35 40 45 агента, вибраного із трифторметилсульфінової кислоти, ангідриду трифторметилсульфінової кислоти, солі трифторметилсульфінату лужного або лужноземельного металу й сумішей кислоти та/або солі(ей), у присутності, принаймні, одного аміно/кислотного комплексу, де амін(и) вибраний(і) третинних амінів, а кислота(и) вибрана(і) із фтористоводневої, хлористоводневої, бромистоводневої і йодистоводневої кислоти й похідних сульфонової кислоти, з додаванням галогенувального агента. Сульфінілувальний агент переважно вибраний із трифторметилсульфінової кислоти, ангідриду трифторметилсульфінової кислоти, солі трифторметилсульфінату натрію, солі трифторметилсульфінату калію і їх сумішей. Відповідно до переважного втілення даного винаходу сіль трифторметилсульфінату натрію використовується як сульфінілувальний агент. Відповідно до іншого переважного втілення даного винаходу сіль трифторметилсульфінату калію використовується як сульфінілувальний агент. Відповідно до ще одного переважного втілення даного винаходу трифторметилсульфінова кислота використовується як сульфінілувальний агент. Відповідно до ще одного переважного втілення даного винаходу ангідрид трифторметилсульфінової кислоти використовується як сульфінілувальний агент. Відповідно до переважного втілення винаходу суміш солей трифторметилсульфінату натрію й калію, у співвідношенні від 0,01:99,99 ваг.% до 50:50 ваг.% використовується як сульфінілувальний агент. Є переважним, коли використовується від 1,0 до 1,35 молярних еквівалентів, найбільш переважно 1,2 молярних еквівалентів, сульфінілувального агента по відношенню до 5-аміно-1[2,6-дихлор-4-(трифторметил)феніл]-1 Н-піразол-3-карбонітрилу. У переважному втіленні сульфінілувальний агент висушують перед його застосуванням до одержання його в істотно вільній від води формі. "Вільний від води" означає, що вміст води у твердій речовині не перевищує 5 част. на млн. – 100 част. на млн. Галогенувальний агент вибраний з тіонілхлориду, тіонілброміду, фосфороксихлориду, оксалілхлориду, фосгену, трифосгену ((ССІ3)2С(=О)), хлорформіатів, фосфорпентахлориду, фосфортрихлориду, трихлорметилхлорметаноату й хлориду ксиленсульфонової кислоти. Відповідно до переважного втілення винаходу хлорувальний агент використовується як галогенувальний агент. Переважно, коли тіонілхлорид або фосфороксихлорид застосовують як хлорувальний агент. Відповідно до іншого переважного втілення даного винаходу фосфороксихлорид використовується як хлорувальний агент. Найбільш переважно, коли тіонілхлорид використовується як хлорувальний агент. Переважно використовують від 1,15 до 1,35 молярних еквівалентів, найбільш переважно приблизно 1,2 молярні еквіваленти, галогенувального агента по відношенню до 5-аміно-1-[2,6дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. Ми виявили, що вибір аміно/кислотного комплексу відіграє ключову роль у сульфінілуванні 5-аміно-1 -[2,6-дихлор-4-(трифторметил)феніл]-1 Н-піразол-3-карбонітрилу. Критичні властивості, які впливають на реакцію сульфінілування, являють собою: просторові (об'ємні) властивості, значення рН, розчинність і молекулярна вага. Реакція сульфінілування відповідно до даного винаходу являє собою синтез, що відбувається в одній посудині, двоетапної реакції. На першому етапі відбувається додавання 4 UA 98474 C2 CF3S(O)-групи до аміногрупи піразольного кільця. На другому етапі утворюється фіпроніл за допомогою перестановки Тіа-Фріса: 5 10 15 20 25 30 35 40 45 Аміно/кислотний комплекс має дві функції в цій двоетапній реакції: (1) коли сульфінілати використовуються як сульфінілувальні агенти, він каталізує активацію сульфінілату за допомогою галогенувального агента за допомогою проміжного утворення сульфінової кислоти. Для цього необхідні каталітичні кількості від 0,01 до 1,0 молярного еквівалента аміно/кислотного комплексу по відношенню до піразольної сполуки II. (2) Це прискорює перестановку Тіа-Фріса й дуже впливає на селективність. З метою одержання високого виходу продукту й високого ступеня чистоти загальні кількості понад 1 молярний еквівалент аміно/кислотного комплексу по відношенню до піразольної сполуки II переважно використовуються для етапу 2. Переважними є аміно/кислотні комплекси, які демонструють низьку гігроскопічність або істотно не мають гігроскопічності, оскільки спосіб сульфінілування відповідно до даного винаходу переважно здійснюють при істотній відсутності води (тобто від 5 до 100 част. на млн.). Переважні третинні аміни являють собою алкіламіни, такі, як триметиламін, триетиламін, трипропіламін, триізопропіламін, трибутиламін, диметилетиламін, діетилметиламін, диметил н-пропіламін, діізопропілетиламін, DBU (1,8-діазобіцикло[5.4.0]ундец-7-ен), DBN (1,5-діазобіцикло[4.3.0]нон-5-ен), метилморфолін, етилморфолін, N.N-диметиланілін, метилпіперидин, метилпіролідин або метилдіабензиламін; ароматичні аміни, такі, як піридин, DMAP (диметиламінопіридин), колідин, лутидин, піримідин, піразин або піперазин. У додатковому переважному втіленні третинний амін вибраний із триетиламіну, трипропіламіну, триізопропіламіну, диметилетиламіну, діетилметиламіну, диметил нпропіламіну, діізопропілетиламіну, DBU (1,8-діазобіцикло[5.4.0]ундец-7-ену), DBN (1,5діазобіцикло[4.3.0]нон-5-ену), метилморфоліну, етилморфоліну, N,N-диметиланіліну, метилпіперидину, метилпіролідину й метилдибензиламіну, DMAP (диметиламінопіридину), колідину, лутидину, піримідину, піразину або піперазину. В іншому переважному втіленні третинний амін вибраний з триметиламіну, триетиламіну, диметилетиламіну, діетилметиламіну, диметил н-пропіламіну, метилморфоліну, N,Nдиметиланіліну, метилпіперидину, метилпіролідину, метилдибензиламіну й піридину. Особливо переважними є триметиламін, триетиламін, диметилетиламін, диметил нпропіламін або піридин. Досить переважними є триетиламін і піридин. У найбільш переважному втіленні амін являє собою триетиламін. У найбільш переважному втіленні амін також являє собою піридин. У найбільш переважному втіленні амін також являє собою триметиламін. У найбільш переважному втіленні, принаймні, одна з алкільних груп, приєднаних до атома азоту, 3 являє собою групу метилу. У найбільш переважному втіленні атом азоту групи аміну є sp гібридизованим, тобто, він не утворює подвійного зв'язку із сусіднім атомом. Переважні кислоти аміно/кислотного комплексу для використання в даному винаході являють собою хлористоводневу кислоту, фтористоводневу кислоту, бромистоводневу кислоту або похідні сульфонової кислоти, такі, як ароматичні сульфонові кислоти, наприклад, птолуолсульфонову кислоту, бензолсульфонову кислоту, 4-етилбензолсульфонову кислоту, 4хлорбензолсульфонову кислоту, ксиленсульфонову кислоту, 2,3-диметилбензолсульфонову кислоту, 2,4-диметилбензолсульфонову кислоту, 2,5-диметилбензолсульфонову кислоту, 2,6диметилбензолсульфонову кислоту, 1-нафталінсульфонову кислоту, 2-нафталінсульфонову кислоту, суміші двох або більше ізомерів диметилбензолсульфонових кислот або мезитиленсульфонову кислоту; або алкілсульфонові кислоти, наприклад, метансульфонову 5 UA 98474 C2 5 10 15 кислоту або камфорсульфонову кислоту; або галоалкілсульфонові кислоти, наприклад, трифторметилсульфонову кислоту. Більш переважні кислоти аміно/кислотного комплексу для використання в даному винаході являють собою хлористоводневу кислоту, фтористоводневу кислоту, бромистоводневу кислоту, йодистоводневу кислоту або похідні сульфонової кислоти, такі, як ароматичні сульфонові кислоти, наприклад, п-толуолсульфонову кислоту, бензолсульфонову кислоту, ксиленсульфонову кислоту, мезитиленсульфонової кислоти; або алкілсульфонові кислоти, наприклад, метансульфонову кислоту; або галоалкілсульфонові кислоти, наприклад, трифторметилсульфонову кислоту. Особливо переважними є кислоти зі значенням рН, нижче 2. 3 аміно/кислотних комплексів, які використовуються в даному винаході, ті, які мають значення рН нижче 6, переважно 5, і вище 10, є переважними. Ще більш переважні кислоти являють собою хлористоводневу кислоту, п-толуолсульфонову кислоту, ксиленсульфонову кислоту або бензолсульфонову кислоту. Найбільш переважна кислота з погляду оптимізованого виходу являє собою хлористоводневу кислоту. Переважні аміно/кислотні комплекси Q наведені в Таблиці 1, що наведена нижче. 6 UA 98474 C2 7 UA 98474 C2 8 UA 98474 C2 9 UA 98474 C2 10 UA 98474 C2 11 UA 98474 C2 12 UA 98474 C2 5 10 15 Аміно/кислотні комплекси, у яких кислота являє собою хлористоводневу кислоту або бромистоводневу кислоту, зокрема, хлористоводневу кислоту, є переважними. Крім того, аміно/кислотні комплекси, у яких кислота являє собою п-толуолсульфонову кислоту, бензолсульфонову кислоту або ксиленсульфонову кислоту, є переважними. Аміно/кислотні комплекси Q-2, Q-5, Q-12, Q-17, Q-22, Q-32, Q-42, Q-52, Q-142, Q-145, Q-147, Q-162, Q-165, Q-172, Q-175, Q-212, Q-215, Q-222, Q-225, Q-232 і Q-235 є переважними. Більш переважними є аміно/кислотні комплекси Q-2, Q-5, Q-6, Q-7, Q-12, Q-82, Q-85, Q-86, Q-87, Q-102, Q-105, Q-106, Q-107, Q-112, Q-115, Q-116, Q-117, Q-122, Q-125, Q-126, Q-127, Q132, Q-135, Q-136, Q-137, Q-142, Q-145, Q-146, Q-147, Q-212, Q-215, Q-216, Q-217, Q-222, Q225, Q-226, Q-227, Q-232, Q-235, Q-236 і Q-237. Найбільш переважними є аміно/кислотні комплекси Q-2, Q-5, Q-6, Q-7, Q-12, Q-142, Q-145, Q-146, Q-147, Q-212, Q-215, Q-216, Q-217, Q-222, Q-225, Q-226, Q-227, Q-232, Q-235, Q-236 і Q237. Відносно їх застосування в способі відповідно до винаходу комбінації сульфінілувального агента й аміно/кислотного комплексу, наведені в таблицях, представлених нижче, є особливо переважними. 13 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таблиця 2 Сіль трифторметилсульфінат натрію використовується як сульфінілувальний агент, а аміно/кислотний комплекс у кожному випадку являє собою рядок Таблиці 1. Таблиця 3 Сіль трифторметилсульфінату калію використовується як сульфінілувальний агент, а аміно/кислотний комплекс у кожному випадку являє собою рядок Таблиці 1. Таблиця 4 Трифторметилсульфінова кислота використовується як сульфінілувальний агент, а аміно/кислотний комплекс у кожному випадку являє собою рядок Таблиці 1. Таблиця 5 Ангідрид трифторметилсульфінової кислоти використовується як сульфінілувальний агент, а аміно/кислотний комплекс у кожному випадку являє собою рядок Таблиці 1. Таблиця 6 Суміш солей трифторметилсульфінату натрію й калію, узятих у співвідношенні від 0,01:99,99 ваг.% до 50:50 ваг.%, використовується як сульфінілувальний агент, а аміно/кислотний комплекс у кожному випадку являє собою рядок Таблиці 1. Крім того, у додатковому втіленні даного винаходу кислоти Л'юіса, такі, як АІСІ 3, FeCI3, CaCI2, ZnCI2, BF3, ТіСl4 або ZrCI4, можуть використовуватися в обміні для протонних кислот, наведених вище. Може бути переважним додавати аміно/кислотний комплекс у вигляді двох частин, одну частину для етапу 1, а іншу частину після додавання піразолу формули II. Може бути переважним використовувати два різні аміно/кислотні комплекси під час здійснення реакції. Наприклад, перший аміно/кислотний комплекс може додаватися на етапі 1 у кількостях від 0,2 до 1 молярного еквівалента по відношенню до піразолу II, каталізуючи активацію сульфінілату за допомогою галогенувального агента. Після додавання піразолу формули II на етапі 2 перестановки Тіа-Фріса додають другий аміно/кислотний комплекс, відмінний від першого, у кількостях від 0,2 до 1 молярного еквіваленту по відношенню до піразолу II. Переважно, коли використовують від 1,4 до 2,2 молярних еквівалентів, найбільш переважно від 1,5 до 1,8 молярних еквівалентів, аміно/кислотного комплексу відповідно до даного винаходу по відношенню до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. Коли сульфінілувальний агент являє собою трифторметилсульфінову кислоту або суміш, що містить трифторметилсульфінову кислоту, молярну кількість аміно/кислотного комплексу, що є молярним еквівалентом до молярної кількості трифторметилсульфінової кислоти, переважно одержують in situ шляхом додавання аміну, а молярну кількість, що залишилася, необхідну для одержання необхідних 1,4 - 2,2 молярних еквівалентів, додають у вигляді аміно/кислотного комплексу. У переважному втіленні аміно/кислотний комплекс висушують перед його застосуванням доти, поки він не стане істотно вільним від води. "Вільний від води" означає, що вміст води у твердій речовині не перевищує кількості від 5 част. на млн. до 100 част. на млн. До реакційної суміші можуть переважно додаватися додаткові добавки, такі, як фторид калію, пентафторфенол, диметилформамід або 2,4-динітрофенол. Ці добавки переважно додають до реакційної суміші або розчину або суспензії вихідних матеріалів, відповідно, перед початком реакції або спочатку реакції. Найбільш переважно, коли добавки додають при низькій температурі в інтервалі від 5°С до 10°С. У переважному втіленні від 0,1 до 1,5 молярних еквівалентів фториду калію по відношенню до 5-аміно-1 -[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу додають до реакційної суміші, розчину або суспензії вихідних матеріалів, відповідно, при температурі від 5°С до 10°С під час або спочатку реакції. Є переважним додавати пентафторфенол, диметилформамід, або 2,4-динітрофенол у каталітичних кількостях або в кількості 0,10 молярного еквівалента по відношенню до 5-аміно-1[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. У переважному втіленні добавку висушують перед застосуванням до стану, істотно вільного від води. "Вільний від води" означає, що вміст води у твердій речовині не перевищує від 5 част. на млн. до 100 част. на млн. Реакцію можна проводити в інертному органічному розчиннику, переважно вибраному з - аліфатичних, аліциклічних або ароматичних, необов'язково галогенованих вуглеводнів, таких, як ароматичні органічні вуглеводні, наприклад, толуол, ксилен, трифторметилбензол, бензол, нітробензол, монохлорбензол, дихлорбензол і етилбензол, переважно толуол і ксилен, найбільш переважно, толуол; або аліфатичних або аліциклічних, необов'язково галогенованих 14 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 60 вуглеводнів, таких, як гексан, циклогексан, бензин, 1,2-дихлоретан, дихлорметан, трихлорметан (хлороформ), чотирихлористий вуглець, переважно 1,2-дихлоретан, дихлорметан, трихлорметан; і - етерів, наприклад, діетилетеру, діоксану, тетрагідрофурану, 2-метилтетрагідрофурану або етиленгліколь диметилового або діетилового етеру; і - кетонів, наприклад, ацетону або бутанону; і - нітрилів, наприклад, ацетонітрилу або пропіонітрилу; і амідів, наприклад, диметилформаміду, DMI (1,3-диметил-2-імідазолідинон), диметилацетаміду, N-метилформаніліду, N-метилпіролідону або триаміду гексаметилфосфорної кислоти, і - сульфоксидів, наприклад, диметилсульфоксиду. У переважному втіленні використовуються розчинники, які є істотно вільними від води. "Вільний від води" означає, що вміст води у твердій речовині не перевищує від 5 част. на млн. до 100 част. на млн. Найбільш переважний розчинник являє собою толуол, вільний від води. Реакцію здійснюють в атмосфері інертного газу, такого, як аргон, або в атмосфері азоту. У переважному втіленні використовують у цілому від 3,0 до 8,0 молярних еквівалентів, більш переважно від 4,0 до 7,5 молярних еквівалентів, і найбільш переважно від 4,5 до 6,5 молярних еквівалентів розчинника по відношенню до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Нпіразол-3-карбонітрилу. Така відносно висока концентрація вихідних матеріалів максимально підвищує перетворення в сульфінамідну проміжну сполуку. У випадках, коли вихідні матеріали розчиняються та/або суспендуються, відповідно, до їх об'єднання використовують приблизно від 25% до 40% розчинника для розчинення та/або суспендування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. У загальному випадку послідовність додавання вихідних матеріалів 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу, аміно/кислотного комплексу, сульфінілувального агента й галогенувального агента може бути вибрана будь-якою. Переважно, коли відповідні вихідні матеріали розчиняють або суспендують, відповідно, у реакційному розчиннику перед додаванням до реакційної суміші. Галогенувальний агент переважно не додається до 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу при відсутності аміно/кислотного комплексу або сульфінілувального агента в реакційній суміші. У переважному втіленні галогенувальний агент розчиняють у розчиннику й додають до реакційної суміші, що містить 5-аміно-1-[2,6дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрил, аміно/кислотний комплекс і сульфінілувальний агент, усі розчиняють або суспендують, відповідно, у розчиннику. У переважному втіленні 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрил (II) з'єднують із сумішшю, що містить сульфінілувальний агент, аміно/кислотний комплекс і галогенувальний агент. У цьому випадку може бути переважно включати першу порцію (рівну приблизно 1 молярному еквіваленту по відношенню до сполуки II) галогенувального агента в суміш, що містить сульфінілувальний агент, аміно/кислотний комплекс і галогенувальний агент, а потім додавати другу порцію (рівну приблизно від 0,1 до 0,2 молярного еквіваленту по відношенню до сполуки II) після додавання сполуки II і перемішування протягом приблизно від 30 до 60 хвилин і безпосередньо перед підвищенням температури до 30 - 50°С. Коли сульфінілувальний агент являє собою трифторметилсульфінову кислоту, може бути переважним одночасно додавати трифторметилсульфінову кислоту й галогенувальний агент до розчину або суспензії аміно/кислотного комплексу, після чого здійснюють додаток розчину 5аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу до реакційної суміші. В іншому переважному втіленні розчинену або суспендовану суміш сульфінілувального агента, аміно/кислотного комплексу й галогенувального агента в розчиннику (переважно толуолі) охолоджують до температури приблизно 3°С - 10°С, а розчин 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу в розчиннику (переважно толуолі), що нагрітий до температури 90°С - 110°С, з'єднують із охолодженою сумішшю. У переважному втіленні після комбінації 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Нпіразол-3-карбонітрилу, сульфінілувального агента, аміно/кислотного комплексу й хлорувального агента, температуру підвищують до 30°С -°55 С протягом 5 - 60 хвилин. Є також переважним витримувати реакційну суміш спочатку при температурі -20°С - 10°С протягом 5-60 хвилин, переважно 20 - 40 хвилин, після чого підвищувати температуру до 30°С 55°С при швидкості 5°С / хв. - 45°С / хв. Є переважним, коли для одержання продуктів високої чистоти температуру реакційної суміші підвищують до температури не вище 35°С. Коли сульфінілувальний агент являє собою або містить CF 3S(O)OH, то первинна температура реакції 15 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 переважно становить -20°С - 5°С, у випадку солей трифторметилсульфінату лужних або лужноземельних металів первинна температура реакції переважно становить -5°С - 10°С. Час реакції залежить від температури реакції, контролю температури в процесі реакції й різних реагентів і розчинників. Фахівець у даній галузі техніки буде здатний визначити прийнятний час реакції для того, щоб досягти бажаного виходу й чистоти. Типово, час реакції буде становити приблизно від 5 до 15 годин, переважно, від 10 до 15 годин. У додатковому переважному втіленні реакцію здійснюють в апарату високого тиску при тиску від 1,013 бар (1 атм) до приблизно 4 бар. Після завершення реакції фіпроніл можна ізолювати шляхом використання традиційних способів, таких, як гасіння реакції за допомогою гідрокарбонатів, таких, як NaHCO 3, карбонатів, таких, як NaCO3, або гідроокисів, таких, як NaOH, екстракція фіпронілу за допомогою неполярного органічного розчинника, такого, як етилацетат або метил-трет-бутиловий етер, промивання екстракту, наприклад, за допомогою гідрокарбонатів, таких, як NaHCO 3, концентрування екстракту, наприклад, у вакуумі, кристалізація фіпронілу, тощо. Ізольований фіпроніл може піддаватися очищенню за допомогою способу, такого, як хроматографія, перекристалізація тощо, якщо буде потреба. Кристалізацію заключного продукту 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрилу звичайно здійснюють із розчину неполярного, інертного, переважно ароматичного, розчинника з нереактивним замісником, таким, як хлор, фтор, ціано, нітро, С 1-С8-алкіл або С1С8-галоалкіл, зокрема, з розчину в бензолі, етилбензолі, монохлорбензолі, монофторбензолі, 1,2-дихлорбензолі, 1,3-дихлорбензолі, 1,4-дихлорбензолі, толуолі, о-ксилені, м-ксилені, пксилені, стирені, ізопропілі, бензолі, н-пропілбензолі, 2-хлортолуолі, 3-хлортолуолі, 4хлортолуолі, трет-бутилбензолі, втор-бутилбензолі, ізобутилбензолі, н-бутилбензолі, 1,3діізопропілбензолі, 1,4-діізопропілбензолі, 2-нітротолуолі, 3-нітротолуолі, 4-нітротолуолі, нітробензолі, бензонітрилі, мезитилені, трифторметилбензолі, 1,2-дихлоретані, ацетонітрилі, диметилсульфоксиді, тетрагідрофурані, ацетоні, спиртах, таких, як метанол, етанол, нпропанол, ізопропанол, н-бутанол, ізобутанол, 2-бутанол або трет-бутанол, переважно, з розчину в монохлорбензолі, дихлорбензолі, етилбензолі або толуолі. Переважно, кристалізацію здійснюють із монохлорбензолу. Переважно, кристалізацію здійснюють із дихлорбензолу. Переважно, кристалізацію здійснюють із етилбензолу. Переважно, кристалізацію здійснюють із толуолу. Може бути переважним додавати приблизно від 1 до 30 відсотків полярного розчинника, такого, як кетони, аміди, спирти, естери або етери, переважно, естери, кетони або етери, такі, як ацетон, метил етилкетон, пентан-2-ол, діетилкетон, 4-метил-2-пентанон, 3-метилбутан-2-он, трет-бутил-метилкетон, циклогексанон, метилацетат, етилацетат, ізопропілацетат, Nбутилацетат, ізобутилацетат, діетилкарбонат, 2-бутоксиетилацетат, диметилформамід, диметилацетамід, диметилсульфоксид, нітрометан, нітроетан, вода, етанол, метанол, пропан-1ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, трет-бутанол, 2-метилпропан-1-ол, 2-метил пропан-2ол, пентан-3-ол, 2-метилбутан-1-ол, 3-метилбутан-1-ол, 1,2-етандіол, 1,3-пропандіол, 1,2пропандіол, циклогексанол, діоксан, тетрагідрофуран, діетиловий етер, метил трет-бутиловий етер, 2-метилтетрагідрофуран, ацетонітрил, пропіонітрил або їх суміші. В іншому втіленні фіпроніл кристалізується з води, необов'язково, з додаванням приблизно 1-30 відсотків полярного органічного розчинника. Очищення сировинного продукту можна здійснювати за допомогою фільтрації через деревне вугілля або двоокис кремнію або промивання водою. При одержанні способом відповідно до даного винаходу отриманий продукт фіпроніл у сировинній реакційній суміші до кристалізації містить менше 3,0 ваг.%, при підрахунку без розчинника, сполуки F, типового біологічно активного побічного продукту синтезу фіпронілу. 16 UA 98474 C2 5 10 15 20 25 30 35 40 Після очищення сировинного продукту за допомогою прийнятних способів, таких, як промивання й (пери-)кристалізація, фіпроніл, отриманий способом відповідно до винаходу, містить менше 1,0 ваг.% сполуки F. Крім того, отриманий продукт фіпроніл являє собою сполуку, вільну від сполуки D, яка є звичайним побічним продуктом сучасного великомасштабного промислового способу, як описано, наприклад, в WO 01/30760, навіть після очищення. Фіпроніл, отриманий способом відповідно до винаходу в інертній атмосфері, містить менше 300 част. на млн. сполук, що містять сірку у своєму окисленому стані (IV). Він також є вільним від сполуки Е, що типово може утворюватися як побічний продукт при сучасному промисловому процесі. Приклади ВЕРХ проводили на Hewlett Packard HP 1200, Chemstation, оснащеному колонкою J'Sphere ODS-H80, 4 мкм, 4,6 х 250 mm (YMC), елюент А: 90 ваг.% води + 10 ваг.% ацетонітрилу, елюент В: 10 ваг.% води + 90 ваг.% ацетонітрилу, швидкість витікання: 0,85 мл/хв., визначення: 235 нм, Виходи, наведені нижче, представлені в мольних відсотках отриманого очищеного кристалічного продукту після обробки. Чистота наведена у вагових відсотках отриманої твердої речовини. Приклад 1: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу з використанням гідрохлориду триетиламіну, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. У тригорлу круглодонну колбу на 50 мл, обладнану магнітною мішалкою й термометром, поміщали висушений у вакуумі трифторметилсульфінат натрію (4,29 г, 27,5 ммоля), висушений у вакуумі гідрохлорид триетиламіну (5,16 г, 37,5 ммоля) і 13 мл безводного толуолу (6,5 молярних еквівалентів по відношенню до 5-аміно-1 -[2,6-дихлор-4-(трифторметил)феніл]-1Нпіразол-3-карбонітрилу) в атмосфері аргону. Після охолодження до температури 0°С - 5°С при використанні льодяної бані повільно додавали тіонілхлорид (3,57 г, 30 ммолів) при підтриманні температури нижче 5°С. Після перемішування протягом наступних 30 хвилин висушений у вакуумі 5-аміно-1-(2,6-дихлор-4-трифторметилфеніл)-1Н-піразол-3-карбонітрил (8,03 г, 25 ммолів, 99% чистоти) додавали при температурі 5С, а реакційну суміш нагрівали до 50°С протягом 5 хв. за допомогою попередньої нагрітої водяної бані. Підтримували температуру на рівні 50°С протягом наступних 6 годин перед тим, як погасити реакцію за допомогою 50 мл насиченого розчину NaHCO3. Отриману суспензію розводили 30 мл етилацетату. Після розділення фаз органічний шар промивали один раз насиченим розчином NaHCO3 (вихід сировинного продукту в органічній фазі визначали за допомогою кількісної ВЕРХ: 72%) і концентрували під зниженим тиском до осушення. Кристалізація сировинного продукту з киплячого толуолу (100 г) забезпечувала одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (8,06 г, вихід 1 6 70%, 94%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Н-ЯМР (Bruker DRX-500, d ДМСО): [част. на млн.]: 8,33 (s), 7,57 (s). Приклад 2: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу за допомогою гідрохлориду триетиламіну, трифторметилсульфінату калію й тіонілхлориду. 17 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 60 У тригорлу круглодонну колбу на 50 мл, обладнану магнітною мішалкою й термометром, поміщали висушений у вакуумі трифторметилсульфінат калію (4,73 г, 27,5 ммоля), висушений у вакуумі гідрохлорид триетиламіну (5,16 г, 37,5 ммоля), тіонілхлорид (3,57 г, 30 ммолів) і 15 мл безводного толуолу в атмосфері аргону. Далі реакцію проводили так, як описано в Прикладі 1. Сировинний продукт викристалізовували з киплячого хлорбензолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (7,44 г, вихід 1 6 66%, 96%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Н-ЯМР (Bruker DRX-500, d ДМСО): [част. на млн.]: 8,33 (s), 7,57 (s). Приклад 3: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу за допомогою суміші трифторметилсульфінату натрію, гідрохлориду триетиламіну й тіонілхлориду до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. У тригорлу круглодонну колбу на 50 мл, обладнану магнітною мішалкою й термометром, поміщали висушений у вакуумі трифторметилсульфінат натрію (4,29 г, 27,5 ммоля), висушений у вакуумі гідрохлорид триетиламіну (5,16 г, 37,5 ммоля) і 10 мл безводного толуолу в атмосфері аргону. Після охолодження до температури 0°С - 5°С при використанні льодяної бані повільно додавали тіонілхлорид (3,57 г, 30 ммолів) при підтриманні температури нижче 5°С. Після перемішування протягом наступних 30 хвилин додавали охолоджений розчин сульфінової кислоти у вигляді однієї порції до перемішаної суспензії висушеного у вакуумі 5-аміно-1-(2,6дихлор-4-трифторметилфеніл)-1Н-піразол-3-карбонітрилу (8,03 г, 25 ммолів, 99% чистоти) в 5 г толуолу при температурі 50°С. Підтримували температуру на рівні 50°С протягом наступних 5 годин перед тим, як погасити реакцію за допомогою 50 мл насиченого розчину NaHCO 3. Отриману суспензію розводили 30 мл етилацетату. Після розділення фаз органічний шар промивали один раз насиченим розчином NaHCO3 і концентрували під зниженим тиском до осушення. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку 1 (7,25 г, вихід - 63%, 94%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Н-ЯМР 6 (Bruker DRX-500, d -ДMCO): [част. на млн.]: 8,33 (s), 7,57 (s). Приклад 4: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу за допомогою гідрохлориду триетиламіну, трифторметилсульфінової кислоти й тіонілхлориду. У тригорлу круглодонну колбу на 50 мл, обладнану магнітною мішалкою й термометром, поміщали трифторметилсульфінову кислоту (3,69 г, 27,5 ммоля), безводний триетиламін (2,78 г, 27,5 ммоля) і 10 г безводного толуолу в атмосфері аргону. Після охолодження до температури 0°С - 5°С при використанні льодяної бані повільно додавали тіонілхлорид (3,57 г, 30 ммолів) при підтриманні температури нижче 5°С. Після перемішування протягом наступних 30 хвилин додавали охолоджений розчин сульфінової кислоти у вигляді однієї порції до перемішаної суспензії висушеного у вакуумі 5-аміно-1-(2,6-дихлор-4-трифторметилфеніл)-1Н-піразол-3карбонітрилу (8,03 г, 25 ммолів, 99% чистоти) і висушеного у вакуумі гідрохлориду триетиламіну (1,38 г, 10,0 ммолів) в 5 г безводного толуолу в другій тригорлій круглодонній колбі на 50 мл, оснащеною магнітною мішалкою й термометром, що має температуру усередині 50°С. Підтримували температуру на рівні 50°С протягом наступних 5 годин перед тим, як погасити реакцію за допомогою 50 мл насиченого розчину NaHCO3. Отриману суспензію розводили 30 мл етилацетату. Після розділення фаз органічний шар промивали один раз насиченим розчином NaHCO3 і концентрували під зниженим тиском до осушення. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку 1 (7,25 г, вихід - 63%, 94%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Н-ЯМР 6 (Bruker DRX-500, d -ДMCO): [част. на млн.]: 8,33 (s), 7,57 (s). Приклад 5: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу за допомогою гідрохлориду триетиламіну, трифторметилсульфінату натрію й тіонілхлориду при додаванні фториду калію. У висушену в сушильній шафі тригорлу круглодонну колбу на 100 мл, обладнану магнітною мішалкою, термопарою, конденсатором, отвором для введення N 2 і гумовою перегородкою, поміщали висушений у вакуумі фторид калію (1,53 г, 26,1 ммоля), безводний толуол (20,1 г), висушений у вакуумі трифторметилсульфінат натрію (4,53 г, 29,0 ммоля) і тіонілхлорид (3,76 г, 31,6 ммоля) в атмосфері азоту. Розчин охолоджували до температури 0°С і повільно додавали гідрохлорид триетиламіну (5,44 г, 39,5 ммоля) при контролі температури на рівні нижче 10°С. Додавали висушений у вакуумі 5-аміно-1-(2,6-дихлор-4-трифторметилфеніл)-1Н-піразол-3карбонітрил (8,48 г, 26,1 ммолів, 99% чистоти) при 0°С. Потім розчин швидко нагрівали до 50°С протягом менше 5 хвилин при використанні гарячої водяної бані. Реакційну суміш залишали для 18 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 перемішування протягом 5 годин при 50°С перед тим, як погасити реакцію за допомогою 50 мл насиченого розчину NaHCO3. Отриману суспензію розводили 30 мл етилацетату й залишали стояти для розділення фаз. Водну фазу екстрагували при використанні 30 мл етилацетату, і об'єднані органічні фази промивали 30 мл насиченого водного розчину NaCO 3. Органічну фазу концентрували при зниженому тиску до осушення, що забезпечувало одержання вказаної в заголовку сировинної 1 6 сполуки (11,6 г, вихід -67%, 68,5%-на чистота). Н-ЯМР (Bruker DRX-500, d -ДМСО): [част. на млн.]: 8,33 (s), 7,57 (s). Приклад 6: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу за допомогою гідрохлориду триетиламіну, трифторметилсульфінату натрію й фосфороксихлориду У тригорлу круглодонну колбу на 50 мл, обладнану магнітною мішалкою й термометром, поміщали висушений у вакуумі трифторметилсульфінат натрію (8,84 г, 55,0 ммолів) і 40 мл сухого толуолу (6,8 молярних еквівалентів по відношенню до 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1 Н-піразол-3-карбонітрилу) в атмосфері азоту. Після охолодження до температури 0°С - 5°С при використанні льодяної бані повільно додавали фосфороксихлорид (9,20 г, 60,0 ммолів) при підтриманні температури реакційної суміші нижче 5°С. Після завершення додавання фосфороксихлориду додавали гідрохлорид триетиламіну (10,32 г, 75,0 ммолів) при температурі 5°С. Після перемішування протягом наступних 30 хвилин висушений у вакуумі 5-аміно-1-(2,6-дихлор-4-трифторметилфеніл)-1Н-піразол-3-карбонітрил (16,06 г, 50 ммолів, 99% чистоти) додавали при температурі 5°С, і реакційну суміш нагрівали при 50°С протягом 5 хв за допомогою попередньо підігрітої водяної бані. Підтримували температуру на рівні 50°С протягом наступних 6 годин перед тим, як погасити реакцію за допомогою 100 г 10% розчину NaHCO3. Отриману суспензію розводили 30 мл етилацетату. Після розділення фаз органічний шар піддавали аналізу за допомогою кількісної ВЕРХ (вихід - 57,3%). Приклад 7: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрил за допомогою тозилату піридину, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 1. Сировинний продукт викристалізовували з киплячого толуолу (100 г), одержуючи при цьому вказану в заголовку сполуку у вигляді білого кристалічного порошку (вихід - 75%, 94%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 8: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрил за допомогою гідрохлориду триметиламіну, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 1. Сировинний продукт викристалізовували з киплячого толуолу (100 г), одержуючи при цьому вказану в заголовку сполуку у вигляді білого кристалічного порошку (вихід - 71%, 97%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 9: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрил за допомогою гідрохлориду піридину, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 1. Сировинний продукт викристалізовували з киплячого толуолу (100 г), одержуючи при цьому вказану в заголовку сполуку у вигляді білого кристалічного порошку (вихід - 67%, 95%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 10: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу за допомогою гідрохлориду триетиламіну, трифторметилсульфінату калію й тіонілхлориду в 4,5 молярних еквівалентах толуолу. У тригорлу круглодонну колбу на 50 мл, обладнану магнітною мішалкою й термометром, поміщали висушений у вакуумі трифторметилсульфінат калію (5,16 г, 30 ммолів), висушений у вакуумі гідрохлорид триетиламіну (5,16 г, 37,5 ммоля) і 10,4 г безводні толуолу (4,5 молярних еквівалентів по відношенню до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу) в атмосфері аргону. Після охолодження до температури 0°С - 5°С із зовнішнім охолодженням додавали тіонілхлорид (3,57 г, 30 ммолів) протягом 15 хвилин при підтриманні температури реакційної суміші нижче 5°С. Після перемішування протягом наступних 30 хв. додавали висушений у вакуумі 5-аміно-1-(2,6-дихлор-4-трифторметилфеніл)-1Н-піразол-3карбонітрил (8,03 г, 25 ммолів, 99% чистоти) при 5°С, і реакційну суміш витримували при 5°С протягом 60 хвилин, а потім нагрівали до 35°С протягом 45 хвилин. Температуру 35°С 19 UA 98474 C2 5 10 15 20 25 30 35 40 45 50 55 підтримували протягом 3 годин перед додаванням 4,6 г толуолу. Через 7 годин при 35°С реакцію гасили при додаванні 20 г розчину гідроокису натрію (10 ваг.%). Отриману суспензію розводили 30 мл етилацетату. Після розділення фаз органічний шар промивали один раз за допомогою розчину гідроокису натрію (10 ваг.%). Після розділення фаз органічний шар піддавали аналізу за допомогою кількісної ВЕРХ (вихід - 80,4%). Сировинний продукт викристалізовували із суміші етилацетату й толуолу, що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (7,98 г, вихід - 73%, 98%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 11: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрил за допомогою тіонілхлориду, гідрохлориду триетиламіну й додавання порцій трифторметилсульфінату калію. У реактор на 750 мл з механічною мішалкою й термометром поміщали висушений у вакуумі гідрохлорид триетиламіну (51,1 г, 368 ммолів), 147 г безводного толуолу (6,5 молярних еквівалентів по відношенню до 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу) і тіонілхлорид (35,7 г, 294 ммоля) в атмосфері аргону. Після охолодження до температури 0°С - 5°С із зовнішнім охолодженням додавали висушений у вакуумі трифторметилсульфінат калію (50,4 г, 296 ммолів) трьома рівними порціями кожні 10 хвилин при підтриманні температури реакції нижче 5°С. Після перемішування протягом наступних 30 хвилин додавали висушений у вакуумі 5-аміно-1-(2,6-дихлор-4-трифторметилфеніл)-1Н-піразол3-карбонітрил (79,5 г, 245 ммолів, 99% чистота) при 5°С, і реакційну суміш витримували при 5°С протягом 60 хвилин, а потім нагрівали до 35°С протягом 45 хвилин. Температуру 35°С підтримували протягом наступних 10 годин перед тим, як погасити реакцію за допомогою 200 г розчину гідроокису натрію (10 ваг.%). Отриману суспензію розводили 176 мл етилацетату. Після розділення органічний шар промивали один раз за допомогою розчину гідроокису натрію (10 ваг.%). Після розділення фаз органічний шар піддавали аналізу за допомогою кількісної ВЕРХ (вихід - 79%). Вміст сполуки F становив нижче 2,9 вагових відсотків у сировинній суміші (без розчинника). Продукт викристалізовували із суміші етилацетату й толуолу, одержуючи при цьому вказану в заголовку сполуку у вигляді білого кристалічного порошку (77,1 г, вихід - 75%, 98%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 12: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу за допомогою тозилату триметиламіну, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 1. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (вихід -76%, 96%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 13: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу за допомогою гідрохлориду піридину, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 1. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (вихід - 67%, 95%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 14: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу за допомогою тозилату триметиламіну, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 11. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (вихід - 73%, 98%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 15: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу за допомогою гідрохлориду триетиламіну, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 11. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної 20 UA 98474 C2 5 10 15 20 в заголовку сполуки у вигляді білого кристалічного порошку (вихід - 75%, 98%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 16: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу за допомогою тозилату піридину, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 11. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (вихід - 72%, 98%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Приклад 17: Сульфінілування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу за допомогою тозилату триетиламіну, трифторметилсульфінату натрію й тіонілхлориду в 6,5 молярних еквівалентах толуолу. Процедуру одержання здійснювали так, як описано вище для Прикладу 1. Сировинний продукт викристалізовували з киплячого толуолу (100 г), що забезпечувало одержання вказаної в заголовку сполуки у вигляді білого кристалічного порошку (вихід - 44%, 76%-на чистота, як оцінювали за допомогою кількісної ВЕРХ). Не спостерігали утворення ніякого нерозчинного матеріалу (як при використанні тозилату діетиламіну як аміно/кислотний комплекс, у порівнянні із Прикладом С4 Таблиці 3). Порівняльні приклади Для того, щоб продемонструвати переваги способу відповідно до винаходу, наступні приклади здійснювали при використанні процедури одержання, наведеної вище для Прикладу 1. 25 30 У цих експериментах демонструється, що спосіб відповідно до винаходу забезпечує більш високий вихід і більш високий ступінь чистоти в порівнянні зі способами сульфінілування, описаними в рівні техніки. Результати підсумовані в Таблиці 3, що наведена нижче. 21 UA 98474 C2 5 10 15 Додаткові порівняльні експерименти здійснювали при використанні наступної процедури одержання: У реактор на 750 мл з механічною мішалкою й термометром, що містить аміно/кислотний комплекс (1,5 екв.), 147 г безводного толуолу (6,5 екв.) і 44,8 г CF 3SOCI (1,2 екв.) в атмосфері аргону при 0С додавали висушений у вакуумі 5-аміно-1-(2,6-дихлор-4-трифторметилфеніл)-1Нпіразол-3-карбонітрил (1 екв., 79,5 г, 245 ммолів, 99% чистоти). Реакційну суміш витримували при 5°С протягом 60 хв, а потім нагрівали до 35 С протягом 45 хв. Температуру 35°С підтримували протягом наступних 10 годин перед тим, як погасити реакцію за допомогою 200 г розчину гідроокису натрію (10 ваг.%). Отриману суспензію розводили 176 мл етилацетату. Після розділення органічний шар промивали один раз за допомогою розчину гідроокису натрію (10 ваг.%). Після розділення фаз органічний шар піддавали аналізу за допомогою кількісної ВЕРХ. Вміст сполуки F становив нижче 2,9 вагових відсотків у сировинній суміші (без розчинника). Продукт викристалізовували із суміші етилацетату й толуолу, одержуючи при цьому вказану в заголовку сполуку у вигляді білого кристалічного порошку. 20 25 Ці експерименти Са і Сb порівнювали із Прикладами 18 і 19, які здійснювали так, як описано вище для Прикладу 11, при використанні трифторметилсульфінату калію / гідрохлориду піридину / SOCI2 і трифторметилсульфінату калію / гідрохлориду триметиламіну / SOCI 2 як реагенти. У цих експериментах демонструється, що спосіб відповідно до винаходу забезпечує більш високий вихід і більш високий ступінь чистоти в порівнянні зі способами сульфінілування, описаними в рівні техніки. 22 UA 98474 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 1. Спосіб сульфінілування похідної піразолу, який характеризується тим, що 5-аміно-1-[2,6дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрил (II) піддають реакції із сульфінілувальним агентом, вибраним із трифторметилсульфінової кислоти, ангідриду трифторметилсульфінової кислоти, солі трифторметилсульфінату лужного або лужноземельного металу й сумішей кислоти та/або солі(ей), у присутності принаймні одного аміно/кислотного комплексу, де амін(и) вибраний(і) з третинних амінів, а кислота(и) вибрана(і) із фтористоводневої, хлористоводневої, п-толуолсульфонової кислоти, бензолсульфонової кислоти, ксиленсульфонової кислоти, метансульфонової кислоти й трифторметилсульфонової кислоти, з додаванням галогенувального агента. 2. Спосіб відповідно до пункту 1, де галогенувальний агент вибирають з тіонілхлориду, тіонілброміду, фосфороксихлориду, оксалілхлориду, фосгену, трифосгену ((ССl 3)2С(=О)), хлорформіатів, фосфорпентахлориду, фосфортрихлориду, трихлорметилхлорметаноату й хлориду ксиленсульфонової кислоти. 3. Спосіб відповідно до пунктів 1 або 2, де галогенувальний агент являє собою хлорувальний агент, вибраний з тіонілхлориду й фосфороксихлориду. 4. Спосіб відповідно до будь-якого з пунктів 1-3, де амін аміно/кислотного комплексу вибирають з алкіламінів триметиламіну, триетиламіну, трипропіламіну, триізопропіламіну, трибутиламіну, диметилетиламіну, діетилметиламіну, диметил-н-пропіламіну, діізопропілетиламіну, DBU (1,8діазобіцикло[5.4.0]ундец-7-ену), DBN (1,5-діазобіцикло[4.3.0]нон-5-ену), метилморфоліну, етилморфоліну, N,N-диметиланіліну, метилпіперидину, метилпіролідину або метилдіабензиламіну; і ароматичних амінів піридину, DMAP(диметиламінопіридину), колідину, лутидину, піримідину, піразину й піперазину. 5. Спосіб відповідно до будь-якого з пунктів 1-4, де амін аміно/кислотного комплексу вибирають із триметиламіну, триетиламіну, диметилетиламіну, диметил-н-пропіламіну або піридину, переважно із триметиламіну, триетиламіну й піридину. 6. Спосіб відповідно до будь-якого з пунктів 1-5, де принаймні одна з алкільних груп, приєднаних до атома азоту аміну, являє собою метильну групу. 3 7. Спосіб відповідно до будь-якого з пунктів 1-6, де атом азоту групи аміну є sр -гібридизованим i не утворює подвійного зв'язку із сусіднім атомом. 8. Спосіб відповідно до будь-якого з пунктів 1-7, де кислоту аміно/кислотного комплексу вибирають із хлористоводневої кислоти й п-толуолсульфонової кислоти. 9. Спосіб відповідно до будь-якого з пунктів 1-8, де сульфінілувальний агент вибирають із трифторметилсульфінової кислоти, солі трифторметилсульфінату натрію, солі трифторметилсульфінату калію і їх сумішей. 10. Спосіб відповідно до будь-якого з пунктів 1-9, де реакцію проводять в органічному розчиннику, який вибирають з толуолу, бензолу, ксилену, трифторметилбензолу, монохлорбензолу, дихлорбензолу й етилбензолу. 11. Спосіб відповідно до будь-якого з пунктів 1-10, де 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрил з'єднують із реакційною сумішшю сульфінілувального агента, аміно/кислотного комплексу й галогенувального агента. 12. Спосіб відповідно до будь-якого з пунктів 1-11, де використовують від 1,4 до 2,2 молярних еквівалентів аміно/кислотного комплексу по відношенню до 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. 13. Спосіб відповідно до будь-якого з пунктів 1-12, де використовують від 1,15 до 1,35 молярних еквівалентів галогенувального агента по відношенню до 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. 14. Спосіб відповідно до будь-якого з пунктів 1-13, де використовують від 1,0 до 1,35 молярних еквівалентів сульфінілувального агента по відношенню до 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу. 15. Спосіб відповідно до будь-якого з пунктів 1-14, де після комбінації 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-1Н-піразол-3-карбонітрилу, сульфінілувального агента, аміно/кислотного комплексу й галогенувального агента температуру підвищують до 30-55 °С, переважно до 30-39 °С, протягом 5-60 хвилин. 16. Спосіб відповідно до будь-якого з пунктів 1-15, де продукт реакції 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил викристалізовують з розчину монохлорбензолу, дихлорбензолу, етилбензолу або толуолу. 23 UA 98474 C2 5 10 17. Спосіб відповідно до будь-якого з пунктів 1-16, де на додатковому етапі 5-аміно-1-[2,6дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил рецептують у вигляді пестицидної композиції. 18. Спосіб відповідно до будь-якого з пунктів 1-16, де на додатковому етапі 5-аміно-1-[2,6дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил рецептують у вигляді ветеринарно прийнятної паразитицидної композиції. 19. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 1-16. 20. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 3-16, що містить менше 20 част. на млн. брому. 21. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 1-16, або відповідно до пункту 20, що містить менше 10 част. на млн. сполуки D NC S N NH2 H2N N Cl Cl F F 15 20 25 30 35 40 45 S F CN N N Cl Cl F Сполука D F F . 22. 5-Аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3карбонітрил, отриманий відповідно до способу, як визначено в будь-якому з пунктів 1-16, або відповідно до пунктів 20 або 21, і в атмосфері інертного газу, що містить менше 200 част. на млн. сполук, що містять сірку в окисленому стані (IV). 23. Пестицидна або паразитицидна композиція, що містить 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрил, як визначено в будьякому з пунктів 19-22. 24. Застосування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, для боротьби зі шкідниками. 25. Застосування 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, для боротьби зі шкідниками й паразитами тварин. 26. Спосіб контролю комах, кліщів або нематод шляхом контакту комах, кліщів або нематод або їх кормових ресурсів, середовища перебування, місця розмноження або їх вогнища з пестицидно ефективною кількістю 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22. 27. Спосіб захисту зростаючих рослин від нападу або інвазії комахами, кліщами або нематодами шляхом застосування до листя або насіння рослин, до ґрунту або до води, у якій вони ростуть, пестицидно ефективної кількості 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22. 28. Спосіб, як заявлено в пунктах 26 або 27, де 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]4-(трифторметилсульфініл)піразол-3-карбонітрил застосовують у кількості від 5 до 2000 г/га. 29. Спосіб лікування, контролю, запобігання або захисту тварин від інвазії або інфекції паразитами, що включає пероральне, місцеве або парентеральне введення або застосування до тварин або середовища їх перебування паразитицидно ефективної кількості 5-аміно-1-[2,6дихлор-4-(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, або його ветеринарно прийнятних енантіомерів або солей. 24 UA 98474 C2 5 30. Спосіб одержання композиції для лікування, контролю, запобігання або захисту тварин від інвазії або інфекції паразитами, що включає змішування 5-аміно-1-[2,6-дихлор-4(трифторметил)феніл]-4-(трифторметилсульфініл)піразол-3-карбонітрилу, отриманого за допомогою способу, як визначено в будь-якому з пунктів 1-16, або як визначено в будь-якому з пунктів 19-22, або його ветеринарно прийнятних енантіомерів або солей з ветеринарно прийнятним носієм. 31. Спосіб відповідно до пункту 30, де 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4(трифторметилсульфініл)піразол-3-карбонітрил або його ветеринарно прийнятний енантіомер або сіль присутні в паразитицидно ефективній кількості. 10 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 25
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the sulfinylation of a pyrazole derivative
Автори англійськоюSukopp, Martin, Kuhn, Oliver, Groning, Carsten, Keil Michael, Longlet, Jon, J.
Назва патенту російськоюСпособ сульфинирования производной пиразола
Автори російськоюЗукопп Мартин, Кун Оливер, Грёнинг Карстен, Кайль Михаэль, Лонглет Джон Дж.
МПК / Мітки
МПК: A01N 43/56, C07D 231/44, A61P 33/00, A61K 31/415
Мітки: похідної, піразолу, спосіб, сульфінілування
Код посилання
<a href="https://ua.patents.su/27-98474-sposib-sulfiniluvannya-pokhidno-pirazolu.html" target="_blank" rel="follow" title="База патентів України">Спосіб сульфінілування похідної піразолу</a>
Попередній патент: Солі та кристалічні форми 2-метил-2-[4-(3-метил-2-оксо-8-хінолін-3-іл-2,3-дигідроімідазо[4,5-с]хінолін-1-іл)феніл]пропіонітрилу
Наступний патент: Спосіб сульфінілування похідної піразолу
Випадковий патент: Діетиламонію 4-(((3-((1н-тетразол-1-іл)метил)-4-феніл-4,5-дигідро-1н-1,2,4-триазол-5-іл)тіо)метил)бензоат, що виявляє антигіпоксичну активність












