Конденсовані похідні тіазолу як інгібітори кінази
Номер патенту: 99469
Опубліковано: 27.08.2012
Автори: Фолі Енні Марі, Александер Ріккі Пітер, Ауджла Павандип Сингх, Крепі Карен Вівьєн Люсіль, Франклін Річард Джеремі
Формула / Реферат
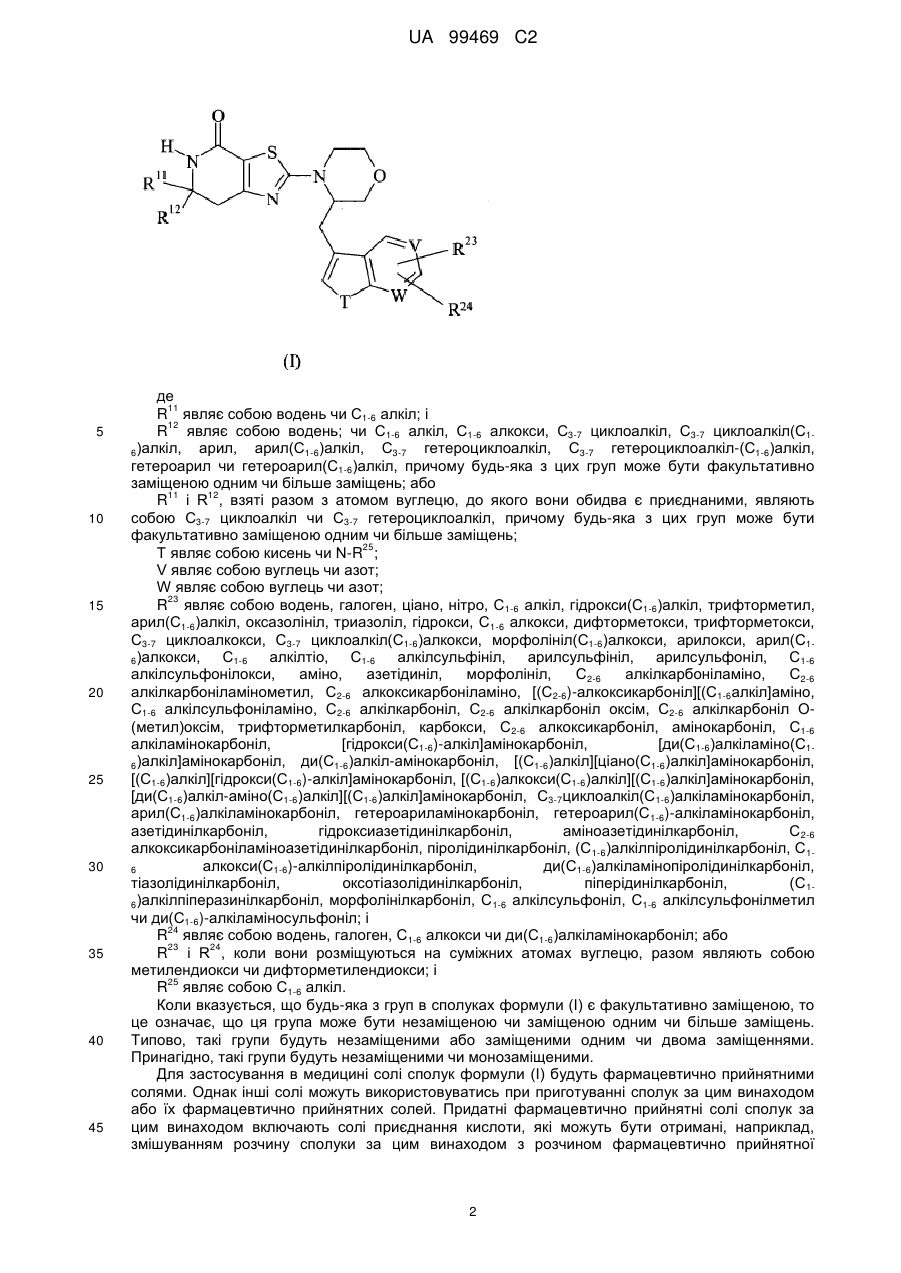
1. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват:
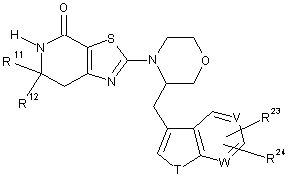 , (І)
, (І)
де
R11 являє собою водень або С1-6алкіл; і
R12 являє собою водень; або С1-6алкіл, С1-6алкокси, С3-7циклоалкіл, С3-7циклоалкіл(С1-6)алкіл, арил, арил(С1-6)алкіл, С3-7гетероциклоалкіл, С3-7гетероциклоалкіл(С1-6)алкіл, гетероарил або гетероарил(С1-6)алкіл, причому будь-яка з цих груп може бути необов'язково заміщеною одним або більше замісниками незалежно вибраними із галогену, ціано, нітро, С1-6алкілу, трифторметилу, гідрокси, С1-6алкокси, дифторметокси, трифторметокси, арилокси, С1-6алкілтіо, С1-6алкілсульфонілу, аміно, С1-6алкіламіно, ді(С1-6)алкіламіно, С2-6алкілкарбоніламіно, С2-6алкоксикарбоніламіно, С1-6алкілсульфоніламіно, формілу, С2-6алкілкарбонілу, карбокси, С2-6алкоксикарбонілу, амінокарбонілу, С1-6алкіламінокарбонілу, ді(С1-6)алкіламінокарбонілу, аміносульфонілу, С1-6алкіламіносульфонілу і ді(С1-6)-алкіламіносульфонілу; або
R11 і R12, взяті разом з атомом вуглецю, до якого вони обидва приєднані, являють собою С3-7циклоалкіл або С3-7гетероциклоалкіл;
гетероциклоалкільні групи, зазначені вище, вибирають з азетидинілу, тетрагідрофуранілу, дигідробензофуранілу, піролідинілу, індолінілу, тіазолідинілу, імідазолідинілу, тетрагідропіранілу, хроманілу, піперидинілу, 1,2,3,4-тетрагідрохінолінілу, 1,2,3,4-тетрагідроізохінолінілу, піперазинілу, 1,2,3,4-тетрагідрохіноксалінілу, гомопіперазинілу, морфолінілу, бензоксазинілу і тіоморфолінілу; та
гетероарильні групи, зазначені вище, вибирають із фурилу, бензофурилу, дибензофурилу, тієнілу, бензотієнілу, піролілу, індолілу, піроло[2,3-b]піридинілу, піроло[3,2-с]піридинілу, піразолілу, піразоло[1,5-а]піридинілу, індазолілу, оксазолілу, бензоксазолілу, ізоксазолілу, тіазолілу, бензотіазолілу, ізотіазолілу, імідазолілу, бензімідазолілу, імідазо[1,2-а]піридинілу, імідазо[4,5-b]піридинілу, імідазо[1,2-а]піримідинілу, імідазо[1,2-а]піразинілу, оксадіазолілу, тіадіазолілу, триазолілу, бензотриазолілу, тетразолілу, піридинілу, хінолінілу, ізохінолінілу, піридазинілу, цінолінілу, піримідинілу, піразинілу, хіноксалінілу і хроменілу;
Т являє собою кисень або N-R25;
V являє собою вуглець або азот;
W являє собою вуглець або азот;
R23 являє собою водень, галоген, ціано, нітро, С1-6алкіл, гідроксі(С1-6)алкіл, трифторметил, арил(С1-6)алкіл, оксазолініл, триазоліл, гідрокси, С1-6алкокси, дифторметокси, трифторметокси, С3-7циклоалкокси, С3-7циклоалкіл(С1-6)алкокси, морфолініл(С1-6)алкокси, арилокси, арил(С1-6)алкокси, С1-6алкілтіо, С1-6алкілсульфініл, арилсульфініл, арилсульфоніл, С1-6алкілсульфонілокси, аміно, азетидиніл, морфолініл, С2-6алкілкарбоніламіно, С2-6алкілкарбоніламінометил, С2-6алкоксикарбоніламіно, [(С2-6)алкоксикарбоніл][(С1-6алкіл]аміно, С1-6алкілсульфоніламіно, С2-6алкілкарбоніл, С2-6алкілкарбоніл оксим, С2-6алкілкарбоніл O-(метил)оксим, трифторметилкарбоніл, карбокси, С2-6алкоксикарбоніл, амінокарбоніл, С1-6алкіламінокарбоніл, [гідроксі(С1-6)алкіл]амінокарбоніл, [ді(С1-6)алкіламіно(С1-6)алкіл]амінокарбоніл, ді(С1-6)алкіламінокарбоніл, [(С1-6алкіл][ціано(С1-6)алкіл]амінокарбоніл, [(С1-6)алкіл][гідроксі(С1-6)-алкіл]амінокарбоніл, [(С1-6)алкоксі(С1-6)алкіл][(С1-6)алкіл]амінокарбоніл, [ді(С1-6)алкіламіно(С1-6)алкіл][(С1-6)алкіл]амінокарбоніл, С3-7циклоалкіл(С1-6)алкіламінокарбоніл, арил(С1-6)алкіламінокарбоніл, гетероариламінокарбоніл, гетероарил(С1-6)алкіламінокарбоніл, азетидинілкарбоніл, гідроксіазетидинілкарбоніл, аміноазетидинілкарбоніл, С2-6алкоксикарбоніламіноазетидинілкарбоніл, піролідинілкарбоніл, (С1-6)алкілпіролідинілкарбоніл, С1-6алкоксі(С1-6)алкілпіролідинілкарбоніл, ді(С1-6)алкіламінопіролідинілкарбоніл, тіазолідинілкарбоніл, оксотіазолідинілкарбоніл, піперидинілкарбоніл, (С1-6)алкілпіперазинілкарбоніл, морфолінілкарбоніл, С1-6алкілсульфоніл, С1-6алкілсульфонілметил або ді(С1-6)алкіламіносульфоніл; і
R24 являє собою водень, галоген, С1-6алкокси або ді(С1-6)алкіламінокарбоніл; або
R23 і R24, коли вони розміщуються на суміжних атомах вуглецю, разом являють собою метилендіокси або дифторметилендіокси; і
R25 являє собою С1-6алкіл.
2. Сполука за п. 1, в якій R11 являє собою С1-6алкіл.
3. Сполука за пп. 1 або 2, в якій R12 являє собою С1-6алкіл.
4. Сполука за будь-яким із попередніх пунктів, в якій Т являє собою N-R25.
5. Сполука за будь-яким із попередніх пунктів, в якій V являє собою вуглець.
6. Сполука за будь-яким із попередніх пунктів, в якій W являє собою вуглець.
7. Сполука за будь-яким із попередніх пунктів, в якій R23 являє собою водень, ціано, карбокси, С2-6алкоксикарбоніл, ді(С1-6)алкіламінокарбоніл, [(С1-6)алкіл][ціано(С1-6)алкіл]амінокарбоніл, [(С1-6)алкоксі(С1-6)алкіл][(С1-6)алкіл]амінокарбоніл або азетидинілкарбоніл.
8. Сполука за будь-яким із попередніх пунктів, в якій R24 являє собою водень.
9. Сполука за будь-яким із пп. 4-8, в якій R25 являє собою метил.
10. Сполука за п. 1, яка вибрана з групи:
метил-3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-1-метил-1Н-iндол-5-карбоксилат,
3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-1-метил-1Н-iндол-5-карбонова кислота,
3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-N,1-диметил-N-(2-метоксіетил)-1Н-індол-5-карбоксамід,
N-(ціанометил)-3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-N,1-диметил-1Н-індол-5-карбоксамід,
2-[(3S)-3-{[5-(азетидин-1-ілкарбоніл)-1-метил-1Н-індол-3-іл]метил}морфолін-4-іл(6,6-диметил-6,7-дигідро[1,3]тіазоло[5,4-с]піридин-4(5Н)-он,
3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-N,N,1-триметил-1Н-індол-5-карбоксамід,
метил-3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-1-бензофуран-5-карбоксилат,
3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-N,N-диметил-1-бензофуран-5-карбоксамід,
2-[(3S)-3-{[5-(азетидин-1-ілкарбоніл)-1-бензофуран-3-іл]метил}морфолін-4-іл(6,6-диметил-6,7-дигідро[1,3]тіазоло[5,4-с]піридин-4(5Н)-он,
3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-1-метил-1Н-iндол-5-карбонітрил,
3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-1-метил-1Н-iндол,
2-[(3S)-3-(1-бензофуран-3-ілметил)морфолін-4-іл]-6,6-диметил-6,7-дигідро[1,3]тіазоло[5,4-с]піридин-4(5Н)-он,
3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-1-бензофуран-5-карбонітрил.
11. Фармацевтична композиція, що містить сполуку формули (І), як її визначено в п. 1, або її фармацевтично прийнятну сіль або сольват, у поєднанні з фармацевтично прийнятним носієм.
12. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват за п. 1, яка призначена для застосування в терапії.
13. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват за п. 1, яка призначена для застосування в лікуванні та/або профілактиці розладу, при якому є показаним введення селективного інгібітора РІ3К.
14. Застосування сполуки формули (І), як її визначено в п. 1, або її фармацевтично прийнятної солі або сольвату для виготовлення медикаменту для лікування та/або профілактики розладу, при якому є показаним введення селективного інгібітора РІ3К.
15. Спосіб лікування та/або профілактики розладу, при якому є показаним введення селективного інгібітора РІ3К, який включає ведення пацієнту, який потребує такого лікування, ефективної кількості сполуки формули (І), як її визначено в п. 1, або її фармацевтично прийнятної солі або сольвату.
16. Сполука за формулою (І), якою є 3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-с]піридин-2-іл)морфолін-3-іл]метил}-N,N,1-триметил-1Н-індол-5-карбоксамід.
17. Фармацевтична композиція, що містить сполуку за п. 16 у поєднанні з фармацевтично прийнятним носієм.
18. Сполука за п. 16 для застосування в терапії.
19. Сполука за п. 16 для застосування в лікуванні та/або профілактиці розладу, при якому є показаним введення селективного інгібітора РІ3К.
20. Сполука за п. 16 для застосування в лікуванні та/або профілактиці запальних, автоімунних, серцево-судинних, нейродегенеративних, метаболічних, онкологічних, больових і офтальмічних розладів.
21. Застосування сполуки за п. 16 для виготовлення медикаменту для лікування та/або профілактики розладу, при якому є показаним введення селективного інгібітора РІ3К.
22. Застосування сполуки за п. 16 для виготовлення медикаменту для лікування та/або профілактики запальних, автоімунних, серцево-судинних, нейродегенеративних, метаболічних, онкологічних, больових і офтальмічних розладів.
Текст
Реферат: Серія похідних 6,7-дигідро[1,3]тіазоло[5,4-с]пирідин-4(5Н)-ону, що є заміщеними в 2-позиції групою заміщеного морфолін-4-ілу O H R 11 N S N O N R 12 V T W R 23 R 24 , де радикали визначені в описі винаходу, які, завдяки своїм властивостям селективних інгібіторів ферментів РІ3-кінази, є корисними для медицини, наприклад в лікуванні запальних, UA 99469 C2 (12) UA 99469 C2 автоімунних, серцево-судинних, нейродегенеративних, ноцицептивних та офтальмічних станів. метаболічних, онкологічних, UA 99469 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується класу конденсованих похідних тіазолу і їх застосування в терапії. Більш точно, цей винахід стосується родини похідних 6,7-дигідро-[1,3]тіазоло[5,4-c]пирідин4(5Н)-ону, які заміщені в 2-ій позиції групою заміщеного морфолін-4-ілу. Ці сполуки є селективними інгібіторами ферментів фосфоінозитид 3-кінази (РІ3К) і, відповідно, є корисними як фармацевтичні агенти, зокрема в лікуванні небезпечних запальних, автоімунних, серцевосудинних, нейродегенеративних, метаболічних, онкологічних, больових і офтальмічних станів. Вважається, що шлях РІ3К є задіяним в різних фізіологічних і патологічних функціях, які розглядаються як визначальні для широкого кола хвороб людини. Так, ферменти РІ3К забезпечують вирішальний сигнал для проліферації клітин, виживання клітин, переносу мембран, транспорту глюкози, росту нейритів, активного переміщення хвиль збудження в мембрані клітини, продукції супероксиду, реорганізації і хемотаксису актину (дивись S. Ward et al., Chemistry & Biology, 2003, 10, 207-213; and S.G. Ward & P. Finan, Current Opinion in Pharmacology, 2003, 3, 426-434); і відомо, що вони задіяні в патології раку, а також метаболічних, запальних і серцево-судинних хвороб (дивись M.P. Wymann et al., Trends in Pharmacol. Sci., 2003, 24, 366-376). Існує думка, що аномальна регуляція на підвищення активності шляху РІ3К має відношення до широкого кола онкологічних захворювань людини (дивись S. Brader & S.A. Eccles, Tumori, 2004, 90, 2-8). Тому зрозуміло, що сполуки у відповідності до даного винаходу, є корисними в лікуванні та/або профілактиці різних недугів людини. Вони включають автоімунні і запальні розлади, такі як ревматоїдний артрит, розсіяний склероз, астма, запальна хвороба кишечнику, псоріаз і відторгнення трансплантату; серцево-судинні розлади, включаючи тромбоз, гіпертрофію серця, гіпертонію і нерегулярну скоротність серця (наприклад, при серцевій недостатності); нейродегенеративні розлади, такі як хвороба Альцгеймера, хвороба Паркінсона, хвороба Гантінгтона, інсульт, аміотрофічний латеральний склероз, пошкодження спинного мозку, травма голови і епілептичні напади; метаболічні розлади, такі як ожиріння і діабет 2 типу; онкологічні стани, включаючи лейкемію, гліобластому, лімфому, меланому і рак печінки, кістки, шкіри, головного мозку, підшлункової залози, легень, молочної залози, шлунку, товстої кишки, прямої кишки, передміхурової залози, яєчника і шийки матки; больові і ноціцептивні розлади; а також офтальмологічні розлади, включаючи пов’язану з віком макулярну дегенерацію (ARMD). До того ж, сполуки у відповідності до даного винаходу можуть використовуватись як фармакологічні стандарти для застосування при розробці нових біологічних тестів і при пошуку нових фармакологічних препаратів. Так, сполуки за цим винаходом можуть бути корисними як радіоліганди в пробах для виявлення сполук, здатних зв’язуватись з ферментами РІ3К людини. Публікація WO 2006/114606 описує конденсовані біциклічні похідні тіазолу як селективні інгібітори ферментів РІ3 кінази, які знаходять застосування в медицині, наприклад в лікуванні запальних, автоімунних, серцево-судинних, нейродегенеративних, метаболічних, онкологічних, больових і офтальмологічних станів. Різні конденсовані похідні тіазолу описані в Liebigs Annalen der Chemie, 1986, 780-784; і в російському Журнале общей химии (переклад Zhurnal Obshchei Khimii), 2000, 70[5], 784-787. Однак жодна із сполук, описаних в цих публікаціях, не відповідає сполуці за цим винаходом; і жодна терапевтична корисність не приписується жодній із сполук, описаних тут. Сполуки у відповідності до даного винаходу є сильними і селективними інгібіторами РІ3К, які мають афінність до зв’язування (ІС50) з ізоформами РІ3Кα та/або РІ3Кβ та/або РІ3Кγ та/або РІ3Кδ людини на рівні 50 мкМ чи менше, загалом 20 мкМ чи менше, звичайно 5 мкМ чи менше, типово 1 мкМ чи менше, принагідно 500 нМ чи менше, ідеально 100 нМ чи менше, а краще 20 нМ чи менше (спеціалістам в цій галузі ясно, що нижча цифра ІС 50 характеризує більш активну сполуку). Сполуки за цим винаходом можуть володіти щонайменше 10-кратною селективною афінністю, типово щонайменше 20-кратною селективною афінністю, принагідно щонайменше 50-кратною селективною афінністю і ідеально щонайменше 100-кратною селективною афінністю до ізоформ РІ3Кα та/або РІ3Кβ та/або РІ3Кγ та/або РІ3Кδ людини у порівнянні з іншими кіназами людини. Сполуки за цим винаходом володіють примітними перевагами з точки зору їх високої активності і селективності, доведеної ефективності і цінних фармакокінетичних властивостей (включаючи кліренс і біодоступність). Даний винахід стосується сполуки формули (І), її фармацевтично прийнятної солі чи сольвату: 1 UA 99469 C2 5 10 15 20 25 30 35 40 45 де 11 R являє собою водень чи С1-6 алкіл; і 12 R являє собою водень; чи С1-6 алкіл, С1-6 алкокси, С3-7 циклоалкіл, С3-7 циклоалкіл(С1арил, арил(С1-6)алкіл, С3-7 гетероциклоалкіл, С3-7 гетероциклоалкіл-(С1-6)алкіл, 6)алкіл, гетероарил чи гетероарил(С1-6)алкіл, причому будь-яка з цих груп може бути факультативно заміщеною одним чи більше заміщень; або 11 12 R і R , взяті разом з атомом вуглецю, до якого вони обидва є приєднаними, являють собою С3-7 циклоалкіл чи С3-7 гетероциклоалкіл, причому будь-яка з цих груп може бути факультативно заміщеною одним чи більше заміщень; 25 Т являє собою кисень чи N-R ; V являє собою вуглець чи азот; W являє собою вуглець чи азот; 23 R являє собою водень, галоген, ціано, нітро, С1-6 алкіл, гідрокси(С1-6)алкіл, трифторметил, арил(С1-6)алкіл, оксазолініл, триазоліл, гідрокси, С 1-6 алкокси, дифторметокси, трифторметокси, С3-7 циклоалкокси, С3-7 циклоалкіл(С1-6)алкокси, морфолініл(С1-6)алкокси, арилокси, арил(С1С1-6 алкілтіо, С1-6 алкілсульфініл, арилсульфініл, арилсульфоніл, С 1-6 6)алкокси, алкілсульфонілокси, аміно, азетідиніл, морфолініл, С2-6 алкілкарбоніламіно, С2-6 алкілкарбоніламінометил, С2-6 алкоксикарбоніламіно, [(С2-6)-алкоксикарбоніл][(С1-6алкіл]аміно, С1-6 алкілсульфоніламіно, С2-6 алкілкарбоніл, С2-6 алкілкарбоніл оксім, С2-6 алкілкарбоніл О(метил)оксім, трифторметилкарбоніл, карбокси, С2-6 алкоксикарбоніл, амінокарбоніл, С1-6 алкіламінокарбоніл, [гідрокси(С1-6)-алкіл]амінокарбоніл, [ди(С1-6)алкіламіно(С1)алкіл]амінокарбоніл, ди(С1-6)алкіл-амінокарбоніл, [(С1-6)алкіл][ціано(С1-6)алкіл]амінокарбоніл, 6 [(С1-6)алкіл][гідрокси(С1-6)-алкіл]амінокарбоніл, [(С1-6)алкокси(С1-6)алкіл][(С1-6)алкіл]амінокарбоніл, [ди(С1-6)алкіл-аміно(С1-6)алкіл][(С1-6)алкіл]амінокарбоніл, С3-7циклоалкіл(С1-6)алкіламінокарбоніл, арил(С1-6)алкіламінокарбоніл, гетероариламінокарбоніл, гетероарил(С 1-6)-алкіламінокарбоніл, азетідинілкарбоніл, гідроксиазетідинілкарбоніл, аміноазетідинілкарбоніл, С 2-6 алкоксикарбоніламіноазетідинілкарбоніл, піролідинілкарбоніл, (С 1-6)алкілпіролідинілкарбоніл, С 1алкокси(С1-6)-алкілпіролідинілкарбоніл, ди(С1-6)алкіламінопіролідинілкарбоніл, 6 тіазолідинілкарбоніл, оксотіазолідинілкарбоніл, піперідинілкарбоніл, (С 1)алкілпіперазинілкарбоніл, морфолінілкарбоніл, С 1-6 алкілсульфоніл, С1-6 алкілсульфонілметил 6 чи ди(С1-6)-алкіламіносульфоніл; і 24 R являє собою водень, галоген, С1-6 алкокси чи ди(С1-6)алкіламінокарбоніл; або 23 24 R і R , коли вони розміщуються на суміжних атомах вуглецю, разом являють собою метилендиокси чи дифторметилендиокси; і 25 R являє собою С1-6 алкіл. Коли вказується, що будь-яка з груп в сполуках формули (І) є факультативно заміщеною, то це означає, що ця група може бути незаміщеною чи заміщеною одним чи більше заміщень. Типово, такі групи будуть незаміщеними або заміщеними одним чи двома заміщеннями. Принагідно, такі групи будуть незаміщеними чи монозаміщеними. Для застосування в медицині солі сполук формули (І) будуть фармацевтично прийнятними солями. Однак інші солі можуть використовуватись при приготуванні сполук за цим винаходом або їх фармацевтично прийнятних солей. Придатні фармацевтично прийнятні солі сполук за цим винаходом включають солі приєднання кислоти, які можуть бути отримані, наприклад, змішуванням розчину сполуки за цим винаходом з розчином фармацевтично прийнятної 2 UA 99469 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоти, такої як соляна кислота, сірчана кислота, метансульфонова кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота чи фосфорна кислота. Більш того, коли сполуки за цим винаходом несуть фрагмент кислоти, наприклад карбокси, їх придатні фармацевтично прийнятні солі можуть включали солі лужних металів, наприклад солі натрію чи калію; солі лужноземельних металів, наприклад солі кальцію чи магнію; і солі, утворені з придатними органічними лігандами, наприклад четвертинні амонієві солі. В об’єм даного винаходу входять сольвати сполук формули (І). Такі сольвати можуть бути утворені зі звичайними органічними розчинниками, наприклад вуглеводневими розчинниками, такими як бензол чи толуол; хлорованими розчинниками, такими як хлороформ чи дихлорметан; спиртовими розчинниками, такими як метиловий спирт, етиловий спирт чи ізопропиловий спирт; ефірними розчинниками, такими як діетиловий ефір чи тетрагідрофуран; складноефірними розчинниками, такими як етилацетат. Як варіант, сольвати сполук формули (І) можуть бути утворені з водою, у випадку чого вони будуть гідратами. Придатні алкильні групи, які можуть бути присутніми на сполуках за цим винаходом, включають лінійні і розгалужені С1-6 алкильні групи, наприклад С1-4 алкильні групи. Типові приклади включають метильну і етильну групи, а також лінійні чи розгалужені пропильну, бутильну і пентильну групи. Конкретні алкильні групи включають метил, етил, n-пропил, ізопропил, n-бутил, sec-бутил, ізобутил, tert-бутил, 2,2-диметилпропил і 3-метилбутил. Похідні вирази, такі як «С1-6 алкокси», «С1-6 алкілтіо», «С1-6 алкілсульфоніл» і «С1-6 алкіламіно», повинні конструюватись відповідно. Конкретними С3-7 циклоалкильними групами є циклопропил, циклобутил, циклопентил, циклогексил і циклогептил. Придатні арильні групи включають феніл і нафтил, переважно феніл. Придатні арил(С1-6)алельні групи включають бензил, феніл етил, феніл пропил і нафтилметил. Придатні гетероциклоалкильні групи, які можуть включати і їх бензо-з’єднані аналоги, включають азетідиніл, тетрагідрофураніл, дигідробензофураніл, піролідиніл, індолініл, тіазолідиніл, імідазолідиніл, тетрагідропіраніл, хроманіл, піперідиніл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4-тетрагідроізохінолініл, піперазиніл, 1,2,3,4-тетрагідро-хіноксалініл, гомопіперазиніл, морфолініл, бензоксазиніл і тіоморфолініл. Придатні гетероарильні групи включають фурил, бензофурил, тіоніл, бензотієніл, піроліл, індоліл, піроло[2,3-b]пирідиніл, піразоліл, піразоло[1,5-a]пирідиніл, індазоліл, оксазоліл, бензоксазоліл, ізоксазоліл, тіазоліл, бензотіазоліл, ізотіазоліл, імідазоліл, бензімідазоліл, імідазо[1,2-a]пирідиніл, оксадіазоліл, тіадіазоліл, триазоліл, бензотриазоліл, тетразоліл, пирідиніл, хінолініл, ізохінолініл, пирідазиніл, цінолініл, пирімідиніл, піразиніл, хіноксалініл і хроменіл. Термін «галоген», як він тут використовується, включає атоми фтору, хлору, брому і йоду, особливо фтору чи хлору. Коли сполуки формули (І) мають один чи більше асиметричних центрів, вони можуть відповідно існувати як енантіомери. Коли сполуки за цим винаходом володіють двома чи більше асиметричними центрами, вони можуть додатково існувати як діастереомери. Слід розуміти, що даний винахід поширюється на всі такі енантіомери і діастереомери, а також на їх суміші в будьякому співвідношенні, включаючи рацемати. Формула (І) і всі подальші формули представляють всі індивідуальні стереоізомери і всі можливі їх суміші, якщо не вказується чи не показується інше. До того ж, сполуки формули (І) можуть існувати як таутомери, наприклад кето (СН 2С=О)енол (СН=СНОН) таутомери. Формула (І) і всі подальші формули представляють всі індивідуальні таутомери і всі можливі їх суміші, якщо не вказується чи не показується інше. 11 11 Типові значення R включають водень, метил і етил. В одному варіанті здійснення R є 11 воднем. В іншому варіанті R є С1-6 алкілом, зокрема метилом. 12 Принагідно, R являє собою водень; або С1-6 алкіл, С3-7 циклоалкіл чи арил, причому будьяка з цих груп може бути факультативно заміщена одним чи більше заміщень. 12 Приклади типових заміщень на R включають галоген, ціано, нітро, С1-6 алкіл, трифторметил, гідрокси, С1-6 алкокси, дифторметокси, трифторметокси, арилокси, С 1-6 алкілтіо, С1-6 алкілсульфоніл, аміно, С1-6 алкіламіно, ди(С1-6)алкіламіно, С2-6 алкілкарбоніламіно, С2-6 алкоксикарбоніламіно, С1-6 алкілсульфоніламіно, форміл, С2-6 алкілкарбоніл, карбокси, С2-6 алкоксикарбоніл, амінокарбоніл, С1-6 алкіламінокарбоніл, ди(С1-6)алкіламінокарбоніл, аміносульфоніл, С1-6 алкіламіносульфоніл і ди(С1-6)-алкіламіносульфоніл; особливо галоген, С1-6 алкокси чи С1-6 алкілтіо. 3 UA 99469 C2 12 5 10 15 20 25 30 35 40 45 50 55 60 Приклади конкретних заміщень на R включають фторо, хлоро, бромо, ціано, нітро, метил, трифторметил, гідрокси, метокси, дифторметокси, трифторметокси, фенікси, метилтіо, метилсульфоніл, аміно, метиламіно, диметиламіно, ацетиламіно, метоксикарбоніламіно, метилсульфоніламіно, форміл, ацетил, карбокси, метоксикарбоніл, амінокарбоніл, метиламінокарбоніл, диметиламінокарбоніл, аміносульфоніл, метиламіносульфоніл і диметиламіносульфоніл; особливо хлоро, метокси чи метилтіо. 12 Типові значення R включають водень, метил, n-пропил, ізопропил, ізобутил, циклогексил і 12 феніл. Конкретним значенням R є метил. 11 12 Як варіант, R і R можуть разом утворювати факультативно заміщений спіро-зв’язок. Так, 11 12 R і R , взяті разом з атомом вуглецю, до якого вони обидва прикріплені, можуть являти собою С3-7 циклоалкіл чи С3-7 гетероциклоалкіл, причому будь-яка з цих груп може бути незаміщеною 11 чи заміщеною одним чи більше, типово одним чи двома, заміщеннями. В цьому контексті, R і 12 R , взяті разом з атомом вуглецю, до якого вони обидва прикріплені, можуть принагідно являти собою факультативно заміщений циклопентил, циклогексил, піролідин чи піперідинове кільце. 25 В кращому варіанті здійснення Т – це N-R . В іншому варіанті Т є киснем. В кращому варіанті здійснення V – це вуглець. В іншому варіанті V є азотом. В кращому варіанті здійснення W – це вуглець. В іншому варіанті W є азотом. Даний винахід стосується також сполуки формули (І) або її фармацевтично прийнятної солі 23 чи сольвату, де R являє собою водень, галоген, ціано, нітро, С1-6 алкіл, гідрокси(С1-6)алкіл, трифторметил, арил(С1-6)алкіл, гідрокси, С1-6 алкокси, дифторметокси, трифторметокси, арилокси, арил(С1-6)алкокси, С1-6 алкілтіо, С1-6 алкілсульфініл, арилсульфініл, арилсульфоніл, С1-6 алкілсульфонілокси, аміно, С2-6 алкілкарбоніламіно, С1-6 алкілсульфоніламіно, С2-6 алкілкарбоніл, карбокси, С2-6 алкоксикарбоніл, амінокарбоніл, С1-6 алкіламінокарбоніл, [гідрокси(С1-6)алкіл]амінокарбоніл, ди(С1-6)-алкіламінокарбоніл, [(C1-6)алкіл][гідрокси(С16)алкіл]амінокарбоніл, арил(С1-6)-алкіламінокарбоніл, азетідинілкарбоніл, піролідинілкарбоніл, піперідинілкарбоніл, (С1-6)-алкілпіперазинілкарбоніл або морфолінілкарбоніл. Даний винахід стосується також сполуки формули (І) або її фармацевтично прийнятної солі 23 чи сольвату, де R являє собою водень, галоген, ціано, С1-6 алкіл, гідрокси(C1-6)алкіл, трифторметил, арил(C1-6)алкіл, гідрокси, С1-6 алкокси, трифторметокси, арилокси, арил(С1С1-6 алкілтіо, С1-6 алкілсульфініл, арилсульфініл, арилсульфоніл, С 1-6 6)алкокси, алкілсульфонілокси, аміно, С2-6 алкілкарбоніламіно, С1-6 алкілсульфоніламіно, С2-6 алкілкарбоніл чи амінокарбоніл. 23 Конкретні значення R включають водень, галоген, ціано, нітро, оксазолініл, триазоліл, С 1-6 алкокси, дифторметокси, трифторметокси, С3-7 циклоалкокси, С3-7 циклоалкіл(С1-6)алкокси, морфолініл(С1-6)алкокси, азетідиніл, морфолініл, С2-6 алкілкарбоніламіно, С2-6 алкілкарбоніламінометил, С2-6 алкоксикарбоніламіно, [(C2-6)-алкоксикарбоніл][(C1-6)алкіл]аміно, С1-6 алкілсульфоніламіно, С2-6 алкілкарбоніл, С2-6 алкілкарбоніл оксім, С2-6 алкілкарбоніл О(метил)оксім, трифторметилкарбоніл, карбокси, С2-6 алкоксикарбоніл, амінокарбоніл, С1-6 алкіламінокарбоніл, [гідрокси(С1-6)алкіл]-амінокарбоніл, [ди(C1-6)алкіламіно(C1ди(C1-6)алкіламінокарбоніл, [(С1-6)алкіл][ціано(С1-6)алкіл]амінокарбоніл, 6)алкіл]амінокарбоніл, [(С1-6)алкіл][гідрокси(С1-6)алкіл]амінокарбоніл, [(С1-6)алкокси(С1-6)алкіл][(С1-6)алкіл]амінокарбоніл, [ди(C1-6)алкіламіно(C1-6)алкіл][(С1-6)-алкіл]амінокарбоніл, С3-7 циклоалкіл(С1-6)алкіламінокарбоніл, арил(С1-6)алкіламіно-карбоніл, гетероариламінокарбоніл, гетероарил(С 1-6)алкіламінокарбоніл, азетідинілкарбоніл, гідроксиазетідинілкарбоніл, аміноазетідинілкарбоніл, С2-6 алкоксикарбоніламіноазетідинілкарбоніл, піролідинілкарбоніл, (С 1-6)алкілпіролідинілкарбоніл, С 1-6 алкокси(С1-6)алкілпіролідинілкарбоніл, ди(С1-6)алкіламінопіролідинілкарбоніл, тіазолідинілкарбоніл, оксотіазолідинілкарбоніл, піперідинілкарбоніл, (С1-6)алкілпіперазинілкарбоніл, морфолінілкарбоніл, С1-6 алкілсульфоніл, С1-6 алкілсульфоніл-метил і ди(С1-6)алкіламіносульфоніл. 23 Типові значення R включають водень, галоген, нітро, дифторметокси, трифторметокси, карбокси, С2-6 алкоксикарбоніл, С1-6 алкіламінокарбоніл, [гідрокси(С1-6)-алкіл]амінокарбоніл, ди(С1-6)алкіламінокарбоніл, [(С1-6)алкіл][гідрокси(С1-6)алкіл]-амінокарбоніл, арил(С16)алкіламінокарбоніл, азетідинілкарбоніл, піперідинілкарбоніл, (С 1-6)алкілпіперазинілкарбоніл і морфолінілкарбоніл. 23 Придатні значення R включають водень, С1-6 алкіл, гідрокси, арил(С1-6)алкокси і С16алкілсульфонілокси. 23 Показові значення R включають водень, фторо, хлоро, бромо, ціано, нітро, метил, гідроксиметил, трифторметил, бензил, гідрокси, метокси, етокси, дифторметокси, трифторметокси, фенокси, бензилокси, метилтіо, метилсульфініл, фенілсульфініл, фенілсульфоніл, метилсульфонілокси, аміно, ацетиламіно, метилсульфоніламіно, ацетил, 4 UA 99469 C2 5 10 15 20 25 30 35 40 45 50 55 60 карбокси, метоксикарбоніл, амінокарбоніл, метиламінокарбоніл, (гідроксиетил)-амінокарбоніл, диметиламінокарбоніл, N-(гідроксиетил)-N-метиламінокарбоніл, бензил-амінокарбоніл, азетідинілкарбоніл, піролідинілкарбоніл, піперідинілкарбоніл, метилпіперазинілкарбоніл і морфолінілкарбоніл. 23 Спеціальні значення R включають водень, фторо, хлоро, бромо, ціано, метил, гідроксиметил, трифторметил, бензил, гідрокси, метокси, етокси, трифторметокси, фенокси, бензилокси, метилтіо, метилсульфініл, фенілсульфініл, фенілсульфоніл, метилсульфонілокси, аміно, ацетиламіно, метилсульфоніламіно, ацетил і амінокарбоніл; особливо водень, метил, гідрокси, бензилокси чи метилсульфонілокси. 23 Остаточні значення R включають водень, фторо, хлоро, ціано, нітро, оксазолініл, триазоліл, метокси, дифторметокси, трифторметокси, циклобутокси, циклопропил-метокси, морфолінілетокси, азетідиніл, морфолініл, ацетиламіно, ацетиламінометил, метоксикарбоніламіно, N-метоксикарбоніл-N-метиламіно, метилсульфоніламіно, ацетил, ацетил оксім, ацетил О-(метил)оксім, трифторметилкарбоніл, карбокси, метоксикарбоніл, амінокарбоніл, метиламінокарбоніл, (гідроксиетил)амінокарбоніл, (диметиламіноетил)амінокарбоніл, (1-гідроксипроп-2-ил)амінокарбоніл, диметиламінокарбоніл, N-(ціанометил)-Nметиламінокарбоніл, N-(ціаноетил)-N-метиламінокарбоніл, N-(гідроксиетил)-Nметиламінокарбоніл, N-(метоксиетил)-N-метиламінокарбоніл, N-(диметиламіноетил)-Nметиламінокарбоніл, N-ізопропил-N-метиламінокарбоніл, диетил-амінокарбоніл, циклопропилметиламінокарбоніл, бензиламінокарбоніл, піразоліламіно-карбоніл, пирідинілметиламінокарбоніл, азетідинілкарбоніл, гідроксиазетідинілкарбоніл, аміноазетідинілкарбоніл, tert-бутоксикарбоніламіноазетідинілкарбоніл, піролідиніл-карбоніл, метилпіролідинілкарбоніл, метоксиметилпіролідинілкарбоніл, диметиламінопіролідинілкарбоніл, тіазолідинілкарбоніл, оксотіазолідинілкарбоніл, піперідинілкарбоніл, метилпіперазинілкарбоніл, морфолінілкарбоніл, метилсульфоніл, метилсульфонілметил і диметиламіносульфоніл. 23 Вибрані значення R включають водень, фторо, нітро, дифторметокси, трифторметокси, карбокси, метоксикарбоніл, метиламінокарбоніл, (гідроксиетил)аміно-карбоніл, диметиламінокарбоніл, N-(гідроксиетил)-N-метиламінокарбоніл, бензиламіно-карбоніл, азетідинілкарбоніл, піперідинілкарбоніл, метилпіперазинілкарбоніл і морфолінілкарбоніл. 23 Типово, R можуть представляти водень, ціано, карбокси, С2-6 алкоксикарбоніл, ди(С16)алкіламінокарбоніл, [(С 1-6)алкіл][ціано(С1-6)алкіл]амінокарбоніл, [(С1-6)алкокси(С1-6)-алкіл][(С16)алкіл]амінокарбоніл чи азетідинілкарбоніл. 23 Принагідно, R можуть представляти водень, ціано, карбокси, метоксикарбоніл, диметиламінокарбоніл, N-(ціанометил)-N-метиламінокарбоніл, N-(ціаноетил)-N-метиламінокарбоніл чи азетідинілкарбоніл. 23 23 23 Конкретним значенням R є водень. Іншим значенням R є ціано. Іншим значенням R є 23 карбокси. Іншим значенням R є С2-6 алкоксикарбоніл, особливо метоксикарбоніл. Додатковим 23 значенням R є ди(С1-6)алкіламінокарбоніл, особливо диметиламінокарбоніл. Додатковим 23 значенням R є [(С1-6)алкіл][ціано(С1-6)алкіл]-амінокарбоніл, особливо N-(ціанометил)-N23 метиламінокарбоніл. Іншим додатковим значенням R є [(С1-6)алкокси(С1-6)алкіл][(С16)алкіл]амінокарбоніл, особливо N-(метоксиетил)-N-метиламінокарбоніл. Додатковим значенням 23 R є азетідинілкарбоніл. 24 Остаточні значення R включають водень, хлоро, метокси і диметиламінокарбоніл. 24 Конкретним значенням R є водень. 25 В одному варіанті здійснення R принагідно є метилом. Характерні нові сполуки у відповідності до даного винаходу включають кожну із сполук, отримання яких описане в супроводжуючих Прикладах, та їх фармацевтично прийнятні солі і сольвати. Даний винахід стосується також фармацевтичної композиції, яка містить сполуку за цим винаходом, як вже описувалось, чи її фармацевтично прийнятну сіль або сольват, в поєднанні з одним чи більше фармацевтично прийнятними носіями. Фармацевтичні композиції згідно з цим винаходом можуть приймати форму, придатну для орального, трансбуккального, парентерального, назального, місцевого, офтальмологічного чи ректального введення, або форму, придатну для введення шляхом інгаляції чи інсуфляції. Для орального введення фармацевтичним композиціям може надаватись форма, наприклад, таблеток, льодяників чи капсул, приготовлених звичайними засобами з використанням фармацевтично прийнятних формоутворюючих добавок, таких як зв’язувальні агенти (наприклад, попередньо желатинізований кукурудзяний крохмаль, полівініл піролідон чи гідроксипропилметилцелюлоза); наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза 5 UA 99469 C2 5 10 15 20 25 30 35 40 45 50 55 60 чи кальцію гідро фосфат); лубриканти (наприклад, магнію стеарат, тальк чи кремнезем); дезінтегратори (наприклад, картопляний крохмаль чи натрію гліколят); чи зволожуючі агенти (наприклад, натрію лаурил сульфат). Таблетки можуть мати покриття, яке наноситься методами, добре відомими в цій галузі. Рідкі препарати для орального введення можуть приймати форму, наприклад, розчинів, сиропів чи суспензій, або вони можуть мати вигляд сухого продукту, який перед використанням розчиняють у воді чи іншому прийнятному розчиннику. Такі рідкі препарати можуть бути приготовлені звичайними засобами з використанням фармацевтично прийнятних добавок, таких як агенти для суспендування, емульгатори, неводні розчинники і консерванти. Такі препарати можуть містити також буферні солі, ароматизатори, барвники, підсолоджувачі і т.п. Препарати для орального введення можуть бути принагідно приготовлені так, щоб забезпечити контрольоване вивільнення активної сполуки. Для трансбуккального введення композиціям може надаватись форма таблеток чи льодяників, які готують звичайним способом. Сполуки формули (І) можуть використовуватись для парентерального введення шляхом ін’єкції, наприклад болюсної ін’єкції чи інфузії. Препарати для ін’єкції можуть бути представлені як дозована лікарська форма, наприклад в скляних ампулах чи контейнерах, розрахованих на певну кількість доз, наприклад в скляних флаконах. Композиціям для ін’єкції можуть надаватись такі форми, як суспензії розчини чи емульсії в олійних чи водних розчинниках, і вони можуть містити додаткові інгредієнти для суспендування, стабілізації, консервації та/або диспергування. Як варіант, активний інгредієнт може бути у вигляді порошку, який перед використанням розчиняють у відповідному розчиннику, наприклад в стерильній воді, що не містить пірогенів. Крім описаних лікарських форм, сполуки формули (І) можуть використовуватись у препаратах типу депо. Такі лікарські форми тривалої дії можуть вводитись шляхом імплантації чи внутрішньом’язової ін’єкції. Для назального введення чи введення шляхом інгаляції сполуки за цим винаходом можуть зручно доставлятись у вигляді аерозолю з використанням відповідного газу-витиснювача, наприклад дихлордифторметану, фтортрихлорметану, дихлортетрафторетану, двоокису вуглецю чи іншого придатного для цього газу чи суміші газів. Композиції за цим винаходом, якщо це бажано, можуть бути в упаковці чи пристрої для роздачі, які можуть містити одну чи більше лікарських дозованих форм, що включають активний інгредієнт. Така упаковка чи пристрій для роздачі можуть супроводжуватись інструкцією для введення. Для місцевого введення сполуки за цим винаходом можуть бути зручно приготовлені у вигляді мазі, що містить активний інгредієнт, суспендований чи розчинений в одному чи більше фармацевтично прийнятному носії. Конкретні носії включають, наприклад, мінеральну олію, рідку нафту, пропілен гліколь, поліоксиетилен, поліоксипропилен, емульсований віск і воду. Альтернативно, сполуки за цим винаходом можуть бути приготовлені у вигляді лосьйону, що містить активний інгредієнт, суспендований чи розчинений в одному чи більше фармацевтично прийнятному носії. Конкретні носії включають, наприклад, мінеральну олію, сорбітмоностеарат, полісорбат 60, віск з цетиловим ефіром, цетеариловий спирт, бензиловий спирт, 2октилдодеканол і воду. Для офтальмічного введення сполуки за цим винаходом можуть бути зручно приготовлені у вигляді мікроіонізованих суспензій в ізотонічному, рН-регульованому, стерильному сольовому розчині без консерванту чи з консервантом, таким як бактерицидний чи фунгіцидний агент, такий як фенілртутьнітрат, бензилалконію хлорид чи хлоргексидину ацетат. Альтернативно, для офтальмічного введення сполуки за цим винаходом можуть бути приготовлені у вигляді мазі, такої як мазь на основі вазеліну. Для ректального введення сполуки за цим винаходом можуть бути зручно приготовлені у вигляді супозиторіїв. Для цього активний компонент змішують з не подразнюючим наповнювачем, що є твердим при кімнатній температурі, але рідким при ректальній температурі. Він буде плавитись в прямій кишці, вивільнюючи активний компонент. Такі матеріали включають, наприклад, масло какао, бджолиний віск і поліетилен гліколі. Кількість сполуки за цим винаходом, необхідна для профілактики чи лікування конкретного стану буде варіювати в залежності від вибраної сполуки і стану пацієнта, який лікується. Загалом, однак, добові дози можуть коливатись від приблизно 10 нг/кг до 1000 мг/кг, типово від 100 нг/кг до 100 мг/кг, наприклад від приблизно 0,01 мг/кг до 40 мг/кг ваги тіла для орального чи трансбуккального введення, від приблизно 10 нг/кг до 50 мг/кг ваги тіла для парентеральнеого введення і від приблизно 0,05 мг до приблизно 1000 мг, наприклад від приблизно 0,5 мг до приблизно 1000 мг для назального введення чи введення шляхом інгаляції чи інсуфляції. 6 UA 99469 C2 Сполуки формули (І) можуть бути приготовлені з використанням процесу, який включає реакцію сполуки формули (ІІ) зі сполукою формули (ІІІ): 5 15 20 12 11 10 11 23 24 1 12 де R , R , T, V, W, R і R є такими, як було визначено раніше, а L являє собою групу, що відщеплюється. 1 Групою L , що відщеплюється типово є атом галогену, наприклад брому. Ця реакція звичайно здійснюється при підвищеній температурі у відповідному розчиннику, наприклад нижчому алканолі, такому як ізопропанол, чи циклічному ефірі, такому як тетрагідрофуран, типово в лужних умовах, наприклад в присутності органічної основи, такої як N,N-диізопропилетиламін чи 2,6-лютидин. Як варіант, ця реакція може здійснюватись при підвищеній температурі у такому розчиннику, як 2-етоксиетанол, в присутності каталітичної кількості мінеральної кислоти, наприклад концентрованої соляної кислоти. Як інший варіант, реакція може здійснюватись при підвищеній температурі у відповідному розчиннику, наприклад циклічному ефірі, такому як тетрагідрофуран, або ароматичному розчиннику, такому як толуол, типово в лужних умовах, наприклад в присутності неорганічної основи, такої як натрію tert-бутоксид, в присутності перехідного металу в якості каталізатору. Таким каталізатором принагідно є паладію(ІІ) ацетат, у випадку чого реакція буде ідеально здійснюватись в присутності tert-бутилфосфонію тетрафторборату чи дициклогексил дифенілфосфіну. 1 Проміжні продукти формули (ІІ), наведеної вище, в якій L є бромо, можуть бути отримані зі сполуки формули (IV): 25 30 де R і R є такими, як було визначено раніше; шляхом диазотування/бромування. Ця реакція звичайно здійснюється шляхом перемішування сполуки формули (IV) з tert-бутил нітритом і бромідом міді(ІІ) у відповідному розчиннику, такому як ацетонітрил. Проміжні продукти формули (IV) можуть бути отримані шляхом реакції тіосечовини зі сполукою формули (V): 7 UA 99469 C2 11 5 10 15 12 2 де R і R є такими, як було визначено раніше, а L являє собою групу, що відщеплюється. 2 Групою L , що відщеплюється типово є атом галогену, наприклад брому. Ця реакція звичайно здійснюється при підвищеній температурі у відповідному розчиннику, наприклад циклічному ефірі, такому як тетрагідрофуран, типово в лужних умовах, наприклад в присутності органічної основи, такої як N,N-диізопропилетиламін. Як варіант, ця реакція може здійснюватись шляхом нагрівання реагентів в нижчому алканолі в якості розчинника, наприклад в С1-6 алкіловому спирті, такому як етиловий спирт. За іншою методикою сполуки формули (І) можуть бути отримані за допомогою процесу, який включає реакцію сполуки формули (V), як її було визначено раніше, зі сполукою формули (VІ): 23 24 де T, V, W, R і R є такими, як було визначено раніше; в умовах, аналогічних тим, які були описані раніше для реакції між тіосечовиною і сполукою формули (V). За додатковою методикою сполуки формули (І), де Т є киснем, можуть бути приготовлені за допомогою процесу, який включає реакцію сполуки формули (VІІ) зі сполукою формули (VІІІ): 20 11 12 23 24 де R , R , V, W, R і R є такими, як було визначено раніше; в присутності перехідного металу в якості каталізатору; з наступним видаленням триметилсілілової групи з 2-ої позиції отриманого продукту циклоприєднання. 8 UA 99469 C2 5 10 Каталізатором з перехідного металу, який використовується в реакції між сполуками формули (VІІ) і формули (VІІІ), принагідно є паладію(ІІ) ацетат, у випадку чого реакція може здійснюватись при підвищеній температурі у відповідному розчиннику, наприклад у диполярному апротонному розчиннику, такому як N,N-диметилформамід, в присутності літію хлориду і основи, типово неорганічної основи, наприклад карбонату лужноземельного металу, такого як натрію карбонат. Видалення триметилсілілової групи з отриманого продукту циклоприєднання може бути досягнуте обробкою кислотою, наприклад мінеральною кислотою, такою як соляна кислота. Як варіант, триметилсілілову групу можна видалити обробкою основою, типово неорганічною основою, наприклад гідрооксидом лужного металу, таким як гідрооксид літію. Проміжні продукти формули (VІІ), наведеної вище, можуть бути отримані шляхом реакції сполуки формули (V), як її було визначено раніше, зі сполукою формули (ІХ): 15 20 25 30 35 40 45 в умовах,які були вже описані для реакції між сполуками формули (V) і формули (VІ). В разі неможливості придбання вихідних матеріалів формули (ІІІ), (V), (VІ), (VІІІ) і (ІХ) їх можна приготувати за допомогою методів, аналогічних тим, що описані в супроводжуючих Прикладах, або стандартними методами, добре відомими спеціалістам в цій галузі. Слід розуміти, що будь-яка сполука формули (І), початково отримана за допомогою будьякого з вищезгаданих процесів, може, коли це доцільно, бути згодом перетвореною на іншу сполуку формули (І) методами, добре відомими в цій галузі. В якості прикладу, сполука 23 формули (І), в якій R являє собою С2-6 алкоксикарбоніл, наприклад метоксикарбоніл, може 23 бути перетворена на відповідну сполуку, в якій R буде являти собою карбокси (-СО2Н), в стандартних умовах омилювання, наприклад шляхом обробки основою, такою як гідрооксид 23 літію. Сполуку формули (І), в якій R являє собою карбокси (-СО2Н), може бути перетворена на 23 відповідну сполуку, в якій R буде містити амідо групу, наприклад метиламінокарбоніл, 2гідроксиетиламінокарбоніл, диметиламінокарбоніл, N-(ціанометил)-N-метиламінокарбоніл, N-(2гідроксиетил)-N-метиламінокарбоніл, N-(2-метоксиетил)-N-метиламінокарбоніл, бензиламінокарбоніл, азетідин-1-ілкарбоніл, піролідин-1-ілкарбоніл, піперидин-1-ілкарбоніл, 4метилпіперазин-1-ілкарбоніл чиморфолін-4-ілкарбоніл, за допомогою двостадійної процедури, яка включає: (1) обробку карбокси похідного пентафторфенолом в присутності конденсуючого агента, такого як 1-(3-диметиламінопропил)-3-етилкарбодиімід; і (2) реакцію отриманого при цьому пентафторфенілового ефіру з відповідним аміном, наприклад метиламіном, 2гідроксиетиламіном, диметиламіном, N-(ціанометил)-N-метиламіном, N-(2-гідроксиетил)-Nметиламіном, N-(2-метоксиетил)-N-метиламіном, бензиламіном, азетідином, піролідином, піперидином, 1-метилпіперазином чи морфоліном. Якщо після будь-якого з описаних процесів для приготування сполук за цим винаходом отримується суміш продуктів, бажаний продукт можна відділити на відповідній стадії звичайними методами, такими як препаративна ВЕРХ, чи з використанням колонкової хроматографії, використовуючи, наприклад, кремнезем та/або глинозем в поєднанні з відповідною системою розчинників. Коли вищеописані процеси для приготування сполук за цим винаходом дають суміш стереоізомерів, ці ізомери можна розділити звичайними методами. Зокрема, коли бажано отримати конкретний енантіомер сполуки формули (І), цього можна досягти за допомогою будьякої придатної звичайної методики розділення енантіомерів. Так, наприклад, діастереомерні похідні, наприклад солі, можуть бути отримані шляхом реакції суміші енантіомерів формули (І), наприклад рацемату, і відповідної хоральної сполуки, наприклад хоральної основи. 9 UA 99469 C2 5 10 15 20 25 30 35 40 45 Діастереомери можна потім розділити будь-якими звичайними засобами, наприклад кристалізацією, і відділити бажаний енантіомер, наприклад обробкою кислотою в тому випадку, коли цим діастереомером є сіль. Іншим шляхом розділення рацемату формули (І) є використання хіральної ВЕРХ. Більш того, якщо це бажано, конкретний енантіомер можна отримати за допомогою відповідного хірального проміжного продукту в одному з процесів, описаних вище. Як варіант, конкретний енантіомер можна отримати, здійснивши специфічну щодо енантіомеру ферментативну біотрансформацію, наприклад гідроліз ефіру за допомогою естерази, а потім очистивши тільки енантіомерно чисту гідролізовану кислоту від антиподу ефіру, що не прореагував. Хроматографія, рекристалізація та інші звичайні методи розділення також можуть бути використані на проміжних чи кінцевих продуктах, коли бажано отримати конкретний геометричний ізомер за цим винаходом. Під час будь-якого з вищезгаданих процесів приготування може бути необхідним та/або бажаним захистити чутливі чи реактивні групи на якійсь з молекул, про які йдеться. Цього можна досягти засобами звичайного захисту груп, такими як описані в книзі Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; і в книзі T.W. Greene & P.G.M. Wuts, Protective rd Groups in Organic Synthesis, John Wiley & Sons, 3 edition, 1999. Захисні групи, які використовуються при цьому, можуть бути видалені на будь-якій наступній стадії методами, відомими в цій галузі. Наступні Приклади ілюструють приготування сполук за цим винаходом. Сполуки за цим винаходом потенційно пригнічують активність ізоформ РІ3Кα та/або РІ3Кβ та/або РІ3Кγ та/або РІ3Кδ кінази людини. Тести на пригнічення ферменту Оцінку здатності сполук за цим винаходом пригнічувати активність ліпідкінази чотирьох класів – ізоформ РІ3Кα, РІ3Кβ, РІ3Кγ та РІ3Кδ – було здійснено з використанням доступного для придбання гомогенного, з часовим розділенням, флуоресцентного аналізу, як описано Gray et al., Anal. Biochem., 2003, 313, 234-245, у відповідності до інструкцій виробника (Upstate). Всі аналізи виконувались при 2 мкМ АТФ і такій концентрації очищеної кінази класу 1 РІ3, про яку було відомо, що вона генерує продукт в межах лінійного діапазону цього аналізу. До зразка додавали розведення інгібітору в ДМСО і порівнювали з прогоном зразків в присутності тільки 2% (о/о) ДМСО (100% активність). Концентрація інгібітору, необхідна для пригнічення активності ферменту на 50%, позначалась як ІС50. При тестуванні за допомогою цього аналізу було встановлено, що всі сполуки з супроводжуючих Прикладів демонструють значення ІС50 щодо пригнічення активності ізоформ РІ3Кα та/або РІ3Кβ та/або РІ3Кγ та/або РІ3Кδ кінази людини на рівні 50 мкМ чи при більш низькій концентрації. Приклади Скорочення DCM: дихлорметан DMF: N,N-диметилформамід DMSO: диметилсульфоксид Et: етил Et2O: діетиловий ефір THF: тетрагідрофуран r.t.: кімнатна температура sat.: насичений MeCN: ацетонітрил EtOAc: етилацетат МеОН: метиловий спирт AcOH: оцтова кислота EtOH: етиловий спирт IPA: ізопропиловий спирт RT: час утримання Me: метил h: година conc.: концентрований SiO2: кремнезем br.: широкий w чи wt: вага M: маса t Bu: tert-бутил v: об’єм NBS: N-бромсукцинімід brine: насичений водний розчин натрію хлориду (розсіл) HPLC: високоефективна рідинна хроматографія (ВЕРХ) LCMS: рідинна хроматомас-спектрометрія DIPEA: N,N-диізопропилетиламін ES+: позитивна іонізація методом електророзпилення ES-: негативна іонізація методом електророзпилення EDC: 1-(3-диметиламінопропил)-3-етилкарбодиімід гідрохлорид DMPU: 1,3-диметил-3,4,5,6-тетрагідро-2(1Н)-пирімідинон Аналітичні умови Всі ЯМР були отримані при 300 МГц або 400 Мгц 10 UA 99469 C2 5 10 Сполуки були названі за допомогою ACD Labs Name (v. 7.0, 9.0 або 10.0) 30 від Advanced Chemical Development, Канада. Всі реакції з участю чутливих до повітря чи вологи реагентів виконувались в атмосфері азоту з використанням висушених розчинників і лабораторного посуду. Чистота сполук і час утримання визначались за допомогою LCMS з використанням одного з Методів 1-9, наведених далі. Препаративна HPLC для сполук, які вимагали цього, виконувалась з використанням одного з Методів 10-13, наведених далі. Метод 1: Колонка Luna C I 8(2) 100 x 4,6 мм, 5 мкм. Мобільна фаза А: 99,92% води, 0,08% мурашиної кислоти. Мобільна фаза В: 99,92% MeCN, 0,08% мурашиної кислоти. Програма зміни градієнту (швидкість потоку 3,0 мл/хв., температура колонки 35С): Час A % B% 0.00 95,0 5,0 4.40 5,0 95,0 5.30 5,0 95,0 5.32 95,0 5,0 6.50 95,0 5,0 Метод 2: Колонка Luna C I 8(2) 100 x 4,6 мм, 5 мкм. Мобільна фаза А: 5 мМ NH 4OAc, pH 5,8. Мобільна фаза В: 95:5 MeCN : 100 мМ NH4OAc, pH 5,8. Програма зміни градієнту (швидкість потоку 3,0 мл/хв., температура колонки 35С): Час A % B % 0.00 5,0 4.40 5,0 95,0 5.30 5,0 95,0 5.32 95,0 5,0 6.50 15 95,0 95,0 5,0 Метод 3: Колонка Gemini C I 8 50 x 4,6 мм, 5 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% мурашиної кислоти. Мобільна фаза B: 94,9% MeCN, 0,1% мурашиної кислоти, 5% мобільної фази А. Програма зміни градієнту (швидкість потоку 0,9 мл/хв., температура колонки 40С): Час A % B % 0.00 5,0 2.00 5,0 95,0 5.50 20 95,0 5,0 95,0 Метод 4: Колонка Gemini C I 8 50 x 4,6 мм, 5 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% аміаку. Мобільна фаза B: 94,9% MeCN, 0,1% аміаку, 5% мобільної фази А. Програма зміни градієнту (швидкість потоку 3,0 мл/хв., температура колонки 40С): Час A % B % 0.00 5,0 2.00 5,0 95,0 5.50 25 95,0 5,0 95,0 Метод 5: Колонка Gemini C I 8 50 x 4,6 мм, 5 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% мурашиної кислоти. Мобільна фаза B: 94,9% MeCN, 0,1% мурашиної кислоти, 5% мобільної фази А. Програма зміни градієнту (швидкість потоку 0,9 мл/хв., температура колонки 40С): Час A % B % 11 UA 99469 C2 0.00 95,0 5,0 2.00 5,0 95,0 4.00 5,0 95,0 Метод 6: Колонка Gemini C I 8 30 x 3,0 мм, 3 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% мурашиної кислоти. Мобільна фаза B: 94,9% MeCN, 0,1% мурашиної кислоти, 5% мобільної фази А. Програма зміни градієнту (швидкість потоку 1,2 мл/хв., температура колонки 40С): Час A % B % 0.00 5,0 4.00 5,0 95,0 5.50 5 95,0 5,0 95,0 Метод 7: Колонка Gemini C I 8 30 x 3,0 мм, 3 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% розчину аміаку. Мобільна фаза B: 94,9% MeCN, 0,1% розчину аміаку, 5% мобільної фази А. Програма зміни градієнту (швидкість потоку 1,2 мл/хв., температура колонки 40С): Час A % B % 0.00 5,0 4.00 5,0 95,0 5.50 10 95,0 5,0 95,0 Метод 8: Колонка Gemini C I 8 30 x 3,0 мм, 3 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% мурашиної кислоти. Мобільна фаза B: 100% MeCN. Програма зміни градієнту (швидкість потоку 1,2 мл/хв., температура колонки 40С): Час A % B % 0.00 95,0 5,0 2.30 5,0 95,0 3.40 5,0 95,0 3.50 95,0 5,0 Метод 9: Колонка Gemini C I 8 30 x 3,0 мм, 3 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% розчину аміаку. Мобільна фаза B: 100% MeCN. Програма зміни градієнту (швидкість потоку 1,2 мл/хв., температура колонки 40С): Час A % B % 0.00 5,0 95,0 3.40 5,0 95,0 3.50 20 5,0 2.30 15 95,0 95,0 5,0 Метод 10: Колонка Luna C I 8(2) 250 x 21,2 мм, 5 мкм. Мобільна фаза A: 99,92% води, 0,08% мурашиної кислоти. Мобільна фаза B: 99,92% MeCN, 0,08% мурашиної кислоти. Програма зміни градієнту (швидкість потоку 25 мл/хв.), температура колонки: температура оточуючого середовища, змінний градієнт. Метод 11: Колонка Luna C I 8(2) 250 x 21,2 мм, 5 мкм. Мобільна фаза A: 10 мМ NH4OAc, pH 5,8. Мобільна фаза B: 95% MeCN, 5% 200 мМ NH4OAc, pH 5,8. Програма зміни градієнту (швидкість потоку 25,0 мл/хв.), температура колонки: температура оточуючого середовища, змінний градієнт. 12 UA 99469 C2 5 10 15 20 25 30 35 40 45 50 55 60 Метод 12: Колонка Gemini C I 8 150 x 21,2 мм, 10 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% мурашиної кислоти. Мобільна фаза B: 94,9% MeCN, 0,1% мурашиної кислоти, 5% мобільної фази А. Програма зміни градієнту (швидкість потоку 20,0 мл/хв.), температура колонки: температура оточуючого середовища, змінний градієнт. Метод 13: Колонка Gemini C I 8 150 x 21,2 мм, 10 мкм. Мобільна фаза A: 99,9% 10 мМ амонію формату, 0,1% розчину аміаку. Мобільна фаза B: 94,9% MeCN, 0,1% розчину аміаку, 5% мобільної фази А. Програма зміни градієнту (швидкість потоку 20,0 мл/хв.), температура колонки: температура оточуючого середовища, змінний градієнт. Проміжний продукт 1 Етил 3-аміно-3-метилбутаноат гідрохлорид При перемішуванні до розчину етил 3,3-диметилакрилату (5,0 г; 39,1 ммоль) в EtOH (20 мл) ® в реакторі Parr при 0С додали рідкий NH3 (приблизно 20 мл). Реактор герметизували і 0 нагрівали до 90 С впродовж 24 годин. Потім реакційну суміш охолодили до кімнатної температури, продули азотом, щоб видалити залишковий NH 3 і обробили 4 М HCl в діоксані (10 мл). Реакційну суміш перемішували 30 хвилин при кімнатній температурі, після чого випарили in vacuo до сухості. Отриману сіру пасту розтерли з DCM, профільтрували і висушили, щоб отримати титульну сполуку (5,0 г; 70%) у вигляді сірої твердої маси, яку було використано без подальшої очистки. δН (CDCI3) 8,27 (3H, br. s), 4,10 (2H, q, J 7,1 Гц), 2,65 (2H, s), 1,26 (6H, s), 1,20 (3H, t, J 7,1 Гц). Проміжний продукт 2 Етил 3-[(3-етокси-3-оксопропаноїл)аміно]-3-метилбутаноат При перемішуванні до суспензії Проміжного продукту 1 (5,0 г; 27,4 ммоль) в DCM (40 мл) 0 додали Net3 (11,1 г; 15,3 мл; 109,6 ммоль). Потім реакційну суміш охолодили до 0 С і краплями додавали етил малоніл хлорид (4,4 г; 3,7 мл; 28,8 ммоль). Суспензію перемішували при кімнатній температурі впродовж 2 годин, після чого її розвели DCM (50 мл) і промили водною 1М HCl (50 мл) і водою (2 х 50 мл). Органіку висушили над MgS04, профільтрували і концентрували під вакуумом, щоб отримати титульну сполуку (5,0 г; 71%) у вигляді оранжевої олії, яку було використано без подальшої очистки. δН (DMSO-d6) 7,75 (1H, br. s), 4,15-3,95 (4H, m), 3,14 (2H, s), 2,71 (2H, s), 1,29 (6H, s), 1,21-1,11 (6H, m). Проміжний продукт 3 6,6-Диметилпіперідин-2,4-діон При перемішуванні до розчину NaOEt, приготовленого in situ з Na (0,53 г; 23,16 ммоль) в EtOH (30 мл), краплями додали розчин Проміжного продукту 2 (5,00 г; 19,30 ммоль) в толуолі (30 мл), і реакційну суміш нагрівали до 80С впродовж 2 годин. Потім розчин концентрували приблизно до 10 мл, а залишок розчинили в толуолі (30 мл) і екстрагували водою (3 х 30 мл). Об’єднані водні шари підкислили до рН 2-3 водною 1М HCl і екстрагували EtOAc (4 х 50 мл). Об’єднані органічні фракції висушили (MgSO4), профільтрували і випарили in vacuo, щоб отримати блідо-жовту тверду масу, яку розчинили в MeCN (90 мл), який містив 1% води. Розчин нагрівали зі зворотним холодильником впродовж 2 годин, після чого випарили in vacuo до сухості. Отриману тверду масу розтерли з диізопропиловим ефіром, профільтрували і висушили, щоб отримати титульну сполуку (1,55 г; 57%) у вигляді кремової твердої маси, яку було використано без подальшої очистки. Спостерігались обидві форми – кето і енол (співвідношення 3,6:1 кето/енол) δН (DMSO-d6) 10,29 (1H, br. s, enol), 8,14 (1H, br. s, keto), 6,66 (1H, s, enol), 4,81 (1H, s, enol), 3,15 (2H, s), 2,51 (2H, s), 1,20 (6H, s, keto), 1,18 (6H, s, enol). Проміжний продукт 4 (3а,R)-Тетрагідро-3Н-[1,2,3]оксатіазоло[4,3-c][1,4]оксазин 1,1-диоксид До розчину Проміжного продукту 19 (30 г; 257 ммоль), розчиненого в безводному DCM (250 мл), додали пирідин (43,5 мл; 539 ммоль) і охолодили розчин до -70С (СО2/ІРА ванна). Хлористий сульфурил (21,7 мл; 270 ммоль), розчинений в безводному DCM (200 мл), краплями додавали впродовж 1 години (так, щоб підтримувати температуру реакції нижче -60С). 0 Реакційну суміш перемішували при -70 С впродовж 2 годин і при температурі від -10 до -20С (МеОН / льодяна ванна) стільки ж, після чого погасили додаванням води (15 мл) і нагріванням до кімнатної температури. Розчин відділили і водну фракцію екстрагували додатковою кількістю DCM (2 х 100 мл). Об’єднані органічні фракції промили водою (15 мл), розсолом (15 мл), висушили (Na2S04), профільтрували і концентрували під вакуумом, щоб отримати титульну сполуку (24,7 г; 54%) у вигляді жовтої олії, яка ствердла до оранжевої клейкої твердої маси після витримки при кімнатній температурі і яку було використано без подальшої очистки. δ Н (CDCl3) 4,51 ( l H , d d , J 8,1 та J 6,4 Гц), 4,23 (1H, dd, J 9,1 та J 8,1 Гц), 3,95 (1H, dd, J 11,6 та J 13 UA 99469 C2 5 10 15 20 25 30 35 40 45 50 55 3,4 Гц), 3,84-3,64 (3H, m), 3,54 (1H, 5 dd, J 11,6 та J 7,7 Гц), 3,29 (1H, dt, J 12,0 та J 3,4 Гц), 3,06 (1H, m). Проміжний продукт 5 (3S)-3-(Проп-2-ин-1-іл)морфолін До розчину триметилсіліл ацетилену (27,59 мл; 195,25 ммоль), розчиненого в безводному THF (250 мл) при 0С, додавали краплями n-бутиллітію (78,1 мл; 201 ммоль, 2,5М в гексанах) впродовж 15 хвилин. Після перемішування при цій температурі впродовж 40 хвилин повільно, за 15 хвилин, додали розчин Проміжного продукту 4 (11,65 г; 65,083 ммоль), розчиненого в DMPU (11 мл), після чого реакційній суміші дали нагрітись до кімнатної температури. Після перемішування при кімнатній температурі впродовж 18 годин реакційну суміш погасили додаванням води (приблизно 4 мл) і розчинник (не DMPU) видалили під вакуумом. До отриманої темної олії додали водну HCl (10% о/о, 200 мл) і МеОН (100 мл), і реакційну суміш перемішували при кімнатній температурі впродовж 18 годин. Потім розчин концентрували під вакуумом, щоб отримати титульну сполуку (17,059 г; вихід біля 74%) у вигляді неочищеної темної олії (яка містила біля 11 мл DMPU), яку було використано без подальшої очистки. δ Н (CD3OD) 3,89 (1H, dd, J 11,2 та J 3 , 1 Гц), 3.76 (1H, dt, J 11,2 та J 2,7 Гц), 3,45-3,56 (1H, m), 3,25 (1H, m), 2,89 (3H, m), 2,39 (1H, t, J 2,7 Гц), 2,25 (2H, dd, J 6,8 та J 2,7 Гц). Обмінного протону не спостерігалось. Проміжний продукт 6 tert-Бутил (3S)-3-(проп-2-ин-1-іл)морфолін-4-карбоксилат До розчину неочищеного Проміжного продукту 5 (17,059 г, містить 11 мл DMPU), 0 розчиненого в безводному DCM (300 мл) при 0 С, додали DIPEA (13,04 мл; 74,85 ммоль) і диtert-бутил дикарбонат (15,624 г; 71,59 ммоль), і реакційну суміш нагріли до кімнатної температури. Після перемішування впродовж 18 годин реакційну суміш промили розсолом. Органічну фракцію висушили за допомогою картриджу фазоділителя Isolute® і концентрували під вакуумом, щоб отримати темно-коричневу олію. Очистка за допомогою колонкової хроматографії (SiO2, 10:1 EtOAc/гексани) дала титульну сполуку (8,79 г; 59% від Проміжного продукту 4) у вигляді жовтої олії. δН (CD3OD) 3,95 (1Н, m), 3,75 (1H, d, J 14,2 Гц), 3,70 (1H, m), 3,58 (1H, m), 3,42 (1H, m), 3,30 (1H, m), 2,95 (1H, m), 2,51 (1H, m), 2,37 (1H, m), 2,19 (1H, t, J 2,7 Гц), 1,35 (9H, s). Проміжний продукт 7 (МЕТОД Н) tert-Бутил (3S)-3-[3-(триметилсіліл)проп-2-ин-1-іл]морфолін-4-карбоксилат До розчину Проміжного продукту 6 (8,05 г; 35,7 ммоль), розчиненого в безводному 0 тетрагідрофурані (250 мл) при 0 С, додавали краплями за 15 хвилин n-бутиллітію (15,7 мл, 39,3 ммоль, 2,5М в гексанах). Після перемішування впродовж 30 хвилин повільно, за 5 хвилин, додали хлортриметилсилан, і реакційну суміш перемішували 45 хвилин, після чого дали нагрітись до кімнатної температури. Після перемішування при кімнатній температурі впродовж 18 годин реакційну суміш погасили додаванням води (біля 1 мл), а розчинник видалили під вакуумом. Неочищену суміш розчинили в DCM і промили водою, водну фазу екстрагували додатковою кількістю DCM (500 мл). Об’єднані органічні фракції висушили за допомогою картриджу фазоділителя Isolute® і концентрували під вакуумом, щоб отримати темно-коричневу олію. Очистка за допомогою колонкової хроматографії (SiO2, 5-20% EtOAc/гексани) дала титульну сполуку (8,1 г; 76%) у вигляді безбарвної олії і відновленого вихідного матеріалу. δН (CD3OD) 3,91 (1H, m), 3,82 (1H, d, J 11,7 Гц), 3,70 (1H, dd, J 3,6 та J 1 1 , 4 Гц), 3,58 (1H, dd, J 2,9 та J 13,7 Гц), 3,40-3,20 (2H, m), 2,95 (1H, m), 2,60 (1H, dd, J 9,1 та J 16,7 Гц), 2,38 (1H, dd, J 6,4 та J 16,7 Гц), 1,35 (9H, s), 0,00 (9H, s). Проміжний продукт 8 (МЕТОД І) tert-Бутил (3S)-3-{[5-(дифторметокси)-2-(триметилсіліл)-1Н-індол-3-іл]метил} морфолін-4карбоксилат До розчину Проміжного продукту 7 (0,571 г; 1,93 ммоль), розчиненого в DMF (23 мл) додали Проміжний продукт 20 (0,55 г; 1,93 ммоль), LiCl (0,082 г; 1,93 ммоль), Na 2CO3 (0,409 г; 3,86 ммоль) і Pd(OAc)2 (0,017 г; 0,08 ммоль), і реакційну суміш піддали дегазації під вакуумом, після чого продули азотом. Потім реакційну суміш нагрівали при 100С впродовж 6 годин. Неочищену реакційну суміш охолодили до кімнатної температури і видалили розчинник під вакуумом, щоб отримати коричневу олію. Очистка за допомогою колонкової хроматографії (SiO2, 10-30% EtOAc/гексани; потім SiO2, DCM), дозволила отримати титульну сполуку (0,462 г, 53%) у вигляді t + жовтої олії. LCMS (ES+) 399,0 ((M- Bu)+H) , RT 3,95 хвилини (Метод 5). Проміжний продукт 9 (МЕТОД J) 5-(Дифторметокси)-3-[(3S)-морфолін-3-ілметил]-1H-індол 14 UA 99469 C2 0 5 10 15 20 25 30 35 40 45 50 55 60 До Проміжного продукту 8 (0,285 г; 0,63 ммоль) при 0 С додали 4М HCl в 1,4-діоксані (8 мл), і реакційну суміш перемішували при кімнатній температурі впродовж 2 годин. Потім реакційну суміш концентрували під вакуумом, і неочищений залишок розчинили в DCM (25 мл) і промили водним насиченим розчином NaHCO3 (5 мл). Водну фракцію екстрагували далі DCM (3 х 20 мл) і об’єднані органічні фракції висушили (Na2SO4), профільтрували і концентрували під вакуумом, щоб отримати титульну сполуку (0,197 г, кількісно) у вигляді жовтої олії, яку було використано + без подальшої очистки. LCMS (ES+) 283,0 (M+H) , RT 2,27 хвилин (Метод 5). Проміжний продукт 10 (МЕТОД К) (3S)-3-{[5-(Дифторметокси)-1Н-індол-3-іл]метил}морфолін-4-карботіоамід До розчину 1,1’-тіокарбонілдиімідазолу (0,137 г; 0,77 ммоль) в THF (5 мл) додали Проміжний продукт 9 (0,197 г; 0,70 ммоль), розчинений в THF (5 мл), і реакційну суміш перемішували при кімнатній температурі впродовж 18 годин. Потім реакційну суміш концентрували під вакуумом, розчинили в MeCN (7 мл) і додали водний розчин NH3 (20% о/о, 7 мл). Реакційну суміш 0 перемішували при 60 С впродовж 4 годин. Після охолодження до кімнатної температури реакційну суміш концентрували під вакуумом, щоб отримати жовту олію. Неочищений матеріал було очищено за допомогою колонкової хроматографії (SiO2, 9:10 EtOAc/гексани), щоб + отримати титульну сполуку (0,106 г, 44%) у вигляді жовтої олії. LCMS (ES+) 342,0 (M+H) , RT 2,91 хвилини (Метод 5). Проміжний продукт 11 Метил 3-{[(3S)-4-(tert-бутоксикарбоніл)морфолін-3-іл]метил}-2-(триметилсіліл)-1Н-індол-5карбоксилат Титульну сполуку було отримано з метил 4-аміно-3-йодобензоату і Проміжного продукту 7 згідно з Методом І і було виділено у вигляді жовтої клейкої твердої маси (59%) після очистки за допомогою колонкової хроматографії (SiO2, 10-25% EtOAc/гексани). LCMS (ES+) 392,0 ((Mt + Bu)+H) , RT 3,58 хвилин (Метод 3). Проміжний продукт 12 Метил 3-[(3S)-морфолін-3-ілметил]-1Н-індол-5-карбоксилат Титульну сполуку було отримано з Проміжного продукту 11 згідно з Методом J і було виділено у вигляді коричневої клейкої субстанції (кількісно), яку було використано як + неочищений проміжний продукт. LCMS (ES+) 275,0 (M+H) , RT 2,30 хвилин (Метод 5). Проміжний продукт 13 Метил 3-{[(3S)-4-амінокарбонотіоїл)морфолін-3-іл]метил}-1Н-індол-5-карбоксилат Титульну сполуку було отримано з Проміжного продукту 12 згідно з Методом К і було виділено у вигляді жовтої твердої маси (99%) після очистки за допомогою колонкової + хроматографії (SiO2, 0-4% MeOH/DCM). LCMS (ES+) 334,0 (M+H) , RT 2,25 хвилин (Метод 4). Проміжний продукт 14 Пентафторфеніл 3-{[(3S)-4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідро[1,3]тіазоло[5,4-c]пирідин2-іл)морфолін-3-іл]метил}-1Н-індол-5-карбоксилат До розчину Проміжного продукту 45 (1,96 г; 4,46 ммоль) в DMF (10 мл) і DCM (150 мл) додали пентафторфенол (0,86 г; 4,68 ммоль) і EDC (0,94 г; 4,91 ммоль), і реакційну суміш перемішували при кімнатній температурі впродовж 16 годин. Потім додали DIPEA (1,15 г; 1,56 мл; 8,92 ммоль) і додаткову кількість пентафторфенолу (0,22 г; 1,20 ммоль) і EDC (0,24 г; 1,25 ммоль) і перемішували ще 2 години при кімнатній температурі. Реакційну суміш промили водою (2 х 50 мл), розсолом (50 мл), висушили (Na 2SO4), профільтрували і концентрували під вакуумом. Очистка за допомогою колонкової хроматографії (SiO2, 0-6% MeOH/DCM) дала + титульну сполуку (1,41 г; 52%) у вигляді коричневої клейкої маси. LCMS (ES+) 607,3 (M+H) , RT 3,23 хвилин (Метод 3). Проміжний продукт 15 3-Бром-6,6-диметилпіперідин-2,4-діон При перемішуванні до суспензії Проміжного продукту 3 (10,00 г; 70,9 ммоль) в тетрагідрофурані (200 мл) додали NaHSO4 (2,12 г; 17,7 ммоль). Потім суспензію охолодили до 0 0 С і частинами додали NBS (12,62 г; 70,9 ммоль). Реакційну суміш перемішували при кімнатній температурі впродовж 5 годин, після чого додали DCM (200 мл) і воду (100 мл). Водну фракцію екстрагували DCM (2 х 100 мл). Об’єднані органічні фракції промили водою (3 х 200 мл), висушили (Na2SO4), профільтрували і випарили розчинник під вакуумом. Отриману тверду масу розтерли з ІРА (3 х 50 мл) і профільтрували, щоб отримати титульну сполуку (10,3 г; 66%) у вигляді білої твердої маси. δН (DMSO-d6) 10,80 (1H, br. s), 7,26 (1H, br. s), 2,50 (2H, s) для + головного таутомера. LCMS (ES+) 220,0 та 222,0 (співвідношення 1:1) (M+H) , RT 1,94 хвилин (Метод 3). Проміжний продукт 16 15 UA 99469 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-Бензил-D-серин При перемішуванні до розчину D-серину (14,7 г; 140,0 ммоль) у водному 2М NaOH (70 мл) додали бензальдегід (14,6 г; 14,0 мл; 138,0 ммоль). Реакційну суміш перемішували при 0 кімнатній температурі впродовж 1 години, після чого охолодили до 5 С. NaBH4 (1,5 г; 40,0 0 ммоль) додавали частинами, щоб підтримувати внутрішню температуру
ДивитисяДодаткова інформація
Назва патенту англійськоюFused thiazole derivatives as kinase inhibitors
Автори англійськоюAlexander, Rikki Peter, Aujla, Pavandeep Singh, Crepy, Karen Viviane Lucile, Foley, Anne Marie, Franklin, Richard Jeremy
Назва патенту російськоюКонденсированные производные тиазола как ингибиторы киназы
Автори російськоюАлександер Рикки Питер, Ауджла Павандип Сингх, Крепи Карен Вивьен Люсиль, Фоли Энни Мари, Франклин Ричард Джереми
МПК / Мітки
МПК: A61K 31/519, A61K 31/437, C07D 513/04, C07D 513/12, C07D 519/06
Мітки: конденсовані, кінази, тіазолу, інгібітори, похідні
Код посилання
<a href="https://ua.patents.su/27-99469-kondensovani-pokhidni-tiazolu-yak-ingibitori-kinazi.html" target="_blank" rel="follow" title="База патентів України">Конденсовані похідні тіазолу як інгібітори кінази</a>