Індазоли, бензізоксазоли і бензізотіазоли, спосіб їх одержання, фармацевтична композиція та їх застосування як естрогенних засобів
Номер патенту: 90280
Опубліковано: 26.04.2010
Автори: Дюранті Ерік, Бонне Поль, Дюк Ігор, Ляфей Жан, Рондо Бенуа, Бльо Крістіан, Шілд Жаклін, Клерк Тьєррі, Майо Філіпп, Пюссьйо Франсуа
Формула / Реферат
1. Сполука формули (І)
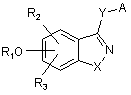 (І)
(І)
або її кислотно-адитивна сіль, або її стереоізомерна форма,
де:
R1 означає атом водню або (С1-С6)алкіл, (С3-С6)циклоалкіл, трифторметил, групу -N=CR5R6, -SO2NR7R8, феніл, феніл(С1-С3)алкіл або (С1-С3)алкіл, заміщений насиченим гетероциклічним радикалом, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси і трифторметил;
R1 може також бути сіллю;
R2 і R3 кожний незалежно означає атом водню або гідроксил, атом галогену, нітро, ціано, (С1-С6)алкіл, (С3-С6)циклоалкіл, (С1-С6)алкокси, трифторметил, групу -NR7R8, -CONR7R8, -COR9 або -CO2R9;
R2 може також бути фенілом або насиченим чи ненасиченим гетероциклом, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси, трифторметил і насичений гетероциклічний радикал;
X означає О, S, SO, SO2 або NR4;
R4 означає атом водню або (С1-С6)алкіл, (С3-С6)циклоалкіл, феніл, феніл(С1-С3)алкіл, (С1-С3)алкіл, заміщений насиченим гетероциклічним радикалом, групу -COR7, -CO2R7 або -SO2NR7R8, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси, трифторметил, феніл(С1-С3)алкіл або феніл(С1-С3)алкокси;
Y означає прямий зв'язок, О, S, SO, SO2, NR4, CO, -(CR10R11)n- або -R10C=CR11-;
R5, R6, R7 і R8 кожний незалежно означають атом водню або (С1-С6)алкільну або (С3-С6)циклоалкільну групу;
R9 означає атом водню, (С1-С6)алкіл, феніл або насичений чи ненасичений гетероциклічний радикал, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси, трифторметил і насичений гетероциклічний радикал;
R10 і R11 кожний незалежно означають атом водню або ціано, (С1-С6)алкіл, -СО-феніл, -СО(ненасичений гетероциклічний радикал) або групу -CONR7R8, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси і трифторметил;
n дорівнює 1 або 2;
А означає (С3-С15)циклоалкіл, (С3-С15)циклоалкен, феніл або нафтил, де циклоалкіл або циклоалкен не заміщений або заміщений принаймні одним (С1-С6)алкілом і де феніл або нафтил не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси і трифторметил;
коли X означає NR4, то Y і R2 разом з індазольним циклом, що їх містить, можуть також утворювати 1Н-пірано[4,3,2-сd]індазол;
за умови, що:
1) коли X означає О, S або NR4, R1 означає атом водню або (С1-С6)алкіл, (С3-С6)циклоалкіл або трифторметил, a Y означає прямий зв'язок, то А не є необов'язково заміщеним фенілом або необов'язково заміщеним нафтилом;
2) коли X означає NR4, де R4 означає Н або (С1-С6)алкіл, a R1O означає 6-ОСН3, то Y не означає CO;
3) коли X означає О, R1O означає 6-ОН або 6-ОСН3, Y означає прямий зв'язок, а А означає циклопентил, то (R2,R3) або (R3,R2) відрізняються від (Н,Сl) у позиції 4,5;
4) коли X означає О, R1O означає 6-ОН, R2 і R3 означають Н, a Y означає СН=СН, то А не є фенілом або 4-метоксифенілом;
5) коли X означає SO2, А означає феніл і R1O означає 5- або 6-ОСН3, то (R2,R3) або (R3,R2) відрізняються від (Н,ОСН3) у позиції 6- або 5-.
2. Сполука за п. 1, де R1 означає атом водню, (С1-С6)алкіл, феніл(С1-С3)алкіл, (С1-С3)алкіл, заміщений насиченим гетероциклічним радикалом, або групу -SO2NR7R8.
3. Сполука за пп. 1 або 2, де R2 означає атом водню, гідроксил, (С1-С6)алкіл або атом галогену.
4. Сполука за будь-яким з пп. 1-3, де R3 означає атом водню.
5. Сполука за будь-яким з пп. 1-4, де Y означає прямий зв'язок.
6. Сполука за будь-яким з пп. 1-5, де А означає (С3-С15)циклоалкіл, необов'язково заміщений принаймні одним (С1-С6)алкілом.
7. Сполука за будь-яким з пп. 1-6, де R1O знаходиться в позиції 6- кільця.
8. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль для застосування як активного терапевтичного засобу.
9. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль для застосування як активної речовини, що модулює рецептори естрогену.
10. Фармацевтична композиція, яка містить (і) сполуку за будь-яким з пп. 1-7 або її фармацевтично прийнятну сіль та (іі) фармацевтично прийнятний наповнювач.
Текст
1. Сполука формули (І) 2 3 90280 4 (С1-С3)алкокси, трифторметил, феніл(С1-С3)алкіл або феніл(С1-С3)алкокси; Y означає прямий зв'язок, О, S, SO, SO2, NR4, CO, -(CR10R11)n- або -R10C=CR11-; R5, R6, R7 і R8 кожний незалежно означають атом водню або (С1-С6)алкільну або (С3С6)циклоалкільну групу; R9 означає атом водню, (С1-С6)алкіл, феніл або насичений чи ненасичений гетероциклічний радикал, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1С3)алкіл, (С1-С3)алкокси, трифторметил і насичений гетероциклічний радикал; R10 і R11 кожний незалежно означають атом водню або ціано, (С1-С6)алкіл, -СО-феніл, СО(ненасичений гетероциклічний радикал) або групу -CONR7R8, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси і трифторметил; n дорівнює 1 або 2; А означає (С3-С15)циклоалкіл, (С3-С15)циклоалкен, феніл або нафтил, де циклоалкіл або циклоалкен не заміщений або заміщений принаймні одним (С1С6)алкілом і де феніл або нафтил не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси і трифторметил; коли X означає NR4, то Y і R2 разом з індазольним циклом, що їх містить, можуть також утворювати 1Н-пірано[4,3,2-сd]індазол; за умови, що: 1) коли X означає О, S або NR4, R1 означає атом водню або (С1-С6)алкіл, (С3-С6)циклоалкіл або трифторметил, a Y означає прямий зв'язок, то А не є необов'язково заміщеним фенілом або необов'язково заміщеним нафтилом; 2) коли X означає NR4, де R4 означає Н або (С1С6)алкіл, a R1O означає 6-ОСН3, то Y не означає CO; 3) коли X означає О, R1O означає 6-ОН або 6ОСН3, Y означає прямий зв'язок, а А означає циклопентил, то (R2,R3) або (R3,R2) відрізняються від (Н,Сl) у позиції 4,5; 4) коли X означає О, R1O означає 6-ОН, R2 і R3 означають Н, a Y означає СН=СН, то А не є фенілом або 4-метоксифенілом; 5) коли X означає SO2, А означає феніл і R1O означає 5- або 6-ОСН3, то (R2,R3) або (R3,R2) відрізняються від (Н,ОСН3) у позиції 6- або 5-. 2. Сполука за п. 1, де R1 означає атом водню, (С1С6)алкіл, феніл(С1-С3)алкіл, (С1-С3)алкіл, заміщений насиченим гетероциклічним радикалом, або групу -SO2NR7R8. 3. Сполука за пп. 1 або 2, де R2 означає атом водню, гідроксил, (С1-С6)алкіл або атом галогену. 4. Сполука за будь-яким з пп. 1-3, де R3 означає атом водню. 5. Сполука за будь-яким з пп. 1-4, де Y означає прямий зв'язок. 6. Сполука за будь-яким з пп. 1-5, де А означає (С3-С15)циклоалкіл, необов'язково заміщений принаймні одним (С1-С6)алкілом. 7. Сполука за будь-яким з пп. 1-6, де R1O знаходиться в позиції 6- кільця. 8. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль для застосування як активного терапевтичного засобу. 9. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль для застосування як активної речовини, що модулює рецептори естрогену. 10. Фармацевтична композиція, яка містить (і) сполуку за будь-яким з пп. 1-7 або її фармацевтично прийнятну сіль та (іі) фармацевтично прийнятний наповнювач. Цей винахід стосується нестероїдних сполук, які є спорідненими до рецепторів естрогену. Зокрема, цей винахід стосується похідних індазолу, бензизоксазолу та бензизотіазолу як модуляторів підтипів рецептора естрогену та/або селективних модуляторів рецептора естрогену (SERM). Цей винахід стосується також фармацевтичних композицій, які містять вказані сполуки, і застосування вказаних сполук при лікуванні захворювань, обумовлених естрогеном. Завершення репродуктивного періоду життя людини часто може супроводжуватися симптомами, які завдають незручностей і є деструктивними, та одними з найбільш поширених є "приливи". Перименопауза, або передклімакс, є періодом, що триває впродовж декількох років, під час якого нормальний цикл овуляції змінюється припиненням менструацій. Цей період характеризується нерегулярністю менструальних циклів. Тривалість циклів починає збільшуватися, а овуляція та фертильність знижуються. Клімакс звичайно визнача ють як момент часу, після втрати активності яєчників, коли менструація повністю припиняється. Крім того, естрогени залучені до різних інших фізіологічних процесів, таких як модуляція імунної відповіді та розвиток раку (раку грудей, ендометрію, товстої кишки, передміхурової залози). Було показано, що ER бере участь у низці захворювань, таких як рак грудей та остеопороз. Достовірно встановлено, що естрогени відіграють важливу роль у розвитку та гомеостазі репродуктивної, центральної нервової, скелетної та серцево-судинної систем як у чоловіків, так і у жінок. У цей час у мозку виявлено безліч рецепторів естрогену, які залучені до різних процесів, таких як регуляція настрою і температури, сон, схильність до приступів епілепсії, механізми поширення болю та когнітивні функції (Toran-Allerand, Endocrinology, 2004, 145, 1069-1074). У цей час відомо, що рецептор естрогену (ER) є ядерним рецептором з двома відомими різними підтипами. Нещодавно був виявлений (Mosselman 5 et al., FEBS Letters, 1996, 392, 49-53) новий підтип ER , який відрізняється від відомого підтипу ER (Green, Nature, 1986, 320, 134-139). Вказані підтипи відіграють різну біологічну роль і можуть знайти вибіркове та ефективне клінічне застосування (Harris H.A., Endocrinology, 2002, 143, 11, 41724177). Ліганд-зв'язувальні ділянки підтипів ER приблизно на 50% є ідентичними (Kuiper et al., Endocrinology, 1998, 139(10), 4252-4263), вони мають подібну спорідненість зв'язування до естрадіолу (Е2) і здатні до гетеро- і гомодимеризації (Cowley, J. Biol. Chem., 1997, 272, 19858-19862) з утворенням сигнального комплексу (Kuiper et al., Endocrinology, 1997, 138(10), 863-870; Kuiper, Proc. Natl. Acad. Sci. USA, 1996, 93, 5925-5930). ER з високими рівнями експресується у низці тканин, включаючи епітелій передміхурової залози (Weihua Ζ., Proc. Natl. Acad. Sci. USA, 2001, 98, 6330-635), симпатетичні ганглії (Zoubina E.V., J. Urol., 2003, 169, 382-385), товсту кишку (Witte D., Hum. Pathol., 2001, 32, 940-944), сечовий міхур, зернисті клітини яєчника (Nilsson S., Physiol. Rev., 2001, 81, 1535-1565), кістковий мозок (Shim G.J., Proc. Natl. Acad. Sci. USA, 2003, 100, 6694-6699), строму молочної залози (Cunha G.R., J. Mammary Gland Biol. Neoplasia, 1997, 2, 393-402), легені, кишечник, ендотелій судин, спинну лінію зрощування, частини мозку (Mitra S.W., Endocrinology, 2003, 144, 2055-2067, Krel W., Proc. Natl. Acad. Sci. USA, 2001, 98, 12278-12282). ER експресується в епітелії грудей (Palmieri C, Endocr. Relat. Cancer, 2002, 9, 1-13), кістки, теки клітин (Couse J., Endocr. Rev., 1999, 20, 358-417), стромі передміхурової залози (Chu S., Mol. Cell Endocrinol., 1997, 132, 195-199), печінці, яєчках. Той факт, що виявлені сполуки, які мають специфічну активність до того чи іншого підтипу, може забезпечити вибіркове лікування естрогензалежних захворювань, таких як хвороба Альцгеймера, скарги у клімактеричний період (зокрема, "приливи", піхвова сухість, атрофія), порушення когнітивних функцій (зокрема, страх, депресія, деменція), остеопороз, естрогензалежні пухлини (рак матки, грудей, товстої кишки або передміхурової залози), доброякісна гіперплазія передміхурової залози, функції сечового міхура, розлади слуху, напад, лейкемія, гіпертензія, ожиріння, синдром подразненого кишечнику або репродуктивні аспекти, такі як контрацепція або фертильність. ER -селективні ліганди можуть виявитися терапевтично корисними засобами при лікуванні хронічних запалень кишечнику та суглобів (Harris et coll., Endocrinology, 2003, 144, 42414249). Згідно з Warembourg M. and Leroy D. (Brain Res., 2004, 26; 55-56), ER виявлений лише у спинних клітинах лінії зрощування у пацюків. Навпаки, лише імуноактивність ER виявлена у перегородці та у магноцелюлярних супраоптичних, паравентрикулярних, дугоподібних та премамілярних ядрах. Вказані спостереження доводять наявність різної нейроанатомічної картини для двох вказаних підтипів рецепторів естрогену. Локалізація ER у серотонінових клітинах доводить зв'язок між ER і серотонінергічним метаболічним шляхом. Нарешті, Суr М. et al. повідомляють (J. 90280 6 Psychiatry Neurosci., 2002, 27, 12-27) про вплив селективних модуляторів рецептора естрогену (SERM), таких як ралоксифен, на рецептор 5НТ2а. Таким чином, доцільно розробити модулятори ER як сполуки, що становлять інтерес для лікування шизофренії, нейродегенеративних захворювань, таких як хвороба Альцгеймера і хвороба Паркінсона. З тих самих причин модулятори ER повинні становити інтерес як нейрозахисні, антидепресантні або антифобічні седативні засоби. Між тим, два рецептори, які відіграють роль активованих лігандами факторів транскрипції, були виявлені в різних тканинах, і їх зв'язувальна кишеня відрізняється лише двома амінокислотами: Leu і Met в ER , Met і llе в ER . Вказані подібності можуть пояснити той факт, що регулювання підтипу альфа або бета призводить до одного й того самого фармакологічного ефекту, як це відбувається у разі передклінічної моделі феномену "приливів". У той час, як модулятор ER знижує виникнення "приливів" у передклінічній моделі у пацюків (Harris et al., Endocrinology, 2002, 143, 4172-4177), селективні модулятори рецептора естрогену, такі як похідні спіроіндену, які мають спорідненість до обох підтипів, справляють той самий ефект на "приливи" (Watanabe et al., J. Med. Chem., 2003, 46, 3961-3964). Було також показано, що рецептори естрогену здатні придушувати NFKB-опосередковану транскрипцію як ліганд-залежним, так і ліганднезалежним чином (Quaedackers et al., Endocrinology 2001, 142: 1156-1166; Bhat et al., Journal of Steroid Biochemistry & Molecular Biology 1998, 67: 233-240; Pelzer et al., Biochemical & Biophysical Research Communications 2001, 286: 1153-7). Вказані дані показують зв'язок між селективними модуляторами рецептора естрогену і NFKB, який бере участь в апоптозі та імунній/запальній відповіді. Безліч сполук описано як агоністи або антагоністи рецептора естрогену, оскільки вони, відповідно, мають подібну активність або блокують активність естрадіолу. Подібні сполуки-агоністи можуть застосовуватися як контрацептивні засоби для жінок у передклімактеричний період. Антагоністи широко застосовують як терапевтичні засоби при лікуванні раку грудей (Vogel, Anticancer Drugs, 2003, 14, 265-273), в той час як агоністи застосовують при проведенні HRT (гормонозамісної терапії) у жінок у післяклімактеричний період (Burkman, Minerva Ginecol, 2003, 55, 107-116) для лікування "приливів", піхвової атрофії. SERM є сполуками, які, залежно від тканин, мають змішану активність (McDonnell, J. Soc. Gynecol. Invest., 2000, 7, S10S15). SERM можуть бути корисними при лікуванні остеопорозу, серцево-судинних захворювань і захворювань, пов'язаних з рецептором естрогену. При зв'язуванні з лігандами рецептори естрогену набувають різних конформацій. Розшифрування тривимірних структур ER і ER проведене шляхом спільної кристалізації з різними лігандами (Pike А. С. W., ЕМВО J., 1999, 18, 4608-4618; Shiau A. K., Cell, 1998, 95, 927-937). Кожний з лігандів має вплив на конформації рецептора ER або ER 7 і призводить до прояву різної біологічної активності. Різні сполуки, представлені як естрогенні засоби, описані у US 2003/0207927 А1 і US 2003/0171412 А1. Похідні індазолу, представлені як блокатори калієвих каналів, описані у WO 2004/043354 і WO 2004/043933. Синтез різних ізоксазолів описаний в Ind. J. Chem. 1980, 19В: 571575. Проміжні бензизоксазолові сполуки, які використовують при одержанні сечогінних засобів, описані у Chem. Pharm. Bull. 1991, 39(7): 17601772. Синтез різних бензизотіазолів описаний у Tetrahedron 1988, 44(10): 2985-2992. Один аспект цього винаходу стосується похідних індазолу, бензизоксазолу та бензизотіазолу, які є спорідненими до рецепторів естрогену. Інший аспект винаходу стосується фармацевтичної композиції, яка містить вказану вище похідну індазолу, бензизоксазолу та бензизотіазолу. Ще один аспект винаходу стосується застосування похідної індазолу, бензизоксазолу та бензизотіазолу для приготування лікарського засобу для лікування або попереджання різних захворювань, опосередкованих рецепторами естрогену. Похідні індазолу, бензизоксазолу та бензизотіазолу за цим винаходом можуть бути представлені такою загальною формулою (І): де: - R1 означає атом водню або (С1-С6)алкіл, (С3С6)циклоалкіл, трифторметил, групу -N=CR5R6, SO2NR7R8, феніл, феніл(С1-С3)алкіл або (С1С3)алкіл, заміщений насиченим гетероциклічним радикалом, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси і трифторметил; R1 може також бути сіллю; - R2 і R3 кожний незалежно означає атом водню або гідроксил, атом галогену, нітро, ціано, (С1С6)алкіл, (С3-С6)циклоалкіл, (С1-С6)алкокси, трифторметил, групу -NR7R8, -CONR7R8, -COR9 або CO2R9; R2 може також бути фенілом або насиченим чи ненасиченим гетероциклом, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1С3)алкокси, трифторметил і насичений гетероциклічний радикал; - X означає О, S, SO, SO2 або NR4; - R4 означає атом водню або (С1-С6)алкіл, (С3С6)циклоалкіл, феніл, феніл(С1-С3)алкіл, (С1С3)алкіл, заміщений насиченим гетероциклічним радикалом, групу -COR7, -CO2R7 або -SO2NR7R8, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, 90280 8 (С1-С3)алкокси, трифторметил, феніл(С1-С3)алкіл або феніл(С1-С3)алкокси; Υ означає прямий зв'язок, О, S, SO, SO2, NR4, CO, -(CR10R11)n- або -R10C=CR11-; - R5, R6, R7 і R8 кожний незалежно означають атом водню або (С1-С6)алкільну або (С3С6)циклоалкільну групу; - R9 означає атом водню, (С1-С6)алкіл, феніл або насичений чи ненасичений гетероциклічний радикал, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси, трифторметил і насичений гетероциклічний радикал; - R10 і R11 кожний незалежно означають атом водню або ціано, (С1-С6)алкіл, -СО-феніл, -CO (ненасичений гетероциклічний радикал) або групу CONR7R8, де феніл не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1-С3)алкокси і трифторметил; - n дорівнює 1 або 2; А означає (С3-С15)циклоалкіл, (С3С15)циклоалкен, феніл або нафтил, де циклоалкіл або циклоалкен не заміщений або заміщений принаймні одним (С1-С6)алкілом і де феніл або нафтил не заміщений або заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену, нітро, ціано, (С1-С3)алкіл, (С1С3)алкокси і трифторметил; - коли X означає NR4, то Υ і R2 разом з індазольним циклом, що їх містить, можуть також утворювати 1Н-пірано[4,3,2-сd]індазол. Заявлені сполуки формули (І), за винятком випадків: 1) коли X означає О, S або NR4, R1 означає атом водню або (С1-С6)алкіл, (С3-С6)циклоалкіл або трифторметил, a Y означає прямий зв'язок, тоді А не є необов'язково заміщеним фенілом або необов'язково заміщеним нафтилом; 2) коли X означає NR4, де R4 є атомом водню або (С1-С6)алкілом, a R1O означає 6-ОСН3, тоді Υ не означає CO; 3) коли X означає О, R1O означає 6-ОН або 6ОСН3, Υ означає прямий зв'язок, а А означає циклопентил, тоді (R2,R3) або (R3,R2) відрізняються від (Н, СІ) у позиції 4,5; 4) коли X означає О, R1O означає 6-ОН, R2 і R3 означають атом водню, a Y означає СН=СН, тоді А не є фенілом або 4-метоксифенілом; 5) коли X означає SO2, А означає феніл і R1O означає 5- або 6-ОСН3, тоді (R2,R3) або (R3,R2) відрізняються від (Н, ОСН3) у позиції 6- або 5-. В описі та у формулі винаходу слід розуміти, що термін "(С1-С6)алкіл" означає лінійний або розгалужений вуглеводневий ланцюг, що містить від 1 до 6 атомів вуглецю. Наприклад, (С1-С6)алкільний радикал означає метильний, етильний, пропільний, ізопропільний, бутильний, ізобутильний, третбутильний, пентильний, ізопентильний або гексильний радикали. Кращими алкільними радикалами є такі радикали, які містять 1, 2 або 3 атоми вуглецю. Слід розуміти, що термін "галоген" означає атом хлору, брому, йоду або фтору. 9 Слід розуміти, що термін "(С3-С15)циклоалкіл" означає насичений, конденсований або містковий, моно-, бі- або трициклічний вуглеводень, який містить від 3 до 15 атомів вуглецю. Моноциклічним радикалом є, наприклад, циклопропільний, циклопентильний, циклогексильний, циклогептильний, циклооктильний або циклододецильний радикали. Конденсованим, містковим або спірановим біциклічним або трициклічним радикалом, наприклад, є норборнільний, борнільний, ізоборнільний, норадамантильний, адамантильний або спіро[5,5]ундеканільний радикал. Кращими циклоалкілами є циклоалкіли, які містять від 5 до 12 атомів вуглецю, при цьому найкращими є циклопентильний, циклогексильний, циклогептильний та адамантильний радикали. Прикладами (С3С6)циклоалкільного радикалу є циклопропільний, циклобутильний, циклопентильний або циклогексильний радикали. Слід розуміти, що термін "(С3-С15)циклоалкен" означає ненасичений (С3-С15)циклоалкіл, а значення цього терміна наведене вище. Слід розуміти, що термін "(С1-С6)алкокси" означає групу OR, в якій R означає (С1-С6)алкіл, значення якого вказане вище. Прикладом (С1С6)алкоксильного радикалу є метоксильний, етоксильний, пропоксильний, ізопропоксильний, бутоксильний, ізобутоксильний, трет-бутоксильний, ппентилоксильний, ізопентилоксильний радикали. Кращими алкоксильними радикалами є такі радикали, які містять 1, 2 або 3 атоми вуглецю. У визначенні R1 слід розуміти, що "сіль" означає сіль лужного металу або сіль лужноземельного металу, таку як сіль натрію, калію, магнію або кальцію, або сіль з амонієм або з органічним аміном, таким як тріетиламін, етаноламін або трис-(2гідроксіетил)амін. Слід розуміти, що термін "гетероцикл" або "гетероциклічний" означає насичений або ненасичений від 5- до 8-членний моноциклічний радикал, який містить один або два гетероатоми, вибрані з О, N або S. Приклади ненасичених гетероциклічних радикалів включають, але цим не обмежуються, фурильний, імідазолінільний, імідазолільний, піридильний, піразинільний, піразолільний, піридазинільний, піримідинільний, піролільний, хінолінільний, ізохінолінільний, тіазолільний, тієнільний, бензімідазолільний, бензоксазолільний, бензотіазолільний, індолільний та індазолільний радикали. Приклади насичених гетероциклічних радикалів включають, але цим не обмежуються, імідазолідинільний, морфолінільний, тіоморфолінільний, піперидильний, піперазинільний, піролідинільний, піразолідинільний, тетрагідрофурильний, 2оксопіперазинільний, 2-оксо-піперидильний і 2оксопіролідинільний радикали, при цьому морфолінільний і піперидильний радикали є кращими. Немає потреби зазначати, що у тому разі, коли X означає NR4, a Y і R2 разом з індазольним циклом, що їх містить, утворюють 1Н-пірано[4,3,2cd]індазол, тоді один з атомів вуглецю "піранового фрагменту" містить замісник А, значення якого вказане вище. 90280 10 Сполуки формули (І) можуть утворювати адитивні солі з кислотами. Вказані солі, особливо солі, що є фармацевтично прийнятними, охоплені цим винаходом. Приклади солей включають солі, які утворені, наприклад, з неорганічними кислотами, такими як соляна кислота, бромисто-воднева кислота, сірчана кислота, азотна кислота, фосфорна кислота, або з органічними карбоновими кислотами, такими як оцтова кислота, пропіонова кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, яблучна кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота. Цей винахід охоплює також стереоізомерні форми сполук формули (І). Кращі сполуки формули (І) включають такі сполуки, які задовольняють принаймні одній з таких умов: - R1 означає атом водню, (С1-С6)алкіл, феніл(С1-С3)алкіл, (С1-С3)алкіл, заміщений насиченим гетероциклічним радикалом, або групу -SO2NR7R8; - R2 означає атом водню, гідроксил, (С1С6)алкіл або атом галогену; - R3 означає атом водню; - Υ означає прямий зв'язок; - А означає (С3-С15)циклоалкіл, необов'язково заміщений принаймні одним (С1-С6)алкілом; - R1O перебуває в позиції 6- кільця. Найкращими сполуками є такі сполуки, в яких: - R1 означає атом водню або групу -SO2NR7R8, де R7 і R8 кожний незалежно означають атом водню або (С1-С6)алкіл; - R2 означає атом водню; - А означає (С3-С12)циклоалкіл, необов'язково заміщений від 1 до 4 (С1-С6)алкілами. Кращими також є такі сполуки: а) Сполуки, де X означає NR4 і - R1 означає атом водню або (С1-С6)алкіл, феніл(С1-С3)алкіл або групу -SO2NR7R8; - R2 і R3 кожний означають атом водню; - R4 означає атом водню або (С1-С6)алкіл, феніл, феніл(С1-С3)алкіл, (С1-С3)алкіл, заміщений насиченим гетероциклічним радикалом, групу SO2NR7R8 або -COR9, де феніл необов'язково заміщений принаймні одним замісником, вибраним з групи, яка містить гідроксил, атом галогену і феніл(С1-С3)алкокси; - Υ означає прямий зв'язок, -(CR10R11)n- або R10C=CR11-; - R7 і R8 кожний незалежно означають атом водню або (С1-С6)алкіл; - R9 означає атом водню або (С1-С6)алкіл; - R10 і R11 кожний незалежно означають атом водню, ціано або групу -CONR7R8; - n дорівнює 1 або 2; - А означає (С3-С15)циклоалкіл, необов'язково заміщений принаймні одним (С1-С6)алкілом, або феніл, необов'язково заміщений гідроксилом або (С1-С3)алкоксильною групою; - Υ і R2 разом з індазольним циклом, що їх містить, можуть також утворювати 1Н-пірано[4,3,2cd]індазол; 11 за умови, що коли R1 означає Η або (С1С6)алкіл, a Y означає прямий зв'язок, тоді А не є необов'язково заміщеним фенілом. b) Сполуки, де X означає О і - R1 означає атом водню або (С1-С6)алкіл, феніл(С1-С3)алкіл, (С1-С3)алкіл, заміщений насиченим гетероциклічним радикалом, або групу -SO2NR7R8; - R2 означає атом водню, атом галогену, гідроксил або (С1-С6)алкокси; - R3 означає атом водню; - Υ означає прямий зв'язок, -(CR10R11)n- або R10C=CR11-; - R7 і R8 кожний незалежно означають атом водню або (С1-С6)алкіл; - R10 і R11 кожний незалежно означають атом водню або ціано; - n дорівнює 1 або 2; - А означає (С3-С15)циклоалкіл, необов'язково заміщений принаймні одним (С1-С6)алкілом, або феніл, необов'язково заміщений принаймні одним замісником, вибраним з (С1-С3)алкокси, гідроксилу, (С1-С3)алкілу та атому галогену; за умови, що b1) коли R1 означає Η або (С1-С6)алкіл, a Y означає прямий зв'язок, тоді А не є необов'язково заміщеним фенілом; b2) коли R1O означає 6-ОН або 6-ОСН3, Υ означає прямий зв'язок, а А означає циклопентил, тоді (R2,R3) відрізняються від (СІ, Н) у позиції 4,5; b3) коли X означає О, R1O означає 6-ОН, R2 і R3 означають Н, a Y означає СН=СН, тоді А не є фенілом або 4-метоксифенілом. c) Сполуки, де X означає S(O)m і - R1 означає атом водню або феніл(С1-С3)алкіл або групу -SO2NR7R8; - R2 і R3 кожний означає атом водню, гідроксил або атом галогену; - Υ означає прямий зв'язок, -(CR10R11)n- або R10C=CR11-; - R7 і R8 кожний незалежно означають атом водню або (С1-С6)алкіл; - R10 і R11 кожний незалежно означають атом водню або ціано; - А означає (С3-С15)циклоалкіл, необов'язково заміщений принаймні одним (С1-С6)алкілом; - m дорівнює 0, 1 або 2. Оскільки вони здатні діяти як агоністи або антагоністи для рецепторів естрогену (іншими словами як SERM), тоді сполуки за цим винаходом можуть застосовуватися індивідуально або у комбінації з іншими активними інгредієнтами для лікування або попереджання будь-якого обумовленого естрогеном захворювання або для керування регульованими естрогеном функціями у людини (Njar V.C. and Brodie A.M., Drugs, 1999, 58: 233-255), а також у диких і хатніх тварин. Оскільки молочні залози є чутливими мішенями для стимульованої естрогеном проліферації та/або диференціації, тоді SERM є найбільш придатними для лікування або попереджання захворювань, перебіг яких має легку форму, молочної залози у жінок, гінекомастії у чоловіків або доброякісних чи злоякісних пухлин грудей з метастазами і без метастаз як у чоловіків, так і у жінок (А. М. Brodie and V. С. Njar, Steroids, 2000, 65: 171-179; 90280 12 K.I.Pritchard, Cancer, 2000, 85, suppl. 12: 30653072) або у самців і самок хатніх тварин. Завдяки залученню естрогенів до механізмів овуляції, імплантації та вагітності, SERM за цим винаходом можуть бути застосовані, відповідно, у контрацептивних, протизаплідних або абортивних цілях у жінок (А. М. Brodie and V. С. Njar, Drugs, 1999, 58: 233-255), а також у самок диких і хатніх тварин. Матка є ще одним репродуктивним органом, чутливим до естрогенної активації. Тому SERM є придатними для лікування або попереджання ендометріозу, захворювань матки, перебіг яких має легку форму, або доброякісних чи злоякісних пухлин матки з метастазами і без метастаз у жінок (А. М. Brodie and V. С. Njar, Drugs, 1999, 58: 233-255) або у самок хатніх тварин. Оскільки яєчник є фізіологічним джерелом естрогену, то SERM можуть застосовуватись для лікування аномального або завчасного продукування естрогену в яєчнику, такого як синдром полікистозу яєчників, або передчасного статевого дозрівання відповідно (Bulun et al., J. Steroid. Biochem. Mol. Biol., 1997, 61: 133-139). Сприятливий вплив на ті, що відносяться, і ті, що не відносяться до яєчників, але які продукують естроген доброякісні або злоякісні пухлини з метастазами і без метастаз (Sasano Η. and Harada N., Endocrine Reviews, 1998, 19: 593-607) може мати також лікування із застосуванням SERM за цим винаходом. У чоловіків до дії естрогенного стимулювання чутливим є також тканини передміхурової залози та яєчок (Abney Т.О., Steroids, 1999, 64: 610-617; Carreau S. et al., Int. J. Androl., 1999, 22: 133-138). Тому SERM можуть бути застосовані для лікування або попереджання доброякісних (Sciarra F. and Toscano V., Archiv Androl., 2000, 44: 213-220) і злоякісних пухлин передміхурової залози з метастазами і без метастаз (Auclerc G. et al., Oncologist, 2000, 5: 36-44) або для лікування, попереджання чи контролювання функцій або порушення функцій сперматогенезу у чоловіків, а також у чоловічих особнів диких або хатніх тварин. Відомо також, що естрогени залучені до регуляції обороту кісткової тканини; тому SERM можуть бути придатними як індивідуально, так і у поєднанні з іншими антирезорбтивними і проостеогенними засобами, при лікуванні або попереджанні захворювань кісток із використанням відповідних послідовностей і режимів введення терапевтичних засобів. Крім того, естрогени залучені до регулювання балансу між домінуючими Th1 і Th2 функціями імунної системи, а тому можуть бути придатними при лікуванні або попереджанні залежних від статі аутоімунних захворювань, таких як вовчак, розсіяний склероз, ревматоїдний артрит. Таким чином, інший аспект цього винаходу стосується способу лікування або попереджання вищевказаних захворювань і розладів, в якому пацієнту або тварині, що потребує подібного лікування або попереджання, вводять терапевтично ефективну кількість сполуки формули (І) або терапевтично ефективну кількість її солі. Цей винахід охоплює також спільне введення сполук за вина 13 ходом разом з однією або декількома речовинами, які є активними при лікуванні або попереджанні вказаних захворювань або розладів. Зокрема, сполуки за цим винаходом можуть бути застосовані при таких показаннях: - лікування когнітивних розладів, наприклад, як нейрозахисних, антидепресантних або антифобічних седативних засобів; - лікування шизофренії та нейродегенеративних захворювань, таких як хвороба Альцгеймера і хвороба Паркінсона; - попереджання або лікування естроген залежних захворювань, наприклад, "приливів", остеопорозу, настрою в період перименопаузи, перименструальних синдромів, вазомоторних синдромів, піхвової атрофії або сухості, сексуальних розладів, таких як зниження статевого потягу, нетримання сечі, сверблячки, місцевих інфекцій статевих шляхів. У цьому разі вказані сполуки можуть поєднуватися з сексуально-ендокринним терапевтичним засобом; - контролювання або регулювання репродуктивних функцій, таких як фертильність чоловіків і жінок, вагітність, переривання вагітності, контрацепція, пологи або регульовані естрогеном захворювання шкіри. У цьому разі вказані сполуки можуть бути поєднані з агоністом або антагоністом LH-RH, естропрогестативним контрацептивом, прогестином, антипрогестином або простагландином; - попереджання або лікування доброякісних або злоякісних захворювань молочної залози, матки або яєчника або синдрому полікистозу яєчників. У цьому разі вказані сполуки можна поєднувати з антиестрогеном, прогестином або агоністом чи антагоністом LH-RH; - попереджання або лікування доброякісних або злоякісних захворювань передміхурової залози або яєчок. У цьому разі вказані сполуки можна поєднувати з антиандрогеном, прогестином, інгібітором ліази або агоністом LH-RH. У разі потреби сполуки за цим винаходом можна також поєднувати з радіотерапевтичним засобом; хіміотерапевтичним засобом, таким як аналог азотистого іприту, наприклад, таким як циклофосфамід, мелфалан, іфосфамід або трофосфамід; з етиленіміном, таким як тіотепа; з нітрозосечовиною, такою як кармустин; з агентом, підданим лізису, таким як темозоломід або дакарбазин; з антиметаболітом фолієвої кислоти, таким як метотрексат або ралтитрексед; з аналогом пурину, таким як тіогуанін, кладрибін або флударабін; з аналогом піримідину, таким як фторурацил, тегафур або гемцитабін; з алкалоїдом винка або його аналогом, таким як вінбластин, вінкристин або вінорелбін; з похідною подофілотоксину, таким як етопозид, таксани, доцетаксель або паклітаксель; з антрацикліном або його аналогом, таким як доксорубіцин, епірубіцин, ідарубіцин або мітоксантрон; з цитотоксичним антибіотиком, таким як блеоміцин або мітоміцин; з похідною сполукою платини, такою як цисплатин, карбоплатин або оксаліплатин; з моноклональним антитілом, таким як ритуксимаб; з антинеопластичним засобом, таким як пентостатин, мілтефосин, естрамустин, топотекан, інотекан або бікалутамід; 90280 14 або з інгібітором простагландину (інгібітором СОХ2/СОХ1); - попереджання або лікування синдрому подразненого кишечнику, хвороби Крона, виразкового проктиту, коліту або артриту; - попереджання або лікування серцевосудинних захворювань, атеросклерозу, гіпертензії, рестенозу (зокрема, для зниження рівня холестерину, тригліцеридів, Lp(a) або LDL або для модулювання рівня HDL). У цьому описі термін "поєднаний" або "комбінація" стосується будь-якого режиму спільного введення сполуки формули (І) та одного або декількох інших фармацевтичних сполук, незалежно від типу і часу введення і варіацій у дозуванні впродовж часу для будь-якого з цих сполук. Спільне введення можна, наприклад, здійснювати паралельно, послідовно або впродовж тривалого періоду часу. Сполуки формули (І) або їх фармацевтично прийнятні солі можуть бути введені, наприклад, перорально, місцево, парентерально у вигляді разових лікарських форм, що містять звичайні нетоксичні фармацевтичні прийнятні носії, допоміжні лікарські засоби та/або носії. Вказані лікарські форми наведені у прикладах, однак для введення сполук формули (І) спеціалісти можуть розробити інші лікарські форми. Термін парентеральний у цьому описі включає підшкірні ін'єкції, методи внутрішньовенних, внутрішньом'язових або внутрішньогрудинних ін'єкцій або вливань. Окрім лікування теплокровних тварин, таких як миші, пацюки, коні, вівці, собаки, кішки тощо, сполуки за цим винаходом є ефективними для лікування людей. Фармацевтичні композиції, що містять активний інгредієнт, можуть бути у формі, зручній для перорального застосування, наприклад, у вигляді таблеток, пастилок, коржів, суспензій на водній або масляній основі, диспергованих порошків або гранул, емульсій, твердих або м'яких капсул, або сиропів, або еліксирів. Сполуки, призначені для перорального застосування, можуть бути одержані будь-якими відомими з рівня техніки способами, які використовують для приготування фармацевтичних композицій, і композиції можуть містити один або декілька засобів, вибраних з групи, яка містить підсолоджувачі, ароматизатори, барвники і консерванти з тим, щоб одержати фармацевтично витончені та приємні на смак препарати. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними наповнювачами, які є придатними для приготування таблеток. Вказані наповнювачі можуть бути, наприклад, інертними розріджувачами, такими як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулювальними засобами та розпушувачами, наприклад кукурудзяним крохмалем або альгіновойю кислотою; зв'язуючими, наприклад крохмалем, желатином або каміддю, та лубрикантами, наприклад стеаратом магнію, стеариновою кислотою або тальком. Таблетки можуть бути без оболонок або на таблетки відомими способами можуть бути нанесені покриття з метою відкладення їх руйнування або адсорбування у шлунково-кишковому тракті і тим самим забезпе 15 чити пролонговану дію на більш тривалий період. Наприклад, може бути використана речовина пролонгованої дії, така як моностеарат гліцерину або дистеарат гліцерину. На таблетки можна також нанести покриття за допомогою способів, наведених у патентах США №№4256108, 4166452 і 4265874, та одержати осмотичні терапевтичні таблетки, які забезпечують контрольоване вивільнення. Сполуки для перорального введення можуть бути також приготовані у вигляді желатинових капсул, в яких активний інгредієнт змішаний з твердим інертним розріджувачем, наприклад карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, в яких активний інгредієнт змішаний з водним або олійним середовищем, наприклад з арахісовою олією, рідким парафіном або оливковою олією. Водні суспензії містять активний інгредієнт у суміші з наповнювачами, які є придатними для приготування водних суспензій. Подібними наповнювачами є суспендувальні засоби, наприклад натрієва похідна карбоксиметилцелюлози, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівінілпіролідон, смола трагаканту і камедь; диспергувальні та змочувальні засоби, такі як природні фосфатиди, наприклад лецитин, або продукти конденсації алкіленоксиду з жирними кислотами, наприклад поліоксіетиленстеарат, або продукти конденсації оксиду етилену з довго ланцюговими аліфатичними спиртами, наприклад гептадекаетиленоксицетанол, або продукти конденсації оксиду етилену з неповними складними ефірами, утвореними жирними кислотами і гекситом, такі як моноолеат поліоксіетиленсорбіту, або продукти конденсації оксиду етилену з неповними складними ефірами, утвореними жирними кислотами та ангідридами гекситу, такі як, наприклад, моноолеат поліетиленсорбітану. Водні суспензії можуть також містити один або декілька консервантів, наприклад етил, або н-пропіл, пгідроксибензоат, один або декілька барвників, один або декілька ароматизаторів і один або декілька підсолоджувачів, таких як цукроза, сахарин або аспартам. Суспензії на олійній основі можуть бути приготовані шляхом диспергування активного інгредієнту в рослинній олії, наприклад арахісовій олії, оливковій олії, кунжутній олії або кокосовій олії, або в мінеральній олії, такій як рідкий парафін. Суспензії на олійній основі можуть містити загущувач, наприклад бджолиний віск, твердий парафін або цетиловий спирт. Можуть бути додані підсолоджував, такі як вказані вище підсолоджувані, та ароматизатори з тим, щоб надати препаратам приємного смаку. До вказаних композицій можна додати консервант у вигляді антіоксиданту, такого як аскорбінова кислота. Порошки і гранули, які є здатними до диспергування, придатні для приготування водних суспензій шляхом додавання води, являють собою активний інгредієнт у суміші з диспергувальним 90280 16 або змочувальним засобом, суспендувальним засобом і одним або декількома консервантами. Як приклади підходящих диспергувальних або змочувальних засобів та суспендувальних засобів можна навести ті, що вказані вище. Можуть бути присутніми додаткові наповнювачі, наприклад підсопідсолоджувачі, ароматизатори та барвники. мацевтичні композиції за цим винаходом можуть також бути у формі емульсії типу олія у воді. на фаза може бути рослинною олією, наприклад оливковою олією або арахісовою олією, або ральною олією, наприклад рідким парафіном, або сумішшю вказаних речовин. Підходящі емульри включають природні фосфатиди, наприклад соєва олія, лецитин і складні ефіри або неповні складні ефіри, одержані з жирних кислот та ридів гекситу, наприклад моноолеат сорбітану, і продукти конденсації вказаних неповних складних ефірів з оксидом етилену, наприклад моноолеат поліоксіетиленсорбітану. Емульсії можуть також містити підсоложувачі та ароматизатори. Фармацевтичні композиції можуть бути у формі стерильних суспензій для ін'єкцій на водній або олійній основі. Вказані суспензії можуть бути складені відповідно до відомих із галузі техніки способів із використанням диспергувальних або змочувальних засобів та суспендувальних засобів, які вже були вказані вище. Придатні для ін'єкцій стерильні препарати можуть являти собою стерильні розчини або суспензії для ін'єкцій, приготовані у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, можуть бути розчином у 1,3-бутандіолі. Придатні до використання прийнятні носії та розчинники включають воду, розчин Рингера та ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендувальне середовище звичайно застосовують стерильні нелетучі олії. З цією метою можуть бути використані будь-які м'які нелетучі олії, включаючи синтетичні моно- або дигліцериди. Крім того, для приготування сполук для ін'єкцій знаходять застосування жирні кислоти, такі як олеїнова кислота. При лікуванні або попереджанні вищевказаних хвороб або розладів рівні дозування складають у діапазоні від приблизно 0,001мг до приблизно 10мг/кг маси тіла на день або, альтернативно, у діапазоні від приблизно 0,1мг до приблизно 100мг на одного пацієнта на день. Кількість активного інгредієнта, яку можна поєднувати з речовинами-носіями для одержання одиничної дозованої форми, варіює залежно від пацієнта і від конкретного шляху введення. Слід, однак, розуміти, що конкретні рівні дозування для будь-якого конкретного пацієнта залежатимуть від різних факторів, включаючи вік, масу тіла, загальний стан здоров'я, стать, дієту, час введення, шлях введення, швидкість виведення з організму, комбінації ліків і тяжкість конкретного захворювання, терапію якого проводять. Похідні індазолу формули (І) можуть бути одержані згідно із загальними схемами Іа, Іb, Іс. 17 Відповідно до схеми Іа похідна фторанізолу (1) взаємодіє з підходящим хлорангідридом кислоти (2) по реакції Фриделя-Крафтса згідно з методикою, приведеною K. L. Kees (J. Med. Chem., 29, 11, 1986, 2329-2334) з утворенням кетону (5). Кетон (5) можна також одержати конденсацією алкілмагнію (4) з похідною фторбензонітрилу (3) відповідно до Н. Shaffer (J. Am. Chem. Soc, 1939, 61, 2175). Потім кетон (5) кип'ятять зі зворотним холодильником в EtOH у присутності заміщеного гідразину або гідразин-гідрата з утворенням відповідного індазольного циклу (6) або (7). Сполука (7) може бути одержана також селективним N-алкілуванням індазолу (6) в умовах, описаних U. Lerch and J. Konig (Synthesis, 1983, 2, 157-8), або в умовах, описаних J. Chung and all (Tetrahedron Letters, 1992, 33, 4717-20). Деметилуванням сполук (6) і (7) (якщо R1 означає метил) або за допомогою трибромборану в умовах, наведених J. F. W. McOmie (Tetrahedron, 1968, 24, 2289-92), або за допомогою HBr/АсОН чи 90280 18 гідрохлориду піридинію або дебензилуванням сполук (6) і (7) (якщо R1 означає бензил) за допомогою Pd/C у присутності або у відсутності РtO2 в умовах, наведених W. Н. Hartung (Org. React., VII, 1953, 263) одержують, відповідно, похідні гідроксііндазолу (8) і (12). Індазол (6) можна безпосередньо N-сульфамоїлувати з утворенням сполуки (10) шляхом обробки гідридом натрію і сульфамоїлхлоридом, як описано P. Nussbaumer (J. Med. Chem., 2002, 45, 4310-20), або за реакцією з сульфамоїлхлоридом у диметилацетаміді (DMAc), як описано О. Makoto (Tetrahedron Letters, 2000, 41, 7047-51), а потім захисну групу видаляють і одержують похідну сульфамату (11). Індазол (8), який вивільнений від захисної групи, можна потім перетворити на дисульфамоїловану похідну (9). Таким самим чином індазол (12) можна ввести у реакцію із сульфамоїлхлоридом і одержати Осульфаматну похідну (13), в якій видаляють захисну групу і одержують сполуку (14). 19 Відповідно до схеми Іb 3-метилзаміщену похідну індазолу (15), яку одержують згідно з умовами, наведеними F. Dennler (Tetrahedron, 22, 1966, 3131), вводять у взаємодію з ВОС2О, TEA і DMAP (Т. Ishizuki, Tetrahedron Lett., 28, 1987, 4185) та одержують сполуку (16). Сполуку (16) бромують за реакцією Воля-Циглера у присутності NBS і пероксиду бензоїлу згідно з B.R.Henke (J. Med. Chem., 1997, 40, 17, 2706-2725) і одержують сполуку (17). Сполуку (18) одержують за реакцією сполуки (17) з KCN в умовах, описаних Ainsworth (J. Am. Chem. Soc, 1957, 79, 5242-5243). Потім сполука (18) взаємодіє з альдегідом (19) у NaH/ДМФА або KОН/EtOH з одержанням сполуки (20) згідно з методикою, описаною M.J.Meyers (J. Med. Chem., 44, 90280 20 24, 2001, 4230) (у процесі цієї реакції проводять видалення захисної групи ВОС). Потім сполука (20) взаємодіє з NaBH4 в EtOH з утворенням сполуки (21). Деметилуванням сполук (21) (якщо R1 означає метил) або за допомогою трибромборану в умовах, наведених J.F.W.McOmie (Tetrahedron, 1968, 24, 2289-92), або за допомогою HBr/АсОН чи гідрохлориду піридинію або дебензилуванням сполуки (21) (якщо R1 означає бензил) за допомогою Pd/C у присутності або у відсутності PtO2 в умовах, наведених W.H.Hartung (Org. React., VII, 1953, 263), одержують похідну нітрилу (22). Деметилування за допомогою HBr/АсОН дає похідну аміду (23). 21 90280 22 Відповідно до схеми Іс сполуку (24), одержану в умовах, які описані M.Kitagawa (Chem. Pharm. Bull., 39, 10, 1991, 2681), вводять у реакцію з гідразин-гідратом або алкіл- чи арилгідразином при кип'ятінні зі зворотним холодильником з утворенням сполуки (25). Сполуку (25) деметилують у присутності BBr3 у СН2СІ2 в умовах, наведених J.F.W.McOmie (Tetrahedron, 1968, 24, 2289-92), і одержують сполуки (26) і (27). Похідні бензизоксазолу формули (І) можуть бути одержані відповідно до загальних схем IIа, lIb, IIe. Відповідно до схеми IIа вже описаний кетон (5) або кетон (29), який одержують за реакцією Фриделя-Крафтса і який наведений у K.L.Kees (J. Med. Chem., 29, 11, 1986, 2329-2334), кип'ятять зі зворотним холодильником з гідрохлоридом гідроксиламіну в умовах, описаних Y.Yamanaka (Pestic. Sci., 1998, 54, 3, 223-229) і одержують відповідний оксим (28) або (30) без закриття циклу. Сполуку (28) потім циклізують при кип'ятінні зі зворотним холодильником у розчині NaOH/EtOH, а сполуку (30) циклізують за допомогою внутрішньомолекулярної реакції Міцунобу (Synthesis, 1981, 1) та одержують відповідний бензизоксазол (31). Деметилуванням сполук (31) (якщо R1 означає метил) або за допомогою трибромборану в умовах, наведених J. F. W. McOmie (Tetrahedron, 1968, 24, 2289-92), або за допомогою HBr/АсОН чи гідрохлориду піридинію або дебензилуванням сполуки (31) (якщо R1 означає бензил) за допомогою Pd/C в умовах, описаних A.M.Felix (J. Org. Chem., 43, 1978, 4194), одержують гідроксипохідну бензизоксазолу (32). Вказану сполуку (32) можна перетворити на відповідний сульфамат (33) шляхом обробки гідридом натрію та сульфамоїлхлоридом (P.Nussbaumer, J. Med. Chem., 2002, 45, 4310-20) або за реакцією з сульфамоїлхлоридом у диметилацетаміді (DMAc) (O.Makoto, Tetrahedron Letters, 2000, 41, 7047-51). Сполуку (32) можна також перетворити на простий ефір (34) за реакцією з 1-(2хлор-етил)піперидином в умовах, описаних M.R.Tremblay (Bioorg. Med. Chem., 1999, 7, 6, 10131024). 23 90280 24 Відповідно до схеми lIb бензизоксазол (35), одержаний в умовах, які описані H.Uno (Chem. Pharm. Bull., 24, 1976, 632), вводять у реакцію з альдегідом (19) у NaH/ДМФА або KOH/EtOH і одержують сполуку (36). Потім сполука (36) взаємодіє з NaBH4 в EtOH з утворенням сполуки (37). Деметилуванням сполук (37) або за допомогою трибромборану в умовах, наведених J.F.W.McOmie (Tetrahedron, 1968, 24, 2289-92), або за допомогою НBr/АсОН чи гідрохлориду піридинію одержують гідроксипохідну бензизоксазолу (38). Відповідно до схеми IIе бензизоксазол (39), одержаний в умовах, які описані M.A.EIkasaby (Indian J. Chem. Sect. В, 1980, 19, 571), захищають із використанням трет-бутилдиметилсилілхлориду в імідазолі/ДМФА (P.M.Kendall, J. Org. Chem., 44, 1979, 1421) і одержану сполуку (40) бромують у присутності NBS і пероксиду бензоїлу, одержуючи сполуку (41). Сполуку (41) вводять у взаємодію з LDA і заміщеною похідною фенілацетонітрилу та одержують сполуку (42) за методикою, наведеною E.Teodori (Bioorg. Med. Chem., 7, 9, 1999, 18731880). Після видалення гідроксильної групи у присутності n-Bu4F в умовах, описаних E.J.Corey (J. Am. Chem. Soc, 94, 1972, 6190), одержують сполуку (43). Похідні бензизотіазолу формули (І) можуть бути одержані відповідно до загальної схеми III. 25 Відповідно до схеми III кетон (5) входить у взаємодію з фенілметантіолом з утворенням сполуки (44). Одержану сполуку (44) кип'ятять зі зворотним холодильником у сульфурилхлориді з подальшою обробкою аміаком та одержують бензизотіазол з закриттям циклу (45) згідно з методикою, наведеною D.M.Fink (Tetrahedron Letters, 1993, 34, 41, 6525-6528). Деметилуванням сполук (45) або за допомогою трибромборану в умовах, наведених J.F.W. McOmie (Tetrahedron, 1968, 24, 2289-92), або за допомогою HBr/АсОН чи гідрохлориду піридинію одержують гідроксипохідні бензизотіазолу (46). Вказані сполуки (46) можна перетворити на відповідні сульфамати (47) шляхом обробки гідридом натрію і сульфамоїлхлоридом (P.Nussbaumer, J. Med. Chem., 2002, 45, 4310-20) або за реакцією з сульфамоїлхлоридом у диметилацетаміді (DMAc) (O.Makoto, Tetrahedron Letters, 2000, 41, 7047-51). Окислення вказаних сполук (46) і (47) пероксидом водню в трифтороцтовій кислоті згідно з умовами, наведеними S.Grivas and E.Ronne (Acta Chemica Scandinavia, 1995, 49, 225-229), дає, відповідно, моно- та/або діокислені бензизотіазоли (49) і (48). Сполуку (49) можна піддати сульфамоїлуванню та одержати сполуку (48). Загальні схеми І, II і III пояснюють синтез сполук (І), в яких замісник R1O знаходиться у положенні 6-гетероциклу. Між тим, слід розуміти, що сполуки (І), в яких замісник R1O знаходиться у положенні 4-, 5- або 7-гетероциклу, також можуть бути одержані за наведеними вище методиками. Подальші приклади наведені для ілюстрування, і вони не обмежують цього винаходу. Одержання ацетофенонів (5) Приклад 1 4-Бензилокси-2-фторбензонітрил До суміші 2-фтор-4-гідроксибензонітрилу (98г, 0,68моль) і K2СО3 (94г, 0,68моль) в ацетонітрилі додають бензилхлорид (86,6г, 0,68моль). Суміш залишають перемішуватися на ніч при кімнатній температурі, і за перебігом реакції слідкують за 90280 26 допомогою тонкошарової хроматографії (ТСХ) (толуол/AcOEt 8/2). Суміш відфільтровують, концентрують у вакуумі і кристалізують з пентану, одержуючи 147г твердої речовини (95%). 1 Н-ЯМР (ДМСО-d6): 5,25 (с, 2Н), 7,05 (дд, 1Н), 7,25 (дд, 1Н), 7,30-7,60 (м, 5Н), 7,75 (т, 1Н). За тією самою методикою, але замінивши 2фтор-4-гідроксибензонітрил на циклогептил(2фтор-4-гідроксифеніл)метанон 1-адамантил(2фтор-4-гідроксифеніл)метанон одержують, відповідно, такі сполуки: Приклад 2 Циклогептил(4-бензилокси 2-фторфеніл)метанон (71%) 1 Н-ЯМР (CDCI3): 1,10-2,00 (м, 12Н), 3,50 (м, 1Н), 5,17 (с, 2Н), 6,85 (дт, 1Н), 7,20 (дд,1Н), 7,307,60 (м, 6Н). Приклад 3 1-Адамантил(4-бензилокси 2-фторфеніл)метанон (38%) 1 Н-ЯМР (ДМСО-d6): 1,30-2,30 (м, 15Н), 5,20 (с, 2Н), 6,85 (дт, 1Н), 7,12 (дд, 1Н), 7,20-7,60 (м, 6Н). Приклад 4 Циклопентил(4-бензилокси 2-фторфеніл)метанон Суспензію магнію (19г, 0,79моль) і йоду (каталітичну кількість) у ТГФ (20мл) кип'ятять зі зворотним холодильником в атмосфері азоту. Повільно додають розчин циклопентилброміду (110г, 0,738моль) у ТГФ (400мл). Суміш кип'ятять зі зворотним холодильником до тих пір, поки весь магній не буде витрачений, потім охолоджують до 30°С в додають розчин 4-бензилокси-2фторбензонітрилу (129г, 0,56моль) у ТГФ (600мл). Реакційну суміш залишають перемішуватися на ніч при температурі 50°С, а потім переривають реакцію додаванням водного розчину NH4CI і льоду, екстрагують етилацетатом і промивають насиченим розчином солі. Суміш сушать над Na2SO4, відфільтровують і концентрують у вакуумі. Очищення методом флеш-хроматографії (геп 27 тан/EtOAc 9/1) дає 60г продукту (35% у вигляді твердої речовини). 1 Н-ЯМР (ДМСО-d6): 1,40-2,00 (м, 8Н), 3,58 (м, 1Н), 5,20 (с, 2Н), 6,85-7,20 (м, 2Н), 7,25-7,55 (м, 5Н), 7,80 (т, 1Н). Використовуючи ту саму методику, але замінивши циклопентилбромід на циклогексилхлорид, одержують таку сполуку: Приклад 5 Циклогексил(4-бензилокси 2-фторфеніл)метанон (35%). т.пл. 78°С 1 Н-ЯМР (ДМСО-d6): 1,00-2,00 (м, 10Н), 3,05 (м, 1Н), 5,20 (с, 2Н), 6,90-7,10 (м, 2Н), 7,20-7,60 (м, 5Н), 7,75 (т, 1Н). Приклад 6 1-Адамантил(2-фтор-4-гідроксифеніл)метанон До суміші АІСІ3 (45г, 0,337моль) в 1,2дихлоретані (DCE, 250мл) при 0°С додають 1адамантилкарбонілхлорид (36,6г, 0,228моль) у DCE (150мл). При температурі 0°С повільно додають 3-фторфенол (21г, 0,183моль) у DCE (100мл). За перебігом реакції слідкують за допомогою ТСХ (гептан/толуол 50/50). Суміш виливають у 2н розчин НСІ, екстрагують за допомогою AcOEt, промивають розчином NaHCO3 і насиченим розчином солі, сушать над Na2SO4, відфільтровують і концентрують у вакуумі. Очищення методом флешхроматографії (гептан/толуол 8/2) дає 27г 1адамантил(2-фтор-4-гідроксифеніл)метанону (48% у вигляді твердої речовини). 1 Н-ЯМР (ДМСО-d6): 1,30 (м, 15Н), 5,97 (с, 1Н), 6,70 (д, 1Н), 6,94 (дд, 1Н), 7,64 (д, 1Н). За тією самою методикою, замінивши 1адамантилкарбонілхлорид на циклогептанкарбонілхлорид, одержують таку сполуку: Приклад 7 циклогептил(2-фтор-4-гідроксифеніл)метанон (60%) 1 Н-ЯМР (CDCI3): 1,20-2,00 (м, 12Н), 3,58 (м, 1Н), 6,70-6,90 (м, 2Н), 7,90-8,10 (м, 1Н), 12,45 (с,1Н). За тією самою методикою, замінивши 1адамантилкарбонілхлорид на циклогептанкарбонілхлорид і замінивши 3-фторфенол на 3фторанізол, одержують таку сполуку: Приклад 8 Циклогептил(4-метокси-2-фторфеніл)метанон (45%) 1 Н-ЯМР (CDCI3): 1,40-2,00 (м, 12Н), 1,9 (3, 2Н), 3,25 (м, 1Н), 3,80 (с, 3H), 6,50 (дд, 1Н), 6,65 (дд, 1Н), 7,75 (т, 1Н). Використовуючи ту саму методику, але замінивши 3-фторфенол на: 3-фторанізол 3,5-диметоксихлорбензол одержують, відповідно, такі сполуки: Приклад 9 1-Адамантил(4-метокси-2-фторфеніл)метанон (15%) 1 Н-ЯМР (CDCI3): 1,50-2,30 (м, 15Н), 3,85 (с, 3H), 6,60 (2д, 1Н), 6,70 (2д, 1Н), 7,70 (т, 1Н). Приклад 10 1-Адамантил(2-хлор-4,6диметоксифеніл)метанон (22%) 90280 28 1 Н-ЯМР (CDCI3-d1): 1,60-2,10 (м, 15Н), 3,75 (с, 3H), 3,80 (с, 3H), 6,35 (с, 1Н), 6,50 (с, 1Н). За тією самою методикою, замінивши 3фторфенол на 3,4-диметоксифторбензол і замінивши 1-адамантилкарбонілхлорид на циклогексанкарбонілхлорид, одержують таку сполуку: Приклад 11 Циклогексил(2-фтор-4-гідрокси-5метоксифеніл)метанон 1 Н-ЯМР (ДМСО-d6): 1,00-2,00 (м, 10Н), 3,05 (м, 1Н), 3,80 (с, 3H), 6,65 (д, 1Н), 7,23 (д, 1Н), 10,50 (с, 1Н). Одержання індазолів (6), (7), (8) i (12) Приклад 12 6-Бензилокси-3-циклопентил-1Н-індазол Суміш циклопентил(4-бензилокси-2фторфеніл)метанону (40г, 0,13моль) у гідразингідраті (50мл) кип'ятять зі зворотним холодильником впродовж ночі. Після охолодження до кімнатної температури тверду речовину відфільтровують, розчиняють в EtOAc, а потім промивають водним розчином NH4CI і насиченим розчином солі. Розчин сушать над Na2SO4, відфільтровують і концентрують у вакуумі. Очищення методом флеш-хроматографії (толуол/EtOAc 9/1) дає очікуваний продукт (13г, 45% у вигляді твердої речовини). 1 Н-ЯМР (ДМСО-d6): 1,40-2,20 (м, 8Н), 3,34 (м, 1Н), 5,13 (с, 2Н), 6,75 (дд, 1Н), 6,90 (д, 1Н), 7,207,53 (м, 5Н), 7,57 (д, 1Н), 9,40 (с, 1Н). За тією самою методикою, але замінивши циклопентил(4-бензилокси-2-фторфеніл)метанон на циклогексил(4-бензилокси-2-фторфеніл)метанон циклогептил(4-бензилокси-2-фторфеніл)метанон 1-адамантил(4-метокси-2-фторфеніл)метанон циклогептил (4-метокси-2-фторфеніл)метанон одержують, відповідно, такі сполуки: Приклад 13 6-Бензилокси-3-циклогексил-1Н-індазол (58%) 1 Н-ЯМР (CDCI3): 1,10-2,10 (м, 10Н), 2,95 (м, 1Н), 5,15 (с, 2Н), 6,75 (дд, 1Н), 6,90 (д, 1Н), 7,207,55 (м, 5Н), 7,65 (д, 1Н), 12,32 (с, 1Н). Приклад 14 6-Бензилокси-3-циклогептил-1Н-індазол (85%) 1 Н-ЯМР (CDCI3): 1,20-2,10 (м, 12Н), 2,55 (м, 1Н), 5,07 (с, 2Н), 6,45 (дд, 1Н), 6,55 (д, 1Н), 6,95 (д, 1Н), 7,20-7,50 (м, 5Н). Приклад 15 3-(1-Адамантил)-6-метокси-1Н-індазол (30%) 1 Н-ЯМР (CDCI3): 1,50-2,70 (м, 15Н), 3,85 (с, 3H), 6,78 (дд, 1Н), 6,88 (д, 1Н), 7,57 (д, 1Н). Приклад 16 3-Циклогептил-6-метокси-1Н-індазол (45%) 1 Н-ЯМР (CDCI3): 1,40-2,30 (м, 12Н), 3,22 (м, 1Н), 3,83 (с, 3H), 6,35 (с, 1Н), 6,65-6,90 (м, 2Н), 7,58 (д, 1Н). За такою самою методикою, але замінивши гідразин-гідрат на 1-(4-бензилоксифеніл)гідразин (синтезують згідно з K.J.Duffy, J. Med. Chem., 2001, 44, 22, 3730-3745), одержують таку сполуку: Приклад 17 6-Бензилокси-3-циклопентил-1-(4-бензилоксифеніл)-1Н-індазол (66%) 29 1 Н-ЯМР (ДМСО-d6): 1,15-2,05 (м, 10Н), 2,95 (дт, 1Н), 3,88 (с, 3H), 5,15 (с, 2Н), 6,75 (ДД, 1Н), 7,12 (д, 1Н), 7,25-7,58 (м, 5Н), 7,65 (д, 1Н). За такою самою методикою, але замінивши циклопентил(4-бензилокси-2-фторфеніл)метанон на циклогексил(4-бензилокси-2фторфеніл)метанон і замінивши гідразин-гідрат на метилгідразин або бензилгідразин, одержують, відповідно, такі сполуки: Приклад 18 6-Бензилокси-3-циклогексил-1-метил-1Ніндазол (66%) 1 Н-ЯМР (ДМСО-d6): 1,15-2,05 (м, 10Н), 2,95 (дт, 1Н), 3,88 (с, 3H), 5,15 (с, 2Н), 6,75 (дд, 1Н), 7,12 (д, 1Н), 7,25-7,58 (м, 5Н), 7,65 (д, 1Н). Приклад 19 1-Бензил-6-бензилокси-3-циклогексил-1Ніндазол (76%) 1 Н-ЯМР (ДМСО-d6): 1,15-2,05 (м, 10Н), 2,95 (дт, 1Н), 5,10 (с, 2Н), 5,15 (с, 2Н), 6,75 (дд, 1Н), 7,12 (д, 1Н), 7,15-7,65 (м, 10Н), 7,65 (д, 1Н). Приклад 20 трет-Бутил-6-бензилокси-3-циклогексил-1Ніндазол-1-карбоксилат При температурі 0°С ди-трет-бутилдикарбонат (36,38г, 0,166моль) в ацетонітрилі (340мл) додають до суміші 6-бензилокси-3-циклогексил-1Ніндазолу (42,50г, 0,138моль), TEA (22мл, 0,152моль), ацетонітрилу (460мл) і DMAP (3,40г, 0,027моль). Суміш перемішують при кімнатній температурі впродовж ночі, потім концентрують у вакуумі, розріджують етилацетатом і промивають водою, підкисленою 2н розчином НСІ до значення рН 2. Суміш сушать над Na2SO4, відфільтровують і розріджують діізопропіловим ефіром, а потім кристалізують очікуваний продукт (44,50г, вихід 79%). 1 Н-ЯМР (ДМСО-d6): 1,15-2,05 (м, 19Н), 3,00 (м, 1Н), 5,19 (с, 2Н), 7,03 (дд, 1Н), 7,25-7,45 (м, 5Н), 7,69 (д, 1Н), 7,78 (д, 2Н). Приклад 21 6-Бензилокси-3-циклопентил-1-(2-піперидин-1ілетил)-1Н-індазол 6-Бензилокси-3-циклопентил-1Н-індазол нагрівають впродовж 1 години разом з NaOH (1,64г, 41ммоль) і 1-(2-хлоретил)піперидином в EtOH (60мл) до 40°С. За перебігом реакції слідкують за допомогою ТСХ (толуол/діоксан: 7/3) і після її завершення суміш охолоджують до кімнатної температури. Переривають реакцію, додавши NH4CI, екстрагують за допомогою AcOEt, сушать над Na2SO4, відфільтровують і концентрують у вакуумі. Очищення методом флеш-хроматографії (толуол/1,4-діоксан 7/3) дає очікуваний продукт (600мг, 8% у вигляді твердої речовини). 1 Н-ЯМР (ДМСО-d6): 1,40-2,40 (м, 14Н), 2,502,80 (м, 2Н), 3,10-3,60 (м, 5Н), 4,30 (т, 2Н), 5,15 (с, 2Н), 6,70 (дд, 1Н), 7,10 (д, 1Н), 7,40 (м, 5Н), 7,60 (д, 1Н). За такою самою методикою, але замінивши 1(2-хлоретил)піперидин на 4-бромбензилбромід, одержують таку сполуку: Приклад 22 6-Бензилокси-1-(4-бромбензил)-3-циклопентил-1Н-індазол 90280 30 1 Н-ЯМР (ДМСО-d6): 1,50-2,20 (м, 8Н), 3,38 (м, 1Н), 5,15 (с, 2Н), 5,50 (с, 2Н), 6,78 (дд, 1Н), 7,057,55 (м, 10Н), 7,60 (д, 1Н). Приклад 23 3-Циклопентил-1Н-індазол-6-ол Суміш 6-бензилокси-3-циклопентил-1Ніндазолу (13г, 0,102моль), Pd/C (5%, 0,65г) і Pt2O (каталітичну кількість) в етанолі (130мл) перемішують при кімнатній температурі в атмосфері водню. За перебігом реакції слідкують за допомогою ТСХ (гептан/EtOAc 50/50). Після завершення реакції суміш відфільтровують крізь целіт і концентрують у вакуумі. Кристалізують з суміші СН2СІ2/пентан і одержують 7,2г кристалів білого кольору (85%), т.пл. 175°С. 1 Н-ЯМР (ДМСО-d6): 1,40-2,20 (м, 8Н), 3,35 (м, 1Н), 6,55 (дд, 1Н), 6,68 (д, 1Н), 7,50 (д, 1Н), 9,45 (с, 1Н), 12,05 (с, 1Н). За такою самою методикою, але замінивши 6бензилокси-3-циклопентил-1Н-індазол на: 6-бензилокси-3-циклогексил-1Н-індазол 6-бензилокси-3-циклогексил-1-метил-1Ніндазол 6-бензилокси-3-циклопентил-1-(4бензилоксифеніл)-1Н-індазол 6-бензилокси-3-циклопентил-1-(2-піперидин-1ілетил)-1Н-індазол 6-бензилокси-1-(4-бромбензил)-3циклопентил-1Н-індазол 1-бензил-6-бензилокси-3-циклопентил-1Ніндазол трет-бутил-6-бензилокси-3-циклогексил-1Ніндазол-1-карбоксилат одержують, відповідно, такі сполуки: Приклад 24 3-Циклогексил-1Н-індазол-6-ол (85%) т.пл. 147°С 1 Н-ЯМР (ДМСО-d6): 1,10-2,10 (м, 10Н), 2,90 (м, 1Н), 6,55 (дд, 1Н), 6,65 (с, 1Н), 7,50 (д, 1Н), 9,45 (с, 1Н), 12,05 (с, 1Н). Приклад 25 3-Циклогексил-1-метил-1Н-індазол-6-ол (75%) т.пл. 205°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,00 (м, 10Н), 2,92 (дт, 1Н), 3,80 (с, 3H), 6,60 (дд, 1Н), 6,68 (д, 1Н), 7,55 (д, 1Н), 9,58 (с, 1Н). Приклад 26 3-Циклопентил-1-(4-гідроксиФенілН Н-індазол6-ол (54%) т.пл. 178°С 1 Н-ЯМР (ДМСО-d6): 1,50-2,20 (м, 8Н), 3,40 (т, 1Н), 6,68 (дд, 1Н), 6,83 (д, 1Н), 6,90 (д, 2Н), 7,38 (д, 2Н), 7,59 (д, 1Н), 9,60 (с, 1Н), 9,68 (с, 1Н). Приклад 27 3-Циклопентил-1-(2-піперидин-1-ілетил)-1Ніндазол-6-ол, гідрохлорид (90%) т.пл. 120°С 1 Н-ЯМР (ДМСО-d6): 1,15-2,30 (м, 14Н), 2,90 (м, 2Н), 3,20-3,60 (м, 5Н), 4,68 (т, 2Н), 6,70 (дд, 1Н), 6,88 (д, 1Н), 7,52 (д, 1Н), 10,80 (с, 1Н). Приклад 28 1-(4-Бромбензил)-3-циклопентил-1Н-індазол-6ол (90%) т.пл. 147°С 1 Н-ЯМР (ДМСО-d6): 1,45-2,30 (м, 8Н), 3,35 (м, 1Н), 5,40 (с, 2Н), 6,60 (д, 1Н), 7,00-7,40 (м, 4Н), 7,50 (д, 1Н), 7,70 (с, 1Н). 31 Приклад 29 1-Бензил-3-циклогексил-1Н-індазол-6-ол (40%) т.пл. 154°С 1 Н-ЯМР (CDCI3): 1,10-2,40 (м, 10Н), 3,03 (м, 1Н), 5,40 (с, 2Н), 5,70 (с, 1Н), 6,53 (д, 1Н), 6,76 (дд, 1Н), 7,00-7,35 (м, 5Н), 7,60 (д, 1Н). Приклад 30 1-трет-Бутил-3-циклогексил-6-гідрокси-1Ніндазол-1-карбоксилат (87%) т.пл. 124°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,05 (м, 19Н), 2,95 (м, 1Н), 6,80 (дд, 1Н), 7,40 (д, 1Н), 7,65 (д, 1Н). Приклад 31 3-(1-Адамантил)-1Н-індазол-6-ол, гідрохлорид Суміш 3-(1-адамантил)-6-метокси-1Н-індазолу (210мг, 0,75моль) у 40%-ному розчині НBr в оцтовій кислоті (10мл) нагрівають впродовж ночі до температури 70°С. Суміш виливають на лід і нейтралізують розчином NaHCO3, а потім екстрагують за допомогою AcOEt, сушать над Na2SO4, відфільтровують і концентрують у вакуумі. Очищення методом флеш-хроматографії (гептан/EtOAc 50/50) дає 200мг продукту. Тверду речовину кристалізують з Et2O у вигляді солі з НСІ. Кристали відфільтровують, промивають ефіром і сушать, одержуючи 160мг солі (80%), т.пл. 140°С. 1 Н-ЯМР (ДМСО-d6): 1,00-2,60 (м, 15Н), 6,65 (д, 1Н), 6,75 (с, 1Н), 7,55 (д, 1Н). Використовуючи ту саму методику, але замінивши 3-(1-адамантил)-6-метокси-1Н-індазол на 3циклогептил-6-метокси-1Н-індазол, одержують таку сполуку: Приклад 32 3-Циклогептил-1Н-індазол-6-ол, гідрохлорид (60%). т.пл. 95°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,00 (м, 12Н), 3,1 (м, 1Н), 6,62 (д, 1Н), 6,64 (с, 1Н), 7,60 (д, 1Н). Одержання 1Н-індазолсульфонамідів (9), (10), (11), (13) i (14) Приклад 33 6-Бензилокси-3-циклогептил-1Н-індазол-1сульфонамід Сульфамоїлхлорид (2,9г, 25ммоль) додають до розчину 6-бензилокси-3-циклогептил-1Ніндазолу (6) (4г, 1,75ммоль) у Ν,Νдиметилацетаміді (40мл) при температурі 0°С. Суміш перемішують при 0°С впродовж 3год. Після екстрагування за допомогою EtOAc органічний шар промивають розчином NH4CI і насиченим розчином солі. Органічний шар сушать над Na2SO4, відфільтровують і концентрують у вакуумі. Очищення методом флеш-хроматографії з подальшою кристалізацією з EtOH дає 1,2г кристалів жовтого кольору (24%). 1 Н-ЯМР (ДМСО-d6): 1,20-2,00 (м, 12Н), 2,58 (м, 1Н), 5,05 (с, 2Н), 6,65-7,00 (м, 1Н), 7,20-7,50 (м, 6Н), 7,92 (с, 1Н), 8,55 (с, 2Н). За такою самою методикою, але замінивши 6бензилокси-3-циклогептил-1Н-індазол на: 6-бензилокси-3-циклогексил-1Н-індазол 3-циклогексил-1Н-індазол-6-ол 3-циклогексил-1-метил-1Н-індазол-6-ол 1-бензил-3-циклогексил-1Н-індазол-6-ол трет-бутил-6-бензилокси-3-циклогексил-1Ніндазол-1-карбоксилат одержують, відповідно, такі сполуки: 90280 32 Приклад 34 6-Бензилокси-3-циклогексил-1Н-індазол-1сульфонамід (100%) 1 Н-ЯМР (ДМСО-d6): 1,10-2,10 (м, 10Н), 3,05 (м, 1Н), 5,15 (с, 2Н), 7,00 (дд, 1Н), 7,25-7,60 (м, 6Н), 7,80 (д, 1Н), 8,35 (с, 2Н). Приклад 35 1-(Аміносульфоніл)-3-циклогексил-1Н-індазол6-ілсульфамат (40%). т.пл. 213°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,10 (м, 10Н), 3,13 (д, 1Н), 7,25 (дд, 1Н), 7,80 (д, 1Н), 8,00 (д, 1Н), 8,10 (с, 2Н), 8,50 (с, 2Н). Приклад 36 3-Циклогексил-1-метил-1Н-індазол-6сульфонамід (84%), т.пл. 188°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,10 (м, 10Н), 3,03 (м, 1Н), 3,95 (с, 3H), 6,98 (д, 1Н), 7,45 (с, 1Н), 7,85 (д, 1Н), 8,00 (с, 2Н). Приклад 37 1-Бензил-3-циклогексил-1H-індазол-6ілсульфамат (85%). т.пл. 188°С 1 Н-ЯМР (ДМСО-d6): 1,10-2,10 (м, 10Н), 3,04 (м, 1Н), 5,55 (с, 2Н), 7,05 (д, 1Н), 7,10 (м, 5Н), 5,53 (с, 1Н), 7,88 (д, 1Н), 8,00 (с, 2Н). Приклад 38 трет-Бутил-6-[(аміносульфоніл)окси]-3циклогексил-1Н-індазол-1-карбоксилат (46%). т.пл. 128°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,10 (м, 19Н), 3,10 (м, 1Н), 7,23 (дд, 1Н), 7,90-8,05 (м, 2Н), 8,11 (с, 2Н). За тією самою методикою, що й у прикладі 21, але замінивши 6-бензилокси-3-циклопентил-1Ніндазол на: 6-бензилокси-3-циклогептил-1Н-індазол-1сульфонамід 6-бензилокси-3-циклогексил-1Н-індазол-1сульфонамід одержують, відповідно, такі сполуки: Приклад 39 3-Циклогептил-6-гідрокси-1Н-індазол-1сульфонамід, т.пл. 155°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,00 (м, 12Н), 2,60 (м, 1Н), 6,70 (м, 2Н), 6,90 (с, 2Н), 7,05 (м, 1Н), 7,80 (с, 1Н). Приклад 40 3-Циклогексил-6-гідрокси-1Н-індазол-1сульфонамід. т.пл. 162°С 1 Н-ЯМР (ДМСО-d6): 1,10-2,10 (м, 10Н), 3,00 (м, 1Н), 6,78 (дд, 1Н), 7,25 (д, 1Н), 7,68 (д, 1Н), 8,22 (с, 2Н), 10,05 (с, 1Н). Приклад 41 3-Циклогексил-1H-індазол-6-ілсульфамат Суміш трет-бутил-6-[(аміносульфоніл)окси]-3циклогексил-1Н-індазол-1-карбоксилату (4,00г, 10,12ммоль), води (10мл), діоксану (30мл) і кількох крапель концентрованого (30%) розчину НСІ перемішують впродовж ночі і виливають у воду. Осад збирають фільтруванням і одержують очікуваний продукт. Кристалізацією з толуолу одержують кристали білого кольору (1,25г, 48%). 1 Н-ЯМР (ДМСО-d6): 1,10-2,10 (м, 10Н), 3,04 (м, 1Н), 6,95 (дд, 1Н), 7,35 (д, 1Н), 7,83 (д, 1Н), 7,96 (с, 2Н). Одержання 3-бромметил-1Н-індазолів (16), (17) i (18) 33 Приклад 42 1-[(трет-Бутоксикарбоніл)окси]-6-метокси-3метил-1Н-індазол Ди-трет-бутилдикарбонат в ацетонітрилі змішують при температурі 0°С з 6-метокси-3-метил1Н-індазолом (одержують за методикою, описаною F.Dennler, Tetrahedron, 22, 1966, 3131-3139) (26,27г, 0,162моль), ацетонітрилом (200мл), тріетиламіном (25мл, 0,178моль), DMAP (3,96г, 0,0324моль). Суміш залишають перемішуватись на ніч при кімнатній температурі. Ацетонітрил концентрують у вакуумі. Суміш екстрагують етилацетатом і підкислюють до рН=2 концентрованим розчином НСІ, сушать над Na2SO4, відфільтровують і переносять у діізопропіловий ефір. Одержують 23,9г очікуваного продукту (у вигляді солі, 59%). 1 Н-ЯМР (ДМСО-d6): 1,60 (с, 9Н), 2,44 (с, 3H), 3,85 (с, 3H), 6,95 (дд, 1Н), 7,50 (д, 1Н), 7,65 (д, 1Н). Приклад 43 1-[(трет-Бутоксикарбоніл)окси]-6-метокси-3бромметил-1Н-індазол 1-[(трет-Бутоксикарбоніл)окси]-6-метокси-3метил-1Н-індазол (25,2г, 0,096моль) розчиняють у ССl4 і змішують з пероксидом бензоїлу (2,33г, 9,6ммоль). До одержаної суміші повільно додають N-бромсукцинімід (NBS, 18,8г, 0,109моль) і кип'ятять зі зворотним холодильником впродовж ночі. Суміш охолоджують до кімнатної температури, фільтрують крізь целіт, фільтрат концентрують у вакуумі та очищують методом флешхроматографії, використовуючи толуол як елюент. Одержують 10,5г очікуваного продукту (32%, у вигляді олії). 1 Н-ЯМР (ДМСО-d6): 1,65 (с, 9Н), 3,85 (с, 3H), 4,95 (с, 2Н), 7,05 (дд, 1Н), 7,55, (с, 1Н), 7,80 (д, 1Н). Приклад 44 {1-[(трет-Бутоксикарбоніл)окси]-6-метокси-1Ніндазол-3-іл}ацетонітрил KCN (5,73г, 88ммоль) у 23мл Н2О додають краплями при температурі 0°С до 1-[(третбутоксикарбоніл)окси]-6-метокси-3-бромметил-1Ніндазолу (10,5г, 30,08ммоль) у 80мл етанолу і перемішують при кімнатній температурі впродовж 1 години 30хв. Суміш виливають у воду та екстрагують етилацетатом. Органічний шар сушать над Na2SO4. Після концентрування та осадження за допомогою діізопропілового ефіру одержують очікуваний продукт (4,42г, 50% у вигляді твердої речовини). 1 Н-ЯМР (ДМСО-d6): 1,65 (с, 9Н), 3,85 (с, 3H), 4,42 (с, 2Н), 7,00 (д, 1Н), 7,50 (д, 1Н), 7,75 (д, 1Н). Одержання (1Н-індазол-3-іл)ацетонітрилів (20), (21) і (22) Приклад 45 2-(Z/Е)-2-(6-Метокси-1Н-індазол-3-іл)-3-(4метоксифеніл)проп-2-еннітрил 40%-ний розчин KОН у воді в кількості 3,5мл і 7,1мл етанолу додають краплями до п-анісового альдегіду (2,06мл, 16,9ммоль) і {1-[(третбутоксикарбоніл)окси]-6-метокси-1Н-індазол-3іл}ацетонітрилу в етанолі. Після завершення реакції суміш відфільтровують і одержують 3,53г очікуваного продукту (77% у вигляді твердої речовини). 1 Н-ЯМР (ДМСО-d6): 3,35 (с, 1Н), 3,85 (с, 3H), 3,90 (с, 3H), 6,70-7,20 (м, 4Н), 7,85-8,15 (м, 4Н). 90280 34 Використовуючи ту саму методику, але замінивши п-анісовий альдегід на циклогексанкарбоксальдегід, одержують таку сполуку: Приклад 46 2-(Z/Е)-3-[-1иклогексил-2-(6-метокси-1Ніндазол-3-іл)проп-2-еннітрил (55,4%) 1 Н-ЯМР (ДМСО-d6): 1,20-1,80 (м, 10Н), 2,602,75 (м, 1Н), 3,80 (с, 3H), 6,85 (дд, 1Н), 6,95 (д, 1Н), 7,15 (д, 1Н), 7,85 (д, 1Н), 13,20 (с, 1Н). Приклад 47 2-(6-Метокси-1Н-індазол-3-іл)-3-(4-метоксиФеніл)пропан нітрил До 2-(6-метокси-1Н-індазол-3-іл)-3-(4метоксифеніл)проп-2-еннітрилу (3,53г, 11,56ммоль), розчиненому в етанолі, порціями додають NaBH4 (0,66г, 17ммоль). Суміш перемішують при температурі 70°С впродовж ночі, а потім виливають у воду, підкислену концентрованою соляною кислотою, та екстрагують етилацетатом. Органічний шар сушать над Na2SO4, відфільтровують і концентрують. Олію осаджують з етанолу і діізопропілового ефіру та одержують очікуваний продукт (3,18г, у вигляді порошку білого кольору, 85,3%). 1 Н-ЯМР (ДМСО-d6): 3,56 (с, 3H), 3,60-3,80 (м, 2Н), 3,85 (с, 3H), 4,26 (т, 1Н), 6,90-7,30 (м, 6Н), 7,97 (д, 1Н), 11,13 (с, 1Н). Використовуючи ту саму методику, але замінивши 2-(Z/Е)-2-(6-метокси-1Н-індазол-3-іл)-3-(4метоксифеніл)проп-2-еннітрил на 2-(Z/Е)-3циклогексил-2-(6-метокси-1Н-індазол-3-іл)проп-2еннітрил, одержують таку сполуку: Приклад 48 3-циклогексил-2-(6-метокси-1Н-індазол-3іл)пропаннітрил (97,5%) 1 Н-ЯМР (ДМСО-d6): 0,85-2,45 (м, 13Н), 3,80 (с, 3H), 4,65 (т, 11-1), 6,75 (дд, 1Н), 6,90 (д, 1Н), 7,65 (д, 1Н), 12,85 (с, 1Н). Приклад 49 3-Циклогексил-2-(6-гідрокси-1Н-індазол-3іл)пропаннітрил 3-Циклогексил-2-(6-метокси-1Н-індазол-3іл)пропаннітрил (1,61г, 5,68ммоль) розчиняють у СН2СІ2 і охолоджують на бані з льодом. До одержаної суміші додають 1М розчин ВВr3/СН2СІ2 (8,6мл, 8,52ммоль), а потім перемішують суміш при температурі 50°С, після чого виливають у насичений розчин NaHCO3, екстрагують етилацетатом, сушать над Na2SO4, відфільтровують, концентрують у вакуумі та очищують методом флешхроматографії (СН2СІ2/МеOН 98/2). Після кристалізації з EtOH одержують 780мг кристалів білого кольору (51%), т.пл. 175°С. 1 Н-ЯМР (ДМСО-d6): 0,80-2,05 (м, 13Н), 4,65 (т, 1Н), 6,70 (дд, 1Н), 6,78 (д, 1Н), 7,60 (д, 1Н), 9,70 (с, 1Н), 12,60 (с, 1Н). Одержання пропанамідів (23) За тією самою методикою, що й прикладі 27, але замінивши 3-(1-адамантил)-6-метокси-1Ніндазол на: 2-(6-метокси-1Н-індазол-3-іл)-3-(4метоксифеніл)пропан нітрил 3-циклогексил-2-(6-метокси-1Н-індазол-3іл)пропан нітрил одержують, відповідно, такі сполуки: 35 Приклад 50 2-(1-Ацетил-6-гідрокси-1Н-індазол-3-іл)-3-(4метокси-феніл)пропанамід (7,7%), т.пл. 152°С. 1 Н-ЯМР (ДМСО-d6): 2,22 (с, 3H), 3,15 (кв, 2Н), 3,80 (с, 3H), 4,15 (м, 1Н), 6,68 (дд, 1Н), 6,80 (д, 1Н), 6,85-7,05 (м, 3H), 7,20 (д, 2Н), 7,52 (с, 1Н), 7,80 (д, 1Н), 12,53 (с, 1Н). Приклад 51 3-Циклогексил-2-(6-гідрокси-1Н-індазол-3іл)пропанамід (34%), т.пл. 199°С 1 Н-ЯМР (ДМСО-d6): 0,70-2,10 (м, 13Н), 3,90 (т, 1Н), 6,55 (д, 1Н), 6,75 (с, 1Н), 6,83 (с, 1Н), 7,45 (с, 1Н), 7,65 (д, 1Н), 9,50 (с, 1Н), 12,20 (с, 1Н). Одержання 1Н-пірано[4,3,2-cd]індазолів (25), (26) і (27) Приклад 52 7-Метокси-3-(4-метоксифеніл)-1Н-пірано[4,3,2cd]індазол За тією самою методикою, що й у прикладі 12, але замінивши циклопентил(4-бензилокси-2фторфеніл)метанон на 5-хлор-7-метокси-3-(4метоксифеніл)-4Н-хромен-4-он (синтезують згідно з Kitagawa Chem. Pharm. Bull., 39, 1991, 2681), одержують очікуваний продукт (у вигляді твердої речовини, 84%). 1 Н-ЯМР (ДМСО-d6): 3,60 (с, 3H), 3,80 (с, 3H), 6,60 (д, 2Н), 6,80 (д, 2Н), 7,10 (д, 1Н), 7,30 (д, 1Н), 7,80 (с, 1Н). За тією самою методикою, що й у прикладі 49, але замінивши 3-циклогексил-2-(6-метокси-1Ніндазол-3-іл)пропаннітрил на 7-метокси-3-(4метоксифеніл)-1Н-пірано[4,3,2-cd]індазол, одержують такі сполуки: Приклад 53 3-(4-МетоксиФеніл)-1Н-пірано[4,3,2-cd]індазол7-ол, гідрохлорид (26%), т.пл. 255°С 1 Н-ЯМР (ДМСО-d6): 3,55 (с, 3H), 6,63 (м, 4Н), 7,05 (д, 2Н), 8,05 (с, 1Н), 10,00 (с, 1Н). Приклад 54 3-(4-Гідроксифеніл)-1Н-пірано[4,3,2свїіндазол-7-ол, гідрохлорид (15%), т.пл. 111°С 1 Н-ЯМР (ДМСО-d6): 6,45 (с, 2Н), 6,65 (д, 2Н), 7,10 (д, 2Н), 8,00 (с, 1Н), 10,00 (с,1Н). Одержання оксимів (28) і (30) Приклад 55 1-Адамантил(2-хлор-4,6дигідроксифеніл)метанон 1М розчин триброміду бору в СН2СІ2 додають до розчину 1-адамантил(2-хлор-4,6дигіметоксифеніл)метанону (7г, 21,0ммоль) і СН2СІ2 (30мл). Суміш нагрівають впродовж ночі, а потім виливають у воду, екстрагують етилацетатом, сушать над Na2SO4 і концентрують у вакуумі, одержуючи очікуваний продукт (1,9г, 30%). 1 Н-ЯМР (ДМСО-d6): 1,00-1,90 (м, 15Н), 6,25 (с, 1Н), 6,30 (с, 1Н), 10,00 (с, 2Н). Приклад 56 Оксим 1-адамантил(2-хлор-4,6-дигідроксифеніл)метанону 1-Адамантил(2-хлор-4,6дигідроксифеніл)метанон (1,9г, 6,2ммоль), гідрохлорид гідроксиламіну (100г) і піридин (50мл) кип'ятять зі зворотним холодильником впродовж 4год. Суміш концентрують у вакуумі, виливають у воду, екстрагують етилацетатом, промивають 1н розчи 90280 36 ном НСІ, сушать над Na2SO4 і концентрують у вакуумі, одержуючи сирий продукт. Очищення методом флеш-хроматографії (AcOEt/толуол 3/7) дає чистий оксим (1г у вигляді твердої речовини, 50%). 1 Н-ЯМР (ДМСО-d6): 1,50-2,00 (м, 15Н), 6,24 (с, 1Н), 6,28 (с, 1Н). Використовуючи ту саму методику, але замінивши 1-адамантил(2-хлор-4,6дигідроксифеніл)метанон на 1-адамантил(4-бензилокси-2-фторфеніл)метанон циклогептил(4-бензилокси-2-фторфеніл)метанон одержують, відповідно, такі сполуки: Приклад 57 Оксим 1-адамантил(4-бензилокси-2фторфеніл)метанону (32%) 1 Н-ЯМР (ДМСО-d6): 1,20-2,20 (м, 15Н), 5,10 (с, 2Н), 6,80 (дт, 1Н), 6,90-7,17 (м, 2Н), 7,20-7,60 (м, 5Н), 10,55 (с, 1Н). Приклад 58 Оксим циклогептил(4-бензилокси-2фторфеніл)метанону (60%) 1 Н-ЯМР (ДМСО-d6): 1,10-2,00 (м, 12Н), 2,102,20 (м, 1Н), 5,10 (с, 2Н), 6,67-6,85 (м, 1Н), 6,907,15 (м, 2Н), 7,25-7,50 (м, 5Н), 10,47 (с, 1Н). Одержання бензизоксазолів (31), (32) і (34) Приклад 59 6-Бензилокси-3-циклогексил-1,2-бензизоксазол Розчин гідрохлориду гідроксиламіну (11,7г) в теплій воді (100мл) виливають у суміш циклогексил(4-бензилокси-2-фторфеніл)метанону (20,22г, 64,7ммоль) і EtOH (54мл). Швидко додають розчин гідроксиду натрію (11,13г, 0,278моль) у воді (54мл) і нагрівають до кипіння. Реакційну суміш нагрівають впродовж 12 годин і потім більшу частину EtOH видаляють дистиляцією. До залишку додають розчин гідроксиду калію (8,7г, 0,155моль) у воді (54мл). Суміш кип'ятять зі зворотним холодильником впродовж 2 днів, потім охолоджують приблизно до 6°С при енергійному перемішуванні. Одержують тверду речовину білого кольору, яку ретельно промивають водою і розтирають з діізопропіловим ефіром. Бензизоксазол одержують після фільтрування у вигляді порошку білого кольору (12,26г, 62%), т.пл. 110°С. 1 Н-ЯМР (ДМСО-d6): 1,00-2,10 (м, 10Н), 3,05 (м, 1Н), 5,20 (с, 2Н), 7,00 (дд, 1Н), 7,25-7,55 (м,6Н), 7,75 (д, 1Н). Використовуючи ту саму методику, але замінивши циклогексил(4-бензилокси-2фторфеніл)метанон на циклогексил-(2-фтор-4гідрокси-5- метоксифеніл)метанон, одержують таку сполуку: Приклад 60 3-циклогексил-6-гідрокси-5-метоксибензизоксазол (50,5%) 1 Н-ЯМР (ДМСО-d6): 1,20-2,10 (м, 10Н), 3,05 (м, 1Н), 3,85 (с, 3H), 6,95 (с, 1Н), 7,23 (с, 1Н), 9,94 (с, 1Н). Приклад 61 3-(1-Адамантил)-4-хлор-1,2-бензизоксазол-6ол 37 Діетилазодикарбоксилат (0,92г, 1,7екв.) у ТГФ (20мл) додають до суміші оксиму 1-адамантил(2хлор-4,6-дигідроксифеніл)метанону (1г, 3,1ммоль), трифенілфосфіну (1,4г, 1,7екв.) у ТГФ (20мл) при 0°С. Суміш перемішують 2 години при 0°С, виливають у воду, екстрагують етилацетатом, сушать над Na2SO4 і концентрують у вакуумі, одержуючи очікуваний продукт. Після очищення методом флеш-хроматографії (AcOEt/толуол 1/9) і кристалізації з EtOH одержують очікуваний продукт (230мг, 23%), т.пл. 215°С. 1 Н-ЯМР (CDCI3): 1,50-2,10 (м, 15Н), 6,23 (д, 1Н), 6,32 (д, 1Н). Приклад 62 3-(1-Адамантил)-6-бензилокси-1,2-бензизоксазол Оксим 1-адамантил(4-бензилокси-2фторфеніл)метанону (2,3мг, 6мМ) у ДМФА (30мл) при температурі 0°С в атмосфері азоту додають краплями до перемішуваної суспензії NaH (0,61г, 18мМ, 60%-на дисперсія в олії) у ДМФА (10мл). Після завершення додавання реакційній суміші дають нагрітися до кімнатної температури і виливають у Н2О. Осад збирають фільтруванням і одержують очікуваний продукт (2,06г, 95%), т.пл. 132°С. 1 Н-ЯМР (ДМСО-d6): 1,20-2,45 (м, 15Н), 5,22 (с, 2Н), 7,00 (д, 1Н), 7,30-7,60 (м, 6Н), 7,72 (д, 1Н). Використовуючи ту саму методику, але замінивши оксим 1-адамантил(4-бензилокси-2фторфеніл)метанону на оксим циклогептил(4бензилокси-2-фторфеніл)метанону, одержують таку сполуку: Приклад 63 6-Бензилокси-3-циклогептил-1,2-бензизоксазол (90%). т. пл. 80°С 1 Н-ЯМР (ДМСО-d6): 1,30-2,20 (м, 12Н), 3,25 (м, 1Н), 5,21 (с, 2Н), 7,00 (дд, 1Н), 7,25-7,60 (м, 6Н), 7,75 (д, 1Н). За тією самою методикою, що й у прикладі 23, але замінивши 6-бензилокси-3-циклопентил-1Ніндазол на: 3-(1-адамантил)-6-бензилокси-1,2-бензизоксазол 6-бензилокси-3-циклогептил-1,2-бензизоксазол 6-бензилокси-3-циклогексил-1,2-бензизоксазол одержують, відповідно, такі сполуки: Приклад 64 3-(1-Адамантил)-1,2-бензизоксазол-6-ол (47,5%), т.пл. 215°С 1 Н-ЯМР (ДМСО-d6): 1,40-2,20 (м, 13Н), 2,35 (с, 2Н), 6,80 (дд, 1Н), 6,92 (д, 1Н), 7,58 (д, 1Н), 10,28 (с, 1Н). Приклад 65 3-Циклогептил-1,2-бензизоксазол-6-ол (48%). т.пл. 156°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,20 (м, 12Н), 3,18 (м, 1Н), 6,80 (д, 1Н), 6,90 (с, 1Н), 7,65 (д, 1Н), 10,25 (с, 1Н). Приклад 66 3-Циклогексил-1,2-бензизоксазол-6-ол (37%), т.пл. 181°С 90280 38 1 Н-ЯМР (ДМСО-d6): 1,10-2,10 (м, 10Н), 3,02 (дт, 1Н), 6,80 (дд, 1Н), 6,90 (с, 1Н), 7,68 (д, 1Н), 10,25 (с, 1Н). Приклад 67 3-Циклогексил-1,2-бензизоксазол-5,6-діол За тією самою методикою, що й у прикладі 49, але замінивши 3-циклогексил-2-(6-метокси-1Ніндазол-3-іл)пропаннітрил на 3-циклогексил-6гідрокси-5-метоксибензизоксазол, одержують очікуваний продукт (48,4%), т.пл. 177°С. 1 Н-ЯМР (ДМСО-d6): 1,20-2,05 (м, 10Н), 3,05 (дт, 1Н), 6,92 (с, 1Н), 7,05 (с, 1Н), 9,55 (ушир.с, 2Н). Приклад 68 3-циклогексил-6-(2-піперидин-1-ілетокси)-1,2бензизоксазол Суміш 3-циклогексил-1,2-бензизоксазол-6-олу (2,69г, 12ммоль), гідрохлориду 1-(2хлоретил)піперидину (2,39г, 13ммоль) і K2СО3 (3,59г, 26ммоль) у CH3CN (30мл) кип'ятять зі зворотним холодильником впродовж 3 годин, а потім залишають перемішуватись на ніч при кімнатній температурі. Реакційну суміш виливають у Н2О та екстрагують за допомогою EtOAc. Органічний шар промивають насиченим розчином солі, сушать (над Na2SO4) і концентрують, одержуючи залишок (3,78г). Залишок очищують методом флешхроматографії (толуол/1,4-діоксан 8/2). Кристалізують з EtOH та одержують кристали білого кольору (0,53г, 13,4%), т.пл. 69°С. 1 Н-ЯМР (ДМСО-d6): 1,20-2,10 (м, 16Н), 2,302,50 (м, 4Н), 2,70 (т, 2Н), 2,95-3,05 (дт, 1Н), 4,15 (т, 2Н), 6,95 (дд, 1Н), 7,25 (д, 1Н), 7,75 (д, 1Н). Приклад 69 Тригідроксибензоїн Резорцин (100г, 0,91моль) і 4гідроксифенілоцтову кислоту (138,4г, 0,91моль) розчиняють у BF3·Et2O (346мл, 2,73моль) в атмосфері азоту. Суміш перемішують і нагрівають до температури 50-60°С. Після завершення реакції суміш охолоджують до кімнатної температури і виливають у великий об'єм крижаної води. Сирий продукт відфільтровують і сушать, одержуючи тригідроксибензоїн (70%), т.пл. 211°С. 1 Н-ЯМР (ацетон-d6): 4,12 (с, 2Н), 6,78 (д, 2Н), 6,91 (д, 1Н), 7,13 (д, 2Н), 7,54-7,6 (м, 2Н), 8,21 (с, 1Н), 8,35 (с, 1Н), 8,70 (с, 1Н). Приклад 70 1-[2-Гідрокси-4-(тетрагідро-2Н-піран-2ілокси)феніл]-2-[4-(тетрагідро-2Н-піран-2ілокси)феніл]етанон До охолодженої (0-5°С) суспензії тригідроксибензоїну (100г, 0,41моль) і TsOH (0,062г) як каталізатора в толуолі (350мл) повільно додають розчин дигідропірану (DHP) (150мл, 1,64моль). Реакційна суміш стає гомогенною, і її перемішують при кімнатній температурі впродовж 1 години. Додають тріетиламін і розчинник упарюють при зниженому тиску. Олія коричневого кольору після розтирання в гарячому ізопропанолі (1,2л) кристалізується, і таким чином виділяють тверду речовину білого кольору, що утворилася (182г, 90%). 1 Н-ЯМР (CDCI3): 1,40-2,05 (м, 12Н), 3,40-3,60 (м, 2Н), 3,65-3,90 (м, 2Н), 4,05 (с, 2Н), 5,30 (т, 1Н), 5,40 (т, 1Н), 6,46 (дд, 1Н), 6,54 (д, 1Н), 6,94 (д, 2Н), 7,10 (д, 2Н), 7,68 (д, 1Н), 12,52 (с, 1Н). 39 Приклад 71 Оксим 1-[2-гідрокси-4-(тетрагідро-2Н-піран-2ілокси)феніл]-2-[4-(тетрагідро-2Н-піран-2ілокси)феніл]етанону Суміш 1-[2-гідрокси-4-(тетрагідро-2Н-піран-2ілокси)]-2-[4-(тетрагідро-2Н-піран-2ілокси)феніл]етанону (5г, 12ммоль) і H2NOH, HCI (8,59г, 12,3ммоль) перемішують впродовж 24 годин у піридині (65мл) при кімнатній температурі. Реакційну суміш виливають у великий об'єм суміші 99/1 Н2О/тріетиламін, а потім екстрагують за допомогою EtOAc. Органічний шар промивають насиченим розчином солі. Після сушіння над сульфатом натрію EtOAc упарюють. Залишок очищують методом колонкової флешхроматографії (толуол/1,4-діоксан 90/1+TEA 1%) і одержують безбарвну олію (5,05г, 97%). 1 Н-ЯМР (ДМСО-d6): 1,30-2,00 (м, 12Н), 3,403,60 (м, 2Н), 3,60-3,80 (м, 2Н), 4,12 (с, 2Н), 5,38 (т, 1Н), 5,45 (т, 1Н), 6,48 (д, 1Н), 6,50 (с, 1Н), 6,93 (д, 2Н), 7,05-7,30 (м, 3H), 7,40 (д, 1Н), 11,63 (с, 1Н), 11,85 (с, 1Н). Приклад 72 6-(Тетрагідро-2Н-піран-2-ілокси)-3-[4(тетрагідро-2Н-піран-2-ілокси)бензил]-1,2бензизоксазол За тією самою методикою, що й у прикладі 61, але замінивши оксим 1-адамантил(2-хлор-4,6дигідроксифеніл)метанону на оксим 1-[2-гідрокси4-(тетрагідро-2Н-піран-2-ілокси)феніл]-2-[4(тетрагідро-2Н-піран-2-ілокси)феніл] етанону, одержують очікуваний продукт (25%). 1 Н-ЯМР (ДМСО-d6): 1,40-2,10 (м, 12Н), 3,403,85 (м, 4Н), 4,25 (с, 2Н), 5,39 (с, 1Н), 5,61 (с, 1Н), 6,90-7,10 (м, 3H), 7,20-7,35 (м, 3H), 7,55 (д, 1Н). Приклад 73 3-(4-Гідроксибензил)-1,2-бензизоксазол-6-ол В метанолі (20мл) розчиняють 6-(тетрагідро2Н-піран-2-ілокси)-3-[4-(тетрагідро-2Н-піран-2ілокси)бензил]-1,2-бензизоксазол (3,85ммоль) і пара-толуолсульфонову кислоту (APTS, каталітичну кількість). Проводять реакцію при температурі 60-70°С впродовж 3 годин, потім реакційну суміш охолоджують до кімнатної температури, виливають у насичений розчин NaHCO3 та екстрагують за допомогою EtOAc. Після промивання (Н2О) і сушіння (MgSO4) екстракт концентрують. Сирий продукт очищують методом флеш-хроматографії (толуол/1,4-діоксан 8/2) і кристалізують, одержуючи кристали білуватого кольору (0,58г, 31%), т.пл. 178°С. 1 Н-ЯМР (ДМСО-d6): 4,11 (с, 2Н), 6,69 (д, 2Н), 6,75 (дд, 1Н), 6,90 (д, 1Н), 7,13 (д, 2Н), 7,48 (д,1Н), 9,80 (с, 2Н). Одержання сульфаматів бензизоксазолу (33) За тією самою методикою, що й у прикладі 33, але замінивши 6-бензилокси-3-циклогептил-1Ніндазол на: 3-(1-адамантил)-1,2-бензизоксазол-6-ол 3-циклогептил-1,2-бензизоксазол-6-ол 3-циклогексил-1,2-бензизоксазол-6-ол одержують, відповідно, такі сполуки: Приклад 74 3-(1-Адамантил)-1,2-бензизоксазол-6ілсульФамат (82%), т.пл. 87°С 90280 40 1 Н-ЯМР (ДМСО-d6): 1,50-2,45 (м, 15Н), 7,28 (дд, 1Н), 7,63 (д, 1Н), 7,96 (д, 1Н), 8,15 (с, 2Н). Приклад 75 3-Циклогептил-1.,-бензизоксазол-6ілсульфамат (54%), т.пл. 82°С 1 Н-ЯМР (ДМСО-d6): 1,40-2,10 (м, 12Н), 3,32 (м, 1Н), 7,30 (д, 1Н), 7,60 (д, 1Н), 8,05 (д, 1Н), 8,15 (с, 2Н). Приклад 76 3-Циклогексил-1,2-бензизоксазол-6-ілсульфамат (46%), т.пл. 145°С 1 Н-ЯМР (ДМСО-d6): 1,20-2,20 (м, 10Н), 3,15 (дт, 1Н), 7,25 (дд, 1Н), 7,62 (д, 1Н), 8,05 (д, 1Н), 8,15 (с, 2Н). Одержання бензизоксазолів (36), (37) і (38) Приклад 77 2-(Z/Е)-(6-Метокси-1,2-бензизоксазол-3-іл)-3(4-метоксифеніл)проп-2-еннітрил 40%-ний розчин KОН/Н2О (3мл) і EtOH (4,8мл) при кімнатній температурі повільно додають до гетерогенної суміші (6-метокси-1,2-бензизоксазол3-іл)ацетонітрилу (2,4г, 12,7ммоль), одержаного згідно з H.Uno (Chem. Pharm. Bull., 24 (4), 632-643, 1976), 4-метоксибензальдегіду (1,1екв., 14ммоль, 1,8г) і EtOH (24мл). Суміш перемішують при кімнатній температурі впродовж 1 години, осад відфільтровують під вакуумом, промивають водою і EtOH та одержують чистий 2-(Z/Е)-(6-метокси-1,2бензизоксазол-3-іл)-3-(4-метоксифеніл)проп-2еннітрил (3,15г, 81%). 1 Н-ЯМР (ацетон-d6): 3,94 (с, 3H), 3,97 (с, 3H), 7,08 (дд, 1Н), 7,15 (д, 2Н), 8,05-8,30 (м, 4Н). Використовуючи ту саму методику, але замінивши 4-метоксибензальдегід на 4гідроксибензальдегід, одержують таку сполуку: Приклад 78 2-(Z/Е)-3-(4-Гідроксифеніл)-2-(6-метокси-1,2бензизоксазол-3-іл)проп-2-еннітрил (86%), т.пл. >380°С. 1 Н-ЯМР (ДМСО-d6): 3,85 (с, 3H), 6,15 (д, 2Н), 7,00 (д, 1Н), 7,25 (с, 1Н), 7,70 (с, 3H), 8,00 (д, 1Н). Приклад 79 2-(6-Метокси-1,2-бензизоксазол-3-іл)-3-(4метокси-феніл)пропаннітрил NaBH4 (1,05екв., 0,2г, 5,15ммоль) додають до гетерогенного розчину 2-(Z/Е)-(6-метокси-1,2бензизоксазол-3-іл)-3-(4-метоксифеніл)проп-2еннітрилу (1,5г, 4,9ммоль) і EtOH (20мл). Суміш нагрівають до 50°С впродовж 1 години, підкислюють до рН 1 за допомогою 1н розчину НСІ, екстрагують за допомогою AcOEt, сушать над Na2SO4 і концентрують у вакуумі, одержуючи чистий 2-(6метокси-1,2-бензизоксазол-3-іл)-3-(4метоксифеніл)пропаннітрил (1,5г, 100%). 1 Н-ЯМР (CDCI3): 3,35 (д, 2Н), 3,80 (с, 3H), 3,90 (с, 3H), 4,45 (т, 1Н), 6,84 (д, 2Н), 6,93 (дд, 1Н), 7,02 (д, 1Н), 7,04 (д, 2Н), 7,50 (д, 1Н). Приклад 80 2-(6-Гідрокси-1,2-бензизоксазол-3-іл)-3-(4гідроксифеніл)пропаннітрил До розчину 2-(6-метокси-1,2-бензизоксазол-3іл)-3-(4метоксифеніл)пропаннітрилу (1,5г, 4,9ммоль) у СН2СІ2 (100мл) в атмосфері азоту додають 1М розчин BBr3 у СН2СІ2 (4екв., 20мл). Суміш кип'ятять впродовж 2 годин, виливають у 41 воду та екстрагують за допомогою EtOAc, потім сушать над Na2SO4, відфільтровують і концентрують у вакуумі, одержуючи сирий продукт. Після очищення методом флеш-хроматографії (СН2СІ2/МеOН 98/2) і кристалізації з EtOH одержують очікувані кристали (850мг, 62%), т.пл. 214°С. 1 Н-ЯМР (ДМСО-d6): 3,25 (м, 2Н), 5,10 (т, 1Н), 6,65 (д, 2Н), 6,90 (д, 1Н), 7,00 (д, 2Н), 7,06 (с, 1Н), 7,70 (д, 1Н), 9,35 (с, 1Н), 10,50 (с, 1Н). За тією самою методикою, що й у прикладі 77, але замінивши 4-метоксибензальдегід на: 3-фтор-4-метоксибензальдегід 4-метокси-2-метилбензальдегід 3-метоксибензальдегід 4-фторбензальдегід циклогексаналь 3,4-диметоксибензальдегід та використовуючи ті самі методики, які наведені у прикладах 79 і 80, одержують, відповідно, такі сполуки: Приклад 81 2-(6-Гідрокси-1,2-бензизоксазол-3-іл)-3-(3фтор-4-гідроксифеніл)пропаннітрил (56%). т.пл. 201°С 1 Н-ЯМР (ДМСО-d6): 3,25 (м, 2Н), 5,15 (т, 1Н), 6,70-7,20 (м, 5Н), 7,72 (д, 1Н), 9,82 (с, 1Н), 10,55 (с, 1Н). Приклад 82 2-(6-Метокси-1,2-бензизоксазол-3-іл)-3-(4гідрокси-2-метилфеніл)пропан нітрил (15%). т.пл. 131°С 1 Н-ЯМР (ацетон-d6): 2,11 (с, 3H), 3,28 (д, 2Н), 3,80 (с, 3H), 4,72 (т, 1Н), 6,40-6,60 (м, 2Н), 6,85 (дд, 1Н), 7,00 (д, 1Н), 7,10 (д, 1Н), 8,09 (с, 1Н). Приклад 83 2-(6-Гідрокси-1,2-бензизоксазол-3-іл)-3-(3гідроксифеніл)пропаннітрил (20%) 1 Н-ЯМР (ацетон-d6): 3,25-3,60 (м, 2Н), 4,90 (т, 1Н), 6,60-7,25 (м, 6Н), 7,70 (д, 1Н), 8,80 (ушир.с, 1Н). Приклад 84 2-(6-Гідрокси-1,2-бензизоксазол-3-іл)-3-(4фторфеніл)пропаннітрил (35%), т.пл. 152°С 1 Н-ЯМР (ДМСО-d6): 2,40-2,70 (м, 2Н), 3,95 (т, 1Н), 4,25 (с, 1Н), 5,90-6,50 (м, 6Н), 6,70 (д, 1Н). Приклад 85 2-(6-Гідрокси-2-бензизоксазол-3-іл)-3циклогексилпропаннітрил (63%), т.пл. 111°С 1 Н-ЯМР (ацетон-d6): 0,80-2,10 (м, 13Н), 4,56 (дд, 1Н), 6,90 (дд, 2Н), 7,02 (д, 1Н), 7,67 (д, 1Н), 9,38 (с, 1Н). Приклад 86 2-(6-Гідрокси-1,2-бензизоксазол-3-іл)-3-(3.4дигідроксифеніл)пропаннітрил (56%), т.пл. 154°С 1 Н-ЯМР (ДМСО-d6): 3,00-3,35 (м, 2Н), 5,06 (т, 1Н), 6,50 (дд, 1Н), 6,55-6,75 (м, 2Н), 6,90 (дд, 1Н), 7,00 (дд, 1Н), 7,70 (д, 1Н), 8,90 (ушир.с, 1Н). Одержання бензизоксазолів (40), (41), (42) і (43) Приклад 87 3-Метил-6-[(трет-бутил(диметил)силіл)окси]1,2-бензизоксазол 3-Метил-1,2-бензизоксазол-6-ол (10г, 67ммоль) (синтезують згідно з M.A.EIkasaby, Indian. J. Сhеm., 1987, 26, 620) і ДМФА (50мл) до 90280 42 дають до суміші трет-бутилдиметилсилілхлориду (1,05екв., 10,6г), імідазолу (2,5екв., 11,4г) і ДМФА (100мл) в атмосфері азоту. Потім суміш перемішують при кімнатній температурі впродовж 1 години, виливають у воду та екстрагують етилацетатом, потім сушать над Na2SO4, відфільтровують і концентрують у вакуумі, одержуючи сирий продукт. Після очищення методом флешхроматографії (AcOEt/толуол 18/85 з 0,1% TEA) одержують 6-[(трет-бутил(диметил)силіл)окси]-3метил-1,2-бензизоксазол (17,1г, 97%). 1 Н-ЯМР (CDCI3-d1): 0,20 (с, 6Н), 1,00 (с, 9Н), 2,60 (с, 3H), 6,80 (дд, 1Н), 6,95 (д, 1Н), 7,45 (д, 1Н). Приклад 88 3-(Бромметил)-6-[(третбутил(диметил)силіл)окси]-1,2-бензизоксазол NBS (12,7г, 71,5ммоль) і пероксид бензоїлу (1,6г, 6,5ммоль) додають до суміші 3-метил-6[(трет-бутил(диметил)силіл)окси]-1,2бензизоксазолу (17,1г, 65ммоль) і ССl4 (200мл). Суміш кип'ятять зі зворотним холодильником впродовж ночі і осад відфільтровують, промивають за допомогою ССl4 та очищують методом флеш-хроматографії (AcOEt/толуол 1/9 з 0,1% TEA), одержуючи 3-(бромметил)-6-[(третбутил(диметил)силіл)окси]-1,2-бензизоксазол (15,1г, 68%). 1 Н-ЯМР (CDCI3-d1): 0,25 (с, 6Н), 1,00 (с, 9Н), 4,57 (с, 2Н), 6,88 (дд, 1Н), 7,02 (д, 1Н), 7,55 (д, 1Н). Приклад 89 3-(6-[(трет-Бутил)силіл)окси]-1,2-бензизоксазол-3-іл)-2-(4-метоксисреніл)пропаннітрил В атмосфері азоту 2,0Μ розчин н-BuLi у ТГФ (9,7ммоль) повільно додають до розчину діізопропіламіну (1,3мл, 1,05екв.) у сухому ТГФ (10мл) при температурі мінус 20°С. Суміш перемішують при мінус 20°С впродовж 30хв., потім при температурі мінус 78°С повільно додають 4метоксибензонітрил (1,3г, 8,8ммоль). Суміш перемішують при мінус 78°С впродовж 30хв., потім повільно додають 3-(бромметил)-6-[(третбутил(диметил)силіл)окси]-1,2-бензизоксазол (3,0г, 8,8ммоль) і сухий ТГФ (10мл). Суміш перемішують впродовж 30хв. при кімнатній температурі, виливають у воду, екстрагують за допомогою AcOEt, сушать над Na2SO4 і очищують методом флеш-хроматографії (AcOEt/гептан 2/8 з 0,1% TEA), одержуючи 3-(6-[(третбутил)диметилсиліл)окси]-1,2-бензизоксазол-3-іл)2-(4-метоксифеніл)пропаннітрил (1г, 28%). 1 Н-ЯМР (CDCI3-d1): 0,20 (с, 6Н), 1,00 (с, 9Н), 3,25-3,65 (м, 2Н), 3,70-4,48 (т, 1Н), 6,80-7,60 (м, 7Н). Приклад 90 3-(6-Гідрокси-1,2-бензизоксазол-3-іл)-2-(4метоксифеніл)пропаннітрил 1н розчин h-Bu4F у ТГФ додають до суміші 3(6-[(трет-бутил)силіл)окси]-1,2-бензизоксазол-3-іл)2-(4-метоксифеніл)пропаннітрилу (1,0г, 2,45ммоль) у сухому ТГФ (20мл) при кімнатній температурі. Потім суміш перемішують при кімнатній температурі впродовж 2 годин, після чого виливають у воду та екстрагують етилацетатом, потім сушать над Na2SO4, відфільтровують і концентрують у вакуумі. Сирий продукт очищують методом флеш 43 хроматографії (AcOEt/толуол 2/8) і кристалізують із суміші МеОН/циклогексан, одержуючи очікуваний продукт (210мг, 30%). 1 Н-ЯМР (ДМСО-d6): 3,00-3,50 (м, 2Н), 5,05 (т, 1Н), 6,60 (д, 2Н), 6,90 (дд, 1Н), 7,00 (д, 2Н), 7,05 (с, 1Н), 7,70 (д, 1Н), 9,40 (с, 1Н), 10,50 (с, 1Н). Одержання бензизотіазолів (45) і (46) Приклад 91 Циклогексил(4-бензилокси-2бензилтіофеніл)метанон Розчин фенілметантіолу (2,35мл, 20ммоль) у ТГФ (10мл) при кімнатній температурі в атмосфері азоту повільно додають до суміші трет-бутоксиду калію (2,24г, 20ммоль) у ТГФ (80мл). Суміш перемішують впродовж 15хв. при кімнатній температурі і повільно додають циклогексил(4-бензилокси-2фторфеніл)метанон (6,5г, 20ммоль) у ТГФ (10мл). Суміш впродовж 2 годин нагрівають до температури 50°С, виливають у водний розчин NH4CI, екстрагують етилацетатом, сушать над Na2SO4 і концентрують у вакуумі. Сирий продукт очищують методом флеш-хроматографії (гептан/AcOEt 90/10 з 0,1% TEA) і одержують циклогексил(4бензилокси-2-бензилтіофеніл)метанон (8,3г, 100%). 1 Н-ЯМР (ДМСО-d6): 1,00-1,85 (м, 10Н), 3,103,30 (м, 1Н), 4,15 (с, 2Н), 5,19 (с, 1Н), 6,85 (дд, 1Н), 7,05 (д, 1Н), 7,15-7,60 (м, 10Н), 7,90 (д, 1Н). Приклад 92 6-Бензилокси-3-циклогексил-1,2-бензизотіазол Сульфурилхлорид (1,77мл, 2,2ммоль) повільно додають до розчину циклогексил(4-бензилокси2-бензилтіофеніл)метанону (8,77г, 21ммоль) у СН2СІ2 (80мл) при температурі 0°С. Суміш перемішують впродовж 2 годин при кімнатній температурі, а потім концентрують у вакуумі. До суміші додають ТГФ (80мл), а потім при температурі 0°С повільно додають EtOH (80мл), насичений аміаком. Залишають суміш перемішуватись на ніч при кімнатній температурі, виливають у воду, екстрагують етилацетатом, сушать над Na2SO4, відфільтровують і концентрують у вакуумі, одержуючи сирий продукт. Після очищення методом флешхроматографії (гептан/AcOEt 98/2) одержують 6бензилокси-3-циклогексил-1,2-бензизотіазол (3,55г, 52%). 1 Н-ЯМР (ДМСО-d6): 1,10-2,00 (м, 10Н), 3,25 (дт, 1Н), 5,20 (с, 2Н), 7,12 (дд, 1Н), 7,25-7,55 (м, 5Н), 7,75 (д, 1Н), 8,02 (д, 1Н). Приклад 93 3-циклогексил-1,2-бензизотіазол-6-ол 1Μ розчин триброміду бору в СН2СІ2 (11,9мл, 11,9ммоль) при температурі 0°С повільно додають до розчину 6-бензилокси-3-циклогексил-1,2бензизотіазолу (3,5г, 10ммоль) у СН2СІ2 (50мл). Суміш перемішують при кімнатній температурі впродовж 15хв. і виливають у воду. Осад відфільтровують, сушать і кристалізують з EtOH, одержуючи чистий 3-циклогексил-1,2-бензизотіазол-6-ол (940мг, 40,3%), т.пл. 190°С. 1 Н-ЯМР (ДМСО-d6): 1,10-2,10 (м, 10Н), 3,20 (дт, 1Н), 6,95 (дд, 1Н), 7,40 (д, 1Н), 7,93 (д, 1Н), 10,18 (с, 1Н). За тією самою методикою, що й у прикладах з 91 по 93, але замінивши циклогексил(4 90280 44 бензилокси-2-фторфеніл)метанон на циклопентил(4-бензилокси-2-фторфеніл)метанон, одержують таку сполуку: Приклад 94 3-циклопентил-1,2-бензизотіазол-6-ол, т.пл. 130°С 1 Н-ЯМР (ДМСО-d6): 1,50-2,20 (м, 8Н), 3,62 (м, 1Н), 6,95 (дд, 1Н), 7,35 (д, 1Н), 7,92 (д, 1Н), 10,18 (с, 1Н). Одержання сульфаматів бензизотіазолів (47) і (48) Приклад 95 3-Циклогексил-1,2-бензизотіазол-6ілсульфамат Сульфамоїлхлорид (780мг, 6,76ммоль) при температурі 0°С додають порціями до суміші 3циклогексил-1,2-бензизотіазол-6-олу (790мг, 3,38ммоль) і диметилацетаміду (15мл). Суміш перемішують при 0°С впродовж 30хв., а потім залишають перемішуватись на ніч при кімнатній температурі, виливають у воду, екстрагують етилацетатом, сушать над Na2SO4 i концентрують у вакуумі. Сирий продукт очищують методом флешхроматографії (толуол/1,4-діоксан 9/1) і кристалізують із суміші EtOH/пентан, одержуючи очікуваний продукт (620мг, 59%), т.пл. 150°С. 1 Н-ЯМР (ДМСО-d6): 1,20-2,05 (м, 10Н), 3,30 (м, 1Н), 7,40 (дд, 1Н), 8,10 (д, 1Н), 8,15 (с, 2Н), 8,25 (д, 1Н). Використовуючи ту саму методику, але замінивши 3-циклогексил-1,2-бензизотіазол-6-ол на 3циклопентил-1,2-бензизотіазол-6-ол, одержують таку сполуку: Приклад 96 3-Циклопентил-1,2-бензизотіазол-6ілсульфамат, т.пл. 132°С 1 Н-ЯМР (ДМСО-d6): 1,55-2,25 (м, 8Н), 3,65-3,85 (м, 1Н), 7,4 (дд, 1Н), 8,10 (с, 1Н), 8,15 (с, 2Н), 8,23 (д, 1Н). Приклад 97 3-циклогексил-1,1-диоксо-1,2-бензизотіазол-6ілсульфамат Пероксид водню (0,6мл) повільно додають при кімнатній температурі до суміші 3-циклогексил-1,2бензизотіазол-6-ілового ефіру сульфамової кислоти (1г, 3,2ммоль), трифтороцтової кислоти (2мл) і дихлорметану (20мл). Потім суміш перемішують впродовж 2 годин і виливають у воду. Осад відфільтровують та очищують методом флешхроматографії (толуол/1,4-діоксан 85/15) і після кристалізації одержують тверду речовину (70мг, 6%), т.пл. 170°С. 1 Н-ЯМР (ДМСО-d6): 1,10-2,20 (м, 10Н), 7,25 (дд, 1Н), 8,07 (д, 1Н), 8,25 (с, 1Н), 8,43 (с, 1Н). Результати фармакологічних тестів In vitro зв'язування підтипу рецептору естрогену Цей спосіб розроблений на базі способу, описаного для рецепторів естрогену з маток пацюків (Botella J. et al., J. Endocrinol. Invest., 1990, 13: 905910) і клітин Ісикави людини (Botella J., J. Steroid. Biochem. Molec. Biol., 1995, 55: 77-84). Величини відносної спорідненості зв'язування (RBA) визначають за допомогою аналізу на конкурентне зв'я 45 90280 зування із використанням повнорозмірних рекомбінантних ER і ER людини (PanVera, Медисон, Вісконсин). Рецептори інкубують у буфері Tris (10мМ Tris, 2мМ DTT, 1мг/BSA, 10% гліцерину, доводять до рН 7,5 за допомогою НСІ) при температурі 4°С впродовж 18-20 годин разом з 2нМ [3Н]Е2 у присутності або у відсутності концентрацій, що зростають, випробуваної сполуки у діапазоні від 1нМ до 10мкМ. Неспецифічне зв'язування визначають у присутності 500-кратного надлишку, що не містить мітку Е2. Поділ зв'язаних і вільних фракцій 3Н-Е2 проводять за допомогою активованого вугілля (2,5%), покритого декстраном (0,25%) в буфері Трис-ЕДТК. Після струшування впродовж декількох секунд і центрифугування з прискоренням 1500 g при температурі 4°С впродовж 10хв., 150мкл на лунку сцинтиляційної рідини Optiphase 46 "Super Mix" змішують з 50мкл супернатанту кожного зразка та визначають радіоактивність за допомогою лічильника часток MicroBeta (Wallac, Турку, Фінляндія). Для оцінювання концентрації конкурента при половинному від максимального значення специфічного зв'язування (ІС50) проводять оцінювання даних із використанням сигмоподібної кривої залежності від дози (Prism, GraphPad Software Inc.). Значення RBA кожного конкурента розраховують у вигляді відношення величин ІС50 і Е2 для конкурента, при цьому значення RBA для Е2 довільно приймають таким, що дорівнює 100%. Селективність відносно ER і ER визначають із відношення R значення ІС50 для ER до значення для ER для кожної тестованої сполуки. Таблиця 1 Аналіз на зв'язування рецептора естрогену Сполука ER Е2 Приклад 23 Приклад 24 Приклад 31 Приклад 35 Приклад 40 Приклад 65 Приклад 66 Приклад 73 Приклад 80 Приклад 81 Приклад 84 Приклад 86 Приклад 93 Середнє значення 1,6 2,1 1332,0 41,8 159,1 10,2 119,0 36,2 2686,0 248,0 1483,0 187,6 75,3 20,2 260,0 44,6 2912,3 484,8 67,5 7,5 139,3 14,4 2300,8 122,9 1894,0 134,8 88,6 37,8 IC50 (нМ) Стандартне ± відхилення ± 0,1 ± 0,1 ± 267,8 ± 7,1 ± 23,7 ± 0,9 ± 45,2 ± 18,7 ± 593,0 ± 48,7 ± 1177,6 ± 34,0 ± 5,4 ± 4,2 ± 40,1 ± 7,7 ± 317,8 ± 157,7 ± 5,0 ± 0,7 ± 33,9 ± 5,3 ± 445,6 ± 25,9 ± 364,8 ± 31,0 ± 11,7 ± 5,4 Середнє значення 100,0 100,0 0,2 10,4 1,2 24,6 3,1 17,7 0,1 0,9 0,1 1,0 2,5 13,2 1,1 9,4 0,1 1,0 3,4 43,0 2,4 35,9 0,1 2,5 0,2 2,4 1,3 5,1 і RBA (%) Стандартне ± відхилення ± ± ± 0,05 ± 4,0 ± 0,2 ± 4,3 ± 0,8 ± 5,1 ± 0,02 ± 0,1 ± 0,02 ± 0,2 ± 0,6 ± 3,1 ± 0,2 ± 3,1 ± 0,0 ± 0,3 ± 0,4 ± 7,8 ± 0,7 ± 14,0 ± 0,03 ± 0,4 ± 0,03 ± 0,4 ± 0,2 ± 0,8 R (ІС50) N 59 59 4 4 9 9 4 4 4 4 5 5 4 4 4 4 3 4 8 8 4 4 4 4 4 4 4 4 08 31,9 15,6 3,3 10,8 7,9 3,7 5,8 6,0 9,0 9,7 18,7 14,1 2,3 n=кількість аналізів Естрогенні та антиестрогенні активності in vitro Потенційну естрогенну та антиестрогенну активність нових сполук оцінюють за ініціюванням активності лужної фосфатази (APase), специфічної естрогенної реакції-відповіді внутрішньо маткових клітин Ісикави аденокарциноми людини (Botella J., J. Steroid. Biochem. Molec. Biol., 1995, 55: 77-84; Littlefield et al., Endocrinology, 1990, 127: 2757-2762). 47 90280 Клітини Ісикави вирощують звичайним способом у вигляді моношарів у модифікованому за методом Дульбекко середовищі Голка (DMEM), що містить 4мМ Glutamax І і доповнене 10% сироваткою плоду корови з видаленим комплементом (dFCS) та антибіотиками. Їх тримають у вологій атмосфері, що містить 5% СО2 і 95% повітря, при температурі 37±0,1°С. Запаси поповнюють раз на тиждень, щоб підтримати безперервний експоненційний ріст. Для проведення досліджень клітини Ісикави кладуть на 96-лункові мікропланшети. Наступного дня середовище міняють на середовище DMEM, яке не містить феноловий червоний і яке містить 5% dFCS та позбавлене ендогенних естрогенів шляхом обробки активованим вугіллям, покритим декстраном. Ще через 24 години середовище обновлюють і до нанесених на планшет клітин додають відповідні контролі і випробувані сполуки, розбавлені відповідним чином за допомогою середовища DMEM, яке не містить естрогену, або індивідуально (естрогенний ефект), або разом з 10-8М Е2 (антиестрогенний ефект) та інкубують впродовж чотирьох днів. Для кожної сполуки діапазон випробуваних концентрацій складає від 1012 Μ до 10-5М, а кінцева концентрація носія не перевищує 0,1%. Після завершення інкубаційного періоду активність APase визначають за методом, який має у 48 своєму складі гідроліз п-нітрофенілфосфату з утворенням п-нітрофенолу при величині рН 9,8 і спектрофотометричне визначення продукту на довжині хвилі 405нм. Коротко кажучи, мікропланшети спочатку двічі споліскують холодним розчином фосфатного буферу, а потім на 15хв. кладуть в умови з температурою мінус 80°С. Після відтаювання при кімнатній температурі впродовж 5-10хв. планшети кладуть на лід і в кожну лунку додають по 50мкл охолодженого льодом розчину, який містить 5мМ пнітрофенілфосфату. Планшетам дають нагрітися до кімнатної температури, щоб стимулювати ферментативний процес (t0). Після завершення інкубаційного періоду, що складає від 15 до 60хв., в кожній лунці на довжині хвилі 405нм вимірюють інтенсивність жовтого кольору, який виникає в результаті утворення п-нітрофенолу, за допомогою мікропланшет-ридера (Wallac, модель 1420 Victor2). Для кожної випробуваної концентрації активність APase, яка має прояв у вигляді поглинання, спочатку виражають у вигляді кратності збільшення порівняно з контролем (FI), а потім у вигляді процента від активності Е2 (10-8), яку приймають за 100%. Будують сигмоподібні криві залежності реакції відповіді від дози і для кожної сполуки розраховують значення ЕС50 (естрогенний ефект) і ІС50 (антиестрогенний ефект). Таблиця 2 Естрогенні та антиестрогенні активності in vitro Сполука Е2 Приклад 23 Приклад 24 Приклад 31 Приклад 35 Приклад 40 Приклад 65 Приклад 66 Приклад 73 Приклад 80 Приклад 81 Приклад 84 Приклад 86 Приклад 93 Естрогенна активність Стандартне ЕС50 (нМ) ± відхилення 0,1 ± 0,05 1695 ± 168 136,3 ± 1,2 30,8 ± 0,5 373,8 ± 43,0 131,9 ± 4,7 51,7 ± 6,2 220,6 ± 14,0 ND ± 147,3 ± 39,9 ND ± 322,5 ± 20 ND ± 123,8 ± 8,9 N 3 4 4 4 3 4 4 4 4 4 4 4 4 4 Антиестрогенна активність Стандартне ІС50 (нМ) ± відхилення ± ND ± ND ± ND ± ND ± ND ± ND ± ND ± ND ± ND ± ND ± ND ± ND ± ± N 1 1 1 1 1 1 1 1 4 1 2 1 1 n=кількість аналізів; ND=не виявлено ; - значення не визначали Проліферативна активність in vitro Проліферативний ефект сполук за цим винаходом оцінюють за клітинною лінією MCF-7 раку молочних залоз людини шляхом вимірювання кількості життєздатних клітин після обробки впродовж 6 днів. Клітини MCF-7 вирощують звичайним способом у вигляді моно шарів у модифікованому за методом Дульбекко середовищі Голка (DMEM), яке містить 4мМ Glutamax і 4,5г/л глюкози і допов нена 5% (об./об.) сироваткою плоду корови з видаленим комплементом (dFCS) та антибіотиками. Клітини кладуть у колби в кількості 2,106 клітин 2 на 75см та інкубують при 37°С у вологій атмосфері, яка містить 5% СО2. Клітини пересіють щотижня, щоб підтримати постійний експоненційний ріст. За сорок вісім годин до початку експерименту середовище над клітинами, які практично досягли стану злиття, міняють на середовище DMEM, яке не містить феноловий червоний і яка містить 5% 49 90280 dFCS та позбавлена стероїдів шляхом обробки активованим вугіллям, покритим декстраном (DCC-DMEM). У день проведення експерименту клітини збирають короткочасною обробкою трипсином і кладуть у середовищі DCC-DMEM на 96лункові планшети із щільністю 4,103 клітин на лунку. Наступного дня середовище обновлюють, додають випробувані сполуки, розбавлені відповідним чином середовищем DMEM, яке не містить естроген, та інкубують впродовж шести днів. Для кожної сполуки діапазон випробуваних концентрацій складає від 10-12Μ до 10-5М, а кінцева концентрація носія не перевищує 0,1% (об./об.). Після завершення інкубаційного періоду проліферацію клітин кількісно оцінюють за вмістом клітинної АТФ, який сигналізує про присутність метаболічно активних клітин. Аналіз АТФ Аналіз, що базується на АТФ-залежній реакції люциферази, дозволяє генерувати люмінесцентний сигнал, який є пропорційним до присутньої кількості АТФ. Оскільки існує лінійна залежність між кількістю АТФ і кількістю присутніх у культурі 50 життєздатних клітин, то люмінесцентний сигнал дозволяє точно оцінити проліферацію клітин (Crouch, S.P.M. et al., J. Immunol. Meth., 1993, 160, 81; Kangas, L. et al., Med. Biol., 1984, 62, 338; Petty, R.D. et al., J. Biolum. Chemilum., 1995, 10, 29). Коротко кажучи, мікропланшети перекидають, щоб декантувати культуральне середовище, і в кожну лунку додають по 100мкл свіжого середовища. Мікропланшети приводять у рівноважний стан при кімнатній температурі впродовж приблизно 30хв. У кожну лунку додають по 100мкл люциферазного реагенту і вміст перемішують впродовж 2хв., щоб стимулювати лізис клітин. Для стабілізування люмінесцентного сигналу планшети інкубують при кімнатній температурі впродовж 10хв. Люмінесценцію реєструють за допомогою мікропланшет-ридера (Wallac, модель 1420 Victor2) і результати виражають як процент від люмінесценції контрольного зразка. Для оцінювання їхньої потенційної проліферативної здатності будують сигмоподібні криві залежності реакції відповіді від дози і для кожної сполуки розраховують значення ЕС50. Таблиця 3 Проліферативна активність ν клітинах MCF-7 Сполука Е2 Приклад 23 Приклад 24 Приклад 31 Приклад 35 Приклад 40 Приклад 65 Приклад 66 Приклад 73 Приклад 80 Приклад 81 Приклад 84 Приклад 86 Приклад 93 ЕС50 (нМ) ± 0,01 376,5 18,5 3,7 58,2 11,5 27,6 25,4 365,1 45,2 634,8 77,9 465,7 16,1 ± ± ± ± ± ± ± ± ± ± ± ± ± ± Стандартне відхилення 0 70,1 1,8 0,7 15,0 2,8 2,0 4,0 126,1 25,6 284,9 4,1 34,0 2,6 Естрогенна активність in vivo Самкам пацюків у препубертатному віці впродовж 3 днів вводять ліки у кількості 3 мг на день на одного пацюка. Наступного дня після введення останньої порції ліків видаляють матки і визначають їх масу. Результати виражають у вигляді % стимулювання маси матки порівняно із введенням носія. Сполуки за прикладами 23, 31, 35, 66, 73, 84, 86 і 93 демонструють помітну селективність для рекомбінантного рецептора людини і виявляють слабкий естрогенний ефект для активності лужної фосфатази в моделі клітин Ісикави. З цієї причини Проліферація клітин Ефект при 10-8Μ (% від Ефект при 10-6Μ (% від n контролю) контролю) 4 211,6 204,7 3 81,7 175,7 3 89,9 142,8 4 138,8 146,3 4 94,4 162,6 4 106,9 151,7 4 123,1 259,5 4 100,3 148,7 4 94,2 133,7 4 109,5 147,2 4 86,8 117,3 4 97,0 285,8 4 85,6 139,4 4 115,8 155,8 вказані сполуки були відібрані для визначення їх естрогенності in vitro. Метою дослідження є тестування вказаних сполук порівняно з тамоксифеном (ТАМ), зі стандартним селективним агоністом ER : DPN або 2,3-біс-(4-гідроксифеніл)пропіонітрилом (Meyers Μ. J., J. Med. Chem., 2001, 44; 24, 42304251) і зі стандартним селективним агоністом ER : PPT або 1,3,5-трис-(4-гідроксифеніл)-4-пропіл-1Нпіразолом (Stauffer S. R., J. Med. Chem., 2000, 43; 4934-4947), коли як стандарт для порівняння використовують 17 -естрадіол (Е2) з пероральною дозою 3мг на день на пацюка. 51 90280 52 Таблиця 4 Естрогенна активність in vitro вибраних сполук Сполука DPN Е2 Приклад 23 Приклад 24 Приклад 31 Приклад 35 Приклад 40 Приклад 65 Приклад 66 Приклад 73 Приклад 80 Приклад 81 Приклад 84 Приклад 86 Приклад 93 РРТ ТАМ % стимулювання порівняно з носієм 358 526 12 101 468 38 41 84 31 52 70 49 24 25 88 96 206 Одержані результати показують, що сполука за прикладом 23 є потенційним лігандом для бета рецептора естрогену, який має слабку in vivo естрогенну активність після перорального введення. Дозозалежна утеротрофічна активність in vivo Самкам пацюків у препубертатному віці впродовж 3 днів перорально вводять ліки у кількості 0,3; 1; 3 або 10мг на день на одного пацюка. На Кількість тварин 8 8 8 8 6 8 8 8 8 8 8 8 8 8 8 6 8 ступного дня після введення останньої порції ліків видаляють матки і визначають їх масу. Результати виражають у вигляді % стимулювання маси матки порівняно з носіями. Як стандарт для порівняння використовують 17 естрадіол (Е2) з пероральною дозою 3мг на день на пацюка. Таблиця 5 Дозозалежна утеротрофічна активність in vivo Сполука Е2 Приклад 23 Приклад 23 Приклад 23 Приклад 23 Дозування (мг надень на пацюка) % стимулювання порівняно з носієм 3 333 0,3 -13 1 -5 3 -4 10 20 Сполука за прикладом 23 була вибрана як потенційно гарний кандидат для лікування естроген залежних захворювань, оскільки вона після перорального введення не має утеротрофічної активності аж до дози 3мг на день на тварину. Ефект сполук на модель "приливів" in vivo Відповідно до Berendsen et al. (Eur. J. Pharmacol., 2003, 482; 329-33) температура шкіри на хвості у пацюків з видаленими яєчниками може слугувати як інструмент для селекції сполук, які є потенційно придатними для лікування "приливів" у жінок у післяклімактеричний період. Метою цього дослідження є оцінювання ефекту сполуки за прикладом 23 впродовж 4 днів на температуру шкіри на хвості у пацюків з видаленими яєчниками. 17 естрадіол, який використовують як стандарт для порівняння, вводять перорально впродовж 13 днів з дозою 1мг на день на пацюка (Watanabe N. et al., 2003). Для проведення досліджень використову Кількість тварин 8 8 8 8 8 ють двадцять самок пацюків IOPS Wistar від компанії Charles River (Франція), маса яких після прибуття складає у діапазоні від 176 до 200г. Пацюків розміщують групами по чотири пацюка у клітки зі сталевої проволоки. Після імплантації телеметричних передатчиків (TA10TA-F40, Data Science International) до кінця досліджень їх розміщують групами по два пацюка у макролонові клітки і підтримують для них режим 14-10 годинного світлого часу/темного часу. Регулярно контролюють стандартні умови утримання вказаних особнів. Тваринам забезпечують вільний доступ до спеціальної дієти, яка не містить естроген, у вигляді гранул Harlan Teklad 2016 від компанії HARLAN. Їм не обмежують доступ до фільтрованої та пом'якшеної водопровідної води. Вода у достатку надходить через автоматичні поїлки у металевих клітках та у пластикових пляшках у макролонових клітках. Потім у пацюків видаляють яєчники і не турбують 53 90280 тварин впродовж принаймні 2 тижнів. Після завершення вказаного періоду гормонального спокою впродовж того самого періоду часу проводять контроль температури шкіри на хвості і потім тварин випадковим чином поділяють на 3 групи залежно від середньої температури. Першу групу складає "контрольна група з видаленими яєчниками", другу групу складає "група естрадіолу" для підтвердження активності естрогену на температуру хвос 54 та, а третю групу складає "група прикладу 23" для тестування впливу вказаної сполуки на температуру. Масу тіла визначають у перший день обробки та у кінці дослідження. Результати виражають у вигляді % стимулювання маси маток порівняно з дією носія. Як стандарт для порівняння використовують 17 естрадіол (Е2) з дозою 3мг на день на пацюка. Таблиця 6 Ефект сполуки за прикладом 23 на температуру шкіри на хвості (TST) у пацюків з видаленими яєчниками TST TST TST Дозування (мг на Зміна у день 1 порівня- Зміна у день 4 порівня- Зміна у день 7 порівнядень на пацюка) но з днем 0 (°С) но з днем 0 (°С) но з днем 0 (°С) Носій -0,6 -0,6 -0,7 Е2 3 -4,8 -3,5 -5,6 Приклад 23 0,3 -0,8 -2,1 -1,9 Сполука Сполука за прикладом 23 знижує температуру шкіри у пацюків з видаленими яєчниками, не маючи шкідливої побічної дії на матки, на відміну від n 4 4 10 активності естрадіолу відносно маси тіла або матки (як указано нижче). Таблиця 7 Ефект сполуки за прикладом 23 на масу тіла і маток через один тиждень після обробки Сполука Носій Е2 Приклад 23 Дозування (мг надень на пацюка) 3 0,3 Маса маток (% збільшення порівняно з носієм) 273 -2,6 Вплив сполук на кістки та параметри серцевосудинної системи in vivo Пацюки з видаленими яєчниками є кращою моделлю для пре клінічного оцінювання нових сполук, які застосовують для запобігання втрати кісткової маси (остеопорозу). У самок пацюків одержаної від Wistar лінії OFA від компанії IFFA CREDO (Франція) видаляють яєчники або імітують проведення операції для одержання контрольної групи. При надходженні пацюків розміщують у підвісних металевих клітках групами по 3-4 тварини на клітину і дають їм у достатку їжу та воду впродовж одного тижня. Через тиждень акліматизації починають проводити денні дозування сполукою, що становить інтерес, або 17 -естрадіолом. У процесі дослідження беруть зразки плазми для проведення аналізу ліпідних параметрів: тригліцеридів, вільного холестерину, повного холестерину, HDL, LDL, VLDL, аполіпопротеїну А і В100; параметрів метаболізму кісток, таких як: DPD, Са2+, колаген типу І і II, фрагментів С-телопептиду; і маркерів ниркових камнів, таких як Са2+ і неорганічний фосфат. Всі аналізи здійснюють відповідно до рекомендацій виробника. Для визначення мінеральної щільності індивідуальних сегментів попереку проводять високо контрастне дослідження попереку або всього тіла методом двоенергетичної рентгеновської абсорб Маси тіла (% збільшення порівняно з носієм) -10 +4,4 N 4 4 10 ціометри; при проведенні вимірювань тварин анестезують за допомогою ізофлурану. Антидепресантна активність сполук Антидепресантна дія естрадіолу була нещодавно встановлена при проведенні досліджень із використанням моделі мишей ER КО. Кріме того, описана локалізація ER у ядрах клітин спинної лінії зрощування у пацюків. Тест "золотого стандарту" на потенційну антидепресантну дію будь-якої сполуки полягає у проведенні тесту примусового плавання, і в цьому експерименті антидепресанти можна відокремити від психостимуляторів, які знижують нерухомість у дозуваннях, що підсилюють загальну активність. Для вивчення передбаченої антидепресантної активності наведених у цьому описі сполук тест примусового плавання проводять згідно з такою процедурою. Тварин розміщують по шість особей на клітку у стандартних умовах утримання колонії з 12 годинним циклом світлого/темного часу і дають у достатку корм і воду. Перед проведенням експериментів їм дають акліматизуватися у колонії принаймні впродовж 7 днів. Для підшкірного введення сполуку за прикладом 23 розчиняють в оливковій олії та розріджують до потрібної концентрації денної дози. Як позитивний контроль внутрішньочеревинно вводять дезипрамін. Дезипрамін розчиняють у бідистильованій воді (10мг/кг). Експерименти проводять через 30хв. після введення ліків, які використовують як 55 90280 позитивний контроль (лише для дезипраміну). Інші сполуки, а саме: естрадіол і сполука за прикладом 23 - щоденно вводять пацюкам підшкірно впродовж 7 днів. Збирання даних здійснюють 8-го дня (через 24 годин після введення останньої ін'єкції) і 9-го дня (через 48 годин після введення естрадіолу або сполуки за прикладом 23) відповідно. Дані, 56 одержані через 24 години після останнього введення, складають "групу тварин, які не зазнали впливу", і ці тварини ніколи раніше не проходили тестування у пристрої. Дані, одержані через 48 годин після останнього введення сполук, складають "групу тренованих тварин". Таблиця 8 Ефект сполуки за прикладом 23 на тривалість стану нерухомості в умовах стресу Сполука Носій Дезипрамін Е2 Приклад 23 Дозування (мг на день на Тварини, які не зазнали впливу Треновані тварини (сек.) пацюка) (сек.) 133,7±28,6 178,1±25,5 30 Не досліджували 2,6±1,5*** 0,007 22,5%±7,1*** 79,2±23,0* 2,8 45,2±15,6* 160,7±44,1 N 11 11 11 11 (дані одержують впродовж 10хв., досліджувані сполуки або дезипрамін порівняно з носієм, р
ДивитисяДодаткова інформація
Назва патенту англійськоюIndazoles, benzisoxazoles and benzisothiazoles and their use as estrogenic agents
Автори англійськоюRondot Benoit, Lafay Jean, Bonnet Paule, Clerc Thierry, Duc Igor, Duranti Eric, Puccio Francois, Shields Jacqueline, Blot Christian, Maillos Philippe
Назва патенту російськоюИндазолы, бензизоксазолы и бензизотиазолы, способ их получения, фармацевтическая композиция и их применение как эстрогенных средств
Автори російськоюРондо Бенуа, Ляфей Жан, Бонне Поль, Клерк Тьерри, Дюк Игор, Дюранти Эрик, Пюссьйо Франсуа, Шилд Жаклин, Бльо Кристиан, Майо Филипп
МПК / Мітки
МПК: C07D 491/06, A61K 31/423, A61K 31/4162, C07D 261/20, A61K 31/416, A61K 31/428, C07D 231/56
Мітки: бензизоксазоли, композиція, застосування, індазоли, одержання, естрогенних, засобів, спосіб, бензізотіазоли, фармацевтична
Код посилання
<a href="https://ua.patents.su/28-90280-indazoli-benzizoksazoli-i-benzizotiazoli-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-kh-zastosuvannya-yak-estrogennikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Індазоли, бензізоксазоли і бензізотіазоли, спосіб їх одержання, фармацевтична композиція та їх застосування як естрогенних засобів</a>
Попередній патент: Стрес-толерантна трансгенна рослина пшениці
Наступний патент: Пристрій і спосіб нанесення покриття у вигляді рідкого покривного матеріалу на ділянку поверхні пластиноподібної заготовки і дошка настилу
Випадковий патент: Спосіб керування рівнями потужності передачі (варіанти), спосіб передачі (варіанти) і пристрій для його здійснення












