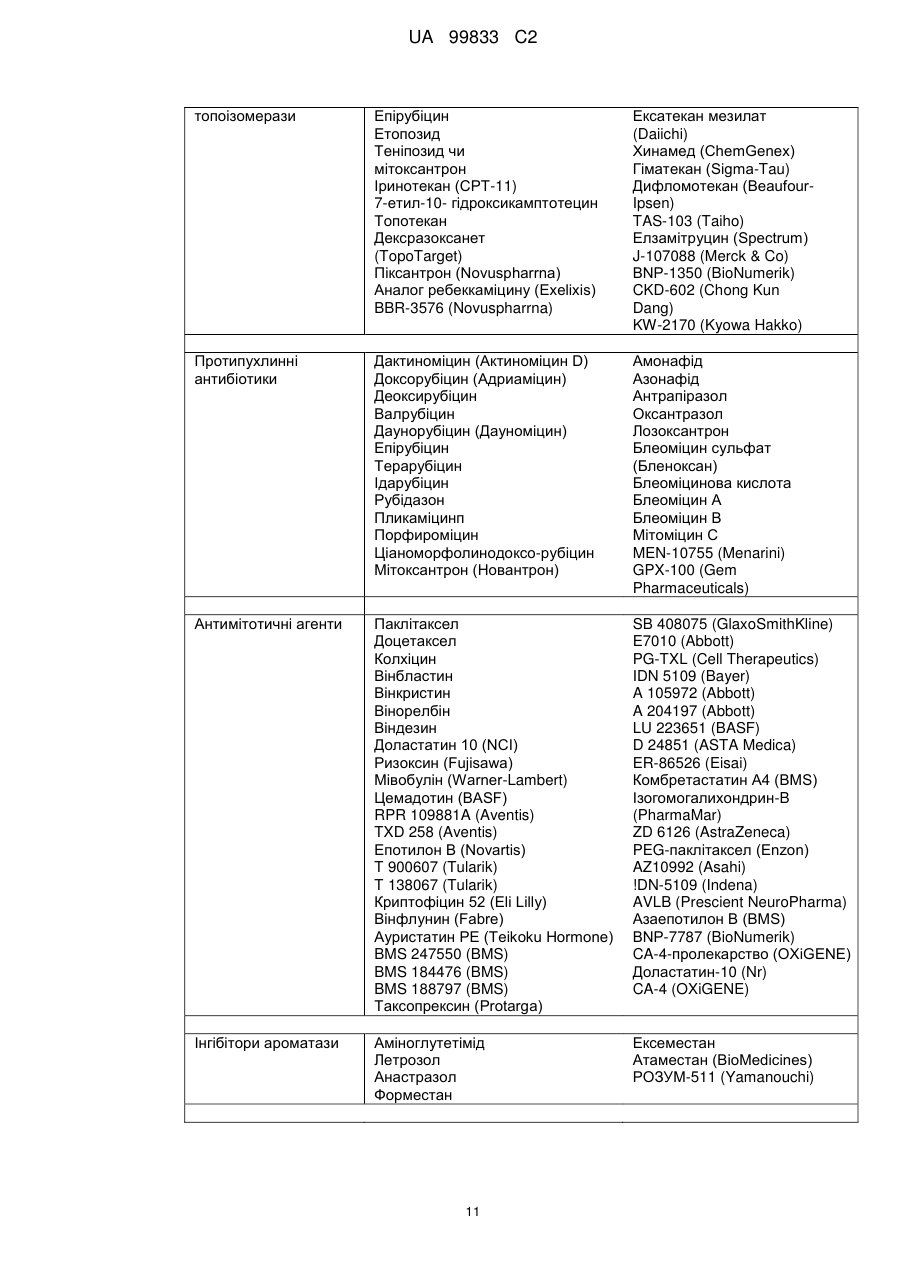
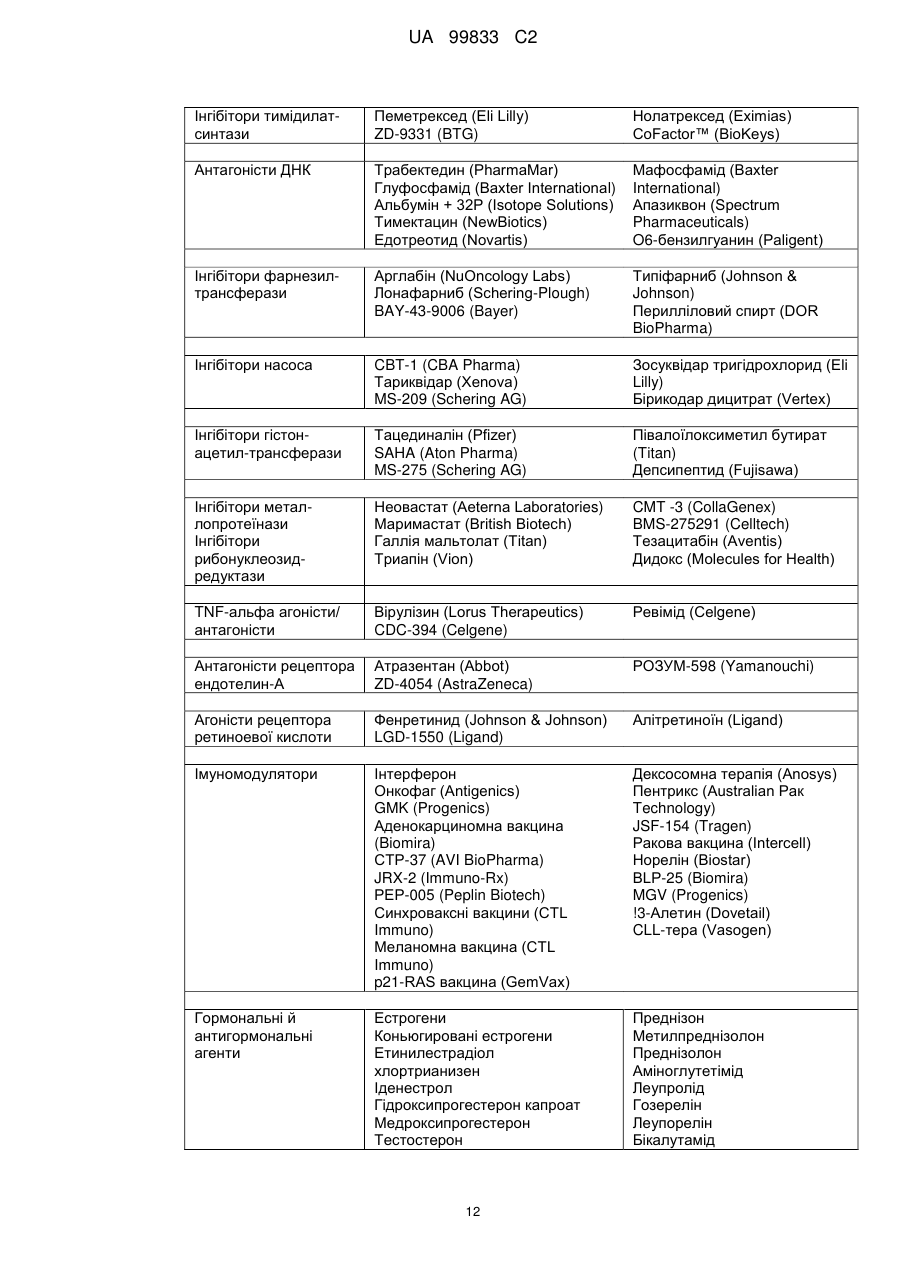
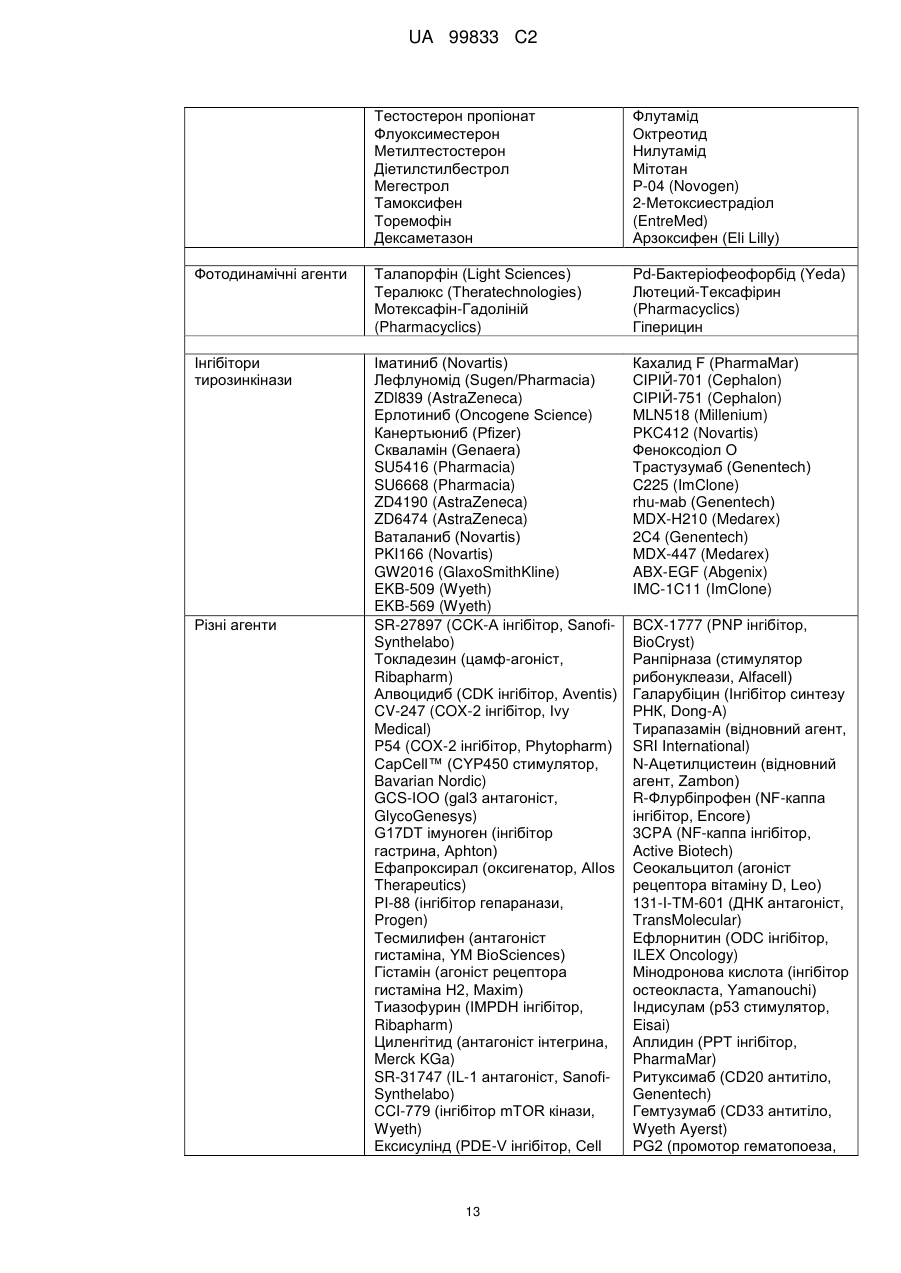
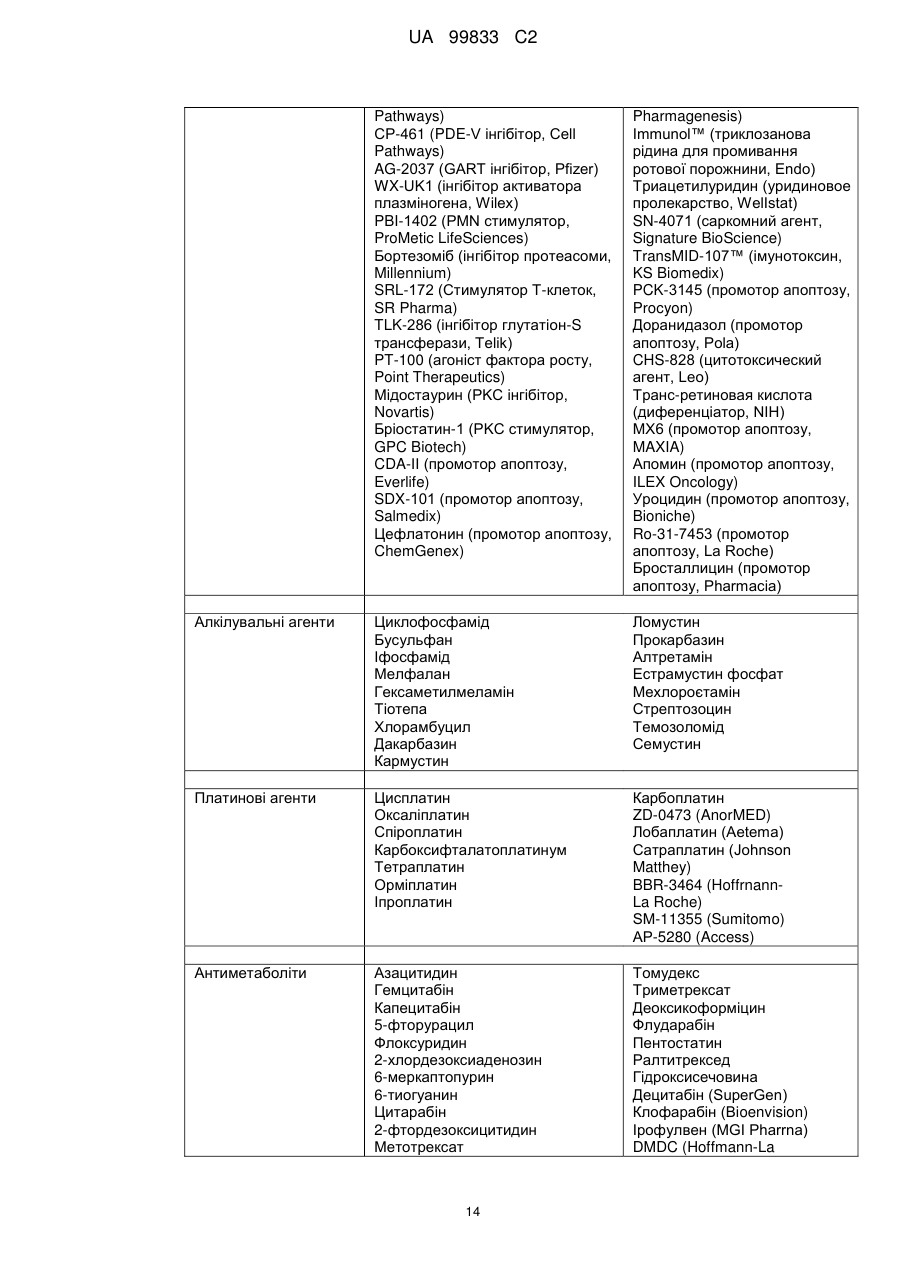
Похідні піримідиніл-піридазинону
Номер патенту: 99833
Опубліковано: 10.10.2012
Автори: Дорш Дітер, Шадт Олівер, Стібер Франк, Блаукат Андрее
Формула / Реферат
1. Сполуки, вибрані з групи
№
Назва і/або структура
"А1"
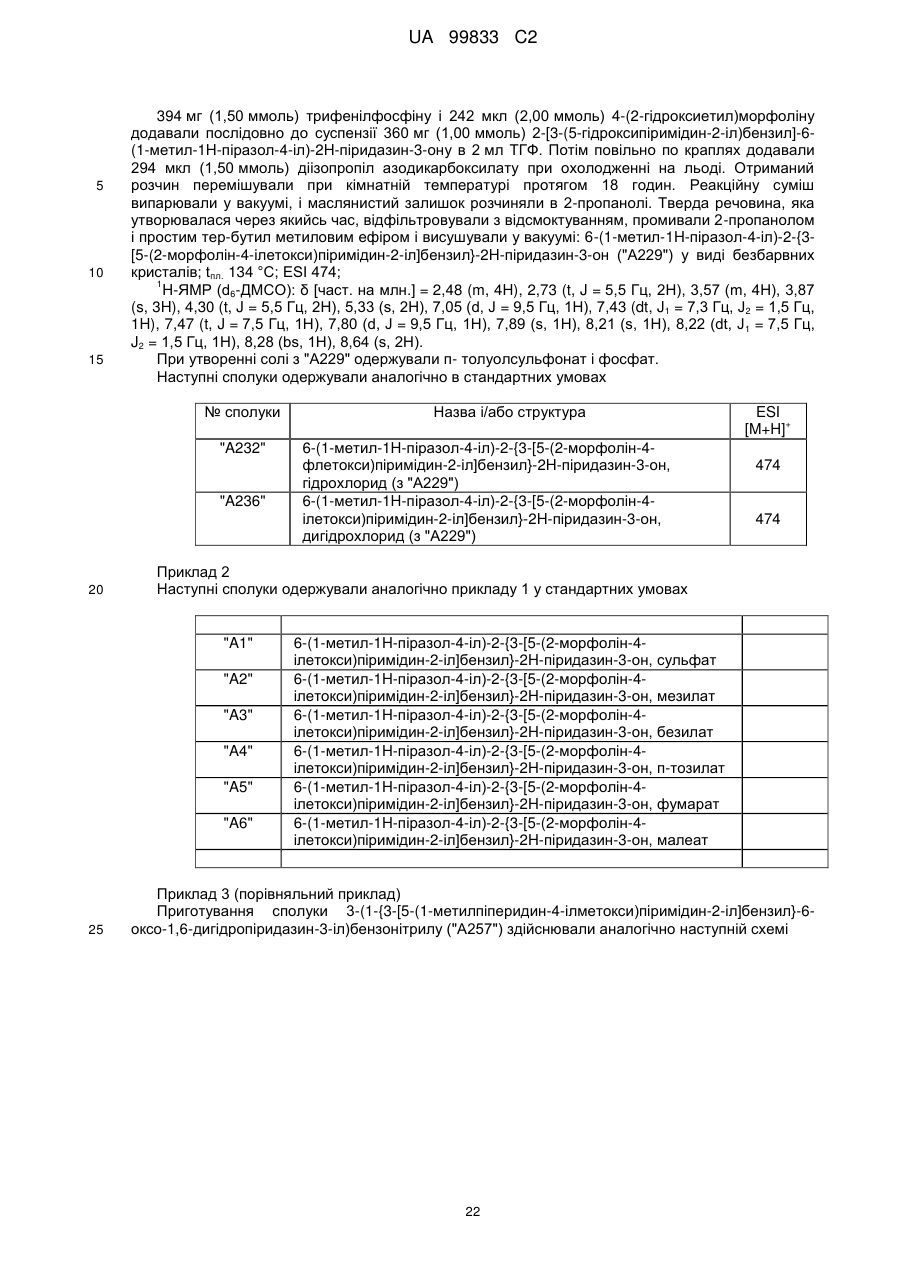
6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2Н-піридазин-3-он, сульфат
"А2"
6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2Н-піридазин-3-он, мезилат
"A3"
6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2Н-піридазин-3-он, безилат
"А4"
6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2Н-піридазин-3-он, п-тозилат
"А5"
6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2Н-піридазин-3-он, фумарат
"А6"
6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2Н-піридазин-3-он, малеат
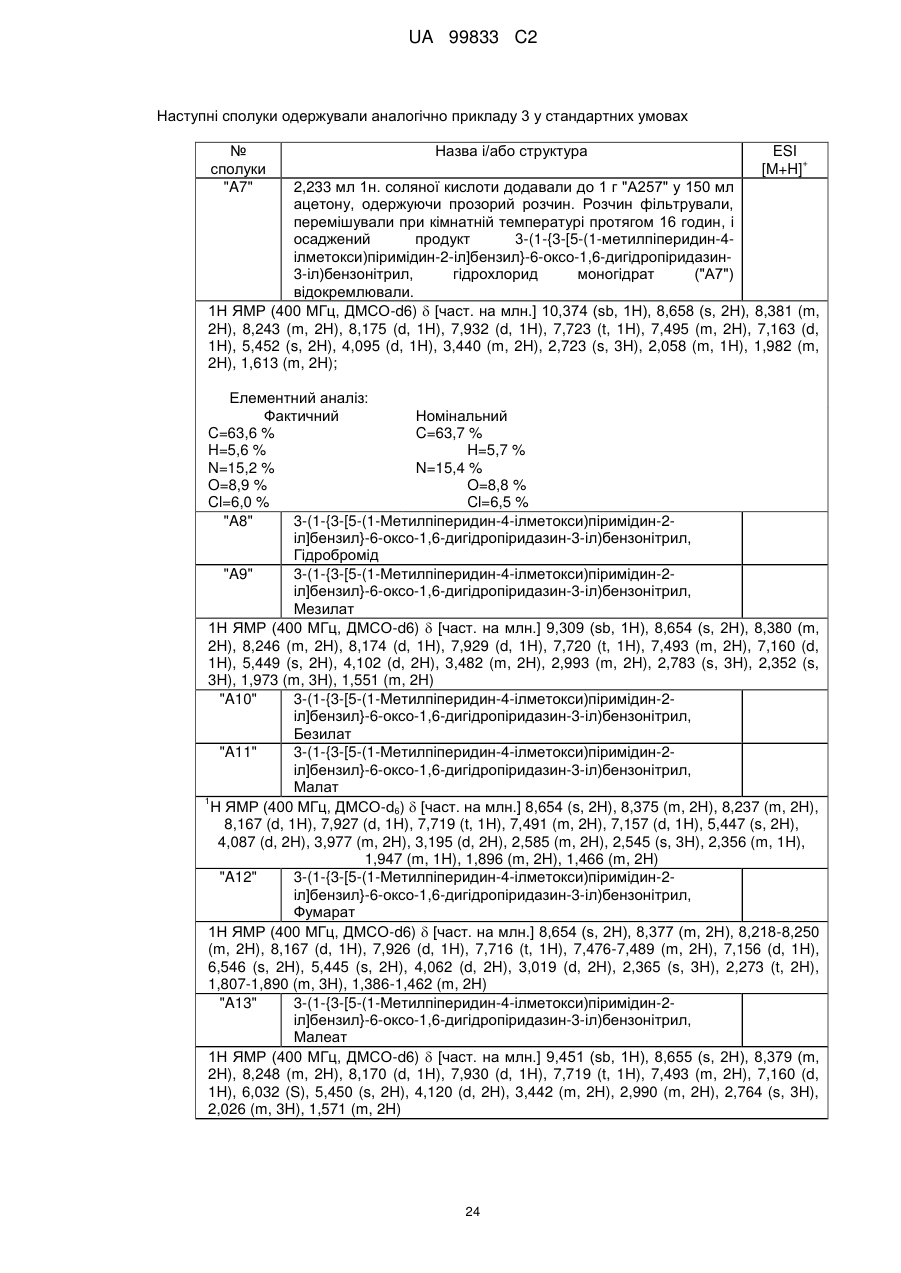
"А7"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, гідрохлориду моногідрат
"А8"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, гідробромід
"А9"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, мезилат
"A10"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, безилат
"A11"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, малат
"A12"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, фумарат
"A13"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, малеат
"A14"
3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, п-тозилат
і їх таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях.
2. Лікарський засіб, що містить щонайменше одну сполуку формули І за п. 1 і/або її таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях, і необов'язково наповнювач і/або допоміжні речовини.
3. Застосування сполук за п. 1 і їх таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування захворювань, при яких відіграє роль інгібування, регуляція і/або модуляція передачі сигналів за допомогою кінази.
4. Застосування за п. 3 сполук за п. 1 і їх таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування захворювань, на які впливає інгібування тирозинкіназ сполуками відповідно до пунктів 1-14.
5. Застосування за п. 3 для приготування лікарського засобу для лікування захворювань, на які впливає інгібування Met-кінази сполуками за п. 1.
6. Застосування за п. 4 або 5, де захворювання, що піддається лікуванню, являє собою солідну пухлину.
7. Застосування за п. 6, де солідна пухлина має походження з групи пухлин плоского епітелію, сечового міхура, шлунка, нирок, голови і шиї, стравоходу, шийки матки, щитовидної залози, кишечнику, печінки, головного мозку, передміхурової залози, сечостатевого тракту, лімфатичної системи, гортані і/або легені.
8. Застосування за п. 6, де солідна пухлина має походження з групи моноцитарного лейкозу, аденокарциноми легені, дрібноклітинного раку легені, раку підшлункової залози, гліобластом і раку молочної залози.
9. Застосування за п. 7, де солідна пухлина має походження з групи аденокарциноми легені, дрібноклітинного раку легені, раку підшлункової залози, гліобластом, раку товстої кишки і раку молочної залози.
10. Застосування за п. 4 чи 5, де захворювання, що піддається лікуванню, являє собою пухлину крові й імунної системи.
11. Застосування за п. 10, де пухлина має походження з групи гострого мієлоїдного лейкозу, хронічного мієлоїдного лейкозу, гострого лімфолейкозу і/або хронічного.
12. Лікарський засіб, що містить щонайменше одну сполуку за п. 1 і/або її таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях, і щонайменше один додатковий активний компонент лікарського засобу.
13. Комплект (набір), що складається з окремих пакетів
(а) ефективної кількості сполуки за п. 1 і/або її таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях,
і
(б) ефективної кількості додаткового активного компонента лікарського засобу.
Текст
Реферат: Сполуки, описані у даному винаході, є інгібіторами тирозинкіназ, і особливо Met-кіназ, та можуть застосовуватися, зокрема, для лікування пухлин. UA 99833 C2 (12) UA 99833 C2 UA 99833 C2 Передумови створення винаходу Об'єктом винаходу є виявлення нових сполук, що володіють коштовними властивостями, зокрема тих, котрі можуть застосовуватися для приготування лікарських засобів. Даний винахід відноситься до сполук та до застосування сполук, які беруть участь у інгібуванні, регуляції та/або модуляції передачі сигналів за допомогою кіназ, особливо тирозинкіназ та/або серин/треонін кіназ, а також до фармацевтичних композицій, що містять зазначені сполуки, і до застосування сполук для лікування захворювань, індукованих кіназою. Зокрема, даний винахід відноситься до сполук і до застосування сполук, що беруть участь у інгібуванні, регуляції та/або модуляції сигналів за допомогою Met кінази. Одним з основних механізмів, за допомогою якого здійснюється клітинна регуляція, є трансдукція позаклітинних сигналів через мембрану, що, у свою чергу, моделює біохімічні шляхи передачі сигналів у клітці. Фосфорілірування білків являє собою один шлях, за допомогою якого внутрішньоклітинні сигнали передаються від молекули до молекули, що в результаті приводить до відповідної реакції в клітці. Ці каскади трансдукції сигналів у високому ступені регулюються і часто перекриваються, мабуть, внаслідок існування багатьох протеїнкіназ, а також фосфатаз. Фосфорілірування білків переважно відбувається в залишках серину, треоніну або тирозину, тому протеїнкінази класифікують за специфічностю їхніх ділянок фосфорілірування, тобто серин/треонінові кінази і тирозинкінази. Оскільки фосфорілірування являє собою широко розповсюджений процес у клітках, а фенотипи кліток значно залежать від активності цих шляхів, то в даний час думають, що багато хворобливих станів та/або захворювань можуть бути викликані або аберантною активацією або функціональними мутаціями в молекулярних компонентах кіназних каскадів. Отже, характеристиці цих білків і сполук, здатних регулювати їхню активність, приділяється пильна увага (для огляду див.: Weinstein-Oppenheimer і ін. Pharma. &. Therap., 2000, 88, 229-279). Роль рецепторної тирозинкінази Met в утворенні і розвитку пухлин у людей і можливість інгібування HGF (фактор росту гепатоцитів)- залежної активації Met описані S. Berthou і ін. у Oncogene, тім 23, № 31, сс. 5387-5393 (2004). Інгібітор SU11274, розкритий у цьому джерелі, пірол-індолінова сполука, потенційно придатна для боротьбі зі злоякісним новоутворенням. Інший інгібітор Met кінази для лікування злоякісного новоутворення описаний J.G. Christensen і ін. у Cancer Res. 2003, 63(21), 7345-55. Подальший інгібітор тирозинкінази для боротьби зі злоякісним новоутворенням описаний H. Hov і ін. у Clinical Cancer Research том 10, 6686-6694 (2004). Сполука PHA-665752, похідна індолу, спрямована проти HGF рецептора c- Met. Крім того, у цьому документі описано, що HGF і Met впливають на злоякісність різних видів рака, таких як, наприклад, множинна мієлома. Тому є бажаним синтезувати невеликі сполуки, які специфічно інгібують, регулюють і/або модулюють передачу сигналів за допомогою тирозинкіназ і/або серин/треонін кіназ, зокрема Met кінази, і це є задачею даного винаходу. Було виявлено, що сполука відповідно до винаходу і їхні солі володіють надзвичайно цінними фармакологічними властивостями, а також гарною переносимістью. Більш докладно, даний винахід відноситься до сполук формули І, що інгібують, регулюють і/або модулюють передачу сигналів Met кіназами, до композицій, що містять ці сполуки, і до способив їхнього застосування для лікування захворювань і станів, індукованих Met кіназою, таких як ангіогенез, рак, утворення, ріст і поширення пухлин, артеріосклероз, захворювання очей, такі як дегенерація жовтої плями, пов'язана зі старінням, утворення нових судин у хоріоїдальній оболонці і діабетична ретинопатія, запальні захворювання, артрит, тромбоз, фіброз, гломерулонефрит, нейродегенерація, псоріаз, рестеноз, загоєння ран, відторгнення трансплантата, порушення обміну речовин і захворювання імунної системи, а також аутоімунні захворювання, цироз, діабет і захворювання кровоносних судин, включаючи нестабільність і проникність, і ін., у ссавців. Солідні пухлини, особливо швидко зростаючі пухлини, можна піддавати лікуванню із застосуванням інгібіторів Met кінази. Такі солідні пухлини включають моноцитарний лейкоз, рак головного мозку, сечостатевого тракту, лімфатичної системи, шлунка, гортані і легені, включаючи аденокарциному легені і дрібноклітинний раклегені. Даний винахід відноситься до способив регуляції, або модуляції інгібування Met кінази для запобігання і/або лікування захворювань, пов'язаних з нерегульованою або порушеною активністю Met кінази. Зокрема, сполуки формули I також можуть застосовуватися для лікування визначених типів злоякісних новоутворень. Крім того, сполуки формули I можуть застосовуватися для забезпечення додаткової або синергетичної дії при визначених існуючих хіміотерапіях при лікуванні злоякісних новоутворень і/або можуть застосовуватися для 1 UA 99833 C2 відновлення ефективності визначених існуючих хіміотерапії і променевої терапії злоякісних новоутворень. Сполуки формули I також можуть застосовуватися для виділення і дослідження активності або експресії Met кінази. Додатково, вони надзвичайно придатні для застосування в діагностичних способах при захворюваннях, пов'язаних з нерегульованою або порушеною активністю Met кінази. Може бути продемонстровано, що сполуки відповідно до винаходу володіють антипроліферативною дією в умовах in vivo на моделі ксенотрансплантованої пухлини. Сполуки відповідно до винаходу вводяться пацієнту з гіперпроліферативним захворюванням, наприклад, для інгібування росту пухлини, для зменшення запалення, пов'язаного з лімфопроліферативним захворюванням, для інгібування відторгнення трансплантата або неврологічного ушкодження в результаті відновлення тканини, і т.п. Ці сполуки придатні для профілактичних або терапевтичних цілей. Як використовується в даному винаході, термін "лікування" застосовується для позначення як запобігання захворювань, так лікування раніше існуючих станів. Запобігання проліферації досягають шляхом уведення сполук відповідно до винаходу до явного розвитку захворювання, наприклад, для запобігання росту пухлин, запобігання метастатичного росту, зменшення рестенозу, пов'язаного із серцево-судинною хірургією і т.п. Альтернативно, сполуки застосовуються для лікування триваючих захворювань шляхом стабілізації або поліпшення клінічних симптомів у пацієнта. Хазяїн або пацієнт може належати до будь-якого виду ссавців, наприклад, такому як, примати, переважно людина; гризуни, включаючи мишей, пацюків і хом'ячків, кролики; коні, корови, собаки, коти і т.п. Тваринні моделі становлять інтерес для експериментальних досліджень, оскільки вони забезпечують модель для лікування захворювання людини. Чутливість визначеної клітки до лікування за допомогою сполук відповідно до винаходу може бути визначена при дослідженнях в умовах in vitro. У загальному випадку культуру кліток поєднують із сполукою відповідно до винаходу при різних концентраціях протягом періоду часу, достатнього для того, щоб дозволити активним речовинам індукувати загибель клітки або інгібувати міграцію, звичайно в інтервалі часу приблизно від однієї години до одного тижня. Для дослідження в умовах in vitro можна використовувати культивовані клітки зі зразка біопсії. Потім підраховують життєздатні клітки, що залишилися після обробки. Доза буде змінюватися в залежності від конкретно застосовуваної сполуки, конкретного захворювання, стану пацієнта і т.п. Звичайно терапевтична доза буде достатньою для істотного зменшення небажаної популяції кліток у тканині-мішені, при підтримці життєздатності пацієнта. Лікування в загальному випадку продовжують доти, поки не буде досягнуто істотного зменшення, наприклад, щонайменше приблизно 50 % зменшення популяції кліток, що представляють інтерес, при цьому лікування можна продовжувати доти, поки власно кажучи в організмі не будуть визначатися небажані клітки. Для ідентифікації шляху сигнальної трансдукції і визначення взаємодій між різними сигнальними шляхами різними вченими були розроблені прийнятні моделі або модельні системи, наприклад, моделі на основі культур кліток (наприклад, Khwaja і ін., EMBO, 1997, 16, 2783-93) і моделі трансгенних тварин (наприклад, White і ін., Oncogene, 2001, 20, 7064-7072). З метою перевірки визначених етапів каскаду для сигнальної трансдукції можна використовувати сполуки, які перешкоджають цьому процесу, для модуляції сигналу (наприклад, Stephens і ін., Biochemical J., 2000, 351, 95-105). Сполуки відповідно до винаходу можуть також бути корисними як реагенти для тестування залежних від кінази шляхів сигнальної трансдукції у тварин і/або на моделях культур кліток, а також на кожному із клінічних розладів, зазначених у даній заявці. Вимір кіназної активності являє собою відомий спосіб, що може здійснити будь-який фахівець у даній галузі. Загальні аналітичні системи для визначення кіназної активності із субстратами, наприклад, гістоном (наприклад, Alessi і ін., FEBS Lett. 1996, 399, 3, стор. 333-338) або основним мієліновим білком описані в літературі (наприклад, Campos-Gonz?lez, R. і Glenney, Jr., J.R. 1992 J. Biol. Chem. 267, стор. 14535). Для ідентифікації інгібіторів кінази доступними є різні аналітичні системи. У дослідженні сцинтиляційної схожості (Sorg і ін., J. of. Biomolecular Screening, 2002, 7, 11-19) і аналізі флешпланшетів вимірюють радіоактивне фосфорілірування білка або пептиду як субстрат з ATP. У присутності інгібіторної сполуки не виявляється ніякого сигналу або виявляється зниження радіоактивного сигналу. Крім того, як аналітичні способи є корисними способи гомогенного переносу енергії флуоресцентного резонансу з розрізненням у часі (HTR-FRET) і флуоресцентної поляризації (FP) (Sills і ін., J. of Biomolecular Screening, 2002, 191-214). 2 UA 99833 C2 В інших нерадіоактивних способах аналізу на основі ELISA використовуються специфічні фосфо-антитіла (фосфо-AB). Фосфо-AB зв'язуються тільки з фосфорі лірованим субстратом. Це зв'язування може бути визначене з використанням вторинного антивівцевого антитіла, кон'югованого з пероксидазою, за допомогою хемілюмінесценції (Ross і ін., 2002, Biochem. J.). Існує багато захворювань, пов'язаних з порушенням регулювання проліферації кліток і клітинної загибелі (апоптозу). Стани, які становлять інтерес, включають, але не обмежуються тільки ними, наступні стани. Сполуки відповідно до винаходу є корисними для лікування різноманітних станів, при яких існує проліферація і/або міграція кліток гладкої мускулатури і/або запальних кліток у шар інтими судин, що приводить до обмеженого потоку крові через цю судину, наприклад, у випадку неоінтимальних оклюзівних ушкоджень. Оклюзівні захворювання трансплантованих судин, які становлять інтерес, включають атеросклероз, коронарне судинне захворювання після трансплантації, стеноз у результаті пересадження вен, перианастомотичний рестеноз у результаті введення протеза, рестеноз після ангіопластики або впровадження стента і т.п. Рівень техніки Інші похідні піридазину описані в якості інгібіторів MET кінази в WO 2007/065518. Тіадіазинони описані в DE19604388, WO2003/037349 WO2007/057093 чи WO2007/057092. Дигідропірідазінони для боротьби зі злоякісним новоутворенням описані в WO 03/037349 A1. Інші пірідазіни для лікування захворювань імунної системи, ішемічних і запальних захворювань відомі з EP 1 043 317 A1 і EP 1 061 077 A1. У EP 0 738 716 A2 і EP 0 711 759 B1 описані інші дигідропірідазінони і пірідазінони як фунгіциди й інсектициди. Інші пірідазінони описані в якості кардіотонічних засобів у US 4,397,854. У JP 57-95964 описані інші пірідазінони. Застосування інших інгібіторів MET для боротьби зі злоякісним новоутворенням описане в WO 2007/075567. Сутність винаходу Винахід відноситься до сполук, вибраним із групи, Винахід також відноситься до оптично активних форм (стереоізомерам), енантіомерам, рацематам, діастереомерам, а також гідратам і сольватам зазначених сполук. Під сольватами сполук мають на увазі адукти молекул інертного розчинника на сполуках, які утворюються завдяки їхній силі взаємного притягання. Сольвати являють собою, наприклад, моногідрати або дигідрати або алкоголяти. Вираз "ефективна кількість" означає кількість лікарського засобу або фармацевтичного активного компонента, який викликає в тканині, системі, тварині або людині біологічну або медичну відповідну реакцію, яку передбачають або бажають одержати, наприклад, дослідник або лікуючий лікар. Додатково, вираз "терапевтично ефективна кількість" означає ту кількість, яка має наступні наслідки в порівнянні з відповідним суб'єктом, який не одержував цієї кількості: поліпшення лікування, вилікування, запобігання або елімінацію захворювання, синдрому, стану, скарги, розладу або побічних дій, або також зменшення прогресування захворювання, скарги або розладу. Вираз "терапевтично ефективна кількість" також охоплює кількості, які ефективні для підвищення нормальної фізіологічної функції. Винахід також відноситься до застосування сумішей сполук формули I, наприклад, сумішей двох діастереомерів, наприклад, у співвідношенні 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 чи 1:1000. Особливо кращими є суміші стереоїзомерних сполук. Фармацевтичні солі й інші форми Сполуки, розкриті у винаході, можуть використовуватися у своїй заключній, несольовій формі. З іншого боку, даний винахід також відноситься до застосування таких сполук у формі їх фармацевтично прийнятних солей, що можуть бути отримані за допомогою різноманітних органічних і неорганічних кислот і основ у відповідності зі способами, добре відомими в даній галузі техніки. Фармацевтично прийнятні форми солей сполук відповідно до винаходу готують, головним чином, при використанні традиційних способів. У випадку, якщо сполука відповідно до винаходу містить групу карбонової кислоти, то його прийнятна сіль може бути утворена за допомогою реакції сполуки з прийнятною основою для одержання відповідної солі приєднання основи. Прикладами таких основ є гідроксиди лужних металів, включаючи гідроксид калію, гідроксид натрію і САА літію; гідроксиди лужно-земельних металів, такі, як гідроксид барію і гідроксид кальцію; алкоксиди лужних металів, наприклад, етанолят калію і пропанолят натрію; а також різні органічні основи, такі, як піперидин, діетаноламін і N-метилглутамін. Сюди також 3 UA 99833 C2 5 10 15 20 25 включені солі сполук алюмінію. Для деяких сполук солі приєднання кислоти можуть бути утворені шляхом обробки зазначених сполук фармацевтично прийнятними органічними і неорганічними кислотами, наприклад, гідрогалогенідами, такими, як гідрохлорид, чи гідробромід гідройодид; іншими мінеральними кислотами, і їх відповідними солями такими, як, сульфат, чи нітрат фосфат, і ін.; і алкіл- і моноарилсульфонатами, такими, як етансульфонат, толуолсульфонат і бензолсульфонат; і іншими органічними кислотами і їх відповідними солями, такими, як ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, саліцилат, аскорбат і ін. Таким чином, фармацевтично прийнятні солі приєднання кислоти сполук включають наступні солі, але не обмежуються тільки ними: ацетат, адипат, альгінат, аргінат, аспартат, бензоат, бензолсульфонат (безилат), бісульфат, бісульфіт, бромід, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропіонат, диглюконат, дигідрофосфат, динітробензоат, додецилсульфат, етансульфонат, фумарат, галактерат (зі слизової кислоти), галактуронат, глюкогептаноат, глюконат, глутамат, гліцерофосфат, гемісукцинат, гемісульфат, гептаноат, гексаноат, гіпурат, гідрохлорид, гідробромід, гідройодид, 2-гідроксиетансульфонат, йодид, ізетіонат, ізобутират, лактат, лактобіонат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногідрофосфат, 2-нафталинсульфонат, нікотинат, нітрат, оксалат, олеат, пальмоат, пектінат, персульфат, фенілацетат, 3-фенілпропіонат, фосфат, фосфонат, фталат. Крім того, основні солі сполук відповідно до винаходу включають, але не обмежуються тільки ними, солі алюмінію, амонію, кальцію, міді, заліза (III), заліза (II), літію, магнію, марганцю (III), марганцю (II), калію, натрію і цинку. Кращими серед перерахованих вище солей є амонійні; солі лужних металів натрію і калію; і солі лужно-земельних металів кальцію і магнію. Солі сполук, які мають походження від фармацевтично прийнятних органічних нетоксичних основ, включають, але не обмежуються тільки ними, солі первинних, вторинних і третинних амінів, заміщених амінів, також включаючи природні заміщені аміни, циклічні аміни й основні іонообмінні смоли, наприклад, аргінін, бетаїн, кофеїн, хлорпрокаїн, холін, N, N'дибензилетилендіамін (бензатин), дициклогексиламін, діетаноламін, діетиламін, 2диетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, Nетилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лідокаїн, лізин, меглумин, N-метил-D-глюкамін, морфолін, піперазин, піперидин, поліаміні смоли, прокаїн, пурини, теобромін, триетаноламін, триетиламін, триметиламін, трипропіламін і трис(гідроксиметил)метиламін (трометамін). Сполуки відповідно до даного винаходу, що включають основні азотоутримуючі групи, можуть бути кватернізіровані за допомогою таких агентів, як C1-C4-алкилгалогениди, наприклад, метил-, етил-, ізопропіл- і трет-бутилхлорид, бромід і йодид; ди-C1-C4-алкилсульфати, наприклад, диметил-, диетил- і диамілсульфат; C10-C18-алкилгалогениди, наприклад, децил-, додецил-, лаурил-, міристил- і стеарилхлорид, бромід і йодид; і арил-C1-C4-алкилгалогениди, наприклад, бензилхлорид і фенетилбромід. Зазначені солі дозволяють одержувати як розчинні у воді, так і розчинні в олії сполуки відповідно до винаходу. Кращі фармацевтичні солі, зазначені вище, включають, але не обмежуються тільки ними, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемісукцинат, гіпурат, гідрохлорид, гідробромід, ізетіонат, манделат, меглумін, нітрат, олеат, фосфонат, півалат, фосфат натрію, стеарат, сульфат, сульфосаліцилат, тартрат, тіомалат, тозилат і трометамін. Кислотно-адитивні солі основних сполук одержують шляхом приведення в контакт форми вільних основ з достатньою кількістю бажаної кислоти для одержання солі традиційним способом. Вільну основу можна регенерувати шляхом приведення в контакт форми солі з основою і виділення вільної основи традиційним способом. Форми вільної основи до деякої міри відрізняються від своїх відповідних форм солей своїми визначеними фізичними властивостями, такими, як розчинність у полярних розчинниках, однак у всьому іншому солі є еквівалентними своїм відповідним формам вільних основ для цілей даного винаходу. Як було зазначено, фармацевтично прийнятні солі приєднання основи сполук утворюються з металами або амінами, такими, як лужні метали і лужно-земельні метали або органічні аміни. Кращі метали являють собою натрій, калій, магній і кальцій. Кращі органічні аміни являють собою N, N'-дибензилетилендіамін, хлорпрокаїн, холін, діетаноламін, етилендіамін, N-метил-Dглюкамін і прокаїн. Солі приєднання основи кислих сполук відповідно до винаходу одержують шляхом приведення в контакт форми вільної кислоти з достатньою кількістю бажаної основи для одержання солі традиційним способом. Форма вільної кислоти може бути регенерована шляхом приведення в контакт форми солі з кислотою і виділення форми вільної кислоти відомим способом. Форми вільної кислоти до деякої міри відрізняються від своїх відповідних форм солей 4 UA 99833 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначеними фізичними властивостями, такими, як розчинність у полярних розчинниках, однак у всьому іншому солі є еквівалентними своїм відповідним формам вільних кислот для цілей даного винаходу. Якщо сполука відповідно до винаходу включає більш, ніж одну групу, яка здатна до утворення фармацевтично прийнятних солей цього типу, то винахід також охоплює складені солі. Приклади типових складових форм солей включають, але не обмежуються тільки ними, бітартрат, діацетат, дифумарат, димеглумін, дифосфат, динатрій і тригідрохлорид. У світлі описаного вище можна побачити, що вираз "фармацевтично прийнятна сіль" у контексті даної заявки призначено для позначення активного компонента, який включає сполуки у формі своєї солі, особливо в тому випадку, якщо зазначена форма солі забезпечує зазначеному активному компоненту поліпшені фармакокінетичні властивості в порівнянні з вільною формою зазначеного активного компонента або будь-якою іншою сіллю зазначеного активного компонента, які використовувалися раніше. Фармацевтично прийнятна форма солі активного компонента може також первісно забезпечувати бажану фармакокінетичну властивість зазначеному активному компоненту, якою він раніше не володів, а також може навіть позитивно впливати на фармакодинаміку зазначеного активного компонента у відношенні його терапевтичної активності в організмі. Винахід, крім того, відноситься до лікарських засобів, що містять щонайменше одну сполуку відповідно до винаходу і/або її таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях, і, необов'язково, наповнювачі і/або допоміжні речовини. Лікарські препарати можуть вводитися у виді дозованих одиниць, які містять заздалегідь установлену кількість активного компонента на дозовану одиницю. Така одиниця може включати, наприклад, від 0,5 мг до 1 г, переважно від 1 мг до 700 мг, більш переважно від 5 мг до 100 мг, сполуки відповідно до винаходу, у залежності від стану, що піддається лікуванню, способу введення, а також віку, ваги тіла і стану пацієнта, або фармацевтичні композиції можуть вводитися у виді дозованих одиниць, які містять заздалегідь установлену кількість активного компонента на дозовану одиницю. Кращими дозованими одиницями лікарських препаратів є ті, котрі містять добову дозу або частину добової дози, як зазначено вище, або відповідну порцію їхнього активного компонента. Лікарські засобі цього типу також можуть бути отримані способом, що добре відомий в галузі фармацевтики. Лікарські препарати можуть адаптуватися для введення за допомогою будь-якого придатного способу, наприклад, шляхом перорального (включаючи букальне або під'язичне), ректального, назального, місцевого (включаючи букальне, під'язичне або трансдермальне), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне або підшкірне) уведення. Такі препарати можуть бути приготовлені за допомогою будь-якого способу, відомого в галузі фармацевтики, наприклад, шляхом об'єднання активного компонента з наповнювачем (ами) чи допоміжним(ими) речовиною(ами). Лікарські препарати, адаптовані для перорального введення, можуть вводитися у виді окремих одиниць, таких як, наприклад, капсули чи таблетки; порошки чи гранули; розчини чи суспензії у водних чи неводних рідинах; харчових пін чи пінистих харчових продуктів; або рідких емульсій олія-в-воді чи рідких емульсій вода-в-олії. Так, наприклад, у випадку перорального введення у виді таблетки або капсули, активний компонент може бути об'єднаний з пероральним, нетоксичним і фармацевтично прийнятним інертним наповнювачем, таким як, наприклад, етанол, гліцерин, вода і т.п. Порошки одержують шляхом здрібнювання сполуки до придатного невеликого розміру і змішування його з фармацевтичним наповнювачем, здрібненим аналогічним способом, таким як, наприклад, харчовий вуглеводень, такий як, наприклад, крохмаль чи маніт. Також можна додавати ароматизатор, консервант, диспергувальна речовина і барвник. Капсули одержують шляхом приготування порошкової суміші, як описано вище, і заповнюють нею желатинові капсули визначеної форми. Перед заповненням капсул до порошкової суміші можна додавати ковзні змазуючи речовини, такі як, наприклад, високо дисперсна кремнієва кислота, тальк, стеарат магнію, стеарат кальцію або поліетиленгліколь у твердій формі. Для поліпшення приступності лікарського засобу, укладеного в капсулу, також можна додавати дезінтегрувальну речовину або солюбілізатор, такий як, наприклад, агар-агар, карбонат кальцію чи карбонат натрію. Додатково, якщо це є бажаним чи необхідним, у суміш також можна додавати придатні зв'язуючі, речовини, що змазують, дезінтегратори, а також барвники. Придатними зв'язуючами є крохмаль, желатин, природні цукри, такі як, наприклад, глюкоза або бета-лактоза, підсолоджувачі, приготовлені з кукурудзи, природних і синтетичних гум, такі як, наприклад, аравійська камедь, трагакантова камедь або альгінат натрію, карбоксиметилцелюлоза, 5 UA 99833 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліетиленгліколь, воски і т.п. Змащувальні речовини, які можуть застосовуватися в таких дозованих формах, включають олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію і т.п. Дезінтегратори включають, але не обмежуються тільки ними, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь і т.п. Лікарські засобі у виді таблеток одержують, наприклад, шляхом приготування порошкової суміші, гранулювання або сухого пресування суміші, додавання змащувальної речовини і дезінтегратора і пресування отриманої суміші в таблетки. Порошкову суміш готують шляхом змішування сполуки, здрібненої придатним чином, з розріджувачем або основою, як описано вище, і необов'язково зі зв'язуючим, таким як, наприклад, карбоксиметилцелюлоза, альгінат, желатин чи полівінілпіролідон, сповільнювачем розчинення, таким як, наприклад, парафін, підсилювачем поглинання, таким як, наприклад, четвертинна сіль, і/або абсорбентом, таким як, наприклад, бентоніт, каолін чи дикальційфосфат. Порошкову суміш можна гранулювати шляхом змочування зі зв'язуючем, таким як, наприклад, сироп, крохмальна паста, слиз акації чи розчини целюлози або полімерних речовин і пресування її через сито. Як альтернативу грануляції, порошкову суміш можна пропускати через таблетувальну машину, одержуючи шматки неправильної форми, які розпадаються, утворюючи гранули. Гранули можна замаслювати шляхом додавання стеаринової кислоти, стеарата, тальку чи мінеральної олії для запобігання злипання в таблетувальній ливарній формі. Після цього змазану суміш спресовують, одержуючи таблетки. Сполуки відповідно до винаходу також можна поєднувати із сипучим інертним наповнювачем і потім піддавати прямому пресуванню, одержуючи таблетки без здійснення стадій грануляції або сухого пресування. Таблетки також можна покривати прозорим чи світлонепроникним захисним шаром, що складається із шелакового шару, що запечатує, шару цукру або полімерної речовини і глянсового шару воску. До цих покрить також можна додавати барвники для можливості розрізнення між різними дозовуваними одиницями. Рідини для перорального введення, такі як, наприклад, розчин, сиропи й еліксири, можуть бути приготовлені у виді дозовуваних одиниць таким чином, щоб вони містили заздалегідь установлену кількість сполуки. Сиропи можуть бути отримані шляхом розчинення сполуки у водяному розчині з придатним ароматизатором, тоді як еліксири готують із застосуванням нетоксичного спиртового наповнювача. Суспензії можуть бути приготовлені шляхом диспергування сполуки в нетоксичному наповнювачі. Також можна додавати солюбілізатори і емульгатори, такі як, наприклад, етоксиловані ізостеарилові спирти і поліоксіетиленові ефіри сорбіту, консерванти, ароматичні добавки, такі як, наприклад, олія м'яти перцевої, чи натуральні замінники цукру чи сахарин, чи інші штучні замінники цукру і т.п. Лікарські препарати для перорального введення у виді дозованих одиниць можуть бути інкапсульовані в мікрокапсули, якщо це є бажаним. Також лікарський препарат може бути приготовлений таким чином, щоб пролонгувати або сповільнити вивільнення, наприклад, шляхом застосування покрить або закладання необхідної речовини в полімери, віск і т.п. Сполуки відповідно до винаходу і їхні солі, сольвати і фізіологічно функціональні похідні також можуть вводитися у виді ліпосомних систем доставки, таких як, наприклад, невеликі одношарові пухирці, великі одношарові пухирці і багатошарові пухирці. Ліпосоми можуть бути утворені за допомогою різних фосфоліпідів, таких як, наприклад, холестерин, стеариламін чи фосфатідихоліни. Сполуки відповідно до винаходу і їхні солі, сольвати і фізіологічно функціональні похідні також можуть доставлятися за допомогою моноклональних антитіл як індивідуальних носіїв, до яких приєднані молекули сполуки. Сполуки також можуть бути з'єднані з розчинними полімерами в якості нащілюючих носіїв, лікарських засобів. Такими полімерами можуть бути полівінілпіролідон, співполімер пірану, полігідроксипропілметакриламідофенол, полігідроксиетиласпартамідофенол чи поліетиленоксид полілізину, заміщений пальмітоїловими радикалами. Крім того, сполуки можна зв'язувати з біорозкладними полімерами, які придатні для забезпечення контрольованого вивільнення лікарського засобу, наприклад полімолочною кислотою, полі-епсилон-капролактоном, полігідроксимасляною кислотою, поліортоефірами, поліацеталями, полідигідроксипіранами, поліціаноакрилатами і перехресно-перехреснозшитими або амфіпатичними блок-співполімерами гідрогелів. Лікарські препарати, адаптовані для трансдермального введення, можуть вводитися у виді незалежних пластирів для подовженого, тісного контакту з епідермісом реципієнта. Таким чином, наприклад, активний компонент може доставлятися з пластиру шляхом іонофорезу, як в загалі описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтичні композиції, адаптовані для місцевого введення, можуть бути приготовлені у виді мазей, кремів, суспензій, лосьйонів, порошків, розчинів, паст, гелів, спреїв, аерозолій чи олій. 6 UA 99833 C2 5 10 15 20 25 30 35 40 45 50 55 Для лікування очей або інших зовнішніх тканин, наприклад рота і шкіри, переважно застосовуються лікарські препарати у виді місцевої мазі чи крему. Для приготування лікарського препарату у виді мазі активний компонент може застосовуватися з парафіновою або мазевою основою, що змішується з водою. Альтернативно, для одержання крему активний компонент може бути приготовлений з основою для крему типу олія- в- воді або основою вода-в-олії. Лікарські препарати, адаптовані для місцевого введення в очі, включають очні краплі, у яких активний компонент розчинений чи суспендований у придатному носії, переважно у водяному розчиннику. Лікарські препарати, адаптовані для місцевого введення в порожнину рота, включають коржі, пастилки і рідини для полоскання рота. Лікарські препарати, адаптовані для ректального введення, можуть вводитися у виді супозиториїв чи клізм. Лікарські препарати, адаптовані для інтраназального введення, у яких носій являє собою тверду речовину, включають великий порошок, що має розмір часточок, наприклад, в інтервалі 20-500 мікронів, що вводиться шляхом вдихання, тобто шляхом швидкого вдиху через ніс з контейнера, що містить порошок, що тримають біля носа. Придатні лікарські препарати для введення у виді інтраназального аерозолю чи носових крапель з рідиною в якості носія, включають розчини активної речовини в воді або в олії. Лікарські препарати, адаптовані для введення шляхом інгаляції, включають тонкоподрібнені часточки у виді пилу чи туману, які можуть бути отримані за допомогою різних диспергувальних пристроїв під тиском з аерозолями, чи розпилювачами інсуфляторами. Лікарські препарати, адаптовані для вагінального введення, можуть вводитися у виді пессаріїв, тампонів, кремів, гелів, паст, пін чи аерозолів. Лікарські препарати, адаптовані для парентерального введення, включають водні чи неводні стерильні розчини для ін'єкцій, що містять антиоксиданти, буфери, бактеріостатичні речовини і розчинені речовини, за допомогою яких лікарський засіб підтримується ізотонічним стосовно крові реципієнта, що піддається лікуванню; і водні чи неводні стерильні суспензії, які можуть містити суспензійне середовище і загусники. Лікарські препарати можуть уводитися за допомогою ємностей для одноразового чи багаторазового введення, наприклад, запечатаних ампул і флаконів, і зберігатися в ліофілізованому стані, при цьому безпосередньо перед уведенням необхідно тільки додати стерильну рідину-носій, наприклад, воду для ін'єкцій. Розчини і суспензії для ін'єкцій, приготовлені відповідно до рецептури, можуть бути приготовлені зі стерильних порошків, гранул і таблеток. Також є очевидним, що додатково до кращих вищеописаних складових, лікарські препарати також можуть містити інші речовини, які використовуються в даній галузі для конкретних типів лікарських засобів; наприклад, лікарські препарати, придатні для перорального введення, можуть містити ароматизатори. Терапевтично ефективна кількість сполуки відповідно до винаходу залежить від багатьох факторів, включаючи, наприклад, вік і вагу тварини, визначений стан, який необхідно лікувати, і його тяжкість, природу лікарського засобу і спосіб уведення, і в кінцевому рахунку вона може бути визначена лікуючим лікарем чи ветеринаром. Проте, ефективна кількість сполуки відповідно до винаходу для лікування росту пухлин, наприклад, рака ободової кишки чи молочної залози, як правило, знаходиться в інтервалі від 0,1 до 100 мг/кг ваги тіла реципієнта (ссавця) за добу і переважно звичайно знаходиться в інтервалі від 1 до 10 мг/кг ваги тіла за добу. Отже, добова діюча кількість для дорослого ссавця вагою 70 кг звичайно може складати від 70 до 700 мг, причому ця кількість може вводитися у виді окремої дози один раз у день чи звичайно у виді циклів часткових доз (таких як, наприклад, два, три, чотири, п'ять чи шість разів) за день, таким чином, загальна добова доза є аналогічною. Ефективна кількість її солі чи сольвату фізіологічно функціонального похідного може бути визначена у виді частки ефективної кількості сполуки відповідно до винаходу per se. Також можна припустити, що аналогічні дози придатні для лікування інших станів, описаних вище. Крім того, винахід відноситься до лікарських засобів, що містять щонайменше одну сполуку відповідно до винаходу і/або її таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях, і щонайменше один додатковий активний компонент лікарського засобу. Винахід також відноситься до комплекту (набору), що складається з окремих пакетів (a) фективної кількості сполуки відповідно до винаходу і/або його таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях, і (б) фективної кількості додаткового активного компонента лікарського засобу. 7 UA 99833 C2 5 10 15 20 25 30 35 40 45 50 55 Комплект включає придатні ємності, такі як коробки, індивідуальні пляшки, пакети чи ампули. Комплект може включати, наприклад, окремі ампули, кожна з яких містить ефективну кількість сполуки відповідно до винаходу і/або його таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях, і ефективна кількість додаткового активного компонента лікарського засобу в розчиненій чи ліофілізованій формі. Застосування Сполуки згідно із даним винаходом придатні в якості фармацевтично активних компонентів для ссавців, особливо для людей, для лікування захворювань, викликаних тирозинкіназою. Ці захворювання включають проліферацію пухлинних кліток, патологічну неоваскуляризацію (чи ангіогенез), які викликають ріст солідних пухлин, неоваскуляризацію ока (діабетичну ретинопатію, дегенерацію жовтої плями, зв'язану зі старінням і т.п.) і запалення (псоріаз, ревматоїдний артрит і т.п.). Даний винахід охоплює застосування сполук і/або їх фізіологічно прийнятних солей і сольватів для приготування лікарського засобу для лікування або запобігання злоякісного новоутворення. Кращі карциноми для лікування вибирають із групи раку головного мозку, рака сечостатевого тракту, рака лімфатичної системи, рака шлунка, рака гортані і рака легені. Подальшою групою кращих типів рака є моноцитарний лейкоз, аденокарцинома легені, дрібноклітинний рак легені, рак підшлункової залози, гліобластоми і рак молочної залози. Також охоплюється застосування сполук за п. 1 відповідно до винаходу для приготування лікарського засобу для лікування чи запобігання захворювання, у яке залучений ангіогенез. Таке захворювання, у яке залучений ангіогенез, являє собою захворювання очей, таке як васкуляризація сітківки, діабетична ретинопатія, дегенерація жовтої плями, зв'язана зі старінням, і т.п. Застосування сполук відповідно до винаходу і/або їх фізіологічно прийнятних солей і сольватів для приготування лікарського засобу для лікування або запобігання запальних захворювань також підпадає під об'єм даного винаходу. Прикладами таких запальних захворювань є ревматоїдний артрит, псоріаз, контактний дерматит, алергійна реакція уповільненого типу і т.п. Також охоплюється застосування сполук відповідно до винаходу для приготування лікарського засобу для лікування чи запобігання захворювання, індукованого тирозинкіназою, чи стану, індукованого тирозинкіназою, у ссавця, при якому в цьому способи терапевтично ефективну кількість сполуки відповідно до винаходу уводять хворому ссавцю, що потребує такого лікування. Терапевтична кількість змінюється в залежності від конкретного захворювання і легко може бути визначена фахівцем у даній галузі. Даний винахід також охоплює застосування сполук формули I і/або їх фізіологічно прийнятних солей і сольватів для приготування лікарського засобу для лікування чи запобігання васкуляризації сітківки. Способи лікування чи запобігання очних захворювань, таких як діабетична ретинопатія і дегенерація жовтої плями, зв'язана зі старінням, також є частиною винаходу. Застосування для лікування або запобігання запальних захворювань, таких як ревматоїдний артрит, псоріаз, контактний дерматит і алергійна реакція уповільненого типу, а також лікування чи запобігання патологій кісток із групи, що включає остеосаркому, остеоартрит і рахіт, також підпадає під об'єм даного винаходу. Вираз " захворювання або стан, індуковані тирозинкіназою" відноситься до патологічних станів, які залежать від активності однієї чи декількох тирозикіназ. Тирозинкінази безпосередньо чи опосередковано беруть участь у шляхах передачі сигналів різних активностей кліток, включаючи проліферацію, адгезію, міграцію і диференціацію. Захворювання, зв'язані з активністю тирозинкінази, включають проліферацію пухлинних кліток, патологічну неоваскуляризацію, яка стимулює ріст солідних пухлин, неоваскуляризацію ока (діабетичну ретинопатію, дегенерацію жовтої плями, зв'язану зі старінням, і т.п.) і запалення (псоріаз, ревматоїдний артрит і т.п.). Сполуки відповідно до винаходу можуть уводитися пацієнтам для лікування злоякісного новоутворення, особливо швидкозростаючих пухлин. Винахід також відноситься до застосування сполук відповідно до винаходу, і їх таутомерів і стереоізомерів, включаючи їхньої суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування захворювань, при яких відіграє роль інгібування, регуляція і/або модуляція передачі сигналів за допомогою кінази. Перевага в даному винаході віддається Met кіназі. 8 UA 99833 C2 5 10 15 20 25 30 35 40 45 50 55 Кращим є застосування сполук відповідно до винаходу, і їх таутомерів і стереоізомерів, включаючи їхньої суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування захворювань, на які впливає інгібування тирозинкіназ сполуками за п. 1. Особливо кращим є застосування для приготування лікарського засобу для лікування захворювань, на які впливає інгібування met кінази сполуками відповідно до винаходу за п. 1. Найбільш кращим є застосування для лікування захворювання, де захворювання являє собою солідну пухлину. Солідну пухлину переважно вибирають із групи пухлин легені, плоского епітелію, сечового міхура, шлунка, нирок, голови і шиї, стравоходу, шейки матки, щитовидної залози, кишечнику, печінки, головного мозку, предстательної залози, сечостатевого тракту, лімфатичної системи, шлунка і/або гортані. Солідну пухлину також переважно вибирають із групи, що включає аденокарциному легені, дрібноклітинний рак легені, рак підшлункової залози, гліобластоми, рак товстої кишки і рак молочної залози. Крім того, кращим є застосування для лікування пухлини крові й імунної системи, переважно для лікування пухлини, обраної з групи, що включає гострий мієлоїдний лейкоз, хронічний мієлоїдний лейкоз, гострий лімфолейкоз і/або хронічний лімфолейкоз. Описані сполуки відповідно до винаходу можуть вводитися в комбінації з іншими відомими лікарськими засобами, включаючи протиракові засобі. Як використовується в даному винаході, термін "протираковий засіб" відноситься до будь-якого засобу, що вводять пацієнту зі злоякісним новоутворенням для лікування раку. Протипухлинне лікування, описане у винаході, може застосовуватися у виді монотерапії, чи, додатково до сполуки за винаходом, можна також застосовувати звичайні хірургічні методи чи радіотерапію, чи хіміотерапію. Така хіміотерапія може включати один чи кілька наступних класів протипухлинних засобів: (i) антипроліферативні/протипухлинні/ що ушкоджують ДНК лікарські засобі і їхні комбінації, які застосовуються в медичній онкології, такі як алкілувальні засоби (наприклад, цисплатин, карбоплатин, циклофосфамід, азотний іприт, мельфалан, хлорамбуцил, бусульфан і нітрозосечовини); антиметаболіти (наприклад, антифолати, такі як фторпіримідини, такі як 5фторурацил і тегафур, ралтитрексед, метотрексат, арабінозид цитозину, гідроксисечовина і гемцитабін); протипухлинні антибіотики (наприклад, антрациклини, такі як адріаміцин, блеоміцин, доксорубіцин, дауноміцин, епірубіцин, ідарубіцин, мітоміцин-C, дактиноміцин і мітраміцин); антимітотичні засоби (наприклад, алкалоїди барвінку, такі як вінкристин, вінбластин, віндезин і вінорелбін і таксоїди, такі як таксол і таксотер); інгібітори топоїзомерази (наприклад, епіподофілотоксини, такі етопозид і теніпозид, амсакрин, топотекан, іринотекан і камптотецин); і засоби, що впливають на диференціацію кліток (наприклад, ретиноева кислота, що цілком знаходиться в трансі-конфігурації, 13-цис-ретиноева кислота і фенретинид); (ii) цитостатичні засобу, такі як антиестрогени (наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен і йодоксифен), інгібітори рецептора естрогену (наприклад, фульвестрант); антиандрогени (наприклад, бікалутамід, флутамід, нілутамід і ципротерон ацетат), антагоністи LHRH чи агоністи LHRH (наприклад, гозерелін, лейпрорелін і бузерелін), прогестогени (наприклад, мегестрол ацетат), інгібітори ароматази (наприклад, анастрозол, летрозол, воразол і ексеместан) і інгібітори 5-редуктази, такі як фінастерид; (iii) засобу, що інгібують інвазію злоякісних кліток (наприклад, інгібітори металопротеїнази, такі як маримастат, і інгібітори функції рецептора урокіназного активатора плазміногену); (iv) інгібітори дії фактора росту, наприклад, такі інгібітори включають антитіла до фактора росту, антитіла до рецептора фактора росту (наприклад, анти-erbb2 антитіло трастузумаб [Herceptin™] і анти-erbb1 антитіло цетуксимаб [C225]), інгібітори фарнезилтрансферази, інгібітори тирозинкінази й інгібітори серин/треоін кінази, наприклад, інгібітори сімейства фактора росту епідермісу (наприклад, інгібітори EGFR сімейства тирозинкіназ, такі як N-(3-хлор-4фторфеніл)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амін (гефітиніб, АZD1839), N-(3етинилфеніл)-6,7-біс(2-метоксиетокси)хиназолин-4-амін (ерлотиніб, OSI-774) і 6-акриламідо-N(3-хлор-4-фторфеніл)-7-(3-морфолинопропокси)хиназолин-4-амін (CI 1033)), наприклад, інгібітори сімейства фактора росту похідних тромбоцитів і, наприклад, інгібітори сімейства фактора росту гепатоцитів; (v) антиангіогенні речовини, такі як ті, котрі інгібують дію фактора росту ендотелія судин, (наприклад, антитіло до фактора росту кліток ендотелія судин бевацизумаб [Avastin™], сполуки, що описані в опублікованих міжнародних заявках на патент WO 97/22596, WO 97/30035, WO 9 UA 99833 C2 5 10 15 20 97/32856 і WO 98/13354) і сполуки, що діють за іншим механізмом (наприклад, ліномід, інгібітори дії інтегрина v3 і ангіостатин); (vi) речовини, що ушкоджують судини, такі як комбретастатин A4 і сполуки, описані в міжнародних заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 і WO 02/08213; (vii) антизмістова терапія, наприклад, така, що спрямована на перераховані вище мішені, така як ISIS 2503, антизмістова терапія на основі гена ras; (viii) способи генної терапії, включаючи, наприклад, способи заміни аберрантних генів, такі як способи аберації p53 чи аберації BRCA1 чи BRCA2, GDEPT (пролекарствена терапія, спрямована на ген ферменту), способи з використанням деамінази цитозину, тимідинкінази чи бактеріальної нітроредуктази і способи підвищення стійкості пацієнта до хіміотерапії або радіотерапії, такі як генна терапія резистентності до багатьох лікарських засобів; і (ix) способи імунотерапії, включаючи, наприклад, способи підвищення імуногенності пухлинних кліток пацієнта в умовах ex vivo і in vivo, такі як трансфекція цитокинами, такими які інтерлейкин 2, інтерлейкин 4 чи фактор стимуляції колоній гранулоцитів-макрофагів, способи зниження активності T-кліток, способи з використанням трансфектируванних імунних кліток, таких як цитокин-трансфектирування дендритні клітки, способи з використанням цитокинтрансфектируванних ліній пухлинних кліток і способи з використанням анти-ідіотипічних антитіл. Лікарські засобі, приведені нижче в таблиці 1, переважно, але не винятково, комбінують із сполуками формули I. Таблиця 1 Алкілувальні агенти Циклофосфамід Бусульфан Іфосфамід Мелфалан Гексаметилмеламін Тіотепа Хлорамбуцил Дакарбазин Кармустин Ломустин Прокарбазин Алтретамін Естрамустин фосфат Мехлороетамін Стрептозоцин Темозоломід Семустин Платинові агенти Цисплатин Оксаліплатин Спіроплатин Карбоксифталатоплатинум Тетраплатин Орміплатин Іпроплатин Карбоплатин ZD-0473 (AnorMED) Лобаплатин (Aetema) Сатраплатин (Johnson Matthey) BBR-3464 (HoffrnannLa Roche) SМ-11355 (Sumitomo) АР-5280 (Access) Антиметаболіти Азацитидин Гемцитабін Капецитабін 5-фторурацил Флоксуридин 2-хлордезоксиаденозин 6-меркаптопурин 6-тіогуанін Цитарабін 2-фтордезоксицитидин Метотрексат Ідатрексат Томудекс Триметрексат Деоксикоформіцин Флударабін Пентостатин Ралтитрексед Гідроксисечовина Децитабін (SuperGen) Клофарабін (Bioenvision) Ірофулвен (MGI Pharrna) DMDC (Hoffmann-La Roche) Етинілцитидин (Taiho) Інгібітори Амсакрин Рубітекан (SuperGen) 10 UA 99833 C2 топоізомерази Епірубіцин Етопозид Теніпозид чи мітоксантрон Іринотекан (CPT-11) 7-етил-10- гідроксикамптотецин Топотекан Дексразоксанет (TopoTarget) Піксантрон (Novuspharrna) Аналог ребеккаміцину (Exelixis) BBR-3576 (Novuspharrna) Ексатекан мезилат (Daiichi) Хинамед (ChemGenex) Гіматекан (Sigma-Tau) Дифломотекан (BeaufourIpsen) TAS-103 (Taiho) Елзамітруцин (Spectrum) J-107088 (Merck & Co) ВNР-1350 (BioNumerik) CKD-602 (Chong Kun Dang) KW-2170 (Kyowa Hakko) Протипухлинні антибіотики Дактиноміцин (Актиноміцин D) Доксорубіцин (Адриаміцин) Деоксирубіцин Валрубіцин Даунорубіцин (Дауноміцин) Епірубіцин Терарубіцин Ідарубіцин Рубідазон Пликаміцинп Порфироміцин Ціаноморфолинодоксо-рубіцин Мітоксантрон (Новантрон) Амонафід Азонафід Антрапіразол Оксантразол Лозоксантрон Блеоміцин сульфат (Бленоксан) Блеоміцинова кислота Блеоміцин A Блеоміцин B Мітоміцин C MEN-10755 (Menarini) GPX-100 (Gem Pharmaceuticals) Антимітотичні агенти Паклітаксел Доцетаксел Колхіцин Вінбластин Вінкристин Вінорелбін Віндезин Доластатин 10 (NCI) Ризоксин (Fujisawa) Мівобулін (Warner-Lambert) Цемадотин (BASF) RPR 109881A (Aventis) TXD 258 (Aventis) Епотилон B (Novartis) T 900607 (Tularik) T 138067 (Tularik) Криптофіцин 52 (Eli Lilly) Вінфлунин (Fabre) Ауристатин PE (Teikoku Hormone) BMS 247550 (BMS) BMS 184476 (BMS) BMS 188797 (BMS) Таксопрексин (Protarga) SB 408075 (GlaxoSmithKline) E7010 (Abbott) PG-TXL (Cell Therapeutics) IDN 5109 (Bayer) A 105972 (Abbott) A 204197 (Abbott) LU 223651 (BASF) D 24851 (ASTA Medica) ER-86526 (Eisai) Комбретастатин A4 (BMS) Ізогомогалихондрин-B (PharmaMar) ZD 6126 (AstraZeneca) PEG-паклітаксел (Enzon) AZ10992 (Asahi) !DN-5109 (Indena) AVLB (Prescient NeuroPharma) Азаепотилон B (BMS) ВNР-7787 (BioNumerik) CA-4-пролекарство (OXiGENE) Доластатин-10 (Nr) CA-4 (OXiGENE) Інгібітори ароматази Аміноглутетімід Летрозол Анастразол Форместан Ексеместан Атаместан (BioMedicines) РОЗУМ-511 (Yamanouchi) 11 UA 99833 C2 Інгібітори тимідилатсинтази Пеметрексед (Eli Lilly) ZD-9331 (BTG) Нолатрексед (Eximias) CoFactor™ (BioKeys) Антагоністи ДНК Трабектедин (PharmaMar) Глуфосфамід (Baxter International) Альбумін + 32P (Isotope Solutions) Тимектацин (NewBiotics) Едотреотид (Novartis) Мафосфамід (Baxter International) Апазиквон (Spectrum Pharmaceuticals) O6-бензилгуанин (Paligent) Інгібітори фарнезилтрансферази Арглабін (NuOncology Labs) Лонафарниб (Schering-Plough) BAY-43-9006 (Bayer) Типіфарниб (Johnson & Johnson) Перилліловий спирт (DOR BioPharma) Інгібітори насоса CBT-1 (CBA Pharma) Тариквідар (Xenova) MS-209 (Schering AG) Зосуквідар тригідрохлорид (Eli Lilly) Бірикодар дицитрат (Vertex) Інгібітори гістонацетил-трансферази Тацединалін (Pfizer) SAHA (Aton Pharma) MS-275 (Schering AG) Півалоїлоксиметил бутират (Titan) Депсипептид (Fujisawa) Інгібітори металлопротеїнази Інгібітори рибонуклеозидредуктази Неовастат (Aeterna Laboratories) Маримастат (British Biotech) Галлія мальтолат (Titan) Триапін (Vion) CMT -3 (CollaGenex) BMS-275291 (Celltech) Тезацитабін (Aventis) Дидокс (Molecules for Health) TNF-альфа агоністи/ антагоністи Вірулізин (Lorus Therapeutics) CDC-394 (Celgene) Ревімід (Celgene) Антагоністи рецептора ендотелин-А Атразентан (Abbot) ZD-4054 (AstraZeneca) РОЗУМ-598 (Yamanouchi) Агоністи рецептора ретиноевої кислоти Фенретинид (Johnson & Johnson) LGD-1550 (Ligand) Алітретиноїн (Ligand) Імуномодулятори Інтерферон Онкофаг (Antigenics) GMK (Progenics) Аденокарциномна вакцина (Biomira) СTР-37 (AVI BioPharma) JRX-2 (Immuno-Rx) РЕР-005 (Peplin Biotech) Синхроваксні вакцини (CTL Immuno) Меланомна вакцина (CTL Immuno) p21-RAS вакцина (GemVax) Дексосомна терапія (Anosys) Пентрикс (Australian Рак Technology) JSF-154 (Tragen) Ракова вакцина (Intercell) Норелін (Biostar) ВLР-25 (Biomira) MGV (Progenics) !3-Алетин (Dovetail) CLL-тера (Vasogen) Гормональні й антигормональні агенти Естрогени Коньюгировані естрогени Етинилестрадіол хлортрианизен Іденестрол Гідроксипрогестерон капроат Медроксипрогестерон Тестостерон Преднізон Метилпреднізолон Преднізолон Аміноглутетімід Леупролід Гозерелін Леупорелін Бікалутамід 12 UA 99833 C2 Тестостерон пропіонат Флуоксиместерон Метилтестостерон Діетилстилбестрол Мегестрол Тамоксифен Торемофін Дексаметазон Флутамід Октреотид Нилутамід Мітотан Р-04 (Novogen) 2-Метоксиестрадіол (EntreMed) Арзоксифен (Eli Lilly) Фотодинамічні агенти Талапорфін (Light Sciences) Тералюкс (Theratechnologies) Мотексафін-Гадоліній (Pharmacyclics) Pd-Бактеріофеофорбід (Yeda) Лютеций-Тексафірин (Pharmacyclics) Гіперицин Інгібітори тирозинкінази Іматиниб (Novartis) Лефлуномід (Sugen/Pharmacia) ZDl839 (AstraZeneca) Ерлотиниб (Oncogene Science) Канертьюниб (Pfizer) Скваламін (Genaera) SU5416 (Pharmacia) SU6668 (Pharmacia) ZD4190 (AstraZeneca) ZD6474 (AstraZeneca) Ваталаниб (Novartis) PKI166 (Novartis) GW2016 (GlaxoSmithKline) EKB-509 (Wyeth) EKB-569 (Wyeth) SR-27897 (CCK-A інгібітор, SanofiSynthelabo) Токладезин (цамф-агоніст, Ribapharm) Алвоцидиб (CDK інгібітор, Aventis) CV-247 (COX-2 інгібітор, Ivy Medical) P54 (COX-2 інгібітор, Phytopharm) CapCell™ (CYP450 стимулятор, Bavarian Nordic) GCS-IOO (gal3 антагоніст, GlycoGenesys) G17DT імуноген (інгібітор гастрина, Aphton) Ефапроксирал (оксигенатор, AlIos Therapeutics) PI-88 (інгібітор гепаранази, Progen) Тесмилифен (антагоніст гистаміна, YM BioSciences) Гістамін (агоніст рецептора гистаміна Н2, Maxim) Тиазофурин (IMPDH інгібітор, Ribapharm) Циленгітид (антагоніст інтегрина, Merck KGa) SR-31747 (IL-1 антагоніст, SanofiSynthelabo) CCI-779 (інгібітор mTOR кінази, Wyeth) Ексисулінд (PDE-V інгібітор, Cell Кахалид F (PharmaMar) СІРІЙ-701 (Cephalon) СІРІЙ-751 (Cephalon) MLN518 (Millenium) PKC412 (Novartis) Феноксодіол O Трастузумаб (Genentech) C225 (ImClone) rhu-маb (Genentech) MDX-H210 (Medarex) 2C4 (Genentech) MDX-447 (Medarex) ABX-EGF (Abgenix) IMC-1C11 (ImClone) Різні агенти 13 BCX-1777 (PNP інгібітор, BioCryst) Ранпірназа (стимулятор рибонуклеази, Alfacell) Галарубіцин (Інгібітор синтезу РНК, Dong-A) Тирапазамін (відновний агент, SRI International) N-Ацетилцистеин (відновний агент, Zambon) R-Флурбіпрофен (NF-каппа інгібітор, Encore) 3CPA (NF-каппа інгібітор, Active Biotech) Сеокальцитол (агоніст рецептора вітаміну D, Leo) 131-I-TМ-601 (ДНК антагоніст, TransMolecular) Ефлорнитин (ODC інгібітор, ILEX Oncology) Мінодронова кислота (інгібітор остеокласта, Yamanouchi) Індисулам (p53 стимулятор, Eisai) Аплидин (PPT інгібітор, PharmaMar) Ритуксимаб (CD20 антитіло, Genentech) Гемтузумаб (CD33 антитіло, Wyeth Ayerst) PG2 (промотор гематопоеза, UA 99833 C2 Pathways) СР-461 (PDE-V інгібітор, Cell Pathways) AG-2037 (GART інгібітор, Pfizer) WX-UK1 (інгібітор активатора плазміногена, Wilex) PBI-1402 (PMN стимулятор, ProMetic LifeSciences) Бортезоміб (інгібітор протеасоми, Millennium) SRL-172 (Стимулятор Т-клеток, SR Pharma) TLK-286 (інгібітор глутатіон-S трансферази, Telik) PT-100 (агоніст фактора росту, Point Therapeutics) Мідостаурин (PKC інгібітор, Novartis) Бріостатин-1 (PKC стимулятор, GPC Biotech) CDA-II (промотор апоптозу, Everlife) SDX-101 (промотор апоптозу, Salmedix) Цефлатонин (промотор апоптозу, ChemGenex) Pharmagenesis) Immunol™ (триклозанова рідина для промивання ротової порожнини, Endo) Триацетилуридин (уридиновое пролекарство, WelIstat) SN-4071 (саркомний агент, Signature BioScience) TransMID-107™ (імунотоксин, KS Biomedix) PCK-3145 (промотор апоптозу, Procyon) Доранидазол (промотор апоптозу, Pola) CHS-828 (цитотоксический агент, Leo) Транс-ретиновая кислота (диференціатор, NIH) MX6 (промотор апоптозу, MAXIA) Апомин (промотор апоптозу, ILEX Oncology) Уроцидин (промотор апоптозу, Bioniche) Ro-31-7453 (промотор апоптозу, La Roche) Бросталлицин (промотор апоптозу, Pharmacia) Алкілувальні агенти Циклофосфамід Бусульфан Іфосфамід Мелфалан Гексаметилмеламін Тіотепа Хлорамбуцил Дакарбазин Кармустин Ломустин Прокарбазин Алтретамін Естрамустин фосфат Мехлороєтамін Стрептозоцин Темозоломід Семустин Платинові агенти Цисплатин Оксаліплатин Спіроплатин Карбоксифталатоплатинум Тетраплатин Орміплатин Іпроплатин Карбоплатин ZD-0473 (AnorMED) Лобаплатин (Aetema) Сатраплатин (Johnson Matthey) BBR-3464 (HoffrnannLa Roche) SМ-11355 (Sumitomo) АР-5280 (Access) Антиметаболіти Азацитидин Гемцитабін Капецитабін 5-фторурацил Флоксуридин 2-хлордезоксиаденозин 6-меркаптопурин 6-тиогуанин Цитарабін 2-фтордезоксицитидин Метотрексат Томудекс Триметрексат Деоксикоформіцин Флударабін Пентостатин Ралтитрексед Гідроксисечовина Децитабін (SuperGen) Клофарабін (Bioenvision) Ірофулвен (MGI Pharrna) DMDC (Hoffmann-La 14 UA 99833 C2 Ідатрексат Roche) Етинилцитидин (Taiho) Інгібітори топоізомерази Амсакрин Епирубіцин Етопозид Тенипозид чи мітоксантрон Іринотекан (CPT-11) 7-етил-10- гідроксикамптотецин Топотекан Дексразоксанет (TopoTarget) Піксантрон (Novuspharrna) Аналог ребеккаміцину (Exelixis) BBR-3576 (Novuspharrna) Рубітекан (SuperGen) Ексатекан мезилат (Daiichi) Хінамед (ChemGenex) Гіматекан (Sigma-Tau) Дифломотекан (BeaufourIpsen) TAS-103 (Taiho) Елзамітруцин (Spectrum) J-107088 (Merck & Co) ВNР-1350 (BioNumerik) CKD-602 (Chong Kun Dang) KW-2170 (Kyowa Hakko) Протипухлинні антибіотики Дактиноміцин (Актиноміцин D) Доксорубіцин (Адріаміцин) Деоксирубіцин Валрубіцин Даунорубіцин (Дауноміцин) Епірубіцин Терарубіцин Ідарубіцин Рубідазон Пликаміцинп Порфіроміцин Ціаноморфолинодоксо-рубіцин Мітоксантрон (Новантрон) Амонафід Азонафід Антрапіразол Оксантразол Лозоксантрон Блеоміцин сульфат (Бленоксан) Блеоміцинова кислота Блеоміцин A Блеоміцин B Мітоміцин C MEN-10755 (Menarini) GPX-100 (Gem Pharmaceuticals) Антимитотические агенти Паклитаксел Доцетаксел Колхіцин Вінбластин Вінкристин Вінорелбін Віндезин Доластатин 10 (NCI) Ризоксин (Fujisawa) Мивобулин (Warner-Lambert) Цемадотин (BASF) RPR 109881A (Aventis) TXD 258 (Aventis) Епотилон B (Novartis) T 900607 (Tularik) T 138067 (Tularik) Криптофіцин 52 (Eli Lilly) Вінфлунін (Fabre) Ауристатин PE (Teikoku Hormone) BMS 247550 (BMS) BMS 184476 (BMS) BMS 188797 (BMS) Таксопрексин (Protarga) SB 408075 (GlaxoSmithKline) E7010 (Abbott) PG-TXL (Cell Therapeutics) IDN 5109 (Bayer) A 105972 (Abbott) A 204197 (Abbott) LU 223651 (BASF) D 24851 (ASTA Medica) ER-86526 (Eisai) Комбретастатин A4 (BMS) Ізогомогалихондрин-B (PharmaMar) ZD 6126 (AstraZeneca) PEG-паклітаксел (Enzon) AZ10992 (Asahi) !DN-5109 (Indena) AVLB (Prescient NeuroPharma) Азаєпотилон B (BMS) ВNР-7787 (BioNumerik) CA-4-проліки (OXiGENE) Доластатин-10 (Nr) CA-4 (OXiGENE) 15 UA 99833 C2 Інгібітори ароматази Аміноглутетімід Летрозол Анастразол Форместан Ексеместан Атаместан (BioMedicines) РОЗУМ-511 (Yamanouchi) Інгібітори тіміділатсинтази Пеметрексед (Eli Lilly) ZD-9331 (BTG) Нолатрексед (Eximias) CoFactor™ (BioKeys) Антагоністи ДНК Трабектедин (PharmaMar) Глуфосфамід (Baxter International) Альбумін + 32P (Isotope Solutions) Тимектацин (NewBiotics) Едотреотид (Novartis) Мафосфамід (Baxter International) Апазиквон (Spectrum Pharmaceuticals) O6-бензилгуанин (Paligent) Інгібітори фарнезилтрансферази Арглабін (NuOncology Labs) Лонафарниб (Schering-Plough) BAY-43-9006 (Bayer) Типіфарниб (Johnson & Johnson) Перилліловий спирт (DOR BioPharma) Інгібітори насоса CBT-1 (CBA Pharma) Тариквідар (Xenova) MS-209 (Schering AG) Зосуквідар тригідрохлорид (Eli Lilly) Бірикодар дицитрат (Vertex) Інгібітори гістонацетилтрансферази Тацединалін (Pfizer) SAHA (Aton Pharma) MS-275 (Schering AG) Півалоїлоксиметил бутират (Titan) Депсипептид (Fujisawa) Інгібітори металопротеїнази Інгібітори рибонуклеозид-редуктази Неовастат (Aeterna Laboratories) Маримастат (British Biotech) Галлія мальтолат (Titan) Триапін (Vion) CMT -3 (CollaGenex) BMS-275291 (Celltech) Тезацитабін (Aventis) Дидокс (Molecules for Health) TNF-альфа агоністи/ антагоністи Вірулізин (Lorus Therapeutics) CDC-394 (Celgene) Ревімід (Celgene) Антагоністи рецептора ендотелін-А Атразентан (Abbot) ZD-4054 (AstraZeneca) РОЗУМ-598 (Yamanouchi) Агоністи рецептора ретиноевої кислоти Фенретинид (Johnson & Johnson) LGD-1550 (Ligand) Алітретиноїн (Ligand) Імуно модулятори Інтерферон Онкофаг (Antigenics) GMK (Progenics) Аденокарциномна вакцина (Biomira) СTР-37 (AVI BioPharma) JRX-2 (Immuno-Rx) РЕР-005 (Peplin Biotech) Синхроваксні вакцини (CTL Immuno) Меланомна вакцина (CTL Immuno) p21-RAS вакцина (GemVax) Дексосомна терапія (Anosys) Пентрикс (Australian Рак Technology) JSF-154 (Tragen) Ракова вакцина (Intercell) Норелін (Biostar) ВLР-25 (Biomira) MGV (Progenics) !3-Алетин (Dovetail) CLL-тера (Vasogen) 16 UA 99833 C2 Гормональні й антигормональні агенти Естрогени Кон'юговання естрогени Етинілестрадіол хлортрианізен Іденестрол Гідроксипрогестерон капроат Медроксипрогестерон Тестостерон Тестостерон пропіонат Флуоксиместерон Метилтестостерон Діетилстилбестрол Мегестрол Тамоксифен Торемофін Дексаметазон Преднізон Метилпреднізолон Преднізолон Аміноглутетімід Леупролід Гозерелін Леупорелін Бікалутамід Флутамід Октреотид Нілутамід Мітотан Р-04 (Novogen) 2-Метоксіестрадіол (EntreMed) Арзоксифен (Eli Lilly) Фотодинамічні агенти Талапорфін (Light Sciences) Тералюкс (Theratechnologies) Мотексафін-Гадолиний (Pharmacyclics) Pd-Бактеріофеофорбід (Yeda) Лютецій-Тексафірин (Pharmacyclics) Гіперицин Інгібітори тирозин кінази Іматиніб (Novartis) Лефлуномід (Sugen/Pharmacia) ZDl839 (AstraZeneca) Ерлотиниб (Oncogene Science) Канертьюниб (Pfizer) Скваламін (Genaera) SU5416 (Pharmacia) SU6668 (Pharmacia) ZD4190 (AstraZeneca) ZD6474 (AstraZeneca) Ваталаниб (Novartis) PKI166 (Novartis) GW2016 (GlaxoSmithKline) EKB-509 (Wyeth) EKB-569 (Wyeth) SR-27897 (CCK-A інгібітор, SanofiSynthelabo) Токладезин (цамф-агоніст, Ribapharm) Алвоцидиб (CDK інгібітор, Aventis) CV-247 (COX-2 інгібітор, Ivy Medical) P54 (COX-2 інгібітор, Phytopharm) CapCell™ (CYP450 стимулятор, Bavarian Nordic) GCS-IOO (gal3 антагоніст, GlycoGenesys) G17DT імуноген (інгібітор гастрину, Aphton) Ефапроксирал (оксигенатор, AlIos Therapeutics) PI-88 (інгібітор гепаранази, Progen) Тесміліфен (антагоніст гістаміну, YM BioSciences) Гістамін (агоніст рецептора гістаміну Н2, Maxim) Тіазофурин (IMPDH інгібітор, Кахалид F (PharmaMar) СІРІЙ-701 (Cephalon) СІРІЙ-751 (Cephalon) MLN518 (Millenium) PKC412 (Novartis) Феноксодіол O Трастузумаб (Genentech) C225 (ImClone) rhu-маb (Genentech) MDX-H210 (Medarex) 2C4 (Genentech) MDX-447 (Medarex) ABX-EGF (Abgenix) IMC-1C11 (ImClone) Різні агенти 17 BCX-1777 (PNP інгібітор, BioCryst) Ранпірназа (стимулятор рибонуклеази, Alfacell) Галарубіцин (Інгібітор синтезу РНК, Dong-A) Тирапазамін (відновний агент, SRI International) N-Ацетилцистеїн (відновний агент, Zambon) R-Флурбіпрофен (NF-каппа інгібітор, Encore) 3CPA (NF-каппа інгібітор, Active Biotech) Сеокальцитол (агоніст рецептора вітаміну D, Leo) 131-I-TМ-601 (ДНК антагоніст, TransMolecular) Ефлорнітин (ODC інгібітор, ILEX Oncology) Мінодронова кислота (інгібітор остеокласту, Yamanouchi) Індисулам (p53 стимулятор, UA 99833 C2 Ribapharm) Циленгітид (антагоніст інтегрина, Merck KGa) SR-31747 (IL-1 антагоніст, SanofiSynthelabo) CCI-779 (інгібітор mTOR кінази, Wyeth) Ексисулінд (PDE-V інгібітор, Cell Pathways) СР-461 (PDE-V інгібітор, Cell Pathways) AG-2037 (GART інгібітор, Pfizer) WX-UK1 (інгібітор активатора плазміногена, Wilex) PBI-1402 (PMN стимулятор, ProMetic LifeSciences) Бортезоміб (інгібітор протеасоми, Millennium) SRL-172 (Стимулятор Т-клеток, SR Pharma) TLK-286 (інгібітор глутатіон-S трансферази, Telik) PT-100 (агоніст фактора росту, Point Therapeutics) Мідостаурин (PKC інгібітор, Novartis) Бріостатин-1 (PKC стимулятор, GPC Biotech) CDA-II (промотор апоптозу, Everlife) SDX-101 (промотор апоптозу, Salmedix) Цефлатонин (промотор апоптозу, ChemGenex) 5 10 15 20 Eisai) Аплідин (PPT інгібітор, PharmaMar) Ритуксимаб (CD20 антитіло, Genentech) Гемтузумаб (CD33 антитіло, Wyeth Ayerst) PG2 (промотор гематопоезу, Pharmagenesis) Immunol™ (триклозанова рідина для промивання ротової порожнини, Endo) Триацетилуридин (уридинове пролекарство, WelIstat) SN-4071 (саркомний агент, Signature BioScience) TransMID-107™ (імунотоксин, KS Biomedix) PCK-3145 (промотор апоптозу, Procyon) Доранідазол (промотор апоптозу, Pola) CHS-828 (цитотоксичний агент, Leo) Транс-ретинова кислота (диференціатор, NIH) MX6 (промотор апоптозу, MAXIA) Апомін (промотор апоптозу, ILEX Oncology) Уроцидин (промотор апоптозу, Bioniche) Ro-31-7453 (промотор апоптозу, La Roche) Бросталіцин (промотор апоптозу, Pharmacia) Комбіноване лікування цього типу можна здійснювати за допомогою одночасного, послідовного чи окремого дозування окремих компонентів для лікування. У комбінованих продуктах цього типу використовують сполуки відповідно до винаходу. Дослідження Сполуки формули I, описані в прикладах, досліджувалися в аналізах, описаних нижче, і було виявлено, що вони володіють інгібувальною активністю стосовно кінази. З літератури відомі інші дослідження і вони легко можуть бути здійснені фахівцем у даній галузі (див., наприклад, Dhanabal і ін., Cancer Res. 59:189-197; Xin і ін., J. Biol. Chem. 274:9116-9121; Sheu і ін., Anticancer Res. 18:4435-4441; Ausprunk і ін., Dev. Biol. 38:237-248; Gimbrone і ін., J. Natl. Cancer Inst. 52:413427; Nicosia і ін., In Vitro 18:538-549). Дослідження Сполуки формули I, описані в прикладах, досліджувалися в аналізах, описаних нижче, і було виявлено, що вони володіють інгібуючою активністю стосовно кінази. З літератури відомі інші дослідження і вони легко можуть бути здійснені фахівцем у даній галузі (див., наприклад, Dhanabal і ін., Cancer Res. 59:189-197; Xin і ін., J. Biol. Chem. 274:9116-9121; Sheu і ін., Anticancer Res. 18:4435-4441; Ausprunk і ін., Dev. Biol. 38:237-248; Gimbrone і ін., J. Natl. Cancer Inst. 52:413427; Nicosia і ін., In Vitro 18:538-549). Вимір активності Met кінази Згідно даним виробника (Met, активна, upstate, № каталогу 14-526), Met кіназу експресували для одержання білка в клітках комах (Sf21; S. frugiperda) і потім очищали за допомогою аффінної хроматографії у виді "N-кінцевого 6His-міченого" рекомбінантного білка людини в бакуловірусному експресіонному векторі. 18 UA 99833 C2 5 10 15 20 25 30 35 40 45 50 55 60 Активність кінази може бути обмірювана за допомогою різних доступних вимірювальних систем. У дослідженні сцинтиляційної схожості (Sorg і ін., J. of. Biomolecular Screening, 2002, 7, 11-19), аналізі флеш-планшетів чи тесту зв'язування на фільтрі вимірюють радіоактивне 32 фосфорілірування білка або пептиду як субстрат за допомогою радіоактивно міченого ATP ( P33 ATP, P-ATP). У присутності інгібіторної сполуки може бути виявлено зниження радіоактивного сигналу чи відсутність сигналів. Крім того, як методи дослідження є корисними способи гомогенного переносу енергії флуоресцентного резонансу з дозволом у часі (HTR-FRET) і флуоресцентної поляризації (FP) (Sills і ін., J. of Biomolecular Screening, 2002, 191-214). В інших нерадіоактивних способах аналізу на основі ELISA використовуються специфічні фосфо-антитіла (фосфо-AB). Фосфо-AB зв'язуються тільки з фосфорилованим субстратом. Це зв'язування може бути визначене з використанням вторинного антитіла, конъюгуваного з пероксидазою, за допомогою хемілюмінесценції (Ross і ін., 2002, Biochem. J.). Метод флеш-планшетів (Met кіназа) Використовуваними тестуемими планшетами були мікротитрувальні планшети на 96 лунок Flashplate від Perkin Elmer (№ кат. SMP200). Компоненти кіназної реакції, описані нижче, пітетували в планшет для дослідження. Met кіназу і субстрат поли Ala-Glu-Lys-Tyr, (pAGLT, 33 6:2:5:1), інкубували протягом 3 годин при кімнатній температурі з радіоактивно міченим P-ATP у присутності і відсутності тестуемих речовин у загальному об'ємі 100 мкл. Реакцію зупиняли за допомогою 150 мкл 60 мм розчину EDTA. Після інкубування додатково протягом 30 хвилин при кімнатній температурі, супернатанти відфільтровували з відсмоктуванням, і лунки три рази промивали щораз 200 мкл 0,9 % розчину NaCl. Зв'язану радіоактивність у крові вимірювали за допомогою приладу для виміру сцинтиляції (Topcount NXT, Perkin-Elmer). Використовуване дійсне значення складало кіназну реакцію без інгібітору. Це приблизно повинно знаходитися в інтервалі 6000-9000 імп. за хвилину. Використовуване значення фармакологічного нуля являло собою стауроспорин у кінцевій концентрації 0,1 мм. Значення інгібування (IC50) визначали за допомогою RS1_MTS програми. Умови кіназної реакції на лунку: 30 мкл буфера для дослідження 10 мкл тестованого субстрату в буфері для дослідження з 10 % ДMСО 33 10 мкл ATP (кінцева концентрація 1 мкM холодн., 0,35 мкКи P-ATP) 50 мкл суміші Met кіназа/субстрат у буфері для дослідження; (10 нг ферменту/лунку, 50 нг pAGLT/лунку) Використовувані розчини: - Буфер для дослідження: 50 мм HEPES 3 мМ хлорид магнію 3 мкМ ортованадат натрії 3 мм хлорид марганцю (II) 1мМ дитіотреїт (DTT) pН = 7,5 (установлювали за допомогою гідроксиду натрію) - Стоп-розчин: 60 мМ Titriplex III (EDTA) 33 - P-ATP: Perkin-Elmer; - Met кіназа: Upstate, № кат. 14-526, матковий розчин 1 мкг/10 мкл; питома активність 954 ед./мг; - Poly-Ala-Glu-Lys-Tyr, 6:2:5 : 1 : Sigma № кат. P1152 Тестування в умовах in-vivo (фігура 1/1) „ Експериментальна методика: Самки мишей Balb/C (від: Charles River Wiga) одержували у віці 5 тижнів. Їх акліматизували, витримуючи в умовах протягом 7 днів. Після цього кожній миші підшкірно вводили в тазову частину у кількості 4 млн. TPR-Met/NIH3T3 кліток у 100 мкл PBS (без Ca++ і Mg++). Через 5 днів, тварин рандомізували на 3 групи, таким чином, щоб кожна група з 9 мишей мала середній розмір пухлини 110 мкл (інтервал: 55-165). 100 мкл наповнювача (0,25 % метилцелюлоза/ 100 мМ ацетатний буфер, pН 5,5) уводили щодня контрольній групі, і 200 мг/кг "A56" чи "A91", розчиненого в наповнювачі (об'єм приблизно 100 мкл/тварина) уводили щодня піддослідним групам, у кожному випадку за допомогою шлункового зонда. Через 9 днів, у контролі середній об'єм пухлини складав 1530 мкл і дослід закінчували. Виміри об'єму пухлини: Довжину (L) і ширину (B) вимірювали за допомогою штангенциркуля, і об'єм пухлини розраховували відповідно до формули L x B x B/2. Умови утримування: 4 чи 5 тварин у клітці, харчування за допомогою комерційно доступного корму для мишей (Sniff). 19 UA 99833 C2 5 10 15 20 25 30 35 40 45 50 Сполуки "A18" і "A22" мають істотну протипухлинну дією. При указівці вище і нижче, уся температура приведена в градусах Цельсія°C. У наступних прикладах "звичайна обробка" означає, що при необхідності додають воду, pН установлюють, при необхідності, на значення від 2 до 10, у залежності від складу кінцевого продукту, суміш екстрагують етилацетатом чи дихлорметаном, фази розділяють, органічну фазу висушують над сульфатом натрію і випарюють, і залишок очищають за допомогою хроматографії на силікагелі і/або кристалізації. Rf значення на силікагелі; елюент: етилацетат/метанол 9:1. + Мас-спектрометрія (МС): EI (іонізація електронним ударом) M + FAB (бомбардування швидкими атомами) (M+H) + ESI (електророзпилювальна іонізація) (M+H) + APCI-МС (хімічна іонізація при атмосферному тиску - мас-спектрометрія) (M+H) . + Мас-спектрометрія (МС): EI (іонізація електронним ударом) M + FAB (бомбардування швидкими атомами) (M+H) + ESI (електророзпилювальна іонізація) (M+H) + APCI-МС (хімічна іонізація при атмосферному тиску - мас-спектрометрія) (M+H) . ВЕЖХ/МС аналізи здійснювали на колонку 3 µ Silica-Rod з 210-секундним градієнтом від 20 до 100 % вода/ацетонітрил/0,01 % трифтороцтова кислота, при швидкості потоку 2,2 мл/хв., визначення при 220 нм. ВЕЖХ аналізи (Метод A) Колонка: Chromolith RP18e 100*3 мм Швидкість потоку: 2 мл/хв. Розчинник A: H2O+0,1 % трифтороцтової кислоти Розчинник B: ацетонітрил + 0,1 % трифтороцтової кислоти Градієнт 5 хв. 0-4 мін.: 99:1 -> 1:99 4-5 хв.: 1:99-1:99 ВЕЖХ аналізи (Method B) Колонка: Chromolith RP18e 100*3 мм Швидкість потоку: 4 мл/хв. Розчинник A: H2O+0,05 % HCOOH Розчинник B: ацетонітрил + 10 % розчинника A Градієнт 8 хв. 0-1 хв.: 99:1 -> 99:1 1-7 хв.: 99:1-1:99 7-8 хв.: 1:99 -> 1:99 ВЕЖХ аналізи (Метод C) Швидкість потоку: 2 мл/хв. 99:01 - 0:100 вода + 0,1 % (про.) ТФО: ацетонітрил + 0,1 % (про.) ТФО від 0,0 до 0,2 хв.: 99:01 від 0,2 до 3,8 хв.: 99:01→ 0:100 від 3,8 до 4,2 хв.: 0:100 Колонка: Chromolith Performance RP18e; довжина 100 мм, внутрішній діаметр 3 мм, довжина хвилі: 220 нм Час утримання Rt у хвилинах [хв.]. Приклад 1 (порівняльний приклад) Приготування сполук 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2Hпіридазин-3-он ("A229"), 2-[3-(5-бромпіримідин-2-іл)бензил]-6-(1-метил-1H-піразол-4-іл)-2H-піридазин-3-он ("A230") і 2-[3-(5-гідроксипіримідин-2-іл)бензил]-6-(1-метил-1H-піразол-4-іл)-2H-піридазин-3-он ("A231") здійснювали аналогічно наступній схемі 20 UA 99833 C2 O O NH N N N Cl Cs2CO3 N N + ÄÌ ÔÀ Br N N N N N N "A230" O O Br O B B O O N N N PdCl2(PPh3)2 KOAc ÄÌ ÔÀ N N N N N N 5 10 15 20 25 30 O "A231" OH O N PPh3/DIAD TÃÔ B O O O HO N N ï åðáî ðàò í àòðèÿ ÒÃÔ âî äà N N N N N N N O O "A229" N 12,4 г (43,6 ммоль) 5-бром-2-(3-хлорметилфеніл)піримідину і 14,2 г (43,6 ммоль) карбонату цезію додавали до суспензії 7,68 г (43,6 ммоль) 6-(1-метил-1H-піразол-4-іл)-2H-піридазин-3-ону в 90 мл ДМФА, і суміш перемішували при кімнатній температурі на протязі 24 годин. Реакційну суміш додавали до 400 мл води. Отриманий осад відфільтровували з відсмоктуванням, промивали водою і висушували у вакуумі; 2-[3-(5-бромпіримідин-2-іл)бензил]-6-(1-метил-1Hпіразол-4-іл)-2H-піридазин-3-он у виді жовто-коричневих кристалів; tпл. 184 °C; ESI 423, 425. 10,9 г (42,9 г) біс(пінаколато)дибору і 9,72 г (99,0 ммоль) ацетату калію додавали до суспензії 14,0 г (33,0 ммоль) 2-[3-(5-бромпіримідин-2-іл)бензил]-6-(1-метил-1H-піразол-4-іл)-2Hпіридазин-3-ону в 65 мл ДМФА, і суміш нагрівали до 70 °C в атмосфері азоту. Після перемішування протягом 15 хвилин при цій температурі, додавали 695 мг (0,99 ммоль) хлориду біс(трифенілфосфін)палладію(II), і реакційну суміш перемішували при 70 °C в атмосфері азоту протягом 18 годин. Реакційній суміші дозволяли остудитися до кімнатної температури, додавали воду і дихлорметан, суміш фільтрували через кізельгур, і органічну фазу відокремлювали. Органічну фазу висушували над сульфатом натрію, випарювали, і залишок перекристалізовували з 2-пропанолу: 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(4,4,5,5-тетраметил1,3,2-діоксаборолан-2-іл)піримідин-2-іл]бензил}-2H-піридазин-3-он у виді сірих кристалів; tпл.204 °C; 1 H-ЯМР (d6-ДМСО): δ [част. на млн.] = 1,34 (s, 12H), 3,87 (s, 3H), 5,35 (s, 2H), 7,05 (d, J = 9,6 Гц, 1H), 7,52 (m, 2H), 7,80 (d, J = 9,6 Гц, 1H), 7,89 (s, 1H), 8,21 (s, 1H), 8,35 (m, 1H), 8,45 (bs, 1H), 9,01 (s, 2H). 8,50 г (85,1 ммоль) перборату натрію порціями додавали при охолодженні на льоді до суспензії 13,4 г (28,4 ммоль) 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)піримідин-2-іл]бензил}-2H-піридазин-3-ону в 55 мл ТГФ і 55 мл води, і суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш фільтрували через кізельгур з відсмоктуванням. Фільтрат концентрували приблизно до половини вихідного об'єму у вакуумі і доводили до pН 1, використовуючи 2 н. соляну кислоту. Отриманий осад відфільтровували з відсмоктуванням, промивали водою і висушували у вакуумі: 2-[3-(5гідроксипіримідин-2-іл)бензил]-6-(1-метил-1H-піразол-4-іл)-2H-піридазин-3-он у виді світлобежевих кристалів; tпл. 239 °C; ESI 361. 21 UA 99833 C2 5 10 15 394 мг (1,50 ммоль) трифенілфосфіну і 242 мкл (2,00 ммоль) 4-(2-гідроксиетил)морфоліну додавали послідовно до суспензії 360 мг (1,00 ммоль) 2-[3-(5-гідроксипіримідин-2-іл)бензил]-6(1-метил-1H-піразол-4-іл)-2H-піридазин-3-ону в 2 мл ТГФ. Потім повільно по краплях додавали 294 мкл (1,50 ммоль) діізопропіл азодикарбоксилату при охолодженні на льоді. Отриманий розчин перемішували при кімнатній температурі протягом 18 годин. Реакційну суміш випарювали у вакуумі, і маслянистий залишок розчиняли в 2-пропанолі. Тверда речовина, яка утворювалася через якийсь час, відфільтровували з відсмоктуванням, промивали 2-пропанолом і простим тер-бутил метиловим ефіром і висушували у вакуумі: 6-(1-метил-1H-піразол-4-іл)-2-{3[5-(2-морфолін-4-ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он ("A229") у виді безбарвних кристалів; tпл. 134 °C; ESI 474; 1 H-ЯМР (d6-ДМСО): δ [част. на млн.] = 2,48 (m, 4H), 2,73 (t, J = 5,5 Гц, 2H), 3,57 (m, 4H), 3,87 (s, 3H), 4,30 (t, J = 5,5 Гц, 2H), 5,33 (s, 2H), 7,05 (d, J = 9,5 Гц, 1H), 7,43 (dt, J1 = 7,3 Гц, J2 = 1,5 Гц, 1H), 7,47 (t, J = 7,5 Гц, 1H), 7,80 (d, J = 9,5 Гц, 1H), 7,89 (s, 1H), 8,21 (s, 1H), 8,22 (dt, J 1 = 7,5 Гц, J2 = 1,5 Гц, 1H), 8,28 (bs, 1H), 8,64 (s, 2H). При утворенні солі з "A229" одержували п- толуолсульфонат і фосфат. Наступні сполуки одержували аналогічно в стандартних умовах № сполуки "A232" "A236" 20 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4флетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, гідрохлорид (з "A229") 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, дигідрохлорид (з "A229") ESI + [M+H] 474 474 Приклад 2 Наступні сполуки одержували аналогічно прикладу 1 у стандартних умовах "A1" "A2" "A3" "A4" "A5" "A6" 25 Назва і/або структура 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, сульфат 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, мезилат 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, безилат 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, п-тозилат 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, фумарат 6-(1-метил-1H-піразол-4-іл)-2-{3-[5-(2-морфолін-4ілетокси)піримідин-2-іл]бензил}-2H-піридазин-3-он, малеат Приклад 3 (порівняльний приклад) Приготування сполуки 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6оксо-1,6-дигідропіридазин-3-іл)бензонітрилу ("A257") здійснювали аналогічно наступній схемі 22 UA 99833 C2 PPh3/DIAD HO N O O + O N O TÃÔ O N O N N OH O N HO DIBAH N TÃÔ N O O O N O N N NH O N N N PPh3/DIAD TÃÔ "A257" 5 10 15 20 25 30 35 N N O N 17,7 г (67,8 ммоль) трифенілфосфіну додавали до суспензії 13,0 г (56,5 ммоль) метил 3-(5гідроксипіримідин-2-іл)бензоату і 13,4 г (62,1 ммоль) N-Boc-піперидінилметанолу в 115 мл ТГФ, і суміш охолоджували до 5 °C. До суспензії по краплях додавали 13,3 мл (67,8 ммоль) діізопропіл азодикарбоксилату, підтримуючи її при цій температурі протягом 45 хвилин. Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Після цього додатково додавали 22,2 г (84,7 ммоль) трифенілфосфіну і 16,6 мл (84,7 ммоль) діізопропіл азодикарбоксилату. Реакційну суміш перемішували при кімнатній температурі протягом 18 годин і випарювали у вакуумі. Отриману тверду речовину відфільтровували з відсмоктуванням, промивали простим діетиловим ефіром і хроматографували на силікагелевої колонці з дихлорметаном/метанолом у якості елюєнта: тер-бутил 4- [2-(3-метоксикарбонилфеніл)піримідин-5-ілoxyметил]піперидин-1карбоксилат у виді лимонно-жовтих кристалів; tпл. 166 °C; ESI 428. 25 мл (25 ммоль) 1 M розчину гідриду діізобутил алюмінію в ТГФ по краплях додавали в атмосфері азоту до суспензії 1,71 г (3,99 ммоль) тер-бутил 4-[2-(3метоксикарбонилфеніл)піримідин-5-ілoxyметил]піперидин-1-карбоксилату в 20 мл ТГФ. Реакційну суміш перемішували при кімнатній температурі протягом 1 години, і додавали 1 мл насиченого розчину сульфату натрію. Отриманий осад відфільтровували з відсмоктуванням і промивали ТГФ і гарячим 2-пропанолом. Фільтрат у випарювали і перекристалізовували з тербутил метилового ефіру: {3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]феніл}метанол у виді бежевих кристалів; tпл. 175 °C; ESI 314. 264 мг (1,30 ммоль) 3- (6-оксо-1,6-дигідропіридазин-3-іл)бензонітрилу і 397 мг (1,5 ммоль) трифенілфосфіну додавали послідовно до розчину 313 мг (1,00 ммоль) {3-[5-(1-метилпіперидин4-ілметокси)піримідин-2-іл]феніл}метанолу в 2 мл ТГФ. Реакційну суміш охолоджували на крижаній бані, і по краплях додавали 294 мкл (1,5 ммоль) діізопропіл азодикарбоксилату при перемішуванні. Реакційну суміш перемішували при кімнатній температурі протягом 18 годин і випаровували. Залишок хроматографували на силікагелевому стовпчикові з дихлорметаном / метанолом. Фракції, що містять продукт, поєднували, випаровували, залишок розщеплювали з тер-бутил метиловим ефіром, відфільтровували з відсмоктуванням і висушували у вакуумі: 3-(1{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин-3іл)бензонітрил у виді безбарвних кристалів; tпл. 177 °C; ESI 493; 1 H-ЯМР (d6-ДМСО): δ [частий. на млн.] = 1,33 (m, 2H), 1,75 (m, 3H), 1,89 (m, 2H), 2,17 (s, 3H), 2,80 (m, 2H), 4,05 (d, J = 6,1 Гц, 2H), 5,45 (s, 2H), 7,16 (d, J = 10 Гц, 1H), 7,49 (m, 2H), 7,73 (t, J = 7,8 Гц, 1H), 7,93 (d, J = 7,8 Гц, 1H), 8,17 (d, J = 10 Гц, 1H), 8,24 (m, 2H), 8,38 (m, 2H), 8,64 (s, 2H). При утворенні солі з "A257" одержували гемисульфат, цитрат, тартрат, сульфат, сукцинат і гідрохлорид. Приклад 4 23 UA 99833 C2 Наступні сполуки одержували аналогічно прикладу 3 у стандартних умовах № сполуки "A7" Назва і/або структура ESI + [M+H] 2,233 мл 1н. соляної кислоти додавали до 1 г "A257" у 150 мл ацетону, одержуючи прозорий розчин. Розчин фільтрували, перемішували при кімнатній температурі протягом 16 годин, і осаджений продукт 3-(1-{3-[5-(1-метилпіперидин-4ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6-дигідропіридазин3-іл)бензонітрил, гідрохлорид моногідрат ("A7") відокремлювали. 1H ЯМР (400 МГц, ДМСО-d6) [част. на млн.] 10,374 (sb, 1H), 8,658 (s, 2H), 8,381 (m, 2H), 8,243 (m, 2H), 8,175 (d, 1H), 7,932 (d, 1H), 7,723 (t, 1H), 7,495 (m, 2H), 7,163 (d, 1H), 5,452 (s, 2H), 4,095 (d, 1H), 3,440 (m, 2H), 2,723 (s, 3H), 2,058 (m, 1H), 1,982 (m, 2H), 1,613 (m, 2H); Елементний аналіз: Фактичний Номінальний C=63,6 % C=63,7 % H=5,6 % H=5,7 % N=15,2 % N=15,4 % O=8,9 % O=8,8 % Cl=6,0 % Cl=6,5 % "A8" 3-(1-{3-[5-(1-Метилпіперидин-4-ілметокси)піримідин-2іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, Гідробромід "A9" 3-(1-{3-[5-(1-Метилпіперидин-4-ілметокси)піримідин-2іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, Мезилат 1H ЯМР (400 МГц, ДМСО-d6) [част. на млн.] 9,309 (sb, 1H), 8,654 (s, 2H), 8,380 (m, 2H), 8,246 (m, 2H), 8,174 (d, 1H), 7,929 (d, 1H), 7,720 (t, 1H), 7,493 (m, 2H), 7,160 (d, 1H), 5,449 (s, 2H), 4,102 (d, 2H), 3,482 (m, 2H), 2,993 (m, 2H), 2,783 (s, 3H), 2,352 (s, 3H), 1,973 (m, 3H), 1,551 (m, 2H) "A10" 3-(1-{3-[5-(1-Метилпіперидин-4-ілметокси)піримідин-2іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, Безилат "A11" 3-(1-{3-[5-(1-Метилпіперидин-4-ілметокси)піримідин-2іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, Малат 1 H ЯМР (400 МГц, ДМСО-d6) [част. на млн.] 8,654 (s, 2H), 8,375 (m, 2H), 8,237 (m, 2H), 8,167 (d, 1H), 7,927 (d, 1H), 7,719 (t, 1H), 7,491 (m, 2H), 7,157 (d, 1H), 5,447 (s, 2H), 4,087 (d, 2H), 3,977 (m, 2H), 3,195 (d, 2H), 2,585 (m, 2H), 2,545 (s, 3H), 2,356 (m, 1H), 1,947 (m, 1H), 1,896 (m, 2H), 1,466 (m, 2H) "A12" 3-(1-{3-[5-(1-Метилпіперидин-4-ілметокси)піримідин-2іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, Фумарат 1H ЯМР (400 МГц, ДМСО-d6) [част. на млн.] 8,654 (s, 2H), 8,377 (m, 2H), 8,218-8,250 (m, 2H), 8,167 (d, 1H), 7,926 (d, 1H), 7,716 (t, 1H), 7,476-7,489 (m, 2H), 7,156 (d, 1H), 6,546 (s, 2H), 5,445 (s, 2H), 4,062 (d, 2H), 3,019 (d, 2H), 2,365 (s, 3H), 2,273 (t, 2H), 1,807-1,890 (m, 3H), 1,386-1,462 (m, 2H) "A13" 3-(1-{3-[5-(1-Метилпіперидин-4-ілметокси)піримідин-2іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, Малеат 1H ЯМР (400 МГц, ДМСО-d6) [част. на млн.] 9,451 (sb, 1H), 8,655 (s, 2H), 8,379 (m, 2H), 8,248 (m, 2H), 8,170 (d, 1H), 7,930 (d, 1H), 7,719 (t, 1H), 7,493 (m, 2H), 7,160 (d, 1H), 6,032 (S), 5,450 (s, 2H), 4,120 (d, 2H), 3,442 (m, 2H), 2,990 (m, 2H), 2,764 (s, 3H), 2,026 (m, 3H), 1,571 (m, 2H) 24 UA 99833 C2 "A14" 3-(1-{3-[5-(1-Метилпіперидин-4-ілметокси)піримідин-2іл]бензил}-6-оксо-1,6-дигідропіридазин-3-іл)бензонітрил, п-тозилат 1H ЯМР (400 МГц, ДМСО-d6) 9,117 (sb, 1H), 8,651 (s, 2H), 8,375 (m, 2H), 8,240 (m, 2H), 8,171 (d, 1H), 7,929 (d, 1H), 7,719 (t, 1H), 7,486 (m, 4H), 7,158 (d, 1H), 7,109 (d, 2H), 5,448 (s, 2H), 4,106 (sb, 1H), 3,460 (sb, 2H), 2,772 (s, 3H), 2,284 (s, 3H), 1,998 (m, 3H), 1,513 (m, 2H) Фармакологічні дані Таблиця 1 Інгібування Met кінази деякими сполуками відповідно до винаходу № сполуки "A1" "A2" "A3" "A4" "A5" "A6" "A7" "A8" "A9" "A10" "A11" "A12" "A13" "A14" 5 10 15 20 25 30 IC50 (клітинне дослідження) < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM IC50 (дослідження ферменту) < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM < 100 нM Наступні приклади відносяться до лікарських засобів: Приклад А: Флакони для ін'єкцій рН розчину 100 г активного компонента формули I і 5 г Na2HPO4 у 3 л бідистильованої води встановлювали на 6,5, використовуючи 2 н. соляну кислоту, стерилізували фільтрацією, переносили у флакони для ін'єкцій, ліофілізували в стерильних умовах і запечатували в стерильних умовах. Кожен флакон для ін'єкцій містить 5 мг активного компонента. Приклад Б: Супозиторії Суміш 20 г активного компонента формули I розплавляли з 100 г соєвого лецитину і 1400 г кавової олії, розливали в прес-форми і охолоджували. Кожен супозиторій містить 20 мг активного компонента. Приклад В: Розчин Розчин готували з 1 г активного компонента формули I, 9,38 г Na 2PО4 • 2 H2О, 28,48 г Na2HPО4 • 12 H2О и 0,1 г бензалконійхлориду в 940 мл бідистильованої води. pН розчину встановлювали на 6,8 і об'єм розчину доводили до 1 л і стерилізували шляхом опромінення. Цей розчин може використовуватися у формі очних крапель. Приклад Г: Мазь 500 мг активного компонента формули I змішували з 99,5 г вазеліну в асептичних умовах. Приклад Д: Таблетки Суміш 1 кг активного компонента формули I, 4 кг лактози, 1,2 кг картопляні крохмалі, 0,2 кг тальки і 0,1 кг стеарату магнію спресовували для одержання таблеток звичайним способом таким чином, щоб кожна таблетка містила 10 мг активного компонента. Приклад Е: Драже Таблетки спресовували аналогічно прикладу Д и потім покривали звичайним способом покриттям із сахарози, картопляного крохмалю, тальку, трагаканта і барвника. Приклад Ж: Капсули 2 кг активні компоненти формули I поміщали у тверді желатинові капсули звичайним способом таким чином, щоб кожна капсула містила 20 мг активного компонента. 25 UA 99833 C2 Приклад З: Ампули Розчин 1 кг активного компонента формули I у 60 л бідистильованої води стерилізували фільтрацією, переносили в ампули, ліофілізували в стерильних умовах і запечатували в стерильних умовах. Кожна ампула містить 10 мг активного компонента. 5 ФОРМУЛА ВИНАХОДУ 1. Сполуки, вибрані з групи № "А1" "А2" "A3" "А4" "А5" "А6" "А7" "А8" "А9" "A10" "A11" "A12" "A13" "A14" Назва і/або структура 6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2іл]бензил}-2Н-піридазин-3-он, сульфат 6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2іл]бензил}-2Н-піридазин-3-он, мезилат 6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2іл]бензил}-2Н-піридазин-3-он, безилат 6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2іл]бензил}-2Н-піридазин-3-он, п-тозилат 6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2іл]бензил}-2Н-піридазин-3-он, фумарат 6-(1-метил-1Н-піразол-4-іл)-2-{3-[5-(2-морфолін-4-ілетокси)піримідин-2іл]бензил}-2Н-піридазин-3-он, малеат 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, гідрохлориду моногідрат 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, гідробромід 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, мезилат 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, безилат 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, малат 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, фумарат 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, малеат 3-(1-{3-[5-(1-метилпіперидин-4-ілметокси)піримідин-2-іл]бензил}-6-оксо-1,6дигідропіридазин-3-іл)бензонітрил, п-тозилат 10 15 20 25 і їх таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях. 2. Лікарський засіб, що містить щонайменше одну сполуку формули І за п. 1 і/або її таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях, і необов'язково наповнювач і/або допоміжні речовини. 3. Застосування сполук за п. 1 і їх таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування захворювань, при яких відіграє роль інгібування, регуляція і/або модуляція передачі сигналів за допомогою кінази. 4. Застосування за п. 3 сполук за п. 1 і їх таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях, для приготування лікарського засобу для лікування захворювань, на які впливає інгібування тирозинкіназ сполуками відповідно до пунктів 1-14. 5. Застосування за п. 3 для приготування лікарського засобу для лікування захворювань, на які впливає інгібування Met-кінази сполуками за п. 1. 6. Застосування за п. 4 або 5, де захворювання, що піддається лікуванню, являє собою солідну пухлину. 7. Застосування за п. 6, де солідна пухлина має походження з групи пухлин плоского епітелію, сечового міхура, шлунка, нирок, голови і шиї, стравоходу, шийки матки, щитовидної залози, кишечнику, печінки, головного мозку, передміхурової залози, сечостатевого тракту, лімфатичної системи, гортані і/або легені. 26 UA 99833 C2 5 10 15 8. Застосування за п. 6, де солідна пухлина має походження з групи моноцитарного лейкозу, аденокарциноми легені, дрібноклітинного раку легені, раку підшлункової залози, гліобластом і раку молочної залози. 9. Застосування за п. 7, де солідна пухлина має походження з групи аденокарциноми легені, дрібноклітинного раку легені, раку підшлункової залози, гліобластом, раку товстої кишки і раку молочної залози. 10. Застосування за п. 4 чи 5, де захворювання, що піддається лікуванню, являє собою пухлину крові й імунної системи. 11. Застосування за п. 10, де пухлина має походження з групи гострого мієлоїдного лейкозу, хронічного мієлоїдного лейкозу, гострого лімфолейкозу і/або хронічного. 12. Лікарський засіб, що містить щонайменше одну сполуку за п. 1 і/або її таутомери і стереоізомери, включаючи їхні суміші у всіх співвідношеннях, і щонайменше один додатковий активний компонент лікарського засобу. 13. Комплект (набір), що складається з окремих пакетів (а) ефективної кількості сполуки за п. 1 і/або її таутомерів і стереоізомерів, включаючи їхні суміші у всіх співвідношеннях, і (б) ефективної кількості додаткового активного компонента лікарського засобу. Комп‟ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 27
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrimidinyl pyridazinone derivates
Автори англійськоюSchadt, Oliver, Dorsch, Dieter, Stieber, Frank, Blaukat, Andree
Назва патенту російськоюПроизводные пиримидинил-пиридазинона
Автори російськоюШадт Оливер, Дорш Дитер, Дорш Дітер, Стибер Франк, Блаукат Андрее
МПК / Мітки
МПК: C07D 413/14, C07D 403/14, C07D 413/10, C07D 417/10
Мітки: піримідиніл-піридазинону, похідні
Код посилання
<a href="https://ua.patents.su/29-99833-pokhidni-pirimidinil-piridazinonu.html" target="_blank" rel="follow" title="База патентів України">Похідні піримідиніл-піридазинону</a>
Попередній патент: Поповнюваний багатодозовий контейнер для зберігання сипучого продукту, машина для приготування напоїв, система для приготування напоїв (варіанти)
Наступний патент: Сільськогосподарська машина та вузол сошника/загортача
Випадковий патент: Пристрій для гідроструминної очистки від окалини заготовок прокатного стана