Антитромбозні подвійні інгібітори з біотиновою міткою
Номер патенту: 94593
Опубліковано: 25.05.2011
Автори: Нікольсон Чарльз Девід, Де Корт Мартін, ван Боекель Констант Адріан Антон
Формула / Реферат
1. Сполука формули І
олігосахарид-прокладка-антагоніст GpIIb/IIIa (I),
де
олігосахарид є негативно зарядженим олігосахаридним залишком, який містить від 4 до 25 моносахаридних одиниць і заряд якого компенсується позитивно зарядженими контр-іонами, а олігосахаридний залишок походить від олігосахариду, який має (опосередковану АТ-ІІІ) власну анти-Ха активність;
прокладка є зв'язком або суттєво фармакологічно неактивним зв'язуючим залишком; антагоніст GpIIb/IIIa є залишком, що імітує RGD і/або фрагмент K(QA)GD фібриногену і включає карбоксилатний компонент і основний компонент, розташовані у залишку на відстані 10-20 Å один від одного;
або її фармацевтично прийнятна сіль або проліки, або сольват; причому сполука формули І також включає щонайменше один ковалентний зв'язок з біотиновою міткою або її аналогом.
2. Сполука за п. 1, яка відрізняється тим, що прокладка є суттєво фармакологічно неактивним зв'язуючим залишком.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що прокладка має довжину 1-50 атомів.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що прокладка включає щонайменше один елемент -(СН2СН2О)-.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що олігосахарид має від 4 до 16 моносахаридних одиниць.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що олігосахарид є сульфатованим пентасахаридним залишком.
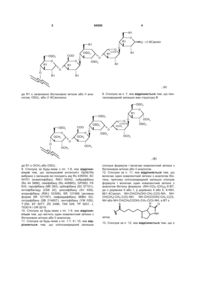
7. Сполука за п. 6, яка відрізняється тим, що пентасахаридний залишок має структуру А
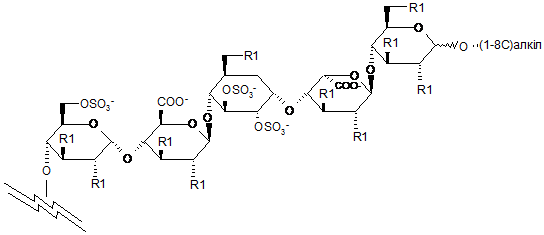 , (A)
, (A)
де R1 є незалежно біотиновою міткою або її аналогом, OSO3- або (1-8С)алкокси.
8. Сполука за п. 7, яка відрізняється тим, що пентасахаридний залишок має структуру В
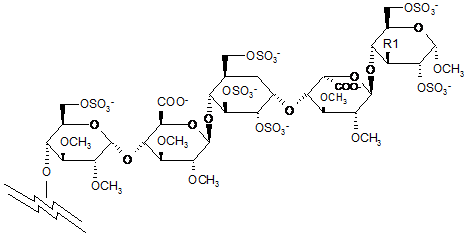 , (В)
, (В)
де R1 є ОСН3 або OSO3-.
9. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що залишковий антагоніст GpIIb/IIIa вибрано з залишків які походять від Ro 435054, SC 54701 (ксемілофібан), RWJ 50042, сибрафібану (Ro 44 3888), лімііфібану (Ro 449883), GPI562, FK 633, тирофібану (МК 383), орбофібану (SC 57101), ептифібатиду (С68 22), роксифібану (XV 459), еларофібану (RWJ 53308), SR 121566 (активна форма SR 121787), лефрадафібану (BІBU 52), лотрафібану (SB 214857), гантофібану (YM 028), Т-250, EF 5077, ZD 2486, ТАК 029, ТР 9201, L 703014 і UR-3216.
10. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що містить один ковалентний зв'язок з біотиновою міткою або її аналогом.
11. Сполука за будь-яким з пп. 1-7, 9 і 10, яка відрізняється тим, що олігосахаридний залишок сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом.
12. Сполука за п. 11, яка відрізняється тим, що включає один ковалентний зв'язок з аналогом біотину, причому олігосахаридний залишок сполуки формули І включає один ковалентний зв'язок з аналогом біотину формули -(NH-CO)n-(CH2)p-X-BT, де n дорівнює 0 або 1, р дорівнює 4 або 5, X=NH, М(1-4С)алкіл, NH-CH(CH2OH)-CH2-C(O)-NH, NH-CH(CH3)-CH2-C(O)-NH, NH-CH(COOH)-CH2-C(O)-NH або NH-CH(CH2COOH)-CH2-C(O)-NH, а ВТ є
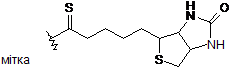 .
.
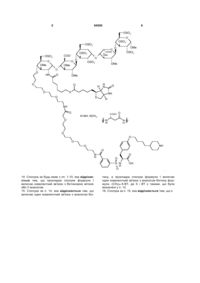
13. Сполука за п. 12, яка відрізняється тим, що є
 .
.
14. Сполука за будь-яким з пп. 1-10, яка відрізняється тим, що прокладка сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом.
15. Сполука за п. 14, яка відрізняється тим, що включає один ковалентний зв'язок з аналогом біотину, а прокладка сполуки формули І включає один ковалентний зв'язок з аналогом біотину формули -(СН2)4-Х-ВТ, де X і ВТ є такими, що були визначені у п. 12.
16. Сполука за п. 15, яка відрізняється тим, що є
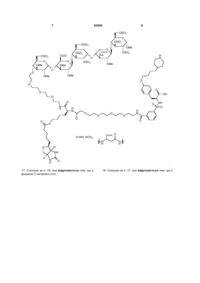
 .
.
17. Сполука за п. 16, яка відрізняється тим, що є формою її натрієвої солі.
18. Сполука за п. 17, яка відрізняється тим, що є
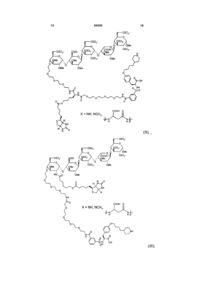
 .
.
19. Сполука за будь-яким з пп. 1-10, яка відрізняється тим, що залишковий антагоніст GpIIb/IIIa сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом.
20. Сполука за п. 19, яка відрізняється тим, що включає один ковалентний зв'язок з біотиновою міткою або її аналогом, а залишковий антагоніст GpIIb/IIIa сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом.
21. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-20 і фармацевтично придатні допоміжні компоненти.
22. Сполука за будь-яким з пп. 1-20, призначена для застосування у терапії.
23. Застосування сполуки за будь-яким з пп. 1-20 у виготовленні медикаменту для лікування або профілактики тромбозу або інших пов'язаних з тромбіном хвороб.
24. Спосіб нейтралізації антитромбозної дії сполуки за будь-яким з пп. 1-20 у пацієнта, який включає введення зазначеному пацієнту ефективної кількості авідину або стрептавідину.
Текст
1. Сполука формули І олігосахарид-прокладка-антагоніст GpIIb/IIIa (I), де олігосахарид є негативно зарядженим олігосахаридним залишком, який містить від 4 до 25 моносахаридних одиниць і заряд якого компенсується позитивно зарядженими контр-іонами, а олігосахаридний залишок походить від олігосахариду, який має (опосередковану АТ-ІІІ) власну анти-Ха активність; прокладка є зв'язком або суттєво фармакологічно неактивним зв'язуючим залишком; антагоніст GpIIb/IIIa є залишком, що імітує RGD і/або фрагмент K(QA)GD фібриногену і включає карбоксилатний компонент і основний компонент, розташовані у залишку на відстані 10-20 Å один від одного; або її фармацевтично прийнятна сіль або проліки, або сольват; причому сполука формули І також включає щонайменше один ковалентний зв'язок з біотиновою міткою або її аналогом. 2. Сполука за п. 1, яка відрізняється тим, що прокладка є суттєво фармакологічно неактивним зв'язуючим залишком. 3. Сполука за п. 1 або п. 2, яка відрізняється тим, що прокладка має довжину 1-50 атомів. 4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що прокладка включає щонайменше один елемент -(СН2СН2О)-. 5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що олігосахарид має від 4 до 16 моносахаридних одиниць. 6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що олігосахарид є сульфатованим пентасахаридним залишком. 7. Сполука за п. 6, яка відрізняється тим, що пентасахаридний залишок має структуру А UA (21) a200803934 (22) 06.10.2006 (24) 25.05.2011 (86) PCT/EP2006/067127, 06.10.2006 (31) 05109403.5 (32) 10.10.2005 (33) EP (31) 05109962.0 (32) 25.10.2005 (33) EP (46) 25.05.2011, Бюл.№ 10, 2011 р. (72) ДЕ КОРТ МАРТІН, NL, ВАН БОЕКЕЛЬ КОНСТАНТ АДРІАН АНТОН, NL, НІКОЛЬСОН ЧАРЛЬЗ ДЕВІД, NL (73) Н.В. ОРҐАНОН, NL (56) WO0224754 A 28.03.2002 EP1574516 A 14.09.2005 WO0142262 A 14.06.2001 ROGER O ET AL: "Polysaccharide labelling: impact on structural and biological properties" CARBOHYDRATE POLYMERS, APPLIED SCIENCE PUBLISHERS, LTD. BARKING, GB, vol. 50, no. 3, 15 November 2002 (2002-11-15), pages 273-278, XP004395905 ISSN: 0144-8617 US6217869 B1 17.04.2001 EGBERTSON M S ET AL: "NON-PEPTIDE FIBRINOGEN RECEPTOR ANTAGONISTS. 2. OPTIMIZATION OF A TYROSINE TEMPLATE AS A MIMIC FOR ARG-GLY-ASP" JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY. WASHINGTON, US, vol. 37, no. 16, 1994, pages 2537-2551, XP000574969 ISSN: 0022-2623 HANSON J ET AL: "UPDATE ON GPIIB/IIIA ANTAGONISTS" EXPERT OPINION ON THERAPEUTIC PATENTS, ASHLEY PUBLICATIONS, GB, vol. 13, no. 8, 1 August 2003 (2003-08-01), pages 1173-1188, XP001179465 ISSN: 1354-3776 JIANG JI ET AL.: "Synthesis of RGD Analogs as Potential Vectors for Targeted Drug Delivery" 2 (19) 1 3 94593 4 R1 O R1 R1 O O O R1 O OSO3 COO OSO3 R1 O (1-8C)алкіл O COO R1 O O OSO3 R1 R1 O R1 R1 , (A) 8. Сполука за п. 7, яка відрізняється тим, що пентасахаридний залишок має структуру В де R1 є незалежно біотиновою міткою або її аналогом, OSO3 або (1-8С)алкокси. OSO3O R1 OSO3O OSO3 COO OSO3O O O OCH3 OCH3 O COO O OSO3 OCH3 OCH3 OSO3 OCH3 O O OCH3 OCH3 , (В) де R1 є ОСН3 або OSO3 . 9. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що залишковий антагоніст GpIIb/IIIa вибрано з залишків які походять від Ro 435054, SC 54701 (ксемілофібан), RWJ 50042, сибрафібану (Ro 44 3888), лімііфібану (Ro 449883), GPI562, FK 633, тирофібану (МК 383), орбофібану (SC 57101), ептифібатиду (С68 22), роксифібану (XV 459), еларофібану (RWJ 53308), SR 121566 (активна форма SR 121787), лефрадафібану (BІBU 52), лотрафібану (SB 214857), гантофібану (YM 028), Т-250, EF 5077, ZD 2486, ТАК 029, ТР 9201, L 703014 і UR-3216. 10. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що містить один ковалентний зв'язок з біотиновою міткою або її аналогом. 11. Сполука за будь-яким з пп. 1-7, 9 і 10, яка відрізняється тим, що олігосахаридний залишок сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом. 12. Сполука за п. 11, яка відрізняється тим, що включає один ковалентний зв'язок з аналогом біотину, причому олігосахаридний залишок сполуки формули І включає один ковалентний зв'язок з аналогом біотину формули -(NH-CO)n-(CH2)p-X-BT, де n дорівнює 0 або 1, р дорівнює 4 або 5, X=NH, М(1-4С)алкіл, NH-CH(CH2OH)-CH2-C(O)-NH, NHCH(CH3)-CH2-C(O)-NH, NH-CH(COOH)-CH2-C(O)NH або NH-CH(CH2COOH)-CH2-C(O)-NH, а ВТ є H O S N NH мітка S . 13. Сполука за п. 12, яка відрізняється тим, що є 5 94593 6 OSO3O OSO3 OSO3O OSO3 COO OSO3O O OMe O OSO3 O OMe OMe O OSO3 COOH OMe OMe O O HN O OMe O O O H H N O X NH O S H NH O COOH X=NH, NCH3, O O N H N H O O O NH O O N H O O S N H O 14. Сполука за будь-яким з пп. 1-10, яка відрізняється тим, що прокладка сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом. 15. Сполука за п. 14, яка відрізняється тим, що включає один ковалентний зв'язок з аналогом біо OH . тину, а прокладка сполуки формули І включає один ковалентний зв'язок з аналогом біотину формули -(СН2)4-Х-ВТ, де X і ВТ є такими, що були визначені у п. 12. 16. Сполука за п. 15, яка відрізняється тим, що є 7 94593 8 OSO3O OSO3 OSO3O OSO3 COO OSO3O O OMe OMe O OSO3 COOH OMe H N O O OSO3 OMe OMe O O OMe OMe O O O O OH O O N H O H N O O O O O O NH S O H N O X COOH X=NH, NCH3, N H O N H H S NH H N H O 17. Сполука за п. 16, яка відрізняється тим, що є формою її натрієвої солі. . 18. Сполука за п. 17, яка відрізняється тим, що є 9 94593 10 OSO3O OSO3 OSO3O OSO3 OSO3 COO O O OMe OSO3 H N O O OSO3 OMe O O OMe O COOOMe OMe 10Na+ OMe OMe O O O O OH O O N H O H N OO O NH X O O O NH S O H N O O O NH O H S HN NH H O . 19. Сполука за будь-яким з пп. 1-10, яка відрізняється тим, що залишковий антагоніст GpIIb/IIIa сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом. 20. Сполука за п. 19, яка відрізняється тим, що включає один ковалентний зв'язок з біотиновою міткою або її аналогом, а залишковий антагоніст GpIIb/IIIa сполуки формули І включає ковалентний зв'язок з біотиновою міткою або її аналогом. 21. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-20 і фармацевтично придатні допоміжні компоненти. 22. Сполука за будь-яким з пп. 1-20, призначена для застосування у терапії. 23. Застосування сполуки за будь-яким з пп. 1-20 у виготовленні медикаменту для лікування або профілактики тромбозу або інших пов'язаних з тромбіном хвороб. 24. Спосіб нейтралізації антитромбозної дії сполуки за будь-яким з пп. 1-20 у пацієнта, який включає введення зазначеному пацієнту ефективної кількості авідину або стрептавідину. Винахід стосується нових антитромбозних інгібіторів, які містять біотинову мітку або похідну біотину, способів їх приготування, фармацевтичних композицій, що містять їх як активні інгредієнти, і застосування зазначених сполук для виготовлення медикаментів. Пошуки антагоністів GPIIb/lIIa з прогнозованою антитромбозною дією, бажано, з довшим напівжиттям (для забезпечення стійких рівнів агрегації 11 тромбоцитів) дозволили отримати нові антитромбозні подвійні інгібітори з змішаним фармакологічним профілем. Ці нові сполук пригнічують два ключові об'єкти, пов'язані з коагуляційним каскадом (фактор Xa) і шляхом агрегації тромбоцитів (GpIIb/HIa) (див. EP 1574516). В антикоагуляційнійі і антиатеротромбозній терапії є потреба в антидоті, здатному ефективно нейтралізувати або мінімізувати активність антикоагуляційних і антиатеротромбозних ліків. Добре відомо лікування пацієнта, що постраждав у нещасному випадку, може викликати кровотечу. Крім того, може виявитись необхідним хірургічне втручання під час антикоагуляційного і антиатеротромбозного лікування. Під час деяких хірургічних процедур у великих дозах застосовують антикоагулянти, щоб запобігти згортанню крові, і їх необхідно нейтралізувати після операції. Не існує клінічно ефективних антидотів в антитромбоцитній терапії, де використовують інгібітори GpIIb/IIIa. Отже, бажано мати антиатеротромбозні і/або антикоагуляційні агенти, які у будь-який момент можуть бути нейтралізовані. У US 2004/0024197 (WO02/24754) відзначено, що у невідкладних випадках, антикоагуляційна активність деяких полісахаридів може бути частково знижена авідином, якщо ці полісахариди містять щонайменше ковалентний зв'язок з біотином або похідною біотину. O. Roger et al. у Carbohydrate Polymers 50 (2002) 273-278 розглядає дериватизацію карбогідратів відновлювальним амінуванням, включаючи біотинyвальні агенти. Ця робота стосується неселективного модифікування полідисперсних природних полісахаридів. Винахід стосується нових здатних до нейтралізації подвійних інгібіторів, що походять від подвійних інгібіторів, описаних у EP 1574516. Було виявлено, що певна біотинова "мітка" (далі - "BT", що походить від гексагідро-2-оксо1H-тієно[3,4-d]імідазол-4-пентанової кислоти, бажано D(+)-ізомеру), або її аналог може бути приєднана або введена у структуру сполуки, описаної у EP 1574516 з отриманням в результаті здатних до нейтралізації подвійних інгібіторів. 94593 12 Отже, винахід стосується сполуки формули (I) олігосахарид-прокладка-антагоніст GplIb/HIa (І), в якій олігосахаридом є негативно заряджений олігосахаридний залишок, що містить 4 - 25 моносахаридних одиниць, де заряд компенсується позитивно зарядженими контр-іонами, а олігосахаридний залишок походить від олігосахариду, в якому (опосередкована AT-lll) анти-Xa активна per se прокладка є зв'язком, або від фармакологічно суттєво неактивного зв'язуючого залишку, а антагоніст GpIIb/IIIa є залишком, що імітує фрагмент RGD і/або K(QA)GD фібриногену і містить карбоксилатний компонент і основний компонент, розташовані у цьому залишку на відстані 10-20 A один від одного; або її фармацевтично прийнятної солі або проліків, або сольватів, причому сполука формули I додатково містить щонайменше один ковалентний зв'язок з біотиновою міткою або її аналогом. Сполуки винаходу є ефективними антитромбозними агентами, що пригнічують як опосередкований ATIll коагуляційний фактор Xa, так і агрегацію тромбоцитів, протидіючи зв'язуванню фібриногену з його рецептором. Вони можуть бути використані для лікування і (можливо) відвернення тромбозних хвороб, включаючи ряд тромбозних і протромбозних станів, в яких активується коагуляційний каскад, зокрема (але не лише), глибокий венний тромбоз, легеневий емболізм, тромбофлебіт, артеріальну оклюзію після тромбозу або емболізму, артеріальну реоклюзію під час або після ангіопластики, рестеноз після артеріальної травми. У сполуках винаходу можуть бути використані будь-які негативно заряджені олігосахаридні залишки з 4 - 25 моносахаридними одиницями. Придатними є сполуки, в яких олігосахаридом є сульфатований олігосахаридний залишок. Бажано, щоб олігосахаридний залишок походив від олігосахариду, який має (опосередкований AT-ІІІ) активний анти-Xa, наприклад, олігосахариду, описаного у EP 0 454 220, EP 0 529 715, WO 97/47659, WO 98/03554 і WO 99/36443. Бажаними є також олігосахаридні залишки з 4 - 16 моносахаридними залишкуми. Найбільш бажаним сульфатований пентасахаридний залишок. Бажані пентасахаридні залишки мають структуру A: 13 94593 14 де R1 є незалежно біотиновою міткою або її аналогом, OSО3 або (1-8C)алкокси. Особливо ба жані пентасахариди мають структуру B: де R1 є OCH3 або OSO3. Бажано, щоб у пентасахаридній структурі B R1 - OSO3. Прокладка є зв'язком або суттєво фармакологічно неактивним гнучким зв'язуючим залишком. Термін "суттєво фармакологічно неактивний" означає, що прокладка не містить атомів або груп, фармакологічно активних per se у дозах, в яких сполуки винаходу є терапевтично ефективними. Отже, при дозах, в яких сполуки винаходу використовуються як антитромбозні, прокладка за природою не дає помітних фармакологічних побічних явищ. У бажаних втіленнях прокладка є суттєво фармакологічно неактивним з'єднуючим залишком, який, бажано, має 1 - 50 атомів уздовж "хребта" прокладки, не включаючи оксиген олігосахаридного залишку. Прокладка може включати (дещо) жорсткі елементи, наприклад, кільцеві структури і ненасичені зв'язки. Прокладки згідно з винаходом є, бажано, гнучкими. Придатні прокладки можуть бути легко побудовані фахівцем. Більш бажана довжина прокладки становить 10 - 35 атомів, зокрема, 10 - 28. З точки зору синтезу довші прокладки вважаються менш придатними, хоча можуть з успіхом використовуватись у сполуках винаходу. Бажані прокладки включають щонайменше один елемент -(CH2CH2O)-, більш бажані - шість елементів -(CH2CH2O)-. Кінець прокладки на боці залишкового антагоністу GplIb/IIIa можна вибирати довільно, за умови збереження активності антагоністу GplIb/IIIa. Отже, звичайно присутній карбоксилатний компонент (як варіант, естерифікований) і основний компонент мають залишатись незмінними. У бажаних сполуках згідно з винаходом залишковий антагоністу GplIb/IIIa вибрано з залишків, що походять від Rо 435054, SC 54701 (ксемілофібан) , RWJ 50042, сібрафібан (Ro 44 3888), ламіфібан (Ro 449883), GPI 562, FK 633, тирофібан (MK 383), орбофібан (SC 57101), ептифібатид (C68 22), роксифібан (XV 459), еларотибан (RWJ 53308), SR 121787, лефрадафібан (BІBU 52), лотрафібан (SB 214857), гантофібан (YM 028), T-250, EF 5077, ZD 2486, TAK 029, TP 9201, L 703014, SR 121566 (активна форма SR 121787) і UR-3216. Похідні зазначених залишків також включають хімічно модифіковані залишки, в яких залишилась частина, що включає (як варіант, естерифікований) карбоксилатний компонент і основний компонент (або захищений основний компонент). У бажаному втіленні вибрано SR 121566 (активна форма SR 121787). Найбільш бажаними є сполуки, в яких залишковий антагоністу GplIb/IIIa походить від тирофібану. Бажані сполуки згідно з винаходом включають один ковалентний зв'язок з біотиновою міткою або її аналогом. Біотинова мітка (або її аналог) може існувати в усіх частинах сполуки формули 1. Таким чином, втіленнями винаходу є сполуки, в яких (a) олігосахаридний залишок сполуки формули I включає ковалентний зв'язок з біотиновою міткою або її аналогом, (b) прокладка сполуки формули I включає ковалентний зв'язок з біотиновою міткою або її аналогом і (c) залишковий антагоністу GpIIb/IIIa у сполуці формули I включає ковалентний зв'язок з біотиновою міткою або її аналогом. Бажаними є сполуки з одним ковалентним зв'язком з аналогом біотину, де олігосахаридний залишок сполуки формули I включає один ковалентний зв'язок з аналогом біотину формули -(NHCO)n-(CH2)p-X-BT, де n = 0 або n = 1 (у цих сполуках бажаним є n = 1), p дорівнює 4 або 5 (бажаним є p = 5), X і BT визначено вище. Інші бажані сполуки винаходу включають один ковалентний зв'язок з аналогом біотину, в якому прокладка сполуки формули I включає один ковалентний зв'язок з аналогом біотин формули (CH2)4-X-BT, де X і BT визначено вище. Типові приклади біотинованих подвійних інгібіторів винаходу мають структури 15 94593 16 і 17 але також сполуки формули 1, в яких прокладка приєднана до олігосахариду в іншій позиції, і/або сполуки, в яких біотинова (аналога) мітка находиться в іншій позиції молекули. Сполуки формули ІІ є бажаними прикладами винаходу. + + Позитивно зарядженими контр-іоном є H , Na , + 2+ K , Ca тощо. Бажаною формою сполук формули I є натрієва сіль. Термін основний компонент означає будь-який відомий основний компонент, наприклад, амін, амідин, гуанідин, піперидин тощо. Вираз "на відстані 10 - 20 A один від одного" визначає просторову взаємну орієнтацію двох груп, виміряну не лише уздовж зв'язку. Фахівець, знайомий з моделюванням, може легко визначити цю відстань (див., наприклад, J.Med.Chem. 1994, 37, 2537-2551). Термін (1-8C)алкіл означає розгалужену або нерозгалужену алкільну групу з 1-8 атомами карбону, наприклад, метил, етил, пропіл, ізопропіл, бутил, втор-бутил, трет-бутил, гексил і октил. Бажаними є метил і етил. У терміні (1-8C)алкокси, алкільний залишок є таким, що був визначений вище. Термін "проліки" означає сполуку, яка метаболізмом активується у тілі, наприклад, у сполуку, в якій основний компонент (наприклад, аміногрупа або бензаміногрупа у залишковому антагоністі GpIIb/IIIа сполуки формули I захищена, наприклад, гідрокси-, (1-6C)алкоксиабо (16C)алкоксикарбонільною групою. Прикладами проліків є також сполуки формули I, в яких карбоксилатна група у залишковому антагоністі Gpllb/llІa є естерифікованою. Сольвати згідно з винаходом включають гыдрати. Сполуки винаходу можна приготувати, як варіант, модифікуючи описані вище антагоністи GPHb/IIIa, що походять, наприклад, від тирофібану, SR 121566, Ro 435054, RWJ 50042 або SC 54701 (фармакологічно активна форма ксемілофібану), ламіфібану або їх аналогів, амінокислотами, пептидоміметиками або додатковими функціональними групами (наприклад, -COOH, -NH2, -SH, OH, -N3, термінальним алкіном тощо) відомими методами. Приклад синтезу модифікованого аналога RGD описано у Bioorganic Chemistry 29, 357379 (2001), де цю сполуку запропоновано як потенційний вектор для спрямованої доставки ліків. Згідно з винаходом, як варіант, модифіковану частину антагоністу GPIIb/lIIa) (а) сполучають безпосередньо з олігосахаридом або (b) сполучають з залишком прокладки олігосахариду, або (c) сполучають з прокладкою, яку потім сполучають з олігосахаридом (див., наприклад, WO 99/65934; WO 01/42262). Для цього можуть бути використані будь-які придатні олігосахариди, наприклад, олігосахариди, відомі, наприклад, з EP 0 454 220 і EP 0 529 715 або комерційні олігосахариди. Олігосахариди можenm бути фосфориловані відомими методами (див., наприклад, Buijsman, R. et al. (Bioorg. Med. Chern. Lett. 1999, 9, 2013-2018). Приєднання прокладки до олігосахариду може бути здійснене, наприклад, методами, описаними у EP 0649854 або EP 04005343,1. 94593 18 Щодо приєднання біотинової мітки до сполук формули 1 було запропоновано декілька варіантів, які можуть бути використані з застосуванням різних наборів відомих захисних груп. Біотинову мітку, що містить реактивну групу, наприклад, типу активованого естеру, малеїміду, йодоацетилу або первинного аміну, бажано вводити у реакцію з амінною функціональною групою, або тіольною функціональною групою, або карбонокислотною функціональною групою, або альдегідною функціональною групою, в умовах, описаних, наприклад, у Savage et al., Avidine-Biotin Chemistry: A Handbook; Pierce Chemical Company, 1992). Біотинова мітка може, наприклад, бути зв'язана безпосередньо з (негативно зарядженим) олігосахаридним залишком або, як варіант, через N-(14C)алкіловану функціональну аміногрупу залишку олігосахаридної прокладки або, як варіант, N-(14C)алкілований амінокислотний залишок, як варіант, з N-(1-4C)алкілованою функціональною аміногрупою олігосахаридного залишку сполуки формули I. В іншому аспекті винаходу біотинова мітка може, наприклад, бути зв'язана безпосередньо з залишковим антагоністом GpIIb/ІIIa або, як варіант, через N-(1-4C)алкіловану функціональну аміногрупу зв'язуючого залишку, або, як варіант, N-(14C)алкілований амінокислотний залишок, як варіант, з N-(1-4C)алкілованою функціональною аміногрупою залишкового антагоністу GpIIb/ІIIa сполуки формули 1. У ще одному аспекті винаходу біотинова мітка може, наприклад, бути введена постадійно спочатку зв'язуванням безпосередньо з залишковим антагоністом GpIIb/IIla або, як варіант, через N-(14C)алкіловану функціональну аміногрупу частини прокладки формули I, або, як варіант, N-(1-4C) алкілований амінокислотний залишок, як варіант, з N-(1-4C)алкілованою функціональною аміногрупою залишкового антагоністу GpIIb/ІIIa сполуки формули I, і потім зв'язуванням безпосередньо з олігосахаридом або, як варіант, з N-(1-4C) алкілованою функціональною аміногрупою частини прокладки формули I, або, як варіант, N-(1-4C)алкілованим амінокислотним залишком, як варіант, з N-(14C)алкілованою функціональною аміногрупою (негативно зарядженого) олігосахариду сполуки формули I, або навпаки. Згідно з іншим аспектом винаходу, як варіант, N-алкіловані амінокислотні залишки або α-Nзаміщені β-амінокислотні аналоги можуть бути введені пептидним сполученням відомими методами. Азидогрупа є придатною латентною функціональною аміногрупою, яка може бути використана у попередниках сполуки формули I для подальшого введення біотинової мітки. Іншими прикладами відомих антагоністів GpJIb/Illa можуть бути (як основа) частина антагоністу GpIIb/IIIа сполукb винаходу (але без обмеження): сполуки Ro 43 8857, Ro 48 3657, BIBL 12, FK 633, GR 144053, EMD 76 334, SR 121566, SB 208651, SC 54684, SC 52012, DMP 754, FR 158999, GR 200976, XV 788, MK 383 (тирофібан), RWJ 53308, ZD 2486, L 709780, RGD 891, T 250, C 6822, BIBU 104, SB 214857, SC 57101, г 7453, TAK 029, 19 XV 454, XV 459, L 734 217, DMP 802, SR 121787, TP 9201, DMP 757, SC 52012, RPR 109891, YM 68128, ME 3229, ME 3230, CT 50352, MK 852, S 1197, DMP 728, SC 57345, L 738 167, GR 233548, Ro 438857, TA 993, YM 337, BIBW 194, BIBU 129, BIBW 98, тетрафібрицин, L 703 014, BIBU 251, GR 91669, RG 13965, г 7446, PS 028, XR 300, NSL 9403, L 756568, S 1762, L 746 223, L 767685, NSL 95301, г 4120, SB 207043, GR 83895, P246, L 739 758, XR 299, SV 873, RWJ 50228, XQ 870, EF 5154, AR 0510, г 7570, г 7442, г 7464, RWJ 52656, TAK 024, MS 180, MS 28168, XU 063, XU 065, L 734115, SM 20302, TS 943, NSL 96184, UR 12947, XU 057, L 750034, UR 3216, UR 2922, CP 4632, AR 0598, SC 79992, SC 4992, RGD 039, ME 3277, T 250, SC 57099B, SKF 106760, SKF 107260, RWJ 52654, PSA 0613, CGH 400, NSL 95317, XT 111, RWJ 27755, L 736622, SC 46749, SM 20302, YM 570029, CY 311176 і антагоністи GpIIb/IIIa, описані у EP 0529858, WO 96/20172, EP 0496378, EP 0530505, Bioorg. & Med. Chem. 3, 539 (1995), WO 93/08174, J.Am.Chem.Soc., 8861 (1993), J. Med. Chem. 43, 3453 (2000), Bioorg. Med. Chem. 3, 337 (1995), US 5 239 113, US 5 344 957, US 5 973 003, US 5 703 125, WO 96/37464, WO 93/07867, US 5 378 712, EP 445 796, US 5 273 982, US 5 770 575, WO 01/602813, EP 656,348, US 5 726 185, EP 505868, EP 560730, US 5 561 112, EP 513675, US 5 574 016, WO 94/09030, EP 478363, US 5 292 756, US 5 206 373, WO 93/16994, US 5 312 923, EP 743 302, US 5 658 929, US 5 880 136, US 5 814 643, US 6 040 317, Expert Opin. Ther. Patents 13 (8), 1173-1188 (2003) і Curr. Pharm. Design 14, 1567-1609 (2004). Винахід включає також сполуки, що містять нові залишкові антагоністи GpIIb/IIIa, які імітують фрагмент RGD і/або K(QA)GD фібриногену, що звичайно включає карбоксилатний компонент (як варіант, естерифікований) і основний компонент, розташований у залишку на відстані 10 - 20 A один від одного. Пептидне сполучення як операція описаної вище процедури приготування сполук винаходу може бути проведене відомими методами сполучення або конденсацією пептидних фрагментів, наприклад, азидним, змішаним ангідридним, активованим естерним, карбодіімідним методами, або, бажано, під дією амоній/уронієвих солей, наприклад, TBTU, зокрема, з доданням каталізаторів і інгібіторів рацемізації, наприклад, Nгідроксисукциніміду, N-гідроксибензотріазолу і 7аза-N-гідроксибензотріазолу (див. огляд у Peptids, Analysis, Synthesis, Biology, Vol 3, E. Gross і J. Meienhofer, eds. (Academic Press, нов York, 1981) і Пептидs: Chemistry і Biology, N. Sewald і H.-D. Jakubke (Wiley-VCH, Weinheim, 2002)). Амінна функція у сполуках може бути захищена під час синтезу N-захисною групою, яку звичайно використовують у пептидній хімії для захисту αаміногрупи, наприклад, третбутилоксикарбонільною (Boc) групою, бензилоксикарбонільною (Z) групою, Офлуоренілметилоксикарбонільною (Fmoc) групою або фталоїльною (Phth) групою, або може введена демаскуванням азпадного компонента. Див. огляд амінозахисних груп і методів їх видалення у 94593 20 Peptids, Analysis, Synthesis, Biology, Vol 3 і Peptids: Chemistry і Biology. Амідинові функції, якщо вони є, можуть бути залишені незахищеними або можуть бути захищен карбаматом, наприклад, алілоксикарбонілом або бензилоксикарбонілом. Амідинову функцію бажано вводити у м'яких умовах, використовуючи 1,2,4-оксадіазолін-5-онний компонент як попередник. Карбонокислотні групи можуть бути захищені групою, яку звичайно використовують у пептидній хімії для захисту α-карбонокислотної групи, наприклад, трет-бутил-естер. Карбонокислотні групи модифікованих антагоністів Gpllb/llla бажано захищати як бензил-естер. Видалення захисних груп можна проводити різними шляхами залежно від їх природи. Звичайно це роблять у кислотних умовах у присутності акцепторів або в основних умовах, наприклад, каталітичним гідрогенуванням. Передумовою для з'єднання антагоністу Gpllb/llla до олігосахариду є присутність ортогонально реактивної анкерної групи, наприклад, карбоксилатної групи, яка може бути приєднана безпосередньо до олігосахаридного залишку або до прокладки похідної олігосахариду, або через прокладку до прокладки похідної олігосахариду. У більшості випадків необхідно додавати модифікацію антагоністу Gpllb/llla. Конструювання складових блоків на основі залишку для синтезу сполуки формули I можна здійснити різними шляхами, використовуючи відомі методи, лінійно або постадійно,з введенням амінокислот, їх похідних або пептидоміметиків, або конвергентно, блочним сполученням проміжних конструктів. Сполуки винаходу у формі вільної основи можуть бути ізольовані з реакційної суміші у формі фармацевтично прийнятних солей. Фармацевтично прийнятні солі можна також отримати обробкою вільної основи формули (I) органічною або неорганічною кислотою, наприклад, гідро хлоридом, гідробромідом, гідройодидом, сульфуровою кислотою, фосфорною кислотою, оцтовою кислотою, пропіоновою кислотою, гліколевою кислотою, малеїновою кислотою, малоновою кислотою, метансульфоновою кислотою, фумаровою кислотою, бурштиновою кислотою, виннокам'яною кислотою, лимонною кислотою, бензойною кислотою, аскорбіновою кислотою тощо. Сполуки винаходу або їх інтермедіати можуть мати хіральні атоми карбону і, отже, можуть бути отримані як чисті енантіомери, або суміші енантіомерів, або як суміші, що містять діастереомери. Способи отримання чистих енантіомерів є добре відомими, наприклад, кристалізацією солей, отриманих з оптично активних кислот і рацемічної суміші або хроматографією на хіральних колонках. Для діастереомерів можуть бути використані прямофазні або зворотно-фазні колонки. Сполуки винаходу можна вводити ентерально або парентерально. Точні дози і режими введення цих сполук і композицій, що їх містять, залежать від потреб пацієнта, якому вводять медикамент і важкості стану і визначаються лікарем. Взагалі парентеральне введення потребує менших доз порівняно з іншими способами введення, які біль 21 ше залежать від абсорбції. Бажана доза для людини становить 0,0001-10 мг, більш бажано, 0,0011 мг на кг маси тіла. Медикамент з сполукою винаходу можна також використовувати як ад'ювант у (гострій) антитромбозній терапії. У такому випадку медикамент вводять разом з іншими сполуками, що використовуються для лікування таких станів, наприклад, аспірином, клодопігрелем або статинами. У суміші з фармацевтично придатними допоміжними засобами, наприклад, описаними у Gennaro et al., Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, 1990 (див. Part 8: Pharmaceutical Preparations and Their Manufacture) сполуки можуть бути пресовані у тверді дозовані одиниці, наприклад, пігулки, таблетки, капсули або супозиторії. Фармацевтично придатні рідкі сполуки можна застосовувати у формі розчину, суспензії, емульсії, наприклад, для ін'єкцій. Для виготовлення дозованих одиниць, наприклад, таблеток, використовують звичайні добавки, наприклад, наповнювачі, забарвлювачі, полімерні зв'язуючі тощо. Взагалі придатною є будь-яка фармацевтично прийнятна добавка, яка не порушує функції активної сполуки. Придатні носії, з якими можна вводити композицію, включають лактозу, крохмаль, похідні целюлози тощо, або їх суміші у належних кількостях. У кресленнях: Фіг. 1: дія авідину на пригнічення агрегації тромбоцитів сполукою 12; попередня інкубація сполуки і авідину, Фіг. 2: дія авідину на пригнічення агрегації тромбоцитів сполукою 10. Попередня інкубація сполуки і авідину, Фіг. 3: дія авідину на пригнічення агрегації тромбоцитів у морських свинок сполукою 12 (додання авідину - через 9 хвил. після викликаної ADP агрегації тромбоцитів), Фіг. 4: дія авідину на пригнічення агрегації тромбоцитів сполукою 10 (додання авідину - через 9 хвил. після викликаної ADP агрегації тромбоцитів), Фіг. 5: дія авідину на пригнічення агрегації тромбоцитів у людини сполукою 12 (додання авідину - через 9 хвил. після викликаної ADP агрегації тромбоцитів), Фіг. 6: середні дані після підшкірного введення 500 нмоль/кг сполуки, Фіг. 7. Середні дані після підшкірного введення 100 нмоль/кг сполуки, Фіг. 8. Середні дані після підшкірного введення 100 нмоль/кг сполуки; у t = 1 год. авідин (10 мг/кг) введено внутрішньовенно щурам, що отримали сполуку 10 або 12; для порівняння наведено фармакокінетичну поведінку сполуки 27 (пентасахаридний компонент) без авідину, Фіг. 9: середні дані після підшкірного введення 500 нмоль/кг сполуки 10, 17 або 26; у t = 1 год. авідин (10 мг/кг) введено внутрішньовенно, після чого були взяті зразки крові у T=25 і 26 год. Для порівняння наведено значення для 100 нмоль/кг введеної підшкірно сполуки 17 з нормалізацією до дози 500 нмоль/кг. Винахід ілюструється наведеними далі прикладами. 94593 22 ПРИКЛАДИ Абревіатури: ADP Aq. ATIII Bn Boc ДХМ DIPEA ДМФ fmoc NMM Me PRP PPP ТФК ТГФ TRAP Z аденозин 5'-дифосфат водний антитромбін III бензил трет--бутилоксикарбоніл дихлорметан N,N-діізопропілетиламін N,N-диметилформамід 9-флуоренілметилкарбамат N-метилморфолін метил збагачена тромбоцитами плазма збіднена тромбоцитами плазма трифлуороцтова кислота тетрагідрофуран пептид агоністу рецептора тромбіну бензилоксикарбоніл Приклад 1. Трет-бутил 15-N-(9флуоренілметилоксикарбоніл)-15-аза-3,6,9,12тетраокса-пентадеканоат (2) Трет-бутил 15-аміно-3,6,9,12-тетраоксапентадеканоат (І) (0,50 г, 1,45 ммоль), приготовлений, як описано у EP 1574516, розчиняють у ТГФ (7,5 мл) і H2O (5 мл). Додають 4N розчин NaOH до pH приблизно 9. Порціями додають N-9флуоренілметил-карбаматсукцинімід (FmocOSu, 0,54 г, 1,60 ммоль, 1,1 екв.). Через 10 хвил. додають ще 4N розчину NaOH до досягнення pH приблизно 9. Через 3 год. Реакційну суміш підкислюють 1N розчином HCІ до pH 6-7. Додають H2O і реакційну суміш екстрагують 3 рази EtOAc. Органічну фазу промивають розсолом і сушать над MgSО4. Після фільтрації розчинник видаляють під зниженим тиском (50 мбар, 50°C). Сире масло очищають силікагелевою колонною хроматографією (ДХМ/MeOH, I/O-* 95/5, об'єм/об'єм), отримуючи сполуку 2 як жовтувате масло (0,61 г, 79%). Rf 0,64 (ДХМ/MeOH, 95/5, об'єм/об'єм). Приклад 2. 15-N-(9флуоренілметилоксикарбоніл)-15-аза-3,6,9,12тетраокса-пентадеканоат(3) Сполуку 2 розчиненяють у ДХМ (3,5 мл) і додають ТФК (3,5 мл) під нітрогено. Після 1,5годинного перемішування реакційну суміш концентрують під зниженим тиском. Надлишок ТФК видаляють багаторазовим концентруванням у толуолі. Додають ДХМ/Et2О (100 мл, 1/2, об'єм/об'єм) і розчин промивають 1N HCl. Водний шар екстрагують ДХМ/Et2О (100 мл, 1/2, об'єм/об'єм). Об'єднані органічні шари промивають розсолом і сушать над MgSО4. Після фільтрації розчинник видаляють під атмосферним тиском (50°C). Сире масло очищають силікагелевою колонною хроматографією (ДХМ/MeOH/AcOH, 99/0/89/10/1, об'єм/об'єм/об'єм), отримуючи сполуку 3. Решту AcOH видаляють розчиненням сирого масляного продукту ДХМ/Et2О (1/2, об'єм/об'єм) і промиванням H2O (3×) і розсолом, з подальшим сушінням над MgSО4. Після фільтрації розчинник видаляють під атмосферним тиском (50°C), отримуючи сполу 23 ку 3 як жовтувате масло (0,37 г, 67%). Rf 0,32 (ДХМ/MeOH/AcOH, 89/10/1, об'єм/об'єм). Приклад 3. Трет-бутил 15-N-(9флуоренілметилоксикарбоніл)-15-аза-3,6,9,12тетраокса-пентадеканоїл-ε-N(бензилоксикарбоніл)-L-лізин (4) Сполуку 3 (0,37 мг, 0,77 ммоль) розчиняють у ДХМ (18 мл). DIPEA(0,40 мкл, 2,31 ммоль, 3 екв.) і TBTU (0,25 г, 0,77 ммоль) послідовно додають в атмосфері N2 і розчин залишають перемішуватись на 10 хвил. Додають ε-(Z)-X-Lys-OtBu-HCl (0,29 г, 0,77 ммоль) і суміш перемішують 1,5 год. Реакційну суміш розріджують ДХМ і промивають H2О, 0,1N HCl, насиченим. NaHCО3 і розсолом. Органічну фазу сушать (MgSО4) і концентрують під атмосферним тисом. Очищення проводять силікагелевою колонною хроматографією (ДХМ/MeOH, 1/0 → 9/1, об'єм/об'єм), отримуючи сполуку 4 як жовтувате масло (0,51 г, 83%). Rf 0,85 (ДХМ/MeOH, 9/1, + + об'єм/об'єм). ESI-MS: 792,6 [M+H] , 814,6 [M+Na] , + 736,4 [M-tBu+H] Приклад 4. Трет-бутил 15-N-третбутилоксикарбоніл-15-аза-3,6,9,12-тетраоксапентадеканоїл-8-N-(бензилоксикарбоніл)-L-лізин (5) Сполуку 4 (0,26 г, 0,32 ммоль) розчиняють у ТГФ (5 мл). Додають Et2NH (1 мл) і розчин залишають перемішуватись на 24 год. Надлишок Et2N і розчинника видаляють під зниженим тиском (50°C). Додають толуол і видаляють під зниженим тиском (50°C, 65 мбар) отримуючи N-незахищений продукт (0,21 г, 0,32 ммоль), Rf 0,23 (ДХМ/MeOH, + 9/1, об'єм/об'єм). ESI-MS: 570,4 [M+H] , 514,4 [M+ tBu+H] . Сирий продукт розчиняють у ДХМ (3 мл). Додають Et3N (0,11 мл) і потім ди-третбутилдикарбонат (73 мг, 0,34 ммоль, 1,1 екв.) в атмосфері N2. Після перемішування протягом 5 год. суміш додають до холодного (5°C) розчину 0,1N HCl і екстрагують EtOAc. Органічний шар промивають розсолом і сушать (MgSO4). Після фільтрації розчинники видаляють під зниженим тиском (180 мбар, 50°C). Очищення проводять силікагелевою колонною хроматографією (ДХМ/MeOH, 1/0 → 95/5, об'єм/об'єм), отримуючи безбарвне масло (0,17 г, 82%). Rf 0,5 (ДХМ/MeOH, 9/1, об'єм/об'єм). ESI-MS: + + + 670,6 [M+H] , 692,4 [M+Na] , 570,4 [M-Boc+H] , + 514,1 [M-Boc-tBu+H] Приклад 5. 15-аза-3,6,9,12-тетраоксапентадеканоїл-ε-[D-(+)-біотиніл]-L-лізин (6) Сполуку 5 (0,23 г, 0,34 ммоль) розчиняють у EtOH (8 мл) і H2О (1,2 мл). Після продування нітроген протягом 5 хвил. додають Pd/C 10 % (0,11 г). Через розчин протягом 4 год. пропускають гідроген, потім продувають нітрогеном протягом 10 хвил. для видалення гідрогену. Суміш фільтрують через декаліт і концентрують під зниженим тиском (170 мбар, 50°C) отримуючи N-L-лізиновий позбавлений захисту інтермедіат як безбарвне масло (0,15 г, 81 %). Rf 0,02 (ДХМ/EtOAc, 9/1, об'єм/об'єм). D-(+)-біотин (75 мг, 0,31 ммоль) суспендують у ДХМ (7 мл). Додають DІPEA (0,11 мл, 0,62 ммоль, 2 екв.) і потім TBTU (0,10 г, 0,31 ммоль) в атмос 94593 24 фері N2 і розчин залишають перемішуватись 1 год.. Розчин згаданого вище ε-N-L-лізинового позбавленого захисту інтермедіату у ДХМ (3 мл) додають до реакційної суміші. Суміш залишають перемішуватись на 16 год. Додають H2O і екстрагують ДХМ (3×). Органічний шар сушать (MgSО4), фільтрують і концентрують під зниженим тиском (850 мбар, 50°C). Очищення проводять силікагелевою колонною хроматографією (елюенти: ДХМ/MeOH, 1/0 → 9/1 об'єм/об'єм), отримуючи масло (0,13 г, 60%). Rf 0,48 (ДХМ/MeOH, 9/1, + + об'єм/об'єм). ESI-MS: 762,6[M+H] , 784,6[M+Na] , + + 662,4 [M-Boc+H] , 606,4 [M-Boc-tBu+H] . Це масло розчиняють у сухому 4N HCl розчині у діоксан (4 мл) і перемішують. Через 1 год. отримують нерозчинне масло після видалення розчинника під зниженим тиском(100 мбар, 50 °C), отримуючи сполу+ ку 6 з кількісним виходом. ESI-MS: 606,4 [M+H] , + 628,4 [M+Na] . Приклад 6. Бензил N-(3-{[-ε-(D-(+)-біотиніл)-Lлізин-15-аза-3,6,9,12-тетраокса-пентадеканоїл]карбоніл}-бензолсульфоніл)-4-О-{4-(Nбензилоксикарбоніл-4-піперидиніл)-бутил}-Lтирозин (8) Сполуку 7 (0,10 г, 0,16 ммоль), приготовлену, як описано у EP 1574516, розчиняють у ДМФ (4 мл). Додають DIPEA (56 мкл, 0,32 ммоль, 2 екв.) і потім TBTU (51 мг, 0,16 ммоль) в атмосфері N 2 і розчин залишають перемішуватись на 45 хвил. Сполуку 6 (0,17 ммоль) розчиняють у ДМФ (1 мл), DIPEA (28 мкл, 0,16 ммоль, 1 екв.) і додають до реакційної суміші. Суміш залишають перемішуватись на 16 год., потім розріджують ДХМ і промивають розчином 1N HCІ. Органічну фазу промивають H2O (3×), сушать (MgSО4), фільтрують і концентрують під зниженим тиском (850 мбар, 50°C). Очищення проводять силікагелевою колонною хроматографією (елюенти: ДХМ/MeOH/AcOH, 99/0/1 → 79/20/1 об'єм/об'єм), отримуючи сполукe 8 (56 мг, 27 %). Rf 0,15 (ДХМ/MeOH, 9/1, + об'єм/об'єм). ESI-MS: 1316,6 [M+H] , 1338,8 + 4+ [M+Na] , 1182,6 [M-Z+H] , 1204,6 [M-Z+Na] . 1314,8 + [M-H] Приклад 7. Загальна процедура приготування сполук 10,12,17 і 26: Похідну карбонової кислоти (33 мкмоль) (тобто сполуку 8, 11, 16 або 25) сушать багаторазовим концентруванням у сухому ДМФ (2×2 мл), розчиняють у ДМФ (1 мл) і перемішують з TBTU (11 мг, 33 мкмоль) і DІPEA (5,7 мкл, 33 мкмоль) в атмосфері N2. Через 1 год. додають пентасахарид 9 (31 мкмоль) і реакційну суміш перемішують протягом ночі при кімнатній температурі і аналізують на іонообмін (моно-Q) зворотно-фазовою (Luna C18) хроматографією. Реакційну суміш концентрують (
ДивитисяДодаткова інформація
Назва патенту англійськоюAnticoagulant antithrombotic dual inhibitors comprising a biotin label
Автори англійськоюDe Kort Martin, Van Boeckel Constant Adriaan Anton, Nicholson David Charles
Назва патенту російськоюАнтитромбозные двойные ингибиторы с биотиновой меткой
Автори російськоюДе Корт Мартин, ван Боекель Констант Адриан Антон, Никольсон Чарльз Девид
МПК / Мітки
МПК: A61K 47/48, A61P 7/02, C07H 15/26
Мітки: антитромбозні, міткою, інгібітори, подвійні, біотиновою
Код посилання
<a href="https://ua.patents.su/31-94593-antitrombozni-podvijjni-ingibitori-z-biotinovoyu-mitkoyu.html" target="_blank" rel="follow" title="База патентів України">Антитромбозні подвійні інгібітори з біотиновою міткою</a>
Попередній патент: Установка для одержання, видалення та переміщення високов’язкої суспензії
Наступний патент: Спосіб одержання полімерних кон’югатів доксорубіцину з рн-контрольованим вивільненням лікарської речовини
Випадковий патент: Епідермотранслокалізаційний фіксаційний рельєфний елемент технологічної пластини