Спосіб одержання клопідогрелу (варіанти) та проміжні сполуки
Номер патенту: 93030
Опубліковано: 10.01.2011
Автори: Франтішек Ярослав, Стохандл Іржі, Несс Вінфрід
Формула / Реферат
1. Спосіб одержання сполуки загальної формули (Ia)
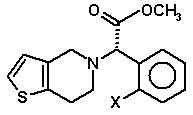 , (Ia)
, (Ia)
в якій X являє собою атом галогену, або її фармацевтично прийнятної солі, який включає стадію, на якій сполуку формули (II)
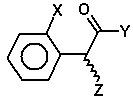 , (II)
, (II)
в якій X має значення, вказані вище, і Y і Z кожен незалежно являють собою групу, яка вилучається,
піддають реакції з оптично активним аміноспиртом формули (III)
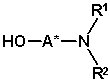 , (III)
, (III)
в якій A* являє собою вуглеводневий радикал з 1-30 атомами вуглецю, який може містить до 5-ти гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і який має одну або більше оптично активних одиниць, і
R1 і R2 незалежно являють собою атоми водню або вуглеводневі радикали з 1-20 атомами вуглецю, кожен з яких може містити до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і який може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або
один або обидва радикали R1 і R2 утворює (утворюють) 5-10-ти членне насичене або ненасичене кільце з атомом вуглецю або гетероатомом радикала A*, яке, додатково до атома азоту, необов’язково може містити як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп,
з утворенням першої суміші діастереомерів,
де перша суміш діастереомерів є сумішшю діастереомерів (IVa) і (IVb), в якій бажаний діастереомер присутній в більшій кількості:
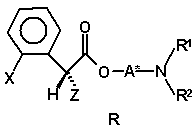 , (IVa)
, (IVa)
 , (IVb)
, (IVb)
в якій X, Z, A*, R1 і R2 мають значення, вказані вище,
та першу суміш діастереомерів потім піддають взаємодії зі сполукою формули (V)
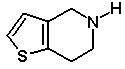 (V)
(V)
з утворенням другої суміші діастереомерів, в якій бажаний діастереомер присутній в більшій кількості, де друга суміш діастереомерів є сумішшю діастереомерів (VIa) і (VIb)
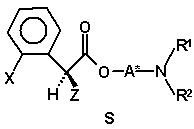
 , (VIa)
, (VIa)
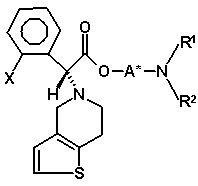 (VIb)
(VIb)
та сполуку формули (Ia) одержують шляхом реакції переетерифікації з другої суміші діастереомерів (VIa) і (VIb).
2. Спосіб за пунктом 1, в якому реакцію переетерифікації з другої суміші діастереомерів (VIa) і (VIb) з утворенням сполуки формули (Ia) проводять після відділення бажаного діастереомеру.
3. Спосіб за пунктом 1 або 2, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності Ti- або Si-каталізатора.
4. Спосіб за пунктом 3, в якому Ti-каталізатор являє собою продукт реакції етиленгліколю і алкоксиду титану (IV), а Si-каталізатор являє собою хлорований кремнезем.
5. Спосіб за пунктом 1 або 2, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності каталізатора, який являє собою галогенід перехідного металу першої або другої підгрупи періодичної таблиці елементів.
6. Спосіб за пунктом 5, в якому каталізатор являє собою каталізатор, вибраний із ZnX2, Cu2X2, CuX2, AgX, AuX, AuX3, CdX2, Hg2X2, CoX2 і HgX2, в якому X являє собою іон галогеніду, вибраний з фториду, хлориду, броміду і йодиду.
7. Спосіб за пунктом 6, в якому каталізатор являє собою хлорид цинку.
8. Спосіб за будь-яким з пунктів 5-7, в якому переетерифікація відбувається в присутності органічної основи.
9. Спосіб за будь-яким з пунктів 1-8, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 2 : 1 або вище.
10. Спосіб за пунктом 9, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 3 : 1 або вище.
11. Спосіб за пунктом 9 або 10, в якому продукт реакції сполуки формули II
 (II)
(II)
і оптично активний аміноспирт нагрівають з кетоном в колбі зі зворотним холодильником.
12. Спосіб за будь-яким з пунктів 1-11, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 3 : 1 або вище.
13. Спосіб за пунктом 12, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 9 : 1 або вище.
14. Спосіб за будь-яким з пунктів 3-13, в якому діастереомер виділяють з другої суміші діастереомерів, яку потім піддають взаємодії з утворенням сполуки формули (Ia).
15. Спосіб за пунктом 1, в якому другу суміш діастереомерів піддають реакції без попереднього відділення діастереомеру з утворенням суміші сполук (Ia)
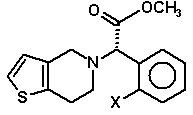 (Ia)
(Ia)
і (Ib)
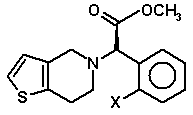 , (Ib)
, (Ib)
де X має значення, вказані вище, і потім сполуку формули (Ia) виділяють із суміші сполук формул (Ia) і (Ib) і, необов’язково, перетворюють в її фармацевтично прийнятну сіль.
16. Спосіб за пунктом 15, в якому виділення сполуки формули (Ia) з суміші сполуки формули (Ia) і (Ib) включає додавання до суміші неорганічної кислоти, осадження й відділення солі рацемату сполук формули (Ia) і (Ib), додавання до маточного розчину додаткової неорганічної кислоти і осадження й відділення солі сполуки формули (Ia).
17. Спосіб за будь-яким з пунктів 1-16, в якому діастереомери другої суміші діастереомерів перетворюють в сіль дикарбонової кислоти, яку потім піддають переетерифікації з утворенням суміші сполук формули (Ia) і (Ib).
18. Спосіб за пунктом 17, в якому дикарбонова кислота являє собою малеїнову кислоту.
19. Спосіб за будь-яким з пунктів 1-18, в якому X являє собою атом хлору.
20. Спосіб за пунктом 1, в якому радикали R1 і R2 незалежно являють собою C1-C6-алкільний радикал, C5-C10-арильний радикал, C5-C10-гетероарильний радикал, C3-C8-циклоалкільний радикал або C2-C8-гетероциклоалкільний радикал, або, разом з атомом азоту, до якого вони приєднані, являють собою насичене або мононенасичене кільце з 3-8 атомами вуглецю, яке, необов’язково, заміщене C1-C6-алкільною групою або атомом галогену і яке, додатково до атома азоту, може містити 1 або 2 додаткові гетероатоми, вибрані з атомів сірки, азоту і кисню.
21. Спосіб за будь-яким з пунктів 1-20, в якому радикал HO-A* являє собою радикал формули
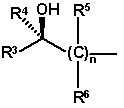 ,
,
де кожен з радикалів R3-R6 незалежно являє собою атом водню або вуглеводневий радикал з 1-20 атомами вуглецю, кожен з яких може мати до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може мати до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або
один або два радикали R3-R6 можуть утворювати 5-10-ти членне насичене або ненасичене кільце з радикалом R1 або радикалом R2, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і де n являє собою ціле число від 1 до 3.
22. Спосіб за пунктом 21, в якому радикали R5 і R6 незалежно вибирають із водню і C1-C6-алкільних радикалів.
23. Спосіб за пунктом 22, в якому лише один з радикалів R5 і R6 відрізняється від атома водню.
24. Спосіб за пунктом 22, в якому всі радикали R5 і R6 є атомами водню.
25. Спосіб за будь-яким з пунктів 21-24, в якому індекс n дорівнює 1 або 2.
26. Спосіб за будь-яким з пунктів 21-25, в якому радикал R3 являє собою C1-C6-алкільний, C5-C10-арильний, C5-C10-гетероарильний, C2-C8-гетероциклоалкільний або C3-C8-циклоалкільний радикал.
27. Спосіб за пунктом 26, в якому радикал R3 являє собою C1-C6-алкільний радикал.
28. Спосіб за будь-яким з пунктів 21-27, в якому радикал R4 являє собою атом водню.
29. Спосіб за пунктом 21, в якому радикал R3 утворює кільце з радикалом R2, де кільце має 5-10 кільцевих атомів і яке, додатково до атома азоту, з яким з’єднаний радикал R2, містить 1-3 додаткові гетероатоми, вибрані з атомів кисню, азоту і сірки, і яке може бути насиченим або моно- або біненасиченим і яке може мати 1-3 замісники, вибрані із C1-C6-алкільних радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів і атомів галогену.
30. Спосіб за будь-яким з пунктів 1-20, в якому радикал HO-A* являє собою радикал формули
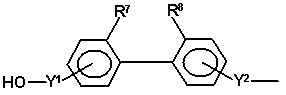 або
або
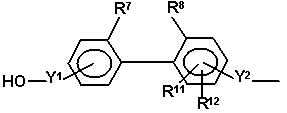 ,
,
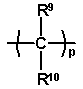
Y1 являє собою радикал
і Y2 являє собою радикал
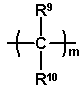 ,
,
де R9 і R10 незалежно вибирають з атомів водню і C1-C6-алкільних радикалів і радикали R7 і R8 являють собою групи, які запобігають вільному обертанню двох фенільних груп одна відносно одної, R11 і R12 незалежно являють собою атоми водню, C1-C4-алкокси радикали, атоми галогену, ціано радикали, C1-C6-алкоксикарбонільні радикали або C1-C6-алкільні радикали, або R11 і R12, разом з бензольним кільцем, до якого вони приєднані, утворюють конденсовану кільцеву структуру, вибрану з 1,3-бенздіоксолільної, α-нафтильної, β-нафтильної, тетрагідронафтильної, бензімідазолільної і бензтриазолільної структури, m являє собою ціле число від 0 до 2 і p являє собою 1 або 2.
31. Спосіб за пунктом 30, в якому один з радикалів R7 і R8 вибирають із C1-C6-алкільної групи, атома галогену і ціаногрупи, а другий радикал вибирають із C3-C6 розгалуженої алкільної групи, переважно трет-бутильної групи, атома галогену і ціаногрупи.
32. Спосіб за пунктом 1, в якому сполука формули (III)
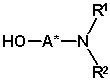 (III)
(III)
являє собою сполуку формули
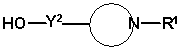 ,
,
в якій Y2 має значення, вказані в пункті 30, R1 має значення, вказані в пункті 1, і група
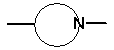
являє собою 5-ти - 10-ти членне насичене або ненасичене кільце, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп.
33. Спосіб за пунктом 32, в якому група

являє собою групу
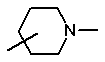 .
.
34. Спосіб одержання сполуки загальної формули (Ia)
 , (Ia)
, (Ia)
в якій X являє собою атом галогену, або її фармацевтично прийнятної солі, який включає стадію, на якій сполуку формули (II)
 , (II)
, (II)
в якій X має значення, вказані вище, і Y і Z кожен незалежно являють собою групу, яка вилучається,
піддають реакції з оптично активний аміноспиртом формули (III)
 , (III)
, (III)
в якій A* являє собою вуглеводневий радикал з 1-30 атомами вуглецю, який може містить до 5-ти гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і який має один або більше оптично активних одиниць, і
R1 і R2 незалежно являють собою атоми водню або вуглеводневі радикали з 1-20 атомами вуглецю, кожен з яких може містити до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і який може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або
один або обидва радикали R1 і R2 утворює (утворюють) 5-10-ти членне насичене або ненасичене кільце з атомом вуглецю або гетероатомом радикала A*, яке, додатково до атома азоту, необов’язково може містити як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп,
з утворенням першої суміші діастереомерів,
де перша суміш діастереомерів є сумішшю діастереомерів (IVa) і (IVb), в якій бажаний діастереомер присутній в більшій кількості:
 , (IVa)
, (IVa)
 , (IVb)
, (IVb)
в якій X, Z, A*, R1 і R2 мають значення, вказані вище,
та першу суміш діастереомерів потім піддають взаємодії зі сполукою формули (VII)
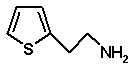 (VII)
(VII)
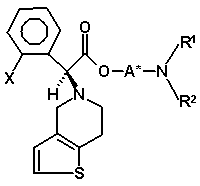
з утворенням другої суміші діастереомерів, в якій бажаний діастереомер присутній в більшій кількості, де друга суміш діастереомерів є сумішшю діастереомерів (VIIIa) і (VIIIb)
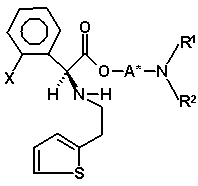 , (VIIIa)
, (VIIIa)
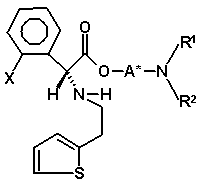 , (VIIIb)
, (VIIIb)
та сполуку формули (Ia) одержують шляхом реакції замикання кільця та реакції переетерифікації з другої суміші діастереомерів (VIIIa) і (VIIIb).
35. Спосіб за пунктом 34, в якому реакцію переетерифікації з другої суміші діастереомерів (VIIIa) і (VIIIb) з утворенням сполуки формули (Ia) проводять після відділення бажаного діастереомеру.
36. Спосіб за пунктом 34 або 35, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності Ti- або Si-каталізатора.
37. Спосіб за пунктом 36, в якому Ti-каталізатор являє собою продукт реакції етиленгліколю і алкоксиду титану (IV), а Si-каталізатор являє собою хлорований кремнезем.
38. Спосіб за пунктом 34 або 35, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності каталізатора, який являє собою галогенід перехідного металу першої або другої підгрупи періодичної таблиці елементів.
39. Спосіб за пунктом 38, в якому каталізатор являє собою каталізатор, вибраний із ZnX2, Cu2X2, CuX2, AgX, AuX, AuX3, CdX2, Hg2X2, CoX2 і HgX2, в якому X являє собою іон галогеніду, вибраний з фториду, хлориду, броміду і йодиду.
40. Спосіб за пунктом 39, в якому каталізатор являє собою хлорид цинку.
41. Спосіб за будь-яким з пунктів 38-40, в якому переетерифікація відбувається в присутності органічної основи.
42. Спосіб за будь-яким з пунктів 34-41, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 2 : 1 або вище.
43. Спосіб за пунктом 42, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 3 : 1 або вище.
44. Спосіб за пунктом 42 або 43, в якому продукт реакції сполуки формули II
 (II)
(II)
і оптично активний аміноспирт нагрівають з кетоном в колбі зі зворотним холодильником.
45. Спосіб за будь-яким з пунктів 34-44, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 3 : 1 або вище.
46. Спосіб за пунктом 45, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 9 : 1 або вище.
47. Спосіб за будь-яким з пунктів 36-46, в якому діастереомер виділяють з другої суміші діастереомерів, яку потім піддають взаємодії з утворенням сполуки формули (Ia).
48. Спосіб за пунктом 34, в якому другу суміш діастереомерів піддають реакції без попереднього відділення діастереомеру з утворенням суміші сполук (Ia)
 (Ia)
(Ia)
і (Ib)
 , (Ib)
, (Ib)
де X має значення, вказані вище, і потім сполуку формули (Ia) виділяють із суміші сполук формул (Ia) і (Ib) і, необов’язково, перетворюють в її фармацевтично прийнятну сіль.
49. Спосіб за пунктом 48, в якому виділення сполуки формули (Ia) з суміші сполуки формули (Ia) і (Ib) включає додавання до суміші неорганічної кислоти, осадження й відділення солі рацемату сполук формули (Ia) і (Ib), додавання до маточного розчину додаткової неорганічної кислоти і осадження й відділення солі сполуки формули (Ia).
50. Спосіб за будь-яким з пунктів 34-49, в якому діастереомери другої суміші діастереомерів перетворюють в сіль дикарбонової кислоти, яку потім піддають переетерифікації з утворенням суміші сполук формули (Ia) і (Ib).
51. Спосіб за пунктом 50, в якому дикарбонова кислота являє собою малеїнову кислоту.
52. Спосіб за будь-яким з пунктів 34-51, в якому X являє собою атом хлору.
53. Спосіб за пунктом 34, в якому радикали R1 і R2 незалежно являють собою C1-C6-алкільний радикал, C5-C10-арильний радикал, C5-C10-гетероарильний радикал, C3-C8-циклоалкільний радикал або C2-C8-гетероциклоалкільний радикал, або, разом з атомом азоту, до якого вони приєднані, являють собою насичене або мононенасичене кільце з 3-8 атомами вуглецю, яке, необов’язково, заміщене C1-C6-алкільною групою або атомом галогену і яке, додатково до атома азоту, може містити 1 або 2 додаткові гетероатоми, вибрані з атомів сірки, азоту і кисню.
54. Спосіб за будь-яким з пунктів 34-53, в якому радикал HO-A* являє собою радикал формули
 ,
,
де кожен з радикалів R3-R6 незалежно являє собою атом водню або вуглеводневий радикал з 1-20 атомами вуглецю, кожен з яких може мати до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може мати до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або
один або два радикали R3-R6 можуть утворювати 5-10-ти членне насичене або ненасичене кільце з радикалом R1 або радикалом R2, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і де n являє собою ціле число від 1 до 3.
55. Спосіб за пунктом 54, в якому радикали R5 і R6 незалежно вибирають із водню і C1-C6-алкільних радикалів.
56. Спосіб за пунктом 55, в якому лише один з радикалів R5 і R6 відрізняється від атома водню.
57. Спосіб за пунктом 55, в якому всі радикали R5 і R6 є атомами водню.
58. Спосіб за будь-яким з пунктів 54-57, в якому індекс n дорівнює 1 або 2.
59. Спосіб за будь-яким з пунктів 54-58, в якому радикал R3 являє собою C1-C6-алкільний, C5-C10-арильний, C5-C10-гетероарильний, C2-C8-гетероциклоалкільний або C3-C8-циклоалкільний радикал.
60. Спосіб за пунктом 59, в якому радикал R3 являє собою C1-C6-алкільний радикал.
61. Спосіб за будь-яким з пунктів 54-60, в якому радикал R4 являє собою атом водню.
62. Спосіб за пунктом 54, в якому радикал R3 утворює кільце з радикалом R2, де кільце має 5-10 кільцевих атомів і яке, додатково до атома азоту, з яким з’єднаний радикал R2, містить 1-3 додаткові гетероатоми, вибрані з атомів кисню, азоту і сірки, і яке може бути насиченим або моно- або бі-ненасиченим і яке може мати 1-3 замісники, вибрані із C1-C6-алкільних радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів і атомів галогену.
63. Спосіб за будь-яким з пунктів 34-53, в якому радикал HO-A* являє собою радикал формули
 або
або
 ,
,
Y1 являє собою радикал

і Y2 являє собою радикал
 ,
,
де R9 і R10 незалежно вибирають з атомів водню і C1-C6-алкільних радикалів і радикали R7 і R8 являють собою групи, які запобігають вільному обертанню двох фенільних груп одна відносно одної, R11 і R12 незалежно являють собою атоми водню, C1-C4-алкокси радикали, атоми галогену, ціано радикали, C1-C6-алкоксикарбонільні радикали або C1-C6-алкільні радикали, або R11 і R12, разом з бензольним кільцем, до якого вони приєднані, утворюють конденсовану кільцеву структуру, вибрану з 1,3-бенздіоксолільної, α-нафтильної, β-нафтильної, тетрагідронафтильної, бензімідазолільної і бензтриазолільної структури, m являє собою ціле число від 0 до 2 і p являє собою 1 або 2.
64. Спосіб за пунктом 63, в якому один з радикалів R7 і R8 вибирають із C1-C6-алкільної групи, атома галогену і ціаногрупи, а другий радикал вибирають із C3-C6 розгалуженої алкільної групи, переважно трет-бутильної групи, атома галогену і ціаногрупи.
65. Спосіб за пунктом 34, в якому сполука формули (III)
 (III)
(III)
являє собою сполуку формули
 ,
,
в якій Y2 має значення, вказані в пункті 63, R1 має значення, вказані в пункті 34, і група

являє собою 5-ти - 10-ти членне насичене або ненасичене кільце, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп.
66. Спосіб за пунктом 65, в якому група

являє собою групу
 .
.
67. Суміш діастереомерів (IVa)
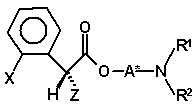 (IVa)
(IVa)
і (IVb)
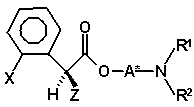 , (IVb)
, (IVb)
де X і Z мають значення, вказані в пункті 1, і A*, R1 і R2 мають значення, вказані в будь-якому з пунктів 1 - 32.
68. Суміш за пунктом 67, в якій співвідношення між діастереомером (IVa) і діастереомером (IVb) становить 2 : 1 або більше.
69. Суміш за пунктом 68, в якій співвідношення між діастереомером (IVa) і діастереомером (IVb) становить 3 : 1 або більше.
70. Сполука формули (IVa)
 , (IVa)
, (IVa)
в якій радикали X, Z, A*, R1 і R2 мають значення, вказані в пункті 67.
71. Суміш діастереомерів (VIa)
 (VIa)
(VIa)
і (VIb)
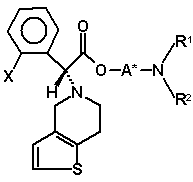 , (VIb)
, (VIb)
де радикал X має значення, вказані в пункті 1, і радикали A*, R1 і R2 мають значення, вказані в будь-якому з пунктів 1-33, або їх солі.
72. Суміш за пунктом 71, в якій діастереомери знаходяться у вигляді малеатної, фумаратної або оксалатної солі.
73. Суміш за пунктом 72, в якій співвідношення між діастереомером (VIa) і діастереомером (VIb) становить 3 : 1 або більше.
74. Суміш за пунктом 73, яка містить 98 % або більше діастереомеру (VIa) і 2 % або менше діастереомеру (VIb).
75. Сполука формули (VIa)
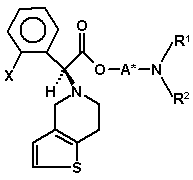 , (VIa)
, (VIa)
в якій радикали X, A*, R1 і R2 мають значення, вказані в пункті 71, або її сіль.
76. Сполука за пунктом 75 у вигляді малеатної, фумаратної або оксалатної солі.
77. Суміш діастереомерів (VIIIa)
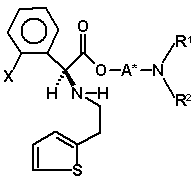 (VIIIa)
(VIIIa)
і (VIIIb)
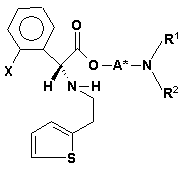 , (VIIIb)
, (VIIIb)
де радикал X має значення, вказані в пункті 1, і радикали A*, R1 і R2 мають значення, вказані в будь-якому з пунктів 34-66, або їх солі.
78. Суміш за пунктом 77, в якій діастереомери знаходяться у вигляді малеатної, фумаратної або оксалатної солі.
79. Суміш за пунктом 78, в якій співвідношення між діастереомерами (VIIIa) і (VIIIb) становить 3 : 1 або більше.
80. Суміш за пунктом 79, в якій міститься 98 % або більше діастереомеру (VIIIa) і 2 % або менше діастереомеру (VIIIb).
81. Сполука формули (VIIIa)
 , (VIIIa)
, (VIIIa)
в якій радикали X, A*, R1 і R2 мають значення, вказані в пункті 77, або її сіль.
82. Сполука за пунктом 81 у вигляді малеатної, фумаратної або оксалатної солі.
Текст
УКРАЇНА (19) UA (11) 93030 (13) C2 (51) МПК C07D 495/04 (2006.01) C07D 333/20 (2006.01) C07C 211/08 (2006.01) C07C 209/68 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) СПОСІБ ОДЕРЖАННЯ КЛОПІДОГРЕЛУ (ВАРІАНТИ) ТА ПРОМІЖНІ СПОЛУКИ S X , (Ia) в якій X являє собою атом галогену, або її фармацевтично прийнятної солі, який включає стадію, на якій сполуку формули (II) X O Y Z , (II) в якій X має значення, вказані вище, і Y і Z кожен незалежно являють собою групу, яка вилучається, піддають реакції з оптично активним аміноспиртом формули (III) R1 HO A* O R1 O A* N X R2 H Z R N R2 , (III) C2 (13) N 93030 OCH3 (11) O в якій A* являє собою вуглеводневий радикал з 130 атомами вуглецю, який може містить до 5-ти гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і який має одну або більше оптично активних одиниць, і R1 і R2 незалежно являють собою атоми водню або вуглеводневі радикали з 1-20 атомами вуглецю, кожен з яких може містити до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і який може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або один або обидва радикали R1 і R2 утворює (утворюють) 5-10-ти членне насичене або ненасичене кільце з атомом вуглецю або гетероатомом радикала A*, яке, додатково до атома азоту, необов’язково може містити як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп, з утворенням першої суміші діастереомерів, де перша суміш діастереомерів є сумішшю діастереомерів (IVa) і (IVb), в якій бажаний діастереомер присутній в більшій кількості: (19) (21) a200611996 (22) 03.12.2004 (24) 10.01.2011 (86) PCT/EP2004/013773, 03.12.2004 (31) 04009280.1 (32) 20.04.2004 (33) EP (46) 10.01.2011, Бюл.№ 1, 2011 р. (72) СТОХАНДЛ ІРЖІ, CZ, ФРАНТІШЕК ЯРОСЛАВ, CZ, НЕСС ВІНФРІД, DE (73) РАТІОФАРМ ГМБХ, DE (56) WO 9918110 A, 15.04.1999 WO 03035652 A1, 01.05.2003 (57) 1. Спосіб одержання сполуки загальної формули (Ia) 2 UA 1 , (IVa) 3 93030 O R1 O A* N X R2 H Z S , (IVb) в якій X, Z, A*, R1 і R2 мають значення, вказані вище, та першу суміш діастереомерів потім піддають взаємодії зі сполукою формули (V) N H S (V) з утворенням другої суміші діастереомерів, в якій бажаний діастереомер присутній в більшій кількості, де друга суміш діастереомерів є сумішшю діастереомерів (VIa) і (VIb) O R1 O A* N X H N X O Y Z , (VIa) O R1 O A* N H N S сиду титану (IV), а Si-каталізатор являє собою хлорований кремнезем. 5. Спосіб за пунктом 1 або 2, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності каталізатора, який являє собою галогенід перехідного металу першої або другої підгрупи періодичної таблиці елементів. 6. Спосіб за пунктом 5, в якому каталізатор являє собою каталізатор, вибраний із ZnX2, Cu2X2, CuX2, AgX, AuX, AuX3, CdX2, Hg2X2, CoX2 і HgX2, в якому X являє собою іон галогеніду, вибраний з фториду, хлориду, броміду і йодиду. 7. Спосіб за пунктом 6, в якому каталізатор являє собою хлорид цинку. 8. Спосіб за будь-яким з пунктів 5-7, в якому переетерифікація відбувається в присутності органічної основи. 9. Спосіб за будь-яким з пунктів 1-8, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 2 : 1 або вище. 10. Спосіб за пунктом 9, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 3 : 1 або вище. 11. Спосіб за пунктом 9 або 10, в якому продукт реакції сполуки формули II R2 S X 4 R2 (VIb) та сполуку формули (Ia) одержують шляхом реакції переетерифікації з другої суміші діастереомерів (VIa) і (VIb). 2. Спосіб за пунктом 1, в якому реакцію переетерифікації з другої суміші діастереомерів (VIa) і (VIb) з утворенням сполуки формули (Ia) проводять після відділення бажаного діастереомеру. 3. Спосіб за пунктом 1 або 2, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності Ti- або Si-каталізатора. 4. Спосіб за пунктом 3, в якому Ti-каталізатор являє собою продукт реакції етиленгліколю і алкок (II) і оптично активний аміноспирт нагрівають з кетоном в колбі зі зворотним холодильником. 12. Спосіб за будь-яким з пунктів 1-11, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 3 : 1 або вище. 13. Спосіб за пунктом 12, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 9 : 1 або вище. 14. Спосіб за будь-яким з пунктів 3-13, в якому діастереомер виділяють з другої суміші діастереомерів, яку потім піддають взаємодії з утворенням сполуки формули (Ia). 15. Спосіб за пунктом 1, в якому другу суміш діастереомерів піддають реакції без попереднього відділення діастереомеру з утворенням суміші сполук (Ia) OCH3 O N S і (Ib) X (Ia) 5 O 93030 OCH3 N S X , (Ib) де X має значення, вказані вище, і потім сполуку формули (Ia) виділяють із суміші сполук формул (Ia) і (Ib) і, необов’язково, перетворюють в її фармацевтично прийнятну сіль. 16. Спосіб за пунктом 15, в якому виділення сполуки формули (Ia) з суміші сполуки формули (Ia) і (Ib) включає додавання до суміші неорганічної кислоти, осадження й відділення солі рацемату сполук формули (Ia) і (Ib), додавання до маточного розчину додаткової неорганічної кислоти і осадження й відділення солі сполуки формули (Ia). 17. Спосіб за будь-яким з пунктів 1-16, в якому діастереомери другої суміші діастереомерів перетворюють в сіль дикарбонової кислоти, яку потім піддають переетерифікації з утворенням суміші сполук формули (Ia) і (Ib). 18. Спосіб за пунктом 17, в якому дикарбонова кислота являє собою малеїнову кислоту. 19. Спосіб за будь-яким з пунктів 1-18, в якому X являє собою атом хлору. 20. Спосіб за пунктом 1, в якому радикали R1 і R2 незалежно являють собою C1-C6-алкільний радикал, C5-C10-арильний радикал, C5-C10гетероарильний радикал, C3-C8-циклоалкільний радикал або C2-C8-гетероциклоалкільний радикал, або, разом з атомом азоту, до якого вони приєднані, являють собою насичене або мононенасичене кільце з 3-8 атомами вуглецю, яке, необов’язково, заміщене C1-C6-алкільною групою або атомом галогену і яке, додатково до атома азоту, може містити 1 або 2 додаткові гетероатоми, вибрані з атомів сірки, азоту і кисню. 21. Спосіб за будь-яким з пунктів 1-20, в якому радикал HO-A* являє собою радикал формули R4 OH R5 6 радикалів, C2-C6-алкенільних радикалів, C1-C6алкокси радикалів, C5-C10-арильних радикалів, C5C10-гетероарильних радикалів, C3-C8циклоалкільних радикалів, C2-C8гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і де n являє собою ціле число від 1 до 3. 22. Спосіб за пунктом 21, в якому радикали R5 і R6 незалежно вибирають із водню і C1-C6-алкільних радикалів. 23. Спосіб за пунктом 22, в якому лише один з радикалів R5 і R6 відрізняється від атома водню. 24. Спосіб за пунктом 22, в якому всі радикали R5 і R6 є атомами водню. 25. Спосіб за будь-яким з пунктів 21-24, в якому індекс n дорівнює 1 або 2. 26. Спосіб за будь-яким з пунктів 21-25, в якому радикал R3 являє собою C1-C6-алкільний, C5-C10арильний, C5-C10-гетероарильний, C2-C8гетероциклоалкільний або C3-C8-циклоалкільний радикал. 27. Спосіб за пунктом 26, в якому радикал R3 являє собою C1-C6-алкільний радикал. 28. Спосіб за будь-яким з пунктів 21-27, в якому радикал R4 являє собою атом водню. 29. Спосіб за пунктом 21, в якому радикал R3 утворює кільце з радикалом R2, де кільце має 5-10 кільцевих атомів і яке, додатково до атома азоту, з яким з’єднаний радикал R2, містить 1-3 додаткові гетероатоми, вибрані з атомів кисню, азоту і сірки, і яке може бути насиченим або моно- або біненасиченим і яке може мати 1-3 замісники, вибрані із C1-C6-алкільних радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8циклоалкільних радикалів, C2-C8гетероциклоалкільних радикалів і атомів галогену. 30. Спосіб за будь-яким з пунктів 1-20, в якому радикал HO-A* являє собою радикал формули R7 HO R8 Y2 Y1 або R3 R7 (C)n R8 R6 , де кожен з радикалів R3-R6 незалежно являє собою атом водню або вуглеводневий радикал з 120 атомами вуглецю, кожен з яких може мати до 4х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може мати до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або один або два радикали R3-R6 можуть утворювати 5-10-ти членне насичене або ненасичене кільце з радикалом R1 або радикалом R2, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних HO Y2 Y1 R11 1 Y являє собою радикал R9 C p R10 і Y2 являє собою радикал R12 , 7 93030 8 R9 C N m R10 , де R і R10 незалежно вибирають з атомів водню і C1-C6-алкільних радикалів і радикали R7 і R8 являють собою групи, які запобігають вільному обертанню двох фенільних груп одна відносно одної, R11 і R12 незалежно являють собою атоми водню, C1-C4-алкокси радикали, атоми галогену, ціано радикали, C1-C6-алкоксикарбонільні радикали або C1-C6-алкільні радикали, або R11 і R12, разом з бензольним кільцем, до якого вони приєднані, утворюють конденсовану кільцеву структуру, вибрану з 1,3-бенздіоксолільної, α-нафтильної, βнафтильної, тетрагідронафтильної, бензімідазолільної і бензтриазолільної структури, m являє собою ціле число від 0 до 2 і p являє собою 1 або 2. 31. Спосіб за пунктом 30, в якому один з радикалів R7 і R8 вибирають із C1-C6-алкільної групи, атома галогену і ціаногрупи, а другий радикал вибирають із C3-C6 розгалуженої алкільної групи, переважно трет-бутильної групи, атома галогену і ціаногрупи. 32. Спосіб за пунктом 1, в якому сполука формули (III) 9 R1 HO A* O OCH3 N S X , (Ia) в якій X являє собою атом галогену, або її фармацевтично прийнятної солі, який включає стадію, на якій сполуку формули (II) X O Y Z , (II) в якій X має значення, вказані вище, і Y і Z кожен незалежно являють собою групу, яка вилучається, піддають реакції з оптично активний аміноспиртом формули (III) R1 N HO R2 (III) являє собою сполуку формули HO . 34. Спосіб одержання сполуки загальної формули (Ia) Y2 N R1 , в якій Y2 має значення, вказані в пункті 30, R1 має значення, вказані в пункті 1, і група N являє собою 5-ти - 10-ти членне насичене або ненасичене кільце, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп. 33. Спосіб за пунктом 32, в якому група N являє собою групу A* N R2 , (III) в якій A* являє собою вуглеводневий радикал з 130 атомами вуглецю, який може містить до 5-ти гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і який має один або більше оптично активних одиниць, і R1 і R2 незалежно являють собою атоми водню або вуглеводневі радикали з 1-20 атомами вуглецю, кожен з яких може містити до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і який може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або один або обидва радикали R1 і R2 утворює (утворюють) 5-10-ти членне насичене або ненасичене кільце з атомом вуглецю або гетероатомом радикала A*, яке, додатково до атома азоту, необов’язково може містити як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8-гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп, з утворенням першої суміші діастереомерів, 9 93030 де перша суміш діастереомерів є сумішшю діастереомерів (IVa) і (IVb), в якій бажаний діастереомер присутній в більшій кількості: O R1 O A* N X R2 H Z R , (IVa) O R1 O A* N X R2 H Z S , (IVb) в якій X, Z, A*, R і R2 мають значення, вказані вище, та першу суміш діастереомерів потім піддають взаємодії зі сполукою формули (VII) 1 S NH2 (VII) з утворенням другої суміші діастереомерів, в якій бажаний діастереомер присутній в більшій кількості, де друга суміш діастереомерів є сумішшю діастереомерів (VIIIa) і (VIIIb) O X R1 O A* N H N H R2 X X O Y , (VIIIa) R1 O A* N H N H R2 S та сполуку формули (Ia) одержують шляхом реакції замикання кільця та реакції переетерифікації з другої суміші діастереомерів (VIIIa) і (VIIIb). 35. Спосіб за пунктом 34, в якому реакцію переетерифікації з другої суміші діастереомерів (VIIIa) і (VIIIb) з утворенням сполуки формули (Ia) проводять після відділення бажаного діастереомеру. 36. Спосіб за пунктом 34 або 35, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності Ti- або Si-каталізатора. 37. Спосіб за пунктом 36, в якому Ti-каталізатор являє собою продукт реакції етиленгліколю і алкоксиду титану (IV), а Si-каталізатор являє собою хлорований кремнезем. 38. Спосіб за пунктом 34 або 35, в якому взаємодія другої суміші діастереомерів з утворенням сполуки формули (Ia) включає переетерифікацію в присутності каталізатора, який являє собою галогенід перехідного металу першої або другої підгрупи періодичної таблиці елементів. 39. Спосіб за пунктом 38, в якому каталізатор являє собою каталізатор, вибраний із ZnX2, Cu2X2, CuX2, AgX, AuX, AuX3, CdX2, Hg2X2, CoX2 і HgX2, в якому X являє собою іон галогеніду, вибраний з фториду, хлориду, броміду і йодиду. 40. Спосіб за пунктом 39, в якому каталізатор являє собою хлорид цинку. 41. Спосіб за будь-яким з пунктів 38-40, в якому переетерифікація відбувається в присутності органічної основи. 42. Спосіб за будь-яким з пунктів 34-41, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 2 : 1 або вище. 43. Спосіб за пунктом 42, в якому співвідношення першого діастереомеру до другого діастереомеру в першій суміші діастереомерів становить 3 : 1 або вище. 44. Спосіб за пунктом 42 або 43, в якому продукт реакції сполуки формули II Z S O 10 , (VIIIb) (II) і оптично активний аміноспирт нагрівають з кетоном в колбі зі зворотним холодильником. 45. Спосіб за будь-яким з пунктів 34-44, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 3 : 1 або вище. 46. Спосіб за пунктом 45, в якому співвідношення першого діастереомеру до другого діастереомеру в другій суміші діастереомерів становить 9 : 1 або вище. 47. Спосіб за будь-яким з пунктів 36-46, в якому діастереомер виділяють з другої суміші діастереомерів, яку потім піддають взаємодії з утворенням сполуки формули (Ia). 48. Спосіб за пунктом 34, в якому другу суміш діастереомерів піддають реакції без попереднього 11 93030 відділення діастереомеру з утворенням суміші сполук (Ia) OCH3 O N S X (Ia) і (Ib) O OCH3 N S X , (Ib) де X має значення, вказані вище, і потім сполуку формули (Ia) виділяють із суміші сполук формул (Ia) і (Ib) і, необов’язково, перетворюють в її фармацевтично прийнятну сіль. 49. Спосіб за пунктом 48, в якому виділення сполуки формули (Ia) з суміші сполуки формули (Ia) і (Ib) включає додавання до суміші неорганічної кислоти, осадження й відділення солі рацемату сполук формули (Ia) і (Ib), додавання до маточного розчину додаткової неорганічної кислоти і осадження й відділення солі сполуки формули (Ia). 50. Спосіб за будь-яким з пунктів 34-49, в якому діастереомери другої суміші діастереомерів перетворюють в сіль дикарбонової кислоти, яку потім піддають переетерифікації з утворенням суміші сполук формули (Ia) і (Ib). 51. Спосіб за пунктом 50, в якому дикарбонова кислота являє собою малеїнову кислоту. 52. Спосіб за будь-яким з пунктів 34-51, в якому X являє собою атом хлору. 1 2 53. Спосіб за пунктом 34, в якому радикали R і R незалежно являють собою C1-C6-алкільний радикал, C5-C10-арильний радикал, C5-C10гетероарильний радикал, C3-C8-циклоалкільний радикал або C2-C8-гетероциклоалкільний радикал, або, разом з атомом азоту, до якого вони приєднані, являють собою насичене або мононенасичене кільце з 3-8 атомами вуглецю, яке, необов’язково, заміщене C1-C6-алкільною групою або атомом галогену і яке, додатково до атома азоту, може містити 1 або 2 додаткові гетероатоми, вибрані з атомів сірки, азоту і кисню. 54. Спосіб за будь-яким з пунктів 34-53, в якому радикал HO-A* являє собою радикал формули R4 OH R5 12 х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може мати до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або 3 6 один або два радикали R -R можуть утворювати 5-10-ти членне насичене або ненасичене кільце з радикалом R1 або радикалом R2, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6-алкенільних радикалів, C1-C6алкокси радикалів, C5-C10-арильних радикалів, C5C10-гетероарильних радикалів, C3-C8циклоалкільних радикалів, C2-C8гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і де n являє собою ціле число від 1 до 3. 55. Спосіб за пунктом 54, в якому радикали R5 і R6 незалежно вибирають із водню і C1-C6-алкільних радикалів. 56. Спосіб за пунктом 55, в якому лише один з радикалів R5 і R6 відрізняється від атома водню. 57. Спосіб за пунктом 55, в якому всі радикали R5 і R6 є атомами водню. 58. Спосіб за будь-яким з пунктів 54-57, в якому індекс n дорівнює 1 або 2. 59. Спосіб за будь-яким з пунктів 54-58, в якому радикал R3 являє собою C1-C6-алкільний, C5-C10арильний, C5-C10-гетероарильний, C2-C8гетероциклоалкільний або C3-C8-циклоалкільний радикал. 60. Спосіб за пунктом 59, в якому радикал R3 являє собою C1-C6-алкільний радикал. 61. Спосіб за будь-яким з пунктів 54-60, в якому радикал R4 являє собою атом водню. 62. Спосіб за пунктом 54, в якому радикал R3 утворює кільце з радикалом R2, де кільце має 5-10 кільцевих атомів і яке, додатково до атома азоту, з яким з’єднаний радикал R2, містить 1-3 додаткові гетероатоми, вибрані з атомів кисню, азоту і сірки, і яке може бути насиченим або моно- або біненасиченим і яке може мати 1-3 замісники, вибрані із C1-C6-алкільних радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8циклоалкільних радикалів, C2-C8гетероциклоалкільних радикалів і атомів галогену. 63. Спосіб за будь-яким з пунктів 34-53, в якому радикал HO-A* являє собою радикал формули R7 HO R8 Y2 Y1 або R3 R7 (C)n R8 R6 , де кожен з радикалів R3-R6 незалежно являє собою атом водню або вуглеводневий радикал з 120 атомами вуглецю, кожен з яких може мати до 4 HO Y1 Y2 R11 R12 , 13 93030 Y1 являє собою радикал 14 66. Спосіб за пунктом 65, в якому група R9 C N p являє собою групу R10 і Y2 являє собою радикал N R9 C . 67. Суміш діастереомерів (IVa) m O R10 , де R9 і R10 незалежно вибирають з атомів водню і C1-C6-алкільних радикалів і радикали R7 і R8 являють собою групи, які запобігають вільному обертанню двох фенільних груп одна відносно одної, R11 і R12 незалежно являють собою атоми водню, C1-C4-алкокси радикали, атоми галогену, ціано радикали, C1-C6-алкоксикарбонільні радикали або C1-C6-алкільні радикали, або R11 і R12, разом з бензольним кільцем, до якого вони приєднані, утворюють конденсовану кільцеву структуру, вибрану з 1,3-бенздіоксолільної, α-нафтильної, βнафтильної, тетрагідронафтильної, бензімідазолільної і бензтриазолільної структури, m являє собою ціле число від 0 до 2 і p являє собою 1 або 2. 64. Спосіб за пунктом 63, в якому один з радикалів R7 і R8 вибирають із C1-C6-алкільної групи, атома галогену і ціаногрупи, а другий радикал вибирають із C3-C6 розгалуженої алкільної групи, переважно трет-бутильної групи, атома галогену і ціаногрупи. 65. Спосіб за пунктом 34, в якому сполука формули (III) R1 HO A* R1 O A* N X R2 H Z O R1 O A* N X R2 , (IVb) H Z де X і Z мають значення, вказані в пункті 1, і A*, R1 і R2 мають значення, вказані в будь-якому з пунктів 1 - 32. 68. Суміш за пунктом 67, в якій співвідношення між діастереомером (IVa) і діастереомером (IVb) становить 2 : 1 або більше. 69. Суміш за пунктом 68, в якій співвідношення між діастереомером (IVa) і діастереомером (IVb) становить 3 : 1 або більше. 70. Сполука формули (IVa) N O R1 R2 (III) являє собою сполуку формули HO Y2 (IVa) і (IVb) N R1 , в якій Y2 має значення, вказані в пункті 63, R1 має значення, вказані в пункті 34, і група H Z 1 R2 , (IVa) в якій радикали X, Z, A*, R і R2 мають значення, вказані в пункті 67. 71. Суміш діастереомерів (VIa) O N являє собою 5-ти - 10-ти членне насичене або ненасичене кільце, яке, додатково до атома азоту, необов’язково містить як кільцеві члени 1-3 гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з C1-C6-алкільних радикалів, C2-C6алкенільних радикалів, C1-C6-алкокси радикалів, C5-C10-арильних радикалів, C5-C10-гетероарильних радикалів, C3-C8-циклоалкільних радикалів, C2-C8гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп. O A* N X O A* N X H N S і (VIb) R1 R2 (VIa) 15 93030 16 і (VIIIb) O O R1 O A* N X X H N R2 S , (VIb) де радикал X має значення, вказані в пункті 1, і радикали A*, R1 і R2 мають значення, вказані в будь-якому з пунктів 1-33, або їх солі. 72. Суміш за пунктом 71, в якій діастереомери знаходяться у вигляді малеатної, фумаратної або оксалатної солі. 73. Суміш за пунктом 72, в якій співвідношення між діастереомером (VIa) і діастереомером (VIb) становить 3 : 1 або більше. 74. Суміш за пунктом 73, яка містить 98 % або більше діастереомеру (VIa) і 2 % або менше діастереомеру (VIb). 75. Сполука формули (VIa) O H N O X R2 S , (VIa) в якій радикали X, A*, R1 і R2 мають значення, вказані в пункті 71, або її сіль. 76. Сполука за пунктом 75 у вигляді малеатної, фумаратної або оксалатної солі. 77. Суміш діастереомерів (VIIIa) O X O A* N H N H R2 S , (VIIIb) де радикал X має значення, вказані в пункті 1, і радикали A*, R1 і R2 мають значення, вказані в будь-якому з пунктів 34-66, або їх солі. 78. Суміш за пунктом 77, в якій діастереомери знаходяться у вигляді малеатної, фумаратної або оксалатної солі. 79. Суміш за пунктом 78, в якій співвідношення між діастереомерами (VIIIa) і (VIIIb) становить 3 : 1 або більше. 80. Суміш за пунктом 79, в якій міститься 98 % або більше діастереомеру (VIIIa) і 2 % або менше діастереомеру (VIIIb). 81. Сполука формули (VIIIa) R1 O A* N X R1 R1 O A* N H N H R2 S , (VIIIa) в якій радикали X, A*, R1 і R2 мають значення, вказані в пункті 77, або її сіль. 82. Сполука за пунктом 81 у вигляді малеатної, фумаратної або оксалатної солі. R1 O A* N H N H R2 S (VIIIa) Даний винахід стосується стереоселективного способу одержання оптично чистих метилових ефірів (2-галогенфеніл)(6,7-дигідро-4Н-тієно[3,2с]піридин-5-іл) оцтової кислоти, зокрема клопідог 17 релу, і проміжних сполук для застосування в цьому способі. Цей спосіб несподівано надає можливість кваліфікованому фахівцю одержувати оптично чисті кінцеві сполуки більш легко та з кращим виходом. Метилові ефіри (2-галогенфеніл)(6,7-дигідро4Н-тієно[3,2-с]піридин-5-іл) оцтової кислоти та їх солі добре відомі як інгібітори агрегації тромбоцитів. Зокрема, сполука Клопідогрел, яка, наприклад, описана в ЕР-А 99 802 і яка має формулу є високоефективною фармацевтичною речовиною. Клопідогрел представляє собою правообертальну сполуку метиловий ефір (+)-[(S)-(2хлорфеніл)-(6,7-дигідро-4Н-тієно[3,2-с]піридин-5іл)оцтової кислоти, який надходить у продаж у вигляді гідросульфату. З рівня техніки відомі різноманітні способи одержання клопідогрелу. У відомих способах, які, наприклад, описані в ЕР-А 99 802 і ЕР-А 420 706, сполуку 93030 18 хідно здійснювати на певній стадії процесу в усіх способах одержання клопідогрелу і будь-які подальші стадії способу повинні відбуватися з оптично чистими енантіомерами. У випадку синтезу клопідогрелу, розділення енантіомерів зазвичай здійснюють на відносно пізній стадії способу, часто лише після останньої стадії синтезу, що зумовлює ризик виникнення утруднень. Якщо розділення енантіомерів здійснюють шляхом взаємодії рацемічної суміші зі сполукою чистих енантіомерів й наступного осадження одного з утворених діастереомерів, то селективного осадження часто не відбувається. Якщо бажаний енантіомер отримують лише з низьким виходом або з мінімальною оптичною чистотою, то необхідно здійснювати додаткові стадії очищення. Таким чином, якщо розділення енантіомерів здійснюють відповідно до прикладів, наведених в WO 98/51681, то часто отримують оптично забруднену речовину і для досягнення потрібної оптичної чистоти необхідно здійснювати додаткову обробку. Розділення рацематів є особливо складним, якщо його здійснюють на сполуці з піридиновим кільцем, яке вже замкнуте. Таким чином, розділення енантіомерів відповідно до способу, описаного в WO 98/51681, здійснюють на проміжній сполуці з відкритим ланцюгом, тобто проміжній сполуці або піддають взаємодії є тієнопіридиновим радикалом Незважаючи на це, ці способи вважають непідходящими для подальшого удосконалення і при їх здійсненні у вказаних умовах одержують відносно низькі виходи. Таким чином, існує багато джерел інформації, метою яких є удосконалений синтез клопідогрелу. Наприклад, в заявці WO 98/51681 описано спосіб, який здійснюють за допомогою проміжних сполук з відкритим ланцюгом В переважній більшості способів, запропонованих останнім часом, пропонується відкладання замикання піридинового кільця на останню стадію способу після розділення енантіомерів. В заявці WO 03/035652 описаний способі одержання клопідогрелу, який здійснюють шляхом одержання проміжної сполуки формули в якій А1 і А2 незалежно можуть бути вибрані із водню або С1-С4-алкільних груп або можуть утворювати кільце. Спочатку сполуку готують у вигляді рацемату, а потім вона розпадається на окремі енантіомери. Клопідогрел отримують з оптично активного аміду кислоти за допомогою реакції, наприклад, з метанолом і сірчаною кислотою. Задачею винаходу є забезпечення нового синтезу сполук формули (Іа) Оскільки цільова молекула є правообертальною молекулою, то розділення енантіомерів необ де X являє собою атом галогену, який є недорогим, а також може здійснюватися за декілька стадій. 19 93030 Ця задача вирішується за допомогою способу одержання сполуки загальної формули (Іа) (Іа) в якій X являє собою атом галогену, або її фармацевтично прийнятної солі, який включає стадію взаємодії сполуки формули (II) (ІІ) в якій X має значення, вказані вище, і Υ і Ζ незалежно представляють собою групу, яка вилучається, з оптично активним аміноспиртом з утворенням першої суміші діастереомерів. Відповідно до винаходу, несподівано було виявлено, що при взаємодії формули (II) (ІІ) з оптично активним аміноспиртом, утворюється перша суміш діастереомерів, яка збагачена одним із двох діастереомерів; в основному, утворюється суміш діастереомерів, в якій співвідношення першого діастереомеру до другого діастереомеру становить 2:1 або більше. Переважно, співвідношення одного діастереомеру до іншого діастереомеру становить навіть 3:1 або вище, особливо приблизно 4:1 або вище. Відповідно до винаходу, можливе виділення бажаного діастереомеру навіть з першої суміші діастереомерів і здійснення подальшого синтезу клопідогрелу лише з цим одним діастереомером. Тим не менше, переважним, відповідно до винаходу, є обробка першої діастереомерної суміші як такої. Також несподівано було виявлено, що при взаємодії цієї першої суміші діастереомерів зі сполукою формули (V) (V) або зі сполукою формули (VII) (VII) утворюється друга суміш діастереомерів, яка збагачена одним з двох діастереомерів, навіть більше, ніж перша суміш діастереомерів. В другій суміші діастереомерів, співвідношення першого діастереомеру до другого діастереомеру переважно становить 3:1 або вище, більш переважно 4:1 або вище, найбільш переважно 9:1 або вище. В особливо переважному варіанті здійснення винаходу, друга суміш діастереомерів містить бажаний діастереомер в співвідношенні 95% або більше, а небажаний діастереомер лише в співвідношенні 20 5% або менше, більш переважно бажаний діастереомер міститься в співвідношенні 98% або більше, а небажаний діастереомер лише в співвідношенні 2% або менше, і може бути отримане співвідношення бажаного діастереомеру до небажаного діастереомеру приблизно 99,5:0,5 або краще. Співвідношення бажаного діастереомеру до небажаного діастереомеру в другій суміші діастереомерів переважно вище, ніж в першій суміші діастереомерів. За допомогою підходящого вибору оптичної активності оптично активного аміноспирту може бути отриманий в надлишку той чи інший діастереомер. Таким чином, шляхом реакції сполуки формули (II) (ІІ) з оптично активним аміноспиртом уже на дуже ранній стадії способу може бути отримана суміш діастереомерів, яка містить бажаний діастереомер в надлишку. Потім її можна піддавати реакції з одержанням сполуки формули (Іа) (Іа) При завершенні реакції отримують або клопідогрел з бажаною просторовою структурою або суміш енантіомерів, в якій у значному надлишку вже присутній бажаний енантіомер (клопідогрел). При цьому не потрібно здійснювати розділення рацемату, або розділення рацемату може бути здійснено більш легко і з кращим виходом. Відповідно до винаходу, радикал X являє собою атом галогену, переважно атом фтору, хлору, брому або йоду, більш переважно атом хлору. Відповідно до винаходу, радикали Υ і Ζ є звичайними групами, що вилучаються, які добре відомі з рівня техніки і описані, наприклад, в Peter Sykes, "Reaktionsmechanismen der organischen Chemie" (Механізми реакції в органічній хімії), 9-те вид., Weinheim 1988. Переважними групами, які вилучаються, є атоми галогену, особливо атоми йоду, хлору, брому або фтору, тозилатний радикал, трифлатний радикал або бросилатний радикал. Оптично активний аміноспирт конкретно не обмежений. Переважними є ті оптично активні аміноспирти, в яких принаймні один оптично активний центр розташований близько до гідроксильної групи, яка сполучається зі сполукою формули II, переважно віддалений від гідроксильної групи не більше, ніж на один, два або три зв'язки. Особливо переважним для застосування є оптично активний аміноспирт формули (III) 21 93030 (ІІІ) В цій формулі А* представляє собою вуглеводневий радикал із 1-30 атомами вуглецю, який може містити до 5ти гетероатомів включно, вибраних із атомів азоту, кисню, сірки і галогену, і який може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і який має один або декілька оптично активних одиниць, і R1 і R2 незалежно являють собою атоми водню або вуглеводневі радикали із 1-20 атомами вуглецю, кожен з яких може містити до 4-х гетероатомів включно, вибраних із атомів азоту, кисню, сірки і галогену, і який може бути заміщений до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або один або обидва радикали R1 і R2 утворює (утворюють) 5-ти - 10ти членне насичене або ненасичене кільце з атомом вуглецю або гетероатомом радикала А*, яке, додатково до атома азоту, необов'язково може містити як кільцеві члени 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і який може бути заміщений до 5-ти замісників включно, вибраних із С1-C6-алкільних радикалів, С2-С6алкенільних радикалів, С1-C6-алкокси радикалів, С5-С10-арильних радикалів (переважно С6-С10арильних радикалів), С5-С10-гетероарильних радикалів, С3-С8-циклоалкільних радикалів, С2-С8гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп. Оптично активні аміноспирти, які можуть застосовуватися відповідно до винаходу, переважно мають лише одну гідроксильну групу для того, щоб уникнути конкуруючих реакцій при взаємодії зі сполукою формули (II). Відповідно до винаходу, переважно, коли радикали R1 і R2 незалежно являють собою С1-C6алкільний радикал, С5-С10-арильний радикал (переважно С6-С10-арильний радикал), С6-С10гетероарильний радикал, С3-С8-циклоалкільний радикал або С2-С8-гетероциклоалкільний радикал або, разом із атомом азоту, з яким вони зв'язані, утворюють насичене або ненасичене кільце із 2-8 атомами вуглецю, яке необов'язково може бути заміщене С1-C6-алкільною групою або атомом галогену, і яке може містити 1 або 2 додаткові гетероатоми, вибрані із атомів сірки, атомів азоту і атомів кисню додатково до атома азоту. В даній заявці, "*", приєднана до групи молекул, означає, що ця група молекул є оптично активною. В даній заявці переважними є наступні радикали: Переважними С1-C6-алкільними радикалами є метильний, етильний, ізопропільний, н-пропільний, н-бутильний, пентильний та гексильний радикали. Переважними арильними радикалами є фенільний або нафтильний радикали, особливо фенільні радикали, які необов'язково можуть бути заміщені 1-3 С1-С3-алкільними радикалами. Переважні С5-С10-гетероарильні радикали мають один або більше, переважно 1 або 2, гетероа 22 томів, особливо атоми азоту, кисню і/або сірки. Прикладами є імідазолільний, оксазолільний, ізоксазолільний, тіазолільний, 1,2,3-триазолільний, піридинільний, піридазинільний, піримідинільний, піразинільний і 1-Н-піразонільний радикали. Переважними С3-С8-циклоалкільними радикалами є циклопропільний, циклобутильний, циклопентильний, циклогексильний, циклогептильний і циклооктильний радикали. Переважними С2-С8-гетероциклоалкільними радикалами є циклоалкільні радикали з 2-8 атомами вуглецю, які мають один або більше гетероатомів. Переважні гетероциклоалкільні радикали мають один або більше, переважно 1 або 2, гетероатомів, особливо атоми азоту, кисню і/або сірки. Прикладами є оксиранільний, азиридинільний, азетидинільний, тетрагідрофуранільний, піролільний і піранільний радикали. Переважними С2-С6-алкенільними радикалами є етенільний, пропенільний, бутенільний і пентенільний радикали. Переважними С1-C6-алкокси радикалами є метокси, етокси і пропокси радикали, особливо метокси радикали. Арильні радикали, гетероарильні радикали, циклоалкільні радикали і гетероциклоалкільні радикали можуть бути незаміщеними або заміщеними. Якщо ці радикали заміщені, то вони переважно заміщені 1-3 замісниками, вибраними з С1-С3алкільних, С1-С3-алкокси радикалів і атомів галогену. Циклоалкільні радикали і гетероциклоалкільні радикали можуть бути насиченими або ненасиченими. Ненасичені радикали переважно мають один або два подвійні зв'язки. При взаємодії сполуки формули (II) (ІІ) з переважним оптично активним аміноспиртом формули (III) (ІІІ) одержують суміш діастереомерів (IVa) (IVa) і (IVb) (IVb) 23 93030 в якій X, Z, A*, R1 і R2 мають значення, вказані вище. Її називають першою сумішшю діастереомерів. Перша суміш діастереомерів переважно містить надлишок діастереомеру формули (IVa) (IVa) і вказаний надлишок, як правило, становить 2:1 або вище. Перша суміш діастереомерів переважно взаємодіє зі сполукою формули (V) (V) 24 (Vllla) до діастереомеру формули (Vlllb) переважно становить приблизно 3 або більше, більш переважно приблизно 4 або більше і, найбільш переважно, може бути аж до 9 або навіть вище. В особливо переважному варіанті здійснення винаходу, друга суміш діастереомерів містить бажаний діастереомер в співвідношенні 95% або більше, а небажаний діастереомер лише в співвідношенні 5% або менше. Більш переважно бажаний діастереомер міститься в співвідношенні 98% або більше, а небажаний діастереомер лише в співвідношенні 2% або менше, і може бути отримане співвідношення бажаного діастереомеру до небажаного діастереомеру приблизно 99,5:0,5 або краще. В вищенаведених формулах, радикали X, Ζ, A*, R1 і R2 мають значення, вказані вище. В переважному варіанті здійснення винаходу, радикал формули НО-А* являє собою радикал формули або сполукою формули (VII) (VII) з утворенням суміші діастереомерів формули (VIa) (IVa) і (VIb) (IVb) або, відповідно, формули (Vllla) (Vllla) і формули (VIllb) (VIllb) Кожна з цих сумішей діастереомерів називається другою сумішшю діастереомерів. Співвідношення діастереомеру формули (Vla) до діастереомеру формули (Vlb) або діастереомеру формули де кожен з радикалів R3-R6 незалежно являє собою атом водню або вуглеводневий радикал з 1-20 атомами вуглецю, кожен з яких може мати до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і може мати до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, або один або два радикали R3-R6 можуть утворювати 5-ти - 10-ти членне насичене або ненасичене кільце з радикалом R1 або радикалом R2, яке, додатково до атома азоту, як кільцеві члени необов'язково містить 1-3 додаткові гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з С1-С6-алкільних радикалів, С2-С6-алкенільних радикалів, С1-С6-алкокси радикалів, С6-С10-арильних радикалів (переважно С6-С10-арильних радикалів), С3-С8-циклоалкільних радикалів, С2-С8-гетероциклоалкільних радикалів, С5-С10-гетероарильних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і де n являє собою ціле число від 1 до 3. В вищенаведеній формулі переважно, коли радикали R5 і R6 незалежно вибирають з атомів водню і С1-С6-алкільних радикалів, переважні С1С6-алкільні радикали є такими, як описано вище. Більш переважно, лише один з радикалів R5 і R6 не являє собою атом водню, і в найбільш переважному варіанті здійснення винаходу всі радикали R5 і R6 є атомами водню. Індекс n переважно являє собою 1 або 2, більш переважно 1. Радикал R3 переважно являє собою С1-С6-алкільний, С1-С6алкокси, С5-С10-арильний (переважно С6-С10арильний), С5-С10-гетероарильний, С2-С8гетероциклоалкільний або С3-С8-циклоалкільний радикал, переважними з яких є алкільний, алкокси, арильний, гетероарильний, гетероциклоалкільний і циклоалкільний радикали, які мають значення, вказані вище. Найбільш переважно, радикал R3 являє собою С1-С6-алкільний радикал. 25 93030 Також є переважним відповідно до даного винаходу, коли радикал R3 утворює кільце з радикалом R2, то вказане кільце містить 5-10 кільцевих атомів. Додатково до атома азоту, з яким зв'яза2 ний радикал R , вказане кільце містить 1-3 додаткові гетероатоми, вибрані з атомів кисню, азоту і сірки, і може бути насиченим або моно- або біненасиченим. Воно може мати 1-3 замісники, вибрані з С1-С6-алкільних радикалів, С1-С6-алкокси радикалів, С5-С10-арильних радикалів (переважно С6-С10-арильних радикалів), С3-С8-циклоалкільних радикалів, С2-С8-гетероциклоалкільних радикали, C5-С10-гетероарильних радикалів і атомів галогену. Особливо переважно радикал R4 являє собою атом водню або С1-С6-алкільний радикал, найбільш переважно атом водню. Радикали R3 і R4 переважно є різними для того, щоб оптично активний центр розташувався на атомі вуглецю, який також несе гідроксильні групи. Проте, радикали R3 і R4 також можуть бути однаковими, наприклад, обидва можуть бути атомами водню, і оптично активний центр може розташовуватися на іншому атому вуглецю, що відбувається внаслідок того, що на цьому атомі вуглецю радикали R5 і R6 є різними. Також є переважним, щоб вибір схеми заміщення відбувався таким чином, що вищевказаний радикал НО-А*, а саме знаходився в R-конфігурації, оскільки це приводить до утворення сумішей діастереомерів на наступних стадіях реакцій, в яких в надлишку знаходиться релевантний діастереомер, що забезпечує вихід клопідогрелу в бажаній стеричній конфігурації. Якщо сполуку формули (II) піддають реакції з оптично активним аміноспиртом формули (III), який є переважним відповідно до винаходу, то це призводить до утворення першої суміші діастереомерів формули (IVa) (IVa) і формули (IVb) (IVb) 26 утворюється діастереомерна суміш сполук формули і де радикали X, Z, R1-R6 і індекс n мають значення, вказані вище. її називають першою сумішшю діастереомерів. Якщо у винаході застосовують оптично активний аміноспирт, який має наступну стеричну конфігурацію (в R-конфігурації) то в надлишку утворюється R,(R,S) сполука формули (IVa-1) по відношенню до S,(R,S)-сполуки формули (IVb-1), і співвідношення між R,(R,S)- і S,(R,S)-сполуками переважно становить 2:1 або вище, більш переважно 3:1 або вище і найбільш переважно приблизно 4:1 або вище. Відповідно до винаходу, є можливим розділення енантіомерів уже в першій суміші діастереомерів і продовження подальшого синтезу клопідогрелу лише з R,(R,S)-діастереомерoм формули (IVa-1). Розділення діастереомерів можна здійснювати шляхом, відомим per se, наприклад, за допомогою кристалізації або хроматографічним шляхом. Проте є переважним, відповідно до винаходу, піддавати реакції першу суміш діастереомерів, як таку, зі сполукою формули (V) В особливо переважному варіанті здійснення винаходу, де радикал НО-А* являє собою радикал формули або зі сполукою формули (VII) (VII) При такій взаємодії зі сполукою формули (V) 27 93030 28 одержують наступну суміш діастереомерів (V) в якій радикали X, R1-R6 і індекс n мають значення, вказані вище. Цю суміш називають другою сумішшю діастереомерів. Вона представляє собою діастереомерів (VIa) S,(R,S)-сполука формули (Vla-1) переважно знаходиться в надлишку відносно R,(R,S)-сполуки формули (Vlb-1). Несподівано було виявлено, що діастереомерний надлишок також ще підвищується в результаті взаємодії сполуки формули (V) (V)і (VIb) де радикал -O-А* являє собою радикал формули таким чином, що співвідношення сполуки формули (Vla-1) до сполуки формули (Vlb-1) переважно становить 3:1 або вище, більш переважно 4:1 або вище. В найбільш переважному варіанті здійснення винаходу, навіть вдається досягти співвідношення діастереомерів 9:1 або вище. В особливо переважному варіанті здійснення винаходу, друга суміш діастереомерів містить бажаний діастереомер в співвідношенні 95% або більше, а небажаний діастереомер лише в співвідношенні 5% або менше. Більш переважно, бажаний діастереомер міститься в співвідношенні 98% або більше, а небажаний діастереомер лише в співвідношенні 2% або менше, і може бути отримане співвідношення бажаного діастереомеру до небажаного діастереомеру приблизно 99,5:0,5 або краще. Якщо суміш діастереомерів (першу суміш діастереомерів) 29 93030 30 піддають реакції зі сполукою формули (VII) (VII) то, відповідно, утворюється суміш діастереомерів (друга суміш діастереомерів): В цій суміш діастереомерів, діастереомер S,(R,S) формули (Vllla-1) переважно міститься в надлишку відносно діастереомеру R,(R,S) формули (Vlllb-1) (за умови, що застосовують "правильний" енантіомер аміноспирту; якщо не вказано інше співвідношення діастереомерів). Крім того, несподівано підвищується надлишок діастереомеру формули (Vllla-1) відносно діастереомеру формули (Vlllb-1) і переважно становить 3:1 або вище, більш переважно 4:1 або вище або навіть 9:1 або вище. В особливо переважному варіанті здійснення винаходу, друга суміш діастереомерів містить можна піддавати реакції звичайним способом з утворенням наступної суміші діастереомерів (другої суміш діастереомерів) бажаний діастереомер в співвідношенні 95% або більше, а небажаний діастереомер лише в співвідношенні 5% або менше. Більш переважно, бажаний діастереомер міститься в співвідношенні 98% або більше, а небажаний діастереомер лише в співвідношенні 2% або менше, і може бути отримане співвідношення бажаного діастереомеру до небажаного діастереомеру приблизно 99,5:0,5 або краще. Суміш наступних діастереомерів (другу суміш діастереомерів) 31 як добре відомо з попереднього рівня техніки. Як тільки задіюється ця реакція, то слід звернути уваги на публікації, які обговорювалися у вступній частині, і наступні спостереження щодо реакції замикання кільця тетрагідротієнопіридину. Найбільш переважним оптично активним спиртом є (R)-1-(диметил-аміно)-2-пропанол ((R)димепранол). Цей оптично активний аміноспирт є комерційно доступним, але у зв'язку з даним винаходом було виявлено, що він легко може бути отриманий шляхом оптичного розділення релевантного рацемічного аміноспирту з ди-О-бензоїл-L 93030 32 (-)-винною кислотою. Це підвищує рентабельність способу за винаходом. Інші оптично активні спирти, які можуть застосовуватися в способі за винаходом, також можуть бути відновлені з релевантного рацемічного спирту вказаним шляхом. З використанням оптично активного аміноспирту (R)-димепранолу, який є переважним відповідно до даного винаходу, для першої суміші діастереомерів і другої суміші діастереомерів характерні наступні формули: Перша суміш діастереомерів: Друга суміш діастереомерів: або, відповідно, зі сполукою з незамкненим циклом: Додаткові оптично активні аміноспирти, які є переважними відповідно до винаходу, являють 33 93030 34 собою сполуки формул (наведені нижче без за значення стереохімії): де радикали R1 і R2 мають значення, вказані вище, і "Sub" означає, що кільце може бути заміщене С1-С3-алкільним радикалом в будь-якому положенні. Сполуки обертанню двох фенільних груп одна відносно одної, R11 і R12 незалежно являють собою атоми водню, С1-С4-алкокси радикали, атоми галогену, ціано радикали, С1-С6-алкоксикарбонільні радикали або С1-С6-алкільні радикали, або R11 і R12, разом з бензольним кільцем, до якого вони приєднані, утворюють конденсовану кільцеву структуру, вибрану з 1,3-бенздіоксолільної, α-нафтильної, βнафтильної, тетрагідронафтильної, бензімідазолільної і бензтриазолільної структури, m являє собою ціле число від 0 до 2 і ρ являє собою 1 або 2. Особливо переважно, коли всі радикали R9 і 10 R є атомами водню або лише один радикал не являє собою атом водню, а являє собою С1-С6алкільний радикал, переважно С1-С3-алкільний радикал. Особливо переважно, один з радикалів R7 і R8 вибирають із С1-С6-алкільної групи, атома галогену і ціаногрупи, а другий радикал вибирають із С3-С6 розгалуженої алкільної групи, переважно третинної бутильної групи, атома галогену і ціаногрупи. Переважними є великооб'ємні атоми галогену, такі як атоми йоду. В цьому радикалі оптичну активність зумовлюють принаймні один із радикалів R7 і R8, переважно обидва радикали R7 і R8, які є радикалами з великим об'ємом, такими як алкільні групи (особливо розгалужені С3-С6-алкільні групи), атоми галогену або ціаногрупи, таким чином вони запобігають обертанню двох фенільних кілець. В іншому переважному варіанті здійснення винаходу, сполука формули легко можуть бути отримані із заміщених оксидів стиролу або заміщених оксидів циклогексену і розділені на їх окремі енантіомери, як описано в "Optical Resolution via Diastereoisomeric Salts Formation", за ред. David Kozma, CRC Press, London, New York, Washington D.C. Відповідно до винаходу, також є переважним, якщо радикал НО-А* являє собою радикал формули або де Υ1 являє собою радикал являє собою сполуку формули і Υ2 являє собою радикал де R9 і R10 незалежно вибирають з атомів водню і С1-С6-алкільних радикалів і радикали R7 і R8 являють собою групи, які запобігають вільному де Y2 має значення, вказані вище, R1 має значення, вказані вище, і переважно являє собою атом водню або вуглеводневий радикал з 1-20 атомами вуглецю, який може містити до 4-х гетероатомів включно, вибраних з атомів азоту, кисню, сірки і галогену, і до 5-ти замісників включно, вибраних із гідроксильних груп, оксогруп, ціаногруп і нітрогруп, і група 35 93030 36 ємодії з переважним оптично активним аміноспиртом формули (III) являє собою 5-ти - 10-ти членне насичене або ненасичене кільце яке, додатково до атома азоту, необов'язково містить як кільцеві члени 1 -З гетероатоми, вибрані з атомів азоту, кисню і сірки, і може бути заміщене до 5-ти замісників включно, вибраних з С1-С6-алкільних радикалів, С1-С6алкокси радикалів, С2-С6-алкенільних радикалів, С5-С10-арильних радикалів (особливо С6-С10арильних радикалів), С5-С10-гетероарильних радикалів, С3-С6-циклоалкільних радикалів, С2-С8гетероциклоалкільних радикалів, атомів галогену, гідроксильних груп, оксогруп, ціаногруп і нітрогруп. Переважно, група (ІІІ) але також можна застосовувати інші аміноспирти. Зокрема, можна використовувати інші аміноспирти, вказані в даній заявці. Якщо присутня суміш діастереомерів формули (VІlla) (Vllla) являє собою групу і (Vlllb) Продукти реакції вищевказаних оптично активних аміноспиртів зі сполуками формули (II), які утворюють першу суміш діастереомерів, і продукти реакції першої суміші діастереомерів зі сполукою формули (V) (VIllb) (V) або сполукою формули (VII) (VІІ) які утворюють другу суміш діастереомерів, є новими сполуками, і винахід також стосується відповідних діастереомерних сумішей у будь-якому бажаному співвідношенні окремих діастереомерів і окремих виділених діастереомерів із цих сумішей діастереомерів. Подальшу обробку другої суміші діастереомерів для одержання кінцевого продукту формули (Іа) то спочатку можна здійснювати реакцію замикання кільця з утворенням суміші діастереомерів формул (VІa) (VIа) і (Vlb) (Іа) (VIb) особливо клопідогрелу здійснюють способом, відомим per se спеціалісту в даній галузі техніки. Загалом, можливо здійснювати наступну послідовність реакцій, при цьому формули, наведені нижче, стосуються вза Потім цю суміш піддають взаємодії, як описано нижче. Також можна спочатку здійснювати розділення діастереомерів в суміші діастереомерів (Vllla) 37 93030 38 (Vllla) яку потім перетворюють в сполуку формули і (Vlllb) (Іа) (Іа) (VIllb) наприклад, шляхом циклізації (переважно) або хроматографії і подальшій реакції піддавати лише діастереомер формули (Vllla) переважно клопідогрел, шляхом замикання кільця, як описано в попередньому рівні техніки, наприклад, в ЕР 466 569. Другу суміш діастереомерів із діастереомерами формули (Vla) (Vllla) (VIа) Потім окремий діастереомер формули (Vllla) і (Vlb) (Vllla) (VIb) можна або спочатку перетворювати в сполуку формули (Vla) ланцюги яких вже замкнені, де діастереомер формули (Vla) (VIа) (VIа) за допомогою реакції замикання кільця із підтриманням стереохімії, як показано для подібних сполук у відомому рівні техніки, а потім піддавати переетерифікації, як показано нижче. Альтернативно, сполуку формули (VIlla) спочатку можна піддавати переетерифікації з утворенням сполуки формули переважно знаходиться в надлишку принаймні 3:1 або більше, більш переважно 4:1 або більше, найбільш переважно 9:1 або більше (або де друга суміш діастереомерів містить бажаний діастереомер в співвідношенні 95% або більше, а небажаний діастереомер лише в співвідношенні 5% або менше, більш переважно, де бажаний діастереомер міститься в співвідношенні 98% або більше, а небажаний діастереомер лише в співвідношенні 2% або менше, і особливо, де співвідношення бажаного діастереомеру до небажаного діастерео 39 93030 40 меру становить приблизно 99,5:0,5 або краще), можна піддавати спочатку виділенню діастереомеру, який переважний відповідно до даного винаходу. В результаті цього виділяють діастереомер формули (Vla) (VIа) (VIа) або коли наступна переетерифікація не може бути завершена при підтриманні стереохімії. Потім при переетерифікації одержують суміш сполук (Іа) Розділення діастереомерів можна здійснювати способом, відомим per se і описаним в рівні техніки й більш докладно в прикладах. Потім діастереомер формули (Vla) (Іа) І(Іb) (VIа) піддають реакції переетерифікації, підтримуючи стереохімію для одержання сполуки формули (Іа) (Іа) Альтернативно, суміш діастереомерів сполук формули (Vla) (VIа) і (Vlb) (VIb) можна піддавати реакції переетерифікації без попереднього розділення. Цей варіант є особливо переважним, коли присутній дуже великий надлишок діастереомеру формули (Vla) (Іb) де, тим не менше, сполука (Іа) знаходиться у значному надлишку в порівнянні зі сполукою формули (Іb). При необхідності, потім цю суміш енантіомерів можна піддавати розділенню енантіомерів, як добре відомо з рівня техніки. Переетерифікацію переважно здійснюють із використанням титанового або кремнієвого каталізатора, більш переважно із використанням алкоксиду титану (IV), зокрема ізопропоксиду титану (IV) (тетраізопропілортотитанату) або етоксиду титану (IV), який комерційно доступний, наприклад, від Fluka Company. Алкоксид титану активують шляхом взаємодії із підходящим спиртом, наприклад, із етиленгліколем. Можна використовувати інший каталізатор, наприклад, хлорований кремнезем, який може бути отриманий, наприклад, шляхом взаємодії кремнезему із тіонілхлоридом, необов'язково в пентахлориді фосфору, або шляхом взаємодії кремнезему лише з пентахлоридом фософру в придатному інертному розчиннику, такому як гексан, хлороформ, хлорбензол або дихлорметан. В особливо переважному варіанті здійснення винаходу, який є особливо бажаним, якщо в суміші уже знаходиться у дуже великому надлишку бажаний діастереомер, переетерифікацію здійснюють із використанням галогеніду перехідного металу першої або другої підгрупи періодичної таблиці елементів. Підходящими каталізаторами є, наприклад, ZnX2, Cu2X2, CuX2, AgX, AuX, AuX3, CdX2, Hg2X2, HgX2, CoX2, X являє собою протиіон галогеніду, особливо іон фториду, хлориду, броміду або йодиду, зокрема іон хлориду. Найбільш переважно перехідним металом є цинк або кобальт, таким чином найбільш переважним каталізатором відповідно до винаходу є ZnX2 або СоХ2. В цілому, також можна застосовувати галогеніди інших металів 3-ої -8-ої перехідної групи металів періодичної таблиці елементів, але, як правило, це потребує кислого середовища, що 41 93030 підвищує ризик рацемізації. Також часто їх каталітичні характеристики є гіршими, тому ці каталізатори не є переважними відповідно до винаходу. Особливою перевагою каталізаторів на основі галогенідів перехідних металів, особливо хлориду цинку, є те, що реакцію можна здійснювати в лужних умовах, і коли при переетерифікації відбувається рацемізація, якщо це все ж таки трапляється, то вона відбувається в дуже незначному ступені. Наприклад, якщо для переетерифікації використовують одну з особливо переважних других сумішей діастереомерів за винаходом, яка містить бажаний діастереомер в співвідношенні 98% або більше, більш переважно 99% або більше, а небажаний діастереомер лише в співвідношенні 2% або менше, особливо 1% або менше, то при ретельному контролі здійснення способу після переетерифікації отримують продукт, який містить 80% або більше, особливо 90% або більше, переважно приблизно 95% або більше, більш переважно приблизно 98% або більше, бажаного енантіомеру формули (Іа) (Іа) (тобто клопідогрелу, коли X являє собою СІ), а залишком є небажаний енантіомер формули (Іb) (Іb) 42 Після очищення суміші клопідогрелу підвищення співвідношення бажаного енантіомеру формули (Іа) (Іа) а саме клопідогрелу, можна досягти шляхом обробки кислотою, як показано в прикладах. Загалом переетерифікацію також можна здійснювати без застосування каталізатора. Проте в цьому випадку необхідно подовжити час здійснення реакції. Для здійснення переетерифікації, найбільш бажаним є використання метанолу як розчинника, оскільки метою є одержання метилового ефіру. Нижче в загальних рисах описано здійснення способу за винаходом з використанням, як прикладу, взаємодії 2-хлорфеніл-оцтової кислоти з (R)димепранолом з наступною взаємодією з 2-(2тієніл)етил-аміном. Проте цю взаємодію можна здійснювати відповідно, якщо замість (R)димепранолу використовують інший оптично активний аміноспирт або замість 2-хлорфеніл-оцтової кислоти використовують іншу 2-галоген-фенілоцтову кислоту, і коли замість 2-(2-тієніл)етил аміну використовують іншу підходящу сполуку з відкритим ланцюгом, яку згодом піддають реакції замикання циклу на подальшій стадії реакції. Загалом, реакцію здійснюють відповідно до наступної схеми реакцій: 43 Навіть коли оптично активний аміноспирт (R)димепранол є комерційно доступним, то спосіб, який забезпечується в даному винаході, дозволяє здійснити легке і недороге одержання оптично активного аміноспирту із рацемічного аміноспирту. Для цього, 0,5 еквівалента дибензоїл-L-винної кислоти розчиняють з 1 еквівалентом рацемічного спирту в придатному розчиннику, такому як С1-С4алканол, переважно етанол, більш переважно суміш приблизно 1 :1 метанолу або етанолу з ізопропанолом, з утворенням відповідного похідного дибензоїл-L-винної кислоти і R(-)димепранолу. Потім розчин підкисляють з ахіральною мінеральною кислотою, наприклад, соляною кислотою. Це викликає утворення солі (наприклад, гідрохлориду) з протилежним енантіомером димепранолу, S(+)димепранолом, який в результаті цього утримується в розчині. Після необов'язкового затравлювання похідне дибензоїл-L-винної кислоти і R( 93030 44 )димепранолу осаджується у вигляді кристалічного продукту, в той час як сіль S(+)димепранолу залишається в розчині. Вільна основа (R)димепранолу може бути відновлена з осадженої солі за допомогою способу, відомого per se, шляхом реакції придатної основи, такої як гідроксид натрію або калію, в придатному розчиннику, такому як спирт, переважно в етанолі. В альтернативному варіанті здійснення винаходу, похідне дибензоїл-L-винної кислоти і R-димепранолу також може бути перетворене, наприклад, в гідрохлорид Rдимепранолу шляхом взаємодії з безводним хлористим воднем. Його можна використовувати як таке або після обробки придатною основою у вигляді лугу. Завдяки способу за даним винаходом, зменшується необхідна кількість дибензоїл-L-винної кислоти, що робить спосіб надзвичайно економним. Додатково, отриманий продукт характеризу 45 93030 46 ється дуже високою оптичною чистотою і, як правило, не потребує повторних перекристалізацій. 2,α-Дихлорфенілацетилхлорид може бути отриманий за допомогою способу, відомого per se, наприклад, за наступною схемою реакцій: Стадію (а) здійснюють шляхом взаємодії сполуки Кислоту відділяють і обробляють за допомогою підходящого способу, наприклад, шляхом розчинення в підходящому розчиннику, такому як хлороформ, екстракцією водою, висушування хлороформної фази за допомогою сульфату натрію або сульфату магнію і упарювання розчинника. За допомогою цього способу отримують 2-галогенфенілоцтову кислоту із хорошим виходом і з чистотою 95% або вище, особливо 98% або вище. 2-Галогенфеніл-оцтову кислоту перетворюють в хлорангідрид звичайним способом, наприклад, як показано на етапі (г), розчиняючи в тіонілхлориді при нагріванні, що приводить до утворення сполуки формули з металевим магнієм в придатному розчиннику, такому як, наприклад, простий ефір (тобто діетиловий ефір), дибутиловий ефір або вищий ефір, ТГФ або інший циклічний простий ефір, толуол і т.д., переважно простий ефір, в колбі зі зворотним холодильником. Це є загальноприйнятою реакцією Гриньяра. На стадій стадії (б), до реакційної суміші можна додавати проміжний СО2, переважно у вигляді сухого льоду, при інтенсивному перемішуванні або без розчинника або, переважно, з розчинником, приданим для розчиненням СО2, таким як ТГФ. Газоподібний діоксид вуглецю випаровується і отримують сполуку Після цього здійснюють гідроліз на стадії (в). Для цього до реакційної суміші, отриманої на стадії (б), додають розведену мінеральну кислоту, таку як розведена соляна кислота, при охолодженні і перемішуванні, що приводить до утворення 2-х фазної суміші. Потім здійснюють нейтралізацію шляхом додавання придатної основи, наприклад, водної основи, такої як розчин NH4OH в воді або лужнокарбонатний розчин або амонійкарбонатний розчин в воді, що приводить до отримання водного розчину солі галогенфенілоцтової кислоти. При необхідності можна додавати додаткову кількість води. Потім органічну фазу відділяють і водну фазу, яка містить сіль 2галогенфеніл-оцтової кислоти, змішують, наприклад, з розведеною мінеральною кислотою до осадження бажаної 2-галогенфеніл-оцтової кислоти, особливо 2-хлорфеніл-оцтової кислоти. Залежно від бажаного радикалу Y, потім здійснюють бромування або хлорування на стадії (д). Бромування може бути здійснено шляхом додаваннярідкого брому в присутності червоного фосфору при нагріванні до температури флегми. Реакційну суміш залишають відстоюватися протягом ночі, і потім непрореагований тіонілхлорид і бром упарюють, одержуючи сполуку формули Для одержання хлорованої сполуки до реакційної суміші додають сульфурилхлорид (SO2CI2) при перемішуванні і нагріванні на стадії (д). Потім залишки SOCl2 і SO2CI2 упарюють, отримуючи сполуку формули 47 Сполука формули Наприклад, вихідна сполука 2-тієнілацетамід може бути отримана з 2-тієнілацетонітрилу або 2тієнілацетилхлориду добре відомим способом. Наприклад, диметоксіетан додають до 2тієнілацетаміду при охолодженні з борогідридом натрію. Потім додають оцтову кислоту при додатковому охолодженні і перемішуванні. Цю суміш нагрівають при перемішуванні і здійснюють гідроліз при додаванні води, при цьому необов'язково охолоджують. Після упарювання диметоксіетану розчин підлуговують, наприклад, шляхом додавання придатної основи, такої як гідроксид калію або гідроксид натрію, і додають придатний розчинник, такий як простий ефір. Водну фазу відділяють. Органічну фазу промивають, підкисляють, наприклад, за допомогою мінеральної кислоти, і знову екстрагують. Органічну фазу відділяють. Водну фазу підлуговують, наприклад, шляхом додавання гідроксиду калію або гідроксиду натрію, і додають простий ефір. Органічна фаза містить бажаний 2-(2-тієніл)етил амін, і після випарювання розчинника отримують 2-(2-тієніл)етил амін із чистотою переважно 95% або вище, більш переважно 98% або вище. 2-(2-Тієніл)етил амін, отриманий в такий спосіб, можна нагрівати при перемішуванні, наприклад, з водним формальдегідом. Після цього охолоджують і додають підходящий органічний розчинник, такий як дихлорметан. Після додавання основи, наприклад, гідроксиду натрію або гідроксиду калію, такої як 10%-ний розчин гідроксиду натрію, здійснюють екстракцію. Водну фазу відділяють, і органічну фазу упарюють насухо. Залишок розчиняють, наприклад, в диметоксіетані, і підкисляють. Після цього здійснюють кристалізацію з основою Шифа при перемішуванні. Після охолодження, фільтрації і промивання отримують бажаний 4,5,6,7-тетрагідро[3,2-с]тієнопіридин. Ця реакція для одержання сполуки також описана, наприклад, в ЕР-А 439 404 і в Arkiv för kemi, 32, (19), 217-227 (1971). Зміст цих публікацій повністю включений як посилання. Вихідні сполуки для синтезу добре відомі фахівцю в даній галузі і можуть бути або комерційно 93030 48 може бути отримана способом, відомим per se, наприклад, відповідно до наступної схеми реакцій: доступними або їх легко можна отримати за допомогою способів, добре відомих з літератури. Взаємодію сполуки формули (II) (ІІ) зі сполукою формули (III) (ІІІ) здійснюють способом, відомим per se. Наприклад, 2,α-дихлорфенілацетилхлорид піддають взаємодії із (R)-1-(диметиламіно)-2-пропанолом в підходящому розчиннику, переважно в біполярному апротонному розчиннику, наприклад, в простому ефірі, такому як ТГФ, переважно в присутності аміну, такого як піридинова сполука, така як 4(диметиламіно)піридин, і особливо переважно в присутності третинного аміну, такого яктриетиламін. Кристалічний гідрохлорид утвореного складного аміноефіру осаджується і може бути виділений. В особливо переважному варіанті здійснення винаходу, суміш спочатку нагрівають в колбі зі зворотним холодильником із підходящим кетоном, особливо із ацетоном, що підвищує вміст бажаного R,R-діастереомеру. Таким чином, цей варіант здійснення винаходу є особливо переважним для одержання бажаного діастереомеру у високому надлишку уже на дуже ранній стадії способу. Якщо для одержання першої суміші діастереомерів використовують третинний амін, такий як триетиламін, то фільтрований кристалічний продукт містить суміш бажаної суміші діастереомерів і триетиламіну. Завдяки тому, що суміш діастереомерів також містить третинний амін, то він, як правило, може бути відфільтрований більш легко і, несподівано, зменшується рацемізація на наступній стадії для одержання другої суміші діастереомерів. Звичайну обробку і, необов'язково, очищення здійснюють добре відомим способом, наприклад, шляхом перекристалізації і/або хроматографії. Часто можливо піддавати неочищену суміш безпосередній обробці. Розчинники, придатні до застосування, особливо не обмежені, але слід уникати 49 93030 50 використання первинних спиртів, таких як метанол або етанол, у зв'язку з небезпекою переетерифікації. Можна використовувати вторинні спирти або третинні спирти, такі як 2-пропанол; особливо для перекристалізації, і також може бути переважним використання таких вторинних спиртів, як 2пропанол. Співвідношення двох діастереомерів в одержаній суміші може бути визначене, наприклад, шляхом хіральної ВЕРХ. Переважно, воно становить приблизно 2:1 або більше, більш переважно 3:1 або більше, особливо переважно приблизно 4:1 або більше. Переважно суміш діастереомерів піддають взаємодії із сполукою формули (V) (V) або сполуку формули (VII) (Vl) переважно із сполукою формули (V) без розділення на окремі діастереомери. Наприклад, гідрохлорид 4,5,6,7-тетрагідро[3,2-с]-тієнопіридину можна перемішувати із гідрохлоридом (R)-1-(диметиламіно)-2-пропілового ефіру 2,α-дихлорфенілоцтової кислоти в підходящому розчиннику, особливо біполярному апротонному розчиннику, наприклад, диметилформаміді, ДМСО або 1,3-диметил-3,4,5,6-тетрагідро-2-(1Н)піримідиноні, в присутності підходящої основи, особливо карбонату, гідрокарбонату або аміну, такої як триетиламін і/або карбонат літію, переважно при температурі в інтервалі від 0 до 100°С вподовж підходящого періоду часу, звичайно впродовж декількох годин. В особливо переважному варіанті здійснення винаходу, цю стадію реакції здійснюють в присутності кремнезему. Показано, що це дозволяє додатково підвищити оптичну чистоту кінцевого продукту. Продукт може бути виділений шляхом розподілу між органічним шаром і водним шаром і наступного випаровування розчинника. При перетворенні в гідрохлорид або гідробромід з підходящою мінеральною кислотою можна отримати кристалічну сіль. Отримана суміш діастереомерів містить надлишок S,R-діастереомеру переважно 4:1 або більше, більш переважно приблизно 9:1 або більше. Несподівано також було показано, що для перетворення діастереомерів у відповідні солі замість мінеральної кислоти із значною перевагою можна застосовувати дикарбонову кислоту. При застосуванні дикарбонової кислоти замість мінеральних кислот співвідношення бажаного діастереомеру відносно небажаного діастереомеру додатково може бути збільшене, і при цьому отримують суміш діастереомерів, яка містить 95% або більше бажаного діастереомеру і 5% або менше небажаного діастереомеру, особливо ту, в якій бажаний діастереомер міститься в співвідно 51 шенні 98% або більше, а небажаний діастереомер в співвідношенні 2% або менше. Можуть бути отримані навіть такі суміші діастереомерів, які містять бажаний діастереомер у співвідношенні 99,5% або більше, а небажаний діастереомер у співвідношенні 0,5% або менше. Придатні дикарбонові кислоти особливо не обмежені, але переважними є малеїнова кислота, щавлева кислота і фумарова кислота. Найбільш переважною є малеїнова кислота, таким чином друга суміш діастереомерів в особливо переважному варіанті здійснення винаходу знаходиться у вигляді солі малеїнової кислоти. Якщо суміш діастереомерів (суміш діастереомерів 2) містить співвідношення (S,R)-енантіомерy до (R,R)-енантіомерy, яке все ще вважається недостатнім для подальної реакції з утворенням клопідогрелу, то вміст бажаного (S,R)-діастереомеру можна підвищити, наприклад, шляхом нагрівання суміші діастереомерів в колбі зі зворотним холодильником в надлишку підходящого полярнопротонного розчинника, наприклад, підходящого спирту, такого як ізопропанол. В такий спосіб можуть бути отримані суміші діастереомерів, які містять бажаний (S,R)-діастереомер в співвідношенні 98% або більше, особливо 99,5% або більше, і, відповідно, містять небажаний (R,R)-діастереомер в кількості 2% або менше, переважно 0,5% або менше. Завдяки цьому способу також можуть бути зменшені інші домішки в суміші діастереомерів. Суміш діастереомерів або виділений діастереомер 93030 52 необов'язково у вигляді солі, особливо малеату, оксалату або фумарату, перетворюють шляхом переетерифікації в суміш S- і R-енантіомерів клопідогрелу, яка збагачена S-енантіомером, або перетворюють в чистий клопідогрел. Для цього переважно застосовують титанові або кремнеземові каталізатори, як описано вище. Як показано вище, особливо переважно здійснювати переетерифікацію в лужному середовищі з використанням каталізатора, який переважно являє собою галогенід перехідного металу першої або другої підгрупи періодичної таблиці елементів, такий як Cu2X2, CuX2, AgX, AuX, AuX3, CdX2, Hg2X2, HgX2, CoX2 або ZnX2, особливо ZnX2 або СоХ2, де X є протиіоном галогеніду, переважно іоном хлориду. Переетерифікацію переважно здійснюють шляхом нагрівання сполуки формули або суміші діастереомерів з каталізатором в метанолі. Для взаємодії можна застосовувати суміш діастереомерів або, відповідно, виділену сполуку у вигляді вільної основи або безпосередньо у вигляді солі, особливо солі з дикарбоновою кислотою, найбільш переважно у вигляді малеату. Якщо застосовують вільну основу, то швидкість реакції є вищою ніж у випадку використання солі; однак використання солі приводить до особливо низької рацемізації при здійсненні переетерифікації. Особливо переважну переетерифікацію з використанням галогеніду перехідного металу, як описано, переважно здійснюють в слабко лужних умовах із використанням придатної неорганічної або переважно органічної основи, такої як діізопропіламін, триетиламін або 53 піролідин, наприклад, N-метилпіролідин. Якщо застосовувану сіль суміші діастереомерів або застосовувані переважні діастереомери використовують для переетерифікації, то може бути сприятливим застосування сильної основи, такої як триетиламін або діізопропіламін, для підвищення швидкості реакції, але це також підвищує ризик рацемізації при здійсненні переетерифікації. Таким чином, переважно застосовувати придатну сіль суміші діастереомерів, де вказана суміш діастереомерів уже збагачена до такого ступеня, що вона містить 95% або більше, більш переважно 98% або більше, особливо 99,5% або більше бажаного діастереомеру. Найбільш переважно, сіль являє собою оксалат, фумарат або малеат, особливо малеат, і реакцію здійснюють в слабко-лужних умовах, таким чином підтримують рацемізацію при здійсненні переетерифікації на мінімально можливому рівні. Після завершення реакції до реакційної суміші додають основу, як показано в прикладах, відфільтровують і піддають звичайній обробці, що також описано в прикладах. Якщо кінцевий продукт усе ще містить сполуку формули то бажаний енантіомер клопідогрелу може бути виділений звичайним способом. При цьому посилання здійснюють на процитовані джерела, вказані вище. Проте небажаний енантіомер клопідогрелу найбільш переважно виділяти шляхом розчинення суміш енантіомерів в підходящому розчиннику, переважно диполярному апротонному розчиннику, такому як кетон, особливо ацетон, і підкислювати розчин, наприклад, концентрованою сірчаною кислотою. Рацемічний гідросульфат клопідогрелу осаджується з розчину, а бажаний енантіомер клопідогрелу залишається в маточному розчині, з якого він може бути виділений з високою чистотою. Якщо вміст небажаного енантіомеру є низьким, то кристалізація рацемічного гідросульфату клопідогрелу не відбувається безпосередньо після додавання стехіометричної кількості сірчаної кислоти, тому кількість сірчаної кислоти необхідно збільшити. Якщо це не приводить до безпосередньої кристалізації, то може бути доцільним затравлювання із рацемічним гідросульфатом клопідогрелу. Якщо в даному описі спеціально не вказано інакше або якщо це й так є очевидним із контексту, "частки" і "відсотки" завжди ґрунтуються на масі. Наступні приклади більш докладно ілюструють винахід. Приклад 1 2,α-Дихлорфенілацетилхлорид 2-Хлорфеніл-оцтову кислоту (171г) додавали до 300мл тіонілхлориду і суміш перемішували при 60°С впродовж 30 хвилин. Декількома порціями додавали кристали йоду, потім 300мл сульфурилхлориду. Суміш нагрівали в колбі зі зворотним 93030 54 холодильником в цілому впродовж 7 годин. Надлишок реагентів відганяли при зниженому тиску. Залишок (228г) містив 82-84% 2,αдихлорфенілацетилхлориду, 5-6% нехлорованого в α-положенні 2-хлорфенілацетилхлориду і приблизно 10% 2,4,(2,6),αтрихлорфенілацетилхлориду. Неочищений ацилхлорид застосовували в подальших реакціях без додаткового очищення. Приклад 2 (R)-1-(Диметиламіно)-2-пропанол ((R)димепранол) Розчин 190г дибензоїл-L-винної кислоти в 1,200мл етанолу змішували з 103г 1(диметиламіно)-2-пропанолу. Отриманий розчин підкисляли за допомогою 36мл 36%-ної соляної кислоти і затравлювали. Після відстоювання протягом ночі, кристалічний продукт відфільтровували, промивали холодним етанолом і діетиловим ефіром і висушували. Неочищений (R)-1(диметиламіно)-2-пропанол дибензоїл-L-тартрат перекристалізовували з 2,700мл гарячого етанолу і одержували 187г чистої діастереомерної солі. Сіль розчиняли в 1000мл холодного 20%-ного розчину гідроксиду натрію і екстрагували в дихлорметані. Екстракт висушували, фільтрували, упарювали і масло, що залишилося, очищали шляхом перегонки при атмосферному тиску. Продукт відганяли при 122-124°С, і одержували 46г (R)димепранолу (45% на основі початкового рацемату), [αD20] -27°. Приклад 3 (R)-1-(Диметиламіно)-2-пропіловий ефір 2,αдихлорфенілоцтової кислоти 2,α-Дихлорфенілацетилхлорид (8,6г) розчиняли в 30мл тетрагідрофурану, додавали 1,2 г4(диметиламіно)-піридину і змішували. Потім швидко додавали розчин 4,1г(R)-димепранолу в 30мл тетрагідрофурану при перемішуванні і охолодженні. Кристалічний гідрохлорид складного аміноефіру відділяли. Потім суміш нагрівали до 55°С і перемішували при цій температурі впродовж 20 хвилин, дозволяли охолонути і потім перемішували при кімнатній температурі додатково впродовж 2 годин. Додавали діетиловий ефір (2мл) і кристалічний продукт відфільтровували, промивали і висушували при кімнатній температурі. Неочищений складний ефір гідрохлориду перекристалізовували з ізопропанолу. Вихід становив 10,0г. Очищений складний ефір гідрохлориду розподіляли між насиченим водним розчином гідрокарбонату натрію і діетиловим ефіром. Після упарювання, одержували складний аміноефір у вигляді вільної основи. Вихід становив 8,1г (72,5%), при цьому (R,R)діастереомер є переважаючим (65-80%). Приклад 4 (R)-1-(Диметиламіно)-2-пропіловий ефір 2,αдихлорфенілоцтової кислоти, гідрохлорид (переважний спосіб) 2,α-Дихлорфенілацетилхлорид (19,2г, 86ммоль) розчиняли в 80мл тетрагідрофурану, і розчин по каплям додавали впродовж 45 хвилин при перемішуванні і охолодженні до 10-15°С на водяно-льодяній бані до розчину 12г (86ммоль) гідрохлориду (R)-1-(диметиламіно)-2-пропанолу в 55 80мл тетрагідрофурану, який містить 12мл (8,9г, 88ммоль) триетиламіну. Суміш перемішували при кімнатній температурі впродовж трьох годин, і протягом двох годин осаджувався кристалічний гідрохлорид простого аміноефіру. Суміш нагрівали в колбі зі зворотним холодильником впродовж двох годин. Потім її охолоджували до 50°С, додавали 60мл ацетону і суміш нагрівали в колбі зі зворотним холодильником іще впродовж двох годин. Після охолодження суміші її заморожували протягом ночі (холодильник). Кристалічний продукт фільтрували через скляну фриту в атмосфері азоту і промивали 20мл ацетону. Після цього, її висушували при кімнатній температурі. Одержували суміш неочищеного гідрохлориду складного ефіру і гідрохлориду триетиламіну, яка містить приблизно 24г діастереомерного складного ефіру. Вміст вказаної в заголовку сполуки в суміші діастереомерних складних ефірів визначали за допомогою ВЕРХ, і суміш діастереомерних складних ефірів містила приблизно 80% вказаної в заголовку сполуки, що відповідає співвідношенню бажаного R,Rдіастереомерy до небажаного діастереомеру 4:1. Суміш діастереомерів, отриману в такий спосіб, що містить гідрохлорид триетиламіну, використовували на подальших стадіях способу без додаткового очищення. Проте, необов'язково, суміш також може бути очищена шляхом розчинення неочищеної суміші гідрохлориду діастереомерного складного аміноефіру і триетиламіну в 2,5-кратній кількості (об./мас.) киплячого 2-пропанолу, додаючи такий же об'єм гарячого пропілацетату, охолоджуючи суміш і залишаючи її в холодильнику на ніч. На наступний день кристалічний продукт можна відфільтрувати в атмосфері азоту, промити 25мл холодного (приблизно 5°С) 2-пропілацетату і висушити. Приклад 5 1-Феніл-2-(1-піролідиніл)-етанолгідрохлорид Воду (10мл) при перемішуванні додавали до суміші 24,0г оксиду стиролу і 21,3г піролідину. Температуру суміші підвищували майже до 100°С. Воду і надлишок піролідину відганяли від отриманого прозорого розчину. Залишок розчиняли в 60мл 1,2-диметоксіетану і розчин підкисляли за допомогою 5,5Μ розчину хлористого водню в 1,2диметоксіетані. Осаджений гідрохлорид відфільтровували, промивали 1,2-диметоксіетаном і висушували. Фільтрат залишали відстоюватися в холодильнику протягом ночі, і одержували другий вихід продукту. Загальний вихід кристалічного гідрохлориду 1-феніл-2-(1-піролідиніл)-етанолу становив 35,9г. Приклад 6 (R)-1-Феніл-2-(1-піролідиніл)-етанол Розчини 35,8г ди-О-бензоїл-L-винної кислоти в 150мл метанолі і 19,1г 1-феніл-2-(1-піролідиніл)етанолу в 100мл метанолу змішували і суміш залишали відстоюватися в холодильнику впродовж 2 днів. Кристалічний продукт відфільтровували, промивали невеликою кількістю холодного метанолу і діетилового ефіру і висушували. Продукт повторно перекристалізовували з гарячого етанолу, одержуючи 15,0г оптично чистої діастереомерної солі. Вільну основу вивільняли шляхом розчи 93030 56 нення солі в 100мл холодного 20%-ного водного гідроксиду натрію і екстрагували в дихлорметані. Після упарювання розчинника отримували 7,2г (38% на основі початкового рацемату) маслянистого (R)-енантіомеру 1-феніл-2-(1-піролідиніл)етанолу, який затвердівав після зберігання в холодильнику і перетворювався в кристалічну масу. Продукт мав значення [αD20] -40° (метанол). Приклад 7 (R)-2-(1-Піролідиніл)-1-фенілетиловий ефір 2,α-дихлорфенілоцтової кислоти Розчин 5,7г (R)-1-феніл-2-(1-піролідиніл)етанолу в 25мл тетрагідрофурану додавали до розчину 6,5г 2,a-дихлорфенілацетилхлориду в 25мл тетрагідрофурану, що містить 0,9г 4диметиламінпіридину. Відповідно до методики, аналогічної описаній в прикладі 3, одержували суміш діастереомерних складних ефірів, що містить 72% (R,R) і 28% (R,S) продукту з виходом 8,4г (74%). Приклад 8 2-Диметиламіно-1-фенілетанол Розчин 12г гідроксиду натрію в 60мл води змішували з 100мл етанолу і 24,0г гідрохлориду диметиламіну. Додавали оксид стиролу (24,0г) і суміш перемішували при кімнатній температурі впродовж двох годин. Осаджений хлорид натрію відфільтровували, етанол упарювали при зниженому тиску, і до водного розчину, що залишився, додавали 8,0г гідроксиду натрію. Аміноспирт екстрагували в діетиловому ефірі, екстракти висушували і упарювали, одержуючи 26,7г маслянистого продукту, який, відповідно до аналізу за допомогою ВЕРХ, містить 87% 2-диметиламіно-1фенілетанолу. Приклад 9 (R)-2-Диметиламіно-1-фенілетанол Рацемічний 2-диметиламіно-1-фенілетанол розщепляли відповідно до 2-піролідиніл-1-феніл етанолу (див. приклад 6), використовуючи 16,5г неочищеного аміноспирту, як описано в прикладі 8. Вихід маслянистого (R)-2-диметиламіно-1фенілетанолу зі значенням [αD20] -45,5° (метанол) становив 8,9г. Приклад 10 (R)-2-Диметиламіно-1-фенілетиловий ефір 2,αдихлорфенілоцтової кислоти Суміш діастереомерних складних ефірів, в якій переважають (R,R)-ефіри, одержували з 5,0г (R)-2диметиламіно-1-фенілетанолу, як описано в прикладі 3 і 7; вихід становив 7,7г. Приклад 11 транс-2-Диметиламіноциклогексан-1-ол Аміноспирт одержували, як описано в прикладі 8, використовуючи оксид циклогексену (19,6г) замість оксиду стиролу. Одержували маслянистий транс-2-диметиламіноциклогексан-1-ол з виходом 22,0г (76%). Приклад 12 транс-2-(3)-Диметиламіно-1-(R)-гідроксициклогексан Рацемічний аміноспирт з прикладу 11 розщеплювали відповідно до прикладів 3, 5 і 8, використовуючи ди-О-бензоїл-L-винну кислоту вмольному співвідношенні 1:1 (35,8г ди-О-бензоїл-L-винної 57 кислоти і 14,5г рацемічного транс-2диметиламіноцикло-гексан-1-олу), застосовуючи ацетон як розчинник. Одержували маслянистий транс-(S,R)-2-диметиламіноциклогексан-1-ол з 20 виходом 5,2г. Значення [αD ] становило -23° (метанол). Приклад 13 транс-(S,R)-2-Диметиламіноциклогексиловий ефір 2,α-дихлорфенілоцтової кислоти Складний ефір транс-2-(S)-диметиламіно-1(R)-гідроксициклогексану з 2,αдихлорфенілоцтовою кислотою одержували з 4,4г аміноспирту і 6,5г ацилхлориду в тетрагідрофурані з виходом 6,7г. Відповідно до аналізу за допомогою ВЕРХ, продукт містив 68% діастереомеру складного ефіру α-(R)-хлорнуватої кислоти. Приклад 14 (R)-1-(Диметиламіно)-2-пропіловий ефір (S)-(2хлорфеніл)-4,5,6,7-тетрагідро-[3,2-с]тієнопіридин5-іл-оцтової кислоти, дигідрохлорид Вільну основу (R)-1-(диметиламіно)-2пропілового ефіру 2,α-дихлорфенілоцтової кислоти, одержану, як описано в прикладі 3 (5,8г), розчиняли в 30мл диметилформаміду і розчин змішували з 3,6г гідрохлориду4,5,6,7-тетрагідро-[3,2-с]тієнопіридину і 3,4г твердого гідрокарбонату літію. Потім суміш перемішували впродовж 45 хвилин при 80°С. Після охолодження до кімнатної температури, суспензію змішували з 100мл хлороформу і 100мл води. Органічний шар відділяли і промивали водою, висушували і хлороформ упарювали. Залишок розчиняли в 40мл 2-пропанолу і знебарвлювали за допомогою активованого вугілля. В розчин вводили газоподібний хлористий водень (1,5г), і осаджували кристалічний гідрохлорид. Сіль відфільтровували і промивали 10мл холодного ізопропанолу. Після висушування одержували продукт, який містить 85% бажаного (R,S) діастереомерного складного ефіру з виходом 7,7г (83%). Приклад 15 (R)-1-(Диметиламіно)-2-пропіловий ефір (S)-(2хлорфеніл)-4,5,6,7-тетрагідро-[3,2-с]тієно-піридин5-іл-оцтової кислоти, дигідробромід Суміш приблизно 3:1 (R,S)- і (R,R)діастереомерів гідрохлориду 1-(диметиламіно)-2пропілового ефіру 2,α-дихлорфенілоцтової кислоти (20,0г) додавали при перемішуванні 4-ма порціями до суспензії 10,5г гідрохлориду 4,5,6,7тетрагідро-[3,2-с]-тієнопіридину в 150мл диметилформаміду, що містить 40мл триетиламіну. Суміш нагрівали до 45°С і перемішували при цій температурі впродовж 2 годин. Потім додавали 150мл метил-трет-бутилового ефіру і 300мл води і ретельно змішували. Органічний шар відділяли і два рази промивали водою, висушували і упарювали. Одержували 20,0г суміші вільних основ діастереомерних складних аміноефірів, що містить 85% (R,S)-діастереомеру (ВЕРХ). Залишок розчиняли в 15-ти кратному надлишку в ізопропілацетаті і розчин охолоджували до 5°С на льодяній бані. В суміш вводили газоподібний бромистий водень при перемішуванні при 5 - 10°С до абсорбції 8,5г НВr. Продовжували перемішувати іще впродовж двох годин при 10°С і потім без охолодження до досягнення кімнатної температури. Суміш затравлюва 93030 58 ли і залишали відстоюватися в холодильнику протягом ночі. Кристали дигідроброміду складного аміноефіру відфільтровували, промивали холодним ізопропілацетатом і висушували. Вихід становив 20,2г, а вміст (R,S)-діастереомеру становив 92%. Приклад 16 (R)-1-(Диметиламіно)-2-пропіловий ефір (S)-(2хлорфеніл)-4,5,6,7-тетрагідро-[3,2-с]тієнопіридин5-іл-оцтової кислоти, малеат (переважний спосіб) 180мл (191,4г) 1,3-диметил-3,4,5,6-тетрагідро2-(1Н)-піримідинону (скорочено: Ν,Ν'диметилпропіленсечовина), 18,0г (100ммоль) гідрохлориду 4,5,6,7-тетрагідро-[3,2-с]тієнопіридину, 60мл (43,5г, 425ммоль) триетиламіну і 21г (250ммоль) карбонату літію вносили в колбу об'ємом 1 літр. При перемішуванні додавали неочищений продукт, одержаний відповідно до прикладу 4, який містить 31,38г (96ммоль) складного аміноефіру. Потім додавали 12,0г діоксиду кремнію (кремнезем, 60Å). Суміш нагрівали до 35°С і перемішували при цій температурі впродовж 4 годин. Після цього температуру підвищували до 50°С і продовжували перемішувати іще впродовж 30 хвилин до завершення реакції. Суміш охолоджували до кімнатної температури, додавали 300мл діізопропілового ефіру і суміш перемішували впродовж 15 хвилин, потім фільтрували через скляну фриту. Кремнезем і тверді солі ресуспендували в 300мл діізопропілового ефіру (на фільтрі), і розчинник зливали. Фільтрати об'єднували, два рази екстрагували кожного разу по 150мл води і два рази екстрагували 150мл боратного буферу, рН6,5. Органічну фазу відділяли і висушували за допомогою безводного сульфату натрію. Осушник відфільтровували. Два рази промивали 15мл діізопропілового ефіру і упарювали. Отримували 37,4г вільної основи у вигляді маслянистого продукту. Визначали чистоту продукту, яка становила 95% відповідно до ВЕРХ, і продукт містив 82-85% бажаного (R.S)-діастереомеру. Неочищений продукт обережно нагрівали і змішували з розчином 11,1г (96ммоль) малеїнової кислоти в 300мл 2-пропанолу. Суміш нагрівали до 50°С при перемішуванні до одержання прозорого розчину. Потім суміш охолоджували до кімнатної температури і перемішували. Бажаний продукт кристалізувався через короткий проміжок часу. Продовжували перемішувати іще впродовж 4 годин і продукт відділяли на фільтрі з пористого скла, два рази промивали 10мл 2-пропанолу і потім висушували на повітрі. Вихід становив 38,8г (97,5%, на основі вмісту (R)-1-(диметиламіно)-2-пропілового ефіру (S)-(2хлорфеніл)-4,5,6,7-тетрагідро-[3,2-с]тієнопіридин5-іл оцтової кислоти у неочищеному вихідному продукті і 80%, на основі загального вмісту суміші діастереомерів у вихідному продукті). Продукт мав точку плавлення 173°С, визначену за допомогою ДСК, і містив понад 98% (ВЕРХ) вказаної в заголовку сполуки. Вміст небажаного (R,R)діастереомеру був нижчим 1%. Маточний розчин і промивний розчин містили обидва діастереомери у співвідношенні 15:85. Співвідношення діастере 59 омерів визначали за допомогою хіральної хроматографії. Вміст бажаного (R,S)-діастереомеру в кінцевому продукті був таким високим, що цей продукт можна піддавати безпосередній взаємодії без додаткового очищення і без додаткового збагачення з бажаним (R,S)-діастереомером для утворення клопідогрелу. Приклад 17 (R)-1-(Диметиламіно)-2-пропіловий ефір (2хлорфеніл)-α-2-[(2-тієно)етил]аміно оцтової кислоти Розчин 2,9г 1-(диметиламіно)-2-пропілового ефіру 2,α-дихлорфенілоцтової кислоти як вільної основи, що містить приблизно 80% (R,R)- і 20% (R,S)-діастереомерів в 20мл ацетонітрилу, змішували з 1,3г 2-тієнілетиламіну і 4мл триетиламіну і суміш нагрівали в колбі зі зворотним холодильником при перемішуванні впродовж 2 годин. Ацетонітрил і надлишок триетиламіну упарювали і залишок розділяли між хлороформом і водою. Органічну фазу відділяли, промивали водою, висушували, і розчинник упарювали. Залишок (3,2г) містить суміш 85% (R,S)- і 15% (R,R)діастереомерних складних ефірів, який використовували на подальшій стадії без додаткового очищення. Приклад 18 (R)-1-(Диметил-аміно)-2-пропіловий ефір (2хлорфеніл)-α-4,5,6,7-тетрагідро-[3,2-с]тієнопіридин-5-іл-оцтової кислоти, дигідробромід Неочищену суміш діастереомерного (1(диметиламіно)-2-пропілового ефіру (R,S)- і (R,R)α-(2-хлорфеніл)-α-2-[(2-тієно)етил]аміно оцтової кислоти (3,1г), одержаного, як описано в прикладі 17, ресуспендували в 10мл 2Μ соляної кислоти, і при перемішуванні додавали 5мл 36%-ного водного формальдегіду. Суміш перемішували впродовж 2 годин при 50°С. Реакційну суміш розподіляли між діізопропіловим ефіром і 10%-ним водним гідрокарбонатом натрію. Органічний шар відділяли, промивали водою, висушували і упарювали при зниженому тиску. Залишок розчиняли в 30мл суміші 1:1 2-пропанол і 2-пропілацетат. В суміш вводили газоподібний бромистий водень (1,6г) при перемішуванні і охолодженні до 10°С. Осаджену сіль відфільтровували, промивали 2пропілацетатом і висушували, і отримували 2,85г кристалічного продукту, який містить приблизно 92% (R,S)- і 8% (R,R)-діастереомеру (хіральна ВЕРХ). Приклад 19 Переетерифікація (R)-1-(диметиламіно)-2пропілового ефіру (S)-(2-хлорфеніл)-4,5,6,7тетрагідро-[3,2-с]тієнопіридин-5-іл-оцтовоїкислоти, гідрохлориду, за допомогою каталізу з ортотитанатом Етиленгліколь (1,36г) додавали до 12,6г ізопропоксиду титану (IV) і обидва компоненти ретельно змішували. Після цього відбувалася екзотермічна реакція з утворенням етилен-біс(триізопропіл)орто-титанату, який застосовували як каталізатор переетерифікації після охолодження суміші. Каталізатор додавали до розчину 7,43г гідрохлориду (R)-1-(диметиламіно)-2-пропілового 93030 60 ефіру (S)-(2-хлорфеніл)-4,5,6,7-тетрагідро-[3,2-с]тієнопіридин-5-іл-оцтовоїкислоти в 70мл метанолу, суміш нагрівали в колбі зі зворотним холодильником впродовж 48 годин і потім дозволяли охолонути до кімнатної температури. Після цього додавали гідрокарбонат натрію (6,3г) і суміш перемішували впродовж 30 хвилин. Тверді речовини відфільтровували і фільтрат упарювали. Залишок суспендували в 200мл діетилового ефіру і суспензію перемішували впродовж 30 хвилин. Каталізатор розкладали шляхом повільного додавання 1,6мл води. До суспензії об'ємного білого осаду утвореного гідрованого оксиду титану додавали твердий безводний сульфат натрію (10г) і суміш перемішували додатково впродовж 20 хвилин. Потім тверді речовини відфільтровували і промивали на фільтрі декількома порціями діетилового ефіру. Фільтрати і воду, які застосовували для промивання, упарювали і отримували 3,9г клопідогрелу у вигляді вільної основи, що містить приблизно 15% (R)-енантіомеру і 85% (S)енантіомеру. Приклад 20 Переетерифікація (R)-1-(диметиламіно)-2пропілового ефіру (S)-2-хлорфеніл)-4,5,6,7тетрагідро-[3,2-с]тієнопіридин-5-іл оцтової кислоти за допомогою каталізу з хлорованим кремнеземом Безводний кремнезем (120°С, 20 тор, 2 годин) з середнім діаметром пор 60Å (20г) суспендували в 60мл тіонілхлориду і суспензію нагрівали в колбі зі зворотним холодильником впродовж 46 годин. Модифікований кремнезем відфільтровували, висушували впродовж 2 годин в вакуумній сушарці при 125°С при зниженому тиску і потім активували шляхом нагрівання до 360°С впродовж 30 хвилин. Вільну основу (R)-1-(диметиламіно)-2-пропілового ефіру (S)-(2-хлорфеніл)-4,5,6,7-тетрагідро-[3,2с]тієнопіридин-5-іл оцтової кислоти (10,0г) розчиняли в 150мл метанолу. Потім додавали 20г активованого модифікованого кремнезему і суміш нагрівали в колбі зі зворотним холодильником при перемішуванні впродовж 48 годин. Кремнезем відфільтровували, декілька разів промивали 100мл метанолу, і об'єднані фільтрати і воду, яку використовували для промивання, упарювали. Залишок після упарювання (10,0г, що містить 7,1г (S)-клопідогрелу) перетворювали в фармацевтично прийнятну сіль (S)-клопідогрелу. Приклад 21 Переетерифікація (R)-1-(диметиламіно)-2пропілового ecbipy (S)-2-хлорфеніл)-4,5,6,7тетрагідро-[3,2-с]тієнопіридин-5-іл оцтової кислоти, дигідрохлориду. за допомогою каталізу з хлорованим кремнеземом Безводний кремнезем (120°С, 20 тор, 2 годин) з середнім діаметром пор 100Å (20г) суспендували в розчині 14г пентахлориду фосфору в 80мл гексану і нагрівали в колбі зі зворотним холодильником впродовж 10 годин. Після охолодження суспензію залишали відстоюватися протягом ночі, потім відфільтровували, два рази промивали 20мл гексану і висушували впродовж двох годин в потоці азоту. Після цього висушували впродовж 2 годин в вакуумній сушарці при 120°С і при зниженому тиску. Потім каталізатор активували шляхом нагрівання впродовж 30 хвилин до
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the production of clopidogrel (variants) and intermediates
Автори англійськоюStohandl Jiri, Frantisek Jaroslav, Ness Winfried
Назва патенту російськоюСпособ получения клопидогрела (варианты) и промежуточные соединения
Автори російськоюСтохандл Иржи, Франтишек Ярослав, Несс Винфрид
МПК / Мітки
МПК: C07D 495/04, C07D 333/20, C07C 209/68, C07C 211/08
Мітки: проміжні, варіанти, клопідогрелу, одержання, сполуки, спосіб
Код посилання
<a href="https://ua.patents.su/32-93030-sposib-oderzhannya-klopidogrelu-varianti-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання клопідогрелу (варіанти) та проміжні сполуки</a>