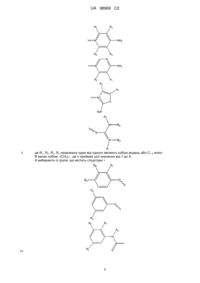
Антикоагулянтні сполуки, фармацевтична композиція на їх основі для лікування тромботичних станів і плазмозаміщуючий розчин для корекції гіперкоагуляційних порушень при гемодилюції
Номер патенту: 98969
Опубліковано: 10.07.2012
Автори: Романов Алєксєй Ніколаєвіч, Боголюбов Алєксєй Алєксєєвіч, Кондакова Ольга Анатолієвна, Бутилін Андрєй Алєксандровіч, Грібкова Іріна Владіміровна, Сулімов Владімір Борісовіч, Атауллакханов Фазоіл Іноятовіч, Сінаурідзе Єлєна Івановна, Кузнєцов Юрій Владіміровіч, Горбатєнко Алєксандр Сєргєєвіч
Формула / Реферат
1. Сполука, що має структуру формули (І):
А-В-С, (І)
або її фармацевтично прийнятна сіль або сольват, де
С вибрано із групи, що містить наступні структури:
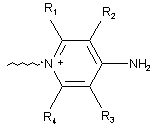 ,
,
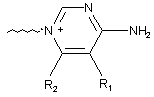 ,
,
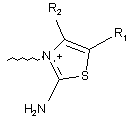 ,
,
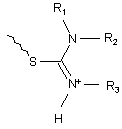 ,
,
де R1, R2, R3, R4 незалежно вибрано із групи, що містить водень або С1-6алкіл; і В являє собою -(CF2)n, де n є цілим числом в межах від 1 до 5;
А вибрано є груп:
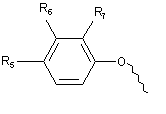 ,
,
 ,
,
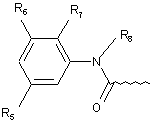 ,
,
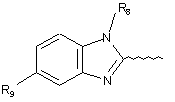 ,
,
R5 вибрано із групи, що містить водень, С1-6алкокси, OH2NR10R11, СН(СН3)NR10R11,
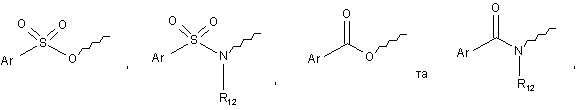
R6 і R7 кожний незалежно вибрано з групи, що містить, водень, С1-6алкіл, С1-6алкокси, галоген;
R8 являє собою водень або С1-6алкіл;
R9 вибрано з груп
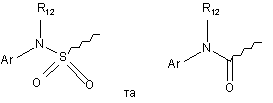 ,
,
R10, R12 кожний незалежно вибрано із групи, що містить водень, С1-6алкіл, (CH2)mCOOR13, (CH2)mCON(R13)2,
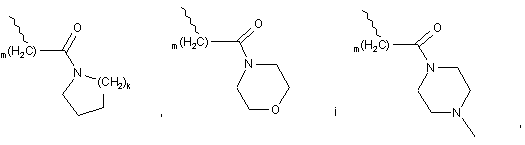
і
m є цілим числом в межах від 1 до 4,
k є цілим числом в межах від 1 до 3,
R13 являє собою водень або С1-6алкіл,
R11 являє собою С1-6алкіл або Аr;
Аr вибрано із групи, що містить феніл, піридил, оксазоліл, тіазоліл, тієніл, фураніл, піримідиніл, піридазиніл, піразиніл, індоліл, бензофураніл, бензотіофеніл, вибірково заміщені від одного до п'яти замісників, вибраних із групи, що містить водень, С1-6алкіл, С1-6алкокси, галоген, N(R13)2, OH, NO2, CN, COOR13, CON(R13)2, SO2R,3,
за умови, якщо А являє собою 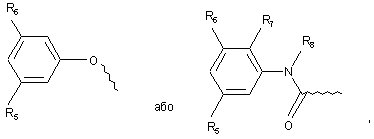
то R5 і R6 кожний не є воднем, а також, за умови, що сполука формули (І) не вибрана з групи, що складається з
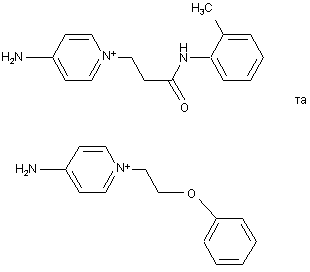 .
.
2. Сполука за п. 1, що має наступні формули:
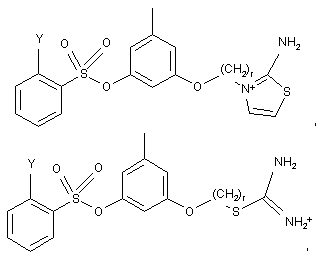
або її фармацевтична сіль або сольват,
де Υ вибрано із групи, що містить водень, галоген, COOR13, CON(R13)2 і SO2R13; a
r є цілим числом в межах від 2 до 5.
3. Сполука за п. 1 або її фармацевтично прийнятна сіль або сольват, яка має властивість інгібування тромбіну.
4. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі або сольвату як антикоагулянтів для лікування тромботичних станів ссавця.
5. Фармацевтична композиція для лікування та/або запобігання тромбінзалежним тромботичним станам, яка містить терапевтично ефективну кількість сполуки за п. 1 або її фармацевтично прийнятної солі або сольвату, а також фармацевтично прийнятний носій.
6. Плазмозаміщуючий розчин для корекції гіперкоагуляційних порушень, обумовлених гемодилюцією, який містить сполуку за п. 1 або її фармацевтично прийнятну сіль або сольват.
Текст
Реферат: Даний винахід описує нові хімічні сполуки, застосування цих сполук як антикоагулянтів, фармацевтичні композиції і плазмозамінюючі розчини на їх основі і може бути використаний для лікування тромбоемболітичних ускладнень при таких хворобах, як інфаркт міокарда, інсульт, тромбоз глибоких вен або легеневої артерії; для профілактики виникнення гіперкоагуляційних станів при травмах, хірургічних операціях, сепсисі, різних акушерських патологіях, у медицині катастроф, в умовах реанімації і т. п. UA 98969 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід описує нові хімічні сполуки, застосування цих сполук як антикоагулянтів, фармацевтичні композиції і плазмозаміщуючі розчини на їх основі і може бути використаний для лікування тромбоемболічних ускладнень при таких хворобах, як інфаркт міокарду, інсульт, тромбоз глибоких вен або легеневої артерії; для профілактики виникнення гіперкоагуляційних станів при травмах, хірургічних операціях, сепсисі, різних акушерських патологіях, у медицині катастроф, в умовах реанімації і т.п. Величезне число найрізноманітніших патологічних станів організму пов'язане з виникненням порушень у системі гемостазу. Тромбоемболічні ускладнення, що виникають при таких хворобах, як інфаркт міокарду, інсульт, тромбоз глибоких вен або легеневої артерії, є однією з основних причин смерті в усьому світі. Не дивно, що протягом великої кількості років ведеться інтенсивний пошук препаратів, які могли б служити в клініці ефективними і безпечними ліками. У першу чергу це різні антитромботичні агенти, що володіють антикоагулянтними властивостями. Тромбін є ключовим ферментом системи згортання крові. Він не тільки здійснює перетворення розчинного білка плазми фібриногену в нерозчинний фібриновий згусток, але й запускає більшість позитивних і негативних зворотних зв'язків у цій системі, активуючи тромбоцити, фактори V, VIII і XIII, а також протеїн С. Тромбін ініціює також різноманітні клітинні й судинні реакції, у тому числі, проліферацію клітин ендотелія, викид з них активаторів плазміногену і т.д. Саме через те, що тромбін бере участь у великому числі найважливіших біорегуляторних подій, інгібування тромбіну по його активному центру повинне бути дуже ефективним і багатообіцяючим у контролі багатьох патофізіологічних станів. Існують три основних напрямки впливу на систему гемостазу з метою попередження небажаного тромбоутворення: застосування прямих і непрямих інгібіторів серинових протеаз згортаючого каскаду (у першу чергу тромбіну і фактору Ха); застосування антитромбоцитарних препаратів (антагоністів GPIIb/IIIa, аспірину, антагоністів тромбінового рецептору і т.п.), що знижують агрегаційні властивості тромбоцитів і перешкоджають у такий спосіб подальшій активації згортання; застосування антагоністів вітаміну K, які знижують синтез попередніх факторів згортання печінкою. У цей час у клініці найчастіше використовують три основних антитромботичних препарати: нефракціонований гепарин, оральний антикоагулянт варфарин (вітамін K антагоніст) і інгібітор агрегації тромбоцитів аспірин. Однак кожний із цих препаратів має свої обмеження застосування і небажані побічні ефекти. Нефракціонований гепарин (UFH) - природний аніонний полісахарид, що представляє собою суміш полісахаридних ланцюжків різної довжини, побудованих з повторюваних дисахаридних одиниць, що складаються із залишків уронової кислоти (L-ідуронової і/або D-глюкуронової) і залишків D-глюкозаміна. Його молекулярна вага розподіляється за даними різних літературних джерел від 3-5 до 30-40 тисяч дальтон з піком на 12-15 тисячах дальтон. Нефракціонований гепарин і його більш легкі аналоги (гепарини низької молекулярної ваги (LMWH)) є непрямими антикоагулянтами. Вони не інгібують тромбін самостійно, а прискорюють дію природного плазменого інгібітору згортання антитромбіну III (АТІІІ). Таким чином, якщо вміст АТІІІ у плазмі хворого з якихось причин сильно знижено, гепарини виконують слабку антикоагулянтну дію. Клінічне застосування нефракціонованого гепарину має ряд недоліків: 1. Дія нефракціонованого гепарину короткоплинна. Вона проходить дуже швидко після скасування ліків, тому використання UFH не може знизити ризику повторних тромботичних подій. 2. Гепарин здійснює свій антитромботичний ефект не прямо, а опосередковано, для чого йому необхідна присутність у системі антитромбіну. 3. Гепарин активний тільки проти циркулюючого тромбіну, але практично не інгібує тромбін, сорбований на згустку. 4. При однаковій дозі гепарин має непередбачену антикоагулянтну відповідь у різних пацієнтів, що пов'язано із цілим рядом причин, у тому числі рівнем АТІІІ у плазмі, індивідуальною швидкістю виведення препарату, зв'язуванням і нейтралізацією гепарину під дією різних білків плазми і активованих тромбоцитів (тромбоцитарний фактор 4, гепариназа і т.п.). Це визначає необхідність частого моніторингу статусу коагуляційної системи. 5. Ризик геморагічних ускладнень і можливість появи тромбоцитопенії. 6. При тривалій гепаринотерапії (більше 6 місяців) і досить високих дозах гепарину (> 15000 одиниць), можливий прояв такого ускладнення, як остеопороз. 7. Гепарин може бути введений тільки внутрівенно в умовах стаціонару. Непрямими інгібіторами згортання є і антагоністи вітаміну K (типу варфарину). Механізм дії цих препаратів на систему згортання крові пов'язаний з тим, що вони ефективно блокують 1 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 55 синтез вітамін K-залежних факторів згортання печінкою. Для синтезу нормальної молекули фактора необхідно посттрансляційне -карбоксілірування N-термінального кінця майбутнього фактора. Це карбоксілірування зовсім необхідне для того, щоб синтезовані молекули фактора +2 могли в ході згортання зв'язуватися (за допомогою іонів Са ) з негативно зарядженою фосфоліпідною поверхнею активованих тромбоцитів і здійснювати свою функцію. Вітамін K є необхідним кофактором цього карбоксілірування. У ході реакції він поперемінно переходить із своєї гідроксіхінонової форми, яка і бере участь у реакції карбоксілірування, в окислену епоксидну форму. Під дією ферменту вітамін K-редуктази ця епоксидна форма відновлюється і може знову брати участь у реакції карбоксілірування. Препарати групи кумаринів блокують це відновлення. Застосування варфарину теж має ряд обмежень і недоліків. По-перше, відповідь на терапію розвивається повільно. Він починає проявлятися через добу, але максимального рівня досягає тільки через кілька днів. Крім того, цей препарат досить сильно зв'язується з різними компонентами їжі і сильно перекривається з багатьма лікарськими речовинами. Існує також більша генетична варіабельність в активності варфарин-метаболізуючого ферменту. Це пояснює більшу індивідуальну варіабельність у відповідь на варфарин і означає, що при його прийомі потрібні певні дієтарні обмеження і систематичний моніторинг. Антитромбоцитарні препарати (аспірин, антагоністи GPIIb/IIIa і т.п.), як уже говорилося вище, перешкоджають повноцінній активації тромбоцитів і їхній участі в прискоренні реакцій згортання, обмежуючи, таким чином, подальше виробництво тромбіну. Однак, вони ніяк не впливають на роботу тромбіну, що вже утворився. Таким чином, всі розглянуті вище, стандартно застосовувані антитромботичні агенти мають свої недоліки. Частина з них не є прямими інгібіторами тромбіну, тому або вимагає для прояву своєї дії присутності в плазмі антитромбіну III (UFH, LMWH), або діє повільно, інгібуючи синтез необхідних факторів згортання (варфарин і т.п.), інші взагалі не діють на тромбін, що вже утворився (антитромбоцитарні агенти). Це сприяє тому, що протягом багатьох років ведуться інтенсивні пошуки "ідеальних" інгібіторів, які володіли б не меншою ефективністю, але були б вільні від багатьох недоліків стандартних препаратів. Дуже привабливою в цьому сенсі виявилася стратегія розробки невеликих синтетичних інгібіторів тромбіну - антикоагулянтів. Подібні інгібітори швидко діють прямо на присутній у крові тромбін, що дозволяє сподіватися на те, що вони будуть ефективні для купірування гострих тромботичних ускладнень навіть в умовах зниженого вмісту АТШ у плазмі. Стратегія пошуку нових прямих синтетичних інгібіторів серинових протеаз згортаючого каскаду орієнтується на наступні вимоги, яким повинен задовольняти такий інгібітор: - Висока спорідненість до ферменту-мішені (тобто висока ефективність інгібування). - Висока селективність стосовно ферменту-мішені в порівнянні з іншими родинними сериновими протеазами. - Хімічна і метаболічна стабільність. - Відсутність токсичності. - Слабке (або не дуже сильне) зв'язування з білками плазми. - Висока біодоступність при прийманні через рот. - Досить великий час напівжиття препарату, що дозволяє при його оральному прийомі підтримувати терапевтичний рівень у плазмі настільки довго, щоб можна було обмежитися прийомом препарату 1-2 рази в день. - Можливість простого методу моніторингу рівня препарату. До теперішнього часу в літературі опублікована велика кількість оглядів, присвячених розробці низькомолекулярних інгібіторів тромбіну (Shafer J.A., Cardiovascular chemotherapy: anticoagulants, Curr. Opin. Chem. Biol., 1998, 2:458-465; Steinmetzer T., Hauptmann J., Sturzebecher J., Advances in the development of thrombin inhibitors, Exp. Opin. Invest. Drugs, 2001, 10(5):845-864; Edmunds JJ, Rapundalo ST, Siddiqui MA, Thrombin and factor Xa inhibition, Ann. Rep. Med. Chem., 1996, 31:51-60; Wiley M.R., Fisher M.J., Small molecule direct thrombin inhibitors, Expert Opin. Ther. Patents, 1997, 7:1265-1282; Hauptmann J, Sturzebecher J., Synthetic inhibitors of thrombin and factor Xa: from bench to bedside, Thromb Res., 1999, 93(5): 203-241; Vacca JP., New advances in the discovery of thrombin and factor Xa inhibitors, Curr Opin Chem Biol., 2000, 4(4):394400). Однак розробка ліків на основі нових хімічних сполук вимагає не тільки визначення їх можливої фармакологічної дії, але й ретельної перевірки токсикологічних властивостей препаратів, їхнього можливого впливу на спадковість і виявлення інших віддалених наслідків застосування. 2 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 55 60 Завдання ускладнюється також тим, що не кожний інгібітор, що знижує активність тромбіну у водних буферних розчинах, може бути реальним антикоагулянтом при згортанні крові в організмі. Це може бути пов'язано, наприклад, з механізмом інгібування. Так, якщо інгібітор є неконкурентним, то навіть при 100 %-ному зв'язуванні всіх активних центрів присутнього в плазмі тромбіну з таким інгібітором, активність ферменту не буде подавлена повністю. Залишкова активність тромбіну може бути не дуже високою, однак, у деяких випадках, вона не може бути до кінця подавлена в плазмі природним інгібітором тромбіну - АТШ. Це відбувається через певну зміну конформації молекули тромбіну при зв'язуванні з таким інгібітором, що не дозволяє АТШ підійти до активного центру фермента. У результаті в крові тривалий час зберігається залишкова активність тромбіну. Це приводить до того, що через присутність такого з'єднання в організмі, інтегральна коагуляційна відповідь не тільки не знизиться, але може сумарно навіть підсилитися. Якщо передбачуваний інгібітор тромбіну взаємодіє також з іншими компонентами системи згортання (факторами або інгібіторами згортання), то сумарну відповідь системи також неможливо пророчити заздалегідь. Сильне зв'язування інгібітору з різними білками плазми може значно підвищити дозу інгібітору, що повинна бути введена в організм для одержання бажаного антикоагуляційного ефекту. Якщо врахувати все вищесказане, то стає зрозумілим, чому при існуванні великої кількості синтезованих сполук, які здатні інгібувати тромбін, дотепер повністю пройшов всі необхідні випробування і реально дозволений для застосування в клініці тільки один препарат цього типу - синтезований у Японії інгібітор тромбіну аргатробан (патент США 5214052, 1993; Schwarz R.P., The preclinical and clinical pharmacology of Novastan (Argatroban), In: "New Anticoagulants for the CardiovascularbPatient, Pifarre R., editor, Hanley and Belfus, Inc., Philadelphia, PA, US, 1997, p. 231-249; Okamoto S, Hijikata A, Kikumoto R, Tonomura S, Hara H, Ninomiya K, Maruyama A, Sugano M, Tamao Y., Potent inhibition of thrombin by the newly synthesized arginine derivative No.805. The importance of stereo-structure of its hydrophobic carboxamide portion, Biochem Biophys Res Commun. 1981,101(2):440-446). Таким чином, пошук нових антикоагулянтів серед низькомолекулярних синтетичних інгібіторів тромбіну продовжує залишатися найактуальнішим завданням. Ці інгібітори - антикоагулянти можуть бути прямо використані для лікування гострих тромботичних станів, що виникають в організмі в результаті різних патологій. Крім того, вони можуть бути використані і для профілактики виникнення гіперкоагуляційних станів. У даній заявці пропонується використати низькомолекулярний синтетичний інгібітор тромбіну, що володіє антикоагулянтною активністю в плазмі, для додавання в стандартний плазмозаміщуючий розчин. У клініці часто виникають ситуації, коли досить більші обсяги загубленої крові доводиться швидко заповнювати штучними плазмозаміщуючими розчинами (ПЗР). Це відбувається при травмах, хірургічних операціях, сепсисі, різних акушерських патологіях, у медицині катастроф, в умовах реанімації і т.п. При цьому переслідуються наступні основні цілі: 1. Заповнення обсягу циркулюючої крові (ОЦК) для підтримки артеріального тиску, обсягу серцевого викиду, попередження колапсу судин, збереження нормальних реологічних характеристик крові і нормальної перфузії органів і тканин. 2. Підтримка нормального колоїдно-осмотичного тиску плазми і її кислотно-лужної рівноваги. 3. Підтримка кисневотранспортної функції крові і функцій системи згортання. Для досягнення перших двох цілей звичайно переливають різні плазмозаміщуючі розчини і розчини альбуміну. Забезпечення кисневотранспортної функції досягається переливанням еритроцитів, модифікованого гемоглобіну або кисневопереміщуючих розчинів типу перфторанів, а підтримка функцій системи згортання - переливанням свіжозамороженої плазми (СЗП), концентратів тромбоцитів, концентратів факторів протромбінового комплексу або окремих факторів згортання. Штучні плазмозаміщуючі розчини діляться на два класи: кристалоїдні і колоїдні. Перші являють собою сольові розчини (наприклад, 0.9 %-ний розчин NaCl - фізіологічний розчин), тоді як другі містять добавки високомолекулярних полімерів (декстранів, гидроксіетил крохмалів, похідні желатину і т.п.). Інфузії більших обсягів стандартних ПЗР приводять до розведення крові цими розчинами (гемодилюції). Так як жоден стандартний ПЗР на сьогоднішній день не містить факторів і інгібіторів згортання, то в результаті гемодилюції відбувається зниження концентрацій компонентів системи згортання в крові. Раніше було показано, що при масивних переливаннях стандартних ПЗР гемодилюція, що виникає в крові, викликає розбаланс роботи системи згортання і посилення коагуляції. Це пов'язане з тим, що при розведенні система виявляється 3 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 55 більш чутливою до зниження концентрації інгібіторів згортання, у той час як прокоагулянтні попередники факторів згортання присутні в плазмі в досить великому надлишку, у результаті чого при помірних ступенях розведення зниження їхніх концентрацій практично не робить впливу на швидкість згортання. Для корекції можливих гіперкоагуляційних порушень, пов'язаних з об'ємними переливаннями ПЗР, авторами був запропонований новий ПЗР, до складу якого був введений природний інгібітор тромбіну - антитромбін III (Патент РФ, рішення про видачу за заявкою №2005140841 від 27.12.2005). Запропонований розчин є першим представником нового покоління ПЗР, які здатні частково корегувати гіперкоагуляційні порушення, викликані об'ємними переливаннями ПЗР. Недоліком цього розчину є те, що антитромбін III - це природний білок, який необхідно виділяти із плазми людини. Це, з одного боку, досить дорого, а з іншого боку - не дозволяє повністю виключити можливість вірусного зараження препарату (ВІЧ, гепатит і т.п.). Гарною альтернативою антитромбіну III може служити синтетичний низькомолекулярний інгібітор тромбіну - антикоагулянт. Відбір сполук, що представляють інтерес, з погляду практичного застосування як антикоагулянти, тобто, які володіють здатністю сповільнювати і/або запобігати згортанню крові, проводився на підставі наступних критеріїв: 1. Речовина повинна бути інгібітором тромбіну, тобто запобігати амідолітичній реакції розщеплення молекули фібриногену, яку каталізує тромбін. 2. Речовина повинна мати прийнятні фізико-хімічні властивості (ліпофільність, гідрофільність), щоб бути присутньою у плазмі крові у вільному виді в достатній концентрації. Іншими словами, зв'язування з іншими білками плазми крові (альбуміни, глобуліни і т.д.) повинне бути помірним. 3. Речовина повинна мати достатній час життя в плазмі крові, щоб міг виявитися властивий їй терапевтичний ефект. Відбір за першим критерієм здійснювався у два етапи. Спочатку була побудована віртуальна бібліотека, сфокусована на структурах, описуваних загальною структурною формулою (І) з наступним докінгом отриманих структур в активний центр молекули тромбіну. У результаті відбиралися найбільш перспективні кандидати ("віртуальні хіти"), тобто ті молекули, які демонстрували значення скоринг-функції (обумовленої в процесі докінгу) не гірше, ніж -5.0 ккал/моль. Другим етапом відбору був експериментальний вимір прямої інгібуючої дії відібраних з'єднань на активність тромбіну у водному буферному розчині, де тромбін розщеплював специфічний хромогенний (або флюорогенний) субстрат. У присутності інгібітору швидкість цієї реакції знижувалася. Для наступних випробувань антикоагулянтної дії нових з'єднань у плазмі крові були відібрані сполуки формули (І), які в досить невеликих концентраціях (< 1 мм) інгібували активність тромбіну в буферному розчині більш, ніж на 60 %. При конструюванні молекул нових інгібіторів тромбіну, які могли б бути ефективними антикоагулянтами в організмі, враховували, що для додання молекулі інгібітора прийнятних фізико-хімічних властивостей, що визначають сприятливу фармакокінетику, бажано частково врівноважити в цілому гідрофобний характер молекули інгібітора формули (І) шляхом вибору гідрофільних лінкерів. Із цією ж метою можлива модифікація гідрофобних фрагментів, розташованих у кишені S3 молекули тромбіну, гідрофільними залишками, які розміщаються в кишені з боку, експонованому в розчинник. Достатній час життя в плазмі крові можна одержати, уникаючи в структурі інгібітора лабільних хімічних груп, які легко розщеплюються в хімічних або біохімічних процесах. Прикладом таких небажаних груп служить, наприклад, складноефірна група. Таким чином, можна відібрати для хімічного синтезу і наступної експериментальної перевірки як антикоагулянти, молекули, що мають у собі перераховані вище оптимальні вимоги, (іноді суперечливі). Остаточне рішення про синтез приймалося, виходячи з оцінки його можливої складності. У даному винаході, якщо не визначено інше, використовуються наступні визначення: Активний центр являє собою ділянку білкової макромолекули, що грає ключову роль у біохімічних взаємодіях. Білок або Протеїн являє собою білкову макромолекулу. Білок-мішень являє собою білкову макромолекулу, що бере участь у процесі зв'язування. Ліганди являють собою колекцію низькомолекулярних хімічних структур. Процес зв'язування - це утворення Ван-дер-Ваальсового або ковалентного комплексу ліганда з активним центром білка-мішені. Скринінг - це виявлення з колекції хімічних структур набору сполук, вибірково взаємодіючих з певною ділянкою білкової макромолекули. 4 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 Правильне позиціювання - це позиціювання, коли ліганд перебуває в положенні, що відповідає мінімуму вільної енергії зв'язування з білком. Вибірково взаємодіючий ліганд - це ліганд, що специфічно зв'язується з даним білкоммішенню. Реперний білок являє собою білок, використовуваний або для коректування параметрів швидка відповідно до експериментальних даних, або в процесі валідації роботи системи, або для оцінки специфічності зв'язування даного інгібітора. Валідація - це набір розрахунків і методика порівнянь, що дозволяє судити про якість роботи системи, оцінити наскільки ефективно система відбирає з довільного набору лігандів ті з них, які добре зв'язуються із заданим білком-мішенню. Специфічно зв'язується ліганд - це ліганд, що зв'язується тільки з даним білком і не зв'язується з іншими білками. Інгібітор - це ліганд, що зв'язується з активним центром заданого білка-мішені і який блокує нормальний хід біохімічних реакцій. Докінг - це позиціювання ліганда в активному центрі білка. Скоринг - це розрахунок для оцінки вільної енергії зв'язування ліганд-білка. G зв'язування - результат розрахунку виграшу вільної енергії при зв'язуванні ліганда з білком-мішенню (за допомогою програми SOL). З1-6 алкіл являє собою алкільну групу, що містить нерозгалужений або розгалужений вуглеводневий ланцюг, що містить від 1 до 6 атомів вуглецю, наприклад, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил і так далі. З1-6 алкоксі являє собою алкоксільну групу, що містить нерозгалужений або розгалужений вуглеводневий ланцюг, що містить від 1 до 6 атомів вуглецю, наприклад, метоксі, етоксі, нпропоксі, ізопропоксі і так далі. Галоген означає хлор, бром, йод або фтор. Фармацевтично прийнятна сіль - будь-яка сіль, утворена активним з'єднанням Формули (І), якщо вона не токсична і не перешкоджає адсорбції і фармакологічній дії активного з'єднання. Ця сіль може бути отримана дією на з'єднання Формули (І) органічної або неорганічної підстави, такого як гідроксід натрію, гідроксід калію, гідроксід амонію, метиламін, етиламін і тому подібне. Сольват являє собою кристалічну форму активного з'єднання Формули (І), до складу кристалічної решітки якої входять молекули води або іншого розчинника, з якого кристалізувалося активне з'єднання Формули (І). Фармацевтично прийнятний носій означає, що носій повинен бути сумісним з іншими інгредієнтами композиції і не наносити шкоди його реципієнтові, тобто бути нетоксичним для клітин або ссавців у тих дозах і концентраціях, у яких його застосовують. Часто фармацевтично прийнятний носій являє собою водний рН буферний розчин. Приклади фізіологічно прийнятних носіїв включають буфери, такі як фосфати, цитрати і інші солі органічних кислот, антіоксіданти, що включають аскорбінову кислоту; поліпептиди з низькою молекулярною вагою (менше 10 залишків); протеши, такі як сироватковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, такі як полівінілпіролідон; амінокислоти, такі як гліцин, глютамін, аспарагін, аргінін або лізин; моносахариди, дисахариди і інші вуглеводи, включаючи глюкозу, манозу або декстрини; хелатоутворюючі агенти, такі як ЕДТА; цукрові спирти, такі як манітол або сорбітол. Терапевтично ефективна кількість - це кількість, необхідна для прояву лікувального ефекту (тобто досягнення потрібного ступеня інгібування тромбоутворення) в організмі ссавця. Ссавець як використовуєтьсятут, містить у собі представників загону приматів (наприклад, людина, людиноподібні мавпи, нелюдиноподібні мавпи, нижчі мавпи), загону хижих (наприклад, кішки, собаки, ведмеді), загону гризунів (наприклад, миша, пацюк, білка), загону комахоїдних (наприклад, землерийка, кріт) і ін. Технічним завданням даного винаходу є одержання нових низькомолекулярних сполук, що мають високу антикоагулянтну активність. У даній заявці описаний ряд таких нових низькомолекулярних сполук, що мають високу антикоагулянтну активність, а саме, сполук загальної структурної формули (І), їх фармацевтично прийнятних солей або сольватів: А-В-С (І) де С вибирають із групи, що містить структури: 5 UA 98969 C2 5 де R1, R2, R3, R4 незалежно один від одного являють собою водень або С1-6 алкіл; В являє собою -(СН2)n-, де n приймає цілі значення від 1 до 5; А вибирають із групи, що містить структури: і 10 6 UA 98969 C2 де R5 вибирають із групи, що містить водень, З1-6-алкокси, CH2NR10R11, CH(CH3)NR10R11, 5 , , , де R6 і R7 незалежно являють собою водень, С1-6 алкіл, С1-6 алкоксі, галоген; R8 являє собою водень або С1-6 алкіл; R9 вибирають із наступної групи, що складається з: , , , R10, R12 незалежно один від одного вибирають із групи, що складається з водню, С1-6 алкілу, (CH2)mCOOR13, (CH2)mCON(R13)2, 10 15 , , де m приймає цілі значення від 1 до 4; R13 являє собою водень або С1-6 алкіл; R11 являє собою С1-6 алкіл або Аr; Аr являє собою феніл, піридил, оксазоліл, тіазоліл, тієніл, фураніл, піримідиніл, піридазиніл, піразиніл, індоліл, бензофураніл, бензотіофеніл, що мають від одного до п'яти замісників, обраних із групи: водень, З1-6 алкіл, З1-6 алкоксі, галоген, N(R13)2, OH, NO2, CN, COOR13, CON(R13)2, SO2R13; за винятком: 7 UA 98969 C2 5 10 15 Виключені сполуки є відомими. 4-аміно-1-[3-[(2-метилфеніл) аміно]-3-оксопропіл] піридиніум хлорид описаний в Journal of Medicinal Chemistry, 17(7), 739-744, 1974 у статті Carbocyclic Derivatives related to indoramin (Карбоцикличні похідні, що ставляться до індораіну). 4-аміно-1-(2феноксіетил)-піридиніум бромід описаний в Journal of Organic Chemistry, 26, 2740-7, 1961 у статті Application of sodium borohydride reduction to synthesis of substituted aminopiperidines, aminopiperazines, aminopyridines and hydrazines (Застосування відновлення боргідридом натрію для синтезу заміщених амінопіперидинів, амінопіперазинів, амінопіридинів і гідразинів). Однак, слід зазначити, що в зазначених джерелах не описана можливість використання цих з'єднань як антикоагулянтів. У кращому варіанті здійснення винаходу описані наступні сполуки за пунктом 1, їх фармацевтично прийнятні солі або сольвати: а) б) в) 20 25 де Y вибирають із групи, що складається з водню, галогену, COOR 13, CON(R13)2, SO2R13; і r приймає цілі значення від 2 до 5. Даний винахід описує також застосування сполуки формули (І), її фармакологічно прийнятних солей і сольватів як антикоагулянтів для лікування і профілактики різних тромботичних станів, а також фармацевтичну композицію для лікування тромботичних станів, що містить терапевтично ефективну кількість сполуки за пунктом 1, і/або її фармацевтично прийнятних солей і/або сольватів, і фармацевтично прийнятний носій. 8 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 Винахід описує також новий плазмозамінюючий розчин, що містить як антикоагулянт сполуки формули (І), її прийнятні фармакологічні солі або сольвати. Для створення такого розчину в стандартні плазмозамінюючі розчини додають сполуку формули (І), її фармакологічно прийнятні солі або сольвати. Концентрація антикоагулянту, що додається, залежить від його інгібуючої здатності, і може мінятися для різних сполук у широких межах (від 0.01 нм до 1 мм). Розчин, що містить антикоагулянт, дозволяє частково корегувати ті гіперкоагуляційні порушення, які виникають в організмі при об'ємних переливаннях стандартних ПЗР, не утримуючих факторів, а головне, інгібіторів згортання. Пропонований новий ПЗР, що містить штучний синтетичний низькомолекулярний антикоагулянт, вигідно відрізняється від аналогічного розчину, що містить природний інгібітор тромбіну АТІІІ, тому що містить замість дорогого природного білка (АТІІІ) стандартний за складом і більш дешевий інгібітор, що, крім того, не створює небезпеки вірусного зараження пацієнта при інфузії ПЗР. Сполуки за винаходом можуть бути введені будь-яким придатним чином, що забезпечив би їх біонакопичення в крові. Це може бути досягнуто парентеральними способами введення, включаючи внутрішньовенні, внутрішньом'язові, внутрішньошкірні, підшкірні і внутрішньочеревні ін'єкції. Можуть бути використані і інші способи введення. Наприклад, абсорбцією через шлунково-кишковий тракт, здійснюваною шляхом перорального введення відповідних складів. Пероральне введення має перевагу за рахунок більш легкого використання. Альтернативно, можуть бути використані способи введення через м'язову тканину - вагінальний і ректальний. Крім того, сполуки за винаходом можуть бути введені через шкіру (наприклад, трансдермально) або інгаляцією. Зрозуміло, що кращий спосіб введення залежить від стану, віку і сприйнятливості пацієнта. Для перорального введення фармацевтичні композиції можуть являти собою, наприклад, таблетки або капсули з фармацевтично придатними добавками, такими як агенти, що зв'язують (наприклад, пептизований маїсовий крохмаль, полівінілпіролідинон або гідроксипропіл метилцелюлоза); наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза, гідрофосфат кальцію; стеарат магнію, тальк або оксид кремнію; картопляний крохмаль або крохмальний гліколят натрію); або зволожувателі (наприклад, лаурилсульфат натрію). Таблетки можуть бути покриті оболонкою. Рідкі суміші для орального введення можуть бути виконані у формі, наприклад, розчинів, сиропів або суспензій. Такі рідкі суміші можуть бути отримані звичайними засобами з фармацевтично прийнятними добавками, такими як суспендуючі агенти (наприклад, похідні целюлози); емульгатори (наприклад, лецитин), розріджувачі (очищені рослинні масла); і консерванти (наприклад, метил або пропіл-п-гідроксибензоати або сорбінова кислота). Суміші можуть також містити відповідні буферні солі, ароматизатори, барвники і підсолоджувателі. Токсичність представлених антикоагулянтів була визначена, використовуючи стандартні фармацевтичні процедури на експериментальних тваринах для визначення LD 50 (доза, летальна для 50 % популяції). Для кращих сполук за винаходом LD 50 виявилося більше 367 мк/кг, що сумірно з летальною дозою в минулих клінічних дослідженнях аргатробану, що має LD50=475 мк/кг. Для того, щоб предмет даного винаходу був більш зрозумілий, нижче наведені деякі приклади одержання нових сполук, описані методи дослідження антикоагулянтної активності цих сполук і результати даних досліджень. Приклади носять ілюстративний характер, причому сутність винаходу ні в якій мері не обмежується представленими прикладами. Приклад 1 Синтез проміжного продукту 3-(3-хлорпропокси)-5-метилфенолу Суміш 3.8 г (27 ммоль) орцин гідрату, 4.8 г (30 ммоль) 1-бром-3-хлорпропану і 4.0г (29 ммоль) карбонату калію кип'ятили в 30 мл ацетонітрилу при перемішуванні протягом 36 годин. Потім реакційну суміш упарили, розчинили в 20 мл ефіру, промили два рази по 15 мл насиченим розчином карбонату калію, водний шар відкинули, ефірний шар екстрагували 3 рази по 15 мл 10 % розчину гідроксиду натрію. Ефірний шар відкинули, водний обережно підкислили концентрованою НСl і потім екстрагували 3×15 мл ефіру. Ефірні екстракти об'єднали, промили невеликою кількістю насиченого розчину гідрокарбонату натрію і сушили безводним сульфатом натрію, розбавили приблизно 1/3 частиною (по об'єму) гексану і профільтрували через шар 9 UA 98969 C2 5 10 15 20 25 30 35 40 силікагелю. Після розпарювання одержали 1.7 г жовтого масла, що представляє із себе суміш, яка складається з ~70 % орцину (Rf 0.10), ~30 % 3-(2-хлорпропокси)-5-метилфенолу (Rf 0.26, вихід ~ 1.2г (22 % на чисту речовину)). Аналогічним чином з гідрату орцину і 1-бром-2-хлоретану отриманий 3-(2-хлоретокси)-5метилфенол (Rf 0.26, вихід ~ 1.1г (20 % на чисту речовину)), а з гідрату орцину і 1-бром-4хлорбутану отриманий 3-(4-хлорбутокси)-5-метилфенол. Приклад 2 Синтез проміжного продукту 3-(3-хлорпропокси)-5-метилфенілового ефіру 2фторбензолсульфокислоти. До розчину 1.3 г суміші з досліду 1А в 30 мл сухого ТГФ додали 2.05 г (10 ммоль) 2фторбензолсульфохлориду і 1.1 г (11 ммоль) триетиламіну. Суміш перемішували протягом 6 годин, відфільтрували осад гідрохлорида триетиламонію і упарили. Отримане масло розчинили в 20 мл ефіру, і кілька разів промили 10 мл ~ 10-12 % водяним розчином аміаку для відділення надлишку непрореагованого бензолсульфохлориду (контроль по ТСХ) і потім 10 мл ~ 20 % соляної кислоти. Після сушіння безводним сульфатом натрію і розпарювання отримано 2.4 г ясно-жовтого масла, що представляє суміш цільового продукту і дибензолсульфоніліруваного орцину в співвідношенні -2:1, вихід на чистий цільовий продукт 1.6 г (97 % по реакції) (ТСХ пластинки Мерк 60, гексан-кетилацетат 2:1. Rf 0.35 - продукт, Rf 0.25 - домішка дибензилового ефіру. Аналогічним чином з 3-(2-хлоретокси)-5-метилфенолу, 3-(3-хлорпропокси)-5-метилфенолу, 3-(4-хлорбутокси)-5-метилфенолу і відповідних арилсульфохлоридів отримані: З-(3-хлорпропокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти (77 % на чисту речовину). 3-(3-хлорпропокси)-5-метилфеніловий ефір бензолсульфокислоти (60 %). 3-(3-хлорпропокси)-5-метилфеніловий ефір 2-карбметокси бензолсульфокислоти (56 %). 3-(2-хлоретокси)-5-метилфеніловий ефір бензолсульфокислоти (72 %). 3-(2-хлоретокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти (35 %). 3-(2-хлоретокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти (34 %). 3-(2-хлоретокси)-5-метилфеніловий ефір 2-карбметоксибензолсульфокислоти (37 %). 3-(4-хлорбутокси)-5-метилфеніловий ефір бензолсульфокислоти (45 %). 3-(4-хлорбутокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти (27 %). 3-(4-хлорбутокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти (32 %). 3-(4-хлорбутокси)-5-метилфеніловий ефір 2-карбметокси бензолсульфокислоти (21 %). Приклад 3 Синтез проміжного продукту 3-(3-йодпропокси)-5-метилфенілового ефіру 2фторбензолсульфокислоти. До 2.4 г суміші з попереднього досліду (2А) в 30 мл сухого ацетону додали 2 г (13 ммоль) прожареного йодиду натрію і кип'ятили протягом 27 годин. Потім розбавили реакційну суміш 10 мл гексану і профільтрували і упарили. Отримане темно-жовте масло розчинили в 20 мл суміші ефір-гексан (2:3), профільтрували через шар силікагелю (2 див, Lancaster) і упарили. Одержали 10 UA 98969 C2 5 10 15 20 25 30 35 2.45 г жовтого масла, що містить 3-(2-йодоетокси)-5-метилфеніловий ефір 2фторбензолсульфокислоти (Rf 0.35), і дибензоілсульфоновий ефір орцину(Rf 0.25). Аналогічним чином з відповідних хлоридів отримані: 3-(3-йодопропокси)-5-метилфеніловий ефір бензолсульфокислоти 3-(3-йодопропокси)-5-метилфеніловий ефір 2-хлорбензолсульфокислоти 3-(3-йодопропокси)-5-метилфеніловий ефір 2-карбметокси бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніловий ефір бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніловий ефір 2-карбметоксибензолсульфокислоти 3-(4-йодбутокси)-5-метилфеніловий ефір бензолсульфокислоти 3-(4-йодбутокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти 3-(4-йодбутокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти 3-(4-йодбутокси)-5-метилфеніловий ефір 2-карбметокси бензолсульфокислоти Приклад 4 Синтез 4-аміно-1-(3-(3-метил-5-(2-фторбензолсульфонілокси)фенокси)пропіл)-піридинного йодиду (HC_029s_IOC). Суміш 0.65 г "сирого йодиду" (з досліду 3А) (в розрахунку на 70 % вмісту активної речовини) і 0.09 г (0.95 ммоль) 4-амінопіридіну в 10 мл сухого діоксану кип'ятили протягом 20 годин. Після того як суміш охолонула, розчин упарили, отримане масло затирали з декількома порціями ефіру до затвердіння. Твердий залишок відфільтрували і перекришталізували із суміші діоксанацетонітрил (5:1), осад солі відфільтрували, промили ефіром. Після сушіння у вакуумі отримано 0.4 г (72 %) світло-бежевої солі, що містила біля 4-5 % неідентифікованих домішок. Для їхнього видалення речовина була ще раз перекришталізована з тієї ж системи. Отримано 0.25 г світлого порошку. Аналогічним чином з відповідних йодидів і гетероциклічних з'єднань, тіомочевини і похідних тіомочевини були отримані: 4-аміно-1-(3-(3-метил-5-(бензолсульфонілокси)фенокси)пропіл)-піридинний йодид (HC_016s_IOC). Вихід 78 %. 1 ЯМР Н (Broker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.20 с, 3Н; 3.88 т, 2Н, J=5.50; 2.16 м, 2Н, J=6.11; 4.25 т, 2Н, J=6.71; 6.31 с, 1Н, 6.44 с, 1Н, 6.66 с, 1H; 7.68 т, 2Н, J=7.94, 7.82 т, 1Н, J=7.94, 7.87 д, 2Н, J=7.32; 6.81 д, 2Н, J=6.72, 8.17 д, 2Н, J=6.72; 8.09 с, 2Н 2-аміно-1-(3-(3-метил-5-(бензолсульфонілокси)фенокси)пропіл)-тіазолій йодид (HC_017s_IOC). 11 UA 98969 C2 5 10 15 20 25 Вихід 65 %. 1 ЯМР Н (Broker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.21 с, 3Н; 3.93 т, 2Н, J=6.11; 2.11 м, 2Н, J=6.10; 4.15 т, 2Н, J=6.71; 6.35 с, 1Н, 6.44 с, 1Н, 6.68 с, 1H; 7.69 т. 2Н, J=7.33, 7.84 т, 1Н, J=7.32, 7.88 д, 2Н, J=7.93; 7.02 д, 1Н, J=4.27, 7.42 д, 1Н, J=4.27; 9.42 с, 2Н 3-(3-метил-5-(бензолсульфонілокси)фенокси)пропіл-ізотіоуроній йодид (HC_018s_IOC). Вихід 80 %. 1 ЯМР Н (Bruker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.21 с, 3Н; 3.95 т, 2Н, J=6.10; 2.00 м, 2Н, J=6.71; 3.25 т, 2Н, J=7.32; 6.40с, 1Н, 6.25 с, 1Н, 6.74 с, 1H; 7.69 т, 2Н, J=7.94, 7.84 т, 1Н, J=7.93, 7.89 д, 2Н, J=7.33; 9.03 с, 4Н 4-аміно-1-(2-(3 -метил-5-(бензолсульфонілокси)феноксі)етил)-піридиній йодид (HC_019s_IOC). Вихід 60 %. 1 ЯМР Н (Bruker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.20 с, 3Н; 4.24 т, 2Н, J=4.88; 4.48 т, 2Н, J=4.89; 6.39 с, 1Н, 6.45 с, 1Н, 6.73 с, 1Н; 7.68 т, 2Н, J=7.93, 7.82 т, 1H, J=7.93, 7.87 д, 2Н, J=7.32; 6.82 д, 2Н, J=7.32, 8.18 д, 2Н, J=7.33; 8.14 с, 2Н 2-(3-метил-5-(бензолсульфонілокси)фенокси)етил-ізотіоуроній йодид (HC_020s_IOC). Вихід 45 %. 1 ЯМР Н (Bruker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.22 с, 3Н; 4.11 т, 2Н, J=5.49; 3.54 т, 2Н, J=5.49; 6.41 с, 1Н, 6.48 с, 1Н, 6.76 с, 1Н; 7.69 т, 2Н, J=7.93, 7.84 т, 1Н, J=7.93, 7.89 д, 2Н, J=7.32; 9.10 с, 4Н 12 UA 98969 C2 2-(3-метил-5-(2-хлорбензолсульфонілокси)фенокси)етил-ізотіоуроній йодид (HC_024s_IOC). 5 10 15 20 25 Вихід 53 %. 1 ЯМР Н (Bruker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.21 с, 3Н; 3.95 т, 2Н, J=5.50; 2.12 м, 2Н, J=5.50; 4.15 т, 2Н, J=6.10; 6.42 с, 1Н, 6.51 с, 1Н, 6.70 с, 1Н; 7.59 т, 1Н, J=7.32, 7.83 т, 1H, J=7.94, 7.88 д, 1Н, J=7.94, 7.95 д, 1Н, J=7.94; 7.01 д, 1Н, J=4.27, 7.42 д, 1Н, J=4.27; 9.39 с, 2Н 3-(3-метил-5-(2-хлорбензолсульфонілокси)фенокси)пропіл-ізотіоуроній йодид (HC_026s_IOC). Вихід 55 %. 1 ЯМР Н (Bruker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.22 с, 3Н; 3.97 т, 2Н, J=6.10; 2.01 м, 2Н, J=7.33, J=6.10; 4.26 т, 2Н, J=7.33; 6.47 с, 1Н, 6.51 с, 1Н, 6.75 с, 1Н; 7.60 т, 1Н, J=7.93, 7.84 т, 1Н, J=7.94, 7.88 д, 1Н, J=7.93, 7.96 д, 1Н, J=7.94; 8.95 с, 2Н, 9.07 с, 2Н 4-аміно-1-(2-(3-метил-5-(2-хлорбензолсульфонілокси)фенокси)етил)-піридиній йодид (HC_025s_IOC). Вихід 58 %. 1 ЯМР Н (Bruker DRX500, 500 МГц, ДМСО-d6, м. д., J Гц): 2.20 с, 3Н; 4.26 т, 2Н, J=4.88; 4.49 т, 2Н, J=4.88; 6.45 с, 1Н, 6.51 с, 1Н. 6.74 с, 1Н; 7.58 т, 1Н, J=7.93, 7.84 т, 1Н, J=7.94, 7.88 д, 1Н, J=7.93, 7.94 д, 1Н, J=7.94; 6.82 д, 2Н, J=7.32, 8.18 д, 2Н, J=7.33; 8.14 с, 2Н Аналогічним чином, за методиками, викладеними у прикладах 1-4 з використанням різних арилсульфохлоридів і гетероциклілсульфохлоридів був отриманий ще ряд речовин, хімічні формули яких, а також параметри мас-спектру і розрахована величина скоринг-функції наведені в таблиці 1. Речовини можуть бути отримані у вигляді відповідних йодидів, бромідів, хлоридів або інших солей. 13 UA 98969 C2 Приклад 5 Синтез з'єднань 5 10 15 20 25 30 1. 4-хлор-3-нітробензол-1-сульфонілхлорид 15 г о-нітрохлораніліну вносять в 30 мл хлорсульфонової кислоти при перемішуванні і нагрівають 2 години при 100 °C, 2 години при 110 °C і 5 годин при 127 °C. Реакційну масу прохолоджують до кімнатної температури і виливають на 140 г колотого льоду. Осад відфільтровують, промивають крижаною водою і сушать на повітрі. Одержують 15 г 4-хлор-3нітробензол-1-сульфонілхлориду. 2. 4-Хлор-N-метил-3-нітро-N-фенілбензолсульфонамід 10.6 г (0.041 моль) 4-хлор-3-нітробензол-1-сульфонілхлориду розчиняють в 50мл толуолу, додають 4,14 г (0,041 моль) триетиламіну і при перемішуванні вносять 4,4 г (0,041 моль) Nметиланіліну. Реакційну суміш нагрівають при 70-80 °C протягом 1 години, після охолодження толуольний розчин двічі промивають 30 мл води. Реакційну масу концентрують у вакуумі і осад перекришталізують з етанолу. Вихід 4-Хлор-N-метил-3-нітро-N-фенілбензолсульфонаміду - 9,4 г (61 %). 3. N-метил-4-(метиламшо)-3-нітро-N-фенілбензолсульфонамід 9,4 г (0,029 моль) 4-хлор-N-метил-3-нітро-N-фенілбензолсульфонаміду розчиняють в 50 мл етанолу і додають 25мл 40 % водяного розчину метиламіну. Реакційну суміш нагрівають до 70 °C і перемішують при цій температурі протягом години. Після охолодження реакційної маси осад відфільтровують, промивають етанолом і сушать при 60 °C. Вихід Н-метил-4-(метиламіно)3-нітро-N-фенілбензолсульфонаміду - 9.0 г (97 %). 4. 3-аміно-N-метил-4-(метиламіно)-N-фенілбензолсульфонамід 9 г (0,028 моль) N-метил-4-(метиламіно)-3-нітро-N-фенілбензолсульфонаміду розчиняють в 90 мл ізопропілового спирту. Додають 11 мл гідразин-гідрату, 2 г активованого вугілля і розчин 0,5 г FеСl3.6Н2О в 10 мл спирту. Реакційну масу кип'ятять протягом 8 годин. Вугілля відфільтровують, фільтрат упаровують досуха. Одержують 8,1 г(99 %) 3-аміно-N-метил-4(метиламіно)-N-фенілбензолсульфонаміду 5. 3-хлор-N-(5-(N-метил-N-фенілсульфамоіл)-2-(метиламіно)феніл)пропанамід 14 UA 98969 C2 5 10 15 20 25 30 До розчину 5,4 г (0,018 моль) 3-аміно-N-метил-4-(метиламіно)-N-фенілбензолсульфонаміду і 1,81 г (0,018 моль) триетиламіну в 16 мол діметилформаміду додають 2,32 г (0,018 моль) хлорпропіонілхлориду при охолодженні на крижаній ванні (~5 °C). Реакційну масу перемішують протягом 5-ти годин при кімнатній температурі. Додають 14 мл води і 5 мл ацетонітрилу. Осад відфільтровують через 4-5 годин. Вихід 3-хлор-N-(5-(N-метил-N-фенілсульфамоіл)-2(метиламіно)феніл)пропанаміду - 3,1 г (45 %). 6. 4-аміно-1-(3-(5-(N-метил-N-фенілсульфамоіл)-2-(метиламіно)феніламіно)-3оксопропіл)піридинійхлорид. 1 г (0,0026 моль) 3-хлор-N-(5-(N-метил-N-фенілсульфамоіл)-2(метиламіно)феніл)пропанаміду і 0,73 г (0,0078 моль) 4-амінопіридину кип'ятять в 50 мл безводного ацетону протягом 50 годин, осад, що виділився, відфільтровують і перекришталізовують із суміші ацетонітрил/етанол - 10/1. Вихід 4-аміно-1-(3-(5-(N-метил-N-фенілсульфамоіл)-2-(метиламіно)феніламіно)-3оксопропіл)піридинійхлориду - 0,54 г (43 %). 7. 4-аміно-1-(2-(1-метил-5-(N-метил-N-фенілсульфамоіл)-1Н-бензо[d]імідазол-2іл)етил)піридинійхлорид. До суспензії 0,2 г (0,00042 моль) 4-аміно-1-(3-(5-(N-метил-N-фенілсульфамоіл)-2(метиламіно)феніламіно)-3-оксопропіл)піридинійхлориду в 8 мл ацетонітрилу додають 0,2 мл тіонілхлориду і реакційну масу кип'ятять протягом 10 хв. Залишають при кімнатній температурі на 24 години. Після витримки реакційну масу розбавляють 8 мл діетилового ефіру, що виділився, осад відфільтровують і перекришталізовують із суміші ацетонітрил/етанол у співвідношенні 10/1. Вихід 4-аміно-1-(2-(1-метил-5-(N-метил-N-фенілсульфамоіл)-1Нбензо[d]імідазол-2-іл)етил)піридинійхлориду - 0,055 г (26 %). Аналогічним чином, за методиками, викладеними у прикладі 5 був отриманий ряд речовин, хімічні формули яких, а також параметри мас-спектру і розрахована величина скоринг-функції наведені в таблиці 2. Речовини можуть бути отримані у вигляді відповідних йодидів, бромідів, хлоридів або інших солей. 15 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 6 Оцінка впливу синтезованих сполук на стан гемостазу. Для оцінки статусу системи згортання в присутності заново синтезованих сполук у даній роботі був використаний стандартний коагулогічний тест - тромбіновий час згортання (ТЧ), а також два сучасних in vitro тести: тест генерації тромбіну і вимір швидкості росту згустку в просторі. На відміну від стандартних тестів виміру часів згортання, які проводяться в умовах максимальної активації згортання по зовнішньому або внутрішньому шляху, відповідно, і, отже, не здатні виявити стан гіперкоагуляції в досліджуваній системі, дані тести проводяться при набагато більш слабкій вихідній активації, близькій до існуючої в організмі. Це робить їх чутливими як до стану гіпо-, так і до стану гіперкоагуляції в досліджуваних зразках плазми. Вимір тромбінового часу Тест тромбінового часу згортання характеризує останній етап у каскаді реакцій згортання перетворення фібріногену плазми під дією тромбіну, що додається в систему, у нерозчинний фібриновий згусток. До бідної тромбоцитами плазми (РРР), яку одержують шляхом центрифугування (15 хвилин при 1300 g) крові, заготовленої на 3.8 %-ному цитраті натрію (рН 5.5) (співвідношення кров:цитрат - 9:1), додають фіксовану кількість тромбіну із стандартною активністю. Вимірюваний час утворення згустку в цьому тесті залежить від кількості інгібіторів тромбіну в плазмі. Він подовжується, коли в системі присутній сильний тромбіновий інгібітор, що зменшує активність ферменту, який додається, і, таким чином, затримує згортання. Тромбіновий час вимірювали за стандартною методикою (З.С. Баркаган, А.П. Момот. "Діагностика і контрольована терапія порушень гемостазу". М., "Ньюдіамед", 2001, стор. 87-89). У кювету агрегометру фірми Biola Ltd.(Росія) вносили 90 мкл РРР, прогрітої на водяній лазні при 37 °C протягом 3 хвилин, додавали 10 мкл суміші тестуємої речовини з буфером (до досягнення кінцевої концентрації в кюветі від 0.005 мМ до 5 мМ для різних з'єднань) і 100 мкл розчину тромбіну (стандартизованого за активністю на контрольній нормальній плазмі). Вимірювали час утворення згустку. Результати усереднювали за трьома незалежними експериментами. Вимір ендогенного тромбінового потенціалу (тест генерації тромбіну) Метод був описаний докладно в цілому ряді робіт (Hemker HC, Giesen PL, Ramjee M, Wagenvoord R, Beguin S. The thrombogram: monitoring thrombin generation in platelet-rich plasma. Thromb. Haemost, 2000; 83(4): 589-591; Hemker HC, AlDieri R, Beguin S. Thrombin generation assays: accruing clinical relevance. Curr. Opin. Hematol., 2004, 11(3):170-175; Hemker HC, Giesen P, AlDieri R, Regnault V, de Smed E, Wagenvoord R, Lecompte T, Beguin S. The calibrated automated thrombogram (CAT): a universal routine test for hyper- and hypocoagulability. Pathophysiol. Haemost. Thromb., 2002, 32(5-6):249-253). При проведенні цього тесту вимірюють кінетику і сумарну кількість активного тромбіну, що утворився в зразку плазми за певний час, при стандартній величині активації згортання в пробі. У нашому варіанті методу вимір концентрації тромбіну здійснюється за допомогою повільного флюорогенного субстрату (BOCIle-Gly-Arg-AMC), при розщепленні якого тромбіном утворюється продукт 7-аміно-4метилкумарин (АМС), який сильно флюоресцює. Використання саме флюорогенного, а не хромогенного субстрату викликане тим, що на величину флюоресценції в зразку практично не впливає утворення у вимірювальному осередку твердого фібринового згустку, у той час, як для хромогенного субстрату це є умовою, що обмежує його застосування (Hemker HC, Giesen P, AlDieri R, Regnault V, de Smed E, Wagenvoord R, Lecompte T, Beguin S. The calibrated automated thrombogram (CAT): a universal routine test for hyper- and hypocoagulability. Pathophysiol. Haemost. Thromb., 2002, 32(5-6):249-253). З іншого боку, відомо, що основна частина тромбіну в зразку (близько 95 %) напрацьовується після того, як перший згусток уже утворився (Hemker HC, AlDieri R, Beguin S. Thrombin generation assays: accruing clinical relevance. Curr. Opin. Hematol., 2004, 11(3):170-175). Кінетика виникнення і наступного зникнення тромбіну в плазмі після активації згортання представлена на Фіг.1. Тут показана залежність концентрації активного тромбіну в зразку плазми від часу. Ендогенним тромбіновим потенціалом (ЕТП) називають площу під кривою генерації тромбіну (у нашому випадку від 0 до 50 хвилин інкубації). Характеристиками кривої є також такі параметри, як tmax - час досягнення максимальної концентрації тромбіну в пробі, Аmах максимальна концентрація тромбіну в системі й tлаг - час до початку згортання, за який умовно приймають час досягнення тромбіном концентрації 5 нМ. Очевидно, що важливу інформацію про згортання несе не тільки інтегральна величина ЕТП, але й сам вид кривої залежності концентрації тромбіну від часу. Так в умовах зниженої концентрації факторів і інгібіторів згортання максимуми концентрації тромбіну можуть стати більш низькими, але широкими, хоча сумарний ЕТП може не змінитися. Присутність у плазмі додаткових інгібіторів тромбіну повинна знижувати величину ЕТП і максимальної досяжної 16 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентрації тромбіну, а також збільшувати лаг-період згортання і час досягнення максимальної концентрації тромбіну. Вимір проводили в такий спосіб. У лунки 96-ямкового планшету поміщали по 90 мкл нормальної донорської плазми (РРР), від 0 до 20 мкл розчину випробуваної речовини і від 20 до 0 мкл розчину буферу (20 мМ HEPES, 140 мМ NaCl, pH 7.5), таким чином, щоб сумарний обсяг доданої речовини і буферу становив завжди 20 мкл. Після цього в кожну лунку планшета додавали 20 мкл розчину флюорогенного субстрату (вихідна концентрація 5 мМ) і протягом 3-5 хвилин прогрівали плазму при 37 °C. Після цього в усі лунки одночасно (багатоканальною піпеткою) вносили по 25 мкл розчину активатору згортання. Активатором служив розчин тромбопластину, приготовлений із стандартного реагента тромбопластину для виміру протромбінового часу (ПЧ) (РЕНАМ, Росія), розведений в 250 разів тим же буфером, що містить додатково 80 мМ СаСl2. Момент внесення активатора був початком відліку. Запис кінетики нагромадження продукту реакції (АМС), який флюоресцює, проводили протягом 60 хвилин. Швидкість нагромадження продукту в кожний момент часу пропорційна концентрації тромбіну присутнього в плазмі в цей момент. Таким чином, продиференціював криву нагромадження АМС, можна одержати залежність концентрації тромбіну в системі від часу і потім визначити параметри, що характеризують цю криву. Умовні одиниці флюоресценції для кожного зразка були переведені в абсолютні концентрації АМС за допомогою калібрування сигналу за величинами сигналів відомих концентрацій АМС у даних зразках плазми. Лінійність методу в широкому діапазоні концентрацій АМС була перевірена попередньо. Вимір швидкості росту згустку в просторі. Швидкість росту згустку в просторі характеризує динаміку згортання, що є процесом, що розвивається не тільки в часі, але й у просторі. У даному методі за допомогою виміру світлорозсіювання визначається розмір згустку в різні моменти часу після початку згортання. Активація згортання проводиться в системі без перемішування строго локалізованим у просторі активатором, у якості якого використовували або просто скляну пластинку із шліфованим краєм для контактної активації згортання по внутрішньому шляху, або поліетилентерфталатні плівки, покриті фібробластами, що несуть на поверхні тканинний фактор, що активує згортання по зовнішньому шляху. У випадку активації згортання по зовнішньому шляху у вихідну плазму додавали інгібітор трипсіну з кукурудзи (СТІ) у концентрації 200 мкг/мл, що запобігав контактній активації згортання в системі. Вимір проводили в плазмі вільної від тромбоцитів (PFP), що одержували шляхом додаткового центрифугування РРР протягом 10 хвилин при 10000g. Мікрокамеру збирали в 35 мм полістироловій чашці Петрі. При активації згортання по зовнішньому шляху торець скляної пластинки товщиною 1 мм обертали поліетилентетфталатною плівкою, на якій були вирощені фібробласти. Після цього пластинку із плівкою фіксували на дні чашки 2-х стороннім скотчем. Торець скла являв собою бічний край мікрокамери, покритий активатором. На верхню площину скла в такий же спосіб прикріплювали виступаючу за край скла зафарбовану із зовнішньої сторони чорним полістиролову пластинку, що формувала верхню поверхню мікрокамери. Рекальцифіковану плазму вільну від тромбоцитів (фінальна концентрація доданого СаСl2 20 м) з добавкою або без передбачуваного інгібітора тромбіну акуратно заливали між верхньою пластинкою і дном камери таким чином, щоб вона прийшла в зіткнення з бічною стінкою, що активує згортання. Момент зіткнення плазми з активатором приймали за t=0. Потім чашку герметично закривали і поміщали в кювету, яка термостатувалася при 37 °С із прозорим дном, через яке плазма в чашці висвітлювалася світлом червоних діодів ( =660нм). Зображення постійної області мікрокамери (7.2×5.4 мм) кожні 30 сек фіксувалося відеокамерою OS-75D (Mintron Enterprise, Тайвань), сполученою із платою захоплення зображень EZ98 (Lifeview Inc., USA), що дозволяє оцифровку і введення в пам'ять комп'ютера зображень із відеокамери. При обробці серії записаних зображень були отримані профілі світлорозсіювання, що відповідають різному часу від початку експерименту. У процесі росту згусток усе далі поширювався від поверхні активатора вглиб плазми. Розмір згустку в кожному кадрі був визначений як відстань від активатора до краю згустку, за який приймали крапку, де величина світлорозсіювання становила половину максимальної. Швидкість росту згустку була потім визначена як тангенс кута нахилу прямої залежності розміру згустку від часу. Докладніше метод описаний у роботах: Ovanesov MV, Krasotkina JV, Ul'yanova LI, Abushinova KV, Plyushch OP, Domogatskii SP, Vorob'ev AI, Ataullakhanov FI. Hemophilia A and В are associated with abnormal spatial dynamics of clot growth. Biochim. Biophys. Acta, 2002, 1572(1):45-57; Ovanesov MV, Lopatina EG, Saenko EL, Ananyeva NM, Ul'yanova LI, Plyushch OP, Butilin AA, Ataullakhanov FI. Effect of factor VIII on tissue factor-initiated spatial clot growth. Thromb. Haemost, 2003, 89(2):235242. 17 UA 98969 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг.2 представлений ряд послідовних вихідних фотографій згустку, що росте в нормальній плазмі (смуга ліворуч - скляний активатор, фібрин - світлі області). На першому кадрі обрана смуга, перпендикулярна активатору, уздовж якої обчислювалися профілі світлорозсіювання. Профілі світлорозсіювання зростаючого згустку в різні моменти часу після початку згортання можна бачити на Фіг.3. Остання стадія обробки результатів являє собою розрахунок швидкості росту згустку на підставі отриманих профілів світлорозсіювання. Розмір згустку в кожний момент часу оцінювали як відстань відповідного профілю світлорозсіювання від активатора (на половині максимальної висоти профілю). На Фіг.4 представлена отримана залежність розміру згустку від часу. Швидкість квазістаціонарного росту згустку обчислювалася за нахилом лінійної ділянки цієї кривої. Проведені випробування показали, що нові синтезовані з'єднання, що заявляються у даній роботі, мають антикоагулянті властивості, тобто сповільнюють згортання плазми. Розглянемо, як приклади, зміни ряду параметрів, вимірюваних у тесті генерації тромбіну, у присутності різних концентрацій сполуки HC-020s-IOC у плазмі (див. Таблицю 3). Фіг.5 представляє криві нагромадження продукту, який флуоресціює, реакції розщеплення флюорогенного субстрату тромбіном, що утворюється в ході згортання плазми, безпосередньо записані приладом (умовні одиниці флюоресценції перераховані в абсолютні концентрації АМС за допомогою спеціально обмірюваних калібрувань). На Фіг.6 наведені кінетичні профілі зміни концентрації тромбіну в ході експерименту, отримані диференціюванням кривих, представлених на Фіг.5. Зменшення тромбінового потенціалу і подовження часу досягнення максимуму на кривій генерації тромбіну при зростанні концентрації інгібітора в системі, наведені на Фіг.7 і Фіг.8, відповідно. Представлені результати показують, що при підвищенні концентрації досліджуваної сполуки (HC-020s-IOC) згортання плазми сильно уповільнюється. Концентрація цієї сполуки, що викликає 50 %-не зменшення ендогенного тромбінового потенціалу (ІС50) становила 0.9 мкМ. Таким чином, дана сполука є сильним антикоагулянтом. Наступні три фігури демонструють зміну просторової динаміки росту згустку в присутності сполуки HC-025s-IOC. На Фіг.9 і Фіг.10 можна бачити профілі світлорозсіювання, що реєструються в ході згортання у вихідній нормальній плазмі, а також у тій же плазмі в присутності 1 мкм даної сполуки, відповідно. Фіг.11 представляє залежності збільшення розміру згустку (вираженого як відстань від активатора, на яку поширився згусток) від часу для контрольної плазми і плазми в присутності 1 мкм сполуки HC-025s-IOC. Порівняння отриманих кривих також показує, що присутність сполуки HC-025s-IOC у плазмі інгібує згортання. Приклади антикоагулянтної дії ряду заново синтезованих сполук представлені в Таблиці 3. Приклад 7 Посилення згортання при розведенні нормальної донорської плазми кристалоїдним плазмозаміщуючим розчином (NaCl 0.9 %) і його корекція при введенні в розчин, що заміщає, різних концентрацій сполуки HC-025S-IOC, що інгібуює активність тромбіну Кров донора, взята на 3.8 %-ному цитраті натрію в співвідношенні кров:цитрат=9:1, (20мл) була центрифугована 15 хв при 1300g. Частина отриманої в такий спосіб бідної тромбоцитами плазми (РРР) була далі центрифугована 10 хв при 10000 g для одержання вільної від тромбоцитів плазми (PFP). Отримана PFP була використана для визначення ендогенного тромбінового потенціалу. PFP була розведена в 1.5, 2, 3 і 4 рази або фізіологічним розчином для переливань (NaCl 0.9 %), або тим же розчином, але утримуючим доданий інгібітор тромбіну HC-025s-IOС (у +2 концентраціях 0.25, 0.5 або 1 мкМ). Для того, щоб підтримувати постійну концентрацію іонів Са у тестах після рекальцифікації, концентрація цитрату натрію у всіх розведеннях плазм була витримана постійною, відповідною цій концентрації у вихідній нерозбавленій плазмі, для чого вихідні плазмозаміщуючі розчини, якими розбавляли плазму, були спочатку змішані з 3.8 %-ним цитратом натрію аналогічно вихідної крові в співвідношенні розчин:цитрат=9:1. В описаному вище методі виміру ЕТП зразок плазми в ході виміру завжди розбавляється в 1.5 рази. Однак, у досвідах по розведенню плазм ПЗР необхідно мати можливість виміряти ЕТП у нерозбавленій плазмі. Тому для виміру ЕТП у даних експериментах була розроблена спеціальна методика, що дозволяє практично не розбавляти зразок плазми в ході виміру. Для проведення виміру в осередки 96-ямкового планшету поміщали по 200 мкл зразків плазми (нерозбавленої або розведеної в бажану кількість разів ПЗР). Потім у кожний осередок було додано по 2 мкл розчину флюорогенного субстрату в ДМСО (вихідної концентрації 30.75 мМ). Згортання запускали, додаючи в кожний осередок по 3 мкл активатори. Активатором служив розчин, приготовлений зі стандартного розчину тромбопластину для виміру протромбінового 18 UA 98969 C2 5 10 15 часу (фірма Ренам, Росія), розведений в 20 разів буфером, що містить 20 мМ HEPES, 140 мМ NaCl і 1.235 М СаСl2, рН 7.5. Далі вимір проводили описаним раніше способом. Ендогенний тромбіновий потенціал був обмірюваний для кожного з розведень плазм у присутності різних концентрацій з'єднання HC-025s-IOC. На Фіг.12 представлені результати по виміру ЕТП у серіях розведень плазми розчином NaCl (0.9 %), що містить різні концентрації інгібітору. Видно, що у відсутності доданого інгібітора при збільшенні ступеня розведення плазми заміщаючим розчином спостерігається істотне збільшення ендогенного тромбінового потенціалу, що говорить про посилення згортання в даних умовах. Необхідно відзначити, що вже змінене ЕТП на 20 % вважається фактором ризику для виникнення тромбозу (Hemker HC, Al Dieri R, Beguin S. Thrombin generation assays: accruing clinical relevance. Curr. Opin. Hematol. 2004, 11(3): 170-175). В той же час, у наших експериментах при розведенні вихідної плазми в 1.5-4 рази максимальне збільшення ЕТП становить у різних плазмах від 1.5 до більш 4-х раз. Додавання інгібітору не скасовує повністю ефекту посилення згортання через розведення плазми, але значно корегує його, знижуючи величину ЕТП для різних розведень плазми. При цьому концентрації HC-025s-IOC у розчині рівні 0.25-0.5 мкм дають криві, для яких значення ЕТП при різних розведеннях плазми найбільш близькі до нормального. 19 UA 98969 C2 Таблиця 1 Параметри мас-спектру і розраховані значення скоринг-функції, для інгібіторів тромбіну, отриманих за методами, описаними у прикладах 1-4 20 UA 98969 C2 21 UA 98969 C2 22 UA 98969 C2 23 UA 98969 C2 24 UA 98969 C2 Таблиця 2 Параметри мас-спектру і розраховані значення скоринг-функції, для інгібіторів тромбіну, отриманих за методами, описаними у прикладах 1-4 25 UA 98969 C2 26 UA 98969 C2 Таблиця 3 Приклади антикоагулянтної дії і величин гострої токсичності (LD 50) для ряду заново синтезованих сполук 27 UA 98969 C2 ФОРМУЛА ВИНАХОДУ 5 1. Сполука, що має структуру формули (І): А-В-С, (І) або її фармацевтично прийнятна сіль або сольват, де 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnticoagulant compounds, pharmaceutical composition based thereon to treat thrombotic conditions, and plasma-substituting solution to correct hypercoagulation defects of hemodilution
Автори англійськоюSinauridze, Elena Ivanovna, Ataullakhanov, Fazoil Inoyatovich, Butylin, Andrey Alexandrovich, Sulimov, Vladimir Borisovich, Romanov, Alexey Nickolayevich, Bogolyubov, Alexey Alexeevich, Kuznetsov, Yury Vladimirovich, Gribkova, Irina Vladimirovna, Gorbatenko, Alexander Sergeevich, Kondakova, Olga Anatolievna
Назва патенту російськоюАнтикоагулянтные соединения, фармацевтическая композиция на их основе для лечения тромботических состояний и плазмозамещающий раствор для коррекции гиперкоагулянтных нарушений при гемодилюции
Автори російськоюСинауридзе Елена Ивановна, Атауллакханов Фазоил Иноятович, Бутилин Андрей Александрович, Сулимов Владимир Борисович, Романов Алексей Николаевич, Боголюбов Алексей Алексеевич, Кузнецов Юрий Владимирович, Грибкова Ирина Владимировна, Горбатенко Александр Сергеевич, Кондакова Ольга Анатолиевна
МПК / Мітки
МПК: C07D 401/06, C07D 277/40, C07D 213/73, A61P 7/02, A61K 31/4425
Мітки: гемодилюції, сполуки, композиція, плазмозаміщуючий, лікування, тромботичних, основі, станів, антикоагулянтні, фармацевтична, розчин, гіперкоагуляційних, порушень, корекції
Код посилання
<a href="https://ua.patents.su/38-98969-antikoagulyantni-spoluki-farmacevtichna-kompoziciya-na-kh-osnovi-dlya-likuvannya-trombotichnikh-staniv-i-plazmozamishhuyuchijj-rozchin-dlya-korekci-giperkoagulyacijjnikh-porushen-p.html" target="_blank" rel="follow" title="База патентів України">Антикоагулянтні сполуки, фармацевтична композиція на їх основі для лікування тромботичних станів і плазмозаміщуючий розчин для корекції гіперкоагуляційних порушень при гемодилюції</a>