Сполуки з функцією інгібування тромбіну та фармацевтичні композиції на їх основі
Номер патенту: 98970
Опубліковано: 10.07.2012
Автори: Романов Алєксєй Ніколаєвіч, Кондакова Ольга Анатолієвна, Грібкова Іріна Владіміровна, Атауллакханов Фазоіл Іноятовіч, Горбатєнко Алєксандр Сєргєєвіч, Бутилін Андрєй Алєксандровіч, Боголюбов Алєксєй Алєксєєвіч, Сулімов Владімір Борісовіч, Сінаурідзе Єлєна Івановна, Кузнєцов Юрій Владіміровіч
Формула / Реферат
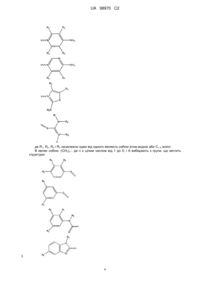
1. Сполука, що має структуру формули (І):
А-В-С, (І)
або її фармацевтично прийнятна сіль або сольват, де С вибрано з групи, що складаються з наступних структур:
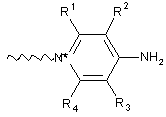 ,
,
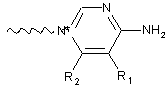 ,
,
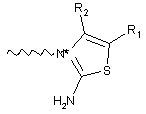 ,
,
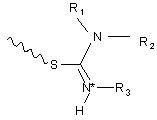 ;
;
R1, R2, R3 і R4 незалежно вибрано із групи, що містить водень, С1-6алкіл;
В являє собою -(СН2)n-, де n є цілим числом в межах від 1 до 5;
А вибрано з групи:
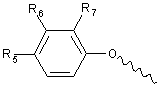 ,
,
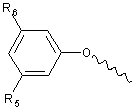 ,
,
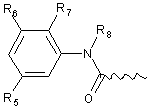 ,
,
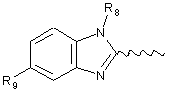 ;
;
R5 вибрано з групи, що містить водень, С1-6алкокси, CH2NR10R11, CH(CH3)NR10R11,
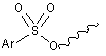 ,
, 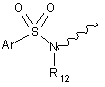 ,
, 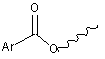 ,
, 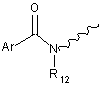 ;
;
і R6 і R7 кожний незалежно вибрано з групи, що містить водень, С1-6алкіл, С1-6алкокси і галоген;
R8 являє собою водень або С1-6алкіл;
R9 вибрано з груп:
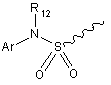 і
і 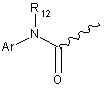 ;
;
R10, R12 кожний незалежно вибрано з групи, що містить водень, С1-6алкіл, (CH2)mCOOR13, (CH2)mCON(R13)2,
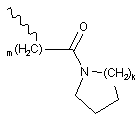 ,
,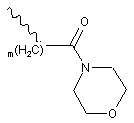 і
і 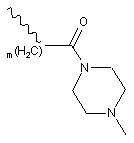 ;
;
m є цілим числом в межах від 1 до 4;
k є цілим числом в межах від 1 до 3;
R13 являє собою водень або С1-6алкіл;
R11 являє собою С1-6алкіл або Аr;
Аr вибрано із групи, що містить феніл, піридил, оксазоліл, тіазоліл, тієніл, фураніл, піримідиніл, піридазиніл, піразиніл, індоліл, бензофураніл, бензотіофеніл, вибірково заміщені від одного до п'яти замісників, вибраних з групи, що містить водень, С1-6алкіл, С1-6алкокси, галоген, N(R13)2, OH, NO2, CN, COOR13, CON(R13)2 і SO2R13;
за умови, якщо А являє собою  або
або  ,
,
то R5 і R6 кожний не є воднем, а також, за умови, що сполука формули (І) не вибрана з групи, що складається з
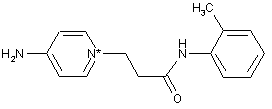 ,
,
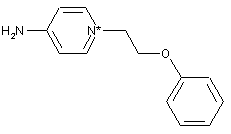 .
.
2. Сполука за п. 1, вибрана з групи сполук, що мають наступні формули
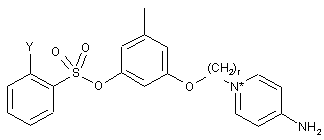 ,
,
 і
і
 ;
;
або її фармацевтично прийнятна сіль або сольват, де Υ вибрано з групи, що містить водень, галоген, COOR13, CON(R13)2, SO2R13, а r є цілим числом в межах від 2 до 5.
3. Сполука за п. 1 або її фармацевтично прийнятна сіль або сольват, які здатні інгібувати тромбін.
4. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі або сольвату як інгібіторів тромбіну.
5. Фармацевтична композиція для лікування і запобігання тромбінзалежним тромбоемболічним реакціям, що містить терапевтично ефективну кількість сполуки за п. 1 або її фармацевтично прийнятної солі або сольвату та фармацевтично прийнятний носій.
Текст
Реферат: Даний винахід стосується нових хімічних сполук, застосування цих сполук як інгібіторів тромбіну, а також фармацевтичних композицій на їх основі, і може використовуватись для лікування і профілактики тромбінзалежних тромбоемболічних реакцій, а також для дослідницьких цілей. UA 98970 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується нових хімічних сполук, застосування цих сполук як інгібіторів тромбіну, а також фармацевтичних композицій на їх основі, і може використовуватись для лікування і профілактики тромбін-залежних тромбоемболічних реакцій, а також для дослідницьких цілей. Тромбін являє собою основний фермент системи згортання крові, що перетворює розчинний білок плазми крові фібриноген у нерозчинний фібриновий згусток. Існує слабка рівновага між процесом утворення тромбіну, який спричиняє полімеризацію фібрину, і процесом інгібування тромбіну, тобто процесом, що пригнічує активність фібрину. Надмірне утворення тромбіну призводить до тромбозів. Прямі інгібітори тромбіну це назва інгібіторів, які утворюють міцний зв'язок безпосередньо з активним центром ферменту та ізолюють від активного центру натуральний субстрат фібриноген. Це призводить до призупинення тромбін-каталізованого процесу утворення фібрину з фібриногену і, як наслідок, перешкоджає утворенню фібринового згустку і сповільнює згортання крові або повністю запобігає йому. Для виявлення сильної антитромбінової активності прямі інгібітори тромбіну повинні максимально міцно зв'язуватись з активним центром тромбіну. Для цього вони повинні відповідати кільком вимогам, обумовленим структурою активного центру молекули тромбіну. Активний центр тромбіну, як правило, поділяється на декілька порожнин, або карманів, для розміщення окремих амінокислот його субстрату фібриногену поблизу місця, де здійснюється амідолітична реакція. Карман S1 являє собою глибоку і вузьку порожнину, стінки якої утворені гідрофобними амінокислотними залишками, і практично на дні цієї порожнини існує джерело негативного заряду, зумовлене наявністю карбоксигрупи амінокислоти Asp 189. Карман S1 призначений для зв'язування залишків основних амінокислот (лізину або аргініну) фібриногену безпосередньо в місці розриву пептидного зв'язку (з боку С-кінця лізину або аргініну). Довгий нерозгалужений вуглеводневий залишок основної амінокислоти розташований по всій довжині карману S1, в той час як позитивно заряджений основний фрагмент на кінці вуглеводневого залишку утворює сольовий місток з негативно зарядженим аспартовим залишком на дні карману S1. Таким чином, карман S1 найкраще пристосований для ідентифікації залишків основних амінокислот у поліпептидному ланцюгу фібриногену. Безпосередньо до карману S1 прилягає ще один карман S2, утворений неполярними амінокислотними залишками, і слугує для ідентифікації малих гідрофобних амінокислот (валін, ізолейцин, лейцин) в амінокислотній послідовності фібриногену за основною амінокислотою, розташованою у кармані S1 (з боку N-кінця основної амінокислоти). Карман S2 має трохи менший об'єм ніж карман S1 і він не містить будь-яких заряджених амінокислотних груп. Тому карман S2 ідеально пристосований для зв'язування незначних вуглеводневих залишків неполярних аліфатичних амінокислот. Поряд із карманом S2 на поверхні тромбіну знаходиться карман S3. Це також гідрофобний карман, але він має значний об'єм і не є чітко вираженим, оскільки значна його частина є відкритою і підданою дії розчинника. Карман S3 слугує для розміщення великих аліфатичних та ароматичних гідрофобних амінокислотних залишків фібриногену, що віддалені на дві або три ланки від місця розриву пептидного ланцюга. Прямий інгібітор тромбіну повинен оптимальним чином заповнювати ці три кармани активного центру молекули тромбіну. Наприклад, відомий трипептидний інгібітор D-Phe-Pro-Arg за даними рентгеноструктурного аналізу взаємодіє з активним центром тромбіну таким чином: аргініновий залишок заповнює карман S1, проліновий залишок заповнює карман S2, а Dфенілаланін розміщується в кармані S3. Засоби, які застосовуються в сучасній клінічній практиці для боротьби з тромбозами, не завжди є придатними для інгібування надлишкового тромбіну, який вже утворився у крові. Лікарі сьогодні найбільш широко використовують непрямі інгібітори тромбіну, а саме нефракціонований гепарин і низькомолекулярні гепарини, а також препарати-антагоністи вітаміну К (варфарину). Всі ці препарати не можуть самостійно інгібувати надлишковий тромбін, що накопичується в системі. Різні гепарини лише прискорюють інгібуючу дію наявного в плазмі природного інгібітору тромбіну - антитромбіну III (АТIII), тому, якщо вміст АТIII у плазмі пацієнта є дуже низьким з будь-яких причин, гепарини мають лише слабку антикоагулянтну дію. Антагоністи вітаміну К знижують швидкість згортання за рахунок пригнічення у печінці синтезів попередників факторів згортання крові. Очевидно, що це досить повільний шлях, який не може допомогти під час серйозних ситуацій, які вимагають швидкого пригнічення тромбіну, наявного у плазмі. Обмеження при терапії непрямими коагулянтами призвели до того, що фармацевтичні компанії намагаються розробити ефективний і селективний прямий інгібітор тромбіну. Сьогодні 1 UA 98970 C2 5 10 15 20 25 30 35 40 45 50 55 60 синтезовано достатню кількість таких інгібіторів тромбіну. Проте більшість цих сполук не має всіх необхідних для лікарського препарату властивостей. Проводяться дослідження щодо покращення їх фармакокінетичних властивостей, таких як тривалість дії, низька токсичність, розчинність у воді, біодоступність при пероральному введенні препарату тощо. Ідеальний інгібітор тромбіну також має бути ефективним проти зв'язаного у згустку тромбіну. Він має бути селективним для тромбіну без інгібування протеаз, залучених до фібринолізу, тривалий час залишатися в крові, протистояти дії ферментів і цитохрому Р450 у печінці, має зберігатися у водному середовищі, бути стійким до зв'язування (або слабко зв'язуватись) з білками крові, і бути нетоксичним. Попереднє тестування сполуки, проте, не є достатнім для того, щоб зробити висновки про її відповідність цим вимогам. Незважаючи на те, що вже синтезовано значну кількість ефективних низькомолекулярних інгібіторів тромбіну, сьогодні використовується лише один - синтезований в Японії аргатробан (патент США № 5,214,052, 1993р.), який пройшов всі необхідні клінічні випробування. Проте цей інгібітор не є ідеальним також, оскільки має низьку стійкість у розчинах (його Т 1/2 у плазмі складає 36 хвилин). Це означає, що потреба у пошуку нових ефективних і безпечних синтетичних інгібіторів тромбіну залишається актуальною. Велика кількість інгібіторів тромбіну описана в опублікованих патентах та результатах наукових досліджень. Короткий огляд цих публікацій наводиться нижче. У патентній заявці США № 2006/0014699 (Astra Zeneca AB), 2006p., і патенті США № 5,795,896 (Astra Aktiebolag), 1998р., описані антитромботичні фармацевтичні сполуки, що містять інгібітор мелагатран. Також з рівня техніки відомі піролідинові інгібітори тромбіну, описані у патенті США № 5,510,369 (Merck & Со), 1996р., і піридинові інгібітори тромбіну, такі наприклад, що описані у патенті США № 5,792,779 (Merck & Со), 1998р.. Заявник проаналізував велику кількість наукових доповідей і статей, що містять інформацію про структури відомих інгібіторів, а також про механізм взаємодії інгібіторів з молекулою тромбіну. Проаналізовані публікації, наведені у таблиці 1, охоплюють практично всі класи хімічних сполук, відомих як інгібітори тромбіну. Перелік публікацій, наведених у таблиці 1 є достатньо повним, але не вичерпним. Під час розробки власних інгібіторів ми свідомо уникали структур, описаних в цих публікаціях. Наведені публікації не містять інформації про інгібітори тромбіну, що містять елементи, якими характеризуються нові сполуки, що заявляються. Завданням даного винаходу є розробка нових сполук, які могли б бути прямими інгібіторами тромбіну. Ці інгібітори можуть бути використані для лікування гострих тромботичних станів, що виникають в організмі в результаті різних патологій. Значна кількість різних патологічних станів організму пов'язана з розладами гемостатичної системи. Тромбоемболічні ускладнення, що виникають в результаті таких хвороб як інфаркт міокарду, інсульт, тромбоз глибоких вен або легеневої артерії, є однією з основних причин смерті в усьому світі. Саме тому протягом багатьох років триває інтенсивний пошук препаратів, які могли б слугувати як ефективні та безпечні ліки. В першу чергу, це антитромботичні агенти, що мають антикоагулянтні властивості. Якщо не зазначено інше, то в даному описі використовуються такі визначення: Активний центр це область у макромолекулі білка, яка відіграє ключову роль у біохімічних реакціях. Протеїн або білок означає макромолекулу білка. Білок-мішень означає макромолекулу білка, залучену до процесу зв'язування. Ліганди означають колекцію низькомолекулярних хімічних структур. Процес зв'язування означає утворення ван-дер-ваальсового або ковалентного комплексу ліганду і активного центру білка-мішені. Скринінг означає ідентифікацію набору сполук з колекції хімічних структур, які вибірково взаємодіють з певною ділянкою макромолекули білка. Правильне позиціонування означає позиціонування, коли ліганд знаходиться у положенні, що відповідає мінімуму вільної енергії комплексу ліганду з білком. Вибірний ліганд означає ліганд, що специфічно зв'язується з конкретним білком-мішенню. Валідація означає систему розрахунків і методику порівнянь для оцінки якості роботи системи та її ефективності щодо відбору з довільного набору лігандів тих, що надійно зв'язуються із заданим білком-мішенню. Стандартизований білок означає білок, що використовується для коригування параметрів модельного розрахунку (бальної оцінки) відповідно до експериментальних даних, або під час валідації роботи системи, або для оцінки специфічності зв'язування даного інгібітору. Ліганд, що специфічно зв'язується, означає ліганд, що зв'язується лише з даним білком, але не зв'язується з іншими білками. 2 UA 98970 C2 5 10 15 20 25 30 35 40 Інгібітор означає ліганд, що зв'язаний з активним центром конкретного білка-мішені і блокує нормальний хід біохімічних реакцій. Докінг означає позиціонування ліганду в активному центрі білка. Скоринг означає розрахунок для оцінки вільної енергії, необхідної для зв'язування ліганду з білком. AG зв 'язування означає результат розрахунку приросту вільної енергії, необхідної для зв'язування ліганду з білком-мішенню (за допомогою програми SOL). С1-6ілкіл означає алкільну групу, що містить нерозгалужений або розгалужений вуглеводневий ланцюг, який містить від 1 до 6 атомів вуглецю, наприклад, метил, етил, nпропіл, ізопропіл, n-бутил, ізобутил, трет-бутил, тощо. С1-6алкокси означає алкоксильну групу, що містить нерозгалужений або розгалужений вуглеводневий ланцюг, який містить від 1 до 6 атомів вуглецю, наприклад, метокси, етокси, nпропокси, ізопропокси, тощо. Галоген означає хлор, бром, йод або фтор. Фармацевтично прийнятна сіль означає будь-яку сіль, утворену активною сполукою формули (І), якщо вона не є токсичною і не інгібує абсорбцію та фармакологічну дію активної сполуки. Така сіль може бути утворена реакцією між сполукою формули (І) і органічною або неорганічною основою, такою як гідроксид натрію, гідроксид калію, гідроксид амонію, метиламін, етиламін тощо. Сольват означає кристалічну форму активної сполуки формули (І), кристалічна решітка якої містить молекули води або іншого розчинника, з якого було кристалізовано активну сполуку формули (І). Фармацевтично прийнятний носій означає носій, який має бути сумісним з іншими інгредієнтами композиції і нешкідливим для реципієнта, тобто бути нетоксичним для клітин або ссавців у дозах і концентраціях, в яких його використовують. Часто, фармацевтично прийнятним носієм є водний pH буферний розчин. Приклади фізіологічно прийнятних носіїв включають буферні розчини, такі як розчини на основі фосфатів, цитратів або інших солей органічних кислот; антиоксиданти, що містять аскорбінову кислоту, поліпептиди низької молекулярної ваги (менше ніж 10 залишків); протеїни, такі як сиворотковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, такі як полівінілпіролідон; амінокислоти, такі як гліцин, глютамін, аспарагін, аргінін або лізин; моносахариди, дисахариди, а також інші вуглеводи, включаючи глюкозу, манозу або декстрини; хелатоутворюючі агенти, такі як етилендіамінтетраацетат (EDTA); а також цукрові спирти, такі як манітол або сорбітол. Терапевтично ефективна кількість означає кількість, необхідну для того, щоб досягти бажаного ступеню інгібування тромбіну в організмі ссавця. Ссавець, у тому розумінні, в якому застосовується в даному описі, включає приматів (наприклад, людей, людиноподібних мавп, нелюдиноподібних мавп, а також нижчих мавп), хижаків (наприклад, котів, собак і ведмедів), гризунів (наприклад, мишей, щурів і білок), комахоїдних (наприклад, землерийок і кротів) тощо. Практичне завдання, поставлене заявником, вирішується шляхом розробки сполуки загальної структурної формули (І), включаючи її фармацевтично прийнятні солі або сольвати: А-В-С (І) де С вибирають з групи, що містить такі структури: 3 UA 98970 C2 де R1, R2, R3 і R4 незалежно один від одного являють собою атом водню або С 1-6 алкіл; В являє собою -(СН2)n-, де n є цілим числом від 1 до 5; і А вибирають з групи, що містить структури: 5 4 UA 98970 C2 де R5 вибирають з групи, що містить водень, С1-6-алкокси, CH2NR10R11, і CH(CH3)R10R11, 5 де R6 і R7 незалежно являють собою водень, С1-6алкіл; С1-6алкокси; галоген; R8 являє собою водень або С1-6алкіл; R9 вибирають з нижченаведеної групи, що містить; R10, R12 незалежно один від одного вибирають з групи, що містить водень, С 1-6алкіл; (CH2)mCOOR13, (CH2)mCON(R13)2, 10 15 20 25 де m є цілим числом від 1 до 4, R13 являє собою водень або С1-6алкіл, R11 являє собою С1-6алкіл або Аr; Аr являє собою феніл, піридил, оксазоліл, тіазоліл, тієніл, фураніл, піримідиніл, піридазиніл, піразиніл, індоліл, бензофураніл, бензотіофеніл, що мають від одного до п'яти замісників, вибраних з групи: водень, С1-6алкіл, С1-6алкокси, галоген, N(R13)2, OH, NO2, CN, COOR13, CON(R13)2, SO2R13; за винятком: Сполуки, виключені з цього переліку вже відомі, зокрема, 4-аміно-1-[3-[(2-метилфеніл)аміно]3-оксопропіл]піридиній хлорид описано в журналі Journal of Medicinal Chemistry, 17(7), 739-744, 1974, у статті "Carbocyclic Derivatives Related to Indoramin" (Карбоциклічні похідні, що належать до індораміну). 4-аміно-1-(2-феноксиетил)-піридиній бромід описано в журналі Journal of Organic Chemistry, 26, 2740-7, 1961, у статті "Application of Sodium Borohydride Reduction to Synthesis of Substituted Aminopiperidines, Aminopiperazines, Aminopyridines and Hydrazines" (Застосування відновлення боргідридом натрію для синтезу заміщених амінопіперазінів, амінопіридинів і гідразинів). Проте слід зазначити, що у наведених джерелах не згадується про можливість використання цих сполук як інгібіторів тромбіну. У кращому варіанті здійснення винаходу описані такі сполуки за пунктом 1, їх фармацевтично прийнятні солі або сольвати: 5 UA 98970 C2 а) b) 5 10 15 20 25 30 35 с) де Υ вибирають з групи, що містить водень, галоген, COOR13, CON(R13)2, і SO2R13; і r є цілим числом від 2 до 5. Заявник виявив, що сполука структурної формули А-В-С, її фармацевтично прийнятні солі або сольвати, здатні інгібувати тромбін. Тому, нові сполуки, їх фармацевтично прийнятні солі або сольвати можуть використовуватись на практиці як інгібітори тромбіну. Відбір сполук, що становлять інтерес з точки зору практичного застосування як інгібіторів тромбіну, тобто мають значну інгібуючу дію, здійснювали таким чином: Будували трьохмірну модель молекул з віртуальної бібліотеки, сфокусованої на структури, що описуються загальною структурою формулою (І). Потім здійснювали докінг отриманих структур до активного центру молекули тромбіну. За результатами докінгу молекулярних структур потенційних інгібіторів тромбіну відбирали кращі об'єкти, тобто ті молекули, які показали значення скоринг-функції (що визначали на стадії докінгу) не гірше ніж -5,0 ккал/моль. Для таких молекул відтворювали методи їх позиціонування, запропоновані процедурою докінгу. Якщо ці способи позиціонування задовольняли викладену вище гіпотезу стосовно зв'язування інгібіторів з активним центром тромбіну, такі молекули вважались «можливими хітами» і розглядались як перспективні об'єкти для синтезу та експериментального вимірювання інгібуючої активності. Остаточне рішення щодо ініціювання синтезу виносили, виходячи з оцінки його можливої складності. Інгібітор тромбіну за цим винаходом оптимально відповідає наведеній вище вимозі щодо ефективного реагування з активним центром тромбіну. Позитивно заряджена хімічна група С інгібітору формули (І) розташована на дні карману S1, утворюючи сольовий місток з амінокислотним залишком Asp 189. Хімічна група В займає місце карману S1, що залишилось, забезпечуючи оптимальну гідрофобну реакцію із стінками карману. Хімічна група А формули (І) розташована в кармані S2, наведені нижче R групи являють собою гідрофобні фрагменти, а зв'язувальні агенти, що зв'язують окремі частини молекули та піддані дії розчинника, розташовані в кармані S3. З точки зору зв'язування з активним центром тромбіну зв'язувальні агенти можуть бути представлені як гідрофільними, так і гідрофобними молекулярними групами, але для надання молекулі інгібітору позитивних фармакокінетичних властивостей бажано частково врівноважити в цілому гідрофобний характер молекули інгібітору шляхом вибору гідрофільних зв'язувальних агентів. Для цього можна модифікувати гідрофобні фрагменти, розташовані у кармані S3, гідрофільними залишками, розташованими в кармані з боку, 6 UA 98970 C2 5 10 15 20 25 30 35 40 45 50 55 підданого дії розчинника. Описані інгібітори тромбіну повністю задовольняють наведені вище вимоги. Цей факт підтверджується шляхом вибіркового позиціонування (докінгу) інгібіторів тромбіну за даним винаходом до активного центру тромбіну відповідно до методики, описаної нижче. Докінг здійснюється шляхом глобальної мінімізації загальної енергії молекули інгібітору. Загальна енергія інгібітору складається з внутрішньої енергії напруження інгібітору в конформації, що відповідає за зв'язування інгібітору з активним центром тромбіну, та енергії інгібітору в полі тромбіну. У свою чергу, поле тромбіну спричиняє електростатичну ван-дерваальсову взаємодію з молекулою інгібітору, а також ряд реакцій, ініційованих сольватацією і десольватацією окремих частин молекули тромбіну і ліганду. Ці реакції описані у багатьох публікаціях і відомі тим, хто працює в даній галузі. Глобальну мінімізацію повторюють декілька разів шляхом використання генетичного алгоритму. Програма мінімізації призводить до геометричного позиціонування тромбіну в активному центрі цього ферменту і отримання значення скоринг-функції, що є оцінкою вільної енергії утворення комплексу інгібіторів тромбіну, описаних в даній заявці, та молекули тромбіну. Для інгібіторів, описаних в даній заявці, значення скоринг-функції завжди менше -5 ккал/моль, що відповідає константам інгібування у макромолекулярному діапазоні і нижче. Надійність прогнозування за допомогою скоринг-функції може бути перевірена різними методами, відомими фахівцям в даній галузі. Зокрема, так званий коефіцієнт збагачення інгібітору тромбіну, що характеризує можливість вибору активних інгібіторів серед випадкових молекул на підставі скоринг-функції, складає 0,85, що свідчить про досить надійний прогноз. Геометричні положення інгібіторів, описані в цій заявці, отримані за допомогою згаданої вище процедури докінгу і відповідають оптимальним умовам зв'язування інгібіторів тромбіну з його активним центром, коли властива їм інгібуюча активність виявляється стосовно реакції амідолізу фібриногену, що каталізується тромбіном. Заявлені сполуки можуть бути отримані звичайними методами, відомими фахівцю в галузі органічної хімії. Значна кількість різноманітних патологічних станів організму пов'язана із розладами гемостатичної системи. Тромбоемболічні ускладнення, що виникають під час таких хвороб як інфаркт міокарду, інсульт, тромбоз глибоких вен або легеневої артерії, є однією з основних причин смерті в усьому світі. Даний винахід включає також фармацевтичну композицію для лікування і профілактики тромбін-залежних тромбоемболічних реакцій, яка містить ефективну кількість сполуки за пунктом 1 формули винаходу або її фармацевтично прийнятну сіль або сольват і фармацевтично прийнятний носій. Сполуки за цим винаходом можуть вводитись будь-яким придатним способом, який призводить до їх біонакопичення у крові. Цього можна досягти за допомогою методів парентерального введення, включаючи внутрішньовенні, внутрішньом'язові, інтрадермальні, підшкірні і внутрішньочеревні ін'єкції. Можуть також застосовуватись інші способи введення, такі як всмоктування через шлунково-кишковий тракт шляхом перорального застосування відповідних композицій. Пероральне введення є більш бажаним через легкість застосування. Як альтернатива, лікарський засіб може вводитись через вагінальні і ректальні м'язові тканини, крім того, сполуки за цим винаходом можуть вводитись через шкіру (наприклад, трансдермально) або вводитись шляхом інгаляції. Слід розуміти, що бажаний спосіб введення залежить від стану, віку і сприйнятливості пацієнта. Для перорального застосування фармацевтичні композиції можуть бути розфасовані, наприклад, у вигляді таблеток або капсул разом з фармацевтично прийнятними допоміжними речовинами, такими як зв'язувальні агенти (наприклад, пептизований кукурудзяний крохмаль, полівінілпіролідин або гідроксипропілметилцелюлоза). Наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза, гідрофосфат кальцію, стеарат магнію, тальк або оксид кремнію, картопляний крохмаль або крохмальний гліколят натрію); або змочувальні агенти (наприклад, лаурилсульфат натрію). Таблетки можуть бути покриті оболонкою. Рідкі пероральні композиції можуть бути отримані, наприклад, у формі розчинів, сиропів або суспензій. Такі рідкі композиції можуть бути отримані звичайними методами з використанням фармацевтично прийнятних допоміжних речовин, таких як суспендуючі агенти (наприклад, похідні целюлози); емульгатори (наприклад, лецитин), розчинники (очищені рослинні олії); а також консерванти (наприклад, метил або пропіл-н-гідроксибензоати або сорбінова кислота). Композиції можуть також містити відповідні буферні солі, ароматизатори, барвники і підсолоджувачі. Вміст активного інгредієнта в цих композиціях змінюється від 0,1 відсотка до 99.9 відсотків від маси композиції, бажано від 5 до 90 відсотків. 7 UA 98970 C2 5 10 15 20 25 30 35 40 Токсичність цих інгібіторів тромбіну визначали, використовуючи стандартні фармацевтичні методики на експериментальних тваринах для визначення LD50 (дози летальної для 50% популяції). Для кращих варіантів сполук за цим винаходом доза LD50 перевищувала 367 мг/кг, що є порівнянним з летальною дозою аргатробану, що пройшов клінічні випробування і має LD50 = 475 мк/кг. Щоб краще зрозуміти предмет даного винаходу, нижче наведено декілька прикладів, що ілюструють синтез нових сполук і речовини, що є напівпродуктами синтезу, а також методи, які використовувались для дослідження антитромбінової активності запропонованих нових сполук. Приклади мають ілюстративний характер, і суть даного винаходу жодним чином не обмежується наведеними прикладами. Приклад 1 Синтез проміжного продукту 3-(3-хлорпропокси)-5-метилфенолу Суміш 3,8 г (27 ммоль) орцин гідрату, 4,8 г 1-бром-3-хлорпропану і 4,0 г (29 ммоль) карбонату калію кип'ятили у 30 мл ацетонітрилу при перемішуванні протягом 36 годин. Реакційну суміш випарювали, розчиняли у 30 мл ефіру, промивали двічі по 15 мл насиченим розчином карбонату калію, водний шар видаляли, а шар ефіру екстрагували тричі по 15 мл 10% розчину гідроксиду натрію. Шар ефіру видаляли, і водний шар обережно підкислювали концентрованою НСl, а потім екстрагували 3 15 мл ефіру. Екстракти ефіру об'єднували, промивали невеликою кількістю насиченого розчину гідрокарбонату натрію і висушували безводним сульфатом натрію, розводили приблизно третиною (за об'ємом) гексану, фільтрували через шар силікагелю. Після випарювання отримували 1,7 г жовтої олії у вигляді суміші приблизно 70% орцину (Rf 0,10) і приблизно 30% 3-(2-хлорпропокси)-5-метилфенолу (Rf 0,26, вихід приблизно 1,2 г (22% на чисту речовину)). Подібний метод використовували для отримання 3-(2-хлоретокси)-5-метилфенолу (Rf 0,26, вихід приблизно 1,2 г (22% на чисту речовину)) з орцин гідрату і 1-бром-2-хлоретану, а 3-(4хлорбутокси)-5-метилфенол отримували з орцин гідрату і 1-бром-4-хлорбутану. Приклад 2 Синтез проміжного продукту 3-(3-хлорпропокси)-5-метилфенілового ефіру бензолсульфокислоти До розчину 1,6 г суміші з попереднього прикладу у 30 мл сухого тетрагідрофурану (THF) вводили 3 г (17 ммоль) бензолсульфохлориду і 2 г (20 ммоль) триетиленаміну. Суміш перемішували протягом 7 годин. Осад гідрохлориду триетиламонію фільтрували і випарювали. Отриману олію розчиняли у 20 мл ефіру і промивали декілька разів у 10 мл 10-12% водного розчину аміаку, щоб відокремити надлишок непрореагувавшого бензолсульфохлориду (контролювали за допомогою тонкошарової хроматографії (ТШХ)), а потім у 10 мл приблизно 20% соляної кислоти. Після висушування безводним сульфатом натрію і випарювання отримували 1,94 г жовтої олії, що містить приблизно рівні кількості 3-(3-хлорпропокси)-5метилфенілового ефіру бензолсульфокислоти (Rf 0,36) і дибензоїлсульфонового ефіру орцину (Rf 0,25) відповідно до ТШХ. Подібним чином з 3-(2-хлоретокси)-5-метилфенолу, 3-(3-хлорпропокси)-5-метилфенолу і 3(4-хлорбутокси)-5-метилфенолу і відповідних арилсульфохлоридів отримували: 8 UA 98970 C2 5 10 15 20 25 30 35 3-(3-хлорпропокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти (77% на чисту речовину). 3-(3-хлорпропокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти (88%). 3-(3-хлорпропокси)-5-метилфеніловий ефір 2-карбометокси бензолсульфокислоти (56%). 3-(2-хлоретокси)-5-метилфеніловий ефір бензолсульфокислоти (72%). 3-(2-хлоретокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти (35%). 3-(2-хлоретокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти (34%). 3-(2-хлоретокси)-5-метилфеніловий ефір 2-карбометокси бензолсульфокислоти (37%). 3-(4-хлорбутокси)-5-метилфеніловий ефір бензолсульфокислоти (45%). 3-(4-хлорбутокси)-5-метилфеніл ефір 2-хлор бензолсульфокислоти (27%). 3-(4-хлорбутокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти (32%). 3-(4-хлорбутокси)-5-метилфеніловий ефір 2-карбометокси бензолсульфокислоти (21%). Приклад 3 Синтез проміжного продукту 3-(3-йодопропокси)-5-метилфенілового ефіру 2-хлор бензолсульфокислоти До 2,6 г суміші, що містить 3-(3-хлорпропокси)-5-метилфеніловий ефір 2-хлор бензол сульфокислоти, отриманої подібно до описаного вище прикладу, у 30 мл сухого ацетону додавали 2 г (13 ммоль) прожареного йодиду натрію і кип'ятили протягом 48 годин. Потім реакційну суміш розводили 10 мл гексану і випарювали. Отримували 2,45 г світло жовтої олії, що містить 3-(2-йодоетокси)-5-метилфеніловий ефір бензолсульфокислоти (Rf 0,35) і відповідний дибензоїлсульфоновий ефір орцину (Rf 0,25). Подібним чином з відповідних хлоридів отримували: 3-(3-йодопропокси)-5-метилфеніловий ефір бензолсульфокислоти 3-(3-йодопропокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти 3-(3-йодопропокси)-5-метилфеніловий ефір 2-карбометокси бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніловий ефір бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніл ефір 2-хлор бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти 3-(2-йодоетокси)-5-метилфеніловий ефір 2-карбометокси бензолсульфокислоти 3-(4-йодобутокси)-5-метилфеніловий ефір бензолсульфокислоти 3-(4-йодобутокси)-5-метилфеніловий ефір 2-хлор бензолсульфокислоти 3-(4-йодобутокси)-5-метилфеніловий ефір 2-фтор бензолсульфокислоти 3-(4-йодобутокси)-5-метилфеніловий ефір 2-карбометокси бензол сульфокислоти. Приклад 4 Синтез 4-аміно-1-(3-(3-метил-5-(2-хлорбензолсульфонілокси)фенокси)пропіл)-піридиній йодиду (HC_023s_IOC) 9 UA 98970 C2 5 10 15 20 25 30 Суміш 0,55 г "сирого йодиду" (з попереднього прикладу) (у розрахунку на 70% вміст активної речовини) і 0,08 г (0,85 ммоль) 4-амінопіридину у 10 мл сухого діоксану кип'ятили протягом 20 годин. Після охолодження суміші, розчин випарювали і отриману олію розтирали з кількома порціями ефіру до затвердіння. Твердий осад фільтрували і двічі перекристалізовували з суміші діоксан-ацетонітрил (5:1), осад солі фільтрували, промивали ефіром. 1 Після сушіння у вакуумі отримували 0,35 г (65%) білої солі. ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.21 с, 3Н; 3.91 т, 2Н, J=5.49; 2.18 м, 2Н, J=6.10; 4.26 т, 2Н, J=6.71; 6.40 с, 1H, 6.50 с, 1Н, 6.68 с, 1H; 7.59 т, 1Н, J=7.94, 7.83 τ, 1Н, J=7.94, 7.87 д, 1H, J=7.93, 7.95 д, 1H, J=7.93; 6.80 д, 2H, J=6.72, 8.17 д, 2Н, J=6.72; 8.07 с, 2Н. Подібним чином з відповідних йодидів і гетероциклічних сполук, тіосечовини і похідних тіосечовини отримували: 4-аміно-1-(3-(3-метил-5-(бензолсульфонілокси)фенокси)пропіл)-піридиній йодид (HC_016s_IOC) Вихід 78%. 1 ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.20 с, 3Н; 3.88 т, 2Н, J=5.50; 2.16 м, 2Н, J=6.11; 4.25 т, 2Н, J=6.71; 6.31 с, 1Н, 6.44 с, 1Н, 6.66 с, 1Н; 7.68 т, 2Н, J=7.94, 7.82 т, 1H, J=7.94, 7.87 д, 2Н, J=7.32; 6.81 d, 2H, J=6.72, 8.17 d, 2H, J=6.72; 8.09 с, 2Н. 2-аміно-1-(3-(3-метил-5-(бензолсульфонілокси)фенокси)пропіл)-тіазолій йодид (HC_017s_IOC) Вихід 65%. 1 ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.21 с, 3Н; 3.93 τ, 2Η, J=6.11; 2.11 м, 2Н, J=6.10; 4.15 т, 2Н, L=6.71; 6.35 с, 1Н, 6.44 с, 1Н, 6.68 с, 1Н; 7.69 т, 2Η, J=7.33, 7.84 т, 1H, J=7.32, 7.88 д, 2H, J=7.93; 7.02 д, 1H, J=4.27, 7.42 d, 1H, J=4.27; 9.42 c, 2H. 3-(3-метил-5-(бензолсульфонілокси)фенокси)пропіл-ізотіуроній йодид (HC_018s_IOC) Вихід 80%. 1 ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.21 с, 3Н; 3.95 т, 2Η, J=6.10; 2.00 м, 2H, J=6.71; 3.25 т, 2Н, J=7.32; 6.40 с, 1H, 6.25 с, Ш, 6.74 с, 1Н; 7.69 т, 2Η, J=7.94, 7.84 т, 1Н, J=7.93, 7.89 д, 2Н, J=7.33; 9.03 с, 4Н. 4-аміно-1-(2-(3-метил-5-(бензолсульфонілокси)фенокси)етил)-піридиній йодид (HC_019s_IOC) 10 UA 98970 C2 5 10 15 20 25 Вихід 60%. 1 ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.20 с, 3Н; 4.24 т, 2Η, J=4.88; 4.48 т, 2Н, J=4.89; 6.39 с, 1H, 6.45 с, 1H, 6.73 с, 1Н; 7.68 т, 2Н, J=7.93, 7.82 т, 1Н, J=7.93, 7.87 д, 2H, J=7.32; 6.82 д, 2Н, J=7.32, 8.18 д, 2Н, J=7.33; 8.14 с, 2Н. 2-(3-метил-5-(бензолсульфонілокси)фенокси)етил-ізотіуроній йодид (HC_020s_IOC) Вихід 45%. 1 ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.22 с, 3Н; 4.11 т, 2H, J=5.49; 3.54 т, 2Н, J=5.49; 6.41 с, 1Н, 6.48 с, 1Н, 6.76 с, 1Н; 7.69 т, 2Η, J=7.93, 7.84 т, 1Η, J=7.93, 7.89 д, 2Н, J=7.32; 9.10 с, 4H. 2-(3-метил-5-(2-хлорбензолсульфонілокси)фенокси)етил-ізотіуроній йодид (HC_024s_IOC). Вихід 53%. 1 ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.21 с, 3Н; 3.95 т, 2Η, J=5.50; 2.12 м, 2Н, J=5.50; 4.15 т, 2Н, J=6.10; 6.42 т, 1H, 6.51 с, 1Н, 6.70 с, 1Н; 7.59 т, 1Н, J=7.32, 7.83 т, 1H, J=7.94, 7.88 д, 1Н, J=7.94, 7.95 д, 1H, J=7.94; 7.01 д, 1Н, J=4.27, 7.42 д, 1H, J=4.27; 9.39 c, 2H. 3-(3-метил-5-(2-хлорбензолсульфонілокси)фенокси)пропіл-ізотіуроній йодид (HC_026s_IOC) Вихід 55%. 1 ЯМР H (Bruker DRX500, 500 МГц, OUSO-d6, м.д., J Гц): 2.22 с, 3Н; 3.97 т, 2Η, J=6.10; 2.01 м, 2Н, J=7.33, J=6.10; 4.26 т, 2H, J=7.33; 6.47 с, 1Н, 6.51 с, 1H, 6.75 с, 1Н; 7.60 т, 1H, J=7.93, 7.84 т, 1Н, J=7.94, 7.88 д, 1Н, J=7.93, 7.96 д, 1H, J=7.94; 8.95 с, 2Н, 9.07 с, 2Н. 4-аміно-1-(2-(3-метил-5-(2-хлорбензолсульфонілокси)фенокси)етил)-піридиній йодид (НС_025s_IOC). 11 UA 98970 C2 5 10 Вихід 58%. 1 ЯМР H (Bruker DRX500, 500 МГц, ДМСО-d6, м.д., J Гц): 2.20 с, 3Н; 4.26 т, 2Н, J=4.88; 4.49 т, 2Н, J=4.88; 6.45 с, 1Н, 6.51 с, 1H, 6.74 с, 1Н; 7.58 т, 1Н, J=7.93, 7.84 т, 1H, J=7.94, 7.88 д, 1Н, J=7.93, 7.94 д, 1Н, J=7.94; 6.82 d, 2Н, J=7.32, 8.18 d, 2H, J=7.33; 8.14 с, 2Н. Подібним чином, за методиками, описаними у прикладах 1-4, сполуки синтезували з різних арилсульфохлоридів і гетероциклілсульфохлоридів. Хімічні формули, мас-спектрометричні параметри і розрахована величина скоринг-функції наведені у таблиці 2. Сполуки можуть бути отримані у формі йодидів, бромідів, хлоридів або інших солей. Приклад 5 Синтез сполук 1. 4-Хлор-3-нітробензол-1-сульфонілхлорид 15 20 25 о-Нітрохлоранілін (15 г) вводили у 30 мл хлорсульфонової кислоти при перемішуванні і нагрівали при 100°С протягом 2 год., потім 2 год. при 110°С і 5 год. при 127°С. Реакційну суміш охолоджували до кімнатної температури і виливали на колотий лід (140 г). Осад фільтрували, відфільтрований осад промивали крижаною водою і сушили на повітрі. Отримували 15 г 4 хлор3-нітробензол-1-сульфонілхлориду. 2. 4-хлор-N-метил-3-нітро-N-фенілбензолсульфонамід 4-Хлор-3-нітробензол-і-сульфонілхлорид (10,6 г, 0,041 моль) розчиняли в толуолі (50 мл); вводили триетиламін (4,14 г, 0,041 моль). До отриманого розчину вводили N-метиланілін (4,4 г, 0,041 моль) при перемішуванні. Реакційну суміш витримували при 70-80°С протягом 1 год. Після цього їй давали охолонути. Охолоджений розчин промивали двічі 30 мл води і випарювали у вакуумі. Залишок перекристалізовували з етанолу. Вихід 4-хлор-М-метил-3-нітро-Nфенілбензолсульфонаміду становив 9,4 г (61%). 3. N-метил-4-(метиламіно)-3-нітро-N-фенілбензолсульфонамід 12 UA 98970 C2 5 10 15 20 25 30 Розчин 4-хлор-N-метил-3-нітро-N-фенілбензоїлсульфонаміду (9,4 г, 0,029 моль) в етанолі (50 мл) об'єднували з 25 мл водного розчину 40% метиламіну. Реакційну суміш нагрівали до 70°С і перемішували при цій температурі протягом 1 год. Після охолодження і фільтрування відфільтрований осад промивали етанолом і висушували при 60°С. Вихід N-метил-4(метиламіно)-3-нітро-N-фенілбензоїлсульфонаміду становив 9,0 г (97%). 4. 3-аміно-N-метил-4-(метиламіно)-N-фенілбензолсульфонамід N-Метил-4-(метиламіно)-3-нітро-N-фенілбензоїлсульфонамід (9 г, 0,028 моль) розчиняли в ізопропанолі (90 мл). До цього розчину вводили гідразин гідрат (11 мл), активоване вугілля (2 г) і розчин FeCl3 6H2O (0,5 г у 10 мл етанолу). Реакційну суміш кип'ятили протягом 8 год. Вугілля видаляли фільтрацією. Фільтрат випарювали до сухого стану. Вихід 3-аміно-N-метил-4(метиламіно)-N-фенілбензолсульфонаміду становив 8,1 г (99%). 5. 3-хлор-N-(5-(N-метил-N-фенілсульфамоїл)-2-(метиламіно)феніл)пропанамід До розчину 3-аміно-N-метил-4-(метиламіно)-N-фенілбензолсульфонаміду (5,4 г, 0,018 моль) і триетиламіну (1,81 г, 0,018 моль) у диметилформаміді (16 мл), охолоджуваного на крижаній бані (~5°С), вводили хлорпропіонілхлорид (2,32 г, 0,018 моль). Реакційну масу перемішували при кімнатній температурі протягом 5 год. Після цього додавали воду (14 мл) і ацетонітрил (5 мл). Утворений осад відфільтровували. Вихід 3-хлор-N-(5-(N-метил-N-фенілсульфамоїл)-2(метиламіно)феніл)пропанаміду становив 3,1 г (45%). 6. 4-аміно-1-(3-(5-(N-метил-N-фенілсульфамоїл)-2-(метиламіно)феніламіно)-3-оксопропіл)піридиній хлорид 3-Хлор-N-(5-(N-метил-N-фенілсульфамоїл)-2-(метиламіно)феніл)пропанамід (1 г, 0,0026 моль) і 4-амінопіридиній (0,73 г, 0,0078 моль) кип'ятили у безводному ацетоні (50 мл) протягом 50 год. Осад фільтрували і піддавали перекристалізації із суміші ацетонітрил/етанол у співвідношенні 10:1. Вихід 4-аміно-1-(3-(5-(N-метил-N-фенілсульфамоїл)-2-(метиламіно)феніламіно)-3-оксопропіл)піридиній хлориду становив 0,54 г (43%). 13 UA 98970 C2 7. 4-аміно-1-(2-(1-метил-5-(N-метил-N-фенілсульфамоїл)-1-Н-бензо[d]імідазол-2-іл)етил) піридиній хлорид 5 10 15 20 25 30 35 40 45 50 До суспензії (0,2 г, 0,00042 моль) 4-аміно-1-(3-(5-(N-метил-N-фенілсульфамоїл)-2(метиламіно)феніламіно)-3-оксопропіл)піридинійхлориду в ацетонітрилі (8 мл) вводили тіоніл хлорид (0,2 мл). Реакційну суміш кип'ятили протягом 10 хв., залишали при кімнатній температурі протягом 24 год. і потім розводили діетиловим ефіром then (8 мл). Утворений осад відфільтровували і перекристалізовували із суміші ацетонітрил/етанол (абс) у співвідношенні 10:1. Вихід 4-аміно-1-(2-(1-метил-5-(N-метил-N-фенілсульфамоїл)-1Н-бензо[d]імідазол-2іл)етил)піридиній хлориду становив 0,055 г (26%). Подібним чином, за методиками, описаними у прикладі 5, отримували сполуки, хімічні формули яких, а також мас-спектрометричні параметри і розрахована величина скоринг-функції наведені у таблиці 3. Сполуки можуть бути отримані у формі йодидів, бромідів, хлоридів або інших солей. Приклад 6 Вивчення впливу досліджуваних сполук на активність тромбіну Вплив синтезованих речовин на активність тромбіну досліджували, вимірюючи швидкість гідролізу специфічних низькомолекулярних субстратів тромбіном у водному буферному розчині за відсутності або присутності цих сполук. Однією з таких речовин був хромогенний субстрат Хромозим ТН (СТН): N-(p-Tosy1)-Gly-Pro-Arg-pNA [Sonder SA, Fenton JW 2nd. Thrombin Specificity with Tripeptide Chromogenic Substrates: Comparison of Human and Bovine Thrombins with and without Fibrinogen Clotting Activities. Clin. Chem., 1986, 32(6):934-937]. У ряді експериментів використовували інший субстрат, а саме флюорогенний субстрат BOC-Ala-ProArg-AMC (S), де ВОС являє собою залишок бутоксикарбонілу, а АМС - 7-аміно-4-метилкумарин [Kawabata S., Miura Т., Morita Т., Kato Η., Fujikawa К., Ivanaga S., Takada К., Kimura Т., Sakakibara S. Highly Sensitive peptide-4-methylcoumaryl-7-amide Substrates for Blood-Clotting Proteases and Trypsin. Eur. J. Biochem., 1988, 172(1): 17-25]. У лунки звичайного 96-лункового планшету вносили буфер, що містить 140 мМ NaCl, 20 мМ HEPES і 0,1% поліетиленгліколь (Мв=6000), рН=8,0. Додавали субстрат (кінцева концентрація в лунці - 100 мкМ), тромбін (кінцева концентрація - 190 пМ), а також досліджувану сполуку (передбачуваний інгібітор тромбіну) у різних концентраціях (від 0,002 мМ до 3,3 мМ). При використанні хромогенного субстрату за накопиченням фарбованого продукту реакції - паранітроаніліну спостерігали на спектрофотометричному планшеті-рідері Molecular Devices (Thermomax, США), вимірюючи збільшення оптичної густини на довжині хвилі 405 нм. У випадку флюорогенного субстрату, у ході гідролізу тромбін відщеплює від нього амінометилкумарин, який у вільній формі значно флюоресцує ( збудження - 380 нм і випромінювання - 440 нм). Кінетику реакції реєстрували на флюорометричному планшеті-рідері Titertek Fluoroskan (LabSystem, Фінляндія). Початкову швидкість реакції визначали як тангенс кута нахилу кінетичної кривої на прямолінійній ділянці (перші 10-15 хвилин реєстрації). Швидкість реакції без інгібітору брали за 100%. Середнє арифметичне двох незалежних вимірювань використовували як кінцевий результат. На фіг. 1 показані приклади характерних кінетичних кривих гідролізу хромогенного субстрату Хромозим ТН (СТН) під дією тромбіну в присутності різних концентрацій сполуки HC-019s-IOC (див. Таблицю 4). Кінетична крива гідролізу за відсутності інгібітору використана як контроль. На фіг. 2 показано залежність ступеня інгібування гідролізу СТН і концентрації в системі іншої нової синтезованої сполуки (HC-018s-IOC), яка є високоефективним інгібітором тромбіну (див. Таблицю 4). Дані щодо значень інгібуючої дії ряду нових синтезованих сполук на активність тромбіну наведені у Таблиці 4. 14 UA 98970 C2 5 Таким чином отримані результати показали, що всі нові синтезовані сполуки є прямими інгібіторами тромбіну. Ступінь інгібування для різних сполук відрізняється, проте більша частина сполук являє собою високоефективні інгібітори тромбіну, які можуть складати основу фармацевтичних композицій, що використовуються для боротьби з тромбіно-залежними тромобоемболічними станами, а крім того, можуть бути використані у дослідженнях. 15 UA 98970 C2 16 UA 98970 C2 17 UA 98970 C2 18 UA 98970 C2 19 UA 98970 C2 20 UA 98970 C2 21 UA 98970 C2 22 UA 98970 C2 23 UA 98970 C2 24 UA 98970 C2 25 UA 98970 C2 26 UA 98970 C2 27 UA 98970 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюThrombin function compounds and pharmaceutical compositions based thereon
Автори англійськоюSinauridze, Elena Ivanovna, Ataullakhanov, Fazoil Inoyatovich, Butylin, Andrey Alexandrovich, Sulimov, Vladimir Borisovich, Romanov, Alexey Nickolayevich, Bogolyubov, Alexey Alexeevich, Kuznetsov, Yury Vladimirovich, Gribkova, Irina Vladimirovna, Gorbatenko, Alexander Sergeevich, Kondakova, Olga Anatolievna
Назва патенту російськоюСоединения с функцией ингибирования тромбина и фармацевтические композиции на их основе
Автори російськоюСинауридзе Елена Ивановна, Атауллакханов Фазоил Иноятович, Бутилин Андрей Александрович, Сулимов Владимир Борисович, Романов Алексей Николаевич, Боголюбов Алексей Алексеевич, Кузнецов Юрий Владимирович, Грибкова Ирина Владимировна, Горбатенко Александр Сергеевич, Кондакова Ольга Анатолиевна
МПК / Мітки
МПК: C07D 277/40, A61P 7/02, C07D 401/06, C07D 213/73, A61K 31/4425
Мітки: інгібування, тромбіну, функцією, композиції, основі, фармацевтичні, сполуки
Код посилання
<a href="https://ua.patents.su/48-98970-spoluki-z-funkciehyu-ingibuvannya-trombinu-ta-farmacevtichni-kompozici-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Сполуки з функцією інгібування тромбіну та фармацевтичні композиції на їх основі</a>