Спосіб фотометричного визначення концентрації йодид-іонів у розчині
Номер патенту: 23386
Опубліковано: 25.05.2007
Автори: Дрозд Анатолій Васильович, Білик Валентина Михайлівна
Формула / Реферат
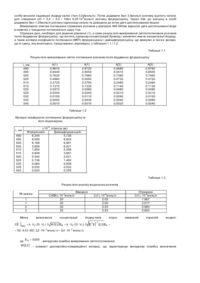
Спосіб фотометричного визначення концентрації йодид-іонів у розчині, що полягає в окисленні йодид-іонів, йодуванні органічного реагенту, вимірюванні світлопоглинання продуктів йодування при довжинах хвиль з області спільного поглинання органічного реагенту і продуктів йодування і розрахунку концентрації йодид-іонів, який відрізняється тим, що окислення йодид-іонів до йодат-іонів проводять електрохімічним шляхом разом з окисленням бромід-іонів до брому, до розчину додають бромід і кип'ятять для вилучення брому, йодування органічного реагенту проводять після додавання надлишку йодиду, а розрахунок концентрації йодид-іонів проводять у два етапи: розрахунок сумарної концентрації йодпохідних шляхом розв'язання системи рівнянь виду
![]()
і розрахунок концентрації йодиду з врахуванням стехіометрії реакції електрохімічного окислення та реакції йодування:
![]()
де εі1, εі2 - коефіцієнти поглинання органічного реагенту і йодпохідного при і-й довжині хвилі, л/(моль×см);
с1, с2 - відповідно концентрації органічного реагенту і дийодпохідного, моль/л;
k - стехіометричний коефіцієнт у реакції йодування органічного реагенту;
V2 - об'єм розчину після йодування, л;
V1 - об'єм проби, л;
ℓ - товщина поглинального шару, см.
Текст
Корисна модель належить до сфери фізико-хімічних вимірювань і може знайти застосування в хімічному аналізі, зокрема, при моніторингу йодидів у навколишнім середовищі, при визначенні йодид-іонів як мікродомішок у різних об'єктах. Відомі способи близькі до заявленого технічного рішення є способи фотометричного визначення йодид-іонів [1]. Способи полягають в окисленні йодид-іонів, галогенуванні органічного реагенту, вимірюванні світлопоглинання продуктів галогенування при довжинах хвиль з області спільного поглинання органічного реагенту і продуктів галогенування та розрахунку концентрації йодид-іонів. При цьому окислення йодид-іонів здійснюють хімічним шляхом до йоду при додаванні окислювача до розчину, що аналізують. Як органічний реагент використовують діамантовий зелений, малахітовий зелений, кристалічний фіолетовий та інш. Розрахунок концентрації йодид-іонів роблять за відомим рівнянням градуювального графіку. Чим вище коефіцієнти поглинання реагенту, тим вище чутливість визначення. Відомі способи дозволяють визначити концентрацію йодид-іонів в розчині при відсутності в ньому переважаючої концентрації бромід-іонів. Способи можна використати тільки з реагентами, які стійкі до дії хімічних окислювачів. Реагенти з високими коефіцієнтами поглинання менш стійкі до хімічного окислення, і їх використання призводить до підвищення систематичних похибок. Найбільш близьким до заявленого технічного рішення є спосіб фотометричного визначення йодид-іонів з йодфеноловим червоним [2], який взято за прототип. Спосіб включає всі процедури, що названо в аналогах, і полягає в окисленні йодид-іонів, йодуванні органічного реагенту, вимірюванні світлопоглинання продуктів йодування при довжинах хвиль з області спільного поглинання органічного реагенту і продуктів йодування та розрахунку концентрації йодид-іонів. Основна перевага способу у тому, що за рахунок використання дийодпохідної сполуки фенолового червоного підвищується коефіцієнт поглинання продукту йодування і, як наслідок, підвищується чутливість визначення йодид-іонів. Основним недоліком відомого способу є складність визначення концентрації йодид-іонів у розчині, де присутня переважаюча концентрація бромід-іонів, що вказує на недостатню селективність визначення йодиду у присутності броміду. Також спосіб має при вимірюванні світлопоглинання систематичну похибку, зумовлену впливом хімічного окислювача на органічний реагент. Способу властива додаткова неточність розрахунку, пов'язана з тим, що вимірювання світлопоглинання проводиться при довжинах хвиль з області спільного поглинання органічного реагенту і продуктів йодування, що вимагає ретельного дозування реагентів і чіткого фіксування часових інтервалів процедур аналізу, що практично важко здійснити. Технічною задачею цієї корисної моделі є створення такого способу фотометричного визначення концентрації йодид-іонів у розчині, у якому за рахунок заміни операції хімічного окислення йодид-іонів на операцію електрохімічного окислення йодид-іонів до йодат-іонов і проведення її разом з електрохімічним окисленням бромід-іонів до брому та відділенням брому шляхом відгону при нагріванні, за рахунок проведення розрахунку в два етапи шляхом розв'язання нової системи рівнянь, забезпечується усунення систематичного впливу бромідіонів на результат визначення йодид-іонів, виключається вплив хімічних окислювачів на органічний реагент і не викривлюється результат розрахунку концентрації йодид-іонів. Таким чином, підвищується селективність визначення йодид-іонів і забезпечується можливість визначення концентрації йодид-іонів у розчині, що містить переважаючу концентрацію бромід-іонів при зменшенні похибки визначення концентрації йодид-іонів. Тобто підвищується точність визначення йодид-іонів. Технічний результат досягається тим, що у відомому способі фотометричного визначення йодид-іонів, що полягає в окисленні йодид-іонів, йодуванні органічного реагенту, вимірюванні світлопоглинання продуктів йодування при довжинах хвиль з області спільного поглинання органічного реагенту і продуктів йодування і розрахунку концентрації йодид-іонів, відповідно до корисної моделі окислення йодид-іонів до йодат-іонів проводять електрохімічним шляхом разом з окисленням бромід-іонів до брому, відділення брому шляхом відгону при нагріванні у присутності броміду; йодування органічного реагенту проводять після введення надлишку йодиду, а розрахунок концентрації йодид-іонів роблять у два етапи: розрахунок сумарної концентрації йодпохідних шляхом розв'язання системи рівнянь виду: e i1*c 1l + e i2* c 2l = A i, деі = 1...n, n ³ 2; j = 12, (1) , і розрахунок концентрації йодид-іонів з врахуванням стехіометрії реакції електрохімічного окислення та реакції йодування: () C I- = k × c 2 × V2 / (3 × V1 ), (2) де e i1, e i2 - коефіцієнти поглинання органічного реагенту і дийодпохідного при і-й довжині хвилі; л/(мольсм); c 1, c 2 - відповідно концентрації органічного реагенту і дийодпохідного, моль/л; k - сте хіометричний коефіцієнт у реакції галогенування; V2 - об'єм розчину, л; V1 - об'єм проби, л; l - товщина поглинаючого шару (робочий розмір кювети ), см. Причинно-наслідковий зв'язок між сукупністю істотних ознак корисної моделі і технічним результатом, що досягається, наступний. Окислення йодид-іонів до йодат-іонів електрохімічним шляхом, (а не хімічним) сумісно з окисленням бромідіонів до брому при потенціалі, що контролюється, дозволяє виключити негативний вплив хімічного окислювача на результат аналізу, оскільки надлишок окислювача може взаємодіяти з органічним реагентом, а його недостатня кількість призводить до неповного окислення йодид-іонів. Крім того, електрохімічне окислення саме до йодат-іонів разом з окисленням бромідів-іонів дозволяє виключити вплив адсорбції на результат аналізу, оскільки йодат-іон, що виділяється в процесі електрохімічного окислення, значимо не адсорбується на поверхні інертного металевого електроду. При цьому на електроді проходять наступні процеси: окислення йодид-іонів до йодат-іонів: I- + 3H2 O - 6e - Û IO 3 - + 6H+ та окислення бромід-іонів до брому: 2Br - - 2e- Û Br2 і забезпечується: - відсутність надлишку хімічного окислювача в розчині, - розділення в часі і в просторі процесів окислення і галогенування, - зменшення систематичної похибки аналізу, - не потрібно ретельно витримувати інтервал часу. При йодуванні органічного реагенту в розчин після електрохімічного окислення вводять бромід-іони, нагрівають до кипіння, охолоджують і додають надлишок йодид-іонів. При обраних умовах сумісного електрохімічного окислення йодид- і бромід-іонів бром, що утвориться, буде адсорбуватися на поверхні електроду і по закінченні процесу електрохімічного окислення його концентрація в розчині не буде стехіометрично відповідати початковій концентрації бромід-іонів. Крім того, при високих концентраціях брому на поверхні електроду можливе подальше окислення брому й утворення, як домішку, деякої кількості бромат-іонів: Br2 + 6H2O - 10e - Û 2BrO3 - + 12H+ При нагріванні розчину в присутності бромід-іонів з нього видаляється бром і домішки бромат-іонів: BrO 3 - + 6H+ + 5Br - Û 3Br2 - +3H2O При цьому введення броміду і нагрівання розчину дозволяє надалі виключити вплив брому на розрахунок концентрації йодиду, а введення надлишку йодиду - дозволяє максимально повно визначити концентрацію йодиду-іону в розчині, що аналізують. Проведення розрахунку концентрації йодид-іонів у два етапи (спочатку визначають сумарну концентрацію йодпохідних органічного реагенту шляхом розв'язання системи рівнянь виду (1), а потім розраховують концентрацію йодид-іонів з урахуванням стехіометрії реакції електрохімічного окислення та реакції йодування за рівнянням виду (2)) дозволяє зменшити систематичну похибку аналізу за рахунок зменшення впливу дозування реагентів на розрахунок концентрації йодид-іонів. Таким чином запропонований розрахунок є більш точним порівняно з методом градуювального графіка. Перед йодуванням органічного реагенту до розчину, що аналізують, додають надлишок йодиду. При цьому в розчині проходить такий процес: 5I - + IO 3 - + 6H+ Û 3I 2 Йод, що утворився, взаємодіє з органічним реагентом. Концентрацію йоду у розчині після електролізу визначають з концентрації йодпохідної сполуки органічного реагенту. Концентрацію останнього знаходять шляхом рішення системи рівнянь виду (1). Концентрацію йодиду у ви хідному розчині одержують з урахуванням стехіометрії реакції електрохімічного окислення та реакції йодування (рівняння виду (2)). У такий спосіб досягається рішення поставленої задачі, тобто даний спосіб дозволяє визначити концентрацію йодид-іонів у розчині в присутності переважаючої концентрації бромід-іонів при зменшенні похибки визначення концентрації йодид-іонів. Спосіб здійснюють так: Пробу розчину, що містить йодид- і бромід-іони, піддають електрохімічному окисленню. При цьому окислення йодид-іонів проводять до йодат-іонів, а окислення бромід-іонів - до брому. Потім до розчину додають бромід, нагрівають до кипіння, охолоджують, додають надлишок йодиду і вводять органічний реагент, здійснюють йодування органічного реагенту. Далі роблять вимірювання світлопоглинання продуктів йодування при довжинах хвиль з області спільного поглинання органічного реагенту і продуктів йодування. Потім проводять розрахунок концентрації йодид-іонів. Розрахунок роблять у два етапи: спочатку розраховують сумарну концентрацію йодпохідних органічного реагенту, а потім знаходять концентрацію йодид-іонів з урахуванням стехіометрії реакції електрохімічного окислення та реакції йодування, і, отже, концентрацію йодид-іонів у пробі. Спосіб, що заявляється, був випробуваний у лабораторії кафедри хімічної метрології Харківського національного університету ім. В.Н. Каразіна на такому обладнанні: спектрофотометр СФ-46, потенціостат П5848, інтегратор кулонометричний ИПТ-1, електрохімічна ячейка з розділеними платиновими електродами і при використанні таких органічних реагентів як флуоресцеїн і йодфеноловий червоний. Приклади конкретної реалізації представлені нижче. Приклад 1. Приготували модельні розчини (див. табл. 1.1). У розчинах створили концентрацію хлорної кислоти 0,1моль/л. Розчини готували на двічі дистильованій воді, що насичена газоподібним азотом. Для проведення холостого (контрольного) досліду приготували розчин хлорної кислоти (0,1моль/л) на тому ж зразку двічі дистильованої води. Порції розчинів по 60мл піддавали електролізу в електрохімічній ячейці з платиновими електродами при 1,10В відносно хлоридсрібного насиченого електроду порівняння. Закінчення електролізу фіксували за сталою величиною швидкості накопичення кількості електрики в кулонометрі. Після електролізу розчин з ячейки кількісно переводили в стакан, додавали 1мл 0,002моль/л броміду калію, кип'ятили до знебарвлення і випаровували до об'єму менше 35мл, переводили в мірну колбу місткістю 50мл. В колбу вносили надлишок йодиду калію (1мл 0,02моль/л). Потім додавали 5мл 3,5моль/л розчину ацетату натрію для створення рН = 5,4 ÷ 5,5 і 10мл 6,25.10-5моль/л розчину флуоресцеїну. Через 5хв. до розчину в колбі додавали 5мл 1,25моль/л розчину гідроксиду натрію та доводили до мітки двічі дистильованою водою. Вимірювали спектри поглинання отриманих розчинів у діапазоні 490-540нм відносно двічі дистильованої води в кюветах з товщиною поглинаючого шару 1см. Отримані дані, необхідні для рішення рівняння (1), а саме результати вимірювання світлопоглинання розчинів після йодування флуоресцеїну, що містять однакову концентрацію броміду і зазначені нижче концентрації йодиду, а також молярні коефіцієнти поглинання (МКП) флуоресцеину і дийодфлуоресцеїну, що виміряні в тих же умовах, що й суміш, яку аналізують, представлені, відповідно, у таблицях 1.1 і 1.2. Таблиця 1.1 Результати вимірювання світло поглинання розчинів після йодування флуоресцеїну l, нм 490 495 500 505 510 515 520 525 530 535 540 А(1) 0.9610 0.9440 0.7630 0.4960 0.2720 0.1310 0.0570 0.0240 0.0100 0.0040 0.0010 А(1) 0.9720 0.9550 0.7660 0.5050 0.2750 0.1330 0.0580 0.0240 0.0110 0.0030 0.0010 А(2) 0.9680 0.9410 0.7380 0.4730 0.2480 0.1140 0.0480 0.0210 0.0090 0.0040 0.0020 А(2) 0.9760 0.9500 0.7460 0.4720 0.2460 0.1130 0.0490 0.0210 0.0100 0.0060 0.0040 Таблиця 1.2 Молярні коефіцієнти поглинання флуоресцеїну та його йодпохідних e-10-4, л/(моль .см) Флуоресцеїн Дийодфлуоресцеїн 8,344 5,726 8,000 6,603 6,168 6,961 3,808 6,521 1,904 5,356 0,848 3,881 0,344 2,521 0,136 1,482 0,064 0,858 0,032 0,522 0,024 0,355 l, нм 490 495 500 505 510 515 520 525 530 535 540 Таблиця 1.3 Результати аналізу модельних розчинів № зразку 1 1 2 2 Межа С(КВr),.10-3моль/л 20 20 20 20 визначення Введено концентрації () С(I-),.10-6моль/л 2.00 2.00 0.93 0.93 йодид-іонів ( ) C I- гран k × V2 / (3 × V1 ) × 3 W (2,2 )= k × V2 / (3 × V1 )× 3 ETE = SA -1 згідно Отримано С(I-),.10-6моль/л 1.967 2.017 0.983 0.883 заявленій корисній моделі: (2,2)= SA = 50 × 4 /(3 × 60 ) × 2,2 × 10 -7 моль / л 2,4 × 10 -7 моль / л, = SA де = 0,005 - випадкова похибка вимірювання світлопоглинання. W (2,2) - елемент дисперсійно-коваріаційної матриці, що характеризує випадкову похибку визначення T концентрації дийодпохідної сполуки; E, E - матриці МКП, відповідно, початкова та транспонована. Приклад 2. Визначення концентрації йодид-іонів у розчинах броміду калію по способу-прототипу. В конусах місткістю (25-30)мл приготували модельні розчини, що містять суміші йодид- і бромід-іонів. У розчини вводили по 1мл 1моль/л хлорної кислоти та по 5мл 1.10-3моль/л органічного реагенту йодфенолового червоного (ЙФК). Потім в кожний розчин вносили надлишок хімічного окислювача - йодату калію, нагрівали отримані розчини в конусах на киплячій водяній бані протягом 10хв і охолоджували до кімнатної температури. Отримані суміші переводили в мірні колби місткістю 50мл, вносили 5мл ацетатного буферу до рН = 5.4. Розчини в колбах доводили до мітки двічі дистильованою водою. Концентрації йодид-іонів в отриманих розчинах наведена в табл. 2.1. Вимірювали світлопоглинання отриманих розчинів при 600нм відносно контрольного розчину, що містить усі використовувані компоненти, за винятком йодид- і бромід-іонів, у кювета х з товщиною поглинаючого шару 1см. Отримані дані, необхідні для визначення концентрації йодид-іонів у модельних розчинах, а саме виміряні світлопоглинання розчинів, що аналізують після йодування йодфенолового червоного, які містять однакову концентрацію йодиду і зазначені нижче концентрації броміду, представлені, відповідно, у таблиці 2.1. Використовуючи градуювальну залежність (Aі=kcі, де k=6350), розраховуємо концентрацію йодид-іонів у розчині. Отримані результати представлені в таблиці 2.1. Таблиця 2.1 Результати аналізу модельних розчинів Введено С(КВr),.10-3 моль/л С(I-), 10 -4моль/л 0 1.50 0.15 1.50 1.5 1.50 9 1.50 15 1.50 Отримано Світлопоглинання при 600нм 0.947 0.958 0.978 1.195 1.3 С(I-), 10-4моль/л 1.49 1.51 1.54 1.88 2.05 Як видно з даних, наведених у табл.2.1 підвищення концентрації бромідів призводить до викривлення результатів визначення йодид-іонів. Розраховують коефіцієнт парціальної чутливості для бромід-іонів за рівнянням A i+ 1 - A i k= Ci+ 1 - Ci k=(1.195 - 0.978)/(0.009 - 0.0015) = 28.9 Використовуючи парціальну чутливість щодо іона, що заважає, розрахували найбільшу концентрацію цього іона, що не вносить систематичної похибки в результат визначення Сlim (Вr-) = SA/k де SA - випадкова похибка спектрофотометричних вимірювань. Сlim (Вr-) = 0.005/28.9 = 1.710-4моль/л. Межа визначення концентрації йодид-іонів за способом-прототипом складає: С(I-)гран = 3SA/6350 - 0.015/6350 = 2 10-6моль/л. Таким чином, спосіб-прототип забезпечує селективне визначення йодид-іонів у присутності бромідів, що не перевищує концентрацію С(КВr) = 1.710-4моль/л. Заявлена корисна модель забезпечує селективне визначення йодиду у присутності броміду з концентрацією C(KBr)=210-2 моль/л, що вказує на підвищення селективності визначення йодид-іонів у присутності переважаючої концентрації бромід-іонів. Межа визначення йодид-іонів у способі-прототипі складає С(I-)гран = 210-6моль/л, а у корисній моделі, що заявляється - 2.410-7моль/л, і, таким чином, у корисній моделі підвищується точність визначення концентрації йодид - іонів. Джерела інформації: 1. Уильямс У.Дж. Определение анионов: Справочник./ Пер. с англ. - М.:Химия, 1982.- 624 С. 2. О.В. Гайдук, Р.П. Панталер, А.Б. Бланк. Фотометрическое определение микрограммовых количеств йодидов в природных и сточных вода х. Вестник Харьковского ун-та, 1999, №454, Химия, Вып. 4(27), с. 111-114.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of photometric analysis for determining concentration of iodide ions in solution
Автори англійськоюDrozd Anatolii Vasyliovych
Назва патенту російськоюСпособ фотометрического анализа для определения концентрации ионов иодидов в растворе
Автори російськоюДрозд Анатолий Васильевич
МПК / Мітки
МПК: G01N 21/00
Мітки: спосіб, йодид-іонів, концентрації, розчині, визначення, фотометричного
Код посилання
<a href="https://ua.patents.su/4-23386-sposib-fotometrichnogo-viznachennya-koncentraci-jjodid-ioniv-u-rozchini.html" target="_blank" rel="follow" title="База патентів України">Спосіб фотометричного визначення концентрації йодид-іонів у розчині</a>
Попередній патент: Пристрій для локальної гіпербаричної оксигенації при запальних захворюваннях пародонта
Наступний патент: Установка для електролітичного нанесення термостійкого покриття
Випадковий патент: Робочий орган для розробки грунту