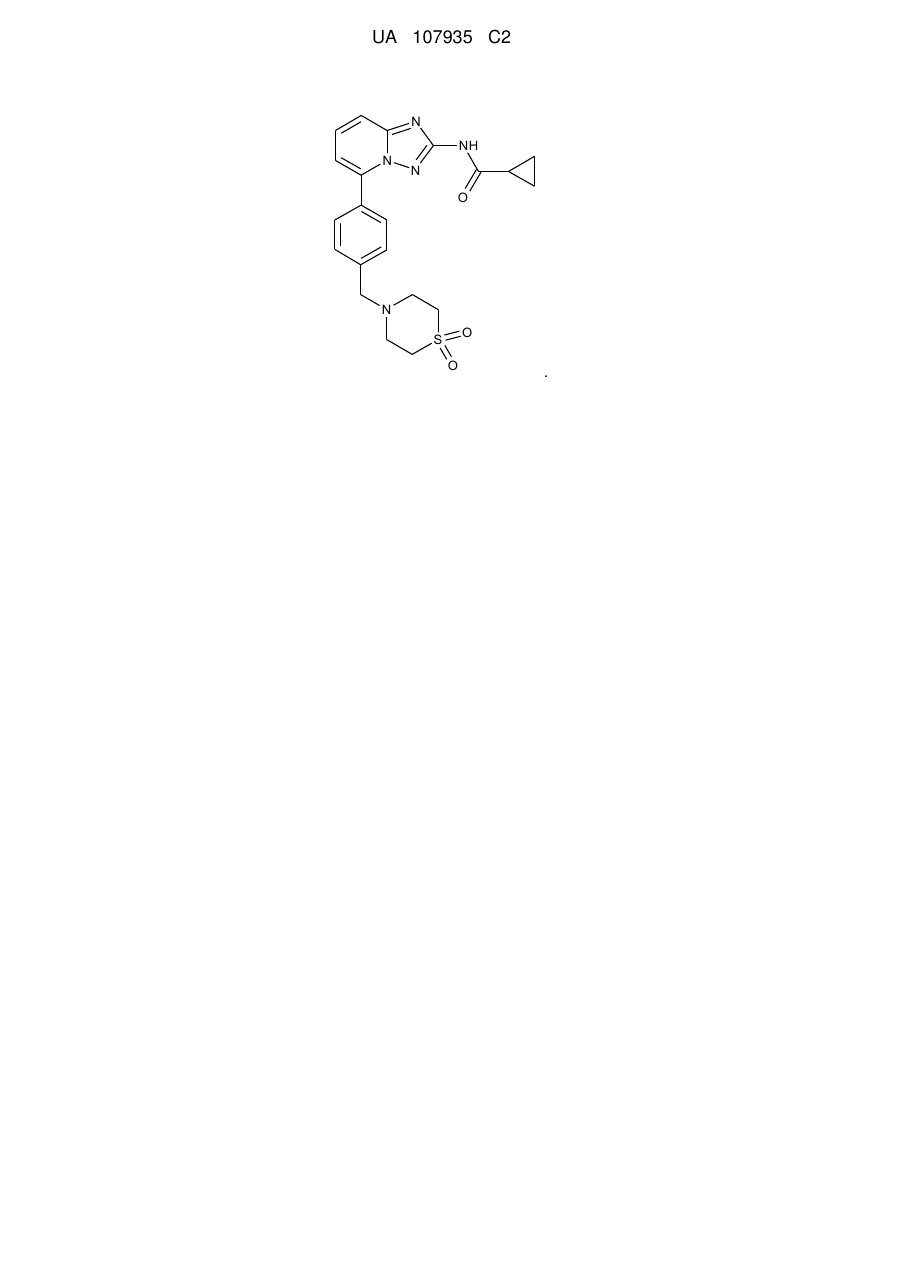
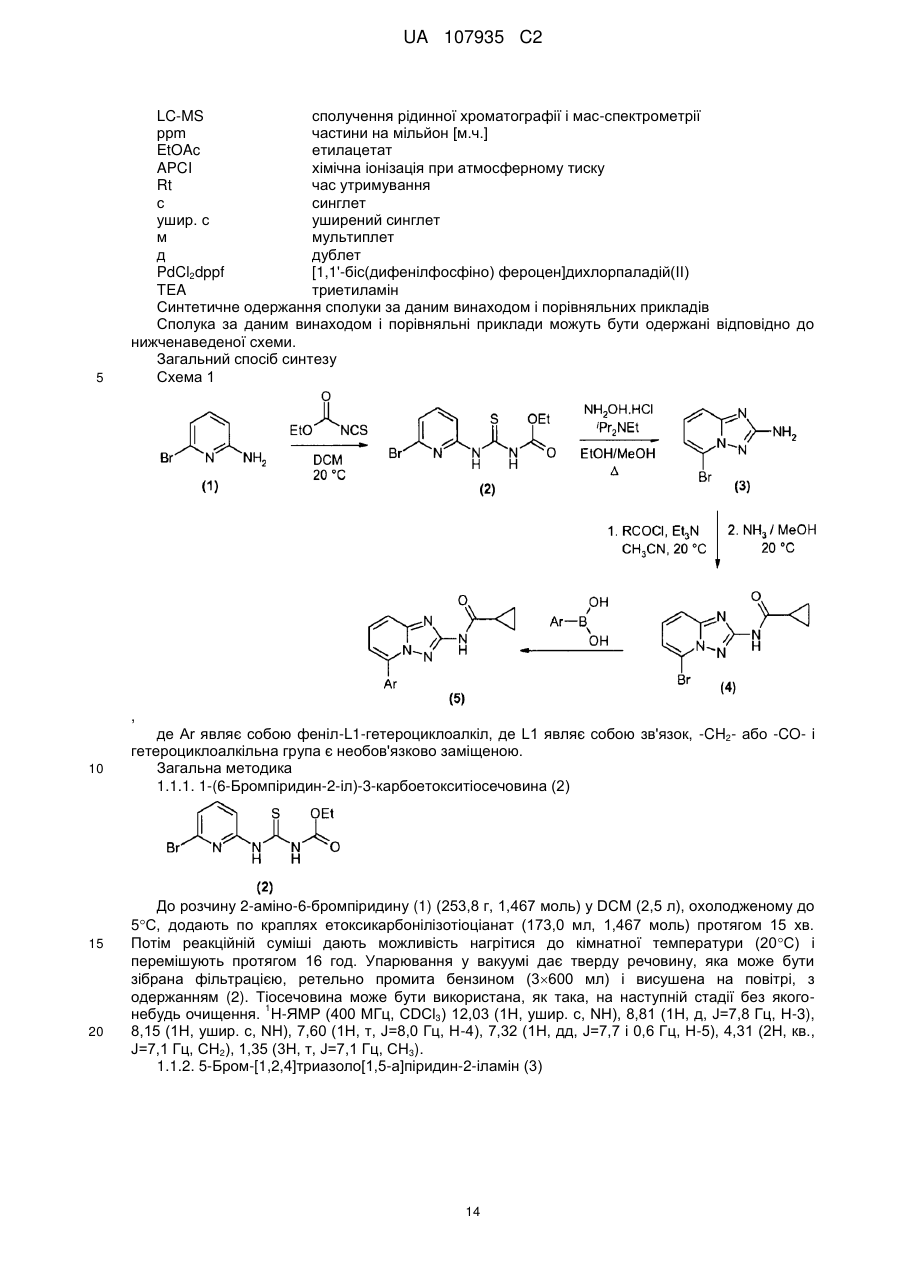
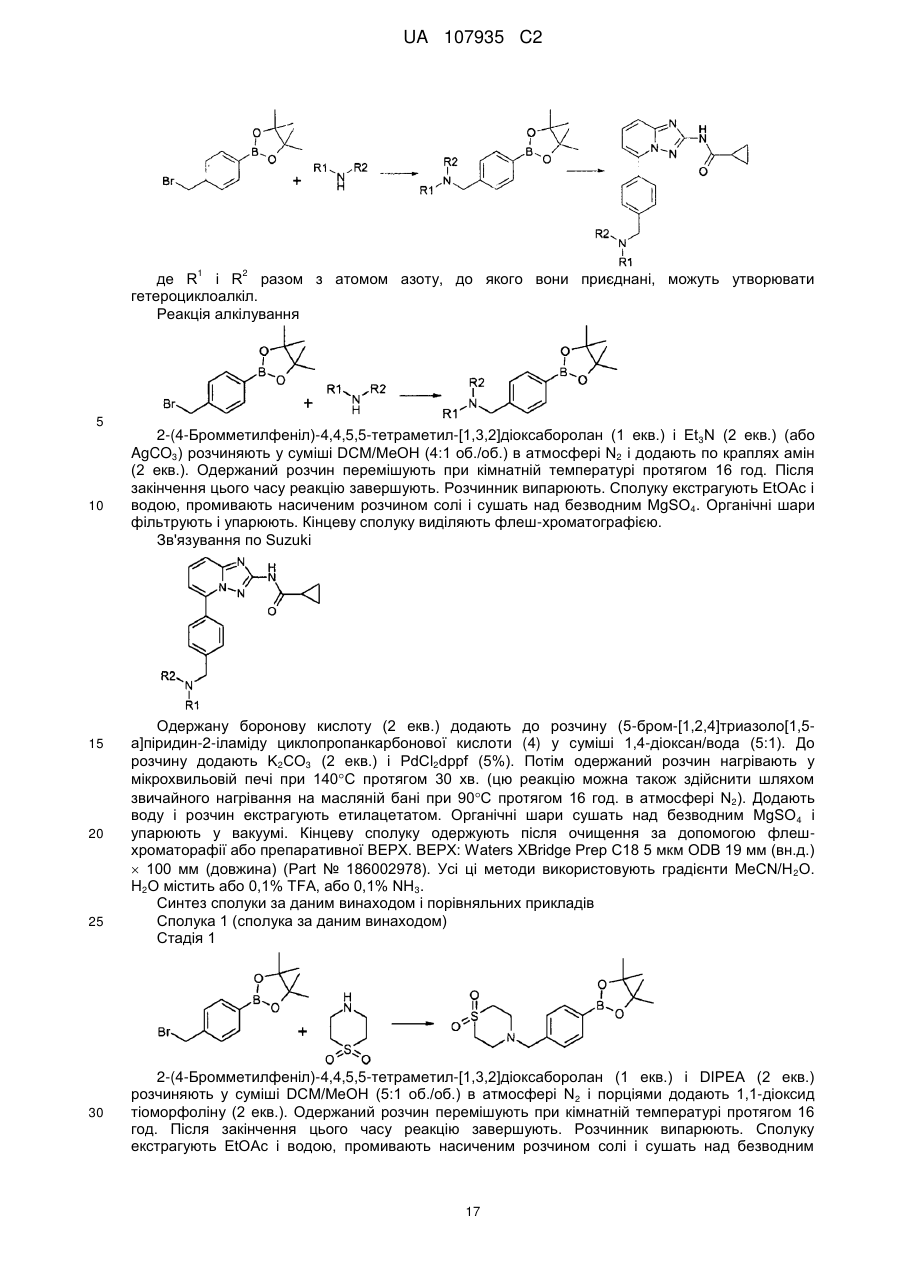
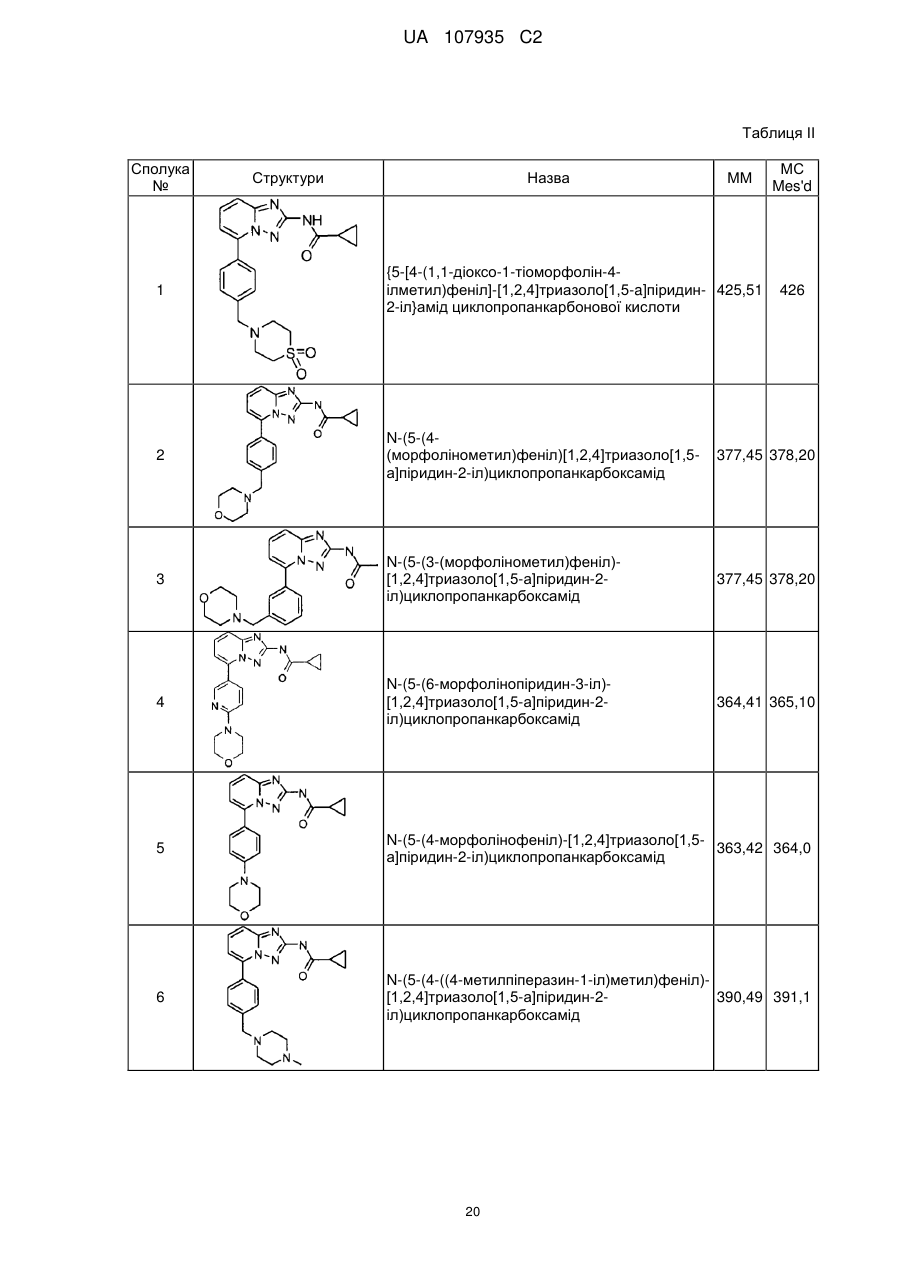
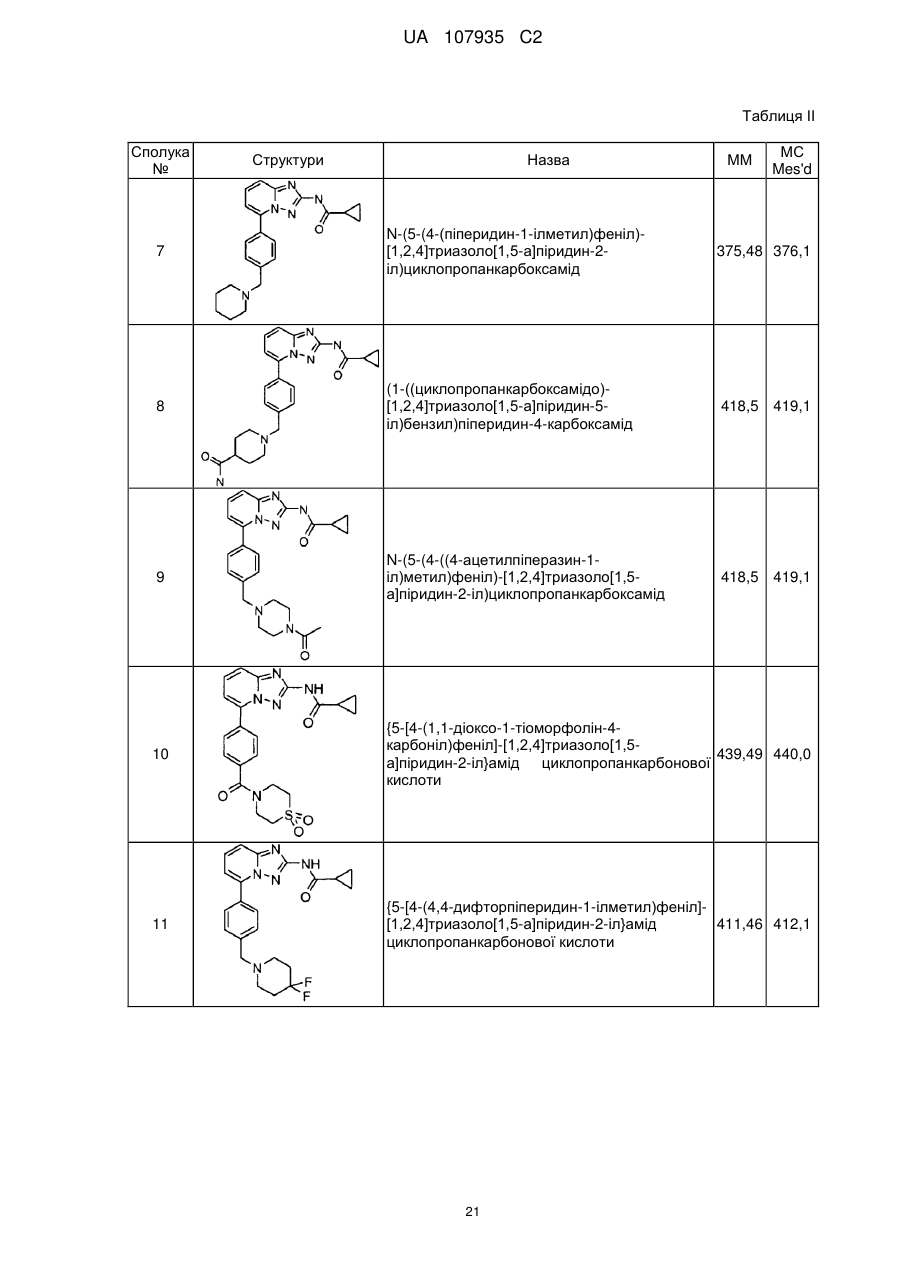
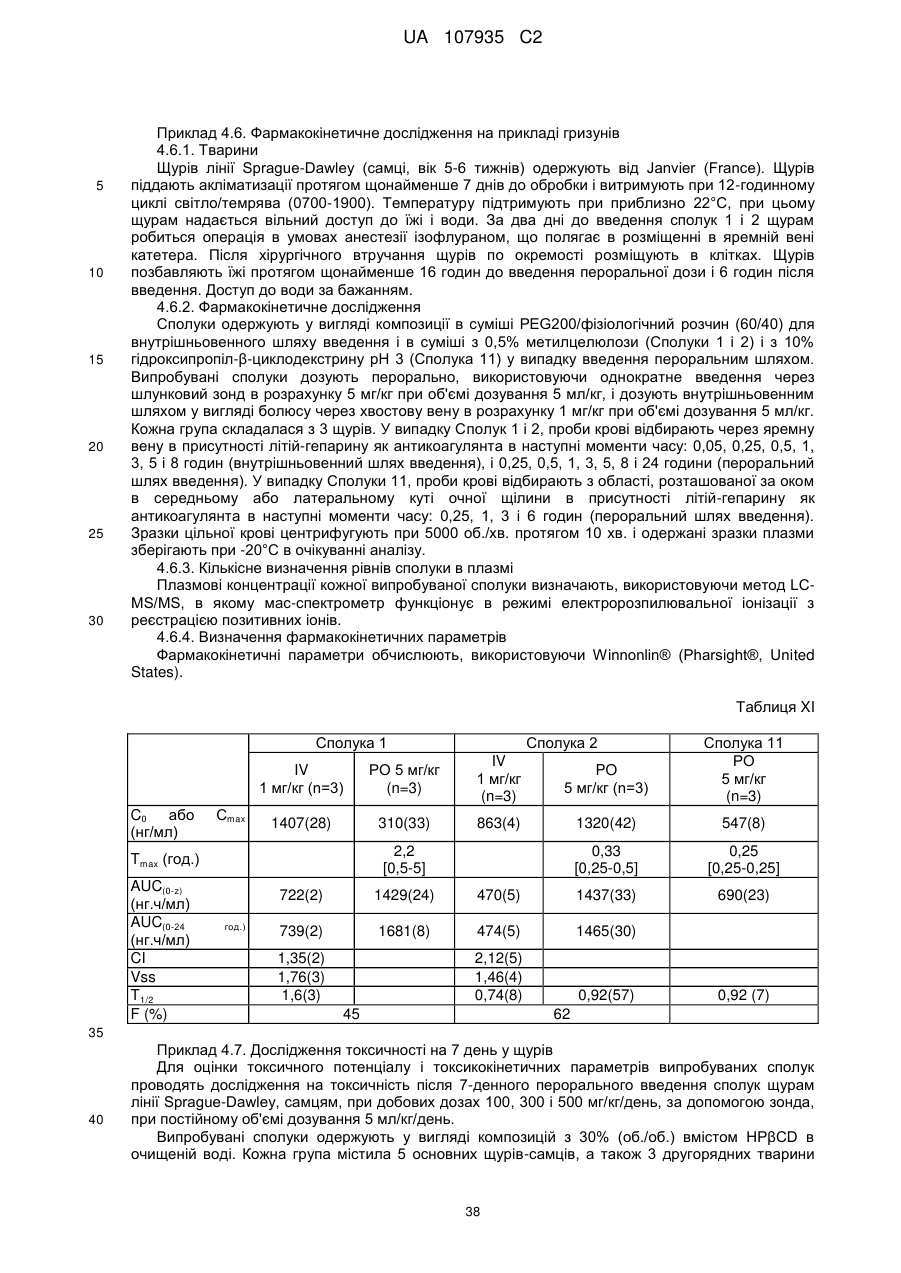
5-феніл-[1,2,4]триазоло[1,5-а]піридин-2-ілкарбоксаміди як інгібітори jak
Формула / Реферат
1. Сполука, що має формулу І:
 , (І)
, (І)
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1 для застосування як лікарського засобу.
3. Сполука за п. 1 для застосування в лікуванні, запобіганні або профілактиці запальних станів, аутоімунних захворювань, проліферативних захворювань, відторгнення при трансплантації, захворювань, пов'язаних з погіршенням поновлення хряща, вродженими вадами розвитку хряща, хвороби Кастлемана, множинної мієломи, псоріазу, саркоми Капоші і/або мезангіального проліферативного гломерулонефриту.
4. Фармацевтична композиція, яка містить фармацевтично прийнятний носій і фармацевтично ефективну кількість сполуки за п. 1.
5. Фармацевтична композиція за п. 4 для застосування як лікарського засобу.
6. Фармацевтична композиція за п. 4, яка містить додатковий терапевтичний засіб.
7. Фармацевтична композиція за п. 6, де додатковий терапевтичний засіб являє собою засіб для лікування, запобігання або профілактики запальних станів, аутоімунних захворювань, проліферативних захворювань, відторгнення при трансплантації, захворювань, пов'язаних з погіршенням поновлення хряща, вродженими вадами розвитку хряща, хвороби Кастлемана, множинної мієломи, псоріазу, саркоми Капоші і/або мезангіального проліферативного гломерулонефриту.
8. Фармацевтична композиція за п. 6, де додатковий терапевтичний засіб вибирають з аналгетиків, нестероїдних протизапальних засобів, стероїдів, синтетичних хвороба-модифікуючих протиревматичних лікарських засобів (DMARDs) і біологічних DMARDs.
9. Застосування сполуки за п. 1 для одержання лікарського засобу.
10. Застосування сполуки за п. 1 для одержання лікарського засобу для лікування, запобігання або профілактики запальних станів, аутоімунних захворювань, проліферативних захворювань, відторгнення при трансплантації, захворювань, пов'язаних з погіршенням поновлення хряща, вродженими вадами розвитку хряща, хвороби Кастлемана, множинної мієломи, псоріазу, саркоми Капоші і/або мезангіального проліферативного гломерулонефриту.
11. Застосування за п. 10, де запальний стан являє собою ревматоїдний артрит.
12. Застосування за п. 10, де запальний стан являє собою хворобу Крона і/або неспецифічний виразковий коліт.
13. Спосіб лікування, запобігання або профілактики запальних станів, аутоімунних захворювань, проліферативних захворювань, відторгнення при трансплантації, захворювань, пов'язаних з погіршенням поновлення хряща, вродженими вадами розвитку хряща, хвороби Кастлемана, множинної мієломи, псоріазу, саркоми Капоші і/або мезангіального проліферативиого гломерулонефриту, що включає введення кількості сполуки за п. 1, достатньої для впливу вказаного лікування, запобігання або профілактики.
14. Спосіб за п. 13, де запальний стан являє собою ревматоїдний артрит.
15. Спосіб за п. 13, де запальний стан являє собою хворобу Крона і/або неспецифічний виразковий коліт.
16. Спосіб за п. 13, де сполуку за п. 1 вводять в комбінації з іншим терапевтичним засобом.
17. Спосіб за п. 16, де додатковий терапевтичний засіб являє собою засіб для лікування, запобігання або профілактики запальних станів, аутоімунних захворювань, проліферативних захворювань, відторгнення при трансплантації, захворювань, пов'язаних з погіршенням поновлення хряща, вродженими вадами розвитку хряща, хвороби Кастлемана, множинної мієломи, псоріазу, саркоми Капоші і/або мезангіального проліферативного гломерулонефриту.
18. Спосіб за п. 16, де додатковий терапевтичний засіб вибирають з аналгетиків, нестероїдних протизапальних засобів, стероїдів, синтетичних хвороба-модифікуючих протиревматичних лікарських засобів (DMARDs) і біологічних DMARDs.
Текст
Реферат: Розкривають нову сполуку, здатну інгібувати JAK, і ця сполука може бути застосована у вигляді фармацевтичної композиції і може бути використана для запобігання і лікування цілого ряду станів у ссавців, в тому числі людей, включаючи, як необмежувальні приклади, запальні стани, аутоімунні захворювання, проліферативні захворювання, відторгнення при трансплантації, хвороби, пов'язані з погіршенням оновлення хряща, вродженими вадами розвитку хряща; і/або хвороби, пов'язані з гіперсекрецією IL-6. UA 107935 C2 (12) UA 107935 C2 N N NH N O N O S O . UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується сполуки, яка являє собою інгібітор JAK, сімейства тирозинкіназ, які залучені в патогенез запальних станів, аутоімунних захворювань, проліферативних захворювань, відторгнення при трансплантації, захворювань, пов'язаних з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і/або захворювань, пов'язаних з гіперсекрецією IL-6. Зокрема, сполука за даним винаходом інгібує JAK1 і JAK2. Крім того, даний винахід пропонує способи одержання сполуки за даним винаходом, фармацевтичні композиції, що містять сполуку за даним винаходом, способи запобігання і/або лікування захворювань, включаючи запальні стани, аутоімунні хвороби, проліферативні хвороби, відторгнення при трансплантації, хвороби, пов'язані з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і/або хвороби, пов'язані з гіперсекрецією IL-6, шляхом введення сполуки за даним винаходом. Janus-кінази (JAK) являють собою цитоплазматичні тирозинкінази, які грають ключову роль в передачі сигналів цитокінів від мембранних рецепторів до факторів транскрипції STAT. Описані чотири представники сімейства JAK, JAK1, JAK2, JAK3 і TYK2. Після зв’язування цитокіну з його рецептором представники сімейства JAK ауто- і/або трансфосфорилують один одного, з подальшим фосфорилуванням факторів транскрипції (STAT), які потім мігрують в ядра клітин, модулюючи транскрипцію. У внутрішньоклітинній сигнальній трансдукції JAK-STAT задіяні інтерферони, більшість інтерлейкінів, а також ряд цитокінів і ендокринних факторів, таких як EPO, TPO, GH, OSM, LIF, CNTF, GM-CSF і PRL (Vainchenker W. et al. (2008)). Дослідження комбінації генетичних моделей і інгібітору JAK, що має невелику молекулу, виявило терапевтичний потенціал деяких JAK. JAK3 атестована генетикою миші і людини як мішень для пригнічення імунітету (O'Shea J. et al. (2004)). Інгібітори JAK3 були успішно випробувані в клінічному розвитку деяких захворювань, спочатку у випадку відторгнення трансплантата органа і пізніше також при інших імунозапальних показаннях, таких як ревматоїдний артрит (RA), псоріаз і хвороба Крона (http://clinicaltrials.gov/). TYK2 являє собою потенційну мішень для імунозапальних захворювань, що підтверджено дослідженням з урахуванням генетики людини і дослідженням з використанням мишей-нокаутів (Levy D. and Loomis С. (2007)). JAK1 являє собою нову мішень в сфері імунозапальних захворювань. JAK1 утворює гетеродимер з іншими JAK, трансдукуючи цитокінстимульовану прозапальну передачу сигналу. Тому інгібування JAK1 і/або інших JAK, як очікують, може мати терапевтичну значущість для цілого ряду запальних станів, а також для інших захворювань, що стимулюються JAKопосередкованою сигнальною трансдукцією. Відомий рівень техніки Дегенерація хряща - відмітна ознака різних захворювань, серед яких найбільш відомі ревматоїдний артрит і остеоартрит. Ревматоїдний артрит (RA) являє собою хронічну дегенеративну хворобу суглобів, що характеризується запаленням і руйнуванням структур суглобів. Коли хвороба неконтрольована, вона веде до значної втрати працездатності і болю внаслідок втрати функції суглоба і навіть передчасної смерті. Мета лікування RA тому полягає не тільки в уповільненні перебігу хвороби, але і в досягненні стану ремісії для того, щоб припинити руйнування суглобів. Крім тяжкості наслідків захворювання, висока поширеність RA (~0,8% дорослих населення у всьому світі уражено цією хворобою) представляє велику соціально-економічну проблему (стосовно одержання інформації по RA, автори відсилають до Smolen and Steiner (2003); Lee and Weinblatt (2001); Choy and Panayi (2001); O'Dell (2004) and Firestein (2003)). Остеоартрит (також називаний OA або артрит, зумовлений виснажуванням або старінням) являє собою найбільш поширену форму артриту і характеризується втратою суглобового хряща, часто пов'язану з гіпертрофією кістки і болями (стосовно докладної інформації по остеоартриту, автори відсилають до Wieland et al. (2005)). Остеоартрит важко піддається лікуванню. На даний час не існує лікування, яке повністю б вилікувало це захворювання, і лікування, як правило, фокусується на ослабленні болю і запобіганні деформації ураженого суглоба. Звичайні лікування включають використання нестероїдних протизапальних лікарських засобів (NSAID). Незважаючи на те, що добавки до раціону, такі як хондроїтину і глюкозаміну сульфат, були рекомендовані як безпечні і ефективні можливі варіанти для лікування остеоартриту, останнє клінічне випробування виявило, що обидва лікування не знижують біль, пов'язаний з остеоартритом (Clegg et al., 2006). Стимулювання анаболічних процесів, блокування катаболічних процесів, або комбінація цих двох шляхів, може привести до стабілізації хряща і, можливо, навіть реверсії порушення, і, відповідно до цього, запобігти подальшому прогресуванню хвороби. Були розроблені 1 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапевтичні методи для корекції патологічних змін суглобового хряща, які з'являються під час остеоартритичного захворювання, але до цього часу жоден з них не зміг опосередкувати регенерацію суглобового хряща in situ і in vivo. Підсумовуючи вищевикладене, можна затверджувати, що на даний момент не існує придатних модифікуючих хворобу остеоартритичних лікарських засобів. Vandeghinste і ін. (WO 2005/124342) розкрили JAK1 як мішень, інгібування якої може мати терапевтичну значущість для деяких захворювань, включаючи OA. Нокаут гена JAK1 у мишей показав, що JAK1 грає суттєву і нерезервовану роль під час розвитку: JAK1 -/- миші гинули протягом 24 год. після народження і розвиток лімфоцитів серйозно сповільнювалося. Крім того, JAK1 -/- клітини виявилися нереактивними або менш реактивними відносно цитокінів, які використовують цитокінові рецептори класу II, цитокінових рецепторів, які використовують гамма-с субодиницю для передачі сигналу, і сімейства цитокінових рецепторів, які використовують субодиницю gp 130 для передачі сигналу (Rodig et al., 1998). У біології хондроцитів різні групи залучені до сигнального шляху JAK-STAT. Li et al. (2001) показали, що Онкостатин М індукує експресію генів MMP і TIMP3 в первинних хондроцитах шляхом активації JAK/STAT і MAPK сигнальних шляхів. Osaki et al. (2003) показали, що інтерферон-гамма-опосередковане інгібування колагену II в хондроцитах включає JAK-STAT сигнальний шлях. IL-1β індукує катаболізм хряща шляхом зниження експресії компонентів матриксу і шляхом індукування експресії колагенів і індукованої синтази оксиду азоту (NOS 2), яка опосередковує продукування оксиду азоту (NO). Otero et al., (2005) показали, що лептин і IL1β синергічно індукують продукування NO або експресію мРНК NOS2 в хондроцитах, і що це блокується інгібітором JAK. Legendre et al. (2003) показали, що IL-6/IL-6 рецептор індукує знижувальну регуляцію генів хрящ-специфічного матриксу, колагену II, появи ядра скостеніння і білка зв'язку в бичачих суглобових хондроцитах, і що це опосередковується JAK/STAT сигнальним шляхом. Таким чином, ці дані спостережень свідчать на користь ролі активності JAK-кіназ в гомеостазі хряща і терапевтичних можливостей інгібіторів JAK-кіназ. Представники сімейства виявилися залученими в патогенез додаткових станів, включаючи мієлопроліферативні порушення (O'Sullivan et al., 2007, Mol. Immunol. 44(10):2497-506), в яких були ідентифіковані мутації в JAK2. Це вказує на те, що інгібітори JAK, зокрема JAK2, можуть також знайти застосування в лікуванні мієлопроліферативних захворювань. Крім того, сімейство JAK, зокрема JAK1, JAK2 і JAK3, виявилося пов'язаним з видами раку, зокрема лейкозом, наприклад гострим мієлоїдним лейкозом (O'Sullivan et al., 2007, Mol. Immunol. 44(10):2497-506; Xiang et al., 2008, "Identification of somatic JAK1 mutations in patients with acute myeloid leukemia" Blood First Edition Paper, prepublished online December 26, 2007; DOI 10.1182/blood-2007-05090308) і гострим лімфобластним лейкозом (Mullighan et al., 2009) або солідними злоякісними пухлинами, наприклад лейоміосаркомою матки (Constantinescu et al., 2007, Trends in Biochemical Sciences 33(3): 122-131), раком передміхурової залози (Tam et al., 2007, British Journal of Cancer, 97, 378-383). Ці результати свідчать про те, що інгібітори JAK, зокрема JAK1 і/або JAK2, можуть також знайти застосування для лікування злоякісних новоутворень (лейкоз і солідні пухлини, наприклад лейоміосаркома матки, рак передміхурової залози). Крім того, хвороба Кастлемана, множинна мієлома, мезангіальний проліферативний гломерулонефрит, псоріаз і саркома Капоші, мабуть, зумовлені гіперсекрецією цитокіну IL-6, біологічні дії якого опосередковані внутрішньоклітинним JAK-STAT сигнальним шляхом (Tetsuji Naka, Norihiro Nishimoto and Tadamitsu Kishimoto, Arthritis Res 2002, 4 (suppl 3):S233-S242). Цей результат показує, що інгібітори JAK можуть також знайти застосування в лікуванні вищезгаданих захворювань. Терапії, що проводяться на даний час, не є достатніми і тому залишається необхідність в ідентифікації додаткових сполук, якіможна було б використовувати для лікування дегенеративних захворювань суглобів, наприклад остеоартриту, ревматоїдного артриту і остеопорозу, зокрема остеоартриту. Відповідно до цього даний винахід пропонує сполуку, способи її одержання і фармацевтичні композиції, що містить сполуку за даним винаходом разом з придатним фармацевтичним носієм. Крім того, даний винахід передбачає використання сполуки за даним винаходом для одержання лікарського засобу для лікування дегенеративних захворювань суглобів. Зокрема, даний винахід пропонує новий інгібітор JAK, який виявляє значно підвищену in vivo активність. Короткий виклад суті винаходу Даний винахід оснований на виявленні того факту, що сполука за даним винаходом здатна діяти як інгібітор JAK і її можна використовувати для лікування запальних станів, аутоімунних хвороб, проліферативних захворювань, відторгнення при трансплантації, хвороб, пов'язаних з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і/або хвороб, пов'язаних з 2 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 гіперсекрецією IL-6. У конкретному аспекті сполука являє собою інгібітор JAK1 і JAK2. Крім того, даний винахід пропонує способи одержання цієї сполуки, фармацевтичні композиції, що містять цю сполуку, і способи лікування запальних станів, аутоімунних хвороб, проліферативних захворювань, відторгнення при трансплантації, хвороб, пов'язаних з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і/або захворювань, пов'язаних з гіперсекрецією IL6, шляхом введення сполуки за даним винаходом. Відповідно до цього в першому аспекті пропонується сполука за даним винаходом, що має формулу (I): Сполука за даним винаходом являє собою новий інгібітор JAK, який, мабуть, має значно поліпшену in vivo активність в порівнянні зі структурно аналогічними сполуками. У конкретному варіанті сполука за даним винаходом являє собою інгібітор JAK1 і JAK2. Зокрема, вона, мабуть, демонструє вищезгадане підвищення в активності при більш низьких рівнях експозиції in vivo в порівнянні зі структурно аналогічними сполуками. Передбачають, що використання сполуки з вищезгаданими перевагами приведе до можливості застосування більш низьких доз (і, отже, поліпшеної схеми дозування лікарського засобу). У іншому аспекті даний винахід пропонує фармацевтичні композиції, які містять сполуку за даним винаходом і фармацевтичний носій, наповнювач або розріджувач. Крім того, сполука за даним винаходом, використовувана в фармацевтичних композиціях і способах лікування, розкритих в даному описі, є фармацевтично прийнятною в тому вигляді, як її одержують і використовують. У цьому аспекті даного винаходу фармацевтична композиція може додатково містити інші активні інгредієнти, придатні для використання в комбінації із сполукою за даним винаходом. У іншому аспекті даний винахід пропонує спосіб лікування ссавця, сприйнятливого до або ураженого станом з числа тих, які перераховані в даному контексті, і, зокрема, такого стану, який може бути пов'язаний з аберантною активністю JAK, наприклад запальні стани, аутоімунні хвороби, проліферативні захворювання, відторгнення при трансплантації, хвороби, пов'язані з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і хвороби, пов'язані з гіперсекрецією IL-6, і цей спосіб включає введення ефективної кількості фармацевтичної композиції або сполуки, розкритої в даному описі. У конкретному варіанті стан пов'язаний з аберантною активністю JAK1 і JAK2. У іншому аспекті пропонується сполука за даним винаходом для використання в лікуванні або запобіганні стану, вибраному зі станів, перерахованих в даному контексті, зокрема таких станів, які можуть бути пов'язані з аберантною активністю JAK, наприклад запальних станів, аутоімунних хвороб, проліферативних захворювань, відторгнення при трансплантації, хвороб, пов'язаних з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і захворювань, пов'язаних з гіперсекрецією IL-6. У черговому аспекті способу лікування цей винахід пропонує спосіб лікування ссавця, сприйнятливого до або ураженого станом, який причинно пов’язаний з аномальною активністю JAK, описаною в даному контексті, і включає введення кількості фармацевтичної композиції або сполуки за даним винаходом, ефективної для лікування або запобігання станам, перерахованим в даному описі. У конкретному аспекті стан причинно пов’язаний з аномальною активністю JAK1 і JAK2. У іншому аспекті пропонується сполука за даним винаходом для використання в лікуванні або профілактиці стану, який причинно пов’язаний з аномальною активністю JAK. У додаткових аспектах даний винахід пропонує способи синтезу сполуки за даним винаходом, причому репрезентативні протоколи і шляхи синтезу вказаної сполуки розкриваються нижче в даному описі. Таким чином, принципова мета даного винаходу полягає в розробці нової сполуки, яка може модифікувати активність JAK і тим самим запобігти або лікувати будь-які захворювання, які 3 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть бути причинно пов’язані з цим. У конкретному аспекті сполука за даним винаходом модулює активність JAK1 і JAK2. Інша мета даного винаходу полягає в розробці сполуки, яка може лікувати або пом'якшувати перебіг захворювань або ослабляти інтенсивність вияву їх симптомів, таких як запальні стани, аутоімунні хвороби, проліферативні захворювання, відторгнення при трансплантації, хвороби, пов'язані з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і захворювання, пов'язані з гіперсекрецією IL-6, які можуть бути причинно пов’язані з активністю JAK, зокрема JAK1 і JAK2. Наступною метою даного винаходу є розробка фармацевтичної композиції, яка може бути використана для лікування або запобігання різним патологічним станам, включаючи захворювання, пов'язані з активністю JAK, такі як запальні стани, аутоімунні хвороби, проліферативні захворювання, відторгнення при трансплантації, хвороби, пов'язані з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і захворювання, пов'язані з гіперсекрецією IL-6. У конкретному варіанті захворювання пов'язане з активністю JAK1 і JAK2. Інші цілі і переваги даного винаходу стають очевидними для фахівців в даній галузі техніки з розгляду нижченаведеного докладного опису. Докладний опис винаходу Визначення Мається на увазі, що нижченаведені терміни мають значення, представлені в даному контексті нижче, і їх використовують для досягнення більш повного розуміння суті опису і передбачуваного обсягу даного винаходу. При описі винаходу, який може включати сполуки, фармацевтичні композиції, що містять такі сполуки, і способи використання вищезгаданих сполук і композицій, нижченаведені терміни, якщо вони присутні, мають наступні значення, якщо не обумовлено інакше. Потрібно також мати на увазі, що при описі в даному контексті будь-яка з частин, визначених нижче, може бути заміщена різними замісниками, і що відповідні визначення, як передбачають, включають такі заміщені частини в межах їх обсягу, як представлено нижче. Якщо не обумовлено особливо, термін 'заміщений' потрібно визначати, як викладено нижче. Крім того, потрібно мати на увазі, що терміни 'групи' і 'радикали' при їх використанні в даному описі можуть розглядатися взаємозамінно. Використовуваний в даному контексті термін 'JAK' стосується сімейства Janus-кіназ (JAK), що являють собою цитоплазматичні тирозинкінази, які грають ключову роль в передачі сигналів цитокінів від мембранних рецепторів до транскрипційних факторів STAT. Описані чотири представники сімейства JAK, JAK1, JAK2, JAK3 і TYK2, і термін 'JAK' може стосуватися всіх представників сімейства JAK, в збірному значенні, або одного або більшого числа представників сімейства JAK, залежно від того, як указано в контексті. 'Фармацевтично прийнятний' означає затверджений або схвалений регулюючим органом Федерального уряду або уряду штату або відповідного відомства в країнах, крім США, або який знаходиться в переліку Фармакопеї США або іншій загальновідомій фармакопеї для використання для тварин і, зокрема, для людей. 'Фармацевтично прийнятна сіль' стосується солі сполуки за даним винаходом, яка є фармацевтично прийнятною і яка має бажану фармакологічну активність вихідної сполуки. Зокрема, такі солі є нетоксичними і можуть являти собою неорганічні або органічні кислотноадитивні солі і основно-адитивні солі. Конкретно, такі солі включають (1) адитивні солі кислоти, утворені з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і т. п.; або утворені з органічними кислотами, такими як оцтова кислота, пропіонова кислота, гексанова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, малонова кислота, янтарна кислота, яблучна кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, 3-(4-гідроксибензоїл)бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, 4хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, 4-толуолсульфокислота, камфорсульфокислота, 4-метилбіцикло[2.2.2]-окт-2-ен-1-карбонова кислота, глюкогептонова кислота, 3-фенілпропіонова кислота, триметилоцтова кислота, трет-бутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота і т. п.; або (2) солі, утворені в тих випадках, коли кислий протон присутній у вихідній сполуці або заміщений на іон металу, наприклад іон лужного металу, іон лужноземельного металу або іон алюмінію; або координує з органічною основою, такою як етаноламін, діетаноламін, триетаноламін, N-метіоглюкамін і т. п. 4 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, солі включають, як приклад, натрій, калій, кальцій, магній, амоній, тетраалкіламоній і т. п.; і, в тих випадках, коли сполука містить основну функціональність, солі нетоксичних органічних або неорганічних кислот, такі як гідрохлорид, гідробромід, тартрат, мезилат, ацетат, малеат, оксалат і т. п. Термін 'Фармацевтично прийнятний катіон' стосується прийнятного катіонного протиіона кислої функціональної групи. Прикладами таких катіонів є катіони натрію, калію, кальцію, магнію, амонію, тетраалкіламонію і т. п. 'Фармацевтично прийнятний наповнювач' стосується розріджувача, ад’юванту, наповнювача або носія, з яким вводять сполуку за даним винаходом. 'Сольват' стосується форм сполуки, в яких сполука зв'язана з розчинником, звичайно за допомогою реакції сольволізу. Цей фізичний зв'язок включає водневий зв'язок. Звичайні розчинники включають воду, етанол, оцтову кислоту і т. п. Сполуку за даним винаходом можна одержати, наприклад, в кристалічній формі, і вона може знаходитися в сольватованій або гідратній формі. Придатні сольвати включають фармацевтично прийнятні сольвати, такі як гідрати, і, крім того, включають як стехіометричні сольвати, так і нестехіометричні сольвати. У деяких випадках сольват може бути виділений у вільному стані, наприклад, коли одна або декілька молекул розчинника включені в кристалічну решітку кристалічної твердої речовини. 'Сольват' охоплює як сольвати в рідкій фазі, так і сольвати, що піддаються виділенню. Репрезентативні сольвати включають гідрати, етанолати і метанолати. 'Суб'єкт' включає людей. Терміни 'людина', 'пацієнт' і 'суб'єкт' використовують в даному контексті взаємозамінно. 'Терапевтично ефективна кількість' має на увазі кількість сполуки, яка при введенні суб'єкту для лікування захворювання виявляється достатньою для впливу такого лікування на таке захворювання. 'Терапевтично ефективна кількість' може варіюватися залежно від сполуки, захворювання і його ступенів тяжкості і віку, маси тіла і т. д. суб'єкта, що підлягає лікуванню. 'Запобігання' або 'профілактика' стосується зниження ризику набуття або розвитку хвороби або порушення (тобто запобігання розвитку щонайменше одного з клінічних симптомів захворювання у суб'єкта, який може бути підданий впливу засобу, що викликає хворобу, або схильний до хвороби до її виникнення). Термін 'профілактика' стосується 'запобігання' і стосується заходу або способу, мета якого полягає в запобіганні, а не лікуванні або вилікуванні захворювання. Необмежувальні приклади профілактичних заходів можуть включати введення вакцин; введення низькомолекулярного гепарину госпіталізованим хворим з підвищеним ризиком виникнення тромбозу внаслідок, наприклад, знерухомлювання; і введення протималярійного засобу, такого як хлорохін, перед візитом в географічний регіон, для якого малярія ендемічна, або де високий ризик контакту з малярією. 'Лікування' або 'терапія' якого-небудь захворювання або порушення стосується, в одному варіанті, поліпшення перебігу хвороби або порушення (тобто усунення клінічних виявів захворювання або зниження маніфестації, ступеня або тяжкості щонайменше одного з клінічних симптомів хвороби). У іншому варіанті 'лікування' або 'терапія' стосується поліпшення щонайменше одного фізичного параметра, який може бути неявним для суб'єкта. У черговому варіанті 'лікування' або 'терапія' стосується модулювання захворювання або порушення або фізично (наприклад, стабілізація помітного симптому), або фізіологічно (наприклад, стабілізація фізичного параметра), або і фізично, і фізіологічно. У іншому варіанті 'лікування' або 'терапія' стосується гальмування прогресування хвороби. Використовуваний в даному описі термін 'запальний стан(и)' стосується групи станів, включаючи ревматоїдний артрит, остеоартрит, ювенільний ідіопатичний артрит, псоріаз, алергічну хворобу дихальних шляхів (наприклад, астма, риніт), запальні захворювання кишечнику (наприклад, хвороба Крона, коліт), ендотоксин-стимульовані патологічні стани (наприклад, ускладнення після операції обхідного шунтування або хронічні ендотоксинові стани, сприяючі, наприклад, розвитку хронічної серцевої недостатності) і споріднені хвороби, що зачіпають хрящ, такі як хвороба суглобів. Зокрема, цей термін стосується ревматоїдного артриту, остеоартриту, алергічної хвороби дихальних шляхів (наприклад, астма) і запальних хвороб кишечнику. Використовуваний в даному описі термін 'аутоімунна хвороба(и)' стосується групи захворювань, включаючи непрохідність дихальних шляхів, включаючи стани, такі як COPD (хронічне обструктивне захворювання легень), астма (наприклад, спадкова бронхіальна астма, набута бронхіальна астма, індукована пилом астма, інфантильна астма), зокрема хронічна або важковиліковна [запущена] астма (наприклад, пізня астма і гіперчутливість дихальних шляхів), бронхіт, включаючи бронхіальну астму, системний червоний вовчак (SLE), розсіяний склероз, цукровий діабет 1 типу і ускладнення, пов'язані з ним, дифузний нейродерматит (атопічний 5 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 дерматит), контактний дерматит і додатковий екзематозний дерматит, запальна хвороба кишечнику (наприклад, хвороба Крона і неспецифічний виразковий коліт), атеросклероз і бічний аміотрофічний склероз. Зокрема, термін стосується COPD, астми, системного червоного вовчака, цукрового діабету I типу і запальної хвороби кишечнику. Використовуваний в даному описі термін 'проліферативна хвороба(и)' стосується станів, таких як рак (наприклад, лейоміосаркома матки або рак передміхурової залози), мієлопроліферативні порушення (наприклад, хвороба Вакеза, есенційний тромбоцитоз і мієлофіброз), лейкоз (наприклад, гострий мієлоїдний лейкоз і гострий лімфобластний лейкоз), множинна мієлома, псоріаз, рестеноз, склеродерматит або фіброз. Зокрема, термін стосується раку, лейкозу, множинної мієломи і псоріазу. Як використано в даному описі, термін 'рак' стосується злоякісного і доброякісного росту клітин в шкірі і органах тіла, наприклад, але ними не обмежуючись, молочна залоза, передміхурова заліза, легеня, нирка, підшлункова залоза, шлунок або кишечник. Рак має тенденцію до інфільтрації в сусідні тканини і поширення (метастазування) до віддалених органів, наприклад в кісткову тканину, печінку, легеню і головний мозок. Використовуваний в даному описі термін 'рак' включає як метастатичні типи пухлинних клітин, такі як, але не обмежуючись ними, меланома, лімфома, лейкемія, фібросаркома, рабдоміосаркома і мастоцитома, так і типи тканинної карциноми, такі як, але ними не обмежуючись, колоректальний рак, рак простати, дрібноклітинний рак легень і недрібноклітинний рак легень, рак молочної залози, рак підшлункової залози, рак сечового міхура, рак нирки, рак шлунка, гліобластома, первинний рак печінки, рак яєчника, рак простати і лейоміосаркома матки. Використовується в даному описі термін 'лейкоз' стосується неопластичних захворювань крові і кровоутворювальних органів. Такі хвороби можуть викликати порушення функції кісткового мозку і імунної системи, що приводить хазяїна в стан високої чутливості до інфекції і кровотечі. Зокрема, термін 'лейкоз' стосується гострого мієлоїдного лейкозу (AML) і гострого лімфобластного лейкозу (ALL). Використовуваний в даному описі термін 'відторгнення транспланата' стосується гострого або хронічного відторгнення клітин, ало- або ксенотрансплантатів тканини або твердих органів, наприклад острівців Лангерганса, стовбурових клітин, кісткового мозку, шкіри, м'яза, корнеальної тканини, нейронної тканини, серця, легені, комбінованого комплексу серця-легені, нирки, печінки, кишки, підшлункової залози, трахеї або стравоходу, або реакцій "трансплантатпроти-хазяїна". Використовуваний в даному описі термін 'хвороби, включаючи погіршення оновлення хряща', включає стани, такі як остеоартрит, псоріатичний артрит, ювенільний ревматоїдний артрит, подагричний артрит, септичний або інфекційний неспецифічний артрит, реактивний артрит, симпатична рефлекторна дистрофія, альгодистрофія, синдром Тітце або дистрофія ребер, фіброміалгія, остеохондрит, нейрогенний або нейропатичний артрит, захворювання суглобів, ендемічні форми артриту, подібні деформуючому ендемічному остеоартриту, хвороба Mseleni і хвороба Handigodu; дегенерацію, що є результатом фіброміалгії, системний червоний вовчак, склеродермію і анкілозуючий спондилоартрит. Використовуваний в даному описі термін 'вроджена вада(и) розвитку хряща' включає стани, такі як спадковий хондроліз, хондродисплазії і псевдохондродисплазії, зокрема, але ними не обмежуючись, мікротію, анотію, метафізарну хондродисплазію і споріднені порушення. Використовуваний в даному описі термін 'хвороба(и), пов'язана з гіперсекрецією IL-6', включає стани, такі як хвороба Кастлемана, множинна мієлома, псоріаз, саркома Капоші і/або мезангіальний проліферативний гломерулонефрит. 'Сполука за даним винаходом' і еквівалентні вирази, як мається на увазі, охоплюють сполуку Формули, описаної вище, і цей вираз включає фармацевтично прийнятні солі і сольвати, наприклад гідрати, і сольвати фармацевтично прийнятних солей, де контекст це допускає. Аналогічно, посилання на проміжні продукти, незалежно від того, заявляються вони, як такі, чи ні, як вважають, охоплює їх солі і сольвати, якщо контекст це допускає. Інші похідні сполуки за даним винаходом мають активність як в їх кислотній формі, так і в формі кислотної похідної, однак кислотна форма часто має переваги в розчинності, тканинній сумісності або уповільненому вивільненні в організмі ссавця (див., Bundgard Н., Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Як використано в даному описі, термін 'ізотопічний варіант' стосується сполуки, яка містить неприродні пропорції ізотопів при одному або декількох атомах, які складають таку сполуку. Наприклад, 'ізотопічний варіант' сполуки може містити один або декілька нерадіоактивних 2 13 15 ізотопів, таких як, наприклад, дейтерій ( H або D), вуглець-13 ( C), азот-15 ( N) або т. п. Повинно бути очевидно, що в сполуці, в якій зроблене таке ізотопне заміщення, наступні атоми, 6 UA 107935 C2 2 5 10 15 20 25 30 35 40 45 50 якщо присутні, можуть мінятися, так що, наприклад, будь-який водень може являти собою H/D, 13 15 будь-який вуглець може бути C або будь-який азот може бути N, і що присутність і розташування таких атомів може бути визначена в рамках знання даної галузі техніки. Аналогічно, винахід може включати одержання ізотопічних варіантів з радіоактивними ізотопами, у випадку, наприклад, коли одержані сполуки можуть бути використані для досліджень розподілу лікарського засобу і/або субстрату в тканині. Для цієї мети, зокрема, 3 14 використовують радіоактивні ізотопи, тритій, тобто H, і вуглець-14, тобто C, беручи до уваги легкість їх включення і наявні засоби їх детектування. Крім того, можна одержати сполуки, які 11 18 15 13 заміщені позитронвипромінюючими ізотопами, такими як C, F, О і N, і вони можуть бути використані в дослідженнях методом позитрон-емісійної томографії (PET) міри зайнятості [заповненості] рецепторів субстрату. Всі ізотопічні варіанти сполуки, представлені в даному описі, незалежно від того, радіоактивні вони чи ні, як передбачають, охоплюються обсягом даного винаходу. 'Таутомери' стосуються сполук, які являють собою взаємозамінні форми структури конкретної сполуки і які відрізняються розташуванням водневих атомів і електронів. Таким чином, дві структури можуть знаходитися в рівновазі завдяки переміщенню -електронів і атома (звичайно Н). Наприклад, еноли і кетони є таутомерами, оскільки вони швидко взаємоперетворюються при обробці або кислотою, або основою. Іншим прикладом таутомерії є аци- і нітроформи фенілнітрометану, які подібним чином утворюються при обробці кислотою або основою. Таутомерні форми можуть бути релевантні в досягненні оптимальної хімічної реакційної здатності і біологічної активності сполуки, що представляє інтерес. Сполука Даний винахід оснований на виявленні того, що сполука за даним винаходом являє собою інгібітор JAK і вона є корисною для лікування запальних захворювань, аутоімунних хвороб, проліферативних захворювань, відторгнення трансплантата, захворювань, пов'язаних з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і хвороб, пов'язаних з гіперсекрецією IL-6. Крім того, даний винахід пропонує способи одержання сполуки за даним винаходом, фармацевтичних композицій, що містять сполуку за даним винаходом, і способи лікування запальних станів, аутоімунних хвороб, проліферативних захворювань, відторгнення трансплантата, хвороб, пов'язаних з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і захворювань, пов'язаних з гіперсекрецією IL-6, шляхом введення сполуки за даним винаходом. У конкретному варіанті сполука за даним винаходом являє собою інгібітор JAK1 і JAK2. Таким чином, в першому аспекті даного винаходу розкривають сполуку, що має формулу (I): У одному варіанті сполука за даним винаходом являє собою неізотопічний варіант. Сполука за даним винаходом являє собою новий інгібітор JAK. Зокрема, сполука являє собою сильнодіючий інгібітор JAK1 і JAK2, однак, ця сполука все ж також інгібує TYK2 і JAK3, але з більш низькою активністю. Сполука за даним винаходом виявляє значно поліпшену активність in vivo. Ці поліпшення реально і несподівано виявляються навіть в порівнянні зі структурно аналогічними сполуками. Використання сполуки з такими перевагами може привести до можливості застосування більш низьких доз (і, отже, поліпшеної схеми дозування лікарського засобу). Фармацевтичні композиції При використанні як фармацевтичного препарату сполуку за даним винаходом звичайно вводять в формі фармацевтичної композиції. Такі композиції можуть бути одержані способом, добре відомим в фармацевтичній галузі, і вони містять щонайменше одну активну сполуку. Як правило, сполуку за даним винаходом вводять в фармацевтично ефективній кількості. Кількість сполуки, що вводиться, звичайно визначається лікарем з урахуванням відповідних обставин, включаючи стан, що підлягає лікуванню, вибраний шлях введення, сполуку, що реально 7 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 вводиться, вік, масу тіла і реакцію конкретного пацієнта, ступінь тяжкості симптомів хвороби у пацієнта і т. п. Фармацевтичні композиції за даним винаходом можуть вводитися різними шляхами, включаючи пероральний, ректальний, трансдермальний, підшкірний, внутрішньосуглобовий, внутрішньовенний, внутрішньом'язовий і інтраназальний. Залежно від передбачуваного шляху доставки сполуку за даним винаходом переважно одержують або у вигляді ін’єктованих композицій, або у вигляді композицій, призначених для перорального введення, або у вигляді цілющих мазей, у вигляді лосьйонів, або у вигляді пластирів, всі у випадку трансдермального застосування. Композиції для перорального введення можуть мати форму розчинів або суспензій рідкого продукту, що зберігаються в посудинах, або сипучих порошків. У більшості випадків, однак, композиції представлені в стандартних лікарських формах для полегшення точності дозування. Термін 'стандартні лікарські форми' стосується фізично дискретних одиниць, придатних для введення у вигляді стандартних доз для людей і інших ссавців, при цьому кожна одиниця містить попередньо встановлену кількість активної сполуки, яка згідно з розрахунком забезпечує вияв бажаної терапевтичної дії, в поєднанні з придатним фармацевтичним носієм. Типові стандартні лікарські форми включають ампули або шприци, попередньо заповнені попередньо виміряною кількістю рідких композицій, або пілюлі, таблетки, капсули або т. п. у випадку твердих композицій. У таких композиціях сполука за даним винаходом являє собою другорядний компонент (від близько 0,1 до близько 50% мас. або переважно від близько 1 до близько 40% мас.), при цьому частину, що залишилася, представляють різні наповнювачі або носії і допоміжні добавки, корисні для формоутворення бажаних лікарських форм. Рідкі форми, придатні для перорального введення, можуть містити придатний водний або неводний наповнювач нарівні з буферами, суспендуючими і диспергуючими засобами, барвниками, коригентами і т. п. Тверді форми можуть містити, наприклад, будь-який з нижченаведених інгредієнтів або сполуки подібної природи: зв'язуюче, таке як мікрокристалічна целюлоза, трагакантова камедь або желатин; наповнювач, такий як крохмаль або лактоза, дезінтегруючий засіб, такий як альгінова кислота, Прімогель, або кукурудзяний крохмаль, мастильну речовину, таку як стеарат магнію; глідант, такий колоїдний діоксид кремнію; підсолоджувальну речовину, таку як сахароза або сахарин; або ароматизуючу речовину, таку як м'ята перцева, метилсаліцилат або віддушка апельсина. Композиції, призначені для ін'єкції, звичайно основані на придатному для ін’єктування стерильному фізіологічному розчині або забуференому фосфатом фізіологічному розчині або інших придатних для ін'єкції носіях, відомих в даній галузі. Як і раніше, активна сполука в таких композиціях є звичайно другорядним компонентом, який часто знаходиться в кількості в діапазоні від близько 0,05 до 10% мас., при цьому частина, що залишилася, являє собою придатний для ін’єктування носій і т. п. Трансдермальні композиції звичайно одержують у вигляді мазі або крему для місцевого нанесення, що містить активний інгредієнт(и), звичайно в кількості, починаючи від близько 0,01 і закінчуючи близько 20% мас., переважно від близько 0,1 до близько 20% мас., переважно від близько 0,1 до близько 10% мас. і більш переважно від близько 0,5 до близько 15% мас. При приготуванні у вигляді мазі активні інгредієнти звичайно змішують з або парафіновою мазевою основою, або водорозчинною мазевою основою. Альтернативно, активні інгредієнти можуть бути введені до складу крему разом з, наприклад, кремовою основою типу "масло-у-воді". Такі трансдермальні фармацевтичні композиції добре відомі в даній галузі і звичайно включають додаткові інгредієнти, що забезпечують підвищену проникність через шкіру активних інгредієнтів і стабільність активних інгредієнтів або фармацевтичної композиції. Всі вищезгадані відомі трансдермальні фармацевтичні композиції і інгредієнти не виходять за рамки обсягу даного винаходу. Сполука за даним винаходом може також вводитися за допомогою трансдермального пристрою. Згідно з цим трансдермальне введення може бути здійснене з використанням пластиру або резервуарного типу, або типу пористої мембрани, або різновиду твердого матриксу. Вищеописані компоненти для композицій, що вводяться перорально, ін’єктуються або вводяться місцево, носять тільки репрезентативний характер. Інші матеріали, а також технології приготування і т. п. наведені в Part 8 of Remington's Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, зміст якої включений в даний опис у вигляді посилання. Крім того, сполука за даним винаходом може вводитися в формах уповільненого вивільнення лікарського засобу або з використанням системи доставки лікарського засобу 8 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 пролонгованої дії. Опис репрезентативних матеріалів, що забезпечують пролонговане вивільнення лікарського засобу, можна знайти в Remington's Pharmaceutical Sciences. Нижченаведені приклади фармацевтичних композицій ілюструють репрезентативні фармацевтичні композиції, які можна одержати відповідно до даного винаходу. Даний винахід, однак, не обмежується наведеними нижче фармацевтичними композиціями. Фармацевтична композиція 1 - таблетки Сполука за даним винаходом може бути змішана у вигляді сухого порошку зі зв'язуючим, сухим желатином, при масовому співвідношенні приблизно 1:2. Як мастильна речовина може бути додана незначна кількість стеарату магнію. Можна надати суміші форму таблетки масою 240-270 мг (80-90 мг активної амідної сполуки на таблетку) в таблетувальному пресі. Фармацевтична композиція 2 - капсули Сполука за даним винаходом може бути змішана у вигляді сухого порошку з розріджувачем, крохмалем, при масовому співвідношенні приблизно 1:1. Суміш може бути заповнена в 250-мг капсули (125 мг активної амідної сполуки на капсулу). Фармацевтична композиція 3 - рідина Сполука за даним винаходом (125 мг) може бути змішана з сахарозою (1,75 г) і ксантановою камеддю (4 мг), і одержана суміш може бути піддана змішуванню, пропусканню через сито з розміром отворів 10 меш США і потім змішана із попередньо приготованим розчином мікрокристалічної целюлози і натрійкарбоксиметилцелюлози (11:89, 50 мг) у воді. Бензоат натрію (10 мг), ароматизатор і барвник можуть бути розбавлені водою і додані в суміш при перемішуванні. Потім для одержання загального об'єму 5 мл при перемішуванні може бути додана необхідна для цього кількість води. Фармацевтична композиція 4 - таблетки Сполука за даним винаходом може бути змішана у вигляді сухого порошку зі зв'язуючим, сухим желатином, при масовому співвідношенні приблизно 1:2. Як мастильна речовина може бути додана незначна кількість стеарату магнію. Можна надати суміші форму таблетки масою 490-900 мг (150-300 мг активної амідної сполуки) в таблетувальному пресі. Фармацевтична композиція 5 - ін'єкція Сполука за даним винаходом може бути розчинена або суспендована в ін’єктованому водному середовищі, забуференому стерильному фізіологічному розчині, з одержанням концентрації приблизно 5 мг/мл. Фармацевтична композиція 6 - для місцевого нанесення Стеариловий спирт (250 г) і медичний вазелін (250 г) можуть бути розплавлені при температурі близько 75°С і потім в одержаний розплав може бути додана суміш сполуки за даним винаходом (50 г), метилпарабену (0,25 г), пропілпарабену (0,15 г), лаурилсульфату натрію (10 г) і пропіленгліколю (120 г), розчинена у воді (близько 370 г), і одержана суміш може бути піддана перемішуванню до її повного застигання. Способи лікування Сполуки за даним винаходом можуть бути використані як терапевтичний засіб для лікування станів у ссавців, які причинно пов’язані з або можуть бути приписані аберантній активності JAK, зокрема стани, пов'язані з відхиленою від норми активністю JAK1 і/або JAK2. Відповідно до цього, сполука і фармацевтичні композиції за даним винаходом знаходять застосування як терапевтичні засоби для запобігання і/або лікування запальних станів, аутоімунних хвороб, проліферативних захворювань, відторгнення трансплантата, захворювань, пов'язаних з погіршенням оновлення хряща, вродженими вадами розвитку хряща, і хвороб, пов'язаних з гіперсекрецією 1L6 у ссавців, включаючи людей. У додатковому аспекті способів лікування цей винахід пропонує способи лікування ссавця, сприйнятливого до або ураженого запальним захворюванням. Способи включають введення ефективної кількості однієї або декількох з фармацевтичних композицій або сполуки за даним винаходом для лікування або запобігання станам, описаним в даному контексті. У конкретному варіанті запальний стан вибраний з ревматоїдного артриту, остеоартриту, алергічного захворювання дихальних шляхів (наприклад, астма) і запальних захворювань кишечнику. У іншому аспекті даний винахід пропонує сполуку для використання в лікуванні, запобіганні або профілактиці запального стану. У конкретному варіанті запальний стан вибраний з ревматоїдного артриту, остеоартриту, алергічної хвороби дихальних шляхів (наприклад, астма) і запальних захворювань кишечнику. У додатковому аспекті способів лікування даний винахід пропонує способи лікування ссавця, сприйнятливого до або ураженого аутоімунною хворобою. Способи включають введення ефективної кількості однієї або декількох з фармацевтичних композицій або сполуки за даним винаходом для лікування або запобігання станам, описаним в даному контексті. У 9 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 конкретному варіанті аутоімунна хвороба вибрана з COPD (хронічне обструктивне захворювання легень), астми, системного червоного вовчака, цукрового діабету I типу і запальної хвороби кишечнику. У іншому аспекті даний винахід пропонує сполуку для використання в лікуванні, запобіганні або профілактиці аутоімунної хвороби. У конкретному варіанті аутоімунне захворювання вибране з COPD, астми, системного червоного вовчака, цукрового діабету I типу і запального захворювання кишечнику. У іншому аспекті способів лікування даний винахід пропонує способи лікування ссавця, сприйнятливого до або ураженого проліферативним захворюванням, зокрема раком (наприклад, солідні пухлини, такі як лейоміосаркома матки або рак передміхурової залози), лейкозом (наприклад, AML або ALL), множинною мієломою і/або псоріазом. У іншому аспекті даний винахід пропонує сполуку для використання в лікуванні, запобіганні і профілактиці проліферативної хвороби, зокрема раку (наприклад, солідні пухлини, такі як лейоміосаркома матки або рак передміхурової залози), лейкозу (наприклад, AML або ALL), множинної мієломи і/або псоріазу. У іншому аспекті способів лікування даний винахід пропонує способи лікування ссавця, сприйнятливого до або ураженого хворобою відторгнення трансплантата. У конкретному варіанті даний винахід пропонує способи лікування відторгнення трансплантата. У іншому аспекті даний винахід пропонує сполуку для використання в лікуванні, запобіганні або профілактиці відторгнення трансплантата. У конкретному варіанті даний винахід пропонує способи лікування відторгнення трансплантата органа. У іншому аспекті способів лікування даний винахід пропонує спосіб лікування, запобігання або профілактики у ссавця, сприйнятливого до або ураженого хворобами, пов'язаними з погіршенням оновлення хряща, і цей спосіб включає введення терапевтично ефективної кількості сполуки за даним винаходом або однієї або декількох з фармацевтичних композицій, розкритих в даному описі. У іншому аспекті даний винахід пропонує сполуку для використання в лікуванні, запобіганні і профілактиці захворювань, пов'язаних з погіршенням оновлення хряща. Крім того, даний винахід пропонує спосіб лікування вроджених вад розвитку хряща, і цей спосіб включає введення ефективної кількості однієї або декількох з фармацевтичних композицій або сполуки, розкритих в даному описі. У іншому аспекті даний винахід пропонує сполуку для використання в лікуванні, запобіганні або профілактиці вроджених вад розвитку хряща. У іншому аспекті способів лікування даний винахід пропонує способи лікування ссавця, сприйнятливого до або ураженого захворюваннями, пов'язаними з гіперсекрецією IL-6, зокрема хворобою Кастлемана або мезангіальним прліферативним гломерулонефритом. У іншому аспекті даний винахід пропонує сполуку для використання в лікуванні, запобіганні або профілактиці захворювань, пов'язаних з гіперсекрецією IL-6, зокрема хвороби Кастлемана або мезангіального проліферативного гломерулонефриту. Як додатковий аспект даного винаходу пропонується сполука за даним винаходом для використання як фармацевтичного препарату, головним чином, для лікування або запобігання вищезазначеним станам і хворобам. Крім того, в даному описі пропонується застосування сполук за даним винаходом для одержання лікарського засобу для лікування або запобігання одному з вищезазначених станів і хвороб. Конкретна схема здійснення способу за даним винаходом включає введення суб'єкту, страждаючому захворюванням, пов'язаним із запаленням, ефективної кількості сполуки за даним винаходом протягом періоду часу, достатнього для зниження рівня запалення у суб'єкта і переважно усунення процесів, відповідальних за вказане запалення. Окремий варіант способу включає введення ефективної кількості сполуки за даним винаходом пацієнту, страждаючому або сприйнятливому до розвитку ревматоїдного артриту, протягом періоду часу, достатнього для зниження або запобігання, відповідно, запалення на суглобах вказаного пацієнта і переважно усунення процесів, відповідальних за вказане запалення. Додаткова конкретна схема здійснення даного способу включає введення суб'єкту, страждаючому патологічним станом, що характеризується деградацією хряща або суглобів (наприклад, ревматоїдний артрит і/або остеоартрит), ефективної кількості сполуки за даним винаходом протягом періоду часу, достатнього для зниження або переважно купірування самовідтворюваних процесів, відповідальних за вказану деградацію. Конкретний варіант способу включає введення ефективної кількості сполуки за даним винаходом пацієнту, страждаючому або сприйнятливому до розвитку остеоартриту, протягом періоду часу, достатнього для зниження або запобігання, відповідно, деградації хряща в суглобах вказаного 10 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнта і переважно купірування самовідтворюваних процесів, відповідальних за вказану деградацію. У конкретному варіанті вказана сполука може виявляти анаболічні і/або протикатаболічні властивості відносно хряща. Рівні ін'єкційних доз коливаються від близько 0,1 мг/кг/год. до щонайменше 10 мг/кг/год., всі протягом від близько 1 до близько 120 годин і переважно від 24 до 96 годин. Для досягнення адекватних рівнів стійкого стану може бути також введений болюс з попереднім навантаженням від близько 0,1 мг/кг до близько 10 мг/кг або більше. Максимальна сумарна доза, як передбачають, не перевищує близько 2 г/день для пацієнта-людини з масою тіла від 40 до 80 кг. Для запобігання і/або лікування тривало існуючих станів, таких як дегенеративні стани, схема лікування звичайно розтягується до декількох місяців або років, і тому для зручності і толерантності пацієнта в цьому випадку переважним є пероральне дозування. При пероральному дозуванні репрезентативні схеми прийому лікарського засобу включають щоденний прийом всередину від однієї до п'яти, переважно від двох до чотирьох і типово трьох доз. Використовуючи ці схеми дозування, кожна доза забезпечує від близько 0,01 до близько 20 мг/кг сполуки за даним винаходом, при цьому окремі дози, кожна, забезпечують від близько 0,1 до близько 10 мг/кг і переважно від близько 1 до близько 5 мг/кг. Трансдермальні дози звичайно вибирають таким чином, щоб вони забезпечували рівні в крові, які аналогічні або нижче рівнів, що досягаються при використанні ін'єкційних доз. При використанні для запобігання виникненню запального стану сполуку за даним винаходом вводять пацієнту з підвищеним ризиком розвитку такого стану, як правило, за порадою і під наглядом лікаря, при рівнях доз, описаних вище. Пацієнти з підвищеним ризиком розвитку конкретного стану звичайно включають пацієнтів, які мають сімейний анамнез стану, або пацієнтів, які були ідентифіковані згідно з генетичним тестуванням і скринінгом як такі, що мають сприйнятливість до розвитку вказаного стану. Сполуку за даним винаходом можна вводити у вигляді єдиного активного засобу або її можна вводити в комбінації з іншими терапевтичними засобами, включаючи інші сполуки, які виявляють таку ж або аналогічну терапевтичну активність і які визначені як безпечні і ефективні для такого комбінованого введення. У конкретному варіанті спільне введення двох (або більшого числа) засобів передбачає використання значно більш низьких доз кожного з засобів, тим самим знижуючи вияв побічних дій. У одному варіанті сполукуза даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання хворобі, пов'язаній із запаленням, конкретні засоби включають, але не обмежуючись ними, імунорегулятори (наприклад азатіоприн), кортикостероїди (наприклад, преднізолон або дексаметазон), циклофосфамід, циклоспорин А, такролімус, мікофеноляту мофетил, муромонаб-CD3 (OKT3, наприклад, Orthocolone®), ATG, аспірин, ацетамінофен, ібупрофен, напроксен і піроксикам. У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання артриту (наприклад, ревматоїдний артрит), конкретні засоби включають, але не обмежуючись ними, аналгетики, нестероїдні протизапальні засоби (NSAIDS), стероїди, синтетичні DMARDS (наприклад, але без обмеження, метотрексат, лефлуномід, сульфасалазин, ауранофін, натрію ауротіомалат, пеніциламін, хлорохін, гідроксихлорохін, азатіоприн, і циклоспорин) і біологічні DMARDS (наприклад, але без обмеження, Інфліксимаб, Етанерцепт, Адалімумаб, Ритуксимаб і Абатацепт). У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання проліферативним розладам, конкретні засоби включають, але без обмеження, метотрексат, лейковорин, адріаміцин, пренізон, блеоміцин, циклофосфамід, 5-фторурацил, паклітаксел, доцетаксел, вінкристин, вінбластин, вінорелбін, доксорубіцин, тамоксифен, тореміфен, мегестролу ацетат, анастрозол, госерелін, моноклональне антитіло проти HER2 (наприклад, Herceptin™), капецитабін, ралоксифену гідрохлорид, інгібітори EGFR (наприклад, Iressa®, Tarceva™, Erbitux™), інгібітори VEGF (наприклад, Avastin™), інгібітори протеасоми (наприклад, Velcade™), Glivec® і інгібітори hsp90 (наприклад, 17-AAG). Крім того, сполуку за даним винаходом можна вводити в комбінації з іншими лікуваннями, включаючи, але без обмеження, променеву терапію або хірургічне втручання. У конкретному варіанті проліферативне порушення вибране із злоякісного новоутворення, мієлопроліферативного захворювання або лейкозу. У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання аутоімунним захворюванням, конкретні засоби включають, але без обмеження, глюкокортикоїди, цитостатичні засоби (наприклад, аналоги пурину), алкілувальні засоби (наприклад, азотисті похідні іприту (циклофосфамід), 11 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 нітрозосечовини, сполуки платини і інші), антиметаболіти (наприклад, метотрексат, азатіоприн і меркаптопурин), цитотоксичні антибіотики (наприклад, дактиноміцин, антрацикліни, мітоміцин С, блеоміцин і мітраміцин), антитіла (наприклад, моноклональні антитіла проти CD20, проти CD25 або проти CD3 (OTK3), Atgam® і Thymoglobuline®), циклоспорин, такролімус, рапаміцин (сиролімус), інтерферони (наприклад, IFN-β), TNF-зв'язуючі білки (наприклад, інфліксимаб (Remicade™), етанерцепт (Enbrel™) або адалімумаб (Humira™)), мікофенолят, Фінголімод і Міріоцин. У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання відторгненню при трансплантації, конкретні засоби включають, але без обмеження, інгібітори кальциневрину (наприклад, циклоспорин або такролімус (FK506)), інгібітори mTOR (наприклад, сиролімус, еверолімус), протипроліферативні засоби (наприклад, азатіоприн, мікофенольна кислота), кортикостероїди (наприклад, преднізолон, гідрокортизон), антитіла (наприклад, моноклональні антитіла проти рецептора IL2R, басиліксимаб, даклізумаб), поліклональні антитіла проти Т-клітин (наприклад, антитіла проти тимоцитного глобуліну (ATG), антитіла проти лімфоцитного глобуліну (ALG)). У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання астмі, і/або риніту, і/або COPD, конкретні засоби включають, але без обмеження, агоністи β2-адренорецептора (наприклад, сальбутамол, левалбутерол, тербуталін і бітолтерол), епінефрин (інгаляційний або таблетки), антихолінергічні засоби (наприклад, бромід іпратропію), глюкокортикоїди (пероральні або інгаляційні), β 2-агоністи пролонгованої дії (наприклад, салметерол, формотерол, бамбутерол і пероральний албутерол пролонгованої дії), комбінації інгаляційних стероїдів і бронхолітичних засобів пролонгованої дії (наприклад, флутиказон/салметерол, будесонід/формотерол), антагоністи лейкотриєнів і інгібітори синтезу лейкотриєнів (наприклад, монтелукаст, зафірлукаст і зилеутон), інгібітори вивільнення медіаторів (наприклад, кромоглікат і кетотіфен), біологічні регулятори IgE-відповіді (наприклад, омалізумаб), антигістаміни (наприклад, цетеризин, цинаризин, фексофенадин) і судинозвужувальні засоби (наприклад, оксиметазолін, ксилометазолін, нафазолін і трамазолін). Крім того, сполука за даним винаходом може вводитися в комбінації з екстреною терапією при астмі і/або COPD, такі терапії включають введення кисню або киснево-гелієвої суміші, інгаляцію аерозолю сальбутамолу або тербуталіну (необов'язково в комбінації з антихолінергічним засобом (наприклад, іпратропій)), системні стероїди (пероральне або внутрішньовенне введення, наприклад, преднізону, преднізолону, метилпреднізолону, дексаметазону або гідрокортизону), внутрішньовенний сальбутамол, неспецифічні β-агоністи, ін'єкційні або інгаляційні (наприклад, епінефрин, ізоетарин, ізопротеренол, метапротеренол), протихолінергічні засоби (внутрішньовенно або інгаляція аерозолем, наприклад глікопіролат, атропін, іпратропій), метилксантини (теофілін, амінофілін, баміфілін), інгаляційні анестетики, які надають бронхолітичну дію (наприклад, ізофлуран, галотан, енфлуран), кетамін і внутрішньовенний сульфат магнію. У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання IBD, конкретні засоби включають, але без обмеження, глюкокортикоїди (наприклад, преднізон, будесонід), синтетичні модифікуючі хворобу імуномодулятори (наприклад, метотрексат, лефлуномід, сульфасалазин, месалазин, азатіоприн, 6-меркаптопурин і циклоспорин) і біологічні модифікуючі хворобу імуномодулятори (інфліксимаб, адалімумаб, ритуксимаб і абатацепт). У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання SLE, конкретні засоби включають, але без обмеження, модифікуючі хворобу протиревматичні лікарські засоби (DMARD), такі як протималярійні засоби (наприклад, плаквеніл, гідроксихлорохін), імунодепресивні засоби (наприклад, метотрексат і азатіоприн), циклофосфамід і мікофенольна кислота; імунодепресивні лікарські засоби і аналгетики, такі як нестероїдні протизапальні лікарські засоби, опіати (наприклад, декстропропоксифен і ко-кодамол), синтетичні наркотичні препарати (наприклад, гідрокодон, оксикодон, MS Contin або метадон) і трансдермальний duragesic патч [пластир] з високим вмістом фентанілу. У одному варіанті сполуку за даним винаходом вводять спільно з іншим терапевтичним засобом для лікування і/або запобігання псоріазу, конкретні засоби включають, але без обмеження, місцеві терапії, такі як розчини для ванн, зволожувачі, лікувальні креми і мазі, що містять кам’яновугільну смолу, дитранол (антралін), кортикостероїди, подібні дезоксиметазону (Topicort™), флуоцинонід, аналоги вітаміну D3 (наприклад, кальципотріол), Argan масло і ретиноїди (етретинат, ацитретин, тазаротен), системні терапії, такі як метотрексат, циклоспорин, ретиноїди, тіогуанін, гідроксисечовина, сульфасалазин, мікофеноляту мофетил, 12 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 азатіоприн, такролімус, складні ефіри фумарової кислоти або біопрепарати, такі як Amevive™, Enbrel™, Humira™, Remicade™, Raptiva™ і устекінумаб (блокатор IL-12 і IL-23). Крім того, сполуку за даним винаходом можна вводити в комбінації з іншими терапіями, включаючи, але без обмеження, світлолікування або фотохіміотерапію (наприклад, поєднання світлочутливого псоралену з опроміненням УФ-променями великої довжини хвиль (А) (PUVA)). Як очевидно фахівцям в даній галузі техніки, при спільному введенні можливе використання будь-якого способу доставки двох або декількох терапевтичних засобів пацієнту як частини однієї і тієї ж схеми лікування. Поки два або декілька вищезгаданих засобів можуть вводитися пацієнту одночасно в складі одного препарату, це не суттєво. Вказані засоби можуть вводитися в складі різних препаратів і в різний час. Загальні способи синтезу Загальні відомості Сполука за даним винаходом і порівняльні приклади, розкриті в W0 2010010190, можуть бути одержані, виходячи з легко доступних вихідних продуктів, використовуючи представлені нижче загальні методи і способи. Варто мати на увазі, що там, де представлені типові або переважні умови проведення способу (тобто температури реакції, часи, мольні відношення реагуючих речовин, розчинники, тиски і т. д.), можуть бути також використані й інші умови здійснення способу, якщо не обговорено інакше. Оптимальні умови проведення реакції можуть варіюватися залежно від використання конкретних реагуючих речовин і розчинників, проте, вищевказані умови можуть бути визначені фахівцем у даній галузі техніки з використанням звичайних методів оптимізації. Крім того, як очевидно фахівцям у даній галузі техніки, для запобігання протіканню небажаних реакцій за участі деяких функціональних груп можливе використання звичайних захисних груп. Вибір придатної захисної групи для конкретної функціональної групи, а також придатних умов для захисту і зняття захисту добре відомі в даній галузі техніки. Наприклад, численні захисні групи і їх введення і видалення описані в Greene T.W. and Wuts P.G.M. Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991, і посиланнях, цитованих у зазначеному документі. Нижченаведені способи докладно представляють способи одержання як для сполуки за цим винаходом, визначеної в даному контексті вище, так і порівняльних прикладів. Фахівець в галузі органічного синтезу може одержати сполуку за даним винаходом і порівняльні приклади, виходячи з відомих або комерційно доступних вихідних продуктів і реагентів. Усі реагенти являють собою продукти торгової якості, і їх використовували без додаткового очищення, якщо не обговорено особливо. Для реакцій, що проводяться в інертній атмосфері, використовували комерційно доступні безводні розчинники. Якщо не обговорено інакше, у всіх інших випадках використовували розчинники реактивної чистоти. Колонкову хроматографію здійснювали на силікагелі 60 (35-70 мкм). Тонкошарову хроматографію здійснювали, використовуючи пластини, попередньо покриті силікагелем F-254 (товщина 0,25 мм). Спектри 1 H-ЯМР реєструють на ЯМР-спектрометрі Bruker DPX 400 (400 МГц). Хімічні зсуви () для 1 спектрів H-ЯМР наводяться в частинах/мільйон (м.ч.) відносно тетраметилсилану ( 0,00) або відповідної лінії залишкового розчинника, тобто CHCl3 (7,27), як внутрішнього стандарту. Типи розщеплення [мультиплетність] представлені у вигляді синглета (с), дуплету (д), триплету (т), квартету (кв), мультиплету (м) і широкого сигналу (ушир.). Константи спін-спінової взаємодії (J) представлені в Гц. Спектри МС із електророзпилювальною іонізацією одержували на комбінованій системі РХ/Мас-спектрометр Micromass. Для всіх аналізів з використанням РХ-МС використовували колонку Waters Acquity UPLC BEH C18 1,7 мкм, 2,1 мм в.д. 50 мм, довжина (Part № 186002350). Препаративна ВЕРХ: колонка Waters XBridge Prep C18 5 мкм ODB 19 мм в.д. 100 мм довжина (Part № 186002978). В усіх методах використовують градієнти MeCN/H 2О. H2О містить або 0,1% TFA, або 0,1% NH3. Перелік абревіатур, використовуваних в експериментальному розділі: DCM дихлорметан DiPEA N,N-діізопропілетиламін MeCN ацетонітрил BOC трет-бутилоксикарбоніл DMF N,N-диметилформамід TFA трифтороцтова кислота THF тетрагідрофуран ЯМР ядерний магнітний резонанс DMSO диметилсульфоксид DPPA дифенілфосфорилазид 13 UA 107935 C2 5 LC-MS сполучення рідинної хроматографії і мас-спектрометрії рpm частини на мільйон [м.ч.] EtOAc етилацетат APCI хімічна іонізація при атмосферному тиску Rt час утримування с синглет ушир. с уширений синглет м мультиплет д дублет PdCl2dppf [1,1'-біс(дифенілфосфіно) фероцен]дихлорпаладій(II) TEA триетиламін Синтетичне одержання сполуки за даним винаходом і порівняльних прикладів Сполука за даним винаходом і порівняльні приклади можуть бути одержані відповідно до нижченаведеної схеми. Загальний спосіб синтезу Схема 1 , 10 15 20 де Ar являє собою феніл-L1-гетероциклоалкіл, де L1 являє собою зв'язок, -CH2- або -CO- і гетероциклоалкільна група є необов'язково заміщеною. Загальна методика 1.1.1. 1-(6-Бромпіридин-2-іл)-3-карбоетокситіосечовина (2) До розчину 2-аміно-6-бромпіридину (1) (253,8 г, 1,467 моль) у DCM (2,5 л), охолодженому до 5C, додають по краплях етоксикарбонілізотіоціанат (173,0 мл, 1,467 моль) протягом 15 хв. Потім реакційній суміші дають можливість нагрітися до кімнатної температури (20C) і перемішують протягом 16 год. Упарювання у вакуумі дає тверду речовину, яка може бути зібрана фільтрацією, ретельно промита бензином (3600 мл) і висушена на повітрі, з одержанням (2). Тіосечовина може бути використана, як така, на наступній стадії без якого1 небудь очищення. H-ЯМР (400 МГц, CDCl3) 12,03 (1H, ушир. с, NH), 8,81 (1H, д, J=7,8 Гц, H-3), 8,15 (1H, ушир. с, NH), 7,60 (1H, т, J=8,0 Гц, H-4), 7,32 (1H, дд, J=7,7 і 0,6 Гц, H-5), 4,31 (2H, кв., J=7,1 Гц, CH2), 1,35 (3H, т, J=7,1 Гц, CH3). 1.1.2. 5-Бром-[1,2,4]триазоло[1,5-a]піридин-2-іламін (3) 14 UA 107935 C2 5 10 15 20 25 30 35 40 До суспензії гідрохлориду гідроксиламіну (101,8 г, 1,465 моль) у суміші EtOH/MeOH (1:1, 900 мл) додають N,N-діізопропілетиламін (145,3 мл, 0,879 моль) і суміш перемішують при кімнатній температурі (20C) протягом 1 год. Потім додають 1-(6-бромпіридин-2-іл)-3карбоетокситіосечовину (2) (89,0 г, 0,293 моль) і суміш повільно нагрівають до кипіння (Зауваження: скрубер потрібний для гасіння виділюваного H 2S). Через 3 год. при кип'ятінні суміші дають можливість остудитися і фільтрують, збираючи осаджену тверду речовину. Додатковий продукт збирають упарюванням у вакуумі фільтрату, додаванням H 2О (250 мл) і фільтрацією. Об'єднані тверді речовини промивають послідовно H 2О (250 мл), сумішшю EtOH/MeOH (1:1, 250 мл) і Et2О (250 мл), потім сушать у вакуумі, одержуючи похідне триазолопіридину (3) у вигляді твердої речовини. Сполука може бути використана як така на 1 наступній стадії без якого-небудь очищення. H-ЯМР (400 МГц, ДМСО-d6) 7,43-7,34 (2H, м, 2ароматичний-H), 7,24 (1H, дд, J=6,8 і 1,8 Гц, ароматичний-H), 6,30 (2H, ушир., NH2); m/z + 213/215 (1:1, M+H , 100%). Загальна методика моноацилювання для одержання проміжного продукту (4) До розчину 2-амінотриазолопіридину (3) (7,10 г, 33,3 ммоль) у сухому CH3CN (150 мл) при 5C додають Et3N (11,6 мл, 83,3 ммоль), за яким іде додавання циклопропанкарбонілхлориду (83,3 ммоль). Потім реакційній суміші дають можливість нагрітися до температури навколишнього середовища і перемішують до повного витрачання вихідного продукту (3). Якщо потрібно, для забезпечення повного протікання реакції додають додаткову кількість Et 3N (4,64 мл, 33,3 ммоль) і циклопропанкарбонілхлориду (33,3 ммоль). Після випарювання розчинника у вакуумі одержаний залишок обробляють 7N метанольним розчином аміаку (50 мл) і перемішують при температурі навколишнього середовища (протягом 1-16 год.) для гідролізу якого-небудь бісацильованого продукту. Виділення продукту проводять шляхом видалення летких речовин у вакуумі з наступним розтиранням у Et2О (50 мл). Тверді речовини збирають фільтрацією, промивають H2О (250 мл), ацетоном (50 мл) і Et2О (50 мл), потім сушать у вакуумі, одержуючи необхідний бромовмісний проміжний продукт (4). Спосіб A Одержання сполук за даним винаходом за допомогою зв'язування по Suzuki (5) Придатну боронову кислоту (2 екв.) додають до розчину бромовмісного проміжного продукту (4) у суміші 1,4-діоксан/вода (5:1). До розчину додають K2CO3 (2 екв.) і PdCl2dppf (5%). Потім одержану суміш нагрівають у мікрохвильовій печі при 140C протягом 30 хв. (цю реакцію можна також здійснити звичайним нагріванням на масляній бані при 90C протягом 16 год. в атмосфері N2). Додають воду і розчин екстрагують етилацетатом. Органічні шари сушать над безводним MgSО4 і упарюють у вакуумі. Одержують кінцеву сполуку після очищення флеш-хроматографією або препаративною ВЕРХ. ВЕРХ: Waters XBridge Prep C18 5 мкм ODB 19 мм (вн.д, ID) × 100 мм (довжина) (Part № 186002978). Усі ці методи використовують градієнти MeCN/H 2О. H2О містить або 0,1% TFA, або 0,1% NH3. Спосіб B B1. 4,4-[2-(Циклопропанкарбоніламіно-[1,2,4]триазоло[1,5-a]піридин-5-іл]бензоїлхлорид 15 UA 107935 C2 5 10 15 20 25 30 2 краплі DMF додають до розчину 4-[2-(циклопропанкарбоніламіно)-[1,2,4]триазоло[1,5a]піридин-5-іл]бензойної кислоти (1 екв.), одержаної за способом A, використовуючи 4карбоксифенілборонову кислоту в DCM в атмосфері N2. Потім до цього одержаного розчину по краплях додають оксалілхлорид (2 екв.) (виділення газу). Суміш перемішують при кімнатній температурі протягом 2 годин. Після завершення реакції згідно з РХ-МС видаляють розчинник. Неочищений хлорангідрид кислоти використовують на наступній стадії без очищення. B2. Утворення аміду (загальний спосіб) Придатний амін (1,1 екв.) і Et3N (5 екв.) розчиняють у DCM в атмосфері N2 і охолоджують при 0C. До цього розчину додають по краплях хлорангідрид кислоти (B1, 1 екв.), розчинений у DCM. Реакційну суміш перемішують при кімнатній температурі протягом 16 год. Після закінчення цього часу реакцію завершують. Сполуку екстрагують EtOAc і водою, промивають насиченим розчином солі і сушать над безводним MgSО4. Органічні шари фільтрують і упарюють. Кінцеву сполуку виділяють препаративною ВЕРХ. Препаративна ВЕРХ: Waters XBridge Prep C18 5 мкм ODB 19 мм (вн.д.) 100 мм (довжина) (Part № 186002978). Усі ці методи використовують градієнти MeCN/H2О. H2О містить або 0,1% TFA, або 0,1% NH3. Спосіб C 3a 3b де R або R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклоалкіл. Гідроалкілування (загальний спосіб) Придатний амін (2 екв.), циклопропанкарбонову кислоту (наприклад, [5-(4-формілфеніл)[1,2,4]триазоло[1,5-a]піридин-2-іл]амід циклопропанкарбонової кислоти), одержану за спсобом A (1 екв.), і Ti(OPr)4 змішують і перемішують при кімнатній температурі протягом 3 годин. Суміш розбавляють у етанолі і додають Na(CN)BH3 (1 екв.). Одержаний розчин перемішують при кімнатній температурі протягом 16 год. Суміш розбавляють у воді і фільтрують. Фільтрат промивають етанолом. Об'єднані органічні фази упарюють у вакуумі. Кінцеву сполуку виділяють за допомогою препаративної ВЕРХ. Спосіб D 16 UA 107935 C2 1 2 де R і R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклоалкіл. Реакція алкілування 5 10 15 20 25 30 2-(4-Бромметилфеніл)-4,4,5,5-тетраметил-[1,3,2]діоксаборолан (1 екв.) і Et3N (2 екв.) (або AgCO3) розчиняють у суміші DCM/MeOH (4:1 об./об.) в атмосфері N2 і додають по краплях амін (2 екв.). Одержаний розчин перемішують при кімнатній температурі протягом 16 год. Після закінчення цього часу реакцію завершують. Розчинник випарюють. Сполуку екстрагують EtOAc і водою, промивають насиченим розчином солі і сушать над безводним MgSО4. Органічні шари фільтрують і упарюють. Кінцеву сполуку виділяють флеш-хроматографією. Зв'язування по Suzuki Одержану боронову кислоту (2 екв.) додають до розчину (5-бром-[1,2,4]триазоло[1,5a]піридин-2-іламіду циклопропанкарбонової кислоти (4) у суміші 1,4-діоксан/вода (5:1). До розчину додають K2СО3 (2 екв.) і PdCl2dppf (5%). Потім одержаний розчин нагрівають у мікрохвильовій печі при 140C протягом 30 хв. (цю реакцію можна також здійснити шляхом звичайного нагрівання на масляній бані при 90C протягом 16 год. в атмосфері N2). Додають воду і розчин екстрагують етилацетатом. Органічні шари сушать над безводним MgSО 4 і упарюють у вакуумі. Кінцеву сполуку одержують після очищення за допомогою флешхроматорафії або препаративної ВЕРХ. ВЕРХ: Waters XBridge Prep C18 5 мкм ODB 19 мм (вн.д.) 100 мм (довжина) (Part № 186002978). Усі ці методи використовують градієнти MeCN/H 2О. H2О містить або 0,1% TFA, або 0,1% NH3. Синтез сполуки за даним винаходом і порівняльних прикладів Сполука 1 (сполука за даним винаходом) Стадія 1 2-(4-Бромметилфеніл)-4,4,5,5-тетраметил-[1,3,2]діоксаборолан (1 екв.) і DIPEA (2 екв.) розчиняють у суміші DCM/MeOH (5:1 об./об.) в атмосфері N2 і порціями додають 1,1-діоксид тіоморфоліну (2 екв.). Одержаний розчин перемішують при кімнатній температурі протягом 16 год. Після закінчення цього часу реакцію завершують. Розчинник випарюють. Сполуку екстрагують EtOAc і водою, промивають насиченим розчином солі і сушать над безводним 17 UA 107935 C2 MgSО4. Органічні шари фільтрують і упарюють. Кінцеву сполуку виділяють без додаткового очищення. Стадія 2 Зв'язування по Suzuki 5 10 15 20 25 30 4-[4-(4,4,5,5-Тетраметил-[1,3,2]діоксаборолан-2-іл)бензил]тіоморфолін-1,1-діоксид (1,1 екв.) додають до розчину (5-бром-[1,2,4]триазоло[1,5-a]піридин-2-іл)аміду циклопропанкарбонової кислоти в суміші 1,4-діоксан/вода (4:1). До розчину додають K2СО3 (2 екв.) і PdCl2dppf (0,03 екв.). Потім одержану суміш нагрівають на масляній бані при 90C протягом 16 год. в атмосфері N2. Додають воду і розчин екстрагують етилацетатом. Органічні шари сушать над безводним MgSО4 і упарюють у вакуумі. Кінцеву сполуку одержують після очищення за допомогою флешхроматографії. Альтернативно, після завершення реакції додають акцептор паладію, такий як 1,2біс(дифенілфосфіно)етан, реакційній суміші дають можливість охолодитися і здійснюють фільтрацію. Осад на фільтрі ресуспендують у придатному розчиннику (наприклад, ацетон), тверду речовину відділяють фільтрацією, промивають додатковою кількістю ацетону і сушать. Одержану тверду речовину ресуспендують у воді, додають водний HCl і після перемішування при КТ одержаний розчин фільтрують на целіті (Celpure P300). Потім до фільтрату додають водний NaOH і одержану суспензію перемішують при КТ, тверду речовину відділяють фільтрацією, промивають водою і сушать відсмоктуванням. Нарешті, осад на фільтрі повторно піддають солюбілізації в суміші THF/H2О, обробляють акцептором паладію (наприклад, SMOPEX 234) при 50°С, суспензію фільтрують, органічні розчинники видаляють випарюванням і одержану завись промивають водою і метанолом, сушать і просівають, одержуючи вказану в заголовку сполуку у вигляді вільної основи. Альтернативний шлях одержання Сполуки 1 (сполука за даним винаходом) Стадія 1 4-(Гідроксиметил)фенілборонову кислоту (1,1 екв.) додають до розчину (5-бром[1,2,4]триазоло[1,5-a]піридин-2-іл)аміду циклопропанкарбонової кислоти в суміші 1,4діоксан/вода (4:1). До розчину додають K2СО3 (2 екв.) і PdCl2dppf (0,03 екв.). Потім одержану суміш нагрівають на масляній бані при 90°С протягом 16 год. в атмосфері N2. Додають воду і розчин екстрагують етилацетатом. Органічні шари сушать над безводним MgSО 4 і упарюють у вакуумі. Одержану суміш використовують без додаткового очищення. Стадія 2 35 18 UA 107935 C2 5 10 15 20 25 30 35 40 45 До розчину [5-(4-гідроксиметилфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]аміду циклопропанкарбонової кислоти (1,0 екв.) в хлороформі повільно додають трибромід фосфору (1,0 екв.). Реакційну суміш перемішують при кімнатній температурі протягом 20 годин, гасять льодом і водою (20 мл) і екстрагують дихлорметаном. Органічний шар сушать над безводним MgSО4, фільтрують і концентрують досуха. Одержаний білий залишок розтирають в суміші дихлорметан/діетиловий ефір 2:1, одержуючи очікуваний продукт у вигляді білої твердої речовини. Стадія 3 [5-(4-Бромметилфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амід циклопропанкарбонової кислоти (1 екв.) і DIPEA (2 екв.) розчиняють в суміші DCM/MeOH (5:1 об./об.) в атмосфері N 2 і по краплях додають 1,1-діоксид тіоморфоліну (1,1 екв.). Одержаний розчин перемішують при кімнатній температурі протягом 16 год. Після закінчення цього часу реакцію завершують. Розчинник випарюють. Сполуку розчиняють в DCM, промивають водою і сушать над безводним MgSО4. Органічні шари фільтрують і упарюють. Кінцеву сполуку виділяють колонковою хроматографією, використовуючи EtOAc, з одержанням бажаного продукту. Порівняльні приклади Сполука 2 Цю сполуку одержують, використовуючи Загальний спосіб А і 4-[4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)бензил]морфолін. Сполука 3 Цю сполуку одержують, використовуючи Загальний спосіб А і гідрохлорид пінаколового ефіру 3-(4-морфолінометил)фенілборонової кислоти. Сполука 4 Цю сполуку одержують, використовуючи Загальний спосіб А і пінаколовий ефір 2-(4морфоліно)піридин-5-боронової кислоти. Сполука 5 Цю сполуку одержують, використовуючи Загальний спосіб А і 4-[4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)феніл]морфолін. Сполука 6 Цю сполуку одержують, використовуючи Загальний спосіб С і N-метилпіперазин. Сполука 7 Цю сполуку одержують, використовуючи Загальний спосіб С і піперидин. Сполука 8 Цю сполуку одержують, використовуючи Загальний спосіб С і амід піперидин-4-карбонової кислоти. Сполука 9 Цю сполуку одержують, використовуючи Загальний спосіб С і 1-піперазин-1-ілетанон. Сполука 10 Цю сполуку одержують, використовуючи Загальний спосіб В і 1,1-діоксид тіоморфоліну. Сполука 11 Цю сполуку одержують, використовуючи Загальний спосіб D і 4,4-дифторпіперидин. Сполука за даним винаходом і порівняльні приклади, які були одержані згідно зі способами синтезу, розкритими в даному описі, представлені в Таблиці I нижче. Дані спектрів ЯМР сполуки за даним винаходом і деяких порівняльних прикладів наводяться в Таблиці II. 19 UA 107935 C2 Таблиця II Сполука № Структури Назва ММ МС Mes'd 1 {5-[4-(1,1-діоксо-1-тіоморфолін-4ілметил)феніл]-[1,2,4]триазоло[1,5-a]піридин- 425,51 2-іл}амід циклопропанкарбонової кислоти 2 N-(5-(4(морфолінометил)феніл)[1,2,4]триазоло[1,5a]піридин-2-іл)циклопропанкарбоксамід 377,45 378,20 3 N-(5-(3-(морфолінометил)феніл)[1,2,4]триазоло[1,5-a]піридин-2іл)циклопропанкарбоксамід 377,45 378,20 4 N-(5-(6-морфолінопіридин-3-іл)[1,2,4]триазоло[1,5-a]піридин-2іл)циклопропанкарбоксамід 364,41 365,10 5 N-(5-(4-морфолінофеніл)-[1,2,4]триазоло[1,5363,42 364,0 a]піридин-2-іл)циклопропанкарбоксамід 6 N-(5-(4-((4-метилпіперазин-1-іл)метил)феніл)[1,2,4]триазоло[1,5-a]піридин-2390,49 391,1 іл)циклопропанкарбоксамід 20 426 UA 107935 C2 Таблиця II Сполука № Структури Назва ММ МС Mes'd 7 N-(5-(4-(піперидин-1-ілметил)феніл)[1,2,4]триазоло[1,5-a]піридин-2іл)циклопропанкарбоксамід 375,48 376,1 8 (1-((циклопропанкарбоксамідо)[1,2,4]триазоло[1,5-a]піридин-5іл)бензил)піперидин-4-карбоксамід 418,5 419,1 9 N-(5-(4-((4-ацетилпіперазин-1іл)метил)феніл)-[1,2,4]триазоло[1,5a]піридин-2-іл)циклопропанкарбоксамід 418,5 419,1 10 {5-[4-(1,1-діоксо-1-тіоморфолін-4карбоніл)феніл]-[1,2,4]триазоло[1,5439,49 440,0 a]піридин-2-іл}амід циклопропанкарбонової кислоти 11 {5-[4-(4,4-дифторпіперидин-1-ілметил)феніл][1,2,4]триазоло[1,5-a]піридин-2-іл}амід 411,46 412,1 циклопропанкарбонової кислоти 21 UA 107935 C2 Таблиця II Дані ЯМР репрезентативних сполук за даним винаходом Сполука № Дані ЯМР () 1 1 2 3 4 5 10 11 5 10 15 20 25 30 H-ЯМР (ДМСО-d6) 11,00 (1H, ушир., NH), 7,99 (2H, д, 2ArH), 7,70 (2H, м, 2ArH), 7,53 (2H, д, 2ArH), 7,30 (1H, дд, ArH), 3,78 (2H, с, CH2), 3,14 (4H, ушир., 4CH), 2,93 (4H, ушир., 4CH), 2,03 (1H, ушир., CH), 0,82 (4H, м, 2CH2) 1 H-ЯМР (CDCl3) 10,20 (1H, ушир., NH), 8,06 (2H, д, ArH), 7,72 (2H, м, ArH), 7,63 (2H, д, ArH), 7,23 (1H, д, ArH), 4,27 (2H, с, CH2), 3,99 (4H, м, 2CH2), 3,50 (2H, ушир., CH2), 2,95 (2H, ушир., CH2), 1,97 (1H, ушир., CH), 1,17 (2H, м, CH2), 0,95 (2H, м, CH2) 1 H-ЯМР (CDCl3) 8,32 (1H, с, ArH), 7,96 (1H, м, ArH), 7,79 (1H, м, ArH), 7,66 (3H, м, ArH), 7,32 (1H, д, ArH), 4,31 (2H, с, CH2), 4,05 (4H, ушир., 2CH2), 3,6 (2H, ушир., CH2), 3,06 (2H, ушир., CH2), 1,85 (1H, ушир., CH), 1,12 (2H, м, CH2), 0,98 (2H, м, CH2) 1 H-ЯМР (CDCl3) 8,71 (1H, с, NH), 8,35 (1H, м, ArH), 8,27 (1H, ушир., ArH), 7,57 (2H, д, ArH), 7,07 (1H, м, ArH), 6,78 (1H, д, ArH), 3,86 (4H, м, 2CH2), 3,66 (4H, м, 2CH2), 1,6 (1H, ушир., CH), 1,22 (2H, м, CH2), 0,95 (2H, м, CH2) 1 H-ЯМР (ДМСО-d6) 11,06 (1H, ушир., NH), 7,98 (2H, д, ArH), 7,67 (1H, м, ArH), 7,59 (1H, д, ArH), 7,25 (1H, м, ArH), 7,08 (2H, м, ArH), 3,67 (4H, м, 2CH2), 3,25 (4H, м, 2CH2), 2,02 (1H, ушир., CH), 0,82 (4H, м, 2CH2) 1 H-ЯМР (ДМСО-d6) 11,03 (1H, ушир., NH), 8,11 (2H, д, ArH), 7,73 (1H, д, ArH), 7,72 (1H, с, ArH), 7,68 (2H, д, ArH), 7,36 (1H, дд, ArH), 4,01 (2H, ушир., CH 2), 3,81 (2H, ушир., CH2), 3,31 (4H, ушир. сигнал, прихований піком води, 2CH2), 2,03 (1H, ушир., CH), 0,81 (4H, м, CH2) 1 H-ЯМР (ДМСО-d6) 10,99 (1H, ушир., NH), 7,98 (2H, д, 2ArH), 7,70 (2H, м, 2ArH), 7,50 (2H, д, 2ArH), 7,29 (1H, дд, ArH), 3,65 (2H, с, CH2), 2,54 (4H, ушир., 4CH), 1,98 (5H, ушир., 5CH), 0,81 (4H, м, 2CH2) Біологічні приклади Приклад 1. Аналізи in vitro 1.1. Аналіз інгібування JAK1 Каталітичний домен рекомбінантної людської JAK1 (амінокислоти 850-1154; номер за каталогом 08-144) закуповують у Carna Biosciences. 10 нг JAK1 інкубують з 12,5 мкг субстрату поліGT (номер за каталогом Sigma P0275) в кіназному реакційному буфері (при кінцевих концентраціях: 15 мМ Тріс-HCl pH 7,5, 1 мМ DTT, 0,01% Твін-20, 10 мМ MgCl2, 2 мкМ 33 нерадіоактивного АТФ, 0,25 мкКі P-гамма-АТФ (GE Healthcare, номер за каталогом AH9968) з або без 5 мкл, що містять випробувану сполуку або наповнювач (ДМСО, кінцева концентрація 1%), в сумарному об'ємі 25 мкл, в поліпропіленовому 96-ямковому планшеті (Greiner, V-подібні ямки). Через 45 хв. при 30°С реакції зупиняють додаванням 25 мкл/ямку 150 мМ фосфорної кислоти. Всі реакційні суміші після закінчення реакції переносять в попередньо промиті (75 мМ фосфорна кислота) 96-ямкові фільтраційні планшети (номер за каталогом Perkin Elmer 6005177), використовуючи харвестер клітин (Perkin Elmer). Планшети промивають 6 разів 300 мкл на ямку 75 мМ розчину фосфорної кислоти і дно планшетів герметизують. Додають 40 мкл/ямку Microscint-20 і верх планшетів герметизують і здійснюють зчитування, використовуючи сцинтиляційний лічильник Topcount (Perkin Elmer). Обчислюють кіназну активність шляхом віднімання числа імпульсів за хвилину (cpm), одержаних в присутності позитивного контрольного інгібітору (10 мкМ стауроспорину), з числа імпульсів/хв. (cpm), одержаних в присутності наповнювача. Здатність випробуваної сполуки інгібувати цю активність визначають як Інгібування, в процентах, = ((cpm, визначене для зразка з випробуваною сполукою, - cpm, визначене для зразка з позитивним контрольним інгібітором), ділене на (cpm, визначене в присутності наповнювача, - cpm, визначене для зразка з позитивним контрольним інгібітором))×100. Одержують серію дозових розведень для сполук, що дає можливість дослідити залежність доза-відповідь в аналізі інгібування JAK1 і обчислити IC50 для кожної сполуки. Кожну сполуку звичайно тестують при концентрації 20 мкМ з подальшим 1/3 серійним розведенням, 8 точок (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нм - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації 22 UA 107935 C2 ДМСО 1%. Коли активність ряду сполук збільшується, одержують більше розведень і/або верхню концентрацію знижують (наприклад, 5 мкМ, 1 мкМ). Нижченаведені сполуки були перевірені на їх активність відносно JAK1, і значення IC 50, визначені, використовуючи аналізи, розкриті в даному описі, представлені нижче в Таблиці IIIA. 5 Таблиця IIIA Сполука № 1 2 3 4 5 6 7 8 9 10 11 10 15 20 25 30 35 40 45 Активність сполук відносно JAK1 JAK1 IC50 (нМ) 47,07; 55,66; 50,1; 48,29 50,91; 52,11 291 1032 1450 3448 504,1 435 334,3 18,16 7,69 1.2. Визначення Ki JAK1 Для визначення Ki різні кількості сполуки змішують з ферментом і ферментативну реакцію простежують як функцію концентрації ATP. Ki, константу зв’язування інгібітору, визначають за допомогою графічної побудови функції Km від концентрації сполуки, де Km визначають, використовуючи лінеаризацію рівняння Міхаеліса-Ментен по Лайнуверу-Берка, методу подвійних зворотних величин. У аналізі використовують 1 нг JAK1 (Invitrogen, PV4774). Субстрат являє собою 50 нМ Ulight-JAK1 (Tyr1023) Пептид (Perkin Elmer, TRF0121). Реакцію здійснюють в 25 мМ MOPS pH 6,8, 0,01%, 2 мМ DTT, 5 мМ MgCl2 Brij-35 при зміні концентрацій ATP і сполуки. Фосфорилований субстрат вимірюють, використовуючи Eu-мічене антитіло PT66 проти фосфотирозину (Perkin Elmer, AD0068). Зчитування здійснюють на приладі Envision (Perkin Elmer) при збудженні при 320 нм і подальшому випромінюванні при 615 нм і 665 нм. Наприклад, коли в цьому аналізі випробовують Сполуку 1, вимірюють значення K i, що дорівнює 39 нМ. 1.3. Аналіз інгібування JAK2 Каталітичний домен рекомбінантної людської JAK2 (амінокислоти 808-1132; номер за каталогом PV4210) закуповують у Invitrogen. 0,025 мО JAK2 інкубують з 2,5 мкг субстрату поліGT (номер за каталогом Sigma P0275) в кіназному реакційному буфері (кінцеві концентрації: 5 мМ MOPS pH 7,5, 9 мМ MgAc, 0,3 мM EDTA, 0,06% Brij і 0,6 мМ DTT, 1 мкМ нерадіоактивного 33 ATP, 0,25 мкКі P-гамма-ATP (GE Healthcare, номер за каталогом AH9968) з або без 5 мкл, що містять випробувану сполуку або наповнювач (ДМСО, кінцева концентрація 1%, в сумарному об'ємі 25 мкл, в поліпропіленовому 96-ямковому планшеті (Greiner, V-подібні ямки)). Через 90 хв. при 30°С реакції зупиняють доданням 25 мкл/яку 150 мМ фосфорної кислоти. Всі реакційні суміші після закінчення реакції переносять в попередньо промиті (75 мМ фосфорна кислота) 96ямкові фільтраційні планшети (номер за каталогом Perkin Elmer 6005177), використовуючи харвестер клітин (Perkin Elmer). Планшети промивають 6 разів 300 мкл на ямку 75 мМ розчину фосфорної кислоти і дно планшетів герметизують. Додають 40 мкл/ямку Microscint-20, і верх планшетів герметизують і здійснюють зчитування, використовуючи сцинтиляційний лічильник Topcount (Perkin Elmer). Обчислюють кіназну активність шляхом віднімання числа імпульсів за хвилину (cpm), одержаних в присутності позитивного контрольного інгібітору (10 мкМ стауроспорину),з числа імпульсів/хв. (cpm), одержаних в присутності наповнювача. Здатність випробуваної сполуки інгібувати цю активність визначають як Інгібування, в процентах, = ((cpm, визначене для зразка з випробуваною сполукою, - cpm, визначене для зразка з позитивним контрольним інгібітором), ділене на (cpm, визначене в присутності наповнювача, - cpm, визначене для зразка з позитивним контрольним інгібітором))×100. Одержують серію дозових розведень для сполук, що дає можливість дослідити залежність доза-відповідь в аналізі інгібування JAK2 і обчислити IC50 для кожної сполуки. Кожну сполуку звичайно тестують при концентрації 20 мкМ з подальшим 1/3 серійним розведенням, 8 точок (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нм - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації ДМСО 1%. Коли активність ряду сполук збільшується, одержують більше розведень і/або 23 UA 107935 C2 знижують верхню концентрацію (наприклад, 5 мкM, 1 мкM). Нижченаведені сполуки були перевірені на їх активність відносно JAK2, і значення IC50, визначені, використовуючи аналізи, розкриті в даному описі, представлені нижче в Таблиці IIIВ. Таблиця IIIB Активність сполук відносно JAK2 Сполука № 1 2 3 4 5 6 7 8 9 10 11 JAK2 IC50 (нМ) 31,37; 41,16; 55,49, 167,34 38,73, 152,3, 184,7 Не аналізували Не аналізували 1760 5070 6449 7731, 1355 848,7 65,42 15,51 5 10 15 20 25 30 35 40 Визначення Kd JAK2 JAK2 (Invitrogen, PV4210) використовують при кінцевій концентрації 5 нМ. Випробування по зв’язуванню здійснюють в 50 нМ Hepes pH 7,5, 0,01% Brij-35, 10 мМ MgCl2, 1 мМ EGTA, використовуючи 25 нМ кіназного індикатора 236 (Invitrogen, PV5592) і 2 нМ Eu-анти-GST (Invitrogen, PV5594) при зміні концентрацій сполук. Детектування індикатора здійснюють згідно з методикою від виробників. Наприклад, коли в цьому аналізі випробовують Сполуку 1, одержують значення K d, що дорівнює 205 нМ. 1.5. Аналіз інгібування JAK3 Каталітичний домен рекомбінантної людської JAK3 (амінокислоти 781-1124; номер за каталогом PV3855) закуповують у Invitrogen. 0,025 мО JAK3 інкубують з 2,5 мкг субстрату поліGT (номер за каталогом Sigma P0275) в кіназному реакційному буфері (кінцеві концентрації: 25 мМ Тріс pH 7,5, 0,5 мМ EGTA, 0,5 мМ Na3VО4, 5 мМ b-гліцеролфосфат, 0,01% Тритон X-100, 33 1 мкМ нерадіоактивного ATP, 0,25 мкКі P-гамма-ATP (GE Healthcare, номер за каталогом AH9968) з або без 5 мкл, що містять випробувану сполуку або наповнювач (ДМСО, кінцева концентрація 1%, в сумарному об'ємі 25 мкл, в поліпропіленовому 96-ямковому планшеті (Greiner, V-подібні ямки)). Через 105 хв. при 30°С реакції зупиняють доданням 25 мкл/ямку 150 мМ фосфорної кислоти. Всі реакційні суміші після закінчення реакції переносять в попередньо промиті (75 мМ фосфорна кислота) 96-ямкові фільтраційні планшети (номер за каталогом Perkin Elmer 6005177), використовуючи харвестер клітин (Perkin Elmer). Планшети промивають 6 разів 300 мкл на ямку 75 мМ розчину фосфорної кислоти і дно планшетів герметизують. Додають 40 мкл/ямку Microscint-20, і верх планшетів герметизують і здійснюють зчитування, використовуючи сцинтиляційний лічильник Topcount (Perkin Elmer). Обчислюють кіназну активність шляхом віднімання числа імпульсів на хвилину (cpm), одержаних в присутності позитивного контрольного інгібітору (10 мкМ стауроспорин), з cpm, одержаних в присутності наповнювача. Здатність випробуваної сполуки інгібувати цю активність визначають як Інгібування, в процентах, = ((cpm, визначене для зразка з випробуваною сполукою, - cpm, визначене для зразка з позитивним контрольним інгібітором), ділене на (cpm, визначене в присутності наповнювача, - cpm, визначене для зразка з позитивним контрольним інгібітором))×100. Одержують серію дозових розведень для сполук, що дає можливість дослідити залежність доза-відповідь в аналізі інгібування JAK3 і обчислити IC50 для кожної сполуки. Кожну сполуку звичайно тестують при концентрації 20 мкМ з подальшим 1/3 серійним розведенням, 8 точок (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нм - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації ДМСО 1%. Коли активність ряду сполук збільшується, приготовляють більше число розведень і/або знижують верхню концентрацію (наприклад, 5 мкM, 1 мкM). Нижченаведені сполуки були перевірені на їх активність відносно JAK3 і значення IC 50, визначені, використовуючи аналізи, розкриті в даному описі, представлені нижче в Таблиці IIIС. 24 UA 107935 C2 Таблиця IIIC Активність сполук відносно JAK3 Сполука № 1 2 11 5 10 15 20 25 30 35 40 45 JAK3 IC50 (нМ) 149,35, 187,3, 189,3, 194,7 2843 194,6 1.6. Визначення Ki JAK3 Для визначення Ki різні кількості сполуки змішують з ферментом і простежують ферментативну реакцію як функцію концентрації ATP. Ki, константу зв’язування інгібітору, визначають за допомогою графічної побудови функції Km від концентрації сполуки, де Km визначають, використовуючи лінеаризацію рівняння Міхаеліса-Ментен по Лайнуверу-Берка, методу подвійних зворотнихвеличин. JAK3 (Carna Biosciences, 09CBS-0625B) використовують при кінцевій концентрації 10 нг/мл. Субстрат являв собою полі(Glu,Tyr)натрієву сіль (4:1), ММ 20000-50000 (Sigma, P0275). Реакцію здійснюють в 25 мМ Тріс pH 7,5, 0,01% Тритон X-100, 0,5 мМ EGTA, 2,5 мМ DTT, 0,5 мМ Na3VО4, 5 мМ b-гліцеролфосфат, 10 мМ MgCl2, при зміні концентрацій ATP і сполуки і реакцію зупиняють шляхом додавання 150 мМ фосфорної кислоти. Вимірювання включеного фосфату в субстрат, поліGT, проводять шляхом завантаження зразків на фільтраційний планшет (використовуючи харвестер, Perkin Elmer) і подальшого промивання. 33 Включений в поліGT P вимірюють в сцинтиляційному лічильнику Topcount після додавання сцинтиляційної рідини в фільтраційні планшети (Perkin Elmer). Наприклад, коли в цьому аналізі тестують Сполуку 1, то одержують значення K i, що дорівнює 353 нМ. 1.7. Аналіз інгібування TYK2 Каталітичний домен рекомбінантної людської TYK2 (амінокислоти 871-1187; номер за каталогом 08-147) закуповують у Carna biosciences. 0,5 нг TYK2 інкубують з 12,5 мкг субстрату поліGT (номер за каталогом Sigma P0275) в кіназному реакційному буфері (кінцеві концентрації: 25 мМ Hepes pH 7,5, 100 мМ NaCl, 0,2 мМ Na3VО4, 0,1% NP-40, 0,1 мкМ нерадіоактивного ATP, 33 0,125 мкКі P-гамма-ATP (GE Healthcare, номер за каталогом AH9968) з або без 5 мкл, що містять випробувану сполуку або наповнювач (ДМСО, кінцева концентрація 1%, в сумарному об'ємі 25 мкл, в поліпропіленовому 96-ямковому планшеті (Greiner, V-подібні ямки)). Через 90 хв. при 30°С реакції зупиняють додаванням 25 мкл/ямку 150 мМ фосфорної кислоти. Всі реакційні суміші після закінчення реакції переносять в попередньо промиті (75 мМ фосфорна кислота) 96-ямкові фільтраційні планшети (номер за каталогом Perkin Elmer 6005177), використовуючи харвестер клітин (Perkin Elmer). Планшети промивають 6 разів 300 мкл на ямку 75 мМ розчину фосфорної кислоти і дно планшетів герметизують. Додають 40 мкл/ямку Microscint-20, і верх планшетів герметизують і здійснюють зчитування, використовуючи сцинтиляційний лічильник Topcount (Perkin Elmer). Обчислюють кіназну активність шляхом віднімання числа імпульсів за хвилину (cpm), одержаних в присутності позитивного контрольного інгібітору (10 мкМ стауроспорину), з cpm, одержаних в присутності наповнювача. Здатність випробуваної сполуки інгібувати цю активність визначають як Інгібування, в процентах, = ((cpm, визначене для зразка з випробуваною сполукою, - cpm, визначене для зразка з позитивним контрольним інгібітором), ділене на (cpm, визначене в присутності наповнювача, - cpm, визначене для зразка з позитивним контрольним інгібітором))×100. Одержують серію дозових розведень для сполук, що дає можливість дослідити залежність доза-відповідь в аналізі інгібування TYK2 і обчислити IC50 для кожної сполуки. Кожну сполуку звичайно тестують при концентрації 20 мкМ з подальшим 1/3 серійним розведенням, 8 точок (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нм - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації ДМСО 1%. Коли активність ряду сполук збільшується, приготовляють більше число розведень і/або знижують верхню концентрацію (наприклад, 5 мкM, 1 мкM). Нижченаведені сполуки були перевірені на їх активність відносно TYK2 і значення IC 50, визначені, використовуючи аналізи, розкриті в даному описі, представлені нижче в Таблиці IIID. 25 UA 107935 C2 Таблиця IIID Активність сполук відносно TYK2 Сполука № 1 2 11 5 10 15 20 25 30 35 40 45 TYK2 IC50 (нМ) 72,7, 73,75, 79,07, 86,77 2096 125,8 1.8. Визначення Kd TYK2 TYK2 (Carna Biosciences, 09CBS-0983D) використовують при кінцевій концентрації 5 нМ. Випробування по зв’язуванню здійснюють в 50 мМ Hepes pH 7,5, 0,01% Brij-35, 10 мМ MgCl2, 1 мМ EGTA, використовуючи 50 нМ кіназної мітки 236 (Invitrogen, PV5592) і 2 нМ Eu-анти-GST (Invitrogen, PV5594) при зміні концентрацій сполуки. Детектування мітки здійснюють згідно з методикою виробників. Наприклад, коли в цьому аналізі випробовують Сполуку 1, одержують значення K d, що дорівнює 376 нМ. Приклад 2. Аналізи з використанням клітин 2.1. JAK-STAT сигнальний шлях Клітини HeLa витримують в модифікованому за способом Дульбекко середовищі Ігла (DMEM), що містить 10% нагрітої інактивованої фетальної телячої сироватки, 100 О/мл пеніциліну і 100 мкг/мл стрептоміцину. Клітини HeLa використовують при 70% злитті для трансфекції. 20000 клітин в 87 мкл клітинного культурального середовища короткочасно трансфікують з 40 нг репортера pSTAT1(2)-люцефераза (Panomics), 8 нг репортера LacZ як внутрішнього контрольного репортера і 52 нг pBSK, використовуючи 0,32 мкл Jet-PEI (Polyplus) як трансфікуючого реагенту на ямку в форматі 96-ямкового планшета. Після інкубації протягом ночі при 37°С 10% CO2, трансфекційне середовище видаляють. Додають 75 мкл DMEM+1,5% нагрітої інактивованої фетальної телячої сироватки. 15 мкл сполуки при 6,7 концентрації додають протягом 60 хв. і потім 10 мкл людського OSM (Peprotech) при кінцевій концентрації 33 нг/мл. Всі сполуки тестують в двох екземплярах, виходячи з 20 мкМ з подальшим 1/3 серійним розведенням, загалом 8 доз (20 мкМ - 6,6 мкМ - 2,2 мкМ - 740 нМ - 250 нМ - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації ДМСО 0,2%. Після інкубації протягом ночі при 37°С, 10% CО 2, клітини піддають лізису в 100 мкл буфера для лізису/ямку (PBS, 0,9 мМ CaCl2, 0,5 мМ MgCl2, 5% Трегалози, 0,025% Тергітолу NP9, 0,15% BSA). 40 мкл клітинного лізату використовують для зчитування активності β-галактозидази шляхом додавання 180 мкл розчину β-Gal (30 мкл ONPG 4 мг/мл + 150 мкл буфера β-галактозидази (0,06 M Na2HPО4, 0,04 M NaH2PО4, 1 мМ MgCl2)) протягом 20 хв. Реакцію зупиняють шляхом додавання 50 мкл 1M Na2CО3. Оптичну густину зчитують при 405 нм. Люцеферазну активність вимірюють, використовуючи 40 мкл клітинного лізату плюс 40 мкл Steadylite®, описаного виробником (Perkin Elmer), на приладі Envision (Perkin Elmer). 10 мкМ інгібітору pan-JAK використовують як позитивний контроль (100% інгібування). Як негативний контроль використовують 0,5% ДМСО (0% інгібування). Позитивні і негативні контролі використовують для обчислення значень 'z' і 'інгібування, вираженого в процентах' (PIN). Інгібування, в %, = ((флуоресценція, визначена в присутності наповнювача, флуоресценція, визначена для зразка з випробуваною сполукою), ділена на (флуоресценція, визначена в присутності наповнювача, - флуоресценція, визначена для зразка без тригера))×100. Значення PIN наносять на графік залежності доза-відповідь проти концентрації випробуваних сполук і одержують значення EC50. Таблиця IV Сполука № 1 2 11 EC50 (нМ) 922,5, 625,6, 987,7, 1767 >10000, 3322, 2492 740,4 26 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 2.2. OSM/IL-Iβ сигнальний шлях Було показано, що OSM і IL-Iβ синергічно підвищують рівні MMP13 в клітинній лінії SW1353 хондросаркоми людини. Клітини висівають в 96-ямкові планшети при 15000 клітин/ямку в об'ємі 120 мкл DMEM (Invitrogen), що містить 10% (об./об.) FBS і 1% пеніцилін/стрептоміцин (Invitrogen), інкубованій при 37°С 5% CO2. Клітини попередньо інкубують з 15 мкл сполуки в середовищі M199 з 2% ДМСО 1 год. до стимуляції за допомогою 15 мкл OSM і IL-1β, досягаючи 25 нг/мл OSM і 1 нг/мл IL-Iβ, і через 48 годин після стимуляції вимірюють рівні MMP13 в кондиціонованому середовищі. Активність MMP13 вимірюють, використовуючи метод визначення активності із захопленням антитіла. Для цієї мети 384-ямкові планшети (NUNC, 460518, MaxiSorb чорні ямки) покривають 35 мкл 1,5 мкг/мл розчину антитіла проти людського MMP13 (R&D Systems, MAB511) протягом 24 годин при 4°С. Після промивання ямок 2 рази сумішшю PBS+0,05% Твін сайти зв’язування, що залишилися, блокують 100 мкл 5% нежирного сухого молока (Santa Cruz, sc-2325, Blotto) в PBS протягом 24 годин при 4°С. Потім ямки промивають двічі PBS+0,05% Твін і додають 35 мкл 1/10 розведення культурального супернатанту, що містить MMP13 в 100-кратно розбавленому буфері для блокування, і інкубують протягом 4 годин при кімнатній температурі. Потім ямки промивають двічі сумішшю PBS+0,05% Твін з подальшою активацією MMP13 додаванням 35 мкл 1,5 мМ розчину 4амінофенілртутьацетату (APMA) (Sigma, A9563) і інкубуванням при 37°С протягом 1 год. Клітини промивають знов сумішшю PBS+0,05% Твін і додають 35 мкл субстрату MMP13 (Biomol, Р-126, OmniMMP флуоресціюючий субстрат). Після інкубації протягом 24 годин при 37°С флуоресценцію перетвореного субстрату вимірюють в Perkin Elmer Wallac EnVision 2102 Multilabel планшет-рідері (довжина хвилі збудження: 320 нм, довжина хвилі випромінювання: 405 нм). Процентне інгібування = ((флуоресценція, визначена в присутності наповнювача, флуоресценція, визначена для зразка з випробуваною сполукою), ділена на (флуоресценція, визначена в присутності наповнювача, - флуоресценція, визначена для зразка без тригера))×100. Наприклад, коли в цьому аналізі тестують Сполуку 1, одержують значення EC 50, що дорівнює 2242,5 (±1098,5) нМ. Приклад 2.3. Аналіз проліферації PBL Лімфоцити периферичної крові (PBL) людини стимулюють за допомогою IL-2 і вимірюють проліферацію, використовуючи метод включення BrdU. PBL спочатку стимулюють протягом 72 годин за допомогою PHA, індукуючи рецептор IL-2, потім їх піддають голодуванню протягом 24 годин, припиняючи тим самим проліферацію клітин, з подальшою стимуляцією за допомогою IL2 протягом ще 72 годин (включаючи 24-годинне BrdU-мічення). Клітини попередньо інкубують з випробуваними сполуками за 1 год. до введення IL-2. Клітини культивують в середовищі RPMI 1640, що містить 10% (об./об.) FBS. Приклад 2.4. Аналіз цільної крові (WBA) 2.4.1. Протокол стимуляції IFN- Для прогнозу активності випробуваних сполук в інгібуванні JAK1- або JAK2-залежних сигнальних шляхів in vivo була розроблена фізіологічно релевантна модель in vitro, використовуючи цільну кров людини. У WBA-аналізі кров, взяту у волонтерів, які надали інформовану згоду, обробляють ex vivo сполукою (1h) і потім стимулюють або протягом 30хвилин інтерфероном-альфа (IFN-, JAK1-залежний шлях) або протягом 2 год. гранулоцитарним макрофагальним колонієстимулюючим фактором (GM-CSF, JAK2-залежний шлях). 2.4.1.1. Аналіз фосфо-STATl У випадку стимуляції IFN- збільшення в фосфорилуванні Трансдукторів Сигналу і Активаторів Транскрипції 1 (pSTAT1) за допомогою IFN- в екстрактах лейкоцитів вимірюють, використовуючи аналіз pSTAT1 методом ELISA. Фосфорилування сигнального білкатрансдуктора і активатора транскрипції 1 (STAT1) після стимуляції інтерфероном-альфа (IFN-) являє собою JAK1-опосередковану подію. Аналіз фосфо-STAT1, який використовують для вимірювання рівнів фосфо-STAT1 в клітинних екстрактах, був розроблений для оцінки здатності сполуки інгібувати JAK1-залежні сигнальні шляхи. Цільну кров людини, взяту у волонтерів, які надали інформовану згоду, обробляють ex vivo сполукою (1h) і потім стимулюють протягом 30 хвилин за допомогою IFN-. Збільшення в фосфорилуванні STAT1 за допомогою INF- в екстрактах лейкоцитів вимірюють, використовуючи фосфо-STAT1 ELISA. Буфер для лізису ACK складався з: 0,15 M NH 4Cl, 10 мМ KHCО3, 0,1 мМ EDTA. pH буфера 27 UA 107935 C2 5 10 15 20 25 30 35 40 45 50 55 60 становив 7,3. 10× концентрат для лізису клітин (частина PathScan діагностичного набору для фосфоSTAT1 (Tyr701) ELISA-аналізу "сендвіч"-типу від Cell Signaling) розводять в 100 разів H 2О. Інгібітори протеїнази додають до буфера до використання. 20 мкг IFN- розчиняють в 40 мкл H2О з одержанням вихідного розчину з концентрацією 500 мкг/мл. Вихідний розчин зберігають при -20°С. Одержують серію 3-кратного розведення сполуки в ДМСО (максимальна концентрація 10 мМ). Згодом сполуку додатково розводять в середовищі (фактор розведення залежить від необхідної концентрації сполуки). 2.4.1.1.1. Інкубація крові із сполукою і стимуляція IFN- Кров людини збирають в оброблених гепарином пробірках. Кров розділяють на аліквоти 392 мкл. Потім 4 мкл розведення сполуки додають до кожної аліквоти і зразки крові інкубують протягом 1 год. при 37°С. Вихідний розчин IFN- розводять в 100 разів в середовищі RPMI, одержуючи робочий розчин з концентрацією 500 нг/мл. 4 мкл 500 нг/мл робочого розчину додають в зразки крові (кінцева концентрація IFN- 5 нг/мл). Зразки інкубують при 37°С протягом 30 хв. 2.4.1.1.2. Одержання клітинних екстрактів наїзниця У кінці стимуляційного періоду для лізису еритроцитів до зразків крові додають 7,6 мл буфера ACK. Зразки перемішують шляхом перевертання пробірок п'ять разів і реакційну суміш інкубують, витримуючи на льоду, протягом 5 хв. Лізис еритроцитів (RBC) повинен бути очевидний під час цієї інкубації. Клітини осаджують центрифугуванням при 300g, 4°С протягом 7 хв. і супернатант видаляють. 10 мл 1 PBS додають в кожну пробірку і дебрис клітин ресуспендують. Зразки знов центрифугують протягом 7 хв. при 300g, 4°С. Супернатант відкидають і дебрис ресуспендують в 500 мкл 1 PBS. Потім суспензію клітин переносять в чисту 1,5 мл мікроцентрифужну пробірку. Клітини осаджують центрифугуванням при 700g протягом 5 хв. при 4°С. Супернатант видаляють і дебрис розчиняють в 150 мкл буфера для лізису клітин. Зразки інкубують, витримуючи на льоду, протягом 15 хв. Після цього зразки зберігають при -80°С до наступної обробки. 2.4.1.1.3. Вимірювання фосфорилування STAT1 методом ELISA Для визначення рівнів фосфо-STAT1 використовують Pathscan набір для ELISA-аналізу сендвіч-типу фосфо-STAT1 (Tyr701) від Cell Signaling (номер за каталогом 7234). Клітинні екстракти розморожують на льоду. Пробірки центрифугують протягом 5 хв. при 16000g, 4°С, і одержують прояснені лізати. Тим часом, мікроямкові смужки з набору зрівноважують при кімнатній температурі і буфер для промивання одержують розведенням 20× буфера для промивання в H2О. Зразки розбавляють в 100 разів в розріджувачі для зразка і 100 мкл додають до смужок мікроямок. Смужки інкубують протягом ночі при 4°С. На наступний день ямки промивають 3 рази буфером для промивання. У ямки додають 100 мкл антитіла детектування. Смужки інкубують при 37°С протягом 1 год. Потім ямки знов промивають 3 рази буфером для промивання. У кожну ямку додають 100 мкл HRP-зв'язаного вторинного антитіла і зразки інкубують при 37°С. Через 30 хв. ямки знову промивають 3 рази і у всі ямки додають 100 мкл субстрату. Після того, як зразки посиніють, для припинення реакції додають 100 мкл SТОР-розчину. Оптичну густину вимірюють при 450 нм. 2.4.1.2. Аналіз даних Інгібування індукції фосфо-STAT1 IFN- в клітинних екстрактах наносять на графік залежно від концентрації сполуки і одержують значення IC50, використовуючи програмне забезпечення 2 Graphpad. Дані акумулюють, якщо R більше ніж 0,8 і нахил кривої менше ніж 3. 2.4.1.2. Аналіз IL-8 методом ELISA У випадку стимуляції за допомогою GM-CSF збільшення рівнівінтерлейкіну-8 (IL-8) в плазмі вимірюють, використовуючи аналіз IL-8 методом ELISA. Індукована гранулоцитарним макрофагальним колонієстимулюючим фактором експресія інтерлейкіну-8 (IL-8) являє собою JAK2-опосередковану подію. Аналіз IL-8 методом ELISA, який може бути використаний для вимірювання рівнів IL-8 в зразках плазми, був розроблений з метою оцінки здатності сполуки інгібувати JAK2-залежні сигнальні шляхи. Цільну кров людини, взяту у волонтерів, які надали інформовану згоду, обробляють ex vivo сполукою (1 год.) і потім стимулюють протягом 2 год. за допомогою GM-CSF. Збільшення рівнів IL-8 в плазмі вимірюють, використовуючи аналіз IL-8 методом ELISA. 10 мкг GM-CSF розчиняють в 100 мкл H2О, одержуючи вихідний розчин з концентрацією 100 мкг/мл. Вихідний розчин зберігають при -20°С. Одержують серію 3-кратного розведення випробуваної сполуки в ДМСО (максимальна концентрація 10 мМ). Згодом сполуку піддають додатковому розведенню в середовищі (фактор 28
ДивитисяДодаткова інформація
Назва патенту англійською5-phenyl-[1,2,4]triazolo[1,5-a]pyridin-2-yl carboxamides as jak inhibitors
Автори англійськоюMenet, Christel Jeanne Marie, Smits, Koen Kurt
Автори російськоюМене Кристель Жанн Мари, Смит Коен Курт
МПК / Мітки
МПК: C07D 471/04, A61P 19/02, A61K 31/437
Мітки: 5-феніл-[1,2,4]триазоло[1,5-а]піридин-2-ілкарбоксаміди, інгібітори
Код посилання
<a href="https://ua.patents.su/44-107935-5-fenil-124triazolo15-apiridin-2-ilkarboksamidi-yak-ingibitori-jak.html" target="_blank" rel="follow" title="База патентів України">5-феніл-[1,2,4]триазоло[1,5-а]піридин-2-ілкарбоксаміди як інгібітори jak</a>
Попередній патент: Система підлогового профілю
Наступний патент: Спосіб обробки кромок будівельних панелей
Випадковий патент: Зносостійкий сплав