Інгібітор продукування меланіну
Номер патенту: 107784
Опубліковано: 25.02.2015
Автори: Като Томомі, Йокояма Коудзі, Ікеда Ю, Тамаі Масасі, Саітох Юко, Кімура Макото
Формула / Реферат
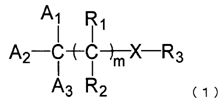
1. Застосування сполуки нижченаведеної загальної формули (1), крім клотримазолу, і/або її фармакологічно прийнятної солі для інгібування продукування меланіну:
 ,
,
де сполука, представлена загальною формулою (1), не містить імідазольне кільце;
де групи A1, A2 і A3, кожну незалежно, вибирають із арильної групи, яка може мати замісник, і ароматичної гетероциклічної групи, яка може мати замісник;
за умови, що загальна кількість атомів вуглецю, що входять в A1, A2 і A3, становить від 6 до 50;
дві сусідні арильні групи або ароматичні гетероциклічні групи можуть бути з'єднані одна з одною алкільним ланцюгом або алкенільним ланцюгом, додатково утворюючи кільце;
m являє собою ціле число від 0 до 2;
X являє собою атом азоту, атом кисню, атом водню або атом вуглецю;
R1 і R2, кожний незалежно, вибирають із атома водню й оксо, за умови, що, коли один з R1 і R2 являє оксо, інший відсутній;
R3 являє собою атом водню і кількість груп R3 складає від 0 до 3; або R3 утворює разом з Х фрагмент, вибраний з групи, представленої загальною формулою (2), групи, представленої загальною формулою (3), групи, представленої загальною формулою (4);
за умови, що, коли присутні дві або більше груп R3, кожна з R3 незалежна одна від одної;
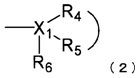 ,
,
де X1 являє собою атом вуглецю або атом азоту;
R4 і R5 з'єднані один з одним, утворюючи разом з X1 гетероциклічне кільце (окрім ароматичної гетероциклічної групи) або вуглеводневе кільце, яке має від 2 до 8 атомів вуглецю й може мати замісник; і
R6 являє собою атом водню, за умови, що R6 відсутній, коли X1 являє собою атом вуглецю, і вуглеводневе кільце являє собою ароматичне кільце, і коли X1 являє собою атом азоту;
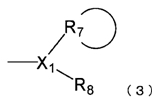 ,
,
де X1 являє собою атом вуглецю або атом азоту;
R7 являє собою вуглеводневу циклічну групу, яка має від 3 до 8 атомів вуглецю й може мати замісник; і
R8 являє собою атом водню, і кількість груп R8 відповідає групам X1;
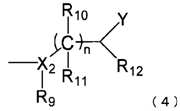 ,
,
де X2 являє собою атом азоту або атом кисню;
n являє собою ціле число від 0 до 5;
Y вибирають із гідроксилу, аміно й алкілокси, що має від 1 до 6 атомів вуглецю;
R9 вибирають із атома водню, гідроксилу й гідроксіалкілу, що має від 1 до 6 атомів вуглецю, коли X2 являє собою атом азоту; і R9 відсутній, коли X2 являє собою атом кисню; і
R10, R11 і R12, кожний незалежно, вибирають із атома водню, гідроксилу, оксо й гідроксіалкілу, що має від 1 до 5 атомів вуглецю, за умови, що, коли один з R10 і R11 являє собою оксо, інший відсутній.
2. Застосування за п. 1, де арильну групу вибирають з фенілу, біфенілу і нафтилу, і ароматичну гетероциклічну групу вибирають з піридилу і хінолілу.
3. Застосування за п. 1 або 2, де m являє собою 0.
4. Застосування за п. 1, де замісник арильної або ароматичної гетероциклічної групи А1, А2 і А3 вибирають незалежно з гідроксилу, лінійного або розгалуженого алкілу, що має від 1 до 8 атомів вуглецю, лінійного або розгалуженого алкілокси, що має від 1 до 8 атомів вуглецю.
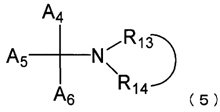
5. Застосування за п. 1, де сполука, представлена загальною формулою (1), включає сполуку, представлену нижченаведеною загальною формулою (5):
 ,
,
де A4, A5 і A6, кожну незалежно, вибирають із фенілу й піридилу, який може бути заміщений метилом, метокси або гідроксилом; і
R13 і R14 з'єднані один з одним, щоб разом з атомом азоту, представленим N, утворювати насичене гетероциклічне кільце, яке має 4 або 5 атомів вуглецю й може бути заміщене гідроксилом або оксо.
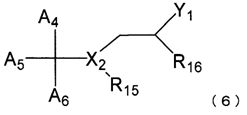
6. Застосування за п. 1, де сполука, представлена загальною формулою (1), включає сполуку, представлену нижченаведеною загальною формулою (6):
 ,
,
де A4, A5 і А6, кожну незалежно, вибирають із фенілу й піридилу, кожний з яких може бути заміщений метилом, метокси або гідроксилом;
X2 являє собою атом азоту або атом кисню;
Yl являє собою гідроксил або аміно;
R15 вибирають із атома водню, гідроксилу й гідроксіалкілу, що має від 1 до 3 атомів вуглецю, коли X2 являє собою атом азоту; і R15 відсутній, коли X2 являє собою атом кисню; і
R16 вибирають із атома водню, гідроксилу й гідроксіалкілу, що має від 1 до 3 атомів вуглецю.
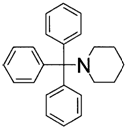
7. Застосування за п. 5, де сполуку, представлену загальною формулою (5), вибирають із 1-(трифенілметил)піперидину (сполука 5) і 1-(трифенілметил)піролідину (сполука 6)
 ,
,
1-(трифенілметил)піперидин (сполука 5)
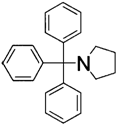
1-(трифенілметил)піролідин (сполука 6).
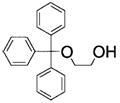
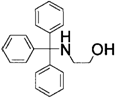
8. Застосування за п. 6, де сполуку, представлену загальною формулою (6), вибирають із 2-(трифенілметилоксі)етанолу (сполука 2), 2-(трифенілметиламіно)етанолу (сполука 3) і 2-(трифенілметилоксі)етиламіну (сполука 4)
 ,
,
2-(трифенілметилоксі)етанол (сполука 2)
 ,
,
2-(трифенілметиламіно)етанол (сполука 3)
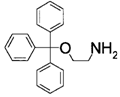
2-(трифенілметилоксі)етиламін (сполука 4).
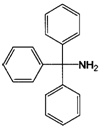
9. Застосування за п. 1, де сполуку, представлену загальною формулою (1), вибирають із трифенілметиламіну, трифенілметанолу і трифенілметану
 ,
,
трифенілметиламін
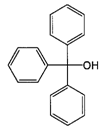 ,
,
трифенілметанол
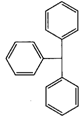
трифенілметан.
10. Застосування сполуки нижченаведеної загальної формули (1), окрім клотримазолу, і/або її фармакологічно прийнятної солі для інгібування продукування меланіну:
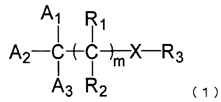 ,
,
де сполука, представлена загальною формулою (1), не містить імідазольне кільце;
де A1 являє собою атом водню, групи A2 і A3, кожну незалежно, вибирають з арильної групи, яка може мати замісник, та ароматичної гетероциклічної групи, яка може мати замісник;
за умови, що загальна кількість атомів вуглецю, що входять до A1, A2 і A3, становить від 6 до 50;
дві сусідні арильні групи або ароматичні гетероциклічні групи можуть бути з'єднані одна з одною алкільним ланцюгом або алкенільним ланцюгом, додатково утворюючи кільце;
m означає 0;
X являє собою атом азоту, атом кисню, атом водню або атом вуглецю;
R1 і R2, кожний незалежно, вибирають із атома водню й оксо, за умови, що, коли один з R1 і R2 являє оксо, інший відсутній;
R3 являє собою атом водню, і кількість груп R3 становить від 0 до 3; або R3 утворює разом з Х фрагмент, який вибирають з групи, представленої загальною формулою (2), групи, представленої загальною формулою (3), групи, представленої загальною формулою (4);
за умови, що, коли присутні дві або більше груп R3, кожна з R3 незалежна одна від одної;
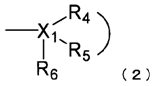 ,
,
де X1 являє собою атом вуглецю або атом азоту;
R4 і R5 з'єднані один з одним, утворюючи разом з X1 гетероциклічне кільце (за винятком ароматичної гетероциклічної групи) або вуглеводневе кільце, яке має від 2 до 8 атомів вуглецю і може мати замісник; і
R6 являє собою атом водню, за умови, що R6 відсутній, коли X1 являє собою атом вуглецю, і вуглеводневе кільце являє собою ароматичне кільце, і коли X1 являє собою атом азоту;
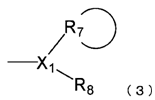 ,
,
де X1 являє собою атом вуглецю або атом азоту;
R7 являє собою вуглеводневу циклічну групу, яка має від 3 до 8 атомів вуглецю і може мати замісник; і
R8 являє собою атом водню, і кількість груп R8 відповідає кількості груп X1;
 ,
,
де X2 являє собою атом азоту або атом кисню;
n являє собою ціле число від 0 до 5;
Y вибирають з гідроксилу, аміно і алкілокси, що має від 1 до 6 атомів вуглецю;
R9 вибирають з атома водню, гідроксилу і гідроксіалкілу, що має від 1 до 6 атомів вуглецю, коли X2 являє собою атом азоту; і R9 відсутній, коли X2 являє собою атом кисню; і
R10, R11 і R12, кожен незалежно, вибирають з атома водню, гідроксилу, оксо і гідроксіалкілу, що має від 1 до 5 атомів вуглецю, за умови, що, коли один з R10 і R11 являє собою оксо, другий відсутній.
11. Застосування за п. 10, де замісник арильної або ароматичної гетероциклічної групи А2 і А3 вибирають незалежно з гідроксилу, лінійного або розгалуженого алкілу, що має від 1 до 8 атомів вуглецю, лінійного або розгалуженого алкілокси, що має від 1 до 8 атомів вуглецю.
12. Застосування за п. 10, де сполука, представлена загальною формулою (1), включає сполуку, представлену нижченаведеною загальною формулою (5):
 ,
,
де A4 являє собою атом водню, а групи A5 і A6, кожну незалежно, вибирають з фенілу і піридилу, який може бути заміщений метилом, метокси або гідроксилом; і R13 і R14 з'єднані один з одним, щоб разом з атомом азоту, представленим N, утворити насичене гетероциклічне кільце, яке має 4 або 5 атомів вуглецю і може бути заміщене гідроксилом або оксо.
13. Застосування за п. 10, де сполука, представлена загальною формулою (1), включає сполуку, представлену нижченаведеною загальною формулою (6):
 ,
,
де A4 являє собою атом водню, а групи A5 і A6, кожну незалежно, вибирають із фенілу і піридилу, кожен з яких може бути заміщений метилом, метокси або гідроксилом;
X2 являє собою атом азоту або атом кисню;
Y1 являє собою гідроксил або аміно;
R15 вибирають з атома водню, гідроксилу і гідроксіалкілу, що має від 1 до 3 атомів вуглецю, коли X2 являє атом азоту; і R15 відсутній, коли X2 являє атом кисню; і
R16 вибирають з атома водню, гідроксилу і гідроксіалкілу, що має від 1 до 3 атомів вуглецю.
14. Застосування за п. 10, де сполука, представлена загальною формулою (1), являє собою амінодифенілметан наступної структури:
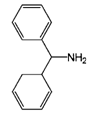
амінодифенілметан.
15. Застосування за будь-яким одним з попередніх пунктів 1-14, де MIC80 інгібітору продукування меланіну в 10 разів або більше перевищує MIC80 клотримазолу.
16. Застосування за будь-яким із пп. 1-15, де інгібітор продукування меланіну в мінімальній ефективній дозі, що інгібує продукування меланіну, не має інгібуючого ефекту на експресію білка тирозинази.
17. Застосування сполуки за будь-яким з пп. 1-16 для виготовлення препарату зовнішнього застосування, який має інгібуючу дію на пігментацію шкіри.
18. Застосування за п. 17, де препарат зовнішнього застосування для шкіри містить сполуку за будь-яким з пп. 1-16 в кількості від 0,001 % мас./мас. до 10 % мас./мас. в розрахунку на загальну кількість препарату зовнішнього застосування для шкіри.
19. Застосування за п. 17 або 18, де препарат зовнішнього застосування для шкіри є косметичним препаратом.
Текст
Реферат: Винахід стосується застосування сполук загальної формули UA 107784 C2 (12) UA 107784 C2 , крім клотримазолу, де сполуки, представлені загальною формулою (1), не містять імідазольне кільце, і/або їх фармакологічно прийнятних солей як інгібіторів продукування меланіну та її застосування у препараті зовнішнього застосування. UA 107784 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується інгібітору продукування меланіну й препарату зовнішнього застосування для шкіри, який його містить, такого як косметичний препарат. Рівень техніки Запобігання й ослаблення таких шкірних симптомів як старечі плями, ластовиння й пігментація, викликаних такими факторами, як старіння, стрес і ультрафіолетове випромінювання, надзвичайно важливо, особливо, коли це стосується жінок. Щоб знайти рішення для подібних проблем, раніше розроблялася множина засобів, призначених для відбілювання шкіри. Наприклад, були розроблені засоби, які відбілюють шкіру, кожен з яких включав аскорбати, перекис водню, колоїдну сірку, глутатіон, гідрохінон або катехін (наприклад, див. непатентний документ 1 і непатентний документ 2). Однак відомо, що кожен з засобів, які відбілюють шкіру, при деяких симптомах не є ефективним. Проте, причини цього до кінця не зрозумілі. Більше того, показано, що деякі з засобів, які відбілюють шкіру, мають проблеми, пов'язані з безпекою використання. Крім того, відомо, що міконазол і клотримазол, які відомі як протигрибкові засоби, мають інгібуючу тирозиназу активність (патентні документи 2 і 3). Однак і міконазол, і клотримазол мають високу протигрибкову активність, і тому з міркувань безпеки використання цих сполук у препараті зовнішнього застосування для шкіри, такому як косметичний препарат, є проблематичним. У цьому зв'язку бажаною є розробка нового високобезпечного засобу, який відбілює шкіру, що має відмінний відбілювальний ефект. З іншого боку, стерично об'ємна ароматична група (зокрема, дифенілметильна група або трифенілметильна група) або ароматична гетероциклічна група широко відома як ефективна захисна група для гідроксильної групи або аміногрупи в синтезі органічної сполуки з низькою молекулярною масою, пептиду й нуклеїнової кислоти (наприклад, див. непатентний документ 3 і непатентний документ 4). Проміжну сполуку, що одержується з використанням такої захисної групи (наприклад, див. непатентний документ 5 і непатентний документ 6), широко застосовують, починаючи від лабораторного синтезу й закінчуючи широкомасштабним промисловим синтезом. Крім того, повідомляли, що деякі зі сполук, кожна з яких має хімічну структуру, що містить стерично об'ємний замісник, такий як заміщена дифенілметильна група або трифенілметильна група, мають біологічну активність, таку як протипухлинна активність (наприклад, див. непатентний документ 5), протигрибковий ефект (наприклад, див. патентний документ 1), антигістамінний ефект (наприклад, див. непатентний документ 6), ефект інгібування зворотного захоплення дофаміну (наприклад, див. непатентний документ 7), і ефект антагоніста кальцію (наприклад, див. непатентний документ 8). [Патентний документ 1] JP 09-255634 A [Патентний документ 2] WO 02/060404 A1 [Патентний документ 3] KR 10-2004-0007044 A [Непатентний документ 1] відредаговане Katsuyuki Takeda et. al., “Utility, Evaluation Technology and Future Perspective of Cosmetics”, опубліковане YAKUJI NIPPO LIMITED. (2001) [Непатентний документ 2] Yoshiyuki Ohmori, FRAGRANCE JOURNAL, extra edition, No. 14, 1995, 118-126 [Непатентний документ 3] Theodora W. Green, Protective Groups in Organic Synthesis, A WileyInterscience Publication.: 1981, P173-176 and P273-274 [Непатентний документ 4] Nobuo Izumiya, Tetsuo Kato, Haruhiko Aoyagi, Michinori Waki, Basic and Experiment of Peptide Synthesis: MARUZEN Co., Ltd., 1985, P38 [Непатентний документ 5] Naohisa Ogo et. al., Bioorganic & Medicinal Chemistry, 17(14), 39213924 (2007) [Непатентний документ 6] Sasse A., et. al., Bioorganic & Medicinal Chemistry, 8(5), 1139-1149 (2000) [Непатентний документ 7] Dutta AK. et. al., Bioorganic & Medicinal Chemistry, 11(17), 23372340 (2001) [Непатентний документ 8] Shanklin JR Jr., et al., J. Med. Chem., 34(10), 3011-3022 (1991). Суть винаходу Технічне завдання Завдання даного винаходу полягає в забезпеченні нового інгібітору продукування меланіну. Ще одним завданням даного винаходу є забезпечення інгібітору продукування меланіну, який має відмінний інгібуючий ефект на продукування меланіну, що і є у високому ступені безпечним. Іншим завданням даного винаходу є забезпечення препарату зовнішнього застосування для 1 UA 107784 C2 5 10 15 20 25 30 35 40 45 50 55 шкіри, який має відмінний інгібуючий ефект на продукування меланіну і є у високому ступені безпечним. Вирішення завдання Автори даного винаходу виявили, що серед сполук, які мають хімічну структуру, що містить стерично об'ємний замісник, такий як заміщена дифенілметильна група або трифенілметильна група, існують певні групи сполук, які мають інгібуючий ефект на продукування меланіну, що й було покладено в основу даного винаходу. Таким чином, згідно із даним винаходом запропонований Інгібітор продукування меланіну (який надалі позначається як “інгібітор продукування меланіну за даним винаходом”), що містить сполуку, представлену загальною формулою (1) (крім клотримазолу) і/або її фармакологічно прийнятну сіль. У загальній формулі (1) кожну із груп A1, A2 і A3 незалежно вибирають із атома водню, арильної групи, яка може містити замісник, і ароматичної гетероциклічної групи, яка може мати замісник, за умови, що щонайменше одну із груп A1, A2, і A3 вибирають із арильної групи й ароматичної гетероциклічної групи, і загальна кількість атомів вуглецю в групах A 1, A2 і A3 становить від 6 до 50; коли дві або більше групи з A1, A2 і A3 являють собою арильні або ароматичні гетероциклічні групи, сусідні дві арильні групи або ароматичні гетероциклічні групи можуть бути з’єднані одна з одною алкільним ланцюгом або алкенільним ланцюгом з наступним утворенням циклу; m являє собою ціле число, що набуває значення від 0 до 2; X являє собою гетероатом, атом водню або атом вуглецю; R1 і R2, кожний незалежно, вибирають із атома водню й оксо, за умови, що, коли один із замісників R1 і R2 являє собою оксо, інший замісник відсутній; R3 вибирають із a атома водню, і вуглеводневої групи, що містить від 1 до 8 атомів вуглецю, у якій частина атомів водню або атомів вуглецю може бути замінена гетероатомами, і число груп R3 відповідає X; за умови, що коли присутні дві або більше груп R3, кожна з них є незалежною одна від одної, і коли присутні дві або більше груп R3, дві сусідні групи R3 можуть бути з'єднані одна з одною з утворенням циклу разом із групою X; і кінцева частина R3 може бути з'єднана з атомом вуглецю, до якого приєднані A1, A2 і A3, тим самим утворюючи цикл. Препарат зовнішнього застосування для шкіри для інгібування продукування меланіну (який надалі позначається як “препарат зовнішнього застосування для шкіри за даним винаходом”), що містить інгібітор продукування меланіну за пунктом . Препарат зовнішнього застосування для шкіри за пунктом , що містить інгібітор продукування меланіну в кількості від 0,001% мас./мас. до 10% мас./мас в розрахунку на загальну кількість препарату зовнішнього застосування для шкіри. Препарат зовнішнього застосування для шкіри за пунктом або , де препарат зовнішнього застосування для шкіри є косметичним препаратом. Застосування сполуки, представленої нижченаведеною загальною формулою (1) (крім клотримазолу), і/або її фармакологічно прийнятної солі для одержання інгібітору продукування меланіну. Спосіб інгібування продукування меланіну шляхом уведення сполуки, представленої нижченаведеною загальною формулою (1) (крім клотримазолу), і/або її фармакологічно прийнятної солі хворому, що потребує інгібування продукування меланіну. Переваги, які надаються винаходом Інгібітор продукування меланіну за даним винаходом має чудовий інгібуючий ефект на продукування меланіну. Крім того, інгібітор продукування меланіну за даним винаходом є у високому ступені безпечним і, отже, є придатним як компонент препарату зовнішнього застосування для шкіри. Препарат зовнішнього застосування для шкіри за даним винаходом має чудовий інгібуючий вплив на продукування меланіну і є у високому ступені безпечним. Тому препарат зовнішнього застосування для шкіри за даним винаходом придатний як препарат зовнішнього застосування для шкіри, який використовують для інгібування продукування меланіну, зокрема, у вигляді 2 UA 107784 C2 5 10 15 20 25 30 35 40 45 50 55 косметичного препарату. Опис варіантів здійснення винаходу Інгібітор продукування за даним винаходом включає сполуку, представлену загальною формулою (1) (крім клотримазолу), і/або її фармакологічно прийнятну сіль. Позначення, що використовуються в загальній формулі (1), описані нижче. У загальній формулі (1) групи A1, A2 і A3, кожну незалежно, вибирають із атома водню, арильної групи, яка може мати замісник, і ароматичної гетероциклічної групи, яка може мати замісник. Однак щонайменше одну із груп A1, A2 і A3 вибирають із арильної групи й ароматичної гетероциклічної групи; і загальна кількість атомів вуглецю, що міститься в A 1, A2 і A3 становить від 6 до 50. Арильну групу, переважно, вибирають із фенілу, біфенілу й нафтилу. Ароматичну гетероциклічну групу переважно вибирають із піридилу й хінолілу. Більш переважно, коли A1, A2 і A3 вибирають із фенілу й піридилу. Переважна комбінація з A1, A2 і A3 є нижченаведеною: кожна група з A1, A2 і A3 являє собою феніл або піридил; дві групи з A1, A2 і A3 являють собою феніл або піридил, а інша являє собою атом водню; одна група з A1, A2 і A3 являє собою нафтил, одна група із двох інших являє собою феніл або піридил, а інша являє собою атом водню; і одна група з A 1, A2 і A3 являє собою хіноліл, одна група із двох інших являє собою феніл або піридил, а інша являє собою атом водню. Далі, у випадку, коли арильна або ароматична гетероциклічна група має замісник, замісник переважно вибирають із фтору, трифторметилу, гідроксилу, аміно, лінійного або розгалуженого алкілу, що має від 1 до 8 атомів вуглецю, лінійного або розгалуженого алкілокси, що має від 1 до 8 атомів вуглецю, лінійного або розгалуженого алкіламіно, що має від 1 до 8 атомів вуглецю, лінійного або розгалуженого діалкіламіно, що має від 2 до 8 атомів вуглецю, лінійного або розгалуженого ацилу, що має від 2 до 9 атомів вуглецю й лінійного або розгалуженого ацилокси, що має від 2 до 9 атомів вуглецю. Число атомів вуглецю, що входять в алкіл, алкілокси або алкіламіно, переважно, становить від 1 до 4, більш переважно, 1 або 2. Число атомів вуглецю, що входять у діалкіламіно, переважно, становить від 2 до 5, більш переважно, від 2 до 4. Число атомів вуглецю, що входять в ацил або ацилокси, переважно, становить від 2 до 5, більш переважно, 2 або 3. Замісник переважно вибирають із гідроксилу, алкілу, що має від 1 до 4 атомів вуглецю, і алкілокси, що має від 1 до 4 атомів вуглецю; більш переважно, вибирають із гідроксилу, метилу й метокси. На додаток, у випадку, коли арильна або ароматична гетероциклічна група має замісник, число замісників, що містяться в одній арильній або ароматичній гетероциклічній групі, переважно, становить 3 або менше, більш переважно 2 або менш. Загальна кількість атомів вуглецю, що містяться в A1, A2 і A3, переважно, становить від 12 до 36, більш переважно, від 18 до 30. Крім того, коли дві або більше груп з A1, A2 і A3 являють собою, кожна, арильну або ароматичну гетероциклічну групу, дві сусідні арильні групи або ароматичні гетероциклічні групи можуть бути з’єднані одна з одною алкільним ланцюгом або алкеніловим ланцюгом, щоб додатково утворювати цикл. У цьому випадку, число атомів вуглецю, включених в алкільний ланцюг або алкенільний ланцюг, переважно, становить від 2 до 3. У загальній формулі (1) m являє собою ціле число, що набуває значення від 0 до 2; m переважно є 0. У загальній формулі (1) група, представлена нижченаведеною загальною формулою, переважно, являє собою наступні: трифенілметил; [дифеніл(фторфеніл)]метил, [біс(фторфеніл)феніл]метил, трис(фторфеніл)метил, [дифеніл(трифторметилфеніл)]метил, біс(трифторметилфеніл)феніл]метил, трис(трифторметилфеніл)метил; [дифеніл(гідроксифеніл)]метил, [біс(гідроксифеніл)феніл]метил, трис(гідроксифеніл)метил; [дифеніл(метилфеніл)]метил, [біс(метилфеніл)феніл]метил, трис(метилфеніл)метил, [дифеніл(етилфеніл)]метил, [біс(етилфеніл)феніл]метил, трис(етилфеніл)метил, [дифеніл(пропілфеніл)]метил, [біс(пропілфеніл)феніл]метил, трис(пропілфеніл)метил, 3 UA 107784 C2 5 10 15 20 25 30 35 40 45 50 55 60 [дифеніл(бутилфеніл)]метил, [біс(бутилфеніл)феніл]метил, трис(бутилфеніл)метил; [дифеніл(метоксифеніл)]метил, [біс(метоксифеніл)феніл]метил, трис(метоксифеніл)метил, [дифеніл(етоксифеніл)]метил, [біс(етоксифеніл)феніл]метил, трис(етоксифеніл)метил, [дифеніл(пропілоксифеніл)]метил, біс(пропілоксифеніл)феніл]метил, трис(пропілоксифеніл)метил, [дифеніл(бутоксифеніл)]метил, [біс(бутоксифеніл)феніл]метил, трис(бутоксифеніл)метил; [біс(амінофеніл)феніл]метил, трис(амінофеніл)метил, [(амінофеніл)дифеніл]метил; [дифеніл(N-метиламінофеніл)]метил, [біс(N-метиламінофеніл)феніл]метил, трис(Nметиламінофеніл)метил, [дифеніл(N-етиламінофеніл)]метил, [біс(Nетиламінофеніл)феніл]метил, трис(N-етиламінофеніл)метил, [дифеніл(Nпропіламінофеніл)]метил, [біс(N-пропіламінофеніл)феніл]метил, трис(Nпропіламінофеніл)метил, [дифеніл(N-бутиламінофеніл)]метил, [біс(Nбутиламінофеніл)феніл]метил, трис(N-бутиламінофеніл)метил; [дифеніл(N,Nдиметиламінофеніл)]метил, [біс(N,N-диметиламінофеніл)феніл]метил, трис(N,Nдиметиламінофеніл)метил, [дифеніл(N,N-діетиламінофеніл)метил, [біс(N,Nдіетиламінофеніл)феніл]метил, трис(N,N-діетиламінофеніл)метил, [дифеніл(N,Nдипропіламінофеніл)]метил, [біс(N,N-дипропіламінофеніл)феніл]метил, трис(N,Nдипропіламінофеніл)метил, [дифеніл(N,N-дибутиламінофеніл)]метил, [біс(N,Nдибутиламінофеніл)феніл]метил, трис(N,N-дибутиламінофеніл)метил; дифенілметил; [(фторфеніл)феніл]метил, біс(фторфеніл)метил, біс(трифторметилфеніл)метил, [(трифторметилфеніл)феніл]метил; [(гідроксифеніл)феніл]метил, біс(гідроксифеніл)метил; [(метилфеніл)феніл]метил, біс(метилфеніл)метил, [(етилфеніл)феніл]метил, біс(етилфеніл)метил, [(пропілфеніл)феніл]метил, біс(пропілфеніл)метил, [(бутилфеніл)феніл]метил, біс(бутилфеніл)метил; [(метоксифеніл)феніл]метил, біс(метоксифеніл)метил, [(етоксифеніл)феніл]метил, біс(етоксифеніл)метил, [(пропілоксифеніл)феніл]метил, біс(пропілоксифеніл)метил, [(бутоксифеніл)феніл]метил, біс(бутоксифеніл)метил; [(амінофеніл)феніл]метил, біс(амінофеніл)метил; [(N-метиламінофеніл)феніл]метил, біс(N-метиламінофеніл)метил, [(Nетиламінофеніл)феніл]метил, біс(N-етилфеніл)метил, [(N-пропіламінофеніл)феніл]метил, біс(Nпропіламінофеніл)метил, [(N-бутиламінофеніл)феніл]метил, біс(N-бутиламінофеніл)метил, [(N,N-диметиламінофеніл)феніл]метил, біс(N,N-диметиламінофеніл)метил, [(N,N)феніл]метил, біс(N,N-діетиламінофеніл)метил, [(N,N-дипропіламінофеніл)феніл]метил, біс(N,Nдипропіламінофеніл)метил, [(N,N-дибутиламінофеніл)феніл]метил, біс(N,Nдибутиламінофеніл)метил; [(нафтил)феніл]метил, біс(нафтил)метил, [дифеніл(нафтил)]метил, [біс(нафтил)феніл]метил, трис(нафтил)метил; [(біфеніл)феніл]метил, біс(біфеніл)метил, [(біфеніл)дифеніл]метил, [біс(біфеніл)феніл]метил, трис(біфеніл)метил; [феніл(піридил)]метил, біс(піридил)метил, [дифеніл(піридил)]метил, [біс(піридил)феніл]метил і трис(піридил)метил. З них найбільш переважними є нижченаведені групи: трифенілметил; [дифеніл(гідроксифеніл)]метил, [біс(гідроксифеніл)феніл]метил, трис(гідроксифеніл)метил; [дифеніл(метилфеніл)]метил, [біс(метилфеніл)феніл]метил, трис(метилфеніл)метил; [дифеніл(метоксифеніл)]метил, [біс(метоксифеніл)феніл]метил, трис(метоксифеніл)метил; дифенілметил; [(гідроксифеніл)феніл]метил, біс(гідроксифеніл)метил; [(метилфеніл)феніл]метил, біс(метилфеніл)метил; [(метоксифеніл)феніл]метил, біс(метоксифеніл)метил; [(нафтил)феніл]метил; [(біфеніл)феніл]метил; [дифеніл(піридил)]метил, [біс(піридил)феніл]метил і трис(піридил)метил. У загальній формулі (1) X являє собою гетероатом, атом водню або атом вуглецю. Переважно, X являє собою гетероатом або атом вуглецю. Гетероатом переважно є атомом азоту або атомом кисню. У загальній формулі (1) R 1 і R2, кожний незалежно, вибирають із атома водню й оксо. Однак 4 UA 107784 C2 5 10 15 20 25 30 35 40 45 50 55 коли один з R1 і R2 являє собою оксо, інший відсутній. У загальній формулі (1) R3 вибирають із атома водню або вуглеводневої групи, що має від 1 до 8 атомів вуглецю, де частина атомів водню або атомів вуглецю може бути заміщена гетероатомом. Тут, у випадку, коли частина атомів вуглецю в вуглеводневій групі замінена гетероатомом, число атомів вуглецю, що містяться в вуглеводневій групі, визначають як число атомів вуглецю в ймовірності відсутності такої заміни. Кількість R 3 груп відповідає X. Коли присутні дві або більше R3 груп, то R3 групи, кожна з них незалежна одна від одної. Число атомів вуглецю, що містяться в вуглеводневій групі, становить від 1 до 6. Вуглеводнева група може бути лінійною, розгалуженою або циклічною. Крім того, циклічна вуглеводнева група включає групу, у якій, коли присутні дві або більше R3 групи, дві сусідні R3 групи з'єднані одна з одною, таким чином, щоб разом з X утворювати цикл. На додаток, кінцева частина R3 може бути з'єднана з атомом вуглецю, до якого приєднані групи A1, A2 і A3, тим самим утворюючи цикл. У випадку, коли атом водню або частина атомів водню або атомів вуглецю замінені гетероатомом, гетероатом переважно являє собою атом азоту або атом кисню. Переважне число замінених атомів становить 0-4, більш переважно 1-3. У загальній формулі (1) фрагмент -X-R3 переважно представлений нижченаведеною загальною формулою (2) У загальній формулі (2) X1 являє собою атом вуглецю або атом азоту. Переважно, коли X 1 являє собою атом азоту. У загальній формулі (2) групи R4 і R5 з'єднані одна з одною з утворенням разом з X 1 гетероциклічного кільця або вуглеводневого циклу, який містить від 2 до 8 атомів вуглецю й може мати замісник. Тут число атомів вуглецю відрізняється від обумовленого числа атомів вуглецю в групі R3 загальної формули (1) і визначається як фактичне число атомів вуглецю. У випадку, коли гетероциклічне кільце або вуглеводневе кільце має замісник, переважно, коли замісник вибирають із алкілу, що має від 1 до 4 атомів вуглецю, алкілокси, що має від 1 до 4 атомів вуглецю, гідроксилу, аміно й оксо. На додаток, у цьому випадку число замісників переважно становить від 1 до 3, більш переважно 1 або 2. У цьому випадку термін «гетероциклічне кільце» охоплює будь-який з нижченаведених варіантів: ароматичне гетероциклічне кільце, неароматичне ненасичене гетероциклічне кільце й насичене гетероциклічне кільце. Переважно, коли гетероциклічне кільце являє собою насичене гетероциклічне кільце. На додаток, число атомів вуглецю, що містяться в гетероциклічному кільці, переважно становить від 3 до 5, більш переважно 4 або 5. Приклади ароматичного гетероциклічного кільця включають пірол, імідазол і піразол. Переважні приклади ароматичного гетероциклічного кільця, що має замісник, включають метилпірол і метилімідазол. Приклади неароматичного ненасиченого гетероциклічного кільця включають піролін, імідазолін і піразолін. Переважні приклади неароматичного ненасиченого гетероциклічного кільця, що має замісник, включають метилпіролін і метилімідазолін. Приклади насиченого гетероциклічного кільця включають азиридин, азетидин, піролідин, піперидин, азепан (пергідроазепін), азокан (пергідроазоцин), піперазин і морфолін. Переважні приклади насиченого гетероциклічного кільця, що має замісник, включають фталимід, сукцинімід, глутаримід, метилпіролідин, гідроксипіролідин, метилпіперидин, гідроксипіперидин, метилазепан і гідроксіазепан. Крім того, вуглеводневе кільце включає кожне з ароматичного вуглеводневого кільця, неароматичного ненасиченого вуглеводневого кільця й циклоалкільного кільця. У загальній формулі (2) R 6 являє собою атом водню й присутній, коли X 1 являє собою атом вуглецю, а гетероциклічне кільце або вуглеводневе кільце не є ароматичним кільцем. Крім того, R6 відсутній, коли X1 являє собою атом вуглецю, а гетероциклічне кільце або вуглеводневе кільце є ароматичним кільцем; і коли X1 являє собою атом азоту. Далі, фрагмент -X-R3 у загальній формулі (1) переважно представлений нижченаведеною загальною формулою (3). 5 UA 107784 C2 5 10 15 20 25 30 35 40 У загальній формулі (3) X1 являє собою атом вуглецю або атом азоту. Переважно, коли X1 являє собою атом азоту. У загальній формулі (3) R7 являє собою вуглеводневу циклічну групу, яка має від 3 до 8 атомів вуглецю й може мати замісник. У випадку, коли вуглеводневий цикл має замісник, замісник переважно вибирають із алкілу, що має від 1 до 3 атомів вуглецю, алкілокси, що має від 1 до 3 атомів вуглецю, гідроксилу, аміно й оксо. Крім того, у цьому випадку число замісників переважно становить від 1 до 3, більш переважно 1 або 2. У цьому випадку вуглеводнева циклічна група включає будь-яку з арильної групи, неароматичної ненасиченої вуглеводневої циклічної групи й циклоалкілу. Вуглеводнева циклічна група переважно є циклоалкілом. Конкретні приклади циклоалкілу включають циклопентил і циклогексил. У загальній формулі (3) R8 являє собою атом водню й число груп R8 відповідає X1. Далі, фрагмент -X-R3 у загальній формулі (1) переважно представляють нижченаведеною загальною формулою (4) У загальній формулі (4) X 2 являє собою атом азоту або атом кисню. n являє собою ціле число від 0 до 5. Переважно, n являє собою ціле число від 1 до 3. Y вибирають із гідроксилу, аміно й алкілокси, що містить від 1 до 6 атомів вуглецю. Переважно, коли алкілокси являє собою метокси або етокси. Коли Y являє собою аміно, X2 переважно є атомом кисню. У загальній формулі (4) R9 присутній, коли X2 є атомом азоту, і R9 вибирають із атома водню, гідроксилу й гідроксіалкілу, що має від 1 до 6 атомів вуглецю. Переважно, коли R 9 вибирають із атома водню й гідроксіалкілу, що має від 1 до 3 атомів вуглецю. Коли X 2 являє собою атом кисню, R9 відсутній. У загальній формулі (4) R10, R11 і R12, кожний незалежно, вибирають із атома водню, гідроксилу, оксо, гідроксіалкілу, що має від 1 до 5 атомів вуглецю. Однак, коли один з R 10 і R11 являє собою оксо, інший відсутній. R10, R11 і R12 переважно вибирають із атома водню, оксо, і гідроксіалкілу, що має від 1 до 3 атомів вуглецю, більш переважно, вибирають із атома водню й гідроксіалкілу, що має від 1 до 3 атомів вуглецю. Група, представлена загальною формулою (4), переважно включає нижченаведені варіанти: 2-гідроксіетилокси, 3-гідроксипропілокси, 2-аміноетилокси, 3-амінопропілокси, етиламіно, 2гідроксіетиламіно, 3-гідроксипропіламіно, 2-аміноетиламіно, біс(2-гідроксіетил)аміно, 2,3дигідроксипропілокси, карбоксиметил, карбокси(гідроксиметил)метил, етоксикарбонілметиламіно й метоксикарбоніл(гідроксиметил)аміно. Сполуку, представлену загальною формулою (1) за даним винаходом, переважно представляють нижченаведеною загальною формулою (5) У загальній формулі (5) A4, A5 і A6, кожний незалежно, вибирають із фенілу й піридилу, який може бути заміщений метилом, метокси або гідроксилом. R13 і R14 з'єднані один з одним з утворенням разом з атомом азоту, представленим як N, насиченого гетероциклічного кільця, яке має 4 або 5 атомів вуглецю й може бути заміщене гідроксилом або оксо. 6 UA 107784 C2 5 10 15 20 25 30 35 40 45 Переважні приклади насиченого гетероциклічного кільця включають піролідин, піперидин, піперазин, морфолін, сукцинімід і піролідинол. Більш переважні приклади включають піролідин, піперидин, піперазин і морфолін. Сполука, представлена формулою (5), зокрема, включає нижченаведені сполуки: 1-(трифенілметил)піролідин, 1-[[дифеніл(метилфеніл)]метил]піролідин, 1-[[біс(метилфеніл)феніл]метил]піролідин, 1-[трис(метилфеніл)метил]піролідин, 1-[[дифеніл(метоксифеніл)]метил]піролідин, 1-[[біс(метоксифеніл)феніл]метил]піролідин, 1-[трис(метоксифеніл)метил]піролідин, 1-[[дифеніл(гідроксифеніл)метил]піролідин, 1-[[біс(гідроксифеніл)феніл]метил]піролідин, 1-[трис(гідроксифеніл)метил]піролідин; 1-(трифенілметил)піперидин, 1-[[дифеніл(метилфеніл)]метил]піперидин, 1-[[біс(метилфеніл)феніл]метил]піперидин, 1-[трис(метилфеніл)метил]піперидин, 1-[[дифеніл(метоксифеніл)]метил]піперидин, 1-[[біс(метоксифеніл)феніл]метил]піперидин, 1-[трис(метоксифеніл)метил]піперидин, 1-[[дифеніл(гідроксифеніл)]метил]піперидин, 1-[[біс(гідроксифеніл)феніл]метил]піперидин, 1-[трис(гідроксифеніл)метил]піперидин; 1-(трифенілметил)піперазин, 1-[[дифеніл(метилфеніл)]метил]піперазин, 1-[[біс(метилфеніл)феніл]метил]піперазин, 1-[трис(метилфеніл)метил]піперазин, 1-[[дифеніл(метоксифеніл)]метил]піперазин, 1-[[біс(метоксифеніл)феніл]метил]піперазин, 1-[трис(метоксифеніл)метил]піперазин, 1-[[дифеніл(гідроксифеніл)]метил]піперазин, 1-[[біс(гідроксифеніл)феніл]метил]піперазин, 1- [трис(гідроксифеніл)метил]піперазин; 1-(трифенілметил)морфолін, 1-[[дифеніл(метилфеніл)]метил]морфолін, 1-[[біс(метилфеніл)феніл]метил]морфолін, 1-[трис(метилфеніл)метил]морфолін, 1-[[дифеніл(метоксифеніл)]метил]морфолін, 1-[[біс(метоксифеніл)феніл]метил]морфолін, 1-[трис(метоксифеніл)метил]морфолін, 1-[[дифеніл(гідроксифеніл)]метил]морфолін, 1-[[біс(гідроксифеніл)феніл]метил]морфолін і 1-[трис(гідроксифеніл)метил]морфолін. З них особливо переважними є сполуки 5 і 6, описані нижче. 1-(Трифенілметил)піперидин (сполука 5) 7 UA 107784 C2 1-(Трифенілметил)піролідин (сполука 6) Крім того, переважно, коли сполуку за даним винаходом, представлену загальною формулою (1), представляють нижченаведеною загальною формулою (6). 5 10 15 20 25 30 35 40 45 У загальній формулі (6) групи A4, A5 і A6, кожну незалежно, вибирають із фенілу й піридилу, кожний з яких може бути заміщений метилом, метокси або гідроксилом. X2 являє собою атом азоту або атом кисню. У загальній формулі (6) Y1 являє собою гідроксил або аміно. Коли Y1 являє собою аміно, X2 переважно являє собою атом кисню. У загальній формулі (6) R15 присутній, коли X2 являє собою атом азоту, і R15 вибирають із атома водню, гідроксилу, і гідроксіалкілу, що має від 1 до 3 атомів вуглецю. У цьому випадку R 15 переважно вибирають із атома водню й гідроксіалкілу, що має від 1 до 3 атомів вуглецю. Коли X2 являє собою атом кисню, R15 відсутній. У загальній формулі (6) R16 вибирають із атома водню, гідроксилу й гідроксіалкілу, що має від 1 до 3 атомів вуглецю. R16 переважно вибирають із атома водню й гідроксіалкілу, що має від 1 до 3 атомів вуглецю. Сполука, представлена загальною формулою (6), зокрема, включає нижченаведені сполуки: 2-(трифенілметилокси)етанол, 2-[[дифеніл(метилфеніл)]метилокси]етанол, 2-[[біс(метилфеніл)феніл]метилокси]етанол, 2-[трис(метилфеніл)метилокси]етанол, 2-[[дифеніл(метоксифеніл)]метилокси]етанол, 2-[[біс(метоксифеніл)феніл]метилокси]етанол, 2-[трис(метоксифеніл)метилокси]етанол; 2-[[дифеніл(гідроксифеніл)]метилокси]етанол, 2-[[біс(гідроксифеніл)феніл]метилокси]етанол, 2-[трис(гідроксифеніл)метилокси]етанол, 2-[[дифеніл(фторфеніл)]метилокси]етанол, 2-[[біс(фторфеніл)феніл]метилокси]етанол, 2-[трис(фторфеніл)метилокси]етанол; 3-(трифенілметилокси)пропанол, 3-[[дифеніл(метилфеніл)]метилокси]пропанол, 3-[[біс(метилфеніл)феніл]метилокси]пропанол, 3-[трис(метилфеніл)метилокси]пропанол, 3-[[дифеніл(метоксифеніл)]метилокси]пропанол, 3-[[біс(метоксифеніл)феніл]метилокси]пропанол, 3-[трис(метоксифеніл)метилокси]пропанол, 3-[[дифеніл(гідроксифеніл)]метилокси]пропанол, 3-[[біс(гідроксифеніл)феніл]метилокси]пропанол, 3-[трис(гідроксифеніл)метилокси]пропанол, 3-[[дифеніл(фторфеніл)]метилокси]пропанол, 3-[[біс(фторфеніл)феніл]метилокси]пропанол, 3-[трис(фторфеніл)метилокси]пропанол; 2-(трифенілметилокси)етиламін, 2-[[дифеніл(метилфеніл)]метилокси]етиламін, 2-[[біс(метилфеніл)феніл]метилокси]етиламін, 8 UA 107784 C2 5 10 15 20 25 30 35 40 45 2-[трис(метилфеніл)метилокси]етиламін, 2-[[дифеніл(метоксифеніл)]метилокси]етиламін, 2-[[біс(метоксифеніл)феніл]метилокси]етиламін, 2-[трис(метоксифеніл)метилокси]етиламін, 2-[[дифеніл(фторфеніл)]метилокси]етиламін, 2-[[біс(фторфеніл)феніл]метилокси]етиламін, 2-[трис(фторфеніл)метилокси]етиламін; 3-(трифенілметилокси)пропіламін, 3-[[дифеніл(метилфеніл)]метилокси]пропіламін, 3-[[біс(метилфеніл)феніл]метилокси]пропіламін, 3-[трис(метилфеніл)метилокси]пропіламін, 3-[[дифеніл(метоксифеніл)]метилокси]пропіламін, 3-[[біс(метоксифеніл)феніл]метилокси]пропіламін, 3-[трис(метоксифеніл)метилокси]пропіламін, 3-[[дифеніл(фторфеніл)]метилокси]пропіламін, 3-[[біс(фторфеніл)феніл]метилокси]пропіламін, 3-[трис(фторфеніл)метилокси]пропіламін; 2-(трифенілметиламіно)етанол, 2-[[дифеніл(метилфеніл)]метиламіно]етанол, 2-[[біс(метилфеніл)феніл]метиламіно]етанол, 2-[трис(метилфеніл)метиламіно]етанол, 2-[[дифеніл(метоксифеніл)]метиламіно]етанол, 2-[[біс(метоксифеніл)феніл]метиламіно]етанол, 2-[трис(метоксифеніл)метиламіно]етанол, 2-[[дифеніл(фторфеніл)]метиламіно]етанол, 2-[[біс(фторфеніл)феніл]метиламіно]етанол, 2-[трис(фторфеніл)метиламіно]етанол; 3-(трифенілметиламіно)пропанол, 3-[[дифеніл(метилфеніл)]метиламіно]пропанол, 3-[[біс(метилфеніл)феніл]метиламіно]пропанол, 3-[трис(метилфеніл)метиламіно]пропанол, 3-[[дифеніл(метоксифеніл)]метиламіно]пропанол, 3-[[біс(метоксифеніл)феніл]метиламіно]пропанол, 3-[трис(метоксифеніл)метиламіно]пропанол, 3-[[дифеніл(фторфеніл)]метиламіно]пропанол, 3-[[біс(фторфеніл)феніл]метиламіно]пропанол, 3-[трис(фторфеніл)метиламіно]пропанол; Трифенілметил-N-етиламін, N-[[дифеніл(метилфеніл)]метил]-N-етиламін, N-[[біс(метилфеніл)феніл]метил]-N-етиламін, N-[трис(метилфеніл)метил]-N-етиламін, N-[[дифеніл(метоксифеніл)]метил]-N-етиламін, N-[[біс(метоксифеніл)феніл]метил]-N-етиламін і N-[трис(метоксифеніл)метил]-N-етиламін. З них сполуки 2-4, описані нижче, є особливо переважними. 2-(Трифенілметилокси)етанол (сполука 2) 2-(Трифенілметиламіно)етанол (сполука 3) 9 UA 107784 C2 2-(Трифенілметилокси)етиламін (сполука 4) Крім того, фрагмент -X-R3 у загальній нижченаведеною загальною формулою (7) 5 10 формулі (1) переважно представляють У загальній формулі (7) X 3 являє собою гетероатом, атом водню, або атом вуглецю. У загальній формулі (7) число індексів p відповідає X 3. Групу, представлену загальною формулою (7), переважно вибирають із аміногрупи, гідроксильної групи й метильної групи. Зі сполук, кожна з яких представляє загальну формулу (1), у яких фрагмент -X-R3 представляють загальною формулою (7), особливо переважними, зокрема, є нижченаведені сполуки: Трифенілметиламін 15 Трифенілметанол Трифенілметан 20 25 Амінодифенілметан Сполука, представлена загальною формулою (1), переважно не містить структурного фрагмента імідазолу. Внаслідок відсутності в структурі структурного фрагмента імідазолу, сполука не проявляє протигрибкової активності й служить як інгібітор продукування меланіну, який є у високому ступені безпечним. Сполука, представлена загальною формулою (1), переважно має мінімальну інгібуючу концентрацію (MIC80), яка являє собою мінімальну концентрацію, необхідну для інгібування 10 UA 107784 C2 5 10 15 20 25 30 35 40 45 50 55 60 росту дерматофітів на 80% або більше. Зазначену концентрацію вимірюють способом, описаним нижче в тестовому прикладі 5, і вона перевищує відповідну концентрацію клотримазолу. Сполука, представлена загальною формулою (1), переважно має MIC80, що перевищує в 10 разів або більше, більш переважно в 20 разів або більше, ще більш переважно в 50 разів або більше, особливо переважно в 100 разів або більше відповідну концентрацію клотримазолу. Це розглядається з погляду безпеки, у випадку використання сполуки як інгібітору продукування меланіну в препараті зовнішнього застосування для шкіри. Крім того, сполука, представлена загальною формулою (1), при мінімальній ефективній дозі, що інгібує продукування меланіну, переважно не чинить ефекту інгібування на експресію білка тирозинази. Можна підтвердити, має чи ні сполука в мінімальній ефективній дозі, що інгібує продукування меланіну, інгібуючий ефект на експресію білка тирозинази, наприклад, вимірюючи активність тирозинази при мінімальній концентрації, у випадку, коли кількість продукованого меланіну, вимірювана способом, описаним у тестовому прикладі 1, наведеному нижче, становить 40% або менше, у порівнянні з контролем, за способом, описаним в тестовому прикладі 7, наведеному нижче. Тут, у випадку, коли активність тирозинази становить 80% або більше у порівнянні з контролем, переважно, 90% або більше у порівнянні з контролем, більш переважно, коли вона аналогічна контролю, сполуку можна оцінювати, як таку, що не має інгібуючого ефекту на експресію білка тирозинази.Слід відмітити, що вираз “аналогічна контролю” стосується випадку, коли активність тирозинази становить від 95 до 100% при порівнянні з контролем. Сполука, представлена загальною формулою (1), наприклад, може бути отримана загальноприйнятим способом з використанням доступних для придбання вихідних речовин згідно зі способом, описаним в J. Org. Chem., 66(23), 7615-7625 (2001). Конкретні приклади одержання описані нижче. Сполуку, представлену загальною формулою (1), перетворюють у сольову форму, обробляючи фармакологічно прийнятною кислотою або основою; сіль можна використовувати як інгібітор продукування меланіну. Придатні приклади солей включають солі мінеральних кислот, такі як гідрохлорид, сульфат, нітрат, фосфат і карбонат; солі органічних кислот, такі як малеат, фумарат, оксалат, цитрат, лактат, тартрат, метансульфонат, парифтолуолсульфонат і бензолсульфонат; солі лужних металів, такі як натрієва сіль і калієва сіль; солі лужноземельних металів, такі як сіль кальцію й сіль магнію; солі органічних амінів, такі як сіль триетиламіну, сіль триетаноламіну, сіль амонію, сіль моноетаноламіну й сіль піперидину; і солі основних амінокислот, такі як сіль лізину й альгінат. Інгібуючий ефект інгібітору продукування меланіну за даним винаходом на продукування меланіну може бути оцінений, використовуючи тіоурацил, який специфічно включають у клітини в процесі синтезу меланіну в клітинах. Наприклад, кількість продукованого меланіну може бути визначена за допомогою вимірювання кількості тіоурацилу, уведеного в клітини, вимірюючи радіацію радіоміченого тіоурацилу. У цьому випадку, коли величина радіоактивного випромінювання зменшується, зменшується й кількість продукованого меланіну й, отже, інгібітор можна оцінювати, як такий, що має сильний інгібуючий ефект на продукування меланіну. Препарат зовнішнього застосування для шкіри за даним винаходом містить зазначений вище інгібітор продукування меланіну за даним винаходом. Препарат зовнішнього застосування для шкіри за даним винаходом може містити тільки один вид інгібітору продукування меланіну за даним винаходом або може містити два або більше видів інгібіторів. Вміст інгібітору продукування меланіну за даним винаходом в препараті зовнішнього застосування для шкіри переважно становить від 0,001 до 10% мас./мас., більш переважно від 0,01 до 5% мас./мас., ще більш переважно від 0,1 до 3% мас./мас. від загальної кількості препарату зовнішнього застосування для шкіри. Препарат зовнішнього застосування для шкіри за даним винаходом використовують для інгібування продукування меланіну. Застосування з метою інгібування продукування меланіну включають застосування, які, головним чином, передбачають цілі, що досягаються за допомогою інгібування продукування меланіну, такі як “зменшення пігментації”, “відбілювання” і “зменшення старечих плям”. Сполука, представлена загальною формулою (1), і/або її фармакологічно прийнятна сіль, мають/має широкий пік поглинання з високим коефіцієнтом поглинання в ультрафіолетовій ділянці. Тому препарат зовнішнього застосування для шкіри за даним винаходом є ефективним для захисту від ультрафіолетового випромінювання. Тобто, препарат зовнішнього застосування 11 UA 107784 C2 5 10 15 20 25 30 35 40 45 50 55 60 для шкіри за даним винаходом проявляє не тільки інгібуючий вплив на продукування меланіну, але також проявляє ефект поглинання ультрафіолетового випромінювання, і, отже, препарат має два нижченаведені ефекти: запобігання засмаги, тобто, ефект попередження потемніння непотемнілої шкіри й запобігання подальшого потемніння шкіри, яка почала темніти; і освітлення засмаги, тобто, ефект освітлення шкіри, що вже потемніла в порівнянні з нормальною шкірою, приводячи її до нормальному кольору, і поліпшення вихідного кольору темної шкіри, перетворюючи його в бажаний білий колір. Крім того, препарат зовнішнього застосування для шкіри за даним винаходом переважно є косметичним препаратом. У даному описі термін “косметичний препарат” включає не тільки косметичні препарати, сертифіковані Законом про фармацевтичну продукцію кожної країни, але також косметичні препарати, що класифікуються як пограничні з лікарським засобом зовнішнього застосування для шкіри, такі як квазілікарські засоби в Японії й косметичні препарати на Тайвані, що містять лікарські засоби. Препарат зовнішнього застосування для шкіри за даним винаходом може включати необов'язкові інгредієнти, звичайно використовувані в препараті зовнішнього застосування для шкіри, на додаток до інгібітору продукування меланіну за даним винаходом. Переважні приклади таких необов'язкових інгредієнтів включають масла/воски, такі як масло австралійського горіха, олія авокадо, кукурудзяна олія, маслинова олія, рапсова олія, кунжутна олія, рицинова олія, сафлорова олія, бавовняна олія, олія жожоба, кокосова олія, пальмова олія, рідкий ланолін, отверджена кокосова олія, отверджена олія, рослинний віск, отверджена рицинова олія, бджолиний віск, канделільський віск, карнаубський віск, віск японського дерева ібота, ланолін, відновлений ланолін, твердий ланолін і віск жожоба; вуглеводні, такі як рідкий парафін, сквалан, пристан, озокерит, парафін, церезин, вазелін, і мікрокристалічний віск; вищі жирні кислоти, такі як олеїнова кислота, ізостеаринова кислота, лауринова кислота, міристинова кислота, пальмітинова кислота, стеаринова кислота, бегенова кислота й ундециленова кислота; вищі спирти, такі як цетиловий спирт, стеариловий спирт, ізостеариловий спирт, бегеновий спирт, октилдодеканол, міристиловий спирт, і цетостеариловий спирт; синтетичні складноефірні масла, такі як цетилізооктаноат, ізопропілміристат, гексилдецилізостеарат, діізопропіладипат, ді-2-етилгексилсебацинат, цетиллактат, діізостеарилмалат, етиленгліколь-(2-етилгексаноат); неопентилглікольдикапринат; гліцериди(2-гептилундеканоат); гліцерилтри(2-етилгексаноат), три(2-етилгексаноат) триметилолпропану; триізостеарат триметилолпропану; і пентанеритриттетра(2-етилгексаноат), ланцюжкові полісилоксани, такі як диметилполісилоксан, метилфенілполісилоксан і дифенілполісилоксан; циклічні полісилоксани, такі як октаметилциклотетрасилоксан, декаметилциклопентасилоксан і додекаметилциклогексасилоксан; мастильні агенти, такі як силіконова олія, що включає модифіковані полісилоксани, такі як модифікований аміном полісилоксан, модифікований поліефіром полісилоксан, модифікований алкілом полісилоксан і модифікований фтором полісилоксан; аніоногені поверхнево-активні речовини, такі як жирнокислотні мила (такі як лаурат натрію й пальмітат натрію), лаурилсульфат калію й простий ефір алкілсульфату триетаноламіну; катіоногенні поверхнево-активні речовини, такі як триметиламонійстеарилхлорид, хлорид бензалконію й лауриламіноксид; амфотерні поверхнево-активні речовини, такі як амфотерні поверхнево-активні речовини на основі імідазоліну (такі як 2-кокоїл-2-імідазолінійгідроксид-1-карбоксіетилоксидинатрієва сіль), поверхнево-активні речовини на основі бетаїну (такі як алкілбетаїн, бетаїнамід і сульфобетаїн) і ацилметилтаурин; неіоногенні поверхнево-активні речовини, такі як складні ефіри жирних кислот і сорбітану (такі як сорбітанмоностеарат і сорбітансесквіолеат), складні ефіри гліцерину й жирних кислот (такі як гліцеринмоностеарат), складні ефіри пропіленгліколю й жирних кислот (такі як пропіленглікольмоностеарат), отверділі похідні рицинової олії, простий алкіловий ефір гліцерину поліоксіетиловані (РОЕ-) ефіри сорбітану й жирних кислот (такі як поліоксіетилований сорбітанмоноолеат і поліоксіетилований сорбітанмоностеарат), поліоксіетиловані ефіри сорбіту й жирних кислот (такі як поліоксіетилований сорбітмонолаурат), поліоксіетиловані ефіри гліцерину й жирних кислот (такі як поліоксіетилований гліцерилмоноізостеарат), поліоксіетиловані ефіри жирних кислот (такі як поліетиленглікольмоноолеат і поліоксіетилований дистеарат), поліоксіетиловані алкілові прості ефіри (такі як поліоксіетилований (POE2) октилдодециловий ефір), поліоксіетиловані алкілфенілові ефіри (такі як поліоксіетилований нонілфеніловий ефір), типу «плюроніки», поліоксіетиловані/поліоксипропіловані (POP) алкілові прості ефіри (такі як поліоксіетилований/POP2-децилтетрадециловий ефір), типу «тетроніки», поліоксіетилована рицинова олія/отверділі похідні рицинової олії (такі як поліоксіетилована рицинова олія й 12 UA 107784 C2 5 10 15 20 25 30 35 40 45 поліоксіетилована отверджена рицинова олія), складний ефір сахарози й жирної кислоти й алкілглюкозид; багатовалентні (багатоатомні) спирти, такі як поліетиленгліколь, гліцерин, 1,3бутиленгліколь, еритрит, сорбіт, ксиліт, мальтит, пропіленгліколь, дипропіленгліколь, дигліцерин, ізопренгліколь, 1,2-пентандіол, 2,4-гександіол, 1,2-гександіол і 1,2-октандіол; інгредієнти, що утримують вологу, такі як піролідонкарбоксилат натрію, лактат і лактат натрію; дрібні частинки, такі як слюда, тальк, каолін, синтетична слюда, карбонат кальцію, карбонат магнію, кремінний ангідрид (діоксид кремнію), оксид алюмінію й сульфат барію, поверхні яких можна обробляти; неорганічні барвники, такі як червоний залізооксидний пігмент, жовтий залізооксидний пігмент, чорний залізооксидний пігмент, оксид кобальту, ультракмарин синій, берлінська лазур, оксид титану й оксид цинку, поверхні яких можна обробляти; перлинні добавки, такі як слюда з титаном, лускоподібна фольга й оксихлорид вісмуту, поверхні яких можна обробляти; органічні барвники, такі як Червоний № 202, Червоний № 228, Червоний № 226, Жовтий № 4 Синій № 404, Жовтий № 5, Червоний № 505, Червоний № 230, Червоний № 223, Жовтогарячий № 201, Червоний № 213, Жовтий № 204, Жовтий № 203, Синій № 1, Зелений № 201, Пурпурний № 201 і Червоний № 204, який може бути лаковим; органічні дрібні частинки, такі як поліетиленовий порошок, поліметилметакрилат, найлоновий порошок і органополісилоксановий еластомер; абсорбент ультрафіолетового випромінювання на основі птамінобензоату; абсорбент ультрафіолетового випромінювання на основі антранілату; абсорбент ультрафіолетового випромінювання на основі саліцилату; абсорбент ультрафіолетового випромінювання на основі цинамату; абсорбент ультрафіолетового випромінювання на основі бензофенону; абсорбент ультрафіолетового випромінювання на основі цукру; абсорбенти ультрафіолетового випромінювання, такі як 2-(2’-гідрокси-5’-третоктилфеніл)бензотриазол і метокси-4’-трет-бутилдибензоїлметан; нижчі спирти, такі як етанол і ізопропанол; вітаміни, такі як вітамін A або його похідні; види вітаміну B, такі як вітамін B 6 гідрохлорид, трипальмітат вітаміну B6, діоктаноат вітаміну B6, вітамін B2 або його похідні, вітамін B12 і вітамін B15 або його похідні; види вітаміну E, такі як -токоферол, -токоферол, токоферол і ацетат вітаміну E; види вітаміну D; вітамін H; пантотенова кислота; пантетин; піролохінолінхінон; і антибактеріальні агенти, такі як феноксіетанол. Препарат зовнішнього застосування для шкіри за даним винаходом можна одержувати обробкою інгібітору продукування меланіну за даним винаходом й необов'язкового інгредієнта, зазначеного вище, згідно із загальноприйнятим способом одержання, і переробкою продукту, що виходить, у різні препарати, такі як лосьйон, косметичне молочко, есенція, крем і косметична маска. Приклади одержання сполук Приклади одержання сполук, кожна з яких представляється формулою (1), як показано нижче. Приклад одержання 1 Синтез 1-(трифенілметил)імідазолу (сполука 1) (Сполука 1) Сполука 1 синтезували способом, описаним в JP 53-16879 A. Слід відмітити, що сполука 1 може бути придбана як реагент у фірмі Wako Pure Chemical Industries, Ltd. Приклад одержання 2 Синтез 2-(трифенілметилокси)етанолу (сполука 2) (Сполука 2) Етиленгліколь (3,10 г, 49,9 ммоль) (Wako Pure Chemical Industries, Ltd.) і трифенілхлорметан (1,39 г, 49,9 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в піридині (6 мл) (Wako Pure 13 UA 107784 C2 5 10 15 20 25 30 35 40 Chemical Industries, Ltd.). Розчин нагрівали до 45°C і перемішували 2 години. Воду (50 мл) вливали в реакційний розчин і суміш екстрагували толуолом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.), і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (сумішшю хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.)= 9:1) з одержанням зазначеної в заголовку сполуки (0,37 г, 24% вихід). Т. пл. (точка плавлення) 103-106°C 1 Н-ЯМР (CDCl3): 3,26 (т, J=4,5 Гц, 2H), 3,75 (т, J=4,5 Гц, 2H), 7,23-7,54 (м, 15H). -1 ІК (см ): 3337, 1448, 1093, 1061. Приклад одержання 3 Синтез 2-(трифенілметиламіно)етанолу (сполука 3) (Сполука 3) Трифенілхлорметан (1,00 г, 3,58 ммоль) (Wako Pure Chemical Industries, Ltd.) і аміноетанол (2,00 г, 32,7 ммоль) розчиняли в ацетонітрилі (5 мл) і розчин перемішували при кімнатній температурі протягом ночі. Воду (100 мл) вливали в реакційний розчин, і осади відфільтровували на вакуум-фільтрі й потім сушили. Твердий продукт перекристалізовували зі змішаного розчинника етанолу (Wako Pure Chemical Industries, Ltd.) і води з одержанням зазначеної в заголовку сполуки (0,43 г, 39% вихід). Т. пл. 94-97°C 1 Н-ЯМР (ДМСО): 2,07 (т, J=6,0 Гц, 2H), 3,51 (т, J=6,0 Гц, 2H), 7,15-7,42 (м, 15H). -1 ІК (см ): 3244, 1488, 1442, 1025. Приклад одержання 4 Синтез 2-(трифенілметилокси)етиламіну (сполука 4) (Сполука 4) Трифенілхлорметан (1,00 г, 3,58 ммоль) (Wako Pure Chemical Industries, Ltd.) і етаноламін гідрохлорид (1,00 г, 10,3 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в піридині (4 мл), і розчин перемішували при кімнатній температурі 3 дні. Воду (200 мл) вливали в реакційний розчин і осади відфільтровували на вакуум-фільтрі. Тверді речовини суспендували в діетиловому ефірі й додавали 3 н. хлористоводневу кислоту (Wako Pure Chemical Industries, Ltd.), з наступним перемішуванням при кімнатній температурі протягом 15 хвилин. Нерозчинні речовини відфільтровували на вакуум-фільтрі. Нерозчинні речовини розчиняли в змішаному розчині етилацетату (Wako Pure Chemical Industries, Ltd.) і насиченого водного розчину гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.); і суміш струшували з наступним відділенням органічного шару. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і потім фільтрували на вакуум-фільтрі й концентрували при зниженому тиску з одержанням зазначеної в заголовку сполуки (0,31 г, 28% вихід). Т. пл. 87-89°C. 1 Н-ЯМР (CDCl3): 2,88 (т, J=5,1 Гц, 2H), 3,14 (т, J=5,1 Гц, 2H), 7,24-7,51 (м, 15H). -1 ІК (см ): 3378, 1594, 1448, 1054. Приклад одержання 5 Синтез 1-(трифенілметил)піперидин (сполука 5) 14 UA 107784 C2 5 10 15 20 25 30 35 (Сполука 5) Піперидин (1,50 г, 17,6 ммоль) (Wako Pure Chemical Industries, Ltd.), трифенілхлорметан (5,40 г, 19,4 ммоль) (Wako Pure Chemical Industries, Ltd.) і карбонат калію (2,68 г, 19,4 ммоль) (Wako Pure Chemical Industries, Ltd.) додавали до ацетонітрилу (30 мл) (Wako Pure Chemical Industries, Ltd.); і суміш 5 годин кип'ятили зі зворотним холодильником. Насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) додавали до реакційного розчину й суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок перекристалізовували зі змішаного розчинника із хлороформу (Wako Pure Chemical Industries, Ltd.) і н-гексану (Wako Pure Chemical Industries, Ltd.) з одержанням зазначеної в заголовку сполуки (1,80 г, 31% вихід). Т. пл. 156-158°C. 1 Н-ЯМР (CDCl3): 0,70-3,50 (м, 10H), 7,14-7,80 (м, 15H). -1 ІК (см ): 2923, 1485, 1448, 708. Приклад одержання 6 Синтез 1-(трифенілметил)піролідину (сполука 6) (Сполука 6) Піролідин (0,26 г, 3,66 ммоль) (Wako Pure Chemical Industries, Ltd.), трифенілхлорметан (1,02 г, 3,66 ммоль) (Wako Pure Chemical Industries, Ltd.) і карбонат калію (0,51 г, 3,66 ммоль) (Wako Pure Chemical Industries, Ltd.) додавали до ацетонітрилу (30 мл) (Wako Pure Chemical Industries, Ltd.) і суміш кип'ятили зі зворотним холодильником протягом 5 годин. Насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) додавали до реакційного розчину й суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (суміш н-гексан (Wako Pure Chemical Industries, Ltd.):етилацетат (Wako Pure Chemical Industries, Ltd.) = 9:l використовували як елюент) з одержанням зазначеної в заголовку сполуки (0,45 г, 80% вихід). Т. пл. 127-129°C. 1 Н-ЯМР (CDCl3): 1,53-1,65 (м, 4H), 2,00-2,30 (4H, м), 7,11-7,28 (м, 5H), 7,48-7,52 (м, 10H). -1 ІК (см ): 2961, 2819, 1486, 1448, 711. Приклад одержання 7 Синтез 1-(трифенілметил)піперазину (сполука 7) (Сполука 7) Піперазин (1,00 г, 11,6 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в N,Nдиметилформаміді (25 мл) (Wako Pure Chemical Industries, Ltd.), і поступово додавали трифенілхлорметан (0,65 г, 2,33 ммоль) (Wako Pure Chemical Industries, Ltd.); і суміш перемішували при кімнатній температурі протягом ночі. У реакційний розчин вливали воду й суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при 15 UA 107784 C2 5 10 15 20 25 30 35 40 зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовували суміш хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 9:1, як елюент). Залишок розчиняли в етилацетаті й насиченому водному розчині гідрокарбонаті натрію (Wako Pure Chemical Industries, Ltd.) і суміш струшували з наступним відділенням органічного шару. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і потім розчинник відганяли при зниженому тиску з одержанням зазначеної в заголовку сполуки (0,76 г, 99% вихід). 1 Н-ЯМР (CDCl3): 1,20-1,92 (м, 4H), 2,68-3,20 (м, 4H), 7,12-7,29 (10H, м), 7,32-7,60 (м, 5H). Приклад одержання 8 Синтез N-(трифенілметил)морфоліну (сполука 8) (Сполука 8) Морфолін (0,47 г, 5,39 ммоль) (Wako Pure Chemical Industries, Ltd.), трифенілхлорметан (1,50 г, 5,39 ммоль) (Wako Pure Chemical Industries, Ltd.) і карбонат калію (0,75 г, 5,39 ммоль) (Wako Pure Chemical Industries, Ltd.) додавали до N,N-диметилформаміду (5 мл) (Wako Pure Chemical Industries, Ltd.) і суміш перемішували при кімнатній температурі протягом ночі. Насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) додавали до реакційного розчину й суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію й розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (як елюент використовували суміш: н-гексан (Wako Pure Chemical Industries, Ltd.):етилацетат (Wako Pure Chemical Industries, Ltd.) = 9:1) з одержанням зазначеної в заголовку сполуки (0,42 г, 71% вихід). Т. пл. 168-172°C. 1 Н-ЯМР (CDCl3): 1,45-1,65 (м, 4H), 3,82-3,83 (м, 4H), 7,13-7,29 (м, 10H), 7,47-7,50 (м, 5H). -1 ІК (см ): 2846, 1490, 1447, 709. Приклад одержання 9 Синтез [дифеніл(4-піридил)]метанолу (сполука 9) (Сполука 9) Реактив Гріньяра одержували з магнію (0,21 г, 8,64 ммоль) (Wako Pure Chemical Industries, Ltd.) і бромбензолу (1,35 г, 8,60 ммоль) (Wako Pure Chemical Industries, Ltd.). У тетрагідрофурані (10 мл) (Wako Pure Chemical Industries, Ltd.) розчиняли 4-бензоїлпіридин (0,52 г, 28,4 ммоль) (Wako Pure Chemical Industries, Ltd.) і по краплях додавали реактив Гріньяра з наступним перемішуванням при кімнатній температурі протягом 5 годин. У реакційний розчин додавали насичений водний розчин хлориду амонію (Wako Pure Chemical Industries, Ltd.) і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (0,72 г, 97% вихід). 1 Н-ЯМР (CDCl3): 2,98 (м, 1H), 7,23-7,35 (м, 12H), 8,53-8,55 (м, 2H). Приклад одержання 10 Синтез 1-{[дифеніл(4-піридил)]метил}піперидину (сполука 10) (Сполука 10) 16 UA 107784 C2 5 10 15 20 25 30 35 40 45 Тіонілхлорид (1 мл) (Wako Pure Chemical Industries, Ltd.) додавали до сполуки 9, описаної вище (0,30 г, 1,15 ммоль), і суміш 30 хвилин кип'ятили зі зворотним холодильником. Потім розчинник відганяли при зниженому тиску. Залишок розчиняли в ацетонітрилі (20 мл) і в розчин додавали піперидин (0,75 г, 8,80 ммоль) (Wako Pure Chemical Industries, Ltd.) з наступним кип'ятінням зі зворотним холодильником протягом 3 годин. Суміш повертали до кімнатної температури й потім у неї додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) з наступним екстрагуванням етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (0,27 г, 71% вихід). Т. пл. 185-188°C 1 Н-ЯМР (CDCl3): 1,20-3,30 (м, 10H), 7,15-7,60 (м, 12H), 8,44-8,48 (м, 2H). -1 ІК (см ): 2923, 2811, 1590, 705. Приклад одержання 11 Синтез 1-(трифенілметил)сукциніміду (сполука 11) (Сполука 11) Сукцинімід (0,53 г, 5,35 ммоль) (Wako Pure Chemical Industries, Ltd.), трифенілхлорметан (1,49 г, 0,535 ммоль) (Wako Pure Chemical Industries, Ltd.) і карбонат калію (0,74 г, 5,35 ммоль) (Wako Pure Chemical Industries, Ltd.) додавали до ацетонітрилу (5 мл) (Wako Pure Chemical Industries, Ltd.) і суміш перемішували при кімнатній температурі протягом ночі. Насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) додавали до реакційного розчину й суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (хлороформ) (Wako Pure Chemical Industries, Ltd.) з одержанням зазначеної в заголовку сполуки (0,48 г, 26% вихід). 1 Н-ЯМР (CDCl3): 2,64 (м, 4H), 7,15-7,26 (м, 9H), 7,38-7,41 (м, 6H). -1 ІК (см ): 2928, 1490, 1455, 707. Приклад одержання 12 Синтез (R)-трифенілметил-3-піролідинолу (cполука 12) (Сполука 12) (R)-(+)-3-піролідинол (1,0 г, 11,5 ммоль) (Aldrich) і трифенілхлорметан (1,00 г, 3,59 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в ацетонітрилі (30 мл) (Wako Pure Chemical Industries, Ltd.) і суміш 3 години кип'ятили зі зворотним холодильником. Суміш залишали охолоджуватися до кімнатної температури й потім до реакційного розчину додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) з наступним екстрагуванням етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (0,73 г, 62% вихід). Т. пл. 137-139°C. 1 Н-ЯМР (CDCl3): 1,55-1,82 (м, 2H), 1,93-2,15 (м, 2H), 2,20-2,29 (м, 1H), 2,60-2,85 (м, 2H), 4,25 (уш. с, 1H), 7,13-7,46 (м, 10H), 7,51-7,52 (м, 5H). -1 ІК (см ): 3434, 2835, 1447, 710. Приклад одержання 13 17 UA 107784 C2 Синтез [(нафтил)феніл]метанолу (Сполука 13) 5 10 15 20 25 30 35 40 (Сполука 13) Реактив Гріньяра одержували з магнію (0,47 г, 19,6 ммоль) (Wako Pure Chemical Industries, Ltd.) і бромбензолу (3,10 г, 19,7 ммоль) (Wako Pure Chemical Industries, Ltd.). У тетрагідрофурані (10 мл) (Wako Pure Chemical Industries, Ltd.) розчиняли 2-нафтальдегід (2,00 г, 12,8 ммоль) (Aldrich) і в розчин додавали реактив Гріньяра з наступним перемішуванням при кімнатній температурі протягом 1 години. До реакційного розчину додавали розведену хлористоводневу кислоту (Wako Pure Chemical Industries, Ltd.) і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням похідного кетону, що є проміжною сполукою (2,97 г, >100%). Проміжну сполуку (2,97 г, 19,6 ммоль) розчиняли в метанолі (30 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали боргідрид натрію (0,83 г, 21,9 ммоль) (Wako Pure Chemical Industries, Ltd.) з наступним перемішуванням при кімнатній температурі протягом 2 годин. Реакційний розчин концентрували при зниженому тиску й потім залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (2,72 г, 91% вихід). 1 Н-ЯМР (CDCl3): 2,38 (ушир. с, 1H), 6,00 (с, 1H), 7,20-7,42 (м, 7H), 7,79-7,89 (м, 5H). Приклад одержання 14 Синтез [біс(4-метилфеніл)]метанолу (сполука 14) (Сполука 14) Використовували 4,4’-диметилбензофенон (Wako Pure Chemical Industries, Ltd.) і боргідрид натрію (Wako Pure Chemical Industries, Ltd.) з одержанням зазначеної в заголовку сполуки способом, аналогічним способу одержання сполуки 13. 1 Н-ЯМР (CDCl3): 2,31 (с, 6H), 5,76 (с, 1H), 7,12 (д, J=7,8 Гц, 4H), 7,23 (д, J=7,8 Гц, 4H). Приклад одержання 15 Синтез [біс(4-метоксифеніл)]метанолу (сполука 15) (Сполука 15) Використовували 4,4’-диметоксибензофенон (Aldrich) і боргідрид натрію (Wako Pure Chemical Industries, Ltd.), щоб зазначеним у заголовку способом, аналогічним способу одержання сполуки 13, одержати сполуку. 1 Н-ЯМР (CDCl3): 2,10 (с, 1H), 3,79 (с, 6H), 5,75 (с, 1H), 6,86 (дд, J=2,1 Гц, J=15,4 Гц, 4H), 7,27 (дд, J=2,1 Гц, J=15,4 Гц, 4H). Приклад одержання 16 Синтез ди(2-піридил)фенілметанолу (Сполука 16) (Сполука 16) Реактив Гріньяра одержували з магнію (Wako Pure Chemical Industries, Ltd.) і бромбензолу (Wako Pure Chemical Industries, Ltd.) способом, аналогічним способу, описаному при одержанні сполуки 13, і ди(2-піридилкетон) (Aldrich) залишали взаємодіяти з реактивом з одержанням зазначеної в заголовку сполуки. 1 Н-ЯМР (CDCl3): 1,86 (с, 1H), 7,05-7,37 (м, 7H), 7,64-7,71 (м, 4H), 8,62 (д, J=0,9 Гц, 2H). -1 ІК (см ): 3397, 1577, 1513, 734. 18 UA 107784 C2 Приклад одержання 17 Синтез [дифеніл(4-метоксифеніл)]метанолу (сполука 17) 5 10 15 20 25 30 35 (Сполука 17) Реактив Гріньяра одержували з магнію (Wako Pure Chemical Industries, Ltd.) і параброманізолу, способом, аналогічним способу, описаному при одержанні сполуки 13; і бензофенон залишали взаємодіяти з реактивом з одержанням зазначеної в заголовку сполуки. Т. пл. 79-81°C. 1 Н-ЯМР (CDCl3): 2,75 (с, 1H), 3,79 (с, 3H), 6,82 (дд, J=3,0 Гц, J=9,6 Гц, 2H), 7,2-7,3 (м, 12H). -1 ІК (см ) : 3479, 1607, 1508, 1249. Приклад одержання 18 Синтез [біс(4-метоксифеніл)феніл]метанолу (сполука 18) (Сполука 18) Реактив Гріньяра одержували з магнію (Wako Pure Chemical Industries, Ltd.) і бромбензолу способом, аналогічним способу, описаному при одержанні сполуки 13; і 4,4’диметоксибензофенон залишали взаємодіяти з реактивом з одержанням зазначеної в заголовку сполуки. 1 Н-ЯМР (CDCl3): 3,80 (с, 6H), 6,82 (дд, J=2,7 Гц, J=6,6 Гц, 2H), 7,17 (дд, J=2,1 Гц, J=6,6 Гц, 2H), 7,2-7,3 (м, 9H). -1 ІК (см ): 3447, 1605, 1506, 1245. Приклад одержання 19 Синтез 1-[[(4-метоксифеніл)дифеніл]метил]піперидину (сполука 19) (Сполука 19) [(4-метоксифеніл)дифеніл]метилхлорид (0,79 г, 2,56 ммоль) (Tokyo Chemical Industry Co., Ltd.) розчиняли в ацетонітрилі (15 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали піперидин (1,20 г, 14,1 ммоль) (Wako Pure Chemical Industries, Ltd.). Суміш 1 годину кип'ятили зі зворотним холодильником і потім розчинник відганяли при зниженому тиску. До концентрованого залишку додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) і воду й суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на оксиді алюмінію (використовуючи н-гексан (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (0,79 г, 86% вихід). Т. пл. 63-67°C. 1 Н-ЯМР (CDCl3): 0,70-3,50 (м, 10H), 3,77 (с, 3H), 6,79 (д, J=9,0 Гц, 2H), 7,10-7,6 (м, 12H). -1 ІК (см ): 2924, 1507, 1441, 712. Приклад одержання 20 Синтез 1-[[біс(4-метоксифеніл)феніл]метил]піперидину (сполука 20) 19 UA 107784 C2 5 10 15 20 25 30 35 (Сполука 20) В ацетонітрилі (15 мл) (Wako Pure Chemical Industries, Ltd.) розчиняли 4,4’диметокситритилхлорид (0,83 г, 2,45 ммоль) (Tokyo Chemical Industry Co., Ltd.) і в розчин додавали піперидин (1,24 г, 14,6 ммоль) (Wako Pure Chemical Industries, Ltd.). Суміш кип'ятили зі зворотним холодильником 1 годину й розчинник відганяли при зниженому тиску. До концентрованого залишку додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар промивали водою й насиченим сольовим розчином. Потім органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на оксиді алюмінію (використовуючи як елюент н-гексан (Wako Pure Chemical Industries, Ltd.) → хлороформ (Wako Pure Chemical Industries, Ltd.): н-гексан (Wako Pure Chemical Industries, Ltd. ) = 1:4) з одержанням зазначеної в заголовку сполуки (0,81 г, 85% вихід). Т. пл. 67-70°C. 1 Н-ЯМР (CDCl3): 0,70-3,50 (м, 10H), 3,77 (с, 6H), 6,79 (д, J=9,0 Гц, 4H),7,08-7,53 (м, 9H). -1 ІК (см ): 2927, 1507, 1249, 1177, 1035. Приклад одержання 21 Синтез 1-[трис(4-метоксифеніл)метил]піперидину (сполука 21) (Сполука 21) В ацетонітрилі (8 мл) (Wako Pure Chemical Industries, Ltd.) розчиняли 4,4’4’’триметокситритилхлорид (0,51 г, 1,38 ммоль) (Aldrich) і в розчин додавали піперидин (0,70 г, 8,22 ммоль) (Wako Pure Chemical Industries, Ltd.). Суміш 1 годину кип'ятили зі зворотним холодильником і потім розчинник відганяли при зниженому тиску. До концентрованого залишку додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар промивали водою й насиченим сольовим розчином. Після цього органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на оксиді алюмінію (використовуючи як елюент суміш хлороформ (Wako Pure Chemical Industries, Ltd.): н-гексан (Wako Pure Chemical Industries, Ltd.)=1:4) з одержанням зазначеної в заголовку сполуки (0,28 г, 49% вихід). Т. пл. 73-75°C. 1 Н-ЯМР (CDCl3): 0,70-3,50 (м, 10H), 3,77 (с, 9H), 6,78 (д, J=9,0 Гц, 6H), 7,36 (д, J=7,8 Гц, 6H). -1 ІК (см ): 2928, 1507, 1249, 1175, 1036. Приклад одержання 22 Синтез трис(4-метилфеніл)метанолу (сполука 22) 20 UA 107784 C2 5 10 15 20 25 30 35 (Сполука 22) Реактив Гріньяра одержували з магнію (0,14 г, 5,76 ммоль) (Wako Pure Chemical Industries, Ltd.) і п-бромтолуолу (0,48 г, 5,45 ммоль) (Wako Pure Chemical Industries, Ltd.). У тетрагідрофурані (5 мл) (KANTO CHEMICAL CO., INC.) розчиняли 4,4’-диметилбензофенон (0,60 г, 2,85 ммоль) (Wako Pure Chemical Industries, Ltd.) і при охолодженні льодом по краплях додавали до реактиву Гріньяра з наступним перемішуванням при кімнатній температурі протягом 4 годин. До реакційного розчину при охолодженні льодом додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар промивали насиченим сольовим розчином. Після цього органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи як елюент суміш: н-гексан (Wako Pure Chemical Industries, Ltd.):етилацетат (Wako Pure Chemical Industries, Ltd.) = 19:l) з одержанням зазначеної в заголовку сполуки (0,74 г, 86% вихід). Т. пл. 91-94°C. 1 Н-ЯМР (CDCl3): 2,33 (с, 9H), 2,68 (с, 1H), 7,08-7,17 (м, 12H). -1 ІК (см ): 3466, 1510, 1010, 818, 784. Приклад одержання 23 Синтез [біс(4-метилфеніл)феніл]метанолу (сполука 23) (Сполука 23) Реактив Гріньяра одержували з магнію (Wako Pure Chemical Industries, Ltd.) і бромбензолу (Wako Pure Chemical Industries, Ltd.) способом, аналогічним способу, описаному при одержанні сполуки 13; і 4,4’-диметилбензофенон (Wako Pure Chemical Industries, Ltd.) залишали взаємодіяти з реактивом з одержанням зазначеної в заголовку сполуки. Т. пл. 73-76°C. 1 Н-ЯМР (CDCl3): 2,38 (с, 6H), 2,72 (с, 1H), 7,09-7,17 (м, 8H), 7,26-7,28 (м, 5H). -1 ІК (см ): 3466, 1510, 1446, 1009, 816, 755, 701. Приклад одержання 24 Синтез [дифеніл(4-метилфеніл)]метанолу (сполука 24) (Сполука 24) Реактив Гріньяра одержували з магнію (Wako Pure Chemical Industries, Ltd.) і п-бромтолуолу (Wako Pure Chemical Industries, Ltd.) способом, аналогічним способу, описаному при одержанні сполуки 13; і бензофенон (Wako Pure Chemical Industries, Ltd.) залишали взаємодіяти з реактивом з одержанням зазначеної в заголовку сполуки. Т. пл. 68-71°C. 21 UA 107784 C2 Н-ЯМР (CDCl3): 2,34 (с, 3H), 2,76 (с, 1H), 7,13-7,17 (м, 4H), 7,26-7,32 (м, 10H). -1 ІК (см ): 3466, 1510, 1445, 1010, 815, 757, 700. Приклад одержання 25 Синтез [[дифеніл(4-метилфеніл)]метил]піперидину (сполука 25) 1 5 10 15 20 25 30 35 40 45 (Сполука 25) Сполуку 24, описану вище (0,17 г, 0,620 ммоль), розчиняли в хлороформі (4 мл) (Wako Pure Chemical Industries, Ltd.) і при охолодженні льодом по краплях додавали тіонілхлорид (0,5 мл) (Wako Pure Chemical Industries, Ltd.). Cуміш повертали до кімнатної температури й 2 години перемішували; потім розчинник відганяли при зниженому тиску з одержанням залишку. Залишок розчиняли в ацетонітрилі (4 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали піперидин (0,19 г, 2,23 ммоль) (Wako Pure Chemical Industries, Ltd.). Суміш кип’ятили 1 годину зі зворотним холодильником і залишали охолоджуватися до кімнатної температури. Розчинник відганяли при зниженому тиску й потім до концентрованого залишку додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар промивали водою й насиченим сольовим розчином. Потім органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на оксиді алюмінію (використовуючи н-гексан (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (0,18 г, 85% вихід). Т. пл. 63-67°C. 1 Н-ЯМР (CDCl3): 0,70-3,50 (м, 10H), 2,29 (с, 3H), 7,02-7,18 (м, 4H), 7,19-7,29 (м, 5H), 7,307,55 (м, 5H). -1 ІК (см ): 2922, 2809, 1489, 1447, 711, 701. Приклад одержання 26 Синтез 1-[[біс(4-метилфеніл)феніл]метил]піперидину (сполука 26) (Сполука 26) Сполуку 23, описану вище (0,17 г, 0,589 ммоль) розчиняли в хлороформі (4 мл) (Wako Pure Chemical Industries, Ltd.), і при охолодженні льодом по краплях додавали тіонілхлорид (0,5 мл) (Wako Pure Chemical Industries, Ltd.). Суміш повертали до кімнатної температури й перемішували 1 годину; потім розчинник відганяли при зниженому тиску, щоб одержати залишок. Залишок розчиняли в ацетонітрилі (4 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали піперидин (0,19 г, 2,23 ммоль) (Wako Pure Chemical Industries, Ltd.). Суміш кип'ятили зі зворотним холодильником 45 хвилин і залишали охолоджуватися до кімнатної температури. Розчинник відганяли при зниженому тиску й потім до концентрованого залишку додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.); і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар промивали водою й насиченим сольовим розчином. Потім органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на оксиді алюмінію (використовуючи як елюент н-гексан (Wako Pure Chemical Industries, Ltd.)) з одержанням зазначеної в заголовку сполуки. Т. пл. 68-71°C. 1 Н-ЯМР (CDCl3): 0,70-3,50 (м, 10H), 2,29 (с, 6H), 7,04-7,46 (м, 13H). -1 ІК (см ): 2922, 1507, 1445, 752, 723. 22 UA 107784 C2 Приклад одержання 27 Синтез 1-[трис(4-метилфеніл)метил]піперидину (сполука 27) 5 10 15 20 25 30 35 40 (Сполука 27) Сполуку 22, описану вище, (0,17 г, 0,562 ммоль) розчиняли в хлороформі (4 мл) (Wako Pure Chemical Industries, Ltd.), і при охолодженні льодом по краплях додавали тіонілхлорид (0,5 мл) (Wako Pure Chemical Industries, Ltd.). Суміш повертали до кімнатної температури, 2 години перемішували й потім при зниженому тиску відганяли розчинник з одержанням залишку. Залишок розчиняли в ацетонітрилі (4 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали піперидин (0,19 г, 2,23 ммоль) (Wako Pure Chemical Industries, Ltd.). Суміш кип'ятили зі зворотним холодильником 1 годину й залишали охолоджуватися до кімнатної температури. Розчинник відганяли при зниженому тиску, і потім до концентрованого залишку додавали насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) і суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар промивали водою й насиченим сольовим розчином. Потім органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на оксиді алюмінію (використовуючи як елюент нгексан (Wako Pure Chemical Industries, Ltd.)) з одержанням зазначеної в заголовку сполуки (0,19 г, 92% вихід). 1 Н-ЯМР (CDCl3): 0,70-3,50 (м, 10H), 2,28 (с, 9H), 7,04 (д, J=8,4 Гц, 6H), 7,23-7,40 (м, 6H). -1 ІК (см ): 2922, 1508, 1185, 807, 781, 569. Приклад одержання 28 Синтез 1-(дифенілметил)піролідину (Сполука 28) (Сполука 28) Хлордифенілметан (0,50 г, 2,47 ммоль) (Wako Pure Chemical Industries, Ltd.), піролідин (0,53 г, 7,45 ммоль) (Tokyo Chemical Industry Co., Ltd.) і йодид калію (0,10 г, 0,60 ммоль) (Wako Pure Chemical Industries, Ltd.) додавали до ацетонітрилу (20 мл) (Wako Pure Chemical Industries, Ltd.) і суміш 2 години кип'ятили зі зворотним холодильником. Суміш залишали охолоджуватися до кімнатної температури. Після цього насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) додавали до реакційного розчину й суміш екстрагували етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи як елюент суміш: хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 99:l) з одержанням зазначеної в заголовку сполуки (0,36 г, 61% вихід). Т. пл. 69-72°C. 1 Н-ЯМР (CDCl3): 1,73-1,79 (м, 4H), 2,40-2,44 (м, 4H), 4,15 (с, 1H), 7,12-7,47 (м, 10H). -1 ІК (см ) : 2793, 1452, 703. Приклад одержання 29 Синтез 1-[біс(4-метилфеніл)метил]піролідину (Сполука 29) (Сполука 29) 23 UA 107784 C2 5 10 15 20 25 30 35 40 Сполуку 14 (0,30 г, 1,41 ммоль) розчиняли в тіонілхлориді (1 мл) (Wako Pure Chemical Industries, Ltd.), і суміш кип'ятили зі зворотним холодильником 2 години. Реакційний розчин концентрували при зниженому тиску з одержанням осаду. Осад розчиняли в ацетонітрилі (5 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали піролідин (0,50 г, 7,03 ммоль). Суміш 2 години кип'ятили зі зворотним холодильником і потім залишали охолоджуватися до кімнатної температури. Насичений водний розчин гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.) додавали до реакційного розчину, і потім суміш екстрагували етилацетатом. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (як елюент використовуючи суміш: хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 99:1) з одержанням зазначеної в заголовку сполуки (0,32 г, 84% вихід). Т. пл. 61-63°C. 1 Н-ЯМР (CDCl3): 1,74-1,78 (м, 4H), 2,40 (с, 6H), 2,35-2,45 (м, 4H), 4,01 (с, 1H), 7,05 (д, J=7,8 Гц, 4H), 7,32 (д, J=7,8 Гц, 4H). -1 ІК (см ): 2962, 2802, 1509, 721. Приклад одержання 30 Синтез N-(трифенілметил)-N-етиламіну (сполука 30) (Сполука 30) Трифенілметиламін (1,00 г, 3,86 ммоль) (Wako Pure Chemical Industries, Ltd.) і йодетан (1,50 г, 9,62 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в ацетонітрилі (5 мл) (Wako Pure Chemical Industries, Ltd.) і суміш залишали в нерухомому стані при кімнатній температурі протягом 3 днів. Розчинник відганяли при зниженому тиску й залишок піддавали колонковій хроматографії на силікагелі (як елюент використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.)) з одержанням зазначеної в заголовку сполуки (0,31 г, 28% вихід). Т. пл. 75-77°C. 1 Н-ЯМР (CDCl3): 1,06 (т, J=6,9 Гц, 3H), 1,98 (т, J=6,9 Гц, 2H), 7,13-7,45 (м, 15H). Приклад одержання 31 Синтез 2-[[дифеніл(4-метоксифеніл)]метилокси]етанолу (сполука 31) (Сполука 31) Етиленгліколь (1,00 г, 16,1 ммоль) (Wako Pure Chemical Industries, Ltd.), 4метокситрифенілхлорид (1,00 г, 3,23 ммоль) (Wako Pure Chemical Industries, Ltd.) і триетиламін (0,89 г, 8,81 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в метиленхлориді (50 мл) (Wako Pure Chemical Industries, Ltd.) і суміш перемішували при кімнатній температурі протягом ночі. До реакційного розчину додавали воду (50 мл) і суміш екстрагували метиленхлоридом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (як елюент використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.)) з одержанням зазначеної в заголовку сполуки (0,91 г, 84% вихід). 1 Н-ЯМР (CDCl3): 3,25 (д, J=5,1 Гц, 2H), 3,78 (д, J=5,1 Гц, 2H), 3,79 (с, 3H), 6,83 (д, J=9,0 Гц, 2H), 7,25-7,54 (м, 12H). -1 ІК (см ): 3419, 1607, 1509, 1251. Приклад одержання 32 Синтез 2-[біс(4-метоксифеніл)фенілметилокси]етанолу (сполука 32) 24 UA 107784 C2 5 10 15 20 25 30 35 (Сполука 32) Етиленгліколь (0,92 г, 14,8 ммоль) (Wako Pure Chemical Industries, Ltd.), 4,4’диметокситритилхлорид (1,00 г, 2,95 ммоль) (Wako Pure Chemical Industries, Ltd.) і триетиламін (0,89 г, 8,81 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в метиленхлориді (25 мл) (Wako Pure Chemical Industries, Ltd.). Суміш перемішували при кімнатній температурі протягом ночі. До реакційного розчину додавали воду (50 мл) і суміш екстрагували метиленхлоридом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (0,51 г, 47% вихід). 1 Н-ЯМР (ДМСО): 3,25 (т, J=5,1 Гц, 2H), 3,79 (т, J=5,1 Гц, 2H), 3,79 (м, 6H), 6,83 (дд, J=2,4 Гц, J=6,9 Гц, 4H), 7,13-7,45 (м, 9H). -1 ІК (см ): 3398, 1607, 1510, 1251. [0157] Приклад одержання 33 Синтез 2-[[дифеніл(4-метоксифеніл)]метиламіно]етанолу (сполука 33) (Сполука 33) 4-метокситритилхлорид (2,77 г, 9,00 ммоль) (Wako Pure Chemical Industries, Ltd.) аміноетанол (2,74 г, 44,9 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в ацетонітрилі (50 мл) (Wako Pure Chemical Industries, Ltd.) і суміш перемішували при кімнатній температурі протягом ночі. Туди додавали етилацетат (Wako Pure Chemical Industries, Ltd.) і воду й суміш екстрагували. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (2,01 г, 67% вихід). 1 Н-ЯМР (CDCl3): 2,36 (т, J=5,1 Гц, 2H), 3,68 (т, J=5,1 Гц, 2H), 3,80 (с, 3H), 6,81 (д, J=9,0 Гц, 2H), 7,23-7,55 (м, 12H). -1 ІК (см ): 3323, 1609, 1508, 1249. Приклад одержання 34 Синтез 2-[[біс(4-метоксифеніл)феніл]метиламіно]етанолу (сполука 34) (Сполука 34) В ацетонітрилі (20 мл) (Wako Pure Chemical Industries, Ltd.) розчиняли 4,4’диметокситритилхлорид (0,50 г, 1,48 ммоль) (Wako Pure Chemical Industries, Ltd.) і аміноетанол (0,27 г, 4,42 ммоль) (Wako Pure Chemical Industries, Ltd.). Суміш перемішували при кімнатній температурі протягом ночі. У неї додавали етилацетат (Wako Pure Chemical Industries, Ltd.) і воду й суміш екстрагували. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням зазначеної в заголовку сполуки (0,43 г, 80% вихід). 25 UA 107784 C2 Н-ЯМР (CDCl3): 2,87 (т, J=5,1 Гц, 2H), 3,14 (т, J=5,1 Гц, 2H), 3,79 (с, 6H), 6,82 (дд, J=2,7 Гц, J=6,9 Гц, 4H), 7,21-7,56 (м, 9H). -1 ІК (см ) : 3380, 1609, 1177. Приклад одержання 35 Синтез 2-[[дифеніл(4-метоксифеніл)]метилокси]етиламіну (сполука 35) 1 5 10 15 20 25 30 35 40 45 (Сполука 35) 4-метокситритилхлорид (2,00 г, 6,48 ммоль) (Wako Pure Chemical Industries, Ltd.), 1-(2тритилоксіетил)піперидин-2,5-діон (1,24 г, 6,48 ммоль) (Wako Pure Chemical Industries, Ltd.) і триетиламін (1,96 г, 19,4 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в метиленхлориді (30 мл) (Wako Pure Chemical Industries, Ltd.) і суміш перемішували при кімнатній температурі протягом ночі. Суміш вливали в змішаний розчин метиленхлориду (Wako Pure Chemical Industries, Ltd.) і розведеної хлористоводневої кислоти (Wako Pure Chemical Industries, Ltd.) і суміш струшували з наступним відділенням органічного шару. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і потім фільтрували на вакуум-фільтрі й концентрували при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням проміжної сполуки (2,67 г, 89% вихід). Проміжну сполуку (0,50 г, 1,10 ммоль) розчиняли в метанолі (10 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали гідразин (2 мл) (Wako Pure Chemical Industries, Ltd.) з наступним перемішуванням при кімнатній температурі протягом 1 години. Розчинник відганяли при зниженому тиску й потім залишок додавали до змішаного розчину хлороформу (Wako Pure Chemical Industries, Ltd.) і насиченого водного розчину гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.). Суміш струшували й потім органічний шар відокремлювали. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і потім фільтрували на вакуум-фільтрі й концентрували при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи як елюент суміш: хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 9:1) з одержанням зазначеної в заголовку сполуки (0,20 г, 57% вихід). 1 Н-ЯМР (CDCl3): 2,87 (т, J=5,4 Гц, 2H), 3,16 (т, J=5,4 Гц, 2H), 3,79 (с, 3H), 6,83 (дд, J=2,1 Гц, J=6,9 Гц, 2H), 7,21-7,56 (м, 12H). -1 ІК (см ): 3385, 1607, 1510, 1251. Приклад одержання 36 Синтез 2-[[біс(4-метоксифеніл)феніл]метилокси]етиламіну (сполука 36) (Сполука 36) 4,4’-диметокситритилхлорид (1, 00 г, 2,95 ммоль) (Wako Pure Chemical Industries, Ltd.), 1-(2тритилоксіетил)піролідин-2,5-діон (0,57 г, 3,00 ммоль) (Wako Pure Chemical Industries, Ltd.) і триетиламін (0,89 г, 8,81 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в метиленхлориді (20 мл) (Wako Pure Chemical Industries, Ltd.) і суміш перемішували при кімнатній температурі протягом ночі. Суміш вливали в змішаний розчин метиленхлориду (Wako Pure Chemical Industries, Ltd.) і розведеної хлористоводневої кислоти (Wako Pure Chemical Industries, Ltd.) і суміш струшували з наступним відділенням органічного шару. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і потім фільтрували на вакуум-фільтрі й концентрували при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.) як елюент) з одержанням проміжної сполуки (0,93 г, 64% вихід). Проміжну сполуку (0,93 г, 1,88 ммоль) розчиняли в метанолі (25 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали гідразин (4 мл) (Wako Pure Chemical Industries, Ltd.) з 26 UA 107784 C2 5 10 15 20 25 30 35 40 наступним перемішуванням при кімнатній температурі протягом 1 години. Розчинник відганяли при зниженому тиску й потім залишок додавали до змішаного розчину хлороформу (Wako Pure Chemical Industries, Ltd.) і насиченого водного розчину гідрокарбонату натрію (Wako Pure Chemical Industries, Ltd.). Суміш струшували й потім органічний шар відокремлювали. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і потім фільтрували на вакуум-фільтрі й концентрували при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи як елюент суміш: хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 9:1) з одержанням зазначеної в заголовку сполуки (0,33 г, 49% вихід). 1 Н-ЯМР (CDCl3): 2,85 (т, J=5,1 Гц, 2H), 3,13 (т, J=5,1 Гц, 2H), 3,79 (с, 6H), 6,81 (д, J=9,0 Гц, 4H), 7,36-7,53 (м, 9H). -1 ІК (см ): 3385, 1608, 1508, 1176. Приклад одержання 37 Синтез N,N-[біс(2-гідроксіетил)]-N-(трифенілметил)аміну (Сполука 37) (Сполука 37) Розчин трифенілхлорметану (2,01 г, 7,20 ммоль) (Wako Pure Chemical Industries, Ltd.) у метиленхлориді (12 мл) (Wako Pure Chemical Industries, Ltd.) по краплях протягом 20 хвилин додавали до розчину діетаноламіну (1,67 г, 15,9 ммоль) (Wako Pure Chemical Industries, Ltd.) в N,N-диметилформаміді (13 мл) (Wako Pure Chemical Industries, Ltd.) при охолодженні льодом і перемішуванні. Суміш повертали до кімнатної температури й перемішували протягом ночі й потім туди додавали діетиловий ефір (Wako Pure Chemical Industries, Ltd.) і воду з наступним екстрагуванням. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок перекристалізовували із суміші хлороформ (Wako Pure Chemical Industries, Ltd.)/ н-гексан (Wako Pure Chemical Industries, Ltd.) з одержанням зазначеної в заголовку сполуки (1,24 г, 49% вихід). Т. пл. 159-160°C. 1 Н-ЯМР (CDCl3): 2,58 (т, J=6,3 Гц, 4H), 3,78 (т, J=6,3 Гц, 4H), 7,13-7,31 (м, 9H), 7,58-7,62 (м, 6H). Приклад одержання 38 Синтез 1,2-дигідрокси-3-(трифенілметилокси)пропану (сполука 38) (Сполука 38) Гліцерин (3,02 г, 32,8 ммоль) (Wako Pure Chemical Industries, Ltd.) і трифенілхлорметан (1,00 г, 3,50 ммоль) (Wako Pure Chemical Industries, Ltd.) розчиняли в піридині (20 мл) (Wako Pure Chemical Industries, Ltd.) і суміш 5 годин кип'ятили зі зворотним холодильником. Суміш залишали охолоджуватися до кімнатної температури й потім у неї додавали воду з наступним екстрагуванням етилацетатом (Wako Pure Chemical Industries, Ltd.). Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи суміш: хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 97:3) з одержанням зазначеної в заголовку сполуки (0,50 г, 42% вихід). Т. пл. 108-110°C. 1 Н-ЯМР (CDCl3): 3,22-3,34 (м, 2H), 3,54-3,81 (м, 2H), 3,85-3,99 (м, 1H), 7,22-7,54 (м, 15H). Приклад одержання 39 Синтез N-(трифенілметил)серину (сполука 39) 27 UA 107784 C2 5 10 15 20 25 30 35 40 (Сполука 39) L-серин (2,10 г, 20,0 моль) (Wako Pure Chemical Industries, Ltd.) розчиняли в метиленхлориді (20 мл) (Wako Pure Chemical Industries, Ltd.) і потім додавали триметилсилілхлорид (8,9 мл) (Shin-Etsu Chemical Co., Ltd.) з наступним кип'ятінням зі зворотним холодильником протягом 20 хвилин. Суміш повертали до кімнатної температури й потім додавали триетиламін (10 мл) (Wako Pure Chemical Industries, Ltd.) з наступним кип'ятінням зі зворотним холодильником протягом 45 хвилин. Суміш прохолоджували на льоді й потім у неї додавали триетиламін (2,8 мл) (Wako Pure Chemical Industries, Ltd.) і трифенілхлорметан (5,61 г, 20,1 ммоль) (Wako Pure Chemical Industries, Ltd.) з наступним перемішуванням при кімнатній температурі протягом 5 годин. До реакційного розчину додавали надлишкову кількість метанолу (Wako Pure Chemical Industries, Ltd.) і суміш концентрували при зниженому тиску. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (використовуючи як елюент суміш: хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 99:1) з одержанням зазначеної в заголовку сполуки (0,36 г, 5% вихід). 1 Н-ЯМР (CDCl3): 2,83-2,92 (м, 2H), 3,51 (м, 1H), 3,67-3,77 (м, 1H), 7,20-7,44 (м, 15H). Приклад одержання 40 Синтез 1-[(дифенілпіридил)метил]імідазолу (сполука 40) (Сполука 40) Сполуку 9, описану вище, (0,35 г, 1,34 ммоль) розчиняли в тіонілхлориді (2 мл) (Wako Pure Chemical Industries, Ltd.) і суміш 30 хвилин кип'ятили зі зворотним холодильником. Реакційний розчин залишали охолоджуватися до кімнатної температури й потім розчинник відганяли при зниженому тиску. Залишок розчиняли в ацетонітрилі (30 мл) (Wako Pure Chemical Industries, Ltd.) і в розчин додавали імідазол (1,50 г, 2,20 ммоль) з наступним кип'ятінням зі зворотним холодильником протягом 3 годин. Реакційний розчин залишали охолоджуватися до кімнатної температури й потім додавали воду й етилацетат (Wako Pure Chemical Industries, Ltd.). Суміш струшували, і потім органічний шар відокремлювали. Органічний шар сушили безводним сульфатом натрію (Wako Pure Chemical Industries, Ltd.) і фільтрували на вакуум-фільтрі й потім розчинник відганяли при зниженому тиску. Залишок піддавали колонковій хроматографії на силікагелі (як елюент використовуючи хлороформ (Wako Pure Chemical Industries, Ltd.)(хлороформ (Wako Pure Chemical Industries, Ltd.):метанол (Wako Pure Chemical Industries, Ltd.) = 99:1) з одержанням зазначеної в заголовку сполуки (266 г, 62% вихід). Т. пл. 210-212°C. 1 Н-ЯМР (CDCl3): 6,80 (д, 1H, J=1,2 Гц), 7,07-7,14 (м, 7H), 7,35-7,38 (м, 6H), 7,45 (т, 1H, J=1,2 Гц), 8,62 (дд, 2H, J=1,5 Гц, J=4,5 Гц). Приклад одержання 41 Синтез 1-[біс(метилфеніл)метил]імідазолу (сполука 41) (Сполука 41) Тіонілхлорид (Wako Pure Chemical Industries, Ltd.) і імідазол (Wako Pure Chemical Industries, Ltd.) використовували, щоб тим же способом, що й спосіб, описаний вище для одержання 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMelanin production inhibitor
Автори російськоюYokoyama, Kouji, Kimura, Makoto, Tamai, Masashi, Saitoh, Yuko, Kato, Tomomi, Ikeda, Yu
МПК / Мітки
МПК: A61K 31/4545, A61Q 19/02, A61K 8/41, A61K 8/40, A61K 31/045, A61K 8/49, A61K 31/40, A61P 17/16, A61K 31/44, A61K 31/135, A61K 31/075, A61K 31/137, A61K 8/34
Мітки: продукування, меланіну, інгібітор
Код посилання
<a href="https://ua.patents.su/45-107784-ingibitor-produkuvannya-melaninu.html" target="_blank" rel="follow" title="База патентів України">Інгібітор продукування меланіну</a>
Попередній патент: Ізоіндолінові сполуки для застосування при лікуванні раку
Наступний патент: Спосіб, апарат і система для електролізу
Випадковий патент: Газова зброя












