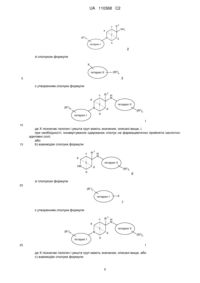
Місточкові похідні піперидину
Номер патенту: 110368
Опубліковано: 25.12.2015
Автори: Томас Ендрю, Лімберг Анья, Луебберс Томас, Грін Люк, Бауманн Карлхайнц
Формула / Реферат
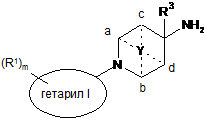
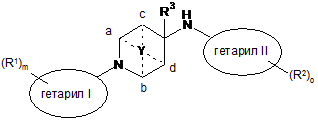
1. Сполука формули
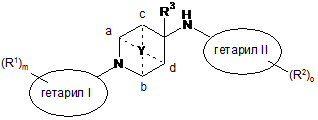 , I
, I
де
гетарил I є п'яти- чи шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N;
гетарил II є шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N, або є двокільцевою системою, що містить 1-4 гетероатоми, вибрані з S чи N, де щонайменше одне кільце є ароматичним;
R1 позначає нижчий алкіл, нижчий алкокси, нижчий алкіл, заміщений галогеном, або галоген;
R2 позначає нижчий алкіл, нижчий алкіл, заміщений галогеном, водень, нижчий алкокси, циклоалкіл, заміщений нижчим алкілом або нижчим алкілом, заміщеним галогеном, або позначає нижчий алкіл, заміщений гідрокси, фурил, О-бензил або -(СН2)р-феніл, можливо заміщений галогеном, нижчим алкокси, нижчим алкілом, заміщеним галогеном, нижчим алкілом або ціано;
R3 позначає водень або нижчий алкіл;
Y позначає -(СН2)n-, -СН2ОСН2-, -СН2О-, CH2S-, -CH2SCH2- та приєднаний до двох кільцевих атомів вуглецю - або до кільцевих атомів вуглецю а та b, або до кільцевих атомів вуглецю с та d;
р позначає 0 або 1;
m позначає 0, 1 або 2; якщо m дорівнює 2, то R1 можуть бути однаковими чи різними;
n позначає 2 або 3;
о позначає 0, 1 або 2, якщо о дорівнює 2, то R2 можуть бути однаковими чи різними;
або її фармацевтично активна кислотно-адитивна сіль.
2. Сполука формули І за п. 1
 ,
,
де
гетарил І позначає піридиніл, 1,2,4-тіадіазоліл, піразиніл або піримідиніл;
гетарил ІІ позначає [1,2,4]триазоло[1,5-а]піридиніл, [1,2,4]триазоло[1,5-а]піразиніл, 5,6,7,8-тетрагідро-[1,2,4]триазоло[1,5-а]піридиніл, [1,2,4]триазоло[1,5-с]піримідиніл, 4,5,6,7-тетрагідробензотіазоліл або піримідиніл;
R1 позначає метил, хлор або CF3;
R2 позначає метил, н-пропіл, фтор, хлор, трифторметил, метокси або позначає -С(СН3)2ОН, або позначає О-бензил, або позначає циклогексил, заміщений метилом чи трифторметилом, або позначає фурил, або позначає -(СН2)р-феніл, можливо заміщений одним, двома чи трьома атомами галогену, вибраними з F або Сl, або ціано чи метокси;
R3 позначає водень або метил;
Y позначає -(СН2)n- або позначає -СН2ОСН2-, або позначає -ОСН2-, або позначає -CH2SCH2-, або позначає -SCH2 та приєднаний до двох кільцевих атомів вуглецю - або до кільцевих атомів вуглецю а та b, або до кільцевих атомів вуглецю с та d;
р позначає 0 або 1;
m позначає 0, 1 або 2;
n позначає 2 або 3;
о позначає 1 або 2, якщо о дорівнює 2, то R2 можуть бути однаковими чи різними;
або її фармацевтично активні кислотно-адитивні солі.
3. Сполука формули І за будь-яким з пп. 1 або 2, де Y позначає -(СH2)2-, гетарил І позначає 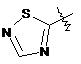 і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми.
і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми.
4. Сполука формули І за будь-яким з пп. 1-3, вибрана з групи, що включає:
[(рац)-3-екзо-8-(3-метил-[1,2,4]тіадіазол-5-іл)-8-азабіцикло[3.2.1]окт-3-ил]-(4-феніл-4,5,6,7-тетрагідробензотіазол-2-іл)амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4-фторфеніл)-6-метил-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4-фторфеніл)-6-фтор-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4-хлор-2-метоксифеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3-ціано-4-фторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3,4-дифторфеніл)-6-трифторметил-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-метокси-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-хлор-6-трифторметил-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5,6-диметил-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-бензилокси-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5-пропіл-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-(5-феніл-[1,2,4]триазоло[1,5-а]піразин-2-іл)амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5-трифторметил-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[6-хлор-8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[7-метил-5-пропіл-[1,2,4]триазоло[1,5-с]піримідин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4,4-диметилциклогексил)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-(7-фуран-2-іл-[1,2,4]триазоло[1,5-а]піримідин-2-іл)амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[7-трифторметил-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4-трифторметилциклогексил)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-(4-фторфеніл)-5,6,7,8-тетрагідро-[1,2,4]триазоло[1,5-а]піридин-2-іл]-[(рац)-8-екзо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін,
[(рац)-8-(3,4-дифторфеніл)-5,6,7,8-тетрагідро-[1,2,4]триазоло[1,5-а]піридин-2-іл]-[(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін.
5. Сполука формули І за будь-яким з пп. 1 або 2, де Y позначає -(СН2)2-, гетарил І позначає 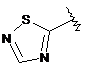 і гетарил II є шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N.
і гетарил II є шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N.
6. Сполука формули І за будь-яким з пп. 1, 2 або 5, де сполукою є:
2-{6-(4-хлорбензил)-2-[(рац)-3-ендо-8-(3-метил-[1,2,4]тіадіазол-5-іл)-8-азабіцикло[3.2.1]окт-3-иламіно]піримідин-4-іл}пропан-2-ол.
7. Сполука формули І за будь-яким з пп. 1 або 2, де Y позначає -(СН2)n-, гетарил І позначає 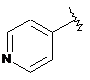 і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми.
і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми.
8. Сполука формули І за будь-яким з пп. 1, 2 або 7, вибрана з групи, що включає:
[(рац)-3-екзо-8-(2-хлорпіридин-4-іл)-8-азабіцикло[3.2.1]окт-3-ил]-[8-(3,4-дифторфеніл)-6-метил-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]-[(рац)-8-ендо-3-(2-трифторметилпіридин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін.
9. Сполука формули І за будь-яким з пп. 1 або 2, де гетероарил І позначає 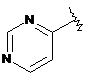 і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми, а інші радикали є такими, як визначено в п. 1.
і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми, а інші радикали є такими, як визначено в п. 1.
10. Сполука формули І за будь-яким з пп. 1, 2 або 9, вибрана з групи, що включає:
[(рац)-8-ендо-3-(6-метилпіримідин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-ендо-3-(6-метилпіримідин-4-іл)-6-окса-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-9-екзо-7-(6-метилпіримідин-4-іл)-3-тіа-7-азабіцикло[3,3,1]нон-9-іл]-[8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-9-ендо-3-(6-метилпіримідин-4-іл)-3-азабіцикло[3,3,1]нон-9-іл]-[8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-9-екзо-7-(6-метилпіримідин-4-іл)-3-окса-7-азабіцикло[3,3,1]нон-9-іл]-[8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[(рац)-8-екзо-метил-3-(6-метилпіримідин-4-іл)-3-азабіцикло[3.2.1]окт-8-ендо-ил]-[8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]амін,
[8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-а]піридин-2-іл]-[(рац)-8-ендо-3-(2-метилпіримідин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін.
11. Спосіб одержання сполук формули І за будь-яким з пп. 1-10, за яким:
проводять взаємодію сполуки формули
 2
2
зі сполукою формули
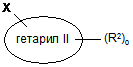 3
3
з утворенням сполуки формули
 , I
, I
де X позначає галоген і решта груп мають значення, описані вище, і,
за необхідності, одержану сполуку формули І перетворюють на фармацевтично прийнятну кислотно-адитивну сіль.
12. Спосіб одержання сполук формули І за будь-яким з пп. 1-10, за яким
проводять взаємодію сполуки формули
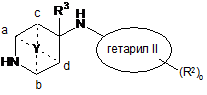 6
6
зі сполукою формули
 7
7
з утворенням сполуки формули
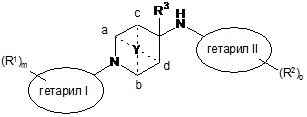 , I
, I
де X позначає галоген і решта груп мають значения, визначені вище в п.1, та,
за необхідності, одержану сполуку формули І перетворюють на фармацевтично прийнятну кислотно-адитивну сіль.
13. Спосіб одержання сполук формули І за будь-яким з пп. 1-10, за яким
проводять взаємодію сполуки формули
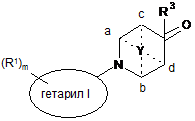 8
8
зі сполукою формули

з утворенням сполуки формули
 , I
, I
де групи мають значения, визначені вище в п. 1, та R3 позначає водень, і,
за необхідності, одержану сполуку формули І перетворюють на фармацевтично прийнятну кислотно-адитивну сіль.
14. Сполука за будь-яким з пп. 1-10, одержана способом за п. 11.
15. Лікарський засіб, що містить одну чи декілька сполук за будь-яким з пп. 1-10 та фармацевтично прийнятні ексципієнти.
16. Лікарський засіб за п. 13 для лікування хвороби Альцгеймера, церебральної амілоїдної ангіопатії, спадкової церебральної геморагії з амілоїдозом голландського типу (HCHWA-D), мультиінфарктної деменції, деменції боксерів та синдрому Дауна.
17. Застосування сполуки за будь-яким з пп. 1-10 у виробництві лікарських засобів для лікування хвороби Альцгеймера, церебральної амілоїдної ангіопатії, спадкової церебральної геморагії з амілоїдозом голландського типу (HCHWA-D), мультиінфарктної деменції, деменції боксерів та синдрому Дауна.
18. Сполука за будь-яким з пп. 1-10 для застосування як терапевтично активної речовини.
19. Застосування сполуки за будь-яким з пп. 1-10 для лікування хвороби Альцгеймера, церебральної амілоїдної ангіопатії, спадкової церебральної геморагії з амілоїдозом голландського типу (HCHWA-D), мультиінфарктної деменції, деменції боксерів та синдрому Дауна.
20. Сполука за будь-яким з пп. 1-10 для лікування хвороби Альцгеймера, церебральної амілоїдної ангіопатії, спадкової церебральної геморагії з амілоїдозом голландського типу (HCHWA-D), мультиінфарктної деменції, деменції боксерів та синдрому Дауна.
21. Спосіб лікування хвороби Альцгеймера, церебральної амілоїдної ангіопатії, спадкової церебральної геморагії з амілоїдозом голландського типу (HCHWA-D), мультиінфарктної деменції, деменції боксерів та синдрому Дауна, за яким суб’єкту вводять ефективну кількість сполуки за будь-яким з пп. 1-10.
Текст
Реферат: Даний винахід стосується сполук формули c R 3 a (R1)m N гетарил І гетарил ІІ Y d b H N (R2)o ,I де гетарил І є п'яти- чи шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N; гетарил II є шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N, або є двокільцевою системою, що містить 1-4 гетероатоми, 1 вибрані з S чи N, де щонайменше одне кільце є ароматичним; R позначає нижчий алкіл, 2 нижчий алкокси, нижчий алкіл, заміщений галогеном, або галоген; R позначає нижчий алкіл, нижчий алкіл, заміщений галогеном, , водень, нижчий алкокси, циклоалкіл, заміщений нижчим UA 110368 C2 (12) UA 110368 C2 алкілом або нижчий алкіл, заміщений галогеном, або позначає нижчий алкіл, заміщений гідрокси, або позначає фурил, або позначає О-бензил, -(СН2)р-феніл, можливо заміщений 3 галогеном, нижчий алкокси, нижчий алкіл, заміщений галогеном, нижчим алкілом або ціано; R позначає водень або нижчий алкіл; Y позначає -(СН2)n-, -СН2ОСН2-, -СН2О-, CH2S-, -CH2SCH2та приєднаний до двох кільцевих атомів вуглецю - або до кільцевих атомів вуглецю а та b, або до кільцевих атомів вуглецю с та d; p позначає 0 або 1; m позначає 0, 1 або 2; якщо m дорівнює 1 2, то R можуть бути однаковими чи різними; n позначає 2 або 3; о позначає 0, 1 або 2, якщо о 2 дорівнює 2, то R можуть бути однаковими чи різними; або їх фармацевтично активних кислотно-адитивних солей. Дані сполуки формули І є модуляторами амілоїду бета і, таким чином, вони можуть бути корисні для лікування або профілактики захворювань, асоційованих з відкладанням -амілоїду в головному мозку, зокрема хвороби Альцгеймера та інших захворювань, таких як церебральна амілоїдна ангіопатія, спадкова церебральна геморагія з амілоїдозом голландського типу (HCHWA-D), мультиінфарктна деменція, деменція боксерів та синдром Дауна. 3 a (1 R ) m N гт иІ ер ал RH c N гт иІ ер І ал Y d b (2 R ) o UA 110368 C2 Даний винахід стосується сполук формули c R 3 a (R1)m N гетарил І H N гетарил ІІ Y d b (R2)o l 5 10 15 20 25 30 35 40 45 50 гетарил I є п’яти- чи шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N; гетарил II є шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N, або є двокільцевою системою, що містить 1-4 гетероатоми, вибрані з S чи N, де щонайменше одне кільце є ароматичним; 1 R позначає нижчий алкіл, нижчий алкокси, нижчий алкіл, заміщений галогеном, або галоген; 2 R позначає нижчий алкіл, нижчий алкіл, заміщений галогеном, водень, нижчий алкокси, циклоалкіл, заміщений нижчим алкілом, або нижчий алкіл, заміщений галогеном, або позначає нижчий алкіл, заміщений гідрокси, фурил, O-бензил, або -(CH2)p-феніл, можливо заміщений галогеном, нижчий алкокси, нижчий алкіл, заміщений галогеном, нижчим алкілом або ціано; 3 R позначає водень або нижчий алкіл; Y позначає -(CH2)n-, -CH2OCH2-, -CH2O-, CH2S-, -CH2SCH2- та приєднаний до двох кільцевих атомів вуглецю - або до кільцевих атомів вуглецю a та b, або до кільцевих атомів вуглецю c та d; p позначає 0 або 1; 1 m позначає 0, 1 або 2; якщо m дорівнює 2, то R можуть бути однаковими чи різними; n позначає 2 або 3; 2 o позначає 0, 1 або 2, якщо o дорівнює 2, то R можуть бути однаковими чи різними; або їх фармацевтично активних кислотно-адитивних солей. Було встановлено, що сполуки формули I за даним винаходом є модуляторами для бетаамілоїду і, таким чином, вони можуть бути корисними для лікування або профілактики захворювання, зв’язаного з відкладанням β-амілоїду в мозку, зокрема, хвороби Альцгеймера, а також інших захворювань, таких как церебральна амілоїдна ангіопатія, спадкова церебральна геморагія з амілоїдозом голландського типу (HCHWA-D), мультиінфарктна деменція, деменція боксерів та синдром Дауна. Хвороба Альцгеймера (ХА) найчастіше є причиною слабоумства в похилому віці. Патологічно, ХА характеризується відкладанням амілоїду у позаклітинних та внутрішньоклітинних бляшках та нейрофібрилярних клубках в головному мозку. Амілоїдні бляшки в основному складаються з амілоїдних пептидів (Aβ пептиди), які походять з білкапопередника β-амілоїду (АРР) в результаті декількох стадій протеолітичного розщеплення. Деякі форми АРР були ідентифіковані, з них найбільш поширеними є білки довжиною 695, 751 та 770 амінокислот. Усі вони походять з одного гена шляхом диференційованого сплайсингу. Aβ пептиди походять з одного домену APP. Aβ пептиди продукуються з АРР в результаті послідовної дії двох протеолітичних ферментів, називаних β- та γ-секретазами. β-секретаза першою розщеплює позаклітинний домен АРР поряд з трансмембранним доменом (TM) з утворенням С-кінцевого фрагмента АРР, що містить ТМ- та цитоплазматичний домени (CTFβ). CTFβ є субстратом для γ-секретази, яка розщеплює [APP] в декількох сусідніх позиціях TM домену з одержанням Aβ пептидів та цитоплазматичного фрагмента. Різні протеолітичні розщеплення, опосередковані γ-секретазою, дають в результаті Aβ пептиди з різною довжиною ланцюга, наприклад, Aβ38, Aβ40 та Aβ42. Останній вважають найбільш патогенним амілоїдним пептидом через його сильну тенденцію до утворення нейротоксичних агрегатів. β-Секретаза є типовою аспартил-протеазою. γ-Секретаза є протеолітичним ферментом, що складається з декількох білків, її точний склад остаточно не зрозумілий. Тим не менш, пресеніліни є важливими компонентами її активності та можуть бути новою групою атипових аспартилпротеаз, які розщепляють TM домен їх субстратів, і які самі по собі є політопними мембранними білками. Іншими важливими компонентами γ-секретази можуть бути нікастрин та продукти генів aph1 та pen-2. Встановленими субстратами для γ-секретази є АРР та білки сімейства рецепторів Notch, однак, γ-секретаза має вільну субстратну специфічність і може 1 UA 110368 C2 5 10 15 20 25 30 35 40 45 розщепляти інші мембранні білки, не зв’язані з APP та Notch. Активність γ-секретази є абсолютно необхідною для утворення Aβ пептидів. Це було показано як генетичними засобами, тобто видаленням гена пресеніліну, так і інгібуючими сполуками з низькою молекулярною вагою. Оскільки згідно із амілоїдною гіпотезою ХА утворення та осадження Aβ є кінцевою причиною захворювання, вважається, що селективні та сильні інгібітори γ-секретази будуть корисні для профілактики та лікування хвороби Альцгеймера. Альтернативним способом лікування є модуляція активності γ-секретази, яка приводить до селективного зменшення утворення Aβ42. Це призведе до збільшення більш коротких Aβ ізоформ, наприклад, Aβ38, Aβ37 чи інших, які мають знижену здатність до агрегації та утворення бляшок, а також є менш нейротоксичними. Сполуки, які виявляють цей эфект на модуляцію γ-секретази, включають деякі нестероїдні протизапальні засоби (НПЗЗ) та споріднені аналоги (Weggen та співавт., Nature, 414 (2001) 212-16). Таким чином, сполуки за даним винаходом можуть бути корисні для лікування або профілактики захворювання, зв’язаного з відкладанням β-амілоїду в мозку, зокрема, хвороби Альцгеймера та інших захворювань, таких як церебральна амілоїдна ангіопатія, спадкова церебральна геморагія з амілоїдозом голландського типу (HCHWA-D), мультиінфарктна деменція, деменція боксерів та синдром Дауна. Численними документами, що описують сучасний рівень знань з модуляції γ-секретази, є, наприклад, такі публікації: Morihara та співавт., J. Neurochem., 83 (2002) 1009-12 Jantzen та співавт., J.Neuroscience, 22 (2002) 226-54 Takahashi та співавт., J. Biol. Chem., 278 (2003) 18644-70 Beher та співавт., J. Biol. Chem. 279 (2004) 43419-26 Lleo та співавт., Nature Med. 10 (2004) 1065-6 Kukar та співавт., Nature Med. 11 (2005) 545-50 Perretto та співавт., J. Med. Chem. 48 (2005) 5705-20 Clarke та співавт., J. Biol. Chem. 281 (2006) 31279-89 Stock та співавт., Bioorg. Med. Chem. Lett. 16 (2006) 2219–2223 Narlawar та співавт., J. Med. Chem. 49 (2006) 7588-91 Використовуються такі визначення для сполук формули I: Як використовується тут, термін "нижчий алкіл" означає насичену лінійну або з розгалуженим ланцюгом групу, що містить від 1 до 7 атомів вуглецю, наприклад, метил, етил, пропіл, ізопропіл, н-бутил, ізобутил, 2-бутил, трет-бутил і т.ін. Кращими алкільними групами є групи з 1-4 атомами вуглецю. Як використовується тут, термін "нижчий алкіл, заміщений галогеном", означає алкільну групу, як визначено вище, де принаймні один атом водню заміщений атомом галогену, наприклад, CF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CF2CHF2, CH2CF2CF3 тощо. Як використовується тут, термін "нижчий алкіл, заміщений гідрокси" означає алкільну групу, як визначено вище, де принаймні один атом водню заміщений гідрокси, CH2OH, CHCH3OH або C(CH3)2OH. Як використовується тут, термін "нижчий алкокси" означає алкільну групу, як визначено вище, яка приєднана через атом O. Термін "галоген" означає хлор, йод, фтор та бром. Термін "п’ятичленна гетероарильна група, що містить від 1 до 3 гетероатомів, вибраних з S чи N", вибраний з групи, що складається з: N NH S S N N , N N , N HN N або S N 50 N Кращою п’ятичленною гетероарильною групою є . Термін "шестичленна гетероарильна група, що містить від 1 до 3 гетероатомів, вибраних з S чи N", вибраний з групи, що складається з N N N N , N N або , 2 N . Кращими шестичленними UA 110368 C2 N N N N N гетероарильними групами є , або . Термін “двокільцева система, що містить 1-4 гетероатоми, вибрані з S чи N, де щонайменше одне кільце є ароматичним”, вибраний з групи, що складається з N N N N N N , N 5 10 15 N N N , N N N N N N N N N N , , N N , N N (R1)m N гетарил І R 3 H N гетарил ІІ Y d b (R2)o l 20 35 S N або . Термін "фармацевтично прийнятні кислотно-адитивні солі" охоплює солі з неорганічними та органічними кислотами, такими як соляна кислота, азотна кислота, сірчана кислота, фосфорна кислота, лимонна кислота, мурашина кислота, фумарова кислота, малеїнова кислота, оцтова кислота, бурштинова кислота, винна кислота, метансульфонова кислота, п-толуолсульфонова кислота тощо. Об’єктами даного винаходу є сполуки формули I, застосування таких сполук при одержанні лікарських засобів для лікування хвороби Альцгеймера, церебральної амілоїдної ангіопатії, спадкової церебральної геморагії з амілоїдозом голландського типу (HCHWA-D), мультиінфарктної деменції, деменції боксерів та синдрому Дауна, їх одержання та лікарські засоби на основі сполук формули I згідно з даним винаходом. Також, об’єктами даного винаходу є усі форми оптично чистих енантіомерів, рацемати або діастереомерні суміші сполук формули I. Одним з об’єктів даного винаходу є сполуки формули a 30 , N N c 25 S N гетарил I є п’яти- чи шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N; гетарил II є шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N, або є двокільцевою системою, що містить 1-4 гетероатоми, вибрані з S чи N, де щонайменше одне кільце є ароматичним; 1 R позначає нижчий алкіл, нижчий алкокси, нижчий алкіл, заміщений галогеном, або галоген; 2 R позначає нижчий алкіл, нижчий алкіл, заміщений гідрокси, або позначає -(CH2)p-феніл, можливо заміщений галогеном; 3 R позначає водень або нижчий алкіл; Y позначає -(CH2)n-, -CH2OCH2-, -CH2O-, CH2S-, -CH2SCH2-, та приєднаний до двох кільцевих атомів вуглецю - або до кільцевих атомів вуглецю a та b, або до кільцевих атомів вуглецю c та d; p позначає 0 або 1; 1 m позначає 0, 1 або 2; якщо m дорівнює 2, то R можуть бути однаковими чи різними; n позначає 2 або 3; 2 o позначає 0, 1 або 2, якщо o дорівнює 2, то R можуть бути однаковими чи різними; або їх фармацевтично активні кислотно-адитивні солі. Одним з втілень даного винаходу також є сполуки формули I, 40 3 UA 110368 C2 c R 3 a (R1)m N гетарил І H N гетарил ІІ Y d b (R2)o l 5 10 15 20 де гетарил I позначає піридиніл, 1,2,4-тіадіазоліл, піразиніл або піримідиніл; гетарил II позначає [1,2,4]триазоло[1,5-а]піридиніл, [1,2,4]триазоло[1,5-а]піразиніл, 5,6,7,8тетрагідро-[1,2,4]триазоло[1,5-а]піридиніл, [1,2,4]триазоло[1,5-с]піримідиніл, 4,5,6,7тетрагідробензотіазоліл або піримідиніл; 1 R позначає метил, хлоро або CF3: 2 R позначає метил, н-пропіл, фторо, хлоро, трифторметил, метокси, або позначає C(CH3)2OH, або позначає O-бензил, або позначає циклогексил, заміщений метилом чи трифторметилом, або позначає фурил, або позначає -(CH2)p-феніл, можливо заміщений одним, двома або трьома атомами галогену, вибраними з F або Cl, або ціано чи метокси; 3 R позначає водень або метил; Y позначає -(CH2)n-, або позначає -CH2OCH2-, або позначає -OCH2-, або позначає -CH2SCH2, або позначає -SCH2 та приєднаний до двох кільцевих атомів вуглецю - або до кільцевих атомів вуглецю a та b, або до кільцевих атомів вуглецю c та d; p позначає 0 або 1; m позначає 0, 1 або 2; n позначає 2, або 3; 2 o позначає 1 або 2, якщо o дорівнює 2, то R можуть бути однаковими чи різними; або їх фармацевтично активні кислотно-адитивні солі. Одним з втілень даного винаходу є також сполуки формули I, де Y позначає -(CH2)2-, S N 25 30 35 40 45 50 N гетарил I позначає , і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми, наприклад, такі сполуки: [(рац)-3-екзо-8-(3-метил-[1,2,4]тіадіазол-5-іл)-8-азабіцикло[3.2.1]окт-3-ил]-(4-феніл-4,5,6,7тетрагідробензотіазол-2-іл)амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4фторфеніл)-6-метил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4фторфеніл)-6-фтор-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4-хлор-2метоксифеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3-ціано-4фторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3,4дифторфеніл)-6-трифторметил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-метокси[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-хлор-6трифторметил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5,6-диметил[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-бензилокси[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5-пропіл[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-(5-феніл[1,2,4]триазоло[1,5-a]піразин-2-іл)амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5-трифторметил[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[6-хлор-8-(3,4 4 UA 110368 C2 5 10 15 дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[7-метил-5-пропіл[1,2,4]триазоло[1,5-c]піримідин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4,4-диметилциклогексил)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-(7-фуран-2-іл[1,2,4]триазоло[1,5-a]піримідин-2-іл)амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[7-трифторметил[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4-трифторметилциклогексил)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-(4-фторфеніл)-5,6,7,8-тетрагідро-[1,2,4]триазоло[1,5-a]піридин-2-іл]-[(рац)-8-екзо-3(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін, або [(рац)-8-(3,4-дифторфеніл)-5,6,7,8-тетрагідро-[1,2,4]триазоло[1,5-a]піридин-2-іл]-[(рац)-8ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін. Додатковим втіленням даного винаходу є сполуки формули I, де Y позначає -(CH2)2-, S N 20 25 N гетарил I позначає , і гетарил II є шестичленною гетероарильною групою, що містить 1-3 гетероатоми, вибрані з S чи N, наприклад, така сполука: 2-{6-(4-хлорбензил)-2-[(рац)-3-ендо-8-(3-метил-[1,2,4]тіадіазол-5-іл)-8-азабіцикло[3.2.1]окт-3иламіно]піримідин-4-іл}пропан-2-ол. Додатковим втіленням даного винаходу є сполуки формули I, де Y позначає -(CH2)n-, N гетарил I позначає , та гетарил II є двокільцевою системою, що містить 1-4 гетероатоми, наприклад, такі сполуки: [(рац)-3-екзо-8-(2-хлорпіридин-4-іл)-8-азабіцикло[3.2.1]окт-3-ил]-[8-(3,4-дифторфеніл)-6метил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін, або [8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]-[(рац)-8-ендо-3-(2-трифторметилпіридин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін. Додатковим втіленням даного винаходу є сполуки формули I, де гетарил I позначає N N 30 35 40 45 і гетарил II є двокільцевою системою, що містить 1-4 гетероатоми, наприклад, такі сполуки: [(рац)-8-ендо-3-(6-метилпіримідин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2,3,4-трифторфеніл)[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-ендо-3-(6-метилпіримідин-4-іл)-6-окса-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2,3,4трифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-9-екзо-7-(6-метилпіримідин-4-іл)-3-тіа-7-азабіцикло[3.3.1]нон-9-іл]-[8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-9-ендо-3-(6-метилпіримідин-4-іл)-3-азабіцикло[3.3.1]нон-9-іл]-[8-(2,3,4-трифторфеніл)[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-9-екзо-7-(6-метилпіримідин-4-іл)-3-окса-7-азабіцикло[3.3.1]нон-9-іл]-[8-(2,3,4трифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін [(рац)-8-екзо-метил-3-(6-метилпіримідин-4-іл)-3-азабіцикло[3.2.1]окт-8-ендо-ил]-[8-(2,3,4трифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін, або [8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]-[(рац)-8-ендо-3-(2-метилпіримідин-4іл)-3-азабіцикло[3.2.1]окт-8-ил]амін. Дані сполуки формули I та їх фармацевтично прийнятні солі можуть бути одержані способами, відомими в даній області, наприклад, способами, описаними нижче, які включають: a) взаємодію сполуки формули 5 UA 110368 C2 c R 3 NH2 a (R1)m N Y d b гетарил І 2 зі сполукою формули X (R2)o гетарил ІІ 3 5 з утворенням сполуки формули c 3 R a (R1)m N H N гетарил ІІ Y d (R2)o b гетарил І I 10 15 де X позначає галоген і решта груп мають значения, описані вище, і, при необхідності, конвертування одержаних сполук на фармацевтично прийнятні кислотноадитивні солі; або b) взаємодію сполуки формули c R 3 a HN H N гетарил ІІ Y d (R2)o b 6 зі сполукою формули 20 (R1)m X гетарил І 7 з утворенням сполуки формули c R 3 a (R1)m N гетарил І H N гетарил ІІ Y d b (R2)o l 25 де X позначає галоген і решта груп мають значения, описані вище, або c) взаємодію сполуки формули 6 UA 110368 C2 c R 3 a (R1)m O Y N d b гетарил І 8 зі сполукою формули 5 H2N гетарил ІІ (R2)o 9 з утворенням сполуки формули R c 3 a (R1)m N гетарил І H N гетарил ІІ Y d b (R2)o l 10 3 15 20 25 де групи мають значения, описані вище, і R позначає водень, і, при необхідності, конвертування одержаних сполук на фармацевтично прийнятні кислотноадитивні солі. Одержання сполук формули I за даним винаходом може здійснюватися послідовним (лінійним) або конвергентним синтезом. Синтез сполук за винаходом показаний на наступних схемах. Навики, необхідні для проведення реакції та очистки одержаних продуктів, відомі фахівцям в даній області. Замісники та індекси, використовувані в наступному описі процесів, мають значення, вказані в даному документі раніше, якщоне зазначене інше. Більш конкретно, сполуки формули I можуть бути одержані способами, наведеними нижче, способами, наведеними в прикладах, або аналогічними способами. Придатні умови реакцій для окремих реакційних стадій відомі фахівцям в даній області. Послідовність реакцій не обмежується такою, що зображена на схемах, однак, в залежності від вихідних матеріалів та їх відповідної реакційної здатності, послідовність реакційних стадій може бути вільно змінена. Вихідні речовини є чи то комерційно доступними, чи то можуть бути одержані способами, аналогічними тим, що наведені нижче, способами, описаними в прикладах, або способами, відомими в даній області техники. Схема 1 30 35 Сполуки формули I за даним винаходом та їх фармацевтично прийнятні солі можуть бути одержані зв’язуванням амінів загальної формули 2 та галідів загальної формули 3 (дивись Схему 1). Ця реакція може бути проведена з використанням загальновідомих методик, наприклад, реакцією заміщення в каталітичних умовах (наприклад, каталіз з використанням паладію(0) або міді(II)) або при температурних умовах чи в основних умовах. Схема 2 7 UA 110368 C2 5 10 15 20 Альтернативно, галіди 3 можуть взаємодіяти в умовах, описаних вище, з амінами загальної формули 4, які несуть захисну групу PG, наприклад, Boc, на азоті піперидину (дивись Схему 2). Після депротекції, наприклад, трифтороцтовою кислотою, піперидини 6 можуть бути зв’язані з галідами гетарилу I формули 7 з одержанням сполук формули I. Схема 3 3 R позначає водень; Альтернативно, аніліни загальної формули 9 можуть вступати в реакцію відновного амінування з кетонами загальної формули 8 або 10 (дивись Схему 3) з одержанням сполук I як напряму, так і після відщеплення захисної групи PG сполук 5, з наступним зв’язуванням з галідом гетероарилу I 7, як показано на Схемі 2. Відновне амінування може проводитися способами, відомими фахівцям в області органічного синтезу, наприклад, нагріванням аміну та кетону в придатному розчиннику (наприклад, толуолі, дихлоретані, ТГФ), можливо, в присутності кислоти (наприклад, оцтової кислоти, тетраізопропілортотитанату), та відновленням проміжного іміну придатним відновним агентом (наприклад, триацетоксиборогідридом натрію, ціаноборогідридом натрію, борогідридом натрію, воднем в присутності паладію на вугіллі). Схема 4 8 UA 110368 C2 5 10 15 Зв’язування анілінів загальної формули 9 з кетонами загальної формули 8 або 10 може, альтернативно, бути проведене за допомогою протоколу аза-Віттіг/відновлення (дивись Схему 4). Аніліни загальної формули 9 спочатку можуть бути конвертовані на їх відповідні триалкілфосфазени 11 шляхом реакції з триалкілфосфораном (наприклад, дихлортриметилфосфораном, одержаним в результаті реакції триметилфосфіну з гексахлоретаном в ТГФ або дихлорметані) та органічним основним аміном (наприклад, триетиламіном, діізопропілетиламіном) в придатному розчиннику (наприклад, ТГФ, дихлорметан). Кетони загальної формули 8 або 10 потім додають до реакційної суміші, що містить одержані in situ фосфазени 11, і суміш нагрівають. Одержані імін/енаміни (енаміни можуть утворюватися для сполук з місточком Y між атомами a та b) 12 або 13 потім обробляють придатним відновним агентом (наприклад, триацетоксиборогідридом натрію, ціаноборогідридом натрію, борогідридом натрію, декабораном, комплексом боран-ТГФ, воднем в присутності паладію на вугіллі) в придатному розчиннику (ТГФ, ДХМ, MeOH та їх суміші) з або без кислотного каталізатора (наприклад, оцтова кислота) при кімнатній або підвищеній температурі з одержанням сполук загальної формули 5 або I (для R3 - водню). Схема 5 20 9 UA 110368 C2 N 5 10 A позначає або . Триазолопіридини загальної формули 5a можуть, альтернативно, бути одержані перетворенням амінів загальної формули 14 на їх відповідні ізотіоціанати 15 (наприклад, реакцією з трифосгеном або 1,1’-тіокарбонілдіімідазолом в дихлорметані в присутності органічної або водної неорганічної основи) та взаємодією з амінами загальної формули 4 (дивись Схему 5). Отримані тіосечовини 16 можуть бути активовані алкілуванням йодометаном та згодом циклізовані в триазолопіридини 5a сильним нагріванням (>130 °C) в присутності придатно функціоналізованого похідного гідроксиламіну, наприклад, O(триметилсиліл)гідроксиламіну в полярному розчиннику, наприклад, диметилацетаміді. Схема 6 c S N O PG 19 D H2 N N a N a PG Y d b DMA N c MeI, DMF b N H d 2 S O Y D N N H (R )o 2 (R )o 20 18 a PG N c S O Y b d N N N H N a NaN3, DMF PG D 2 (R )o N N O Y b N d 21 + N c N N H D 2 (R )o 22 PMe3 a PG N P c N O Y b N d D N N H 2 (R )o 23 c H N a PG 15 20 N Y d b N N N D 2 (R )o 5b D позначає карбоциклічне кільце, краще, Триазолопіридини загальної формули 5b можуть бути одержані спочатку конденсуванням циклічних гідразидів 18 та ізотіоціанатів 19 (одержаних способами, відомими кваліфікованим в рівні техніки фахівцям) з утворенням тіосечовини 20 (дивись Схему 6). Активація сірки шляхом алкілування (наприклад, йодометаном в ДМФ при підвищених температурах) дозволяє замінити її азидом (наприклад, азидом натрію в ДМФ при підвищених температурах) з одержанням азидогуанідину 22. Відновлення Штаудингера з триметилфосфіном дає проміжний фосфазен 23, який циклізується при нагріванні з одержанням триазолопіридину 5b. Аніліни загальної формули 9, які можуть бути використані як вихідні речовини для одержания сполук формули I, можуть бути одержані, як описано в наступних схемах. Схема 7 10 UA 110368 C2 OEt S O H2N Pd, R2-B(OH)2 N N H H2N A N SCN-CO2Et A NH2OH, iPr2EtN N H N 2 A 24 N N N 2 R X H2N A 14 2 R R 25 9a N 5 10 A позначає або , і X позначає Cl або Br. Аніліни 9a, в яких гетероарил II позначає анелований триазоловий залишок (дивись Схему 7), можуть бути одержані з відповідних амінопохідних 14, які є як комерційно доступними, так і можуть бути одержані з відповідних галідів 24 шляхом каталізованого паладієм сполучення Сузукі з бороновими кислотами або бороновими ефірами (наприклад, пінаколіновим ефіром). Аміни 14 можуть взаємодіяти з етоксикарбонілізотіоціанатом з одержанням похідних тіосечовини 25, які циклізують шляхом обробки гідроксиламіном в присутності основи з виділенням діоксиду вуглецю з одержанням анелованих тіазолів 9a (як, наприклад, описано у M. Nettekoven та співавт., Synthesis 2003, 11, 1649-1652). Схема 8 N 15 20 A позначає або , і X позначає Cl або Br. Альтернативно, порядок стадій на Схемі 7 може бути змінений (дивись Схему 8). Галіди 24 (які є як комерційно доступними, так і можуть бути одержані способами, відомими з рівня техніки) можуть взаємодіяти з етоксикарбонілізотіоціанатом з подальшою обробкою гідроксиламіном з одержанням анелованих триазолів 27. Ці галіди можуть бути піддані, наприклад, каталізованій паладієм реакції сполучення Сузукі з бороновими кислотами або каталізованому міддю(I) зв’язуванню з фенолами (наприклад, згідно з D.Maiti та співавт. JOC 2010, 75, 1791-1794) з одержанням заміщених амінотриазолів 9a. Схема 9 N H2N N N H2, Pd/C A N H2N N 2 (R )o N B 2 (R )o 9a 9b 25 N A позначає або , NH 30 B позначає або , Сполуки 9a можуть бути гідрогенізовані з паладієм на вугіллі як каталізатором з одержанням відповідних частково насичених сполук 9b (дивись Схему 9). В залежності від природи кільця A 11 UA 110368 C2 5 проведення даної реакції може потребувати підвищеної температури або тиску водню або присутності кислоти (наприклад, HCl). Альтернативно, сполуки 9a можуть бути відновлені металами, наприклад, магнієм в спиртовому розчині (такому як етанольний) з або без активації металу (наприклад, активація каталітичною кількістю йоду). Схема 10 NH2 H2 N O S C Br N H2 N 15 2 (R )o (R )o 28 10 C S 2 9c C позначає карбоциклічне кільце, краще, . Аніліни 9c, в яких гетероарил II позначає анелований тіазол (дивись Схему 10), можуть бути одержані конденсацією α-бромкетонів 28 з тіосечовиною (наприклад, нагріванням в придатному розчиннику, наприклад, етанолі). α-Бромкетони є як комерційно доступними, так і можуть бути легко одержані способами, відомими кваліфікованим в області органічного синтезу фахівцям, наприклад, взаємодією придатного кетону з бромом в хлороформі. Галіди загальної формули 3, які можуть бути використані як вихідні речовини для одержания сполук формули I, можуть бути одержані, як описано на наступних схемах. Схема 11 (R2)n N H2 N N N X tBuONO2 A (R2)n N A N N CuX 9 3 20 Галотриазол 3 може бути одержаний з аніліну 9 (дивись Схему 11) через утворення відповідної солі діазонію та подальший розпад в присутності джерела галіду, такого як галід міді(I) або галоводень (X = хлор або бром). Схема 12 25 Cl N N Cl N Cl 2'' R Cl 30 N 29 N N 2'' R Cl Cl Cl N N 2'' R 2' R 2'' R 2' R 2''' R 3a Cl 31 2’ 30 2 2 R , R ’’ та R ’’’ позначають нижчий алкіл, нижчий алкіл, заміщений гідрокси, або -(CH2)pфеніл, можливо заміщений галогеном. Галіди 3a, у яких гетероарил II позначає піримідин (дивись Схему 12) можуть бути одержані, наприклад, як описано у K. Baumann та співавт., WO2009103652, відновленням трихлорпіримідинів 29 з одержанням дихлорпохідного 30, наприклад, обробкою цинком в водному розчині аміаку при 0 °C. Потім, 4-хлор замісник сполуки 30 може бути заміщений в 2’ реакції нуклеофільного заміщення (такій як реакція з реагентом Гриняра R MgX, наприклад, 12 UA 110368 C2 5 бензилмагнію хлоридом в тетерагідрофурані при від -80 до +20 °C), або шляхом реакції заміщення, каталізованої каталізатором-металом (наприклад, використовуючи ацетат паладію, 2-(дициклогексилфосфіно-біфеніл, тетрагідрофуран, мікрохвильова піч, 30 хв, 200 °C). 2’ Альтернативно, один з активних атомів хлору сполуки 29 спочатку заміщається групою R , з 2’’’ наступним заміщенням другого хлор-замісника в проміжній сполуці 31 групою R , з одержанням 3a. Схема 13 Cl Cl N N MeO Cl Cl N N O Cl N 2 R N OH OH 3b 10 15 20 25 2 R позначає -(CH2)p-феніл, можливо заміщений галогеном. Галіди 3b, у яких гетероарил II позначає піримідин (дивись Схему 13) можуть бути одержані з 2,6-дихлорпіримідин-4-карбонової кислоти метилового ефіру взаємодією з, наприклад, метилмагнію хлоридом в ТГФ при температурі від -78 °C до 0 °C, що дає 2-(2,6дихлорпіримідин-4-іл)пропан-2-ол. Хлорид в позиції 4 2-(2,6-дихлорпіримідин-4-іл)пропан-2-олу 2 може бути замінений на замісник R , наприклад, в реакції сполучення Сузукі з 2 арил/гетероарилбороновою кислотою/ефіром R -B(OH/OR’)2 в присутності паладієвого каталізатора та основи (наприклад, карбонату натрію) в, наприклад, диметоксіетані як розчиннику, з одержанням хлориду 3b. Альтернативно, 4-хлор замісник може взаємодіяти з 2 органічним хлоридом цинку R ZnCl, наприклад, хлоридом бензилцинку в присутності паладієвого каталізатора з одержанням хлориду 3b. Для проведення даної модификації може потребуватися захист спиртової групи 2-(2,6-дихлорпіримідин-4-іл)пропан-2-олу перед другою стадією, наприклад, захист за допомогою триметилсилільної групи, яка може вводитися, наприклад, з біс(триметилсиліл)ацетамідом та може бути відщеплена після зазначеної модификації за допомогою, наприклад, п-TsOH, у ТГФ/воді. Кетони загальної формули 8, які можуть бути використані як вихідні речовини для одержання сполук формули I, можуть бути одержані, як описано на наступних схемах. Схема 14 30 35 40 Реакція Манніха кетону на Схемі 14 з формальдегідом та придатним аміном PG-NH2 приводить до кетону 10a. Захисна група 10a може бути змінена як необхідно (наприклад, з бензилу на boc-захист). Конденсація 2,5-диметокситетрагідрофурану з бікислотою в присутності придатного аміну PG-NH2 приводить до кетону 10b. Депротекція сполук 10b або 10a та зв’язування з придатним галідом гетарилу I в основних умовах, температурних умовах або в присутності металу-каталізатора приводить до кетону 8. Аміни загальної формули 2, які можуть бути використані як вихідні речовини для одержання сполук формули I, можуть бути одержані, як описано на наступних схемах. Схема 15 13 UA 110368 C2 3 5 Кетони 8 можуть бути легко конвертовані на аміни 2a (R = H) шляхом відновного амінування з аміаком або гідроксиламіном або іншим придатним попередником аміну (дивись 3 Схему 15). Одержання аміну 2b (R = Me) починається з додавання метил-реагенту Гриняра до кетону 10a. Одержаний третинний спирт використовують в реакції Ріттера з ацетонітрилом при сильнокислих умовах. Омилення аміду та заміна захисної групи на групу гетарилу I, як описано раніше на Схемі 14, приводить до аміну 2b. Схема 16 10 c c a HN Y + d a Cl S NHBoc N N S N N H2N S 15 20 N N Y d b c NHBoc N N S 2c c a d NH2 a Y b N b c NHBoc Y d NHBoc a N N b N S Y d b Аміни 2c, у яких гетероарил I позначає 3-метил-[1,2,4]тіадіазол (дивись Схему 15) можуть, наприклад, бути одержані каталізованим паладієм зв’язуванням 5-хлор-3-метил[1,2,4]тіадіазолу з піперидин-4-ілкарбамінової кислоти трет-бутиловим ефіром та подальшим відщепленням захисної Boc-групи в присутності кислоти. Альтернативно, аміни 2c можуть бути одержані з Boc-захищених амінопіперидинів реакцією з джерелом ізотіоціанату, таким як бензоїлізотіоціанат, ізотіоціанат металу, тіофосген або активоване похідне тіосечовини з одержанням відповідних похідних тіосечовини. Конденсація з 1,1-диметоксіетил)диметиламіном та подальша циклизація з гідроксиламін-О-сульфоновою кислотою в присутності основи, такої як піридин, приводить після депротекції до амінів 2c. Схема 17 1 R позначає OMe або OEt 25 1 Сполуки загальної формули Ia, де R позначає галоген, такий як Cl, можуть бути 1 конвертовані на сполуки загальної формули Ib, де R позначає алкокси, такий як OMe, OEt, 14 UA 110368 C2 5 10 15 20 25 30 обробкою придатною сіллю натрію (NaOMe або NaOEt) в придатному спиртовому розчиннику, такому як метанол або етанол, відповідно (дивись Схему 17). Сполуки тестувалися згідно із експериментом, описаним тут. Опис аналізу γ-секретази Аналіз клітинної γ-секретази Клітини H4 нейрогліоми людини, що надекспресують APP людини, примістили в кількості 30000 клітин/лунку/200 мкл на 96-лункові планшети в середовищі IMDM, що містить 10% ФТС, 0.2 мг/л гігроміцину B, та інкубували протягом 2 годин при 37 °C, 5% CO2, перед додаванням тестованих сполук. Сполуки для тестування розчинили в 100% Me2SO з одержанням 10 мМ стокового розчину. Звичайно 12 мкл цього розчину потім разводили в 1000 мкл середовища IMDM (без ФТС). Послідовні розведення 1:1 дали 10-точкову криву доза-відповідь. 100 мкл кожного розведення додавали до клітин в 96-лункові планшети. Як придатні контролі в даному тестуваннї використовували тільки носій та референсну сполуку. Кінцева концентрація Me 2SO становила 0,4%. Після інкубування протягом 22 годин при 37 °C, 5% CO2, 50 мкл супернатанта перемістили в круглодонні 96-лункові поліпропіленові планшети для детекції Aβ42. Додали в лунки 50 мкл буфера для аналізу (50 мМ Трис/Cl, pH 7,4, 60 мМ NaCl, 0.5% БСА, 1% TWEEN 20) з наступним додаванням 100 мкл антитіла для детекції (рутеніловане BAP15 0,0625 мкг/мл в буфері для аналізу). Інкубували 50 мкл попередньо змішаного антитіла захоплення (біотиніловане антитіло 6E10, 1 мкг/мл) та покритих стрептавідином магнітних кульок (Dynal M-280, 0,125 мг/мл) протягом 1 години при кімнатній температурі перед додаванням на планшети для аналізу. Планшети для аналізу інкубували на шейкері протягом 3 годин при кімнатній температурі та зчитували на Bioveris M8 Analyser згідно з інструкцією виробника (Bioveris). Токсичність сполук аналізували за допомогою тесту клітинної життєздатності для клітин, оброблених сполуками, шляхом калориметричного аналізу (CellTiter 96TM AQ аналіз, Promega) згідно з інструкцією виробника. Стисло, після видалення 50 мкл супернатанта клітинної культури для детекції Aβ42, додали до клітин 20 мкл 1× розчину MTS/PES та інкубували протягом 30 хвилин при 37 °C, 5% CO2. Потім реєстрували оптичну густину при 490 нм. Значення IC50 для інгібування секреції Aβ42 підраховували за допомогою нелінійного регресійного аналізу з оптимізацією, використовуючи програмне забезпечення XLfit 4.0 (IDBS). В нижченаведеному списку показані дані інгібування секреції Aβ42 для усіх сполук (мкМ): Приклад № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 35 40 EC50 Aβ42 (мкМ) 2,95 0,41 3,37 0,627 0,273 0,179 0,175 0,199 0,232 0,296 0,428 0,833 0,557 0,215 Приклад № 15 16 17 18 19 20 21 22 23 24 25 26 27 28 EC50 Aβ42 (мкМ) 0,217 0,235 0,273 0,158 0,42 0,289 0,553 0,623 0,917 0,300 3,237 3,833 0,643 0,642 Сполуки формули I та фармацевтично прийнятні солі сполук формули I можуть застосовуватися як лікарські засоби, наприклад, у вигляді фармацевтичних препаратів. Фармацевтичні препарати можуть бути введені перорально, наприклад, у вигляді таблеток, таблеток з покриттям, драже, твердих та м’яких желатинових капсул, розчинів, емульсій або суспензій. Введення, однак, може також бути здійснене ректально, наприклад, в формі супозиторіїв, парентерально, наприклад, в формі розчинів для ін’єкцій. Сполуки формули I можуть готуватися разом з фармацевтично інертними, неорганічними або органічними носіями для одержання фармацевтичних препаратів. Лактоза, кукурудзяний крохмаль або його похідні, тальк, стеаринова кислота або її солі тощо, можуть бути використані, наприклад, як такі носії для таблеток, таблеток з покриттям, драже та твердих желатинових 15 UA 110368 C2 5 10 15 20 25 капсул. Придатними носіями для м’яких желатинових капсул є, наприклад, рослинні олії, воски, жири, напівтверді та рідкі поліоли тощо. В залежності від природи активної речовини, однак, носії, як правило, не потрібні у випадку м’яких желатинових капсул. Придатними носіями для одержання розчинів та сиропів є, наприклад, вода, поліоли, гліцерин, рослинна олія тощо. Придатними носіями для супозиторіїв є, наприклад, природні або гідрогенізовані масла, воски, жири, напіврідкі або рідкі поліоли тощо. Фармацевтичні препарати можуть, крім того, містити консерванти, солюбілізатори, стабілізатори, змочувальні агенти, емульгатори, підсолоджувачі, барвники, ароматизатори, солі для зміни осмотичного тиску, буфери, маскувальні агенти або антиоксиданти. Вони також можуть містити інші терапевтично цінні речовини. Лікарські засоби, що містять сполуку формули I або її фармацевтично прийнятну сіль та терапевтично інертний носій, також є об’єктом даного винаходу, так само як і спосіб їх одержання, який включає приведення однієї чи декількох сполук формули I та/або їх фармацевтично прийнятних кислотно-адитивних солей і, при необхідності, однієї чи декількох інших терапевтично цінних речовин, в галенову форму разом з одним чи декількома терапевтично інертними носіями. Згідно з даним винаходом, сполуки формули I, а також їх фармацевтично прийнятні солі, є корисними для лікування або профілактики захворювань, на основі інгібування секреції Aβ42, таких як хвороба Альцгеймера. Дозування може варіюватися в широких межах і, кінцево, має бути адаптоване до індивідуальних вимог в кожному конкретному випадку. У випадку перорального введення, дозування для дорослих може варіювати від близько 0,01 мг до близько 1000 мг на день сполуки загальної формули I, або відповідної кількості її фармацевтично прийнятної солі. Добову дозу можна вводити у вигляді однократної дози або у вигляді розділених доз і, крім того, верхня межа може бути також перевищена, якщо це необхідно. Приготування таблеток (волога грануляція) № 1 2 3 4 5 30 Інгредієнти 5 5 125 6 30 1 167 Сполука формули I Безводна лактоза DTG Sta-Rx 1500 Мікрокристалічна целюлоза Стеарат магнію Усього мг/таблетку 25 100 25 100 105 30 6 6 30 30 1 1 167 167 500 500 150 30 150 1 831 Спосіб приготування 1. Змішують інгредієнти 1, 2, 3 та 4 та гранулюють за допомогою очищеної води. 2. Висушують гранули при 50 °C. 3. Пропускають гранули через придатний розмельний пристрій. 4. Додають інгредієнт 5 та змішують протягом трьох хвилин, пресують на придатному пресі. Приготування капсул 35 № 1 2 3 4 5 40 Інгредієнти 5 5 159 25 10 1 200 Сполука формули I Водна лактоза Кукурудзяний крохмаль Тальк Стеарат магнію Усього мг/капсулу 25 100 25 100 123 148 35 40 15 10 2 2 200 300 500 500 70 25 5 600 Спосіб приготування 1. Змішують інгредієнти 1, 2 та 3 в придатному міксері протягом 30 хвилин. 2. Додають інгредієнти 4 та 5 та перемішують протягом 3 хвилин. 3. Наповнюють сумішшю придатні капсули. Приклад 1 [(рац)-3-екзо-8-(2-Хлорпіридин-4-іл)-8-азабіцикло[3.2.1]окт-3-ил]-[8-(3,4-дифторфеніл)-6метил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін 16 UA 110368 C2 F F Cl H N N N N N 5 10 15 20 25 30 35 40 45 50 N a) 3-(3,4-Дифторфеніл)-5-метилпіридин-2-амін 3-Бромо-5-метилпіридин-2-амін (0,5 г, 2,7 ммоль), 3,4-дифторфенілборонову кислоту (0,5 г, 3,2 ммоль) та [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладію(II) дихлорметановий комплекс (0,1 г, 0,1 ммоль) розчинили в суміші діоксану (10 мл) та 1M водного розчину карбонату натрію (8 мл) в атмосфері аргону і суміш нагрівали при 100 °C протягом 1 години. Реакційну суміш розбавили етилацетатом, розділили та органічний шар промили сольовим розчином, висушили над сульфатом натрію, відфільтрували та розчинник випарили при зниженому тиску. Залишок очистили колонковою хроматографією на силікагелі з використанням н-гептану/етилацетату (об./об. 1:1) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді світло-коричневого кристалічного осаду (0,6 г, кількісн.). + MS ISP (m/e): 221,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 7,95 (s, 1H), 7,32-7,16 (m, 4H), 4,50 (brs, 2H), 2,38 (s, 3H). b) 3-(3,4-Дифторфеніл)-2-ізотіоціанато-5-метилпіридин До розчину 3-(3,4-дифторфеніл)-5-метилпіридин-2-аміну (0,6 г, 2,7 ммоль) в дихлорметані (15 мл) додали розчин бікарбонату натрію (2,3 г, 26,7 ммоль) у воді (25 мл) з наступним додаванням розчину тіофосгену (0,25 мл, 3,2 ммоль) в дихлорметані (1 мл) і суміш перемішували протягом 15 хвилин. Фази розділили та органічну фазу висушили над сульфатом натрію і розчинник випарили під вакуумом з одержанням сполуки, зазначеної в заголовку, у вигляді кристалічного жовтого осаду (0,7 г, 100 %). + MS ISP (m/e): 263,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 8,27 (s, 1H), 7,50 (s, 1H), 7,32-7,25 (m, 2H), 7,22-7,18 (m, 1H), 2,39 (s, 3H). c) 1-((рац)-3-екзо-8-Бензил-8-азабіцикло[3.2.1]октан-3-іл)-3-(3-(3,4-дифторфеніл)-5метилпіридин-2-іл)тіосечовина До розчину 3-(3,4-дифторфеніл)-2-ізотіоціанато-5-метилпіридину (0,3 г, 1,1 ммоль) в диметилацетаміді (0,2 мл) додали (рац)-3-екзо-8-бензил-8-азабіцикло[3.2.1]октан-3-амін (0,3 г, 1,1 ммоль) і суміш нагрівали при 50 °C протягом 15 хвилин. Реакційну суміш розбавили етилацетатом, промили водою, сольовим розчином, висушили над сульфатом натрію і розчинник частково випарили при зниженому тиску, що привело до кристалізації продукту. Сполуку, зазначену в заголовку, одержали у вигляді сіро-білого кристалічного осаду (0,4 г, 75 %). + MS ISP (m/e): 479,3 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 12,57 (brs, 1H), 12,24 (d, 1H), 8,21 (s, 1H), 7,89-7,82 (m, 3H), 7,47-7,44 (m, 3H), 7,35-7,30 (m, 2H), 7,21-7,16 (m, 1H), 7,13-7,09 (m, 1H), 4,97-4,86 (m, 1H), 4,10 (d, 2H), 3,80 (s, 2H), 2,93 (t, 2H), 2,35-2,17 (m, 8H). d) Метил-N'-((рац)-3-екзо-8-бензил-8-азабіцикло[3.2.1]октан-3-іл)-N-(3-(3,4-дифторфеніл)-5метилпіридин-2-іл)карбамімідотіоат До розчину 1-((рац)-3-екзо-8-бензил-8-азабіцикло[3.2.1]октан-3-іл)-3-(3-(3,4-дифторфеніл)-5метилпіридин-2-іл)тіосечовини (0,3 г, 0,6 ммоль) в диметилацетаміді (1,5 мл) додали йодометан (0,06 мл, 1,0 ммоль) і суміш нагрівали при 80 °C протягом 2 годин. Реакційну суміш випарили досуха, залишок перерозчинили в етилацетаті, промили насиченим гідрокарбонатом натрію, сольовим розчином, висушили над сульфатом натрію, відфільтрували та розчинник випарили при зниженому тиску. Сполуку, зазначену в заголовку, одержали у вигляді світло-жовтої смоли (0,3 г, 94 %). + MS ISP (m/e): 493,2 [(M+H) ]. e) ((рац)-3-екзо-8-Бензил-8-азабіцикло[3.2.1]октан-3-іл)-8-(3,4-дифторфеніл)-6-метил[1,2,4]триазоло[1,5-a]піридин-2-амін До розчину метил-N'-((рац)-3-екзо-8-бензил-8-азабіцикло[3.2.1]октан-3-іл)-N-(3-(3,4дифторфеніл)-5-метилпіридин-2-іл)карбамімідотіоату (0,05 г, 0,1 ммоль) в ДМФ (0,5 мл) додали O-(триметилсиліл)гідроксиламін (0,03 мл, 0,2 ммоль) і суміш нагрівали до 150 °C протягом 1 17 UA 110368 C2 5 10 15 20 2530 години з наступним нагріванням протягом 1 години при 200 °C в мікрохвильовій печі. Реакційну суміш розбавили етилацетатом, промили водою, сольовим розчином, висушили над сульфатом натрію, відфільтрували та розчинник випарили при зниженому тиску. Залишок очистили колонковою хроматографією на силікагелі з використанням н-гептану/етилацетату (об./об. від 1:1 до 0:1) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді світло-коричневої смоли (0,01 г, 22 %). + MS ISP (m/e): 460,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 8,10 (s, 1H), 7,94-7,90 (m, 1H), 7,40-7,16 (m, 1H), 4,934,82 (m, 7H), 4,39 (s, 1H), 4,30 (d, 1H), 4,07-3,95 (m, 1H), 3,60 (s, 2H), 3,27 (s, 2H), 2,38 (s, 3H) 2,11-1,99 (m, 4H), 1,83-1,72 (m, 2H), 1,62 (t, 2H). f) ((рац)-3-екзо-8-(2-Хлорпіридин-4-іл)-8-азабіцикло[3.2.1]октан-3-іл)-8-(3,4-дифторфеніл)-6метил-[1,2,4]триазоло[1,5-a]піридин-2-амін До розчину ((рац)-3-екзо-8-бензил-8-азабіцикло[3.2.1]октан-3-іл)-8-(3,4-дифторфеніл)-6метил-[1,2,4]триазоло[1,5-a]піридин-2-аміну (0,02 г, 0,03 ммоль) в метанолі (1 мл) додали на кінці шпателя 10% паладій на вугіллі, а потім краплину 25% водного розчину хлористого водню і суміш перемішували в атмосфері водню (балон) протягом 3 годин. Реакційну суміш відфільтрували через Hyflo та сконцентрували досуха. Залишок перерозчинили в диметилацетаміді (1 мл), суміш підлугували додаванням триетиламіну та додали 2-хлор-4фторпіридин (0,02 г, 0,15 ммоль). Суміш нагрівали при 120 °C протягом 3 годин, після чого суміш розбавили етилацетатом, промили водою, сольовим розчином, висушили над сульфатом натрію, відфільтрували та розчинник випарили при зниженому тиску. Залишок очистили колонковою хроматографією на силікагелі з використанням н-гептану/етилацетату (об./об. від 7:3 до 1:7) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді сіро-білого осаду (0,05 г, 33 %). + MS ISP (m/e): 481,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 8,11 (s, 1H), 8,00 (d, 1H), 7,97-7,91 (m, 1H), 7,71-7,67 (m, 1H), 7,34 (s, 1H), 7,23-7,16 (m, 1H), 6,57 (d, 1H), 6,48 (dd, 1H), 4,37-4,26 (m, 3H), 2,18-2,11 (m, 4H), 2,05-2,00 (m, 2H), 1,61 (t, 2H). Приклад 2 [(рац)-3-екзо-8-(3-Метил-[1,2,4]тіадіазол-5-іл)-8-азабіцикло[3.2.1]окт-3-ил]-(4-феніл-4,5,6,7тетрагідробензотіазол-2-іл)амін N H N N S N S 35 40 45 50 N a) 3-(4-Феніл-4,5,6,7-тетрагідробензотіазол-2-іламіно)-(рац)-3-екзо-8-азабіцикло[3.2.1]октан8-карбонової кислоти трет-бутиловий ефір До розчину 4-феніл-4,5,6,7-тетрагідробензотіазол-2-іламіну (46 мг, 0,2 ммоль) в дихлоретані (0,6 мл) додали при кімнатній температурі з перемішуванням BOC-нортропінон (64 мг, 0,28 ммоль) та тетраізопропілортотитанат (178 мкл, 0,6 ммоль). Реакційну суміш перемішували протягом ночі при 90 °C в закритій пробірці під азотом. При кімнатній температурі додали етанол (0,6 мл) та борогідрид натрію (15 мг, 0,4 ммоль) і реакційну суміш перемішували при 85 °C протягом 4 годин та 30 хвилин. Додали воду, реакційну суміш перемішували протягом 30 хвилин і преципітат відфільтрували та промили етанолом. Фільтрат сконцентрували при зниженому тиску. Додали воду та реакційну суміш екстрагували двічі етилацетатом. Об’єднані органічні шари промили концентрованим водним розчином хлориду натрію, висушили над сульфатом натрію, відфільтрували та сконцентрували при зниженому тиску. Залишок очистили колонковою хроматографією на силікагелі з використанням градієнта від CH 2Cl2 до CH2Cl2/MeOH 19:1 (об./об.) як елюенту з одержанням сполуки, зазначеної в заголовку, у вигляді світло-коричневого осаду (73 мг, 83 %). + MS ISP (m/e): 440,3 (100) [(M+H) ]. b) ((рац)-3-екзо-8-Азабіцикло[3.2.1]окт-3-ил)-(4-феніл-4,5,6,7-тетрагідробензотіазол-2іл)аміну гідрохлорид До розчину 3-(4-феніл-4,5,6,7-тетрагідробензотіазол-2-іламіно)-(рац)-3-екзо-8азабіцикло[3.2.1]октан-8-карбонової кислоти трет-бутилового ефіру (93 мг, 0,21 ммоль) в 18 UA 110368 C2 5 10 15 20 25 метиленхлориді (5 мл) додали 2M розчин гідрохлориду в діетиловому ефірі (1,1 мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Розчинник видалили при зниженому тиску і залишок обробили діетиловим ефіром та випарили. Сполуку, зазначену в заголовку, одержали у вигляді світло-коричневого осаду (76 мг, 96 %). + MS ISP (m/e): 340,2 (100) [(M+H) ], 231,2 (34). c) [(рац)-3-екзо-8-(3-Метил-[1,2,4]тіадіазол-5-іл)-8-азабіцикло[3.2.1]окт-3-ил]-(4-феніл-4,5,6,7тетрагідробензотіазол-2-іл)амін Ацетат паладію(II) (3,3 мг, 0,015 ммоль) та 2-(дициклогексилфосфіно)біфеніл (11 мг, 0,03 ммоль) перемішували під азотом при кімнатній температурі в діоксані (1,7 мл) протягом 10 хвилин. Додали трет-бутилат натрію (27 мг, 0,28 ммоль), ((рац)-3-екзо-8-азабіцикло[3.2.1]окт-3ил)-(4-феніл-4,5,6,7-тетрагідробензотіазол-2-іл)аміну гідрохлорид (70 мг, 0,19 ммоль), N,Nдіізопропілетиламін (63 мкл, 0,37 ммоль) та 5-хлор-3-метил-[1,2,4]тіадіазол (28 мг; 0,21 ммоль) і реакційну суміш нагрівали при 200 °C протягом 30 хвилин в мікрохвильовій печі. Реакційну суміш розбавили водою та екстрагували двічі етилацетатом. Об’єднані органічні шари промили водою, висушили над сульфатом натрію, відфільтрували та сконцентрували при зниженому тиску. Залишок очистили колонковою хроматографією на силікагелі з використанням градієнта від CH2Cl2 до CH2Cl2/MeOH 19:1 (об./об.) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді світло-жовтого осаду (48 мг, 59 %). + MS ISP (m/e): 438,2 (100) [(M+H) ]. 1 H ЯМР (CDCl3, 300 МГц): δ (ppm) = 7,28 (d, 1H), 7,18 (t, 2H), 7,11 (t, 1H), 4,70 (m, 0,5H), 4,51 (m, 0,5H), 4,21 (m, 1,5H), 4,00 (m, 1H), 3,60 (m, 0,5H), 2,72 (m, 2H), 2,47 (s, 1,5H), 2,42 (s, 1,5H), 2,32 (m, 1H), 2,15 (m, 3H), 2,18 (m, 5H), 1,65 (m, 3H). Приклад 3 2-{6-(4-Хлорбензил)-2-[(рац)-3-ендо-8-(3-метил-[1,2,4]тіадіазол-5-іл)-8-азабіцикло[3.2.1]окт-3иламіно]піримідин-4-іл}пропан-2-ол N N S N HN N N Cl OH 30 35 40 45 50 a) (рац)-3-[(Z)-Гідроксііміно]-8-азабіцикло[3.2.1]октан-8-карбонової кислоти трет-бутиловий ефір До розчину Boc-нортропінону (1,13 г, 5 ммоль) в етанолі (5 мл) додали з перемішуванням гідроксиламіну гідрохлорид (0,695 г, 10 ммоль) у воді (5 мл). Додали порціями бікарбонат натрію (0,84 г, 10 ммоль) та реакційну суміш кип’ятили зі зворотним холодильником протягом 45 хвилин під азотом та перемішували при кімнатній температурі протягом ночі. Розчинник випарили при зниженому тиску. Додали воду та реакційну суміш екстрагували двічі етилацетатом. Об’єднані органічні шари висушили над сульфатом натрію, відфільтрували і розчинник випарили при зниженому тиску з одержанням сполуки, зазначеної в заголовку, у вигляді коричневого масла (1,28 г, 100 %). b) (рац)-3-ендо-3-Аміно-8-азабіцикло[3.2.1]октан-8-карбонової кислоти трет-бутиловий ефір Розчин (рац)-3-[(Z)-гідроксііміно]-8-азабіцикло[3.2.1]октан-8-карбонової кислоти третбутилового ефіру (635 мг, 2,64 ммоль) в етанолі (4 мл) та оцтовій кислоті (1 мл) гідрогенізували в атмосфері водню протягом ночі при кімнатній температурі в присутності PtO 2 (42 мг, 6,6 % мас.). Додали іншу порцію PtO2 (42 мг) і реакційну суміш додатково гідрогенізували протягом ночі. Каталізатор відфільтрували, промили етанолом. Фільтрат сконцентрували при зниженому тиску і залишок очистили колонковою хроматографією на силікагелі з використанням CH2Cl2/MeOH/NH3 19:1:0,1 (об./об./об.) як елюенту з одержанням сполуки, зазначеної в заголовку, у вигляді жовтого осаду (622 мг, 100 %). + MS ISP (m/e): 227,3 (100) [(M+H) ]. c) (рац)-(3-ендо)-3-[4-(4-Хлорбензил)-6-(1-гідрокси-1-метилетил)піримідин-2-іламіно]-8азабіцикло[3.2.1]октан-8-карбонової кислоти трет-бутиловий ефір Розчин (рац)-3-ендо-3-аміно-8-азабіцикло[3.2.1]октан-8-карбонової кислоти трет-бутилового ефіру (189 мг, 0,837 ммоль), 2-[2-хлор-6-(4-хлорбензил)піримідин-4-іл]-пропан-2-олу (342 мг, 0,92 ммоль) та N,N-діізопропілетиламіну (214 мкл, 1,26 ммоль) в діоксані (2 мл) нагрівали при 150 °C в мікрохвильовій печі протягом 1 години. Реакційну суміш розбавили водою та 19 UA 110368 C2 5 10 15 20 25 30 35 екстрагували двічі етилацетатом. Об’єднані органічні шари промили насиченим водним розчином хлориду натрію, висушили над сульфатом натрію, відфільтрували та сконцентрували при зниженому тиску. Залишок очистили колонковою хроматографією на силікагелі з використанням градієнта від CH2Cl2 до CH2Cl2:MeOH 19:1 (об./об.) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді жовтого масла (86 мг, 21 %). + MS ISP (m/e): 487,4 (100) [(M+H) ]. d) 2-[2-[(рац)-(3-ендо)-(8-Азабіцикло[3.2.1]окт-3-ил)аміно]-6-(4-хлорбензил)піримідин-4-іл]пропан-2-олу гідрохлорид До розчину (рац)-3-ендо-3-[4-(4-хлорбензил)-6-(1-гідрокси-1-метилетил)піримідин-2-іламіно]8-азабіцикло[3.2.1]октан-8-карбонової кислоти трет-бутилового ефіру (86 мг, 0,177 ммоль) в метиленхлориді (2 мл) додали при кімнатній температурі з перемішуванням 2 M розчин гідрохлориду в діетиловому ефірі (0,9 мл) та перемішували при кімнатній температурі протягом ночі. Розчинник видалили при зниженому тиску та додали трифтороцтову кислоту (2 мл). Розчинник видалили при зниженому тиску з одержанням сполуки, зазначеної в заголовку, у вигляді коричневої смоли (95 мг, 127%). + MS ISP (m/e): 387,4 (100) [(M+H) ]. e) 2-{6-(4-Хлорбензил)-2-[(рац)-3-ендо-8-(3-метил-[1,2,4]тіадіазол-5-іл)-8азабіцикло[3.2.1]окт-3-иламіно]піримідин-4-іл}пропан-2-ол Ацетат паладію(II) (3,8 мг, 0,017 ммоль) та 2-(дициклогексилфосфіно)біфеніл (12 мг, 0,034 ммоль) перемішували під азотом при кімнатній температурі в діоксані (1 мл) протягом 10 хвилин. Додали трет-бутилат натрію (32 мг, 0,32 ммоль), 2-[2-[(рац)-3-ендо-(8азабіцикло[3.2.1]окт-3-ил)аміно]-6-(4-хлорбензил)піримідин-4-іл]-пропан-2-олу гідрохлорид (90 мг, 0,213 ммоль), N,N-діізопропілетиламін (72,3 мкл, 0,425 ммоль) в діоксані (2 мл) та 5-хлор-3метил-[1,2,4]-тіадіазол (32 мг; 0,234 ммоль) і реакційну суміш нагрівали при 150 °C протягом 1 години в мікрохвильовій печі. Реакційну суміш розбавили водою та екстрагували двічі етилацетатом. Об’єднані органічні шари промили насиченим водним розчином хлориду натрію, висушили над сульфатом натрію, відфільтрували та сконцентрували при зниженому тиску. Залишок очистили колонковою хроматографією на силікагелі з використанням градієнта від CH2Cl2 до CH2Cl2:MeOH 19:1 (об./об.) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді світло-коричневої смоли (55 мг, 48 %). + MS ISP (m/e): 485,4/487,4 (100/33) [(M+H) ], 467,3/469,3 (38/16). 1 H ЯМР (CDCl3, 300 МГц): δ (ppm) = 7,28 (d, 2H), 7,19 (d, 2H), 6,43 (s, 1H), 4,94 (br d, 1H), 4,22 (m, 2H), 4,19 (m, 1H), 3,85 (s, 2H), 3,70 (s, 1H), 2,45 (m, 2H), 2,44 (s, 3H), 2,19 (m, 4H), 1,92 (d, 2H), 1,41 (s, 6H). Приклад 4 [8-(3,4-Дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]-[(рац)-8-ендо-3-(2трифторметилпіридин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін F F F F F N H N N N N N 40 45 50 a) (рац)-8-ендо-3-Бензил-3-азабіцикло[3.2.1]октан-8-амін (рац)-3-Бензил-3-азабіцикло[3.2.1]октан-8-ону оксим (1,2 г, 5,1 ммоль, WO2005/21536 A2) розчинили в метанолі (20 мл), додали шпателем значну кількість нікелю Ренея і суміш ® перемішували в атмосфері водню протягом 1 години, після чого її відфільтрували через Hyflo та сконцентрували. Залишок очистили колонковою хроматографією на силікагелі з використанням градієнта CH2Cl2:MeOH (об./об. 9:1-7:3) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді воскоподібного осаду (0,3 г, 26 %), а також елюйований раніше екзо-ізомер (0,4 г, 36 %). + MS ISP (m/e): 217,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 7,32-7,21 (m, 5H), 3,46 (s, 2H), 2,88 (s, 1H), 2,67 (dd, 2H), 2,11 (d, 2H), 1,97 (brs, 2H), 1,81-1,74 (m, 4H). b) N-(3-Бромопіридин-2-іл)-N’-етоксикарбонілтіосечовина 3-Бромпіридин-2-амін (30 г, 168 ммоль) та етоксикарбонілізотіоціанат (24,8 г, 21,3 мл, 185 20 UA 110368 C2 5 10 15 20 25 30 35 40 45 50 55 60 ммоль) розчинили в діоксані (300 мл) та перемішували при кімнатній температурі. Через 4 години додали додаткову кількість етоксикарбонілізотіоціанату (1 мл, 8,4 ммоль). Через 1 годину розчинник випарили і залишок висушили під глибоким вакуумом протягом 12 годин. Сполуку, зазначену в заголовку, одержали у вигляді світло-жовтого осаду (51,2 г, 100 %) та використовували неочищеною на наступній стадії. + MS ISP (m/e): 304,0/305,9 (100/73) [(M+H) ]. 1 H ЯМР (CDCl3, 300 МГц): δ (ppm) = 8,41 (m, 1H) 7,99-7,96 (m, 1H), 7,11-7,07 (m, 1H), 4,32 (q, 2H), 1,36 (t, 3H). c) 8-Бромо-[1,2,4]триазоло[1,5-a]піридин-2-амін Гідроксиламін (58,5 г, 842 ммоль) та N,N-діізопропілетиламін (65,3 г, 86,3 мл, 505 ммоль) розчинили в метанолі (200 мл) та етанолі (200 мл). Додали N-(3-бромопіридин-2-іл)-N’етоксикарбонілтіосечовину (51,2 г, 168 ммоль) та реакційну суміш перемішували при кімнатній температурі протягом 1 години, а потім при 60 °C протягом 3 годин. Білий преципітат відфільтрували та тритурували з водою протягом 25 хвилин, відфільтрували та тритурували два рази з діетиловим ефіром. Осад висушили спільною евапорацією з толуолом та висушили під вакуумом. Сполуку, зазначену в заголовку, одержали у вигляді білого осаду (27,9 г, 78%). + MS ISP (m/e): 213,0/ 215,1 (86/ 95) [(M+H) ]. 1 H ЯМР (CDCl3, 300 МГц): δ (ppm) = 8,28 (dd, 1H) 7,62 (dd, 1H), 6,73 (t, 1H), 4,66 (bs, 2H). d) 8-(3,4-Дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іламін Суспензію 8-бромо-[1,2,4]триазоло[1,5-a]піридин-2-аміну (5,33 г, 25 ммоль), 3,4дифторфенілборонову кислоту (5,92 г, 37,5 ммоль) та 2M водний розчин карбонату натрію (62,5 мл, 125 ммоль) в 1,4-діоксані (250 мл) обробили 1,1'-біс(дифенілфосфіно)фероценпаладію(II) дихлориду дихлорметановим комплексом (1,02 г, 1,25 ммоль) при кімнатній температурі і потім перемішували протягом 18 годин при 110 °C. Реакційну суміш охолодили до кімнатної температури та розділили між водою (312 мл) та етилацетатом (500 мл). Водний шар екстрагували додатковою кількістю етилацетату (500 мл). Органічні шари промили насиченим водним розчином хлориду натрію (300 мл), об’єднали, висушили над сульфатом натрію, відфільтрували та випарили. Коричневий осад тритурували діетиловим ефіром (130 мл) та дихлорметаном (25 мл) з одержанням сполуки, зазначеної в заголовку, у вигляді світлокоричневого осаду (6,33 г, 97 %). + MS ISP (m/e): 247,2 (100) [(M+H) ]. e) 2-Бромо-8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин До розчину броміду міді(II) (5,86 г, 26,3 ммоль) та трет-бутилнітриту (3,01 г, 3,48 мл, 26,3 ммоль) в ацетонітрилі (93 мл) додали 8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-амін (4,30 г, 17,5 ммоль) порціями при 60 °C. Реакційну суміш перемішували протягом 2 годин при 75 °C, охолодили до кімнатної температури та погасили 1M водним розчином хлористого водню (186 мл). Суміш екстрагували дихлорметаном (186 мл) три рази. Органічні шари об’єднали, висушили над сульфатом натрію, відфільтрували та випарили. Флеш-хроматографія на силікагелі (120 г) з дихлорметаном дала сполуку, зазначену в заголовку, у вигляді світложовтого осаду (4,30 г, 79 %). + MS ISP (m/e): 310,2/ 312,0 (100/100) [(M+H) ]. f) N-((рац)-8-ендо-3-Бензил-3-азабіцикло[3.2.1]октан-8-іл)-8-(3,4-дифторфеніл)[1,2,4]триазоло[1,5-a]піридин-2-амін Розчин 2-бромо-8-(3,4-дифторфеніл)-[1,2,4]триазоло[1,5-a]піридину (85 мг, 0,27 ммоль), (рац)-8-ендо-3-бензил-3-азабіцикло[3.2.1]октан-8-аміну (50 мг, 0,23 ммоль) та феноксиду натрію (40 мг, 0,35 ммоль) в безводному 1,4-діоксані (1 мл) в закритій пробірці продули аргоном протягом 10 хвилин. Додали до розчину Pd2(dba)3.CHCl3 (19 мг, 0,02 ммоль) та ксантфос (21 мг, 0,04 ммоль) і дегазування продовжили протягом додаткових 5 хвилин перед тим, як реакційну суміш нагрівали при 130 °C протягом 0,5 годин. Реакційну суміш розбавили дихлорметаном, промили 1M водним розчином карбонату натрію, органічну фазу висушили над сульфатом натрію, розчинник випарили, залишок очистили колонковою хроматографією на силікагелі з використанням н-гептану/етилацетату (об./об. 8:2 до 1:1) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді світло-жовтого осаду (88 мг, 85 %). + MS ISP (m/e): 446,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 8,35 (d, 1H), 7,90 (dd, 1H), 7,70-7,65 (m, 1H), 7,46 (d, 1H), 7,33-7,24 (m, 6H), 6,86 (t, 1H), 4,48 (d, 1H), 3,68 (d, 1H), 3,53 (s, 2H), 2,74 (dd, 2H), 2,33-2,30 (m, 4H), 1,86-1,62 (m 4H). g) [8-(3,4-Дифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]-[(рац)-8-ендо-3-(2трифторметилпіридин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]амін До N-((рац)-8-ендо-3-бензил-3-азабіцикло[3.2.1]октан-8-іл)-8-(3,4-дифторфеніл) 21 UA 110368 C2 5 10 15 [1,2,4]триазоло[1,5-a]піридин-2-аміну (0,09 г, 0,2 ммоль) в метанолі (5 мл) додали шпателем значну кількість 10% паладію на вугіллі, з наступним додаванням декількох крапель 25% водної соляної кислоти і суміш перемішували в атмосфері водню протягом 2 днів. Потім реакційну ® суміш відфільтрували через Hyflo та сконцентрували досуха. Залишок перерозчинили в диметилацетаміді (1 мл), додали триетиламін, довівши pH до основного, з наступним додаванням 4-йодо-2-(трифторметил)піридину (0,05 г, 0,2 ммоль), і суміш нагрівали при 135 °C протягом 16 годин. Реакційну суміш потім розбавили етилацетатом, промили повторно водою, потім сольовим розчином, висушили над сульфатом натрію та сконцентрували. Залишок очистили колонковою хроматографією на силікагелі з використанням н-гептану/етилацетату (об./об. 1:1) як елюенту. Сполуку, зазначену в заголовку, одержали у вигляді світло-жовтого осаду (8,4 мг, 9 %). + MS ISP (m/e): 501,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 8,35 (d, 1H), 8,40 (d, 1H), 7,90 (dd, 1H), 7,71-7,68 (m, 1H), 7,46 (d, 1H), 7,31-7,24 (m, 1H), 7,00 (d, 1H), 6,92 (t, 1H), 6,73 (dd, 1H), 4,57 (d, 1H), 3,98 (d, 1H), 3,72 (dd, 2H), 3,23 (d, 2H), 2,65 (s, 2H), 2,04-1,98 (m, 2H), 1,68-1,62 (m 2H). Приклад 5 [(рац)-8-ендо-3-(6-Метилпіримідин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2,3,4-трифторфеніл)[1,2,4]триазоло[1,5-a]піридин-2-іл]амін F F F N N H N N N N N 20 25 30 35 40 45 a) 2-Бромо-8-(2,3,4-трифторфеніл)-[1,2,4]триазоло[1,5-a]піридин Сполуку, зазначену в заголовку, білий осад, одержали за аналогією з прикладом 4, стадії від d до e, з 8-бромо-[1,2,4]триазоло[1,5-a]піридин-2-аміну та 2,3,4-трифторфенілборонової кислоти. b) N-((рац)-8-ендо-3-Бензил-3-азабіцикло[3.2.1]октан-8-іл)-8-(2,3,4-трифторфеніл)[1,2,4]триазоло[1,5-a]піридин-2-амін Сполуку, зазначену в заголовку, світло-коричневу піну, одержали за аналогією з прикладом 4f, з (рац)-8-ендо-3-бензил-3-азабіцикло[3.2.1]октан-8-аміну та 2-бромо-8-(2,3,4-трифторфеніл)[1,2,4]триазоло[1,5-a]піридину. + MS ISP (m/e): 464,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 8,35 (d, 1H), 7,69-7,64 (m, 1H), 7,58-7,52 (m, 1H), 7,44 (dt, 1H), 7,33-7,24 (m, 5H), 6,86 (t, 1H), 4,48 (d, 1H), 3,66 (d, 1H), 3,52 (s, 2H), 2,74 (dd, 2H), 2,33-2,30 (m, 4H), 1,83-1,74 (m 4H). c) [(рац)-8-ендо-3-(6-Метилпіримідин-4-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2,3,4трифторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін Сполуку, зазначену в заголовку, світло-коричневу піну, одержали за аналогією з прикладом 4g, з N-((рац)-8-ендо-3-бензил-3-азабіцикло[3.2.1]октан-8-іл)-8-(2,3,4-трифторфеніл)[1,2,4]триазоло[1,5-a]піридин-2-аміну та 4-хлор-6-метилпіримідину. + MS ISP (m/e): 466,2 [(M+H) ]. 1 H ЯМР (CDCl3, 400 МГц): δ (ppm) = 8,51 (s, 1H), 8,37 (d, 1H), 7,55-7,49 (m, 2H), 7,11-7,05 (m, 1H), 7,31-7,24 (m, 1H), 6,92 (t, 1H), 6,36 (s, 1H), 4,70 (d, 1H), 3,96 (d, 1H), 3,38 (t, 1H), 3,15 (d, 2H), 2,85 (s, 2H), 2,55 (brs, 2H), 2,40-2,35 (m, 4H), 1,88-1,85 (m 2H). Приклад 6 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4фторфеніл)-6-метил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін 22 UA 110368 C2 F Cl N N S 5 10 15 20 25 30 35 40 45 50 HH N N N N H N a) [(рац)-8-ендо-Бензил-3-азабіцикло[3.2.1]окт-8-ил]карбамінової кислоти трет-бутиловий ефір До розчину (рац)-8-ендо-3-бензил-3-азабіцикло[3.2.1]октан-8-аміну (3,9 г, 17,9 ммоль) в дихлорметані (40 мл) додали Boc-ангідрид (6,19 мл, 26,9 ммоль) і реакційну суміш перемішували при 25 °C протягом 2 годин. Видалення розчиннику при зниженому тиску з подальшою очисткою одержаного сирового матеріалу колонковою хроматографією на нормальному силікагелі (0-10% EtOAc/гексан) дало сполуку, зазначену в заголовку, у вигляді білого осаду (4,5 г, 79 %). 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 7,33-7,27 (m, 4H), 7,23-7,21 (m, 1H), 6,60 (br s, 1H, NH), 3,44 (s, 2H), 3,25 (m, 1H), 2,58 (dm, 2H), 2,07 (br d, 2H), 2,03 (br s, 1H), 1,70 (br m, 2H), 1,55 (br m, 2H), 1,37 (s, 9H). b) [(рац)-8-ендо-3-Азабіцикло[3.2.1]окт-8-ил]карбамінової кислоти трет-бутиловий ефір До розчину [(рац)-8-ендобензил-3-азабіцикло[3.2.1]окт-8-ил]карбамінової кислоти третбутилового ефіру (4,5 г, 14,2 ммоль) в метанолі (60 мл) додали Pd/C (10%; 750 мг) та реакційну суміш перемішували в атмосфері водню при 25 °C протягом 3 годин. Реакційну суміш відфільтрували через шар целіту і фільтрат випарили під вакуумом з одержанням сполуки, зазначеної в заголовку, у вигляді білого осаду (3,1 г, 96 %). + MS ISP (m/e): 227,2 (95) [(M+H) ], 171,2 (100). 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 6,52 (br s, 1H, NH), 2,55 (m, 4H), 1,91 (br s, 2H), 1,68 (m, 2H), 1,42 (m, 2H), 1,37 (s, 9H). c) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]карбамінової кислоти трет-бутиловий ефір До розчину [(рац)-8-ендо-3-азабіцикло[3.2.1]окт-8-ил]карбамінової кислоти трет-бутилового ефіру (3,5 г, 15,4 ммоль) в етанолі (40 мл) в закритій пробірці додали 5-хлор-3-метил[1,2,4]тіадіазол (1,73 мл, 18,5 ммоль) та триетиламін (3,26 мл, 23,2 ммоль). Реакційну суміш перемішували при 100 °C протягом 12 годин. Розчинник видалили під вакуумом. Одержаний неочищений матеріал очистили колонковою хроматографією на нормальному силікагелі (0-15% EtOAc/гексан) з одержанням сполуки, зазначеної в заголовку, у вигляді білого осаду (3,9 г, 91 %). + MS ISP (m/e): 325,2 (95) [(M+H) ], 269,0 (100). d) (рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-амін До розчину [(рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8ил]карбамінової кислоти трет-бутилового ефіру (700 мг, 2,16 ммоль) в дихлорметані (15 мл) додали трифтороцтову кислоту (2,5 мл) і реакційну суміш перемішували при 25 °C протягом 2 годин. Леткі компоненти видалили під вакуумом. Одержаний залишок нейтралізували насиченим розчином водного бікарбонату натрію та екстрагували дихлорметаном (2×30 мл). Об’єднаний органічний шар висушили над безводним сульфатом натрію, відфільтрували, і розчинник випарили під вакуумом з одержанням сполуки, зазначеної в заголовку, у вигляді білого осаду (480 мг, 96 %). + MS ISP (m/e): 225,0 (100) [(M+H) ]. e) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4фторфеніл)-6-метил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін До розчину 2-бромо-8-(2-хлор-4-фторфеніл)-6-метил-[1,2,4]триазоло[1,5-a]піридину (CAS 1329673-52-0; US 20110201605) (30 мг, 0,088 ммоль) в безводному 1,4-діоксані (2 мл) додали (рац)-8-ендо-3-(3-метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-амін (29,6 мг, 0,13 ммоль) та феноксид натрію (15,3 мг, 0,132 ммоль). Суміш продули аргоном протягом 10 хвилин. До цієї суміші потім додали Pd2(dba)3∙CHCl3 (7,3 мг, 0,007 ммоль) та ксантфос (8,16 мг, 0,014 ммоль). Реакційну суміш продули ще раз аргоном протягом 10 хвилин. Реакційну суміш нагрівали при 130 °C протягом 0,5 годин в мікрохвильовій печі. Її розбавили EtOAc (10 мл) та промили водою (5 мл). Органічний шар висушили над безводним сульфатом натрію, відфільтрували, і розчинник випарили під вакуумом. Одержаний неочищений матеріал очистили 23 UA 110368 C2 5 за допомогою препаративної ВЕРХ з одержанням сполуки, зазначеної в заголовку, у вигляді сіро-білого осаду (8,8 мг, 21 %). + MS ISP (m/e): 484,2/486,2 (100/35) [(M+H) ]. 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 8,57 (br s, 1H, NH), 7,59 (m, 2H), 7,33 (m, 2H), 6,70 (d, 1H), 4,02 (q, 1H), 3,75 (m, 1H), 3,55 (br m, 1H), 3,36 (d, 2H), 2,33 (s, 3H), 2,27 (s, 3H), 1,91 (m, 2H), 1,39 (br d, 2H). Приклад 7 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4фторфеніл)-6-фтор-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін 10 F Cl N N 15 20 25 30 35 H N S N N H H N N F a) 2-Бромо-8-(2-хлор-4-фторфеніл)-6-фтор-[1,2,4]триазоло[1,5-a]піридин До розчину броміду міді(II) (60 мг, 0,268 ммоль) та трет-бутилнітриту (27,8 мг, 0,268 ммоль) в ацетонітрилі (2 мл) при 60 °C додали 8-(2-хлор-4-фторфеніл)-6-фтор-[1,2,4]триазоло[1,5a]піридин-2-іламін (CAS 1319068-45-5; WO2011092272) (50 мг, 0,179 ммоль) однією порцією, і реакційну суміш перемішували протягом 2 годин при 75 °C. Реакційну суміш охолодили до 25 °C та погасили водним розчином HCl (1M, 5 мл). Реакційну суміш розбавили водою (5 мл) та екстрагували EtOAc (2×10 мл). Об’єднаний органічний шар висушили над безводним сульфатом натрію, відфільтрували та випарили при зниженому тиску з одержанням сполуки, зазначеної в заголовку (55 мг, неочищена), у вигляді коричневого осаду, який використовували на наступній стадії без будь-якої додаткової очистки. + MS ISP (m/e): 344,2/346,2 (98/100) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(2-хлор-4фторфеніл)-6-фтор-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (48,8 мг, 0,021 ммоль) та 2-бромо-8(2-хлор-4-фторфеніл)-6-фтор-[1,2,4]триазоло[1,5-a]піридину (CAS 1319068-45-5; WO 2011092272) (50 мг, 0,14ммоль), у вигляді білого осаду (11,3 мг, 16 %). + MS ISP (m/e): 488,0/489,1 (100/35) [(M+H) ]. 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 9,11 (q, 1H), 7,66-7,60 (m, 3H), 7,37 (t, 1H), 6,87 (d, 1H), 3,75 (d, 1H), 3,58 (br m, 2H), 3,35 (d, 2H), 2,45 (br s, 2H), 2,27 (s, 3H), 1,91 (m, 2H), 1,39 (br d, 2H). Приклад 8 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4-хлор-2метоксифеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін N N H N S N N H H N N O F 40 a) 2-Бромо-8-(4-фтор-2-метоксифеніл)-[1,2,4]триазоло[1,5-a]піридин Сполуку, зазначену в заголовку, білий осад, одержали за аналогією з прикладом 4, стадії від d до e, з 8-бромо-[1,2,4]триазоло[1,5-a]піридин-2-аміну та 4-фтор-2-метоксифенілборонової 24 UA 110368 C2 5 10 15 кислоти. + MS ISP (m/e): 322,2/324,2 (100/100) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(4-хлор-2метоксифеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (52,1 мг, 0,23 ммоль) та 2-бромо-8(4-фтор-2-метоксифеніл)-[1,2,4]триазоло[1,5-a]піридину (50 мг, 0,14 ммоль), у вигляді сіро-білого осаду (13,8 мг, 19 %). + MS ISP (m/e): 466,0 (100) [(M+H) ]. 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 8,61 (br s, 1H, NH), 7,57 (t, 1H), 7,43 (d, 1H), 7,04 (dd, 1H), 6,92 (t, 1H), 6,88 (dt, 1H), 6,73 (d, 1H), 3,76 (s, 3H), 3,77 (m, 1H), 3,58 (br m, 2H), 3,37 (d, 2H), 2,27 (s, 3H), 1,92 (m, 2H), 1,40 (br d, 2H). Приклад 9 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3-ціано-4фторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін N H N N N S N N N H N 20 25 30 F a) 5-(2-Бромо-[1,2,4]триазоло[1,5-a]піридин-8-іл)-2-фторбензонітрил Сполуку, зазначену в заголовку, білий осад, одержали за аналогією з прикладом 4, стадії від d до e, з 8-бромо-[1,2,4]триазоло[1,5-a]піридин-2-аміну та 4-фтор-3-ціанофенілборонової кислоти. + MS ISP (m/e): 317,0/319,0 (98/100) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3-ціано-4фторфеніл)-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (39,2 мг, 0,17 ммоль) та 5-(2-бромо[1,2,4]триазоло[1,5-a]піридин-8-іл)-2-фторбензонітрилу (37 мг, 0,11 ммоль), у вигляді сіро-білого осаду (14,6 мг, 27 %). + MS ISP (m/e): 461,4 (100) [(M+H) ]. Приклад 10 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3,4дифторфеніл)-6-трифторметил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін F F N N S HH N N H F N N F 35 40 N F a) 2-Бромо-8-(3,4-дифторфеніл)-6-трифторметил-[1,2,4]триазоло[1,5-a]піридин Сполуку, зазначену в заголовку, коричневий осад (57 мг, неочищена), одержали за аналогією з прикладом 7a, з 8-(3,4-дифторфеніл)-6-трифторметил-[1,2,4]триазоло[1,5-a]піридин2-іламіну (CAS 1319068-34-2, WO 2011092272) (50 мг, 0,159 ммоль). + MS ISP (m/e): 378,0/380,1 (100/98) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-(3,4дифторфеніл)-6-трифторметил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін 25 UA 110368 C2 5 10 Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (44,4 мг, 0,19 ммоль) та 2-бромо-8(3,4-дифторфеніл)-6-трифторо[1,2,4]триазоло[1,5-a]піридину (CAS 1319068-34-2, WO2011092272) (50 мг, 0,13 ммоль), у вигляді сіро-білого осаду (22,0 мг, 14 %). + MS ISP (m/e): 522,2 (100) [(M+H) ]. 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 9,35 (br s, 1H, NH), 8,38 (dd, 1H), 8,12 (m, 1H), 8,08 (s, 1H),7,59 (q, 1H), 7,27 (d, 1H), 3,84 (d, 1H), 3,59 (br m, 2H), 3,39 (d, 2H), 2,54 (br s, 2H), 2,28 (s, 3H), 1,98 (m, 2H), 1,44 (br d, 2H). Приклад 11 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-метокси[1,2,4]триазоло[1,5-a]піридин-2-іл]амін N HH N N N S N N N H O 15 20 25 Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (51,5 мг, 0,23 ммоль) та 2-бромо-8метоксил-[1,2,4]триазоло[1,5-a]піридину (CAS 1319067-40-7; WO 2011092272) (35 мг, 0,15 ммоль), у вигляді білого осаду (15,3 мг, 27 %). + MS ISP (m/e): 372,2 (100) [(M+H) ]. 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 8,21 (br d, 1H), 6,92 (d, 1H), 6,79 (t, 1H), 6,56 (d, 1H), 3,91 (s, 3H), 3,81 (d, 1H), 3,57 (br m, 2H), 3,38 (d, 2H), 3,23 (m, 1H), 2,27 (s, 3H), 1,94 (m, 2H), 1,41 (br d, 2H). Приклад 12 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-хлор-6трифторметил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін F N N S H N N N N F F N H Cl 30 35 40 a) 2-Бромо-8-хлор-6-трифторметил[1,2,4]триазоло[1,5-a]піридин Сполуку, зазначену в заголовку, коричневий осад (60 мг, неочищена), одержали за аналогією з прикладом 7a, з 8-хлор-6-трифторметил-[1,2,4]триазоло[1,5-a]піридин-2-іл-аміну (CAS 1206640-61-0; WO2011092272) (50 мг, 0,212 ммоль). + MS ISP (m/e): 300,2/302,0 (80/100) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-хлор-6трифторметил-[1,2,4]триазоло[1,5-a]піридин-2-іл]амін Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (56,0 мг, 0,25 ммоль) та 2-бромо-8хлор-6-трифторметил-[1,2,4]триазоло[1,5-a]піридину (CAS 1206640-61-0; WO2011092272) (50 мг, 0,167 ммоль), у вигляді сіро-білого осаду (8,7 мг, 12 %). + MS ISP (m/e): 444,2/445,2 (100/36) [(M+H) ]. Приклад 13 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5,6-диметил[1,2,4]триазоло[1,5-a]піридин-2-іл]амін 26 UA 110368 C2 N H N N N S 5 10 15 N N N H a) 2-Бромо-5,6-диметил-[1,2,4]триазоло-[1,5-a]піридин Сполуку, зазначену в заголовку, коричневий осад (50 мг, неочищена), одержали за аналогією з прикладом 7a, з 5,6-диметил-[1,2,4]триазоло[1,5-a]піридин-2-іл-аміну (CAS 131906794-1; WO 2011092272) (40 мг, 0,24 ммоль). + MS ISP (m/e): 226,2/228,0 (90/100) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5,6-диметил[1,2,4]триазоло[1,5-a]піридин-2-іл]амін Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (74,3 мг, 0,33 ммоль) та 2-бромо5,6-диметил-[1,2,4]триазоло[1,5,-a]піридину (CAS 1319067-94-1; WO2011092272) (50 мг, 0,22 ммоль), у вигляді білого осаду (11,9 мг, 15 %). + MS ISP (m/e): 369,8 (100) [(M+H) ]. Приклад 14 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-бензилокси[1,2,4]триазоло[1,5-a]піридин-2-іл]амін O N H N N N S H N N N 20 25 30 35 a) 8-Бензилокси-2-бромо-[1,2,4]триазоло[1,5-a]піридин Сполуку, зазначену в заголовку, коричневий осад (50 мг, неочищена), одержали за аналогією з прикладом 7a, з 8-бензилокси-[1,2,4]триазоло[1,5-a]піридин-2-іл-аміну (CAS 1319067-83-8; WO 2011092272) (40 мг, 0,167 ммоль). + MS ISP (m/e): 304,1/306,0 (98/100) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[8-бензилокси[1,2,4]триазоло[1,5-a]піридин-2-іл]амін Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (55,2 мг, 0,24 ммоль) та 8бензилокси-2-бромо-[1,2,4]триазоло[1,5-a]піридину (CAS 1319067-83-8; WO2011092272) (50 мг, 0,16 ммоль), у вигляді білого осаду (15,9 мг, 22 %). + MS ISP (m/e): 448,0 (100) [(M+H) ]. Приклад 15 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5-пропіл[1,2,4]триазоло[1,5-a]піридин-2-іл]амін N N S 40 45 H N N N N N H a) 2-Бромо-5-пропіл-[1,2,4]триазоло-[1,5-a]піридин Сполуку, зазначену в заголовку, білий осад (53 мг, неочищена), одержали за аналогією з прикладом 7a, з 5-пропіл-[1,2,4]триазоло[1,5-a]піридин-2-іл-аміну (CAS 1319067-63-4; WO 2011092272) (40 мг, 0,22 ммоль). + MS ISP (m/e): 240,0/242,0 (96/100) [(M+H) ]. b) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5-пропіл[1,2,4]триазоло[1,5-a]піридин-2-іл]амін 27 UA 110368 C2 5 10 Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (70 мг, 0,31 ммоль) та 2-бромо-5пропіл-[1,2,4]триазоло[1,5-a]піридину (CAS 1319067-63-4; WO 2011092272) (50 мг, 0,20 ммоль), у вигляді сіро-білого осаду (11,2 мг, 14%). + MS ISP (m/e): 384,0 (100) [(M+H) ]. 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 7,40 (t, 1H), 7,29 (d, 1H), 6,76 (d, 1H), 6,67 (d, 1H), 3,85 (d, 1H), 3,57 (br m, 2H), 3,40 (d, 2H), 2,96 (t, 2H), 2,28 (s, 3H), 1,96 (m, 2H), 1,79 (q, 2H), 1,43 (br d, 2H), 0,95 (t, 3H). Приклад 16 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-(5-феніл[1,2,4]триазоло[1,5-a]піразин-2-іл)амін N N 15 20 25 30 35 40 45 H N S N N H H N N N a) 2-Аміно-5-феніл-[1,2,4]триазоло[1,5-a]піразин До розчину 6-(4-фторфеніл)піразин-2-аміну (1,484 г, 7,84 ммоль), розчиненого в безводному діоксані (60 мл), додали етоксикарбонілізотіоціанат (1,02 мл, 8,63 ммоль) з одержанням жовтої суспензії. Реакційну суміш перемішували при кімнатній температурі протягом 2 днів, при цьому колір змінювався від жовтого до червоного, і зрештою одержали світло-коричневу суспензію. Реакційну суміш випарили досуха при зниженому тиску. Неочищений продукт одразу + використовували на наступній стадії (2,92 г, неочищений). MS ISP (m/e): 321,1 (100) [(M+H) ]. Неочищений продукт додали до суспензії гідроксиламіну гідрохлориду (2,72 г, 39,2 ммоль) та N,N-діізопропілетиламіну (4,03 мл, 23,5 ммоль), суспендованого в метанолі (20 мл) та етанолі (20 мл). Після перемішування протягом 1 години при кімнатній температурі, реакційну суміш перемішували при 60 °C протягом 3 годин. Реакційну суміш випарили досуха при зниженому тиску та залишок розділили між насиченим водним гідрокарбонатом натрію та метиленхлоридом. Органічний шар висушили над сульфатом натрію, відфільтрували та розчинники випарили при зниженому тиску. Неочищений матеріал очистили двічі флешхроматографією (силікагель, 100 г, від 0% до 15% MeOH/NH 4OH в дихлорметані) з одержанням сполуки, зазначеної в заголовку, у вигляді сіро-білого осаду (985 мг, 55 %). + MS ISP (m/e): 230,3 [(M+H) ]. b) 2-Бромо-5-феніл-(1,2,4)триазоло(1,5-a)піразин Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 7a, з 2-аміно-5-феніл[1,2,4]триазоло[1,5-a]піразину (145,9 мг, 0,69 ммоль)), у вигляді світло-жовтого кристалічного осаду (210 мг, кількісн.). + MS ISP (m/e): 277,1/275,1 (100/99) [(M+H) ]. c) [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-(5-феніл[1,2,4]триазоло[1,5-a]піразин-2-іл)амін Сполуку, зазначену в заголовку, одержали за аналогією з прикладом 6e, з (рац)-8-ендо-3-(3метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]октан-8-аміну (42,6 мг, 0,19 ммоль) та 2-бром-5феніл-(1,2,4)триазоло(1,5-a)піразину (35 мг, 0,08 ммоль), у вигляді білого осаду (10,9 мг, 20 %). + MS ISP (m/e): 419,4 (100) [(M+H) ]. 1 H ЯМР (ДМСО-d6, 400 МГц): δ (ppm) = 8,92 (br s, 1H, NH), 8,24 (s, 1H), 8,09 (br d, 2H), 7,617,54 (m, 3H), 6,23 (d, 1H), 3,90 (d, 1H), 3,59 (br m, 2H), 3,39 (d, 2H), 2,95 (b s, 1H), 2,32 (s, 3H), 1,96 (m, 2H), 1,43 (br d, 2H). Приклад 17 [(рац)-8-ендо-3-(3-Метил-[1,2,4]тіадіазол-5-іл)-3-азабіцикло[3.2.1]окт-8-ил]-[5-трифторметил[1,2,4]триазоло[1,5-a]піридин-2-іл]амін 28
ДивитисяДодаткова інформація
Автори англійськоюBaumann, Karlheinz, Green, Luke, Limberg, Anja, Luebbers, Thomas, Thomas, Endrew
Автори російськоюБауманн Карлхайнц, Грин Люк, Лимбэрг Анья, Луэббэрс Томас, Томас Эндрю
МПК / Мітки
МПК: A61K 31/4196, C07D 471/04, A61P 25/00, C07D 519/00
Мітки: місточкові, похідні, піперидину
Код посилання
<a href="https://ua.patents.su/45-110368-mistochkovi-pokhidni-piperidinu.html" target="_blank" rel="follow" title="База патентів України">Місточкові похідні піперидину</a>
Попередній патент: Катодний блок з верхнім шаром, який містить твердий матеріал
Наступний патент: Парова турбіна та спосіб створення пікової потужності на енергоблоках теплових електростанцій
Випадковий патент: Осаджувальна центрифуга