Інгібітори р70 s6-кінази
Номер патенту: 99284
Опубліковано: 10.08.2012
Автори: Даллі Роберт Дін, Джоузеф Саджан, Хуан Цзяньпін, Холст Крістіан Л., Шеперд Тімоті Алан
Формула / Реферат
1. Сполуки формули:
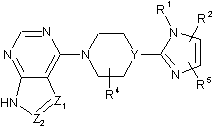 , I
, I
де:
Y - CR6;
Z1 та Z2 незалежно один від одного є CR3 або N, за умови, що Z1 та Z2 не є N водночас;
R1 - Н або СН3;
R2 - феніл, заміщений першим замісником, вибраним із групи, яку складають галоген та трифторметил, факультативно додатково заміщений другим замісником, яким є галоген;
R3 - водень, галоген, С1-С4-алкіл, С3-С6-циклоалкіл або С2-С6-алкініл, де С2-С6-алкініл факультативно заміщений гідроксилом;
R4 та R5 незалежно один від одного є водень або С1-С4-алкіл;
R6 - водень;
або фармацевтично прийнятні солі цих сполук.
2. Сполуки за п. 1, де Z2 - N, або фармацевтично прийнятні солі цих сполук.
3. Сполука за п. 1, яка являє собою 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1-метил-1H-імідазол-2-іл]піперидин-1-іл}-1Н-піразоло[3,4-d]піримідин, або фармацевтично прийнятна сіль цієї сполуки.
4. Сполука за п. 3, яка являє собою n-толуолсульфонат 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1-метил-1H-імідазол-2-іл]піперидин-1-іл}-1Н-піразоло[3,4-d]піримідину.
5. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-4 або фармацевтично прийнятну сіль цієї сполуки у комбінації з фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
6. Сполука за будь-яким із пп. 1-4 або фармацевтично прийнятна сіль цієї сполуки для застосування у терапії.
7. Застосування сполуки за будь-яким із пп. 1-4 або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для пригнічення ангіогенезу.
8. Застосування сполуки за будь-яким із пп. 1-4 або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування аденокарцином товстої кишки.
9. Спосіб пригнічення ангіогенезу у ссавців, який включає введення в організм ссавця, який цього потребує, ефективної кількості сполуки за будь-яким із пп. 1-4 або фармацевтично прийнятної солі цієї сполуки.
10. Спосіб лікування аденокарцином товстої кишки у ссавців, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки за будь-яким із пп. 1-4 або фармацевтично прийнятної солі цієї сполуки.
Текст
Реферат: Цей винахід пропонує інгібітори р70 S6-кінази формули: R N 1 R N 5 Y N Z1 Z2 R N N HN 2 R 4 , фармацевтичні композиції, які містять їх, та їх застосування. UA 99284 C2 (12) UA 99284 C2 UA 99284 C2 5 10 p70 S6-кіназа є нижчим ефектором мішені фосфатидилінозит-3-кінази (PI3K)/AKT/ рапаміцинового (mTOR) сигнального шляху. р70 S6-кіназа звичайно активується у багатьох людських твердих пухлинах. Діяльність р70 S6-кінази регулює біогенез рибосом, ріст клітин та проходження клітинного циклу як реакцію на мітогенні подразнення. Таким чином, пригнічення активності р70 S6-кінази спричиняє блокування біогенезу рибосом, синтезу певних протеїнів, росту клітин та проходження клітинного циклу. Отже, р70 S6-кіназа відіграє певну роль у проліферації пухлинних клітин та у захисті клітин від апоптозу. Крім того, інгібітори р70 S6-кінази описані як корисні засоби при лікуванні інфекцій, запалення та утворення пухлин, а також захворювань метаболічного походження та розладів метаболізму (WO 2005/117909, WO 2006/071819, WO 2006/046024, WO 2007/125321 та WO 2008/012635). Цей винахід пропонує надзвичайно ефективні сполуки, які пригнічують активність р70 S6-кінази. Крім того, конкретні сполуки за цим винаходом мають високу біодоступність. Цей винахід пропонує сполуки формули I: 1 R N N 2 R N N Y N HN 15 20 25 30 35 40 45 50 Z2 Z1 4 R 5 R I, де: 6 Y – N або CR ; 3 Z1 та Z2 незалежно один від одного є CR або N, за умови, що не обидва Z1 та Z2 є N; 1 R – H або C1-C4-алкіл; 2 R – феніл, факультативно заміщений першим замісником, вибраним із групи, яку складають C1-C4-алкілоксигрупа, ціаногрупа, NO2, галоген, трифторметил та трифторметоксигрупа, та факультативно додатково заміщений другим замісником, вибраним із групи, яку складають галогени; 3 R – водень, галоген, C1-C4-алкіл, C3-C6-циклоалкіл або C2-C6-алкініл, де C2-C6-алкініл факультативно заміщений гідроксилом; 4 5 R та R незалежно один від одного є водень або C 1-C4-алкіл; 6 R – водень або гідроксил; або фармацевтично прийнятні солі цих сполук. Цей винахід також пропонує сполуки формули I, де: 6 Y – N або CR ; 3 Z1 та Z2 незалежно один від одного є CR або N, за умови, що не обидва Z1 та Z2 є N; 1 R – H або C1-C4-алкіл; 2 R – феніл, факультативно заміщений першим замісником, вибраним із групи, яку складають C1-C4-алкілоксигрупа, ціаногрупа, NO2, галоген, трифторметил та трифторметоксигрупа, та факультативно додатково заміщений другим замісником, вибраним із групи, яку складають галогени; 3 R – водень, галоген або C3-C6-циклоалкіл; 4 5 R та R незалежно один від одного є водень або C 1-C4-алкіл; 6 R – водень або гідроксил; або фармацевтично прийнятні солі цих сполук. Цей винахід також пропонує спосіб інгібування p70 S6-кінази у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує спосіб пригнічення ангіогенезу у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Крім того, цей винахід також пропонує спосіб лікування аденокарцином товстої кишки у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Крім того, цей винахід також пропонує спосіб лікування недрібноклітинного раку легенів у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. 1 UA 99284 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід також пропонує спосіб лікування мультиформної гліобластоми у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує спосіб лікування карциноми яєчника у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує спосіб лікування лейкозу у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує спосіб лікування раку підшлункової залози у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід, крім того, пропонує спосіб лікування раку передміхурової залози у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує спосіб лікування раку грудної залози у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує спосіб лікування лімфангіолейоміоматозу у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує фармацевтичну композицію, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з фармацевтично прийнятним носієм, розріджувачем або наповнювачем. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для інгібування p70 S6-кінази. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у інгібуванні p70 S6-кінази у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, призначену для інгібування p70 S6-кінази, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для пригнічення ангіогенезу. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у пригніченні ангіогенезу у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для пригнічення ангіогенезу, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування аденокарцином товстої кишки. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль такої сполуки для застосування у лікуванні аденокарцином товстої кишки у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування аденокарцином товстої кишки, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування недрібноклітинного раку легенів. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні недрібноклітинного раку легенів у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування недрібноклітинного раку легенів, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування мультиформної гліобластоми. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні мультиформної гліобластоми у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування мультиформної гліобластоми, яка містить сполуку формули I або фармацевтично прийнятну 2 UA 99284 C2 5 10 15 20 25 30 35 40 45 50 55 сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування карциноми яєчника. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні карциноми яєчника у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування карциноми яєчника, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування лейкозу. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні лейкозу у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування лейкозу, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування раку підшлункової залози. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні раку підшлункової залози у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування раку підшлункової залози, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування раку передміхурової залози. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні раку передміхурової залози у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування раку передміхурової залози, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування раку грудної залози. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні раку грудної залози у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування раку грудної залози, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Цей винахід також пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування лімфангіолейоміоматозу. Крім того, цей винахід пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування у лікуванні лімфангіолейоміоматозу у ссавців. Крім того, цей винахід пропонує фармацевтичну композицію, прийнятну для лікування лімфангіолейоміоматозу, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки у комбінації з одним або декількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами цієї сполуки. Крім того, цей винахід пропонує застосування сполуки формули I у терапії. Загальні хімічні терміни, вжиті у наведених вище формулах, мають свої звичайні значення. Наприклад, термін "C1-C4-алкіл" означає лінійний або розгалужений, одновалентний, насичений аліфатичний ланцюг, який містить від одного до чотирьох атомів вуглецю, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил та трет-бутил тощо. Аналогічно, термін "C1-C3-алкіл" охоплює метил, етил та ізопропіл тощо. У значенні, вживаному у цьому описі, термін "C 1-C4-алкокси[група]" означає лінійний або розгалужений алкільний ланцюг, який містить від одного до чотирьох атомів вуглецю, приєднаний до атома кисню. До типових C1-C4-алкоксильних груп належать метокси-, етокси-, пропокси-, ізопропокси-, бутокси-, трет-бутоксигрупа тощо. 3 UA 99284 C2 5 10 15 20 25 30 35 40 45 50 55 60 У значенні, вживаному у цьому описі, термін "галоген" означає атоми хлору, брому, йоду або фтору, якщо конкретно не зазначено інше. У значенні, вживаному у цьому описі, термін "C3-C6-циклоалкіл" означає повністю насичений цикл, який містить атоми вуглецю та водню, та охоплює циклопропіл та циклобутил. У значенні, вживаному у цьому описі, термін "C 2-C6-алкініл" означає лінійний або розгалужений алкінільний ланцюг, який містить від двох до шести атомів вуглецю та один потрійний зв’язок, в тому числі, проте без обмеження ними, етиніл, пропініл, бутиніл, пентиніл тощо. Сполуки за цим винаходом є основами та відповідно реагують із будь-якою із численних органічних та неорганічних кислот з утворенням фармацевтично прийнятних солей, і цей винахід охоплює фармацевтично прийнятні солі сполук формули I. Термін "фармацевтично прийнятна сіль" у значенні, вживаному у цьому описі, означає солі сполук формули I, які є практично нетоксичними для живих організмів. До таких солей належать фармацевтично прийнятні солі, перелічені у Journal of Pharmaceutical Science, 66, 2-19 (1977), які є відомими фахівцю у галузі. Перевага віддається таким солям, як гідрохлориди, мезилати та тозилати (також відомі як п-толуолсульфонати). Найбільша перевага віддається гідрохлоридам та тозилатам. Деякі сполуки цього винаходу містять один або декілька хіральних центрів та можуть, таким чином, існувати у різноманітних стереоізомерних конфігураціях. Внаслідок наявності цих хіральних центрів сполуки за цим винаходом можуть зустрічатися у вигляді рацематів, сумішей енантіомерів та індивідуальних енантіомерів, а також діастереомерів та сумішей діастереомерів. Всі такі рацемати, енантіомери та діастереомери охоплюються цим винаходом. Конкретні стереоізомери та енантіомери сполук формули I можуть бути одержані із застосуванням звичайних методік та способів, відомих у галузі, наприклад, таких як описані у монографіях Жак та ін. (J. Jacques, et al., "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, Inc., 1981), та Ельєль та Уайлен (E.L. Eliel and S.H. Wilen, "Stereochemistry of Organic Compounds", Wiley-Interscience 1994), та у Європейській патентній заявці № EP-A-838448, опублікованій 29 квітня 1998 р. До прикладів способів розділення належать перекристалізація та хіральна хроматографія. 1 Фахівцю буде також зрозуміло, що сполуки формули I, де R – водень, або Z1 чи Z2 – N, існують у формі таутомерів. Хоча таутомери є структурно відмінними, для фахівця зрозуміло, що між ними існує рівновага, і за звичайних умов кожний з них легко та швидко перетворюється в інший. (Дивись монографії Марч – March, Advanced Organic Chemistry, Third Edition, Wiley Interscience, New York, New York (1985), pp. 66-70; та Аллінгер – Allinger, Organic Chemistry, Second Edition, Worth Publishers, New York, New York, (1976), p. 173). Таким чином, представлення сполуки формули I в одній таутомерній формі охоплює обидві таутомерні форми 1 окремо та їх суміші. Аналогічно, кожна з назв сполуки формули I, де, наприклад, R – водень, така як 1H-імідазол або 3H-імідазол, охоплює обидві таутомерні форми. Певні класи сполук формули I є інгібіторами p70 S6-кінази, яким віддається перевага. У нижченаведених абзацах описані такі класи, яким віддається перевага: 6 a) Y – CR ; b) Y – CH; 1 c) R – H; 1 d) R – CH3; 3 e) Z1 – CR ; f) Z1 – CH; g) Z2 – N; 2 h) R – феніл, заміщений першим замісником, вибраним із групи, яку складають галогени та трифторметил, та факультативно додатково заміщений другим замісником, яким є галоген; 2 i) R – феніл, заміщений першим замісником, вибраним із групи, яку складають галогени та трифторметил, та додатково заміщений другим замісником, яким є галоген; 2 j) R – феніл, заміщений у положенні 3 або 4 першим замісником, вибраним із групи, яку складають галогени та трифторметил, та факультативно додатково заміщений другим замісником, яким є галоген; 2 k) R – феніл, заміщений у положенні 3 або 4 першим замісником, вибраним із групи, яку складають галогени та трифторметил, та додатково заміщений другим замісником, яким є галоген; 2 l) R – феніл, заміщений у положенні 3 першим замісником, вибраним із групи, яку складають галогени та трифторметил, та факультативно додатково заміщений в положенні 4 другим замісником, яким є галоген; 4 UA 99284 C2 5 5 10 15 20 25 30 m) R – H; n) сполука формули I – вільна основа; o) сполука формули I – сіль; p) сполука формули I – гідрохлорид; q) сполука формули I – тозилат. 6 1 Перевага також віддається іншим сполукам формули I, де Y – CR , та R – H або CH3. Крім 6 1 2 того, перевага віддається сполукам формули I, де Y – CR , та R – H або CH3; та R – феніл, заміщений першим замісником, вибраним із групи, яку складають галогени та трифторметил, та факультативно додатково заміщений другим замісником, яким є галоген. 6 1 2 Перевага віддається також сполукам формули I, де Y – CR , та R – H або CH3; R – феніл, заміщений першим замісником, вибраним із групи, яку складають галогени та трифторметил, та 5 3 факультативно додатково заміщений другим замісником, яким є галоген; R – H; Z1 – CR та Z2 – N. 1 2 Перевага віддається також сполукам формули I, в яких Y – CH; R – H або CH3; R – феніл, заміщений першим замісником, вибраним із групи, яку складають галогени та трифторметил, та 5 факультативно додатково заміщений другим замісником, яким є галоген; R – H; Z1 – CH та Z2 – N. 1 2 Крім того, перевага віддається тим сполукам формули I, в яких Y – CH; R – H або CH3; R – феніл, заміщений першим замісником, вибраним із групи, яку складають галогени та 5 трифторметил, та додатково заміщений другим замісником, яким є галоген; R – H; Z1 – CH та Z2 – N. 1 2 Більша перевага віддається тим сполукам формули I, в яких Y – CH; R – H або CH3; R – феніл, заміщений у положенні 3 першим замісником, вибраним із групи, яку складають галогени та трифторметил, та факультативно додатково заміщений в положенні 4 другим замісником, 5 яким є галоген; R – H; Z1 – CH, та Z2 – N. 1 Крім того, більша перевага віддається тим сполукам формули I, в яких Y – CH; R – H або 2 CH3; R – феніл, заміщений у положенні 3 першим замісником, вибраним із групи, яку складають галогени та трифторметил, та додатково заміщений в положенні 4 другим замісником, яким є 5 галоген; R – H; Z1 – CH, та Z2 – N. Особлива перевага віддається тим сполукам формули I, в яких Y – CH, Z1 – CH, та Z2 – N. Найбільша перевага віддається наведеній нижче сполуці, 4-{4-[4-(3-(трифторметил)феніл)1H-імідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину: H N N N N N HN N CF3 , 35 або фармацевтично прийнятній солі цієї сполуки. Крім того, найбільша перевага віддається сполуці – 4-{4-[4-(4-фтор-3-трифторметилфеніл)1-метил-1H-імідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину: H3C N N N N N HN N 40 F CF3 , або фармацевтично прийнятній солі цієї сполуки. 5 UA 99284 C2 5 10 15 20 Сполуки формули I є інгібіторами p70 S6-кінази, і тому корисні при лікуванні хвороб та розладів обміну речовин, наприклад, ожиріння, діабету, метаболічного синдрому, резистентності до інсуліну, гіперглікемії, гіпераміноацидемії та гіперліпідемії, та проліферативних розладів, особливо мультиформної гліобластоми, раку кишечнику, печінковоклітинного раку, раку легенів, раку грудної залози, раку яєчника та раку нирки у ссавців. Крім того, виявлено, що сигнальний шлях р70 S6-кінази активується у клітинах доброякісних пухлин, наприклад, у клітинах, пов’язаних із лімфангіолейоміоматозом (LAM). Дивись Journal of Bological Chemistry, 277:34, 30958-30967 (2002), та Modern Pathology 19, 839-846 (2006). Таким чином, інгібітори p70 S6-кінази можуть бути корисними також при лікуванні LAM. Інгібітори p70 S6кінази є також корисними інгібіторами ангіогенезу у ссавців. Серед ссавців, які підлягають лікуванню, перевага віддається людині. Сполуки формули I можуть бути одержані фахівцем у галузі за відомими методиками та способами. Більш конкретно, сполуки формули I можуть бути одержані як показано на поданих нижче схемах та описано нижче у способах та прикладах. Фахівцю в галузі буде зрозуміло, що для одержання сполук формули I окремі стадії на наведених нижче схемах можна варіювати. Реагенти та вихідні матеріали є легкодоступними для фахівця в галузі. Усі замісники, якщо не зазначено інше, відповідають наведеним вище визначенням. У поданих нижче схемах деякі замісники для ясності не вказано, і ця обставина жодним чином не обмежує інформацію, представлену на схемах. 1 2 Сполуки формули I можна одержати, як показано на представленій нижче схемі, де R , R , 4 5 R , R , Z1, Z2 та Y відповідають наведеним вище визначенням, та L – прийнятна відщеплювана група, наприклад, галоген. Схема 1 2 5 R R 5 R 2 R 1 R L 1 R Z1 N Z2 N + N N Y 4 R Y N 4 R N Z1 N N (a) N N Z2 (b) N I 25 30 35 40 45 N H Заміщений піразолопіримідин (або пурин чи піролопіримідин) – сполуку формули (a) – вводять в реакцію із заміщеним піперазином або піперидином формули (b), і одержують сполуки формули I. Наприклад, розчин сполуки формули (a), піперазин (b) та прийнятну основу, наприклад, триетиламін, діізопропілетиламін або N-метилморфолін, у прийнятному розчиннику, наприклад, пропанолі або ізопропіловому спирті, нагрівають до приблизно 70-100C, і одержують сполуки формули I, які потім можна розділити та, в разі необхідності або за бажанням, очистити із застосуванням способів, добре відомих в галузі, наприклад, хроматографії. Сполуки формули (a) є наявними на ринку або можуть бути синтезовані способами, 3 відомими фахівцям. Наприклад, сполуки формули (a), де Z 1 – CR та Z2 – N, можна одержати з алопуринолу шляхом введення в реакцію з хлорувальним реагентом, наприклад, фосфорилхлоридом, та нагрівання до приблизно 80-90C. Потім сполуки формули (a) можуть бути за бажанням піддані заміщенню в умовах, добре відомих в галузі. Наприклад, сполуку 3 формули (a), де Z1 або Z2 – CR , фторують дією прийнятного фторувального реагента, такого як [1-(хлорметил)-4-фтор-1,4-діазоніабіцикло[2,2,2]октанбіс-(тетрафторборат)] у прийнятному розчиннику або суміші прийнятних розчинників, таких як ацетонітрил та оцтова кислота. Крім 3 того, сполуки формули (a), де R – алкіл або циклоалкіл, синтезують за способами, відомими у галузі. Наприклад, дихлорпіримідин вводять в реакцію з циклопропанкарбальдегідом у присутності сильної основи, такої як LDA, у розчиннику, такому як THF, при зниженій 6 UA 99284 C2 5 10 температурі, та одержують потрібний спирт. Після окиснювання у присутності оксиду хрому (VI) при 0C у прийнятному розчиннику, такому як ацетон, одержують необхідний кетон, який потім вводять у реакцію з гідразингідратом у прийнятному розчиннику, такому як THF, при кімнатній температурі, і одержують циклоалкіл-заміщене похідне піразолопіримідину формули (a). Крім 3 того, фахівцям в галузі відомі способи одержання сполук, де R – алкініл. Наприклад, після хлорування сполуки формули (a) дією триметилсилілацетилену у триетиламіні та прийнятному розчиннику, такому як DMF та/або THF, із застосуванням тетракіс(трифенілфосфін)паладію(0) (Pd(Ph3P)4) як каталізатора, одержують етинілзаміщену сполуку формули (a). Необхідні піперидинові/піперазинові сполуки (b) можна одержати, як показано на 1 2 4 5 нижченаведеній схемі, де R , R , R , R та Y відповідають наведеним вище визначенням, та PG – прийнятна група захисту. Схема 2 2 R 2 R NH2 O NBoc H N O R R (c) R O 1 (d) HN 5 2 R 5 5 R R NH2 R 5 2 N N Y N Y NH 4 R N H (b1) Y N PG N PG (e) (f) 2 R 2 2 R R Br O N N (m) 2 R N N H (n) N PG N PG HO N boc (o) (p) 15 20 25 30 35 Амін (c) вводять в реакцію із захищеним піперидином у присутності прийнятних сполучних реагентів, таких як ізобутилхлорформіат, гідрохлорид 1-етил-3-[3диметиламінопропіл]карбодііміду (EDC) або циклічний ангідрид 1-пропанфосфонієвої кислоти (PPA), та прийнятної основи, такої як N-метилморфолін або триетиламін, у прийнятному розчиннику, такому як THF, дихлорметан або N,N-диметилформамід (DMF), при знижених температурах для одержання амідної сполуки формули (d). Подальший продукт – 6 імідазолпіперидин (b1), де Y – CR , одержують введенням в реакцію сполуки (d) з ацетатом 5 амонію або хлоридом амонію у герметичному реакторі, або для сполуки, де R – H, шляхом нагрівання у мікрохвильовому реакторі під тиском. Альтернативно, сполуки формули (b1) можна одержати шляхом введення в реакцію амідину (e) з прийнятним галогенкетоном у прийнятному розчиннику, такому як DMF або ацетон, у присутності основи, такої як карбонат калію або карбонат натрію, з подальшим відщепленням групи захисту в умовах, добре відомих фахівцю в галузі. Гідроксипіперидини формули (b1) можна також синтезувати шляхом введення в реакцію фенацилброміду формули (m) із формамідом при нагріванні. Потім імідазол (n) додають до прийнятного розчинника, такого як THF, охолоджують, та обробляють реагентом для введення групи захисту азоту, такого як 2,2-(триметилсиліл)етоксиметилхлорид, у присутності гідриду натрію, дозволяючи при цьому реакційній суміші нагрітися до кімнатної температури, і одержують проміжний продукт формули (o). Одержаний захищений імідазол потім може бути підданий обробленню металувальним реагентом, таким як н-бутиллітій, у інертному розчиннику, такому як THF, при знижених температурах та в інертній атмосфері. Цю суміш обробляють відповідно заміщеним піперидиноном, та дозволяють нагрітися до кімнатної температури протягом приблизно 1 год, одержуючи сполуки типу (p). Після обробки проміжного продукту (p) 7 UA 99284 C2 водним розчином кислоти, таким як 1-н. розчин HCl, при підвищенних температурах одержують сполуку (b1). Необхідні амідини можуть бути синтезовані як показано на схемі 3, де PG – прийнятна група захисту: 5 Схема 3 N OH N N PG O NH ClH (j) 20 25 30 35 40 NH2 N PG (e) H2N NH ClH N PG 15 HN N PG (h) (g) 10 NH2 ClH N PG (e1) Амідин (e) легко одержати з нітрилів. Більш конкретно, гідрохлорид гідроксиламіну розчиняють у прийнятному розчиннику, такому як вода, вводять в реакцію з ціанопіперидином (g) у присутності основи, такої як карбонат натрію, у прийнятному розчиннику, такому як метанол, та нагрівають, одержучи гідроксикарбамімідоїлпіперидин (h). Потім одержаний гідроксикарбамімідоїлпіперидин (h) у прийнятному розчиннику, такому як оцтова кислота, гідрують за допомогою паладієвого каталізатора у присутності ангідриду оцтової кислоти під тиском, і одержують амідин (e). За альтернативним варіантом карбоксимідну кислоту (j) одержують шляхом розчинення ціанопіперидину (g) у прийнятному розчиннику, такому як метанол, та охолодження, з подальшим введенням в реакцію з газоподібним хлоридом водню. Потім одержують амідин шляхом оброблення карбоксимідної кислоти (j) аміаком у метанолі, після чого насичують суміш газоподібним аміаком. Для фахівця в галузі зрозуміло, що не всі замісники в сполуках формули I є стабільними у певних умовах реакцій, які застосовуються для синтезу цих сполук. Такі групи можна в разі необхідності або за бажанням вводити у зручний момент у процесі синтезу або захищати з подальшим відщепленням груп захисту. Для фахівця в галузі зрозуміло, що у процесі синтезу сполук за цим винаходом групи захисту можуть бути видалені у будь-який зручний момент. Способи введення та видалення груп захисту азоту та кисню добре відомі в галузі; дивись, rd наприклад, Гріні та Вутс (Greene and Wuts, Protective Groups in Organic Synthesis, 3 Ed., John Wiley and Sons, New York, Chapter 7 (1999)). Крім того, для фахівця в галузі зрозуміло, що у багатьох випадках послідовність введення груп не має вирішального значення. Конкретний порядок стадій, необхідних для одержання сполуки формули I, може залежати від конкретної сполуки, яку слід синтезувати, вихідних реагентів та відносної лабільності груп-замісників. Абревіатури, символи та терміни, вжиті в описах прикладів та випробувань, мають такі значення: BuOH – бутанол, DCM – дихлорметан, DMF – N,N-диметилформамід, EtOAc – етилацетат, EtOH – етанол, MeOH – метанол, Pd(OH)2/C – гідроксид паладію на вугіллі (каталізатор Пірлмана), год – година(и), LDA – діізопропіламід літію, EDCI – гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду, Et2O – діетиловий простий ефір, Et3N (або TEA) – триетиламін, NaBH(OAc)3 – триацетоксиборгідрид натрію, TBAF – тетрабутиламонійфторид, Tf2O – трифторметансульфоновий ангідрид, THF – тетрагідрофуран. Підготовчий синтез 1 2-бром-1-(2-фтор-5-трифторметилфеніл)пропан-1-он 8 UA 99284 C2 F F F Br F 5 10 O Повільно додають розчин брому (3,34 г, 0,95 екв.) у дихлорметані (80,00 мл) до розчину 2фтор-5-(трифторметил)пропіофенону (5 г, 22,03 ммоль) у дихлорметані (80 мл) при перемішуванні так, щоб коричневий колір брому одразу ж зникав. Промивають реакційну суміш насиченим NaHCO3, сушать над Na2SO4 та концентрують, і одержують 6,22 г неочищеного матеріалу. MS(ES): m/z = 301,2 [M+2H]. Сполуки Підготовчих синтезів 2-5-D можна одержати практично як описано у Підготовчому синтезі 1. Підготовчий синтез 2 3 4 5 5-A 5-B 5-C 5-D 15 20 25 Сполука 2-бром-1-(4-фтор-3-трифторметилфеніл)пропан-1-он 2-бром-1-(2-хлор-5-трифторметилфеніл)етанон 2-бром-1-(3-фтор-5-трифторметилфеніл)етанон 2-бром-1-(2-фтор-5-трифторметилфеніл)етанон 2-бром-1-(4-трифторметилфеніл)пропан-1-он 2-бром-1-(3-трифторметилфеніл)пропан-1-он 2-бром-1-(3-хлор-4-фторфеніл)пропан-1-он 2-бром-1-(3-фторфеніл)пропан-1-он MS(ES): m/z [M+2H] 301,2 285,2 287,2 287,2 281 281,2 265,2 231,2 Підготовчий синтез 6 Гідрохлорид 2-аміно-1-(3-(трифторметил)феніл)етанону Додають 3-(трифторметил)фенацилбромід (10 г, 37,4 ммоль) до розчину гексаметилентетраміну (HMTA) (5,80 г, 41,3 ммоль) у тетрахлориді вуглецю (100 мл). Перемішують при кімнатній температурі протягом ночі. Відфільтровують одержаний осад, та суспендують осад на фільтрі у етанолі (200 мл). Розводять одержану суміш концентрованою хлористоводневою кислотою (28 мл), та перемішують суміш при кімнатній температурі протягом ночі. Відфільтровують одержаний осад, концентрують фільтрат у вакуумі, та одержують злегка забарвлену тверду речовину. Перекристалізовують тверді речовини з гарячого 1% розчину концентрованої хлористоводневої кислоти у 2-пропанолі, не охолоджуючи суміш нижче кімнатної температури, і одержують гідрохлорид 2-аміно-1-(3-(трифторметил)феніл)етанону (7,67 г, 86%). MS(APCI): m/z = 204 [M + H]. Сполуки Підготовчих синтезів 7-16 можна одержати практично як описано у Підготовчому синтезі 6. Підготовчий синтез Сполука Фізичні дані 7 гідрохлорид 2-аміно-1-(4(трифторметил)феніл)етанону 8 гідрохлорид 2-аміно-1-фенілетанону (одержаний шляхом розтирання з гарячим пропанолом) 9 гідрохлорид 2-аміно-1-(4хлорфеніл)етанону 10 гідрохлорид 2-аміно-1-(4-фтор-3(трифторметил)феніл)етан-ону MS (APCI): m/z=204 [M+H] 9 H ЯМР (500 МГц, DMSO-d6) 8,80-8,10 (br s, 3H), 8,02 (dd, J=1,0 Гц, 8,5 Гц, 2H), 7,75-7,72 (m, 1H), 7,61-7,58 (m, 2H), 4,59 (s, 2H) 1 H ЯМР (DMSO-d6) 8,05-8,02 (m, 2H), 7,69-7,66 (m, 2H), 4,59 (s, 2H) 1 H ЯМР (DMSO-d6) 8,44-8,35 (m, 2H), 7,98-7,80 (m, 1H), 5,11-4,90 (m, 2H), 4,73-4,68 (m, 2H) 1 UA 99284 C2 Підготовчий синтез Сполука Фізичні дані 11 гідрохлорид 2-аміно-1-(3-фтор-4(трифторметил)феніл)етан-ону 12 гідрохлорид 2-аміно-1-(3-фтор-5трифторметилфеніл)етанону 13 14 гідрохлорид 2-аміно-1-(2-хлор-5трифторметилфеніл)етанону гідрохлорид 2-аміно-1-(2-фтор-5трифторметилфеніл)етанону H ЯМР (DMSO-d6) 8,55-8,40 (br s, 2H), 8,15 (d, J=18 Гц, 2H), 7,98-7,80 (m, 1H), 5,11-4,90 (m, 2H), 4,73-4,68 (m, 2H) 1 H ЯМР (DMSO-d6, 400 МГц) 3,93 (2H, s), 7,41(1H, d, J=8,8 Гц), 8,10 (1H, s), 8,16 (1H, s), 8,18 (3H, s) MS(ES): m/z=238,2 [M+H] 1 MS(ES): m/z=222,2 [M+H] H ЯМР (DMSO-d6, 400 МГц) 4,62 (2H, s), 7,81-7,77 (1H, m), 8,18 (1H, d, J=7,6 Гц), 8,28 (1H, d, J=8,4 Гц), 8,50 (1H, s), 8,56 (3H, s) 1 H ЯМР (DMSO-d6, 400 МГц) 4,62 (2H, s), 8,06 (2H, d, J=8,4 Гц), 8,16 (2H, d, J=8,4 Гц), 8,54 (3H, s) 1 15 16 5 10 15 20 25 гідрохлорид 3-(2-аміноацетил)бензонітрилу гідрохлорид 4-(2-аміноацетил)бензонітрилу Підготовчий синтез 17 2-аміно-1-(3-(трифторметокси)феніл)етанон Додають азид натрію (583 мг, 8,96 ммоль) до розчину 3-(трифторметокси)фенацилброміду (2,17 г, 7,66 ммоль) у метанолі (20 мл). Перемішують при кімнатній температурі протягом 2 год. Концентрують суміш у вакуумі. Розчиняють залишок у EtOAc (20 мл), та промивають водою (10 мл). Сушать органічний шар (Na2SO4), фільтрують, концентрують фільтрат у вакуумі, та 1 одержують 2-азидо-1-(3-(трифторметокси)феніл)етанон (1,70 г, 91%). H-ЯМР (CDCl3): 7,83 (m, 1H), 7,77 (s, 1H), 7,56 (m, 1H), 7,49 (m, 1H), 4,55 (s, 2H). Додають паладій на вугіллі (720 мг, 10% Pd/C, 50% (мас.) у воді) при продуванні азотом до розчину 2-азидо-1-(3-(трифторметокси)феніл)етанону (1,70 г, 6,93 ммоль) у етанолі (15 мл). Продувають колбу воднем (з еластичної камери). Перемішують при кімнатній температурі протягом ночі. Фільтрують суміш через целіт, ополіскують целіт етанолом (330 мл), концентрують фільтрат у вакуумі, та одержують неочищений 2-аміно-1-(3-(трифторметокси)1 феніл)етанон (1,56 г, 88%). H ЯМР (DMSO-d6) 8,56 (br s, 2H), 8,07 (m, 1H), 7,95 (s, 1H), 7,76 (m, 2H), 4,63 (s, 2H). Підготовчий синтез 18 Толуол-4-сульфонат 2-аміно-1-(4-фтор-3-трифторметилфеніл)пропан-1-ону Додають азид натрію (640,94 мг; 1,05 екв.; 9,76 ммоль) однією порцією до розчину 2-бром-1(4-фтор-3-трифторметилфеніл)пропан-1-ону (2,78 г; 1,00 екв.; 9,30 ммоль) у тетрагідрофурані (15 мл). Перемішують одержану суміш при кімнатній температурі протягом ночі. Відфільтровують тверді речовини, та промивають THF. Додають неочищений азид (1,00 екв.; 9,30 ммоль; 2,43 г) до розчину трифенілфосфіну (1,06 екв.; 9,86 ммоль; 2,61 г) та птолуолсульфонової кислоти (2,2 екв.; 20,47 ммоль; 3,56 г) у тетрагідрофурані (15 мл) при 20C. Перемішують суміш протягом ночі. Відфільтровують одержану тверду речовину, після чого промивають її THF, одержуючи 920 мг (24%) вказаної в заголовку сполуки. MS(ES): m/z=236,2 [M+H]. Сполуки Підготовчих синтезів 18A-18-D можна одержати практично як описано у Підготовчому синтезі 18. 30 10 UA 99284 C2 Підготовчий синтез MS(ES): m/z [M+H] Сполука толуол-4-сульфонат 2-аміно-1-(4-трифторметил-феніл)пропан-1ону толуол-4-сульфонат 2-аміно-1-(3-трифторметил-феніл)пропан-1ону толуол-4-сульфонат 2-аміно-1-(3-хлор-4-фторфеніл)-пропан-1-ону толуол-4-сульфонат 2-аміно-1-(3-фторфеніл)пропан-1-ону 18-A 18-B 18-C 18-D 217,2 217 210 167 Підготовчий синтез 19 Трет-бутил-4-(2-оксо-2-(3-(трифторметил)феніл)етилкарбамоїл)піперидин-1-карбоксилат 5 CF3 NBoc H N O O 10 15 20 Додають N-метилморфолін (13,0 мл, 118 ммоль) до розчину 1-(третбутоксикарбоніл)піперидин-4-карбонової кислоти (11,2 г, 48,8 ммоль) у THF (400 мл) при -10C, та перемішують протягом 5 хв. Додають ізобутилхлорформіат (5,1 мл, 38,8 ммоль) та продовжують перемішування при -10C протягом 2 год. Додають гідрохлорид 2-аміно-1-(3(трифторметил)-феніл)етанону (9,35 г, 39,0 ммоль), та продовжують перемішування протягом 1 год. Додають до суміші дихлорметан (500 мл), та фільтрують. Промивають фільтрат насиченим водним розчином бікарбонату натрію (400 мл), та концентрують у вакуумі. Очищають залишок хроматографією на силікагелі (колонка RediSep 330 г, елюювання сумішшю етилацетат:гексан, градієнт від 0% до 100%, 6,0 л), і одержують трет-бутил-4-(2-оксо-2-(3(трифторметил)-феніл)етилкарбамоїл)піперидин-1-карбоксилат (9,72 г, 60%). + MS (APCI): m/z=315 [M- C5H8O2+H] . Сполуки Підготовчих синтезів 20-25 можна одержати практично як описано у Підготовчому синтезі 19. Підготовчий синтез 20 21 22 23 24 25 25 30 Сполука трет-бутил-4-(2-оксо-2-(4-(трифторметил)феніл)етилкарбамоїл)піперидин-1-карбоксилат трет-бутил-4-(2-оксо-2-фенілетилкарбамоїл)-піперидин-1карбоксилат трет-бутил-4-(2-(4-хлорфеніл)-2оксоетилкарбамоїл)піперидин-1-карбоксилат трет-бутил-4-(2-(2,4-дихлорфеніл)-2оксоетилкарбамоїл)піперидин-1-карбоксилат трет-бутил-4-(2-(4-фтор-3-(трифторметил)-феніл)-2оксоетилкарбамоїл)піперидин-1-карбоксилат трет-бутил-4-(2-(3-фтор-4-(трифторметил)-феніл)-2оксоетилкарбамоїл)піперидин-1-карбоксилат Фізичні дані MS(APCI) m/z=315 [M-C5H8O2 + +H] m/z=247 [M-C5H8O2 + +H] m/z=280 [M-C5H8O2 + +H] m/z=315 [M-C5H8O2 + +H] m/z=433 [M+H] m/z=433 [M+H] Підготовчий синтез 26 Трет-бутил-4-(2-оксо-2-(3-трифторметокси)феніл)етилкарбамоїл)піперидин-1-карбоксилат Додають триетиламін (1,1 мл, 7,89 ммоль) та гідрохлорид 1-(3-диметил-амінопропіл)-3етилкарбодііміду (EDC) (1,51 г, 7,87 ммоль) до розчину 2-аміно-1-(3(трифторметокси)феніл)етанону (1,56 г, 6,10 ммоль) та 1-(трет-бутоксикарбоніл)піперидин-4карбонової кислоти (1,66 г, 7,24 ммоль) у CH2Cl2 (15 мл) при 0C. Перемішують при 0C протягом 3 год, після чого при кімнатній температурі протягом ночі. Концентрують суміш у вакуумі. Очищають залишок хроматографією на силікагелі (80 г SiO2, елюювання сумішшю 50% етилацетат/гексан, 1 л), і одержують трет-бутил-4-(2-оксо-2-(3(трифторметокси)феніл)етилкарбамоїл)піперидин-1-карбоксилат (1,50 г, 57%). 11 UA 99284 C2 + 5 10 15 MS (APCI): m/z=331 [M – C5H8O2+H] . Підготовчий синтез 27 Трет-бутиловий складний ефір 4-[2-(4-фтор-3-трифторметилфеніл)-1-метил-2оксоетилкарбамоїл]піперидин-1-карбонової кислоти Додають диметилформамід (20 мл) до суміші толуол-4-сульфонату 2-аміно-1-(4-фтор-3трифторметилфеніл)пропан-1-ону (900 мг; 1,00 екв.; 2,21 ммоль) та 1-Boc-піперидин-4карбонової кислоти (Boc-Inp-OH) (613,96 мг, 1,20 екв.; 2,65 ммоль) при кімнатній температурі. Додають до вищезгаданого розчину N-метилморфолін (6,00 екв.; 13,26 ммоль; 1,46 мл), після чого циклічний ангідрид 1-пропанфосфонієвої кислоти (1,50 екв.; 3,31 ммоль; 862,14 мкл) при 0C. Нагрівають суміш до кімнатної температури при перемішуванні протягом 1 год. Розводять суміш EtOAc, промивають водою, 1 M розчином лимонної кислоти, водою, насиченим розчином NaHCO3 та насиченим водним розчином хлориду натрію, та сушать над Na 2SO4. Очищають залишок шляхом розчинення у CH2Cl2, завантажують у колонку із силікагелем, та елююють EtOAc, одержуючи 500 мг (51%) вказаної в заголовку сполуки. MS(ES): m/z=445,2 [M - H]. Сполуки Підготовчих синтезів 28-32 можна одержати практично як описано у Підготовчому синтезі 27. Підготовчий синтез 28 29 30 31 32 32-A 32-B 32-C 32-D 20 25 30 35 Сполука трет-бутиловий складний ефір 4-[2-(4-ціанофеніл)-2оксоетилкарбамоїл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[2-(3-ціанофеніл)-2оксоетилкарбамоїл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[2-(2-хлор-5-трифторметил-феніл)2-оксоетилкарбамоїл]-піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[2-(3-фтор-5-трифторметилфеніл)2-оксоетилкарбамоїл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[2-(2-фтор-5-трифторметилфеніл)-2-оксоетилкарбамоїл]-піперидин-1-карбонової кислоти трет-бутил-4-(1-оксо-1-(4-(трифторметил)феніл)-пропан-2ілкарбамоїл]піперидин-1-карбоксилат трет-бутил-4-(1-оксо-1-(3-(трифторметил)феніл)-пропан-2ілкарбамоїл]піперидин-1-карбоксилат трет-бутил-4-(1-оксо-1-(3-хлор-4-фторфеніл)пропан-2ілкарбамоїл]піперидин-1-карбоксилат трет-бутил-4-(1-оксо-1-(3-фторфеніл)пропан-2ілкарбамоїл]піперидин-1-карбоксилат MS(ES) m/z=372 + [M +H] m/z=372 + [M +H] m/z=449 + [M +H] m/z=433 + [M +H] m/z=433 + [M +H] m/z=428,2 + [M +H] m/z=428 + [M +H] m/z=412 + [M +H] m/z=378 + [M +H] Підготовчий синтез 33 4-(4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин Нагрівають у мікрохвильовому реакторі CEM Discover суміш трет-бутил-4-(2-оксо-2-(3(трифторметил)феніл)етилкарбамоїл)піперидин-1-карбоксилату (2,5 г, 6,09 ммоль) та NH4Cl (1,68 г, 31,4 ммоль) у етанолі (20 мл) при 300 Вт, 120C та 200 фунтів на кв. дюйм (1,38 МПа) протягом 16 год. Охолоджують суміш до кімнатної температури. Повторюють процедуру з другою порцією трет-бутил-4-(2-оксо-2-(3-(трифторметил)феніл)-етилкарбамоїл)піперидин-1карбоксилату (2,35 г, 5,67 ммоль) та NH4Cl (1,8 г, 33,6 ммоль) у етанолі (20 мл) із застосуванням тієї самої послідовності мікрохвильової обробки та нагрівання. Охолоджують суміш до кімнатної температури. Повторюють вищеописану процедуру з третьою порцією трет-бутил-4-(2-оксо-2-(3(трифторметил)феніл)етилкарбамоїл)піперидин-1-карбоксилату (2,0 г, 4,82 ммоль) та NH4Cl (1,34 мг, 25,0 ммоль) у етанолі (15 мл) при 300 Вт, 160C та 200 фунтів на кв. дюйм (1,38 МПа) протягом 12 год у мікрохвильовому реакторі. Охолоджують суміш до кімнатної температури. Об’єднують порції, адсорбують на силікагель, та концентрують у вакуумі. Очищають залишок хроматографією на силікагелі (колонка RediSep, 120 г, елюювання сумішшю CMA:дихлорметан, градієнт від 0% до 100%, 3 л), та одержують 4-(4-(3-(трифторметил)феніл)-1H-імідазол-2іл)піперидин (3,40 г, 75%). MS (APCI): m/z=296 [M+H]. Сполуки Підготовчих синтезів 34-35 можна одержати практично як описано у Підготовчому синтезі 33. 40 12 UA 99284 C2 Підготовчий синтез Сполука Фізичні дані 34 35 5 10 15 4-(4-(4-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин 4-(4-(2,4-дихлорфеніл)-1H-імідазол-2-іл)-піперидин Підготовчий синтез 36 Гідрохлорид 4-(4-феніл-1H-імідазол-2-іл)піперидину Нагрівають у мікрохвильовому реакторі Personal Chemistry суміш трет-бутил-4-(2-оксо-2фенілетилкарбамоїл)піперидин-1-карбоксилату (1,0 г, 2,88 ммоль) та NH4Cl (0,462 г, 8,65 ммоль) у етанолі (12 мл) при 300 Вт, 160C та 14 бар (1,4 МПа) протягом 11 год. Охолоджують суміш до кімнатної температури, додають силікагель (5 мл), та концентрують суміш у вакуумі. Очищають залишок хроматографією на силікагелі (80 г колонка RediSep, елююювання сумішшю CMA/дихлорметан, градієнт від 0% до 100% протягом 60 хв, 60 мл/хв), та одержують 4-(4-феніл1H-імідазол-2-іл)піперидин (0,418 г, 64%) у вигляді злегка забарвленої твердої речовини. Додають 4-(4-феніл-1H-імідазол-2-іл)піперидин (0,060 г, 0,26 ммоль) до дихлорметану (15 мл) та концентрованої хлористоводневої кислоти (28 мкл). Перемішують суміш протягом 45 хв, після чого концентрують суміш у вакуумі, та одержують гідрохлорид 4-(4-феніл-1H-імідазол-2іл)піперидину (0,070 г, 99%). MS (APCI): m/z=228 [M+H]. Сполуку Підготовчого синтезу 37 можна одержати практично як описано у Підготовчому синтезі 36. Підготовчий синтез 37 20 25 30 35 40 45 50 MS (APCI): m/z=296 [M+H] MS (ES): m/z=296 [M+H] Сполука гідрохлорид 4-(4-(4-хлорфеніл)-1H-імідазол-2іл)піперидину Фізичні дані MS (APCI): m/z=262 [M+H] Підготовчий синтез 38 Гідрохлорид 4-(4-(4-фтор-3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидину Нагрівають у мікрохвильовому реакторі Personal Chemistry суміш трет-бутил-4-(2-оксо-2-(4(трифторметил)феніл)етилкарбамоїл)піперидин-1-карбоксилату (1,7 г, 3,92 ммоль) та NH4Cl (0,579 г, 10,8 ммоль) у етанолі (17 мл) при 300 Вт, 120C та 14 бар (1,4 Па) протягом 12 год. Охолоджують суміш до кімнатної температури, та додають силікагель (20 г). Очищають залишок хроматографією на силікагелі (колонка RediSep, 330 г, елюювання сумішшю CMA/дихлорметан, градієнт від 0% до 100% протягом 30 хв та витримка при 100% CMA ще 30 хв, 100 мл/хв), і одержують 4-(4-(4-фтор-3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин (600 мг, 51%). MS (APCI): m/z=314 [M+H]. Суспендують 4-(4-(4-фтор-3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин (250 мг, 0,80 ммоль) у метанолі (20 мл), та додають хлороводень (2 M розчин у діетиловому ефірі, 0,798 мл, 0,80 ммоль). Перемішують при кімнатній температурі протягом 30 хв. Концентрують суміш у вакуумі, й додають воду (15 мл) та ацетонітрил (5 мл). Піддають суміш сублімаційному сушінню, одержуючи злегка забарвлену тверду речовину. Сушать цю тверду речовину у вакуумі при 100C протягом 2 год, одержуючи гідрохлорид 4-(4-(4-фтор-3-(трифторметил)феніл)-1Hімідазол-2-іл)піперидину у вигляді злегка забарвленої твердої речовини (220 мг, 79%). MS (APCI): m/z=314 [M+H]. Підготовчий синтез 39 Гідрохлорид 4-(4-(3-фтор-4-(трифторметил)феніл)-1H-імідазол-2-іл)піперидину Нагрівають у мікрохвильовому реакторі CEM Discover суміш трет-бутил 4-(2-(3-фтор-4(трифторметил)феніл)-2-оксоетилкарбамоїл)піперидин-1-карбоксилату (517 мг, 1,19 ммоль) та NH4Cl (350 мг, 6,54 ммоль) у етанолі (2 мл) при 300 Вт, 120C та 200 фунт на кв. дюйм (1,38 МПа) на максимальній потужності протягом 12 год. Охолоджують суміш до кімнатної температури, та додають силікагель (~5 г). Очищають залишок хроматографією на силікагелі (колонка RediSep, 40 г, елюювання сумішшю CMA/дихлорметан, градієнт від 0% до 100% протягом 60 хв, 40 мл/хв), і одержують 4-(4-(4-фтор-3-(трифторметил)феніл)-1H-імідазол-2іл)піперидин (228 мг, 61%) у вигляді злегка забарвленої твердої речовини. MS (APCI): m/z=314 [M+H]. Розчиняють одержаний продукт (29 мг) у метанолі (2 мл), додають хлороводень (2 M розчин у діетиловому ефірі, 95 мкл), та перемішують при кімнатній температурі протягом 30 хв. 13 UA 99284 C2 5 10 15 20 25 30 35 40 45 50 55 60 Концентрують суміш у вакуумі, додають воду (10 мл), та піддають сублімаційному сушінню, одержуючи гідрохлорид 4-(4-(3-фтор-4-(трифторметил)феніл)-1H-імідазол-2-іл)піперидину (29 мг) у вигляді злегка забарвленої твердої речовини. MS (APCI): m/z=314 [M+H]. Підготовчий синтез 40 4-(4-(3-(трифторметокси)феніл)-1H-імідазол-2-іл)піперидин Додають трет-бутил-4-(2-оксо-2-(3-(трифторметокси)феніл)-етилкарбамоїл)піперидин-1карбоксилат (1,50 г, 3,48 ммоль) до суміші ацетату амонію (1,40 г, 18,1 ммоль) та льодяної оцтової кислоти (10 мл), та нагрівають зі зворотним холодильником протягом 15 год. Охолоджують суміш до кімнатної температури, та концентрують у вакуумі. Розчиняють залишок у етилацетаті (50 мл), та доводять до pH 8 насиченим NaHCO 3. Екстрагують водний шар етилацетатом (250 мл). Об’єднують органічні шари, сушать (Na 2SO4), фільтрують, та концентрують у вакуумі. Очищають залишок хроматографією на силікагелі (80 г, елюювання сумішшю метанол/етилацетат, градієнт від 10% до 20%, 1,5 л), і одержують 4-(4-(3(трифторметокси)феніл)-1H-імідазол-2-іл)піперидин (491 мг, 45%). MS (APCI): m/z=312 [M+H]. Підготовчий синтез 41 Трет-бутиловий складний ефір 4-(N-гідроксилкарбамімідоїл)-піперидин-1-карбонової кислоти Розчиняють гідрохлорид гідроксиламіну (1,65 г; 4,99 екв.; 23,74 ммоль) у воді (5 мл), та додають карбонат натрію (2,53 г; 23,87 ммоль). Завантажують трет-бутиловий складний ефір 4ціанопіперидин-1-карбонової кислоти (1 г; 1,00 екв.; 4,76 ммоль) (Astatech) у невелику пробірку, та розчиняють у метанолі (6 мл; 148,25 ммоль), після чого завантажують у колбу з гідроксиламіном. Нагрівають суміш до кипіння при перемішуванні та витримують протягом 3 год. Видаляють метанол випарюванням, та екстрагують водний шар етилацетатом (2Ч100 мл). Промивають об’єднані органічні шари водою (1100 мл), сушать над сульфатом магнію, фільтрують, та концентрують, одержуючи білу тверду речовину. Сушать під зниженим тиском, одержуючи 1,05 г (91%) вказаної в заголовку сполуки у вигляді білої твердої речовини. LCMS: m/z=188,2 [M-tBu, M+H]. Підготовчий синтез 42 Трет-бутиловий складний ефір 4-карбамімідоїлпіперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-(N-гідроксилкарбамімідоїл)піперидин-1карбонової кислоти (9,7 г 1,00 екв.; 39,9 ммоль) у метанолі (300 мл), та додають оцтову кислоту (2 екв., 79,73 ммоль; 4,6 мл) та промитий метанолом нікель Ренея (2,7 г). Нагрівають реакційну суміш до 50C, після чого гідрують газоподібним воднем під тиском 1 атм (0,1 МПа) протягом 4,5 год. Фільтрують реакційну суміш через целіт, та концентрують під зниженим тиском. Суспендують одержану тверду речовину у діетиловому ефірі, фільтрують, та сушать під зниженим тиском, одержуючи 10,39 г трет-бутилового складного ефіру 4карбамімідоїлпіперидин-1-карбонової кислоти. MS (ES): m/z=228 [M+H]. Підготовчий синтез 43 Оцтовокисла сіль трет-бутилового складного ефіру 4-карбамімідоїлпіперидин-1-карбонової кислоти Додають 10% Pd/C (0,079 г; 37,12 мкмоль) до трет-бутилового складного ефіру 4-(Nгідроксилкарбамімідоїл)піперидин-1-карбонової кислоти (805 мг; 1,00 екв.; 3,31 ммоль) у оцтовій кислоті (15 мл; 261,77 ммоль) та оцтовому ангідриді (0,5 мл; 5,29 ммоль). Гідрують при кімнатній температурі протягом 7 год при 20 фунт на кв. дюйм (137,9 кПа). Продувають колбу азотом, і одержують 1,2 г піни. Розтирають з ацетонітрилом, фільтрують, і одержують 270 мг (28%) продукту у вигляді білої твердої речовини. MS (ES): m/z=228,0 [M+H]. Підготовчий синтез 44 Трет-бутиловий складний ефір 4-[4-(3-хлорфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти Суспендують оцтовокислу сіль трет-бутилового складного ефіру 4-діамінометилпіперидин-1карбонової кислоти (685 мг; 1,00 екв.; 2,38 ммоль) у диметилформаміді (10 мл; 129,33 ммоль), та додають порошкоподібний карбонат калію (1400 мг; 10,13 ммоль). Перемішують 10 хв при кімнатній температурі, після чого додають до амідину краплями 2-бром-1-(3-хлор-феніл)етанон (1400 мг; 6,00 ммоль), розчинений у 4 мл DMF, при кімнатній температурі. Через 3 год розводять реакційну суміш етилацетатом, та промивають 50% водним розчином бікарбонату натрію. Сушать органічний шар над сульфатом натрію, фільтрують, та концентрують з одержанням неочищеного масла. Очищають із застосуванням ISCO хроматографії на колонці 14 UA 99284 C2 5 10 Biotage 40M, елююючи градієнтом від DCM до 6% MeOH/DCM. Концентрують відповідні фракції, одержуючи трет-бутиловий складний ефір 4-[4-(3-хлорфеніл)-1H-імідазол-2-іл]піперидин-1карбонової кислоти (вихід 20%). MS (ES): m/z=262,0 [M+H]. Розчиняють трет-бутиловий складний ефір 4-[4-(3-хлорфеніл)-1H-імідазол-2-іл]піперидин-1карбонової кислоти (171 мг; 472,54 мкмоль) у дихлорметані (3 мл; 46,80 ммоль), та повільно додають хлороводень (4 мл; 16,00 ммоль) (4M розчин HCl у діоксані) при кімнатній температурі. Перемішують розчин протягом 1 год. Концентрують у вакуумі (2DCM), одержуючи гідрохлорид 4-[4-(3-хлорфеніл)-1H-імідазол-2-іл]піперидину. MS (ES): m/z=262,0 [M+H]. Сполуки Підготовчих синтезів 45-47 можна одержати практично як описано у Підготовчому синтезі 44. Підготовчий синтез 45 46 47 47-A 15 20 25 30 35 40 45 50 Сполука гідрохлорид 4-[4-(2,4-дифторфеніл)-1H-імідазол-2іл]піперидину гідрохлорид 4-[4-(3-хлор-5-фторфеніл)-1H-імідазол-2іл]піперидину гідрохлорид 4-[4-(3-нітрофеніл)-1H-імідазол-2-іл]піперидину трет-бутил-4-(4-(3-бромфеніл)-1H-імідазол-2-іл)піперидин-1карбоксилат MS (ES): m/z=[M+H] 264,0 280,0 273,2 408,0 Підготовчий синтез 48 Додають 4-ціанопіперидин (7,19 г; 1,00 екв.; 65,269 ммоль); бензальдегід (1,05 екв.; 68,533 ммоль; 7,0 мл), після чого триацетоксиборгідрид натрію (1,3 екв., 84,85 ммоль; 18,73 г) до 2% (об’ємн.) розчину оцтової кислоти у тетрагідрофурані (435 мл), та інтенсивно перемішують до завершення реакції. Розводять етилацетатом, та промивають насиченим розчином бікарбонату натрію, насиченим водним розчином хлориду натрію, сушать MgSO 4, фільтрують, випарюють під зниженим тиском, одержуючи 13,0 г масла. Розчиняють у діетиловому ефірі (~300 мл), фільтрують, та повільно додають 60 мл 1 M розчину HCl у діетиловому ефірі. Охолоджують на льодяній бані. Фільтрують, ополіскують діетиловим ефіром, сушать у вакуумі, та одержують 13,616 г (57,51 ммоль, 88%) 1-бензилпіперидин-4-карбонітрилу. MS (ES): m/z=201 [M+H]. Підготовчий синтез 49 Гідрохлорид метилового складного ефіру 1-бензилпіперидин-4-карбоксимідової кислоти Розчиняють гідрохлорид 1-бензилпіперидин-4-карбонітрилу (1,00 екв.; 57,3 ммоль; 13,57 г) у 75 мл MeOH, та охолоджують на льодяній бані. Насичують газоподібним HCl протягом 25 хв, після чого відстороняють льодяну баню, та перемішують протягом 3 год. Випарюють під зниженим тиском, одержуючи 17,47 г (65,0 ммоль, 113%) гідрохлориду метилового складного ефіру 1-бензилпіперидин-4-карбоксимідової кислоти. MS (ES): m/z=233 [M+H]. Підготовчий синтез 50 Дигідрохлорид 1-бензилпіперидин-4-карбоксамідину Розчиняють гідрохлорид метилового складного ефіру 1-бензилпіперидин-4-карбоксимідової кислоти (17,47 г 1,00 екв.; 65 ммоль) у 2M розчині аміаку у метанолі (~350 мл). Насичують газоподібним амонієм протягом 15 хв. Перемішують протягом 18 год, та випарюють. Випарюють спільно з безводним метанолом. Сушать у високому вакуумі, одержуючи 18,29 г (63,03 ммоль, 97%) дигідрохлориду 1-бензилпіперидин-4-карбоксамідину у вигляді світло-жовтої твердої речовини. MS (ES): m/z=218 [M+H]. Підготовчий синтез 51 1-бензил-4-[5-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидин Розчиняють дигідрохлорид 1-бензилпіперидин-4-карбоксамідину (2 г; 1,00 екв.; 6,89 ммоль) у диметилформаміді (90 мл). Додають порошкоподібний карбонат калію (4 екв.; 27,56 ммоль; 3,8095 г), та нагрівають до ~45C. Додають краплями 3-хлор-4-фторфенацилбромід (2,00 екв.; 13,782 ммоль; 3,5366 г) у 8 мл DMF протягом 40 хв. Розводять етилацетатом (50 мл), перемішують 5 хв, та фільтрують. Випарюють, та розподіляють між етилацетатом та насиченим розчином бікарбонату натрію, промивають органічний шар водою, після чого насиченим водним розчином хлориду натрію. Сушать над MgSO 4, фільтрують, та випарюють, одержуючи червону піну. Очищають флеш-хроматографією на силікагелі, елююючи градієнтом 0-10% MeOH/ACN. 15 UA 99284 C2 5 Об’єднують фракції, одержуючи 1,9772 г (5,346 ммоль, 78%) 1-бензил-4-[5-(3-хлор-4фторфеніл)-1H-імідазол-2-іл]піперидину. MS (ES): m/z=370 [M+H]. Сполуки Підготовчих синтезів 52-53 можна одержати практично як описано у Підготовчому синтезі 51. Підготовчий синтез 52 53 10 15 20 55 56 30 MS (ES): m/z=[M+H] 1-бензил-4-[5-(3,4-дифторфеніл)-1H-імідазол-2-іл]піперидин 1-бензил-4-[4-(4-фторфеніл)-1H-імідазол-2-іл]піперидин 368 336,0 Підготовчий синтез 54 Дигідрохлорид 4-[5-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидину Розчиняють 1-бензил-4-[5-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]-піперидин (1,00 екв.; 1,595 ммоль; 590 мг), N,N,N',N'-тетраметил-1,8-нафталіндіамін (1 екв.; 1,595 ммоль; 341,8 мг) у 1,2-дихлоретані (12 мл), та охолоджують на льодяній бані. Додають 1-хлоретилхлорформіат (3 екв.; 4,785 ммоль; 517 мкл), та нагрівають зі зворотним холодильником протягом 1 год. Охолоджують до кімнатної температури та фільтрують через шар силікагелю товщиною 1 см, ополіскують DCM. Випарюють, та одержують 760 мг піни. Розчиняють у MeOH, та нагрівають зі зворотним холодильником протягом 6 год. Випарюють розчинник, та одержують 556,3 мг (99%) дигідрохлориду 4-[5-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидину у вигляді жовтої піни. MS (ES): m/z=280 [M+H]. Сполуки Підготовчих синтезів 55-56 можна одержати практично як описано у Підготовчому синтезі 54. Підготовчий синтез 25 Сполука Сполука дигідрохлорид 4-[5-(4-хлор-3-трифторметил-феніл)-1Hімідазол-2-іл]піперидину дигідрохлорид 4-[5-(3,4-дихлорфеніл)-1H-імідазол-2іл]піперидину 40 330 297 Підготовчий синтез 57 4-[4-(4-фторфеніл)-1H-імідазол-2-іл]піперидин Гідрують 1-бензил-4-[4-(4-фторфеніл)-1H-імідазол-2-іл]піперидин у 20% розчині Pd(OH)2/C (каталізатор Перлмана) (0,15 г) у 125 мл EtOH гатунку 2B, при 30C протягом 23 год під тиском 60 фунтів на кв. дюйм (413,7 кПа). Фільтрують та концентрують, одержуючи вказану в заголовку сполуку у вигляді масла. MS (ES): m/z=246,0 [M+H]. Сполуки Підготовчих синтезів 58-59 можна одержати практично як описано у Підготовчому синтезі 57. Підготовчий Сполука синтез 58 4-[4-(4-метокси-феніл)-1H-імідазол-2-іл]піперидин 4-[4-(3,4-дифторфеніл)-1H-імідазол-2-іл]піперидин 59 (NH4CO2) 35 MS (ES): m/z=[M+H] MS (ES): m/z=[M+H] 258,0 264,0 Підготовчий синтез 60 Трет-бутил-4-(4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-карбоксилат Додають 4-(4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин (795 мг, 2,69 ммоль) до суміші CH2Cl2 (25 мл) та THF (25 мл) у атмосфері азоту, після чого додають триетиламін (0,985 мл, 5,64 ммоль) та ди-трет-бутилдикарбонат (650 мг, 2,96 ммоль). Перемішують суміш при кімнатній температурі протягом ночі. Концентрують суміш у вакуумі, та очищають залишок хроматографією на силікагелі (колонка RediSep, 120 г, елюювання сумішшю етилацетат/гексан, градієнт від 0% до 100% протягом 35 хв, 85 мл/хв), і одержують трет-бутил-4-(4-(3(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-карбоксилат (550 мг, 51%) у вигляді злегка забарвленої твердої речовини. MS (APCI): m/z=396 [M+H]. 16 UA 99284 C2 Сполуку Підготовчого синтезу 61 можна одержати практично як описано у Підготовчому синтезі 60. Підготовчий синтез 10 15 Фізичні дані 61 5 Сполука трет-бутил-4-(4-(4-(трифторметил)феніл)-1H-імідазол-2іл)піперидин-1-карбоксилат MS (APCI): m/z=396 [M+H] Підготовчий синтез 62 Трет-бутил-4-(1-метил-4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-карбоксилат Додають трет-бутил-4-(4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-карбоксилат (540 мг, 1,36 ммоль) до діетилового ефіру (100 мл), та охолоджують до 0C. Додають до суміші гідрид натрію (55 мг, 1,5 ммоль, 60% у мінеральному маслі), після чого додають метилйодид (0,142 мл, 2,72 ммоль). Перемішують суміш протягом 1 год при 0C та підігрівають до кімнатної температури. Додають THF (40 мл), та перемішують суміш протягом 12 год. Концентрують суміш, та очищають залишок хроматографією на силікагелі (колонка RediSep, 120 г, елюювання сумішшю етилацетат:гексан, градієнт від 0% до 100% протягом 40 хв, 85 мл/хв), і одержують трет-бутил-4-(1-метил-4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-карбоксилат (425 мг, 76%). MS (APCI): m/z=410 [M+H]. Сполуку Підготовчого синтезу 63 можна одержати практично як описано у Підготовчому синтезі 62. Підготовчий синтез 63 63-A Сполука трет-бутил-4-(1-метил-4-(4-(трифторметил)феніл)-1Hімідазол-2-іл)піперидин-1-карбоксилат трет-бутил-4-(4-(3-бромфеніл)-1-метил-1H-імідазол-2іл)піперидин-1-карбоксилат Фізичні дані MS (APCI): m/z=410 [M+H] MS(ES):m/z=422(M +H) 20 25 Підготовчий синтез 64 Дигідрохлорид 4-(1-метил-4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидину Додають хлороводень (4 M розчин у 1,4-діоксані, 5 мл, 20 ммоль) до розчину трет-бутил-4(1-метил-4-(3-(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-карбоксилату (400 мг, 1,10 ммоль) у CH2Cl2 (10 мл) при 0C у атмосфері азоту, та перемішують протягом 2 год. Концентрують суміш у вакуумі, і одержують дигідрохлорид 4-(1-метил-4-(3(трифторметил)феніл)-1H-імідазол-2-іл)піперидину (435 мг, >99%). MS (APCI): m/z=310 [M+H]. Сполуку Підготовчого синтезу 65 можна одержати практично як описано у Підготовчому синтезі 64. 30 Підготовчий синтез 65 35 40 45 Сполука дигідрохлорид 4-(1-метил-4-(4-(трифторметил)-феніл)-1Hімідазол-2-іл)піперидину Фізичні дані MS (APCI): m/z=310 [M+H] Підготовчий синтез 66 Трет-бутиловий складний ефір 4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-карбонової кислоти Додають ацетат амонію (3,24 г, 41,63 ммоль) до розчину трет-бутил-4-(2-оксо-2-(4(трифторметил)феніл)етилкарбамоїл)піперидин-1-карбоксилату (600 мг, 1,00 екв.; 1,39 ммоль) у 1-бутанолі (7 мл), після чого додають триетиламін (1 екв.; 193,40 мкл). Перемішують суміш при 160C у запаяній трубці протягом 2 год. Видаляють розчинник у вакуумі шляхом спільного випарювання з толуолом та CH2Cl2. Повторно розчиняють неочищений залишок у EtOAc, промивають водою, сушать над Na2SO4, та концентрують. Очищають залишок хроматографією на силікагелі, елююючи сумішшю EtOAc:гексан (6:4), та одержують 280 мг (вихід 49%) вказаної в заголовку сполуки. LCMS: MS(IS): m/z=314,2 [M+H]. Сполуки Підготовчих синтезів 67-73 можна одержати практично як описано у Підготовчому синтезі 66. 17 UA 99284 C2 Підготовчий синтез 67 68 69 70 71 72 73 73-A 73-B 73-C 73-D 5 10 15 20 25 Сполука трет-бутиловий складний ефір 4-[4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]-3-метил-піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-[4-(4-ціанофеніл)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[4-(4-фтор-3трифторметилфеніл)-5-метил-1H-імідазол-2-іл]піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-[4-(3-ціанофеніл)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[4-(2-хлор-5трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-[4-(3-фтор-5трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-[4-(2-фтор-5трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1карбонової кислоти трет-бутил-4-(5-метил-4-(4-(трифторметил)-феніл)-1Hімідазол-2-іл]піперидин-1-карбоксилат трет-бутил-4-(5-метил-4-(3-(трифторметил)-феніл)-1Hімідазол-2-іл]піперидин-1-карбоксилат трет-бутил-4-(5-метил-4-(3-хлор-4-фторфеніл)-1H-імідазол2-іл]піперидин-1-карбоксилат трет-бутил-4-(5-метил-4-(3-фторфеніл)-1H-імідазол-2іл]піперидин-1-карбоксилат Фізичні дані MS(IS): m/z=428,2 [M+H] MS (ES): m/z=353,2 [M+H] MS (ES): m/z=428,2 [M+H] MS (ES): m/z=353,2 [M+H] MS (ES): m/z=430,2 [M+H] MS (ES): m/z=414,2 [M+H] MS (ES): m/z=414,2 [M+H] MS(IS): m/z=409,2 [M+H] MS(IS): m/z=409,2 [M+H] MS(IS): m/z=393,2 [M+H] MS(IS): m/z=359,2 [M+H] Підготовчий синтез 74 Трет-бутиловий складний ефір 4-[4-(4-фтор-3-трифторметилфеніл)-1-метил-1H-імідазол-2іл]піперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол2-іл]піперидин-1-карбонової кислоти (860 мг, 2,08 ммоль) у діетиловому простому ефірі (100 мл) у атмосфері азоту. Охолоджують розчин до 0C на льодяній бані, та додають гідрид натрію (1,1 екв.; 2,29 ммоль; 91,52 мг), після чого вводять за допомогою шприца метилйодид (2,00 екв.; 4,16 ммоль; 259,12 мкл). Перемішують суміш протягом 1 год при 0C, після чого нагрівають до кімнатної температури. Вводять у вищезгадану суміш за допомогою шприца тетрагідрофуран (40 мл), після чого перемішують при кімнатній температурі протягом ночі. Концентрують суміш під зниженим тиском, а потім розчиняють залишок у EtOAc. Промивають насиченим водним розчином хлориду натрію. Очищають залишок хроматографією на силікагелі, елююють сумішшю EtOAc:гексан (7:3), та одержують 270 мг (вихід 30%) вказаної в заголовку сполуки. MS (IS): m/z=428,2 [M+H]. Підготовчий синтез 74-A Трет-бутил-4-(1,5-диметил-4-(4-(трифторметил)феніл)-1H-імідазол-2-іл]-піперидин-1карбоксилат Додають свіжоподрібнений порошкоподібний гідроксид калію (193,45 мг, 2,93 ммоль, 4 екв.) до розчину трет-бутил-4-(5-диметил-4-(4-(трифторметил)феніл)-1H-імідазол-2-іл]піперидин-1карбоксилату (300 мг, 0,73 ммоль) у диметилсульфоксиді (2 мл). Перемішують суміш при кімнатній температурі протягом 1 год, та додають однією порцією метилйодид (156 мг, 1,5 екв.). Після перемішування протягом 3 год розводять AcOEt, промивають насиченим водним розчином хлориду натрію, та сушать над Na2SO4. Очищають залишок хроматографією на силікагелі, елююючи сумішшю EtOAc:гексан (6:4), та одержують 210 мг (вихід 68%) вказаної в заголовку сполуки. MS (IS): m/z=423,2 [M+H]. Сполуки Підготовчих синтезів 74-B–74-F можна одержати практично як описано у Підготовчому синтезі 74-A. 18 UA 99284 C2 Підготовчий синтез 74-B 74-C 74-D 74-E 74-F 5 10 Сполука трет-бутил-4-(1,5-диметил-4-(3-(трифторметил)-феніл)-1Hімідазол-2-іл]піперидин-1-карбоксилат трет-бутил-4-(4-(3-хлор-4-(фторфеніл)-1,5-диметил-1Hімідазол-2-іл]піперидин-1-карбоксилат трет-бутил-4-(4-(3-фторфеніл)-1,5-диметил-1H-імідазол-2іл]піперидин-1-карбоксилат трет-бутил-4-(4-(3,4-дифторфеніл)-1-ізопропіл-1H-імідазол-2іл)піперидин-1-карбоксилат трет-бутил-4-(1-ізопропіл-4-(3-(трифторметил)-феніл)-1Hімідазол-2-іл)піперидин-1-карбоксилат MS (IS): m/z=[M+H] 423,2 407,2 373,2 Підготовчий синтез 75 Гідрохлорид 4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидину Додають хлороводень (2 мл, 12 M водний розчин) до розчину трет-бутилового складного ефіру 4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (275 мг; 665,19 мкмоль) у метанолі (10 мл). Перемішують суміш при кімнатній температурі протягом ночі, після чого концентрують, та сушать, одержуючи 210 мг (вихід 90%) вказаної в заголовку сполуки. MS (IS): m/z=314,2 [M+H]. Сполуки Підготовчих синтезів 76-83F можна одержати практично як описано у Підготовчому синтезі 75. Підготовчий синтез 76 77 78 79 80 81 82 83 83-A 83-B 83-C 83-D 83-E 83-F 83-G Сполука дигідрохлорид 4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол2-іл]-3-метил-піперидину гідрохлорид 4-[4-(4-фтор-3-трифторметилфеніл)-1-метил-1Hімідазол-2-іл]піперидину дигідрохлорид 4-[4-(4-фтор-3-трифторметилфеніл)-5-метил-1Hімідазол-2-іл]піперидину дигідрохлорид 4-(2-піперидин-4-іл-1H-імідазол-4іл)бензонітрилу дигідрохлорид 3-(2-піперидин-4-іл-1H-імідазол-4іл)бензонітрилу дигідрохлорид 4-[4-(2-хлор-5-трифторметилфеніл)-1H-імідазол2-іл]піперидину дигідрохлорид 4-[4-(3-фтор-5-трифторметил-феніл)-1Hімідазол-2-іл]піперидину дигідрохлорид 4-[4-(2-фтор-5-трифторметил-феніл)-1Hімідазол-2-іл]піперидину гідрохлорид 4-(1,5-диметил-4-(4-(трифторметил)-феніл)-1Hімідазол-2-іл]піперидину гідрохлорид 4-(1,5-диметил-4-(3-(трифторметил)-феніл)-1Hімідазол-2-іл)піперидину гідрохлорид 4-(4-(3-хлор-4-фторфеніл)-1,5-диметил-1Hімідазол-2-іл)піперидину гідрохлорид 4-(4-(3-фторфеніл)-1,5-диметил-1H-імідазол-2іл)піперидину гідрохлорид 4-[4-(3,4-дифторфеніл)-1-ізопропіл-1H-імідазол-2іл]піперидину гідрохлорид 4-(1-ізопропіл-4-(3-(трифторметил)-феніл)-1Hімідазол-2-іл)піперидину гідрохлорид 4-(4-(3-бромфеніл)-1-метил-1H-імідазол-2іл)піперидину 15 19 MS (IS): m/z=[M+H] 328,2 328,2 328,2 253,2 253,2 330,2 314,2 314,2 323,2 323,2 307,2 273,2 322 UA 99284 C2 5 10 15 20 25 30 35 Підготовчий синтез 84 1-бензил-4-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперазин Нагрівають суміш гемісульфaту 4-бензилпіперазин-1-карбоксамідину (500 мг, 1,00 екв.; 1,580 ммоль); карбонату натрію (4 екв., 6,321 ммоль); диметилформаміду (10,5 мл) та ацетону (110 мл) до кипіння. Додають краплями 2-бром-1-[4-фтор-3(трифторметил)феніл]-1-етанон (1,00 екв.; 1,580 ммоль; 450 мг) у 4 мл ацетону протягом 15 хв, та перемішують реакційну суміш протягом 30 хв, після чого охолоджують до кімнатної температури. Фільтрують реакційну суміш, та концентрують під зниженим тиском, розводять етилацетатом, промивають 20% насиченим розчином бікарбонату натрію, водою та насиченим водним розчином хлориду натрію. Сушать над MgSO4, фільтрують, та випарюють під зниженим тиском. Очищають на колонці із силікагелем, елююючи 2-5% 1 M NH3-MeOH/DCM, та одержують 262,0 мг (0,678 ммоль, 43%) 1бензил-4-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперазину. MS (ES): m/z=405 [M+H]. Підготовчий синтез 85 1-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперазин Об’єднують 1-бензил-4-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперазин (260 мг, 1,00 екв.; 0,643 ммоль), 20% (мас.) Pd(OH)2/C Degussa E101NE/W (250 мг); метанол (10 мл), амонієву сіль мурашиної кислоти (20 екв., 12,8 ммоль; 810 мг), та нагрівають до 50C протягом 2 год, після чого охолоджують до кімнатної температури. Фільтрують реакційну суміш через целіт, випарюють під зниженим тиском, та випарюють один раз спільно з метанолом, одержуючи 195,2 мг (0,621 ммоль, 97%) 1-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2іл]піперазину у вигляді жовтої піни. MS (ES): m/z=315 [M+H]. Підготовчий синтез 86 1-бензил-4-[4-(3-хлор-4-фторфеніл)-1-етил-1H-імідазол-2-іл]піперидин Додають диметилсульфоксид (0,3 M, 2,7 мл) до порошкоподібного гідроксиду калію (1,5 екв., 1,217 ммоль; 68 мг). Додають 1-бензил-4-[5-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидин (300 мг, 1,00 екв.; 0,811 ммоль), додають краплями йодетан (1,1 екв., 0,892 ммоль; 71 мкл) протягом 8 хв. Перемішують реакційну суміш протягом 60 хв, після чого розводять водою (120 мл) та насиченим розчином хлориду натрію (25 мл), та екстрагують чотири рази DCM. Промивають органічні екстракти водою, після чого насиченим водним розчином хлориду натрію, та сушать над MgSO4. Фільтрують, очищають на колонці із силікагелем, елююючи сумішшю 10% метанол/ацетонітрил, та одержують 262 мг (0,659 ммоль, 81%) 1-бензил-4-[4-(3-хлор-4фторфеніл)-1-етил-1H-імідазол-2-іл]піперидину. MS (ES): m/z=398 [M+H]. Сполуки Підготовчих синтезів 87-89 можна одержати практично як описано у Підготовчому синтезі 86. Підготовчий синтез 87 88 89 Сполука 1-бензил-4-[4-(3-хлор-4-фторфеніл)-1-метил-1H-імідазол-2іл]піперидин 1-бензил-4-[4-(3-хлор-4-фторфеніл)-1-ізопропіл-1H-імідазол-2іл]піперидин 1-бензил-4-[4-(3,4-дифторфеніл)-1-метил-1H-імідазол-2іл]піперидин MS (ES): m/z=[M+H] 384 412 412 40 45 50 Підготовчий синтез 90 Гідрохлорид 4-[4-(3-хлор-4-фторфеніл)-1-етил-1H-імідазол-2-іл]піперидину Розчиняють 1-бензил-4-[4-(3-хлор-4-фторфеніл)-1-етил-1H-імідазол-2-іл]піперидин (263,3 мг, 1,00 екв.; 0,662 ммоль), та N,N,N',N'-тетраметил-1,8-нафталіндіамін (0,05 екв., 0,033 ммоль, 7,0 мг) у 1,2-дихлоретані (5 мл), та охолоджують на льодяній бані. Додають 1хлоретилхлорформіат (1,2 екв., 0,794 ммоль; 0,086 мл). Перемішують реакційну суміш 10 хв на льодяній бані, після чого нагрівають зі зворотним холодильником протягом 20 хв, та випарюють досуха. Розчиняють залишок у метанолі (5 мл), кип’ятять зі зворотним холодильником протягом 45 хв, та випарюють досуха, одержуючи 268 мг (0,779 ммоль, 118%) гідрохлориду 4-[4-(3-хлор4-фторфеніл)-1-етил-1H-імідазол-2-іл]піперидину. MS (ES): m/z=308 [M+H]. 20 UA 99284 C2 Сполуки Підготовчих синтезів 91-93 можна одержати практично як описано у Підготовчому синтезі 90. Підготовчий синтез 91 92 93 5 10 15 20 25 30 35 40 45 50 Сполука гідрохлорид 4-[4-(3-хлор-4-фторфеніл)-1-метил-1H-імідазол-2іл]піперидину гідрохлорид 4-[4-(3-хлор-4-фторфеніл)-1-ізопропіл-1H-імідазол2-іл]піперидину 4-[4-(3,4-дифторфеніл)-1-метил-1H-імідазол-2-іл]-піперидин MS (ES): m/z=[M+H] 294 440,2 278,0 Підготовчий синтез 94 4-хлор-5-фтор-7H-піроло[2,3-d]піримідин Змішують 4-хлорпіроло[2,3-d]піримідин (2,985 г, 19,40 ммоль), [1-(хлорметил)-4-фтор-1,4діазоніабіцикло[2,2,2]октанбіс(тетрафторборат)] (Selectfluorо) (10,523 г, 29,704 ммоль)], ацетонітрил (200 мл) та оцтову кислоту (40 мл), нагрівають до 70C і витримують протягом 24 год. Контролюють витрачання вихідного матеріалу за допомогою РХВЕ, після чого концентрують. Додають дві порції толуолу (50 мл), та випарюють. Фільтрують неочищений матеріал через шар целіту, промиваючи сумішшю 1:1 EtOAc/CH 2Cl2. На закінчення, концентрують фільтрат, та хроматографують на колонці із силікагелем, елююючи сумішшю CH2Cl2/MeOH [градієнт 0-10%MeOH]. Аналізують фракції мас-спектрометрією, об’єднують фракції, які містять продукт, і одержують 1,931 г (58%) 4-хлор-5-фтор-7H-піроло[2,3d]піримідину. MS (ES): m/z=172 [M+H]. Підготовчий синтез 95 4-хлор-1H-піразоло[3,4-d]піримідин До розчину алопуринолу (20 г, 146,94 ммоль) у толуолі (205,71 мл), додають фосфорилхлорид (68,27 мл, 734,68 ммоль) та діізопропілетиламін (56,38 мл, 323,26 ммоль), та нагрівають суміш при 80C протягом 2 год. Видаляють розчинник у вакуумі до половини об’єму, та виливають суміш у 2 M розчин дикальційортофосфату (734,68 мл, 1,47 моль) у воді при 4C. Перемішують суміш протягом ночі при кімнатній температурі. Відфільтровують одержаний осад через шар целіту та промивають його EtOAc. Відділяють фільтрат, промивають водний шар додатковою кількістю EtOAc, об’єднують органічні шари, сушать їх над MgSO4, фільтрують, та концентрують у вакуумі, одержуючи 4-хлор-1H-піразоло[3,4-d]піримідин (16 г, вихід 70,45%) у вигляді жовтої твердої речовини. MS (APCI): m/z=155,1 [M+H]. Підготовчий синтез 95-A 4,6-дихлорпіримідин-5-карбальдегід Завантажують DMF (8,9 мл, 1,3 екв.) у круглодонну колбу та охолоджують до 0C. Додають краплями POCl3 (32,6 мл, 4,0 екв.) до реакційної суміші при 0C. Перемішують реакційну суміш при 0C протягом 1 год. Додають до реакційної суміші 4,6-дигідроксилпіримідин (10,0 г, 1,0 екв.), та дозволяють їй повільно нагрітися до кімнатної температури. Кип’ятять реакційну суміш зі зворотним холодильником протягом 4 год, та спостерігають за ходом реакції за допомогою ТШХ (10% ацетону у DCM). Концентрують реакційну суміш у вакуумі, та виливають концентровану реакційну суміш на подрібнений лід. Екстрагують одержаний продукт діетиловим ефіром, та промивають насиченим водним розчином хлориду натрію. Сушать органічний шар над безводним сульфатом натрію, та концентрують у вакуумі, одержуючи продукт у вигляді блідожовтої твердої речовини (6,2 г, 40%). Підготовчий синтез 95-B 1-(4,6-дихлорпіримідин-5-іл)пропан-1-ол Завантажують 4,6-дихлорпіримідин-5-карбальдегід (2,5 г, 1,0 екв.) та толуол (50 мл) у круглодонну колбу. Охолоджують реакційну суміш до -10C. Додають краплями розчин етилмагнійброміду (3 M) у THF (5,1 мл, 1,1 екв.) при -10C. Дозволяють реакційній суміші повільно нагрітися до кімнатної температури протягом 1 год. Додають до реакційної суміші охолоджений розчин хлориду амонію, та екстрагують діетиловим ефіром. Промивають ефірний шар насиченим водним розчином хлориду натрію. Сушать ефірний шар над безводним сульфатом натрію, та концентрують під зниженим тиском, одержуючи бажаний продукт (2,3 г, 79,3%). Сполуку Підготовчого синтезу 95-C можна одержати практично як описано у Підготовчому синтезі 95-B. 21 UA 99284 C2 Підготовчий Сполука синтез 95-C 1-(4,6-дихлорпіримідин-5-іл)етанол 5 10 15 20 25 30 35 40 45 Підготовчий синтез 95-D 4-хлор-3-йод-1H-піразоло[3,4-d]піримідин Завантажують 4-хлор-1H-піразоло[3,4-d]піримідин (6,1 г, 1,0 екв.), N-йодсукцинімід (NIS) (21,55 г, 2,0 екв.) та DMF (213,5 мл) у круглодонну колбу. Перемішують реакційну суміш при 50C протягом 16 год. Спостерігають за ходом реакції за допомогою ТШХ (10% ацетону у DCM). Концентрують реакційну суміш під зниженим тиском. Завантажують етилацетат, та промивають водою та насиченим водним розчином хлориду натрію. Сушать органічний шар над безводним сульфатом натрію, та концентрують органічний шар під зниженим тиском, одержуючи 4-хлор-3йод-1H-піразоло[3,4-d]піримідин (6,8 г, 61,43%). Підготовчий синтез 95-E 4-хлор-3-((триметилсиліл)етиніл)-1H-піразоло[3,4-d]піримідин Завантажують 4-хлор-3-йод-1H-піразоло[3,4-d]піримідин (5,4 г, 1,0 екв.), триметилсилілацетилен (11,347 г, 6,0 екв.), CuI (1,833 г, 0,5 екв.), TEA (2,68 мл, 1,0 екв.), DMF (67,5 мл) та THF (202,5 мл) у круглодонну колбу у атмосфері аргону. Перемішують реакційну суміш у атмосфері аргону протягом 30 хв. Завантажують (PPh3)4Pd (2,225 г, 0,1 екв.), та перемішують реакційну суміш при 35C протягом 3 год. Спостерігають за ходом реакції за допомогою ТШХ (10% ацетону у DCM). Концентрують реакційну суміш під зниженим тиском. Завантажують етилацетат, та промивають насиченим розчином бікарбонату натрію, водою та насиченим водним розчином хлориду натрію. Сушать органічний шар над безводним сульфатом натрію, та концентрують органічний шар під зниженим тиском. Очищають сполуку хроматографією на колонці (діоксид кремнію 100-200 меш, DCM-ацетон), одержуючи бажаний продукт (1,81 г, 36,14%). Підготовчий синтез 96 Циклопропіл-(4,6-дихлорпіримідин-5-іл)-метанол Додають повільно n-BuLi (2,37 г, 36,0 ммоль) до охолодженого розчину діізопропіламіну (3,72 г, 36,0 ммоль) у 50,0 мл THF при -78C у атмосфері азоту. Перемішують реакційну суміш протягом 30 хв при тій самій температурі, після чого додають 4,6-дихлорпіримідин (5,0 г, 33,0 ммоль), розчинений у 15 мл THF. Перемішують одержану реакційну суміш ще 30 хв при 78C, після чого додають циклопропанкарбальдегід (2,58 г, 36,8 ммоль). Дозволяють реакційній суміші нагрітися до кімнатної температури. Додають 50,0 мл води, та екстрагують органічний шар етилацетатом (350 мл), промивають насиченим водним розчином хлориду натрію, після чого сушать над безводним сульфaтом натрію. Концентрують під зниженим тиском у вакуумі, одержуючи циклопропіл-(4,6-дихлорпіримідин-5-іл)метанол (4,0 г, вихід 54%). MS (APCI): m/z=220 [M+H]. Підготовчий синтез 97 Циклопропіл-(4,6-дихлорпіримідин-5-іл)метанон Додають порціями оксид хрому (VI) (5,84 г, 58,4 ммоль) до циклопропіл-(4,6дихлорпіримідин-5-іл)метанолу (4,0 г, 18,2 ммоль) у 80,0 мл ацетону при 0C, та перемішують протягом 30 хв при 0C. Потім додають ізопропіловий спирт для гашення надлишку реагента, та перемішують ще 15 хв при кімнатній температурі. Охолоджують до 0C та виливають у насичений розчин NaHCO3. Фільтрують через шар целіту, екстрагують етилацетатом (350 мл), та промивають об’єднані органічні шари насиченим водним розчином хлориду натрію. Сушать, та концентрують під зниженим тиском, одержуючи вказану в заголовку сполуку у вигляді безбарвного масла (2,0 г, вихід 50%, 9,2 ммоль). MS (ES): m/z=218 [M+H]. Нижченаведені Підготовчі синтези можна одержати практично як описано у Підготовчому синтезі 97. Підготовчий синтез 97-A 97-B Сполука 1-(4,6-дихлорпіримідин-5-іл)пропан-1-он 1-(4,6-дихлорпіримідин-5-іл)етанон 50 Підготовчий синтез 98 4-хлор-3-циклопропіл-1H-піразоло[3,4-d]піримідин 22 UA 99284 C2 5 10 15 20 Додають повільно при кімнатній температурі гідразингідрат (2,67 г, 53,4 ммоль) до циклопропіл-(4,6-дихлорпіримідин-5-іл)метанону (9,66 г, 44,5 ммоль), розчиненого у 300 мл THF, та перемішують протягом 4 год. Після завершення додавання розподіляють реакційну суміш між водою та етилацетатом, збирають органічний шар, промивають насиченим водним розчином хлориду натрію, сушать над безводним сульфaтом натрію, та концентрують у вакуумі. Очищають одержану вказану в заголовку сполуку пропусканням через коротку колонку із силікагелем (60-120 меш) із застосуванням суміші хлороформ/метанол (97:3) як елюенту. MS (ES): m/z=195 [M+H]. Підготовчий синтез 99 4-(3-трифторметилфеніл)-1H-імідазол Завантажують формамід (15 мл; 32,72 екв.; 376,99 ммоль; 15,00 мл; 16,98 г) та 2-бром-1-(3трифторметилфеніл)етанон (3,077 г; 1,00 екв.; 11,52 ммоль; 3,08 г) у трубку, запаюють її, нагрівають та витримують при 185C протягом 3 год. Виливають реакційну суміш у NaHCO3 та розводять EtOAc, промивають водою, насиченим водним розчином хлориду натрію, та сушать над Na2SO4, фільтрують, та концентрують досуха. Розчиняють неочищену суміш та очищають флеш-хроматографією на діоксиді кремнію, елююючи градієнтом дихлорметан (DCM)/метанол 0-10%. Збирають фракції продукту, та видаляють розчинник, одержуючи 4-(3трифторметилфеніл)-1H-імідазол (1,373 г; 0,56 екв.; 6,47 ммоль; 1,37 г; вихід 56,16%). MS (ES): m/z=213,0 [M+H]. Сполуку Підготовчого синтезу 100 можна одержати практично як описано у Підготовчому синтезі 99. Підготовчий Сполука синтез 100 4-(4-трифторметилфеніл)-1H-імідазол 25 30 35 40 102 50 MS (ES): m/z=213,0 [M+H] Підготовчий синтез 101 4-(3-трифторметилфеніл)-1-(2-триметилсиланілетоксиметил)-1H-імідазол У круглодонну колбу місткістю 250 мл (обладнану гумовою мембраною, пристроєм для створення захисної азотної атмосфери та стрижневою мішалкою) завантажують тетрагідрофуран (30 мл; 368,66 ммоль; 30,00 мл; 26,58 г), 4-(3-трифторметилфеніл)-1H-імідазол (1,047 г; 1,00 екв.; 4,93 ммоль; 1,05 г), охолоджують суміш до 0C при перемішуванні та витримують протягом 5 хв. Додають у колбу гідрид натрію (0,138 г; 1,11 екв.; 5,46 ммоль; 138,00 мг), та перемішують реакційну суміш протягом 20 хв. Додають 2(триметилсиліл)етоксиметилхлорид (1,15 мл; 1,31 екв.; 6,49 ммоль; 1,15 мл; 1,08 г), та дозволяють реакційній суміші нагрітися до кімнатної температури. Розводять реакційну суміш водою, екстрагують суміш двічі етилацетатом, та відкидають водну фазу. Сушать одержаний матеріал над Na2SO4, фільтрують, та концентрують досуха. Очищають неочищену суміш флешхроматографією на силікагелі, елююючи сумішшю етилацетат/гексан з градієнтом EtOAc 1060%. Об’єднують відповідні фракції, та концентрують, одержуючи 4-(3-трифторметилфеніл)-1(2-триметилсиланілетоксиметил)-1H-імідазол (1,178 г; 0,70 екв.; 3,44 ммоль; 1,18 г; вихід 69,71%). MS(ES): (m/z)=343,2 [M+H]. Сполуку Підготовчого синтезу 102 можна одержати практично як описано у Підготовчому синтезі 101. Підготовчий синтез 45 Фізичні дані Сполука Фізичні дані 4-(4-трифторметилфеніл)-1-(2триметилсиланілетоксиметил)-1H-імідазол MS(ES): (m/z)=343,2 [M+H] Підготовчий синтез 103 Трет-бутиловий складний ефір 4-гідрокси-4-[4-(3-трифторметилфеніл)-1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти У круглодонну колбу місткістю 100 мл (обладнану охолоджувальною банею, стрижневою мішалкою та пристроєм для створення захисної азотної атмосфери) завантажують 4-(3трифторметилфеніл)-1-(2-триметилсиланіл-етоксиметил)-1H-імідазол (0,995 г; 1,00 екв.; 2,91 ммоль; 995,00 мг), н-бутиллітій (2,8 мл; 1,54 екв.; 4,48 ммоль; 2,80 мл; 1,90 г) та тетрагідрофуран (30 мл; 368,66 ммоль; 30,00 мл; 26,58 г), охолоджують суміш до -78C при перемішуванні та витримують протягом 30 хв. Додають N-трет-бутоксикарбоніл-4-піперидон 23 UA 99284 C2 5 10 (0,706 г; 1,22 екв.; 3,54 ммоль; 706,00 мг), та дозволяють реакційній суміші нагрітися до кімнатної температури. Розводять реакційну суміш CH2Cl2, промивають водою, сушать над Na2SO4, фільтрують, та концентрують досуха. Очищають неочищену суміш флешхроматографією на діоксиді кремнію, елююючи сумішшю етилацетат/гексан з градієнтом EtOAc 10-50%. Об’єднують відповідні фракції, та концентрують, одержуючи трет-бутиловий складний ефір 4-гідрокси-4-[4-(3-трифторметилфеніл)-1-(2-триметилсиланілетоксиметил)-1H-імідазол-2іл]-піперидин-1-карбонової кислоти (1,248 г; 0,79 екв.; 2,30 ммоль; 1,25 г; вихід 79,29%). MS(ES): (m/z)=542,2 [M+H]. Сполуку Підготовчого синтезу 104 можна одержати практично як описано у Підготовчому синтезі 103. Підготовчий синтез 104 15 20 Сполука Фізичні дані трет-бутиловий складний ефір 4-гідрокси-4-[4-(4MS(ES): трифторметилфеніл)-1-(2-триметилсиланіл-етоксиметил)-1H(m/z)=542,2 [M+H] імідазол-2-іл]піперидин-1-карбонової кислоти Підготовчий синтез 105 4-[4-(3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-4-ол У пробірку, придатну для нагрівання у мікрохвильовому реакторі, вміщують трет-бутиловий складний ефір 4-гідроксил-4-[4-(3-трифторметилфеніл)-1-(2-триметилсиланілетоксиметил)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти (0,453 г; 1,00 екв.; 836,28 мкмоль; 453,00 мг), етанол (5 мл; 85,88 ммоль; 5,00 мл; 3,96 г) та хлороводень (5 мл; 5,00 ммоль; 1-н. водний розчин), нагрівають до 70C у мікрохвильовому реакторі при перемішуванні та витримують протягом 4 год. Концентрують реакційну суміш, та одержують сіль 4-[4-(3-трифторметилфеніл)1H-імідазол-2-іл]піперидин-4-олу (0,32 г; 1,00 екв.; 832,84 мкмоль; 320,00 мг; вихід 99,59%). MS(ES): (m/z)=312,2 [M+H]. Сполуку Підготовчого синтезу 106 можна одержати практично як описано у Підготовчому синтезі 105. 25 Підготовчий синтез 106 30 35 40 45 50 Сполука Фізичні дані 4-[4-(4-трифторметилфеніл)-1H-імідазол-2іл]піперидин-4-ол MS(ES): (m/z)=312,2 [M+H] Підготовчий синтез 107 1-метил-4-феніл-1H-імідазол Додають 20 мл диметилсульфоксиду (35 мл; 492,74 ммоль) до порошкоподібного гідроксиду калію (20,81 ммоль; 1,17 г). Додають 5-феніл-1H-імідазол (13,87 ммоль; 2,00 г) при кімнатній температурі, причому тверда речовина швидко розчиняється, утворюючи оранжевий розчин. Після перемішування протягом 5 хв додають однією порцією метилйодид (15,26 ммоль; 950,36 мкл). Перемішують 4 год при кімнатній температурі. Розводять водою, та екстрагують етилацетатом (2), промивають органічний шар сумішшю насиченого водного розчину хлориду натрію з водою (2), сушать над MgSO4, фільтрують, і випарюють, одержуючи 1,71 г жовтої твердої речовини. Очищають неочищену речовину хроматографією ISCO на колонці Biotage 40M, елююючи градієнтом від 0,5%MeOH/DCM до 5%MeOH/DCM при швидкості потоку 40 мл/хв. Сушать фракції продукту, та одержують 1,43 г (вихід 65%) злегка забарвленої твердої речовини. (7% небажаного регіоізомеру) MS(ES): (m/z)=159,0 [M+H]. Підготовчий синтез 108 Дигідрохлорид 4-(1-метил-4-феніл-1H-імідазол-2-іл)піперидин-4-олу Розчиняють 1-метил-4-феніл-1H-імідазол (9,05 ммоль; 1,43 г) у безводному тетрагідрофурані (30,00 мл), та охолоджують суміш до -78C. Повільно додають н-бутиллітій (1,30 екв.; 11,77 ммоль; 7,35 мл) (1,6 M розчин у гексані), та перемішують реакційну суміш при 78C протягом 30 хв, після чого додають краплями розчин N-трет-бутоксикарбоніл-4-піперидону (11,77 ммоль; 2,34 г) у THF (20 мл) протягом 20 хв. Витримують суміш при перемішуванні протягом ночі з нагріванням до кімнатної температури. Розводять DCM та сумішшю насиченого водного розчину хлориду натрію з водою (50/50), (2 DCM), після чого сушать над MgSO4. Фільтрують, та концентрують, одержуючи 3,8 г неочищеного жовтого масла. Очищають реакційну суміш хроматографією ISCO на колонці Biotage 40M, елююючи сумішшю 50:50 EtOAc:Hex при швидкості потоку 40 мл/хв. Концентрують фракції продукту, одержуючи 2,00 г 24 UA 99284 C2 5 10 15 20 25 30 трет-бутилового складного ефіру 4-гідрокси-4-(1-метил-4-феніл-1H-імідазол-2-іл)піперидин-1карбонової кислоти у вигляді білої твердої речовини. ES-MS (M+H)=358,3. Розчиняють продукт у 5 мл дихлорметану, та повільно додають хлороводень (20,00 ммоль; 5,00 мл) (4 M розчин у діоксані) при кімнатній температурі. Через приблизно 5 хв розчин стає каламутним; до нього додають 3 мл метанолу для переведення реакційної суміші знову у розчин. Через 1 год реакція завершується на 95%. Додають 1 мл 4 M розчину HCl у діоксані, та перемішують 15 хв. Концентрують, одержуючи 2,1 г дигідрохлориду 4-(1-метил-4-феніл-1H-імідазол-2-іл)піперидин4-олу у вигляді світло-жовтої твердої речовини. MS(ES): (m/z)=258,3 [M+H]. Підготовчий синтез 109 4-хлор-5-йод-7H-піроло[2,3-d]піримідин Розчиняють 6-хлор-7-деазапурин (10,75 г, 70 ммоль) та N-йодсукцинімід (16,8 г, 75 ммоль) у 400 мл безводного DMF, та витримують при кімнатній температурі у темряві протягом ночі. Випарюють розчинник. Розподіляють одержаний темний залишок між 500 мл етилацетату та 150 мл 10% розчину Na2SO3. Промивають органічну фракцію 10% розчином Na2SO3 (2100 мл) та насиченим водним розчином хлориду натрію (150 мл), сушать над Na2SO4, та випарюють. Перекристалізують жовтий залишок з етанолу, і одержують 16,2 г (83%) 4-хлор-5-йод-7Hпіроло[2,3-d]піримідину у вигляді злегка забарвлених кристалів. Випарюють маточний розчин, розчиняють у толуолі, та очищають флеш-хроматографією на силікагелі (74 см). Промивають колонку толуолом до одержання безбарвного елюату, після чого елююють вказану в заголовку сполуку 5% розчином етилацетату у толуолі, одержуючи ще 3,5 г продукту. Підготовчий синтез 110 4-(4-хлор-7H-піроло[2,3-d]піримідин-5-іл)-2-метилбут-3-ін-2-ол Змішують 4-хлор-5-йод-7H-піроло[2,3-d]піримідин (5,0 г, 1,0 екв.), 2-метил-3-бутин-2-ол (9,02 г, 6,0 екв.), TEA (1,68 г, 0,93 екв.), CuI (1,36 г, 0,4 екв.), DMF (62,5 мл) та THF (187,5 мл) при кімнатній температурі у атмосфері аргону. Перемішують реакційну суміш при кімнатній температурі у атмосфері аргону протягом 5 хв. Додають Pd(PPh3)4 (1,03 г, 0,05 екв.), та перемішують реакційну суміш при 45C протягом 16 год. Спостерігають за ходом реакції за допомогою ТШХ (елюент 65% CHCl3: 23% гексан: 12% ацетон). Концентрують реакційну суміш у вакуумі. Завантажують етилацетат, та промивають водою та насиченим водним розчином хлориду натрію. Сушать органічний шар над безводним Na 2SO4, та концентрують його у вакуумі. Кристалізують продукт із суміші 65% CHCl3: 23% гексан: 12% ацетон, та одержують бажану сполуку (3,35 г,79,7%). Сполуки Підготовчих синтезів 111-112 можна одержати практично як описано у Підготовчому синтезі 110. 35 Підготовчий синтез 111 112 40 45 Сполука 3-(4-хлор-7H-піроло[2,3-d]піримідин-5-іл)-проп-2-ін-1-ол 4-хлор-5-триметилсиланілетиніл-7H-піроло[2,3-d]LCMS=250(M+H) піримідин Підготовчий синтез 113 4-хлор-5-(3-метил-3-(триметилсилілокси)бут-1-ініл)-7H-піроло[2,3-d]піримідин Змішують 4-(4-хлор-7H-піроло[2,3-d]піримідин-5-іл)-2-метилбут-3-ін-2-ол (3,35 г, 1,0 екв.), імідазол (2,9 г, 3,0 екв.), TEA (2,16 г, 1,5 екв.) та діетиловий ефір (84 мл) при кімнатній температурі. Охолоджують реакційну суміш до 0C, та додають триметилсилілхлорид (1,53 г, 1,0 екв.). Перемішують реакційну суміш при кімнатній температурі протягом 4 год. Спостерігають за ходом реакції за допомогою ТШХ (5% MeOH у DCM). Додають охолоджену демінералізовану воду, та екстрагують діетиловим ефіром. Промивають ефірний шар насиченим водним розчином хлориду натрію. Сушать органічний шар над безводним Na 2SO4, та концентрують його у вакуумі, одержуючи бажану сполуку (3,06 г,70%). Підготовчий синтез 114 50 Фізичні дані Сполука Фізичні дані 4-хлор-5-(3-(триметилсилілокси)проп-1-ініл)-7Hпіроло[2,3-d]піримідин ПРИКЛАД 1 Гідрохлорид піримідину 4-(4-(5-(2,4-дихлорфеніл)-1H-імідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d] 25 UA 99284 C2 5 10 15 Витримують суміш 4-(4-(2,4-дихлорфеніл)-1H-імідазол-2-іл)піперидину (270 мг, 0,91 ммоль), 4-хлор-1H-піразоло[3,4-d]піримідину (280 мг, 1,82 ммоль), Et3N (0,63 мл, 4,5 ммоль) та 2пропанолу (10 мл) при 90C протягом ночі у атмосфері азоту. Охолоджують суміш до кімнатної температури та виливають у воду (100 мл). Екстрагують суміш CH2Cl2 (2200 мл), об’єднують органічні шари, та промивають водою (50 мл). Сушать органічний шар (Na2SO4), фільтрують суміш, та концентрують фільтрат у вакуумі. Очищають залишок хроматографією на силікагелі (25 г SiO2, елюювання сумішшю CH2Cl2/CMA 4:1, 1000 мл), і одержують 4-(4-(5-(2,4дихлорфеніл)-1H-імідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідин (304 мг, 80%). Додають хлористоводневу кислоту (2,0 M водний розчин, 0,36 мл, 0,72 ммоль) до суспензії 4-(4(5-(2,4-дихлорфеніл)-1H-імідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину (300 мг, 0,72 ммоль) у метанолі (7 мл). Концентрують суміш у вакуумі досуха. Розчиняють залишок у метанолі (2 мл), та додають діетиловий ефір (50 мл) для утворення осаду. Відфільтровують одержаний осад, та промивають його на фільтрі Et2O. Розчиняють цю тверду речовину у метанолі (10 мл), видаляють розчинник у вакуумі досуха, і одержують гідрохлорид 4-(4-(5-(2,4дихлорфеніл)-1H-імідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину (210 мг, 65%) у вигляді злегка забарвленої твердої речовини. MS (APCI): m/z=414 [M+H]. Сполуки Прикладів 2-33 можна одержати практично як описано у Прикладі 1. Приклад Сполука 2 гідрохлорид 4-(4-(4-(4-(трифторметил)феніл)-1H-імідазол-2іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину 3 гідрохлорид 4-(4-(4-феніл-1H-імідазол-2-іл)-піперидин-1-іл)-1Hпіразоло[3,4-d]піримідину 4 гідрохлорид 4-(4-(4-(4-хлорфеніл)-1H-імідазол-2-іл)-піперидин-1іл)-1H-піразоло[3,4-d]піримідину 5 гідрохлорид 4-{4-[4-(3-(трифторметил)феніл)-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]-піримідину 6 гідрохлорид 4-(4-(4-(4-фтор-3-трифторметил)феніл)-1H-імідазол2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]-піримідину 7 гідрохлорид 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол2-іл]піперидин-1-іл}-7H-піроло[2,3-d]-піримідину 8 гідрохлорид 6-{4-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол2-іл]піперидин-1-іл}-9H-пурину 9 гідрохлорид 5-фтор-4-{4-[4-(4-фтор-3-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-7H-піроло[2,3-d]піримідину 10 гідрохлорид 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1-метил-1Hімідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину 11 гідрохлорид 4-(4-(1-метил-4-((3-трифторметил)-феніл)-1Hімідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину 12 гідрохлорид 4-(4-(1-метил-4-((4-трифторметил)-феніл)-1Hімідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину 13 гідрохлорид 4-(4-(4-(3-фтор-4-(трифторметил)феніл)-1H-імідазол2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]-піримідину 14 гідрохлорид 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол2-іл]-3-метилпіперидин-1-іл}-1H-піразоло[3,4-d]піримідину 15 гідрохлорид 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол2-іл]-3-метилпіперидин-1-іл}-7H-піроло[2,3-d]піримідину 16 дигідрохлорид 4-{4-[4-(4-фтор-3-трифторметил-феніл)-5-метил1H-імідазол-2-іл]піперидин-1-іл}-7H-піроло[2,3-d]піримідину 17 дигідрохлорид 4-{4-[4-(4-фтор-3-трифторметил-феніл)-5-метил1H-імідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину 18 дигідрохлорид 6-{4-[4-(4-фтор-3-трифторметил-феніл)-5-метил1H-імідазол-2-іл]піперидин-1-іл}-9H-пурину 19 дигідрохлорид 4-{2-[1-(3-циклопропіл-1H-піразоло[3,4d]піримідин-4-іл)піперидин-4-іл]-3H-імідазол-4-іл}бензонітрилу 20 дигідрохлорид 4-{2-[1-(1H-піразоло[3,4-d]піримідин-4іл)піперидин-4-іл]-3H-імідазол-4-іл}бензонітрилу 21 дигідрохлорид 3-{2-[1-(1H-піразоло[3,4-d]піримідин-4іл)піперидин-4-іл]-3H-імідазол-4-іл}бензонітрилу 26 Фізичні дані MS (APCI): m/z=414 [M+H] MS (APCI): m/z=346 [M+H] MS (APCI): m/z=380 [M+H] MS (APCI): m/z=414 [M+H] MS (APCI): m/z=432 [M+H] MS (IS): (m/z)=431,41 [M+H] MS (IS): (m/z)=431,41 [M+H] MS (IS): (m/z)=449,40 [M+H] MS (IS): (m/z)=446,2 [M+H] MS (APCI): m/z=428 [M+H] MS (APCI): m/z=428 [M+H] MS (APCI): m/z=432 [M+H] MS (IS): (m/z)=446,2 [M+H] MS (IS): (m/z)=445,2 [M+H] MS (IS): (m/z)=445,2 [M+H] MS (IS): (m/z)=446,2 [M+H] MS (IS): (m/z)=446,2 [M+H] MS (IS): (m/z)=411,2 [M+H] MS (IS): (m/z)=371,2 [M+H] MS (IS): (m/z)=371,2 [M+H] UA 99284 C2 22 23 24 25 26 27 28 29 30 30-A 30-B 30-C 30-D 31 32 33 33-A 33-B 33-C 33-D 33-E 33-F 33-G 33-H дигідрохлорид 3-{2-[1-(3-циклопропіл-1H-піразоло-[3,4d]піримідин-4-іл)піперидин-4-іл]-3H-імідазол-4-іл}бензонітрилу дигідрохлорид 4-{4-[5-(2-хлор-5-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину дигідрохлорид 4-{4-[5-(3-фтор-5-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину дигідрохлорид 4-{4-[5-(2-фтор-5-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-7H-піроло[2,3-d]піримідину дигідрохлорид 4-{4-[5-(2-фтор-5-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину дигідрохлорид 6-{4-[5-(2-фтор-5-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-9H-пурину дигідрохлорид 3-циклопропіл-4-{4-[5-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-1Hпіразоло[3,4-d]піримідину дигідрохлорид 1-(1H-піразоло[3,4-d]піримідин-4-іл)-4-[4-(3трифторметилфеніл)-1H-імідазол-2-іл]-піперидин-4-олу дигідрохлорид 1-(1H-піразоло[3,4-d]піримідин-4-іл)-4-[4-(4трифторметилфеніл)-1H-імідазол-2-іл]-піперидин-4-олу дигідрохлорид 1-(7H-піроло[2,3-d]піримідин-4-іл)-4-(4-(3(трифторметил)феніл)-1H-імідазол-2-іл)-піперидин-4-олу дигідрохлорид 1-(9H-пурин-6-іл)-4-(4-(3-(трифторметил)феніл)1H-імідазол-2-іл)піперидин-4-олу дигідрохлорид 1-(7H-піроло[2,3-d]піримідин-4-іл)-4-(4-(4(трифторметил)феніл)-1H-імідазол-2-іл)-піперидин-4-олу дигідрохлорид 1-(9H-пурин-6-іл)-4-(4-(4-(трифторметил)феніл)1H-імідазол-2-іл)піперидин-4-олу гідрохлорид 6-{4-[4-(4-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-іл}-9H-пурину гідрохлорид 6-{4-[4-(3-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-іл}-9H-пурину гідрохлорид 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1-метил-1Hімідазол-2-іл]піперидин-1-іл}-7H-піроло[2,3-d]піримідину дигідрохлорид 4-(4-(1,5-диметил-4-(4-трифторметил)феніл)-1Hімідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину (Реакція сполучення у диметилформаміді з діізопропілетиламіном) дигідрохлорид 4-(4-(1,5-диметил-4-(3-трифторметил)феніл)-1Hімідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину (Реакція сполучення у диметилформаміді з діізопропілетиламіном) дигідрохлорид 4-(4-(4-(3-хлор-4-фторфеніл)-1,5-диметил-1Hімідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідину (Реакція сполучення у диметилформаміді з діізопропілетиламіном) дигідрохлорид 4-(4-(4-(3-фторфеніл)-1,5-диметил-1H-імідазол-2іл)піперидин-1-іл)-1H-піразоло[3,4-d]-піримідину (Реакція сполучення у диметилформаміді з діізопропілетиламіном) гідрохлорид 6-{4-[4-(3,4-дифторфеніл)-1-ізопропіл-1H-імідазол-2іл]піперидин-1-іл}-9H-пурину гідрохлорид 4-{4-[4-(3,4-дифторфеніл)-1-ізопропіл-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину гідрохлорид 4-{4-[1-ізопропіл-4-(3-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-7H-піроло[2,3-d]піримідину гідрохлорид 4-{4-[1-ізопропіл-4-(3-трифторметил-феніл)-1Hімідазол-2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину 27 MS (IS): (m/z)=411,22 [M+H] MS (IS): (m/z)=448,2 [M+H] MS (IS): (m/z)=432,2 [M+H] MS (IS): (m/z)=432,2 [M+H] MS (IS): (m/z)=432,2 [M+H] MS (IS): (m/z)=432,2 [M+H] MS (IS): (m/z)=472,2 [M+H] MS (ES): (m/z)=430,0 [M+H] MS (ES): (m/z)=430,0 [M+H] ES-MS (M+H)=429,0 ES-MS (M+H)=430,0 ES-MS (M+H)=429,2 ES-MS (M+H)=430,0 MS (ES): (m/z)=414,0 [M+H] MS (ES): (m/z)=414,0 [M+H] MS (ES): (m/z)=445,0 [M+H] MS (APCI): m/z=441 [M+H] MS (APCI): m/z=441 [M+H] MS (APCI): m/z=425 [M+H] MS (APCI): m/z=391 [M+H] MS (APCI): m/z=424 [M+H] MS (APCI): m/z=424 [M+H] MS (APCI): m/z=455 [M+H] MS (APCI): m/z=456 [M+H] UA 99284 C2 5 10 15 ПРИКЛАД 34 Гідрохлорид 4-{4-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]-піперазин-1-іл}-1Hпіразоло[3,4-d]піримідину Змішують 1-[5-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]-піперазин (195 мг, 1,00 екв.; 0,620 ммоль); 4-хлор-1H-піразоло[3,4-d]піримідин (1,00 екв.; 0,620 ммоль; 96 мг); ізопропіловий спирт (3 мл); діізопропілетиламін (1 мл), та витримують у мікрохвильовому реакторі при 80C протягом 60 хв. Випарюють реакційну суміш, та очищають на силікагелі, елююючи сумішшю 5% MeOH/DCM. Об’єднують фракції, одержуючи 213,2 мг (0,494 ммоль, 80%) 4-{4-[5-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперазин-1-іл}-1H-піразоло[3,4-d]піримідину. Розчиняють одержану вільну основу в суміші DCM/MeOH, та додають 1,0 екв. 1 M розчину HCl у діетиловому ефірі. Концентрують суміш, одержуючи 237,2 мг гідрохлориду 4-{4-[5-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперазин-1-іл}-1H-піразоло[3,4-d]-піримідину. MS (ES): m/z=443 [M+H]. Перелічені нижче сполуки можна одержати практично як описано у Прикладі 34. Приклад 35 36 37 38 39 40 41 41-A 41-B 42 43 44 44-A 44-B 44-C 45 46 47 48 49 Сполука гідрохлорид 4-{4-[5-(3-хлор-4-фторфеніл)-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]-піримідину гідрохлорид 4-{4-[5-(4-хлор-3-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]-піримідину гідрохлорид 4-{4-[5-(3,4-дихлорфеніл)-1H-імідазол-2-іл]піперидин1-іл}-1H-піразоло[3,4-d]піримідину гідрохлорид 4-{4-[4-(4-фторфеніл)-1H-імідазол-2-іл]піперидин-1іл}-1H-піразоло[3,4-d]піримідину гідрохлорид 4-{4-[4-(3-хлор-4-фторфеніл)-1-етил-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]-піримідину гідрохлорид 4-{4-[4-(3-хлор-4-фторфеніл)-1-метил-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]-піримідину гідрохлорид 6-{4-[4-(3-хлор-4-фторфеніл)-1-метил-1H-імідазол-2іл]піперидин-1-іл}-9H-пурину 3-циклопропіл-4-(4-(4-(4-фтор-3-(трифторметил)-феніл)-1-метил1H-імідазол-2-іл)піперидин-1-іл)-1H-піразоло[3,4-d]піримідин 3-циклопропіл-4-(4-(4-(3,4-дифторфеніл)-1-метил-1H-імідазол-2іл)піперидин-1-іл)-1H-піразоло[3,4-d]-піримідин гідрохлорид 4-{4-[4-(3-хлорфеніл)-1H-імідазол-2-іл]-піперидин-1іл}-1H-піразоло[3,4-d]піримідину гідрохлорид 4-{4-[4-(2,4-дифторфеніл)-1H-імідазол-2-іл]піперидин1-іл}-1H-піразоло[3,4-d]піримідину гідрохлорид 4-{4-[4-(3-хлор-5-фторфеніл)-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]-піримідину біс-гідрохлорид 4-{4-[4-(3,4-дифторфеніл)-1-метил-1H-імідазол-2іл]піперидин-1-іл}-7H-піроло[2,3-d]-піримідину біс-гідрохлорид 6-{4-[4-(3,4-дифторфеніл)-1-метил-1H-імідазол-2іл]піперидин-1-іл}-9H-пурину біс-гідрохлорид 4-{4-[4-(3-хлор-4-фторфеніл)-1-метил-1Hімідазол-2-іл]піперидин-1-іл}-7H-піроло[2,3-d]піримідину гідрохлорид 4-{4-[4-(3-хлор-4-фторфеніл)-1-ізопропіл-1H-імідазол2-іл]піперидин-1-іл}-1H-піразоло[3,4-d]піримідину гідрохлорид 4-{4-[4-(3,4-дифторфеніл)-1-метил-1H-імідазол-2іл]піперидин-1-іл}-1H-піразоло[3,4-d]-піримідину гідрохлорид 4-{4-[4-(3,4-дифторфеніл)-1H-імідазол-2-іл]піперидин1-іл}-1H-піразоло[3,4-d]піримідину гідрохлорид 4-{4-[4-(3-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-іл}-7H-піроло[2,3-d]-піримідину гідрохлорид 4-{4-[1-метил-4-(3-трифторметилфеніл)-1H-імідазол2-іл]піперидин-1-іл}-7H-піроло[2,3-d]-піримідину 28 Фізичні дані MS (ES) + m/z=398 [M +H] + m/z=348 [M +H] + m/z=414 [M +H] + m/z=364,2 [M +H] + m/z=426 [M +H] + m/z=412 [M +H] + m/z=412 [M +H] MS (M+H): m/z=486,5 MS (M+H): m/z=436,4 + m/z=380,2 [M +H] + m/z=382,0 [M +H] + m/z=398,0 [M +H] MS (APCI): m/z=395 [M+H] MS (APCI): m/z=396 [M+H] MS (APCI): m/z=411 [M+H] + m/z=440,2 [M +H] + m/z=396,0 [M +H] + m/z=382,0 [M +H] + m/z=413 [M +H] + m/z=427 [M +H]
ДивитисяДодаткова інформація
Назва патенту англійськоюP70 s6 kinase inhibitors
Автори англійськоюDally, Robert Dean, Huang, Jianping, Joseph, Sajan, Shepherd, Timothy Alan, Holst, Christian L.
Назва патенту російськоюИнгибиторы р70 s6-киназы
Автори російськоюДалли Роберт Дин, Хуан Цзяньпин, Джоузеф Саджан, Шеперд Тимоти Алан, Холст Кристиан Л.
МПК / Мітки
МПК: A61P 35/00, C07D 487/04, A61K 31/437
Мітки: s6-кінази, інгібітори
Код посилання
<a href="https://ua.patents.su/45-99284-ingibitori-r70-s6-kinazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори р70 s6-кінази</a>
Попередній патент: Вакцина
Наступний патент: Спосіб дегазації вуглепородного масиву при розробці вугільних пластів
Випадковий патент: Комбінована зубна коронка












