Похідні хіноліну і хіноксаліну як інгібітори кінази
Номер патенту: 109153
Опубліковано: 27.07.2015
Автори: Партон Ендрю Харрі, Алі Мезхер Хуссейн, Ньюсс Джуді Шарлотт, Брукінгс Даніель Крістофер, Лангхам Баррі Джон, Квінсі Джоанна Рейчел, Браун Джуліен Алістар, Форд Даніель Джеймс, Франклін Річард Джеремі
Формула / Реферат
1. Сполука формули (І) або її N-оксид, або її фармацевтично прийнятна сіль або сольват:
 , (I)
, (I)
в якій
U являє собою -CF3, -CHF2 або -CH2F;
Q являє собою кисень, сірку, N-R4 або ковалентний зв'язок;
Z являє собою хінолініл, ізохінолініл, цинолініл, хіназолініл, хіноксалініл, фталазиніл, нафтиридиніл, піридопіримідиніл або птеридиніл, усі ці групи зв'язані з рештою молекули через атом вуглецю, і будь-яка з цих груп може бути необов'язково заміщеною одним або більше замісниками, незалежно вибраними з фторо, хлоро, бромо, ціано, нітро, метилу, ізопропілу, трифторметилу, гідрокси, оксо, метокси, дифторметокси, трифторметокси, метилтіо, метилсульфінілу, метилсульфонілу, аміно, метиламіно, трет-бутиламіно, диметиламіно, феніламіно, метоксибензиламіно, ацетиламіно, метоксикарбоніламіно, метилсульфоніламіно, формілу, ацетилу, циклопропілкарбонілу, азетидинілкарбонілу, N-метилазетидинілкарбонілу, піролідинілкарбонілу, N-метилпіролідинілкарбонілу, піперидинілкарбонілу, N-метилпіперидинілкарбонілу, піперазинілкарбонілу, N-метилпіперазинілкарбонілу, морфолінілкарбонілу, карбокси, метоксикарбонілу, амінокарбонілу, метиламінокарбонілу, диметиламінокарбонілу, аміносульфонілу, метиламіносульфонілу і диметиламіносульфонілу;
М являє собою феніл, піроліл, фурил, тієніл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піразоліл, триазоліл, оксадіазоліл, тіадіазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, тетразоліл або триазиніл, будь-яка з цих груп може бути необов'язково заміщеною одним або більше замісниками, вибраними з фторо, хлоро, бромо, ціано, нітро, метилу, етилу, ізопропілу, трифторметилу, гідрокси, метокси, ізопропокси, дифторметокси, трифторметокси, метилтіо, метилсульфінілу, метилсульфонілу, аміно, метиламіно, диметиламіно, ацетиламіно, метоксикарбоніламіно, метилсульфоніламіно, формілу, ацетилу, карбокси, метоксикарбонілу, амінокарбонілу, метиламінокарбонілу, диметиламінокарбонілу, аміносульфонілу, метиламіносульфонілу, диметиламіносульфонілу, циклопропілу, азетидинілу, N-метилазетидинілу, тетрагідрофуранілу, піролідинілу, N-метилпіролідинілу, імідазолідинілу, N-метилімідазолідинілу, тетрагідропіранілу, піперидинілу, N-метилпіперидинілу, піперазинілу, N-метилпіперазинілу, морфолінілу, тіоморфолінілу, фенілу, піролілу, фурилу, тієнілу, імідазолілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піразолілу, триазолілу, оксадіазолілу, тіадіазолілу, піридинілу, піримідинілу, піридазинілу, піразинілу, тетразолілу і триазинілу;
W являє собою C-R5 або N;
R1, R2 і R3 незалежно являють собою водень, галоген, ціано, нітро, С1-6алкіл, трифторметил, С3-7циклоалкіл(С1-6)алкіл, С3-7гетероциклоалкіл(С1-6)алкіл, арил(С1-6)алкіл, гетероарил(С1-6)алкіл, гідрокси, С1-6алкокси, дифторметокси, трифторметокси, С1-6алкілтіо, С1-6алкілсульфініл, С1-6алкілсульфоніл, аміно, С1-6алкіламіно, ді(С1-6)алкіламіно, С2-6алкілкарбоніламіно, С2-6алкоксикарбоніламіно, С1-6алкілсульфоніламіно, форміл, С2-6алкілкарбоніл, карбокси, С2-6алкоксикарбоніл, амінокарбоніл, С1-6алкіламінокарбоніл, ді(С1-6)алкіламінокарбоніл, аміносульфоніл, С1-6алкіламіносульфоніл або ді(С1-6)алкіламіносульфоніл;
R4 являє собою водень або С1-6алкіл; і
R5 являє собою водень, галоген, С1-6алкіл або С1-6алкокси.
2. Сполука формули (І) за пунктом 1 або її фармацевтично прийнятна сіль або сольват, де сполукою є N-оксидне похідне.
3. Сполука за пунктом 1 або 2, в якій U являє собою -CF3.
4. Сполука за пунктом 3, в якій атом вуглецю, до якого безпосередньо приєднані фрагменти -Q-Z і -CF3, знаходиться в (R)-конфігурації.
5. Сполука за будь-яким з попередніх пунктів, в якій Q являє собою N-R4.
6. Сполука за пунктом 5, в якій R4 являє собою водень або метил.
7. Сполука за будь-яким з попередніх пунктів, в якій Z являє собою хінолініл, ізохінолініл, цинолініл, хіназолініл, хіноксалініл, фталазиніл, нафтиридиніл, піридопіримідиніл або птеридиніл, усі ці групи зв'язані з рештою молекули через атом вуглецю, і будь-яка з цих груп може бути необов'язково заміщеною одним або більше замісниками, незалежно вибраними з галогену, ціано, нітро, С1-6алкілу, трифторметилу, гідрокси, оксо, С1-6алкокси, дифторметокси, трифторметокси, С1-6алкілтіо, С1-6алкілсульфінілу, С1-6алкілсульфонілу, аміно, С1-6алкіламіно, ді(С1-6)алкіламіно, ариламіно, С1-6алкоксіарил(С1-6)алкіламіно, С2-6алкілкарбоніламіно, С2-6алкоксикарбоніламіно, С1-6алкілсульфоніламіно, формілу, С2-6алкілкарбонілу, С3-6циклоалкілкарбонілу, С3-6гетероциклоалкілкарбонілу, (С1-6)алкіл(С3-6)гетероциклоалкілкарбонілу, карбокси, С2-6алкоксикарбонілу, амінокарбонілу, С1-6алкіламінокарбонілу, ді(С1-6)алкіламінокарбонілу, аміносульфонілу, С1-6алкіламіносульфонілу і ді(С1-6)алкіламіносульфонілу.
8. Сполука за пунктом 7, в якій Z являє собою піридо[3,2-d]піримідин-4-іл.
9. Сполука за будь-яким з попередніх пунктів, в якій М являє собою феніл, піроліл, фурил, тієніл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піразоліл, триазоліл, оксадіазоліл, тіадіазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, тетразоліл або триазиніл, будь-яка з цих груп може бути необов'язково заміщеною одним або більше замісниками, вибраними з галогену, ціано, нітро, С1-6алкілу, трифторметилу, гідрокси, С1-6алкокси, дифторметокси, трифторметокси, С1-6алкілтіо, С1-6алкілсульфінілу, С1-6алкілсульфонілу, аміно, С1-6алкіламіно, ді(С1-6)алкіламіно, С2-6алкілкарбоніламіно, С2-6алкоксикарбоніламіно, С1-6алкілсульфоніламіно, формілу, С2-6алкілкарбонілу, карбокси, С2-6алкоксикарбонілу, амінокарбонілу, С1-6алкіламінокарбонілу, ді(С1-6)алкіламінокарбонілу, аміносульфонілу, С1-6алкіламіносульфонілу, ді(С1-6)алкіламіносульфонілу, С3-7циклоалкілу, С3-6гетероциклоалкілу, (С1-6)алкіл(С3-6)гетероциклоалкілу, моноциклічного арилу і моноциклічного гетероарилу.
10. Сполука за пунктом 9, в якій М являє собою феніл, піридиніл або піразиніл, будь-яка з цих груп може бути необов'язково заміщеною одним або більше замісниками, вибраними з галогену, С1-6алкілу і С1-6алкокси.
11. Сполука за пунктом 10, в якій М являє собою піридиніл.
12. Сполука за пунктом 10, в якій М являє собою метилпіридиніл.
13. Сполука за будь-яким з попередніх пунктів, в якій W являє собою C-R5.
14. Сполука за пунктом 13, в якій R5 являє собою водень.
15. Сполука за будь-яким з попередніх пунктів, в якій R3 являє собою водень.
16. Сполука за пунктом 1, яка представлена формулою (IIА), або її фармацевтично прийнятна сіль або сольват:
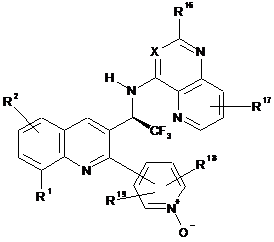 , (IIА)
, (IIА)
в якій R1 і R2 є такими, як визначено в пункті 1;
X являє собою N або СН;
R16 і R17 незалежно являють собою водень, галоген, ціано, С1-6алкіл, трифторметил, аміно, С1-6алкіламіно або ді(С1-6)алкіламіно; і
R18 і R19 незалежно являють собою водень, галоген, ціано, С1-6алкіл, трифторметил або амінокарбоніл.
17. Сполука за пунктом 16, в якій R19 являє собою водень.
18. Сполука за пунктом 17, яка представлена формулою (IIВ), або її фармацевтично прийнятна сіль або сольват:
 , (IIB)
, (IIB)
в якій R1 і R2 є такими, як визначено в пункті 1; і
X, R16, R17 і R18 є такими, як визначено в пункті 16.
19. Сполука за будь-яким з пунктів 16-18, в якій X являє собою N.
20. Сполука за будь-яким з пунктів 16-19, в якій R16 являє собою водень.
21. Сполука за будь-яким з пунктів 16-20, в якій R17 являє собою водень.
22. Сполука за будь-яким з пунктів 16-21, в якій R18 являє собою водень або С1-6алкіл.
23. Сполука за пунктом 22, в якій R18 являє собою водень.
24. Сполука за пунктом 22, в якій R18 являє собою метил.
25. Сполука за будь-яким з попередніх пунктів, в якій R1 являє собою водень, галоген, С1-6алкіл, трифторметил або С1-6алкілсульфоніл.
26. Сполука за пунктом 25, в якій R1 являє собою хлоро.
27. Сполука за пунктом 25, в якій R1 являє собою трифторметил.
28. Сполука за будь-яким з попередніх пунктів, в якій R2 являє собою водень, галоген або С1-6алкіл.
29. Сполука за пунктом 28, в якій R2 являє собою водень.
30. Сполука формули (І) за пунктом 1, яка вибрана з групи:
N-{(R)-1-[8-хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]-піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]-піримідин-4-іламіну,
N-[(R)-1-(8-хлор-2-фенілхінолін-3-іл)-2,2,2-трифторетил]піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(4-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(4-метил-1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(2-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(2-метил-1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(5-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(5-метил-1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(піразин-2-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(6-метоксипіразин-2-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(6-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[8-хлор-2-(6-метил-1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[8-метил-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[8-метил-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[7-фтор-8-метил-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[7-фтор-8-метил-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[7-фтор-8-метил-2-(2-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[7-фтор-8-метил-2-(2-метил-1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[7-фтор-8-метил-2-(5-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[7-фтор-8-метил-2-(5-метил-1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[2-(піридин-3-іл)-8-(трифторметил)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[2-(1-оксипіридин-3-іл)-8-(трифторметил)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[2-(6-метилпіридин-3-іл)-5,6,8-трифторхінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[2-(6-метил-1-оксипіридин-3-іл)-5,6,8-трифторхінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[8-хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}-N-метилпіридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[8-хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}-N-(1-оксипіридо[3,2-d]піримідин-4-іл)аміну,
N-{(R)-1-[8-хлор-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}-N-(1-оксипіридо[3,2-d]піримідин-4-іл)аміну,
N-{(S)-1-[8-хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(S)-1-[8-хлор-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[8-хлор-2-(6-хлорпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіну,
N-{(R)-1-[2-(2-метил-1-оксипіридин-3-іл)-8-(трифторметил)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[8-(метансульфоніл)-2-(2-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну,
N-{(R)-1-[8-(метансульфоніл)-2-(2-метил-1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну або
N-{(R)-1-[8-(метансульфоніл)-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-аміну.
31. Сполука формули (І) за пунктом 1 або її N-оксид, або її фармацевтично прийнятна сіль або сольват, яка призначена для використання в лікуванні та/або профілактиці розладу, для якого є показаним введення селективного інгібітора РІ3K.
32. Сполука формули (І) за пунктом 1 або її N-оксид, або її фармацевтично прийнятна сіль або сольват, яка призначена для застосування для одержання медикаменту для лікування та/або профілактики розладу, для якого є показаним введення селективного інгібітора РІ3K.
33. Сполука за пунктом 30, яка є N-{(R)-1-[8-хлор-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламіном.
34. Сполука за пунктом 33, яка призначена для застосування в лікуванні та/або профілактиці запального, автоімунного, серцево-судинного, нейродегенеративного, метаболічного, онкологічного, ноцицептивного або офтальмологічного стану.
35. Сполука за пунктом 30, яка призначена для застосування для одержання медикаменту для лікування та/або профілактики запального, автоімунного, серцево-судинного, нейродегенеративного, метаболічного, онкологічного, ноцицептивного або офтальмологічного стану.
36. Фармацевтична композиція, яка містить сполуку формули (І), як визначено в пункті 1, або її N-оксид, або її фармацевтично прийнятну сіль або сольват у поєднанні з фармацевтично прийнятним носієм.
37. Фармацевтична композиція, яка містить N-{(R)-1-[8-хлор-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}піридо[3,2-d]піримідин-4-іламін в поєднанні з фармацевтично прийнятним носієм.
Текст
Реферат: Серія похідних хіноліну і хіноксаліну, що містять бічний ланцюг фторованого етилу і є селективними інгібіторами ферментів кінази РІ3 і, завдяки цьому, є корисними в медицині, наприклад в лікуванні запальних, автоімунних, серцево-судинних, нейродегенеративних, метаболічних, онкологічних, ноцицептивних або офтальмологічних станів. Q-Z 3 R W U 2 R N 1 R (I) M UA 109153 C2 (12) UA 109153 C2 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується класу похідних хіноліну і хіноксаліну та їх застосування в терапії. Більш конкретно, даний винахід пропонує похідні хіноліну і хіноксаліну, які містять бічний ланцюг фторованого етилу. Ці сполуки є селективними інгібіторами ферментів фосфоінозитид 3-кінази (PI3K) і, відповідно, є корисними як фармацевтичні агенти, зокрема в лікуванні небажаних запальних, автоімунних, серцево-судинних, нейродегенеративних, метаболічних, онкологічних, ноціцептивних і офтальмологічних станів. Провідний шлях PI3K є причетним до широкого кола фізіологічних і патологічних функцій, які вважаються задіяними в різноманітних хворобах людини. Так, PI3K забезпечують критичний сигнал для проліферації клітин, виживання клітин, перенесення мембран, транспорту глюкози, розростання нейритів, активних переміщень в мембрані клітини, продукції супероксиду, реорганізації актину і хемотаксису (cf. S. Ward et al., Chemistry & Biology, 2003, 10, 207-213; і S.G. Ward & P. Finan, Current Opinion in Pharmacology, 2003, 3, 426-434); і відомо, що вони задіяні в патології раку, а також в метаболічних, запальних і серцево-судинних хворобах (cf. M.P. Wymann et al., Trends in Pharmacol. Sci., 2003, 24, 366-376). Змінена позитивна регуляція провідного шляху PI3K є задіяною в широкому спектрі різновидів раку (cf. S. Brader & S.A. Eccles, Tumori, 2004, 90, 2-8). Сполуки згідно даного винаходу, як сильні і селективні інгібітори PI3K, є корисними в лікуванні та/або попередженні різних нездужань у людини. Вони включають автоімунні і запальні розлади, такі як ревматоїдний артрит, розсіяний склероз, астму, запальну хворобу кишечнику, псоріаз і відторгнення трансплантату; серцево-судинні розлади, включаючи тромбоз, гіпертрофію серця, гіпертензію і неправильну скорочувальну здатність серця (наприклад, під час серцевої недостатності); нейродегенеративні розлади, такі як хвороба Альцгеймера, хвороба Паркінсона, хвороба Хантінгтона, інсульт, аміотрофічний латеральний склероз, травма спинного мозку, травма голови і припадки; метаболічні розлади, такі як ожиріння і діабет 2 типу; онкологічні стани, включаючи лейкемію, гліобластому, лімфому, меланому, а також рак печінки, кісток, шкіри, головного мозку, підшлункової залози, легені, молочної залози, шлунку, товстої кишки, прямої кишки, передміхурової залози, яєчника і шийки матки; біль і ноціцептивні розлади; а також офтальмологічні розлади, включаючи вікову макулярну дегенерацію (ARMD). Крім цього, сполуки згідно даного винаходу можуть бути корисними як фармакологічні стандарти для використання при розробці нових біологічних тестів і в пошуку нових фармакологічних агентів. Так, сполуки за цим винаходом можуть використовуватись як радіоліганди в аналізах, метою яких є виявлення сполук, здатних зв'язуватись з ферментами PI3K людини. WO 2008/118454, WO 2008/118455 і WO 2008/118468 описують різні серії похідних хіноліну і хіноксаліну, які є структурно спорідненими між собою і які, як стверджується, є корисними для пригнічення біологічної активності PI3Kδ людини і застосовуються в лікуванні опосередкованих PI3K станів і розладів. WO 2009/081105, WO 2010/046639 і WO 2011/058108, що розглядається одночасно (заявлений пріоритет від патентних заявок Великої Британії 0919829.2 і 1012102.8), опубліковані 19 травня 2011 року, описують окремі класи похідних зшитого біциклічного гетероарилу в якості селективних інгібіторів ферментів PI3K, що є корисними в лікуванні несприятливих запальних, автоімунних, серцево-судинних, нейродегенеративних, метаболічних, онкологічних, ноціцептивних і офтальмологічних станів. Однак жодна з попередніх публікацій не розкриває і не припускає точного структурного класу похідних хіноліну і хіноксаліну, що містять бічний ланцюг фторованого етилу, як передбачено даним винаходом. Сполуки за цим винаходом є сильними і селективними інгібіторами PI3K, які мають афінність до зв'язування (ІС50) з ізоформами PI3Kα та/або PI3Kβ та/або PI3Kγ та/або PI3Kδ людини 50 мкМ або менше, загалом 20 мкМ або менше, звичайно 5 мкМ або менше, типово 1 мкМ або менше, принагідно 500 нМ або менше, ідеально 100 нМ або менше, а краще 20 нМ або менше (спеціаліст в цій галузі оцінить, що нижча цифра ІС 50 означає більш активну сполуку). Сполуки за цим винаходом можуть володіти щонайменше 10-кратною селективною афінністю, типово щонайменше 20-кратною селективною афінністю, принагідно щонайменше 50-кратною селективною афінністю, а ідеально щонайменше 100-кратною селективною афінністю до ізоформ PI3Kα та/або PI3Kβ та/або PI3Kγ та/або PI3Kδ людини по відношенню до інших кіназ людини. Сполуки за цим винаходом володіють помітними перевагами з точки зору їх високої потенції і селективності, демонструють ефективність і цінні фармакокінетичні властивості (включаючи кліренс і біоактивність). 1 UA 109153 C2 Даний винахід пропонує сполуку формули (І) або її N-оксид, або її фармацевтично прийнятну сіль або сольват: R Q-Z 3 W R U 2 N R M 1 (I) 5 10 15 20 25 30 35 40 45 50 , де U представляє собою -CF3, -CHF2 або -CH2F; 4 Q представляє собою кисень, сірку, N-R або ковалентний зв'язок; Z представляє собою необов'язково заміщену біциклічну гетероарильну частину, яка складається з двох зшитих 6-членних ароматичних кілець, гетероарильна частина Z містить щонайменше один атом азоту і зв'язана з рештою молекули через атом вуглецю; M представляє собою арил або гетероарил, кожний з яких може бути необов'язково заміщеним одним або більше заміщеннями; 5 W представляє собою C-R або N; 1 2 3 R , R і R незалежно представляють собою водень, галоген, ціано, нітро, C 1-6 алкіл, трифторметил, C3-7 циклоалкіл(C1-6)алкіл, C3-7 гетероциклоалкіл(C1-6)алкіл, арил(C1-6)-алкіл, гетероарил(C1-6)алкіл, гідрокси, C1-6 алкокси, дифторметокси, трифторметокси, C1-6 алкілтіо, C1-6 алкілсульфініл, C1-6 алкілсульфоніл, аміно, C1-6 алкіламіно, ди(C1-6)алкіл-аміно, C2-6 алкілкарбоніламіно, C2-6 алкоксикарбоніламіно, C1-6 алкілсульфоніламіно, форміл, C2-6 алкілкарбоніл, карбокси, C2-6 алкоксикарбоніл, амінокарбоніл, C1-6 алкіламінокарбоніл, ди(C1аміносульфоніл, C1-6 алкіламіно-сульфоніл або ди(C16)алкіламінокарбоніл, 6)алкіламіносульфоніл; 4 R представляє собою водень або C1-6 алкіл; і 5 R представляє собою водень, галоген, C1-6 алкіл або C1-6 алкокси. Коли стверджується, що будь-яка з груп в сполуках формули (І) є необов'язково заміщеною, ця група може бути незаміщеною або заміщеною одним або більше заміщеннями. Типово, такі групи будуть незаміщеними або заміщеними одним або двома заміщеннями. Для використання в медицині сполуки формули (І) будуть фармацевтично прийнятними солями. Інші солі можуть, однак, застосовуватись в приготуванні сполук за цим винаходом або їх фармацевтично прийнятних солей. Придатні фармацевтично прийнятні солі сполук за цим винаходом включають солі приєднання кислоти, які можуть, наприклад, утворюватись при змішуванні розчину сполуки за цим винаходом з розчином фармацевтично прийнятної кислоти, такої як соляна кислота, сірчана кислота, метансульфонова кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота або фосфорна кислота. Більше того, коли сполуки за цим винаходом несуть кислотну функціональну групу, наприклад карбокси, їх придатні фармацевтично прийнятні солі можуть включати солі лужних металів, наприклад солі натрію або калію, солі лужноземельних металів, наприклад солі кальцію або магнію; і солі, утворені з придатними органічними лігандами, наприклад четвертинні солі амонію. Даний винахід включає в свій об'єм сольвати сполук формули (І), наведеної вище. Такі сольвати можуть утворюватись зі звичайними органічними розчинниками, наприклад вуглеводневими розчинниками, такими як бензол або толуол; хлорованими розчинниками, такими як хлороформ або дихлорметан; спиртовими розчинниками, такими як метиловий спирт, етиловий спирт або ізопропанол; простими ефірними розчинниками, такими як діетиловий ефір або тетрагідрофуран; або складними ефірними розчинниками, такими як етилацетат. Як варіант, сольвати сполук формули (І) можуть утворюватись з водою, у випадку чого вони будуть гідратами. Придатні алкільні групи, які можуть бути присутніми на сполуках за цим винаходом, включають лінійні і розгалужені групи C1-6 алкілу, наприклад групи C1-4 алкілу. Типові приклади включають метильну і етильну групи, а також лінійні або розгалужені групи пропилу, бутилу і пентилу. Конкретні алкільні групи включають метил, етил, n-пропил, ізопропил, n-бутил, secбутил, ізобутил, tert-бутил, 2,2-диметилпропил і 3-метилбутил. Похідні вирази, такі як "C1-6 2 UA 109153 C2 5 10 15 20 25 30 алкокси", "C1-6 алкілтіо", "C1-6 алкілсульфоніл" і "C1-6 алкіламіно", слід розглядати відповідним чином. Конкретними C3-7 циклоалкільними групами є циклопропил, циклобутил, циклопентил, циклогексил і циклогептил. Придатні арильні групи включають феніл і нафтил, краще феніл. Придатні арил(C1-6)алкільні групи включають бензил, фенілетил, фенілпропил і нафтилметил. Придатні гетероциклоалкільні групи, які можуть включати їх бензо-зшиті аналоги, включають азетидиніл, тетрагідрофураніл, дигідробензофураніл, піролідиніл, індолініл, тіазолідиніл, імідазолідиніл, тетрагідропіраніл, хроманіл, піперидиніл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4тетрагідроізохінолініл, піперазиніл, 1,2,3,4-тетрагідро-хіноксалініл, гомопіперазиніл, морфолініл, бензоксазиніл і тіоморфолініл. Придатні гетероарильні групи включають фурил, бензофурил, дибензофурил, тієніл, бензотієніл, дибензотієніл, піроліл, індоліл, піроло[2,3-b]піридиніл, піроло[3,2-c]піридиніл, піразоліл, піразоло[1,5-a]піридиніл, піразоло[3,4-d]піримідиніл, індазоліл, оксазоліл, бензоксазоліл, ізоксазоліл, тіазоліл, бензотіазоліл, ізотіазоліл, імідазоліл, бензімідазоліл, імідазо[1,2-a]піридиніл, імідазо[4,5-b]піридиніл, пуриніл, імідазо[1,2-a]піримідиніл, імідазо[1,2a]піразиніл, оксадіазоліл, тіадіазоліл, триазоліл, бензотриазоліл, тетразоліл, піридиніл, хінолініл, ізохінолініл, нафтирідиніл, піридазиніл, цинолініл, фталазиніл, піримідиніл, хіназолініл, піразиніл, хіноксалініл, птерідиніл, триазиніл і хроменіл. Термін "галоген", як він тут використовується, включає атоми фтору, хлору, брому і йоду, типово фтору, хлору або брому. Коли сполуки формули (I) мають один або більше асиметричних центрів, вони можуть відповідно існувати як енантіомери. Коли сполуки за цим винаходом володіють двома або більше асиметричними центрами, вони можуть додатково існувати як діастереомери. Має бути зрозумілим, що даний винахід поширюється на всі такі енантіомери і діастереомери, а також на їх суміші в будь-якому співвідношенні, включаючи рацемати. Формула (I) і формули, наведені далі, представляють всі індивідуальні стереоізомери і всі можливі їх суміші, якщо не вказано або не показано інше. Крім того, сполуки формули (I) можуть існувати як таутомери, наприклад кето (CH2C=O)↔енол (CH=CHOH) таутомери або амід (NHC=O)↔гідроксиімін (N=COH) таутомери. Формула (I) і формули, наведені далі, представляють всі індивідуальні таутомери і всі можливі їх суміші, якщо не вказано або не показано інше. Переважно, абсолютна стереохімічна конфігурація сполук формули (I) буде такою, як зображена у формулі (I-1): R Q-Z 3 W R N R 35 40 45 50 U 2 M 1 (I-1) , 1 2 3 де U, Q, Z, M, W, R , R і R є такими, як було визначено раніше. В одному вибраному варіанті здійснення, де U представляє собою -CF3, конкретні сполуки формули (I), як їх було визначено вище, включають ті, в яких атом вуглецю, до якого безпосередньо приєднаними є фрагменти -Q-Z і -CF3, знаходяться в (R) конфігурації. Має бути зрозумілим, що кожний індивідуальний атом, присутній у формулі (I) або у формулах, наведених далі, може в дійсності бути присутнім у формі будь-якого зі своїх природних ізотопів, причому перевага віддається найбільш поширеним ізотопам. Так, тільки для прикладу, кожний індивідуальний атом водню, присутній у формулі (I) або у формулах, 1 2 3 1 наведених далі, може бути присутнім як атом H, H (дейтерій) або H (тритій), переважно H. Подібним чином, тільки для прикладу, кожний індивідуальний атом вуглецю, присутній у 12 13 14 формулі (I) або у формулах, наведених далі, може бути присутнім як атом C, C або C, 12 переважно C. В одному конкретному варіанті здійснення U представляє собою -CF3. В іншому варіанті здійснення U представляє собою -CHF2. В подальшому варіанті здійснення U представляє собою -CH2F. 3 UA 109153 C2 5 В одному варіанті здійснення W представляє собою C-R . В іншому варіанті здійснення W представляє собою N. Конкретні підкласи сполук у відповідності до даного винаходу представлені сполуками формул (IA) і (IB), особливо (IA): R R 3 R 5 Q-Z U 2 M N R 5 1 R Q-Z 3 N R U 2 N R (IA) (IB) M 1 , 1 2 3 5 де U, Q, Z, M, R , R , R і R є такими, як було визначено раніше. Переважно, абсолютна стереохімічна конфігурація сполук формули (IA), наведеної вище, буде такою, як зображено формулою (IA-1): R R 3 R 5 U 2 N R 10 Q-Z M 1 (IA-1) , 1 2 3 5 де U, Q, Z, M, R , R , R і R є такими, як було визначено раніше. Переважно, абсолютна стереохімічна конфігурація сполук формули (IB), наведеної вище, буде такою, як зображено формулою (IB-1): R Q-Z 3 N R U 2 N R M 1 (IB-1) 15 20 25 , 1 2 3 де U, Q, Z, M, R , R і R є такими, як було визначено раніше. В одному вибраному варіанті здійснення, де U представляє собою -CF3, конкретні сполуки формул (IA) і (IB), як їх було визначено вище, включають ті, в яких атом вуглецю, до якого безпосередньо приєднані фрагменти -Q-Z і -CF3, знаходиться в (R) конфігурації. У відповідності до одного аспекту цього винаходу, Q представляє собою кисень, сірку або N4 R. 4 Придатні значення Q включають кисень і N-R . В одному варіанті здійснення Q представляє собою кисень. В іншому варіанті здійснення Q 4 представляє собою сірку. В одному конкретному варіанті здійснення Q представляє собою N-R . В подальшому варіанті здійснення Q представляє собою ковалентний зв'язок. Загалом, біциклічний гетероарильний фрагмент Z містить один, два, три або чотири атоми 4 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 азоту і жодних інших гетероатомів. Типово, Z містить два, три або чотири атоми азоту. Принагідно, Z містить два або три атоми азоту. В одному варіанті здійснення Z містить один атом азоту. В іншому варіанті здійснення Z містить два атоми азоту. В одному конкретному варіанті здійснення Z містить три атоми азоту. В подальшому варіанті здійснення Z містить чотири атоми азоту. Типові групи для гетероарильного фрагменту Z включають хінолініл, ізохінолініл, цинолініл, хіназолініл, хіноксалініл, фталазиніл, нафтиридиніл, піридо-піримідиніл і птерідиніл і будь-яка з цих груп може бути необов'язково заміщеною одним або більше заміщеннями. В одному варіанті здійснення Z представляє собою необов'язково заміщений піридопіримідиніл. В одному аспекті цього варіанту здійснення Z представляє собою необов'язково заміщений піридопіримідин-4-іл. В іншому аспекті цього варіанту здійснення Z представляє собою необов'язково заміщений піридо[3,2-d]-піримідиніл. В більш точному аспекті цього варіанту здійснення Z представляє собою необов'язково заміщений піридо[3,2-d]піримідин-4-іл. В одному конкретному варіанті здійснення гетероарильний фрагмент Z є незаміщеним. В іншому варіанті здійснення Z є заміщеним одним або більше заміщень. В одній підгрупі цього варіанту здійснення Z є монозаміщеним. В одній підгрупі цього варіанту здійснення Z є дизаміщеним. Типові приклади необов'язкових заміщень на гетероарильному фрагменті Z включають одне або більше заміщень, незалежно вибраних з галогену, ціано, нітро, C 1-6 алкілу, трифторметилу, гідрокси, оксо, C1-6 алкокси, дифторметокси, трифторметокси, C1-6 алкілтіо, C1-6 алкілсульфінілу, C1-6 алкілсульфонілу, аміно, C1-6 алкіламіно, ди(C1-6)алкіл-аміно, ариламіно, C1-6 алкоксиарил(C16)алкіламіно, C2-6 алкілкарбоніламіно, C1-6 алкілсульфоніламіно, формілу, C2-6 алкілкарбонілу, C3циклоалкілкарбонілу, C3-6 гетероциклоалкіларбонілу, карбокси, C2-6 алкоксикарбонілу, 6 амінокарбонілу, C1-6 алкіламінокарбонілу, ди(C1-6)алкіламінокарбонілу, аміносульфонілу, C1-6 алкіламіносульфонілу і ди(C1-6)алкіламіносульфонілу. Додаткові приклади включають C2-6 алкоксикарбоніламіно і (C1-6)алкіл(C3-6)гетероциклоалкілкарбоніл. Типові приклади конкретних заміщень на Z включають фторо, хлоро, бромо, ціано, нітро, метил, ізопропил, трифторметил, гідрокси, оксо, метокси, дифторметокси, трифторметокси, метилтіо, метилсульфініл, метилсульфоніл, аміно, метиламіно, tert-бутиламіно, диметиламіно, феніламіно, метоксибензиламіно, ацетиламіно, метоксикарбоніламіно, метилсульфоніламіно, форміл, ацетил, циклопропилкарбоніл, азетидинілкарбоніл, N-метилазетидинілкарбоніл, піролідинілкарбоніл, N-метилпіролідинілкарбоніл, піперидинілкарбоніл, Nметилпіперидинілкарбоніл, піперазинілкарбоніл, N-метилпіперазинілкарбоніл, морфолінілкарбоніл, карбокси, метоксикарбоніл, амінокарбоніл, метиламінокарбоніл, диметиламінокарбоніл, аміносульфоніл, метиламіносульфоніл і диметиламіносульфоніл. Одним конкретним значенням Z є піридо[3,2-d]піримідин-4-іл. Принагідно, група M представляє собою моноциклічну арильну або гетероарильну групу, кожна з яких може бути необов'язково заміщеною одним або більше заміщень. В одному конкретному варіанті здійснення арильна або гетероарильна група M є незаміщеною. В іншому варіанті здійснення M є заміщеною одним або більше заміщень. В одній підгрупі цього варіанту здійснення M є монозаміщеною групою. В іншій підгрупі цього варіанту здійснення M є дизаміщеною групою. В подальшій підгрупі цього варіанту здійснення M є тризаміщеною групою. Типові значення для групи M включають феніл, піроліл, фурил, тієніл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піразоліл, триазоліл, оксадиазоліл, тіадиазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, тетразоліл і триазиніл, і будь-яка з цих груп може бути необов'язково заміщеною одним або більше заміщень. Вибрані значення M включають феніл, піридиніл і піразиніл, і будь-яка з цих груп може бути необов'язково заміщеною одним або більше заміщень… Типові приклади необов'язкових заміщень на арильній або гетероарильній групі M включають одне або більше заміщень, незалежно вибраних з галогену, ціано, нітро, C 1-6 алкілу, трифторметилу, гідрокси, C1-6 алкокси, дифторметокси, трифторметокси, C1-6 алкілтіо, C1-6 алкілсульфінілу, C1-6 алкілсульфонілу, аміно, C1-6 алкіламіно, ди(C1-6)алкіламіно, C2-6 алкілкарбоніламіно, C1-6 алкілсульфоніламіно, формілу, C2-6 алкілкарбонілу, карбокси, C2-6 алкоксикарбонілу, амінокарбонілу, C1-6 алкіламіно-карбонілу, ди(C1-6)алкіламінокарбонілу, аміносульфонілу, C1-6 алкіламіносульфонілу, ди(C1-6)алкіламіносульфонілу, C3-7 циклоалкілу, C36 гетероциклоалкілу, моноциклічного арилу і моноциклічного гетероарилу. Додаткові приклади включають C2-6 алкоксикарбоніламіно і (C1-6)алкіл(C3-6)гетероциклоалкіл. Вибрані приклади необов'язкових заміщень на M включають одне або більше заміщень, незалежно вибраних з галогену, C1-6 алкілу і C1-6 алкокси. 5 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 Типові приклади специфічних заміщень на M включають одне або більше заміщень, незалежно вибраних з фторо, хлоро, бромо, ціано, нітро, метилу, етилу, ізопропилу, трифторметилу, гідрокси, метокси, ізопропокси, дифторметокси, трифторметокси, метилтіо, метилсульфінілу, метилсульфонілу, аміно, метиламіно, диметиламіно, ацетиламіно, метоксикарбоніламіно, метилсульфоніламіно, формілу, ацетилу, карбокси, метоксикарбонілу, амінокарбонілу, метиламінокарбонілу, диметиламінокарбонілу, аміносульфонілу, метиламіносульфонілу, диметиламіносульфонілу, циклопропилу, азетидинілу, Nметилазетидинілу, тетрагідрофуранілу, піролідинілу, N-метилпіролідинілу, імідазолідинілу, Nметилімідазолідинілу, тетрагідропіранілу, піперідинілу, N-метилпіперідинілу, піперазинілу, Nметилпіперазинілу, морфолінілу, тіоморфолінілу, фенілу, піролілу, фурилу, тієнілу, імідазолілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піразолілу, тіазолілу, оксадіазолілу, тіадіазолілу, піридинілу, піримідинілу, піридазинілу, піразинілу, тетразолілу і триазинілу. Вибрані приклади специфічних заміщень на M включають одне або більше заміщень, незалежно вибраних з хлоро, метилу і метокси. Індивідуальні значення M включають феніл, піридиніл, хлорпіридиніл, метил-піридиніл, піразиніл і метоксипіразиніл. В одному конкретному варіанті здійснення M представляє собою піридиніл. В одному конкретному аспекті цього варіанту здійснення M представляє собою піридин-3-іл. В іншому варіанті здійснення M представляє собою метилпіридиніл. В одному конкретному аспекті цього варіанту здійснення M представляє собою 2-метилпіридин-3-іл. 1 2 3 Придатні значення R , R та/або R включають водень, галоген, C1-6 алкіл, трифторметил, арил(C1-6)алкіл, C1-6 алкокси і C1-6 алкілсульфоніл. 1 2 3 Типові значення R , R та/або R включають водень, галоген, C1-6 алкіл, трифторметил, арил(C1-6)алкіл і C1-6 алкокси. 1 2 3 Вибрані значення R , R та/або R включають водень, галоген, C1-6 алкіл, трифторметил і C16 алкілсульфоніл. 1 2 3 Принагідно, R , R і R незалежно представляють собою водень, фторо, хлоро, бромо, ціано, нітро, метил, етил, трифторметил, бензил, гідрокси, метокси, дифторметокси, трифторметокси, метилтіо, метилсульфініл, метилсульфоніл, аміно, метиламіно, диметиламіно, ацетиламіно, метоксикарбоніламіно, метилсульфоніламіно, форміл, ацетил, карбокси, метоксикарбоніл, амінокарбоніл, метиламінокарбоніл, диметиламінокарбоніл, аміносульфоніл, метиламіносульфоніл або диметиламіно-сульфоніл. 1 Принагідно, R представляє собою водень, галоген, C1-6 алкіл, трифторметил, арил(C16)алкіл, C1-6 алкокси або C1-6 алкілсульфоніл. 1 Типово, R представляє собою водень, галоген, C 1-6 алкіл, арил(C1-6)алкіл або C1-6 алкокси. 1 Вибрані значення R включають водень, галоген, C1-6 алкіл, трифторметил і C1-6 алкілсульфоніл. 1 Ілюстративні значення R включають водень, галоген і C1-6 алкіл. 1 1 В одному варіанті здійснення R представляє собою водень. В іншому варіанті здійснення R представляє собою галоген, зокрема фторо або хлоро. В одному аспекті цього варіанту 1 1 здійснення R представляє собою фторо. В іншому аспекті цього варіанту здійснення R 1 представляє собою хлоро. В подальшому варіанті здійснення R представляє собою C1-6 алкіл, 1 особливо метил або етил. В одному аспекті цього варіанту здійснення R представляє собою 1 метил. В іншому аспекті цього варіанту здійснення R представляє собою етил. В іншому 1 1 варіанті здійснення R представляє собою трифторметил. В ще іншому варіанті здійснення R 1 представляє собою арил(C1-6)алкіл, особливо бензил. В додатковому варіанті здійснення R 1 представляє собою C1-6 алкокси, особливо метокси. В іншому варіанті здійснення R 1 представляє собою C1-6 алкілсульфоніл. В одному аспекті цього варіанту здійснення R представляє собою метилсульфоніл. 2 Принагідно, R представляє собою водень, галоген або C1-6 алкіл. 2 Типово, Rпредставляє собою водень або галоген. 2 2 В одному варіанті здійснення R представляє собою водень. В іншому варіанті здійснення R представляє собою галоген, зокрема фторо або хлоро. В одному аспекті цього варіанту 2 2 здійснення R представляє собою фторо. В іншому аспекті цього варіанту здійснення R 2 представляє собою хлоро. В подальшому варіанті здійснення R представляє собою C1-6 алкіл. 2 В одному аспекті цього варіанту здійснення R представляє собою метил. 3 Принагідно, R представляє собою водень або галоген. 3 Типово, R представляє собою водень. 3 3 В одному варіанті здійснення R представляє собою водень. В іншому варіанті здійснення R 3 представляє собою галоген. В одному аспекті цього варіанту здійснення R представляє собою 6 UA 109153 C2 5 10 15 фторо. 2 3 В одному конкретному варіанті здійснення R і R обидва представляють собою водень. 4 4 В одному варіанті здійснення R представляє собою водень. В іншому варіанті здійснення R представляє собою C1-6 алкіл, особливо метил. 4 Придатні значення групи R включають водень і метил. 5 Типово, R представляє собою водень або C1-6 алкіл. 5 5 В одному варіанті здійснення R представляє собою водень. В іншому варіанті здійснення R представляє собою галоген, зокрема фторо або хлоро. В одному аспекті цього варіанту 5 5 здійснення R представляє собою фторо. В іншому аспекті цього варіанту здійснення R 5 представляє собою хлоро. В подальшому варіанті здійснення R представляє собою C1-6 алкіл, 5 особливо метил. В додатковому варіанті здійснення R представляє собою C1-6 алкокси, особливо метокси. 5 Придатні значення групи R включають водень, фторо, хлоро, бромо, метил і метокси. 5 5 Принагідно, R представляє собою водень або метил. Типово, R представляє собою водень. В одному вибраному варіанті здійснення даний винахід пропонує N-оксидне похідне сполуки формули (I), як було визначено вище, або його фармацевтично прийнятну сіль або сольват. Один підклас сполук за цим винаходом є представленим сполуками формули (IIA) та їх фармацевтично прийнятними солями і сольватами: R 16 N X H R 2 N R N CF3 R N R 17 18 1 R + N 19 O (IIA) 20 25 30 35 40 , де R і R є такими, як було визначено раніше; X представляє собою N або CH; 16 17 R і R незалежно представляють собою водень, галоген, ціано, C 1-6 алкіл, трифторметил, аміно, C1-6 алкіламіно або ди(C1-6)алкіламіно; і 18 19 R і R незалежно представляють собою водень, галоген, ціано, C1-6 алкіл, трифторметил або амінокарбоніл. В одному варіанті здійснення X – це N. В іншому варіанті здійснення X – це CH. 16 Типові значення R включають водень, флоро, хлоро, ціано, метил, етил, ізопропил, трифторметил, аміно, метиламіно, етиламіно, tert-бутиламіно і диметиламіно. 16 Конкретним значенням R є водень. 17 Типові значення R включають водень, флоро, хлоро, ціано, метил, етил, ізопропил, трифторметил, аміно, метиламіно, етиламіно, tert-бутиламіно і диметиламіно. 17 Конкретним значенням R є водень. 18 Придатні значення R включають водень і C1-6 алкіл. 18 Типові значення R включають водень, флоро, хлоро, ціано, метил, трифторметил і амінокарбоніл. 18 Вибрані значення R включають водень і метил. 18 В одному варіанті здійснення R представляє собою водень. В іншому варіанті здійснення 18 18 R представляє собою галоген. В одному аспекті цього варіанту здійснення R представляє 18 собою флоро. В іншому аспекті цього варіанту здійснення R представляє собою хлоро. В 18 18 подальшому варіанті здійснення R представляє собою ціано. В іншому варіанті здійснення R 18 представляє собою C1-6 алкіл. В одному аспекті цього варіанту здійснення R представляє 18 собою метил. В подальшому варіанті здійснення R представляє собою трифторметил. В 18 додатковому варіанті здійснення R представляє собою амінокарбоніл. 1 2 7 UA 109153 C2 19 Типові значення R включають водень, галоген, C1-6 алкіл і трифторметил. 19 Конкретним значенням R є водень. Конкретний підклас сполук формули (IIA), наведеної вище, є представленим сполуками формули (IIB) та їх фармацевтично прийнятними солями і сольватами: R 16 N X H R 2 N R N CF3 N R R 1 17 18 + N O 5 10 15 20 25 30 35 40 (IIB) , 17 18 де R , R , X, R , R і R є такими, як було визначено раніше. Конкретні нові сполуки за даним винаходом включають кожну зі сполук, приготування яких є описаним в супроводжуючих Прикладах, та їх фармацевтично прийнятні солі і сольвати. Даний винахід пропонує також фармацевтичну композицію, яка включає сполуку у відповідності до цього винаходу, як описано вище, або її фармацевтично прийнятну сіль або сольват, в поєднанні з одним або більше фармацевтично прийнятними носіями. Фармацевтичні композиції за цим винаходом можуть приймати форму, придатну для орального, букального, парентерального, назального, місцевого, офтальмологічного або ректального введення, або форму, придатну для введення шляхом інгаляції або вдування. Для орального введення фармацевтичні композиції можуть приймати форму, наприклад, таблеток, льодяників або капсул, приготовлених звичайними засобами з фармацевтично прийнятними допоміжними речовинами, такими як агенти для зв'язування (наприклад, попередньо желатинізований кукурудзяний крохмаль, полівініл піролідон або гідроксипропил метил целюлоза); наповнювачами (наприклад, лактоза, мікрокристалічна целюлоза або кальцію гідроортофосфат); лубрикантами (наприклад, магнію стеарат, тальк або кремнезем); агентами для дезінтеграції (наприклад, картопляний крохмаль або натрію гліколат); або зволожувачами (наприклад, натрію лаурил сульфат). Таблетки можуть бути покритими з використанням методів, добре відомих в цій галузі. Рідкі препарати для орального введення можуть приймати форму, наприклад, розчинів, сиропів або суспензій, або вони можуть бути представлені як сухий продукт для розчинення водою або іншим придатним розчинником перед використанням. Такі рідкі препарати можуть готуватись звичайними засобами з долученням фармацевтично прийнятних добавок, таких як агенти для суспендування, емульгатори, неводні розчинники або консерванти. Ці препарати можуть містити також буферні солі, ароматизатори, барвники або підсолоджувачі, що підійде. Препарати для орального введення можут виготовлятись так, щоб забезпечувалось контрольоване вивільнення активної сполуки. Для букального введення композиції можуть приймати форму таблеток або льодяників, приготовлених у звичайний спосіб. Сполуки формули (I) можуть призначатись для парентерального введення шляхом ін'єкції, наприклад болюсної ін'єкції, або інфузії. Препарати для ін'єкції можуть бути представленими в одиничній лікарській формі, наприклад в скляних ампулах, або в розрахованих на певну кількість доз контейнерах, наприклад скляних флаконах. Композиції для ін'єкції можуть приймати такі форми, як суспензії, розчини або емульсії в олійних або водних розчинниках, і можуть містити технологічні добавки, такі як агенти для суспендування, стабілізації, консервування та/або диспергування. Як варіант, активний інгредієнт може бути в порошковій формі для розчинення перед використанням відповідним розчинником, наприклад стерильною, вільною від пірогенів водою. Крім препаратів, описаних вище, сполуки формули (I) можуть також готуватись як препарат1 2 16 8 UA 109153 C2 5 10 15 20 25 30 35 40 депо. Такі препарати тривалої дії можуть вводитись шляхом імплантації або внутрішньом'язової ін'єкції. Для назального введення або введення шляхом інгаляції сполуки за цим винаходом можуть зручно доставлятись у формі аерозольного спрею для упаковок під тиском або небулайзеру, з застосуванням відповідного пропеленту, наприклад дихлордифторметану, фтортрихлорметану, дихлортетрафторетану, двоокису вуглецю або іншого придатного газу або суміші газів. Композиції можуть, коли бажано, знаходитись в упаковці або пристрої для роздачі, які можуть включати одну або більше одиничних лікарських форм, які містять активний інгредієнт. Така упаковка або пристрій для роздачі можуть доповнюватись інструкціями щодо введення. Для місцевого введення сполуки, використовувані в даному винаході, можуть бути зручно введені у відповідну мазь, що містить активний компонент, суспендований або розчинений в одному або більше фармацевтично прийнятних носіях. Конкретні носії включають, наприклад, мінеральну олію, рідку нафту, пропілен гліколь, поліоксиетилен, поліоксипропілен, віскемульгатор і воду. Як варіант, сполуки, використовувані в даному винаході, можуть вводитись у відповідний лосьйон, що містить активний компонент, суспендований або розчинений в одному або більше фармацевтично прийнятних носіях. Конкретні носії включають, наприклад, мінеральну олію, сорбітан моностеарат, полісорбат 60, віск цетилових ефірів, цетеариловий спирт, бензиловий спирт, 2-октилдодеканол і воду. Для офтальмологічного введення сполукам, використовуваним в даному винаході, може надаватись форма тонкодисперсних суспензій в ізотонічному, з відрегульованим pH стерильному сольовому розчині, без консерванту або з консервантом, таким як бактерицидний або фунгіцидний агент, наприклад нітрат фенілртуті, бензилалконію хлорид або хлоргексидин ацетат. Як варіант, для офтальмологічного введення сполуки можуть вводитись в мазь, таку як вазелін. Для ректального введення сполукам, використовуваним в даному винаході, може надаватись форма супозиторіїв. Вони можуть готуватись змішуванням активного компонента з придатною неподразнюючою допоміжною речовиною, яка є твердою при кімнатній температурі, але рідкою при ректальній температурі, так що вона буде плавитись в прямій кишці з вивільненням активного компонента. Такі матеріали включають, наприклад, масло какао, бджолиний віск і поліетилен гліколі. Кількість сполуки за цим винаходом, необхідна для профілактики або лікування якогось конкретного стану, буде коливатись в залежності від вибраної сполуки і стану пацієнта, який лікується. Загалом, однак, добові дози можуть встановлюватись в межах від приблизно 10 нг/кг до 1000 мг/кг, типово від 100 нг/кг до 100 мг/кг, наприклад від близько 0,01 мг/кг до 40 мг/кг маси тіла, для орального або букального введення, від близько 10 нг/кг до 50 мг/кг маси тіла для парентерального введення і від близько 0,05 мг до близько 1000 мг, наприклад від близько 0,5 мг до близько 1000 мг для назального введення або введення шляхом інгаляції або вдування. 4 Сполуки формули (I), наведеної вище, де Q представляє собою кисень, сірку або N-R , 1 можуть бути одержані з використанням процесу, який включає реакцію сполуки формули L -Z зі сполукою формули (III): R 1 Q -H 3 W R U 2 N R M 1 (III) , 4 1 де Q представляє собою кисень, сірку або N-R , L представляє собою відповідну 1 2 3 4 заміщувану групу, а U, Z, M, W, R , R , R і R є такими, як було визначено раніше. 1 Заміщуваною групою L типово є атом галогену, наприклад хлоро. Як варіант, заміщуваною 1 групою L може бути 2,5-диоксопіролідин-1-ілокси. Ця реакція звичайно здійснюється при підвищеній температурі у відповідному розчиннику, наприклад в хлорованому розчиннику, такому як дихлорметан або хлороформ, або в вітрильному розчиннику, такому як ацетонітрил. Необов'язково, ця реакція може здійснюватись в присутності промотору реакції, такого як 4-(диметиламіно)піридин або p-толуолсульфонова кислота. Як варіант, реакція може здійснюватись при підвищенні температури у відповідному 1 45 50 9 UA 109153 C2 5 розчиннику, наприклад тетрагідрофурані, n-бутанолі, 1-метил-2-піролідиноні (NMP) або 1,4діоксані, типово в присутності відповідної основи, наприклад органічної основи, такої як N, Nдиізопропилетиламін. 1 Проміжні продукти формули (III), де Q представляє собою NH, а U представляє собою -CF3, можуть бути приготовлені методом у три етапи, який включає: (i) обробку відповідної сполуки (IV): R 3 W N R CHO M 2 R 1 (IV) 10 , 1 2 3 де M, W, R , R і R є такими, як було визначено раніше, 2-метил-2-пропансульфінамідом в присутності титану(IV) ізопропоксиду або калію фосфату; (ii) реакцію одержаної сполуки з (трифторметил)триметилсиланом в присутності тетрабутиламонію дифтортрифенілсилікату або тетрабутиламонію ацетату; і (iii) обробку одержаної сполуки мінеральною кислотою, наприклад соляною кислотою. Проміжні продукти формули (IV) можуть бути приготовлені шляхом реакції сполуки формули 1 M-T зі сполукою формули (V): R 3 W N R R 15 20 25 CHO L 2 2 1 (V) , 1 де L представляє собою відповідну заміщувану групу, T представляє собою фрагмент боронової кислоти -B(OH)2 або її циклічний складний ефір, утворений з органічним діолом, 1 наприклад пінаколом, 1,3-пропан-діолом або неопентилгліколем, або T представляє собою 1 1 1 2 Sn(Alk )3, де Alk – це C1-6 алкільна група, типово n-бутил, або T представляє собою -B(Alk )2, 2 1 2 3 де Alk це C1-6 алкільна група, типово етил, а M, W, R , R і R є такими, як було визначено раніше; в присутності каталізатору з перехідного металу. 2 Заміщувана група L типово є атомом галогену, наприклад хлоро. Каталізатором з перехідного металу принагідно є тетракіс (трифенілфосфін)паладій(0), у випадку чого реакція звичайно здійснюється при підвищенні температури у відповідному розчиннику, наприклад ефірному розчиннику, такому як етиленгліколь диметиловий ефір або 1,4-діоксан, типово в присутності натрію карбонату або натрію бікарбонату. Як варіант, проміжні продукти формули (IV) можуть бути приготовлені шляхом обробки сполуки формули (VI): 2 R 3 a W N R CO2R M 2 R 1 (VI) 30 , 1 2 3 де R представляє собою C1-6 алкіл, наприклад етил, а M, W, R , R і R є такими, як було визначено раніше; з відновлювальним агентом, наприклад диізобутилалюмінію гідридом (DIBAL-H); з наступною обробкою одержаної у такий спосіб сполуки окислювальним агентом, таким як диоксидом марганцю. a 10 UA 109153 C2 Проміжні продукти формули (VI), де W представляє собою CH, можуть бути приготовлені шляхом реакції сполуки формули (VII) зі сполукою формули (VIII): R 3 a CO2R Hal R 2 R HO NH2 1 (VIII) (VII) , де M, R , R , R і R є такими, як було визначено раніше, а Hal представляє собою галоген, наприклад бромо абойодо, в присутності каталізатору з перехідного металу, наприклад паладію(II) ацетату; з наступною обробкою одержаної у такий спосіб сполуки окислювальним агентом, таким як диоксид марганцю. Проміжні продукти формули (VIII) можуть бути приготовлені шляхом реакії сполуки формули M-CHO зі сполукою формули (IX): 1 5 M 2 3 a a CO2R 10 15 (IX) , a де M і R є такими, як було визначено раніше. Ця реакція звичайно здійснюється в присутності основи, ідеально органічної основи, такої як 1,4-диазабіцикло[2.2.2]октан (DABCO). У відповідності до іншого методу, проміжні продукти формули (IV), де W представляє собою CH, можуть бути приготовлені шляхом реакції сполуки формули M-CH=CH-CHO зі сполукою формули (X): R 3 CHO R 2 R NH2 1 (X) 20 25 30 35 , 1 2 3 де M, R , R і R є такими, як було визначено раніше; в присутності основи, наприклад 2,5диметилпіролідину; з наступною обробкою одержаної у такий спосіб сполуки окислювальним агентом, таким як диоксид марганцю. 1 У варіантному підході проміжні продукти формули (III), де Q представляє собою NH, а U представляє собою -CF3, можуть бути приготовлені методом у чотири етапи, який включає: (i) обробку відповідної сполуки формули (V), як визначено вище, з 2-метил-2-пропансульфінамідом в присутності титану(IV) ізопропоксиду або калію фосфату; (ii) реакцію 1 одержаної сполуки зі сполукою формули M-T в умовах, аналогічних тим, що були описані вище 1 для реакції між M-T і сполукою (V); (iii) реакцію одержаної сполуки з (трифторметил)триметилсиланом в присутності тетрабутиламонію дифтортрифеніл-силікату або тетрабутиламонію ацетату; і (iv) обробку одержаної сполуки мінеральною кислотою, наприклад соляною кислотою. Коли вони недоступні комерційно, вихідні матеріали формули (V), (VII), (IX) і (IX) можуть бути приготовлені методами, аналогічними тим, які описані в супроводжуючих Прикладах, або стандартними методами, добре відомими в цій галузі. Має бути зрозумілим, що будь-яка сполука формули (I), початково одержана з якогось з вищеописаних процесів, може згодом, коли це потрібно, може бути перетвореною на іншу сполуку формули (I) методами, відомими в цій галузі. В якості прикладу, сполука формули (I), де M представляє собою піридиніл, може бути перетворена на відповідну сполуку, де M є групою піридин-N-оксид обробкою підходящим окислювальним агентом, наприклад 3хлорпероксибензойною кислотою. Подібно до цього, сполука формули (I), де Z представляє 11 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 собою піридопіримідиніл, може перетворена на відповідну сполуку, де Z є групою піридопіримідин-N-оксид обробкою підходящим окислювальним агентом, наприклад 34 хлорпероксибензойною кислотою. Сполука формули (I), де R представляє собою водень, може 4 перетворена на відповідну сполуку, де R представляє собою C1-6 алкіл, наприклад метил, обробкою відповідним алкілуючим агентом, наприклад метилуючим агентом, таким як йодометан в присутності основи, такої як натрію гідрид. Коли в результаті будь-якого з описаних вище процесів для приготування сполук за цим винаходом отримується суміш продуктів, бажаний продукт може бути відділений від неї на відповідній стадії звичайними методами, такими як препаративна ВЕРХ; або колонкова хроматографія, із застосуванням, наприклад, кремнезему та/або глинозему в поєднанні з відповідною системою розчинників. Коли в результаті описаних вище процесів для приготування сполук за цим винаходом отримується суміш стереоізомерів, ці ізомери можуть бути розділені звичайними методами. Зокрема, коли бажано отримати конкретний енантіомер сполуки формули, (I) це можна зробити з відповідної суміші енантіомерів, використовуючи будь-яку підходящу звичайну методику для розділення енантіомерів. Так, наприклад, діастереомерні похідні, наприклад солі, можна отримати реакцією суміші енантіомерів формули (I), наприклад рацемату, і відповідної хіральної сполуки, наприклад хіральної основи. Такі діастереомери можна потім розділити звичайними засобами, наприклад кристалізацією, і відновити бажаний енантіомер, наприклад обробкою кислотою, у випадку, коли діастереомер є сіллю. В іншому процесі розділення рацемат формули (I) може бути розділений з використанням хіральної ВЕРХ. Більше того, коли бажано, конкретний енантіомер можна отримати шляхом використання відповідного хірального проміжного продукту в одному з вищеописаних процесів. Як варіант, конкретний енантіомер можна отримати, здійснивши енантіомер-специфічну ферментативну біотрансформацію, наприклад складно-ефірний гідроліз з використанням естерази, і потім очистивши тільки енантіомерно чисту гідролізовану кислоту від антиподу складного ефіру, який не прореагував. Хроматографія, рекристалізація та інші звичайні методи розділення також можуть використовуватись на проміжних або кінцевих продуктах, коли бажано отримати конкретний геометричний ізомер за цим винаходом. Під час будь-якого з вищеописаних процесів синтезу може бути необхідним та/або бажаним захистити чутливі або реакційно здатні групи на якійсь з задіяних молекул. Цього можна досягти за допомогою звичайних захисних груп, таких як ті, що описані в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; та T.W. Greene & P.G.M. Wuts, Protective rd Groups in Organic Synthesis, John Wiley & Sons, 3 edition, 1999. Захисні групи можуть видалятись на будь-якій зручній наступній стадії за допомогою методів, відомих в цій галузі. Наступні Приклади ілюструють одержання сполук за цим винаходом. Сполуки за цим винаходом сильно пригнічують активність PI3Kα та/або PI3Kβ та/або PI3Kγ та/або PI3Kδ людини. Проби на пригнічення дії ферментів Оцінку здатності сполук пригнічувати активність ліпідкінази чотирьох ізоформ (α, β, γ і δ) класу 1 PI3 було здійснено з використанням комерційно доступного гомогенного аналізу флуоресценції в часі, як описано Gray et al., Anal. Biochem., 2003, 313, 234-245, у відповідності до інструкцій виробника (Upstate). Всі аналізи здійснювались при 2 мкМ АТФ і концентрації очищеної кінази 1 PI3, відомої тим, що вона генерує продукт в межах лінійного діапазону цього аналізу. Розведення інгібітору в ДМСО додавались до проби і порівнювались з прогоном проб в присутності тільки 2 % (о/о) ДМСО (100 % активність). Концентрація інгібітору, необхідна для пригнічення активності ферменту на 50 %, наводиться як IC50. При тестуванні у вищеописаній проб було встановлено, що всі сполуки з супроводжуючих Прикладів володіють значеннями IC50, для пригнічення активності PI3Kα та/або PI3Kβ та/або PI3Kγ та/або PI3Kδ людини 50 мкМ або кращими. ПРИКЛАДИ Скорочення DCM: дихлорметан DMAP: 4-(диметиламіно)піридин EtOAc: етилацетат MeOH: метиловий спирт THF: тетрагідрофуран DME: етилен гліколь диметиловий ефір DMSO: диметилсульфоксид MCPBA: 3-хлорпероксибензойна кислота 12 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 DABCO: 1,4-диазабіцикло[2.2.2]октан DIBAL-H: диізобутилалюмінію гідрид Rochelle сіль: калію натрію тартрат DBU: 1,8-диазабіцикло[5.4.0]ундек-7-ен AcOH: оцтова кислота DMF: N, N-диметилформамід r.t.: кімнатна температура RT: час ретенції SiO2: кремнезем h: година br: широкий M: маса Pd(PPh3)4: тетракіс(трифенілфосфін)паладій(0) PyBOP: (бензотриазол-1-ілокси)трипіролідинофосфонію гексафторфосфат brine: насичений водний розчин натрію хлориду (розсол) LCMS: Рідинна хроматографія/ Мас-спектрометрія ES+: Електроспреєм позитивна іонізація ПРОМПКНИЙ ПРОДУКТ 1 8-Хлор-2-(піридин-3-іл)хінолін-3-карбальдегід Суміш 2,8-дихлорхінолін-3-карбальдегід (5,0 г; 22,2 ммоль), Na2CO3 (3,51 г; 33,2 ммоль), 3піридилборонової кислоти (2,72 г, 22.2 ммоль) в DME (60 мл) і води (30 мл) піддали дегазації шляхом барботажу N2 через неї впродовж 5 хвилин. Додали Pd(PPh3)4 (1,28 г; 1,11 ммоль) і суміш нагрівали при 90ºC впродовж 7 годин. Потім суміші дали охолонути до кімнатної температури. Осад, що утворився, відфільтрували і промили водою (5 × 50 мл) і діетиловим ефіром (5 × 50 мл), щоб отримати титульну сполуку (5,4 г, 91 %) у вигляді твердої маси жовтувато-коричневого кольору. δH (DMSO-d6) 10,15 (s, 1H), 9,15 (s, 1H), 8,94 (dd, J 2,3; 0,8 Гц, 1H), 8,77 (dd, J 4,9; 1,7 Гц, 1H), 8,31(dd, J 8,3; 1,3 Гц, 1H), 8,20-8,19 (m, 1H), 8,18-8,16 (m, 1H), + 7,75 (dd, J 7,9; 7,5 Гц, 1H), 7,62 (ddd, J 7,7; 4,9; 0,8 Гц, 1H). LCMS (ES+) 269 (M+H) , RT 1,82 хвилини. Альтернативна методика До розчину нікотинальдегіду (10,0 г; 93,4 ммоль) в етилакрилаті (20 мл, ~200 ммоль) при кімнатній температурі додали DABCO (0,5 г; 4,5 ммоль), і суміш перемішували впродовж ночі. Надлишок етилакрилату видалили in vacuo, щоб отримати неочищену тведу речовину. Її промили гексаном, щоб отримати 2-[(гідрокси)(піридин-3-іл)метил]акрилової кислоти етиловий ефір (18,5 г; 95 %) у вигляді твердої речовини майже білого кольору. δ H (CDCl3) 8,62 (d, J 1,7 Гц, 1H), 8,53 (dd, J 4,8; 1,3 Гц, 1H), 7,81 (d, J 7,9 Гц, 1H), 7,28 (s, 1H), 6,42 (s, 1H), 5,93 (s, 1H), 5,63 + (s, 1H), 4,18 (m, 2H), 3,20 (br, 1H), 1,27 (t, J 7,1 Гц, 3H). LCMS (ES+) 208,2 (M+H) . Дегазовану суміш 2-[(гідрокси)(піридин-3-іл)метил]акрилової кислоти етилового ефіру (8,2 г; 39,6 ммоль), 6-хлор-2-йодоаніліну (10,0 г; 39,5 ммоль), триетиламіну (9 мл, 122 ммоль) і паладію(II) ацетату (300 мг) в ацетонітрилі (80 мл) нагрівали при 70ºC впродовж ночі. Потім суміш охолодили до кімнатної температури і розділили між етилацетатом (200 мл) і водою (100 мл). Водний шар відділили, а органічний шар промили розсолом (50 мл), профільтрували, висушили (фазовий сепаратор) і концентрували in vacuo, щоб отримати неочищену тверду речовину. Її промили мінімальною кількістю охолодженого на льоду діетилового ефіру, щоб одержати 8-хлор-2-(піридин-3-іл)-1,4-дигідрохінолін-3-карбонової кислоти етиловий ефір (10,8 г, 87 %) у вигляді білої твердої маси. δH (CDCl3) 8,73 (m, 2H), 8,04 (m, 1H), 7,66 (dd, J 7,9; 5,5 Гц, 1H), 7,18 (m, 1H), 7,05 (m, 1H), 6,94 (m, 1H), 6,29 (s, 1H), 3,99 (m, 4H), 1,04 (t, J 7,1 Гц, 3H). LCMS + (ES+) 315,0 (M+H) . Суспензію 8-хлор-2-(піридин-3-іл)-1,4-дигідохінолін-3-карбонової кислоти етилового ефіру (10,7 г, 34 ммоль) в хлорбензолі (60 мл) обробили MnO2 (10 г), і суміш нагрівали до 60ºC впродовж 3 годин. Потім суміш профільтрували через прокладку з целіту і концентрували in vacuo. Залишок промили діетиловим ефіром, щоб отримати 8-хлор-2-(піридин-3-іл)хінолін-3карбонової кислоти етиловий ефір (8,4 г, 79 %) у вигляді білої твердої маси. δH (CDCl3) 8,96 (d, J 1,7 Гц, 1H), 8,83 (s, 1H), 8,75 (dd, J 5,0; 1,1 Гц, 1H), 8,27 (dt, J 7,9; 1,7 Гц, 1H), 8,00 (dd, J 7,5; 1,0 Гц, 1H), 7,92 (dd, J 8,2; 1,0 Гц, 1H), 7,60 (m, 2H), 4,32 (q, J 7,1 Гц, 2H), 1,24 (t, J 7,1 Гц, 3H). LCMS + (ES+) 313,2 (M+H) . До суспензії 8-хлор-2-(піридин-3-іл)хінолін-3-карбонової кислоти етилового ефіру (1,0 г; 3,2 ммоль) в толуолі при -78ºC додали краплями розчин DIBAL-H (10 мл, 1M в DCM) за 10 хвили. Суміш перемішували при цій температурі впродовж 2 годин, після чого погасили додаванням насиченого водного розчину солі Rochelle (сегнетової солі) (5 мл). Після нагрівання до кімнатної 13 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 температури додали надлишок розчину солі Rochelle (5 мл). Одержану тверду речовину відфільтрували, промили на агломераті водним розчином NaOH (2N) і водою і висушили, щоб одержати [8-хлор-2-(піридин-3-іл)хінолін-3-іл]метанол (860 мг, кількісно) у вигляді бежевої твердої речовини. δH (DMSO-d6) 8,92 (d, J 1,7 Гц, 1H), 8,73 (dd, J 4,8; 1,6 Гц, 1H), 8,61 (s, 1H), 8,17 (dt, J 7,9; 1,9 Гц, 1H), 8,09 (dd, J 8,2; 1,1 Гц, 1H), 7,97 (dd, J 7,5; 1,2 Hz, 1H), 7,63 (m, 1H), 7,58 (ddd, J 7,8; 4,8; 0,6 Гц, 1H), 5,76 (s, 1H), 5,62 (t, J 5,2 Гц, 1H), 4,68 (d, J 4,9 Гц, 2H). LCMS + (ES+) 271,0 (M+H) . Суміш [8-хлор-2-(піридин-3-іл)хінолін-3-іл]метанолу (0,6 г; 2,2 ммоль) і MnO2 (1,0 г) в хлорбензолі (30 мл) нагрівали при 70ºC впродож ночі, профільтрували через прокладку з целіту, концентрували in vacuo і промили DCM, щоб отримати титульну сполуку (510 мг, 86 %) у вигляді білої твердої речовини. ПРОМПКНИЙ ПРОДУКТ 2 2-Метилпропан-2(S)-сульфінова кислота N-[8-хлор-2-(піридин-3-іл)хінолін-3-іл]мет-(E)иліденімід Титан(IV) ізопропоксид (3,17 г; 11,2 ммоль) додали до суспензії Проміжного продукту 1 (1,5 г; 5,58 ммоль) в безводному THF (30 мл). Суміш перемішували при кімнатній температурі впродовж 10 хвилин. Додали (S)-2-метил-2-пропансульфінамід (0,74 г; 6,14 ммоль), і суміш перемішували при 50ºC 3 години. Потім реакційній суміші дали охолонути до кімнатної температури, після чого вилили на розсол (50 мл) і профільтрували через целіт, промиваючи EtOAc. Фільтрат промили розсолом, висушили (Na 2SO4) і концентрували in vacuo. Очистка за допомогою колонкової хроматографії (SiO2, 40-100 % EtOAc в гексані) дала титульну сполуку (1,88 г, 91 %) у вигляді жовтувато-коричневої твердої речовини. δH (DMSO-d6) 9,20 (s, 1H), 8,85 (d, J 1,7 Гц, 1H), 8,77 (dd, J 4,9; 1,7 Гц, 1H), 8,61 (s, 1H), 8,29 (dd, J 8,3; 1,1 Гц, 1H), 8,13 (dd, J 7,5; 1,3 Гц, 1H), 8,12-8,08 (m, 1H), 7,72 (dd, J 8,1; 7,7 Гц, 1H), 7,64 (ddd, J 7,7; 4,9; 0,8 Гц, 1H), 1,21 (s, + 9H). LCMS (ES+) 372 (M+H) , RT 2,37 хвилини. ПРОМПКНИЙ ПРОДУКТ 3 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2трифторетил}амід Суміш Проміжного продукту 2 (2,24 г; 6,03 ммоль) і тетрабутиламонію дифтортрифенілсилікату (3,58 г; 6,64 ммоль) в безводному THF (40 мл) охолодили до -40ºC. Додали (трифторметил)триметилсилан (1,03 г; 7,24 ммоль), і перемішували суміш при -40ºC впродовж 1 години. Додали насичений водний розчин амонію хлориду (5 мл), і реакційній суміші дали нагрітись до кімнатної температури. Розчинник видалили in vacuo, а залишок поділили між EtOAc і водою. Водну фазу екстрагували додатковим EtOAc, а об'єднані органічні фракції промили розсолом, потім висушили (Na2SO4) і випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 40-100 % EtOAc в гексані), щоб отримати титульну сполуку (1,78 г, 67 %) у вигляді жовтої смоли. δH (DMSO-d6) 9,02 (s, 1H), 8,80 (dd, J 4,9; 1,7 Гц, 1H), 8,78 (dd, J 2,3; 0,6 Гц, 1H), 8,15-8,09 (m, 2H), 8,04-7,99 (m, 1H), 7,77-7,71 (m, 1H), 7,67 (ddd, J + 7,9; 4,9; 0,8 Гц, 1H), 6,65 (d, J 8,5 Гц, 1H), 5,12-5,00 (m, 1H), 1,15 (s, 9H). LCMS (ES+) 442 (M+H) , RT 2,39 хвилини. ПРОМПКНИЙ ПРОДУКТ 4 (R)-1-[8-Хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 3 (1,78 г; 4,04 ммоль) в метиловому спирті (20 мл) додали 4N розчин HCl в 1,4-діоксані (4 мл, 16,0 ммоль). Суміш перемішували при кімнатній температурі 1 годину. Розчинник видалили in vacuo, а залишок розтерли з діетиловим ефіром (x 2). Потім залишок поділили між DCM і насиченим водним розчином NaHCO 3. Водну фазу екстрагували додатковим DCM, а об'єднані органічні фракції промили розсолом, потім висушили (Na 2SO4) і випаровували in vacuo, щоб отримати титульну сполуку (1,28 г, 94 %) у вигляді жовтої смоли. δH (DMSO-d6) 8,92 (s, 1H), 8,82 (d, J 2,1 Гц, 1H), 8,76 (dd, J 4,9; 1,5 Гц, 1H), 8,13-8,09 (m, 1H), 8,07+ 8,03 (m, 2H), 7,72-7,60 (m, 2H), 4,72-4,65 (m, 1H), 2,88-2,83 (m, 2H). LCMS (ES+) 338 (M+H) , RT 2.01 хвилини. ПРОМПКНИЙ ПРОДУКТ 5 8-Хлор-2-фенілхінолін-3-карбальдегід Суміш 2,8-дихлорхінолін-3-карбальдегіду (2,0 г; 8,85 ммоль), 2M водного розчину Na2CO3 (8 мл), фенілборонової кислоти (1,5 г; 12,3 ммоль) і тетракіс-(трифенілфосфін)паладію(0) (0,25 г; 0,216 ммоль) в DME (30 мл) піддали дегазації, після чого нагрівали при 110ºC впродовж 4 годин. Потім суміші дали охолонути до кімнатної температури, розвели EtOAc і промили розсолом. Органічний шар висушили (MgSO4), розчинник видалили під зниженим тиском. Одержану тверду речовину розтерли в ефірі, профільтрували, промили невеликою кількістю того ж простого ефіру, потім петролейним ефіром, і висушили, щоб отримати титульну сполуку (2,3 г, 14 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 97 %) як майже білу тверду речовину. δH (CDCl3) 10,25 (s, 1H), 8,86 (s, 1H), 7,95-8,02 (m, 2H), + 7,78-7,14 (m, 2H), 7,54-7,62 (m, 4H). LCMS (ES+) 268 (M+H) , RT 1,98 хвилини. ПРОМПКНИЙ ПРОДУКТ 6 2-Метилпропан-2(S)-сульфінової кислоти N-(8-хлор-2-фенілхінолін-3-іл)мет-(E)-іліден-амід Титану(IV) ізопропоксид (5,1 мл, 17,24 ммоль) додали при перемішуванні до розчину Проміжного продукту 5 (2,3 г; 8,6 ммоль) в безводному THF (35 мл). Суміш перемішували при кімнатній температурі впродовж 10 хвилин, після чого додали (S)-2-метил-2-пропансульфінамід (1,15 г; 9,5 ммоль) і суміш перемішували при 50ºC впродовж 5,5 годин. Нагрівання відключали і реакційну суміш продовжували перемішувати при кімнатній температурі впродовж ночі. Потім додали льодяної води, суміш перемішували 10 хвилин, розвели EtOAc і профільтрували через целіт, промиваючи EtOAc. Потім фільтрат промили розсолом, висушили (MgSO4) і концентрували in vacuo. Одержану неочищену тверду речовину розтерли з ефіром, потім профільтрували, промили ефіром і висушили, щоб отримати титульну сполуку (2,45 г, 77 %) у вигляді білої твердої речовини. δH (DMSO-d6) 9,14 (s, 1H), 8,61 (s, 1H), 8,27 (dd, J 4,9; 1,7 Гц, 1H), + 8,10 (dd, J 8,3; 1,1 Гц, 1H), 7,59-7,69 (m, 6H), 1,24 (s, 9H). LCMS (ES+) 371 (M+H) , RT 2,1 хвилини. ПРОМПКНИЙ ПРОДУКТ 7 2-Метилпропан-2(S)-сульфінової кислоти [(R)-1-(8-хлор-2-фенілхінолін-3-іл)-2,2,2трифторетил]амід Суміш Проміжного продукту 6 (2,45 г; 6,61 ммоль) і тетрабутиламонію дифтортрифенілсилікату (3.,93 г; 7,28 ммоль) в безводному THF (30 mL) охолодили до температури -70ºC. Додали краплями (трифторметил)триметилсилан (1,2 мл; 8,13 ммоль) і суміш перемішували впродовж 2 годин, дозволяючи температурі повільно підніматись. LCMS показали, що певна кількість вихідного матеріалу не прореагувала, так що суміш знову охолодили до -70ºC і додали більше (трифторметил)триметилсилану (0,5 мл; 3,39 ммоль). Суміш перемішували ще 2 години, дозволяючи температурі повільно підніматись до 0ºC. Потім додали насичений водний розчин амонію хлориду (0,5 мл) і реакційній суміші дали нагрітись до кімнатної температури. Екстракцію реакційної суміші провели двічі, використовуючи EtOAc, потім висушили (MgSO4) і видалили розчинник in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 10-60 % EtOAc в гексані), щоб отримати титульну сполуку (1,7 г, 58 %) у вигляді блідо-жовтої смоли. δH (DMSO-d6) 8,98 (s, 1H), 8,04-8,11 (m, 2H), 7,56-7,73 (m, + 6H), 6,59 (d, J 8,63 Гц, 1H), 5,09-5,75 (m, 1H), 1,16 (s, 9H). LCMS (ES+) 441 (M+H) , RT 2,06 хвилини. ПРОМПКНИЙ ПРОДУКТ 8 (R)-1-(8-Хлор-2-фенілхінолін-3-іл)-2,2,2-трифторетиламін До розчину Проміжного продукту 7 (0,75 г; 1,7 ммоль) в DCM (2 мл) додали 4N розчин HCl в 1,4-діоксані (10 мл). Суміш перемішували при кімнатній температурі 20 хвилин. Розчинник видалили in vacuo, а залишок потім поділили між DCM і насиченим водним розчином NaHCO 3. Водну фазу екстрагували додатковим DCM, а об'єднані органічні фракції висушили (MgSO 4) і випарили in vacuo, щоб отримати титульну сполуку (0,55 г, 96 %) у вигляді жовтої піни, яку було + використано без додаткової очистки. LCMS (ES+) 337 (M+H) , RT 1,99 хвилини. ПРОМПКНИЙ ПРОДУКТ 9 2-Метилпропан-2(S)-сульфінової кислоти N-(2,8-дихлорхінолін-3-іл)мет-(E)-іліденамід Калію фосфат (16 г, 75,47 ммоль) розчинили у воді (50 мл) і додали (S)-2-метил-2пропансульфінамід (10,5 г; 86,78 ммоль). Суміш перемішували 10 хвилин, після чого додали розчин 2,8-дихлорхінолін-3-карбальдегіду (17,0 г; 75,22 ммоль) в 2-пропанолі (50 мл) і реакційну суміш перемішували ще впродовж 2 днів. Тверду речовину відфільтрували, промили водою і висушили in vacuo. Одержану тверду речовину розчинили в DCM, промили розсолом і висушили (MgSO4), видаливши розчинник під зниженим тиском. Після цього тверду речовину розтерли в ефірі, профільтрували, промили ефіром і висушили, щоб отримати титульну сполуку (23,6 г, 95 %) у вигляді яскраво-жовтої твердої речовини. δH (CDCl3) 9,12 (s, 1H), 8,83 (s, 1H), 7,90 (d, J 1,9 Гц, 1H), 7,87 (d, J 8,2 Гц, 1H), 7,55 (t, J 7,9 Гц, 1H), 1,33 (s, 9H). LCMS (ES+) 330 + (M+H) , RT 1,94 хвилини. ПРОМПКНИЙ ПРОДУКТ 10 2-Метилпропан-2(S)-сульфінової кислоти N-[8-хлор-2-(4-метилпіридин-3-іл)хінолін-3-іл]-мет(E)-іліденамід Суміш Проміжного продукту 9 (5,0 г; 15,2 ммоль), 4-метилпіридин-3-ілборонової кислоти (3,15 г; 21,43 ммоль), тетракіс(трифенілфосфін)паладію(0) (0,17 г; 0,147 ммоль) і 2M водного розчину натрію бікарбонату (20 мл) в 1,4-діоксані (80 мл) піддали дегазації і нагрівали зі зворотним холодильником в атмосфері азоту впродовж 1 години. Реакційну суміш охолодили 15 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 до кімнатної температури, потім поділили між EtOAc і розсолом, і водний шар екстрагували ще раз із застосуванням EtOAc. Об'єднані органічні екстракти висушили (MgSO4), розчинник видалили під зниженим тиском. До розчину одержаного матеріалу в 2-пропанолі (10 мл) додали розчин, приготовлений перемішуванням калію фосфату (2,8 г; 13,21 ммоль) і (S)-2-метил-2пропансульфінаміду (1,85 г; 15,3 ммоль) у воді (10 мл) впродовж 15 хвилин. Реакційну суміш залишили перемішуватись на вихідні дні. Додали льодяної води, одержану тверду речовину зібрали фільтрацією, ретельно промили водою і висушили на повітрі, щоб отримати титульну сполуку (5,84 г, 99 %) у вигляді коричневої твердої речовини. δH (CDCl3) 8,91 (s, 1H), 8,58 (d, J 5,1 Гц, 1H), 8,52 (s, 1H), 8,50 (s, 1H), 7,96 (m, 2H), 7,58 (t, J 7,9 Гц, 1H), 7,29 (d, J 5,1 Гц, 1H), 2,29 + (s, 3H), 1,24 (s, 9H). LCMS (ES+) 386 (M+H) , RT 1,88 хвилини. ПРОМПКНИЙ ПРОДУКТ 11 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(4-метилпіридин-3-іл)хінолін-3-іл]2,2,2-трифторетил}амід Розчин Проміжного продукту 10 (5 г, 12,96 ммоль) і тетрабутиламонію дифтортрифенілсилікату (7,7 г; 14,26 ммоль) в безводному THF (100 мл) охолодили до температури -70ºC. Додали краплями (трифторметил)триметилсилан (2,3 мл; 15,58 ммоль), і суміш перемішували 2 години, дозволяючи температурі повільно підніматись. LCMS показали, що певна частина вихідного матеріалу не прореагувала, так що суміш знову охолодили до -70ºC і додали більше (трифторметил)триметилсилану (2,3 мл; 15,58 ммоль). Суміш перемішували ще 2,5 години, дозволяючи температурі повільно підніматись до 0ºC. Потім додали насичений водний розчин амонію хлориду (0,5 мл), і реакційній суміші дали нагрітись до кімнатної температури. Одержаний матеріал екстрагували двічі, використовуючи EtOAc, потім висушили (MgSO4), випаривши розчинник in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 60 % EtOAc в гексані). Фракції, які містили чистий бажаний ізомер, об'єднали, а розчинник видалили під зниженим тиском, щоб отримати титульну сполуку (3,79 г, 32 %) у вигляді блідо-жовтої гуми. δH (DMSO-d6 при 90ºC) 9,03 (s, 1H), 8,62 (d, J 5,0 Гц, 1H), 8,49 (br s, 1H), 8,06-8,11 (m, 2H), 7,73 (t, J 7,9 Гц, 1H), 7,49 (d, J 5,0 Гц, 1H), 6,29 (br s, 1H), 4,83 (br s, + 1H), 2,18 (s, 3H), 1,18 (s, 9H). LCMS (ES+) 456 (M+H) , RT 1,93 хвилини. ПРОМПКНИЙ ПРОДУКТ 12 (R)-1-[8-Хлор-2-(4-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 11 (1,8 г; 3,95 ммоль) в 1,4-діоксані (2,5 мл) додали 4N розчин HCl в 1,4-діоксані (15 мл). Суміш перемішували при кімнатній температурі впродовж 20 хвилин. Розчинник видалили in vacuo, а залишок потім поділили між DCM і насиченим водним розчином NaHCO3. Водну фазу екстрагували додатковою кількістю DCM, і об'єднані органічні фракції висушили (MgSO4), випарили in vacuo і очистили за допомогою колонкової хроматографії (SiO2, 60 % EtOAc в гексані), щоб отримати титульну сполуку (1,25 г, 90 %) у вигляді блідо-жовтої піни. δH (CDCl3) 8,42-8,65 (m, 3H), 7,95 (d, J 7,1 Гц, 1H), 7,86 (d, J 8,2 Гц, 1H), 7,55 (t, J 7,8 Гц, 1H), 7,24-7,40 (m, 2H), 2,15-2,32 (br s, 2H), 1,50-1,80 (br s, 3H). LCMS (ES+) + 352 (M+H) , RT 1,81 хвилини. ПРОМПКНИЙ ПРОДУКТ 13 2-Метилпропан-2(S)-сульфінової кислоти N-[8-хлор-2-(2-метилпіридин-3-іл)хінолін-3-іл]-мет(E)-іліденамід Суміш Проміжного продукту 9 (5,0 г; 15,2 ммоль), 2-метилпіридин-3-ілборонової кислоти піна колового ефіру (5 г, 22,43 ммоль), тетракіс(трифенілфосфін)паладій(0) (0,2 г; 0,17 ммоль) і 2M водний розчин натрію бікарбонату (20 мл) в 1,4-діоксані (80 мл) піддали дегазації і нагрівали зі зворотним холодильником в атмосфері азоту впродовж 3 годин. Реакційну суміш охолодили до кімнатної температури, розділили між EtOAc і розсолом, і водний шар екстрагували ще раз із застосуванням EtOAc. Об'єднані органічні екстракти висушили (MgSO4), а розчинник видалили під зниженим тиском. До розчину одержаного матеріалу в 2-пропанолі (10 мл) додали розчин, приготовлений перемішуванням калію фосфату (2,8 г; 13,21 ммоль) і (S)-2-метил-2пропансульфінаміду (1,85 г; 15,3 ммоль) у воді (10 мл) впродовж 15 хвилин. Реакційну суміш перемішували 1 годину. Додали льодяної води і одержаний матеріал екстрагували з застосуванням DCM. Органічний екстракт висушили (MgSO4), а розчинник видалили in vacuo. Колонкова хроматографія (SiO2, 50-60 % EtOAc в гексані) дала титульну сполуку (4,3 г, 73 %) у вигляді блідо-жовтої піни. δH (CDCl3) 8,91 (s, 1H), 8,66 (dd, J 5,0; 1,7 Гц, 1H), 8,55 (s, 1H), 7,97 (m, 2H), 7,67 (dd, J 7,7; 1,6 Гц, 1H), 7,60 (m, 1H), 7,33 (dd, J 7,6; 5,0 Гц, 1H), 2,30 (s, 3H), 1,24 (s, 9H). + LCMS (ES+) 386 (M+H) , RT 1,49 хвилини. ПРОМПКНИЙ ПРОДУКТ 14 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(2-метилпіридин-3-іл)хінолін-3-іл]2,2,2-трифторетил}амід 16 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчин Проміжного продукту 13 (4,3 г; 11,17 ммоль) і тетрабутиламонію дифтортрифенілсилікату (7,5 г; 13,9 ммоль) в безводному THF (60 мл) охолодили до -50ºC в атмосфері азоту і додали краплями (трифторметил)триметилсилан (4,5 мл; 30,5 ммоль). Цю суміш перемішували впродовжж 2 годин, даючи температурі повільно підніматись до кімнатної температури. Потім суміш знову охолодили до -20ºC, додали насичений водний розчин амонію хлориду і дали реакційній суміші нагрітись до кімнатної температури. Реакційну суміш екстрагували двічі з застосуванням DCM, потім органічні екстракти висушили (MgSO 4) і профільтрували, а розчинник випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 60 % EtOAc в гексані). Фракції, що містили чистий бажаний ізомер об'єднали, а розчинник видалили під зниженим тиском, щоб отримати титульну сполуку (3,2 г, 63 %) у вигляді блідо-жовтого сиропу. δH (DMSO-d6) 8,98 (d, J 17,8 Гц, 1H), 8,59 (dd, J 4,9; 1,7 Гц, 1H), 8,04 (m, 2H), 7,66 (t, J 7,9 Гц, 1H), 7,47 (m, 2H), 6,52 (m, 1H), 4,55-4,78 (m, 1H), 2,43 (br s, + 3H), 1,10 (br s, 9H). LCMS (ES+) 456 (M+H) , RT 1,5 хвилини. ПРОМПКНИЙ ПРОДУКТ 15 (R)-1-[8-Хлор-2-(2-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 14 (3,5 г; 7,03 ммоль) в 1,4-діоксані (8 мл) додали 4N розчин HCl в 1,4-діоксані (15 мл). Суміш перемішували при кімнатній температурі впродовж 1 години. Розчинник видалили in vacuo, а залишок потім поділили між DCM і насиченим водним розчином NaHCO3. Органічний екстракт висушили (MgSO4). Розчинник видалили під зниженим + тиском, щоб отримати титульну сполуку у вигляді блідо-жовтої смоли. LCMS (ES+) 352 (M+H) , RT 1,36 хвилини. ПРОМПКНИЙ ПРОДУКТ 16 2-Метилпропан-2(S)-сульфінової кислоти N-[8-хлор-2-(5-метилпіридин-3-іл)хінолін-3-іл]-мет(E)-іліденамід Суміш Проміжного продукту 9 (2,0 г; 6,08 ммоль), 5-метилпіридин-3-ілборонової кислоти пінаколового ефіру (1,6 г; 7,31 ммоль), тетракіс(трифенілфосфін)паладію(0) (0,35 г; 0,31 ммоль) і 2M водного розчину натрію бікарбонату (5 мл) в 1,4-діоксані (25 мл) піддали дегазації і нагрівали зі зворотним холодильником в атмосфері азоту впродовж 2 годин. Реакційну суміш охолодили до кімнатної температури, розділили між DCM і розсолом, і водний шар екстрагували ще раз з застосуванням EtOAc. Об'єднані органічні екстракти висушили (MgSO4), а розчинник видалили під зниженим тиском. До розчину одержаного матеріалу в 2-пропанолі (10 мл) додали розчин, приготовлений перемішуванням калію фосфату (1,2 г; 5,66 ммоль) і (S)-2-метил-2пропансульфінаміду (0,75 г; 6,2 ммоль) у воді (10 мл) впродовж 15 хвилин. Реакційну суміш перемішували впродовж ночі, потім інкубували при 60ºC ще 24 години. Додали DCM і промили розсолом, органічний екстракт висушили (MgSO4), а розчинник видалили in vacuo. Колонкова хроматографія (SiO2, 50-60 % EtOAc в гексані) дала титульну сполуку (2,28 г; 97 %) у вигляді блідо-жовтої піни. δH (CDCl3) 8,93 (s, 1H), 8,81 (s, 1H), 8,63 (m, 1H), 7,98 (m, 2H), 7,69 (m, 1H), + 7,61 (m, 1H), 7,50 (m, 1H), 2,54 (s, 3H), 1,31 (s, 9H). LCMS (ES+) 386 (M+H) , RT 1,56 хвилини. ПРОМПКНИЙ ПРОДУКТ 17 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(5-метилпіридин-3-іл)хінолін-3-іл]2,2,2-трифторетил}амід Розчин Проміжного продукту 16 (2,28 г; 5,91 ммоль) і тетрабутиламонію дифтортрифенілсилікату (3,83 г; 7,09 ммоль) в безводному THF (60 мл) охолодили до -50ºC в атмосфері азоту і додали краплями (трифторметил)триметилсилан (2,1 мл; 14,23 ммоль). Суміш перемішували 2 години, дозволяючи температурі повільно підніматись до 0ºC. Реакційну суміш охолодили знову до -10ºC, додали насичений водний розчин амонію хлориду і дали реакційній суміші нагрітись до кімнатної температури. Реакційну суміш екстрагували двічі з застосуванням DCM, потім органічні екстракти висушили (MgSO 4), а розчинник випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO 2, 50-60 % EtOAc в гексані). Кристалізація з ефіру/гексану дала титульну сполуку (1,2 г, 44 %) у вигляді білої кристалічної твердої речовини. δH (DMSO-d6) 9,00 (s, 1H), 8,65 (d, J 1,5 Гц, 1H), 8,59 (d, J 2,0 Гц, 1H), 8,12 (m, 2H), 7,84 (m, 1H), 7,73 (m, 1H), 6,66 (d, J 8,3 Гц, 1H), 5,04 (m, 1H), 2,45 (s, 3H), 1,16 + (s, 9H). LCMS (ES+) 456 (M+H) , RT 1,55 хвилини. ПРОМПКНИЙ ПРОДУКТ 18 (R)-1-[8-Хлор-2-(5-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 17 (1,2 г; 2,63 ммоль) в DCM (3 мл) додали 4N розчин HCl в 1,4-діоксані (10 мл). Суміш перемішували при кімнатній температурі 20 хвилин. Розчиник видалили in vacuo, після чого залишок поділили між DCM і насиченим водним розчинои NaHCO. Водну фазу екстрагували ще раз із застосуванням DCM, а об'єднані органічні екстракти висушили (MgSO4) і випарили in vacuo, щоб отримати титульну сполуку (0,9 г, 97 %) у вигляді 17 UA 109153 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 блідо-жовтої смоли. LCMS (ES+) 352 (M+H) , RT 1,41 хвилини. ПРОМПКНИЙ ПРОДУКТ 19 8-Хлор-2-(піразин-2-іл)хінолін-3-карбальдегід Суміш 2,8-дихлорхінолін-3-карбальдегіду (2,3 г; 10,18 ммоль), 2-(трибутилстаннаніл)піразину (4,5 г; 12,2 ммоль) і тетракіс(трифенілфосфін)-паладію(0) (0,4 г; 0,35 ммоль) в 1,4-діоксані (25 мл) піддали дегазації і нагрівали в атмосфері азоту при 110ºC впродовж 5 годин. Суміш дали охолонути до кімнатної температури впродовж ночі, а твердий продукт зібрали фільтрацією і промили кілька разів ефіром. Фільтрат концентрували і залишили в холодильнику на 2 години, щоб отримати другий збір, який профільтрували, промили ефіром і об'єднали з попереднім матеріалом, щоб отримати титульну сполуку (2,74 г, 99 %) у вигляді жовтої твердої кристалічної + речовини. LCMS (ES+) 270 (M+H) , RT 1,41 хвилини. ПРОМПКНИЙ ПРОДУКТ 20 2-Метилпропан-2(S)-сульфінової кислоти N-[8-хлор-2-(піразин-2-іл)хінолін-3-іл]мет-(E)іліденамід Титан(IV) ізопропоксид (6,1 мл; 20,62 ммоль) додали при перемішуванні до суспензії Проміжного продукту 19 (2,74 г; 10,2 ммоль) в безводному THF (30 мл). Суміш перемішували при кімнатній температурі 10 хвилин, після чого додали (S)-2-метил-2-пропан-сульфінамід (1,35 г; 11,16 ммоль) і суміш перемішували при 50ºC вподовж 2 годин. Додали льодяної води і перемішували суміш 10 хвилин. Одержану тверду речовину відфільтрували, промили водою і висушили на повітрі. Тверду речовину помістили у спечену воронку і екстрагували тричі з застосуванням гарячого DCM. Екстракти DCM концентрували під зниженим тиском, щоб отримати титульну сполуку (1,1 г, 29 %) у вигляді коричневої смоли. δH (DMSO-d6) 9,18 (s, 1H), + 8,91 (m, 1H), 8,28 (m, 2H), 8,13 (m, 2H), 7,74 (m, 2H), 1,26 (s, 9H). LCMS (ES+) 373 (M+H) , RT 1,58 хвилин. ПРОМПКНИЙ ПРОДУКТ 21 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(піразин-2-іл)хінолін-3-іл]-2,2,2трифторетил}амід Суміш Проміжного продукту 20 (1,1 г; 2,95 ммоль) і тетрабутиламонію дифтортрифенілсилікату (1,9 г; 3,52 ммоль) в безводному THF (25 мл) перемішували при -50ºC. Додали краплями (трифторметил)триметилсилан (1,1 мл; 7,45 ммоль) і суміш перемішували впродовж 2 годин, дозволяючи температурі повільно підвищуватись. Реакційну суміш знову охолодили до -20ºC, додали розсол і дали нагрітись впродовж 30 хвилин. Реакційну суміш екстрагували двічі з застосуванням DCM, після чого органічні екстракти висушили (MgSO4), а розчинник випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO 2, 50-60 % EtOAc в гексані), щоб отримати титульну сполуку (0,36 г, 28 %) у вигляді коричневої смоли. δH (DMSO-d6) 9,39 (s, 1H), 8,95 (s, 1H), 8,77 (m, 2H), 8,04 (m, 2H), 7,69 (m, 1H), 6,83 (m, + 1H), 6,65 (d, J 9,5 Гц, 1H), 1,04 (s, 9H). LCMS (ES+) 443 (M+H) , RT 1,55 хвилини. ПРОМПКНИЙ ПРОДУКТ 22 (R)-1-[8-Хлор-2-(піразин-2-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 21 (0,36 г; 0,8 ммоль) в DCM (2 мл) додали 4N розчин HCl в 1,4-діоксані (5 мл). Суміш перемішували при кімнатній температурі впродовж 20 хвилин. Розчинник видалили in vacuo, а залишок потім розділили між DCM і насиченим водним розчином NaHCO3. Водну фазу екстрагували додатковою кількістю DCM, і об'єднані органічні фракції висушили (MgSO4) і випарили. Залишок очистили за допомогою колонкової хроматографії (SiO2, 50 % EtOAc і гексані), щоб отримати титульну сполуку (0,15 г, 28 %) у вигляді коричневої смоли. δH (DMSO-d6) 9,36 (d, J 1,4 Гц, 1H), 9,00 (s, 1H), 8,82 (m, 2H), 8,10 (m, + 2H), 7,73 (m, 1H), 5,96 (q, J 7,8 Гц, 1H), 2,86 (br s, 2H). LCMS (ES+) 339 (M+H) , RT 1,41 хвилини. ПРОМПКНИЙ ПРОДУКТ 23 8-Хлор-2-(6-метоксипіразин-2-іл)хінолін-3-карбальдегід Суміш 2,8-дихлорхінолін-3-карбальдегіду (0,5 г; 2,21 ммоль), 2-метокси-6(трибутилстаннаніл)піразину (1,0 г; 2,51 ммоль) і тетракіс(трифенілфосфін)паладію(0) (0,2 г; 0,173 ммоль) в 1,4-діоксані (10 мл) піддали дегазації і нагрівали при 110ºC впродовж ночі. Суміші дали охолонути до кімнатної температури і розвели EtOAc. Одержану тверду речовину зібрали фільтрацією, промили EtOAc, потім ефіром, і висушили, щоб отримати титульну сполуку (0,42 г, 63 %) у вигляді жовтої твердої речовини. δH (DMSO-d6) 10,58 (s, 1H), 9,24 (s, 1H), 8,93 (s, 1H), 8,53 (s, 1H), 8,27 (dd, J 8,3; 1,2 Гц, 1H), 8,17 (dd, J 7,5; 1,2 Гц, 1H), 7,75 (m, 1H), 3,96 (s, 3H). + LCMS (ES+) 300 (M+H) , RT 1,51 хвилини. ПРОМПКНИЙ ПРОДУКТ 24 2-Метилпропан-2(S)-сульфінової кислоти N-[8-хлор-2-(6-метоксипіразин-2-іл)хінолін-3-іл]мет-(E)-іліденамід 18 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 Титан(IV) ізопропоксид (0,85 мл; 2,87 ммоль) додали при перемішуванні до суспензії Проміжного продукту 23 (0,42 г; 1,4 ммоль) в безводному THF (10 мл). Суміш перемішували при кімнатній температурі 10 хвилин, потім додали (S)-2-метил-2-пропан-сульфінамід (0,2 г; 1,65 ммоль) і суміш перемішували при 50ºC впродовж 8 годин. Додали льодяної води, і суміш перемішували 10 хвилин, потім профільтрували через целіт. Одержану тверду речовину кілька разів промили з застосуванням EtOAc. Фільтрат промили розсолом, висушили (MgSO 4) і концентрували in vacuo. Неочищений матеріал очистили за допомогою колонкової хроматографії (SiO2, 25 % EtOAc в гексані), щоб отримати титульну сполуку (0,5 г, 49 %) у вигляді майже білої твердої маси. δH (DMSO-d6) 9,35 (s, 1H), 9,17 (d, J 0,3 Гц, 1H), 9,13 (s, 1H), 8,50 (m, 1H), 8,29 (dd, J 8,3; 1,2 Гц, 1H), 8,13 (dd, J 7,5; 1,2 Hz, 1H), 7,73 (m, 1H), 4,00 (s, 3H), 1,26 + (s, 9H). LCMS (ES+) 403 (M+H) , RT 1,69 хвилини. ПРОМПКНИЙ ПРОДУКТ 25 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(6-метоксипіразин-2-іл)хінолін-3іл]-2,2,2-трифторетил}амід Розчин Проміжного продукту 24 (0,5 г; 1,24 ммоль) і тетрабутиламонію ацетату (0,45 г; 1,5 ммоль) в безводному THF (15 мл) перемішували при -50ºC в атмосфері азоту і додали краплями (трифторметил)триметилсилан (0,4 мл; 2,71 ммоль). Суміш перемішували 2 години, дозволяючи температурі повільно піднятись до кімнатної температури. Реакційну суміш знову охолодили до -10ºC і погасили розсолом. Реакційній суміші дали нагрітись до кімнатної температури і екстрагували двічі з застосуванням EtOAc. Об'єднані органічні екстракти висушили (MgSO4), розчинник випарували in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 30-50 % EtOAc в гексані), щоб отримати титульну сполуку (120 мг, 20 %) у вигляді блідо-жовтої піни. δH (DMSO-d6) 9,07 (d, J 0,2 Гц, 1H), 9,01 (s, 1H), 8,53 (s, 1H), 8,11 (m, 2H), 7,75 (dd, J 8,1; 7,6 Гц, 1H), 7,07 (m, 1H), 6,80 (d, J 9,3 Гц, 1H), 4,06 (s, 3H), 1,08 (s, 9H). LCMS + (ES+) 473 (M+H) , RT 1,62 хвилини. ПРОМПКНИЙ ПРОДУКТ 26 2-Метилпропан-2(S)-сульфінової кислоти N-[8-хлор-2-(6-метилпіридин-3-іл)хінолін-3-іл]-мет(E)-іліденамід Суміш Проміжного продукту 9 (3,0 г; 9,1 ммоль), 2-метилпіридин-5-ілборонової кислоти (1,24 г; 9,1 ммоль) і тетракіс(трифенілфосфін)паладію(0) (0,10 г; 0,1 ммоль) в DME (60 мл) обробили 2M водним розчином Na2CO3 (11 мл). Реакційну суміш піддали дегазації і тричі продули газом азот, після чого нагрівали при 90ºC впродовж 20 годин. Суміші дали охолонути до кімнатної температури і розвели EtOAc (50 мл). Органічний розчин промили водою (50 мл) і розсолом (50 мл), потім висушили (MgSO4) і випарили in vacuo. Одержаний неочищений матеріал потім обробили сумішшю титану(IV) ізопропоксиду (5,4 мл; 18,0 ммоль) і (S)-2-метил-2-пропансульфінаміду (1,21 г; 10,0 ммоль) в безводному THF (50 мл), у відповідності до процедури, описаної для Проміжного продукту 2. Титульну сполуку (1,46 г; 41 %) було одержано у вигляді жовтої смоли. δH (DMSO-d6) 9,17 (s, 1H), 8,70 (d, J 1,9 Гц, 1H), 8,61 (s, 1H), 8,28 (dd, J 8,3; 1,1 Гц, 1H), 8,11 (dd, J 7,5; 1,3 Гц, 1H), 8,00 (dd, J 7,9; 2,3 Гц, 1H), 7,71 (dd, J 8,1; 7,7 Гц, 1H), 7,50 (d, J + 8,1 Гц, 1H), 2,60 (s, 3H), 1,22 (s, 9H). LCMS (ES+) 386 (M+H) , RT 1,65 хвилини. ПРОМПКНИЙ ПРОДУКТ 27 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(6-метилпіридин-3-іл)хінолін-3-іл]2,2,2-трифторетил}амід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 3, з застосуванням Проміжного продукту 26 (1,46 г; 3,79 ммоль), тетрабутиламонію дифтортрифенілсилікату (2,25 г; 4,17 ммоль), (трифторметил)триметилсилану (1,4 мл; 9,47 ммоль) і безводного THF (40 мл). Титульну сполуку (0,94 г, 55 %) було одержано у вигляді жовтої смоли. δH (DMSO-d6) 9,00 (s, 1H), 8,65 (d, J 1,7 Гц, 1H), 8,13-8,08 (m, 2H), 7,90 (dd, J 7,9; 2,3 Гц, 1H), 7,72 (dd, J 7,9; 7,9 Гц, 1H), 7,52 (d, J 8,1 Гц, 1H), 6,64 (d, J 8,5 Гц, 1H), 5,14-5,03 (m, + 1H), 2,62 (s, 3H), 1,15 (s, 9H). LCMS (ES+) 456 (M+H) , RT 1,70 хвилини. ПРОМПКНИЙ ПРОДУКТ 28 (R)-1-[8-Хлор-2-(6-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін Приготовлений у відповідності до процедури, описаної для Проміжного продукту 4, з застосуванням Проміжного продукту 27 (0,94 г; 2,07 ммоль), 4N розчину HCl в 1,4-діоксані (3 мл, 12,0 ммоль) і метилового спирту (18 мл). Титульну сполуку (1,28 г, 84 %) було одержано у вигляді безбарвної смоли. δH (DMSO-d6) 8,89 (s, 1H), 8,68 (d, J 1,9 Гц, 1H), 8,10 (dd, J 8,3; 1,3 Гц, 1H), 8,04 (dd, J 7,5; 1,3 Гц, 1H), 7,93 (dd, J 7,9; 2,4 Гц, 1H), 7,67 (dd, J 8,1; 8,1 Гц, 1H), 7,47 (d, J + 7,9 Гц, 1H), 4,70 (tq, J 7,2; 7,2 Гц, 1H), 2,84 (d, J 7,0 Гц, 2H), 2,60 (s, 3H). LCMS (ES+) 352 (M+H) , RT 1,51 хвилини. ПРОМПКНИЙ ПРОДУКТ 29 19 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 4-(Бензотриазол-1-ілокси)піридо[3,2-d]піримідин В реакторі, під зарядом азоту, етилен гліколь (2,7 л) нагрівали при 45ºC. Додали 3амінопіридин-2-карбонову кислоту (1,37 кг) і формамідин ацетат (1,37 кг). Суміш нагріли до 50ºC, щоб полегшити перемішування. Суміш поступово нагріли до 125ºC (приблизно за 1 годину) до завершення реакції (2-3 години). Після охолодження суміші до 50ºC повільно додали воду (7 л). Суспензію охолодили до 20ºC і перемішували впродовж ночі, потім охолодили до 5ºC і перемішували 1 годину. Одержану тверду речовину було виділено фільтрацією. Корж промили холодною водою (1,5 л) і ацетоном (1,5 л) і висушили під вакуумом при 55ºC, щоб отримати тверду речовину (985 г, 67,5 %; ВЕРХ чистота 99,25 %). Суміш цього матеріалу (10 г, 68,0 ммоль) і PyBOP (38,9 г; 74,8 ммоль) в ацетонітрилі (250 мл) обробили DBU (12,2 мл; 81,6 ммоль) і перемішували впродовж 2,5 годин. Реакційну суміш профільтрували, осад промили діетиловим ефіром (3 × 50 мл) і висушили під вакуумом. Титульну сполуку (13,51 г, 75 %) було одержано у вигляді кремової твердої речовини. δH (DMSO-d6) 9,28 (dd, J 4,2; 1,6 Гц, 1H), 8,82 (s, 1H), 8,59 (dd, J 8,6; 1,5 Гц, 1H), 8,24-8,18 (m, 2H), 7,88-7,85 (m, 1H), 7,69-7,64 (m, 1H), 7,60-7,54 + (m, 1H). LCMS (ES+) 265 (M+H) , RT 1,23 хвилини. ПРОМПКНИЙ ПРОДУКТ 30 1-(Піридо[3,2-d]піримідин-4-ілокси)піролідин-2,5-діон Суміш Проміжного продукту 29 (13,51 г; 51,0 ммоль) і N-гідроксисукциніміду (8,83 г; 77 ммоль) в дихлорметані (350 мл) перемішували впродовж 20 годин. Реакційну суміш профільтрували, і фільтрат промили водою, потім розсолом, висушили (MgSO 4) і випарили in vacuo. Залишок розтерли з діетиловим ефіром, а осад висушили під вакуумом. Титульну сполуку (10,9 г, 87 %) було одержано у вигляді блідо-жовтої твердої речовини. δH (DMSO-d6) 9,18 (dd, J 4,1; 1,5 Гц, 1H), 8,94 (s, 1H), 8,52 (dd, J 8,7; 1,7 Гц, 1H), 8,13 (dd, J 8,7; 4,3 Гц, 1H), 2,97 + (s, 4H). LCMS (ES+) 245 (M+H) , RT 0,51 хвилини. ПРОМПКНИЙ ПРОДУКТ 31 N-(o-Толіл)ацетамід Оцтовий ангідрид (33,0 мл; 350 ммоль) додали при перемішуванні до розчину o-толуїдину (30,0 г; 280 ммоль) в дихлорметані (500 мл) при 0ºC. Реакційній суміші дали нагрітись до кімнатної температури і перемішували впродовж 20 годин. Потім реакційну суміш поділили між DCM і водою. Органічну фазу промили розсолом, потім висушили (MgSO 4) і випарили in vacuo. Залишок перемішували в ізогексані при 0ºC впродовж 2 годин, потім профільтрували. Осад промили ізогексаном і висушили під вакуумом. Титульну сполуку (39,87 г, 95 %) отримали у вигляді блідо-рожевої твердої речовини. δH (CDCl3) 7,80-7,78 (m, 1H), 7,26-7,20 (m, 2H), 7,13+ 7,08 (m, 1H), 6,92 (br s, 1H), 2,29 (s, 3H), 2,23 (s, 3H). LCMS (ES+) 150 (M+H) , RT 0,85 хвилини. ПРОМПКНИЙ ПРОДУКТ 32 2-Хлор-8-метилхінолін-3-карбальдегід N, N-Диметилформамід (51,8 мл; 668 ммоль) додали частинами за 15 хвилин, при перемішуванні, до оксихлориду фосфору (175 мл, 1,87 моль) при 0ºC. Реакційній суміші дали нагрітись до кімнатної температури і обробили Проміжним продуктом 31 (39,8 г; 267 ммоль), потім нагріли до 80ºC і перемішували впродовж 72 годин. Реакційну суміш охолодили до кімнатної температури, потім обережно влили частинами в інтенсивно перемішувану суміш води і льоду. Суміші води і льоду дали нагрітись до кімнатної температури за 30 хвилин, потім профільтрували. Осад промили водою і висушили під вакуумом. Титульну сполуку (37,3 г, 68 %) було одержано у вигляді кремової твердої речовини. δH (CDCl3) 10,50 (s, 1H), 8,73 (s, 1H), 7,83 (d, J 8,1 Гц, 1H), 7,76-7,72 (m, 1H), 7,55 (dd, J 7,9; 7,3 Гц, 1H), 2,81 (s, 3H). LCMS (ES+) 206 + (M+H) , RT 1,54 хвилини. ПРОМПКНИЙ ПРОДУКТ 33 8-Метил-2-(піридин-3-іл)хінолін-3-карбальдегід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 1, з застосуванням Проміжного продукту 32 (10 г; 48,7 ммоль), Na2CO3 (7,74 г; 73 ммоль), 3піридилборонової кислоти (5,98 г; 48,7 ммоль) і тетракіс (трифенілфосфін)паладію(0) (2,81 г; 2,43 ммоль) в DME (150 мл) і води (40 мл). Титульну сполуку (11,36 г, 94 %) було одержано у вигляді коричневої твердої речовини. δH (CDCl3) 10,20 (s, 1H), 9,02 (dd, J 2,3; 0,8 Гц, 1H), 8,86 (s, 1H), 8,80 (dd, J 4,9; 1,7 Гц, 1H), 8,10 (ddd, J 7,9; 2,3; 1,7 Гц, 1H), 7,90 (d, J 8,3 Гц, 1H), 7,78-7,75 (m, 1H), 7,58 (dd, J 8,1; 7,2 Гц, 1H), 7,53 (ddd, J 7,9; 4,9; 0,8 Гц, 1H), 2,88 (s, 3H). LCMS (ES+) 249 + (M+H) , RT 1,41 хвилини. ПРОМПКНИЙ ПРОДУКТ 34 2-Метилпропан-2(S)-сульфінової кислоти N-[8-метил-2-(піридин-3-іл)хінолін-3-іл]мет-(E)іліденамід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 2, з 20 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосуванням Проміжного продукту 33 (5 г, 20,2 ммоль), титану(IV) ізопропоксиду (11,9 мл; 40,3 ммоль), (S)-2-метил-2-пропансульфінаміду (2,69 г; 22,0 ммоль) і безводного THF (60 мл). Титульну сполуку (7,8 г, >99 %) було одержано у вигляді коричневої смоли. δH (DMSO-d6) 9,08 (s, 1H), 8,85 (dd, J 2,3; 0,8 Гц, 1H), 8,75 (dd, J 4,9; 1,7 Гц, 1H), 8,62 (s, 1H), 8,11-8,07 (m, 2H), 7,82+ 7,78 (m, 1H), 7,65-7,59 (m, 2H), 2,76 (s, 3H), 1,20 (s, 9H). LCMS (ES+) 352 (M+H) , RT 1,58 хвилини. ПРОМПКНИЙ ПРОДУКТ 35 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-метил-2-(піридин-3-іл)хінолін-3-іл]-2,2,2трифторетил]амід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 3, із застосуванням Проміжного продукту 34 (7,8 г; 22,2 ммоль), тетрабутиламонію дифтортрифенілсилікату (13,2 г; 24,4 ммоль), (трифторметил)триметилсилану (3,9 мл; 26,7 ммоль) і безводного THF (150 мл). Титульну сполуку (5,34 г, 57 %) було одержано у вигляді жовтої смоли. δH (DMSO-d6) 8,89 (s, 1H), 8,80-8,77 (m, 2H), 8,03 (ddd, J 7,7; 1,9; 1,9 Гц, 1H), 7,94 (d, J 7,7 Гц, 1H), 7,78-7,75 (m, 1H), 7,68-7,61 (m, 2H), 6,62 (d, J 8,5 Гц, 1H), 5,05 (dq, J 7,9; 7,9 Гц, + 1H), 3,17 (s, 3H), 1,15 (s, 9H). LCMS (ES+) 422 (M+H) , RT 1,56 хвилини. ПРОМПКНИЙ ПРОДУКТ 36 (R)-1-[8-Метил-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін Приготовлений у відповідності до процедури, описаної для Проміжного продукту 4, з застосуванням Проміжного продукту 35 (1,0 г; 2,4 ммоль), 4N розчину HCl в 1,4-діоксані (3,5 мл; 14,0 ммоль) і метилового спирту (18 мл). Титульну сполуку (611 г, 81 %) було одержано у вигляді жовтої смоли. δH (DMSO-d6) 8,83-8,82 (m, 1H), 8,77 (s, 1H), 8,73 (dd, J 4,7; 1,5 Гц, 1H), 8,04 (ddd, J 7,7; 2,1; 2,1 Гц, 1H), 7,92 (d, J 7,9 Гц, 1H), 7,72-7,69 (m, 1H), 7,62-7,56 (m, 2H), 4,74+ 4,61 (m, 1H), 2,82 (d, J 7,0 Гц, 2H), 2,70 (s, 3H). LCMS (ES+) 318 (M+H) , RT 1,41 хвилини. ПРОМПКНИЙ ПРОДУКТ 37 7-Фтор-8-метил-2-(піридин-3-іл)хінолін-3-карбальдегід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 1, з застосуванням 2-хлор-7-фтор-8-метилхінолін-3-карбальдегіду (5,0 г; 22,36 ммоль), 3піридилборонової кислоти (3,02 г; 24,6 ммоль), тетракіс(трифенілфосфін)паладію(0) (127 мг, 0,11 ммоль) і Na2CO3 (3,55 г; 33,54 ммоль) у воді (30 мл) і DME (60 мл). Титульну сполуку (5,52 г, 93 %) було одержано у вигляді бежевої твердої речовини. δH (DMSO-d6) 10,13 (s, 1H), 9,08 (s, 1H), 8,95 (dd, J 2,3; 0,8 Гц, 1H), 8,75 (dd, J 4,9; 1,7 Гц, 1H), 8,24 (dd, J 9,0; 6,4 Гц, 1H), 8,16-8,21 (m, 1H), 7,68 (t, J 9,2 Гц, 1H), 7,61 (ddd, J 7,9; 4,0; 0,8 Гц, 1H), 2,66 (d, J 2,4 Гц, 3H). LCMS (ES+) + 267 (M+H) , RT 2,16 хвилини. ПРОМПКНИЙ ПРОДУКТ 38 2-Метилпропан-2(S)-сульфінової кислоти N-[7-фтор-8-метил-2-(піридин-3-іл)хінолін-3-іл]мет-(E)-іліденамід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 2, з застосуванням Проміжного продукту 37 (4,52 г; 16,99 ммоль), титану(IV) ізопропоксиду (9,66 г; 33,98 ммоль), (S)-2-метил-2-пропансульфінаміду (2,27 г; 18,69 ммоль) і безводного THF (90 мл). Неочищений матеріал розтерли в діетиловому ефірі (20 мл), і тверду речовину відфільтрували і висушили під вакуумом, щоб отримати титульну сполуку (4,37 г, 70 %) у вигляді бежевої твердої речовини. δH (DMSO-d6) 9,14 (s, 1H), 8,85 (d, J 1,7 Гц, 1H), 8,76 (dd, J 4,9; 1,5 Гц, 1H), 8,60 (s, 1H), 8,23 (dd, J 9,4; 7,0 Гц, 1H), 8,10 (dt, J 7,9; 1,9 Гц, 1H), 7,59-7,71 (m, 2H), 2,65 (d, J 2,3 Гц, 3H), 1,21 + (s, 9H). LCMS (ES+) 370 (M+H) , RT 1,62 хвилини. ПРОМПКНИЙ ПРОДУКТ 39 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[7-фтор-8-метил-2-(піридин-3-іл)хінолін-3-іл]2,2,2-трифторетил}амід Суміш Проміжного продукту 38 (4,37 г; 11,83 ммоль) і тетрабутиламонію дифтортрифенілсилікату (7,02 г; 13,01 ммоль) в безводному THF (100 мл) охолодили до -50ºC. Додали (трифторметил)триметилсилан (2,02 г; 14,2 ммоль) і суміш перемішували при -50ºC впродовж 2,5 годин. Додали насичений водний розчин амонію хлориду (15 мл) і реакційній суміші дали нагрітись до кімнатної температури. Розчинник видалили in vacuo, а залишок поділили між DCM (100 мл) і водою (100 мл). Органічну фазу промили розсолом (100 мл), висушили (фазовий сепаратор) і випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 35-100 % EtOAc в гексані), щоб отримати титульну сполуку (3,14 г, 60 %) у вигляді білої піни. δH (DMSO-d6) 8,94 (s, 1H), 8,77-8,81 (m, 2H), 8,00-8,09 (m, 2H), 7,62-7,70 (m, 2H), 6,62 (d, J 8,5 Гц, 1H), 5,05 (quint, J 8,1 Гц, 1H), 2,60 (d, J 2,3 Гц, 3H), 1,15 (s, 9H). LCMS (ES+) + 440 (M+H) , RT 2,56 хвилини. ПРОМПКНИЙ ПРОДУКТ 40 21 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 (R)-1-[7-Фтор-8-метил-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін Приготовлений у відповідності до процедури, описаної для Проміжного продукту 4, з застосуванням Проміжного продукту 39 (3,14 г; 7,15 ммоль), 4N розчину HCl в 1,4-діоксані (6 мл, 24,0 ммоль) і метилового спирту (30 мл). Титульну сполуку (2,40 г; кількісний вихід) було одержано у вигляді жовтої олії. δH (DMSO-d6) 8,82-8,85 (m, 2H), 8,74 (dd, J 4,9; 1,7 Гц, 1H), 8,008,08 (m, 2H), 7,57-7,64 (m, 2H), 4,69 (q, J 7,7 Гц, 1H), 2,79-2,97 (m, 2H), 2,60 (d, J 2,4 Гц, 3H). + LCMS (ES+) 336 (M+H) , RT 2,20 хвилини. ПРОМПКНИЙ ПРОДУКТ 41 7-Фтор-8-метил-2-(2-метилпіридин-3-іл)хінолін-3-карбальдегід Суміш 2-хлор-7-фтор-8-метилхінолін-3-карбальдегіду (8,0 г; 35,77 ммоль), 2-метилпіридин-3ілборонової кислоти пінаколового ефіру (9,58 г; 39,35 ммоль), тетракіс(трифенілфосфін)паладію(0) (207 мг, 18 ммоль) і Na2CO3 (5,69 г; 53,66 ммоль) у воді (50 мл) і DME (100 мл) піддали дегазації і тричі продули газом азотом, потім нагрівали при 90ºC впродовж 24 годин. Потім суміші дали охолонути до кімнатної температури. Реакційну суміш розвели DCM (150 мл) і промили водою (150 мл). Водну фазу екстрагували DCM (2 × 100 мл), а об'єднані органічні фракції промили розсолом (150 мл), потім висушили (фазовий сепаратор) і випарили in vacuo. Неочищений матеріал розтерли в гексані (50 мл), потім тверду речовину відфільтрували і висушили під вакуумом, щоб отримати титульну сполуку (9,07 г, 90 %) у вигляді блідо-жовтої твердої речовини. δH (DMSO-d6) 9,94 (s, 1H), 9,09 (1H, s), 8,61 (dd, J 4,9; 1,7 Гц, 1H), 8,26 (dd, J 8,9; 6,4 Гц, 1H), 7,78 (dd, J 7,7; 1,7 Гц, 1H), 7,69 (t, J 9,2 Гц, 1H), 7,40 (dd, J 7,7; + 4,9 Гц, 1H), 2,61 (d, J 2,4 Гц, 3H), 2,34 (s, 3H). LCMS (ES+) 281 (M+H) , RT 2,26 хвилини. ПРОМПКНИЙ ПРОДУКТ 42 2-Метилпропан-2(S)-сульфінової кислоти N-[7-фтор-8-метил-2-(2-метилпіридин-3-іл)-хінолін3-іл]-мет-(E)-іліденамід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 2, з застосуванням Проміжного продукту 41 (5,0 г; 17,84 ммоль), титану(IV) ізопропоксиду (10,14 г; 35,68 ммоль), (S)-2-метил-2-пропансульфінаміду (2,38 г; 19,63 ммоль) і безводного THF (100 мл). Неочищений матеріал розтерли в діетиловому ефірі (20 мл), тверду речовину відфільтрували і висушили під вакуумом, щоб отримати титульну сполуку (5,14 г, 75 %) у вигляді блідо-жовтої твердої речовини. δH (DMSO-d6) 9,16 (s, 1H), 8,61 (dd, J 4,9; 1,7 Гц, 1H), 8,37 (s, 1H), 8,22 (dd, J 8,9; 6,4 Гц, 1H), 7,74 (dd, J 7,7; 1,7 Гц, 1H), 7,67 (t, J 9,0 Гц, 1H), 7,40 (dd, J + 7,5; 4,9 Гц, 1H), 2,60 (d, J 2,4 Гц, 3H), 2,29 (s, 3H), 1,11 (s, 9H). LCMS (ES+) 384 (M+H) , RT 2,59 хвилини. ПРОМПКНИЙ ПРОДУКТ 43 2-Метилпропан-2(S)-сульфонової кислоти {(R)-1-[7-фтор-8-метил-2-(2-метил-піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}амід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 39, з застосуванням Проміжного продукту 42 (5,13 г; 13,38 ммоль), тетрабутиламонію дифтортрифенілсилікату (7,95 г; 14,72 ммоль), (трифторметил)триметилсилану (4,56 г; 32,12 ммоль) і безводного THF (100 мл). Титульну сполуку (2,64 г, 43 %) було одержано у вигляді майже білої піни. δH (DMSO-d6, 400 МГц, 110ºC) 8,90 (s, 1H), 8,63 (dd, J 4,8; 1,5 Гц, 1H), 8,00 (dd, J 9,1; 6,3 Гц, 1H), 7,65-7,76 (m, 1H), 7,58 (t, J 9,3 Гц, 1H), 7,40 (dd, J 7,6; 5,1 Гц, 1H), 6,00-6,11 (m, + 1H), 4,74-4,87 (m, 1H), 2,59 (d, J 2,5 Гц, 3H), 2,32 (s, 3H), 1,18 (s, 9H). LCMS (ES+) 454 (M+H) , RT 2,55 хвилини. ПРОМПКНИЙ ПРОДУКТ 44 (R)-1-[7-Фтор-8-метил-2-(2-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил-амін До розчину Проміжного продукту 43 (2,64 г; 5,82 ммоль) в метиловому спирті (25 мл) додали 4N розчин HCl в 1,4-діоксані (5,0 мл, 20,0 ммоль). Суміш перемішували при кімнатній температурі впродовж ночі. Розчинник видалили in vacuo, а залишок розчинили у воді (10 мл) і промили DCM (3 × 10 мл). Потім водну фазу зробили основною за допомогою 10 % водного розчину NaOH (10 мл) і екстрагували DCM (4 × 25 мл). Об'єднані органічні фракції потім висушили (фазовий сепаратор) і випарили in vacuo, щоб отримати титульну сполуку (1,76 г, 87 %) у вигляді блідо-жовтої твердої речовини. δH (DMSO-d6, 400 МГц, 110ºC) 8,75 (s, 1H), 8,60 (dd, J 4,8; 1,8 Гц, 1H), 7,99 (dd, J 8,8; 6,1 Гц, 1H), 7,67-7,71 (m, 1H), 7,53 (t, J 9,3 Гц, 1H), 7,34-7,39 + (m, 1H), 4,34-4,46 (m, 1H), 2,60 (d, J 2,5 Гц, 3H), 2,31 (s, 3H). LCMS (ES+) 350 (M+H) , RT 2,22 хвилини. ПРОМПКНИЙ ПРОДУКТ 45 7-Фтор-8-метил-2-(5-метилпіридин-3-іл)хінолін-3-карбальдегід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 41, з застосуванням 2-хлор-7-фтор-8-метилхінолін-3-карбальдегіду (5,0 г; 22,36 ммоль), 5 22 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилпіридин-3-ілборонової кислоти (6,95 г; 50,75 ммоль), тетракіс(трифеніл-фосфін)паладію(0) (258 мг, 0,22 ммоль) і Na2CO3 (3,55 г; 33,54 ммоль) у воді (30 мл) і DME (60 мл). Неочищений матеріал розтерли в діетиловому ефірі (75 мл), і тверду речовину відфільтрували і висушили під вакуумом, щоб отримати титульну сполуку (5,0 г, 80 %) у вигляді коричневої твердої речовини. δH (DMSO-d6) 10,12 (s, 1H), 9,06 (s, 1H), 8,72 (d, J 1,9 Гц, 1H), 8,60 (d, J 1,5 Гц, 1H), 8,24 (dd, J 9,0; 6,4 Гц, 1H), 7,99 (d, J 0,6 Гц, 1H), 7,68 (t, J 9,2 Гц, 1H), 2,66 (d, J 2,4 Гц, 3H), 2,44 + (s, 3H). LCMS (ES+) 281 (M+H) , RT 1,66 хвилини. ПРОМПКНИЙ ПРОДУКТ 46 2-Метилпропан-2(S)-сульфінової кислоти N-[7-фтор-8-метил-2-(5-метилпіридин-3-іл)-хінолін3-іл]мет-(E)-іліденамід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 2, з застосуванням Проміжного продукту 45 (4,99 г; 17,80 ммоль), титану(IV) ізопропоксиду (10,12 г; 35,60 ммоль), (S)-2-метил-2-пропансульфінаміду (2,38 г; 19,6 ммоль) і безводного THF (100 мл). Титульну сполуку (5,63 г, 82 %) було одержано у вигляді темно-коричневої твердої речовини. δH (DMSO-d6) 9,13 (s, 1H), 8,62 (dd, J 7,7; 1,9 Гц, 2H), 8,59 (s, 1H), 8,22 (dd, J 9,0; 6,4 Гц, 1H), 7,887,91 (m, 1H), 7,65 (t, J 9,2 Гц, 1H), 2,65 (d, J 2,4 Гц, 3H), 2,42 (s, 3H), 1,21 (s, 9H). LCMS (ES+) 384 + (M+H) , RT 2,76 хвилини. ПРОМПКНИЙ ПРОДУКТ 47 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[7-фтор-8-метил-2-(5-метил-піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}амід Приготовлений у відповідності до процедури, описаної для Проміжного продукту 39, з застосуванням Проміжного продукту 46 (5,63 г; 14,68 ммоль), тетрабутиламонію дифтортрифенілсилікату (8,72 г; 16,15 ммоль), (трифторметил)триметилсилану (10,04 г; 70,60 ммоль) і безводного THF (100 мл). Титульну сполуку (3,48 г, 52 %) було одержано у вигляді бежевої твердої речовини. δH (DMSO-d6) 8,91 (s, 1H), 8,58-8,68 (m, 2H), 8,05 (dd, J 9,0; 6,4 Гц, 1H), 7,83-7,87 (m, 1H), 7,65 (t, J 9,2 Гц, 1H), 6,62 (d, J 8,3 Гц, 1H), 4,97-5,10 (m, 1H), 2,60 (d, J 2,4 + Гц, 3H), 2,44 (s, 3H), 1,17 (s, 9H). LCMS (ES+) 454 (M+H) , RT 2,66 хвилини. ПРОМПКНИЙ ПРОДУКТ 48 (R)-1-[7-Фтор-8-метил-2-(5-метилпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил-амін Приготовлений у відповідності до процедури, описаної для Проміжного продукту 44, з застосуванням Проміжного продукту 47 (3,42 г; 7,54 ммоль), 4N розчину HCl в 1,4-діоксані (5,0 мл; 20,0 ммоль) і метилового спирту (25 мл). Титульну сполуку (2,41 г, 92 %) було одержано у вигляді блідо-жовтої твердої речовини. δH (DMSO-d6) 8,82 (s, 1H), 8,60 (d, J 1,9 Гц, 1H), 8,57 (dd, J 2,1; 0,6 Гц, 1H), 8,02 (dd, J 8,9; 6,2 Гц, 1H), 7,85 (td, J 2,1; 0,6 Гц, 1H), 7,59 (t, J 9,2 Гц, 1H), 4,60+ 4,75 (m, 1H), 2,80 (d, J 7,0 Гц, 2H), 2,59 (d, J 2,4 Гц, 3H), 2,43 (s, 3H). LCMS (ES+) 350 (M+H) , RT 2,39 хвилини. ПРОМПКНИЙ ПРОДУКТ 49 2-Аміно-3-(трифторметил)бензальдегід Диоксид марганцю (27 г, 0,32 моль) додали до розчину [2-аміно-3(трифторметил)феніл]метанолу (12,0 г; 0,063 моль) в DCM (150 мл), і суміш перемішували впродовж 18 годин при кімнатній температурі. Після цього додали ще одну порцію диоксиду марганцю (27 г, 0,32 моль), і реакційну суміш залишили ще на 18 годин. Потім реакційну суміш профільтрували через целіт, а розчинник видалили in vacuo, щоб отримати титульну сполуку (9,5 г, 80 %) у вигляді помаранчевої олії. δH (DMSO-d6) 9,93 (s, 1H), 7,68 (m, 2H), 6,82 (m, 3H). ПРОМПКНИЙ ПРОДУКТ 50 2-(Піридин-3-іл)-8-(трифторметил)-1,2-дигідрохінолін-3-карбальдегід 2,5-Диметилпіролідину гідрохлорид (100 мг) додали до розчину Проміжного продукту 49 (4,1 г; 0,022 моль) і 3-(піридин-3-іл)акролейну (2,9 г; 0,022 моль) в хлороформі (100 мл). Реакційну суміш нагрівали зі зворотним холодильником, при перемішуванні, впродовж 7 днів. Реакційну суміш концентрували in vacuo перед очисткою за допомогою колонкової хроматографії (SiO 2, 10-100 % EtOAc/DCM), щоб отримати титульну сполуку (3,4 г, 51 %) у вигляді блідо-коричневої + олії. LCMS (ES+) 301.2 (M+H) , RT 1,29 хвилини. ПРОМПКНИЙ ПРОДУКТ 51 2-(Піридин-3-іл)-8-(трифторметил)хінолін-3-карбальдегід Диоксид марганцю (4,8 г; 0,056 моль) додали до розчину Проміжного продукту 50 (3,4 г; 0,011 моль) в хлороформі (100 мл), і реакційну суміш перемішували впродовж 18 годин. Додали більше диоксиду марганцю (2,0 г), і суміш перемішували ще 2 години. Потім реакційну суміш профільтрували через целіт, промиваючи THF. Фільтрат висушили (Na 2SO4) і концентрували in vacuo, після чого очистили за допомогою колонкової хроматографії (SiO 2, діетиловий ефір), щоб отримати титульну сполуку (505 мг, 15 %) у вигляді помаранчевої твердої речовини. LCMS 23 UA 109153 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 (ES+) 303.2 (M+H) , RT 1,29 хвилини. ПРОМПКНИЙ ПРОДУКТ 52 2-Метилпропан-2(S)-сульфінової кислоти N-[2-(піридин-3-іл)-8-(трифторметил) хінолін-3-іл]мет-(E)-іліденамід Титан(IV) ізопропоксид (909 мг, 3,2 ммоль) додали до розчину Проміжного продукту 51 (485 мг, 1,60 ммоль) в безводному THF (30 мл). Суміш перемішували при кімнатній температурі 10 хвилин. Додали (S)-2-метил-2-пропансульфінамід (213 мг, 1,76 ммоль), і суміш перемішували при кімнатній температурі 18 годин. Потім реакційну суміш вилили на розсол (50 мл) і профільтрували через целіт, промиваючи EtOAc. Фільтрат промили розсолом, висушили (Na2SO4) і концентрували in vacuo. Очистка за допомогою колонкової хроматографії (SiO2, 40+ 100 % EtOAc в гексані) дала титульну сполуку (395 мг, 61 %). LCMS (ES+) 406 (M+H) , RT 1,64 хвилини. ПРОМПКНИЙ ПРОДУКТ 53 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[2-(піридин-3-іл)-8-(трифторметил) хінолін-3іл]-2,2,2-трифторетил}амід Суміш Проміжного продукту 52 (320 мг, 0,79 ммоль) і тетрабутиламонію дифтортрифенілсилікату (405 мг, 0,75 ммоль) в безводному THF (20 мл) охолодили до -78ºC. Додали (трифторметил)триметилсилан (123 мг, 0,87 ммоль), суміші дали нагрітись до -35ºC і при цій температурі перемішували 30 хвилин. Додали більше (трифторметил)триметилсилану (123 мг, 0,87 ммоль), і суміш перемішували ще 2 години, підтримуючи температуру нижче -35ºC. Потім додали насичений водний розчин амонію хлориду (5 мл), і реакційній суміші дали нагрітись до кімнатної температури. Розчинник видалили in vacuo, а залишок поділили між EtOAc і водою. Водну фазу екстрагували додатковою кількістю EtOAc, а об'єднані органічні фракції промили розсолом, висушили (Na2SO4) і випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 10-100 % EtOAc в DCM), щоб отримати титульну + сполуку (270 мг, 72 %) у вигляді жовтої смоли. LCMS (ES+) 476 (M+H) , RT 1,70 хвилини. ПРОМПКНИЙ ПРОДУКТ 54 (R)-1-[2-(Піридин-3-іл)-8-(трифторметил)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 53 (243 мг, 0,51 ммоль) в метиловому спирті (20 мл) додали 4N розчин HCl і 1,4-діоксані (4 мл, 16,0 ммоль). Суміш перемішували при кімнатній температурі 1 годину. Розчинник видалили in vacuo, а залишок поділили між DCM і насиченим водним розчином NaHCO3 і випарили in vacuo, щоб отримати титульну сполуку (180 мг, 95 %) у + вигляді жовтої смоли. LCMS (ES+) 372.2 (M+H) , RT 1,56 хвилини. ПРОМПКНИЙ ПРОДУКТ 55 2-[(Гідрокси)(6-метилпіридин-3-іл)метил]акрилової кислоти етиловий ефір До розчину 6-метилпіридин-3-карбальдегіду (5,0 г, 41 ммоль) в етилакрилаті (10 мл) при кімнатній температурі додали DABCO (1,0 г, 9 ммоль), і суміш перемішували впродовж ночі. Реакційну суміш концентрували in vacuo, а залишок очистили за допомогою колонкової хроматографії (SiO2, гексан до 40 % етилацетату), щоб отримати титульну сполуку (5,6 г, 62 %) + у вигляді жовтої олії. LCMS (ES+) 222.2 (M+H) , RT 0,98 хвилини. ПРОМПКНИЙ ПРОДУКТ 56 2-(6-Метилпіридин-3-іл)-5,6,8-трифтор-1,4-дигідрохінолін-3-карбонової кислоти етиловий ефір До розчину Проміжного продукту 55 (4,2 г; 19,09 ммоль), 2,4,5-трифтор-6-бром-аніліну (4,3 г; 19,09 ммоль) і три(o-толіл)фосфін (590 мг, 10 моль %) в пропіонітрилі (50 мл) додали триетиламін (9,6 мл, 60 ммоль). Реакційну суміш піддали дегазації і продули азотом перед додаванням паладію(II) ацетату (215 мг, 5 моль %). Реакційну суміш нагрівали до 100ºC впродовж ночі. Потім реакційну суміш розвели етилацетатом, і органічну фазу двічі промили водою. Органічну фазу пропустили через фазовий сепаратор і концентрували. Одержану коричневу смолоподібну речовину очистили за допомогою колонкової хроматографії (SiO 2, градієнт EtOAc/гексан, 40-80 % EtOAc), щоб отримати титульну сполуку (3 г, 45 %) у вигляді + помаранчевої олії. LCMS pH 10 (ES+) 349 (M+H) , RT 1,40 хвилини. ПРОМПКНИЙ ПРОДУКТ 57 2-(6-Метилпіридин-3-іл)-5,6,8-трифторхінолон-3-карбонової кислоти етиловий ефір До розчину Проміжного продукту 56 (2,8 г; 8,02 ммоль) в DCM was додали диоксид марганцю (2,8 г; 28,73 ммоль). Реакційну суміш перемішували при кімнатній температурі впродовж ночі. Потім реакційну суміш профільтрували через прокладку з целіту, а фільтрат концентрували, щоб отримати титульну сполуку (2,8 г, 100 %) у вигляді жовтої твердої речовин. + LCMS pH 10 (ES+) 347 (M+H) , RT 1,38 хвилини. ПРОМПКНИЙ ПРОДУКТ 58 24 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 [2-(6-Метилпіридин-3-іл)-5,6,8-трифторхінолін-3-іл]метанол До розчину Проміжного продукту 57 (2,8 г; 8,1 ммоль) в толуолі при -78ºC додали DIBAL-H за 20 хвилин. Одержаний розчин перемішували при -78ºC впродовж 60 хвилин. Реакцію погасили за допомогою 2M NaOH, і одержану тверду речовину видалили фільтрацією. Фільтрат поділили між EtOAc і водою, і водну фазу екстрагували з застосуванням EtOAc. Об'єднані органічні фази висушили, профільтрували і випарили, щоб отримати титульну сполуку (2,5 г, 97 %) у вигляді + майже білої твердої речовини. LCMS (ES+) 305 (M+H) . ПРОМПКНИЙ ПРОДУКТ 59 2-(6-Метилпіридин-3-іл)-5,6,8-трифторхінолон-3-карбальдегід Суміш Проміжного продукту 58 (2,5 г; 8,2 ммоль) і диоксиду марганцю (3,5 г; 41 ммоль) в дихлорметані перемішували при кімнатній температурі впродовж 20 годин. Реакційну суміш профільтрували через целіт, і одержаний жовтий розчин концентрували, щоб отримати + титульну сполуку (1,1 г, 44 %) у вигляді жовтої твердої речовини. LCMS (ES+) 303 (M+H) . ПРОМПКНИЙ ПРОДУКТ 60 2-Метилпропан-2(S)-сульфінової кислоти N-[2-(6-метилпіридин-3-іл)-5,6,8-трифторхінолін-3іл]мет-(E)-іліденамід Титан(IV) ізопропоксид (2,1 г; 7,2 ммоль) додали до суспензії Проміжного продукту 59 (1,1 г; 3,6 ммоль) в безводному THF (30 мл). Цю суміш перемішували при кімнатній температурі 10 хвилин. Додали (S)-2-метил-2-пропансульфінамід (480 мг, 3,9 ммоль), і суміш перемішували при 60ºC впродовж 1 години. Потім реакційну суміш концентрували, а залишок очистили за допомогою колонкової хроматографії (SiO2, 40-80 % EtOAc в гексані), щоб отримати титульну + сполуку (1,1 г) у вигляді жовтувато-коричневої твердої речовини. LCMS (ES+) 406 (M+H) , RT 1,526 хвилини. ПРОМПКНИЙ ПРОДУКТ 61 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[2-(6-метилпіридин-3-іл)-5,6,8-трифторхінолін-3-іл]-2,2,2-трифторетил}амід Суміш Проміжного продукту 60 (2,24 г; 6,03 ммоль) і тетрабутиламонію дифтортрифенілсилікату (3,58 г; 6,64 ммоль) в безводному THF (40 мл) охолодили до -40ºC. Додали (трифторметил)триметилсилан (1,03 г; 7,24 ммоль), і суміш перемішували при -40ºC впродовж 1 години. Потім додали насичений водний розчин амонію хлориду (5 мл), і реакційній суміші дали нагрітись до кімнатної температури. Розчинник видалили in vacuo, а залишок поділили між EtOAc і водою. Водну фазу екстрагували додатковою кількістю EtOAc, а об'єднані органічні фракції промили розсолом, потім висушили (Na2SO4) і випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO 2, 40-100 % EtOAc в гексані), щоб + отримати титульну сполуку (1,78 г, 67 %) у вигляді жовтої смоли. LCMS (ES+) 476 (M+H) , RT 1,509 хвилини. ПРОМПКНИЙ ПРОДУКТ 62 (R)-1-[2-(6-Метилпіридин-3-іл)-5,6,8-трифторхінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 61 (400 мг, 0,84 ммоль) в метиловому спирті (10 мл) додали 4N розчин HCl в 1,4-діоксані (10 мл). Суміш перемішували при кімнатній температурі 1 годину. Розчинник видалили in vacuo, а залишок поділили між DCM і насиченим водним розчином NaHCO3. Водну фазу екстрагували з застосуванням DCM, потім висушили (Na 2SO4) і випарили in vacuo, щоб отримати титульну сполуку (160 мг) у вигляді жовтої твердої речовини. + LCMS (ES+) 372 (M+H) , RT 1,394 хвилини. ПРОМПКНИЙ ПРОДУКТ 63 2-Метилпропан-2(R)-сульфінової кислоти N-[8-хлор-2-(піридин-3-іл)хінолін-3-іл]мет-(E)іліденамід Титан(IV) ізопропоксид (3,6 г; 12,6 ммоль) додали до суспензії Проміжного продукту 1 (1,7 г; 6,33 ммоль) в безводному THF (20 мл). Суміш перемішували при кімнатній температурі 10 хвилин. Додали (R)-2-метил-2-пропансульфінамід (0,84 г; 6,96 ммоль), і суміш перемішували при 50ºC впродовж 3 годин. Реакційній суміші дали охолонути до кімнатної температури, після чого її вилили на розсіл (50 мл) і профільтрували через целіт, промиваючи EtOAc. Фільтрат промили розсолом, висушили (Na2SO4) і концентрували in vacuo. Очистка за допомогою колонкової хроматографії (SiO2, 30-100 % EtOAc в гексані) дала титульну сполуку (1,88 г, 91 %) у вигляді жовтувато-коричневої твердої речовини. δH (DMSO-d6) 9,20 (s, 1H), 8,85 (d, J 1,7 Гц, 1H), 8,77 (dd, J 4,9; 1,7 Гц, 1H), 8,61 (s, 1H), 8,29 (dd, J 8,3; 1,1 Гц, 1H), 8,13 (dd, J 7,5; 1,3 Гц, 1H), 8,12-8,08 (m, 1H), 7,72 (dd, J 8,1; 7,7 Гц, 1H), 7,64 (ddd, J 7,7; 4,9; 0,8 Гц, 1H), 1,21 (s, 9H). LCMS + (ES+) 372 (M+H) , RT 2,30 хвилини. ПРОМПКНИЙ ПРОДУКТ 64 2-Метилпропан-2(R)-сульфінової кислоти {(S)-1-[8-хлор-2-(пирідин-3-іл)хінолін-3-іл]-2,2,2 25 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 трифторетил}амід Суміш Проміжного продукту 63 (0,69 г; 1,86 ммоль) і тетрабутиамонію дифтортрифенілсилікату (1,1 г; 2,04 ммоль) в безводному THF (20 мл) охолодили до -78ºC. Додали (трифторметил)триметилсилан (0,32 г; 2,23 ммоль), і суміш перемішували при -78ºC до кімнатної температури впродовж 4 годин. Потім додали насичений водний розчин амонію хлориду (5 мл). Суміш поділили між EtOAc і водою. Водну фазу екстрагували додатковою кількістю EtOAc, і об'єднані органічні фракції промили розсолом, потім висушили (Na 2SO4) і випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO 2, 65-90 % EtOAc в гексані), а потім на другій колонці (SiO2, 20-80 % EtOAc в гексані), щоб отримати титульну сполуку (0,42 г, 51 %) у вигляді блідо-коричневої смоли. δH (DMSO-d6) 9,02 (s, 1H), 8,80 (dd, J 4,9; 1,7 Гц, 1H), 8,78 (dd, J 2,3; 0,6 Гц, 1H), 8,15-8,09 (m, 2H), 8,04-7,99 (m, 1H), 7,77-7,71 (m, 1H), 7,67 (ddd, J 7,9; 4,9; 0,8 Гц, 1H), 6,65 (d, J 8,5 Гц, 1H), 5,12-5,00 (m, 1H), 1,15 (s, 9H). + LCMS (ES+) 442 (M+H) , RT 2,37 хвилини. ПРОМПКНИЙ ПРОДУКТ 65 (S)-1-[8-Хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 64 (0,42 г; 0,952 ммоль) в метиловому спирті (10 мл) додали 4N розчин HCl в 1,4-діоксині (1 мл, 4,0 ммоль). Суміш перемішували при кімнатній температурі 1 годину. Розчинник видалили in vacuo, а залишок розтерли з діетиловим ефіром (x 2). Потім залишок розділили між DCM і насиченим водним розчином NaHCO3. Водну фазу екстрагували додатковою кількістю DCM, і об'єднані органічні фракції промили розсолом, потім висушили (Na2SO4) і випарили in vacuo, щоб отримати титульну сполуку (0,184 г, 57 %) у вигляді + жовтої смоли. LCMS (ES+) 338 (M+H) , RT 1,52 хвилини. ПРОМПКНИЙ ПРОДУКТ 66 N-{(S)-1-[8-Хлор-2-(піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}ацетамід Розчин Проміжного продукту 65 (0,50 г; 1,48 ммоль) в оцтовій кислоті (10 мл) нагрівали при 60ºC впродовж 16 годин. Розчинник видалили in vacuo, а залишок поділили між DCM і насиченим водним розчином NaHCO3. Водну фазу екстрагували додатковою кількістю DCM, і об'єднані органічні фракції промили розсолом, потім висушили (Na 2SO4) і випарили in vacuo, + щоб отримати титульну сполуку (0,55 г, 98 %) у вигляді жовтої смоли. LCMS (ES+) 380.2 (M+H) , RT 1,27 хвилини. ПРОМПКНИЙ ПРОДУКТ 67 N-{(S)-1-[8-Хлор-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетил}ацетамід Розчин Проміжного продукту 66 (550 мг, 1,45 ммоль) в DCM (30 мл) охолодили при премішуванні до 0ºC. Додали MCPBA (650 мг, 2,90 ммоль), і суміші дали повільно нагрітись до кімнатної теператури за 3 години. Реакційну суміш поділили між DCM і насиченим водним розчином NaHCO3. Водну фазу екстрагували додатковою кількістю DCM, а об'єднані органічні фракції промили розсолом, висушили (Na2SO4) і випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 0-15 % MeOH в EtOAc), щоб отримати титульну + сполуку (506 мг, 88 %) у вигляді безбарвної смоли. LCMS (ES+) 396 (M+H) , RT 1,75 хвилини. ПРОМПКНИЙ ПРОДУКТ 68 (S)-1-[8-Хлор-2-(1-оксипіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін Суміш Проміжного продукту 67 (0,506 г; 1,28 ммоль) і концентрованої HCl (5 мл) у воді (5 мл) і етиловому спирті (10 мл) нагрівали при 70ºC впродовж 40 годин. Розчинник видалили in vacuo, а залишок поділили між DCM і насиченим водним розчином NaHCO 3. Водну фазу екстрагували додатковою кількістю DCM, а об'єднані органічні фракції промили розсолом, висушили (Na 2SO4) і випарили in vacuo, щоб отримати титульну сполуку (0,344 г, 76 %) у вигляді жовтувато+ коричневої твердої речовини. LCMS (ES+) 354.0 (M+H) , RT 1,41 хвилини. ПРОМПКНИЙ ПРОДУКТ 69 2-(Піридин-3-іл)хінолін-3-карбальдегід Суміш 2-хлорхінолін-3-карбальдегіду (5,0 г; 26,1 ммоль), Na2CO3 (4,15 г; 39,1 ммоль) і діетил(3-піридил)борану (4,22 г; 28,7 ммоль) в DME (100 мл) і воді (30 мл) піддали дегазації, пропускаючи через неї азот впродовж 5 хвилин. Додали тетракіс-(трифенілфосфін)паладій(0) (0,30 г; 0,261 ммоль), і суміш нагрівали при 90ºC 5 годин. Потім суміші дали охолонути до кімнатної температури. Одержаний осад відфільтрували і промили водою (5 × 50 мл) і діетиловим ефіром (5 × 50 мл), щоб отримати титульну сполуку (4,3 г, 70 %) у вигляді блідо+ зеленої твердої речовини. LCMS (ES+) 235 (M+H) , RT 1,53 хвилини. ПРОМПКНИЙ ПРОДУКТ 70 2-Метилпропан-2(S)-сульфінової кислоти N-[2-(піридин-3-іл)хінолін-3-іл]мет-(E)-іліденамід Титан(IV) ізопропоксид (6,07 г; 21,4 ммоль) додали до суспензії Проміжного продукту 69 (2,5 г; 10,7 ммоль) в безводному THF (80 мл). Суміш перемішували при кімнатній температурі 10 26 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 хвилин. Додали (S)-2-метил-2-пропансуотфінамід (1,42 г; 11,7 ммоль), і суміш перемішували при 50ºC впродовж 3 годин. Потім реакційній суміші дали охолонути до кімнатної температури, після чого її вилили на розсол (50 мл) і профільтрували через целіт, промиваючи EtOAc. Фільтрат промили розсолом, висушили (Na2SO4) і концентрували in vacuo, щоб отримати титульну + сполуку (3,6 г; 99 %) у вигляді жовтувато-коричневої твердої речовини. LCMS (ES+) 338 (M+H) , RT 2,01 хвилини. ПРОМПКНИЙ ПРОДУКТ 71 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[2-(піридин-3-іл)хінолін-3-іл]-2,2,2трифторетил}амід Суміш Проміжного продукту 70 (3,6 г; 10,7 ммоль) і тетрабутиламонію дифтортрифенілсилікату (6,35 г; 11,8 ммоль) в безводному THF (60 мл) охолодили до -40ºC. Додали (трифторметил)триметилсилан (2,28 г; 16,1 ммоль), і суміш перемішували при -40ºC впродовж 1 години. Додали насичений водний розчин амонію хлориду (5 мл), і реакційній суміші дали нагрітись до кімнатної температури. Розчинник видалили in vacuo, а залишок поділили між EtOAc і водою. Водну фазу екстрагували додатковою кількістю EtOAc, а об'єднані органічні фракції промили розсолом, потім висушили (Na 2SO4) і концентрували in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO2, 60-100 % EtOAc в гексані), щоб + отримати титульну сполуку (1,9 г, 44 %) у вигляді жовтої смоли. LCMS (ES+) 408 (M+H) , RT 1,80 хвилини. ПРОМПКНИЙ ПРОДУКТ 72 (R)-1-[2-(Піридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 71 (0,90 г; 2,21 ммоль) в метиловому спирті (10 мл) додали 4N розчин HCl в 1,4-діоксані (2 мл, 8,0 ммоль). Суміш перемішували при кімнатній температурі впродовж 2 годин. Розчинник видалили in vacuo, а залишок розтерли з діетиловим ефіром (x 2). Потім залишок поділили між DCM і насиченим водним розчином NaHCO 3. Водну фазу екстрагували додатковою кількістю DCM, а об'єднані органічні фракції промили розсолом, потім висушили (Na2SO4) і випарили in vacuo, щоб отримати титульну сполуку (0,86 г, кількісний вихід) + у вигляді жовтої смоли. LCMS (ES+) 304 (M+H) , RT 1,57 хвилини. ПРОМПКНИЙ ПРОДУКТ 73 8-Хлор-2-(6-хлорпіридин-3-іл)хінолін-3-карбальдегід Суміш 2,8-дихлорхінолін-3-карбальдегіду (2,6 г; 11,5 ммоль), Na2CO3 (1,83 г; 17,3 ммоль) і 2хлорпіридин-5-ілборонової кислоти (1,81 г; 11,5 ммоль) в 1,4-діоксані (40 мл) і воді (20 мл) піддали дегазації пропусканням через неї азоту впродовж 5 хвилин. Додали тетракіс(трифенілфосфін)паладій(0) (0,13 г; 0,115 ммоль), і суміш нагрівали при 90ºC впродовж 16 годин. Потім суміші дали охолонути до кімнатної температури. Одержаний осад відфільтрували і промили водою (5 × 50 мл) і діетиловим ефіром (5 × 50 мл), щоб отримати титульну сполуку (4,3 г, 70 %) у вигляді жовтувато-коричневої твердої речовини. LCMS (ES+) + 305 (M+H) , RT 1,54 хвилини. ПРОМПКНИЙ ПРОДУКТ 74 2-Метилпропан-2(S)-сульфінової кислоти N-[8-хлор-2-(6-хлорпіридин-3-іл)хінолін-3-іл]мет(E)-іліденамід Титан(IV) ізопропоксид (5,04 г; 17,8 ммоль) додали до суспензії Проміжного продукту 73 (2,69 г; 8,88 ммоль) в безводному THF (80 мл). Суміш перемішували при кімнатній температурі 10 хвилин. Потім додали (S)-2-метил-2-пропансульфінамід (1,18 г; 9,77 ммоль), і суміш перемішували при 50ºC впродовж 3 годин. Реакційній суміші дали охолонути до кімнатної температури, після чого її вилили на розсіл (50 мл) і профільтрували через целіт, промиваючи EtOAc. Фільтрат промили розсолом, висушили (Na2SO4) і концентрували in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO 2, 25-80 % EtOAc в гексані), щоб отримати титульну сполуку (1,98 г, 55 %) у вигляді блідо-жовтої твердої речовини. LCMS (ES+) 406.2 + (M+H) , RT 1,68 хвилини. ПРОМПКНИЙ ПРОДУКТ 75 2-Метилпропан-2(S)-сульфінової кислоти {(R)-1-[8-хлор-2-(6-хлорпіридин-3-іл)хінолін-3-іл]2,2,2-трифторетил}амід Суміш Проміжного продукту 74 (1,97 г; 4,85 ммоль) і тетрабутиламонію ацетату (1,61 г; 5,34 ммоль) в безводному THF (50 мл) охолодили до -40ºC. Додали (трифторметил)триметилсилан (1,38 г; 9,70 ммоль), і суміш перемішували при -40ºC впродовж 2 годин. Потім додали насичений водний розчин амонію хлориду (5 мл), і реакційній суміші дали нагрітись до кімнатної температури. Розчинник видалили in vacuo, а залишок поділили між EtOAc і водою. Водну фазу екстрагували додатковою кількістю EtOAc, а об'єднані органічні фракції промили розсолом, потім висушили (Na2SO4) випарили in vacuo. Залишок очистили за допомогою колонкової 27 UA 109153 C2 5 10 15 20 25 30 35 40 45 50 55 60 хроматографії (SiO2, 15-65 % EtOAc в гексані), щоб отримати титульну сполуку (0.50 g, 22 %) у + вигляді жовтої смоли. LCMS (ES+) 476 (M+H) , RT 2,67 хвилини. ПРОМПКНИЙ ПРОДУКТ 76 (R)-1-[8-Хлор-2-(6-хлорпіридин-3-іл)хінолін-3-іл]-2,2,2-трифторетиламін До розчину Проміжного продукту 75 (0,50 г; 1,05 ммоль) в метиловому спирті (20 мл) додали 4N розчин HCl в 1,4-діоксані (5 мл, 20,0 ммоль). Цю суміш перемішували при кімнатній температурі впродовж 2 годин. Розчинник видалили in vacuo, а залишок поділили між DCM і насиченим водним розчином NaHCO3. Водну фазу екстрагували додатковою кількістю DCM, а об'єднані органічні фракції промили розсолом, потім висушили (Na2SO4) випарили in vacuo. Залишок очистили за допомогою колонкової хроматографії (SiO 2, 30-70 % EtOAc в гексані), щоб + отримати титульну сполуку (0,37 г, 95 %) у вигляді жовтої смоли. LCMS (ES+) 372.2 (M+H) , RT 1,56 хвилини. ПРОМПКНИЙ ПРОДУКТ 77 2-[(Гідрокси)(2-метилпіридин-3-іл)метил]акрилової кислоти етиловий ефір До 2-метилпіридин-3-карбальдегіду (5 г, 0,04 моль) в етилакрилаті (10 мл) додали DABCO (1 г, 0,01 моль) і метиловий спирт (1 мл). Реакційну суміш перемішували при 45ºC впродовж 3 днів. Потім реакційну суміш концентрували і очистили за допомогою колонкової хроматографії (SiO 2, 60-100 % EtOAc/DCM), щоб отримати титульну сполуку (62 %) у вигляді безбарвної олії. δH (DMSO-d6) 8,32 (dd, J 4,8; 1,7 Гц, 1H), 7,51 (dd, J 7,7; 1,7 Гц, 1H), 7,17 (dd, J 7,7; 4,8 Гц, 1H), 6,28 (t, J 1,3 Гц, 1H), 5,91 (t, J 1,6 Гц, 1H), 5,78 (d, J 5,0 Гц, 1H), 5,62 (d, J 5,0 Гц, 1H), 4,10-4,00 (m, 2H), + 3,29 (s, 3H), 1,10 (t, J 7,0 Гц, 3H). LCMS (ES+) 222 (M+H) , RT 1,11 хвилини. ПРОМПКНИЙ ПРОДУКТ 78 2-(2-Метилпіридин-3-іл)-8-(трифторметил)хінолін-3-карбонової кислоти етиловий ефір До дегазованої суміші 2-аміно-3-бромбензотрифториду (3,2 г, 17 ммоль), Проміжного продукту 77 (3,3 г, 15 ммоль), три(o-толіл)фосфіну (256 мг) і триетиламіну (4 мл) в пропіонітрилі (40 мл) при кімнатній температурі додали паладію(II) ацетат (120 мг, 5 моль %). Суміш знову піддали дегазації і нагрівали до 110ºC впродовж 2 годин, після чого розвели водою (20 мл) і EtOAc (100 мл). Водний шар відділили і екстрагували в EtOAc (100 мл). Об'єднані органічні фракції промили розсолом (10 мл), висушили (Na 2SO4), профільтрували і концентрували in vacuo, щоб отримати жовту олію. Одержаний неочищений матеріал розчинили в хлорбензолі (30 мл), обробили MnO2 (6 г) і нагрівали при 60ºC впродовж 2 годин, потім при 100ºC впродовж 4 годин. Потім суміш профільтрували через прокладку з целіту (при 70ºC), промили DCM і концентрували in vacuo. Одержану темну олію очистили за допомогою колонкової хроматографії (SiO2, гексан до 40 % EtOAc), щоб отримати титульну сполуку (3,3 г, 66 %) у вигляді коричневої олії. δH (DMSO-d6) 8,87 (s, 1H), 8,59 (dd, J 4,9; 1,7 Гц, 1H), 8,18 (m, 2H), 7,70 (t, J 7,7 Гц, 1H), 7,59 (dd, J 7,7; 1,7 Гц, 1H), 7,23 (dd, J 7,6; 4,9 Гц, 1H), 4,18 (q, J 7,1 Гц, 2H), 2,48 (s, + 3H), 1,06 (t, J 7,1 Гц, 3H). LCMS (ES+) 361,2 (M+H) . ПРОМПКНИЙ ПРОДУКТ 79 2-(2-Methylpyridin-3-yl)-8-(trifluoromethyl)quinoline-3-carbaldehyde До холодного (-50ºC) розчину Проміжного продукту 78 (3,3 мл; 9,3 ммоль) в толуолі (50 мл) додали краплями DIBAL-H (27,6 мл 1M розчину в DCM). Суміші дали нагрітись до кімнатної температури за 2 години, перемішували при цій температурі ще 30 хвилин, потім охолодили до -78ºC, перед додаванням краплями 1M водного розчину NaOH (45 мл), під час якого температурі дали піднятись до температури оточуючого середовища. Органічну фазу відділили, а водну фазу екстрагували в EtOAc (30 мл). Об'єднані органічні фракції промили 2M водним розчином NaOH (3 × 50 мл), водою (50 мл) і розсолом (50 мл), потім висушили (Na 2SO4), профільтрували і концентрували in vacuo, щоб отримати блідо-коричневу тверду речовину (3,1 г). Цю суміш обробили MnO2 (1,7 г), нагрівали при 70ºC впродовж 4 годин, профільтрували через прокладку з целіту, промили DCM і концентрували in vacuo. Одержаний неочищений твердий матеріал промили діетиловим ефіром, щоб одержати титульну сполуку (2,3 г, 78 %) у вигляді білого порошку. δH (DMSO-d6) 9,97 (s, 1H), 9,23 (s, 1H), 8,63 (m, 2H), 8,41 (d, J 7,0 Гц, 1H), 7,92 (t, J 7,8 Гц, 1H), 7,82 (dd, J 7,7; 1,7 Гц, 1H), 7,41 (dd, J 7,5; 5,0 Гц, 1H), 2,39 (s, 3H). LCMS + (ES+) 317,2 (M+H) . ПРОМПКНИЙ ПРОДУКТ 80 2-Метилпропан-2(S)-сульфінової кислоти N-[2-(2-метилпіридин-3-іл)-8-(трифтор метил)хінолін-3-іл]мет-(E)-іліденамід До розчину Проміжного продукту 79 (2,0 г; 6,3 ммоль) в THF (15 мл) при кімнатній температурі додали титан(IV) ізопропоксид (3,5 мл). Суміш перемішували 15 хвилин перед додаванням (S)-2-метил-2-пропансульфінаміду (0,91 г; 7,5 ммоль), а потім нагрівали при 50ºC впродовж 2 годин. Після охолодження до кімнатної температури додали воду (10 мл). Осад, що 28
ДивитисяДодаткова інформація
Автори англійськоюParton, Andrew Harry, Ali, Mezher Hussein, Brookings Daniel Christopher, Brown, Julien Alistair, Ford, Daniel James, Franklin, Richard Jeremy, Langham Barry John, Neuss, Judi Charlotte, Quincey, Joanna Rachel
Автори російськоюПартон Эндрю Харри, Али Мезхер Хуссэйн, Брукингс Даниэль Кристофер, Браун Джулиэн Алистар, Форд Даниель Джеймс, Франклин Ричард Джереми, Лангхам Барри Джон, Ньюсс Джуди Шарлотт, Квинси Джоанна Рэйчэл
МПК / Мітки
МПК: A61P 25/28, A61K 31/519, C07D 471/04, A61P 29/00, A61P 9/00
Мітки: хіноліну, хіноксаліну, кінази, інгібітори, похідні
Код посилання
<a href="https://ua.patents.su/46-109153-pokhidni-khinolinu-i-khinoksalinu-yak-ingibitori-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні хіноліну і хіноксаліну як інгібітори кінази</a>
Попередній патент: Спосіб виробництва форстеритового електроплавленого матеріалу
Наступний патент: Спосіб відокремлення інбредного насіння і машина для його здійснення
Випадковий патент: Стенд для дослідження гвинтового конвеєра












