Похідні стрептограмінів, спосіб їх одержання і композиція на їх основі
Номер патенту: 71619
Опубліковано: 15.12.2004
Автори: Баррьєр Жан-Клод, Ронан Батіст, Десмазо Паскаль, Ашар Даніель, Бак Ерік, Букерель Жан, Грізоні Серж, Рібей Ів, Лєконт Жан-П'єр
Формула / Реферат
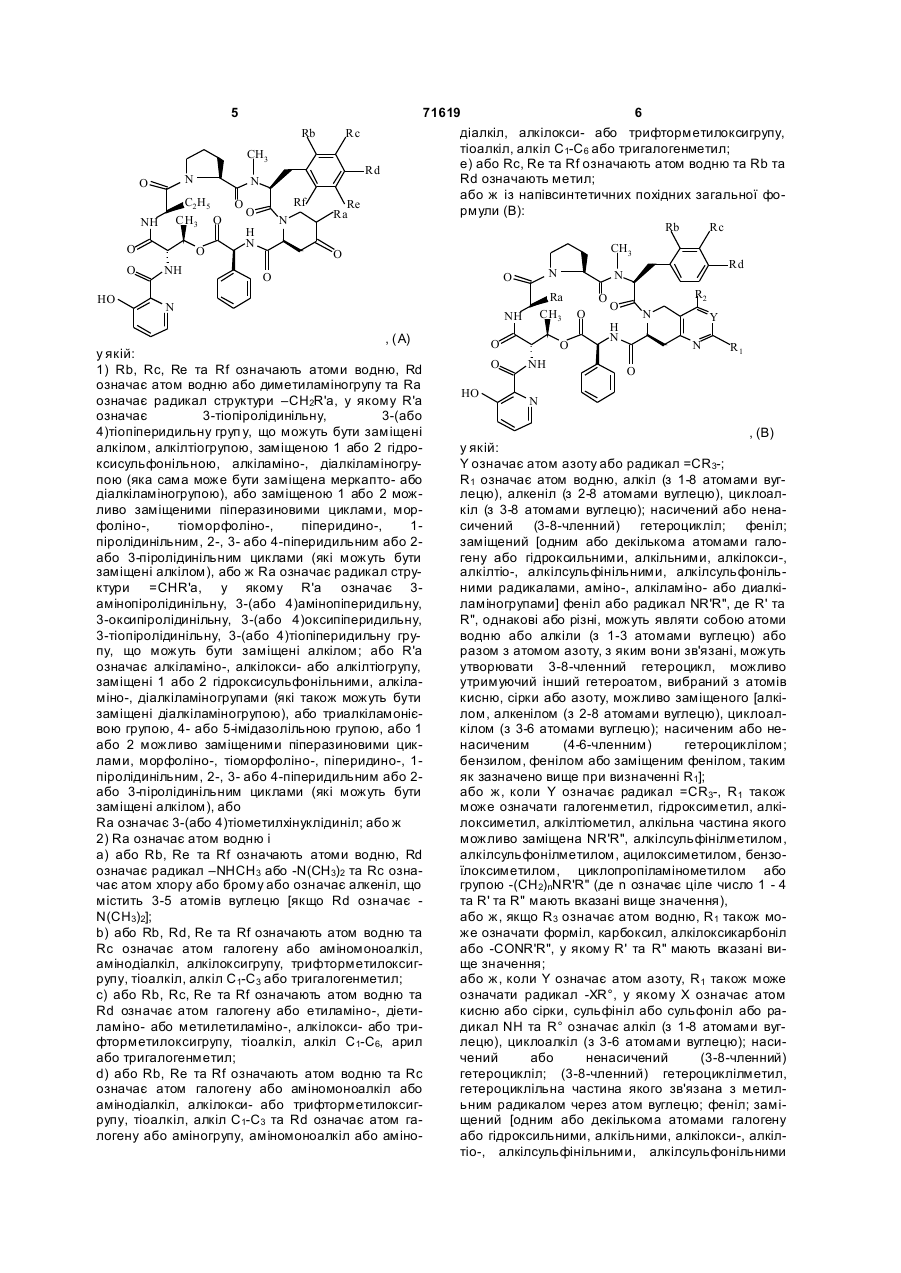
1. Похідне групи А стрептограмінів загальної формули (І):
 , (I)
, (I)
у якій:
R1 означає атом галогену або азидо- або тіоціанатогрупу;
R2 означає атом водню або метил, або етил;
R3 означає атом водню або залишок аліфатичного, циклоаліфатичного, ароматичного, араліфатичного, гетероциклічного або гетероциклілаліфатичного складного ефіру, що може бути заміщений;
зв'язок ![]() означає простий зв'язок (стереохімія 27R) або
означає простий зв'язок (стереохімія 27R) або
подвійний зв'язок; та його солі, коли вони існують.
2. Похідне групи А стрептограмінів за п. 1 формули (І), у якій залишок R3 аліфатичного, циклоаліфатичного, ароматичного, араліфатичного, гетероциклічного або гетероциклілаліфатичного складного ефіру, що може бути заміщений, означає радикал R'3 –CO-, у якому R'3 означає феніл або фенілалкіл, незаміщені або заміщені на фенільному радикалі [одним або декількома радикалами, вибраними з алкілу, який можливо містить радикал NR'R", у якому радикали R' та R", однакові або різні, можуть бути атомами водню або алкільними радикалами, що разом з атомом азоту, з яким вони зв'язані, можуть утворювати насичений або ненасичений 3-8-членний гетероцикліл, що можливо включає інший гетероатом, вибраний з атомів кисню, сірки або азоту, причому зазначений вище гетероцикл може бути сам також заміщений одним або декількома радикалами (алкілом, гідроксіалкілом, алкілоксіалкілом, алкілоксикарбонілалкілом, арильним, 3-8-членним гетероциклільним або гетероциклілалкільним радикалом, насиченими або ненасиченими, або радикалом –CH2-CO-NR'R"), або ж R' і/або R" можуть являти собою гідроксіалкіл, феніл, 3-8-членний гетероциклічний радикал, насичений або ненасичений, або радикал -СО-NR'R", у якому NR'R" має вказане вище значення, або алкіл або ацил, заміщені групою NR'R", вказаним вище],
або ж R'3 може бути вибраний з фенільних або фенілалкільних радикалів, заміщених на фенільному радикалі одним або декількома радикалами [вибраними з алкільних радикалів, що можуть бути заміщені алкілокси- або алкілтіогрупою, які самі можуть містити радикал карбокси або радикал NR'R", вказаними, або вибраними з ацилоксигруп, що можуть бути заміщені групою NR'R", вказаною вище],
або ж R'3 може бути вибраний з алкільних або циклоалкільних радикалів, можливо заміщених [карбокси, карбоксіалкілдисульфанілом або радикалом NR'R", -CH2-NR'R", -CO-NR'R", або алкілоксикарбонілом, алкілоксигрупою або алкілдисульфанілом, можливо заміщеними -NR'R" або -CO-NR'R", у яких NR'R" має вказане вище значення],
або ж R'3 може бути вибраний з насичених або ненасичених 3-8-членних гетероциклічних радикалів, можливо заміщених [алкілом або ацилом, які самі також можуть бути заміщені NR'R"].
3. Похідне групи А стрептограмінів по будь-якому із пп. 1 або 2, у якому:
R1 означає атом фтору, хлору, брому або йоду або азидо- або тіоціанатогрупу;
R2 означає метил;
R3 означає атом водню або радикал R'3-СО-, у якому R'3 означає феніл або фенілалкіл, незаміщені або заміщені на фенільному радикалі [одним або декількома радикалами, вибраними з алкілу, можливо утримуючий радикал NR'R", у якому радикали R' та R", однакові або різні, можуть бути атомами водню або алкільними радикалами, що разом з атомом азоту, з яким вони зв'язані, можуть утворювати насичений або ненасичений 3-8-членний гетероцикліл, можливо утримуючий інший гетероатом, вибраний з атомів кисню, сірки або азоту, причому вказаний вище гетероцикл сам може бути також заміщений одним або декількома радикалами (алкілом, гідроксіалкілом, алкілоксіалкілом, алкілоксикарбонілалкілом, арилом, насиченим або ненасиченим 3-8-членним гетероциклілом або гетероциклілалкілом або радикалом –CH2-CO-NR'R"), або ж R' і/або R" можуть означати гідроксіалкіл, феніл, насичений або ненасичений 3-8-членний гетероциклілалкіл, радикал -CO-NR'R", у якому NR'R" має зазначене вище значення, або алкіл або ацил, заміщені NR'R", вказаний вище], або ж R'3 може являти собою феніл, заміщений одним або декількома радикалами [вибраними з алкільних радикалів, що можуть бути заміщені алкілокси- або алкілтіогрупою, що сама можливо містить карбоксил або радикал NR'R", вказаний вище, або вибраними з ацилоксигруп, що можуть бути заміщені NR'R", вказаним вище], або ж R'3 може бути вибраний з алкільних або циклоалкільних радикалів, можливо заміщених [карбоксилом, карбоксіалкілдисульфанілом або радикалом NR'R", -CH2-NR'R", -CO-NR'R", або алкілоксикарбонілом, алкілоксигрупою або алкілдисульфанілом, можливо заміщеними NR'R" або -CO-NR'R", у яких NR'R" є таким, як вказано вище], або ж R'3 може бути вибраний з насичених або ненасичених 3-8-членних гетероциклільних радикалів, можливо заміщених [алкілом або ацилом, що самі можливо заміщені NR'R"], причому гетероцикли вибирають з піролідинілу, імідазолілу, піридилу, піперидинілу, піперазинілу або морфолінілу; і
зв'язок ![]() означає простий зв'язок (стереохімія 27R) або подвійний зв'язок; а також його солі, коли вони існують.
означає простий зв'язок (стереохімія 27R) або подвійний зв'язок; а також його солі, коли вони існують.
4. Похідне групи А стрептограмінів по будь-якому із пп. 1-3, що являє собою (16Р)-16-дезоксо-16-фторпристинаміцин ІІв.
5. Похідне групи А стрептограмінів по будь-якому із пп. 1-3, що являє собою (16Р)-16-дезоксо-16-тіоціанатопристинаміцин ІІв.
6. Похідне групи А стрептограмінів по будь-якому із пп. 1-3, що являє собою (16Р)-16-дезоксо-16-хлорпристинаміцин IIв.
7. Похідне групи А стрептограмінів по будь-якому із пп. 1-3, що являє собою (16Р)-16-азидо-16-дезоксопристинаміцин ІІв.
8. Похідне групи А стрептограмінів по будь-якому із пп. 1-3, що являє собою (16Р)-16-дезоксо-16-фторпристинаміцин IIа.
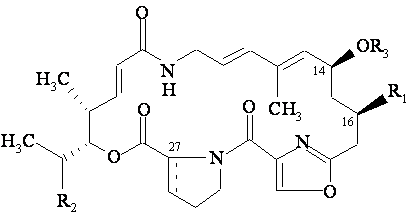
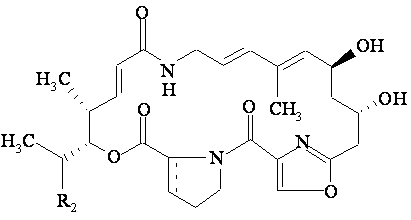
9. Спосіб одержання похідного групи А стрептограмінів за п. 1, який відрізняється тим, що галогенують або перетворюють у азид, або перетворюють у тіоціанат похідне стрептограміну загальної формули (II):
 , (ІІ)
, (ІІ)
у якій R2 має вказане вище значення; зв'язок ![]() означає простий зв'язок (стереохімія 27R) або подвійний зв'язок; гідроксильна функціональна група якого в положенні 14 попередньо захищена, потім видаляють захисну групу і, у разі потреби, для одержання похідного стрептограміну групи А за пп. 1 або 2, у якому R3 є іншим, ніж атом водню, вводять залишок аліфатичного, циклоаліфатичного, ароматичного, араліфатичного, гетероциклічного або гетероциклілаліфатичного складного ефіру, що може бути заміщений (R3), і, у разі потреби, перетворюють у сіль.
означає простий зв'язок (стереохімія 27R) або подвійний зв'язок; гідроксильна функціональна група якого в положенні 14 попередньо захищена, потім видаляють захисну групу і, у разі потреби, для одержання похідного стрептограміну групи А за пп. 1 або 2, у якому R3 є іншим, ніж атом водню, вводять залишок аліфатичного, циклоаліфатичного, ароматичного, араліфатичного, гетероциклічного або гетероциклілаліфатичного складного ефіру, що може бути заміщений (R3), і, у разі потреби, перетворюють у сіль.
10. Спосіб за п. 9, який відрізняється тим, що працюють у присутності трифториду аміносульфіду або в присутності тетрафториду сірки, при використанні реагенту, такого як тетраалкіламоній-, триалкілбензиламоній- або триалкілфеніламонійгалогенід, -азид або -тіоціанат, або при використанні галогеніду, азиду або тіоціанату лужного металу з доданим, у разі потреби, краун-ефіром.
11. Спосіб за п. 9, який відрізняється тим, що реакцію фторування здійснюють шляхом впливу фторуючого агента, вибраного з фториду сірки, гексафторпропілдіетиламіну або N-(2-хлор-1,1,2-трифторетил)діетиламіну.
12. Спосіб за будь-яким із пп. 9, 10 або 11, який відрізняється тим, що, у разі потреби, етерифікацію здійснюють будь-яким відомим способом, який не торкається іншої частини молекули.
13. Спосіб за будь-яким із пп. 9, 10 або 12, який відрізняється тим, що трифторид аміносульфіду може бути вибраний із трифториду діетиламіносульфіду, трифториду біс(2-метоксіетил)аміносульфіду або трифториду морфоліносульфіду.
14. Фармацевтична композиція, що містить похідне стрептограміну групи А за пп. 1 або 2 як таке або у вигляді асоціації, щонайменше, з одним похідним стрептограміну групи В, у разі потреби, у формі солі, і/або у вигляді асоціації з одним або декількома сумісними та фармацевтично прийнятними розріджувачами або добавками.
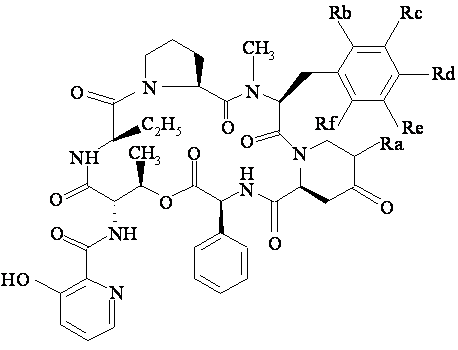
15. Фармацевтична композиція за п. 14, яка відрізняється тим, що похідне стрептограміну групи В вибирають із природних компонентів: пристинаміцину ІА, пристинаміцину ІВ, пристинаміцину ІC, пристинаміцину ID, пристинаміцину ІЕ, пристинаміцину IF, пристинаміцину IG, віргініаміцину S1, S3 або S4, вернаміцину В або С, етаміцину, або з напівсинтетичних похідних загальної формули (А):
 , (А)
, (А)
у якій:
1) Rb, Rс, Re та Rf означають атоми водню, Rd означає атом водню або диметиламіногрупу та Ra означає радикал структури –CH2R'a, у якому R'a означає 3-тіопіролідинільну, 3-(або 4)тіопіперидильну групу, що можуть бути заміщені алкілом, алкілтіогрупою, заміщеною 1 або 2 гідроксисульфонільною, алкіламіно-, діалкіламіногрупою (яка сама може бути заміщена меркапто- або діалкіламіногрупою), або заміщеною 1 або 2 можливо заміщеними піперазиновими циклами, морфоліно-, тіоморфоліно-, піперидино-, 1-піролідинільним, 2-, 3- або 4-піперидильним або 2- або 3-піролідинільним циклами (які можуть бути заміщені алкілом), або ж Ra означає радикал структури =CHR'a, у якому R'a означає 3-амінопіролідинільну, 3-(або 4)амінопіперидильну, 3-оксипіролідинільну, 3-(або 4)оксипіперидильну, 3-тіопіролідинільну, 3-(або 4)тіопіперидильну групу, що можуть бути заміщені алкілом; або R'a означає алкіламіно-, алкілокси- або алкілтіогрупу, заміщені 1 або 2 гідроксисульфонільними, алкіламіно-, діалкіламіногрупами (які також можуть бути заміщені діалкіламіногрупою), або триалкіламонієвою групою, 4- або 5-імідазолільною групою, або 1 або 2 можливо заміщеними піперазиновими циклами, морфоліно-, тіоморфоліно-, піперидино-, 1-піролідинільним, 2-, 3- або 4-піперидильним або 2- або 3-піролідинільним циклами (які можуть бути заміщені алкілом), або
Ra означає 3-(або 4)тіометилхінуклідиніл; або ж
2) Ra означає атом водню і
a) або Rb, Re та Rf означають атоми водню, Rd означає радикал –NНСН3 або -N(СН3)2 та Rc означає атом хлору або брому або означає алкеніл, що містить 3-5 атомів вуглецю [якщо Rd означає -N(СН3)2];
b) або Rb, Rd, Re та Rf означають атом водню та Rc означає атом галогену або аміномоноалкіл, амінодіалкіл, алкілоксигрупу, трифторметилоксигрупу, тіоалкіл, алкіл С1-С3 або тригалогенметил;
c) або Rb, Rc, Re та Rf означають атом водню та Rd означає атом галогену або етиламіно-, діетиламіно- або метилетиламіно-, алкілокси- або трифторметилоксигрупу, тіоалкіл, алкіл С1-С6, арил або тригалогенметил;
d) або Rb, Re та Rf означають атом водню та Rc означає атом галогену або аміномоноалкіл або амінодіалкіл, алкілокси- або трифторметилоксигрупу, тіоалкіл, алкіл С1-С3 та Rd означає атом галогену або аміногрупу, аміномоноалкіл або амінодіалкіл, алкілокси- або трифторметилоксигрупу, тіоалкіл, алкіл С1-С6 або тригалогенметил;
e) або Rc, Re та Rf означають атом водню та Rb та Rd означають метил;
або ж із напівсинтетичних похідних загальної формули (В):
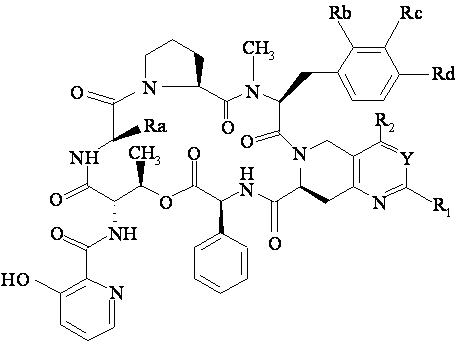 , (B)
, (B)
у якій:
Y означає атом азоту або радикал =CR3-;
R1 означає атом водню, алкіл (з 1-8 атомами вуглецю), алкеніл (з 2-8 атомами вуглецю), циклоалкіл (з 3-8 атомами вуглецю); насичений або ненасичений (3-8-членний) гетероцикліл; феніл; заміщений [одним або декількома атомами галогену або гідроксильними, алкільними, алкілокси-, алкілтіо-, алкілсульфінільними, алкілсульфонільними радикалами, аміно-, алкіламіно- або диалкіламіногрупами] феніл або радикал NR'R", де R' та R", однакові або різні, можуть являти собою атоми водню або алкіли (з 1-3 атомами вуглецю) або разом з атомом азоту, з яким вони зв'язані, можуть утворювати 3-8-членний гетероцикл, можливо утримуючий інший гетероатом, вибраний з атомів кисню, сірки або азоту, можливо заміщеного [алкілом, алкенілом (з 2-8 атомами вуглецю), циклоалкілом (з 3-6 атомами вуглецю); насиченим або ненасиченим (4-6-членним) гетероциклілом; бензилом, фенілом або заміщеним фенілом, таким як зазначено вище при визначенні R1];
або ж, коли Y означає радикал =СR3-, R1 також може означати галогенметил, гідроксиметил, алкілоксиметил, алкілтіометил, алкільна частина якого можливо заміщена NR'R", алкілсульфінілметилом, алкілсульфонілметилом, ацилоксиметилом, бензоїлоксиметилом, циклопропіламінометилом або групою -(CH2)nNR'R" (де n означає ціле число 1 - 4 та R' та R" мають вказані вище значення),
або ж, якщо R3 означає атом водню, R1 також може означати форміл, карбоксил, алкілоксикарбоніл або -CONR'R", у якому R' та R" мають вказані вище значення;
або ж, коли Y означає атом азоту, R1 також може означати радикал -XR°, у якому Х означає атом кисню або сірки, сульфініл або сульфоніл або радикал NH та R° означає алкіл (з 1-8 атомами вуглецю), циклоалкіл (з 3-6 атомами вуглецю); насичений або ненасичений (3-8-членний) гетероцикліл; (3-8-членний) гетероциклілметил, гетероциклільна частина якого зв'язана з метильним радикалом через атом вуглецю; феніл; заміщений [одним або декількома атомами галогену або гідроксильними, алкільними, алкілокси-, алкілтіо-, алкілсульфінільними, алкілсульфонільними радикалами; аміно-, алкіламіно- або діалкіламіногрупами] феніл або радикал -(CH2)nNR'R", у якому R' та R" мають зазначені вище значення та n означає ціле число 2-4, або ж, якщо Х означає NH, R° також може означати атом водню;
R2 означає атом водню або алкіл (з 1-3 атомами вуглецю);
R3 означає атом водню або алкіл, карбоксил, алкілоксикарбоніл або карбамоїл структури -CO-NR'R", у якій R' та R" мають вказані вище значення;
Ra означає метил або етил; і
Rb, Rc та Rd мають вказані нижче значення:
1) Rb та Rc означають атоми водню та Rd означає атом водню або метиламіно- або диметиламіногрупу;
2) Rb означає атом водню; Rc означає атом водню, хлору або брому або означає алкеніл (С3-C5); та Rd означає радикал -NMe-R'", у якому R"' означає алкіл, гідроксіалкіл (С2-C4) або алкеніл (С2-C8), можливо заміщений фенілом, циклоалкіл(С3-C6)метилом, бензилом; заміщеним [одним або декількома атомами галогену або гідроксильним, алкільним, алкілокси-, алкілтіо-, алкілсульфінільним, алкілсульфонільним радикалами; амiно-, алкіламіно- або діалкіламіногрупами] бензилом, гетероциклілметилом або гетероциклілетилом, гетероциклільна частина якого є насиченою або ненасиченою та 5-6- членною та містить 1 або 2 гетероатоми, вибраних з атомів сірки, кисню або азоту, можливо заміщеного [алкілом, алкенілом (з 2-8 атомами вуглецю), циклоалкілом (із 3-6 атомами вуглецю); насиченим або ненасиченим (4-6-членним) гетероциклілом, фенілом; заміщеним фенілом, таким як зазначено вище при визначенні R1, або бензилом],
або ж R"' означає ціанометил або радикал –CH2CORe, у якому або Re означає -OR'e, де R'e являє собою атом водню, алкіл (з 1-6 атомами вуглецю), алкеніл (з 2-6 атомами вуглецю), бензил або гетероциклілметил, гетероциклільна частина якого є 5-6-членною та містить 1 або 2 гетероатоми, вибраних з атомів сірки, кисню або азоту, або Re означає алкіламіно-, алкілметиламіно-, гетероцикліламіно- або гетероциклілметиламіногрупу, гетероциклільна частина якої є насиченою та 5-6-членною та містить 1 або 2 гетероатоми, вибраних з атомів сірки, кисню або азоту, можливо заміщеного алкілом, бензилом або алкілоксикарбонілом;
3) Rb означає атом водню, Rd означає радикал –NНСН3 або -N(СН3)2 та Rc означає атом хлору або брому або означає алкеніл (С3-C5) [якщо Rd означає -N(СН3)2];
4) Rb та Rd означають атоми водню та Rc означає атом галогену або алкіламіно- або діалкіламіно-, алкілокси-, трифторметоксигрупу; тіоалкіл, алкіл (С1-C6) або тригалогенметил;
5) Rb та Rc означають атоми водню та Rd означає атом галогену або етиламіно-, діетиламіно- або метилетиламіно-, алкілокси- або трифторметокси-, алкілтіогрупу; алкілсульфініл, алкілсульфоніл, алкіл (С1-C6), феніл або тригалогенметил;
6) Rb означає атом водню; Rc означає атом галогену або алкіламіно- або діалкіламіно-, алкілокси- або трифторметоксигрупу; тіоалкіл, алкіл (С1-C3) та Rd означає атом галогену або аміно-, алкіламіно- або диалкіламіно-, алкілокси або трифторметоксигрупу; тіоалкіл, алкіл (С1-C6) або тригалогенметил;
7) Rc oзначає атом водню та Rb та Rd означають метил; а також їхніх солей.
Текст
1. Похідне групи А стрептограмінів загальної формули (І): O C2 2 (19) 1 3 71619 4 або декількома радикалами, вибраними з алкілу, O можливо утримуючий радикал NR'R", у якому раOH дикали R' та R", однакові або різні, можуть бути N H3C атомами водню або алкільними радикалами, що H OH разом з атомом азоту, з яким вони зв'язані, можуть O CH3 O утворювати насичений або ненасичений 3-8H3C N членний гетероцикліл, можливо утримуючий інший O N гетероатом, вибраний з атомів кисню, сірки або O азоту, причому вказаний вище гетероцикл сам R2 , (ІІ) може бути також заміщений одним або декількома у якій R2 має вказане вище значення; зв'язок радикалами (алкілом, гідроксіалкілом, алкілоксіалкілом, алкілоксикарбонілалкілом, арилом, насичеозначає простий зв'язок (стереохімія 27R) або подвійний зв'язок; гідроксильна функціональна ним або ненасиченим 3-8-членним гетероциклілом або гетероциклілалкілом або радикалом –CH2-COгрупа якого в положенні 14 попередньо захищена, NR'R"), або ж R' і/або R" можуть означати гідроксіпотім видаляють захисну групу і, у разі потреби, алкіл, феніл, насичений або ненасичений 3-8для одержання похідного стрептограміну групи А членний гетероциклілалкіл, радикал -CO-NR'R", у за пп. 1 або 2, у якому R3 є іншим, ніж атом водню, вводять залишок аліфатичного, циклоаліфатичноякому NR'R" має зазначене вище значення, або алкіл або ацил, заміщені NR'R", вказаний вище], го, ароматичного, араліфатичного, гетероциклічноабо ж R'3 може являти собою феніл, заміщений го або гетероциклілаліфатичного складного ефіру, одним або декількома радикалами [вибраними з що може бути заміщений (R3), і, у разі потреби, алкільних радикалів, що можуть бути заміщені перетворюють у сіль. 10. Спосіб за п. 9, який відрізняється тим, що алкілокси- або алкілтіогрупою, що сама можливо містить карбоксил або радикал NR'R", вказаний працюють у присутності трифториду аміносульфівище, або вибраними з ацилоксигруп, що можуть ду або в присутності те трафториду сірки, при вибути заміщені NR'R", вказаним вище], або ж R'3 користанні реагенту, такого як тетраалкіламоній-, може бути вибраний з алкільних або циклоалкіль триалкілбензиламоній- або триалкілфеніламонійгалогенід, -азид або -тіоціанат, або при викорисних радикалів, можливо заміщених [карбоксилом, карбоксіалкілдисульфанілом або радикалом танні галогеніду, азиду або тіоціанату лужного меNR'R", -CH2-NR'R", -CO-NR'R", або алкілоксикарталу з доданим, у разі потреби, краун-ефіром. бонілом, алкілоксигрупою або алкілдисульфані11. Спосіб за п. 9, який відрізняється тим, що лом, можливо заміщеними NR'R" або -CO-NR'R", у реакцію фторування здійснюють шляхом впливу фтор уючого агента, вибраного з фториду сірки, яких NR'R" є таким, як вказано вище], або ж R'3 може бути вибраний з насичених або ненасичених гексафторпропілдіетиламіну або N-(2-хлор-1,1,23-8-членних гетероциклільних радикалів, можливо трифторетил)діетиламіну. заміщених [алкілом або ацилом, що самі можливо 12. Спосіб за будь-яким із пп. 9, 10 або 11, який заміщені NR'R"], причому гетероцикли вибирають відрізняє ться тим, що, у разі потреби, етерифікацію здійснюють будь-яким відомим способом, який з піролідинілу, імідазолілу, піридилу, піперидинілу, піперазинілу або морфолінілу; і не торкається іншої частини молекули. 13. Спосіб за будь-яким із пп. 9, 10 або 12, який зв'язок означає простий зв'язок (стереохівідрізняє ться тим, що трифторид аміносульфіду мія 27R) або подвійний зв'язок; а також його солі, може бути вибраний із трифториду діетиламіносуколи вони існують. льфіду, три фториду біс(24. Похідне групи А стрептограмінів по будь-якому метоксіетил)аміносульфіду або трифториду моріз пп. 1-3, що являє собою (16Р)-16-дезоксо-16фоліносульфіду. фторпристинаміцин ІІв. 14. Фармацевтична композиція, що містить похідне 5. Похідне групи А стрептограмінів по будь-якому стрептограміну групи А за пп. 1 або 2 як таке або у із пп. 1-3, що являє собою (16Р)-16-дезоксо-16вигляді асоціації, щонайменше, з одним похідним тіоціанатопристинаміцин ІІв. стрептограміну групи В, у разі потреби, у формі 6. Похідне групи А стрептограмінів по будь-якому солі, і/або у вигляді асоціації з одним або декільіз пп. 1-3, що являє собою (16Р)-16-дезоксо-16кома сумісними та фармацевтично прийнятними хлорпристинаміцин IIв. розріджувачами або добавками. 7. Похідне групи А стрептограмінів по будь-якому 15. Фармацевтична композиція за п. 14, яка відрііз пп. 1-3, що являє собою (16Р)-16-азидо-16зняється тим, що похідне стрептограміну групи В дезоксопристинаміцин ІІв. вибирають із природних компонентів: пристинамі8. Похідне групи А стрептограмінів по будь-якому цину ІА, пристинаміцину ІВ, пристинаміцину ІC, із пп. 1-3, що являє собою (16Р)-16-дезоксо-16пристинаміцину ID, пристинаміцину ІЕ, пристинафторпристинаміцин IIа. міцину IF, пристинаміцину IG, віргініаміцину S1, S3 9. Спосіб одержання похідного групи А стрептогабо S4, вернаміцину В або С, етаміцину, або з рамінів за п. 1, який відрізняється тим, що галонапівсинтетичних похідних загальної формули (А): генують або перетворюють у азид, або перетворюють у тіоціанат загальної формули (II): похідне стрептограміну 5 Rb CH3 N O O O HO O NH Rd N C2 H5 CH3 O NH O Rf O N H N 71619 6 діалкіл, алкілокси- або трифторметилоксигрупу, тіоалкіл, алкіл С 1-С6 або тригалогенметил; e) або Rc, Re та Rf означають атом водню та Rb та Rd означають метил; або ж із напівсинтетичних похідних загальної формули (В): Rc Re Ra Rb Rc CH3 O O N O N Ra CH3 NH , (А) у якій: 1) Rb, Rс, Re та Rf означають атоми водню, Rd означає атом водню або диметиламіногрупу та Ra означає радикал структури –CH2R'a, у якому R'a означає 3-тіопіролідинільну, 3-(або 4)тіопіперидильну груп у, що можуть бути заміщені алкілом, алкілтіогрупою, заміщеною 1 або 2 гідроксисульфонільною, алкіламіно-, діалкіламіногрупою (яка сама може бути заміщена меркапто- або діалкіламіногрупою), або заміщеною 1 або 2 можливо заміщеними піперазиновими циклами, морфоліно-, тіоморфоліно-, піперидино-, 1піролідинільним, 2-, 3- або 4-піперидильним або 2або 3-піролідинільним циклами (які можуть бути заміщені алкілом), або ж Ra означає радикал структури =CHR'a, у якому R'a означає 3амінопіролідинільну, 3-(або 4)амінопіперидильну, 3-оксипіролідинільну, 3-(або 4)оксипіперидильну, 3-тіопіролідинільну, 3-(або 4)тіопіперидильну групу, що можуть бути заміщені алкілом; або R'a означає алкіламіно-, алкілокси- або алкілтіогрупу, заміщені 1 або 2 гідроксисульфонільними, алкіламіно-, діалкіламіногрупами (які також можуть бути заміщені діалкіламіногрупою), або триалкіламонієвою групою, 4- або 5-імідазолільною групою, або 1 або 2 можливо заміщеними піперазиновими циклами, морфоліно-, тіоморфоліно-, піперидино-, 1піролідинільним, 2-, 3- або 4-піперидильним або 2або 3-піролідинільним циклами (які можуть бути заміщені алкілом), або Ra означає 3-(або 4)тіометилхінуклідиніл; або ж 2) Ra означає атом водню і a) або Rb, Re та Rf означають атоми водню, Rd означає радикал –NНСН3 або -N(СН3)2 та Rc означає атом хлору або брому або означає алкеніл, що містить 3-5 атомів вуглецю [якщо Rd означає N(СН3)2]; b) або Rb, Rd, Re та Rf означають атом водню та Rc означає атом галогену або аміномоноалкіл, амінодіалкіл, алкілоксигрупу, трифторметилоксигрупу, тіоалкіл, алкіл С 1-С3 або тригалогенметил; c) або Rb, Rc, Re та Rf означають атом водню та Rd означає атом галогену або етиламіно-, діетиламіно- або метилетиламіно-, алкілокси- або трифторметилоксигрупу, тіоалкіл, алкіл С1-С6, арил або тригалогенметил; d) або Rb, Re та Rf означають атом водню та Rc означає атом галогену або аміномоноалкіл або амінодіалкіл, алкілокси- або трифторметилоксигрупу, тіоалкіл, алкіл С 1-С3 та Rd означає атом галогену або аміногрупу, аміномоноалкіл або аміно O O HO O NH Rd N O O R2 O N H N Y N R1 O N , (B) у якій: Y означає атом азоту або радикал =CR3-; R1 означає атом водню, алкіл (з 1-8 атомами вуглецю), алкеніл (з 2-8 атомами вуглецю), циклоалкіл (з 3-8 атомами вуглецю); насичений або ненасичений (3-8-членний) гетероцикліл; феніл; заміщений [одним або декількома атомами галогену або гідроксильними, алкільними, алкілокси-, алкілтіо-, алкілсульфінільними, алкілсульфонільними радикалами, аміно-, алкіламіно- або диалкіламіногрупами] феніл або радикал NR'R", де R' та R", однакові або різні, можуть являти собою атоми водню або алкіли (з 1-3 атомами вуглецю) або разом з атомом азоту, з яким вони зв'язані, можуть утворювати 3-8-членний гетероцикл, можливо утримуючий інший гетероатом, вибраний з атомів кисню, сірки або азоту, можливо заміщеного [алкілом, алкенілом (з 2-8 атомами вуглецю), циклоалкілом (з 3-6 атомами вуглецю); насиченим або ненасиченим (4-6-членним) гетероциклілом; бензилом, фенілом або заміщеним фенілом, таким як зазначено вище при визначенні R1]; або ж, коли Y означає радикал =СR3-, R1 також може означати галогенметил, гідроксиметил, алкілоксиметил, алкілтіометил, алкільна частина якого можливо заміщена NR'R", алкілсульфінілметилом, алкілсульфонілметилом, ацилоксиметилом, бензоїлоксиметилом, циклопропіламінометилом або групою -(CH2)nNR'R" (де n означає ціле число 1 - 4 та R' та R" мають вказані вище значення), або ж, якщо R3 означає атом водню, R1 також може означати форміл, карбоксил, алкілоксикарбоніл або -CONR'R", у якому R' та R" мають вказані вище значення; або ж, коли Y означає атом азоту, R1 також може означати радикал -XR°, у якому Х означає атом кисню або сірки, сульфініл або сульфоніл або радикал NH та R° означає алкіл (з 1-8 атомами вуглецю), циклоалкіл (з 3-6 атомами вуглецю); насичений або ненасичений (3-8-членний) гетероцикліл; (3-8-членний) гетероциклілметил, гетероциклільна частина якого зв'язана з метильним радикалом через атом вуглецю; феніл; заміщений [одним або декількома атомами галогену або гідроксильними, алкільними, алкілокси-, алкілтіо-, алкілсульфінільними, алкілсульфонільними 7 71619 8 радикалами; аміно-, алкіламіно- або діалкіламіногабо ж R"' означає ціанометил або радикал – рупами] феніл або радикал -(CH2)nNR'R", у якому CH2CORe, у якому або Re означає -OR'e, де R'e R' та R" мають зазначені вище значення та n ознаявляє собою атом водню, алкіл (з 1-6 атомами чає ціле число 2-4, або ж, якщо Х означає NH, R° вуглецю), алкеніл (з 2-6 атомами вуглецю), бензил також може означати атом водню; або гетероциклілметил, гетероциклільна частина R2 означає атом водню або алкіл (з 1-3 атомами якого є 5-6-членною та містить 1 або 2 гетероатовуглецю); ми, вибраних з атомів сірки, кисню або азоту, або R3 означає атом водню або алкіл, карбоксил, алкіRe означає алкіламіно-, алкілметиламіно-, гетеролоксикарбоніл або карбамоїл структури -CO-NR'R", цикліламіно- або гетероциклілметиламіногрупу, у якій R' та R" мають вказані вище значення; гетероциклільна частина якої є насиченою та 5-6Ra означає метил або етил; і членною та містить 1 або 2 гетероатоми, вибраних Rb, Rc та Rd мають вказані нижче значення: з атомів сірки, кисню або азоту, можливо заміще1) Rb та Rc означають атоми водню та Rd означає ного алкілом, бензилом або алкілоксикарбонілом; атом водню або метиламіно- або диметиламіног3) Rb означає атом водню, Rd означає радикал – рупу; NНСН3 або -N(СН3)2 та Rc означає атом хлору або 2) Rb означає атом водню; Rc означає атом водброму або означає алкеніл (С3-C5) [якщо Rd ознаню, хлору або брому або означає алкеніл (С3-C5); чає -N(СН3)2]; та Rd означає радикал -NMe-R'", у якому R"' озна4) Rb та Rd означають атоми водню та Rc означає чає алкіл, гідроксіалкіл (С2-C4) або алкеніл (С2-C8), атом галогену або алкіламіно- або діалкіламіно-, можливо заміщений фенілом, циклоалкіл(С3алкілокси-, трифторметоксигрупу; тіоалкіл, алкіл C6)метилом, бензилом; заміщеним [одним або (С1-C6) або тригалогенметил; декількома атомами галогену або гідроксильним, 5) Rb та Rc означають атоми водню та Rd означає алкільним, алкілокси-, алкілтіо-, алкілсульфінільатом галогену або етиламіно-, діетиламіно- або ним, алкілсульфонільним радикалами; амiно-, алметилетиламіно-, алкілокси- або трифторметокси-, кіламіно- або діалкіламіногрупами] бензилом, геалкілтіогрупу; алкілсульфініл, алкілсульфоніл, алтероциклілметилом або гетероциклілетилом, кіл (С1-C6), феніл або тригалогенметил; гетероциклільна частина якого є насиченою або 6) Rb означає атом водню; Rc означає атом галоненасиченою та 5-6- членною та містить 1 або 2 гену або алкіламіно- або діалкіламіно-, алкілоксигетероатоми, вибраних з атомів сірки, кисню або або трифторметоксигрупу; тіоалкіл, алкіл (С1-C3) азоту, можливо заміщеного [алкілом, алкенілом (з та Rd означає атом галогену або аміно-, алкіламі2-8 атомами вуглецю), циклоалкілом (із 3-6 атоно- або диалкіламіно-, алкілокси або трифтормемами вуглецю); насиченим або ненасиченим (4-6токсигрупу; тіоалкіл, алкіл (С1-C6) або тригалогенчленним) гетероциклілом, фенілом; заміщеним метил; фенілом, таким як зазначено вище при визначенні 7) Rc oзначає атом водню та Rb та Rd означають R1, або бензилом], метил; а також їхніх солей. Даний винахід відноситься до похідних групи А стрептограмінів загальної формули (І): а також до їхніх солей, які мають значну антибактеріальну активність. Із відомих стрептограмінів пристинаміцин (RP 7293), антибактеріальний продукт природного походження, був виділений вперше в 1955р. з Streptomyces pR1stinaespiralis. Пристинаміцин, є у продажу під назвою PyostacineÒ, являє собою головним чином пристинаміцин ІІА, асоційований із пристинаміцином ІА. Інший антибактеріальний продукт класу стрептограмінів, віргініаміцин, був виділений з Streptomyces virginiae, ATCC 13161 [Antibiotics and Chemotherapy, 5, 632 (1955)]. Віргініаміцин (StaphylomycineÒ) являє собою головним чином фактор М1 (VM1), асоційований з фактором S (VS). Напівсинтетичні похідні стрептограмінів структури: у якій n означає 0-2, описані в Європейських патентах ЕР 135410 та ЕР 191662. У поєднанні із напівсинтетичним компонентом групи В стрептограмінів вони виявляють синергізм дії та їх використовують у вигляді ін'єкцій. У Міжнародній заявці на патент WO 99/05165 описані похідні групи А стрептограмінів загальної формули (І): 9 71619 10 фенілалкільних радикалів, заміщених на фенільному радикалі одним або декількома радикалами [вибраними з алкільних радикалів, що можуть бути заміщені алкілокси- або алкілтіогрупою, що самі можуть містити радикал карбокси або радикал NR’R’’, описаний вище, або вибраними з ацилоксигруп, що можуть бути заміщені групою NR’R’’, зазначеною вище], або ж R’3 може бути вибраний з алкільних або циклоалкільних радикалів, можливо заміщених у якій R1 означає радикал -NR’R’’ або -NR’OR’’, [карбокси, карбоксиалкілдисульфанілом або радиR2 означає атом водню, метил або етил, та зв'язок калом NR’R’’, -CH2-NR’R’’, -CO-NR’R’’, або алкілок--- означає простий зв'язок або подвійний зв'язок, сикарбонілом, алкілоксигрупою або алкілдисульякі є антимікробними засобами. фанілом, можливо заміщеними -NR’R’’ або -COДані похідні, однак, не досягають особливо виNR’R’’, у яких NR’R’’ має зазначене вище значенсоких рівнів активності і, крім того, не завжди маня], ють також бажаний широкий спектр дії. або ж R’3 може бути вибраний з насичених або В даний час знайдено, що похідні стрептограненасичених 3-8-членних гетероциклічних радикаміну групи А загальної формули (і), у якій: лів, можливо заміщених [алкілом або ацилом, які R1 означає атом галогену або азидо- або тіоцісамі також можуть бути заміщені NR’R’’]. анатогрупу; У загальній формулі (1), за винятком спеціаR2 означає атом водню або метил або етил; льної вказівки, алкільні або ацильні радикали або R3 означає атом водню або залишок аліфатиалкільні або ацильні частини радикалів є лінійними чного, циклоаліфатичного, ароматичного, араліабо розгалуженими та містять 1-12 атомів вуглефатичного, гетероциклічного або гетероциклілаліцю; гетероциклічні радикали можуть бути обрані, фатичного складного ефіру, що може бути зокрема, з піролідинілу, піролілу, фурилу, тієнілу, заміщений; імідазолілу, піридилу, піперидинілу, піперазинілу, зв'язок --- означає простий зв'язок (стереохімія морфолінілу, тіоморфолінілу, піразинілу, піриміди27R) або подвійний зв'язок; нілу, піридазинілу, імідазолідинілу; арильні радиі їхні солі, коли вони існують, виявляють особкали можуть бути обрані, зокрема, з можливо заливо сильну антибактеріальну активність при виміщених фенільних радикалів та особливо користанні індивідуально або в поєднанні з похідфенільних радикалів, заміщених алкілом, алкілокним стрептограміну гр упи В і/або мають більш сигрупою, галогеном або радикалом -СН2ОН, широкий спектр дії в порівнянні зі звичайним спек(CH2)n-NH2, -(CH2)n-NH-алкіл або -(СН2)n-N(алкіл)2. тром дії стрептограмінів. Похідні стрептограміну загальної формули (І) Відповідно до винаходу, коли R1 означає атом можуть бути отримані галогенуванням, перетвогалогену, він може бути вибраний з атомів фтору, ренням у азид або перетворенням у тіоціанат похлору, брому або йоду; хідного стрептограміну загальної формули (II): якщо радикал R3 означає залишок аліфатичного, циклоаліфатичного, ароматичного, араліфатичного, гетероциклічного або гетероциклілаліфатичного складного ефіру, який може бути заміщений, то даний радикал може бути вибраний, наприклад, з радикалів R’3-CO-, у яких R’3 означає феніл або фенілалкіл, незаміщені або заміщені на фенільному радикалі [одним або декількома радикалами, вибраними з алкілу, який можливо містить радикал NR’R’’, у якому радикали R’ та R’’, однакові або різні, можуть бути атомами водню або у якій R2 має зазначене вище значення; зв'язок алкільними радикалами, що разом з атомом азоту, --- означає простий зв'язок (стереохімія 27R) або з яким вони зв'язані, можуть утворювати насичеподвійний зв'язок; та гідроксильна функціональна ний або ненасичений 3-8-членний гетероцикліл, група якого в положенні 14 попередньо захищена, що можливо включає інший гетероатом, вибраний з подальшим видаленням захисної групи і, у разі з атомів кисню, сірки або азоту, причому зазначепотреби, для одержання похідного загальної форний вище гетероцикл може бути сам також замімули (І), у якому R3 є іншим, ніж атом водню, ввещений одним або декількома радикалами (алкіденням залишку аліфатичного, циклоаліфатичнолом, гідроксиалкілом, алкілоксиалкілом, го, ароматичного, араліфатичного, алкілоксикарбонілалкілом, арильним, 3-8-членним гетероциклічного або гетероциклілаліфатичного гетероциклільним або гетероциклілалкільним раскладного ефіру, що може бути заміщений (R3), дикалом, насиченими або ненасиченими, або разгідно звичайних способів, що не торкаються іншої дикалом -CH2-CO-NR’R’’), або ж R’ і/або R’’ можуть частини молекули. являти собою гідроксиалкіл, феніл, 3-8-членний Реакції галогенування, перетворення в азид гетероциклічний радикал, насичений або ненасиабо перетворення в тіоціанат можуть бути здійсчений, або радикал -CO-NR’R’’, у якому NR’R’’ має нені в присутності трифториду аміносульфіду (назазначене вище значення, або алкіл або ацил, приклад, такого як трифторид діетиламіносульфізаміщені групою NR’R’’, описаною вище], ду, трифторид біс(2-метоксиетил)аміносульфіду або ж R’3 може бути вибраний з фенільних або 11 71619 12 аміну (триалкіламіну, такого як триетиламін або (DeoxofluorÒ), трифторид морфоліносульфіду) діізопропілетиламін, або піридину або його похідабо, альтернативно, у присутності тетрафториду сірки, за допомогою реагенту, наприклад, такого як ного) і, у разі потреби, каталізатора, такого як 4-Nдиметиламінопіридин, при температурі від -40°С тетраалкіламоній-, триалкілбензиламоній- або до +80°С, в органічному розчиннику, такому як триалкілфеніламонійгалогенід, -азид або амід (наприклад, диметилформамід або N-метилтіоціанат, або за допомогою галогеніду, або азиду 2-піролідинон), піридин, галогенований розчинник тіоціанату лужного металу з доданим, у разі потреби, краун-ефіром. Реакції фторування також (наприклад, дихлорметан, дихлоретан або хлороформ) або простий ефір (тетрагідрофуран, диокможуть бути здійснені шляхом впливу фторуючого сан, диметоксиетан). Зрозуміло, що функціональні агента, наприклад, такого як фторид сірки [напригрупи, які можуть впливати на реакцію, попереклад, трифторид морфоліносульфіду, тетрафтодньо захищають, потім знімають захист після реарид сірки (J. Org. Chem., 40, 3808 (1975)) трифторид діетиламіносульфіду (Tetrahedron, 44, 2875 кції. Використовувану кислоту або реакціоноздатне (1988)), трифторид біс(2похідне кислоти одержують, як описано нижче в метоксиетил)аміносульфіду (DeoxofluorÒ). Альтеприкладах або за аналогією з описаними способарнативно, реакції фтор ування також можна здійсми. нювати за допомогою фторуючого агента, наприДигідроксильоване похідне стрептограміну клад, такого як гексафторпропілдіетиламін (JP групи А загальної формули (II) може бути отрима2039546) або N-(2-хлор-1,1,2но селективним відновленням компонента приротрифторетил)діетиламін. дного пристинаміцину загальної формули (III): Якщо використовують тетраалкіламонійгалогенід, -азид або -тіоціанат, то останній може бути вибраний, наприклад, з тетраметиламоній-, тетраетиламоній-, тетрапропіламоній-, тетрабутиламоній- (наприклад, тетра-н-бутиламоній-), тетрапентиламоній-, тетрациклогексиламоній-, триетилметил-амоній-, трибутилметиламоній- або триметилпропіл-амонійгалогеніду, -азиду або тіоціанату. Реакції здійснюють в органічному розчиннику, такому як хлорований розчинник (наприклад, диху якій R2 має зазначене вище значення та лорметан, дихлоретан, хлороформ), або в просзв'язок --- означає простий зв'язок (стереохімія тому ефірі (як, наприклад, тетрагідрофуран), при 27R) або подвійний зв'язок, з подальшим відділентемпературі від -78°С до 40°С (переважно при 0ням епімерної форми 16S. 30°С). Переважно реакції здійснюють в атмосфері Відновлення здійснюють переважно в присутаргону або азоту. Зрозуміло, що використання ності відновника, такого як боргідрид лужного мегідроксивмісного похідного конфігурації (16S) приталу, наприклад, боргідрид натрію або триацетокводить до похідного конфігурації (16R). сиборгідрид натрію, в органічному розчиннику, Введення та видалення захисної групи у випавибраному із хлорованих розчинників (таких, надку гідрокси в положенні 14 здійснюють звичайниприклад, як дихлорметан, дихлоретан, хлороми методами, що не торкаються іншої частини форм), тетрагідрофурану, оцтової кислоти та молекули, зокрема, при використанні методів, спиртів, таких як, наприклад, метанол, етанол або описаних T.W. Greene та Ρ G Μ Wuts "Protective 2-пропанол, при температурі від -78°С до 40°С. Groups in Organic Synthesis" (2-і видання), A. Wiley Поділ епімерних форм 16R та 16S здійснюють |nteR3cience Publication (1991), або Mac Omie звичайними методами; наприклад, поділ епімер"Protective Groups in Organic Chemistry", Plenum них форм можна здійснювати хроматографією, Press (1973). Захист здійснюють, наприклад, за флеш-хроматографією, високоефективною рідиндопомогою триалкілсилільного, алкілдифенілсиліною хроматографією (ВЕРХ), при використанні льного (наприклад, трет-бутилдифенілсилільного хіральної або нехіральної фази, або розподільною та трет-бутилдиметилсилільного) або алільного центрифужною хроматографією (СРС), виходячи радикала, що вводять та видаляють як описано із суміші епімерів 16R та 16S; або кристалізацією. нижче в прикладах. Зокрема, (16S)-16-гідроксипристинаміцин ІІА У разі потреби, коли бажають одержати проможе бути отриманий згідно F. Le Goffic та ін., Eur. дукт загальної формули (І), у якому R3 означає J. Med. - Chimica Therapeutica; січень-лютий, -16(l), залишок аліфатичного, циклоаліфатичного, аро69-72 (1981). матичного, араліфатичного, гетероциклічного або Похідні пристинаміцину загальної формули (III) гетероциклілаліфатичного складного ефіру, який відповідають, відповідно, пристинаміцину IIА може бути заміщений, подальшу операцію етери(РIIА), пристинаміцину ІІВ (РIIВ), пристинаміцину фікації здійснюють звичайними способами, що не IIC (РIIС), пристинаміцину IID (PIID), пристинаміторкаються іншої частини молекули. Етерифікацію цину IIF (PIIF) та пристинаміцину IIG (PIIG), які є переважно проводять реакцією кислоти або реаквідомими компонентами природного пристинаміційноздатного похідного кислоти (наприклад, такоцину. Компоненти PIlF та PIIG описані в Європейго як хлорангідрид кислоти, реакційноздатний ському патенті ЕР 614910. складний ефір, ангідрид), можливо в присутності Пристинаміцин IIC (РIIС) та пристинаміцин IID зв'язуючого агента, такого як карбодиімід (напри(PIID) можуть бути отримані як описано J.C. клад, дициклогексилкарбодиімід), та третинного BarR1ere та ін., Expert. Opin. Invest. Drugs, 3(2), 13 71619 14 115-131 (1994). у якій: Одержання та поділ компонентів природних 1. Rb, Re, Re та Rf означають атоми водню, Rd стрептограмінів групи А [стрептограміни загальної означає атом водню або диметиламіногрупу та Ra формули (III)] здійснюють ферментацією та видіозначає радикал структури -CH2R’a, у якому R’a ленням компонентів з ферментативного бульйону означає 3-тіопіролідиніл, 3-(або 4-)тіопіперидил, або згідно за аналогією зі способом, описаним J. що можуть бути заміщені алкілом; алкілтіогрупою, Preud’ homme та ін., Bull. Soc. Chim. Fr., 2, 585 заміщеною 1 або 2 гідроксисульфонільною, алкі(1968) або в Європейському патенті ЕР 614910. ламіно-, диалкіламіногрупою (яка сама може бути Альтернативно, природні компоненти групи А мозаміщена меркапто- або диалкіламіногрупою) або жуть бути отримані специфічною ферментацією, заміщеною 1 або 2 можливо заміщеними піпераяк описано в заявці на патент Франції FR 2689518. зиновими циклами, морфоліно-, тіоморфоліно-, Похідні стрептограміну загальної формули (І) піперидино-, 1-піролідинільним, 2-, 3- або 4можуть бути, у раз, потреби, очищені фізичними піперидильним або 2- або 3-піролідинільним цикметодами, такими як кристалізація, хроматографія лами (які можуть бути заміщені алкілом), або ж Ra або СРС. означає радикал структури =CHR’a, у якому R’a Деякі похідні стрептограміну загальної формуозначає 3-амінопіролідинільну, 3-(або ли (І) можуть бути перетворені в адитивні солі з 4)амінопіперидильну, 3-оксипіролідинільну, 3-(або кислотами звичайними способами. Зрозуміло, що 4)оксипіперидильну, 3-тіопіролідинільну, 3-(або такі солі, коли вони існують, також входять в об'єм 4)тіопіперидильну груп у, яка може бути заміщена даного винаходу. алкілом; або R’a означає алкіламіно-, алкілоксиЯк приклади адитивних солей з фармацевтичабо алкілтіогрупу, заміщену 1 або 2 гідроксисульно прийнятними кислотами можна назвати солі, фонільними, алкіламіно-, диалкіламіногрупами (які утворені з неорганічними кислотами (гідрохлорисамі можуть бути заміщені диалкіламіногрупою), ди, гідроброміди, сульфати, нітрати, фосфати) або або триалкіламонійною групою, 4- або 5з органічними кислотами (сукцинати, фумарати, імідазолільною групою, або 1 або 2 можливо замітартрати, ацетати, пропіонати, малеати, цитрати, щеними піперазиновими циклами, морфоліно-, метансульфонати, етансульфонати, фенілсультіоморфоліно-, піперидино-, 1-піролідинільним, 2-, фонати, п-толуолсуль фонати, ізотіонати, нафтил3- або 4-піперидильним або 2- або 3сульфонати або камфорсульфонати, або з похідпіролідинільним циклами (які можуть бути заміщеними, які одержують заміщенням зазначених ні алкілом), або сполук). Ra означає 3-(або 4)тіометилхінуклідиніл-; Похідні стрептограміну даного винаходу мають або ж антибактеріальні властивості та властивості, що 2. Ra означає атом водню і приводять до синергізму антибактеріально, активa) або Rb, Re та Rf означають атоми водню, ності похідних стрептограміну гр упи В. Вони особRd означає радикал -NHCH3 або -N(CH3)2 та Rс ливо становлять інтерес внаслідок їхньої сильної означає атом хлору або брому або означає алкеактивності при використанні індивідуально або у ніл, що містить 3-5 атомів вуглецю [якщо Rd ознавигляді асоціацій. чає -N(CH3)2]; Коли вони асоційовані з компонентом або поb) або Rb, Rd, Re та Rf означають атом водню хідним групи В стрептограмінів, то останні можуть та Rс означає атом галогену або аміномоноалкіл, бути обрані в залежності від форми введення, пеамінодиалкіл, алкілоксигрупу, трифторметилоксигроральної або парентеральної, із природних комрупу, тіоалкіл, алкіл С 1-С3 або тригалогенметил; понентів: пристинаміцину ІА, пристинаміцину IB, c) або Rb, Re, Re та Rf означають атом водню пристинаміцину lС, пристинаміцину ID, пристината Rd означає атом галогену або етиламіно-, діеміцину IE, пристинаміцину IF, пристинаміцину IG, тиламіно- або метилетиламіно-, алкілокси- або віргініаміцину S1, S3 або S4 вернаміцину В або С трифторметилоксигрупу, тіоалкіл, алкіл С1-С6, етаміцину, або з напівсинтетичних похідних, таких, арил або тригалогенметил; які описані в патентах або заявках на патент US d) або Rb, Re та Rf означають атом водню та 4618599, US 4798827, US 5326782, ЕР 772630 або Rс означає атом галогену або аміномоноалкіл або ЕР 770132, зокрема, похідних стрептограмінів заамінодиалкіл, алкілокси- або трифторметилоксиггальної формули (А): рупу, тіоалкіл, алкіл С 1-С3 та Rd означає атом галогену або аміногрупу, аміномоноалкіл або амінодиалкіл, алкілокси- або трифторметилоксигрупу, тіоалкіл, алкіл з 1-6 атомами вуглецю або тригалогенметил; е) або Re, Re та Rf означають атом водню та Rb та Rd означають метил; або ж з напівсинтетичних похідних групи В стрептограмінів загальної формули (В): 15 71619 у якій: Υ означає атом азоту або радикал =CR3-; R1 означає атом водню, алкіл (з 1-8 атомами вуглецю), алкеніл (з 2-8 атомами вуглецю), циклоалкіл (з 3-8 атомами вуглецю); насичений або ненасичений (3-8-членний) гетероцикліл; феніл; заміщений [одним або декількома атомами галогену або гідроксильними, алкільними, алкілокси-, алкілтіо-, алкілсульфінільними, алкілсульфонільними радикалами, аміно-, алкіламіно- або диалкіламіногрупами] або феніл радикал NR’R’’, де R’ та R’’, однакові або різні, можуть являти собою атоми водню або алкіли (з 1-3 атомами вуглецю) або разом з атомом азоту, з яким вони зв'язані, можуть утворювати 3-8-членний гетероцикл, можливо утримуючий інший гетероатом, вибраний з атомів кисню, сірки або азоту, можливо заміщеного [алкілом, алкенілом (з 2-8 атомами вуглецю), циклоалкілом (з 3-6 атомами вуглецю), насиченим або ненасиченим (4-6-членним) гетероциклілом, бензилом, фенілом або заміщеним фенілом, таким як зазначено вище при визначенні R1]; або ж, коли Υ означає радикал =CR3-, R1 також може означати галогенметил, гідрокси метил, алкілоксиметил, алкілтіометил, алкільна частина якого можливо заміщена NR’R’’, алкілсульфінілметилом, алкілсульфонілметилом, ацилоксиметилом, бензоїлоксиметилом, циклопропїламінометилом або -(CH2)nNR’R’’ (де n означає ціле число від 1 до 4 та R’ і R’’ мають вказані вище значення), або ж, якщо R3 означає атом водню, то R1 також може означати форміл, карбоксил, алкілоксикарбоніл або -CONR’R’’, у якому R’ та R’’ мають зазначені вище значення; або ж, коли Υ означає атом азоту, R1 також може означати радикал -XR°, у якому X означає атом кисню або сірки, сульфініл або сульфоніл, або радикал NH, та R° означає алкіл (з 1-8 атомами вуглецю), циклоалкіл (з 3-6 атомами вуглецю); насичений або ненасичений (3-8-членний) гетероцикліл; (3-8-членний) гетероциклілметил, гетероциклільна частина якого зв'язана з метильним радикалом через атом вуглецю; феніл; заміщений [одним або декількома атомами галогену або гідроксильними, алкільними, алкілокси-, алкілтіо-, алкілсульфінільними, алкілсульфонільними радикалами; aміно-, алкіламіно- або диалкіламіногрупами] феніл або радикал -(CH2)nNR’R’’, у якому R’ та R’’ мають зазначені вище значення та n означає ціле число від 2 до 4, або ж, якщо X означає ΝΗ, то R° також може означати атом водню; R2 означає атом водню або алкіл (з 1-3 атомами вуглецю); 16 R3 означає атом водню або алкіл, карбоксил, алкілоксикарбоніл аб карбамоїл структури -CONR’R’’, у якій R’ та R’’ мають зазначені вищe значення; Ra означає метил або етил; і Rb, Re та Rd мають зазначені нижче значення: 1) Rb та Rc означають атоми водню та Rd означає атом водню абo метиламіно- або диметиламіногрупу; 2) Rb означає атом водню; Rc означає атом водню, хлору або брому або означає алкеніл (С3С5); та Rd означає радикал -NMe-R’’’, у якому R’’’ означає алкіл, гідроксиалкіл (С2-С4) або алкеніл (С2-С8), можливо заміщений фенілом, циклоалкіл (С3-С6)метилом, бензилом, заміщеним [одним або декількома атомами галогену або гідроксильним, алкільним, алкілокси-, алкілтіо-, алкілсульфінільним, алкілсульфонільним радикалами; аміно-, алкіламіно- або диалкіламіногрупами] бензилом, гетероциклілметилом або гетероциклілетилом, гетероциклільна частина якого є насиченою або ненасиченою та 5-6 членною та містить 1 або 2 гетероатома, вибраних з атомів сірки, кисню або азоту, можливо заміщеного [алкілом, алкенілом (з 2-8 атомами вуглецю), циклоалкілом (з 3-6 атомами вуглецю), насиченим або ненасиченим (4-6членним) гетероциклілом, фенілом, заміщеним фенілом таким як зазначено вище для визначення R1, або бензилом], або ж R’’’ означає ціанометил або радикал -CH2CORe, у якому Re означає -OR'e, де R'е являє собою атом водню, алкіл (з 1-6 атомами вуглецю), алкеніл (з 2-6 атомами вуглецю), бензил або гетероцикліл метил, гетероциклільна частина якого є 5-6-членною та містить 1 або 2 гетероатома, вибраних з атомів сірки, кисню або азоту, або Re означає алкіламіно-, алкілметиламіно-, гетероцикліламіно- або гетероциклілметиламіногрупу, гетероциклільна частина якої є насиченою та 5-6 членною та містить 1 або 2 гетероатома, вибраних з атомів сірки, кисню або азоту, можливо заміщеного алкілом, бензилом або алкілоксикарбонілом; 3) Rb означає атом водню, Rd означає радикал -NНСН3 або -N(СН3)2 та Rc означає атом хлору або брому або означає алкеніл (С3-С5) [якщо Rd означає -N(СН3)2]; 4) Rb та Rd означає атоми водню та Rc означає атом галогену або алкіламіно- або диалкіламіно-, алкілокси-, трифторметоксигрупу; тіоалкіл, алкіл(С 1-С6) або тригалогенметил; 5) Rb тa RC означають атоми водню та Rd означає атом галогену або етиламіно, діетиламіно- або метилетиламіно-, алкілокси-, або трифторметокси, алкілтіогрупу, алкілсульфініл, алкілсульфоніл, алкіл(С 1-С6), феніл або тригалогенметил; 6) Rb означає атом водню та Rc означає атом галогену або алкіламіно- або диалкіламіно-, алкілокси- або трифторметоксигрупу, тіоалкіл, алкіл(С1-С3) та Rd означає атом галогену або аміно-, алкіламіно- або диалкіламіно, алкілокси або трифторметоксигрупу, тіоалкіл, алкіл(С1-С6) або тригалогенметил; 7) Rc означає атом водню та Rb та Rd означають метил; а також їхніх солей. Зрозуміло, що асоціації повних винаходу та стрептограмінів групи В також входять в об'єм да 17 71619 18 ного винаходу. бонілом, алкілоксигрупою або алкілдисульфаніПохідні групи В стрептограмінів структури (В) лом, можливо заміщеними NR’R’’ або -CO-NR’R’’, у можуть бути отримані, методами, описаними в яких NR’R’’ є таким, як зазначено вище], або ж R’3 міжнародній заявці WO 9943699. може бути вибраний з насичених або ненасичених Похідні стрептограміну згідно винаходу вияви3-8-членних гетероциклільних радикалів, можливо лися активними в тесті in vitro у концентраціях, що заміщених [алкілом або ацилом, що самі можливо складають від 0,015 до 32мкг/мл, у відношенні, заміщені NR’R’’], причому гетероцикли вибирають Ztaphylococcus aureus 209P, при використанні інз піролідинілу, імідазолілу, піридилу, піперидинілу, дивідуально або в асоціації з похідним групи В, піперазинілу або морфолінілу; і таким, наприклад, як пристинаміцин ІВ, та в концезв'язок --- означає простий зв'язок (стереохімія нтраціях, що складають від 0,015 до 32мкг/мл, у 27R) або подвійний зв'язок; відношенні StaphyІococcus aureus Schiclia (стійкого а також їхні солі, коли вони існують; та з цих до метициліну), при використанні індивідуально продуктів найбільш цікаві наступні: або асоціації з пристинаміцином ІВ; у тесті іn vi vо (16R)-16-дезоксо-16-фторпристинаміцин ІIB; на мишах вони показують синергічну дію на анти(16R)-16-дезоксо-16-тіоціанопристинаміцин ІІВ; мікробну активність пристинаміцину ІВ у випадку (16R)-16-дезоксо-16-хлорпристинаміцин IIB; експериментальних інфекцій, викликаних (16R)-16-азидо-16-дезоксопристинаміцин IIB; StaphyІococcus aureus IP8203 у дозах, що склада(16R)-16-дезоксо-16-фторпристинаміцин ІІА. ють 5-150мг/кг, при введенні підшкірно (DC50) та Наступні приклади, пояснюють даний винахід, більшість зі сполук були активні також при введеняк дані не обмежуючі обсяг винаходу. ні перорально в дозах, що складають 30-150мг/кг У нижченаведених прикладах номенклатура (DС50). 16-дезоксопристинаміцин ІІА (або ІІВ) означає заміНарешті, продукти винаходу особливо цікаві ну кетоної групи в положенні 16 двома атомами тим, що вони слаботоксичні. Жоден із продуктів не водню. В міру проходження хроматографічної обвиявив токсичності в дозах 150мг/кг у випадку робки усі фракції аналізують тонкошаровою хроStaphylococcus aureus IP8203 при введенні 2 рази матографією (ТШХ) на пластинах з диоксидом в день підшкірно або перорально миші. кремнію Merck 60F254. Фракції, що відповідають Особливий інтерес представляють продукти тій самій плямі в ТШХ, поєднують, потім концентзагальної формули (І) , у яких: рують насухо при зниженому тиску (30°С; 2,7кПа). R1 означає атом фтору, хлор у, брому або йоду Таким чином отримані залишки аналізують звиабо азидо- або тіоціанатогрупу; чайними спектроскопічними методами [ядерний R2 означає метил; магнітний резонанс (ЯМР); інфрачервона спектроR3 означає атом водню або радикал R’3-CO-, у скопія (ІК); мас-спектрометрія (МС)], що дозволяє якому R’3 означає феніл або фенілалкіл, незаміідентифікувати цільовий продукт. щені або заміщені на фенільному радикалі [одним Приклад 1 або декількома радикалами, вибраними з алкілу, (16R)-16-Дезоксо -16-фторпристинаміцин ІІВ можливо такого, що містить радикал NR’R’’, у якоДо розчину 1,12г (16R)-16-дезоксо-16-фтор-14му радикали R’ та R’’, однакові або різні, можуть О-(трет-бутилдифенілсиліл)пристинаміцину ІI B в бути атомами водню або алкільними радикалами, 10см 3 тетрагідрофурану, при температурі 20°С та що разом з атомом азоту, з яким вони зв'язані, в атмосфері аргону, додають 0,2см 3 оцтової кисможуть утворювати насичений або ненасичений 3лоти та 0,6г тригідрату тетра-н8-членний гетероцикліл, можливо утримуючий бутиламонійфториду. Після перемішування протяінший гетероатом, вибраний з атомів кисню, сірки гом 168 годин реакційну суміш концентрують насуабо азоту, причому зазначений вище гетероцикл хо при зниженому тиску (2,7кПа), одержуючи 1г сам може бути також заміщений одним або декільолії каштанового кольору, що очищають флешкома радикалами (алкільним, гідроксиалкільним, хроматографією [елюент: дихлормеалкілоксиалкільним, алкілоксикарбонілалкільним, тан/метанол/ацетонітрил (90/5/5, за об'ємом)]. арильним, насиченими або ненасиченими 3-8Одержують 0,3г (16R)-16-дезоксо-16членними гетероциклільним або гетероциклілалкіфторпристинаміцину ІІВ у вигляді твердої речовильним радикалами або радикалом -CH2-COни світло-бежевого кольору, що плавиться при NR’R’’), або ж R’ і/або R’’ можуть означати гідротемпературі близько 125°С (розкладання). 1 ксиалкіл, феніл, насичений або ненасичений 3-8Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 членний гетероциклілалкіл, радикал -CO-NR’R’’, у (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, якому NR’R’’ має зазначене вище значення, або J=6,5Гц:3Н); 1,55-2,05 (м:5Н); 1,83 (с:3Н); 2,10-2,30 алкіл або ацил, заміщені NR’R’’, зазначеним ви(м:2Н); 2,76 (м:1Н); 2,98 (м:1Н); 3,21 (м:1Н); 3,48 ще], або ж R’3 може являти собою феніл, заміще(м:1Н); 3,87 (м:1Н); 4,07 (м:1Н); 4,55 (м:1Н); 4,75ний одним або декількома радикалами [вибраними 4,90 (м:3Н); 5,14 (нероздільний дублет; з алкільних радикалів, що можуть бути заміщені JHF=48Гц:1); 5,39 (д, J=9Гц:1Н); 5,71 (м: 1Н) ; 5,82 алкілокси- або алкілтіогрупою, що самі можливо (дд, J=17 та 2Гц:1Н); 6,00 (м: 1Н); 6,21 (д, містять карбоксил або радикал NR’R’’, зазначений J=16Гц:1Н); 6,52 (дд, J=17 та 5Гц:1Н); 8,12 (с:1Н). вище, або вибраними з ацилоксигруп, що можуть (16R)-16-дезоксо-16-фтор-14-О-(третбути заміщені NR’R’’, зазначеним вище], або ж R’3 бутилди фенілсиліл)пристинамицин ІІВ може бути може бути вибраний з алкільних або циклоалкіль отриманий таким способом: них радикалів, можливо заміщених {карбоксилом, До розчину 2г (16S)-16-гідрокси-14-О-(треткарбоксиалкілдисульфанілом або радикалом бутилди фенілсиліл)пристинаміцину ІІВ у 50см 3 NR’R’’, -CH2-NR’R’’, -CO-NR’R’’ або алкілоксикардихлорметану, при температурі 20°С та в атмос 19 71619 20 фері аргону, повільно додають 0,464см 3 трифтодихлорметану кип'ятять зі зворотним холодильнириду діетиламіносульфіду. Після перемішування ком протягом 20 хвилин. Додають по краплях, пропротягом 2 годин реакційну суміш виливають у тягом приблизно 30 хвилин, 68,6см 3 оцтової кис3 100см водного насиченого розчину бікарбонату лоти, потім, протягом приблизно 45 хвилин, розчин натрію. Органічну фазу декантують, промивають 2 (попередньо висушений над сульфатом натрію) рази 100см 3 води, сушать над сульфатом магнію, 52,75г пристинаміцину ІІВ у 230см 3 дихлорметану. фільтрують, потім концентрують насухо при зниРеакційну суміш перемішують протягом 4,5 годин женому тиску (2,7кПа), одержуючи 2,1г твердої при температурі кипіння зі зворотним холодильниречовини кольору вохри, яку очищають флешком, потім протягом 16 годин при температурі хроматографією [елюент: градієнт дихлорме20°С. Після цього до реакційної суміші додають тан/ацетонітрил/метанол (100/0/0; 99/0,5/0,5, потім 500см 3 дихлорметану та 1500см 3 води. Органічну 98/1/1, за об'ємом)]. Одержують 1,35г (16R)-16фазу декантують та водну фаз у екстрагують дезоксо-16-фтор-14-О-(трет500см 3 дихлорметану. Органічні фази поєднують бутилди фенілсиліл)пристинаміцину ІІB у вигляді та значення рН доводять до 8 повільним додавантвердої речовини білого кольору, що плавиться ням 1000см 3 водного насиченого розчину бікарбопри температурі близько 116°С (розкладання). нату натрію. Отриману в результаті органічну фазу 1 промивають послідовно 1000см 3 води та 1000см 3 Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 (д, J=6,5Гц:3Н); 0,99 (д, J=6,5Гц:3Н); 1,00-1,15 водного насиченого розчину хлориду натрію, після чого обробляють рослинною сажею 3S, сушать (м:12Н); 1,29(с:3Н); 1,55-1,95 (м:4Н); 1,96 (м:1Н); над сульфатом натрію, фільтрують та концентру2,13 (м:1Н); 2,24 (м:1Н); 2,76 (м:1Н); 2,85 (м:1Н); ють насухо при зниженому тиску (2,7кПа), одер3,03 (м:1Н); 3,39 (м:1Н); 3,80 (м:1Н); 4,01 (м:1Н); жуючи 50г твердої речовини ясно-жовтого кольо4,57 (м: 1Н); 4,72 (м: 1Н); 4,75-4,85 (м:2Н); 5,01 (нероздільний дублет, JHF=48Гц: 1Н); 5,38 (д, ру. До розчину отриманого вище твердої речовини в 900см 3 дихлорметану при температурі 20°С доJ=9Гц:1Н); 5,50 (м:1Н); 5,81 (дд, J=17 та 1,5Гц:1Н); дають 378см 3 0,5Μ водного розчину гідроксиду 5,97 (м:1Н); 6,10 (д, J=15,5 ц:1Н); 6,49 (дд, J=17 та амонію. Після перемішування протягом 16 годин 5Гц:1Н); 7,30-7,50 (м:6Н); 7,63 (шир.д, J=7Гц:2Н); при температурі 20°С органічну фазу декантують, 7,68 (шир.д, J=7Гц:2Н); 8,08 (с:1Н). (16S)-16-гідрокси-14-О-(третпромивають 1000см 3 води, потім 1000см 3 водного насиченого розчину хлориду натрію, сушать над бутилди фенілсиліл)пристинаміцин ІІВ може бути сульфатом натрію, фільтрують та концентрують отриманий таким способом: насухо при зниженому тиску (2,7кПа), одержуючи До розчину 22г (16S)-1646г твердої речовини блідо-жовтого кольору, яку гідроксипристинаміцину ІІВ у 200см 3 дихлорметану, при температурі 20°С та в атмосфері аргону, доочищають флеш-хроматографією [елюент: градієнт дихлорметан/метанол (98/2 та 97/3, за об'дають по краплях 29см 3 діізопропілетиламіну, ємом]. Одержують 31,68г (16S)-1643,2см 3 трет-бутилди фенілхлорсилану та 1,01г 4гідроксипристинаміцину ІІВ у вигляді твердої речодиметиламінопіридину. Після перемішування провини не зовсім білого кольору, що плавиться при тягом 22 годин реакційну суміш виливають у 600см 3 водного насиченого розчину бікарбонату температурі близько 131°С (розкладання). 1 натрію. Водну фазу декантують, потім екстрагують Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 2 рази 100см 3 дихлорметану. Органічні фази по(д, J=6,5Гц:3Н); 1,02 (д, J=6,5Гц:3Н); 1,07 (д, єднують, промивають 400см 3 водного насиченого J=6,5Гц:3Н); 1,70-1,90 (м:3Н); 1,76 (с:3Н); 1,97 розчину хлориду натрію, сушать над сульфатом (м:2Н); 2,12 (м:1Н); 2,26 (шир.д:14,5Гц:1Н); 2,56 (д, натрію, фільтрують, потім концентрують насухо J=3Гц:1Н); 2,76 (м:1Н); 2,90 (дд, J=16 та 10Гц:1Н); при зниженому тиску (2,7кПа), одержуючи 70,6г 3,08 (дд, J=16 та 3Гц:1Н); 3,35 (м:1Н); 3,82 (м:2Н); грузлої олії жовтогарячого кольору, яку перемішу3,99 (д, J=2,5Гц:1Н); 4,40-4,55 (м:2Н); 4,65-4,75 ють у 600см 3 діізопропілового ефіру протягом 16 (м:2Н); 5,03 (м: 1Н) ; 5,65-5,85 (м:3Н); 6,01 (м:1Н); годин. Після фільтрування та висушування при 6,21 (д, J=16Гц:1Н); 6,46 (дд, J=17 та 5Гц:1Н); 8,13 зниженому тиску (2,7кПа) при 20°С одержують 28г (с: 1Н). (16S)-16-гідрокси-14-О-(третПриклад 2 бутилди фенілсиліл)пристинаміцину ІІВ у вигляді (16R)-16-Дезоксо-16-Фторпристинаміцин IIB твердої речовини рожевого кольору, що плавиться До розчину 257г (16R)-16-дезоксо-16-фтор-14при температурі близько 133°С (розкладання). O-(трет-бутил-диметилсиліл)пристинаміцину IIB у 1 2500см 3 дихлорметану протягом 40 хвилин, при Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,95 температурі 40°С та в атмосфері аргону, повільно (д, J=6,5Гц:3Н); 1,00-1,05 (м:9Н); 1,08 (с:9Н); 1,40додають 970см 3 триетиламінтригідрофториду. 1,80 (м:3Н); 1,90-2,15 (м:3Н); 2,23 (шир.д, Після перемішування протягом 2 годин при темпеJ=14Гц:1Н); 2,75 (м:1Н); 2,83 (дд, J=17 та 11Гц:1Н); ратурі 40°С реакційну суміш прохолоджують до 3,10 (дд, J=17 та 2,5Гц:1Н); 3,25 (м: 1Н) ; 3,60-3,75 температури 8°С, потім гідролізують повільним (м:2Н); 4,49 (м:1Н); 4,56 (м:1Н); 4,60-4,70 (м:2Н); додаванням протягом 25 хвилин 1940см 3 води. 4,87 (м:1Н); 5,49 (м:1Н); 5,74 (дд, J=17 та 2Гц:1Н); Після перемішування протягом 10 хвилин органіч5,78 (д, J=9Гц:1Н); 5,95 (м:1Н); 6,04 (д, J=16Гц:1Н); ну та водн у фази декантують та поверхню розділу 6,41 (дд, J=17 та 4Гц:1Н); 7,30-7,50 (м:6Н) ; 7,64 фаз молочного кольору обробляють 4000см 3 води (дд, J=7 та 1,5Гц:2Н); 7,69 (дд, J=7 та 1,5Гц:2Н); та 1000см 3 дихлорметану. Після перемішування 8,11 (с:1Н). двох фаз органічну фазу декантують та водні фази (16S)-16-гідроксипристинаміцин ІІВ може бути поєднують, потім екстрагують 1000см 3 дихлормеотриманий таким способом: 3 тану. Органічні фази поєднують та додають до Суспензію 11,35г боргідриду натрію в 550см 21 71619 22 1500см 3 води. Значення рН водної фази доводять 44,4см 3 діізопропілетиламіну та розчин 39,6г третдо 7 повільним додаванням, протягом 10 хвилин бутилдиметилхлорсилану в 140см 3 дихлорметану. при температурі 10°С, 400см 3 водного насиченого Після перемішування протягом 17 годин реакційну розчину бікарбонату натрію. Органічну фазу декасуміш промивають 3 рази 300см 3 води. Органічну 3 нтують, розбавляють 1500см етилацетату, потім фазу сушать над сульфатом магнію, фільтрують, промивають 1000см 3 води. Органічну фазу деканпотім концентрують насухо при зниженому тиску тують та водн у фазу екстрагують 2 рази 1500см 3 (2,7кПа), одержуючи олію жовтогарячого кольору, що очищають флеш-хроматографією [елюент: етилацетату, після чого фільтрують через целітÒ градієнт дихлорметан/метанол/ацетонітрил на пористому скляному фільтрі. ЦелітÒ промива(100/0/0; від 99/0,5/0,5 до 96/2/2, за об'ємом)]. ють 3 рази 400см 3 етилацетату. Органічні фази Одержують 24г (16S)-16-гідрокси-14-О-(третпоєднують, сушать над суль фатом натрію, потім бутилдиметилсиліл)пристинаміцину ІIB у вигляді фільтрують через целітÒ на пористому скляному твердої речовини ясно-жовтого кольору, що плафільтрі. ЦелітÒ промивають 4 рази 800см 3 етилавиться при температурі близько 139°С (розклацетату. Фільтрат концентрують насухо при знижедання). ному тиску (2,7кПа), одержуючи, після висушуван1 Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,05 ня до постійної маси при температурі 25°С, 218,5г (с:3Н); 0,10 (с:3Н); 0,91 (с:9Н); 0,96 (д, J=6,5Гц:3Н); (16R)-16-дезоксо-16-фторпристинаміцину ІІВ у ви1,02 (д, J=6,5Гц:3Н); 1,06 (д, J=6,5Гц:3Н); 1,70-2,05 гляді білого кристалічного порошку, що плавиться (м:5Н); 1,71 (с:3Н); 2,12 (м:1Н); 2,31 (шир.д, при температурі близько 133°С (розкладання). 1 J=14Гц:1Н); 2,70-2,80 (м:1Н); 2,80 (дд, J=17 та Н-ЯМР-спектр (400МГц, CDCI3, d у м.ч.): 0,96 11Гц:1Н); 3,06 (дд, J=17 та 2,5Гц:1Н); 3,30 (м:1Н); (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, 3,79 (м:2Н); 4,47 (шир.т, J=10Гц:1Н); 4,52 (с:1Н); J=6,5Гц:3Н); 1,55-2,05 (м:5Н); 1,83 (с:3Н); 2,10-2,30 4,54 (м:1Н); 4,65-4,75 (м:2Н); 4,99 (м:1Н) ; 5,69 (м:2Н); 2,76 (м:1Н); 2,98 (м:1Н); 3,21 (м:1Н); 3,48 (м:1Н); 5,76 (дд, J=17 та 2Гц:1Н); 5,78 (д, (м:1Н); 3,87 (м:1Н); 4,07 (м:1Н); 4,55 (м:1Н); 4,75J=9Гц:1Н); 6,00 (м:1Н) ; 6,20 (д, J=16Гц:1Н); 6,43 4,90 (м:3Н); 5,14 (нероздільний дублет, (дд, J=17 та 4Гц:1Н); 8,12 (с:1Н). JHF=48Гц:1Н) ; 5,39 (д, J=9Гц:1Н); 5,71 (м:1Н) ; 5,82 Приклад 3 (дд, J=17 та 2Гц:1Н); 6,00 (м:1Н); 6,21 (д, (16R)-16-Дезоксо-16-Фторпристинаміцин ІIB J=16Гц:1Н); 6,52 (дд, J=17 та 5Гц:1Н); 8,12 (с:1Н). До суспензії 0,09г п-толуолсульфінату натрію в (16R)-16-дезоксо-16-фтор-14-О-(трет6см 3 дихлорметану, при температурі 0°С та в атбутилдиметилсиліл)пристинаміцин ІІВ може бути мосфері аргону, додають 0,5см 3 1Η водного розотриманий таким способом: чину соляної кислоти. Після перемішування протяДотримуючись аналогічної методики прикладу гом 15 хвилин при температурі 20°С органічну 1, але виходячи з розчину 22г (16S)-16-гідроксифазу декантують, сушать над сульфа том магнію 14-O-(трет-бутилдиметилсиліл)пристинаміцину ІІВ та фільтрують. До фільтрату, при температурі у 500см 3 дихлорметану, при температурі 20°С та в 3 20°С та в атмосфері аргону, додають 0,26г (16R)атмосфері аргону повільно додають 6,7см три14-О-аліл-16-дезоксо-16-фторпристинаміцину ІІВ фториду діетиламіносульфіду. Після перемішута 0,04г тетракіс(трифенілфосфін)паладію. Після вання протягом 4 годин та аналогічної обробки за перемішування протягом двох годин додають 0,01г прикладом 1 одержують 25г олії жовтогарячого триетиламіну. Після додаткового перемішування кольору, що очищають фле ш-хроматографїєю протягом 30 хвилин реакційну суміш концентрують [елюент: градієнт дихлорменасухо, потім очищають флеш-хроматографією тан/метанол/ацетонітрил (100/0/0; від 99/0,5/0,5 до [елюент: дихлорметан/метанол/ацетонітрил 96/2/2, за об'ємом)]. Одержують 6,6г (16R)-16(90/5/5, за об'ємом)], одержуючи 0,2г (16R)-16дезоксо-16-фтор-14-О-(третдезоксо-16-фторпристинаміцину ІI B. бутилдиметилсиліл)пристинаміцину ІІB у вигляді 1 Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 твердої речовини ясно-жовтого кольору, що пла(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, виться при температурі близько 128°С (розклаJ=6,5Гц:3Н); 1,50-2,05 (м:5Н); 1,62 (д, J=4Гц:1Н); дання). 1 1,83 (с:3Н); 2,10-2,30 (м:2Н); 2,77 (м:1Н); 2,98 Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,04 (м:1Н); 3,21 (м:1Н); 3,48 (м:1Н); 3,87 (м:1Н); 4,06 (с:3Н); 0,07 (с:3Н); 0,89 (с:9Н); 0,96 (д, J=6,5Гц:3Н); (м:1Н); 4,55 (м:1Н) ; 4,75-4,85 (м:3Н); 5,14 (нероз0,99 (д, J=6,5Гц:3Н); 1,09 (д, J=6,5Гц:3Н); 1,50-2,05 дільний дублет, JHF=48Гц:1Н); 5,39 (д, J=9Гц:1Н); (м:5Н); 1,79 (с:3Н); 2,10-2,25 (м:2Н); 2,76 (м:1Н); 5,72 (м:1Н); 5,82 (дд, J=16 та 2Гц:1Н); 5,98 (м:1Н); 2,90 (м:1Н); 3,15 (м:1Н); 3,43 (м:1Н); 3,88 (м:1Н); 6,21 (д, J=16Гц:1Н); 6,51 (дд, J=16 та 5Гц:1Н); 8,11 4,09 (м:1Н); 4,59 (м:1Н); 4,75 (м:1Н); 4,79 (дд, J=10 (с:1Н). та 1,5Гц:1Н); 4,84 (дд, J=9 та 3Гц:1Н); 5,12 (нероз(16R)-14-О-аліл-16-дезоксо-16дільний дублет, JHF=48Гц:1Н) ; 5,34 (д, J=9Гц:1Н); фторпристинаміцин ІIB може бути отриманий та5,64 (м: 1Н) ; 5,82 (дд, J=17 та 2Гц:1Н); 5,99 (м: ким способом: 1Н); 6,20 (д, J= 16Гц:1Н); 6,50 (дд, J=17 та 5Гц:1Н); До розчину 0,8г (16S)-14-О-аліл-168,09 (с:1Н). гідроксипристинаміцину ІІВ у 25см 3 дихлорметану, (16S)-16-гідрокси-14-О-(третпри температурі 0°С та в атмосфері аргону, додабутилдиметилсиліл)пристинаміцин ІІВ може бути ють по краплях розчин 0,28см 3 трифториду діетиотриманий таким способом: ламіносульфіду в 5см 3 ди хлорметану. Після переДо розчину 27г (16S)-16мішування протягом 45 хвилин при температурі гідроксипристинаміцину ІІВ (отриманого як описано 0°С, потім при температурі 20°С, реакційну суміш в прикладі 1) у 270см 3 дихлорметану, при темпевиливають у 70см 3 водного насиченого розчину ратурі 20°С та в атмосфері аргону, додають 23 71619 24 гідрокарбонату натрію при температурі 0°С. Отрихолодильником ще протягом трьох годин. Реакційману в результаті суміш екстрагують 100см 3 дихну суміш після цього виливають у 80см 3 води, полорметану. Органічну фазу промивають послідовтім нейтралізують додаванням бікарбонату натрію. но 70см 3 водного насиченого розчину Органічну фазу декантують, сушать над сульфагідрокарбонату натрію та 70см 3 водного насиченотом магнію, фільтрують та концентрують насухо го розчину хлориду натрію, потім сушать над супри зниженому тиску (2,7кПа), одержуючи 0,61г льфатом магнію. Після фільтрування та конценттвердої речовини, що очищають флешрування насухо при зниженому тиску (2,7кПа) при хроматографією [елюент: дихлорметан/метанол температурі 20°С одержують 0,8г (16R)-14-O-аліл(96/4, за об'ємом)]. Одержують 0,36г (16R)-1616-дезоксо-16-фторпристинаміцину ІІВ у вигляді дезоксо-16-тіоціанатопристинаміцину ІІВ у вигляді твердої речовини кремового кольору. твердої речовини білого кольору, що плавиться 1 при температурі близько 140°С (розкладання). Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 1 (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, Н-ЯМР-спектр (400МГц; CDCI3) d у м.ч.): 0,96 J=6,5Гц:3Н); 1,50-2,05 (м:5Н); 1,81 (с:3Н); 2,16 (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, (м:1Н); 2,29 (м:1Н); 2,76 (м:1Н); 2,93 (м:1Н); 3,18 J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,85 (с:3Н); 2,10-2,30 (дт, J=17 та 7Гц:1Н); 3,45 (м:1Н); 3,80-3,95 (м:2Н); (м:2Н); 2,77 (м:1Н); 3,15 (дд, J=17 та 7ГЦ:1Н); 3,40 4,00-4,15 (м:2Н); 4,47 (дт, J=9,5 та 4Гц:1Н); 4,59 (дд, J=17 та 7Гц:1Н); 3,52 (м:1Н); 3,62 (м:1Н); 3,83 (м:1Н); 4,78 (дд, J=10 та 1,5Гц:1Н); 4,83 (дд, J=9 та (м:1Н); 4,02 (м:1Н); 4,52 (м:1Н); 4,75-4,85 (м:2Н); 3Гц:1Н); 5,05-5,35 (м:4Н); 5,69 (м:1Н); 5,82 (дд, 4,77 (дд, J=10 та 2Гц:1Н); 5,36 (д, J=9Гц:1Н); 5,77 J=16 та 2Гц:1Н); 5,90 (м:1Н); 6,00 (м:1Н); 6,25 (д, (м:1Н); 5,81 (дд, J=16 та 2Гц:1Н); 6,05 (м:1Н); 6,21 J=16Гц:1Н); 6,51 (дд, J=16 та 4Гц:1Н); 8,11 (с:1Н). (д, J=16Гц:1Н); 6,52 (дд, J=16 та 5Гц:1Н); 8,14 (16S)-14-О-аліл-16-гідроксипристинаміцин ІІВ (с:1Н). може бути отриманий таким способом: (16R)-16-дезоксо-16-тіоціанато-14-О-(третДо розчину 10,6г (16S)-16бутилди фенілсиліл)пристинаміцин ІIB може бути гідроксипристинаміцину ІІВ (отриманого як описано отриманий таким способом: в прикладі 1) у 500см 3 2-бутанону додають 19г До розчину 5,85г тетра-нкарбонату калію та 31,5см 3 алілброміду. Реакційну бутиламонійтіоціанату в 70см 3 дихлорметану, при суміш кип'ятять зі зворотним холодильником протемпературі 20°С та в атмосфері аргону, додають тягом 90 годин. Після охолодження до температу2,6г (16S)-16-гідрокси-14-О-(третри 20°С та фільтрування реакційну суміш концентбутилди фенілсиліл)пристинаміцину ІІВ (отриманорують при зниженому тиску (2,7кПа). Залишок го як описано в прикладі 1), потім, по краплях, обробляють 100см 3 дистильованої води та 300см 3 1,56см 3 трифториду діетиламіносульфіду. Після дихлорметану. Органічну фазу декантують, потім перемішування протягом 10 хвилин реакційну супромивають 100см 3 дистильованої води, сушать міш розбавляють 100см 3 дихлорметану. Отриманад сульфатом магнію, фільтрують та концентруний розчин промивають послідовно 2 рази 100см 3 ють насухо при зниженому тиску (2,7кПа), одерводи та 100см 3 водного насиченого розчину хложуючи 12,5г залишку, що очищають флешриду натрію, потім сушать над сульфатом магнію, хроматографією [елюент: дихлорметан/метанол фільтрують та концентрують насухо при знижено(95/5, за об'ємом)]. Одержують тверду речовину, му тиску (2,7кПа), одержуючи 7,6г олії темнояку перемішують у діетиловому ефірі, відфільтрожовтого кольору, що очи щають флешвують та сушать (2,7кПа) при температурі 20°С, хроматографією [елюент: циклогексан/етилацетат одержуючи 1,4г (16S)-14-О-аліл-16(6/4, за об'ємом)]. Одержують 0,87г (16R)-16гідроксипристинаміцину ІІВ у вигляді білого дезоксо-16-тіоціанато-14-О-(третпорошку. бутилди фенілсиліл)пристинаміцину ІІВ у вигляді 1 твердої речовини білого кольору. Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,97 1 (д, J=6,5Гц:3Н); 1,04 (д, J=6,5Гц:3Н); 1,07 (д, Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 J=6,5Гц:3Н); 1,70-2,05 (м:5Н); 1,75 (с:3Н); 2,12 (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,05-1,10 (м:1Н); 2,34 (шир.д, J=16Гц:1Н); 2,77 (м:1Н); 2,85 (м:3Н); 1,06 (с:9Н); 1,28 (с:3Н); 1,70-1,95 (м:4Н); (дд, J=16 та 10Гц:1Н); 3,09 (дд, J=16 та 3Гц:1Н); 1,96 (м:1Н); 2,10-2,25 (м:2Н); 2,77 (м:1Н); 3,04 (дд, 3,32 (м:1Н); 3,75-3,90 (м:3Н); 4,05-4,15 (м:2Н); 4,42 J=17 та 6Гц:1Н); 3,27 (дд, J=17 та 8Гц:1Н); 3,40(м:1Н); 4,53 (м:1Н); 4,65-4,75 (м:3Н); 5,15-5,30 3,50 (м:2Н); 3,75 (м:1Н); 3,95 (м:1Н); 4,53 (м:1Н); (м:2Н); 5,65-5,80 (м:1Н); 5,70 (шир.д, J=9Гц:1Н); 4,67 (м:1Н); 4,75-4,85 (м:2Н); 5,35 (д, J=9Гц:1Н); 5,80 (дд, J=16 та 1,5Гц:1Н); 5,79 (м:1Н); 5,98 5,56 (м:1Н); 5,81 (дд, J=16 та 1,5Гц:1Н); 6,04 (м:1Н); 6,25 (д, J=16Гц:1Н); 6,45 (дд, J=16 та (м:1Н); 6,11 (д, J=16Гц:1Н); 6,49 (дд, J=16 та 4Гц:1Н); 8,14 (с:1Н). 5Гц:1Н); 7,30-7,50 (м:6Н); 7,63 (шир.д, J=7Гц:2Н); Приклад 4 7,69 (м:2Н); 8,12 (с:1Н). (16R)-16-дезоксо-16-тіоціанатопристинаміцин Приклад 5 ІIB (16R)-16-Дезоксо-16-бромпристинаміцин ІIB До розчину 0,85г (16R)-16-дезоксо-16Дотримуючись аналогічної методики прикладу тіоціанато-14-О-(трет4, але виходячи з розчину 1,2г (16R)-16-дезоксобутилди фенілсиліл)пристинаміцину ІIB в 40см 3 16-бром-14-О-(третдихлорметану при температурі 20°С додають 5см 3 бутилди фенілсиліл)пристинаміцину ІІВ в 30см 3 тригідрофториду триетиламіну. Після перемішудихлорметану, при температурі 20°С додають вання протягом 20 годин при кип'ятінні зі зворот7,5см 3 тригідрофториду триетиламіну. Після пе3 ним холодильником додають 3см тригідрофториремішування протягом 25 годин при кип'ятінні зі ду триетиламіну та кип'ятять зі зворотним зворотним холодильником та аналогічною оброб 25 71619 26 кою за прикладом 4 одержують тверду речовину хлорпристинаміцину ІІВ у вигляді кристалів білого жовтогарячого кольору, що очищають флешкольору, які плавляться при температурі близько хроматографією [елюент: дихлорметан/метанол 142°С (розкладання). 1 (97/3, за об'ємом)]. Одержують 0,78г твердої речоН-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 3 вини білого кольору, що перекристалізують з 5см (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, ацетонітрилу, одержуючи 0,48г (16R)-16-дезоксоJ=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,88 (с:3Н); 2,10-2,25 16-бромпристинаміцину ІІВ у вигляді кристалів не (м:2Н); 2,75 (м:1Н) ; 3,10 (дд, J=17 і 7Гц:1Н); 3,30 зовсім білого кольору, що плавляться при темпе(дд, J=17 і 6,5Гц:1Н); 3,53 (м:1Н); 3,84 (м:1Н); 4,06 ратурі близько 140°С (розкладання). (м: 1Н) ; 4,37 (м: 1Н) ; 4,49 (м: 1Н) ; 4,75-4,90 1 Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 (м:3Н); 5,35 (д, J=9Гц:1Н); 5,76 (м:1Н); 5,83 (дд, (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,09 (д, J=17 і 2Гц:1Н); 5,99 (м: 1Н) ; 6,22 (д, J=15,5Гц: 1Н); J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,90 (с:3Н); 2,15 6,51 (дд, J=17 і 5Гц:1Н); 8,09 (с:1Н). (м:1Н); 2,32 (м:1Н); 2,77 (м:1Н); 3,22 (дд, J=17 та (16R)-16-дезоксо-16-хлор-14-О-(трет7Гц:1Н); 3,44 (дд, J=17 та 7Гц:1Н); 3,52 (м:1Н); 3,83 бутилди фенілсиліл)пристинаміцин І їв може бути (м:1Н); 4,09 (м: 1Н); 4,37 (м:1Н); 4,52 (м: 1Н); 4,75отриманий таким способом: 4,90 (м:2Н); 4,79 (дд, J=10 та 1,5Гц:1Н); 5,34 (д, Дотримуючись аналогічної методики приклада J=9Гц:1Н); 5,75 (м:1Н); 5,82 (дд, J=17 та 1,5Гц:1Н); 4, але виходячи з розчину 7,27г тетра-н6,03 (м:1Н); 6,22 (д, J=16Гц:1Н); 6,52 (дд, J=17 та бутиламонійхлориду в 50см 3 дихлорометану, при 5Гц:1Н);8,11 (с:1Н). температурі 20°С і в атмосфері аргону додають 4г (16R)-16-дезоксо-16-бром-14-О-(трет(16S)-16-гидрокси-14-О-(трет-бутилдифенілсиліл) бутилди фенілсиліл)пристинаміцин ІІВ може бути пристинаміцину ІІВ (отриманого як описано в приотриманий таким способом: кладі 1), потім, по краплях, додають 2,44см 3 триДотримуючись аналогічної методики прикладу фториду діетиламіносульфіду. Після перемішу4, але виходячи з розчину 5,25г тетра-нвання протягом 10 хвилин та аналогічної обробки бутиламонійброміду в 60см 3 дихлорметану, при за прикладом 4, одержують 4,45г твердої речовитемпературі 20°С та в атмосфері аргону, додають ни жовтого кольору, що очищають флеш2,5г (16S)-16-гідрокси-14-О-(третхроматографією [елюент: циклогексан/етилацетат бутилди фенілсиліл)пристинаміцину ІІВ (отримано(55/45, за об'ємом)]. Одержують 0,51г (16R)-16го як описано в прикладі 1), потім повільно додадезоксо-16-хлор-14-О-(третють 1,5см 3 трифториду діетиламіносульфіду. Пісбутилди фенілсиліл)пристинаміцину ІІВ у вигляді ля перемішування протягом 10 хвилин та твердої речовини білого кольору. 1 аналогічної обробки за прикладом 4 одержують Н-ЯМР-спектр (400МГц; CDCI3) d у м.ч.): 0,96 4,6г твердої речовини жовтого кольору, що очи(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,07 (с:9Н); щають флеш-хроматографією [елюент: циклогек1,10 (д, J=6,5Гц:3Н); 1,33 (с:3Н); 1,70-1,90 (м:4Н); сан/ етилацетат (6/4, за об'ємом)]. Одержують 1,96 (м:1Н); 2,05-2,25 (м:2Н); 2,77 (м:1Н); 2,98 (дд, 1,38г (16R)-16-дезоксо-16-бром-14-О-(третJ=17 та 5,5Гц:1Н); 3,16 (дд, J=17 та 8Гц;1Н); 3,45 бутилди фенілсиліл)пристинаміцину ІІВ у вигляді (м:1Н); 3,76 (м:1Н); 4,03 (м:1Н); 4,25 (м:1Н); 4,55 твердої речовини білого кольору. (м:1Н); 4,75-4,85 (м:3Н); 5,34 (д, J=9Гц:1Н); 5,54 1 Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 (м:1Н); 5,82 (дд, J=16 та 2Гц:1Н); 5,99 (м:1Н); 6,11 (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,07 (с:9Н); (д, J=16Гц:1Н); 6,50 (дд, J=16 та 5Гц:1Н); 7,30-7,45 1,10 (д, J=6,5Гц:3Н); 1,37 (с:3Н); 1,70-2,05 (м:5Н); (м:6Н); 7,63 (дд, J=7 та 1,5Гц:2Н); 7,68 (дд, J=7 та 2,14 (м:1Н); 2,31 (м:1Н); 2,77 (м:1Н); 3,12 (дд, J=17 1,5Гц:2Н); 8,08 (с:1Н). і 5,5Гц:1Н); 3,30 (дд, J=17 і 8Гц:1Н); 3,45 (м:1Н) ; Приклад 7 3,77 (м:1Н); 4,03 (м:1Н) ; 4,23 (м:1Н); 4,55 (м:1Н); (16R)-16-Дезоксо-16-йодпристинаміцин ІІВ 4,75-4,85 (м:3Н); 5,33 (д, J=9Гц:1H); 5,54 (м:1H); Дотримуючись аналогічної методики прикладу 5,82Z (шир.д, J=10Гц:1Н); 6,00 (м:1Н); 6,12 (д, 4, але виходячи з розчину 0,83г (16R)-16-дезоксоJ=16Гц:1Н); 6,50 (дд, J=16 і 5Гц:1Н), 7,30-7,45 16-йод-14-О-(трет(м:6Н); 7,63 (шир.д, J=7Гц:2Н); 7,69 (шир.д, бутилди фенілсиліл)пристинаміцину ІІВ у 15см 3 J=7Гц:2Н); 8,08 (с:1Н). дихлорметану, при температурі 20°С додають Приклад 6 6,2см 3 тригідрофториду триетиламіну. Після пе(16R)-16-Дезоксо-16-хлорпристинаміцин ІІВ ремішування протягом 23 годин при кип'ятінні зі Дотримуючись аналогічної методики приклада зворотним холодильником та аналогічною оброб4, але виходячи з розчину 1,4г (16R)-16-дезоксокою за прикладом 4 одержують 0,9г твердої речо16-хлор-14-О-(трет-бутилдифенілсиліл) пристинавини не зовсім білого кольору, що очи щають міцину ІІВ в 35см 3 дихлорометану, при температурі флеш-хроматографією [елюент: дихлорме20°С додають 11см 3 тригідрофториду триетиламітан/метанол/ацетонітрил (98/1/1, за об'ємом)]. ну. Після перемішування протягом 20 годин при Одержують 0,41г твердої речовини жовтого кольокип'ятінні зі зворотним холодильником і аналогічру, що очищають високоефективною рідинною ної обробки за прикладом 4 одержують тверду хроматографією на колонці KromasilÒ з диоксидом речовину жовтогарячогокольору, що очищають кремнію С18, 5мкм (діаметр стовпчика = 2см, довфлеш-хроматографією [елюент: дихлормежина стовпчика = 25см) [елюент: градієнт вотан/метанол (97/3, за об'ємом)]. Одержують 1г да/ацетонітрил (від 80/20 до 60/40, за об'ємом)]. твердої речовини білого кольору, до якого додаОдержують 0,18г твердої речовини білого кольору, ють 0,5г отриманого в ідентичному досліді речовидо якого додають 0,12г отриманих в еквівалентних ни. Після перекристалізації з 10см 3 ацетонітрилу дослідах речовин, одержуючи 0,3г (16R)-16одержують 1,12г (16R)-16-дезоксо-16дезоксо-16-йодпристинаміцину ІІВ у вигляді твер 27 71619 28 дої речовини бежевого кольору, що плавиться при Одержують 0,38г твердої речовини жовтого кольотемпературі близько 140°С (розкладання). ру, до якої додають 0,21г отриманого в ідентично1 му досліді речовини. Після перемішування в діеН-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 тиловому ефірі, фільтрування та висушування при (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,09 (д, зниженому тиску (2,7кПа) при температурі 20°С J=6,5Гц:3Н); 1,67 (д, J=3Гц:1Н); 1,73 (м:1Н); 1,80одержують 0,58г (16R)-16-дезоксо-162,05 (м:4Н); 1,94 (с:3Н); 2,17 (м:1Н); 2,36 (м:1Н); фторпристинаміцину ІІА у вигляді твердої речови2,77 (м:1Н) ; 0,31 (дд, J=17 та 7Гц:1Н); 3,45-3,60 (м:1Н); 3,53 (дд, J=17 та 7Гц:1Н); 3,85 (м:1Н); 4,10 ни ясно-жовтого кольору, що плавиться при температурі близько 110°С (розкладання). (м:1Н); 4,32 (м:1Н); 4,53 (м:1Н); 4,75-4,85 (м:3Н) ; 1 5,31 (д, J=9Гц:1Н); 5,76 (м:1Н); 5,82 (дд, J=17 та Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,99 1,5Гц:1Н); 6,00 (м:1Н); 6,21 (д, J=16Гц:1Н); 6,51 (м:6Н); 1,14 (д, J=6,5Гц:3Н); 1,77 (с:3Н); 1,85-2,10 (дд, J=17 та 5Гц:1Н);8,11 (с:1Н). (м:2Н); 2,28 (м:1Н); 2,65-2,90 (м:3Н); 3,08 (м:1Н); (16R)-16-дезоксо-16-йод-14-О-(трет3,25 (м:1Н); 3,98 (шир.д, J=17Гц:1Н); 4,10-4,25 бутилди фенілсиліл)пристинаміцин ІІВ може бути (м:2Н); 4,31 (м:1Н); 4,55-4,80 (м:2Н); 4,90-5,00 отриманий таким способом: (м:2Н); 5,69 (м:1Н); 5,96 (д, J=16Гц:1Н); 5,99 (д, Дотримуючись аналогічної методики прикладу J=16Гц:1Н); 6,17 (шир.т, J=3Гц:1Н); 6,61 (дд, J=16 4, але виходячи з розчину 7,2г тетра-нта 7Гц:1Н); 7,06 (м:1Н); 7,93 (с:1Н). бутиламоніййодиду в 60см 3 дихлорметану, при (16R)-16-дезоксо-16-фтор-14-О-(треттемпературі 20°С та в атмосфері аргону додають бутилди феніл-силіл)пристинаміцин ІІА може бути 3г (16S)-16-гідрокси-14-О-(третотриманий таким способом: бутилди фенілсиліл)пристинаміцину ІІВ (отриманоДо розчину 65г (16S)-16-гідрокси-14-О-(третго як описано в прикладі 1), потім, по краплях та бутилди феніл-силіл)пристинаміцину ІІА в 700см 3 при температурі 0°С, додають 1,8см 3 трифториду дихлорметану, при температурі 20°С та в атмосдіетиламіносульфіду. Після перемішування протяфері аргону, повільно додають 20,5см 3 трифторигом 20 хвилин при температурі 0°С та аналогічної ду діетиламіносульфіду. Після перемішування обробки за прикладом 4 одержують 10,5г олії жовпротягом 3 годин реакційну суміш повільно вилитогарячого кольору, що перемішують протягом 15 вають у 1000см 3 водного насиченого розчину бікахвилин у 30см 3 суміші циклогексан/етилацетат рбонату натрію. Органічну фазу декантують та (60/40). Після фільтрування та концентрування водну фаз у екстрагують 2 рази 500см 3 дихлормефільтрату при зниженому тиску (2,7кПа) одержутану. Органічні фази поєднують, сушать над сують 5,5г твердої речовини жовтого кольору, що льфатом магнію, фільтрують, потім концентрують очищають флеш-хроматографією [елюент: циклонасухо при зниженому тиску (2,7кПа), одержуючи гексан/етилацетат (60/40, за об'ємом)]. Одержують 67,62г твердої речовини жовтогарячого кольору. 1,81г (16R)-16-дезоксо-16-йод-14-О-(третПісля перемішування твердої речовини в пентані, бутилди фенілсиліл) пристинаміцину ІІВ у вигляді фільтрування та висушування при зниженому тиствердої речовини білого кольору, що плавиться ку (2,7кПа) при температурі 20°С одержують 65,55г при температурі близько 105°С. (16R)-16-дезоксо-16-фтор-14-О-(трет1 бутилди фенілсиліл)пристинаміцину ІІА у вигляді Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): 0,96 твердої речовини жовто-жовтогарячого кольору. (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,05 (с:9Н); 1 1,09 (д, J=6,5Гц:3Н); 1,41 (с:3Н); 1,70-1,95 (м:4Н); Н-ЯМР-спектр (400МГц; CDCI3) d у м.ч.): 0,951,96 (м:1Н); 2,14 (м:1Н); 2,33 (м:1Н); 2,77 (м:1Н); 1,05 (м:6Н); 1,05 (с:9Н); 1,13 (д, J=6,5Гц:3Н); 1,28 3,20 (дд, J=17 та 6Гц:1Н); 3,38 (дд, J=17 та (с:3Н); 1,80-2,10 (м:2Н); 2,10-2,30 (м:1Н); 2,65-2,85 8Гц:1Н); 3,45 (м:1Н); 3,79 (м: 1Н); 4,03 (м:1Н); 4,17 (м:3Н); 2,90-3,15 (м:2Н); 3,95-4,10 (м:2Н); 4,16 (м:1Н); 4,54 (м:1Н); 4,71 (дт, J=9 та 3Гц:1Н); 4,78 (м:1Н); 4,28 (м:1Н); 4,40-4,60 (м:2Н); 4,99 (дд, J=10 (дд, J=10 та 2,5Гц:1Н); 4,75-4,85 (м:1Н); 5,30 (д, та 1,5Гц:1Н); 5,05 (д, J=9Гц:1Н); 5,50 (м:1Н); 5,90 J=9Гц:1Н); 5,55 (м:1Н); 5,81 (дд, J=17 та 2Гц:1Н); (д, J=16Гц:1Н); 6,00 (шир.д, J=17Гц:1Н); 6,16 (т, 5,99 (м:1Н); 6,11 (д, J=16Гц:1Н); 6,49 (дд, J=17 та J=3Гц:1Н); 6,61 (дд, J=17 та 7Гц:1Н); 7,02 (т, 5Гц:1Н); 7,30-7,45 (м:6Н); 7,63 (дд, J=7 та J=5,5Гц:1Н); 7,25-7,50 (м:6Н); 7,58 (шир.д, 1,5Гц:2Н); 7,69 (дд, J=7 та 1,5Гц:2Н); 8,08 (с:1Н). J=7Гц:2Н); 7,67 (шир.д, J=7Гц:2Н); 7,89 (с:1Н). Приклад 8 (16S)-16-гідрокси-14-О-(трет(16R)-16-Дезоксо-16-фторпристинаміцин ІІА бутилди фенілсиліл)пристинаміцин ІІА може бути До розчину 0,97г (16R)-16-дезоксо-16-фтор-14отриманий таким способом: О-(трет-бутилдифенілсиліл)пристинаміцину ІІ А в Дотримуючись аналогічної методики прикладу 8см 3 тетрагідрофурану, при температурі 20°С та в 1, але виходячи з розчину 10г (16S)-16атмосфері аргону, додають 0,2см 3 оцтової кислоти гідроксипристинаміцину ІІА в 100см 3 дихлорметата 0,6г тригідрату тетра-н-бутиламонійфториду. ну, при температурі 20°С та в атмосфері аргону Після перемішування протягом 168 годин реакційдодають 13,2см 3 діізопропілетиламіну, по краплях 3 ну суміш виливають у 50см водного насиченого додають 19,7см 3 трет-бутилди фенілхлорсилану та розчину бікарбонату натрію. Органічну фазу дека0,46г 4-диметиламінопіридину. Після перемішунтують та водну фаз у екстрагують 30см 3 дихлорвання протягом 20 годин та аналогічної обробки за метану. Органічні фази поєднують, сушать над прикладом 1 одержують 35г олії каштанового косульфатом магнію, фільтрують, потім концентрульору, що очищають флеш-хроматографією [елюють насухо при зниженому тиску (2,7кПа), одерент: дихлорметан/метанол/ацетонітрил (96/2/2, за жуючи залишок, що очищають флешоб'ємом)]. Одержують 10,5г (16S)-16-гідрокси-14хроматографією [елюент: дихлормеО-(трет-бутилдифенілсиліл)пристинаміцину ІІА у тан/метанол/ацетонітрил (95/2,5/2,5, за об'ємом)]. вигляді твердої речовини бежевого кольору. 29 71619 30 температурі 30°С, одержуючи 1,69г (16R)-16Н-Н-ЯМР-спектр (400МГц; CDCI3, d у м.ч.): дезоксо-16-фтор-14-О-[4-(морфолін-4-ілметил) 0,90-1,05 (м: 6Н); 1,05-1,15 (м:15Н); 1,90-2,05 (м:3Н); 2,54 (м:1Н); 2,66 (м:1Н); 2,76 (м:1Н); 2,82 бензоїл]пристинаміцину ІІВ у вигляді твердої речовини не зовсім білого кольору, що плавиться при (дд, J=16 та 11Гц:1Н); 3,11 (дд, J=16 та 3Гц:1Н); температурі близько 120°С (розкладання). 3,28 (м:1Н); 3,83 (шир.с:1Н); 4,00-4,15 (м:2Н); 4,50 1 (м:1Н); 4,57 (м:1Н); 4,81 (м:1Н); 4,94 (дд, J=10 та Н-ЯМР-спектр (400МГц; CDCI3; d у м.ч.): 0,96 2Гц:1Н); 5,38 (м:1Н); 5,63 (д, J=9Гц:1Н); 5,88 (дд, (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, J=16 та 1,5Гц:1Н); 5,94 (д, J=16Гц:1Н); 6,01 (т, J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,95 (с:3Н); 2,16 J=3Гц:1Н); 6,34 (м:1Н); 6,47 (дд, J=16 та 5Гц:1Н); (м:1Н); 2,30-2,50 (м:1Н); 2,44 (м:4Н); 2,76 (м:1Н); 7,25-7,50 (м:6Н); 7,62 (дд, J=7 та 1,5Гц:2Н); 7,68 3,05 (дт, J=17 та 6Гц:1Н); 3,29 (м:1Н); 3,49 (м:1Н); (дд, J=7 та 1,5Гц:2Н); 8,06 (с:1Н). 3,55 (с:2Н); 3,71 (м:4Н); 3,89 (м:1Н); 4,09 (м:1Н); (16S)-16-гідроксипристинаміцин ІІА може бути 4,52 (м:1Н); 4,79 (шир.д, J=10Гц:1Н); 4,83 (дд, J=9 отриманий згідно F. Le Goffic та ін., Eur. J. Med. та 3Гц:1Н); 5,18 (нероздільний дублет, Chimica Therapeutica; січень-лютий, - 16(1), 69-72 JHF=48Гц:1Н); 5,45 (д, J=9,5Гц:1); 5,70-5,85 (м:1Н); (1981). 5,82 (шир.д, J=17Гц:1Н); 5,94 (м:1Н); 6,06 (дт, Приклад 9 J=9,5 та 5Гц:1Н); 6,22 (д, J=16Гц:1Н); 6,52 (дд, Метансуль фонат (16R)-16-дезоксо-16-фторJ=17 та 5Гц:1Н); 7,41 (д, J=8Гц:2Н); 7,98 (д, 14-О-[4-(морфолін-4J=8Гц:2Н); 8,14 (с:1Н). ілметил)бензоїл]пристинаміцину ІІ В (16R)-16-дезоксо-16-фтор-14-О-[4-(хлорметил До розчину 0,15г (16R)-16-дезоксо-16-фтор-14)бензоїл]пристинаміцин ІІВ може бути отриманий О-[4-(морфолін-4-ілметил)бензоїл]пристинаміцину таким способом: ІІВ у 5см 3 метанолу при температурі 20°С додають До розчину 5,32г (16R)-16-дезоксо-162см 3 0,1Η розчину метансульфокислоти в етанолі. фторпристинаміцину ІІВ (о триманого як описано в Після перемішування протягом 10 хвилин реакційприкладі 1) у 150см 3 дихлорметану та 2,1см 3 трину суміш концентрують насухо при зниженому тисетиламіну при температурі 10°С додають 2,84г 4ку (2,7кПа), одержуючи залишок білого кольору, (хлорметил)бензоїлхлорида та 0,095г 4який перемішують у 10см 3 діетилового ефіру. Пісдиметиламінопіридину. Після перемішування проля фільтрування, промивання твердої речовини тягом 20 годин при температурі 20°С реакційну 10см 3 діетилового ефіру та висушування при знисуміш промивають послідовно 50см 3 води, 50см 3 женому тиску (2,7кПа) при температурі 20°С одер5%-ного водного розчину бікарбонату натрію, жують 0,15г метансульфонату (16R)-16-дезоксо30см 3 води та 30см 3 водного насиченого розчину 16-фтор-14-О-[4-(морфолін-4хлориду натрію. Органічну фазу сушать над сульілметил)бензоїл]пристинаміцину ІІ В у вигляді тверфатом магнію, фільтрують, потім концентрують дої речовини білого кольору, що плавиться при насухо при зниженому тиску (2,7кПа), одержуючи температурі близько 150°С (розкладання). 7,2г залишку бежевого кольору, що очищають 1 флеш-хроматографією [елюент: градієнт дихлорН Н-ЯМР-спектр (400МГц; (CD3)2SO-d6; d у метан/метанол/ацетонітрил (99/0,5/0,5 та 98/1/1, за м.ч.): 0,85 (д, J=6,5Гц:3Н); 0,95 (д, J=6,5Гц:3Н); об'ємом)]. Одержують 4,5г (16R)-16-дезоксо-161,05 (д, J=6,5Гц:3Н); 1,54 (м:1Н); 1,75-2,00 (м:3Н); фтор-14-O-[4-(хлорметил )бензоїл]пристинаміцину 1,86 (с:3Н); 2,05-2,25 (м:2Н); 2,30-2,45 (м;1Н); 2,32 ІІВ у вигляді твердої речовини ясно-жовтого кольо(с:3Н); 2,78 (м:1Н); 3,05-3,45 (м:6Н); 3,55-3,70 ру. (м:3Н); 3,72 (м:1Н); 3,84 (м:1Н); 3,90-4,05 (м:3Н); 1 4,47 (масив:2Н); 4,70-4,80 (м:2Н); 5,18 (нероздільН-ЯМР-спектр (400МГц; CDCI3; d у м.ч.): 0,96 ний дублет, JHF=48Гц:1Н); 5,55 (д, J=9,5Гц:1Н); (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, 5,66 (м:1Н); 5,81 (шир.д, J=16Гц:1Н); 6,00 (м:1Н); J=6,5Гц:3Н);1,75-2,05 (м:5Н); 1,95 (с:3Н); 2,16 6,21 (д, J=16Гц:1Н); 6,64 (дд, J=16 та 5Гц:1Н); 7,68 (м:1Н); 2,40 (м:1Н); 2,76 (м: 1Н); 3,04 (дт; J=17 та (шир.д, J=7,5Гц:2Н); 8,08 (шир.д, J=7,5Гц:2Н); 8,16 6Гц:1Н); 3,29 (м:1Н); 3,49 (м:1Н); 3,88 (м:1Н); 4,09 (м:1Н); 8,55 (с:1Н); 9,95 (масив:1Н). (м:1Н); 4,53 (м:1Н); 4,62 (с:2Н); 4,78 (дд, J=10 та (16R)-16-дезоксо-16-фтор-14-O-[4-(морфолін2Гц:1Н); 4,83 (дд, J=9 та 3Гц:1Н); 5,18 (нерозділь4-ілметил)бензоїл]пристинаміцин ІІВ може бути ний дублет, JHF=48Гц:1Н); 5,44 (д, J=9,5Гц:1Н); отриманий таким способом: 5,75-5,85 (м:1Н); 5,82 (дд, J=17 та 2Гц:1Н); 5,94 До розчину 2г (16R)-16-дезоксо-16-фтор-14-О(м:1Н); 6,06 (дт, J=9,5 та 5Гц:1Н); 6,22 (д, [4-(хлорметил)бензоїл]пристинаміцину ІІВ в 50см 3 J=16Гц:1Н); 6,52 (дд, J=17 та 5Гц:1Н); 7,47 (д, тетрагідрофурану при температурі 20°С додають J=8Гц:2Н); 8,02 (д, J=8Гц:2Н); 8,14 (с:1Н). 0,44г йодиду натрію та 0,5см 3 морфоліну. Після Приклад 10 перемішування протягом 17 годин при кип'ятінні зі (16R)-16-Дезоксо-16-фтор-14-О-[4-(імідазол-1зворотним холодильником реакційну суміш вилиілметил)бензоїл]пристинаміцин IIВ вають у 50см 3 води, потім екстрагують 2 рази Дотримуючись аналогічної методики прикладу 50см 3 дихлорметану. Органічні фази поєднують, 9, але виходячи з розчину 0,499г (16R)-16-дезоксо3 промивають 2 рази 100см води, сушать над су16-фтор-14-О-[4льфатом магнію, фільтрують, потім концентрують (хлорметил)бензоїл]пристинаміцину ІІВ (отриманонасухо при зниженому тиску (2,7кПа), одержуючи го як описано в прикладі 9) у 30см 3 тетрагідрофу2,5г залишку, який очищають флешрану, при температурі 20°С додають 0,11г йодиду хроматографією [елюент: градієнт дихлорменатрію та 0,099г імідазолу. Після перемішування тан/метанол (100/0; 99/1 та 98/2, за об'ємом)]. протягом 17 годин при кип'ятінні зі зворотним хоОдержують тверду речовину, що перемішують у лодильником та аналогічною обробкою за приклапентані, відфільтровують та суша ть (90Па) при дом 9 одержують 0,5г твердої речовини жовтого 1 31 71619 32 кольору, що очи щають флеш-хроматографією вання протягом 15,5 годин при кип'ятінні зі зворот[елюент: дихлорметан/метанол (97/3, за об'ємом)]. ним холодильником та аналогічною обробкою за Одержують тверду речовину, що перемішують у прикладом 9 одержують залишок, що очищають діетиловому ефірі, відфільтровують та сушать флеш-хроматографією [елюент: дихлорме(90Па) при температурі 20°С, одержуючи 0,289г тан/метанол (95/5, за об'ємом)]. Одержують твер(16R)-16-дезоксо-16-фтор-14-О-[4-(імідазол-1ду речовину, що перемішують у 20см 3 пентану, ілметил)бензоїл]пристинаміцину ІІ В у вигляді твервідфільтровують та суша ть (90Па) при температурі дої речовини жовтого кольору, що плавиться при 20°С, одержуючи 0,14г (16R)-16-дезоксо-16-фтортемпературі близько 136°С (розкладання). 14-О-[41 (діетиламінометил)бензоїл]пристинаміцину ІІВ у Н-ЯМР-спектр (400МГц; CDCI3; d у м.ч.): 0,96 вигляді твердої речовини блідо-жовтого кольору, (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, що плавиться при температурі близько 150°С J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,95 (с:3Н); 2,16 (м:1Н); 2,39 (м:1Н); 2,76 (м:1Н); 3,04 (тд, J=17 та (розкладання). 1 6Гц:1Н); 3,28 (м:1Н); 3,49 (м:1Н); 3,87 (м:1Н); 4,08 Н-ЯМР-спектр (400МГц; CDCI3; d у м.ч.): 0,96 (м:1Н); 4,53 (м:1Н); 4,78 (шир.д, J=10Гц:1Н); 4,83 (д, J=6,5Гц:3Н); 1,03 (м:9Н); 1,09 (д, J=6,5Гц:3Н); (дд, J=9 та 3Гц:1Н); 5,17 (нероздільний дублет, 1,75-2,05 (м:5Н); 1,95 (с:3Н); 2,16 (м:1Н); 2,40 JHF=48Гц:1Н); 5,19 (с:2Н); 5,43 (д, J=9Гц:1Н); 5,78 (м:1Н); 2,52 (до, J=7Гц:4Н); 2,77 (м:1Н); 3,05 (тд, (м:1Н); 5,82 (дд, J=17 та 1,5Гц:1Н); 5,94 (м:1Н); J=17 та 6Гц:1Н); 3,28 (м:1Н) ; 3,48 (м:1Н); 3,61 6,05 (м:1Н); 6,22 (д, J=16Гц:1Н); 6,52 (дд, J=17 та (с:2Н); 3,89 (м:1Н); 4,09 (м:1Н); 4,53 (м:1Н); 4,79 5Гц:1Н); 6,90 (с:1Н); 7,13 (с:1Н); 7,20 (д, J=8Гц:2Н); (шир.д, J=10Гц:1Н); 4,82 (дд, J=9 та 3Гц:1Н); 5,17 7,58 (с:1Н); 8,01 (д, J=8Гц:2Н); 8,14 (с:1Н). (нероздільний дублет, JHF=48Гц:1Н); 5,44 (д, Приклад 11 J=9Гц:1Н); 5,77 (м:1Н); 5,82 (дд, J=17 та 1,5Гц:1Н); (16 R)-16-Дезоксо-16-фтор-14-О-[4-(45,92 (м: 1Н); 6,05 (м:1Н); 6,21 (д, J=6Гц:1Н); 6,50 метилпіперазин-1-ілметил)бензоїл]пристинаміцин (дд, J=16 та 5Гц:1Н); 7,42 (д, J=8Гц:2Н); 7,96 (д, ІІВ J=8Гц:2Н); 8,14 (с:1Н). Дотримуючись аналогічної методики прикладу Приклад 13 9, але виходячи з розчину 2г (16R)-16-дезоксо-16(16R)-16-Дезоксо-16-Фтор-14-О-{4-[((2S)-2фтор-14-О-[4-(хлорметил)бензоїл]пристинаміцину гідроксиметил)піролідин-1ІІВ (отриманого як описано в прикладі 9) у 90см 3 ілметил]бензоїл}пристинаміцин ІІВ тетрагідрофурану, при температурі 20°С додають Дотримуючись аналогічної методики прикладу 0,44г йодиду натрію та розчин 0,65см 3 метилпіпе9, але виходячи з розчину 1г (16R)-16-дезоксо-16разину в 10см 3 тетрагідрофурану. Після перемішуфтор-14-O-[4-(хлорметил)бензоїл]пристинаміцину вання протягом 20 годин при кип'ятінні зі зворотІІВ (отриманого як описано в прикладі 9) у 45см 3 ним холодильником та аналогічною обробкою за тетрагідрофурану, при температурі 20°С додають прикладом 9, одержують 2,4г залишку, що очи ща0,22г йодиду натрію та розчин 0,29см 3 L-пролінолу ють флеш-хроматографією [елюент: дихлормев 5см 3 тетрагідрофурану. Після перемішування тан/метанол (99/1, за об'ємом)]. Одержують тверпротягом 12 годин при кип'ятінні зі зворотним ходу речовину, що перемішують у 15см 3 діетилового лодильником та аналогічною обробкою за приклаефіру, відфільтровують та суша ть (90Па) при темдом 9 одержують 1,25г залишку, який очищають пературі 20°С, одержуючи 1г (16R)-16-дезоксо-16флеш-хроматографією [елюент: дихлормефтор-14-О-[4-(4-метилпіперазин-1тан/метанол (98/2, за об'ємом)]. Одержують тверілметил)бензоїл]пристинаміцину ІІ В у вигляді тверду речовину, яку перемішують у 10см 3 діетилового дої речовини блідо-жовтого кольору, що плавиться ефіру, відфільтровують та суша ть (90Па) при темпри температурі близько 160°С (розкладання). пературі 20°С, одержуючи 0,4г (16R)-16-дезоксо1 16-фтор-14-О-{4-[((2S)-2-гідроксиметил)піролідинН-ЯМР-спектр (400МГц; CDCI3; d у м.ч.): 0,96 1-ілметил]бензоїл}пристинаміцину ІІВ в вигляді (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, твердої речовини білого кольору, що плавиться J=6,5Гц:3Н); 1,75-2,25 (м:6Н); 1,95 (с:3Н); 2,30-2,50 при температурі близько 158°С (розклад). (м:1Н); 2,40 (с:3Н); 2,62 (масив:8Н); 2,76 (м:1Н); 1 3,04 (дт, J=17 та 6Гц:1Н); 3,29 (м:1Н); 3,49 (м:1Н); Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 3,59 (с:2Н); 3,88 (м:1Н); 4,08 (м:1Н); 4,52 (м:1Н); (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, 4,79 (шир.д, J=10Гц:1Н); 4,83 (дд, J=9 та 3Гц:1Н); J=6,5Гц:3Н); 1,55-2,05 (м:8Н); 1,96 (с:3Н); 2,17 5,18 (нероздільний дублет, JHF=48Гц:1Н); 5,44 (д, (м:1Н); 2,29 (м:1Н); 2,41 (м:1Н); 2,77 (м:2Н); 2,96 J=9,5Гц:1Н); 5,70-5,85 (м:1Н); 5,82 (дд, J=17 та (м:1Н); 3,05 (тд, J=17 та 6Гц:1Н); 3,29 (м:1Н); 3,401,5Гц:1Н); 5,95 (м:1Н); 6,05 (дт, J=9,5 та 6Гц:1Н); 3,55 (м:3Н); 3,66 (дд, J=11 та 4Гц:1Н); 3,88 (м:1Н); 6,22 (д, J=16Гц:I); 6,52 (дд, J=17 та 5Гц:1Н); 7,40 4,02 (д, J=13Гц:1Н); 4,09 (м:1Н); 4,53 (м:1Н); 4,79 (д, J=8,5Гц:2Н); 7,97 (д, J=8,5Гц:2Н); 8,14 (с:1Н). (дд, J=10 та 2Гц:1Н); 4,83 (дд, J=9 та 3Гц:1Н); 5,18 Приклад 12 (нероздільний дублет, JHF=48Гц:1Н); 5,45 (д, (16R)-16-Дезоксо-16-Фтор-14-О-[4J=9,5Гц:1Н); 5,78 (м:1Н); 5,82 (дд, J=16 та 2Гц:1Н); (діетиламіно-метил)бензоїл]пристинаміцин ІІВ 5,95 (м:1Н); 6,05 (м:1Н); 6,22 (д, J=16Гц:1Н); 6,52 Дотримуючись аналогічної методики прикладу (дд, J=16 та 5Гц:1Н); 7,38 (д, J=8Гц:2Н); 7,98 (д, 9, але виходячи з розчину 0,55г (16 R)-16-дезоксоJ=8Гц:2Н); 8,14 (с:1Н). 16-фтор-14-О-[4Приклад 14 (хлорметил)бензоїл]пристинаміцину ІІВ (отримано(1R)-16-Дезоксо-16-Фтор-14-O-[4-(2го як описано в прикладі 9) у 30см 3 тетрагідрофупіколіламінометил)бензоїл]пристинаміцин ІІВ рану, при температурі 20°С додають 0,12г йодиду Дотримуючись аналогічної методики прикладу натрію та 0,17см 3 діетиламіну. Після перемішу9, але виходячи з розчину 2г (16R)-16-дезоксо-16 33 71619 34 фтор-14-О-[4-(хлорметил)бензоїл]пристинаміцину Приклад 16 ІІВ (отриманого як описано в прикладі 9) у 20см 3 (16R)-16-Дезоксо-16-фтор-14-О-[4-(піперидинтетрагідрофурану, при температурі 20°С додають 1-іл)бензоїл]пристинаміцин ІІВ 0,44г йодиду натрію та 1,2см 3 2Дотримуючись аналогічної методики прикладу (амінометил)піридину. Після перемішування про9, але виходячи з розчину 0,75г (16R)-16-дезоксотягом 17 годин при кип'ятінні зі зворотним холоди16-фтор-14-O-[4льником та аналогічною обробкою за прикладом 9 (хлорметил)бензоїл]пристинаміцину ІІВ (отриманоодержують 2,1г твердої речовини темно-жовтого го як описано в прикладі 9) у 20см 3 тетрагідрофукольору, яку очищають двома послідовними операну, при температурі 20°С додають 0,16г йодиду раціями флеш-хроматографії [елюент: відповідно, натрію та 0,22см 3 піперидину. Після перемішувандихлорметан/метанол/ацетонітрил (92/4/4 та ня протягом 15 годин при температурі 66°С та 95/2,5/2,5, за об'ємом)]. Одержують тверду речоаналогічній обробці за прикладом 9 одержують 1г вину, яку перемішують в діетиловому ефірі, відфітвердої речовини жовтого кольору, що очи щають льтровують та сушать (90Па) при температурі флеш-хроматографією [елюент: дихлорме20°С, одержуючи 1,59г (16R)-16-дезоксо-16-фтортан/метанол (97/3, за об'ємом)]. Таким чином, піс14-О-[4-(2ля перемішування в діетиловому е фірі, потім у піколіламінометил)бензоїл]пристинаміцину ІІВ в пентані, фільтрування та висушування (90Па) при вигляді твердої речовини білого кольору, що платемпературі 20°С, одержують 0,33г (16R)-16виться при температурі близько 106°С (розклад). дезоксо-16-фтор-14-О-[4-(піперидин-11 іл)бензоїл]пристинаміцину ІІ В в вигляді твердої Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 речовини білого кольору, що плавиться при тем(д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, пературі близько 110°С (розклад). J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,95 (с:3Н); 2,16 1 (м:1Н); 2,40 (м:1Н); 2,77 (м:1Н); 3,05 (дт, J=17 та Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 6Гц:1Н); 3,29 (м:1Н); 3,49 (м:1Н); 3,90 (м:1Н); 3,92 (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, (с:2Н); 3,93 (с:2Н); 4,10 (м: 1Н); 4,53 (м:1Н); 4,79 J=6,5Гц:3Н); 1,35-1,70 (м:6Н); 1,75-2,05 (м:5Н); 1,95 (дд, J=10 та 2Гц:1Н); 4,83 (дд, J=9 та 3,5Гц:1Н); (с:3Н); 2,16 (м:1Н); 2,30-2,50 (м:5Н); 2,76 (м:1Н); 5,18 (нероздільний дублет, JHF=48Гц:1Н); 5,45 (д, 3,05 (тд, J=17 та 6Гц:1Н); 3,29 (м:1Н); 3,49 (м:1Н); J=9Гц:1Н); 5,79 (м:1Н); 5,82 (дд, J=16 та 2Гц:1Н); 3,52 (с:2Н); 3,89 (м:1Н); 4,09 (м:1Н); 4,53 (м:1Н); 5,92 (м:1Н); 6,06 (м:1Н); 6,22 (д, J=16Гц:1Н); 6,51 4,79 (дд, J=10 та 1,5Гц:1Н); 4,83 (дд, J=9 та (дд, J=16 та 5Гц:1Н); 7,18 (дд, J=8 та 5Гц:1Н); 7,30 3Гц:1Н); 5,18 (нероздільний дублет, JHF=48Гц:1Н); (д, J=8Гц:1Н);7,45 (д, J=9Гц:2Н); 7,65 (дт, J=8 та 5,45 (д, J=9,5Гц:1Н); 5,77 (м:1Н); 5,82 (дд, J=16 та 2Гц:1Н); 7,99 (д, J=8Гц:2Н); 8,14 (с:1Н); 8,58 2Гц:1Н); 5,93 (м:1Н); 6,05 (м:1Н); 6,22 (д, (шир.д, J=5Гц:1Н). J=16Гц:1Н); 6,51 (дд, J=16 та 5Гц:1Н); 7,40 (д, Приклад 15 J=8Гц:2Н); 7,97 (д, J=8Гц:2Н); 8,14 (с:1Н). (16R)-16-Дезоксо-1 6-Фтор-14-О-[4-(піролідинПриклад 17 1-іл)бензоїл]пристинаміцин ІІВ (16R)-16-Дезоксо-16-фтор-14-O-{4-[(2Дотримуючись аналогічної методики прикладу гідроксиетил)амінометил]бензоїл}пристинаміцин 9, але виходячи з розчину 1г (16R)-16-дезоксо-16ІІВ фтор-14-О-[4-(хлорметил)бензоїл]пристинаміцину Дотримуючись аналогічної методики прикладу ІІВ (отриманого як описано в прикладі 9) у 50см 3 9, але виходячи з розчину 0,8г (16R)-16-дезоксотетрагідрофурану, при температурі 20°С додають 16-фтор-14-О-[40,22г йодиду натрію та 0,24см 3 піролідину. Після (хлорметил)бензоїл]пристинаміцину ІІВ (отриманоперемішування протягом 7 годин при кип'ятінні зі го як описано в прикладі 9) у 20см 3 тетрагідрофузворотним холодильником та аналогічною обробрану, 0,17г йодиду натрію та 0,14см 3 етаноламіну кою за прикладом 9 одержують залишок, який та після перемішування протягом 16 годин при очищають флеш-хроматографією [елюент: ди хлокип'ятінні зі зворотним холодильником та аналогірметан/метанол (99/1, за об'ємом)]. Таким чином, чною обробкою за прикладом 9 одержують 0,8г після перемішування в 10см 3 пентану, фільтрутвердої речовини бежевого кольору, що очищають вання та висушування (90Па) при температурі флеш-хроматографією [елюент: градієнт дихлор20°С, одержують 0,4г (16R)-16-дезоксо-16-фторметан/метанол (95/5 та 90/10, за об'ємом)]. Після 14-O-[4-(піролідин-1-іл)бензоїл]пристинаміцину ІІВ перемішування в діетиловому ефірі, фільтр ування в вигляді твердої речовини жовтого кольору, що та висушування (90Па) одержують 0,36г твердої плавиться при температурі близько 170°С (розречовини білого кольору, що очи щають висококлад). ефективною рідинною хроматографією на колонці 1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 HypersilÒ, 5мкм (діаметр колонки = 2см, довжина (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, колонки = 25см) [елюент: дихлорметан/метанол J=6,5Гц:3Н); 1,70-2,05 (м:5Н); 1,81 (м:4Н); 1,95 (97/3, за об'ємом)]. Одержують 0,129г (16R)-16(с:3Н); 2,16 (м:1Н); 2,40 (м:1Н); 2,53 (м:4Н); 2,76 дезоксо-16-фтор-14-О-{4-[(2(м:1Н); 3,04 (тд, J=17 та 6Гц:1Н); 3,28 (м:1Н); 3,48 гідроксиетил)амінометил]бензоїл}пристинаміцину (м:1Н); 3,68 (с:2Н); 3,88 (м:1Н); 4,09 (м:1Н); 4,53 ІІВ в вигляді твердої речовини білого кольору, що (м:1Н); 4,79 (дд, J=10 та 1Гц:1Н); 4,83 (дд, J=9 та плавиться при температурі близько 194°С 3гц:1Н); 5,17 (нероздільний дублет, JHF=48Гц:1Н); (розклад). 1 5,45 (д, J=9,5Гц:1Н); 5,77 (м:1Н); 5,81 (дд, J=17 та Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 1,5Гц:1Н); 5,95 (м:1Н); 6,05 (м:1Н); 6,22 (д, (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, J=16Гц:1Н); 6,51 (дд, J=17 та 5Гц:1Н); 7,42 (д, J=6,5Гц:3Н); 1,70-2,05 (м:5Н); 1,95 (с:3Н); 2,16 J=8Гц:2Н); 7,97 (д, J=8Гц:2Н); 8,14 (с:1Н). (м:1Н); 2,39 (м:1Н); 2,76 (м:1Н); 2,81 (т, 35 71619 36 J=5,5Гц:2Н); 3,04 (тд, J=17 та 6Гц:1Н); 3,28 (м:1Н); Після перемішування протягом 15 хвилин знижу3,48 (м:1Н); 3,67 (т, J=5,5Гц:2Н); 3,85-3,95 (м:1Н); ють температуру реакційної суміші до -50°С та 3,88 (с:2Н); 4,09 (м:1Н); 4,52 (м:1Н); 4,78 (шир.д, повільно додають по краплях розчин 2г (16R)-16J=10Гц:1Н); 4,82 (дд, J=9 та 3Гц:1Н); 5,17 (нероздезоксо-16-фтор-14-О-[4дільний дублет, JHF=48Гц:1Н); 5,44 (д, J=9,5Гц:1Н); (хлорметил)бензоїл]пристинаміцину ІІВ (отримано5,78 (м:1Н); 5,81 (шир.д, J=16Гц:1Н); 5,93 (м:1Н); го як описано в прикладі 9) в 10см 3 тетрагідрофу6,05 (м:1Н); 6,22 (д, J=16Гц:1Н); 6,51 (дд, J=16 та рану. Після перемішування протягом 3 годин при 5Гц:1Н); 7,40 (д, J=8Гц:2Н); 7,99 (д, J=8Гц:2Н); 8,13 температурі -50°С та 15 годин при температурі (с:1Н). 20°С знову знижують температуру реакційної суПриклад 18 міші до -50°С та додають по краплях розчин, при(16R)-16-Дезоксо-16-Фтор-14-О-(4-[(2готовлений як зазначено вище, при температурі діетиламіно)етилтіометил]бензоїл}пристинаміцин 50°С, але з 0,2см 3 меркаптооцтової кислоти та ІІВ 2,32см 3 розчину бутиллітію (2,5Μ в гексані) в 5см 3 3 До розчину 0,46см 2-діетиламіноетантіолу в тетрагідрофурану. Після перемішування при тем10см 3 тетрагідрофурану при температурі 0°С допературі -50°С протягом 5 годин реакційну суміш дають 0,82см 3 розчину бутиллітію (2,5Μ в гексані). виливають у 100см 3 води та значення рН доводять Після перемішування протягом 15 хвилин додають до 3-4 додаванням 0,1н водного розчину соляної по краплях, протягом 15 хвилин, розчин 1,4г (16R)кислоти. Після додавання 20см 3 дихлорметану та 16-дезоксо-16-фтор-14-О-[420см 3 водного насиченого розчину хлориду натрію (хлорметил)бензоїл]пристинаміцину ІІВ (отриманоорганічну фазу декантують та водну фазу екстраго як описано в прикладі 9) в 15см 3 тетрагідрофугують 20см 3 дихлорметану. Органічні фази поєдрану. Після перемішування протягом 6,5 годин при нують, сушать над суль фатом магнію, фільтрують температурі 0°С та 15 годин при температурі 20°С та концентрують насухо при зниженому тиску додають по краплях розчин, приготовлений як за(2,7кПа), одержуючи 2,1г твердої речовини жовтозначено вище, але з 0,153см 3 2го кольору, що очищають флеш-хроматографією діетиламіноетантіолу та 0,205см 3 розчину бутиллі[елюент: дихлорметан/метанол/ацетонітрил тію (2,5Μ в гексані) в 0,5см 3 тетрагідрофурану. (90/5/5, за об'ємом)]. Таким чином, після переміПісля перемішування протягом 3,5 годин при темшування в діетиловому ефірі, фільтрування та пературі 20°С реакційну суміш концентрують насувисушування (90Па) при температурі 20°С, одерхо при зниженому тиску (2,7кПа), одержуючи зажують 0,21г (16R)-16-дезоксо-16-фтор-14-О-[4лишок, що обробляють 20см 3 дихлорметану. (карбоксиметилтіометил)бензоїл]пристинаміцину Отриманий розчин промивають 50см 3 води, потім ІІВ в вигляді твердої речовини жовтого кольору, що декантують. Водну фазу екстрагують 20см 3 дихлоплавиться при температурі близько 142°С рметану. Органічні фази поєднують, промивають 2 (розклад). 1 рази 70см 3 води, суша ть над сульфатом магнію, Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 фільтрують та концентрують насухо при знижено(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, му тиску (2,7кПа), одержуючи 1,6г твердої речовиJ=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,95 (с:3Н); 2,17 ни жовтого кольору, що очищають флеш(м:1Н); 2,39 (м:1Н); 2,76 (м:1Н); 3,05 (дт, J=17 та хроматографією [елюент: дихлорме6Гц:1Н); 3,08 (с:2Н); 3,28 (м:1Н); 3,50 (м:1Н); 3,88 тан/метанол/ацетонітрил (92/4/4, за об'ємом)]. Та(м:1Н); 3,88 (с:2Н); 4,10 (м:1Н); 4,52 (м:1Н); 4,78 ким чином, після перемішування в пентані, фільт(дд, J=10 та 2Гц:1Н); 4,83 (дд, J=9 та 3,5Гц:1Н); рування та висушування (2,7кПа) при температурі 5,19 (нероздільний дублет, JHF=48Гц:1Н); 5,44 (д, 20°С, одержують 0,926г (16R)-16-дезоксо-16-фторJ=9Гц:1Н); 5,78 (м:1Н); 5,83 (дд, J=16 та 2Гц:1Н); 14-О-{4-[(26,00 (м:1Н); 6,05 (м:1Н); 6,22 (д, J=16Гц:1Н); 6,52 діетиламіно)етилтіометил]бензоїл}пристинаміцину (дд, J=16 та 5Гц:1Н); 7,41 (д, J=8Гц:2Н); 7,97 (д, ІІВ в вигляді твердої речовини бежевого кольору, J=8Гц:2Н); 8,16 (с:1Н). що плавиться при температурі близько 84°С (розПриклад 20 клад). (16R)-16-Дезоксо-16-фтор-14-О-(4-[(21 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,90діетиламіно)етоксиметил]бензоїл}пристинаміцин 1,05 (м:12Н); 1,10 (д, J=6,5Гц:3Н); 1,75-2,05 (м:5Н); ІІВ 1,96 (с:3Н); 2,16 (м:1Н); 2,40 (м:1Н); 2,50 (м:6Н); До розчину 1г (16R)-16-дезоксо-162,62 (м:2Н); 2,76 (м:1Н); 3,05 (дт, J=17 та 6Гц:1Н); фторпристинаміцину ІІВ (о триманого як описано в 3,29 (м:1Н); 3,49 (м:1Н); 3,77 (с:2Н); 3,89 (м:1Н); прикладі 1) в 15см 3 дихлорметану при температурі 4,09 (м:1Н); 4,53 (м:1Н); 4,78 (дд, J=10 та 20°С додають 0,6г 4-((21,5Гц:1Н); 4,83 (дд, J=9 та 3Гц:1Н); 5,17 (нероздідіетиламіно)етоксиметил)бензойної кислоти, 0,05г льний дублет, JHF=48Гц:1Н); 5,45 (д, J=9Гц:1Н); 4-диметиламінопіридину, 0,43г Ν,Ν'5,78 (м:1Н); 5,82 (дд, J=17 та 1,5Гц:1Н); 5,92 дициклогексилкарбодііміду та 2г сульфату магнію. (м:1Н); 6,05 (м:1Н); 6,22 (д, J=16Гц:1Н); 6,52 (дд, Після перемішування протягом 40 годин при темJ=17 та 5Гц:1Н); 7,40 (д, J=8,5Гц:2Н); 7,97 (д, пературі 20°С додають 0,24г 4-((2J=8,5Гц:2Н); 8, 14 (с:1Н). діетиламіно)етоксиметил)бензойної кислоти, Приклад 19 0,025г 4-диметиламінопіридину та 0,2г Ν,Ν'(16R)-16-Дезоксо-16-Фтор-14-O-[4дициклогексилкарбодііміду. Після перемішування (карбоксиметилтіометил)бензоїл]пристинаміцин ІІВ протягом додаткових 3 годин при температурі До розчину 0,4см 3 меркаптооцтової кислоти в 20°С реакційну суміш фільтрують та нерозчинну 10см 3 тетрагідрофурану при температурі 0°С дочастину промивають 20см 3 дихлорметану. Фільт3 дають 4,64см розчину бутиллітію (2,5Μ в гексані). рат промивають 3 рази 100см 3 води, сушать над 37 71619 38 сульфатом магнію, фільтрують, потім концентрупотім 50см 3 диметилформаміду. Після перемішують насухо при зниженому тиску (2,7кПа), одервання протягом 17 годин при температурі 20°С жуючи 1,5г твердої речовини бежевого кольору, додають 100см 3 метанолу, потім реакційну суміш що очищають флеш-хроматографією [елюент: концентрують насухо при зниженому тиску градієнт дихлорметан/метанол/ацетонітрил (90/5/5 (2,7кПа), одержуючи олію жовтого кольору, яку та 84/8/8, за об'ємом)]. Таким чином, після перерозбавляють 200см 3 етилацетату. Отриманий роз3 мішування в 20см діетилового ефіру, фільтруванчин промивають 300см 3 води. Водну фазу декання та висушування одержують 0,86г твердої речотують, потім екстрагують 100см 3 етилацетату. Ор3 вини білого кольору, що розчиняють в 20см ганічні фази поєднують, промивають 2 рази 500см 3 дихлорметану. Отриманий розчин промивають 2 води, сушать над сульфатом магнію, фільтрують рази 50см 3 водного насиченого розчину бікарбоната концентрують насухо при зниженому тиску ту натрію, сушать над сульфатом магнію, фільт(2,7кПа), одержуючи 10г олії жовтого кольору, яку рують, потім концентрують при зниженому тиску очищають флеш-хроматографією [елюент: граді(2,7кПа) при температурі 20°С, одержуючи 0,67г єнт дихлорметан/метанол (96/4 та 90/10, за об'(16R)-16-дезоксо-16-фтор-14-О-{4-[(2ємом)]. Таким чином одержують 3,67г метил 4-[(2діетиламіно)етоксиметил]бензоїл}пристинаміцину діетиламіно)етоксиметил]бензоату в вигляді олії ІІВ в вигляді твердої речовини білого кольору, що жовтого кольору. 1 плавиться при температурі близько 76°С Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 1,02 (розклад). (т, J=7,5Гц:6Н); 2,58 (к, J=7,5Гц:4Н); 2,70 (т, 1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 J=6Гц:2Н); 3,57 (т, J=6Гц:2Н); 3,88 (c:3H); 4,56 (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,05 (т, (c:2H); 7,38 (д, J=8Гц:2Н); 7,99 (д, J=8Гц:2Н). J=7Гц:6Н); 1,10 (д, J=6,5Гц:3Н); 1,75-2,05 (м:5Н); Приклад 21 1,95 (с:3Н); 2,16 (м:1Н); 2,40 (м:1Н); 2,60 (до, (16R)-16-Дезоксо-16-фтор-14-О-[3-(морфолінJ=7Гц:4Н); 2,72 (т, J=6,5Гц:2Н); 2,77 (м:1Н); 3,04 4-ілметил)бензоїл]пристинаміцин ІІВ (дт, J=17,5 та 6Гц:1Н); 3,29 (м:1Н); 3,49 (м:1Н); Дотримуючись аналогічної методики прикладу 3,59 (т, J=6,5Гц:2Н); 3,89 (м:1Н); 4,09 (м:1Н); 4,53 9, але виходячи з розчину 1г (16R)-16-дезоксо-16(м:1Н); 4,59 (с:2Н); 4,79 (дд, J=10 та 2Гц:1Н); 4,83 фтор-14-О-[3-(хлорметил)бензоїл]пристинаміцину (дд, J=9 та 3,5Гц:1Н); 5,18 (нероздільний дублет, ІІВ в 25см 3 тетрагідрофурану, при температурі JHF=48Гц:1Н); 5,45 (д, J=9Гц:1Н); 5,78 (м:1Н); 5,82 20°С додають 0,212г йодиду натрію та 0,253см 3 (дд, J=17 та 2Гц:1Н); 5,92 (м:1Н); 6,05 (м:1Н); 6,22 морфоліну Після перемішування протягом 16 го(д, J=16Гц:1Н); 6,51 (дд, J=17 та 5Гц:1Н); 7,41 (д, дин при кип'я тінні зі зворотним холодильником та J=8Гц:2Н); 7,99 (д, J=8Гц:2Н); 8,14 (с:1Н). аналогічною обробкою за прикладом 9 одержують 4-[(2-Діетиламіно)етоксиметил]бензойна кис1г твердої речовини жовтого кольору, що очи щалота може бути отримана наступним чином: ють флеш-хроматографією [елюент: градієнт дихДо розчину 3,67г метил 4-[(2лорметан/метанол/ацетонітрил (100/0/0, потім діетиламіно)етоксиметил]бензоату в 50см 3 мета98/1/1, за об'ємом)]. Таким чином одержують 0,8г нолу при температурі 20°С додають 28см 3 1н водтвердої речовини жовтого кольору яка після переного розчину гідроксиду натрію. Після перемішумішування в 10см 3 діетилового ефіру, фільтруванвання протягом 2,5 годин при температурі 20°С ня та висушування (90Па) при температурі 20°С значення рН реакційної суміші встановлюють рівдає 0,68г (16R)-16-дезоксо-16-фтор-14-O-[3ним 5 додаванням 29см 3 1н водного розчину соля(морфолін-4-ілметил)бензоїл]пристинамицину ІІВ в ної кислоти. Реакційну суміш концентрують насухо вигляді твердої речовини білого кольору, що плапри зниженому тиску (2,7кПа), одержуючи заливиться при температурі близько 198°С (розклад). 3 1 шок, що перемішують в 50см метанолу. Після Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 відфільтровування нерозчинної частини, фільтрат (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, концентрують насухо при зниженому тиску J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,96 (с:3Н); 2,17 (2,7кПа), одержуючи залишок, що перемішують в (м:1Н); 2,35-2,50 (м:1Н); 2,46 (м:4Н); 2,76 (м:1Н); 50см 3 дихлорметану. Після відфільтровування 3,05 (тд, J=17 та 6Гц:1Н); 3,29 (м:1Н); 3,45-3,60 нерозчинної частини, фільтрат концентрують на(м:1Н); 3,54 (с:2Н); 3,72 (м:4Н); 3,88 (м:1Н); 4,10 сухо при зниженому тиску (2,7кПа) при температу(м:1Н); 4,53 (м:1Н); 4,79 (дд, J=10 та 1,5Гц:1Н); рі 20°С, одержуючи 3,5г 4-[(24,83 (дд, J=9 та 3Гц:1Н); 5,18 (нероздільний дубдіетиламіно)етоксиметил]бензойної кислоти в вилет, JHF=48Гц:1Н); 5,45 (д, J=9Гц:1Н); 5,79 (м:1Н); гляді олії жовтого кольору. 5,82 (дд, J=17 та 2Гц:1Н); 5,93 (м:1Н); 6,06 (м:1Н); 1 Н-ЯМР-спектр (300МГц; (CD3)2SO-d6; d в м.ч.): 6,22 (д, J=16Гц:1Н); 6,52 (дд, J=17 та 5Гц:1Н); 7,40 1,07 (т, J=7,5Гц:6Н); 2,79 (к, J=7,5Гц:4Н); 2,93 (т, (т, J=8Гц:І); 7,56 (шир.д, J=8Гц:1Н); 7,92 (шир.д, J=6,5Гц:2Н); 3,66 (т, J=6,5Гц:2Н); 4,57 (c:2H); 7,42 J=8Гц:1Н); 7,96 (шир.с:1Н); 8,14 (с:1Н). (д, J=8Гц:2Н); 7,92 (д, J=8Гц:2Н). (16R)-16-Дезоксо-16-фтор-14-О-[3Метил 4-[(2-діетиламіно)етоксиметил]бензоат (хлорметил)бензоїл]пристинамицин ІІВ може бути може бути отриманий наступним чином: отриманий наступним чином: До розчину 5,8см 3 Ν,Ν-діетилетаноламіну в До розчину 5г (16R)-16-дезоксо-1615см 3 диметилформаміду при температурі 0°С фторпристинаміцину ІІВ (о триманого як описано в додають 2,64г гідриду натрію (60%мас, в вазеліноприкладі 1) в 250см 3 дихлорметану при темперавій олії). Після перемішування протягом 1 години турі 20°С додають 2см 3 триетиламіну, 2см 3 3при температурі 0°С додають по краплях, протя(хлорметил)бензоїлхлориду та 0,23г 4гом 20 хвилин, розчин 10г метил 4диметиламінопіридину. Після перемішування про(бромметил)бензоату в 10см 3 диметилформаміду, тягом 24 годин при температурі 20°С реакційну 39 71619 40 суміш промивають 3 рази 120см 3 води, сушать над рану, при температурі 20°С додають 0,263г йодиду сульфатом магнію, фільтрують, потім концентрунатрію та 0,238г імідазолу. Після перемішування ють насухо при зниженому тиску (2,7кПа), одерпротягом 16 годин при кип'ятінні зі зворотним хожуючи тверду речовину жовтого кольору, яку пелодильником та аналогічною обробкою за прикларемішують в 50см 3 діетилового ефіру. Після дом 9 одержують 0,9г твердої речовини жовтого фільтрування, промивання твердої речовини 2 кольору, яку очищають флеш-хроматографією рази 10см 3 діетилового ефіру та висушування при [елюент: градієнт дихлормезниженому тиску (2,7кПа) при температурі 20°С тан/метанол/ацетонітрил (98/1/1, потім 96/2/2, поодержують 5,56г (16R)-16-дезоксо-16-фтор-14-Отім 90/5/5, за об'ємом)]. Таким чином одержують [3-(хлорметил)бензоїл]пристинаміцину ІІВ в вигляді 0,53г (16R)-16-дезоксо-16-фтор-14-O-[3-(імідазолтвердої речовини білого кольору, що плавиться 1-ілметил)бензоїл]пристинаміцину ІІВ в вигляді при температурі близько 190°С (розклад). твердої речовини жовтого кольору, яка плавиться 1 при температурі близько 125°С (розклад). Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 1 (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 J=6,5Гц:3Н); 1,80-2,05 (м:5Н); 1,96 (с:3Н); 2,17 (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, (м:1Н); 2,40 (м:1Н); 2,76 (м:1Н); 3,05 (дт, J=17 та J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,95 (с:3Н); 2,16 6Гц:1Н); 3,29 (м:1Н); 3,50 (м:1Н); 3,88 (м:1Н); 4,10 (м:1Н); 2,38 (м:1Н); 2,76 (м:1Н); 3,04 (дт, J=17 та (м:1Н); 4,53 (м:1Н); 4,63 (с:2Н); 4,79 (дд, J=10 та 6Гц:1Н); 3,28 (м:1Н); 3,50 (м:1Н); 3,86 (м:1Н); 4,10 2Гц:1Н); 4,84 (дд, J=9 та 3Гц:1Н); 5,18 (нерозділь(м:1Н); 4,53 (м:1Н); 4,79 (дд, J=10 та 2Гц:1Н); 4,83 ний дублет, JHF=48Гц:1Н); 5,45 (д, J=9,5Гц:1Н); (дд, J=9 та 4Гц:1Н); 5,17 (с:2Н); 5,17 (нероздільний 5,77-5,85 (м:1Н); 5,82 (дд, J=16 та 1,5Гц:1Н); 5,92 дублет, JHF=48Гц:1Н); 5,43 (д, J=9Гц:1Н); 5,79 (м:1Н); 6,07 (дт, J=9,5 та 5Гц:1Н); 6,23 (д, (м:1Н); 5,82 (дд, J=16 та 2Гц:1Н); 5,97 (м:1Н); 6,06 J=16Гц:1Н); 6,52 (дд, J=16 та 5Гц:1Н); 7,46 (т, (м:1Н); 6,22 (д, J=16Гц:1Н); 6,52 (дд, J=16 та J=8Гц:1Н); 7,61 (шир.д, J=8Гц:1Н); 7,99 (шир.д, 5Гц:1Н); 6,91 (масив:1Н); 7,11 (шир.с:1Н); 7,32 J=8Гц:1н); 8,04 (шир.с:1Н); 8,14 (с:1Н). (шир.д, J=8Гц:1Н); 7,44 (т, J=8Гц:1Н); 7,57 Приклад 22 (шир.с:1Н); 7,88 (шир.с:1Н); 7,99 (шир.д, Метансуль фонат (16R)-16-дезоксо-16-фторJ=8Гц:1Н); 8,14 (с:1Н). 14-О-[3-(імідазол-1Приклад 23 ілметил)бензоїл]пристинаміцину ІІ В (16R)-16-Дезоксо-16-фтор-14-О-[3До розчину 0,450г (16R)-16-дезоксо-16-фтор(діетиламінометил)бензоїліпристинаміцин ІІВ 14-O-[3-(імідазол-1Дотримуючись аналогічної методики прикладу ілметил)бензоїл]пристинаміцину ІІВ в 10см 3 етано9, але виходячи з розчину 1г (16R)-16-дезоксо-16лу при температурі 20°С додають 6,28см 3 0,1н фтор-14-О-[3-(хлорметил)бензоїл]пристинаміцину розчину метансульфокислоти в етанолі. Після пеІІВ (отриманого як описано в прикладі 21) в 25см 3 ремішування протягом 10 хвилин реакційну суміш тетрагідрофурану, при температурі 20°С додають концентрують насухо при зниженому тиску 0,217г йодиду натрію та 0,3см 3 діетиламіну. Після (2,7кПа), одержуючи залишок, який перемішують у перемішування протягом 16 годин при кип'ятінні зі 7см 3 діетилового ефіру. Після фільтрування, прозворотним холодильником та аналогічною обробмивання твердої речовини 2 рази 2см 3 діетилового кою за прикладом 9 одержують 1г твердої речовиефіру та висушування при зниженому тиску ни жовтого кольору, яку очищають флеш(2,7кПа) одержують 0,479г метансульфонату хроматографією [елюент: градієнт дихлорме(16R)-16-дезоксо-16-фтор-14-О-[3-(імідазол-1тан/метанол/ацетонітрил (100/0/0, потім 98/1/1, за ілметил)бензоїл]пристинаміцину ІІ В в вигляді твероб'ємом)]. Одержують тверду речовину, яку передої речовини білого кольору, що плавиться при мішують в пентані, відфільтровують та сушать температурі близько 160°С (розклад). (2,7кПа) при температурі 20°С, одержуючи 0,313г 1 (16R)-16-дезоксо-16-фтор-14-O-[3Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 (діетиламінометил)бензоїл]пристинаміцину ІІВ в (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,11 (д, вигляді твердої речовини жовтого кольору, яка J=6,5Гц:3Н); 1,75-2,05 (м:5Н); 1,96 (с:3Н); 2,17 плавиться при температурі близько 115°С (м:1Н); 2,37 (м:1Н); 2,77 (м:1Н); 2,86 (с:3Н); 3,05 (розклад). (м:1Н); 3,29 (м:1Н); 3,53 (м:1Н); 3,85 (м:1Н); 4,11 1 (м:1Н); 4,53 (м:1Н); 4,80 (шир.д, J=10Гц:1Н); 4,84 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 (дд, J=9 та 3Гц:1Н); 5,18 (нероздільний дублет, (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3К); 1,05-1,15 JHF=48Гц:1Н); 5,35-5,50 (м:3Н); 5,82 (м:1Н); 5,86 (м:9Н); 1,75-2,05 (м:5Н); 1,97 (с:3Н); 2,16 (м:1Н); (шир.д, J=17Гц:1Н); 6,07 (м:1Н); 6,11 (м:1Н); 6,22 2,41 (м:1Н); 2,56 (м:4Н); 2,77 (м:1Н); 3,05 (тд, J=17 (д, J=16Гц:1Н); 6,55 (дд, J=17 та 5Гц:1Н); 7,10 та 6Гц:1Н); 3,29 (м:1Н); 3,49 (м:1Н); 3,64 (шир.с:1Н); 7,43 (шир.с:1Н); 7,54 (м:2Н); 7,95 (шир.с:2Н); 3,89 (м:1Н); 4,10 (м:1Н); 4,53 (м:1Н); (шир.с:1Н); 8,09 (м:1Н); 8,12 (с:1Н); 9,11 4,79 (дд, J=10 та 1,5Гц:1Н); 4,83 (дд, J=9 та (шир.с:1Н). 3Гц:1Н); 5,19 (нероздільний дублет, JHF=48Гц:1Н); (16R)-16-Дезоксо-16-фтор-14-О-[3-(імідазол-15,46 (д, J=9,5Гц:1Н); 5,78 (м:1Н); 5,82 (дд, J=16 та ілметил)бензоїл]пристинаміцин ІІВ може бути 2Гц:1Н); 5,94 (м:1Н); 6,06 (м:1Н); 6,23 (д, отриманий наступним чином: J=16Гц:1Н); 6,52 (дд, J=16 та 5Гц:1Н); 7,40 (т, Дотримуючись аналогічної методики прикладу J=8Гц:1Н); 7,62 (м:1Н); 7,91 (д, J=8Гц:1Н); 7,97 9, але виходячи з розчину 1,2г (16R)-16-дезоксо(шир.с:1Н); 8,14 (с:1Н). 16-фтор-14-О-[3Приклад 24 (хлорметил)бензоїл]пристинаміцину ІІВ (отримано(16R)-16-Дезоксо-16-фтор-14-O-[4-(морфолінго як описано в прикладі 21) в 30см 3 тетрагідрофу4-ілметил)фенілацетил]пристинаміцин ІІВ 41 71619 42 До розчину 0,87г (16R)-16-дезоксо-16-фтор-14магнію, фільтрують та концентрують насухо при О-[4-(галогенметил)фенілацетил]пристинаміцину зниженому тиску (2,7кПа) при температурі 20°С, ІІВ (суміш хлор- та бромпохідних) в 5см 3 диметилодержуючи 1,04г (16R)-16-дезоксо-16-фтор-14-Оформаміду при температурі 20°С додають 0,25см 3 [4-(галогенметил)фенілацетил]пристинаміцину ІІВ морфоліну та кілька кристалів йодиду натрію. Піс(суміш хлор- та бромпохідних) в ви гляді твердої ля перемішування протягом 15 хвилин при темперечовини жовтого кольору. ратурі 85°С реакційну суміш виливають у 90см 3 4-(Бромметил)фенілацетилхлорид може бути води. отриманий відповідно до заявки на патент ЕР Водну фазу декантують, потім екстрагують 2 274999. рази 50см 3 етилацетату. Органічні фази поєднуПриклад 25 ють, промивають послідовно 30см 3 води та 30см 3 Метансуль фонат (16R)-16-дезоксо-16-фторводного насиченого розчину хлориду натрію, потім 14-О-[(2-імідазол-1сушать над сульфатом магнію, фільтрують та конілетокси)ацетил]пристинаміцину ІІВ центрують насухо при зниженому тиску (2,7кПа). До розчину 0,19г (16R)-16-дезоксо-16-фтор-14Таким чином одержують 0,91г твердої речовини О-[(2-імідазол-1-ілетокси)ацетил]пристинаміцину коричнево-жовтогарячого кольору, яку очищають ІІВ в 8см 3 етанолу при температурі 20°С додають флеш-хроматографією [елюент: дихлорме0,26см 3 1,09н розчину метансульфокислоти в етатан/метанол/ацетонітрил (92/4/4, за об'ємом)], нолі. Після перемішування протягом 10 хвилин одержуючи 0,46г твердої речовини жовтого кольореакційну суміш концентрують насухо при знижеру, яку обробляють 5см 3 дихлорметану. Після фіному тиску (2,7кПа), одержуючи маслянистий залишок, який перемішують в 5см 3 діетилового ефільтрування через целітÒ, целітÒ промивають диру. Розчинник потім видаляють при зниженому хлорметаном. Фільтрат концентрують насухо при зниженому тиску (2,7кПа), одержуючи 0,42г твертиску (2,7кПа). Таким чином отриману тверду речовину перемішують в 5см 3 діетилового ефіру, дої речовини жовтого кольору, яку перемішують після чого відфільтровують, промивають діетилопротягом 15 хвилин в 5см 3 води. Після фільтрувим ефіром та сушать при зниженому тиску вання та висушування при зниженому тиску (2,7кПа), одержуючи 0,189г метансульфонату (2,7кПа) при температурі 20°С одержують 0,38г (16R)-16-дезоксо-16-фтор-14-О-[4-(морфолін-4(16R)-16-дезоксо-16-фтор-14-О-[(2-імідазол-1ілетокси)ацетил]пристинаміцину ІІВ в вигляді поілметил)фенілацетил]пристинаміцину ІІВ в вигляді рошку білого кольору, який плавиться при темпетвердої речовини жовтого кольору, яка плавиться ратурі близько 115°С (розклад). при температурі близько 100°С (розклад). 1 1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,95 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 (м:6Н); 1,12 (д, J=6,5Гц:3Н); 1,50-2,25 (м:7Н); 1,86 (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,09 (д, (с:3Н); 2,79 (м:1Н); 2,83 (с:3Н); 3,02 (м:1Н); 3,26 J=6,5Гц:3Н); 1,60-2,05 (м:5Н); 1,85 (с:3Н); 2,10-2,30 (м:1Н); 3,58 (м:1Н); 3,72 (м:1Н); 3,80-3,90 (м:2Н); (м:2Н); 2,44 (м:4Н); 2,76 (м:1Н); 2,97 (дт, J=17 та 4,00-4,15 (м:3Н); 4,34 (м:1Н); 4,50-4,60 (м:2Н); 4,806Гц:1Н); 3,22 (м:1Н); 3,40-3,55 (м:1Н); 3,48 (с:2Н); 4,90 (м:2Н); 4,90-5,00 (м:1Н); 4,94 (шир.д, 3,59 (с:2Н); 3,71 (м:4Н); 3,85 (м:1Н); 4,04 (м: 1Н); J=10Гц:1Н); 5,75-5,95 (м:2Н); 6,06 (шир.д, 4,52 (м:1Н); 4,78 (шир.д, J=10Гц:1Н); 4,82 (дд, J=9 J=16Гц:1Н); 6,12 (д, J=16Гц:1Н); 6,65 (дд, J=16 та та 3Гц:1Н); 5,06 (нероздільний дублет, 5Гц:1Н); 6,95 (м:1Н); 7,30 (шир.с:1Н); 7,36 JHF=48Гц:1Н); 5,31 (д, J=9Гц:1Н); 5,75-5,85 (м:1Н); (шир.с:1Н); 8,12 (с:1Н); 9,18 (шир.с:1Н); 14,73 5,75 (м:1Н); 5,81 (шир.д, J=17Гц:1Н); 5,93 (м:1Н); (шир. масив:1Н). 6,18 (д, J=16Гц:1Н); 6,51 (дд, J=17 та 4Гц:1Н); 7,22 (16R)-16-Дезоксо-16-фтор-14-О-[(2-імідазол-1(д, J=8Гц:2Н); 7,29 (д, J=8Гц:2Н); 8,12 (с:1Н). ілетокси)ацетил]пристинаміцин ІІВ може бути (16R)-16-Дезоксо-16-фтор-14-О-[4отриманий наступним чином: (галогенметил)фенілацетил]пристинаміцин ІІВ (суДо розчину 1,3г (16R)-16-дезоксо-16-фтор-14міш хлор- та бромпохідних) може бути отриманий О-[2-хлоретоксиацетил]пристинаміцину ІІВ в 6,5см 3 наступним чином: диметилсульфоксиду при температурі 20°С додаДо розчину 2г (16R)-16-дезоксо-16ють 0,41г імідазолу та кілька кристалів йодиду нафторпристинаміцину ІІВ (о триманого як описано в трію. Після перемішування протягом 4 годин при прикладі 1) в 60см 3 дихлорметану протягом 5 хвитемпературі 60°С додають 0,3г йодиду натрію. лин додають, при температурі 20°С та в атмосфері Після перемішування ще протягом 4 годин при аргону, 1,3см 3 діізопропілетиламіну та 1,75г 4температурі 60°С, 72 годин при температурі 85°С, (бромметил)фенілацетилхлориду. Після переміпотім 60 годин при температурі 20°С, реакційну шування протягом 16 годин при температурі 20°С суміш виливають в суміш 35см 3 води з льодом, реакційну суміш промивають послідовно 2 рази 3 3 потім додають 0,17г бікарбонату натрію. Після фі25см води та 25см водного насиченого розчину льтрування, промивання твердої речовини водою, хлориду натрію, потім суша ть над сульфатом магпотім висушування на повітрі одержують маслянинію, фільтрують та концентрують насухо при знистий залишок, який розбавляють 30см 3 дихлормеженому тиску (2,7кПа). Таким чином одержують тану. Після концентрування при зниженому тиску 2,79г твердої речовини жовтогарячого кольору, яку (2,7кПа) одержують 1,23г твердої речовини жовтоочищають флеш-хроматографією [елюент: ди хлого кольору, яку очищають флеш-хроматографією рметан/метанол (97/3, за об'ємом)], одержуючи 1,3г твердої речовини жовтого кольору, яку обробна діоксиді кремнію АміконÒ, 20-40 A [елюент: ляють 50см 3 етилацетату. Отриманий розчин продихлорметан/метанол/ацетонітрил (88/6/6, за об'мивають 2 рази 25см 3 водного насиченого розчину ємом)]. Таким чином одержують 0,64г (16R)-16бікарбонату натрію, потім сушать над сульфатом дезоксо-16-фтор-14-О-[(2-імідазол-1 43 71619 44 їлетокси)ацетил]пристинаміцину ІІ В в вигляді тверв 150см 3 дихлорметану. Отриманий розчин продої речовини блідо-жовтого кольору. мивають три рази 20см 3 дистильованої води, су1 шать над сульфатом магнію, фільтрують, потім Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 концентрують насухо при зниженому тиску (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, (2,7кПа), одержуючи 1,7г залишку, який очищають J=6,5Гц:3Н); 1,65-2,05 (м:5Н); 1,89 (с:3Н); 2,10-2,30 флеш-хроматографією [елюент: дихлорме(м:2Н); 2,76 (м:1Н); 2,99 (дт, J=17 та 6,5Гц:1Н); тан/метанол (94/6, за об'ємом)]. Одержують твер3,24 (м:1Н); 3,51 (м:1Н); 3,75-3,90 (м:3Н); 4,03 (АВсистема обмежена:2Н); 4,07 (м:1Н); 4,17 (т, ду речовину, яка після перемішування в діізопропіловому ефірі, фільтрування та висушування J=5Гц:2Н); 4,55 (м:1Н); 4,75-4,85 (м:2Н); 5,10 (не(2,7кПа) при температурі 20°С, приводить до 0,52г роздільний дублет, JHF=48Гц:1Н); 5,24 (д, (16R)-14-О-{3,3-диметил-3-[4,6-диметил-2-(4J=9Гц:1Н); 5,78 (м: 1Н): 5,80-5,95 (м:1Н); 5,87 (дд, морфолін-4-ілбутирил-окси)феніл]пропіоніл}-16J=16 та 2Гц:1Н); 6,18 (д, J=16Гц:1Н); 6,31 (м:1Н); 6,56 (дд, J=16 та 5Гц:1Н); 7,01 (с:1Н); 7,08 (с:1Н); дезоксо-16-фторпристинаміцину ІІ В в вигляді твердої речовини білого кольору, яка плавиться при 7,59 (с:1Н); 8,12 (с:1Н). температурі близько 88°С (розклад). (16R)-16-дезоксо-16-фтор-14-O-[21 хлоретоксиацетил]пристинамицин ІІВ може бути Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 отриманий наступним чином: (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,09 (д, До розчину 5,32г (16R)-16-дезоксо-16J=6,5Гц:3Н); 1,40-1,60 (м:1Н); 1,56 (с:3Н); 1,58 фторпристинаміцину ІІВ (о триманого як описано в (с:3Н); 1,75-2,05 (м:7Н); 1,80 (с:3Н); 2,14 (м:1Н); прикладі 1) в 130см 3 дихлорметану при темпера2,25 (с:3Н); 2,40-2,50 (м:6Н); 2,54 (с:3Н); 2,63 (т, турі 20°С додають 3,1г Ν,Ν'J=7,5Гц:2Н); 2,70-2,80 (м:1Н); 2,75 (д, J=15Гц:1Н); дициклогексилкарбодііміду, 0,61г 42,85 (д, J=15Гц:1Н); 2,91 (м:1Н); 3,15 (м:1Н); 3,45 диметиламінопіридину та 2,08г 2(м:1Н); 3,73 (т, J=5Гц:4Н); 3,86 (м:1Н); 4,01 (м:1Н); хлоретоксиоцтової кислоти в вигляді розчину в 4,53 (м:1Н); 4,70-4,95 (м:1Н); 4,77 (дд, J=10 та 20см 3 дихлорметану. Після перемішування протя1,5Гц:1Н); 4,80 (дд, J=9 та 3Гц:1Н); 5,11 (д, гом 1 години при температурі 20°С реакційну суJ=9Гц:1Н); 5,66 (м:1Н); 5,71(м:1Н); 5,81 (дд, J=17 міш фільтрують та залишок промивають дихлорта 2Гц:1Н); 5,93 (м:1Н); 6,12 (д, J=16Гц:1Н); 6,50 метаном. Фільтрат концентрують насухо при (дд, J=17 та 5Гц:1Н); 6,61 (д, J=1,5Гц:1Н); 6,81 зниженому тиску (2,7кПа), одержуючи 7,68г твер(шир.с:1Н); 8,12 (с:1Н). дої речовини жовтогарячого кольору, яку очища(16R)-14-О-{3-[2-(4-бромбутирилокси)-4,6ють флеш-хроматографією на діоксиді кремнію диметилфеніл]-3,3-диметилпропіоніл}-16-дезоксо16-фторпристинаміцин ІІВ може бути отриманий АміконÒ, 20-40 [елюент: дихлормеA наступним чином: тан/етилацетат (50/50, за об'ємом)]. Таким чином До розчину 2,7г 3-[2-(4-бромбутирилокси)-4,6одержують 4,68г (16R)-16-дезоксо-16-фтор-14-Одиметилфеніл]-3,3-диметилпропіонової кислоти в [2-хлоретоксиацетил]пристинаміцину ІІВ в вигляді 150см 3 дихлорметану додають, при температурі порошку білого кольору. 1 20°С та в атмосфері аргону, 1,2г Ν,Ν'Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 дициклогексилкарбодііміду, 2,06г (16R)-16(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, дезоксо-16-фторпристинаміцину ІІ В (отриманого як J=6,5Гц:3Н); 1,70-2,05 (м:5Н); 1,90 (с:3Н); 2,15 описано в прикладі 1) та 0,07г 4(м:1Н); 2,26 (м:1Н); 2,76 (м:1Н); 2,99 (дт, J=17 та диметиламінопіридину. Після перемішування про6Гц:1Н); 3,24 (м: 1Н); 3,50 (м:1Н); 3,67 (т, тягом 18 годин реакційну суміш фільтрують для J=6Гц:2Н); 3,80-3,90 (м:1Н); 3,83 (т, J=6Гц:2Н); 4,05 видалення нерозчинної частини. Фільтрат проми(м:1Н); 4,14 (АВ-система необмежена, J=13Гц:2Н); вають чотири рази 25см 3 дистильованої води, су4,52 (м:1Н); 4,78 (дд, J=10 та 1,5Гц:1Н); 4,82 (дд, шать над сульфатом магнію, фільтрують, потім J=9 та 3Гц:1Н); 5,12 (нероздільний дублет, концентрують насухо при зниженому тиску JHF=48Гц:1Н); 5,31 (шир.д, J=9Гц:І); 5,78 (м:1Н); (2,7кПа), одержуючи 4,6г залишку, який очищають 5,82 (дд, J=16 та 2Гц:1Н); 5,85-5,95 (м:2Н); 6,19 (д, двома послідовними операціями флешJ=16Гц:1Н); 6,52 (дд, J=16 та 5Гц:1Н); 8,12 (с:1Н). хроматографії [елюент: дихлорметан/метанол 2-хлоретоксиоцтова кислота може бути отри(96/4, потім 97/3, за об'ємом)]. Одержують 1,6г мана згідно E.J. Corey та Christopher J.Helal, (16R)-14-О-{3-[2-(4-бромбутирилокси)-4,6Tetrahedron Letters, Vol. 3Z, №28, pp. 4837-4840, диметилфеніл]-3,3-диметилпропіоніл}-16-дезоксо1996. 16-фторпристинаміцину ІІВ в вигляді твердої речоПриклад 26 вини кремового кольору. (16R)-14-О-{3,3-диметил-3-[4,6-диметил-2-(41 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 морфолін-4-іл-бутирилокси)феніл]пропіоніл}-16(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, дезоксо-16-фторпристинаміцин ІІВ J=6,5Гц:3Н); 1,45-2,05 (м:12Н); 1,79 (с:3Н); 2,13 До розчину 1,6г (16R)-14-О-{3-[2-(4(м:1Н); 2,24 (с:3Н); 2,29 (м:2Н); 2,54 (с:3Н); 2,70бромбутирилокси)-4,6-диметилфеніл]-3,32,90 (м:5Н); 2,91 (м:1Н); 3,15 (м:1Н); 3,45 (м:1Н); диметилпропіоніл}-16-дезоксо-163,56 (т, J=6,5Гц:2Н); 3,86 (м:1Н); 4,01 (м:1Н); 4,53 фторпристинамицину ІІВ в 8см 3 диметилсульфок(м:1Н); 4,75-4,95 (м:1Н); 4,77 (дд, J=10 та 2Гц:1Н); сиду додають, при температурі 20°С та в атмос4,80 (дд, J=9 та 3Гц:1Н); 5,12 (д, J=9Гц:1Н); 5,60фері аргону, 0,48см 3 морфоліну. Після перемішу5,75 (м:2Н); 5,81 (дд, J=16 та 2Гц:1Н); 5,92 (м:1Н); вання протягом 30 хвилин при температурі 60°С 6,13 (д, J=16Гц:1Н); 6,50 (дд, J=16 та 5Гц:1Н); 6,59 реакційну суміш виливають в 300см 3 суміші води з (д, J=1,5Гц:1Н); 6,82 (д, J=1,5Гц:1Н); 8,12 (с:1Н). льодом. Осад відфільтровують , промивають два 3 3-[2-(4-бромбутирилокси)-4,6-диметилфеніл]рази 20см дистильованої води, потім розчиняють 45 71619 46 3,3-диметилпропіонова кислота може бути отриконформера в співвідношенні 80-20): 1,50 та 1,52 мана наступним чином: (2с:6Н в цілому); 2,00 - 2,10 (м:2Н); 2,23 та 2,24 До розчину 2,3г 3-[2-(4-бромбутирилокси)-4,6(2с:3Н в цілому); 2,30 (м:2Н); 2,54 (с:3Н); 2,78 (т, диметилфеніл]-3,3-диметилпропаналю в 200см 3 J=7Гц:2Н); 3,50-3,60 (м:4Н); 6,55 та 6,56 (2 ацетону при температурі 20°С додають по краплях шир.с:1Н в цілому); 6,82 та 6,84 (2 шир.с:1Н в розчин 1г перманганату калію в суміші 46см 3 дисцілому). тильованої води та 30см 3 ацетону. Після перемі4-Бромбутират 2-{3-(третшування протягом 24 годин до реакційної суміші бутилдиметилсилілокси)-1,1-диметилпропіл}-3,5додають 100см 3 дистильованої води, підкисляють диметилфенолу може бути отриманий наступним до значення рН, рівного 1-2, додаванням 1н водчином: ного розчину соляної кислоти, потім екстрагують До розчину 3,22г 2-{3-(третп'ять разів 100см 3 дихлорметану. Органічні фази бутилдиметилсилілокси)-1,1-диметилпропіл}-3,5поєднують, сушать над сульфатом магнію, фільтдиметилфенолу в 60см 3 тетрагідрофурану додарують, потім концентрують насухо при зниженому ють, при температурі 20°С та в атмосфері аргону, тиску (2,7кпа). Одержують 2,7г 3-[2-(4маленькими порціями 0,32г гідриду натрію (75% в бромбутирилокси)-4,6-диметилфеніл]-3,3мінеральній олії), потім через 15 хвилин додають диметилпропіонової кислоти в вигляді безбарвної 1,16см 3 4-бромбутирилхлориду. Після перемішуолії. вання протягом 40 хвилин додають 100см 3 діети1 лового ефіру, 10см 3 дистильованої води та 10см 3 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): (2 водного насиченого розчину хлориду натрію. Після конформера в співвідношенні 80-20): 1,58 та 1,59 перемішування органічну фазу декантують, су(2с:6Н в цілому); 2,23 та 2,24 (2с:3Н в цілому); 2,29 шать над сульфатом магнію, фільтрують, потім (м:2Н); 2,54 та 2,55 (2с:3Н в цілому); 2,78 (т, J=7Гц:2Н); 2,84 та 2,87 (2с:2Н в цілому); 3,55 (т, концентрують насухо при зниженому тиску (2,7кПа), одержуючи залишок, який фільтрують з J=6,5Гц:2Н); 6,57 та 6,59 (2 шир.с:1Н в цілому); використанням 75г діоксиду кремнію (грануломет6,81 та 6,83 (2 шир.с:1Н в цілому). рія 0,063 - 0,2мм), елююючи послідовно циклогек3-[2-(4-бромбутирилокси)-4,6-диметилфеніл]саном, потім сумішшю циклогексан/етилацетат 3,3-диметилпропаналь може бути отриманий наступним чином: (90/10, за об'ємом). Таким чином одержують 2г 4бромбутирату 2-{3-(трет-бутилдиметилсилілокси)До суспензії 3,1г піридинійхлорхромату в 1,1-диметилпропіл}-3,5-диметилфенолу в вигляді 900см 3 дихлорметану при температурі 24°С додабезбарвної олії. ють по краплях розчин 2,5г 3-[2-(41 бромбутирилокси)-4,6-диметилфеніл]-3,3Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): (2 диметилпропан-1-олу в 160см 3 дихлорметану. конформера в співвідношенні 80-20): 0,00 та 0,03 Після перемішування протягом 2 годин при темпе(2с:6Н в цілому); 0,87 та 0,89 (2с:9Н в цілому); ратурі 24°С реакційну суміш фільтрують з викори1,45-1,55 (м:6Н); 2,05 (т, J=7,5Гц:2Н); 2,24 та 2,25 станням 630г діоксиду кремнію (гранулометрія (2 с:3Н в цілому); 2,31 (м:2Н); 2,54 (с:3Н); 2,77 (т, 0,063 - 0,2мм), елююючи послідовно чистим дихJ=7,5Гц:2Н); 3,40-3,65 (м:4Н); 6,56 та 6,58 (2 лорметаном, потім сумішшю ди хлорметана та шир.с:1Н в цілому); 6,81 та 6,83 (2 шир.с:1Н в етилацетата (80/20, за об'ємом). Таким чином цілому). одержують 2,4г 3-[2-(4-бромбутирилокси)-4,62-{3-(трет-бутилдиметилсилілокси)-1,1диметилфеніл]-3,3-диметилпропаналю в вигляді диметилпропіл}-3,5-диметилфенол може бути безбарвної в'язкої олії. отриманий згідно K.L. Amsberry, Α.Ε. 1 Gerstenberger, R.T. Borchardt, Pharm. Res., 8 (4), Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): (2 455-61 (1991). конформера в співвідношенні 80-20): 1,57 (с:6Н); Приклад 27 2,25 (с:3Н); 2,29 (м:2Н); 2,55 (с:3Н); 2,78 (т, Метансуль фонат (16R)-16-дезоксо-16-фторJ=7Гц:2Н); 2,80-2,90 (м:2Н); 3,56 (т, J=6Гц:2Н); 6,59 14-О-[4-(гморфолін-4-іл)бутирил]пристинаміцину та 6,61 (2 шир.с:1Н в цілому); 6,85 та 6,87 (2 ІІВ шир.с:1Н в цілому); 9,55 (шир.с:1Н). До розчину 0,453г (16R)-16-дезоксо-16-фтор3-[2-(4-бромбутирилокси)-4,6-диметилфеніл]14-O-[4-(морфолін-4-іл)бутирил]пристинаміцину ІІВ 3,3-диметилпропан-1-ол може бути отриманий в 10см 3 етанолу при температурі 20°С додають наступним чином: 6,58см 3 0,1н розчину метансульфокислоти в етаДо розчину 5,4г 4-бромбутирату 2-{3-(третнолі. Після перемішування протягом 10 хвилин бутилдиметилсилілокси)-1,1-диметилпропіл}-3,5реакційну суміш концентрують насухо при знижедиметилфенолу в 60см 3 дихлорметану додають по ному тиску (2,7кПа), одержуючи залишок, який краплях, при температурі 0°С та в атмосфері арперемішують в 10см 3 діетилового ефіру. Після гону, 2,24см 3 тригідрофториду триетиламіну. Після фільтрування, промивання твердої речовини 4см 3 перемішування протягом 42 годин при температурі діетилового ефіру та висушування при зниженому 20°С реакційну суміш фільтрують з використанням тиску (2,7кПа) при температурі 20°С одержують 750г діоксиду кремнію (гранулометрія 0,063 0,506г метансульфонату (16R)-16-дезоксо-160,2мм), елююючи послідовно дихлорметаном, пофтор-14-О-[4-(морфолін-4тім сумішшю ди хлорметан/етилацетат (90/10, за іл)бутирил]пристинаміцину ІІВ в вигляді твердої об'ємом). Таким чином одержують 2,6г 3-[2-(4речовини білого кольору, яка плавиться при тембромбутирилокси)-4,6-диметилфєніл]-3,3пературі близько 122°С (розклад). диметилпропан-1-олу в вигляді безбарвної в'язкої 1 олії. Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 1 (д, J=6,5Гц:3Н); 0,99 (д, J=6,5Гц:3Н); 1,10 (д, Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): (2 47 71619 48 J=6,5Гц:3Н); 1,60-2,00 (м:5Н); 1,89 (с:3Н); 2,10-2,30 турі 60°С додають додаткові 0,5г імідазолу та про(м:4Н); 2,48 (т, J=7Гц:2Н); 2,77 (м:1Н); 2,82 (с:3Н); довжують перемішувати протягом 2 годин при 2,88 (м:2Н); 2,99 (дт, J=17 та 6Гц:1Н); 3,13 (м:2Н); температурі 65°С. Суміш концентрують при зни3,23 (дт, J=17 та 6Гц:1Н); 3,45-3,60 (м: 3Н); 3,82 женому тиску (2,7кПа), одержуючи залишок, який (м:1Н); 3,95-4,20 (м:5Н); 4,53 (м:1Н); 4,79 (дд, J=10 обробляють 20см 3 дистильованої води та 25см 3 та 2Гц:1Н); 4,83 (дд, J=9 та 3,5Гц:1Н); 5,11 (нероздихлорметану. Органічну фазу декантують, потім дільний дублет, JHF=48Гц:1Н); 5,28 (д, J=10Гц:1Н); промивають 2 рази 20см 3 дистильованої води. 5,75-5,85 (м:2Н); 5,84 (дд, J=17 та 2Гц:1Н); 6,09 Органічну фазу сушать над сульфатом магнію, (м:1Н); 6,19 (д, J=16Гц:1Н); 6,53 (дд, J=17 та фільтрують, потім концентрують насухо при зни5Гц:1Н); 8,11 (с:1Н). женому тиску (2,7кПа), одержуючи 1,13г твердої (16R)-16-Дезоксо-16-фтор-14-О-[4-(морфолінречовини, яку очищають флеш-хроматографією 4-іл)бутирил]пристинаміцин ІІВ може бути отрима[елюент: дихлорметан/метанол (98/2, за об'ємом, ний наступним чином: потім 95/5, за об'ємом)]. Таким чином одержують До розчину 1,3г (16R)-16-дезоксо-16325мг продукту, який перемішують в діетиловому фторпристинаміцину ІІВ (о триманого як описано в ефірі, відфільтровують, потім сушать при темпеприкладі 1) в 35см 3 дихлорметану при температурі ратурі 20°С (90Па), одержуючи 248мг (16R)-1620°С додають 0,512г гідрохлориду 4-(морфолін-4дeзoкco-16-фтop-14-O-(4-iмiдaзoл-1іл)масляної кислоти та 0,343см 3 триетиламіну в ілбутирил)пристинаміцину ІІВ в вигляді твердої вигляді розчину в 35см 3 дихлорметану, 0,503г речовини бежевого кольору, яка плавиться при Ν,Ν’-дициклогексилкарбодііміду та 0,03г 4температурі 125°С. 1 диметиламінопіридину. Після перемішування проН-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 тягом 16 годин при температурі 20°С реакційну (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, суміш концентрують насухо при зниженому тиску J=6,5Гц:3Н); 1,60-2,05 (м:5Н); 1,90 (с:3Н); 2,00-2,35 (2,7кПа). Залишок обробляють 10см 3 дихлормета(м:2Н); 2,08 (м:2Н); 2,26 (м:2Н); 2,76 (м:1Н); 2,99 ну, потім фільтрують. Фільтрат розбавляють 40см 3 (дт, J=17 та 6,5Гц:1Н); 3,24 (м:1Н); 3,50 (м:1Н); дихлорметану, промивають 50см 3 води, потім су3,94 (м:1Н); 4,01 (т, J=7Гц:2Н); 4,06 (м:1Н); 4,54 шать над сульфатом магнію, фільтрують та конце(м:1Н); 4,79 (дд, J=10 та 2Гц:1Н); 4,82 (дд, J=9 та нтрують насухо при зниженому тиску (2,7кПа), 3Гц:1Н); 5,11 (нероздільний дублет, JHF=48Гц:1Н); одержуючи 1г твердої речовини жовтого кольору, 5,28 (д, J=9Гц:1Н); 5,75-5,90 (м:1Н); 5,78 (м:1Н); яку очищають флеш-хроматографією [елюент: 5,84 (дд, J=16 та 1,5Гц:1Н); 6,09 (м:1Н); 6,20 (д, градієнт дихлорметан/метанол/ацетонітрил J=16Гц:1Н); 6,53 (дд, J=16 та 5Гц:1Н); 6,91 (с:1Н); (98/1/1, потім 96/2/2, потім 94/3/3, за об'ємом)]. 7,07 (с:1Н); 7,44 (с:1Н); 8,12 (с:1Н). Таким чином одержують 0,584г твердої речовини (16R)-14-О-(4-бромбутирил)-16-дезоксо-163 білого кольору, яку обробляють 20см дихлормефторпристинаміцин ІІВ може бути отриманий натану. Отриманий розчин промивають 20см 3 води, ступним чином: сушать над сульфатом магнію, фільтрують, потім До розчину 5г (16R)-16-дезоксо-16концентрують насухо при зниженому тиску фторпристинаміцину ІІВ (о триманого як описано в (2,7кПа), одержуючи, після перемішування в пенприкладі 1) в 150см 3 дихлорметану додають тані, фільтрування та висушування (2,7кПа) при 2,64см 3 триетиламіну, потім 2,3см 3 хлорангідриду температурі 20°С, 0,524г (16R)-16-дезоксо-164-броммасляної кислоти. Після перемішування фтор-14-О-[4-(морфолін-4протягом 18 годин при температурі 25°С додають іл)бутирил]пристинаміцину ІІВ в вигляді твердої додаткові 1,32см 3 триетиламіну та 1,15см 3 хлоранречовини білого кольору, яка плавиться при темгідриду 4-броммасляної кислоти. Реакційну суміш пературі близько 100°С (розклад). перемішують протягом 2 годин при температурі 1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 25°С, потім промивають 2 рази 100см 3 дистильо(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, ваної води. Органічну фазу сушать над сульфатом J=6,5Гц:3Н); 1,60-2,05 (м:7Н); 1,89 (с:3Н); 2,16 магнію, фільтрують, потім концентрують насухо (м:1Н); 2,23 (м:1М); 2,35 (м:4Н); 2,43 (м:4Н); 2,76 при зниженому тиску (2,7кПа), одержуючи 8,19г (м:1Н); 2,99 (дт, J=17 та 6Гц:1Н); 3,24 (м:1Н); 3,49 олії коричневого кольору, яку очищають флеш(м:1Н); 3,71 (м:4Н); 3,85 (м:1Н); 4,07 (м:1Н); 4,54 хроматографією [елюент: дихлорметан/метанол (м:1Н); 4,78 (дд, J=10 та 1,5Гц:1Н); 4,82 (дд, J=9 та (97/3, за об'ємом)]. Таким чином одержують 3,4г 3Гц:1Н); 5,11 (нероздільний дублет, JHF=48Гц:1Н); продукти, що перемішують з діізопропіловим ефі5,30 (д, J=9Гц:1Н); 5,75-5,85 (м:1Н); 5,76 (м:1Н); ром, фільтрують, сушать, потім очищають флеш5,81 (дд, J=17 та 1,5Гц:1Н); 5,95 (м:1Н); 6,19 (д, хроматографією [елюент: дихлорметан/метанол J=16Гц:1Н); 6,51 (дд, J=17 та 5Гц:1Н); 8,12 (с:1Н). (98/2, за об'ємом)]. Таким чином одержують, після Гідрохлорид 4-(морфолін-4-іл) масляної кисперемішування в діізопропіловому ефірі, фільтрулоти може бути отриманий згідно Raj К. Razdan, вання та висушування при температурі 20°С Barbara Zitko Terris, Harry G. Pars, J. Med. Chem. (90Па), 1,32г (16R)-14-О-(4-бромбутирил)-161976, 19 (4), 454-461. дезоксо-16-фторпристинаміцину ІІ В в вигляді тверПриклад 28 дої речовини не зовсім білого кольору, яка викори(16R)-16-дeзoкco-16-фтop-14-О-(4-iмiдaзoл-1стовується без подальшого очищення. 1 iлбутиpил)пpиcтинaмiцин ІІВ Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 До розчину 600мг (16R)-14-O-(4-бромбутиpил)(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, 16-дезоксо-16-фторпристинаміцину ІІВ в 2,5см 3 J=6,5Гц:3Н); 1,65-2,05 (м:5Н); 1,89 (с:3Н); 2,10-2,35 диметилформаміду додають 150мг імідазолу. Піс(м:2Н); 2,17 (м:2Н); 2,49 (м:2Н); 2,77 (м:1Н); 2,99 ля перемішування протягом 4 годин при темпера(м:1Н); 3,24 (м:1Н); 3,45-3,55 (м: 1Н); 3,47 (т, 49 71619 50 J=6,5Р4:2Н); 3,86 (м:1Н); 4,06 (м: 1Н); 4,54 (м:1Н); (розклад). 1 4,78 (дд, J=10 та 1,5Гц:1Н); 4,82 (дд, J=9 та Н-ЯМР-спектр (400МГц; (CD3)2SO-d6; d в м.ч.): 3Гц:1Н); 5,13 (нероздільний дублет, JHF=48Гц:1Н); 0,85 (д, J=6,5Гц:3Н); 0,94 (д, J=6,5Гц:3Н); 1,03 (д, 5,31 (д, J=9Гц:1Н); 5,75-5,90 (м:1Н); 5,77 (м:1Н); J=6,5Гц:3Н); 1,45-1,70 (м:5Н); 1,70-2,25 (м:6Н); 1,77 5,82 (дд, J=16 та 2Гц:1Н); 5,93 (м:1Н); 6,20 (д, (с:3Н); 2,32 (с:3Н); 2,39 (т, J=7Гц:2Н); 2,77 (м:1Н); J=15Гц:1Н); 6,52 (дд, J=16 та 5Гц:1Н); 8,12 (с:1Н). 2,95-3,50 (м:8Н); 3,50-3,70 (м:4Н); 3,80 (м:1Н); 3,90Приклад 29 4,05 (м:3Н); 4,70-4,80 (м:2Н); 5,09 (нероздільний (16R)-16-Дезоксо-16-фтор-14-О-{4-[4дублет, JHF=48Гц:1Н); 5,42 (д, J=9,5Гц:1Н); 5,62 (піролідин-1-ілкарбонілметил)піперазин-1(м:1Н); 5,75 (м: 1Н); 5,80 (шир.д, J=16Гц:1Н); 6,18 іл]бутирил}пристинаміцин ІІВ (д, J=16Гц:1Н); 6,62 (дд, J=16 та 4Гц:1Н); 8,15 До розчину 680мг (16R)-14-О-(4-бромбутирил)(м:1Н); 8,52 (с:1Н); 9,46 (шир. масив:1Н). 16-дезоксо-16-фторпристинаміцину ІІВ (о триманого (16R)-16-дезоксо-16-фтор-14-O-[5-(морфоліняк описано в прикладі 28) в 3см 3 диметилформа4-іл)пентаноїл]пристинаміцин ІІВ може бути настуміду додають 590мг 1пним чином: (піролідинокарбонілметил)піперазину. Після переДо розчину 2г (16R)-16-дезоксо-16-фтор-14-Омішування протягом 4 годин при температурі 60°С [5-хлор-пентаноїл]пристинаміцину ІІВ в 30см 3 тетсуміш концентрують при зниженому тиску (2,7кПа), рагідрофурану при температурі 20°С додають одержуючи залишок, який обробляють 40см 3 дис0,46г йодиду натрію та 0,54см 3 морфоліну. Після 3 тильованої води та 20см дихлорметану. Після перемішування протягом 27 годин при кип'ятінні зі додавання хлориду натрію водну фаз у декантузворотним холодильником додають додаткові ють, потім екстрагують 2 рази 20см 3 дихлормета0,54см 3 морфоліну. Після перемішування протягом ну. Органічні фази поєднують, сушать над сульдодаткових 16 годин при кип'ятінні зі зворотним фатом магнію, фільтрують, потім концентрують холодильником додають 1см 3 диметилформаміду насухо при зниженому тиску (2,7кПа), одержуючи та 0,54см 3 морфоліну. Після перемішування ще 1г твердої речовини каштанового кольору, яку протягом 24 годин при кип'ятінні зі зворотним хоочищають флеш-хроматографією [елюент: ди хлолодильником реакційну суміш розбавляють 20см 3 рметан/метанол (95/5, за об'ємом)]. Таким чином дихлорметану та промивають 50см 3 води. Органіодержують 650мг продукту, який перемішують в чну фазу декантують та водну фаз у екстрагують діетиловому ефірі протягом 1 години, фільтрують, 50см 3 дихлорметану. Органічні фази поєднують, потім сушать при температурі 20°С (90Па), одерпромивають 3 рази 150см 3 води, сушать над сужуючи 413мг (16R)-16-дезоксо-16-фтор-14-О-{4-[4льфатом магнію, фільтрують, потім концентрують(піролідин-1-ілкарбонілметил)піперазин-1насухо при зниженому тиску (2,7кПа), одержуючи іл]бутирил}пристинаміцину ІІВ в вигляді твердої 2г залишку, що очищають флеш-хроматографією речовини не зовсім білого кольору, яка плавиться [елюент: дихлорметан/метанол/ацетонітрил при температурі 128°С. (92/4/4, за об'ємом)]. Таким чином, після перемі1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 шування в пентані, фільтрування та висушування (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, (2,7кПа) при температурі 20°С, одержують 0,81г J=6,5Гц:3Н); 1,60-2,05 (м:11Н); 1,88 (с:3Н); 2,10(16R)-16-дезоксо-16-фтор-14-О-[5-(морфолін-42,35 (м:2Н); 2,32 (т, J=7,5Гц:2Н); 2,40 (масив:2Н); іл)пентаноїл]пристинаміцині ІІВ в вигляді твердої 2,50-2,70 (масив:8Н); 2,75 (м;1Н); 2,99 (дт, J=17 та речовини бежевого кольору. 1 6Гц: 1Н); 3,12 (с:2Н); 3,24 (м: 1Н); 3,40-3,55 (м:5Н); Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 3,86 (м: 1Н); 4,06 (м:1Н); 4,53 (м: 1Н); 4,78 (дд, (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, J=10 та 1,5Гц:1Н); 4,82 (дд, J=9 та 3Гц:1Н); 5,09 J=6,5Гц:3Н); 1,52 (м:2Н); 1,55-2,05 (м:7Н); 1,89 (нероздільний дублет, JHF=48Гц:1Н); 5,29 (д, (с:3Н); 2,10-2,35 (м:2Н); 2,32 (м:4Н); 2,42 (маJ=9Гц:1Н); 5,75-5,85 (м:1Н); 5,75 (м: 1Н); 5,83 (дд, сив:4Н); 2,76 (м:1Н); 2,99 (дт, J=17 та 6Гц:1Н); 3,24 J=17 та 1,5Гц:1Н); 6,05 (м:1Н); 6,18 (д, J=16Гц:1Н); (м:1Н); 3,48 (м: 1Н); 3,72 (т, J=5Гц:4Н); 3,86 (м:1Н); 6,52 (дд, J=17 та 5Гц:1Н); 8,12 (с:1Н). 4,07 (м:1Н); 4,53 (м: 1Н); 4,78 (дд, J=10 та 2Гц:1Н); Приклад 30 4,82 (дд, J=9 та 3Гц:1Н); 5,11 (нероздільний дубМетансуль фонат (16R)-16-Дезоксо-16-фторлет, JHF=48Гц:1Н); 5,30 (д, J=9Гц:1Н); 5,70-5,85 14-О-[5-(морфолін-4-іл)пентаноїл]пристинаміцину (м:2Н); 5,82 (дд, J=16,5 та 2Гц:1Н); 5,96 (м:1Н); ІІВ 6,19 (д, J=16Гц:1Н); 6,51 (дд, J=16,5 та 5Гц:1Н); До розчину 0,79г (16R)-16-дезоксо-16-фтор-148,12 (с:1Н). O-[5-(морфолін-4-іл)пентаноїл]пристинаміцину ІІВ в (16R)-16-Дезоксо-16-фтор-14-О-[53 15см етанолу при температурі 20°С додають хлорпентаноїл]пристинаміцин ІІВ може бути отри11см 3 0,1н розчину метансульфокислоти в етаноманий наступним чином: лі. Після перемішування протягом 20 хвилин реакДо розчину 4г (16R)-16-дезоксо-16ційну суміш концентрують насухо при зниженому фторпристинаміцину ІІВ (о триманого як описано в тиску (2,7кПа), одержуючи залишок, що перемішуприкладі 1) в 100см 3 дихлорметану при темперають в 10см 3 діетилового ефіру. Після фільтрувантурі 28°С додають 2,1см 3 триетиламіну, 2см 3 53 ня, промивання твердого речовини 5см діетилохлорпентаноїлхлориду та 0,18г 4вого ефіру та висушування при зниженому тиску диметиламінопіридину. Після перемішування про(2,7кПа) при температурі 20°С одержують 0,89г тягом 2 годин при температурі 28°С реакційну суметансульфонату (16R)-16-дезоксо-16-фтор-14-Оміш виливають в 100см 3 води. Органічну фазу де[5-(морфолін-4-іл)пентаноїл]пристинаміцину ІІ В в кантують та водну фазу екстрагують 100см 3 вигляді твердої речовини не зовсім білого кольору, дихлорметану. Органічні фази поєднують, промищо плавиться при температурі близько 120°С вають 2 рази 200см 3 води, сушать над сульфатом 51 71619 52 магнію, фільтрують, потім концентрують насухо вають 100см води. Органічну фазу декантують та при зниженому тиску (2,7кПа), одержуючи 6г тверводну фазу екстрагують 50см 3 дихлорметану. Ордої речовини каштанового кольору, що очищають ганічні фази поєднують, сушать над сульфатом флеш-хроматографією [елюент: дихлормемагнію, фільтрують, потім концентрують насухо тан/метанол (98/2, за об'ємом)]. Таким чином, піспри зниженому тиску (2,7кПа), одержуючи 1,6г ля перемішування в пентані, фільтрування та витвердої речовини жовтогарячого кольору, що очисушування (2,7кПа) при температурі 20°С, щають двома послідовними операціями флешодержують 3,77г (16R)-16-дезоксо-16-фтор-14-Oхроматографії [елюент: дихлорметан/метанол (5-хлорпентаноїл)пристинаміцину ІІВ в вигляді тве(97/3, за об'ємом)]. Таким чином, після перемішурдої речовини білого кольору. вання в діетиловому ефірі, фільтрування та вису1 шування (2,7кПа) при температурі 20°С, одержуН-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 ють 0,66г (16R)-16-дезоксо-16-фтор-14-О-[5(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, J=6,5Гц:3Н); 1,65-2,05 (м:9Н); 1,89 (с:3Н); 2,15 (імідазол-1-іл)пентаноїл]пристинаміцину ІІВ в вигляді твердої речовини жовтого кольору. (м:1Н); 2,24 (м:1Н); 2,33 (т, J=7Гц:2Н); 2,76 (м:1Н); 1 2,99 (м:1Н); 3,24 (м:1Н); 3,49 (м:1Н); 3,55 (т, Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 J=7Гц:2Н); 3,86 (м:1Н); 4,06 (м:1Н); 4,52 (м:1Н); (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,11 (д, 4,78 (дд, J=10 та 2Гц:1Н); 4,82 (дд, J=9 та 3Гц:1Н); J=6,5Гц:3Н); 1,60-2,05 (м:9Н); 1,90 (с:3Н); 2,10-2,25 5,11 (нероздільний дублет, JHF=48Гц:1Н); 5,30 (д, (м:2Н); 2,31 (т, J=7Гц:2Н); 2,76 (м:1Н); 3,00 (м:1Н); J=9Гц:1Н); 5,75-5,85 (м:1Н); 5,76 (м:1Н); 5,82 (дд, 3,25 (дт, J=17 та 5,5Гц:1Н); 3,51 (м:1Н); 3,84 J=17 та 2Гц:1Н); 5,96 (м:1Н); 6,19 (д, J=16Гц:1Н); (м:1Н); 3,94 (т, J=7Гц:2Н); 4,06 (м:1Н); 4,56 (м:1Н); 6,51 (дд, J=17 та 5Гц:1Н); 8,13 (с:1Н). 4,75-4,90 (м:2Н); 5,06 (нероздільний дублет, Приклад 31 JHF=48Гц:1Н); 5,24 (д, J=9Гц:1Н); 5,75-5,90 (м:2Н); Метансуль фонат (16R)-16-дезоксо-16-фтор5,90 (дд, J=16 та 1,5Гц:1Н); 6,17 (д, J=15Гц:1Н); 14-О-[5-(імідазол-1-іл)пентаноїл]пристинаміцину ІІВ 6,52 (м:1Н); 6,57 (дд, J=16 та 5Гц:1Н); 6,89 (с:1Н); До розчину 0,66г (16R)-16-дезоксо-16-фтор-147,06 (с:1Н); 7,45 (с:1Н); 8,10 (с:1Н). O-[5-(імідазол-1-іл)пентаноїл]пристинаміцину ІІВ в Приклад 32 10см 3 етанолу при температурі 20°С додають (16R)-16-Дезоксо-16-фтор-14-О-{5-[410,2см 3 0,095н розчину метансульфокислоти в (піролідин-1-ілкарбонілметил)піперазин-1етанолі. Після перемішування протягом 10 хвилин iл]пентаноїл}пристинаміцин ІІВ реакційну суміш концентрують насухо при знижеДо розчину 1,8г (16R)-16-дезоксо-16-фтор-14ному тиску (2,7кПа), одержуючи залишок, що пеО-(5-хлорпентаноїл)пристинаміцину ІІВ (отриманоремішують в 20см 3 діетилового ефіру. Після фільго як описано в прикладі 30) в 20см 3 диметилфортрування, промивання твердої речовини 5см 3 маміду при температурі 20°С додають 1,1г (піролідіетилового ефіру та висушування при зниженому дин-1-ілкарбонілметил)піперазину та 0,42г йодиду тиску (2,7кПа) одержують 0,712г метансульфонату натрію. Після перемішування протягом 27,5 годин (16R)-16-дезоксо-16-фтор-14-О-[5-(імідазол-1при температурі 50°С додають 0,55г (піролідин-1іл)пентаноїл]пристинаміцину ІІВ в вигляді твердої ілкарбонілметил)піперазину. Після перемішування речовини жовтого кольору, що плавиться при темпротягом додаткових 27,5 годин при температурі пературі близько 126°С (розклад). 54°С реакційну суміш концентрують насухо при 1 зниженому тиску (2,7кПа), одержуючи залишок, що Н-ЯМР-спектр (400МГц; (CD3)2SO-d6; d в м.ч.): розбавляють 100см 3 дихлорметану. Отриманий 0,85 (д, J=6,5Гц:3Н); 0,94 (д, J=6,5Гц:3Н); 1,03 (д, розчин промивають 4 рази 300см 3 води. Органічну J=6,5Гц:3Н); 1,40-1,60 (м:3Н); 1,70-2,30 (м:8Н); 1,76 фазу сушать над сульфатом магнію, фільтрують (с:3Н); 2,32 (с:3Н); 2,37 (т, J=7Гц:2Н); 2,77 (м:1Н); та концентрують насухо при зниженому тиску 3,10-3,40 (м:2Н); 3,58 (м:1Н); 3,67 (м:1Н); 3,80 (2,7кПа), одержуючи 1,61г твердої речовини жов(м:1Н); 3,97 (м:1Н); 4,21 (т, J=7Гц:2Н); 4,65-4,80 того кольору, що очищають флеш-хроматографією (м:2Н); 5,08 (нероздільний дублет, JHF=48Гц:1Н); [елюент: дихлорметан/метанол (95/5, за об'ємом)]. 5,40 (д, J=9Гц:1Н); 5,61 (м:1Н); 5,73 (м:1Н); 5,80 Таким чином, після перемішування в пентані, фі(шир.д, J=16Гц:1Н); 6,18 (д, J=16Гц:1Н); 6,63 (дд, льтрування та висушування (2,7кПа) одержують J=16 та 4Гц:1Н); 7,72 (шир.с:1Н); 7,80 (шир.с:1Н); 0,726г (16R)-16-дезоксо-16-фтор-14-O-{5-[48,15 (т, J=6Гц:1Н); 8,52 (с:1Н); 9,14 (шир.с:1Н). (піролідин-1-ілкарбонілметил)піперазин-1(16R)-16-Дезоксо-16-фтор-14-О-[5-(імідазол-1іл]пентаноїл}пристинаміцину ІІВ в вигляді твердої іл)пентаноїл]пристинаміцин ІІВ може бути отримаречовини бежевого кольору, що плавиться при ний наступним чином: температурі близько 100°С (розклад). До розчину 1,4г (16R)-16-дезоксо-16-фтор-141 О-[5-хлорпентаноїл]пристинаміцину ІІВ (отриманоН-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 3 го як описано в прикладі 30) в 20см тетрагідрофу(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, рану при температурі 20°С додають 0,29г імідазоJ=6,5Гц:3Н); 1,51 (м:2Н); 1,55-1,80 (м:3Н); 1,75-2,05 лу та 0,32г йодиду натрію. Після перемішування (м:8Н); 1,88 (с:3Н); 2,15 (м:1Н); 2,23 (м:1Н); 2,25протягом 20 годин при кип'ятінні зі зворотним хо2,40 (м:4Н); 2,50 (масив:4Н); 2,58 (масив:4Н); 2,76 лодильником додають 1см 3 диметилформаміду та (м:1Н); 2,99 (дт, J=17 та 6Гц:1Н); 3,11 (с:2Н); 3,24 0,29г імідазолу. Після перемішування протягом (м:1Н); 3,45-3,55 (м:5Н); 3,86 (м:1Н); 4,06 (м:1Н); додаткових 8,5 годин при кип'ятінні зі зворотним 4,53 (м:1Н); 4,78 (дд, J=10 та 2Гц:1Н); 4,82 (дд, J=9 холодильником додають 0,20г імідазолу. Після та 3Гц:1Н); 5,09 (нероздільний дублет, перемішування ще протягом 15,5 годин при кип'я JHF=48Гц:1Н); 5,30 (д, J=9Гц:1Н); 5,75-5,90 (м:1Н); тінні зі зворотним холодильником реакційну суміш 5,75 (м:1Н); 5,83 (дд, J=17 та 1,5Гц:1Н); 6,04 розбавляють 50см 3 дихлорметану, потім проми(м:1Н); 6,19 (д, J=16Гц:1Н); 6,53 (дд, J=17 та 53 71619 54 5Гц:1Н); 8,12 (с:1Н). 2,66 (масив:2Н); 2,77 (масив:2Н); 3,78 (т, Приклад 33 J=5Гц:4Н). (16R)-16-Дезоксо-16-фтор-14-О-[(RR,SS)Етил (RR,SS)-транс-2-(морфолінометил)-1транс-2-(морфолінометил)-1цикпопропанкарбоксилат може бути отриманий циклопропанкарбоніл]пристинаміцин ІІВ (суміш наступним чином: двох діастереоізомерів у співвідношенні 50/50) До розчину 2,82г етил (RR,SS)-тpaнс-2До розчину 2,1г (16R)-16-дезоксо-16форміл-1-циклопропанкарбоксилату в 100см 3 дихфторпристинаміцину ІІВ (о триманого як описано в лорметану додають, при температурі 20°С та в прикладі 1) в 80см 3 дихлорметану додають, при атмосфері аргону, 1,74см 3 морфоліну та 6,36г температурі 20°С та в атмосфері аргону, 1,1г трис(ацетат-О)гідридборату натрію. Після перемі(RR,SS)-транс-2-(морфолінометил)-1шування протягом 4 годин додають 100см 3 дистициклопропанкарбонової кислоти, 1,24г Ν,Ν’льованої води. Після перемішування органічну дициклогексилкарбодііміду та 0,73г 4фазу декантують, потім промивають 100см 3 дисдиметиламінопіридину. Після перемішування протильованої води. Органічну фазу сушать над сутягом 16 годин реакційну суміш фільтрують для льфатом магнію, фільтрують, потім концентрують видалення нерозчинної частини, потім концентрунасухо при зниженому тиску (2,7кПа). Таким чином ють насухо при зниженому тиску (2,7кПа), одеродержують 1,1г етил (RR,SS)-тpaнс-2жуючи 4,2г залишку, що очищають флеш(морфолінометил)-1-циклопропанкарбоксилату в хроматографією [елюент: градієнт дихлормевигляді жовтої олії. 1 тан/метанол (від 98/2 до 95/5, за об'ємом)]. ОдерН-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,76 жують тверду речовину, що перемішують в діізоп(м:1Н); 1,20-1,35 (м:4Н); 1,44 (м:1Н); 1,54 (м:1Н); ропіловому ефірі, відфільтровують та висушують 2,31 (дд, J=13 та 7Гц:1Н); 2,36 (дд, J=13 та (2,7кПа) при температурі 20°С, одержуючи 1,5г 7Гц:1Н); 2,50 (шир.т, J=5Гц:4Н); 3,73 (т, J=5Гц:4Н); (16R)-16-дезоксо-16-фтop-14-O-[(RR,SS)-тpaнс-24,13 (м:2Н). (морфолінометил)-1Приклад 34 циклопропанкарбоніл]пристинаміцину ІІВ (суміш (16R)-16-дезоксо-16-фтор-14-О-[6-(імідазол-1двох діастереоізомерів у співвідношенні 50/50) в іл)гексаноїл]пристинаміцин ІІВ вигляді не зовсім білого порошку. До розчину 1,42г (16R)-16-дезоксо-16-фтор-141 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): (споО-(6-бромгексаноїл)пристинаміцину ІІВ в 7см 3 дистерігається наявність двох діастереоізомерів у метилсульфоксиду при температурі 20°С додають співвідношенні 50/50): 0,77 (м:1Н); 0,96 (д, 0,34г імідазолу та кілька кристалів йодиду натрію. J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, Після перемішування протягом 2 годин при темпеJ=6,5Гц:3Н); 1,24 (м:1Н); 1,41 (м:1Н); 1,52 (м:1Н); ратурі 53°С, потім 16 годин при температурі 20°С, 1,60-2,05 (м:5Н); 1,87 (с:3Н); 2,05-2,45 (м:4Н); 2,50 реакційну суміш виливають в 35см 3 води та фільт(масив:4Н); 2,76 (м:1Н); 2,99 (м:1Н); 3,24 (м:1Н); рують через пористий скляний фільтр. Нерозчинну 3,49 (м:1Н); 3,73 (т, J=5Гц:4Н); 3,84 (м:1Н); 4,06 частину промивають водою та розчиняють в 70см 3 (м:1Н); 4,53 (м:1Н); 4,75-4,85 (м:2Н); 5,09 (нероздіетилацетату. Отриманий в результаті розчин екстльний дублет, JHF=48Гц:1Н); 5,30 (м:1Н); 5,70-5,85 рагують 25см 3 0,1н водного розчину соляної кис(м:3Н); 5,96 та 6,03 (2м:1Н в цілому); 6,19 (д, лоти. Водну фазу декантують, екстрагують 10см 3 J=16Гц:1Н); 6,51 (м:1Н); 8,12 (с:1Н). етилацетату, потім нейтралізують 0,5см 3 5н водно(RR,SS)-транс-2-(Морфолінометил)-1го розчину гідроксиду натрію. Водну фазу екстрациклопропанкарбонова кислота може бути отригують 2 рази 25см 3 етилацетату. Органічні фази мана наступним чином: поєднують, сушать над сульфатом магнію, фільтДо розчину 1,0г етил (RR,SS)-транс-2рують, потім концентрують насухо при зниженому (морфолінометил)-1-циклопропанкарбоксилату в тиску (2,7кПа), одержуючи 1г твердої речовини 50см 3 етанолу при температурі 20°С додають блідо-жовтого кольору, що очищають флеш10см 3 1н водного розчину гідроксиду натрію. Після хроматографією [елюент: дихлормеперемішування протягом 2 годин при температурі тан/метанол/ацетонітрил (88/6/6, за об'ємом)]. 80°С етанол видаляють при зниженому тиску Одержують 0,59г твердої речовини білого кольору, (2,7кПа) та залишкову водну фаз у промивають що обробляють 5см 3 дихлорметану. Органічну 3 50см етилацетату. В водній фазі встановлюють фазу фільтрують через целітÒ. ЦелітÒ промивазначення рН, рівне 6, додаванням 1н водного розють дихлорметаном. Фільтрат концентрують насучину соляної кислоти, після чого концентрують хо при зниженому тиску (2,7кПа) при температурі насухо при зниженому тиску (2,7кПа). Залишок два 20°С, одержуючи 0,58г (16R)-16-дезоксо-16-фторрази обробляють 50см 3 толуолу та концентрують 14-О-[6-(імідазол-1-іл)гексаноїл]пристинаміцину ІІВ насухо при зниженому тиску (2,7кПа). Залишок в вигляді твердої речовини білого кольору, що обробляють 50см 3 етанолу при температурі 50°С, плавиться при температурі близько 90°С нерозчинну частину видаляють фільтруванням та (розклад). 1 фільтрат концентрують при зниженому тиску Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,95 (2,7кПа). Таким чином одержують 0,9г (RR,SS)(д, J=6,5Гц:3Н); 0,99 (д, J=6,5Гц:3Н); 1,10 (д, транс-2-(морфолінометил)-1J=6,5Гц:3Н); 1,27 (м:2Н); 1,60-2,10 (м:5Н); 1,63 циклопропанкарбонової кислоти в вигляді жовтої (м:2Н); 1,78 (м:2Н); 1,88 (с:3Н); 2,10-2,25 (м:2Н); олії. 2,27 (т, J=7Гц:2Н); 2,75 (м:1Н); 3,00 (м:1Н); 3,25 1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,68 (дт, J=17 та 5Гц:1Н); 3,51 (м:1Н); 3,82 (м:1Н); 3,94 (м:1Н); 1,20 (м:1Н); 1,46 (м:1Н); 1,56 (м:1Н); 2,28 (т, J=7Гц:2Н); 4,08 (м:1Н); 4,58 (м:1Н); 4,75-4,85 (дд, J=13 та 8Гц:1Н); 2,60 (дд, J=13 та 5Гц:1Н); (м:2Н); 5,07 (нероздільний дублет, JHF=48Гц:1Н); 55 71619 56 5,20 (д, J=9Гц:1Н); 5,75-5,85 (м:2Н); 5,90 (дд, J=16 човини білого кольору, що обробляють 5см 3 дихта 1,5Гц:1Н); 6,18 (д, J=16Гц:1Н); 6,56 (дд, J=16 та лорметану. Органічну фазу фільтрують через 5Гц:1Н); 6,77 (м:1Н); 6,90 (с:1Н); 7,10 (с:1Н); 7,45 целітÒ. ЦелітÒ промивають дихлорметаном. Філь(с:1Н); 8,12 (с:1Н). трат концентрують насухо при зниженому тиску (16R)-16-дезоксо-16-фтор-14-О-(6(2,7кПа) при температурі 20°С, одержуючи 0,26г бромгексаноїл)пристинаміцин ІІВ може бути отри(16R)-16-дезоксо-16-фтор-14-О-[6-(4маний наступним чином: метилпіперазин-1-іл)гексаноїл]пристинаміцину ІІВ в До розчину 5,32г (16R)-16-дезоксо-16вигляді твердої речовини білого кольору, що плафторприетинаміцину ІІВ (отриманого як описано в виться при температурі близько 95°С (розклад). 1 прикладі 1) в 150см 3 дихлорметану при темпераН-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 турі 28°С додають 1,7см 3 триетиламіну та 1,8см 3 (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, 6-бромгексаноїлхлориду. Після перемішування J=6,5Гц:3Н); 1,33 (м:2Н); 1,51 (м:2Н); 1,55-2,05 протягом 21,5 годин при температурі 23°С дода(м:7Н); 1,88 (с:3Н); 2,10-2,65 (м:14Н); 2,29 (с:3Н); ють 0,43см 3 триетиламіну та 0,45см 3 62,76 (м:1Н); 2,99 (м:1Н); 3,24 (м:1Н); 3,48 (м:1Н); бромгексаноїлхлориду. Після перемішування до3,86 (м:1Н); 4,06 (м:1Н); 4,53 (м:1Н); 4,78 (дд, J=10 датково протягом 21 години при температурі 28°С та 2Гц:1Н); 4,82 (дд, J=9 та 3Гц:1Н); 5,10 (нероздіреакційну суміш виливають в 50см 3 води. Органічльний дублет, JHF=48Гц:1Н); 5,30 (д, J=9Гц:1Н); ну фазу декантують, сушать над сульфа том маг5,75-5,85 (м: 1Н); 5,75 (м:1Н); 5,82 (дд, J=17 та нію, фільтрують, потім концентрують насухо при 2Гц:1Н); 5,98 (м:1Н); 6,19 (д, J=16Гц:1Н); 6,52 (дд, зниженому тиску (2,7кпа), одержуючи 8,05г твердої J=17 та 5Гц:1Н); 8,13 (с:1Н). речовини коричневого кольору, що очищають Приклад 36 флеш-хроматографією [елюент: дихлорме(16R)-16-Дезоксо-16-фтор-14-О-{6-[4тан/метанол/ацетонітрил (96/2/2, за об'ємом)]. Та(піролідин-1-ілкарбонілметил)піперазин-1ким чином одержують 5,6г (16R)-16-дезоксо-16іл]гексаноїл}пристинаміцин ІІВ фтор-14-О-(6-бромгексаноїл)пристинаміцину ІІВ в До розчину 1,35г (16R)-16-дезоксо-16-фтор-14вигляді твердої речовини блідо-жовтого кольору. О-(6-бромгексаноїл)пристинаміцину ІІВ (отримано1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 го як описано в прикладі 34) в 7см 3 диметилсуль(д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц: 3Н); 1,09 (д, фоксиду при температурі 20°С додають 1,18г (піJ=6,5Гц:3Н); 1,48 (м:2Н); 1,60-2,05 (м:9Н); 1,88 ролідин-1-ілкарбонілметил)піперазину. Після (с:3Н); 2,15 (м:1Н); 2,24 (м:1Н); 2,31 (т, перемішування протягом 3 годин при температурі J=7,5Гц:2Н); 2,76 (м:1Н); 2,99 (м:1Н); 3,24 (м:1Н); 60°С реакційну суміш виливають в 35см 3 води з 3,41 (т, J=7Гц:2Н); 3,49 (м:1Н); 3,86 (м:1Н); 4,06 льодом, потім екстрагують 2 рази 25см 3 етилаце(м:1Н); 4,53 (м:1Н); 4,78 (дд, J=10 та 2Гц:1Н); 4,82 тату. Органічні фази поєднують, суша ть над суль(дд, J=9 та 3Гц:1Н); 5,11 (нероздільний дублет, фатом магнію, фільтрують, потім концентрують JHF=48Гц:1Н); 5,31 (д, J=Гц:l); 5,75-5,85 (м:1Н); 5,75 насухо при зниженому тиску (2,7кПа), одержуючи (м:1Н); 5,82 (дд, J=17 та 2Гц:1Н); 5,95 (м:1Н); 6,19 1,53г смолоподібного залишку, що очищають (д, J=16Гц:1Н); 6,51 (дд, J= 7 та 4Гц:1Н); флеш-хроматографією [елюент: дихлорме8,13(с:1Н). тан/метанол (90/10, за об'ємом)]. Одержують 0,96г Приклад 35 клейкої смоли, що обробляють 10см 3 дихлормета(16R)-16-Дезоксо-16-фтор-14-О-[6-(4ну. Цей розчин фільтрують через целітÒ. ЦелітÒ метилпіперазин-1-іл]гексаноїл]пристинаміцин ІІВ промивають дихлорметаном. Фільтрат концентруДо розчину 1,42г (16R)-16-дезоксо-16-фтор-14ють насухо при зниженому тиску (2,7кпа), одержуO-(6-бромгексаноїл)пристинаміцину ІІВ (отриманоючи смолу, що перемішують послідовно в діетило3 го як описано в прикладі 34) в 7см диметилсульвому ефірі та пентані. Після фільтрування, потім фоксиду при температурі 20°С додають 0,67см 3 Nвисушування при зниженому тиску (2,1кПа) одерметилпіперазину. Після перемішування протягом жують 0,78г (16R)-16-дезоксо-16-фтор-14-О-{6-[40,5 години при температурі 60°С реакційну суміш (піролідин-1-ілкарбонілметил)піперазин-1виливають в 35см 3 води з льодом та екстрагують іл]гексаноїл}пристинаміцину ІІВ в вигляді твердої 3 50см дихлорметану. Органічну фаз у промивають речовини жовтого кольору, що плавиться при тем25см 3 водного насиченого розчину хлориду напературі близько 80°С (розклад). 1 трію, сушать над сульфатом магнію, фільтрують Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 та концентрують насухо при зниженому тиску (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,09 (д, (2,7кПа), одержуючи 1,2г твердої речовини жовтоJ=6,5Гц:3Н); 1,32 (м:2Н); 1,50 (м:2Н); 1,60-2,05 гарячого кольору, що розчиняють в 30см 3 етила(м:11Н); 1,88 (с:3Н); 2,10-2,40 (м:6Н); 2,50 (масив: цетату. Отриманий в результаті розчин екстрагу4Н); 2,59 (масив: 4Н); 2,76 (м: 1Н); 2,99 (м:1Н); 3,12 ють послідовно 20см 3 0,1н водного розчину (с:2Н); 3,24 (м:1Н); 3,40-3,55 (м:5Н); 3,86 (м:1Н); 3 соляної кислоти та 10см води. Водні фази поєд4,05 (м:1Н); 4,52 (м: 1Н); 4,78 (дд, J=10 та 2Гц:1Н); нують та нейтралізують 0,4см 3 5н водного розчину 4,82 (дд, J=9 та 3Гц:1Н); 5,10 (нероздільний дубгідроксиду натрію. Водну фазу екстрагують 2 рази лет, JHF=48Гц:1Н); 5,30 (д, J=9Гц:1Н); 5,75-5,90 25см 3 дихлорметану. Органічні фази поєднують, (м:1Н); 5,75 (м:1Н); 5,82 (дд, J=17 та 2Гц:1Н); 6,02 сушать над сульфатом магнію, фільтрують, потім (м: 1Н); 6,19 (д, J =16Гц:1Н); 6,52 (дд, J=17 та концентрують насухо при зниженому тиску 5Гц:1Н); 8,13 (с:1Н). (2,7кПа), одержуючи 0,94г твердої речовини жовПриклад 37 того кольору, що очищають флеш-хроматографією Метансуль фонат (16R)-16-дезоксо-16-фтор[елюент: дихлорметан/метанол (90/10, за об'14-О-[7-(iмідазол-1-іл)гептаноїл]пристинаміцину ІІВ ємом)]. Таким чином одержують 0,27г твердої реДо розчину 1,96г (16R)-16-дезоксо-16-фтор-14 57 71619 58 О-[7-(імідазол-1-іл)гептаноїл]пристинаміцину ІІВ в клад). 1 10см 3 етанолу при температурі 20°С додають Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,95 2,7см 3 1н розчину метансульфокислоти в етанолі. (д, J=6,5Гц:3Н); 0,99 (д, J=6,5Гц:3Н); 1,09 (д, Після перемішування протягом 10 хвилин реакційJ=6,5Гц:3Н); 1,25-1,40 (м:4Н); 1,55-2,05 (м:9Н); 1,88 ну суміш концентрують насухо при зниженому тис(с:3Н); 2,10-2,30 (м:2Н); 2,27 (т, J=7,5Гц:2Н); 2,76 ку (2,7кПа), одержуючи залишок, що перемішують (м:1Н); 2,99 (дт, J=17 та 6Гц:1Н); 3,24 (м:1Н); 3,48 в 10см 3 діетилового ефіру. Після фільтрування, (м:1Н); 3,85 (м:1Н); 3,93 (т, J=7,5Гц:2Н); 4,06 промивання твердої речовини 5см 3 діетилового (м:1Н); 4,53 (м: 1Н); 4,78 (дд, J=10 та 2Гц:1Н); 4,82 ефіру та висушування при зниженому тиску (дд, J=9 та 3Гц:1Н); 5,09 (нероздільний дублет, (2,7кПа) одержують 2,13г метансульфонату (16R)JHF=48Гц:1Н); 5,29 (д, J=9Гц:1Н); 5,70-5,85 (м:2Н); 16-дезоксо-16-фтор-14-О-[7-(імідазол-15,83 (дд, J=16,5 та 2Гц:1Н); 6,17 (м:1Н); 6,19 (д, іл)гептаноїл]пристинаміцину ІІВ в вигляді твердої J=15Гц:1Н); 6,52 (дд, J=16,5 та 5Гц:1Н); 6,90 речовини кремового кольору, що плавиться при (с:1Н); 7,06 (с:1Н); 7,45 (с:1Н); 8,12 (с:1Н). температурі близько 110°С (розклад). Гідрохлорид 7-(імідазол-1-іл)гептанової кисло1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,95 ти може бути отриманий згідно Kinji iizuka та ін., J. (д, J=6,5Гц:3Н); 0,98 (д, J=6,5Гц:3Н); 1,09 (д, Med. Chem., Vol.24, №10, pages 1139-1148 (1981). J=6,5Гц:3Н); 1,25-1,45 (м:4Н); 1,55-2,05 (м:9Н); 1,88 Приклад 38 (с:3Н); 2,10-2,30 (м:2Н); 2,28 (т, J=7,5Гц:2Н); 2,76 (16R)-16-Дезоксо-16-фтор-14-О-(4-метил піпе(м:1Н); 2,85 (с:3Н); 3,00 (дт, J=17 та 6Гц:1Н); 3,24 разин-1-іл)карбонілацетилпристинаміцин ІІВ (м:1Н); 3,51 (м:1Н); 3,84 (м:1Н); 4,05 (м:1Н); 4,18 (т, До розчину 2,5г (16R)-16-дезоксо-16J=7,5Гц:2Н); 4,49 (м:1Н); 4,78 (дд, J=10 та 2Гц:1Н); фторпристинаміцину ІІВ (о триманого як описано в 4,82 (дд, J=9 та 3Гц:1Н); 5,09 (нероздільний дубприкладі 1) в 100см 3 дихлорметану додають, при лет, JHF=48Гц:1Н); 5,28 (д, J=9,5Гц:1Н); 5,70-5,85 температурі 20°С та в атмосфері аргону, 1,74г 4(м:2Н); 5,84 (дд, J=16 та 2Гц:1Н); 6,13 (м:1Н); 6,18 метилпіперазин-1-ілкарбонілоцтової кислоти, 1,44г (д, J=16Гц:1Н); 6,53 (дд, J=16 та 5Гц:1Н); 7,13 Ν,Ν'-дициклогексилкарбодііміду та 0,09г 4(с:1Н); 7,41 (с:1Н); 8,12 (с:1Н); 8,92 (с:1Н). диметиламінопіридину. Після перемішування про(16R)-16-Дезоксо-16-фтор-14-О-[7-(імідазол-1тягом 18 годин реакційну суміш розбавляють іл)гептаноїл]пристинаміцин ІІВ може бути отрима50см 3 дихлорметану, фільтрують для видалення ний наступним чином: нерозчинної частини, потім промивають чотири До розчину 3,2г (16R)-16-дезоксо-16рази 50см 3 дистильованої води. Органічну фазу фторпристинаміцину ІІВ (о триманого як описано в декантують, сушать над сульфатом магнію, потім прикладі 1) в 100см 3 дихлорметану при темпераконцентрують насухо при зниженому тиску турі 23°С додають 1,49г Ν,Ν'(2,7кПа). Залишок (3,4г) очищають флешдициклогексилкарбодііміду, 0,075г 4хроматографією [елюент: градієнт дихлормедиметиламінопіридину, 1,68г гідрохлориду 7тан/метанол (97/3 та 92/8, за об'ємом)]. Одержу(імідазол-1-іл)гептанової кислоти та 1см 3 триетиють тверду речовину білого кольору, що після пеламіну. Після перемішування протягом 84 годин ремішування в діетиловому ефірі, фільтрування та при температурі 23°С реакційну суміш фільтр ують висушування (2,7кПа) дає 1,3г (16R)-16-дезоксота нерозчинну частину промивають дихлормета16-фтор-14-О-(4-метилпіперазин-1ном. Фільтрат концентрують насухо при зниженоіл)карбонілацетилпристинаміцину ІІВ в вигляді му тиску (2,7кПа), одержуючи маслянистий залитвердої речовини білого кольору. 1 шок, що розбавляють 100см 3 етилацетату. Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 Отриманий в результаті розчин промивають по(д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, 3 3 слідовно 2 рази 40см води та 40см водного наJ=6,5Гц:3Н); 1,70-2,00 (м:5Н); 1,89 (с:3Н); 2,15 сиченого розчину хлориду натрію, потім екстрагу(м:1Н); 2,25-2,35 (м:1Н); 2,31 (с:3Н); 2,40 (м:4Н); ють 60см 3 0,1н водного розчину соляної кислоти. 2,76 (м:1Н); 3,01 (дт, J=16 та 6Гц:1Н); 3,23 (м:1Н); Водну кислу фазу екстрагують 20см 3 етилацетату, 3,40-3,55 (м:5Н); 3,66 (м:2Н); 3,87 (м:1Н); 4,05 доводять до значення рН, рівного 8, додаванням (м:1Н); 4,53 (м:1Н); 4,78 (шир.д, J=10Гц:1Н); 4,82 3 6см 1н водного розчину гідроксиду натрію, потім (дд, J=9 та 3Гц:1Н); 5,14 (нероздільний дублет, екстрагують 2 рази 40см 3 етилацетату. Органічні JHF=48Гц:1Н); 5,34 (д, J=9,5Гц:1Н); 5,77 (м:1Н); фази поєднують, промивають водним насиченим 5,82 (дд, J=16 та 2Гц:1Н); 5,88 (дт, J=9,5 та розчином хлориду натрію, суша ть над сульфатом 5Гц:1Н); 5,95 (м:1Н); 6,20 (д, J=16Гц:1Н); 6,51 (дд, магнію, фільтрують, потім концентрують насухо J=16 та 4Гц:1Н); 8,12 (с:1Н). при зниженому тиску (2,7кПа), одержуючи 3,05г 4-Метилпіперазин-1-ілкарбонілоцтова кислота твердої речовини блідо-жовтого кольору, що очиможе бути отримана наступним чином: щають флеш-хроматографією [елюент: дихлормеДо розчину 4,5г етил 4-метилпіперазин-1тан/метанол/ацетонітрил (86/7/7, за об'ємом)]. Таілкарбонілацетату в 100см 3 етанолу при темпераким чином одержують 2,58г твердої речовини, що турі 20°С додають 23см 3 0,1н водного розчину обробляють 10см 3 дихлорметану. Отриманий розгідроксиду натрію. Після перемішування протягом чин фільтрують через целітÒ. ЦелітÒ промивають 24 годин реакційну суміш концентрують насухо при дихлорметаном. Фільтрат концентрують насухо зниженому тиску (2,7кПа). Отриманий залишок при зниженому тиску (2,7кПа) при температурі обробляють 50см 3 дистильованої води та розчин 20°С, одержуючи 2,58г (16R)-16-дезоксо-16-фторпромивають чотири рази 50см 3 дихлорметану. 14-O-[7-(імідазол-1-іл)гептаноїл]пристинаміцину ІІВ Значення рН водної фази доводять до 5-6 додав вигляді твердої речовини білого кольору, що ванням 1н водного розчину соляної кислоти, екстплавиться при температурі близько 80°С (розрагують два рази 50см 3 дихлорметану, потім кон 59 71619 60 центрують насухо при зниженому тиску (2,7кПа). ілкарбоніл)пропіоніл]пристинаміцину ІІВ в 6см 3 меТри рази залишок обробляють 100см 3 толуолу та тилізобутилкетону додають 3н розчин хлористого концентрують насухо в тих самих умовах. водню в діетиловому ефірі аж до випадання рясОдержують 4,6г пастоподібного залишку жовного осаду. Його відфільтровують, промивають 2 того кольору, що перемішують в 50см 3 етанолу рази 2см 3 метилізобутилкетону, потім 3 рази 10см 3 при температурі близько 60°С. Нерозчинну частидіетилового ефіру. Після висушування при темпену видаляють фільтруванням та фільтрат конценратурі 50°С (90Па) одержують 600мг гідрохлориду трують насухо при зниженому тиску (2,7кпа). Та(16R)-16-дезоксо-16-фтор-14-О-[3-(4ким чином одержують 3,5г 4-метилпіперазин-1метилпіперазин-1ілкарбонілоцтової кислоти в вигляді клейкої гігроілкарбоніл)пропіоніл]пристинаміцину ІІВ в вигляді скопічної маси, яка використовується без подальбілого порошку, що плавиться при температурі шого очищення. 160°С. 1 (16R)-16-дезоксо-16-фтор-14-О-[3-(4Н-ЯМР-спектр (400МГц; (CD3)2SO-d6; d в м.ч.): метилпіперазин-12,21 (с:3Н); 2,29 (т, J=5Гц:2Н); 2,34 (т, J=5Гц:2Н); ілкарбоніл)пропіоніл]пристинаміцин ІІВ може бути 3,30-3,50 (м:4Н); 3,39 (с:2Н). отриманий наступним чином: Етил 4-метилпіперазин-1-ілкарбонілацетат У трьохгорлу колбу в атмосфері азоту поміможе бути отриманий згідно Morren Η., Troiin S., Denayer R., Gri vsky E., Bull. Soc. Chim. Belg. 1950, щають 450мг 4-(4-метилпіперазин-1-іл)-4оксомасляної кислоти, 1г (16R)-16-дезоксо-1659, 228-232. фторпристинаміцину ІІВ (о триманого як описано в Приклад 39 прикладі 1), 470мг N,N’-дициклогексилкарбодііміду, (16R)-14-О-(4-Карбоксибутирил)-16-дезоксо140мг 4-диметиламінопіридину, потім 20см 3 дих16-фторпристинаміцин ІІВ До розчину 400мг (16R)-16-дезоксо-16лорметану. Реакційну суміш перемішують протягом 48 годин при температурі 20°С. Потім неї розфторпристинаміцину ІІВ (о триманого як описано в бавляють 10см 3 дихлорметану, після чого прикладі 1) в 2см 3 піридину при температурі 20°С виливають в 50см 3 дистильованої води. Отриману додають 258мг глутарового ангідриду та 84,5мг 4суміш фільтрують через вату. Органічну фазу дедиметиламінопіридину. Після перемішування протягом 20 годин піридин випарюють при зниженому кантують та водн у фазу екстрагують 2 рази 5см 3 3 дихлорметану. Органічні фази поєднують, сушать тиску (2,7кПа) та отриману олію обробляють 20см над сульфатом магнію, фільтрують, потім конценетилацетату. Отриманий в результаті розчин протрують насухо при зниженому тиску (2,7кПа), одемивають 2 рази 10см 3 дистильованої води, потім ржуючи 1,66г суміші, що очищають флеш0,1н водним розчином соляної кислоти. Водну фазу екстрагують етилацетатом, потім декантують. хроматографією [елюент: дихлорметан/метанол (95/5, за об'ємом)]. Таким чином одержують 975мг Органічну фазу промивають дистильованою вопродукту, що перемішують в 10см 3 діетилового дою, потім 2 рази 2см 3 насиченого розчину хлориефіру, фільтрують та сушать, потім знову очищаду натрію. Органічну фазу декантують, сушать над ють флеш-хроматографією [елюент: етилацесульфатом магнію, фільтрують, потім концентрують насухо при зниженому тиску (2,7кПа), одертат/метанол (93/7, за об'ємом)]. Фракції концентрують, одержуючи тверду речовину, що жуючи тверду речовину ясно-жовтого кольору, що обробляють 10см 3 діетилового ефіру та переміперемішують в 20см 3 діетилового ефіру, відфільтшують протягом 30 хвилин. Отриману тверду реровують , потім сушать при зниженому тиску човину білого кольору відфільтровують , проми(2,7кПа). Таким чином одержують 363мг твердої речовини, що очищають флеш-хроматографією вають діетиловим ефіром, потім сушать при температурі 50°С (90Па), одержуючи 500мг (16R)[елюент: дихлорметан/метанол (97/3, за об'ємом)], 16-дезоксо-16-фтор-14-О-[3-(4-метилпіперазин-1одержуючи 100мг (16R)-14-O-(4-карбоксибутирил)ілкарбоніл)пропіоніл]пристинаміцинуІІВ в вигляді 16-дезоксо-16-фторпристинаміцину ІІВ в вигляді білого порошку, що плавиться при температурі твердої речовини білого кольору, що плавиться при температурі 98°С. 130°С. 1 1 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 Н-ЯМР-спектр (400МГц; CDCI3; d в м.ч.): 0,96 (д, J=6,5Гц:3Н); 1,00 (д, J=6,5Гц:3Н); 1,10 (д, (д, J=6,5Гц:3Н); 1,01 (д, J=6,5Гц:3Н); 1,10 (д, J=6,5Гц:3Н); 1,65-2,05 (м:5Н); 1,88 (с:3Н); 2,15 J=6,5Гц:3Н); 1,55-2,05 (м:7Н); 1,89 (с:3Н); 2,17 (м:1Н); 2,20-2,45 (м:5Н); 2,31 (с:3Н); 2,50-2,75 (м:1Н); 2,25 (м: 1Н); 2,37 (т, J=7Гц:2Н); 2,42 (т, (м:4Н); 2,76 (м:1Н); 3,00 (м:1Н); 3,23 (м:1Н); 3,40J=7Гц:2Н); 2,77 (м:1Н); 3,00 (тд, J=17 та 6Гц:1Н); 3,55 (м:1Н); 3,50 (м:2Н); 3,63 (м:2Н); 3,87 (м:1Н); 3,25 (м:1Н); 3,50 (м:1Н); 3,86 (м:1Н); 4,08 (м:1Н); 4,06 (м:1Н); 4,53 (м:1Н); 4,78 (шир.д, J=10Гц:1Н); 4,53 (м:1Н); 4,79 (дд, J=10 та 1,5Гц:1Н); 4,82 (дд, 4,82 (дд, J=9 та 3Гц:1Н); 5,14 (нероздільний дубJ=9 та 3Гц:1Н); 5,13 (нероздільний дублет, лет, JHF=48Гц:1Н); 5,33 (д, J=9,5Гц:1Н); 5,75-5,90 JHF=48Гц: 1Н); 5,31 (д, J=9,5Гц:1Н); 5,75-5,90 (м:1Н); 5,75 (м:1Н); 5,81 (шир.д, J=16Гц:1Н); 5,96 (м:1Н); 5,77 (м: 1Н); 5,83 (дд, J=17 та 2Гц:1Н); 5,97 (м:1Н); 6,20 (д, J=16r4:I); 6,51 (дд, J=16 та 5Гц:1Н); (м:1Н); 6,19 (д, J=16Гц:1Н); 6,53 (дд, J=17 та 8,12 (с:1Н). 5Гц:1Н); 8,14 (с:1Н). 4-(4-метилпіперазин-1-іл)-4-оксомасляна кисПриклад 40 лота може бути отримана наступним чином: Гідрохлорид (16R)-16-дезоксо-16-фтор-14-ОДо 20см 3 діоксану додають 1,17г бурштиново[3-(4-метилпіперазин-1го ангідриду, потім 1,19см 3 N-метилпіперазину. ілкарбоніл)пропіоніл]пристинаміиину ІІВ Після перемішування протягом 18 годин при кімДо розчину 615мг (16R)-16-дезоксо-16-фторнатній температурі осад, що випав, відфільтрову14-О-[3-(4-метилпіперазин-1
ДивитисяДодаткова інформація
Назва патенту англійськоюStreptogramines derivatives, a method for the preparation thereof and a composition based thereon
Автори англійськоюBacque Eric, Ronan Baptiste
Назва патенту російськоюПроизводные стрептограминов, способ их получения и композиция на их основе
Автори російськоюБак Эрик, Ронан Батист
МПК / Мітки
МПК: A61K 38/00, C07K 5/078, A61K 38/12, A61K 38/15, A61P 31/04
Мітки: композиція, стрептограмінів, одержання, похідні, основі, спосіб
Код посилання
<a href="https://ua.patents.su/48-71619-pokhidni-streptograminiv-sposib-kh-oderzhannya-i-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні стрептограмінів, спосіб їх одержання і композиція на їх основі</a>
Попередній патент: Контейнер для зберігання і/чи транспортування екологічно небезпечних речовин і радіоактивних відходів низької і середньої активності
Наступний патент: Валковий класифікатор
Випадковий патент: Спосіб прогнозування характеру порушень репродуктивної функції у жінок на фоні урогенітальної інфекції