Індоли як противірусні агенти відносно респіраторного синтиціального вірусу
Номер патенту: 109792
Опубліковано: 12.10.2015
Автори: Демін Самуель Домінік, Ху Лілі, Вендевіль Сандрін Марі Елен, Тахрі Абделла, Рабуассон П'єр Жан-Марі Бернар, Йонкерс Тім Хьюго Марія, Койманс Людвіг Поль
Формула / Реферат
1. Сполука формули І, її проліки, N-оксид, адитивна сіль, четвертинний амін або стереохімічно ізомерна форма:
 ,
,
де кожен X незалежно є С або N;
R1 вибирають з групи, що включає Н, галоген, С1-С6алкокси, СF3 та OCF3;
R2 вибирають з групи, що включає Н, галоген, С1-С6алкіл, С3-С7циклоалкіл, С1-С6алкокси і CO(R7);
R3 є -(CR8R9)n-R10;
R4 вибирають з групи, що включає Н, С1-С10алкіл, С3-С7циклоалкіл, С2-С10алкеніл, SO2-R8, CH2CF3, SO2CH3 або 4-6-членний насичений цикл, що містить атом кисню;
R5 присутній у разі, коли X є С, і його вибирають з групи, що включає Н, С1-С6алкіл, С3-С7циклоалкіл, С1-С6алкокси, CO(R7), CF3 і галоген;
R5 відсутній у разі, коли X є N;
R7 вибирають з групи, що включає ОН, О(С1-С6алкіл), NH2, NНSО2N(С1-С6алкіл)2, NHSO2NHCH3, NHSO2(С1-С6алкіл), NHSО2(С3-С7циклоалкіл) і Н(С1-С6алкіл)2, NR8R9, NR9R10;
n є цілим числом від 2 до 6;
кожен з R8 і R9 незалежно вибирають з Н, С1-С10алкілу, С3-С7циклоалкілу, або R8 і R9, узяті разом, утворюють 4-6-членний аліфатичний цикл, який необов'язково містить один або більше гетероатомів, вибраних з групи N, S, О;
R10 вибирають з групи, що включає Н, С1-С6алкіл, ОН, CN, F, CH2F, CF3, C(=NOH)NH2, CONR8R9, COOR8, CONR8SO2R9, CON(R8)SO2N(R8R9), NR8R9, NR8COOR9, OCOR8, NR8SO2R9, SO2NR8R9, SO2R8 або 4-6-членний насичений цикл, що містить атом кисню.
2. Сполука за п. 1, де
R4 вибирають з групи, що включає Н, С1-С10алкіл, С3-С7циклоалкіл, С2-С10алкеніл, SO2-R8 або 4-6-членний насичений цикл, що містить атом кисню.
3. Сполука за п. 1 або 2, де R1 вибирають з групи, що включає Н, галоген.
4. Сполука за будь-яким з попередніх пунктів, де R1 у пара-положенні до N-R3 вибирають з групи, що включає Н, галоген, а всі інші R1 є Н.
5. Сполука за будь-яким з попередніх пунктів, де R1 вибирають з групи, що включає бром і хлор.
6. Сполука за будь-яким з попередніх пунктів, де R2 вибирають з групи, що включає Н, галоген і CO(R7).
7. Сполука за будь-яким з попередніх пунктів, де R2 вибирають з групи, що включає Н, І і CONH2.
8. Сполука за будь-яким з попередніх пунктів, де R3 містить ланцюжок -(CR8R9)n, де R8 і R9 є Н, а n складає 2-4.
9. Сполука за будь-яким з попередніх пунктів, де R10 вибирають з групи, що включає F, CF3, OH, CN і SO2R8, при цьому R8 є метилом.
10. Сполука за будь-яким з пп. 1 або 3-9, де R4 є С3-С7циклоалкілом або CH2CF3.
11. Сполука за будь-яким з попередніх пунктів, де X у пара-положенні до N-R4 є С, a R5 у даному X є F.
12. Сполука за будь-яким з попередніх пунктів, де X є N, а інші X є С, при цьому N знаходиться в пара-положенні до N-R4.
13. Сполука за будь-якому з попередніх пунктів, де щонайбільше один R5 вибирають з групи, що містить С1-С6алкіл, С1-С6алкокси і галоген, а інші R5 є Н.
14. Сполука за будь-яким з попередніх пунктів, де всі R5 є H.
15. Сполука за п. 1, яка є
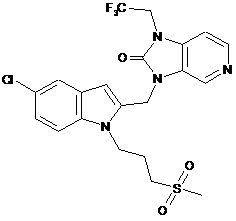 ,
,
або її N-оксид, адитивна сіль і четвертинний амін.
16. Сполука за п. 15, де сполука є
 .
.
17. Застосування сполуки за будь-яким з пп. 1-16 як лікарського засобу.
18. Фармацевтична композиція, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-16.
19. Спосіб отримання фармацевтичної композиції за п. 18, що включає ретельне змішування фармацевтично прийнятного носія з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-16.
20. Застосування сполуки за будь-яким з пп. 1-16 як лікарського засобу для інгібування реплікації RSV.
21. Спосіб одержання сполуки за будь-яким з пп. 1-16, в якому здійснюють поєднання сполуки, вибраної з групи, що включає ІІ-а, ІІ-b і II-с, із сполукою III відповідно до наведеної далі схеми 1, що приводить до отримання похідних формули (І), де всі замісники R і X мають значення згідно з п. 1,
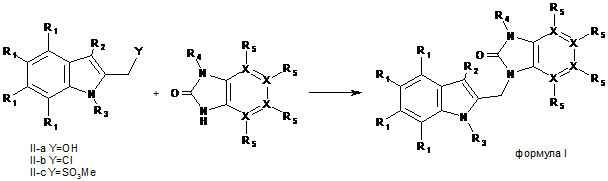 .
.
22. Застосування сполуки за будь-яким з пп.1-16 для отримання лікарського засобу для інгібування реплікації RSV.
Текст
Реферат: Індоли, що мають інгібуючу активність відносно реплікації RSV, і мають формулу І, їх N-оксиди, адитивні солі, четвертинні аміни і стереохімічні ізомерні форми, композиції, що містять дані сполуки як активний інгредієнт, і способи отримання даних сполук і композицій. R5 R4 N R1 R1 O R2 R5 N R5 R5 N R1 R1 R3 І UA 109792 C2 (12) UA 109792 C2 UA 109792 C2 5 10 15 20 25 30 35 40 45 50 55 Область техніки, до якої відноситься винахід Даний винахід відноситься до індолів, що мають противірусну активність, зокрема, що мають інгібуючу активність відносно респіраторного синцитіального вірусу (RSV). Крім того, даний винахід відноситься до отримання таких індолів, композицій, що містять дані індоли, і до сполук для застосування при лікуванні інфекції респіраторного синцитіального вірусу. Попередній рівень техніки RSV людини або респіраторний синцитіальний вірус є крупним вірусом, що містить РНК, член родини Параміксовірусів, підродини пневмовірусів, разом із коров'ячим вірусом RSV. RSV людини відповідальний за ряд захворювань дихальних шляхів у людей різного віку у всьому світі. Він є основною причиною захворювань нижніх дихальних шляхів у немовлят і дитячому віці. Майже половина всіх немовлят стикаються з RSV на першому році життя, і майже всі впродовж перших двох років життя. Дана інфекція у маленьких дітей може призвести до ураження легенів, що зберігається протягом багатьох років, і може сприяти розвитку хронічного легеневого захворювання в подальшому житті (хронічна задишка, астма). Більш старші діти і дорослі в разі RSV-інфекції часто страждають на звичайну застуду. У літньому віці знову підвищується сприйнятливість, і RSV спричиняє за собою ряд спалахів пневмонії у літніх людей, призводячи до значної смертності. Зараження вірусом з даної підгрупи не захищає від подальшого інфікування RSV, виділеного з тієї ж підгрупи в наступному зимовому сезоні. Таким чином, повторне зараження RSV є звичайним, не дивлячись на існування всього лише двох підтипів А і В. На даний час для застосування проти RSV-інфекції прийнято лише три лікарські засоби. Перший є рибавірином, аналогом нуклеозида, що надає аерозольне лікування в разі серйозної RSV-інфекції у госпіталізованих дітей. Аерозольний спосіб введення, токсичність (небезпека тератогенності), вартість і вкрай непостійна ефективність обмежує його застосування. Два інших лікарських засоби, RespiGam (RSV-IG) і Synagis (палівізумаб), імуностимулятори на основі поліклональних і моноклональних антитіл, призначені для профілактичного застосування. Обидва вони є дуже дорогими і вимагають парентерального введення. Всі останні спроби розробити безпечну і ефективну вакцину проти RSV до цього часу закінчувались невдачею. Інактивовані вакцини не здатні захистити від захворювання, а фактично, у деяких випадках, підсилюють захворювання при подальшій інфекції. Спроби застосування живих аттенуйованих вакцин мали обмежений успіх. Очевидно, що існує необхідність в ефективному і простому для введення лікарському засобі проти RSV-інфекції. Було особливо бажано надати лікарські засоби проти реплікації RSV, які можна було б вводити перорально. Посилальний документ WO 01/95910, що називається "противірусні агенти на основі імідазопіридина і імідазопіримідина", фактично, відноситься до бензімідазольних противірусних агентів. У ньому представлені сполуки, що мають противірусну активність, проте зі значеннями ЕС50 у широкому інтервалі від 0,001 мкМ до 50 мкМ (що зазвичай не надає необхідної біологічної активності). Іншим посилальним документом, що відноситься до RSV-противірусних агентів на основі 2-метилбензімідазола в тому ж інтервалі активності, є WO 03/053344. Наступним посилальним документом з родинного попереднього рівня техніки, що відноситься до сполук у тому ж інтервалі активності, є WO 02/26228, в якому розглядаються бензімідазолонові противірусні агенти. Посилальним документом по взаємозв'язку структураактивність у відношенні до інгібування RSV, що відноситься до сполук 5-заміщеного бензімідазолу, є X.A. Wang et al., Bioorganic and Medicinal Chemistry 17 (2007) 4592-4598. Бажано надати нові лікарські засоби, що мають противірусну активністю. Зокрема, було б бажано знайти структури сполук, які дадуть можливість отримати противірусну біологічну активність з порядком величини у вищих областях попереднього рівня техніки (тобто у нижнього кордону вищезазначеного інтервалу до 50 мкМ), а бажано, на рівні близько найбільшої активності, бажаніше, навіть більш високої активності, ніж у сполук, розкритих у даній області. Наступна мета полягає у виявленні сполук, що мають пероральну противірусну активність. Короткий опис винаходу Для того, щоб краще дослідити одну або більше з вищезазначених цілей, у даному винаході, в одному з аспектів, надані противірусні сполуки на основі індолу, представлені формулою I, їх проліки, N-оксид, аддитивна сіль, четвертинний амін, комплекс з металами, або стереохімічно ізомерна форма. 1 UA 109792 C2 , 5 10 15 20 25 30 35 40 45 де кожен Х незалежно є С або N; R1 вибирають з групи, що включає Н, галоген, С1-С6алкіл, С3-С7циклоалкіл, С1-С6алкокси, N(R6)2, CO(R7), CH2NH2, CH2ОH, CN, C(=NOH)NH2, C(=NOCH3)NH2, C(=NH) NH2, CF3, OCF3 або В(ОН)2, В(О-С1-С6алкіл)2; R2 вибирають з групи, що включає Н, галоген, С1-С6алкіл, С3-С7циклоалкіл, С1-С6алкокси і CO(R7); R3 є -(CR8R9)n-R10; R4 вибирають з групи, що включає Н, С1-С10алкіл, С3-С7циклоалкіл, С2-С10алкеніл, SO2-R8, CH2CF3, SO2CH3, або 4-6-членний насичений цикл, що містить атом кисню; R5 присутній у разі, коли Х є С, і його вибирають з групи, що включає Н, С 1-С6алкіл, С3С7циклоалкіл, С1-С6алкокси, CO(R7), CF3 і галоген; R5 відсутній у разі, коли Х є N; R6 вибирають з групи, що включає Н, С1-С6алкіл, СООСН3 і CONHSO2CH3; R7 вибирають з групи, що включає ОН, О(С1-С6алкіл), NH2, NHSO2N(С1-С6алкіл)2, NHSO2NHCH3, NHSO2(С1-С6алкіл), NHSO2(С3-с7циклоалкіл) і N(С1-С6алкіл)2, NR8R9, NR9R10; n є цілим числом від 2 до 6; кожен з R8 і R9 незалежно вибирають з Н, С1-С10алкіла, С3-С7циклоалкіла, або R8 і R9, узяті разом, утворюють 4-6-членний аліфатичний цикл, який необов'язково містить один або більше гетероатомів, вибраних з групи N, S, O; R10 вибирають з групи, що включає Н, С1-С6алкіл, ОН, CN, F, CH2F, CF3, C(=NOH)NH2, CONR8R9, COOR8, CONR8SO2R9, CON(R8)SO2N(R8R9), NR8R9, NR8COOR9, OCOR8, NR8SO2R9, SO2NR8R9, SO2R8, або 4-6-членний насичений цикл, що містить атом кисню. У бажаному варіанті здійснення R7 вибирають з групи, що включає ОН, О(С 1-С6алкіл), NH2, NHSO2N(С1-С6алкіл)2, NHSO2NHCH3, NHSO2(С1-С6алкіл), NHSO2(С3-С7циклоалкіл) і N(С1С6алкіл)2; кожен з R8 і R9 незалежно вибирають з Н, С1-с10алкіла, С3-С7циклоалкіла, або R8 і R9, узяті разом, утворюють 4-6-членний аліфатичний цикл, який необов'язково містить гетероатом, вибраний з групи N, S, O; R10 вибирають з групи, що включає Н, С1-С6алкіл, ОН, CN, F, CH2F, CF3, CONR8R9, COOR8, CONR8SO2R9, CON(R8)SO2N(R8R9), NR8R9, NR8COOR9, OCOR8, NR8SO2R9, SO2NR8R9, SO2R8, або 4-6-членний насичений цикл, що містить атом кисню. Бажано, R4 вибирають з групи, що включає Н, С1-С10алкіл, С3-С7циклоалкіл, С2-С10алкеніл, SO2-R8 або 4-6-членний насичений цикл, що містить атом кисню. У іншому аспекті винахід відноситься до вищезазначених сполук для застосування при лікуванні RSV-інфекції у теплокровних тварин, бажано, людей. У ще одному аспекті, винахід надає спосіб лікування вірусних RSV-інфекцій у суб'єкта, який потребує цього, що включає введення вказаному суб'єктові ефективної кількості сполуки, визначеної вище. У ще одному аспекті даний винахід полягає у застосуванні визначеної вище сполуки для отримання лікарського засобу для лікування RSV-інфекцій. У наступному аспекті даний винахід відноситься до фармацевтичної композиції, що містить визначену вище сполуку і фармацевтично прийнятний ексципієнт. У ще одному аспекті у винаході надані способи отримання сполук, визначених вище. Детальний опис винаходу У молекулах формули I, на відміну від попереднього рівня техніки, з одного з боків (з лівого боку зображеної формули) є заміщена індольна група. Даний винахід, у широкому сенсі, заснований на здоровому визнанні того факту, що дані сполуки заміщених індолів, як правило, мають цікаву інгібуючу активність, відносно RSV. Крім того, дані сполуки дозволяють домогтись 2 UA 109792 C2 5 10 15 20 25 30 35 40 45 50 55 вищих значень анти-RSV активності (тобто нижчого рівня значень ЕС 50) у межах, доступних у згаданих вище посиланнях. Зокрема, виходячи з даних сполук, можна виявити молекулярні структури, які навіть перевершують еталонні сполуки відносно біологічної активності. Далі даний винахід буде описаний відносно конкретних варіантів здійснення і з посланням на деякі приклади, але винахід обмежений не ними, а лише формулою винаходу. У разі, коли термін "включає" використовується в даному описі і формулі винаходу, він не виключає інших елементів або стадій. Використання іменника в однині включає і множину даного іменника, якщо не встановлено що-небудь ще. Використаний у тексті термін "проліки" означає фармацевтично прийнятні похідні, наприклад, складні ефіри і аміди, такі, для яких кінцевий продукт біоперетворення даного похідного є активним лікарським засобом, визначеним у разі сполук формули (I). Послання by Goodman (The Pharmacological Basis of Therapeutics, 8th ed., MeGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", pp.13-15), в якому проліки описані у загальних рисах, включене у даний опис. Проліки характеризуються хорошою розчинністю у воді і біодоступністю, і легко метаболізуються в активні інгібітори in vivo. Як використано в даному описі, С1-С6алкіл як група або частина групи, позначає лінійні або розгалужені насичені вуглеводневі радикали, що містять від 1 до 6 атомів вуглецю, такі як метил, етил, пропіл, 1-метилетил, бутил, пентил, гексил, 2-метилбутил і так далі. С1-С10алкіл як група або частина групи, позначає лінійні або розгалужені насичені вуглеводневі радикали, що містять від 1 до 10 атомів вуглецю, такі як групи, визначені для С 1С6алкіла і гептил, октил, ноніл, 2-метилгексил, 2-метилгептил, децил, 2-метилноніл і так далі. Мається на увазі, що термін "С2-С10алкеніл", використаний у даному описі як група або частина групи, включає лінійні або розгалужені ненасичені вуглеводневі радикали, що містять, щонайменше, один подвійний зв'язок, а бажано такі, що містять один подвійний зв'язок, і від 2 до 10 атомів вуглецю, такі як етеніл, пропеніл, бутен-1-іл, бутен-2-іл, пентен-1-іл, пентен-2-іл, гексен-1-іл, гексен-2-іл, гексен-3-іл, 2-метилбутен-1-іл, гептен-1-іл, гептен-2-іл, гептен-3-іл, гептен-4-іл, 2-метилгексен-1-іл, октен-1-іл, октен-2-іл, октен-3-іл, октен-4-іл, 2-метилгептен-1-іл, нонен-1-іл, нонен-2-іл, нонен-3-іл, нонен-4-іл, нонен-5-іл, 2-метилоктен-1-іл, децен-1-іл, децен-2іл, децен-3-іл, децен-4-іл, децен-5-іл, 2-метилнонен-1-іл і так далі; Усякий раз, коли С2-С10алкенільна група пов'язана з гетероатомом, вона бажано зв'язана через насичений атом вуглецю. С1-С6алкокси, як група або частина групи, позначає О-С1-С6алкільний радикал, де С1-6алкіл незалежно має визначене вище значення. С3-С7циклоалкіл є загальним терміном для циклопропіла, циклобутила, циклопентила, циклогексила або циклогептила. Використаний у даному описі термін -(CR8R9)n визначає n повторень підгрупи CR8R9, де кожна з даних підгруп визначена незалежно. Термін "галоген" є загальним для фтору, хлору, брому і йоду. Слід зазначити, що положення радикала в будь-якій молекулярній групі, використаній у даних визначеннях, може бути будь-яким у даній групі до того часу, поки вона є хімічно стабільною. Радикали, використані у визначеннях змінних, включають усі можливі ізомери, якщо не встановлено інакше. Наприклад, пентил включає 1-пентил, 2-пентил і 3-пентил. Якщо яка-небудь змінна зустрічається в якому-небудь компоненті більше одного разу, кожне визначення є незалежним. Усякий раз при використанні надалі мається на увазі, що термін "сполуки формули (I)" або "дані сполуки" включають сполуки загальної формули (I), їх проліки, N-оксиди, аддитивні солі, четвертинні аміни, комплекси з металами і стереохімічно ізомерні форми. Зрозуміло, що деякі сполуки формули (I) можуть містити один або більше центрів хіральності, і існують у вигляді стереохімічно ізомерних форм. Використаний вище термін "стереохімічно ізомерні форми" визначає всі можливі сполуки, що складаються з однакових атомів, зв'язаних однаковою послідовністю зв'язків, але такі, що мають різні тривимірні структури, що не взаємоперетворюються, які можуть мати сполуки формули (I). Якщо не згадано або не вказано інакше, хімічне позначення сполуки включає суміш усіх можливих стереохімічно ізомерних форм, які може мати вказана сполука. Вказана суміш може містити всі діастереомери і енантіомери основної молекулярної структури вказаної сполуки. Мається на увазі, що всі стереохімічно ізомерні форми сполуки даного винаходу, як у чистому вигляді, так і в суміші один з одним, входять в обсяг даного винаходу. 3 UA 109792 C2 5 10 15 20 25 30 35 40 45 50 55 Чисті стереоізомерні форми згаданих в даному описі сполук і проміжних сполук визначають як ізомери, що по суті не містять інших енантіомерних або діастереомерних форм однієї і тієї ж основної молекулярної структури вказаних сполук або проміжних сполук. Зокрема, термін "стереохімічно чистий" відноситься до сполук або проміжних сполук із стереоізомерним надлишком, що складає, щонайменше, від 90% (тобто мінімум 90% одного ізомеру і максимум 10% інших можливих ізомерів) до стереоізомерного надлишку 100% (тобто 100% одного ізомеру і відсутність іншого), конкретніше, до сполук або проміжних сполук із стереоізомерним надлишком, що складає, щонайменше, від 90% до 100%, ще конкретніше, із стереоізомерним надлишком, що складає, щонайменше, від 97% до 100%. Терміни "енантіомерно чистий" і "діастереомерно чистий" слід розуміти однаково, але тоді відносно енантіомерного надлишку і, відповідно, діастереомерного надлишку даної суміші. Чисті стереоізомерні форми сполук і проміжних сполук за даним винаходом можна отримати з використанням відомих у даній області методів. Наприклад, енантіомери можна розділити один від одного селективною кристалізацією їх діастереомерних солей з оптично активними кислотами або основами. Їх прикладами є винна кислота, дибензоїлвинна кислота, дитолуоїлвинна кислота і камфорсульфонова кислота. Альтернативним чином, енантіомери можна розділити методом хроматографії з використанням хіральних носіїв. Вказані чисті стереохімічно ізомерні форми можна також отримати з відповідних чистих стереохімічно ізомерних форм відповідних первинних речовин, за умови, що реакція протікає стереоспецифічно. Бажано, якщо необхідний певний стереоізомер, вказану сполуку можна синтезувати за допомогою стереоспецифічного способу отримання. У даних способах переважно використовуються енантіомерно чисті первинні речовини. Індивідуальні діастереомерні рацемати формули (I) можна отримати стандартними способами. Прийнятні способи фізичного розділення, які бажано можна використовувати, є, наприклад, селективною кристалізацією і хроматографією, наприклад, колонковою хроматографію. Для деяких сполук формули (I), їх проліків, N-оксидів, солей, сольватів, четвертинних амінів або комплексів з металами, і проміжних сполук, що застосовуються при їх отриманні, абсолютну стереохімічну конфігурацію експериментально не визначали. Фахівець у даної області може визначити абсолютну конфігурацію подібних сполук за допомогою відомих у даній області способів, наприклад, таких як рентгеноструктурний аналіз. Мається на увазі також, що даний винахід включає всі ізотопи атомів, наявних у даному винаході. Ізотопи включають такі атоми, які мають однаковий атомний номер, але різні масові числа. За допомогою загального прикладу і без обмеження, ізотопи водню включають тритій і дейтерій. Ізотопи вуглецю включають С-13 і С-14. Для терапевтичних цілей, солями сполук формули (I) є солі, в яких протиіон є фармацевтично прийнятним. Проте солі кислот і основ, що не є фармацевтично прийнятними, можуть також знайти застосування, наприклад, при отриманні або очищенні фармацевтично прийнятної сполуки. Всі солі, чи є вони фармацевтично прийнятними чи ні, входять в обсяг даного винаходу. Мається на увазі, що згадані вище фармацевтично прийнятні кислотно- і основно-аддитивні солі включають терапевтично активні нетоксичні форми кислотно- і основно-аддитивних солей, які здатні утворювати сполуки формули (I). Фармацевтично прийнятні кислотно-аддитивні солі можна легко отримати, обробляючи форму основи подібною прийнятною кислотою. Прийнятні кислоти включають, наприклад, неорганічні кислоти, такі як галогеноводневі кислоти, наприклад, хлористоводневу або бромистоводневу кислоту, сірчану, азотну, фосфорну і тому подібні кислоти, або органічні кислоти, наприклад, такі як оцтова, пропіонова, гідроксиоцтова, молочна, піровиноградна, щавлева (тобто етандіова), малонова, бурштинова (тобто бутандіова), малеїнова, фумарова, яблучна (тобто гідроксибутандіова), винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, п-аміносаліцилова, памова і тому подібні кислоти. Навпаки, вказані сольові форми можна перевести у форму вільної основи обробкою прийнятною основою. Сполуки формули (I), що містять кислий протон, можна також перевести в їх нетоксичні форми аддитивних солей з металом або аміном обробкою відповідними органічними і неорганічними основами. Прийнятні форми основних солей включають, наприклад, солі амонію, солі лужних і лужноземельних металів, наприклад, солі літію, натрію, калію, магнію, кальцію і так далі, солі органічних основ, наприклад, солі бензатина, N-метил-D-глюкаміна, гідрабаміна і солі амінокислот, наприклад, таких як аргінін, лізин і так далі. 4 UA 109792 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використаний вище термін аддитивна сіль включає також сольвати, які здатні утворювати сполуки формули (I), а також їх солі. Подібні сольвати є, наприклад, гідратами, алкоголятами і так далі. Використаний вище термін "четвертинна сіль" визначає четвертинні амонієві солі, які сполуки формули (I) здатні утворювати по реакції основного атома азоту сполуки формули (I) з відповідним кватернізуючим агентом, наприклад, таким як необов'язково заміщений алкілгалогенід, арилгалогенід або арилалкілгалогенід, наприклад, йодистий метил або йодистий бензил. Можна використовувати також інші реагенти з хорошою групою, що відходить, такі як алкілтрифторметансульфонати, алкілметансульфонати і алкіл-п-толуолсульфонати. Четвертинний амін має позитивно заряджений атом азоту. Фармацевтично прийнятні протиіони включають хлор, бром, йод, трифторацетат і ацетат. Вибраний протиіон можна вводити за допомогою іонообмінних смол. Мається на увазі, що N-оксидні форми даних сполук включають сполуки формули (I), в яких один або декілька атомів азоту окислено до так званого N-оксида. Зрозуміло, що сполуки формули (I) можуть мати зв'язок з металом, хелатучі і комплексоутворюючі властивості і, отже, можуть існувати у вигляді комплексів з металами або хелатів з металами. Мається на увазі, що подібні метальовані похідні сполук формули (I) включені в обсяг даного винаходу. Деякі із сполук формули (I) можуть також існувати у вигляді таутомерних форм. Мається на увазі, що подібні форми, хоча вони явно не вказані в наведених вище формулах, включені в обсяг даного винаходу. Зрозуміло, що сполуки даного винаходу, у тому, що стосується згаданих вище лівої і правої частин формули I, надають велике різноманіття модифікацій. Не зменшуючи загального обсягу винаходу, деякі варіанти здійснення детальніше обговорюються далі. В одному з бажаних варіантів винаходу, R1 вибирають з групи, що включає Н, галоген, С 1С6алкокси, CF3 і ОCF3. У наступному бажаному варіанті винаходу, R1 у пара-положенні до N-R3 вибирають з групи, що включає Н, галоген, а решта R 1 є Н. У іншому бажаному варіанті винаходу, галогеном є бром або хлор. У наступному бажаному варіанті винаходу R3 включає ланцюг -(CR8R9)n, в якому R8 і R9 бажано є Н, а n дорівнює 2-4. Бажано, R10 вибирають з групи, що включає ОН, F, CF2H, CF3, SO2R8 і CN. R8 бажано є метилом. У бажаному варіанті здійснення R4 є С3-С7циклоалкілом, бажаніше, циклопропілом. У бажаному варіанті здійснення, а бажаніше, у зв'язку з іншими бажаними варіантами здійснення, один Х є N, а інші Х є С. У найбільш бажаному варіанті здійснення, один з Х, що є N, є Х у пара-положенні до N-R4. Бажано, не більше одного R5 вибирають з групи, що включає С1-С6алкіл, С1-С6-алкокси, галоген. Найбажаніше, всі R5 є Н. Бажаними сполуками є сполуки, перераховані в наведеній далі таблиці 1. Найбільш бажаними є сполуки номер 1, 2 і 3. Сполуки формули I можна отримати описаними нижче способами, з використанням методів синтезу, які відомі в області органічної хімії, або за допомогою модифікацій і отримання похідних, які знайомі фахівцям у даній області. Використані тут первинні речовини є комерційно доступними, або можуть бути отримані стандартними способами, які відомі у даній області, такими як способи, описані в звичайних довідниках. Бажані способи включають, але не обмежуються, описаними нижче способами. В ході будь-якої їх наступних синтетичних послідовностей може виявитись потрібним та/або бути бажаним захистити чутливі або реакційноспроможні групи, такі як групи, описані в T.W. Green and P.G. M. Wuts, Protective Groups in Organic Chemistry, John Wiley & Sons, 1999, які включені, таким чином, у вигляді посилання. Сполуки формули I, або їх фармацевтично прийнятні солі, можна отримати відповідно до схем реакцій, які обговорюються в даному описі далі. Якщо не вказано інакше, замісники в схемі визначені відповідно до вказаного вище. Виділення і очищення продуктів здійснюють стандартними методами, які добре відомі хіміку стандартної кваліфікації. На схемі 1 показаний спосіб отримання сполук формули I, в яких радикали від R1 до R5 і Х визначені, як вказано вище. Звертаючись до схеми 1, сполуку формули I можна синтезувати поєднанням 23 3 гідроксиметиленіндола II-а з N -заміщеним 2-оксоімідазопіридином або з N -заміщеним 2оксоімідазобензолом III за допомогою способу, відомого в даній області, такого як реакція Міцунобу, в якій використовується азадіізопропілдикарбоксилат і трифенілфосфін у 5 UA 109792 C2 прийнятному розчиннику, такому як ДМФА або ТГФ. Альтернативним чином, сполуку формули I можна отримати заміщенням Y, який є галогенідом, бажано, хлор II-b, або сульфонат, такий як мезилат II-с, у присутності основи, такої як гідрид натрію, карбонат калію або карбонат цезію, у прийнятному розчиннику, такому як ДМФА або ТГФ. 5 Схема 1 10 15 Отримання сполуки II-а Використані в даному винаході первинні речовини IV є комерційно доступними, або можуть бути синтезовані, без обмеження, способами, які відомі в даній області, такими, як синтез Рейсерта або синтез Фішера, реакцією подібних індолів з R 3-LG, де LG є групою, що відходить, такою, як галогенід, бажано, бром, або сульфонат, у присутності основи, такої як гідрид натрію, карбонат калію або карбонат цезію, у прийнятному розчиннику, такому як ДМФА або ТГФ, з утворенням сполуки V (схема 2). Перетворення алкілового складного ефіру сполуки V на спирт II-а проводили з використанням гідриду металу, такого як алюмогідрид літію або боргідрид натрію, у прийнятному розчиннику, такому як ТГФ, метанол або етанол. Схема 2 20 25 Обробка спирту II-а тіонілхлоридом призводить до 2-хлорметиліндолу II-b. Альтернативним чином, спирт II-а можна перетворити на проміжну сполуку II-с реакцією з метансульфонілхлоридом у присутності органічної основи, такої як триетиламін або діізопропілетиламін у прийнятному розчиннику, такому як хлористий метилен (схема 3). Схема 3 30 35 Сполуки III можна синтезувати з використанням методики, наведеної на схемі 4. Заміщення аміном Z, який є галогенідом, бажано, фтором або алкоксигрупою, бажано, метокси, в нітропіридині або нітроарилі VI, у прийнятному розчиннику, такому як ТГФ або ДМФА, у присутності органічної основи, такої як триетиламін або діізопропілетиламін, призводить до отримання сполуки VII. Відновлення нітрогрупи до аміну VIII можна здійснити каталітичним способом з використанням водню у присутності каталізатора, такого як палладій або платина, у 6 UA 109792 C2 5 10 прийнятному розчиннику, такому як метанол, або стехіометричним способом, при використанні заліза у присутності хлориду амонію або хлориду олова у присутності концентрованої хлористоводневої кислоти. В результаті циклізації отриманого діаміна VIII за допомогою СDI, 3 фосгену або трифосгену, в розчиннику, такому як ацетонітрил або ТГФ, утворюються N заміщені бензімідазолони III. Альтернативним чином, сполуку типу III можна отримати, виходячи з комерційно доступних діанілінів IX, які можна зациклізувати шляхом замикання циклу за допомогою CDI, фосгену або трифосгену, призводячи до проміжних сполук типу Х. Алкілуваня або сульфонілування атома азоту сечовини Х можна здійснити за реакцією Міцунобу з використанням комерційно доступних спиртів, або заміщенням атома хлору в сполуках типу XI, отримуючи сполуки формули III. Схема 4 15 20 25 30 35 40 45 Сполуки формули (I) можна перевести у відповідні N-оксидні форми за відомими в даній області методикам перетворення тривалентного атома азоту в його N-оксидну форму. Як правило, вказану реакцію N-окислення можна здійснити, вводячи первинну речовину формули (I) у взаємодію з відповідним органічним або неорганічним перекисом. Прийнятні неорганічні перекиси включають, наприклад, перекис водню, перекиси лужних або лужноземельних металів, наприклад, перекис натрію, перекис калію; прийнятні органічні перекиси можуть включати пероксокислоти, наприклад, такі як бензолкарбопероксокислота або галогензаміщена бензолкарбопероксокислота, наприклад, 3-хлорбензолкарбопероксокислота, пероксоалканові кислоти, наприклад, пероксооцтова кислота, алкілгідропероксиди, наприклад третбутилгідропероксид. Прийнятні розчинники є, наприклад, водою, нижчими спиртами, наприклад, етанолом і так далі, вуглеводнями, наприклад, толуолом, кетоном, наприклад, 2-бутаноном, вуглеводнями, що містять галоген, наприклад, хлористим метиленом, і суміші подібних розчинників. Чисті стереохімічно ізомерні форми сполук формули (I) можна отримати, використовуючи відомі в даній області методи. Діастереомери можна розділити фізичними методами, такими як селективна кристалізація, і хроматографічними методами, наприклад, методом протиточного розподілу, рідинною хроматографією і так далі. Сполуки формули (I), отримані описаними вище способами, зазвичай є рацемічними сумішами енантіомерів, які можна відокремити один від одного за допомогою відомих в даній області методів розділення. Рацемічні сполуки формули (I), що є досить основними або кислими, можна перевести у відповідні їм форми діастереомерних солей реакцією з прийнятною хіральною кислотою, відповідно, хіральною основою. Вказані форми діастереомерних солей потім розділяють, наприклад селективною або дробною кристалізацією, і вивільняють з них енантіомери дія лугу або кислоти. Альтернативний спосіб розділення енантіомерних форм сполук формули (I) включає рідинну хроматографію, зокрема, рідинну хроматографию з використанням хірального носія. Вказані чисті стереохімічно ізомерні форми можна також отримати з відповідних чистих стереохімічно ізомерних форм відповідних первинних речовин, за умови, що реакція протікає стереоспецифічно. Бажано, якщо потрібний конкретний стереоізомер, вказана сполука буде синтезована стереоспецифічними способами отримання. У даних способах бажано використовують енантіомерно чисті первинні речовини. У наступному аспекті даний винахід відноситься до фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (I), визначену в даному описі, або сполуки будь-якої з підгруп сполуки формули (I), визначеної в даному описі, і фармацевтично прийнятний носій. Терапевтично ефективна кількість у даному контексті є кількістю, якої 7 UA 109792 C2 5 10 15 20 25 30 35 40 45 50 55 60 вистачає для надання профілактичної дії проти, для стабілізації або для зменшення вірусної інфекції, зокрема, вірусної RSV-інфекції у інфікованих суб'єктів, або суб'єктів з ризиком інфікування. У ще одному аспекті даний винахід відноситься до способу отримання визначеної в даному описі фармацевтичної композиції, який включає ретельне перемішування фармацевтично прийнятного носія з терапевтично ефективною кількістю сполуки формули (I), визначеної в даному описі, або сполуки будь-якої з підгруп сполуки формули (I), визначеної в даному описі. Таким чином, на основі сполук даного винаходу або будь-якого варіанту їх здійснення можна отримати різні фармацевтичні форми для цілей введення. Як прийнятні композиції можна перерахувати всі композиції, які зазвичай використовують для лікарських засобів, що системно вводяться. Для отримання фармацевтичних композицій за даним винаходом, ефективну кількість конкретної сполуки, необов'язково у формі аддитивної солі або комплексу з металом, як активний інгредієнт, об'єднують при ретельному перемішуванні з фармацевтично прийнятним носієм, при цьому носій може приймати всілякі форми залежно від форми препарату, бажаної для введення. Дані фармацевтичні композиції бажані у вигляді одиничної дозованої форми, прийнятної, зокрема, для введення пероральним, ректальним, черезшкірним способом або шляхом парентеральної ін'єкції. Наприклад, при отриманні композицій у пероральній дозованій формі, можна застосовувати будь-які звичайні фармацевтичні середовища, наприклад, такі як вода, гліколі, масла, спирти і так далі в разі пероральних рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії і розчини, або тверді носії, такі як крохмалі, цукри, каолін, лубриканти, зв'язуючі речовини, дезінтегранти і так далі в разі порошків, пілюль, капсул і пігулок. Завдяки простоті введення, пігулки і капсули є найбільш бажаними пероральними одиничними дозованими формами, в разі яких, очевидно, використовуються тверді фармацевтичні носії. У разі парентеральних композицій носій зазвичай включатиме стерильну воду, щонайменше, в значній частині, хоча може включати інші інгредієнти, наприклад, для підвищення розчинності. Наприклад, можна отримати розчини для ін'єкцій, в яких носій включає фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину і розчину глюкози. Можна також отримати суспензії для ін'єкцій, у разі яких можна застосовувати прийнятні рідкі носії, суспендуючі агенти, і так далі. Включені також препарати в твердій формі, що призначені для переведення, незадовго до застосування, в препарати, що мають рідку форму. У композиціях, прийнятних для черезшкірного введення, носій необов'язково включає агент, що підвищує проникнення, та/або прийнятний зволожуючий агент, необов'язково в сполученні з прийнятними добавками будь-якої природи в мінорних кількостях, при цьому дані добавки не спричиняють значної шкідливої дії на шкіру. Сполуки за даним винаходом можна також вводити шляхом оральної інгаляції або інсуффляції за допомогою способів і препаратів, що застосовуються в даній області для введення таким методом. Так, загалом, сполуки за даним винаходом можна вводити в легені у формі розчину, суспензії або сухого порошку, при цьому бажаним є розчин. Для введення даних сполук підходить будь-яка система, розроблена для доставки розчинів, суспензій або сухих порошків шляхом оральної інгаляції або інсуффляції. Таким чином, у даному винаході надана також фармацевтична композиція, що пристосована для введення шляхом інгаляції або інсуффляції через рот, містить сполуку формули (I) і фармацевтично прийнятний носій. Бажано, сполуки за даним винаходом вводять шляхом інгаляції розчину в небулізованих або аерозолізованих дозах. Для простоти введення і рівномірності дозування особливо бажано скласти згадані вище фармацевтичні композиції у вигляді одиничної дозованої форми. Одинична дозована форма, як використано в даному описі, відноситься до фізично дискретних одиниць, прийнятних як одиничні дози, при цьому кожна одиниця містить визначену заздалегідь кількість активного інгредієнта, розраховану для надання необхідного терапевтичного ефекту, у поєднанні з необхідним фармацевтичним носієм. Прикладами подібних одиничних дозованих форм є пігулки (включаючи пігулки з насічкою або з покриттям), капсули, пілюлі, супозиторії, пакетики з порошком, облатки, розчини або суспензії для ін'єкції і так далі, і їх розділені кратні кількості. Сполуки формули (I) проявляють противірусні властивості. Вірусні інфекції, які можна вилікувати за допомогою сполук і способів за даним винаходом, включають вірусні інфекції, викликані орто- і параміксовірусами і, зокрема, людським і коров'ячим респіраторним синцитіальним вірусом (RSV). Крім того, ряд сполук за даним винаходом проявляють активність відносно штамів RSV, що мутували. Окрім цього, багато сполук за даним винаходом проявляють сприятливий фармакокінетичний профіль і мають привабливі властивості відносно біодоступності, включаючи прийнятний період напіввиведення, AUC і пікові значення і 8 UA 109792 C2 5 10 15 20 25 30 35 40 45 50 відсутність несприятливих явищ, таких як недостатньо швидкий початок дії і утримання в тканинах. Противірусна активність відносно RSV даних сполук in vitro була протестована в експерименті, описаному в експериментальній частині опису, і її також можна продемонструвати за допомогою аналізу на зниження виходу вірусу. Противірусна активність відносно RSV даних сполук in vivo можна продемонструвати на експериментальній моделі з використанням бавовняних щурів, як описано у Wyde et al. (Antiviral Research (1998), 38, 31-42). Завдяки своїм противірусним властивостям, зокрема, своїм властивостям проти RSV, сполуки формули (I) або будь-який варіант їх здійснення, їх проліки, N-оксиди, аддитивні солі, четвертинні аміни, комплекси з металами і стереохімічно ізомерні форми, застосовні для лікування індивідуумів, страждаючих на вірусну інфекцію, зокрема, RSV-інфекцію, і для профілактики даних інфекцій. У цілому, сполуки за даним винаходом можуть застосовуватись для лікування теплокровних тварин, заражених вірусами, зокрема, респіраторним синцитіальним вірусом. Отже, сполуки за даним винаходом або будь-який варіант їх здійснення можна застосовувати як лікарські засоби. Вказане застосування як лікарського засобу або спосіб лікування включає системне введення зараженим вірусом суб'єктам або суб'єктам, сприйнятливим до вірусних інфекцій, ефективної кількості для боротьби із станами, пов'язаними з вірусною інфекцією, зокрема, RSV-інфекцією. Даний винахід відноситься також до застосування даних сполук або будь-якого варіанту їх здійснення для отримання лікарського засобу для лікування або запобігання вірусним інфекціям, зокрема, RSV-інфекції. Крім того, даний винахід відноситься до способу лікування теплокровної тварини, зараженої вірусом, або такої, що має ризик зараження вірусом, зокрема, RSV, при цьому вказаний спосіб включає введення ефективної відносно вірусу кількості сполуки формули (I), визначеної в даному описі, або сполуки будь-якої з підгруп сполуки формули (I), визначених у даному описі. Зазвичай передбачається, що ефективна відносно вірусу добова кількість складає від 0,01 мг/кг до 500 мг/кг маси тіла, бажаніше, від 0,1 мг/кг до 50 мг/кг маси тіла. Може виявитись доречним вводити необхідну дозу у вигляді двох, трьох, чотирьох або більше суб-доз з відповідними інтервалами протягом доби. Вказані суб-дози можуть бути складені у вигляді одиничних дозованих форм, наприклад, таких, що містять від 1 до 1000 мг, а, зокрема, від 5 до 200 мг активного інгредієнту в одиничній дозованій формі. Точне дозування і частота введення залежать від конкретної сполуки формули (I), що застосовується, конкретного стану, що підлягає лікуванню, важкості даного стану, що підлягає лікуванню, віку, статі, міри порушення і загального фізичного стану конкретного пацієнта, а також інших лікарських засобів, які може приймати індивідуум, як добре відомо фахівцеві в даній області. Крім того, очевидно, що вказану ефективну добову кількість можна зменшити або збільшити залежно від реакції суб'єкта, який отримує лікування та/або залежно від оцінки лікаря, який прописує сполуки за даним винаходом. Таким чином, інтервали ефективної добової кількості, згадані вище, є лише методичними вказівками. Крім того, як лікарський засіб можна застосовувати комбінацію іншого противірусного агента і сполуки формули (I). Таким чином, даний винахід відноситься до продукту, що містить (а) сполуку формули (I), і (b) іншу противірусну сполуку, як об'єднаний препарат для одночасного, окремого або послідовного застосування для противірусного лікування. В одному препараті з фармацевтично прийнятними носіями можна об'єднати різні лікарські засоби. Наприклад, з метою лікування або запобігання RSV-інфекцій, сполуки за даним винаходом можна об'єднати з інтерфероном-бета або фактором некрозу пухлини-альфа. Далі винахід буде ілюстрований із посиланням на наступні необмежуючі приклади. Приклад 1 Синтез проміжних сполук Усі проміжні сполуки, необхідні для синтезу цільових сполук формули I, синтезують, як описано на наступній схемі 5 по наступну схему 9. 55 Схема 5: синтез 1-бром-3-(метилсульфоніл)пропана 5-с Стадія 1: Синтез 3-(метилсульфоніл)пропан-1-ола 5-b 9 UA 109792 C2 5 10 15 20 25 30 35 40 45 Спирт 5-а (200 г, 1900 ммоль) розчиняли в CH2Cl2 (2000 мл). Суміш охолоджували до 0С. Додавали порціями 85%-ний розчин м-СРВА у воді (970 г, 5700 ммоль), підтримуючи температуру в інтервалі від 0 до 5С. Після додавання суміш залишали нагріватися до 25С і перемішували протягом 15 год. Суміш фільтрували через шар целіта. Фільтрат очищали флешхроматографією (елюент: петролейний ефір:етилацетат=3:1, а потім сумішшю етилацетат:метанол=10:1), отримуючи проміжну сполуку 5-b (75 г, 29%). Стадія 2: Синтез 1-бром-3-(метилсульфоніл)пропану 5-с Проміжну сполуку 5-b (75 г, 543 ммоль) розчиняли в CH2Cl2 (750 мл). Суміш охолоджували до 0С. Додавали по краплях трибромистий фосфор (53,6 мл, 570 ммоль), підтримуючи температуру в інтервалі від 0 до 5С. Після додавання суміш залишали нагріватись до 25С і перемішували протягом 15 год. Суміш виливали в крижану воду. Відокремлений органічний шар промивали розчином солі (2×1500 мл), сушили над Na 2SO4, фільтрували і упарювали у вакуумі, отримуючи вказану в заголовку сполуку 5-с (77 г, 71%). 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 2,25-2,40 (м, 2Н), 2,91 (с, 3Н), 3,1-3,2 (м, 2Н), 3,5-3,6 (м, 2Н). Схема 6: синтез трет-бутил(4-хлорбутокси)диметилсилана 6-b Спирт 6-а (100 г, 920 ммоль) розчиняли в CH2Cl2 (1000 мл) при кімнатній температурі. Суміш охолоджували до 0С, потім додавали імідазол (81,5 г, 1200 ммоль) і TBDMS-Cl (152 г, 1010 ммоль). Отриману суміш перемішували протягом 4 год. при кімнатній температурі, потім фільтрували. Фільтрат послідовно промивали 10%-ною HCl і розчином солі. Отриманий розчин сушили над MgSO4, фільтрували, потім концентрували, отримуючи вказану в заголовку сполуку 6-b (100 г, 50%) у вигляді безбарвного масла. Схема 7: синтез 1-циклопропіл-1Н-імідазо[4,5-с]піридин-2(3Н)-она 7-d Стадія 1: Синтез N-циклопропіл-3-нітропіридин-4-аміна 7-b 4-метокси-3-нітропіридин 7-а (CAS 3187-62-5) (200 г, 1300 ммоль), циклопропіламін (185,5 г, 3250 ммоль) і діізопропілетиламін (336 г, 2600 ммоль) у сухому етанолі (800 мл) кип'ятили протягом 3 годин. Суміш охолоджували до 0С. Осад виділяли фільтруванням. Залишок на фільтрі промивали холодним етанолом (150 мл). Тверду речовину сушили, отримуючи вказану в заголовку сполуку 7-b (167 г, вихід 72%) у вигляді порошку білого кольору. 4 Стадія 2: Синтез N -циклопропілпіридин-3,4-діаміна 7-с Проміжну сполуку 7-b (167 г, 932 ммоль) в етанолі (1400 мл) гідрували (50 фунтів/кв.дюйм) при 20С з використанням вологого 10%-ного Pd/C (34 г) як каталізатора протягом ночі. Після поглинання Н2 (3 екв.) каталізатор відфільтровували, а фільтрат упарювали. Залишок промивали метилтретбутиловим ефіром, отримуючи вказану в заголовку сполуку 7-с (133 г, 95%) у вигляді порошку жовтого кольору. Стадія 3: Синтез 1-циклопропіл-1Н-імідазо[4,5-с]піридин-2(3Н)-она 7-d Карбонілдіімідазол (151,8 г, 936 ммоль) додавали до розчину проміжної сполуки 7-с (133 г, 891,4 ммоль) у CH3CN (1800 мл) при 0С. Реакційній суміші давали нагрітись до 10С і перемішували протягом 1 год. Осад виділяли фільтруванням і промивали CH 3CN (200 мл), отримуючи вказану в заголовку сполуку 7-d (101 г, 65%) у вигляді порошку білого кольору. 10 UA 109792 C2 5 10 15 20 25 30 35 Схема 8: Синтез 1-(оксетан-3-іл)-1Н-імідазо[4,5-с]піридин-2(3Н)-она 8-d Сполуку 8-d отримували так само, як сполуку 7-d, використовуючи 3-амінооксетан як первинну сполуку. Схема 9: синтез 1-циклопропіл-5-фтор-1Н-бензо[d]імідазол-2(3Н)-она 9-d Стадія 1: Синтез N-циклопропіл-4-фтор-2-нітроаніліна 9-b 1,4-дифтор-2-нітробензол 9-а (CAS 364-74-9) (15 г, 94,3 ммоль) розчиняли в ДМФА (500 мл). Додавали циклопропіламін (7 мл, 100 ммоль), потім триетиламін (30 мл, 217 ммоль). Отриману суміш перемішували при кімнатній температурі протягом ночі. Суміш виливали у воду і екстрагували хлористим метиленом, сушили над MgSO 4 і концентрували. Тверду речовину помаранчевого кольору очищали колонковою хроматографією з використанням хлористого метилену і метанолу, отримуючи проміжну сполуку 9-b (16 г, 86%) у вигляді твердої речовини помаранчевого кольору. + m/z=197 (М+Н) . 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,63-0,68 (м, 2H), 0,88-0,95 (м, 2H), 2,54-2,55 (м, 1H), 7,27-7,34 (м, 2H), 7,84-7,90 (м, 1H), 7,93-8,02 (м, 1H). Стадія 2: Синтез N4-циклопропіл-4-фторбензол-1,2-діаміна 9-с Проміжну сполуку 9-b (16 г, 82 ммоль) в етанолі (200 мл) гідрували при кімнатній температурі з використанням вологого 10%-вого Pd/C як каталізатора протягом ночі. Після поглинання Н2 (3 екв.) каталізатор фільтрували, а фільтрат упарювали. Залишок промивали етанолом, отримуючи вказану в заголовку сполуку 9-с (12,8 г, 94%) у вигляді твердої речовини + білого кольору. m/z=167 (М+Н) . Стадія 3: Синтез 1-циклопропіл-5-фтор-1Н-бензо[d]імідазол-2(3Н)-она 9-d Карбонілдіімідазол (13,15 г, 81 ммоль) додавали до розчину проміжної сполуки 9-с (12,8 г, 77,3 ммоль) у CH3CN (150 мл) при 0С. Реакційній суміші давали нагрітись до кімнатної температурі і перемішували протягом 4 год. Розчинник видаляли, потім залишок очищали колонковою хроматографією з використанням суміші CH2Cl2/метанол, отримуючи тверду речовину світло-коричневого кольору, яку розтирали з діетиловим ефіром, отримуючи сполуку + 9-d (7,4 г, 50%) у вигляді твердої речовини білого кольору. m/z=193 (М+Н) . 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,99-1,08 (м, 2H) 1,08-1,20 (м, 2H) 2,89 (м, 1H) 6,756,84 (м, 1H) 6,87 (дд, J=8,53, 2,51 Гц, 1H) 7,10 (дд, J=8,53, 4,27 Гц, 1H) 10,33 (ушир.c, 1H). Приклад 2 Синтез 3-((5-бром-1-(3-метилсульфоніл)пропіл)-1Н-індол-2-іл)метил)-1-циклопропіл-1Німідазо[4,5-с]піридин-2(3Н)-она 2 11 UA 109792 C2 Стадія 1: Синтез етил 5-бром-1-(3-(метилсульфоніл)пропіл)-1Н-індол-2-карбоксилата 2-1 5 10 15 Етил 5-бром-1Н-індол-2-карбоксилат (CAS 16732-70-0) (2,3 г, 8,6 ммоль) розчиняли в ДМФА (50 мл). Суміш перемішували при кімнатній температурі, потім додавали 60%-ву суспензію гідриду натрію в мінеральному маслі (0,52 г, 12,8 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 1 год., потім додавали 1-бром-3-(метилсульфоніл)пропан 5-с (2,6 г, 12,8 ммоль). Отриману суміш перемішували при кімнатній температурі протягом ночі. Суміш виливали в суміш крига-вода і екстрагували етилацетатом. Органічний шар сушили над MgSO4 і концентрували, отримуючи сире масло коричневого кольору. Сиру речовину очищали колонковою хроматографією з використанням суміші хлористий метилен/метанол, отримуючи вказану в заголовку сполуку 2-1 (3,2 г, 96%) у вигляді твердої речовини білого кольору. m/z=389 + (М+Н) . Стадія 2: Синтез (5-бром-1-(3-(метилсульфоніл)пропіл)-1Н-індол-2-іл)метанолу 2-2 20 25 30 До розчину проміжної сполуки 2-1 (3,2 г, 8,24 ммоль) у ТГФ (100 мл) додавали при кімнатній температурі алюмогідрид літію (2 М розчин у ТГФ, 5,2 мл, 10,4 ммоль). Отриману суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш гасили, додаючи етилацетат і етанол. Отриману суміш виливали в суміш крига-вода, потім фільтрували через целіт. Водний шар екстрагували етилацетатом (3×50 мл). Об'єднані органічні екстракти промивали насиченим розчином солі (100 мл), сушили над MgSO4, фільтрували і концентрували при зниженому тиску. Залишок очищали колонковою хроматографією з використанням суміші хлористий метилен/метанол як елюента. Продукт 2-2 виділяли (2,5 г, 88%) у вигляді твердої + речовини білого кольору. m/z=347 (М+Н) . Стадія 3: Синтез 3-((5-бром-1-(3-метилсульфоніл)пропіл)-1Н-індол-2-іл)метил)-1циклопропіл-1Н-імідазо[4,5-с]піридин-2(3Н)-она 2 12 UA 109792 C2 5 10 15 20 25 До перемішуваного розчину проміжної сполуки 2-2 (0,5 г, 1,3 ммоль), трифенілфосфіна (0,37 г, 1,4 ммоль) і піридобензімідазолона 7-d (0,34 г, 2 ммоль) у сухому ТГФ (30 мл) додавали по краплях DIAD (94%, 0,71 мл, 1,36 ммоль) при кімнатній температурі. Реакційну суміш перемішували протягом ночі. Після закінчення реакції суміш концентрували насухо і очищали залишок колонковою хроматографією при елююванні сумішшю етилацетат/CH 2Cl2, потім CH2Cl2/метанол, отримуючи вказану в заголовку сполуку 2 (458 мг, 70%) у вигляді твердої + речовини білого кольору. m/z=504 (М+Н) . 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,99-1,07 (м, 2H), 1,13-1,21 (м, 2H), 2,11 (м, 2H), 2,86 (с, 3H), 2,93-2,99 (м, 1H), 3,00-3,07 (м, 2H), 4,37-4,48 (м, 2H), 5,22 (с, 2H), 6,61 (с, 1H), 7,12-7,21 (м, 2H), 7,30 (дд, J=8,8, 1,8 Гц, 1H), 7,71 (д, J=1,8 Гц, 1H), 8,32 (д, J=5,3 Гц, 1H), 8,40 (с, 1H). Приклад 3 Сполуки 1, 5, 6 і 8 отримували так само, як і сполуку 2. 3-((5-хлор-1-(3-метилсульфоніл)пропіл)-1Н-індол-2-іл)метил)-1-циклопропіл-1Н-імідазо[4,5с]піридин-2(3Н)-он 1 + m/z=460 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,90-0,97 (м, 2H), 1,02-1,10 (м, 2H), 1,86-1,99 (м, 2H), 2,97 (с, 3H), 2,98-3,03 (м, 1H), 3,10-3,18 (м, 2H), 4,38 (т, J=7,5 Гц, 2H), 5,75 (с, 2H), 6,53 (с, 1H), 7,16 (дд, J=8,8, 2,0 Гц, 1H), 7,27 (д, J=5,3 Гц, 1H), 7,54 (д, J=8,8 Гц, 1H), 7,57 (д, J=2,0 Гц, 1H), 8,25 (д, J=5,3 Гц, 1H), 8,40 (с, 1H). 3-((5-бром-1-(3-метилсульфоніл)пропіл)-1Н-індол-2-іл)метил)-1-(оксетан-3-іл)-1Н-імідазо[4,5с]піридин-2(3Н)-он 5 13 UA 109792 C2 + 5 m/z=520 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 1,92 (ддд, J=15,2, 7,8, 7,7 Гц, 2H), 2,96 (с, 3H), 3,13 (м, 2H), 4,38 (т, J=7,7 Гц, 2H), 4,97 (д, J=7,8 Гц, 2H), 5,07 (т, J=6,7 Гц, 2Н), 5,36 (с, 2Н), 5,56 (тдд, J=7,8, 7,8, 6,3, 6,1 Гц, 1H), 6,56 (с, 1H), 7,28 (дд, J=8,8, 2,0 Гц, 1H), 7,50 (д, J=8,8 Гц, 1H), 7,54 (д, J=5,3 Гц, 1H), 7,71 (д, J=1,8 Гц, 1H), 8,30 (д, J=5,5 Гц, 1H), 8,41-8,57 (м, 1H). 3-((5-бром-1-(3-метилсульфоніл)пропіл)-1Н-індол-2-іл)метил)-1-циклопропіл-5-фтор-1Німідазол-2(3Н)-он 6 10 + 15 m/z=521 (М+Н) . 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,99-1,06 (м, 2H), 1,09-1,17 (м, 2H), 2,11 (м, 2H), 2,85 (с, 3H), 2,92 (м, 1H), 2,97-3,05 (м, 2H), 4,38-4,47 (м, 2H), 5,16 (с, 2H), 6,57 (с, 1H), 6,76-6,84 (м, 1H), 6,87 (дд, J=8,4, 2,0 Гц, 1H), 7,12 (дд, J=8,4, 4,5 Гц, 1H), 7,19 (д, J=8,8 Гц, 1H), 7,30 (дд, J=8,8, 2,0 Гц, 1H), 7,72 (д, J=1,8 Гц, 1H). 3-((5-хлор-1-(3-метилсульфоніл)пропіл)-1Н-індол-2-іл)метил)-1-циклопропіл-5-фтор-1Німідазол-2(3Н)-он 8 20 + 25 m/z=477 (М+Н) . 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,99-1,05 (м, 2H), 1,10-1,17 (м, 2H), 2,11-2,17 (м, 2H), 2,85 (с, 3H), 2,89-2,96 (м, 1H), 2,97-3,05 (м, 2H), 4,39-4,46 (м, 2H), 5,16 (с, 2H), 6,57 (с, 1H), 6,77 14 UA 109792 C2 5 10 15 20 25 30 6,84 (м, 1H), 6,88 (дд, J=8,4, 2,4 Гц, 1H), 7,12 (дд, J=8,7, 4,4 Гц, 1H), 7,17 (м, J=2,0 Гц, 1H), 7,217,25 (м, 1H), 7,56 (д, J=1,5 Гц, 1H). Приклад 4 Синтез 3-((5-бром-1-(4-(трет-бутилдиметилсилілокси)бутил)-1Н-індол-2-іл)метил)-1циклопропіл-1Н-імідазо[4,5-с]піридин-2(3Н)-она 11 Стадія 1: Синтез карбоксилата 11-1 етил 5-бром-1-(4-(трет-бутилдиметилсилілокси)бутил)-1Н-індол-2 Етил 5-бром-1Н-індол-2-карбоксилат, який є комерційно доступним (CAS 16732-70-0) (3 г, 11 ммоль), розчиняли в ДМФА (50 мл). Суміш перемішували при кімнатній температурі, потім додавали 60%-ву суспензію гідриду натрію в мінеральному маслі (0,49 г, 12,3 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 1 години. Додавали трет-бутил(4хлорбутокси)диметилсилан 6-b (2,5 г, 11,2 ммоль). Отриману суміш перемішували при 60С протягом 5 днів. Суміш залишали остигати до кімнатної температури, потім виливали в суміш води з кригою, потім екстрагували етилацетатом. Органічний шар сушили над MgSO4 і концентрували, отримуючи масло помаранчевого кольору. Сиру речовину очищали колонковою хроматографією з використанням суміші хлористий метилен/гептан, отримуючи вказану в + заголовку сполуку 11-1 (3,93 г, 77%) у вигляді безбарвного масла. m/z=455 (М+Н) . Стадія 2: Синтез (5-бром-1-(4-(третбутилдиметилсилілокси)бутил)-1Н-індол-2-іл) метанолу 11-2 До розчину проміжного сполуки 11-1 (3,93 г, 6,72 ммоль) у ТГФ (100 мл) додавали при -78С 1 М розчин алюмогідриду літію в ТГФ (8 мл, 8 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш гасили, додаючи етилацетат і етанол. Дану суміш виливали в суміш крига-вода і фільтрували отриману суміш через целіт. Водний шар екстрагували етилацетатом (3×50 мл). Об'єднані органічні екстракти промивали насиченим розчином солі (100 мл), сушили над MgSO 4, фільтрували і концентрували при зниженому тиску. 15 UA 109792 C2 5 10 15 20 Залишок очищали колонковою хроматографією з використанням суміші хлористий метилен/метанол як елюент. Проміжну сполуку 11-2 виділяли у вигляді безбарвного масла (2,68 + г, 96%). m/z=413 (М+Н) . Стадія 3: Синтез 3-((5-бром-1-(4-(третбутилдиметилсилілокси)бутил)-1Н-індол-2-іл)метил)-1циклопропіл-1Н-імідазо[4,5-с]піридин-2(3Н)-она 11 До перемішуваного розчину проміжної сполуки 11-2 (0,77 г, 1,86 ммоль), трифенілфосфіна (0,54 г, 2,05 ммоль) і піридобензімідазолона 7-d (0,34 г, 2 ммоль) у сухому ТГФ (30 мл) додавали по краплях DIAD (94%, 0,38 мл, 1,96 ммоль) при кімнатній температурі. Реакційну суміш перемішували протягом ночі. Після закінчення реакції суміш концентрували насухо і очищали залишок колонковою хроматографією при елююванні сумішшю етилацетат/CH 2Cl2, потім CH2Cl2/метанол, отримуючи вказаний у заголовку продукт 11 (1,06 г, 61%) у вигляді безбарвного + масла. m/z=570 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. -0,02 (с, 6H), 0,79-0,83 (м, 9H), 0,88-0,96 (м, 2H), 1,03-1,12 (м, 2H), 1,36-1,58 (м, 4H), 2,93-3,03 (м, 1H), 3,51 (т, J=6,1 Гц, 2H), 4,24 (т, J=7,3 Гц, 2H), 5,28 (с, 2H), 6,56 (с, 1H), 7,22 (дд, J=8,8, 2,0 Гц, 1H), 7,27 (д, J=5,3 Гц, 1H), 7,41 (д, J=8,8 Гц, 1H), 7,70 (д, J=2,0 Гц, 1H), 8,23 (д, J=5,3 Гц, 1H), 8,34 (с, 1H). Приклад 5 Синтез 3-((5-хлор-1-(4-(третбутилдиметилсилілокси)бутил)-1Н-індол-2-іл)етил)-1циклопропіл-1Н-імідазо[4,5-с]піридин-2(3Н)-она 13 25 30 Сполуку 13 отримували так само, як і сполуку 11, виходячи з комерційно доступного індолу. + m/z=526 (М+Н) . Приклад 6 Синтез 3-((5-бром-1-(4-(гідроксибутил)-1Н-індол-2-іл)метил)-1-циклопропіл-1Н-імідазо[4,5с]піридин-2(3Н)-она 4 16 UA 109792 C2 5 10 15 20 25 30 Проміжну сполуку 11 (1,06 г, 1,14 ммоль) розчиняли в метанолі (30 мл), а потім додавали фторид амонію (0,172 г, 4,6 ммоль). Отриману суміш перемішували при 60С протягом ночі. Реакційну суміш залишали остигати до кімнатної температури, потім видаляли розчинник. Залишок очищали колонковою хроматографією з використанням суміші хлористий метилен/метанол, отримуючи даний продукт у вигляді твердої речовини білого кольору (323 мг, + 62%). m/z=456 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,88-0,97 (м, 2H), 1,03-1,13 (м, 2H), 1,32-1,53 (м, 4H), 2,99 (дт, J=7,0, 3,4 Гц, 1H), 3,34-3,40 (м, 2H), 4,23 (т, J=7,4 Гц, 2H), 4,40 (т, 7=5,0 Гц, 1H), 5,28 (с, 2H), 6,55 (с, 1H), 7,23 (дд, J=8,7, 1,9 Гц, 1H), 7,27 (д, J=5,3 Гц, 1H), 7,42 (д, J=8,8 Гц, 1H), 7,70 (д, J=1,8 Гц, 1H), 8,23 (д, J=5,3 Гц, 1H), 8,34 (с, 1H). Приклад 7 Сполуки 7, 9, 10, 15 і 16 отримували так само, як і сполуку 4, виходячи з відповідних комерційно доступних індолів. 3-((5-хлор-1-(4-гідроксибутил)-1Н-індол-2-іл)метил)-1-циклопропіл-1Н-імідазо[4,5-с]піридин2(3Н)-он 7 + m/z=456 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,87-0,97 (м, 2H), 1,03-1,14 (м, 2H), 1,31-1,57 (м, 4H), 2,99 (м, 1H), 3,26-3,43 (м, 2H), 4,23 (т, J=7,3 Гц, 2H), 4,40 (т, J=5,1 Гц, 1H), 5,28 (с, 2H), 6,55 (с, 1H), 7,12 (дд, J=8,7, 2,1 Гц, 1H), 7,27 (д, J=5,3 Гц, 1H), 7,46 (д, J=8,8 Гц, 1H), 7,55 (д, J=2,0 Гц, 1H), 8,23 (д, J=5,0 Гц, 1H), 8,35 (с, 1H). 1-циклопропіл-3-((5-фтор-1-(4-гідроксибутил)-1Н-індол-2-іл)метил)-1Н-імідазо[4,5-з]піридин2(3Н)-он 9 + m/z=456 (М+Н) . 17 UA 109792 C2 1 5 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,97-1,06 (м, 2H), 1,12-1,20 (м, 2H), 1,54-1,74 (м, 4H), 2,26 (ушир.c, 1H), 2,89-3,00 (м, 1H), 3,64 (т, J=5,9 Гц, 2H), 4,17-4,29 (м, 2H), 5,22 (с, 2H), 6,60 (с, 1H), 6,93 (тд, J=9,2, 2,5 Гц, 1H), 7,10-7,24 (м, 3H), 8,29 (д, J=5,3 Гц, 1H), 8,39 (с, 1H). 1-циклопропіл-3-((1-(4-гідроксибутил)-5-метокси-1Н-індол-2-іл)метил)-1Н-імідазо[4,5с]піридин-2(3Н)-он 10 + 10 15 m/z=407 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,87-0,96 (м, 2H), 1,02-1,12 (м, 2H), 1,30-1,50 (м, 4H), 2,98 (дт, J=7,0, 3,5 Гц, 1H), 3,27-3,29 (м, 2H), 3,73 (с, 3H), 4,17 (т, J=6,9 Гц, 2H), 4,39 (т, J=5,0 Гц, 1H), 5,24 (с, 2H), 6,51 (с, 1H), 6,76 (дд, J=8,8, 2,5 Гц, 1H), 7,01 (д, J=2,5 Гц, 1H), 7,26 (д, J=5,3 Гц, 1H), 7,30 (д, J=8,8 Гц, 1H), 8,22 (д, J=5,0 Гц, 1H), 8,35 (с, 1H). 3-((6-хлор-1-(4-гідроксибутил)-3-йод-1Н-індол-2-іл)метил)-1-циклопропіл-1Н-імідазо[4,5с]піридин-2(3Н)-он 15 + 20 25 m/z=538 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,88-0,97(м, 2H), 1,05-1,13 (м, 2H), 1,16-1,27 (м, 2H), 1,271,39 (м, 2H), 2,99 (тт, J=7,0, 3,7 Гц, 1H), 3,19-3,28 (м, 2H), 4,14-4,28 (м, 2H), 4,37 (т, J=4,9 Гц, 1H), 5,30 (с, 2H), 7,17 (дд, J=8,4, 1,9 Гц, 1H), 7,27 (дд, J=5,1, 0,6 Гц, 1H), 7,35 (д, J=8,5 Гц, 1H), 7,64 (д, J=1,8 Гц, 1H), 8,09 (с, 1H), 8,22 (д, J=5,3 Гц, 1H). 3-((6-хлор-1-(4-гідроксибутил)-1Н-індол-2-іл)метил)-1-циклопропіл-1Н-імідазо[4,5-с]піридин2(3Н)-он 16 18 UA 109792 C2 + 5 m/z=412 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,80-0 97 (м, 2H), 1,00-1,19 (м, 2H), 1,31-1,56 (м, 4H), 2,873,10 (м, 1H), 3,34-3,45 (м, 2H), 4,22 (т, J=7,2 Гц, 2H), 4,41 (т, J=5,0 Гц, 1H), 5,27 (с, 2H), 6,60 (с, 1H), 7,01 (дд, J=8,3, 1,8 Гц, 1H), 7,27 (дд, J=5,1, 0,6 Гц, 1H), 7,51 (д, J=8,5 Гц, 1H), 7,53-7,60 (м, 1H), 8,23 (д, J=5,3 Гц, 1H), 8,35 (с, 1H). Приклад 8 Синтез 5-((5-бром-2-(1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)-іл) метил)-1Ніндол-1-іл)пентаннітрила 3 10 Стадія 1: Синтез 4-(5-бром-1-((1-циклопропіл-2-оксо-1Н-імідазол[4,5-с]піридин-3(2Н)іл)метил)-1Н-індол-1-іл)бутил 4-метилбензолсульфоната 3-1 15 20 25 До розчину сполуки 4 (0,88 г, 1,95 ммоль) у сухому хлористому метилені (30 мл) в атмосфері азоту додавали триетиламін (0,81, 5,83 ммоль), 4-диметиламінопіридин (0,07 г, 0,58 ммоль) і 4метилбензол-1-сульфонілхлорид (0,445 г, 2,33 ммоль) при кімнатній температурі. Отриману суміш перемішували протягом ночі в атмосфері азоту. Реакційну суміш розбавляли хлористим метиленом, потім промивали водою, сушили над MgSO 4 і концентрували. Залишок очищали колонковою хроматографією з використанням хлористого метилену і метанолу. Проміжну + сполуку 3-1 (760 мг, 65%) виділяли у вигляді піни білого кольору. m/z=610 (М+Н) . Стадія 2: Синтез 5-((5-бром-2-(1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)іл)метил)-1Н-індол-1-іл)пентаннітрила 3 19 UA 109792 C2 5 10 15 До проміжної сполуки 3-1 (0,76 г, 1,25 ммоль) у ДМСО (30 мл) додавали ціанід натрію (75 мг, 1,5 ммоль). Отриману суміш перемішували протягом ночі в атмосфері азоту при 90С. Реакційну суміш залишали остигати до кімнатної температури, потім виливали в суміш вода/хлористий метилен. Отриману суміш екстрагували хлористим метиленом, сушили над MgSO4 і концентрували. Отриманий залишок очищали колонковою хроматографією при елююванні сумішшю хлористий метилен/метанол, отримуючи вказану в заголовку сполуку 3 + (500 мг, 86%) у вигляді порошку білого кольору. m/z=465 (М+Н) . 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,99-1,06 (м, 2H), 1,15-1,21 (м, 2H), 1,64-1,72 (м, 2H), 1,72-1,82 (м, 2H), 2,33 (т, J=6,8 Гц, 2H), 2,95 (м, 1H), 4,28 (т, J=7,2 Гц, 2H), 5,21 (с, 2H), 6,63 (с, 1H), 7,10-7,16 (м, 2H), 7,28 (дд, J=8,8, 1,8 Гц, 1H), 7,71 (д, J=1,8 Гц, 1H), 8,32 (д, J=5,3 Гц, 1H), 8,39 (с, 1H). Приклад 9 Синтез 1-циклопропіл-3-((1-ізопентил-1Н-індол-2-іл)метил)-1Н-імідазо[4,5-с]піридин-2(3Н)она 12 Стадія 1: Синтез (1-ізопентил-1Н-індол-2-іл)метанолу 12-1 20 25 30 (1Н-індол-2-іл)метанол (CAS 24621-70-3) (0,5 г, 3 ммоль) розчиняли в ДМФА (20 мл) і перемішували суміш при кімнатній температурі. Після цього додавали 60%-ву суспензію гідриду натрію в мінеральному маслі (0,13 г, 3,43 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 1 години, потім додавали 1-бром-3-метилбутан (CAS 107-82-4) (0,45 мл, 3,7 ммоль). Отриману суміш перемішували при кімнатній температурі протягом ночі. Суміш виливали в суміш крига/вода і екстрагували етилацетатом. Органічний шар сушили над MgSO 4 і концентрували, отримуючи масло чорного кольору. Сиру речовину очищали колонковою хроматографією з використанням суміші хлористий метилен/етилацетат, отримуючи вказану в + заголовку сполуку 12-1 (177 мг, 26%) у вигляді порошку рожевого кольору. m/z=218 (М+Н) . Стадія 2: Синтез 1-циклопропіл-3-((1-ізопентил-1Н-індол-2-іл)метил)-1Н-імідазо[4,5с]піридин-2(3Н)-она 12 35 20 UA 109792 C2 5 10 До перемішуваного розчину проміжної сполуки 12-1 (0,17 г, 0,79 ммоль), трифенілфосфіна (0,23 г, 0,87 ммоль) і піридобензімідазолона 7-d (0,14 г, 0,83 ммоль) у сухому ТГФ (20 мл) додавали по краплях DIAD (94%, 0,17 мл, 0,83 ммоль) при кімнатній температурі. Реакційну суміш перемішували протягом ночі в атмосфері азоту. Після закінчення реакції суміш концентрували насухо. Залишок очищали колонковою хроматографією при елююванні сумішшю етилацетат/CH2Cl2, потім CH2Cl2/метанол, отримуючи вказану в заголовку сполуку 12 (68 мг, + 22%) у вигляді порошку білого кольору. m/z=375 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,89 (д, J=6,6 Гц, 6H), 0,90-0,95 (м, 2H), 1,04-1,12 (м, 2H), 1,20-1,30 (м, 2H), 1,54-1,67 (м, 1H), 2,98 (с, 1H), 4,16-4,25 (м, 2H), 5,28 (с, 2H), 6,61 (с, 1H), 7,01 (тд, J=7,5, 0,9 Гц, 1H), 7,13 (ддд, J=8,3, 7,1, 1,2 Гц, 1H), 7,27 (дд, J=5,3, 0,8 Гц, 1H), 7,35 (д, J=8,8 Гц, 0H), 7,51 (д, J=7,8 Гц, 1H), 8,22 (д, J=5,1 Гц, 1H), 8,35 (с, 1H). Приклад 10 Синтез етил 2-((1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)-іл)етил)-1-ізопентил-1Ніндол-3-карбоксилата 18 15 Стадія 1: Синтез етил 3-(2-фенілгідразон)бутаноата 18-1 20 25 30 35 До розчину фенілгідразину (125 г, 1150 ммоль) і етил 3-оксобутаноата (100 г, 770 ммоль) у трет-бутилметиловому ефірі (1000 мл) додавали оцтову кислоту (2 мл). Отриману суміш перемішували при 0 °C протягом 1 год. Розчинник випарювали у вакуумі. Залишок (220 г) використовували на наступній стадії як є. Стадія 2: Синтез етил 2-метил-1Н-індол-3-карбоксилату 18-2 Проміжну сполуку 18-1 (160 г) додавали порціями до конц. H 2SO4 (800 мл) при -10С при енергійному перемішуванні. Розчин перемішували протягом 1 год. при -10С і протягом 2 год. при 15 °C. Розчин виливали в суміш крига-вода і екстрагували трет-бутилметиловим ефіром. Після видалення розчинника тверду речовину промивали петролейним ефіром. Отримували проміжну сполуку 18-2 (80 г, 70%). Стадія 3: Синтез етил 1-ізопентил-2-метил-1Н-індол-3-карбоксилата 18-3 21 UA 109792 C2 5 10 15 20 25 30 35 До розчину проміжного сполуки 18-2 (38 г, 187 ммоль) у CH3CN (1000 мл) додавали 1-бром3-метилбутан (94 мл, 747 ммоль) і Cs2CO3 (121 г, 374 ммоль). Отриману суміш нагрівали при кипінні протягом 2 год. Осад фільтрували, а фільтрат упарювали у вакуумі. Залишок очищали високоефективною рідинною хроматографією (С18, елюент: СН 3ОН/Н2О від 15/85 до 45/55 у присутності 0,1% ТФУ як буфера). Збирали чисті фракції і видаляли леткі речовини у вакуумі, а рН водного розчину доводили до 8 додаванням NaHCO 3. Залишок екстрагували CH2Cl2 (2×100 мл). Органічний шар промивали насиченим розчином солі (100 мл) і сушили над Na 2SO4. Розчинник видаляли у вакуумі, отримуючи необхідну проміжну сполуку 18-3 (20 г, 40%). Стадія 4: Синтез етил 2-форміл-1-ізопентил-1Н-індол-3-карбоксилата 18-4 До розчину проміжної сполуки 18-3 (9,8 г, 35,8 ммоль) в оцтовій кислоті (150 мл) додавали SeO2 (14 г, 71,6 ммоль). Отриману суміш нагрівали при кипінні протягом 12 год., потім залишали остигати до кімнатної температури. Після цього додавали воду (200 мл) і CH2Cl2 (200 мл). Органічний шар промивали насиченим розчином солі (150 мл) і сушили над Na 2SO4. Розчинник видаляли у вакуумі. Залишок використовували на наступній стадії без додаткового очищення. Отримували суміш продуктів (10 г, 70% 18-5 і 10% 18-4). Стадія 5: Синтез етил 2-(гідроксиметил)-1-ізопентил-1Н-індол-3-карбоксилата 18-6 Суміш проміжних продуктів 18-4 і 18-5 (10 г) розчиняли в метанолі (100 мл) і охолоджували до -15С. Порціями додавали NaBH4 (0,4 г, 10,4 ммоль). Суміш перемішували при -15С протягом 10 хв. і нагрівали до 15С протягом 0,5 год. Додавали насичений розчин NaHCO 3. Розчинник видаляли у вакуумі. Додавали CH2Cl2 (100 мл) і Н2О (100 мл). Органічний шар промивали насиченим розчином солі і сушили над Na2SO4. Отриманий залишок розчиняли в метанолі (150 мл). Додавали K2СО3 (9,8 г, 71,6 ммоль). Суміш перемішували при 15С протягом 2 год. рН доводили до 4 додаванням 1н HCl. Суміш екстрагували CH 2Cl2 (200 мл). Органічний шар промивали насиченим розчином солі і сушили над Na 2SO4. Розчинник видаляли у вакуумі. Залишок очищали колонковою хроматографією (елюент: петролейний ефір/етилацетат=1:3), отримуючи проміжну сполуку 18-6 (3,63 г, 35% від 18-3) у вигляді порошку білого кольору. Стадія 6: Синтез етил 2-((1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)-іл)метил)-1ізопентил-1Н-індол-3-карбоксилата 18 22 UA 109792 C2 5 10 15 20 25 Для синтезу сполуки 18 використовували ту ж саму методику, що і для отримання сполуки + 12. m/z=447 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d) δ м.д. 0,89 (д, J=6,6 Гц, 6H), 1,00-1,09 (м, 2Н), 1,10-1,24 (м, 4Н), 1,51 (т, J=7,1 Гц, 3Н), 1,57-1,73 (м, 1Н), 2,85-2,97 (м, 1Н), 4,16-4,29 (м, 2Н), 4,51 (кв, J=7,3 Гц, 2Н), 5,88 (с, 2Н), 7,12 (д, J=5,1 Гц, 1Н), 7,21-7,32 (м, 3Н), 8,16-8,23 (м, 1Н), 8,27 (д, J=5,1 Гц, 1Н), 8,32 (с, 1Н). Приклад 11 Синтез 2-((1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)-іл)метил)-1-ізопентил-1Ніндол-3-карбонової кислоти 17 Сполуку 18 (0,5 г, 1 ммоль) розчиняли в ТГФ (25 мл), додавали гідроксид літію (48 мг, 2 ммоль), розчинений у воді (5 мл). Отриману суміш перемішували при 60С протягом ночі. Реакційну суміш залишали остигати до кімнатної температури, потім виливали у воду. рН отриманої суміші доводили до рН=4, додаючи 1 М розчин хлористоводневої кислоти. Після цього суміш екстрагували етилацетатом. Органічний шар сушили над MgSO4 і концентрували. Залишок очищали колонковою хроматографією з використанням хлористого метилену і метанолу. Вказану в заголовку сполуку 17 (400 мг, 94%) виділяли у вигляді порошку білого + кольору. m/z=419 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,82 (д, J=6,6 Гц, 6H), 0,88-0,95 (м, 2H), 0,97-1,14 (м, 4H), 1,49-1,64 (м, 1H), 2,96 (м, 1H), 4,21 (м, 2H), 5,77 (с, 2H), 7,19-7,31 (м, 3H), 7,45 (д, J=7,7 Гц, 1H), 8,08-8,14 (м, 1H), 8,16 (с, 1H), 8,21 (д, J=5,1 Гц, 1H), 12,39-12,47 (м, 1H). Приклад 12 Синтез 2-((1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)-іл)метил)-1-ізопентил-1Ніндол-3-карбоксаміда 14 30 35 До сполуки 17 (150 мг, 0,36 ммоль) у сухому ацетонітрилі (20 мл) додавали карбонілдіімідазол (CDI) (145 мг, 0,9 ммоль). Отриману суміш перемішували при 50С в атмосфері азоту протягом ночі. Після отримання проміжної сполуки, що утворилась між кислотою і CDI, реакційну суміш залишали остигати до кімнатної температури. Після цього 23 UA 109792 C2 5 10 15 20 25 30 35 додавали розчин аміаку у воді (448 мг, 3,5 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 2 годин. Осад фільтрували, потім послідовно промивали водою і ацетонітрилом. Отриману тверду речовину сушили в печі, отримуючи сполуку 14 (150 мг, 94%) у + вигляді твердої речовини білого кольору. m/z=418 (М+Н) . 1 Н ЯМР (400 Мгц, хлороформ-d) δ м.д. 0,88 (д, J=6,6 Гц, 6H), 0,99-1,07 (м, 2H), 1,11-1,22 (м, 3H), 1,55-1,71 (м, 4H), 2,86-2,94 (м, 1H), 4,16-4,25 (м, 2H), 5,82 (с, 2H), 7,12 (д, J=5,1 Гц, 1H), 7,24-7,27 (м, 1H), 7,28-7,34 (м, 2H), 7,80-7,86 (м, 1H), 8,28 (д, J=5,1 Гц, 1H), 8,45 (с, 1H). Приклад 13 Синтез 2-((1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)-іл)метил)-1-ізопентил-N(метилсульфоніл)-1Н-індол-3-карбоксаміда 19 До сполуки 17 (200 мг, 0,47 ммоль) у сухому ацетонітрилі (20 мл) додавали карбонілдіімідазол (CDI) (170 мг, 1,05 ммоль). Отриману суміш перемішували при 50С в атмосфері азоту протягом ночі. Після отримання проміжної сполуки, що утворилась між кислотою і CDI, реакційну суміш залишали остигати до кімнатної температури. Після цього до отриманої суміші додавали метансульфонамід (113,6 мг, 1,2 ммоль) і DBU (0,18 мг, 1,2 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 5 годин, потім при 50С протягом 2 годин. Реакційну суміш залишали остигати до кімнатної температури. Після цього додавали оцтову кислоту (3 ммоль). Отриману суміш концентрували, потім залишок розчиняли в етилацетаті і промивали водою. Органічний шар сушили над MgSO 4 і концентрували. Залишок очищали колонковою хроматографією, отримуючи сполуку 19 (120 мг, 50%) у вигляді порошку + білого кольору. m/z=496 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,80 (д, J=6,8 Гц, 6H), 0,87-0,95 (м, 2H), 1,00-1,17 (м, 4H), 1,42-1,57 (м, 1H), 2,93-3,01 (м, 1H), 3,36 (с, 3H), 4,14-4,26 (м, 2H), 5,59 (с, 2H), 7,22-7,30 (м, 2H), 7,33 (д, J=5,5 Гц, 1H), 7,47 (д, J=8,0 Гц, 1H), 7,89 (д, J=7,5 Гц, 1H), 8,26 (д, J=5,3 Гц, 1H), 8,30 (с, 1H). Приклад 14 Синтез 5-хлор-2-((1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2Н)-іл)метил)-1-(4фторбутил)-1Н-індол-3-карбоксаміда Р54 Стадія 1: синтез метил 5-хлор-1-(4-фторбутил)-2-(гідроксиметил)-1Н-індол-3-карбоксилата 54-1 24 UA 109792 C2 5 10 15 20 25 30 Метил 5-хлор-1-(4-фторбутил)-2-(гідроксиметил)-1Н-індол-3-карбоксилат 54-1 синтезували за методикою, що використовувалась для синтезу 18-6 (тобто стадії 3-5), виходячи з метил 5хлор-2-метил-1Н-індол-3-карбоксилата (отриманого, як описано в Angew. Chem. 2008, 47, 72307233) замість 18-2, і 1-бром-4-фторбутана замість 1-бром-3-метилбутана. Необхідний продукт Р54 синтезували, слідуючи стадіям, описаним для синтезу Р14, + виходячи з 54-1 замість 18-6. m/z=456 (М+Н) . 1 Н ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,82-0,94 (м, 2H) 1,01-1,11 (м, 2H), 1,20-1,33 (м, 2H), 1,481,64 (м, 2H), 2,92-3,01 (м, 1H), 4,26 (с, 3H), 4,39 (т, J=6,00 Гц, 1H), 5,63 (с, 2H), 7,23-7,28 (м, 2H), 7,57 (д, J=8,78 Гц, 1H), 7,86 (д, J=2,01 Гц, 1H), 8,21 (д, J=5,27 Гц, 1H), 8,39 (с, 1H). Приклад 15 Характеристика сполук 1-19 і Р20-Р81 і перевірка на інгібуючу активність відносно RSV наведені в таблицях 1-3. Приклад 16 Похідні Р82-Р105 отримані згідно з описаними вище способами, або в комбінації з методами, які відомі в даній області (таблиця 4). Загальні подробиці експерименту Аналіз методом ВЕРХ-МС проводили з використанням будь-якого з наступних способів: Спосіб 1: Вимір методом ВЕРХ проводили з використанням модуля Agilent 1100, що включає насос, детектор на діодній матриці (DAD) (використана довжина хвилі 220 нм), нагрівач колонок і колонку, описану далі. Потік з колонки розділяли на Agilent MSD серії G1946С і G1956А. На МС детектор встановлювали інтерфейс API-ES (іонізація при атмосферному тиску типа електроспрей). Мас-спектри отримували шляхом сканування від 100 до 1000. Напруга на капілярній голці складала 2500 В у режимі позитивної іонізації і 3000 В у режимі негативної іонізації. Напруга фрагментації складала 50 В. Температуру осушуючого газу підтримували при 350 °C при потоці 10 л/хв. ВЕРХ з оберненою фазою здійснювали на YMC-Pack ODS-AQ колонці 50х2,0 мм 5 мм при швидкості потоку 0,8 мл/хв. Використовували дві рухомі фази (рухома фаза 25 UA 109792 C2 5 10 15 20 25 30 35 40 45 50 55 А: вода з 0,1% ТФУ; рухома фаза В: ацетонітрил з 0,05% ТФУ). Спочатку витримували 100% А протягом 1 хвилини. Потім застосовували градієнт до 40% А і 60% В протягом 4 хвилин і витримували протягом 2,5 хвилин. Використовували звичайні об'єми ін'єкцій, рівні 2 мл. Температура печі складала 50 °C. (ПолярністьМС: позитивна). Спосіб 2: Вимір методом ВЕРХ проводили з використанням модуля Agilent 1100, що включає насос, детектор на діодній матриці (DAD) (використана довжина хвилі 220 нм), нагрівач колонок і колонку, описану далі. Потік з колонки розділяли на Agilent MSD серії G1946С і G1956А. На МС детектор встановлювали інтерфейс API-ES (іонізація при атмосферному тиску типа електроспрей). Мас-спектри отримували шляхом сканування від 100 до 1000. Напруга на капілярній голці складала 2500 В у режимі позитивної іонізації і 3000 В у режимі негативної іонізації. Напруга фрагментації складала 50 В. Температуру осушуючого газу підтримували при 350 °C при потоці 10 л/хв. ВЕРХ з оберненою фазою здійснювали на YMC-Pack ODS-AQ колонці 50х2,0 мм 5 мм при швидкості потоку 0,8 мл/хв. Використовували дві рухомі фази (рухома фаза А: вода з 0,1% ТФУ; рухома фаза В: ацетонітрил з 0,05% ТФУ). Спочатку витримували 90% А і 10% В протягом 0,8 хвилин. Потім застосовували градієнт до 20% А і 80% В протягом 3,7 хвилини і витримували протягом 3 хвилин. Використовували звичайні об'єми ін'єкцій, рівні 2 мл. Температура печі складала 50 °C. (Полярність МС: позитивна). Спосіб 3: Колонка: XTerra MS C18 2,5 мкм, 4,6×50 мм, рухома фаза А: 10 мМ NH4OOCH + 0,1% НСООН в Н2О, рухома фаза В: МеОН при роботі при температурі колонки 50С з використанням швидкості потоку 1,5 мл/хв. Умови градієнта: t=0 хв.: 65% А, 35% В; t=3,5 хв.: 5% А, 95% В; t=5,5 хв.: 5% А, 95% В; t=5,6 хв: 65% А, 35% В; t=7 хв.: 65% А, 35% В. Спосіб 4: Колонка: SunFire C18 3,5 мкм, 4,6×100 мм, рухома фаза А: 10 мМ NH 4OOCH + 0,1% НСООН в Н2О, рухома фаза В: МЕОН при роботі при температурі колонки 50С з використанням швидкості потоку 1,5 мл/хв. Умови градієнта: t=0 хв.: 65% А, 35% В; t=7 хв.: 5% А, 95% В; t=9,6 хв.: 5% А, 95% В; t=9,8 хв.: 65% А, 35% В; t=12 хв.: 65% А, 35% В. Спектри ЯМР реєстрували на спектрометрі Bruker Avance 400, що працює при частоті 400 1 . МГЦ у разі Н Хімічні зрушення наведені в м.д., а значення J у Гц. Мультиплетність вказана з використанням наступних скорочень: д - у разі дублета, т - у разі триплета, м - у разі мультиплета і так далі. Тонкошарову хроматографію (ТШХ) здійснювали на алюмінієвих пластинках 5×10 см, вкритих силікагелем 60 F254 (Merck KGaA). Противірусна активність Чорні 96-лункові мікротитрувальні планшети (Corning, Амстердам, Нідерланди) заповнювали в двох екземплярах з використанням замовленої роботизованої системи з серійними 4-кратними розбавленнями сполуки в кінцевому об'ємі 50 мкл живильного середовища [середовище RPMI без фенолового червоного, 10% FBS, 0,04% гентаміцина (50 4 мг/мл) і 0,5% ДМСО]. Потім у кожну лунку додавали 100 мкл суспензії клітин HeLa (5×10 клітин/мл) у живильному середовищі, після чого додавали 50 мкл вірусу rgRSV224 (MOI=0,02) у живильному середовищі за допомогою дозатора-диспенсера Multidrop (Thermo Scientific, Ерембодегем, Бельгія). Вірусом rgRSV224 є штучно створений вірус, що включає додатковий ген GFP (Hallak et al, 2000) і ліцензований від NIH (Bethesda, MD, США). У кожний тест включали холості досліди з середовищем, вірус- і mock-інфікуванням. Клітини інкубували при 37С в атмосфері 5% СO2. Через три дні після піддавання дії вірусу проводили кількісну оцінку реплікації вірусу, визначаючи експресію GFS у клітинах за допомогою лазерного мікроскопа MSM (Tibotec, Берсе, Бельгія). ЕС50 визначали як 50% інгібуючу концентрацію відносно експресії GFP. Паралельно з цим, сполуки інкубували протягом трьох днів у наборі білих 96-лункових мікротитрувальних планшетів (Corning) і визначали цитотоксичність сполук у клітках HeLa, визначаючи вміст АТФ даних кліток за допомогою набору реактивів ATPlite (Perkin Elmer, Завентем, Бельгія) відповідно до інструкцій виробника. СС 50 визначали як 50% концентрацію для цитотоксичності. Посилання Hallak L.K, Spillmann D, Collins P.L, Peeples M.E. Glycosaminoglycan sulfation requirements for respiratory syncytial virus infection. J. Virol. 740, 10508-10513 (2000). 26 UA 109792 C2 Таблиця 1 Х-R5 Активність WT EC50 (мкМ) Токсичність СС50 (мкМ) Cl N 0,000286 >9,83603 2 Br N 0,000288 >9,83603 3 Br N 0,000452 >9,83603 4 Br N 0,001117 48,65192 5 Br N 0,001564 >9,83603 6 Br C-F 0,001605 >9,83603 7 Cl N 0,00224 47,59376 8 Cl C-F 0,003785 >9,83603 № R1 1 R3 R4 27 UA 109792 C2 Таблиця 1 Х-R5 Активність WT EC50 (мкМ) Токсичність СС50 (мкМ) F N 0,029368 50,28633 10 OMe N 0,038288 >9,83603 12 H N 0,360637 65,47266 № R1 9 R3 R4 Таблиця 2 Х-R5 Активність WT EC50 (мкМ) Токсичність СС50 (мкМ) CONH2 N 0,004507 >24,5901 Cl I N 0,076685 >9,83603 16 Cl H N 0,123894 >9,83603 17 H CO2H N 0,159012 >98,3603 № R1 R2 14 H 15 R3 R4 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIndoles as respiratory syncytial virus antiviral agents
Автори англійськоюCooymans, Ludwig Paul, Demin, Samuel Dominique, Hu, Lili, Jonckers, Tim Hugo Maria, Raboisson, Pierre Jean-Marie Bernard, Tahri, Abdellah, Vendeville, Sandrine Marie Helene
Автори російськоюКойманс Людвиг Поль, Демин Самуель Доминик, Ху Лили, Йонкерс Тим Хьюго Мария, Рабуассон Пьер Жан-Мари Бернар, Тахри Абделла, Вендевиль Сандрин Мари Елен
МПК / Мітки
МПК: C07D 403/06, C07D 471/04, A61P 31/12, A61K 31/437
Мітки: вірусу, противірусні, індоли, синтиціального, агенти, респіраторного, відносної
Код посилання
<a href="https://ua.patents.su/51-109792-indoli-yak-protivirusni-agenti-vidnosno-respiratornogo-sinticialnogo-virusu.html" target="_blank" rel="follow" title="База патентів України">Індоли як противірусні агенти відносно респіраторного синтиціального вірусу</a>
Попередній патент: Пристрій і спосіб для оснащення регулюючого пристрою для регулювання тиску газу в камері коксової печі без викликаних розширенням відхилень від контрольного розміщення
Наступний патент: Арилсульфонаміди для лікування захворювань центральної нервової системи (цнс)
Випадковий патент: Пристрій тестування пристроїв захисного відключення і нульових захисних провідників












