Сполуки,які містять біциклічне конденсоване ядро, спосіб їх одержання, проміжні сполуки, спосіб їх одержання (варіанти) та фармацевтична композиція для інгібування перетворення ферменту ангіотензину та нейтраль
Номер патенту: 39924
Опубліковано: 16.07.2001
Автори: Кронентал Девід Р., Годфрей Джоллі Д., Робл Джефрі А.
Формула / Реферат
1. Соединения, содержащие конденсированное бициклическое ядро формулы
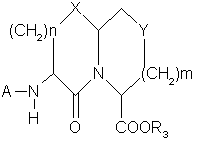 ,
,
или их фармацевтически приемлемая соль, где А представляет
или
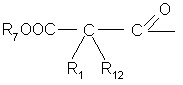 ,
,
Χ представляет О или S,
r1 и R12 независимо выбраны из группы, состоящей из водорода, C1-C5-алкила с прямой или разветвленной цепью, фенил-(низшего)алкилена, нафтил-(низшего)алкилена, С3-С7-циклоалкил-(низшего)алкилена, тиенил-(низшего)алкилена, или R1 и R12 взятые вместе с атомом углерода, к которому они присоединяются, замыкают С5-С6-циклоалкильное кольцо,
R2 представляет водород или ![]() ,
,
R3 и R12 независимо выбраны из группы, состоящей из водорода или низшего алкила,
R6 представляет низший алкил,
m равно 0 или 1,
Υ представляет СН2 или О, при условии, что Y представляет О только если m равно 1,
n равно 1 или 2,
r равно 0 или 1.
2. Соединение по п. 1, имеющее формулу
 ,
,
где А представляет
 ,
,
r2 представляет водород или ![]() ,
,
R3 представляет водород или низший алкил с 1-4 атомами углерода,
r равно 0 или 1,
r1 - С1-С5-алкил с прямой или разветвленной цепью, фенил-(СН2)-, нафтил-(CH2)-, тиенил- (CH2)-, (С3-С7)-циклоалкил-(СН2)-,
R12 - водород или R1 и R12 взятые вместе с атомом углерода, к которому они присоединяются, замыкают С5-С6-циклоалкильное кольцо,
R6 представляет низший алкил с 1 - 4 атомами углерода,
n равно 1 или 2,
m равно 0 или 1,
Χ представляет О или S,
Y представляет О или CH2 при условии, что Υ представляет О только если m равно 1.
3. Соединение по п.2, где R2 представляет водород или 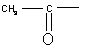 , R3 представляет водород, r равно 0 или 1, R1 – C1-C5- алкил с прямой или разветвленной цепью, R12 представляет водород, n равно 1 или 2, m равно 0 или 1, Χ представляет О или S, Υ представляет О или СН2 при условии, что Υ представляет О только если m равно 1.
, R3 представляет водород, r равно 0 или 1, R1 – C1-C5- алкил с прямой или разветвленной цепью, R12 представляет водород, n равно 1 или 2, m равно 0 или 1, Χ представляет О или S, Υ представляет О или СН2 при условии, что Υ представляет О только если m равно 1.
4. Соединение по п.2, где Χ представляет S, Υ представляет CH2, n равно 2, m равно 1, r равно 0 или 1, R2 представляет водород, R1 представляет бензил или изобутил и r12 представляет водород или Χ представляет S, Υ представляет СН2, n равно 1, m равно 1, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород или Χ представляет S, Υ представляет СН2, n равно 2, m равно 0, r равно 0, R2 представляет водород, R1 представляет бензил, циклопропилметил, н-бутил, изобутил, н-пропил или СН2С(СН3)3, и R12 представляет водород или Χ представляет О, Υ представляет CH2, n равно 2, m равно 1, r равно 0, r2 представляет водород, R1 представляет бензил, R12 представляет водород или Χ представляет О, Υ представляет СН2, n равно 2, m равно 0, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород или Χ представляет О, Υ представляет О, n равно 2, m равно 1, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород или Χ представляет S, Υ представляет О, n равно 2, m равно 1, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород.
5. Соединение по п.4, которое представляет собой (4S-[4α(R*),7α,10αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2,1-b][1,3]-тиазепин-7-карбоновую кислоту;
1,1-диметилэтиламиновую соль [4S-[4α(R*),7α,10αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2,1-b][1,3] тиазепин-7-карбоновoй кислоты;
[4S-[4α(S*),7α,10αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2,1-b][1,3]-тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,10αβ]]-октагидро-4-[(2-меркаптометил-1-оксо-3-фенилпропил) амино]-5-оксо-7Н-пиридо [2,1-b][1,3] -тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,10αβ]]-октагидро-4-[(2-меркапто-4-метил-1-оксопентил)амино]-5-оксо-7Н-пиридо[2,1-b][1,3]тиазепин-7-карбоновую кислоту;
[3R-[3α(S*),6α,9αβ]]-гексагидро-3-[(2-меркапто-1-оксо-3-фенилпропил)амино]-4-оксо-2Н,6Н-пиридо[2,1-b][1,3]тиазепин-6-карбоновую кислоту;
[4S-[4α(R*),7α,9αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксопирроло[2,1-b][1,3]-тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,9αβ]]-октагидро-4-[(3-циклопропил-2-меркапто-1-оксопропил)амино]-5-оксопирроло[2,1-b][1,3]-тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,9αβ]]-октагидро-4-[(2-меркапто-1-оксогексил)амино]-5-оксопирроло[2,1-b][1,3]-тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,9αβ]]-октагидро-4-[(2-меркапто-1-оксо-4-метилпентил)амино]-5-оксопирроло[2,1-b][1,3]тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,9αβ]]-октагидро-4-[(2-меркапто-1-оксопентил)амино]-5-оксопирроло[2,1-b][1,3]тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,9αβ]]-октагидро-4-[(2-меркапто-4,4-диметил-1-оксопентил)амино]-5-оксопирроло[2,1-b][1,3]тиазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,10αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2,1-b][1,3]-оксазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,9αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксопирроло[2,1-b][1,3]оксазепин-7-карбоновую кислоту;
[4S-[4α(R*),7α,10αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-[1,4]оксазино[3,4-b][1,3]оксазепин-7-карбоновую кислоту, или
[4S-[4α(R*),7α,10αβ]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-[1,4]оксазино[3,4-b][1,3]тиазепин-7-карбоновую кислоту.
6. Соединение по п.1 формулы
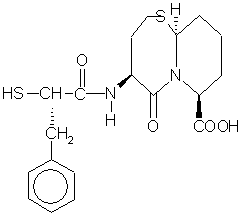
или его фармацевтически приемлемая соль.
7. Фармацевтическая композиция для ингибирования превращения фермента ангиотензина и нейтральной эндопептидазы, отличающаяся тем, что включает фармацевтически приемлемый носитель и эффективное количество одного или более соединений формулы
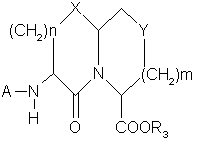
или его фармацевтически приемлемой соли, где А, X, Y, n, m и R3 имеют значения, как они определены по п.1.
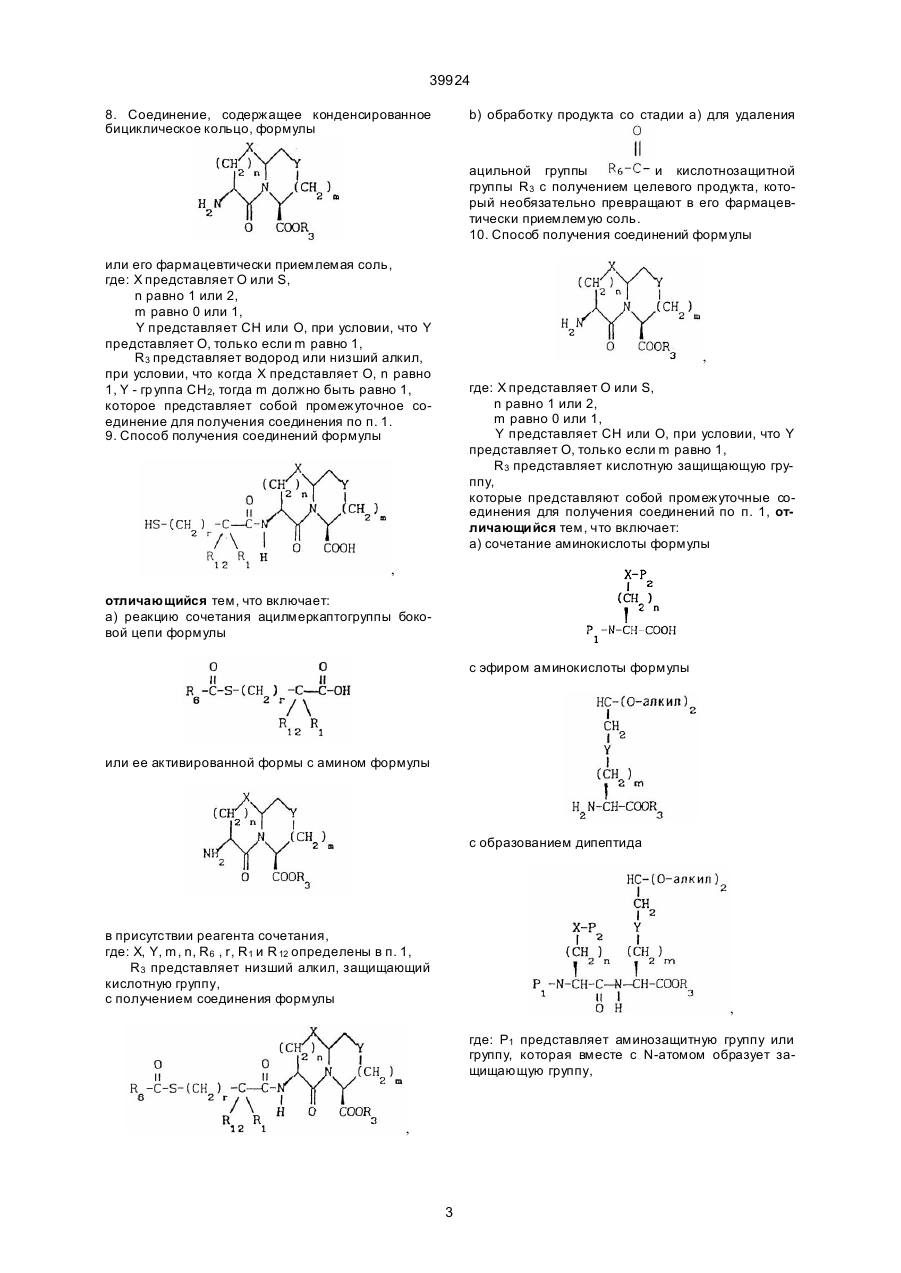
8. Соединение, содержащее конденсированное бициклическое кольцо, формулы
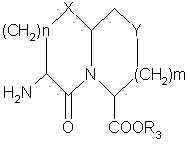
или его фармацевтически приемлемая соль,
где Χ представляет О или S,
n равно 1 или 2,
m равно 0 или 1,
Υ представляет СН или О, при условии, что Υ представляет О, только если m равно 1,
R3 представляет водород или низший алкил,
при условии, что когда Χ представляет О, n равно 1, Υ – группа СН2 , тогда m должно быть равно 1, которое представляет собой промежуточное соединение для получения соединения по п.1.
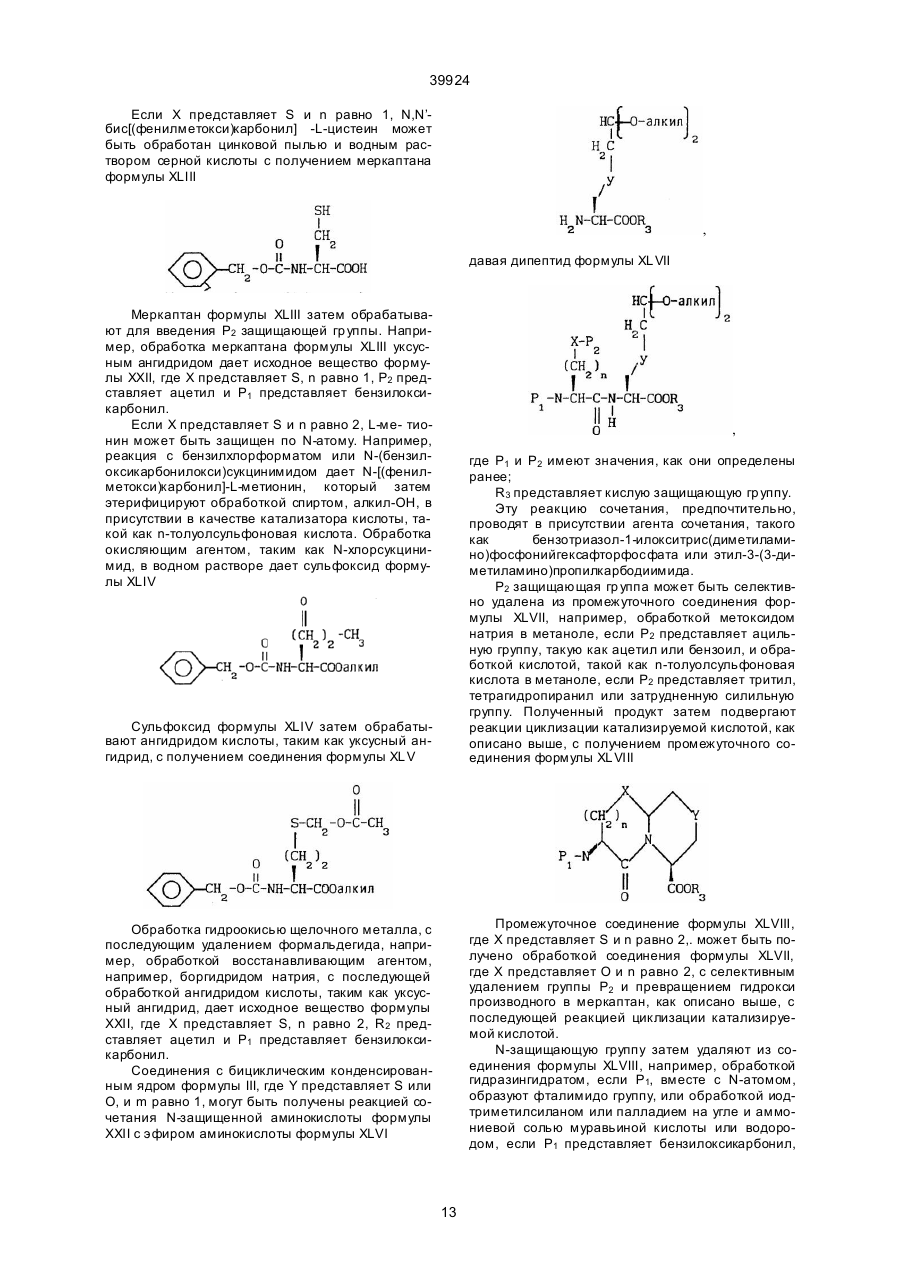
9. Способ получения соединений формулы
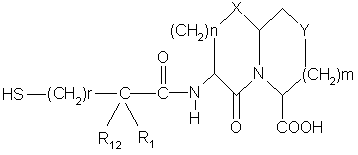 ,
,
отличающийся тем, что включает:
а) реакцию сочетания ацилмеркаптогруппы боковой цепи формулы
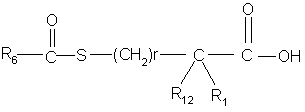
или ее активированной формы с амином формулы
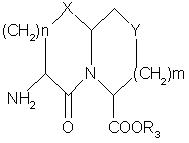 ,
,
в присутствии реагента сочетания,
где Χ, Υ, m, n, R6 , r, R1 и R12 определены в п.1,
R3 представляет низший алкил, защищающий кислотную группу, с получением соединения формулы
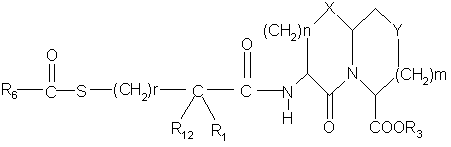 ,
,
b) обработку продукта со стадии а) для удаления ацильной группы ![]() и кислотнозащитной группы r3 с получением целевого продукта, который необязательно превращают в его фармацевтически приемлемую соль.
и кислотнозащитной группы r3 с получением целевого продукта, который необязательно превращают в его фармацевтически приемлемую соль.
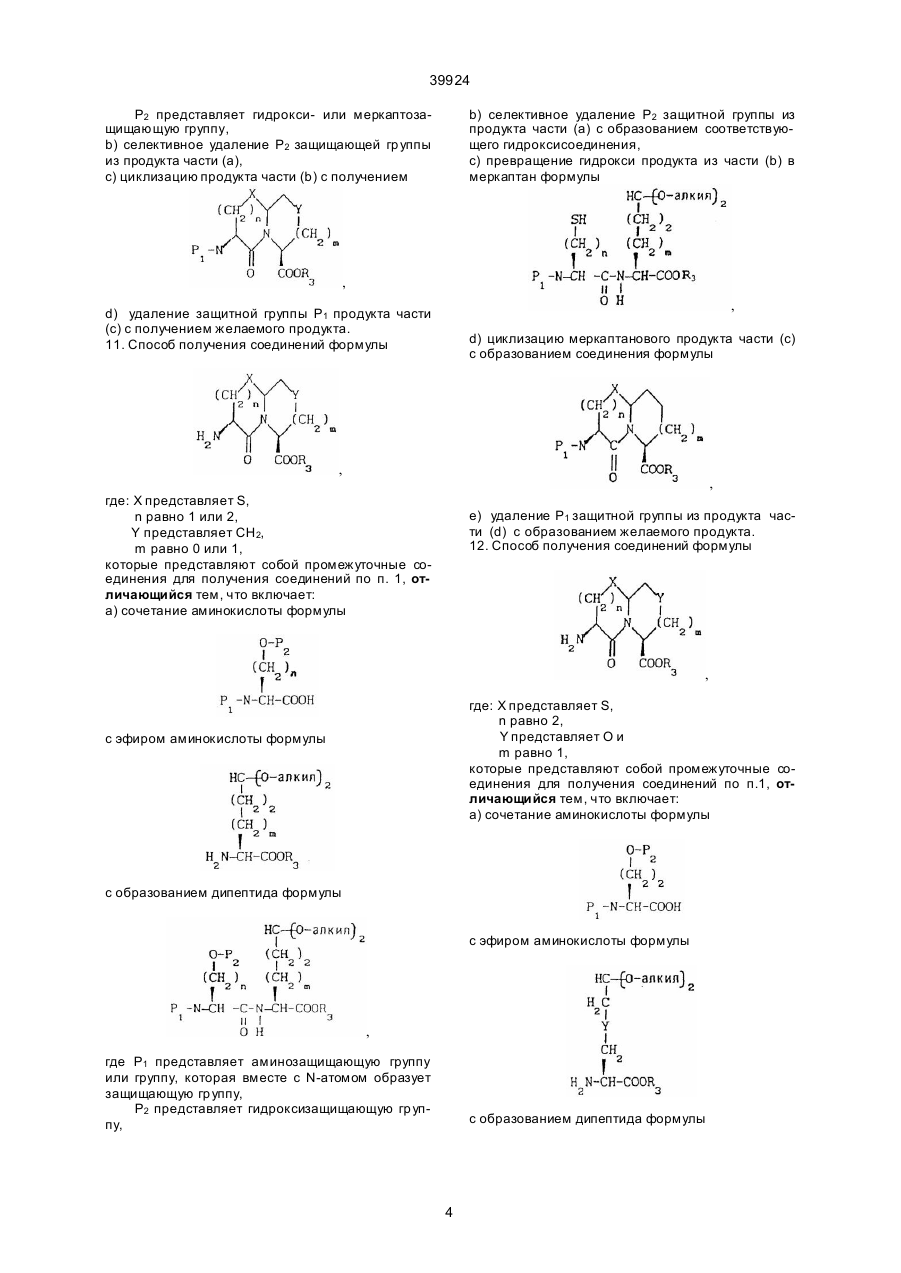
10. Способ получения соединений формулы
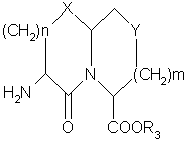 ,
,
где X представляет О или S,
n равно 1 или 2,
m равно 0 или 1,
Υ представляет СН или О, при условии, что Υ представляет О, только если m равно 1,
R3 представляет кислотную защищающую группу,
которые представляют собой промежуточные соединения для получения соединений по п.1,
отличающийся тем, что включает:
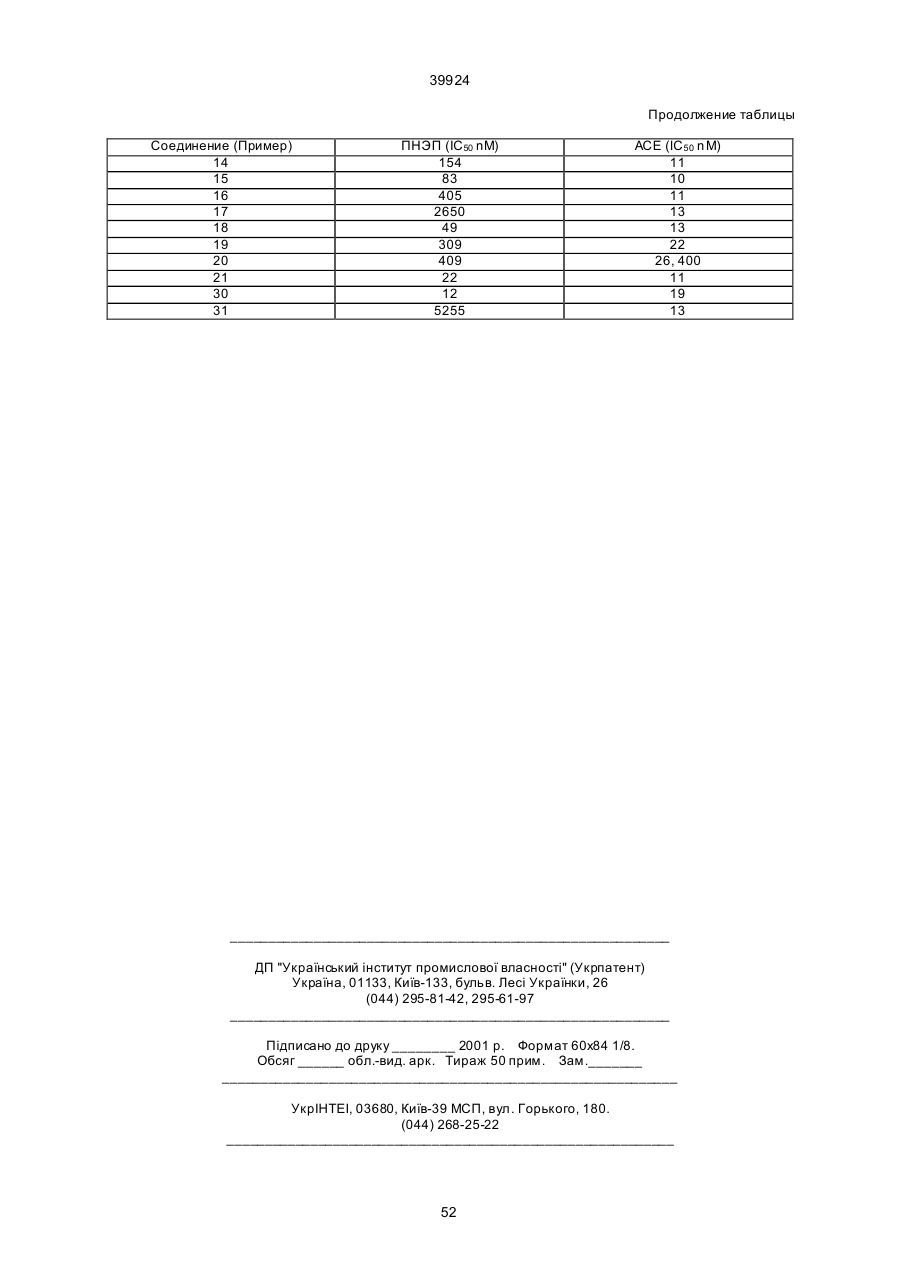
a) сочетание аминокислоты формулы
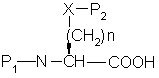
(О-алкил)2
с эфиром аминокислоты формулы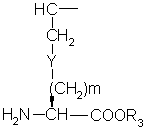
(О-алкил)2
с образованием дипептида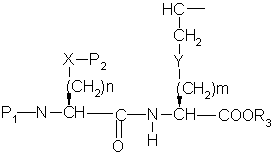 ,
,
где P1 представляет аминозащитную группу или группу, которая вместе с N-атомом образует защищающую группу,
p2 представляет гидрокси- или меркаптозащищающую группу,
b) селективное удаление Р2 защищающей группы из продуктa части (а),
c) циклизацию продукта части (b) с получением
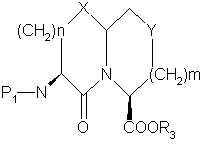 ,
,
d) удаление защитной группы P1 продукта части (с) с получением желаемого продукта.
11. Способ получения соединений формулы
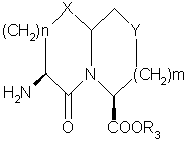 ,
,
где Χ представляет S,
n равно 1 или 2,
Υ представляет CH2,
m равно 0 или 1,
которые представляют собой промежуточные соединения для получения соединений по п.1,
отличающийся тем, что включает:
а) сочетание аминокислоты формулы
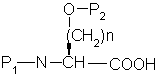
с эфиром аминокислоты формулы
(О-алкил)2
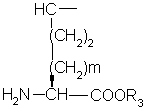
(О-алкил)2
с образованием дипептида формулы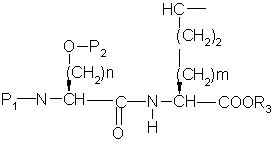 ,
,
где P1 представляет аминозащищающую группу или группу, которая вместе с N-атомом образует защищающую группу,
P2 представляет гидроксизащищающую группу,
b) селективное удаление Р2 защитной группы из продукта части (а) с образованием соответствующего гидроксисоединения,
(О-алкил)2
c) превращение гидрокси продукта из части (b) в меркаптан формулы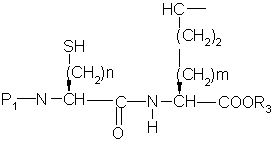 ,
,
d) циклизацию меркаптанового продукта части (с) с образованием соединения формулы
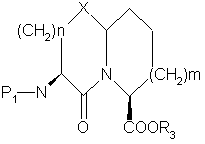 ,
,
е) удаление P1 защитной группы из продукта части (d) с образованием желаемого продукта.
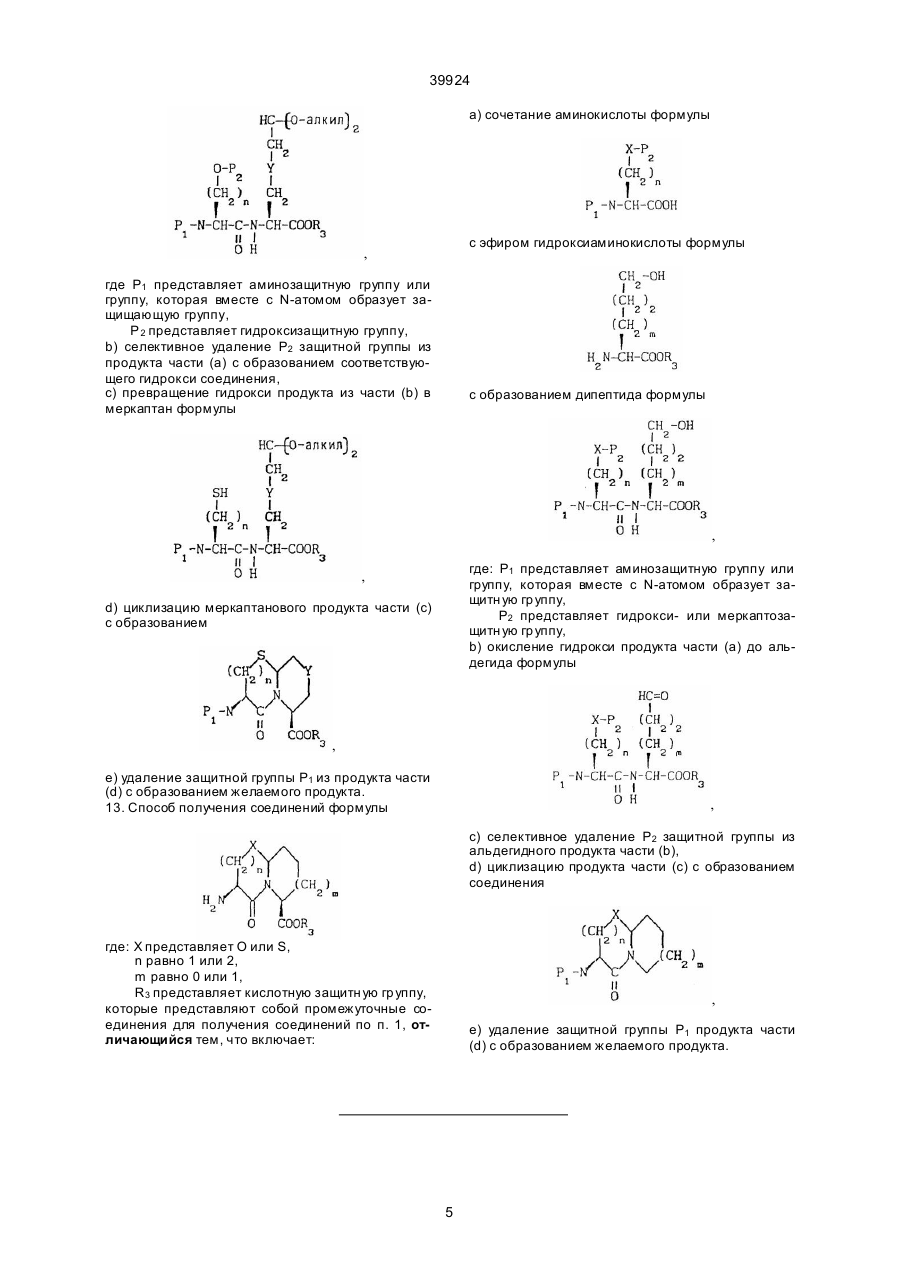
12. Способ получения соединений формулы
 ,
,
где Χ представляет S,
n равно 2,
Y представляет О и
m равно 1,
которые представляют собой промежуточные соединения для получения соединений по п.1,
отличающийся тем, что включает:
а) сочетание аминокислоты формулы
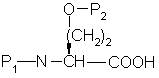
с эфиром аминокислоты формулы
(О-алкил)2
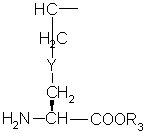 ,
,
(О-алкил)2
с образованием дипептида формулы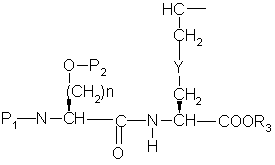 ,
,
где P1 представляет аминозащитную группу или группу, которая вместе с n-атомом образует защищающую группу,
p2 представляет гидроксизащитную группу,
b) селективное удаление Р2 защитной группы из продукта части (а) с образованием соответствующего гидрокси соединения,
(О-алкил)2
c) превращение гидрокси продукта из части (b) в меркаптан формулы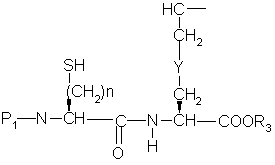 ,
,
d) циклизацию меркаптанового продукта части (с) с образованием
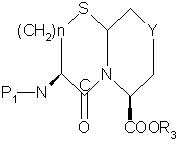 ,
,
е) удаление защитной группы P1 из продукта части (d) с образованием желаемого продукта.
13. Способ получения соединений формулы
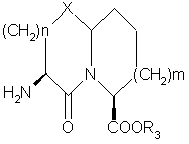 ,
,
где X представляет О или S,
n равно 1 или 2,
m равно 0 или 1,
R3 представляет кислотную защитную группу,
которые представляют собой промежуточные соединения для получения соединений по п.1,
отличающийся тем, что включает:
a) сочетание аминокислоты формулы
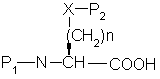
с эфиром гидроксиаминокислоты формулы
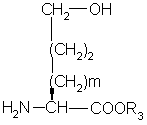
с образованием дипептида формулы
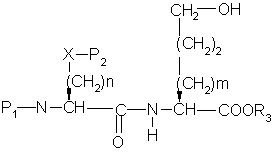 ,
,
где P1 представляет аминозащитную группу или группу, которая вместе с N-атомом образует защитную группу,
р2 представляет гидрокси или меркаптозащитную группу,
b) окисление гидрокси продукта части (а) до альдегида формулы
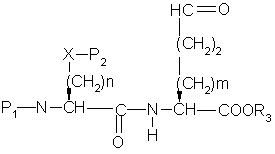 ,
,
с) селективное удаление Р2 защитной группы из альдегидного продукта части (b),
d) циклизацию продукта части (с) с образованием соединения
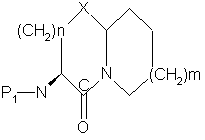 ,
,
e) удаление защитной группы P1 продукта части (d) с образованием желаемого продукта.
Текст
1. Соединения, содержащие конденсированное бициклическое ядро формулы , или , X представляет О или S, R1 и R12 независимо выбраны из группы, состоящей из водорода, C1-C5-алкила с прямой или разветвленной цепью, фенил-(низшего)алкилена, R2 представляет водород или , R3 представляет водород или низший алкил с 1-4 атомами углерода, r равно 0 или 1, R1 - С1-С5-алкил с прямой или разветвленной цепью, фенил-(СН2)-, нафтил-(CH2)-, тиенил(CH2)-, (С3-С7)-циклоалкил-(СН2)-, R12 - водород или R1 и R12, взятые вместе с атомом углерода, к которому они присоединяются, замыкают С5-С6-циклоалкильное кольцо, UA или их фармацевтически приемлемая соль, где А представляет (19) где А представляет (11) 39924 , 39924 R6 представляет низший алкил с 1-4 атомами углерода, n равно 1 или 2, m равно 0 или 1, X представляет О или S, Y представляет О или CH2 при условии, что Y представляет О, только если m равно 1. 3. Соединение по п. 2, где R 2 представляет водо [4S-[4a(R*),7a,9ab]]-октагидро-4-[(2-меркапто1-оксо-3-фенилпропил)амино]-5-оксопирроло[2, 1-b] [1,3]-тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,9ab]]-октагидро-4-[(3-циклопропил-2-меркапто-1-оксопропил)амино]-5-оксопирроло[2,1-b] [1,3]-тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,9ab]]-октагидро-4-[(2-меркапто1-оксогексил)амино]-5-оксопирроло[2,1-b] [1,3]-тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,9ab]]-октагидро-4-[(2-меркапто1-оксо-4-метилпентил)амино]-5-оксопирроло[2, 1-b] [1,3]тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,9ab]]-октагидро-4-[(2-меркапто1-оксопентил)амино]-5-оксопирроло[2,1-b] [1,3]тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,9ab]]-октагидро-4-[(2-меркапто4,4-диметил-1-оксопентил)амино]-5-оксопирроло[2,1-b] [1,3]тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,10ab]]-октагидро-4-[(2-меркапто1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2, 1-b] [1,3]-оксазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,9ab]]-октагидро-4-[(2-меркапто1-оксо-3-фенилпропил)амино]-5-оксопирроло[2, 1-b] [1,3]оксазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,10ab]]-октагидро-4-[(2-меркапто1-оксо-3-фенилпропил)амино]-5-оксо-[1,4]оксазино[3,4-b] [1,3]оксазепин-7-карбоновую кислоту или [4S-[4a(R*),7a,10ab]]-октагидро-4-[(2-меркапто1-оксо-3-фенилпропил)амино]-5-оксо-[1,4]оксазино[3,4-b] [1,3]тиазепин-7-карбоновую кислоту. 6. Соединение по п.1 формулы род или, , R3 представляет водород, r равно 0 или 1, R1 - C1-C5-алкил с прямой или разветвленной цепью, R12 представляет водород, n равно 1 или 2, m равно 0 или 1, X представляет О или S, Y представляет О или СН2 при условии, что Y представляет О, только если m равно 1. 4. Соединение по п. 2, где X представляет S, Y представляет CH2, n равно 2, m равно 1, r равно 0 или 1, R2 представляет водород, R1 представляет бензил или изобутил и R12 представляет водород или X представляет S, Y представляет СН 2, n равно 1, m равно 1, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород или X представляет S, Y представляет СН2, n равно 2, m равно 0, r равно 0, R2 представляет водород, R1 представляет бензил, циклопропилметил, н-бутил, изобутил, н-пропил или СН2С(СН3)3, и R12 представляет водород или X представляет О, Y представляет CH2, n равно 2, m равно 1, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород или X представляет О, Y представляет СН2, n равно 2, m равно 0, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород или X представляет О, Y представляет О, n равно 2, m равно 1, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород или X представляет S, Y представляет О, n равно 2, m равно 1, r равно 0, R2 представляет водород, R1 представляет бензил, R12 представляет водород. 5. Соединение по п. 4, которое представляет собой [4S-[4a(R*),7a,10ab]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2,1-b] [1,3]-тиазепин-7-карбоновую кислоту; 1,1-диметилэтиламиновую соль [4S-[4a(R*),7a, 10ab]]-октагидро-4-[(2-меркапто-1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2,1-b] [1,3]тиазепин-7-карбоновoй кислоты; [4S-[4a(S*),7a,10ab]]-октагидро-4-[(2-меркапто1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо[2, 1-b] [1,3]-тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,10ab]]-октагидро-4-[(2-меркаптометил-1-оксо-3-фенилпропил)амино]-5-оксо-7Н-пиридо [2,1-b] [1,3] -тиазепин-7-карбоновую кислоту; [4S-[4a(R*),7a,10ab]]-октагидро-4-[(2-меркапто4-метил-1-оксопентил)амино]-5-оксо-7Н-пиридо[2, 1-b] [1,3]тиазепин-7-карбоновую кислоту; [3R-[3a(S*),6a,9ab]]-гексагидро-3-[(2-меркапто1-оксо-3-фенилпропил)амино]-4-оксо-2Н,6Н-пиридо[2,1-b] [1,3]тиазепин-6-карбоновую кислоту; или его фармацевтически приемлемая соль. 7. Фармацевтическая композиция для ингибирования превращения фермента ангиотензина и нейтральной эндопептидазы, отличающаяся тем, что включает фармацевтически приемлемый носитель и эффективное количество одного или более соединений формулы или его фармацевтически приемлемой соли, где А, X, Y, n, m и R3 имеют значения, как они определены по п.1. 2 39924 8. Соединение, содержащее конденсированное бициклическое кольцо, формулы b) обработку продукта со стадии а) для удаления ацильной группы и кислотнозащитной группы R3 с получением целевого продукта, который необязательно превращают в его фармацевтически приемлемую соль. 10. Способ получения соединений формулы или его фармацевтически приемлемая соль, где: X представляет О или S, n равно 1 или 2, m равно 0 или 1, Y представляет СН или О, при условии, что Y представляет О, только если m равно 1, R3 представляет водород или низший алкил, при условии, что когда X представляет О, n равно 1, Y - гр уппа СН 2, тогда m должно быть равно 1, которое представляет собой промежуточное соединение для получения соединения по п. 1. 9. Способ получения соединений формулы , где: X представляет О или S, n равно 1 или 2, m равно 0 или 1, Y представляет СН или О, при условии, что Y представляет О, только если m равно 1, R3 представляет кислотную защищающую группу, которые представляют собой промежуточные соединения для получения соединений по п. 1, отличающийся тем, что включает: a) сочетание аминокислоты формулы , отличающийся тем, что включает: а) реакцию сочетания ацилмеркаптогруппы боковой цепи формулы с эфиром аминокислоты формулы или ее активированной формы с амином формулы с образованием дипептида в присутствии реагента сочетания, где: X, Y, m, n, R 6 , r, R1 и R 12 определены в п. 1, R3 представляет низший алкил, защищающий кислотную группу, с получением соединения формулы , где: P1 представляет аминозащитную группу или группу, которая вместе с N-атомом образует защищающую группу, , 3 39924 P2 представляет гидрокси- или меркаптозащищающую группу, b) селективное удаление Р2 защищающей гр уппы из продуктa части (а), c) циклизацию продукта части (b) с получением b) селективное удаление Р2 защитной группы из продукта части (а) с образованием соответствующего гидроксисоединения, c) превращение гидрокси продукта из части (b) в меркаптан формулы , , d) удаление защитной группы P1 продукта части (с) с получением желаемого продукта. 11. Способ получения соединений формулы d) циклизацию меркаптанового продукта части (с) с образованием соединения формулы , , где: X представляет S, n равно 1 или 2, Y представляет CH2, m равно 0 или 1, которые представляют собой промежуточные соединения для получения соединений по п. 1, отличающийся тем, что включает: а) сочетание аминокислоты формулы е) удаление P1 защитной группы из продукта части (d) с образованием желаемого продукта. 12. Способ получения соединений формулы , где: X представляет S, n равно 2, Y представляет О и m равно 1, которые представляют собой промежуточные соединения для получения соединений по п.1, отличающийся тем, что включает: а) сочетание аминокислоты формулы с эфиром аминокислоты формулы с образованием дипептида формулы с эфиром аминокислоты формулы , где P1 представляет аминозащищающую группу или группу, которая вместе с N-атомом образует защищающую гр уппу, P2 представляет гидроксизащищающую гр уппу, с образованием дипептида формулы 4 39924 a) сочетание аминокислоты формулы с эфиром гидроксиаминокислоты формулы , где P1 представляет аминозащитную группу или группу, которая вместе с N-атомом образует защищающую группу, P 2 представляет гидроксизащитную группу, b) селективное удаление Р2 защитной группы из продукта части (а) с образованием соответствующего гидрокси соединения, c) превращение гидрокси продукта из части (b) в меркаптан формулы с образованием дипептида формулы , где: P1 представляет аминозащитную группу или группу, которая вместе с N-атомом образует защитн ую гр уппу, Р2 представляет гидрокси- или меркаптозащитн ую гр уппу, b) окисление гидрокси продукта части (а) до альдегида формулы , d) циклизацию меркаптанового продукта части (с) с образованием , е) удаление защитной группы P1 из продукта части (d) с образованием желаемого продукта. 13. Способ получения соединений формулы , с) селективное удаление Р2 защитной группы из альдегидного продукта части (b), d) циклизацию продукта части (с) с образованием соединения где: X представляет О или S, n равно 1 или 2, m равно 0 или 1, R3 представляет кислотную защитн ую гр уппу, которые представляют собой промежуточные соединения для получения соединений по п. 1, отличающийся тем, что включает: , e) удаление защитной группы P1 продукта части (d) с образованием желаемого продукта. 5 39924 Изобретение относится к новым соединениям, содержащим конденсированное бициклическое ядро, которые используются в качестве ангистензина ингибиторов превращения фермента. Некоторые из этих соединений обладают ингибирующей активностью по отношению к нейтральной эндопептидазе. Это изобретение также относится к фармацевтическим композициям, содержащим такие селективные или двойственного действия ингибиторы, и способу использования таких композиций. Это изобретение также относится к способу получения таких новых соединений, новых промежуточных соединений и способам получения таких промежуточных соединений. Новые конденсированные бициклические ингибиторы этого изобретения включают соединения формулы I щенного арила-(СН2)р-, гетероарила-(СН2)р-, и ; R4 представляет алкил, циклоалкил-(СН2)р-, замещенный алкил, арил-(СН2)р-, замещенный арил(СН2)р-, или гетероарил-(СН2)р-; R6 представляет алкил, замещенный алкил, циклоалкил-(СН2)р-, арил-(СН2)р-, замещенный арил-(СН2)р-, или гетероарил-(СН2)р; R8 представляет водород, низший алкил, циклоалкил или фенил; R9 представляет водород, низший алкил, низший алкокси или фенил: R10 представляет низший алкил или арил(СН2)рR11 представляет водород, алкил, замещенный алкил, циклоалкил-(СН2)р-, арил-(СН2)р- замещенный арил-(СН2)р-, гетероарил-(СН2)р- или -S-R11 образует симметричный дисульфид, где R11 представляет и их фармацевтически приемлемые соли, где А представляет m равно 0 или 1; Y представляет CH2, S(О)t или О при условии, что Y представляет S-(O) t или O только если m равно 1; n равно 1 или 2; р равно 0 или целому от 1 до 6; q равно 0 или целому от 1 до 3; r равно 0 или 1 и t равно 0, 1 или 2. Термин "алкил" относится к радикалам с неразветвленной или разветвленной цепью, содержащим вплоть до 7 атомов углерода. Термин "низший алкил" относится к радикалам с неразветвленной или разветвленной цепью, содержащим вплоть до 4 атомов углерода, и является предпочтительной подгруппой для термина алкил. Термин "замещенный алкил" относится к таким радикалам с неразветвленной или разветвленной цепью с 1-7 атомами углерода, где один или более, предпочтительно, один, два или три атома водорода заменены гидрокси, амино, циано, галоид, трифторметильной, -NH(низшей алкильной), -N-(низшей алкильной)2, низшей алкокси, низшей алкилтио или карбокси группой. Термины "низший алкокси" и "низший алкилтио" относятся к таким низшим алкильным группам, которые, как определенные выше, присоединяются к атому кислорода или серы. Термин "циклоалкил" относится к насыщенным кольцам с 3-7 атомами углерода с циклопропилом, циклобутилом, циклопентилом и циклогексилом, являющимся наиболее предпочтительным. , , или ; X представляет 0, или S-(0)t: R1 и R12 независимо выбраны из водорода, алкила, алкенила, циклоалкила, замещенного алкила, замещенного алкенила, арила, замещенного арила, гетероарила. циклоалкилалкилена-, арил-алкилена, замещенного арил-алкилена, и гетероарилалкилена или R1 и R12, взятые вместе с атомом углерода, к которому они присоединяются, образуют циклоалкильное кольцо или конденсированное бензоциклоалкильное кольцо; R6 C O , или R , -S-; R2 представляет водород, 11 R3, R5, и R7 независимо выбраны из водорода, алкила, замещенного алкила, арила-(СН2)р-, заме 6 39924 Термин "алкенил" относится к радикалам с неразветвленной и разветвленной цепью с 3-7 атомами углерода, содержащим одну или две двойных связи. Предпочтительно, "алкенильные" группы представляют радикалы с неразветвленной цепью с 3-5 атомами углерода, содержащими одну двойную связь. Термин "замещенный алкенил" относится к таким радикалам с неразветвленной или разветвленной цепью с 3-7 атомами углерода, содержащим одну или две двойные связи, где водород замещен гидрокси, амино, галоидной, трифторметильной, циано, -NH(низшей алкильной), -N(низшей алкильной)2, низшей алкокси, низшей алкилтио или карбокси группой. Термин "алкилен" относится к радикалам с неразветвленной или разветвленной цепью, содержащим вплоть до 7 атомов углерода, т.е. X представляет O или S, и Y представляет СН 2, О или S. могут быть получены реакцией сочетания соединения с арилмеркапто боковой цепью формулы II с соединением с конденсированным бициклическим кольцом формулы III -СН2-, -(СН2)2-,-(СН2)3-,-(СН2)4-, и т.д. Термин "арил" относится к фенилу, 1-нафтилу и 2-нафтилу. Термин "замещенный арил" относится к фенилу, 1-нафтилу и 2-нафтилу, содержащим заместитель, выбранный из низшего алкила, низшего алкокси, низшего алкилтио, галоида, гидрокси, трифторметила, амино, -NH(низшего алкила) или -N(низшего алкила)2 и ди- или три-замещенного фенила, 1-нафтила или 2-нафтила, где указанные заместители выбраны из метила, метокси, метилтио, галоида, гидрокси и амино. Термин "гетероарил" относится к ненасыщенным кольцам с 5 или 6 атомами углерода, содержащим один или два атома О и S и/или 1-4 атома азота при условии, что общее число гетероатомов в кольце равно 4 или меньше. Гетероарильное кольцо присоединяется с помощью имеющегося атома углерода или атома азота. Предпочтительные гетероарильные группы включают 2-, 3- или 4-пиридил, 4-имидазолил, 4-тиазолил, 2- и 3-тиенил и 2- и 3-фурил. Термин "гетероарил" также включает бициклические кольца, где 5- или 6членное кольцо, содержащее атомы О, S и N, как оно определено выше, представляется конденсированным с бензольным или пиридильным кольцом. Предпочтительные бициклические ядра представляют 2-или 3-индоил и 4- и 5-хинолинил. Моно- или бициклическое гетероарильное кольцо может быть также дополнительно замещено по имеющемуся атому углерода низшим алкилом, галоидом, гидрокси, бензилом или циклогексилметипом. Кроме того, если моно- или бициклическое ядро имеет N-атом, то такой N-атом также может быть замещен N-защищающей гр уппой, такой как с получением продукта формулы IV R3 представляет водород или кислую защищающую группу, такую как метил, этил, т-бутил или бензил. Вышеприведенная реакция может быть проведена в органическом растворителе, таком как метиленхлорид, и в присутствии агента сочетания, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид, дициклогексилкарбодиимид, бензолтриазол-1-илокситрис(диметиламино)-фосфонийгексафтор фосфат или карбонилдиимидазол. Или же ацилмеркаптокарбоновая кислота формулы II может быть превращена в активированную форму до реакции сочетания, такую как хлорид кислоты, смешанный ангидрид, симметричный ангидрид, активированный эфир и т. д. Продукт формулы IV может быть превращен в меркаптановый продукт формулы I, где R2 представляет водород и R3 представляет водород, способом, известным в литературе. Например, если R6 представляет метил и R3 представляет этил, обработка метанольным раствором гидроокиси натрия с последующей обработкой водным раствором кислоты дает продукты, где R2 и R3 представляют водород. Продукт формулы I, где R2 представляет водород, может быть ацилирован ацилгалоидом формулы V , 2,4-динитрофенил, низший алкил, бензил или бензгидрил. Соединения формулы I, где А представляет где галоид представляет F, Cl или Вr, или ацилирован ангидридом формулы VI 7 39924 соединение формулы II, где R1 и R12 - оба водород, и r равно 0. Или же замещенная карбоновая кислота формулы VIII может взаимодействовать с литийдиизопропиламидом и серой, давая меркаптан формулы Х с получением других продуктов формулы I, где R2 представляет Продукты формулы I, где R2 представляет -SR11, и R11 представляет алкил, замещенный алкил, циклоалкил-(СН2)р-, арил-(СН2)р-, замещенный арил-(СН2)р- или гетероарил-(СН2)р-, могут быть получены взаимодействием продуктов формулы I, где R2 представляет водород, с сульфонильным соединением формулы VII Меркаптан формулы X может быть затем ацилирован ацилгалоидом формулы V или ангидридом формулы VI, давая соединение формулы II, где R1, и R12 оба другие, чем водород, и r равно 0. Соединения с боковой ацилмеркаптоцепью формулы II. где R1 и R12 оба другие, чем водород, и r равно 1, могут быть получены взаимодействием замещенной карбоновой кислоты формулы XI H3C-SO2-S-R11 в водном спиртовом растворителе, с получением желаемых продуктов. Соединения формулы VII являются известными в литературе или могут быть получены известными способами, например, Smith и др., Biochemistry, 14. с. 766-771 (1975). Продукт формулы I, где R2 представляет SH, может быть получен взаимодействием продукта формулы I, где R2 представляет водород, с соединением формулы VII, где R 11 представляет трифенилметил или триарилсилил, с последующим удалением трифенилметильной или триалкилсилильной группы в кислых условиях. Симметричные дисульфидные продукты формулы I могут быть получены прямым окислением продукта формулы I, где R2 представляет водород, иодом, согласно известным способам, например, см.: Ondetti и др., патент США 4105776. Соединения с боковой арилмеркаптоцепью формулы II, где R12 представляет водород, описаны в литературе (см., например, Ondetti и др. патент США 4105776 и 4339600; Haslanger и др. патент США 4801609; Delaney и др. патент США 4722810 и т. д.). Соединения с боковой арилмеркаптоцепью формулы II, где R1 и R12 оба другие, чем водород, и r равно 0, могут быть получены взаимодействием замещенной карбоновой кислоты формулы VIII с пара-толуолсулфонилхлоридом в пиридине с получением лактама формулы XII Обработка лактама формулы XII цезийтиокислотой формулы XIII в присутствии диметилформамида дает желаемое соединение с арилмеркаптобоковой цепью формулы II, где R1 и R12 оба другие, чем водород, и r равно 1. Соединения формулы I, где А представляет , с бис///(4-метокси)фенил/метилдисульфидом в присутствии литийдиизопропиламида с получением соединения формулы IX X представляет O или S и Y представляет СН2, О или S, могут быть получены реакцией сочетания кислоты формулы XIV Обработка соединения формулы IX сильной кислотой, такой как трифторметансульфоновая кислота, удаляет метоксибензильную защищающую группу, и последующее ацилирование ацилгалоидом формулы V или ангидридом формулы VI дает где R7 представляет кислую защищающую гр уппу, с соединением с конденсированным бициклическим ядром формулы III в присутствии агента сочетания, как он определен выше. с получением продукта формулы XV 8 39924 где R5 представляет низший алкил или бензил, с соединением с конденсированным бициклическим ядром формулы ІІІ, с получением продукта формулы XX Или же кислота формулы XIV может быть превращена в активированную форму, такую как хлорид кислоты, до реакции сочетания. Кислоты формулы XIV описаны Warshawsky и др. в Европейской патентной заявке 534396 и 534492. Соединения формулы I, где А представляет Предпочтительно R3, в соединении формулы III представляет низший алкил или бензил. R3 и R5 кислые защищающие группы могут быть затем удалены, например, гидрированием с получением соответствующи х продуктов формулы I, где R3 и R5 представляют водород. Фосфонохлоридаты формулы XIX известны в литературе (см., например, Karanewsky и др. патент США 4432971 и 4432972 и Karanewsky патент США 4460579). Продукты формулы I. где Х или Y или оба представляют S-(O)t и t равно 1 или 2, могут быть получены окислением соединений формул IV, XV, XVII или XX известными окисляющими агентами, такими как мета-хлорбензойная кислота, перуксусная кислота, монопероксифталевая кислота, гексагидратная соль магния и т. д. Контролированием количества окисляющего агента и времени реакции получают продукты, где t равно 1 или 2. Продукты формулы 1 в эфирной форме, где R5 или R7 представляют , Х представляет О или S и Y представляет СН2, О или S, могут быть получены взаимодействием кетокислоты или эфира формулы XVI с соединением с конденсированным бициклическим ядром формулы III в условия х восстановления с получением продукта формулы XVII или , могут быть получены обработкой соответствующи х соединений формулы I, где R5 или R7 представляют водород, и R3 представляет кислую защищающую группу, соединением формулы XXI Кетокислоты и эфиры формулы XVI описаны в литературе (см., например, Ruyle патент США 4584294 и Parsons и др. патент США 4873235). Или же соединение с конденсированным бициклическим ядром формулы III может взаимодействовать с трифталатом формулы XVIII , или давая продукт формулы XVII. Соединения формулы I, где А представляет , где L представляет удаляемую группу, такую как хлор, бром или толилсульфонилокси, с последующим удалением кислой защищающей группы R3. Эфирные продукты формулы I, где R3 представтавляет X представляет О или S и Y представляет СН2, О или S, могут быть получены реакцией сочетания фосфонхлоридата формулы XIX или , могут быть получены обработкой соответстствующи х соединений формулы I, где R3 представ 9 39924 n-толуолсульфоновая кислота в метаноле, если Р2 представляет ацетил, бензоил, тритил, тетрагиропиранил или 1,1-диметилэтилдиметилсилил. Полученный продукт затем подвергают реакции циклизации катализируемой кислотой, предпочтительно, обработкой сильной кислотой, такой как трифтор уксусная кислота, пара-толуолсульфоновая кислота или коммерчески доступным полистиролсульфонатным полимером типа ионообменной смолы, такой как Амберлит15â . Эта реакция циклизации может быть выполнена в непротонном растворителе, таком как метиленхлорид или хлороформ, с получением промежуточного соединения формулы XXV. ляет водород и R2 представляет , соединением формулы XXI. Соединения с конденсированными бициклическими ядрами формулы III могут быть получены согласно следующим способам, которые также являются частью этого изобретения. Например, если Y представляет СН2, то N-защищенная аминокислота формулы XXII может быть подвергнута реакции сочетания с эфиром аминокислоты формулы XXIII Соединения формулы XXIV, после удаления Р2 защищающей группы и до реакции циклизации, где Х представляет O, могут быть превращены в соответствующие соединения, где Х представляет S. Это может быть проведено различными способами. Например, соединение формулы XXIV, после удаления Р2 группы, может быть обработано трифенилфосфином, диизопропилазадикарбоксилатом и тиоуксусной кислотой. Полученный тиоацетат затем обрабатывают метоксидом натрия в метаноле, получая соответствующий меркаптан, который может быть затем подвергнут описанной выше реакции циклизации. В другом способе, соединение формулы XXIV, после удаления Р2 группы, обрабатывают известными способами, получая соединение формулы XXVI с получением дипептида формулы XXIV где: P1 представляет аминозащищающую гр уппу, такую, как бензилоксикарбонил или т-бутилоксикарбонил, или группу, которая вместе с N-атомом образует защищающую группу, такую как фталимидо; Р2 представляет гидрокси или меркаптозащищающую группу; R3 представляет легко удаляемую эфирную защищающую гр уппу. Предпочтительными Р2 защищающими группами, если Х представляет S, являются ацильные группы, такие как ацетильная или бензоипьная, особенно, ацетильная. Предпочтительными Р2 защищающими группами, если Х представляет О, являются ацильные группы, тетрагидропираны, затрудненные силильные группы и тритилы, особенно, трифенилметил и 1,1-диметилэтилдиметилсилил. Эту реакцию сочетания проводят, предпочтительно, в присутствии агента сочетания, такого как бензотриазол-1-илокситрис-(диметиламино)фосфорнийгексафторфосфат, этил-3-(3-диметиламино)пропилкарбодиимид или метансульфонилоксибензотриазол. Р2 защищающая гр уппа может быть селективно удалена из промежуточного соединения формулы XXIV. например, обработкой метоксидом натрия в метаноле, если Р2 представляет ацетил или бензоил. или обработкой кислотой, такой как , где L представляет удаляемую группу, такую как метансульфонилокси, пара-толуолсульфонилокси, йод или бром. Например, обработка соединения формулы XXIV, после удаления Р2 защи щающей группы метансульфонилхлоридом, дает соединение формулы XXVI, где L представляет метансульфонилокси. Соединение формулы XXVI затем обрабатывают цезийтиоацетатом, получая соответствующий тиоацетат. Обработка метоксидом натрия в метаноле дает соответствующий меркаптан, который может быть затем подвергнут реакции циклизации, описанной выше. Или же соединение формулы XXIV, где Х представляет 0, может быть непосредственно превращено в промежуточное соединение формулы XXV обработкой сильной кислотой, такой как три 10 39924 фтор уксусная кислота, пара-толуолсульфоновая кислота, или коммерчески доступным полистиролсульфонатным полимером типа ионообменной смолы, такой как Амберлит 15®, в соответствующем растворителе, таком как метиленхлорид или хлороформ. N-защищающую группу затем удаляют из соединения формулы XXV, например, обработкой гидразинмоногидратом, если R1 образует вместе с атомом N фталимидо группу, или обработкой иодтриметилсиланом или палладием на угле и аммониевой солью муравьиной кислоты или водородом, если Р1 представляет бензилоксикарбонил, или обработкой хлористоводородной кислотой в диоксане или другой сильной кислоте, если Р1 представляет т-бутоксикарбонил, получая соединение формулы III с конденсированным бициклическим ядром. Еще в другом способе, если Y представляет СН2, N-защищенная аминокислота формулы XXII может быть подвергнута реакции сочетания с эфиром гидроксиаминовой кислоты формулы XXVII щищающей группы и затем подвергают реакции циклизации катализируемой кислотой, как описано выше, давая промежуточное соединение формулы XXV. Исходное вещество формулы XXIII, где m равно 1, может быть получено селективной защитой N-атома L-e-гидроксинорлейцина, что дает соединение формулы XXX , где Р3 представляет N-защищающую гр уппу. Например, R3 и N-атом могут образовывать фталимидный остаток. N-защищенный L-e-гидроксинорлейцин формулы XXX затем обрабатывают для введения Р3 кислой защищающей группы метилиодидом в присутствии основания или обрабатывают сильной кислотой в метаноле, где R3 предcтавляет метил. Этот эфир затем окисляют, получая альдегид формулы XXXI с получением дипептида формулы XXVIII Альдегид формулы XXXI затем обрабатывают орто-муравьиным эфиром формулы XXXII HC-(-O-алкил)3 , В присутствии в качестве катализатора сильной кислоты и соответствующего спирта, т. е. ОНалкила, где алкил представляет такой же алкил как в орто-муравьином эфире формулы XXXII, получая соединение формулы XXXIII где Р1 и Р2 имеют значения, как они определены выше. Эту реакцию сочетания предпочтительно проводят в присутствии агента сочетания, такого как метансульфонилоксибензотриазол или этил-3-(диметиламино)карбодиимид. Гидроксисоединение XXVIII затем окисляют до альдегида формулы XXIX Удаление N-защищающей группы R3, например, обработкой гидразингидратом, если R3 и Nатом образуют фталимидный остаток, дает исходное вещество формулы XXIII, где m равно 1. Исходное вещество формулы XXIII, где m равно 0, может быть получено путем защиты Nатома g-бензилглутамата с получением соединения формулы ХХХIV обработкой оксалилхлоридом/диметилсульфоксидом с последующей обработкой третичным амином в непротонном растворителе, таком как метиленхлорид Альдегид формулы XXIX затем обрабатывают, как описано выше, для удаления Р2 за 11 39924 , Раствор диэтилового эфира формулы XXXIХ обрабатывают гидроокисью натрия и нагревают и затем подкисляют, и нагревают вновь с получением гидроксиаминокислоты формулы XL где Р3 представляет N-защищающую группу, такую как т-бутилоксикарбонил, или где Р3 и N-атом могут образовать фталимидный остаток. N-защищенную глутаминовую кислоту формулы XXXIV затем обрабатывают для введения R3 кислой защищающей гр уппы, как описано выше, с получением XXXV Гидроксиаминокислоту формулы XL затем обрабатывают ацилазой свиной почки или другим соответствующим гидролизующим ферментом с получением гидроксиаминокислоты формулы XLI Гидролизом, если R3 представляет низший алкил, удаляют бензильную эфирную группу из соединения XXXV с получением XXXVI Гидроксиаминокислоту формулы XLI затем превращают в эфир формулы XXVII обычным способом. Например, гидроксиаминокислота формулы XLI может быть обработана триметилсилилхлоридом в метаноле с получением гидрохлоридной соли метилового эфира соединения формулы XXVII. Исходные вещества формулы XXII могут быть получены следующим образом. Если Х представляет О, гидрокси a-аминокислоту формулы XLII Селективное восстановление соединения XXXVI, например, обработкой этантиолом, этил-3(3-диметиламино)пропил карбодиимидом и диметиламинопиридином с последующей обработкой триэтилсиланом, палладием на угле и ацетонитрилом дает альдегид формулы XXXVII. Альдегид формулы XXXVII затем обрабатывают орто-эфиром муравьиной кислоты, как описано выше, и N-защищающую группу Р 3 удаляют, как описано выше, с получением исходного вещества формулы XXIII, где m равно 0. Гидроксисодержащий эфир аминокислоты исходного вещества формулы XXVII может быть получен взаимодействием раствора диэтилацетамидомалоната с суспензией гидрида натрия при перемешивании с последующей реакцией с галоидалкилацетатом формулы XXXVIII подвергают взаимодействию для введения Р1 и Р2 защищающи х гр упп. Например, обработка кислоты формулы XLII N-карбетоксифталимидом в присутствии карбоната натрия с последующей обработкой хлортрифенилметаном и триэтиламином дает исходное вещество формулы XXII, где Х представляет О, R1, вместе с атомом N, образует фталимидо и Р2 представляет тритил. Или же обработка кислоты формулы XLII N-(бензилоксикарбонилокси)сукцинимидом в водном растворе карбоната натрия и ацетона с последующей обработкой т-бутилдиметилсилилхлоридом или ацилирующим агентом формулы V или VI дает исходное вещество формулы XXII, где Х представляет О, Р1 представляет бензилоксикарбонил и Р2 представляет т-бутилдиметилсилип или ацильную группу, такую как ацетильная. , где галоид представляет Br, I или СІ, с получением соединения формулы XXXIX 12 39924 Если Х представляет S и n равно 1, N,N’бис[(фенилметокси)карбонил] -L-цистеин может быть обработан цинковой пылью и водным раствором серной кислоты с получением меркаптана формулы XLIII , давая дипептид формулы XL VII Меркаптан формулы XLIII затем обрабатывают для введения Р2 защищающей гр уппы. Например, обработка меркаптана формулы XLIII уксусным ангидридом дает исходное вещество формулы XXII, где Х представляет S, n равно 1, Р2 представляет ацетил и Р1 представляет бензилоксикарбонил. Если Х представляет S и n равно 2, L-ме- тионин может быть защищен по N-атому. Например, реакция с бензилхлорформатом или N-(бензилоксикарбонилокси)сукцинимидом дает N-[(фенилметокси)карбонил]-L-метионин, который затем этерифицируют обработкой спиртом, алкил-ОН, в присутствии в качестве катализатора кислоты, такой как n-толуолсульфоновая кислота. Обработка окисляющим агентом, таким как N-хлорсукцинимид, в водном растворе дает сульфоксид формулы XLIV , где Р1 и Р2 имеют значения, как они определены ранее; R3 представляет кислую защищающую гр уппу. Эту реакцию сочетания, предпочтительно, проводят в присутствии агента сочетания, такого как бензотриазол-1-илокситрис(диметиламино)фосфонийгексафторфосфата или этил-3-(3-диметиламино)пропилкарбодиимида. Р2 защищающая гр уппа может быть селективно удалена из промежуточного соединения формулы XLVII, например, обработкой метоксидом натрия в метаноле, если Р2 представляет ацильную группу, такую как ацетил или бензоил, и обработкой кислотой, такой как n-толуолсульфоновая кислота в метаноле, если Р2 представляет тритил, тетрагидропиранил или затрудненную силильную группу. Полученный продукт затем подвергают реакции циклизации катализируемой кислотой, как описано выше, с получением промежуточного соединения формулы XL VIII Сульфоксид формулы XLIV затем обрабатывают ангидридом кислоты, таким как уксусный ангидрид, с получением соединения формулы XL V Промежуточное соединение формулы XLVIII, где Х представляет S и n равно 2,. может быть получено обработкой соединения формулы XLVII, где Х представляет O и n равно 2, с селективным удалением группы Р2 и превращением гидрокси производного в меркаптан, как описано выше, с последующей реакцией циклизации катализируемой кислотой. N-защищающую группу затем удаляют из соединения формулы XLVIII, например, обработкой гидразингидратом, если Р1, вместе с N-атомом, образуют фталимидо группу, или обработкой иодтриметилсиланом или палладием на угле и аммониевой солью муравьиной кислоты или водородом, если Р1 представляет бензилоксикарбонил, Обработка гидроокисью щелочного металла, с последующим удалением формальдегида, например, обработкой восстанавливающим агентом, например, боргидридом натрия, с последующей обработкой ангидридом кислоты, таким как уксусный ангидрид, дает исходное вещество формулы XXII, где Х представляет S, n равно 2, R2 представляет ацетил и Р1 представляет бензилоксикарбонил. Соединения с бициклическим конденсированным ядром формулы III, где Y представляет S или О, и m равно 1, могут быть получены реакцией сочетания N-защищенной аминокислоты формулы XXII с эфиром аминокислоты формулы XLVI 13 39924 давая соединения формулы III с конденсированным ядром. Исходное вещество формулы XLVI, где Y представляет O, может быть получено взаимодействием N-фталимино защищенного эфира аминокислоты формулы XLIX Соединения формулы I содержат три асимметричных центра в конденсированной бициклической части структуры с возможными дополнительными центрами в боковой цепи. Ввиду того, что оптически чистая форма конденсированных бициклических продуктов является предпочтительной, все такие формы находятся в пределах объема этого изобретения. Вышеописанные способы могут использовать рацематы, энантиомеры или диастереомеры в качестве исходных веществ. Если получают диастереомерные соединения, они могут быть разделены обычными хроматографическими способами или фракционной кристаллизацией. Предпочтительно, водород присоединяется к главному мостиковому атому углерода в ориентации, показанной ниже с аллилтрихлорацетимидатом в присутствии трифторметансульфоновой кислоты с получением соединения формулы L Обработка соединения формулы L озоном в метаноле, затем диметилсульфидом с последующей обработкой ортоформиатом формулы XXXII в присутствии n-толуолсульфоновой кислоты дает защищеное соединение формулы LI. Соединения формулы I, где R3 , R5 и/или R7 представляют водород, могут быть выделены в форме фармацевтически приемлемой соли. Соответствующие соли для этой цели представляют соли щелочных металлов, таких как натрий и калий, соли щелочноземельных металлов, таких как кальций и магний, соли, полученные из аминокислот, таких как аргинин, лизин и т. д., и соли, полученные из аминов, таких как алкиламины, например, т-бутиламин, т-амиламин и т. д., замещенных алкиламинов, например, бензиламин, диалкипаминов, замещенных диалкиламинов, например, N-метилглюкамин, триалкиламинов, замещенных триалкиламинов и четвертичных аммониевых солей. Эти соли могут быть получены взаимодействием кислой формы соединения с основанием, обеспечивающим нужный ион, в среде, в которой осаждается сопь, или в водной среде, затем лиофилизацией. Предпочтительными соединениями этого изобретения являются те соединения, где А представляет Удаление N-защищающей группы, например, обработкой гидразингидратом, дает исходное вещество формулы XL VI, где Y представляет O. Исходное вещество формулы XLVI, где Y представляет S, может быть получено взаимодействием цистеинового эфира формулы LII с бромацеталем формулы LIII в присутствии гидрида натрия и иодида калия с получением эфира аминокислоты формулы LIV 14 39924 R2 представляет водород, , или R11 -S-; R3 представляет водород или низший алкил с 1-4 атомами углерода; r равно 0 или 1; R11 представляет низший алкил с 1-4 атомами углерода; R1 представляет арил-СН 2-, замещенный арилСН2-; гетероарил-СН2-; циклоалкил-СН 2-, где циклоалкил содержит 3-7 атомов углерода или неразветвленную, или разветвленную алкильную цепь с 1-7 атома углерода и R12 представляет водород; или R1 и R12, взятые вместе с атомом углерода, к которому они присоединяются, дают циклоалкильное кольцо с 5-7 атомами углерода; R6 представляет низший алкил с 1-4 атомами углерода или фенил; n равно 1 или 2; m равно 0 или 2; Х представляет O или S и Y представляет СН2, О или S при условии, что Y представляет О или S, только если m равно 1. Наиболее предпочтительными являются соединения, приведенные выше, где R2 представля являются селективными ингибиторами, обладающими способностью ингибировать превращение фермента ангиотензина. Таким образом, соединения формулы I, включающие их фармацевтически приемлемые соли, являются полезными при лечении физиологических состояний, в которых ингибиторы превращения фермента ангиотензина были показаны как полезные. Такие состояния включают болезненные состояния, характеризующиеся нарушениями давления крови; внутриглазного давления, включая сердечно-сосудистые заболевания, в частности, гипертензию и застойную сердечную недостаточность, глаукому и ренальные болезни, такие как почечная недостаточность, диабетическая нефропания, и почечная недостаточность (renal impairment) с последующим лечением циклоспорином или другими иммунодепрессантами. Другие состояния, в которых ингибиторы превращения фермента ангиотензина, как сообщалось, являются полезными, включают цирроз печени, ингибирование прогрессирования атеросклероза, предупреждение или лечение гипотензивной или диабетической ретинопатии, улучшение сердечной дисфункции или последующие перебои сердечной деятельности и предупреждение рестинозиса после пластической операции на сосудах. Ингибиторы двойного действия являются также полезными при лечении физиологических состояний, в которых, как показано, будут полезными ингибиторы нейтральной эндопептидазы. Такие состояния также включают сердечнососудистые заболевания, в частности, гипертензию, гиперальдостеромию, почечные болезни, глаукому, а также ослабление острой и хронической боли. Таким образом, соединения формулы I являются полезными для снижения кровяного давления, а ингибиторы формулы I двойного действия являются, кроме того, полезными для этой цели, благодаря их диурезным и натриурезным свойствам. Ингибиторы двойного действия являются особенно полезными для лечения застойных сердечных нарушений. Соединения формулы I, включающие их фармацевтически приемлемые соли, могут быть введены для этих целей в количествах, аналогичных тем, которые применяли ранее для ингибиторов превращения фермента ангиотензина. Например, соединения формулы I могут быть введены млекопитающему, например, человеку, дозой от около 0,1 мг до около 100 мг на кг веса тела в день, предпочтительно, от около 0,5 мг до около 25 мг на кг веса тела в день. Соединения формулы I, предпочтительно, вводятся орально, но парентеральные пути, такие как подкожно, внутримышечно и внутривенно, также могут быть использованы, как могут быть использованы и локальные пути введения. Дневная доза может быть введена в один прием или может быть разделена на 2-4 дозы введения в течение дня. ет водород или , особенно, водород; R3 представляет водород; r равно 0 или 1, особенно, 1; R1 представляет бензил, циклопропилметил или неразветвленную, или разветвленную алкильную цепь с 3-5 атомами углерода, особенно, бензил; R12 представляет водород; n равно 1 или 2; m равно 0 или 1; Х представляет О или S и Y представляет СН 2, О или S при условии, что Y представляет О или S, только если m равно 1. Единственное наиболее предпочтительное соединение представляет /4S-/4a(r*),7a,10аb//-октагидро-4-/(2-меркапто-1-оксо-3-фенилпропил)амино/-5-оксо-7Н-пиридо[2,1-b]-/1,3/тиазепин7-карбоновую кислоту, т. е. соединение формулы Соединения формулы I, где А представляет являются ингибиторами двойного действия, обладающими способностью ингибировать превращение фермента ангиотензина и нейтральной эндопептидазы. Соединения формулы I, где А представляет 15 39924 Ингибиторы формулы I могут быть введены в комбинации с ANF 99-126 человека. Такая комбинация будет содержать ингибитор формулы I от около 1 до около 100 мг на 1 кг веса тела и ANF 99-126 человека от около 0,001 до около 0,1 мг на 1 кг веса тела. Ингибиторы формулы I могут быть введены в комбинации с другими типами фармацевтически активных соединений. Например, диуретических, блокаторов кальциевых каналов, активаторов калиевых каналов, восстанавливающих агентов холестерина, b-блокаторов и т. д. Ингибиторы формулы I или их фармацевтически приемлемые соли и другие фармацевтически приемлемые ингредиенты могут быть включены в композицию для вышеописанного фармацевтического использования. Соответствующие композиции для орального введения включают таблетки, капсулы и эликсиры, и соответствующие композиции для парентерального введения включают стерильные растворы и суспензии. Соответствующие композиции для печения глаукомы также включают локальные композиции, такие как растворы, мази и твердые включения, как описано в патенте США 4442089. От около 10 до 500 мг активного ингредиента включается вместе с физиологически приемлемым связующим, носителем, наполнителем, консервантом, стабилизатором, ароматическим веществом и т. д. в форме единичной дозы, как отмечено, для приемлемой фармацевтической практики. Следующие примеры иллюстрируют изобретение. Температуры даны в градусах. Тонкослойную хроматографию выполняли на силикагеле, если не оговорено особо. Пример 1. /4S-/4a(R*),7a,10ab//-oктагидро-4-//2-меркапто1-оксо-3-фенилпропил/амино/-5-оксо-7Н-пиридо/2,1-b//1,3/оксазепин-7-карбоновая кислота a) (S)-2-фталимидо-4-гидроксибутановая кислота, соль триэтиламина Раствор L-гомосерина (3,0 г, 25,2 ммоля) и карбоната натрия (2,670 г, 25,2 ммоля) в воде (60 мл) обрабатывали N-карбетоксифталимидом (5,570 г, 25,4 ммоля). После перемешивания при комнатной температуре в течение 2 часов раствор подкисляли 6N соляной кислотой и экстрагировали этилацетатом. Этилацетатный экстракт промывали рассолом, сушили (сульфатом натрия) и фильтровали в раствор триэтиламина (4,0 мл) в метиленхлориде (40 мл). Мутный раствор концентрировали и растирали с этилацетатом и этиловым эфиром с получением 5,11 г указанного в названии соединения в виде белого твердого вещества: т. пл. 142-144°С, TLC (5% уксусная кислота в этилацетате) Rf = 0.36; [a]D=-6,2° (с=0,8 хлороформ). Данные анализа для С18 Н26 N2 O 5: Вычислено, %: С 61,70; Н 7,48; N 7,99. Найдено, %: С 61,45; Н 7,47; N 7,84. b) (S)-2-фталимидо-4-/трифенилметокси/бутановая кислота, соль триэтиламина Гомогенный раствор продукта стадии (а) (1,890 г, 5,4 ммоля) в хлороформе (20 мл) обрабатывали триэтиламином (80 мкл) с последующей обработкой твердым хлортрифенилметаном (1,590 г, 5,70 ммоля). После перемешивания при комнатной температуре в течение 2,5 часов раствор разделялся между этилацетатом и 0,1 N соляной кислотой (150 мл). Органический слой промывали водой и рассолом, затем сушили (сульфатом натрия) и фильтровали в раствор триэтиламина (1,0 мл) в метиленхлориде (30 мл). Раствор концентрировали до масла, вновь растворяли в небольшом количестве метиленхлорида и этилацетата и растирали с этилацетатом до тех пор, пока раствор не помутнеет. В смесь помещали затравку и оставляли при комнатной температуре. Образующийся осадок собирали фильтрованием, промывали этилацетатом и этиловым эфиром и сушили в вакууме с получением 2,538 г указанного в названии соединения в виде белого твердого вещества : т. пл. 165-170°С (разлож.) TLC (10% метанола в хлороформе) Rf = 0,23; [a]D=+7,0° (с=1,2, хлороформ). c) (S)-2-фталимидо-6-гидроксигексановая кислота Раствор (+)-L-e-гидроксинорлейцина (полученного согласно способу Bodanszky и др., J Med. Chem. 1978, 21, 1030-1035) (1,030 г, 7,0 ммоля) и карбоната натрия (745 мг, 7,0 ммоля) в воде (12 мл) обрабатывали N-карбетоксифталимидом (1,495 г, 7,0 ммоля) и смесь перемешивали при комнатной температуре в течение 2 часов. Раствор фильтровали, охлаждали до 0°C и подкисляли 6N соляной кислотой с получением белого осадка. Твердое вещество собирали фильтрованием и сушили в вакууме при 80°С в течение 1 часа с получением 1,297 г указанного в названии соединения: т. пл. 162-163°С; [a]D=-35,7° (с=1,3, метанол). d) (S)-2-фталимидо-6,6-диметоксигексановая кислота, метиловый эфир Сырой продукт из стадии (с) (3,752 г, 13,5 ммоля) и карбонат цезия (2,178 г, 6,7 ммоля) в диметилформамиде (44 мл) обрабатывали метилиодидом (3,0 мл. 6,84 г, 48,2 ммоля). После перемешивания при комнатной температуре в течение 2 часов смесь разбавляли этилацетатом и промывали последовательно водой, содержащей небольшое количество бисульфита натрия, водой, 50% насыщенным раствором бикарбоната натрия и рассолом, затем сушили (сульфатом натрия), фильтровали и удаляли с получением промежуточного эфира в виде бесцветного масла (3,825 г). Масло было гомогенным, по данным TLC (1:1 ацетон:гексан), Rf = 0,37. Раствор оксалилхлормда при -78°С (1,37 мл, 2,00 г. 15,7 ммоля) в сухом метиленхлориде (58 мл) обрабатывали по каплям раствором сухого диметилсульфоксида (2,24 мл, 2,47 г, 31,6 ммоля) в метиленхлориде (2 мл). Через 10 минут добавляли раствор приведенной выше спирт-эфирной смеси (3,825 г, 13,1 ммоля) в метилехлориде (10 мл). Затем через 15 минут добавляли тризтиламин (8,0 мл) и смесь перемешивали при -78°С в течение 5 минут, затем нагревали до 0°С. Смесь разбавляли этилацетатом/этиловым эфиром и последовательно промывали 1N соляной кислотой, водой и рассолом, затем сушили (сульфатом натрия), фильтровали и удаляли с получением неочищенного желаемого альдегида. Масло было гомогенным, по данным TLC (1:1 ацетон:гексан), Rf=1,48. 16 39924 Раствор приведенного выше альдегида в метаноле (17 мл) и метиленхлорида (17 мл) обрабатывали триметиловым эфиром орто-муравьиной кислоты (1,7 мл) с последующей обработкой моногидратом n-толуолсульфоновой кислоты (180 мг). Смесь перемешивали при комнатной температуре в течение 1,5 часов, затем разделяли между этилацетатом и 50% насыщеным раствором бикарбоната натрия. Органический слой промывали водой и рассолом, затем сушили (сульфатом натрия), фильтровали и удаляли. Остаток подвергали флеш-хроматографии (Мерк силикагель, 1:1 этилацетат:гексан) и чистили фракции продукта кристаллизацией из смеси этилацетат/гексан, получая аналитически чистый указанный в названии продукт (3,452 г, первый отбор и 215 мг второй отбор) в виде белого игольчатого вещества: т. пл. 69-70°С, TLC (1:1 – этилацетат:гексан) Rf=0,35; [a]D=-27,4° (с=1,5, хлороформ). Данные для анализа для С17Н21NO6 : Вычислено, %: С 60,89; Н 6,31; N 4,18 Найдено, %: С 60,80; Н 6,32: N 4,16. е) /S/-/R*R*//-2//2-фталимидо-4-/трифенилметокси/-1-оксобутил/амино/-6,6-диметоксигексановая кислота, метиловый эфир Неочищенный продукт из часта (d) (2,540 г, 7,57 ммоля) в метаноле (18 мл) обрабатывали гидразинмоногидратом (378 мкл, 390 мг, 7,80 ммоля). Смесь становилась гомогенной в течение 10 минут. После перемешивания при комнатной температуре в течение 3 дней полученный шлам фильтровали, удаляли, смешивали с метиленхлоридом, фильтровали и вновь удаляли, получая неочищенный промежуточный амин в виде бесцветного масла. В то же время раствор соли триэтиламина продукта из части (b) (4,622 г, 7,80 ммоля) в метиленхлориде (50 мл) при 0°С обрабатывали бензотриазол-1-илокситрис/диметиламино/фосфоний гексафторфосфатом (3,519 г, 7,95 ммоля). Смесь перемешивали в течение 35 минут, затем обрабатывали раствором приведенного выше амина в метиленхлориде (15 мл). Через 10 минут реакции при 0°С и 2 часов при комнатной температуре, раствор разделялся между этиловым эфиром и водой. Органический слой промывали 50% насыщенным раствором бикарбоната натрия и рассолом, затем сушили (сульфатом натрия), фильтровали и удаляли. Остаток подвергали флеш-хроматографированию (Мерк силикагель, 6:4 этилацетат:гексан), получая 3,580 г. чистого указанного в названии соединения в виде белой пены. TLC (6:4 этилацетат: гексан) Rf=0,32; [a]D=+26,2° (с=0,6, хлороформ). f) /S-/R*,R*//-2//2-фталимидо-4-гидрокси-1-оксо-бутил/амино/-6,6-диметоксигексановая кислота, метиловый эфир Раствор продукта из части (е) (5,420 г, 8,0 ммоля) в метаноле (60 мл) обрабатывали моногидратом n-толуолсульфоновой кислоты (520 мг). После перемешивания при комнатной температуре в течение 1,5 часов смесь разделялась между этилацетатом и разбавленным раствором бикарбоната натрия. Фазы разделяли и водный слой вновь экстрагировали этилацетатом. Собранные органические экстракты промывали рассолом, сушили (сульфатом натрия), фильтровали и удаляли. Остаток подвергали флеш хроматографированию (Мерк силикагель 8:2 – этилацетат:гексан с последующим 5% метанола в этилацетате) с получением 2,860 г указанного в названии продукта в виде бесцветного масла. TLC (7:3 этилацетат:гексан) Rf=0,26; [a]D=+18,7° (с=1,3, хлороформ). g) /4S-4a,7a,10ab //-Октагидро-4-фталимидо-5оксо-7Н-пиридо[2,1-b]-/1,3/оксазепин-7-карбоновая кислота, метиловый эфир Раствор продукта из части (f) (2,10 г, 4,95 ммоля) в метиленхлориде (100 мл) обрабатывали Амберлитом ®15-ионообменной смолой (240 мг, предварительно последовательно промытой 6N соляной кислотой, водой, тетрагидрофураном. затем метиленхлоридом). После перемешивания при комнатной температуре в течение 2,5 часов раствор фильтровали, удаляли и подвергали фпеш-хроматографированию (Мерк силикагель, 6:4 – этилацетат:гексан с последующим 100% этилацетатом), получая 1,40 г указанного в названии продукта в виде белой пены. h) /S/-2-/Ацетилтио/бензолпропановая кислота Раствор нитрита (10,3 г, 280 ммолей) добавляли к раствору D-фенилаланина (30,0 г, 181 ммоля) и бромида калия (73,5 г) в серной кислоте (2,5 N, 365 мл) в течение 1 часа, поддерживая одновременно температуру реакции при 0°С. Смесь дополнительно перемешивали в течение 1 часа при 0°С и затем в течение 1 часа при комнатной температуре. Реакционный раствор экстрагировали эфиром, эфир обратно экстрагировали водой и эфирный слой сушили над сульфатом натрия. Эфир удаляли в вакууме - отгоняли маслообразный остаток, получая 25,7 г /R/-2-бром-3бензолпропановой кислоты: т. кип. 141°С (0,55 мм Hg); [a]D= +14,4° (с=2.4, хлороформ). Смесь тиоуксусной кислоты (7 мл, 97,9 ммоля) и гидроокиси калия (5,48 г, 97,9 ммоля) в ацетонитриле (180,5 мл) перемешивали в атмосфере аргона при комнатной температуре в течение 1 и 3/4 часа. Смесь охлаждали в бане со льдом и раствор /R/-2-бром-3-бензолпропановой кислоты (20,4 г, 89 ммоля) в ацетонитриле (20 мл) добавляли в течение 10 минут. Реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение 5 часов, фильтровали и удаляли ацетонитрил в вакууме. Маслообразный остаток вновь растворяли в этилацетате и промывали 10% раствором бисульфата калия и водой. Этилацетат удаляли в вакууме, получая 19,6 г неочищенного продукта. Неочищенный продукт чистили через получение его дициклогексиламиновой соли, используя изопропиловый эфир в качестве растворителя для кристаллизации. Аналитически чистый образец /S/-2-/ацетилтио/бензолпропановой кислоты, дициклогексиламиновой соли получали перекристаллизацией из этилацетата: т. пл. 146-147°С; [a]D= -39,6°С (с=1,39, хлороформ). Данные анализа для С11Н12О 3S×С12Н23N: Вычислено, %: С 68,11; Н 8,70; N 3,45, S 7,91 Найдено, %: С 67,93; Н 8,71; N 3.37, S 7,94. Свободную кислоту регенерировали разделением дициклогексиламиновой соли между 5% раствором бисульфата калия и этилацетатом, получая /S/-2-/ацетилтио/бензолпропановую кислоту; [a]D= -70,1°С (с=1,91, хлороформ). 17 39924 Данные анализа для С11Н12О 3S: Вычислено, %: С 58,91; Н 5,39; S 14,30 Найдено, %: С 58,73; Н 5,41; S 14,53. i) Метиловый эфир /4S-/4a/R*/,7a10аb//-октагидро-4-//2-/ацетилтио/-1-оксо-3-фенилпропил/амино/-5-оксо-7Н-[2,1-b]/1,3/оксазепин-7-карбо новой кислоты Продукт из части (g) (620 мг, 166 ммоля) в метаноле (10 мл) обрабатывали гидразинмоногидратом (85 мкл, 88 мг, 1,75 ммоля) и раствор перемешивали при комнатной температуре в течение 44 часов. Смесь фильтровали и твердое вещество промывали метанолом. Фильтрат удаляли, растирали с метиленхлоридом, снова фильтровали и удаляли, получая неочищенный амин в виде мутного масла (около 400 мг). Холодный раствор (0°С) /S/-2-/ацетилтио/бензолпропановой кислоты (410 мг, 1,83 ммоля) и триэтиламина (250 мкл, 182 мг. 1,80 ммоля) в метиленхлориде (10 мл) обрабатывали вышеуказанным амином (в виде раствора в 8 мл метилхлоридa) с последующей обработкой бензтриазол-1илокситрис/диметиламино/фосфонийгексафторфосфа том (808 мг, 1,83 ммоля). Прозрачный, практически бесцветный перемешивали при 0°С в течение 40 минут и затем при комнатной температуре в течение 2 часов. Смесь разделялась между этилацетатом/этиловым эфиром и водой. Органический слой промывали последовательно 50% раствором насыщенного бикарбоната натрия и рассолом, затем сушили (сульфа том натрия), фильтровали и удаляли. Остаток подвергали флеш-хроматографированию (Мерк силикагель 60-70% этилацетата в гексане), получая 602 мг чистого, указанного в названии продукта в виде белой пены; TLC (6:4 – этилацетат:гексан) Rf=0,27. j) /4S-/4a/R*/,7a,10аb/-октагидро-4-//2-меркапто-1-оксо-3-фенилпропил/амино/-5-оксо-7Н-пиридо[2,1-b]/1,3/оксазепин-7-карбоновая кислота Раствор продукта из части (і) при 0°С (590 мг, 1,32 ммоля) в метаноле (10 мл, обескислороженный пробулькиванием аргона) обрабатывали 1N раствором гидроокиси натрия (7 мл, обескислороженным пробулькиванием аргона). После перемешивания в течение 15 минут раствор нагревали до комнатной температуры и продолжали перемешивание в атмосфере аргона дополнительно 4,5 часа. Смесь подкисляли 5% бисульфатом калия, разбавляли водой и экстрагировали этилацетатом. Этилацетатный экстракт промывали водой и рассолом, затем сушили (сульфатом натрия), фильтровали и концентрировали до, приблизительно, 3 мл. Остаток смешивали с этилацетатом и небольшим количеством гексана, и полученное твердое вещество собирали фильтрованием и сушили в вакууме, получая 413 мг указанного в названии продукта: т. пл. 180,5°С (разложен.). TLC (2% уксусной кислоты в этилацетате) Rf=0.39; [a]D= -37,6° (с=0,36, метанол). HPLC: YMC S30DS колонка (6,0х150 мм); элюируют 40% А:90% воды - 10% метанола – 0,2% фосфоновой кислоты и 60% В: 10% воды - 90% метанола - 0,2% фосфоновой кислоты; скорость потока 1,5 мл/мин с детектированием при 220 нм; t=6,73 мин (95,7%). Данные анализа для С 20Н28N2О 4S×0,12 этилацетат. Вычислено, %: С 58,05; Н 6,24; N 6,95; S 7,96 Найдено, %: С 58,23; Н 6,34; N 6,83; S 7,81. Пример 2. /3R/3a/S*/,6а,9аb//-гексагидро-3-//2-меркапто1-оксо-3-фенилпропил/амино/-4-оксо-2Н,6Н-пиридо[21-b]/1,3-тиазин-6-карбоновая кислота а) N-//фенилметокси/карбонил/-L-цистеин Раствор N,N’-бис//фенилметокси/карбонил/-Lцистеина (4,658 г, 9,16 ммоля) в метаноле (35 мл) обрабатывали 2N раствором серной кислоты (23 мл) с последующей обработкой порциями цинковой пылью (2,442 г, 37,3 ммоля). Смесь нагревали при 70°С в течение 1,5 часов, фильтровали, пока раствор остается еще теплым, и концентрировали на роторном испарителе. Оставшийся раствор экстрагировали этиловым эфиром, и эфирный экстракт промывали водой и рассолом и сушили (сульфа том натрия), фильтровали и удаляли. Остаток (масло) растворяли в четыреххлористом углероде, охлаждали до 0°С и вводили затравку до медленного образования осадка. Твердое вещество собирали фильтрованием и промывали холодным четыреххлористым углеродом и подвергали флеш-хроматографированию (Мерк силикагель, этилацетат с последующей обработкой 4% уксусной кислоты в этилацетате), получая дополнительный продукт после кристаллизации (246 мг). Полный выход продукта 2,894 г. TLC (5% уксусная кислота в этилацетате) Rf=0.58. b) S-Ацетил-N-//фенилметокси/карбонил/-Lцистеин Гомогенный раствор продукта из части (а) (2,70 г, 10,6 ммоля) в воде (30 мл, обескислороженный пробулькиванием аргона), содержащий бикарбонат калия (2,140 г, 21,4 ммоля), обрабатывали уксусным ангидридом (8,0 мл, 8,66 г, 84,8 ммоля). Через 10 минут при комнатной температуре смесь подкисляли 10% соляной кислотой и экстрагировали этиловым эфиром. Эфирный экстракт промывали дважды водой и рассолом и сушили (сульфатом натрия), фильтровали и удаляли, получая масло. Остаток подвергали азеотропной разгонке три раза с толуолом и дважды со смесью -- этиловый эфир/гексан, после чего масло кристаллизовалось. Остаток растирали со смесью - этиловый эфир/гексан, и твердое вещество собирали фильтрованием, получая 2,19 г чистого, указанного в названии, продукта. TLC (5% уксусная кислота в этилацетате) Rf=0,56. c) Метиловый эфир /S/-2-//N-фенилметокси/карбонил-S-ацетил-L-цистеинил/амино/-6,6-диметоксигексановой кислоты Шлам метилового эфира /S/-2-фталимидо-6,6диметокси-гексановой кислоты (полученный как описано в примере 1 (d), 1,158 г, 3,45 ммоля) в метаноле (12 мл) обрабатывали гидразинмоногидратом (176 мкл, 182 мг, 3,63 ммоля). Смесь становилась гомогенной в течение 10 минут. После перемешивания при комнатной температуре 67 часов полученный шлам фильтровали, удаляли, смешивали с метиленхлоридом, фильтровали и вновь удаляли, получая неочищенный промежуточный амин в виде бесцветного масла. В то же время часть шлама продукта из части (b) (1,185 г, 3,98 ммоля) в метиленхлориде (14 мл) обрабатывали триэтиламином (555 мкл, 403 мг, 3,98 ммоля). Затем гомогенный раствор охлажда 18 39924 ли до 0°С, обрабатывали указанным выше амином в виде раствора в метиленхлориде (7 мл), затем обрабатывали бензотриазол-1-илокситрис/диметиламино/фосфоний-гексафторфосфатом (1,762 г, 3,98 ммоля). Смесь перемешивали при 0°С в течение 2,5 часов, затем при комнатной температуре в течение 45 минут. Растворитель удаляли, и остаток разделяли между этилацетатом и водой. Органический слой промывали 50% насыщенным раствором бикарбоната натрия и рассолом, затем сушили (сульфатом натрия), фильтровали и удаляли. Остаток подвергали флеш-хроматографированию (Мерк силикагель, 65:35 этилацетат:гексан), получая 1,15 г чистого указанного в названии продукта в виде белой пены. TLC (75:25 - этилацетат:гексан) Rf=0,42. Данные анализа для С22Н32N2О 8S: Вычислено, %: С 54,53; Н 6,66; N 5,78; S 6,62 Найдено, %: С 54,79; Н 6,72; N 5,77; S 6,95. d) Метиловый эфир /3R-/3a,6a,9аb//-гексагидро-3-//-фенилметокси/карбонил/амино/-4-оксо-2Н, 6Н-пиридо[2,1-b]/1,3/-тиазин-6-карбоновой кислоты Обескислороженный раствор (пробулькивание аргоном) продукта из части (с) (1,040 г, 2,15 ммоля) в метаноле (12 мл) при 0°С обрабатывали метоксидом натрия (25 вес.% в метаноле, 490 мкл, 463 мг, 2,14 ммоля). Через 20 минут смесь гасили насыщенным раствором хлористого аммония, разбавляли водой и экстрагировали этилацетатом. Этилацетатный экстракт промывали водой и рассолом и сушили (сульфатом натрия), фильтровали и удаляли. Остаток вновь растворяли в метиленхлориде (200 мл) и перемешивали при комнатной температуре с Амберлитомâ - ионообменной смолой 820 мг, предварительно промытой последовательно 6N соляной кислотой, водой, тетрагидрофураном, затем метиленхлоридом. Через 3 часа раствор фильтровали, удаляли и подвергали флеш-хроматографированию (Мерк силикагель, 65:35 –этилацетат:гексан), получая 757 мг указанного в названии продукта в виде бесцветного масла. TLC (75:25 - этилацетат гексан) Rf=0,58. Е) Ме тиловый эфир /3R/3a,6a,9аb//--гексагидро-3-амино-4-оксо-2Н,6Н-пиридо[2,1-b]/1,3/тиазин6-карбоновой кислоты Раствор продукта из части (d) (752 мг, 1,99 ммоля) в сухом метиленхлориде (15 мл) обрабатывали при комнатной температуре иодтриметилсиланом (620 мкл, 872 мг, 4,36 ммоля). После перемешивания в течение 3 часов смесь гасили водой, обрабатывали небольшим количеством 10% соляной кислоты и экстрагировали этиловым эфиром. Слои разделяли и эфирный слой вновь экстрагировали водой. Собранные водные слои подщелачивали (рН 13) 10% раствором гидроокиси натрия и дважды экстрагировали метиленхлоридом. Собранные метиленхлоридные экстракты (сульфатом натрия) фильтровали и удаляли, получая 290 мг неочищенного указанного в названии продукта в виде бесцветного масла. TCL (10% метанола в метиленхлориде) Rf=0,38. f) Ме тиловый эфир /3R/3a/S*/6a9ab//-гексагидро-3-//2-/ацетилтио/1-оксо-3-фенилпропил/амино/4-оксо-2Н,6Н-пиридо[2,1-b]-/1,3/тиазин-6-карбоновой кислоты Холодный раствор (0°С) /S/-2-ацетилтио/бензолпропановой кислоты (294 мг, 1,31 ммоля) и триэтиламина (180 мкл, 131 мг, 1,29 ммоля) в метиленхлориде (8 мл) обрабатывали продуктом из части (е) (287 мг, 1,17 ммоля) в виде раствора в 6 мл метиленхлорида. Затем добавляли бензотриазол-1-илокситрис/диметиламино/фосфонийгексафторофосфат (575 мг, 1.30 ммоля). Прозрачный, практически бесцветный раствор перемешивали при 0°С в течение 1 часа и затем при комнатной температуре в течение 1 часа. Растворитель удаляли на роторном испарителе, и остаток разделяли между этилацетатом и 5% раствором бисульфата калия. Органический слой последовательно промывали водой. 50% насыщенным раствором бикарбоната натрия и рассолом, затем сушили (сульфатом натрия), фильтровали и удаляли. Остаток подвергали флеш-хроматографированию (Мерк силикагель; 1:1 - этилацетат:гексан), получая 412 мг чистого, указанного в названии, продукта в виде белой пены. TLC (1:1 – этилацетат:гексан) Rf=027; [a]D/= -107,0°С (с=0,6, хлороформ), g) /3R-/3a/S*,/6a,9ab//-гексагидро-3-//-2-меркапто-1-оксо-3-фенилпропил/амино/-4-оксо-2Н,6Нпиридо[2,1-b]-/1,3/тиазин-6-карбоновая кислота Раствор продукта из части (f) при 0°С (406 мг, 0,90 ммоля) в метаноле (5 мл, обескислороженной пробулькиванием аргона) обрабатывали 1N раствором гидроокиси натрия (5 мл, обескислороженным пробулькиванием аргона). После перемешивания в течение 1 часа раствор нагревали до комнатной температуры, и перемешивание в атмосфере аргона продолжали дополнительно 1,25 часа. Смесь подкисляли 5% раствором бисульфата калия, разбавляли водой и экстрагировали этилацетатом. Этилацетатный экстракт промывали водой и рассолом, затем сушили {сульфатом натрия), фильтровали и удаляли. Остаток дважды подвергали флеш-хроматографированию (Мерк силикагель, 2% уксусная кислота в этилацетате). Фракции продукта контролировали по данным HPLC. Желаемые фракции собирали, удаляли и дважды подвергали азеотропной разгонке с этилацетатом. Остаток помещали в небольшое количество этилацетата и растирали с гексаном. Растворитель удаляли, и остаток с гексаном удаляли и сушили в вакууме, получая 98,3 мг указанного в названии продукта в виде твердой белой пены. TLC (2% уксусная кислота в этилацетате) Rf=0,46; [a]D= -57,0°С (с=0,4, хлороформ). Данные HPLC (гель-проникающей хроматографии) : YMC S 3 ODS колонка (6,0 • 150 мм); элюированная 40% А: 90% воды - 10 метанола - 0,2% фосфорной кислоты и 60% В: 10% воды - 90% метанола - 0,2% фосфорной кислоты; скорость потока 1,5 мл/мин детектирование при 220 нм; tR= =8,33 мин (95.0%). Данные анализа для С 18Н22N2О 4S2 × 0,2 этилацетат Вычислено, %: С 54,79; Н 5,77; N 6,80; S 15,56 Найдено. %: С 54,59; Н 6,04; N 6,59; S 15,16. Пример 3. /4S-/4a/R*/,7a,10аb//-Октагидро-4-//2-меркапто1-оксо-3-фенилпропил/амино/-5-оксо-7Н-пиридо[2, 1-b]/1,3/тиазепин-7-карбоновая кислота 19 39924 а) Метиловый эфир /S-/R*,R*//-2-//2-фталимидо-4-/aцетилтио/-1-оксобутил/амино-6,6-диметоксигексановой кислоты Холодный раствор (0°С) трифенилфосфина (1,143 г, 4,36 ммоля) в тетрагидрофуране (20 мл) обрабатывали диизопропилазидодикарбоксилатом (860 мкл, 883 мг, 4,37 ммоля). В течение 5 минут появлялся белый шлам. Через 30 минут добавляли раствор метилового эфира /S-/R*,R*/-2//2-фталимидо-4-гидрокси-1-оксобутил/амино/-6,6диметоксигексановой кислоты (полученный как описано в примере 1 (f), 928 мг, 2,19 ммоля) в тетрагидрофуране (8 мл) с последующим добавлением слабой тиоуксусной кислоты (312 мкп, 332 мг, 4,36 ммоля). Смесь перемешивали при 0°С в течение 1,25 часа, затем разделяли между 50% раствором насыщенного бикарбоната натрия и этилацетатом. Этилацетатный экстракт промывали рассолом, сушили (сульфатом натрия), фильтровали и удаляли. Остаток вновь растворяли в этилацетате и обрабатывали небольшим количеством гексана для осаждения трифенилфосфиноксида. Смесь фильтровали и фильтрат подвергали флеш-хроматографированию (Мерк силикагель, 65:35 – этилацетат:гексан), получая 894 мг указанного в названии продукта в виде бесцветного масла. TLC (75:25 - этилацетат гексан) Rf=0,43. b) Метиловый эфир /4S-/4a,7a,10ab//-окгагидро-4-фталимидо-5-оксо-7Н-пиридо[2,1-b]/1,3/тиазепин-7-карбоновой кислоты Обескислороженный (пробулькиванием аргона) продукт из части (а) (814 мг, 1,65 ммоля) в метаноле (15 мл) при 0°С обрабатывали метоксидом натрия (25 вес.% в метаноле, 1,05 мл, 4,6 ммоля). Через 5 минут смесь гасили раствором насыщенного хлористого аммония, разбавляли водой и экстрагировали этилацетатом. Этилацетатный экстракт промывали водой и рассолом, затем сушили (сульфа том натрия), фильтровали и удаляли. Остаток вновь растворяли в метиленхлориде (180 мл) и перемешивали при комнатной температуре с ионообменной смолой Амберлит®15 (285 мг, предварительно промытой последовательно 6N соляной кислотой, водой, тетрагидрофураном, затем метиленхлоридом). Через 46 часов раствор фильтровали, удаляли и подвергали флеш-хроматографированию (Мерк силикагель, 1:1 – этилацетат:гексан), получая 314 мг указанного в названии продукта в виде белой пены. Растирание пены с этилацетатом дало указанный в названии продукт в виде твердого белого вещества. Т. пл. = 147-148°С. TLC (75:25 этилацетат:гексан) Rf=0,56; [a]D= -143,2° (с=0,6, хлороформ). с) Метиловый эфир /4S-/4a/R*/,7a10аb//-октагидро-4-//2-/ацетилтио/-1-оксо-3-фенилпропил/амино/-5-оксо-7Н-пиридо[2,1-b]/1,3/тиазепин7-карбоновой кислоты Продукт из части (b) (280 мг, 0,72 ммоля) в метаноле (8 мл) обрабатывали гидразинмоногидратом (42 мкл, 43,3 мг, 0,86 ммоля), и раствор перемешивали при комнатной температуре, в течение 67 часов. Смесь фильтровали, и твердое вещество промывали метанолом. Фильтрат удаляли, растирали с метиленхлоридом, вновь фильтровали и удаляли, получая неочищенный амин в виде желтого масла (около 205 мг). Холодный раствор (0°С) /S/-2-ацетилтио/бензопропановой кислоты (178 мг, 0,79 ммоля) и триэтиламина (111 мкл, 80 мг, 0,80 ммоля) в метиленхлориде (3 мл) обрабатывали указанным выше амином (в виде раствора в 7 мл метиленхлорида) с последующей обработкой бензотриазол-1-илокситрис/диметиламино/фосфонийгексафторфосфа-том (353 мг, 0,80 ммоля). Раствор перемешивали при 0°С в течение 1 часа и затем при комнатной температуре в течение 2 часов. Растворитель удаляли и остаток разделяли между этилацетатом и 5% раствором бисульфата калия. Органический слой последовательно промывали водой, 50% насыщеным раствором бикарбоната натрия и рассолом и затем сушили (сульфатом натрия), фильтровали и удаляли. Остаток подвергали флеш-хроматографированию (Мерк силикагель, 1:1 – этилацетат:гексан), получая 272 мг чистого, указанного в названии, продукта в виде белой пены. d) /4S-/4a/R*/,7a,10аb//-Октагидро-4-//2-меркапто-1-оксо-3-фенилпропил/амино/-5-оксо-7Н-пиридо[2,1-b] /1,3/-тиазепин-7-карбоновая кислота Раствор продукта из части (с) (227 мг, 0,49 ммоля) в метаноле (5 мл, обескислороженный пробулькиванием аргона) обрабатывали при комнатной температуре 1N раствором гидроокиси натрия (8 мл, обескислороженным пробулькиванием аргона). После перемешивания в течение 1 часа смесь подкисляли 10% соляной кислотой, разбавляли водой и экстрагировали этилацетатом. Этилацетатный экстракт промывали водой и рассолом и затем сушили (сульфатом натрия), фильтровали и концентрировали. Полученное твердое вещество смешивали с этилацетатом и собирали фильтрованием. Фильтрат подвергали флеш-хроматографированию (Мерк силикагель, 1% уксусная кислота в этилацетате), и желаемую фракцию собирали, удаляли и растирали со смесью этилацетат/этиловый эфир, получая дополнительно твердое вещество. Твердое вещество собирали, получая общее количество 150 мг указанного в названии продукта, т. пл. 216-217°С (разложение). TLC (2% уксусная кислота в этилацетате) Rf=0,56; [a]D=-72,6°С (с=0,28, диметилформамид). HPLC YMC S 3 ODS колонка (6,0×150 мм): элюируют 40% А: 90% воды - 10% метанола - 02% фосфорной кислоты и 60% В: 10% воды - 90% метанола - 0,2% фосфорной кислоты, скорость потока 1,5 мл/мин, детектирование при 220 нм, tR= =9,48 мин (97,4%). Данные анализа для С 19Н24N2О4S 2 × 0,14 этилацетат Вычислено, %: С 55,82; Н 6,02; N 6,66; S 15,24 Найдено, %: С 55,53; Н 6,01; N 6,63; S 14,91. Пример 4/ /4S-/4a/R*/,7a,9аb//-Октагидро-4-//2-меркапто1-оксо-3-фенилпропил/амино/-5-оксопирроло[2, 1-b]/1,3/оксазепин-7-карбоновая кислота а) /S/-2-фталимидо-5-оксо-5-/фенилметокси/пе нтановая кислота К раствору g-бензил-L-глутамата (17,49 г, 73,70 ммоля) в водной среде (180 мл) карбоната натрия (7,81 г, 73,70 ммоля) и диоксана (120 мл) добавляли N-карбетоксифталимид (16,50 г, 75,27 ммоля, 1,02 экв). После перемешивания при 20 39924 комнатной температуре в течение 4,5 часов реакционную смесь подкисляли 6N соляной кислотой (30 мл.) и экстрагировали этилацетатом (2´ ´400 мл). Объединенные этилацетатные экстракты промыли 50% рассолом (200 мл) и рассолом (200 мл), сушили над сульфатом натрия, фильтровали, концентрировали и сушили в вакууме, получая неочищенное масло (41,4 г). К раствор у неочищенного остатка в этилацетате (100 мл) добавляли дициклогексиламин (14 мл). После пребывания в холодильнике в течение ночи этиловый эфир удаляли на роторном испарителе, и маслообразный остаток кристаллизовали из смеси этилацетат/гексан. Полученный осадок собирали фильтрованием, промывали гексаном и сушили в вакууме, получая 21,21 г указанного в названии продукта в виде дициклогексиламиновой соли. Суспензию этой дициклогексиламиновой соли в этилацетате (200 мл) промывали 5% раствором бисульфата натрия (3×50 мл), рассолом (50 мл) и сушили над сульфатом магния, фильтровали и концентрировали, получая 13,5 г указанного в названии продукта в виде белой пены. TLC (3% уксусная кислота в 9:1 этилацетат:гептане) Rf=0,30. b) Этиловый эфир /S/-2-фталимидо-5-оксо-5/фенилметокси/-пентановой кислоты К раствору продукта из части (а) (13,22 г, 36,0 ммоля) и карбоната цезия (5,86 г, 18,0 ммоля) в диметилформамиде (100 мл) добавляли иодметан (8,1 мл, 129,6 ммоля, 3,6 экв.). Желтый раствор перемешивали в течение 2,5 часов и затем разделяли между этилацетатом (300 мл) и водой (250 мл). Этилацетатный экстракт промывали 5% раствором бикарбоната натрия и рассолом, сушили на сульфатом магния, фильтровали и концентрировали, получая 13,68 г желтого масла. Остаток чистили хроматографически на колонке с силикагелем (5×20 см), элюируя 30% смесью этилацетат/гексан. Желаемые фракции объединяли и концентрировали, получая 10,0 г указанного в названии продукта. TLC (1:1 этилацетат:гексан) Rf=0,45. c) Ме тиловый эфир /S/-2-фталимидо-4-/карбокси/бутановой кислоты К раствору продукта из части (b) (10,0 г, 26,22 ммоля) в этилацетате (115 мл) добавляли 20% гидроокиси палладия на углероде в качестве катализатора (1,90 г) и полученную суспензию перемешивали в атмосфере водорода (баллон) в течение 2,5 часов. Смесь фильтровали, интенсивно промывали этилацетатом, концентрировали и сушили в вакууме с вы ходом 7,29 г неочищенного указанного в названии продукта в виде белого твердого вещества, т. пл. 137-138°С. TLC (10% метанол/метилен хлорид) Rf=0,43. d) Метиловый эфир /S/-2-фталимидо-5-оксо-5/этилтио/-пентановой кислоты К раствору продукта из части (с) (7,27 г, 24,95 ммоля) в метиленхлориде (125 мл) при 0°С в автмосфере аргона добавляли этантиол (4,81 мл, 64,92 ммоля, 2,6 экв.), 4-диметил-аминопиридин (609 мг, 4,99 ммоля, 0,2 экв.) и этил-3-/3ди-метиламино/пропилкарбодиимид гидрохлоридной соли (5,27 г, 27,47 ммоля, 1,1 экв.). После перемешивания при 0°С в течение 2 часов и при комнатной температуре в течение 1 часа реакционную смесь концентрировали, разбавляли этил ацетатом (400 мл) и промывали 5% бисульфатом калия (200 мл) и рассолом (200 мл), сушили над сульфатом натрия, фильтровали, концентрировали и сушили в вакууме с вы ходом 8,30 г указанного в названии продукта в виде неочищенного масла. TLC (1:1, этилацетат:гексан) Rf=0,47. e) Метиловый эфир /S/-2-фталимидо-5-оксопентановой кислоты Суспензию продукта из части (d) (8,30 г, 24,75 ммоля) и 10% палладия на угле (1,24 г) в ацетонитриле (150 мл) в атмосфере аргона обрабатывали по каплям триэтилсиланом (7,91 мл, 49,5 ммоля. 2 экв.). После перемешивания при комнатной температуре в течение 45 минут смесь фильтровали, концентрировали и сушили в вакууме. Неочищенный остаток чистили хроматографически на колонке (5 25 см) с силикагелем, элюируя 25% смесью этилацетат/гексан (4 л) с последующим элюированием 35% смесью этилацетат/гексан (2 л). Желаемые фракции объединяли, получая 5,60 г указанного в названии продукта. TLC (1:1 этилацетат:гексан) Rf=0,32. f) Метиловый эфир /S/-2-фталимидо-5,5-диметоксипентановой кислоты Раствор продукта из части (е) (5,60 г, 20,34 ммоля) в метаноле (60 мл) и метиленхлориде (40 мл) обрабатывали триметиловым эфиром ортомуравьиной кислоты (3,8 мл, 34,59 ммоля, 1,7 экв.) и моногидратом n-толуолсульфоновой кислоты (280 мг). После перемешивания при комнатной температуре в течение 1,5 часа реакцию гасили 2 мл насыщенного раствора бикарбоната натрия, концентрировали и разделяли между этилацетатом (400 мл) и водой (100 мл). Этилацетатный экстракт промывали насыщенным раствором бикарбоната натрия (100 мл), рассолом (100 мл), сушили над сульфатом магния, фильтровали и концентрировали до неочищенного масла. Неочищенный остаток чистили хроматографически на колонке 5×20 см с силикагелем, элюируя 30% смесью этилацетат/гексан (2 л). Желаемые фракции объединяли, концентрировали и сушили в вакууме, получая 6,20 указанного в названии продукта. TLC (1:1 этилацетат/гексан) Rf=0,40. g) метиловый эфир /S/-2-амино-5,5-диметоксипентановой кислоты Раствор продукта из части (f) (6,16 г, 19.18 ммоля) в метаноле (125 мл) обрабатывали гидразинмоногидратом (0,98 мл, 20,14 ммоля, 1,05 экв). После перемешивания при комнатной температуре в течение 6 дней полученный шлам фильтровали, концентрировали, растирали в метиленхлориде, фильтровали, концентрировали и сушили в вакууме с получением 3,57 г указанного в названии продукта в виде мутного масла. TLC (10% метанола в метиленхлоридe) Rf=0,41. h) Метиловый эфир /S-/R*,R*//-2-//2-фталимидо-4-/трифенилметокси/-1-оксобутил/амино-5,5диметоксипентановой кислоты Раствор триэтиламиновой соли /S/-2-фталимидо-4-/трифенилметокси/бутановой кислоты, полученной, как описано в примере 1 (b), (11,62 г, 19,60 ммоля, 1,05 экв.) в метиленхлориде (100 мл) при 0°С обрабатывали бензотриазол-1-илокситрис/диметиламино/фосфонийгексафторфосфатным реагентом (8,67 г, 19,60 ммоля, 1,05 экв.). 21 39924 Смесь перемешивали в течение 45 минут при 0°С, затем обрабатывали раствором продукта из части (g) (3,57 г, 18,67 ммоля) в метиленхлориде (50 мл). Через 10 минут реакции при 0°С и 2 часов - при комнатной температуре, раствор разделяли между этилацетатом (300 мл) и водой (100 мл). Этилацетатный слой промывали 50% насыщенным раствором бикарбоната натрия (100 мл) и рассолом (100 мл), сушили над суль фатом магния, фильтровали и концентрировали. Остаток чистили хроматографически на колонке 5×25 см с силикагелем, элюируя смесь 1:1 этилацетат/гексан, с получением 8,58 г указанного в названии продукта. TLC (1:1 этилацетат/гексан) Rf=020. і) Метиловый эфир /S-/R*,R*//-2-//2-фталимидо-4-гидрокси-1-оксобутил/амино/-5,5-диметоксипентановой кислоты Раствор продукта из части (h) (8,58 г, 12,91 ммоля) в метаноле (100 мл) обрабатывали моногидратом n-толуолсульфоновой кислоты (850 мг). После перемешивания при комнатной температуре в течение 3,5 часов смесь разделяли между этилацетатом (200 мл) и 10% насыщенным раствором бикарбоната натрия (100 мл). Фазы разделяли и водный слой экстрагировали вновь этилацетатом (100 мл). Объединенные этилацетатные экстракты промывали рассолом, сушили над сульфатом магния, фильтровали и концентрировали. Остаток чистили хроматографически на колонке 5×20 см с силикагелем, элюируя 8:2 смесью этилацетат:гексан (1 л) с последующим элюированием 1% метанолом в этилацетате (2 л). Желаемые фракции объединяли, концентрировали и сушили в вакууме, получая 4,33 г указанного в названии соединения. TLC (8:2 этилацетат:гексан) Rf=0,21. j) Метиловый эфир /4S-/4a,7a,9аb/-октагидро4-фталимидо-5-оксопирроло [2,1-b]/1,3/оксазепин7-карбоновой кислоты Раствор продукта из части (i) (1,89 г, 4,48 ммоля) в метиленхлориде (90 мл) обрабатывали ионообменной смолой - Амберлит®15 (400 мг, предварительно последовательно промытой 6N соляной кислотой, водой, тетрагидрофураном и метиленхлоридом). После перемешивания при комнатной температуре в течение 3 часов раствор фильтровали, концентрировали и подвергали флеш-хроматографированию на колонке 5×15 см с силикагелем, элюируя смесью 6:4 этилацетат/гексан, получая 1,51 г указанного в названии продукта в виде белой пены. TLC (8:2 этилацетат - гексан) Rf=0,32. k) Метиловый эфир /4S-/4a,7a,9аb/- -4-аминооксагидро-5-оксопирроло[2,1-b]/1,3/оксазепин-7карбоновой кислоты Продукт из части (j) (764 г, 2,13 ммоля) в метаноле (15 мл) обрабатывали гидразинмоногидратом (109 мкл, 2,24 ммоля, 1,05 экв.) и раствор перемешивали при комнатной температуре в течение 4 дней. Смесь фильтровали, и твердое вещество промывали метанолом. Фильтрат концентрировали, растирали с метиленхлоридом, вновь фильтровали и концентрировали. Остаток чистили хроматографически на колонке 2×15 см с силикагелем, элюируя 3% метанолом в метиленхлориде (3 л). Желаемые фракции объединяли и концентрировали с получением 451 мг указанного в на звании продукта в виде масла. TLC (10% метанола в метиленхлориде) Rf=0,18. I) Метиловый эфир /4S-/4a/R*/,7a,9аb//-октагидро-4-//2-/ацетилтио/-1-оксо-3-фенилпропил/амино/-5-оксо-пирроло[2,1-b]/1,3/-оксазепин-7-карбоновой кислоты Суспензию дициклогексиламиновой соли /S/-2ацетилтио-3-бензолпропановой кислоты (полученной, как описано в примере 1 (h), 870 мг, 2,14 ммоля, 1,14 экв.) в этилацетате (70 мл) промывали 5% раствором бисульфата калия (5×20 мл), 50% рассолом (20 мл) и рассолом (20 мл), сушили (безводным сульфатом натрия). Фильтровали, концентрировали и сушили в вакууме в течение ночи, получая /S/-2-/ацeтилтио/бензолпропановую кислоту. Эту свободную кислоту растворяли в сухом метиленхлориде (10 мл), охлаждали до 0°С (в бане - лед с солью) и обрабатывали триэтиламином (298 мкл, 2,14 ммоля) с последующей обработкой раствором продукта из части (k) (430 мг, 1,88 ммоля) в метиленхлориде (10 мл) и бензотриазол-1илокситрис/-диметиламино/фосфонийгексафторфосфа том (947 мг, 2,14 ммоля, 1,14 экв.). Полученный раствор перемешивали при 0°С в течение 50 минут и затем при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали, разбавляли этилацетатом (150 мл), промывали 0,5N соляной кислотой (50 мл), водой (50 мл), насыщенным раствором бикарбоната натрия (50 мл), водой (50 мл) и рассолом (50 мл), сушили (безводным сульфатом магния), фильтровали и выпаривали досуха. Неочищенный продукт адсорбировали на целите (CeliteR) и хроматографировали на колонке с силикагелем (5×10 см), элюируя 60% смесью этилацетат/гексан (3 л). Желаемые фракции объединяли и концентрировали, получая 779 мг чистого указанного в названии продукта. TLC (6:4 этилацетат:гексан) Rf=0,17. m) /4S-/4a/R*/,7a,9ab//-Октагидро-4-//2-меркапто-1-оксо-3-фенилпропил/амино/-5-оксопирроло[2, 1-b]/1,3/оксазепин-7-карбоновая кислота Раствор продукта из части (l) (754 мг, 1,74 ммоля) в метаноле (15 мл) продували аргоном в течение 30 минут, о хлаждали до 0°С (баня лед с солью), затем по каплям обрабатывали предварительно продутым (аргоном, в течение 30 минут) раствором 1,0 N гидроокиси натрия (12 мл), продолжая пробулькивание аргона в течение дополнительного времени протекания реакции. Реакционную смесь перемешивали при 0°С в течение 3 часов, подкисляли при 0°С 5% раствором бисульфата калия до рН 1, затем экстрагировали этилацетатом (3х100 мл). Объединенные органические экстракты промывали 50% рассолом (100 мл), рассолом (100 мл), сушили (безводным сульфатом натрия), фильтровали, выпаривали досуха и сушили в вакууме, получая белую пену. Остаток чистили хроматографически на колонке 2,5´ ´15 см с силикагелем, элюируя этилацетатом (500 мл) и 0,3% уксусной кислотой в этилацетате (1 л). Желаемые фракции концентрировали, удаляли хлороформом и сушили в вакууме в течение ночи при 50°С над пятиокисью фосфора, получая указанный в названии продукт в виде белой пены, т. пл. 88-92°С, [a]D=(с=1,0, метанол). TLC (1% уксусная кислота в этилацетате) Rf=0,24. 22 39924 1 нии соединения в виде масла. TLC (8:2 этилацетат:гексан) Rf=0,43. c) Ме тиловый эфир /4S-/4a,7a,9аb//-октагидро4-фталимидо-5-оксопирроло[2,1-b]/1,3/тиазепин-7карбоновой кислоты Раствор продукта из части (b) (847 мг, 1,93 ммоля) в метиленхлориде (20 мл) обрабатывали ионообменной смолой - Амберлитâ 15 (700 мг, предварительно последовательно промытой 6 N соляной кислотой, водой, тетрагидрофураном и метиленхлоридом). После перемешивания при комнатной температуре в течение 17 часов раствор фильтровали, концентрировали и подвергали флеш-хроматографированию на колонке 2,5×15 см с силикагелем, элюируя смесь 1:1 этилацетат:гексан, получая 691 мг указанного в названии продукта в виде белой пены. TLC (8:2 этилацетат:гексан) Rf=0,48. d) Метиловый эфир /4S-/4a,7a,9ab//-4-аминооктагидро-5-оксопирроло[2,1-b]/1,3/тиазепин-7-карбоновой кислоты Продукт из части (с) (899 мг, 2,40 ммоля) в метаноле (17 мл) обрабатывали гидразинмоногидратом (122 мкл, 2,52 ммоля, 1,05 экв.) и раствор перемешивали при комнатной температуре в течение 3 дней. Смесь фильтровали, и твердое вещество промывали метанолом. Фильтрат концентрировали, растирали с метиленхлоридом, вновь фильтровали, концентрировали и сушили в вакууме, получая 572 мг указанного в названии продукта в виде мутного масла. TLC (10% метанол в метиленхлориде) Rf=0,13. e) Метиловый эфир /4S-/4a/R*/,7a,9ab/-октагидро-4-//2-/ацетилтио/-1-оксо-3-фенилпропил/амино/-5-оксо-пирроло[2,1-b]/1,3/тиазепин-7-карбоновой кислоты Суспензию дициклогексиламиновой соли /S/-2/ацетилтио/-бензолпропановой кислоты (полученной, как описано в примере 1 (h), (1,045 г, 2,58 ммоля, 1,1 экв.) в этилацетате (100 мл) промывали 5% раствором бисульфата калия (5×25 мл), 50% рассолом (25 мл) и рассолом (25 мл), сушили (безводным сульфатом натрия), фильтровали, концентрировали и сушили в вакууме в течение 1 часа, получая /S/-2-/ацетилтио/-бензолпропановую кислоту. Эту свободную кислоту растворяли в сухом метиленхлориде (10 мл), охлаждали до 0°С (в бане - лед с солью) и обрабатывали триэтиламином (360 мкл, 2,58 ммоля), бензотриазол-1-илокситрис/диметиламино/фосфонийгексафторфосфатом (1,141 г, 2,58 ммоля) и затем раствором продукта из части (d) (572 мг, 2,34 ммоля) в метиленхлориде (10 мл). Полученный раствор перемешивали при 0°С в течение 30 минут и затем при комнатной температуре в течение 2,5 часов. Реакционную смесь концентрировали. разбавляли этилацетатом (100 мл), промывали 0,5 N соляной кислотой (50 мл), водой (50 мл), насыщенным раствором бикарбоната натрия (50 мл), водой (50 мл) и рассолом (50 мл), сушили (безводным сульфатом магния), фильтровали и выпаривали досуха. Неочищенный продукт адсорбировали на целите и подвергали хроматографированию на колонке (5×10 см) с силикагелем, элюируя 25% (5 л), 30% (2 л) и 40% (2 л) смесью этилацетат/гексан. Смешанные фракции объединяли и повторно хрома H-NMR: 400 MHz; CDCI3:d 1,80-2,31 (m's , 7H), 3,10 (m, 1Н), 3,27 (m, 1H), 3,63 (m, 1H), 4,0 (m, 1H), 4,20 (m, 1H), 4,49 (m, 1H), 4,75 (m, 1H), 5,23 (m, 1H), 7,19-7,30 (m’s, 5Н), 7,52 (d, 1H, J=6 Hz). 13 C-NMR: 100 MH z; CDCI3:d 26,4, 32,0, 32,6, 41,2, 44,2, 53,0. 59.4, 70,6, 89,47, 126,9, 128,4. 129,3, 137,4, 171,2, 171,6, 174,8. Данные анализа для С19Н22N2О 5S × 0,85 Н2O Вычислено, %: С 54,91; Н 6,07; N 7,12; S 8,14 Найдено, %: C 54,85; H5,68; N 7,18; S8,14. HPLC: tR=13,5 мин (96,7%, УФ 220): YMCS 30DS (C-18) 6,0×150 мм 30% В:А - 100% В: A, 25 мин линейный градиент (А=90% вода/метанол 0,2% фосфорной кислоты В=90% метанол/вода+ +0,2% фосфорной кислоты) скорость потока 1,5 мл/мин. Пример 5. /4S-/4a/R*/,7a,9аb//-Октагидро-4-//2-меркапто1-оксо-3-фенилпропил/амино/-5-оксопирро-ло[2, 1-b]/1,3/тиазепин-7-карбоновая кислота a) Метиловый эфир /S-/R*,R*//-2-//2-фталимидо-4-/ацетилтио/-1-оксобутил/амино/-5,5-диметоксипентановой кислоты Раствор трифенилфосфина (1,26 г, 4,79 ммоля) при 0°С в сухом тетрагидрофуране (15 мл) обрабатывали диизопропил азодикарбоксилатом (943 мкл, 4,79 ммоля). Полученный белый шлам перемешивали в течение 30 минут и затем обрабатывали раствором метилового эфира /S-/R*, R*//-2-//2-фталимидо-4-гидрокси-1-оксобутил/амино/-5,5-диметоксипентановой кислоты (полученной, как описано в примере 4 (і), 1,35 г, 3,20 ммоля) в сухом тетрагидрофуране (15 мл) с последующей обработкой слабой тиолуксусной кислотой (343 мкл. 4,79 ммоля). Смесь перемешивали при 0°С в течение 1,5 часов и затем разделяли между этилацетатом (150 мл) и 50% раствором бикарбоната натрия (100 мл). Этилацетатный слой промывали рассолом, сушили над сульфатом магния, фильтровали, концентрировали, поглощали на целит и сушили в вакууме. Неочищенное вещество чистили хроматографически на колонке 2,5×15 см с силикагелем, элюируя 1:1 смесью этилацетат:гексан (1 л) и 6:4 этилацетат:гексан (1 л). Желаемые фракции объединяли, концентрировали и сушили в вакууме, получая 1,35 г указанного в названии продукта в виде масла. TLC (8:2 этилацетат:гексан) Rf=0,42 b) Метиловый эфир /S-/R*,R*//-2-//2-фталимидо-4-меркапто-1-оксобутил/амино/-5,5-диметоксипентановой кислоты Обескислороженный (пробулькиванием аргона) раствор продукта из части (а) (1,33 г, 2,76 ммоля) в метаноле (25 мл) при 0°С обрабатывали метоксидом натрия (25 вес.% в метаноле). 1,52 мл. 6,63 ммоля. 2,4 экв./. Через 3 минуты смесь гасили насыщенным раствором хлористого аммония (3 мл), разбавляли водой и экстрагировали этилацетатом (100 мл). Этилацетатный экстракт промывали водой (50 мл) и рассолом (50 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Остаток чистили хроматографически на колонке 5×15 см с силикагелем, элюируя 1:1 (3 л), с последующим элюированием 8:2 (2 л) смесью этилацетат:гексан. Фракции, содержащие желаемый продукт, объединяли, концентрировали, получая 853 мг указанного в назва 23 39924 тографировали, элюируя с тем же градиентом. Желаемые фракции объединяли и концентрировали, получая 490 мг чистого, указанного в названии, продукта. TLC (1:1 этилацетат:гексан) Rf= =0.16. f) /4S-/4a/R*/,7a,9аb//-Октагидро-4-//-2-меркапто-1-оксо-3-фенилпропил/амино/-5-оксопирроло[2, 1-b] /1,3/тиазепин-7-карбоновая кислота Раствор продукта из части (е) (490 мг, 1,09 ммоль) в смеси метанол:тетрагидрофуран (8 мл:4 мл) продували аргоном в течение 30 минут, о хлаждали до 0°С (в бане - лед с солью) и затем обрабатывали по каплям предварительно продутым (аргоном в течение 30 минут) раствором 1,0 N гидроокиси натрия (10 мл), пробулькивая аргон в течение добавления и протекания реакции. Реакционную смесь перемешивали при 0°С в течение 3 часов, подкисляли при 0°С 5% раствором бисульфата калия до рН 2 и затем экстрагировали этилацетатом (3×75 мл). Объединенные органические экстракты промывали рассолом (75 мл), сушили (безводным сульфатом магния), фильтровали, выпаривали досуха и сушили в вакууме, получая белую пену (489 мг). Остаток чистили хроматографически на колонке (2,5×15 см) с силикагелем, элюируя смесью этилацетат:гептан 9:1 (400 мл) и 0,5% уксусной кислотой в 9:1 смеси этилацетат:гептан (1 л). Желаемые фракции концентрировали, удаляли смесью метиленхлорид/гептан и сушили в вакууме, получая 428 мг продукта. Чистое ве щество перекристаллизовывали из смеси этилацетат/метанол/гексан. Кристаллы собирали фильтрованием, интенсивно промывали этиловым эфиром и сушили в вакууме в течение ночи при 40°С над пятиокисью фосфора, получая 305 мг указанного в названии продукта в виде белых кристаллов, т. пл. 206-208°С, [a]D=-96,3° (с= =1,0, метанол). TLC (5% уксусная кислота в 9:1 смеси этилацетат:гептан) Rf=0,29 1 H-NMR; 400 Hz; CDCI3 w/2 drops CD3OD: d 1,94 (m. 1Н), 2,02 (d, 1H, J = 9 Hz), 2,08 (m, 1Н). 2,20-2,55 (m’s, 4H), 2,95 (m, 1H), 3,08 (m, 1H), 3,23 (m, 1H), 3,27 (m, 1H), 3,59 (m, 1H), 4,54 (t, 1H, J = =7,3 Hz), 4,60 (m, 1H), 5,23 (m, 1H), 7,18-7,34 (m's , 5H), 7,63 (d, 1H, J = 6 Hz). 13 С-NMR: 100 MH z; CDCI3 w/2 drops CD 3OD: d 27,6, 31,1, 32,1, 32,9. 41,1, 44,0, 52,8, 60,4, 62,2, 126,77, 128,3, 129,0, 137,4, 170,2, 171,4, 172,6. Данные анализа для С18Н22N2О 4S2×0,08 Н2О. Вычислено, %: С 54,60; Н 5,64; N 7,07; S 16,19 Найдено, %: С 54,65; Н 5,54; N 7,02; S 15,80. HPLC: tR = 13,0 мин (98,8%, УФ 220): YMC S-3 ODS (C-18) 6,0×150 мм; 40% В:А - 100% В:A, 25 минут линейный градиент (А=90% вода/метанол+ +0,2% фосфорной кислоты; В=90% метанол/вода+ +0,2% фосфорной кислоты) скорость потока 1,5 мл/мин. Пример 6. /4S-/4a/R*/,7a,9аb//-Октагидро-4-//2-меркапто1-оксо-3-фенилпропил/амино/-5-оксопирро-ло[2, 1-b]/1,3/тиазепин-7-карбоновая кислота Продукт примера 5 был также приготовлен как показано далее: а) N-//Фенилметокси/карбонил/-L-гомосерин N-/Бензилоксикарбонилокси/сукцинимид (23,57 г, 94,58 ммоля) добавляли в раствору Lгомосерина (10,24 г, 85,98 ммоля) и бикарбоната натрия (7,95 г, 94,58 ммоля,1,1 экв.). В смеси воды (100 мл) и ацетона (100 мл). Смесь перемешивали при комнатной температуре в течение ночи. Ацетон удаляли при пониженном давлении (на роторном испарителе), и водный раствор промывали метиленхлоридом (2×75 мл). Затем водный слой подкисляли до рН 2 добавлением 6N соляной кислоты и экстрагировали этилацетатом (2×25 мл). Объединенные этилацетатные слои промывали водой (2×100 мл) и рассолом, сушили над сульфатом натрия, фильтровали, концентрировали и сушили в вакууме, получая 19,54 г указанного в названии продукта в виде белого твердого вещества. TLC (этилацетат:н-бутанол:уксусная кислота:вода 2:1:1:1) Rf=0,74. b) N-//Фенилметокси/карбонил/-О-/трифенилметил-L-гомосерин К суспензии продукта из части (а) (19,54 г, 77,04 ммоля) в хлороформе (250 мл) добавляли триэтиламин (12,35 мл, 88,59 ммоля, 1,15 экв.). Гомогенную смесь обрабатывали трифенилметилхлоридом (24,70 г, 88,59 ммоля), и реакционную смесь перемешивали в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении (на роторном испарителе), разделяли между этилацетатом (400 мл) и 5% раствором бисульфата калия (200 мл). Этилацетатный слой промывали 5% раствором бисульфата калия (200 мл), водой (2×200 мл), и рассолом (200 мл), сушили над сульфатом натрия, фильтровали и концентрировали, получая 45,4 г вещества. Остаток хроматографировали на колонке 10×30 см с силикагелем, элюируя смесью 6:4 этилацетат:гексан (2 л) с последующим элюированием 1% уксусной кислотой в смеси 8:2 этилацетат:гексан, получая 8,76 г чистого указанного в названии продукта. c) Ме тиловый эфир /S/-2-амино-5,5-диметоксипентановой кислоты Метиловый эфир /S/-2-фталимидо-5,5-диметоксипентановой кислоты (полученный, как описано в примере 4 (f), 3,35 г, 10,43 ммоля) в метаноле (70 мл) обрабатывали гидразинмоногидратом (531 мкл, 10,95 ммоля, 1,05 экв.), и раствор перемешивали при комнатной температуре в течение 6 дней. Смесь фильтровали, и твердое вещество промывали метанолом. Фильтрат концентрировали, растирали с метиленхлоридом, вновь фильтровали, концентрировали и сушили в вакууме, получая 1,89 г указанного в названии продукта в виде мутного масла. TLC (10% метанол в метиленхлориде) Rf=0,39. d) Метиловый эфир /S-/R*,R*//-2-//2-///фенилметокси/карбонил/амино/-4-/трифенилметокси/-1оксобутил/амино/-5,5-диметоксипентановой кислоты Раствор продукта из части (b) (528 г, 10,65 ммоля, 1,1 экв.) в сухом метиленхлориде (50 мл) обрабатывали при 0°С триэтиламином (1,48 мл, 10,65 ммоля) с последующей обработкой продуктом из части (с) (1,85 г. 9,68 ммоля) в сухом метиленхлориде (30 мл) в бензотриазол-1-илокситрис/диметиламино/фосфонийгексафторфосфатом (4,71 г, 10,65 ммоля, 1,1 экв.). Смесь перемешивали в течение 1 часа при 0°С и затем перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разделяли между этилацетатом (300 мл) и водой (150 мл). Этилацетат 24 39924 ный слой промывали 50% насыщенным раствором бикарбоната натрия (200 мл) и рассолом (2´ ´200 мл), сушили над сульфатом магния, фильтровали, концентрировали, адсорбировали на целите и чистили на колонке 7×20 см с силикагелем, злюируя 40% смесью этилацетат/гексан (3 л) с последующим элюированием 50% (2 л) смесью этилацетат/гексан, получая 4,84 г указанного в названии продукта. TLC (этилацетат/гексан 1:1) Rf=0,22. e) Метиловый эфир /S-/R*,R*//-2-//2-///фенилметоксм/карбонил/амино/-4-гидрокси-1-оксобутил/амино/-5,5-диметоксипентановой кислоты Раствор продукта из части (d) (4,80 г, 7,18 ммоля) в метаноле (70 мл) обрабатывали моногидратом n-толуолсульфоновой кислоты (300 мг). После перемешивания при комнатной температуре в течение 2 часов смесь разделяли между этилацетоном (400 мл) и 25% насыщенным раствором бикарбоната натрия (200 мл). Фазы разделяли, и водный слой вновь экстрагировали этилацетатом (100 мл). Объединенные этилацетатные экстракты промывали рассолом, сушили над сульфатом магния, фильтровали и концентрировали. Остаток чистили хроматографически на колонке 5×20 см с силикагелем, элюируя 7:3 (1 л), 8:2 (1 л) смесью этилацетат:гексан с последующим элюированием 10% метанолом в этилацетате (2 л). Желаемые фракции объединяли, концентрировали и сушили в вакууме, получая 2,92 г указанного в названии продукта. TLC (этилацетат:гексан 8:2) Rf=0,09. f) Метиловый эфир /S-/R*,R*//-2-//2-///фенилметокси/карбонил/амино-4-/ацетилтио/-1-оксобутил/амино-5,5-диметоксипентановой кислоты Раствор трифенилфосфина (3,06 г, 11,65 ммоля, 1,7 экв.) в сухом тетрагидрофуране (40 мл) при 0°С обрабатывали диизопропилазадикарбоксилатом (2,29 мл, 11,65 ммоля). Полученный белый шлам перемешивали в течение 30 минут и затем обрабатывали раствором продукта из части (е) (2,92 г, 6,85 ммоля) в сухом тетрагидрофуране с последующей обработкой слабой тиолуксусной кислотой (833 мкл, 11,65 ммоля). Смесь перемешивали при 0°С в течение 2 часов и затем разделяли между этилацетатом (300 мл) и 50% раствором бикарбоната натрия (200 мл). Этилацетатный слой промывали рассолом, сушили над сульфатом магния, фильтровали, концентрировали, адсорбировали на целит и сушили в вакууме. Неочищенное вещество чистили хроматографически на колонке 5×20 см с силикагелем, элюируя смесью этилацетат:гексан 1:1 (3 л). Желаемые фракции объединяли, концентрировали и сушили в вакууме, получая 2,58 г указанного в названии продукта в виде сверхбелого твердого продукта. TLC (этилацетат:гексан, 8:2) Rf=0,40. g) Метиловый эфир /S-/R*,R*//-2-//2-///фенилметокси/карбонил/амино/-4-меркапто-1-оксобутил/амино/-5.5-диметокси-пентановой кислоты Обескислороженный (пробулькиванием аргона) раствор продукта из части (f) (2,56 г, 5,28 ммоля) в метаноле (50 мл) при 0°С обрабатывали метоксидом натрия (25 вес.% в метаноле, 3,62 мл, 15,84 ммоля, 3 экв.). Через 10 минут смесь гасили насыщеным раствором хлористого аммония (40 мл), разбавляли водой (100 мл) и экстрагировали этилацетатом (300 мл). Этилацетатный экс тракт промывали водой (100 мл) и рассолом (150 мл), сушили над сульфатом магния, фильтровали и концентрировали. Остаток чистили хроматографически на колонке 5×20 см с силикагелем, элюируя 1:1 (3 л) смесью этилацетат:гексан. Желаемое соединение объединяли и концентрировали, получая 1,99 г указанного в названии продукта в виде масла. TLC (этилацетат:гексан, 8:1) Rf=0,43. h) Метиловый эфир /4S-/4a,7a,9аb//-октагидро-4-///фенилметоксикарбонил/амино/-5-оксопирроло[2,1-b]/1,3/-тиазепин-7-карбоновой кислоты Раствор продукта из части (g) (2,16 г, 4,88 ммоля) в метиленхлориде (50 мл) обрабатывали ионообменной смолой - Амберлитом ® 15 (620 мг, предварительно последовательно промытой 6 N соляной кислотой водой, тетрагидрофураном и метиленхлоридом). После перемешивания при комнатной температуре в течение 3 часов раствор фильтровали, концентрировали и подвергали флеш-хроматографированию на колонке 5´ ´20 см с силикагелем, элюируя 6:4 смесью этилацетат:гексан, получая 1,34 г указанного в названии продукта в виде белой пены. TLC (этилацетат:гексан, 8:2) R f=0,51. і) Метиловый эфир /4S-/2a,7a,9аb//-4-аминооктагидро-5-оксопирроло[2,1-b]/1,3/тиазепин-7-карбоновой кислоты Раствор продукта из части (h) (1,20 г, 3,17 ммоля, удаленный толуолом три раза и высушенный в вакууме в течение ночи) в сухом метиленхлориде (40 мл) обрабатывали иодтриметилсиланом (632 мкл, 4,44 ммоля, 1,4 экв.) и перемешивали при комнатной температуре в атмосфере аргона в течение 1,5 часов. Смесь гасили водой (50 мл), обрабатывали 10% соляной кислотой (5 мл, рН 1) и промывали этилацетатом (50 мл). Водную фазу обрабатывали 10% раствором гидроокиси натрия и экстрагировали метиленхлоридом (три раза). Собранные экстракты сушили над сульфатом натрия, фильтровали, концентрировали и сушили в вакууме, получая 396 мг указанного в названии продукта в виде прозрачного масла. TLC (10% метанол в метиленхлориде) Rf=0,10. j) /4S-/4a/R*/,7a,9ab//-Октагидро-4-//2-меркапто-1-оксо-3-фенилпропил/амино/-5-оксопирроло[2, 1-b]/1,3/-тиазепин-7-карбоновая кислота Раствор /S/-2-/ацетилтио/бензолпропановой кислоты в сухом метиленхлориде обрабатывали триэтиламином. Затем добавляли раствор продукта из части (і) в метиленхлориде с последующим добавлением бензотриазол-1-илокситрис/диметиламино/фосфонийгексафторфосфата. Полученный раствор обрабатывали, как описано в примере 5 (е), получая метиловый эфир /4S-/4a/R*/,7a,9аb//-окстагидро-4-//2-ацетилтио/-1-оксо-3-фенилпропил/амино/-5-оксопирроло[2,1-b]/1,3/- тиазепин-7-карбоновой кислоты. Суспензию этого метилового эфира в смеси метанол:тетрагидрофуран продували аргоном, охлаждали до 0°С и обрабатывали предварительно продутым 1,0 N раствором гидроокиси натрия. Обрабатывали таким образом, как описано в примере 5 (f), и получали указанный в названии продукт. 25 39924 Пример 7. /4S-/4a/R*/,7a,9аb//-Окстагидро-4-//3-циклогексил-2-меркапто-1-оксопропил/амино/-5-оксопирроло[2,1-b]/1,3/-тиазепин-7-карбоновая кислота а) Соль метилового эфира /4S-/4a,7a,9аb//-4аминооксагидро-5-оксопирроло[2,1-b]/1,3/тиазепин-7-карбоновой кислоты и n-толуолсульфоновой кислоты. Раствор метилового эфира /4S-/4a,7a,9аb//октагидро-4-///фенилметокси/карбонил/амино/-5оксопирроло[2,1-b]-/1,3/-тиазепин-7-карбоновой кислоты (полученный, как описано в примере 6 (h), 738 мг, 1,95 ммоля, удаленный три раза толуолом и высушенный в вакууме в течение ночи) в сухом метиленхлориде (25 мл) обрабатывали иодтриметилсиланом (389 мкл, 2,73 ммоля, 1,4 экв.) и перемешивали при комнатой температуре в атмосфере аргона. Через 2 часа реакционную смесь обрабатывали дополнительным количеством иодтриметилсилана (40 мкл) и перемешивали в течение 30 минут. Смесь гасили 0,4 М соляной кислотой в растворе метанол:диоксан (9:1,9,7 мл) и перемешивали в течение 5 минут. Летучие удаляли в вакууме (на роторном испарителе), и остаток разделяли между водой и этилацетатом. Отделенный этилацетатный слой промывали водой, и объединенные водные фазы промывали этилацетатом. Водные фазы охлаждали до 0°С и доводили рН до 10,3 (по показаниям рН-метра) 1,0 N раствором гидроокиси натрия. Водную фазу экстрагировали метиленхлоридом (три раза) и затем водную фазу насыщали солью и вновь экстрагировали метиленхлоридом (три раза). Собранные экстракты сушили над сульфатом натрия, фильтровали, концентрировали и сушили в вакууме, получая 455 мг свободного амина в виде прозрачного масла, TLC (10% метанола в метиленхлориде) Rf=0,28. Этот свободный амин растворяли в этилацетате (5 мл) и обрабатывали раствором моногидрата n-толуолсульфоновой кислоты (354 мг, 1 экв) в этилацетате (1 мл). Немедленно образовывались белые кристаллы. Кристаллы держали в холодильнике (5°С) в течение 30 минут и затем собирали фильтрованием, хорошо промывая этилацетатом, и высушивали в течение ночи в вакууме с получением 639 мг указанного в названии продукта в виде белого твердого вещества. b) Дициклогексиламиновая соль /S/-2-/ацетилтио/-3-циклогексилпропионовой кислоты Раствор D-фенилаланина (5,20 г, 31,5 ммоля) в 2 М растворе соляной кислоты (75 мл) в 500 мл сосуде для гидрирования (Parr) продували газообразным азотом и обрабатывали оксидом платины (640 мг, 2,82 ммоля). Гидрирование начинали при давлении Р0»3 кг/см 2 в откаченной склянке, наполняя вновь, если необходимо. Полное количество поглощенного водорода было около 5,8 кг/см 2 (теоретически 5,86 кг/см 2) в течение 6 часов. Реакционную смесь продували газообразным азотом и фильтровали через целит, промывая остаток на фильтре горячей водой. Фильтрат концентрировали до, около, 40 мл и хранили в течение ночи при 5°С. Полученные твердые вещества собирали, промывали небольшим количеством холодной воды и сушили в вакууме при 60°С, получая 5,46 г гидрохлоридной соли /R/-2-амино-3-циклогексилпропановой кислоты. К перемешиваемому раствору этой гидрохлоридной соли (2,81 г, 13,5 ммоля) в 2,5 N серной кислоте (32 мл) при комнатной температуре добавляли бромид калия (10,0 г, 84 ммоля). Реакционную смесь охлаждали до -4°С и добавляли порциями в течение 1 часа твердый нитрит натрия (1,75 г, 25,4 ммоля), поддерживая температуру ниже 0°С. Реакционная смесь вспенивалась, и начинало образовываться масло. После окончания добавления реакционную смесь перемешивали в течение 1 часа и затем нагревали до комнатной температуры и перемешивали еще 1 час. Реакционную смесь затем дважды экстрагировали эфиром, экстракты сушили (сульфатом магния), фильтровали и выпаривали, получая 2,3 г /R/-2бром-3-циклогексилпропионовой кислоты в виде бесцветного масла. К перемешиваемому шламу тиоацетата калия (1,07 г, 9,36 ммоля) в сухом ацетонитриле (15 мл) при 0°С в атмосфере аргона добавляли раствор /R/-2-бром-3-циклогексилпропановой кислоты (2,20 г, 9,36 ммоля) в ацетонитриле (3 мл) в течение 10 минут. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 часов. Полученный шлам фильтровали и выпаривали. Остаток вновь растворяли в этилацетате, промывали один раз 5% раствором бисульфата калия, сушили (сульфатом натрия) и выпаривали. Маслообразный желтый остаток (2,21 г) растворяли в эфире и обрабатывали раствором дициклогексиламина (1,8 мл, 9,0 ммоля) в 5 мл эфира. Царапанье поверхности склянки стеклянным стержнем давало 2,38 г белых кристаллов указанного в названии продукта, т. пл. 159-161°С, [a]D= -41,2° (с=1,0, хлороформ). Данные анализа для С23Н41NSO3 : Вычислено, %: С 67,11; Н 10,04; N 3,40; S 7,79 Найдено, %: С 66,95; Н 10,12; N 3,25; S 7,89. c) Ме тиловый эфир /4S-/4a/R*/,7a,9аb/-окстагидро-4-//2-/ацетилтио/-3-цикпогексил-1-оксопропил/амино/-5-оксо-пирроло(2,1-b]/1,3/тмазепин-7карбоновой кислоты Суспензию дициклогексиламиновой соли /S/-2/-ацетилтио/-3-циклогексилпропановой кислоты (285 г, 0,69 ммоля, 1,05 экв.) в этилацетате (15 мл) промывали 5% раствором бисульфата калия (3´ ´10 мл), 50% рассолом (10 мл) и рассолом (10 мл), сушили (безводным сульфатом магния), фильтровали, концентрировали, удаляли метиленхлоридом (дважды) и сушили в вакууме в течение 1 часа, получая /S/-2-/-3-циклогексилпропановую кислоту в виде масла. Эту свободную кислоту растворяли в сухом метиленхлориде (5 мл), охлаждали 0°С (баня со льдом) и обрабатывали триэтиламином (96 мкл, 0,69 ммоля. 1,05 экв.), затем продуктом из части (а) (275 мг, 0,66 ммоля), триэтиламином (92 мкл, 0,66 ммоля) и, наконец, бензотриазол-1-илокситрис/диметиламино/фосфонийгексафторфосфатом/ 305 мг, 0,69 ммоля. Полученный раствор перемешивали при 0°С в течение 1 часа и затем при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали, разбавляли этилацетатом, промывали 5% раствором бисульфатом калия (20 мл), 50% насыщенным раствором 26 39924 бикарбоната натрия (20 мл), рассолом (20 мл), сушили (безводным сульфатом магния), фильтровали и выпаривали досуха. Неочищенный продукт адсорбировали на целит и хроматографировали на колонке с силикагелем (2,5×10 см), элюируя 40% (1 л) смесью этилацетат/гексан. Желаемые фракции объединяли и концентрировали, получая 265 мг чистого, указанного в названии, продукта. TLC (этилацетат гексан, 8:2) Rf=0,53. d) /4S-/4a/R*/,7a,9ab//-Октагидро-4-//3-циклогексил-2-меркапто-1-оксопропил/амино/-5-оксопирро ло[2,1-b]/1,3/тиазепин-7-карбоновая кислота Раствор продукта из части (с) (245 мг, 0,54 ммоля) в метаноле (6 мл), продутый аргоном в течение 30 минут, о хлажденный до 0°С обрабатывали по каплям предварительно продутым (аргоном в течение 30 минут) раствором 1,0 N гидроокиси натрия (5 мл), продолжая пробулькивание аргона в течение добавления раствора и протекания реакции. Реакционную смесь перемешивали при 0°С в течение 2 часов, подкисляли при 0°С 5% раствором бисульфита калия до рН 2, затем экстрагировали этилацетатом (3×20 мл). Объединенные органические экстракты промывали 50% рассолом (20 мл) и рассолом (20 мл), сушили (безводным сульфатом магния), фильтровали и выпаривали досуха. Остаток чистили хроматографически на колонке (2,5×10 см) с силикагелем, элюируя 7:3 смесью этилацетат:гептан (300 мл) и 1% уксусной кислотой в 7:3 смеси этилацетата/гептана (500 мл). Желаемые фракции концентрировали, удаляли метиленхлоридом и сушили в вакууме, получая 172 мг указанного в названии продукта в виде белой пены: [a]D= -116,9° (с=0,5 метанол). TLC (1% уксусная кислота в этилацетате) Rf=0,35. 1 H-NMR: 400 MHz; CDCI3:d 0,91 (m,2Н), 1,22 (m,3Н), 1,44 (m,1H), 1,55 (m,1H), 1,68 (m’S,5H), 1,83 (m,1Н), 1,97 (m'S,2H), 2,12 (m,1H), 2,19-2,40 (m’S,3H), 2,53 (m,1), 2,96 (m,1H), 3,38 (m'S,2H), 4,62 (t 1H,J=6,8 Hz), 4,70(m,1H), 5,25 (m,1H), 7.. 55(d, 1H,J=6,4 Hz). 13 C-NMR: 100 MH z; CDCI3:d 26,0, 26,1, 27,5, 31,5, 32,3, 33,0, 33,3, 35,2, 40,7, 43.0, 52,9, 60,6, 62,5, 170,9, 172,7, 175,3. Данные анализа для С18Н28N2О 4S2 : Вычислено. %: С 53,98; Н 7,05; N 6,99; S 16,01 Найдено, %: С 53,97; Н 7,18; N 6,84; S 15,75. HPLC: tR=16 мин/>99%, УФ 217/; YMCS-30DS /C-18/ 6,0-150 мм; 50% В:А - 100% В:А, 25 минут линейный градиент /A=90% вода/метанол+0,2% фосфорной кислоты; В: 90% метанол/вода+02% фосфорной кислоты/; скорость потока при 1,5 мл/мин. Пример 8. /4S-/4a/R*/,7a,9аb//-Октагидро-4-//2-меркапто1-оксогексил/амино/-5-оксопирроло[2,1-b]/1,3/тиазепин-7-карбоновая кислота а) /S/-2-Бромгексановая кислота Бромид калия (15,9 г, 133 ммоля) добавляли к перемешиваемому раствору D-норлейцина (5,0 г, 38 ммоля) в 2,5 N серной кислоте (77 мл) при комнатной температуре. Реакционную смесь охлаждали до -10°С и добавляли твердый нитрит натрия (3,94 г, 57 ммоля) порциями, поддерживая температур у между -10° и -5° С. После окончания добавления пенистую реакционную массу перемешивали в течение 1 часа и затем нагревали до комнатной температуры и перемешивали еще 1 час. Затем реактивную смесь экстрагировали дважды эфиром. Эфирные экстракты промывали один раз водой и сушили (сульфатом магния), фильтровали и выпаривали, получая 3,3 г неочищенного, указанного в названии, продукта. b) Дициклогексиламиновая соль /S/-2-/ацетилтио/гексановой кислоты К перемешиваемому шламу тиоцетата калия (2,11 г, 18,5 ммоля) в 50 мл сухо го ацетонитрила при комнатной температуре в атмосфере аргона добавляли раствор продукта из части (а) (3,27 г, 16,8 ммоля) в 26 мл ацетонитрила. Реакционную смесь перемешивали в течение 5 часов. Полученный шлам фильтровали и выпаривали. Остаток вновь растворяли в этиловом эфире, промывали один раз 5% раствором бисульфата калия и один раз рассолом, сушили (сульфатом магния) и выпаривали. Остаток растворяли в эфире (64 мл) и обрабатывали дициклогексиламином (3,4 мл, 16,8 ммоля). Эфирный раствор концентрировали в вакууме и растирали с гексаном, получая белое твердое вещество, которое перекристаллизовывали из смеси этиловый эфир/гексан, получая указанный в названии продукт. Маточный раствор концентрировали и перекристаллизовывали дважды, получая полный выход 2,2 г указанного в названии продукта; т. пл. 145-147°С; [a]D= -33,8° (с=1,08, хлороформ). с) Метиловый эфир /4S-/4a/R*/,7a,9аb//-октагидро-4-//2-/ацетилтио/-1-оксогексил/амино/-5-оксопирроло-[2,1-b]/3,3/тиазепин-7-карбоновой кислоты Суспензию дицикпогексиламиновой соли из части (b) (255 мг, 9,69 ммоля, 1,05 экв.) в этилацетате (15 мл) промывали 5% раствором бисульфата калия (3×5 мл) и рассолом (10 мл), сушили (безводным сульфатом магния),.фильтровали, концентрировали, удаляли метиленхлоридом (дважды) и сушили в вакууме в течение 1 часа, получая свободную кислоту в виде масла. Это масло растворяли в сухом метиленхлориде (6 мл), охлаждали до 0°С (баня со льдом) и обрабатывали триэтиламином (96 мкл, 0,69 ммоля, 1,05 экв.), затем солью метилового эфира /4S-/4a, 7a,9ab//-4-аминооктагидро-5-оксопирроло[2,1-b]/1, 3/тиазепин-7-карбоновой кислоты и п-толуолсульфоновой кислоты, полученной как описано в примере 7 (а), (275 мг, 0,66 ммоля), триэтиламином (92 мкл, 0,66 ммоля) и, наконец, бензотриазол-1илокситрис/диметиламино/фосфонийгексафторфосфа том (305 мг, 0,69 ммоля). Полученный раствор перемешивали при 0°С в течение 1 часа, затем при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали, разбавляли этилацетатом, промывали 5% раствором биосульфата калия (20 мл), 50% насыщеным раствором бикарбоната натрия (20 мл), рассолом (20 мл), сушили (безводным сульфатом магния), фильтровали и выпаривали досуха. Неочищенный продукт адсорбировали на целите и хроматографировали на колонке (2,5×10 см) с силикагелем, элюируя 40% (1 л) смесью этилацетат/гексан. Желаемые фракции объединяли и концентрировали, получая 258 мг чистого указанного в названии продукта. TLC (этилацетат:гексан, 8:2) Rf=0,54. 27 39924 К перемешиваемому шламу тиоацетата калия (1,7 г, 15,0 ммоля) в 50 мл сухого ацетонитрила при комнатной температуре аргона добавляли раствор продукта из части (а) (2,6 г, 13 ммоля) в 17 мл ацетонитрила. Реакционную смесь перемешивали в течение 4 часов. Полученный шлам фильтровали и выпаривали. Остаток вновь растворяли в этиловом эфире, промывали один раз 5% раствором гидросульфата калия и один раз рассолом, сушили (сульфатом магния) и выпаривали. Остаток растворяли в эфире (64 мл) и обрабатывали дициклогексиламином (2,7 мл, 1,4 ммоля). Из раствора немедленно начинало выпадать белое твердое вещество. Раствор фильтровали и собирали белое твердое вещество, получая 2,0 г указанного в названии продукта, т. пл. 153-158°С: [a]D= -54,5°С (с=0,61, хлороформ). c) Метиловый эфир /4S-/4a/R*/,7a,9аb//-октагидро-4-//2-/ацетилтио/-1-оксо-4-метилпентил/амино/-5-оксопирроло[2,1-b]/1,3/тиазепин-7-карбоновой кислоты Перемешиваемую суспензию дициклогексиламиновой соли продукта из части (b) (234 мг, 0,63 ммоля) в этилацетате (15 мл) промывали 5% водным раствором бисульфата калия (3×5 мл). Органический экстракт сушили (безводным сульфатом магния), фильтровали и дважды выпаривали из гексана. Полученное масло растворяли в метиленхлориде (6 мл) и перемешивали в атмосфере азота при 0°С. К этому раствору добавляли триэтиламин (88 мкл, 0,63 ммоля), затем соль метилового эфира /4S-/4a,7a,9аb//-4-амино-октагидро5-оксопирроло[2,1-b]/1,3/-тиазепин-7-карбоновой кислоты и n-толуолсульфоновой кислоты (полученной, как описано в примере 7 (а), 249 мг, 0,6 ммоля), дополнительное количество триэтиламина (84 мкл, 0,609 ммоля) и через 10 минут бензотриазол-1-илокситрис-/диметиламино/-фосфоний гексафторфосфата (279 мг, 0,63 ммоля). Через 1 час реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Полученный бесцветный раствор выпаривали при температуре ниже 30°С, и маслообразный остаток вновь растворяли в этилацетате. Раствор промывали один раз 5% раствором бисульфата калия, один раз насыщенным раствором бикарбоната натрия и один раз рассолом. Органический слой сушили (сульфатом магния), фильтровали и выпаривали на 5 г силикагеля. Очистка флеш-хроматографированием на колонке (2,5´ ´15 см, элюирование смесью 1:1 этилацетат/гексан) давала 203 мг указанного в названии продукта в виде белого твердого вещества, т. пл. 101103°С. [a]D= -157,5°С (с=1,04, хлороформ). TLC (этилацетат гексан, 1:1) Rf= 0,19. d) /4S-/4a/R*/,7a,9ab//-Октагидро-4-//2-меркапто-1-оксо-4-метилпентил/амино/-5-оксопирроло[2, 1-b]/1,3/-тиазепин-7-карбоновая кислота Раствор продукта из части (с) (184 мг, 0,44 ммоля) в 5 мл метанола продували азотом в течение 10 минут и охлаждали до 0°С. К этому раствору по каплям добавляли 5 мл продутого азотом раствора 1 М гидроокиси натрия. Азот медленно пробулькивали через раствор в процессе реакции. Через 2 часа реакционную смесь подкисляли 2 мл 6М соляной кислоты, экстрагировали дважды этилацетатом и экстракты объединяли, d) /4S-/4a/R*/,7a,9ab//-Октагидро-4-//2-меркапто-1-оксогексил/-амино/-5-оксопирроло[2,1-b]/1, 3/тиазепин-7-карбоновая кислота Раствор продукта из части (с) (255 мг, 0,54 ммоля) в метаноле (5 мл), продутый аргоном в течение 30 минут, о хлажденный до 0°С, обрабатывали по каплям предварительно продутым (аргоном в течение 30 минут) раствором 1,0 N гидроокиси натрия (5 мл), поддерживая условия пробулькивания аргона в течение периода добавления и протекания реакции. Реакционную смесь перемешивали при 0°С в течение 2 часов, подкисляли при О°С 5% раствором бисульфата калия до рН 2, затем экстрагировали этилацетатом (3´ ´20 мл). Объединенные органические экстракты промывали 50% рассолом (20 мл) и рассолом (20 мл), сушили (безводным сульфатом магния), фильтровали и выпаривали досуха. Остаток чистили хроматографически на колонке 2,5×10 см с силикагелем, элюируя 7:3 смесью этилацетат:гептан (300 мл) и 1% уксусной кислотой в 7:3 смеси этилацетат:гептан (500 мл). Желаемые фракции концентрировали, удаляли метиленхлоридом и сушили в вакууме, получая 170 мг указанного в названии продукта в виде белой пены; [a]D= -135,1° (с=0,5, метанола). TLC (1% уксусная кислота в этилацетате) Rf=0,32. 1 Н NMR: 400 MH z; CDCI3:d 0,89 (t, 3Н, J=7Hz), 1,32(m,4H), 1,73(m,1H), 1,96 (m,2H), 2,00 (d,1H), J= =8,6 Hz), 2,11 (m,1H), 2,32 (m's,3Н), 2,52 (m,1H), 2,98 (m,1H), 3,32 (m’s,2H), 4,61 (t,1H, J=7,1 Hz), 4,72 (m,1H), 5,25 (m,1H),7, 63 (d,1H, J = 6,4Hz). 13 С - N MR: 100 MH z; CDCI3:d 13,8, 22,2, 27,6, 29,2, 31,4, 32,6, 33,1, 35,3, 43,0, 52,8, 60,6, 62,42, 170,7, 172,5, 174,0. Данные анализа для С15Н24N4О 4S20×0,08 Н2О Вычислено, %: С 49,79; Н 6,73; N 7,74; S 17,72 Найдено. %: С 49,90; Н 6,92; N 7,63; S 17,57. HPLC: tR = 9,4 мин (> 9%, УФ 220): YMC S-3 ODS (C-18) 6,0×150 мм; 50% В:А–100% В:А, 25 минут линейный градиент (А=90% вода/метанол+ +0,2% фосфорной кислоты/; В=90% метанол/вода+0,2% фосфорной кислоты/ скорость потока при 1,5 мл/мин. Пример 9. /4S-/4a/R*/,7a,9аb//-Октагидро-4-//2-меркапто1-оксо-4-метилфенил/амино/-5-оксопирроло[2, 1-b]/1,3/тиазепин-7-карбоновая кислота a) /S/-2-Бром-4-метилпентановая кислота Бромид калия (9,5 г, 80 ммоля) добавляли к перемешиваемому раствору D-лейцина (3,0 г, 23 ммоля) в 2,5 N серной кислоте (47 мл) при комнатной температуре. Реакционную смесь охлаждали до -10°С и порциями добавляли твердый нитрит натрия (2,4 г, 34 ммоля), поддерживая температуру между -10° и -5°С. После окончания добавления реакционную смесь перемешивали в течение 1 часа и затем нагревали до комнатной температуры и перемешивали еще один час. Затем реакционную смесь дважды экстрагировали эфиром, эфирные экстракты промывали один раз водой, сушили (сульфатом магния), фильтровали и выпаривали, получая 2,7 г неочищенного, указанного в названии, продукта. b) Дициклогексиламиновая соль /S/-2-/ацетилио/-4-метиленпентановой кислоты 28 39924 сушили (сульфатом магния) и выпаривали. Повторное выпаривание из гексана и растирание остатка в смеси метанол/вода давало 132 мг указанного в названии продукта в виде твердого кристаллического вещества, т. пл. 94-96°С, [a]D= = -158,6°С (с=0.42, метанол). TLC (этилацетат:уксусная кислота 4:4:0,1), R f=0,13. Данные анализа для С15Н24N2S2 O4 ×0,75 Н2О Вычислено. %: С 48,17; Н 6,87; N 7,49; S 17,15 Найдено. %: С 48,33; Н 6,51; N 7,37; S 16,82. HPLC: Rf=17,6 мин; (99,2%) YMC S-3-ODS(C18), 6,0×150 мм; 0% до 100% В:А, 25 мин линейный градиент и 15 мин выдерживания 1,5 мл/мин. A=90% вода/метанол+0,2% фосфорной кислоты; В=90% метанол/вода+0,2 фосфорной кислоты; 220 нм. Пример 10. /4S-/4a/R*/,7a,10аb//-Октагидро-4-//2-меркапто1-оксо-3-фенилпропил/амино/-5-оксо-/1,4/оксазино[3,4-b]/1,3/оксазепин-7-карбоновая кислота a) 2-Пропениловый эфир 2,2,2-трихлорацетимидовой кислоты Суспензия 80% гидрида натрия (945 мг, 31,5 ммоля, дважды промытую 25 мл гексана) в сухом эфире (30 мл) обрабатывали по каплям раствором 2-пропен-1-олом (21,4 мл, 18,3 г, 315 ммоля) в сухом эфире (45 мл), перемешивали в течение 20 минут при комнатной температуре в атмосфере аргона и затем охлаждали до 0°С (в бане лед с солью). Трихлорацетонитрил (30 мл или 42,3 г, 0,30 моля) добавляли в течение 15 минут и коричневый раствор перемешивали при 0°С в течение 40 минут, при 10°С в течение 10 минут и при комнатной температуре в течение 10 минут. Реакционную смесь концентрировали до сиропа, обрабатывали раствором метанола (1,2 мл) в пентане (30 мл) и интенсивно перемешивали в течение 5,0 минут. Светло-коричневый осадок отфильтровывали, промывали пентаном (2×30 мл) и объединенные фильтраты концентрировали до светлокоричневой жидкости. Жидкость повторно растворяли в пентане (30 мл) перемешивали в течение нескольких минут и полученную суспензию отфильтровывали, и полученные осадки промывали пентаном (30 мл), повторяли эту процедуру, по крайней мере, еще не менее одного раза. Чистый фильтрат концентрировали и сушили в вакууме, получая 54,0 г указанного в названии соединения в виде светло-красной окрашенной жидкости. Это вещество хранили в виде раствора в гексане при 10°С. b) Метиловый эфир N-фталоил-L-серина Суспензию гидрохлорида метилового эфира L-серина (25 г, 161 ммоля) в воде (350 мл) разбавляли диоксаном (250 мл) и полученный прозрачный раствор обрабатывали твердым карбонатом натрия (17,0 г, 1,0 экв.) с последующей обработкой N-карбетоксифталимидом (37 г, 1,05 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов в атмосфере аргона. Смесь экстрагировали этилацетатом (3´ ´500 мл), и объединенные органические экстракты промывали последовательно 5% раствором бикарбоната натрия (250 мл). 5% бисульфатом калия (250 мл) и рассолом (250 мл), сушили (без водным сульфатом натрия), фильтровали, выпаривали досуха и сушили в вакууме. Продукт смеси хроматографировали на колонке и силикагелем (Мерк), элюируя смесью этилацетат:гексан (1:3, 1:2), и желаемые фракции объединяли, выпаривали досуха и сушили в вакууме, получая 31 г указанного в названии соединения в виде вязкого сиропа. TLC (этилацетат:гексан, 1:1) Rf=0,52. c) Метиловый эфир N-фталоил-1-/2-пропенил/-L-серина Раствор продукта из части (b) (7,37 г, 29,5 ммоля) в сухом метиленхлориде (30 мл) обрабатывали раствором продукта из части (а) (11,97 г, 59,1 ммоля, 2 экв.) в циклогексане (60 мл) с последующей обработкой трифторметансульфоновой кислотой (0,37 мл) и реакционную смесь перемешивали при комнатной температуре в течение 20 часов в атмосфере аргона. Осадки отфильтровывали, промывали минимальным количеством метиленхлорида, и объединенные фильтраты промывали 5% раствором бикарбоната натрия (30 мл) и водой (30 мл), сушили (безводным сульфатом натрия), фильтровали, выпаривали досуха и сушили в вакууме. Неочищенную смесь хроматографировали на колонке с силикагелем (Мерк), элюируя смесью этилацетат:гексан (1:9). Желаемые фракции объединяли, выпаривали досуха и сушили в вакууме, получая 7,56 г указанного в названии соединения в виде прозрачного вязкого сиропа. TLC (этилацетат:гексан, 1:1), Rf=0,70. d) Метиловый эфир N-фталоил-О-/ацетальдегид/-L-серина Раствор продукта из части (с) (2,5 г, 8,64 ммоля) в смеси сухого метиленхлорида (46,4 мл) и метанола (4,6 мл) охлаждали до -78°С (в бане сухой лед-ацетон) и обрабатывали озоном до устойчивой голубой окраски (около 15 минут). Затем смесь продували азотом в течение 10 минут (до исчезновения голубой окраски), обрабатывали диметилсульфидом (14,0 мл, 0,19 моля, 22,1 экв.), нагревали до комнатной температуры и перемешивали в течение 2,5 часов в атмосфере азота. Реакционную смесь выпаривали досуха, и остаток в виде сиропа растворяли в этилацетате (50 мл), промывали водой (15 мл) и рассолом (15 мл), сушили (безводным сульфатом магния), фильтровали, выпаривали досуха и сушили в вакууме. Неочищенный продукт хроматографировали на колонке с силикагелем (Мерк), элюируя смесью этилацетат:гексан (1:9; 1:4; 1:2) с получением 1,54 г указанного в названии соединения. TLC (этилацетат:гексан, 1:1) Rf=0,33. e) Метиловый эфир N-фталоил-О-/2,2-диметоксиэтил/-L-серина Раствор продукта из части (d) (1,54 г, 5,29 ммоля) в смеси сухого метиленхлорида (8,3 мл) и сухого метанола (8,3 мл) обрабатывали триметиловым эфиром орто-муравьиной кислоты (0,84 мл, 7,68 ммоля, 1,45 экв.) и моногидратом n-толуолсульфоновой кислоты (92 мг). Реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение 2,5 часов, затем разделяли между этилацетатом (50 мл) и насыщенным раствором бикарбоната натрия (15 мл). Органическую фазу промывали водой (15 мл) и рассолом (15 мл), сушили (безводным 29 39924 сульфатом натрия), фильтровали, выпаривали досуха и сушили в вакууме. Неочищенный продукт хроматографировали на колонке с силикагелем (Мерк), элюируя смесью этилацетат:гексан (1:4), получая 1,35 г указанного в названии продукта в виде вязкого прозрачного сиропа. TLC (этилацетат:гексан. 1:1) R f=0,58. f) Ме тиловый эфир О-/2,2-диметоксиэтил/-Lсерина Раствор продукта из части (е) (2,0 г, 5,93 ммоля) в сухом метаноле (14 мл) обрабатывали гидразингидратом (0,30 мл, 6,1 ммоля) и перемешивали при комнатной температуре в течение 4 дней в атмосфере аргона. Полученную суспензию фильтровали, промывали осадок метанолом (2´ ´14 мл), и фильтрат концентрировали досуха. Сироп повторно растворяли в метиленхлориде и фильтровали более двух раз до тех пор, пока осадка уже больше не получалось. Прозрачный фильтрат концентрировали, получая 1,17 г указанного в названии продукта в виде светложелтого сиропа. TLC (метиленхлорид:метанол, 9:1) R f=0,54. g) N-//фeнилметокси/карбонил/-О-//1,1-диметилэтил/-диметилсилил/-L-гомосерин Раствор N-//фенилметокси/карбонил/-L-гомосерина, полученного, как описано в примере 6(а), (3,0 г, 11,85 ммоля) в сухом диметилформамиде (65 мл) обрабатывали //1,1-диметилэтил/-диметилсилил хлоридом (10,72 г, 71,1 ммоля) и имидазолом (9,65 г, 0,14 моля) и перемешивали при комнатной температуре в атмосфере аргона в течение 24 часов. Реакционную смесь разбавляли метанолом (207 мл), перемешивали еще 24 часа при комнатной температуре и затем концентрировали до сиропа. Оставшийся сироп растворяли в этилацетате (200 мл), промывали 10% лимонной кислотой (2×75 мл) и рассолом, сушили (безводным сульфатом натрия), фильтровали, выпаривали досуха и сушили в вакууме. Неочищенную смесь хроматографировали на колонке с силикагелем (Мерк), элюируя смесью этилацетат гексан (1:1) с последующим элюированием смесью этилацетат:уксусная кислота (99,5:0,5). Желаемые фракции объединяли, концентрировали и выпаривали несколько раз из толуола, получая 3,56 г указанного в названии соединения в виде воскообразного твердого вещества. TLC (этилацетат:уксусная кислота, 95:5) Rf=0,82. h) Метиловый эфир N-/О-//1,1-диметилэтил/диметилсилил/-N-//фенилметокси/карбонил/L-гoмоceрил/-O-/2,2-диметоксиэтил/-L-cepинa Раствор продукта из части (g) (2,18 г, 5,93 ммоля) в сухом метиленхлориде до 0°С (в бане - лед с солью) и обрабатывали последовательно раствором продукта из части (f) (1,71 г, 5,65 ммоля) в сухом метиленхлориде (5 мл), триэтиламином (0,78 мл, 5,65 ммоля) и бензотриазол1-илокситрис-/диметиламино/фосфонийгексафтор фосфатом (2,63 г, 6,0 ммоля). Реакционную смесь перемешивали при 0°С в течение 30 минут и при комнатной температуре в течение 1 часа и 45 минут. Реакционную смесь разделяли между этиловым эфиром (2×100 мл) и водой (30 мл) и объединенные органические экстракты промывали 50% насыщенным раствором бикарбоната натрия (20 мл) и рассолом (25 мл), сушили (безвод ным сульфатом натрия), фильтровали, выпаривали досуха и сушили в вакууме. Неочищенную смесь хроматографировали на колонке с силикагелем (Мерк), элюируя смесью этилацетат:гексан (1:4, 1:3, 1:1), получая 2,38 г указанного в названии продукта, TLC (этилацетат:гексан, 1:1) Rf= =0,40. і) Метиловый эфир /4S-/4a,7a,10аb//-октагидро-4-//фенилметокси/-карбонил/амино-5-оксо-/1, 4/оксазино[3,4-b]/1,3/оксазепин-7-карбоновой кислоты Раствор продукта из части (h) (1,0 г, 1,8 ммоля) в сухом метиленхлориде (50 мл) обрабатывали ионообменной смолой - Амберлит®15 (кислая форма) и метанолом (0,1 мл), и полученную смесь перемешивали при комнатной температуре в атмосфере аргона в течение трех дней. Смолу отфильтровывали, промывали небольшим количеством метиленхлорида и фильтрат концентрировали до сиропа. Неочищенную смесь хроматографировали на колонке с силикагелем, элюируя смесью этилацетат:гексан (1:1), получая 339 мг указанного в названии продукта. TLC (этилацетат:гексан, 3:1) R f=0,53. j) Метиловый эфир /4S-/4a,7a,10аb/-октагидро4-амино-5-оксо/1,4/оксазино[3,4-b]/1,3/оксазепин-7карбоновой кислоты Раствор продукта, полученного, как описано в части (і) (771 мг, 2,04 ммоля), в сухом метаноле (25 мл) обрабатывали 10% палладием на угле в качестве катализатора (125 мг) и гидрировали (из баллона) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через целитную подложку и подложку промывали метанолом (2×25 мл). Прозрачный фильтрат выпаривали досуха и сушили в вакууме, получая 448 мг указанного в названии продукта в виде сиропа. TLC (метиленхлорид:метанол, 9:1) Rf=0,22. k) Метиловый эфир /4S-/4a/R*/,7a,10аb/октагидро-4-//2-/ацетилтио/-1-оксо-3-фенилпропил/амино/-5-оксо-/1,4/оксазино[3,4-b]/1,3/оксазепин-7-карбоновой кислоты Дициклогексиламиновую соль /S/-2-/ацетилтио/бензолпропановой кислоты (813 мг, 2,01 ммоля) суспендировали в этилацетате (70 мл), промывали 5% раствором бисульфата калия (5´ ´9,3 мл) и рассолом (9,3 мл), сушили (безводным сульфатом магния), фильтровали, выпаривали досуха и сушили в вакууме. Эту свободную кислоту растворяли в сухом метиленхлориде (12 мл), охлаждали до 0°С (в бане - лед с солью) и обрабатывали последовательно раствором продукта из части (j) (448 мг, 1,84 ммоля) в сухом, метиленхлориде (4,0 мл), триэтиламином (0,25 мл, 1,80 ммоля) и бензотриазол-1-илокситрис/диметиламино/фосфонийгексафтор фосфатом (823 мг, 1,86 ммоля). Реакционную смесь перемешивали при 0°С в течение 1 часа и при комнатной температуре в течение 2 часов в атмосфере аргона. Реакционную смесь отгоняли досуха, и полученный сироп вновь растворяли в этилацетате (60 мл), промывали 0,5 N соляной кислотой (2×11 мл), водой (11 мл) и рассолом (11 мл), сушили (безводный сульфатом натрия), фильтровали, выпаривали досуха и сушили в вакууме. Неочищенную смесь хроматографировали дважды на колонке с силикагелем (Мерк), элюируя 30
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 513/04, A61K 31/554, A61K 31/553, C07C 327/00, C07C 317/50, C07C 319/00, A61K 31/55, C07C 323/59, C07D 498/04, A61P 9/04, C07K 5/078, A61K 31/535, A61K 31/54, A61P 43/00, A61K 31/542, A61K 38/00, A61P 9/12
Мітки: ферменту, ангіотензину, ядро, варіанти, проміжні, конденсоване, одержання, перетворення, інгібування, фармацевтична, біциклічне, нейтраль, композиція, містять, спосіб, сполуки,які, сполуки
Код посилання
<a href="https://ua.patents.su/52-39924-spolukiyaki-mistyat-biciklichne-kondensovane-yadro-sposib-kh-oderzhannya-promizhni-spoluki-sposib-kh-oderzhannya-varianti-ta-farmacevtichna-kompoziciya-dlya-ingibuvannya-peretvoren.html" target="_blank" rel="follow" title="База патентів України">Сполуки,які містять біциклічне конденсоване ядро, спосіб їх одержання, проміжні сполуки, спосіб їх одержання (варіанти) та фармацевтична композиція для інгібування перетворення ферменту ангіотензину та нейтраль</a>
Попередній патент: Спосіб одержання п- нітрофенолу
Випадковий патент: Захисна пов'язка