Похідні ізотіазолу, спосіб їх одержання, фармацевтична композиція та спосіб лікування гіперпроліферативного захворювання у ссавця
Номер патенту: 60365
Опубліковано: 15.10.2003
Автори: Гант Томас Георг, Ное Марк Карл, Ларсон Ерік Роберт
Формула / Реферат
1. Похідні ізотіазолу формули
або їх фармацевтично прийнятна сіль, пролікарська форма або їх сольват, де:
X1 є О або S;
R1 є Н, С1-С10 алкілом, С2-С10 алкенілом, С2-С10 алкінілом, -С(O)(С1-С10 алкілом), -(СН2)t(С6-С10 арилом), -(СН2)t(4-10-членним гетероциклом), -С(O)(СН2)t(С6-С10 арилом) або -С(O)(СН2)t(5-10-членним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атом О і S не зв'язані безпосередньо один з одним; згадані арильна і гетероциклічна R1 групи, необов'язково, приконденсовані до С6-С10 арильної групи, C5-C8 насиченої циклічної групи або 5-10-членної гетероциклічної групи; 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=O) замісником; -(СН2)t замісники вищезгаданих R1 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t є цілим числом, що знаходиться в інтервалі від 2 до 5; і вищезгадані R1 групи, за винятком Н, необов'язково, заміщені від 1 до 3 R4 групами;
R2 вибирають з переліку замісників, передбачених приведеними значеннями для R1, -SO2(СН2)t(С6-С10 арилу), -SO2(СН2)t(5-10-членного гетероциклу) і -OR5, t є цілим числом, що знаходиться в інтервалі від 0 до 5, -(СН2)t- замісники вищезгаданих R2 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t є цілим числом, що знаходиться в інтервалі від 2 до 5, і вищезгадані R2 групи, необов'язково, заміщені від 1 до 3 R4 групами;
або R1 i R2 можуть бути взяті разом з атомом азоту, до якого кожний з них приєднаний, утворюючи 4-10-членне насичене моноциклічне або поліциклічне кільце або 5-10-членне гетероарильне кільце, де згадані насичене і гетероарильне кільця, необов'язково, включають 1 або 2 гетероатоми, що вибирають з О, S i -N(R6)-, на додаток до атому азоту, до якого приєднані R1 і R2, згадана -N(R6)- є, необов'язково, =N- або -N=, де R1 і R2 узяті разом у вигляді згаданої гетероарильної групи, згадане насичене кільце, необов'язково, може бути частково ненасиченим, включаючи 1 або 2 подвійних вуглець-вуглецевих зв'язки, і згадані насичене і гетероарильне кільця, включаючи R6 групу згаданої -N(R6)-, необов'язково, заміщені від 1 до 3 R4 групами;
R3 є Н, С1-С10 алкілом, С2-С10 алкенілом, С2-С10 алкінілом, -(СН2)t(С6-С10 арилом), або -(СН2)t(5-10-членним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним; згадані арильна і гетероциклічна R3 групи, необов'язково, приконденсовані до С6-С10 арильної групи, C5-C8 насиченої циклічної групи або 5-10-членної гетероциклічної групи; 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=O) замісником; -(СH2)t- замісники вищезгаданих R3 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t є цілим числом, що знаходиться в інтервалі від 2 до 5; і вищезгадані R3 групи, необов'язково, заміщені від 1 до 5 R4 групами;
кожну R4 незалежно вибирають з С1-С10 алкілу, С2-С10 алкенілу, С2-С10 алкінілу, галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -OR5, -C(O)R5, -C(O)OR5, -NR6C(O)OR5, -OC(O)R5, -NR6SO2R5, -SO2NR5R6, -NR6C(O)R5, -C(O)NR5R6, -NR5R6, -S(O)jR7, де j є цілим числом, що знаходиться в інтервалі від 0 до 2, -SО3Н, -NR5(CR6R7)tOR6, -(СН2)t(С6-С10 арилу), -SO2(СН2)t(С6-С10 арилу), -S(СН2)t(С6-С10 арилу), -O(СН2)t(С6-С10 арилу), -(CH2)t(5-10-членного гетероциклу) і -(CR6R7)mOR6, де m є цілим числом, що знаходиться в інтервалі від 1 до 5 і t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним; згадані арильна і гетероциклічна R4 групи, необов'язково, приконденсовані до С6-С10 арильної групи, C5-C8 насиченої циклічної групи або 5-10-членної гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=O) замісником, і алкільний, арильний і гетероциклічний замісники вищезгаданих R4 груп, необов'язково, заміщені від 1 до 3 замісниками, що незалежно вибирають з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -NR6SO2R5, -SO2NR5R6, -C(O)R5, -C(O)OR5, -OC(O)R5, -NR6C(O)R5, -C(O)NR5R6, -NR5R6, -(СR6R7)mОR6, де m є цілим числом, що знаходиться в інтервалі від 1 до 5, -OR5 і замісників, вказаних для значень R5;
кожну R5, незалежно, вибирають з H, С1-С10 алкілу, -(СН2)t(С6-С10 арилу) і -(CH2)t(5-10-членного гетероциклу), де t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R5 групи, необов'язково, приконденсовані до С6-С10 арильної групи, C5-C8 насиченої циклічної групи, або 5-10-членної гетероциклічної групи, і вищезгадані R5 замісники, за винятком Н, необов'язково, заміщені від 1 до 3 замісниками, незалежно вибраними з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -C(O)R6, -C(O)OR6, -CO(O)R6, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гідрокси, C1-C6 алкілу і C1-C6 алкокси,
і кожна R6 i R7, незалежно, є Н або С1-С6 алкілом;
за умови, що згаданою сполукою формули 1 не є 1-метил-3-(4-карбамоїл-3-етокси-5-ізотіазоліл)сечовина, 1,1-диметил-3-(4-карбамоїл-3-етокси-5-ізотіазоліл)сечовина, 1-метил-3-(4-карбамоїл-3-пропокси-5-ізотіазоліл)сечовина, 1-метил-3-(4-карбамоїл-3-(метилтіо)-5-ізотіазоліл)сечовина, 1-метил-3-(4-карбамоїл-3-(етилтіо)-5-ізотіазоліл)-сечовина, 1,1-диметил-3-(4-карбамоїл-3-(етилтіо)-5-ізотіазоліл)сечовина, 1-метил-3-(4-карбамоїл-3-(пропілтіо)-5-ізотіазоліл)сечовина, 1,1-диметил-3-(4-карбамоїл-3-(пропілтіо)-5-ізотіазоліл)сечовина або 1-метил-3-(4-карбамоїл-3-(ізопропілтіо)-5-ізотіазоліл)сечовина.
2. Похідні ізотіазолу згідно з пунктом 1, в яких R2 є Н і R1 є С1-С10 алкілом, необов'язково, заміщеним 1 або 2 замісниками, що незалежно вибирають з -NR6R7, -NR5(СR6R7)tOR6 і -(СН2)t(5-10-членного гетероциклу), де t є цілим числом, що знаходиться в інтервалі від 0 до 5.
3. Похідні ізотіазолу згідно з пунктом 2, в яких R1 вибирають з пропілу, бутилу, пентилу і гексилу, і згадані R1 групи, необов'язково, заміщені диметиламіно, гідрокси, піролідинілом, морфоліно і етил-(2-гідроксіетил)аміно.
4. Похідні ізотіазолу згідно з пунктом 1, в яких R2 є H і R1 є -(СН2)t(5-10-членним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана гетероциклічна група є, необов'язково, приконденсованою до С6-С10 арильної групи, C5-C8 насиченої циклічної групи або 5-10-членної гетероциклічної групи; і згадана R1 група, включаючи, необов'язково, приконденсовану частину згаданої R1 групи, є, необов'язково, заміщеною 1 або 2 замісниками, що незалежно вибирають з С1-С4 алкілу, гідрокси і гідроксиметилу.
5. Похідні ізотіазолу згідно з пунктом 4, в яких гетероциклічні замісники згаданої R1 групи вибирають з морфоліно, піролідинілу, імідазолілу, піперазинілу, піперидинілу і 2,5-діазабіцикло[2.2.1]гепт-2-илу, t змінюється у згаданій R1 групі в інтервалі від 2 до 5, і згадана R1 група, необов'язково, заміщена гідрокси, гідроксиметилом і метилом.
6. Похідні ізотіазолу згідно з пунктом 1, в яких R3 є -(СН2)t(С6-С10 арилом), де t є цілим числом, що знаходиться в інтервалі від 1 до 3, і згадана R3 група є, необов'язково, заміщеною від 1 до 4 R4 групами.
7. Похідні ізотіазолу згідно з пунктом 6, в яких R3 є бензилом, необов'язково, заміщеним від 1 до 4 замісниками, незалежно вибраними з галогену і С1-С4 алкілу.
8. Похідні ізотіазолу згідно з пунктом 7, в яких R3 є бензилом, необов'язково, заміщеним від 1 до 4 замісниками, незалежно вибраними з метилу, фтору, хлору і брому.
9. Похідні ізотіазолу згідно з пунктом 1, що вибирають з групи, яка містить наступні сполуки:
Мезилатна сіль 3-(4-Бром-2,6-дифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреїдо]ізотіазол-4-карбоксаміду;
5-{3-(3-(4-Метилпіперазин-1-іл)пропіл]уреїдо}-3-(2,3,6-трифтор-4-метил-
бензилоксі)ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилоксі)-5-(3-{4-[етил-(2-гідроксіетил)аміно]бутил}-уреїдо)ізотіазол-4-карбоксамід;
3-(2-Фтор-4-метилбензилокси)-5-{3-[3-(4-метилпіперазин-1-іл)пропіл]уреїдо}-ізотіазол-4-карбоксамід;
3-(2,5-Дифтор-4-метилбензилокси)-5-(3-{4-[4-(2-гідроксіетил)піперазин-1-іл]-бутил}уреїдо)ізотіазол-4-карбоксамід;
3-(2,5-Дифтор-4-метилбензилокси)-5-[3-(6-диметиламіногексил)уреїдо]ізотіазол-4-карбоксамід;
3-(2-Фтор-4-метилбензилоксі)-5-[3-(5-ізопропіламінопентил)уреїдо]ізотіазол-4-карбоксамід;
Гідрохлоридна сіль 3-(4-Бром-2,6-дифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)-уреїдо]ізотіазол-4-карбоксаміду;
3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреїдо]ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(4-метилпіперазин-1-іл)пропіл]уреїдо}-ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[2-(1-метилпіролідин-2-іл)етил]уреїдо}-ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреїдо]ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-(3-{4-[4-(2-гідроксіетил)піперазин-1-іл]бутил}-уреїдо)ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3-гідрокси-5-піролідин-1-ілпентил)уреїдо]-ізотіазол-4-карбоксамід;
3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3,4-дигідроксипіролідин-1-іл]бутил]-уреїдо}ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(3,4-дигідроксипіролідин-1-іл)бутил]-
уреїдо}ізотіазол-4-карбоксамід;
3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(2-гідроксиметилпіролідин-1-іл)-бутил]уреїдо}ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(2-гідроксиметилпіролідин-1-іл)бутил]-уреїдо}ізотіазол-4-карбоксамід;
3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3-гідроксипіролідин-1-іл)бутил]-уреїдо}ізотіазол-4-карбоксамід;
3-(4-Бром-2,6-дифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреїдо]ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4-гідрокси-5-піперидин-1-ілпентил)уреїдо]-ізотіазол-4-карбоксамід;
3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3-гідрокси-5-піперидин-1-іл)пентил]уреїдо}ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(2-гідроксиметилпіперидин-1-іл)бутил]-уреїдо}ізотіазол-4-карбоксамід;
3-(2,5-Дифтор-4-метилбензилокси)-5-(3-{4-[етил-(2-гідроксіетил)аміно]бутил}-уреїдо)ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(5-гідрокси-6-піперидин-1-іл)гексил)уреїдо}-ізотіазол-4-карбоксамід;
3-(4-Бром-2,3,6-трифторбензилокси)-5-{3-[3-(4-метилпіперазин-1-іл)пропіл]-уреїдо}ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[3-(4-метилпіперазин-1-іл)пропіл]уреїдо}-ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3-гідрокси-5-піролідин-1-ілпентил)уреїдо]-ізотіазол-4-карбоксамід;
5-[3-(4-Піролідин-1-ілбутил)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-[3-(3-Гідрокси-5-піролідин-1-ілпентил)уреїдо]-3-(2,3,6-трифтор-4-метил-
бензилоксі)ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(5-метил-2,5-діазабіцикло[2.2.1]гепт-2-ил)пропіл)уреїдо}ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[3-(5-метил-2,5-діазабіцикло[2.2.1]гепт-2-ил)пропіл]уреїдо)ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[2-(1-метилпіролідин-2-іл)етил]уреїдо}-ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреїдо]ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[4-(2-гідроксиметилпіролідин-1-іл)-бутил]уреїдо}ізотіазол-4-карбоксамід;
5-{3-[2-(1-Метилпіролідин-2-іл)-етил]уреїдо}-3-(2,3,6-трифтор-4-метилбензилоксі)-ізотіазол-4-карбоксамід;
5-[3-(4-Диметиламінобутил)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-[3-(3-Диметиламінопропіл)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-[3-(3-Гідроксі-5-ізопропіламінопентил)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-[3-(3-Ізопропіламінопропіл)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-{3-[4-(4-Метилпіперазин-1-іл)бутил]уреїдо}-3-(2,3,6-трифтор-4-метилбензилоксі)-ізотіазол-4-карбоксамід;
5-(3-{4-[4-(2-Гідроксіетил)піперазин-1-іл]бутил}уреїдо)-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-[3-(3-Піролідин-1-ілпропіл)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-[3-(4-Гідрокси-5-піперидин-1-ілпентил)уреїдо]-3-(2,3,6-трифтор-4-
метилбензилоксі)ізотіазол-4-карбоксамід;
3-(4-Хлор-2,6-дифторбензилоксі)-5-[3-(4-імідазол-1-ілбутил)уреїдо]ізотіазол-4-карбоксамід;
5-(3-{4-[Етил-(2-гідроксіетил)аміно]бутил}уреїдо)-3-(2,3,6-трифтор-4-метил-бензилоксі)ізотіазол-4-карбоксамід;
3-(4-Хлор-(2,3,6-трифторбензилокси)-5-{3-[4-(2-гідроксиметилпіперидин-1-іл)-бутил]уреїдо}ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилокси)-5-[3-(3-гідрокси-5-піролідин-1-ілпентил)-уреїдо]ізотіазол-4-карбоксамід;
3-(4-Бром-2,6-дифторбензилокси)-5-{3-[3-(4-метилпіперазин-1-іл)пропіл]уреїдо}-ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[2-(1-метилпіролідин-2-іл)етил]уреїдо}-ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4-диметиламінобутил)уреїдо]ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3-диметиламінопропіл)уреїдо]ізотіазол-4-карбоксамід;
3-(4-Бром-2,3,6-трифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреїдо]ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилоксі)-5-[3-(4-імідазол-1-ілбутил)уреїдо]ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилоксі)-5-(3-{3-[етил-(2-гідроксіетил)аміно]пропіл}-уреїдо)ізотіазол-4-карбоксамід;
3-(4-Хлор-2,3,6-трифторбензилоксі)-5-(3-{3-[етил-(2-гідроксиетил)аміно]пропіл}-уреїдо)ізотіазол-4-карбоксамід:
5-[3-(3-Метиламінопропіл)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
5-[3-(3-Амінопропіл)-3-метилуреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-
4-карбоксамід;
5-[3-(4-Діетиламінобутил)уреїдо]-3-(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід;
3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3-піролідин-1-ілпропіл)уреїдо]ізотіазол-4-карбоксамід;
3-(3-Хлор-2,6-дифтор-4-метилбензилокси)-5-[3-(4-диметиламінобутил)уреїдо]-ізотіазол-4-карбоксамід;
5-(3-{4-[Біс(2-гідроксіетил)аміно]бутил}уреїдо)-3-(2,6-дифтор-4-метилбензилоксі)-ізотіазол-4-карбоксамід;
фармацевтично прийнятні солі, проліки і сольвати згаданих сполук.
10. Фармацевтична композиція для лікування гіперпроліферативного захворювання у ссавця, яка включає терапевтично ефективну кількість похідної ізотіазолу згідно з пунктом 1 і фармацевтично прийнятний носій.
11. Фармацевтична композиція згідно з пунктом 10, де згаданим гіперпроліферативним захворюванням є рак, такий як рак мозку, легенів, лусочкових клітин, міхура, шлунка, підшлункової залози, грудей, голови, шиї, нирки, яєчника, простати, прямої кишки, стравоходу, гінекологічний або рак щитовидної залози.
12. Фармацевтична композиція згідно з пунктом 10, де згаданим захворюванням є неракове гіперпроліферативне захворювання.
13. Фармацевтична композиція згідно з пунктом 12, де згаданим захворюванням є доброякісна гіперплазія шкіри або простати.
14. Спосіб лікування гіперпроліферативного захворювання у ссавця, при якому згаданому ссавцеві вводять терапевтично ефективну кількість похідної ізотіазолу згідно з пунктом 1.
15. Спосіб згідно з пунктом 14, де згаданий спосіб використовують для лікування раку, такого як рак мозку, лусочкових клітин, міхура, шлунка, підшлункової залози, грудей, голови, шиї, стравоходу, простати, прямої кишки, легенів, нирки, яєчника, гінекологічного або раку щитовидної залози.
16. Спосіб згідно з пунктом 14, де згаданий спосіб використовують при лікуванні неракового гіперпроліферативного захворювання.
17. Спосіб згідно з пунктом 16, де згаданий спосіб використовують при лікуванні доброякісної гіперплазії шкіри або простати.
18. Спосіб лікування гіперпроліферативного захворювання у ссавця, при якому згаданому ссавцеві вводять терапевтично ефективну кількість похідної ізотіазолу згідно з пунктом 1 в комбінації з антипухлинним агентом, що вибирають з групи, що містить інгібітори мітозу, алкілувальні агенти, антиметаболіти, інтеркалюючі антибіотики, інгібітори фактору росту, інгібітори клітинного циклу, ензими, інгібітори топоізомерази, модифікатори біологічної відповіді, антигормони, антагоніст рецептора NK1, антагоніст 5-НТ3 рецептора, інгібітори СОХ-2, інгібітор EGFR і антиандрогени.
19. Сполука, що вибрана з групи, яка містить (2,6-дифтор-4-метилфеніл)метанол, (2,3,6-трифтор-4-метилфеніл)метанол, (4-бром-2,6-дифторфеніл)метанол, (4-бром-2,3,6-трифторфеніл)метанол, (4-хлор-2,6-дифторфеніл)метанол, (3-хлор-2,6-дифторфеніл)метанол і (4-хлор-2,3,6-трифторфеніл)метанол.
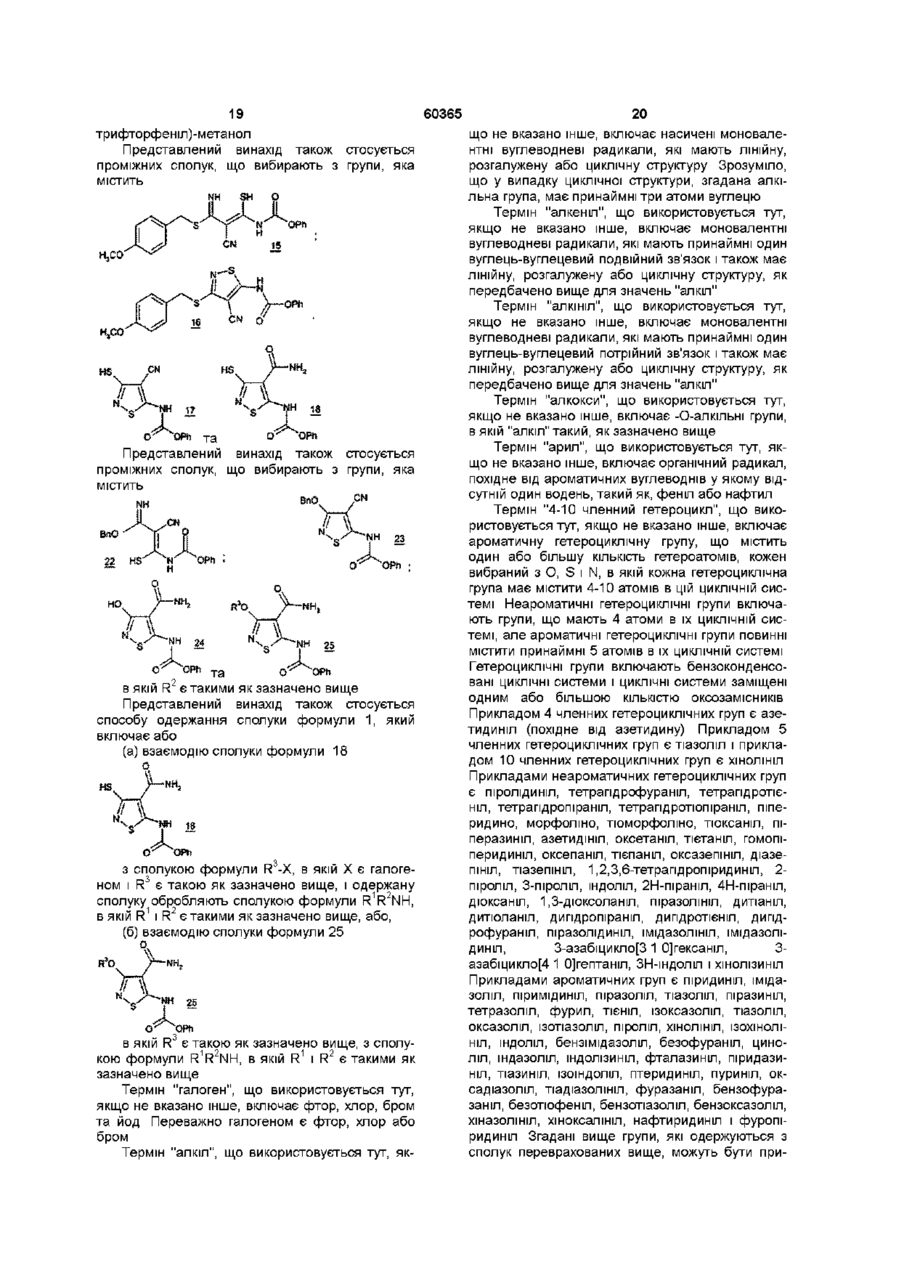
20. Сполука, що вибрана з групи, яка містить:
;
;
та
.
21. Сполука, що вибрана з групи, яка містить:
;
;
та
,
де R3 є Н, С1-С10 алкілом, С2-С10 алкенілом, С2-С10 алкінілом, -(СН2)t(С6-С10 арилом), або -(СН2)t(5-10-членним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним; згадані арильна і гетероциклічна R3 групи, необов'язково, приконденсовані до С6-С10 арильної групи, C5-C8 насиченої циклічної групи або 5-10-членної гетероциклічної групи; 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=O) замісником; -(СН2)t- замісники вищезгаданих R3 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t є цілим числом, що знаходиться в інтервалі від 2 до 5; і вищезгадані R3 групи, необов'язково, заміщені від 1 до 5 R4 групами;
кожну R4 незалежно вибирають з С1-С10 алкілу, С2-С10 алкенілу, С2-С10 алкінілу, галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -OR5, -C(O)R5, -C(O)OR5, -NR6C(O)OR5, -OC(O)R5, -NR6SO2R5, -SO2NR5R6, -NR6С(О)R5, -C(O)NR5R6, -NR5R6, -S(O)jR7, де j є цілим числом, що знаходиться в інтервалі від 0 до 2, -SО3Н, -NR5(CR5R6)tOR6, -(СН2)t(С6-С10 арилу), -SO2(CH2)t(C6-C10 арилу), -S(СН2)t(С6-С10 арилу), -O(СН2)t(С6-С10 арилу), -(СН2)t(5-10-членного гетероциклу) і -(CR6R7)mOR6, де m є цілим числом, що знаходиться в інтервалі від 1 до 5, і t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з O, S i -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним; згадані арильна і гетероциклічна R4 групи, необов'язково, приконденсовані до С6-С10 арильної групи, C5-C8 насиченої циклічної групи, або 5-10-членної гетероциклічної групи; 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=O) замісником; і алкільний, арильний і гетероциклічний замісники вищезгаданих R4 груп, необов'язково, заміщені від 1 до 3 замісниками, що незалежно вибирають з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -NR6SO2R5, -SO2NR5R6, -C(O)R5, -C(O)OR5, -OC(O)R5, -NR6C(O)R5, -C(O)NR5R6, -NR5R6, -(CR6R7)mOR6, де m є цілим числом, що знаходиться в інтервалі від 1 до 5, -OR5 і замісників, вказаних для значень R5;
кожну R5, незалежно, вибирають з Н, С1-С10 алкілу, -(СН2)t(С6-С10 арилу) і -(СН2)t(5-10-членного гетероциклу), де t є цілим числом, що знаходиться в інтервалі від 0 до 5; згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним; згадані арильна і гетероциклічна R5 групи, необов'язково, приконденсовані до С6-С10 арильної групи, C5-C8 насиченої циклічної групи, або 5-10-членної гетероциклічної групи; і вищезгадані R5 замісники, за винятком Н, необов'язково, заміщені від 1 до 3 замісниками, незалежно вибраними з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -C(O)R6, -C(O)OR6, -CO(O)R6, -NR6C(O)R7, -C(O)NR6R7, -NR5R6, гідрокси, С1-С6 алкілу і С1-С6 алкокси;
і кожна R6, R7, незалежно, є Н або С1-С6 алкілом.
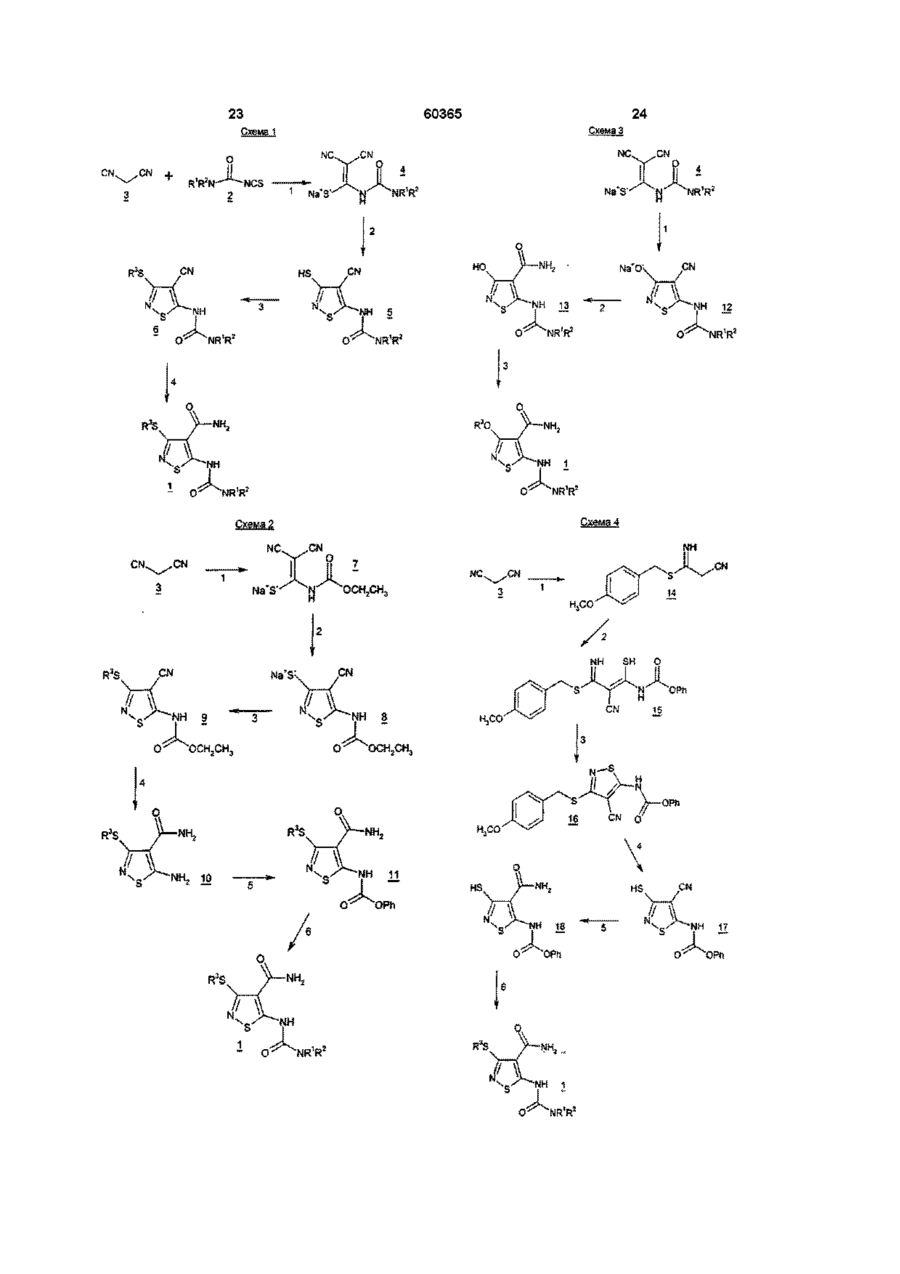
22. Спосіб одержання похідних ізотіазолу згідно з пунктом 1, при якому або:
(а) сполуку формули
вводять у взаємодію зі сполукою формули R3-X, в якій Х є галогеном і R3 є такою, як зазначено в пункті 1, і одержану сполуку обробляють сполукою формули R1R2NH, в якій R1 і R2 є такими, як зазначено в пункті 1; або
(б) сполуку формули
,
в якій R3 є такою, як зазначено в пункті 1, вводять у взаємодію зі сполукою формули R1R2NH, в якій R1 і R2 є такими, як зазначено в пункті 1.
Текст
1 ПОХІДНІ ізотіазолу формули I або їх фармацевтично прийнятна сіль, пролікарська форма або їх сольват, де X 1 є О або S, R1 є Н, С-і-С-ю алкілом, Сг-С-ю алкенілом, Сг-С-ю алкінілом, -С(О)(Сі-Сю алкілом), -(СНгИСб-Сю арилом), -(CH2)t(4-10-4neHHHM гетероциклом), C(0)(CH 2 )t(C 6 -Cio арилом) або -C(O)(CH 2 )t(5-10членним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атом О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R1 групи, необов'язково, приконденсовані до Сє-С-ю арильної групи, Cs-Cs насиченої циклічної групи або 5-10-членноі гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, -(Cbbjt замісники вищезгаданих R1 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t є цілим числом, що знаходиться в інтервалі від 2 до 5, і вищезгадані R1 групи, за винятком Н, необов'язково, заміщені від 1 до З R4 групами, R вибирають з переліку замісників, передбачених приведеними значеннями для R1, -SCbfCbbMCeС-іо арилу), -SO2(CH2)t(5-10-4neHHoro гетероциклу) і -OR5, t є цілим числом, що знаходиться в інтервалі від 0 до 5, -(CH2)t- замісники вищезгаданих R2 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t є цілим числом, що знаходиться в інтервалі від 2 до 5, і вищезгадані R2 групи, необов'язково, заміщені від 1 до З R групами, або R1 і R2 можуть бути взяті разом з атомом азоту, до якого кожний з них приєднаний, утворюючи 4-10-членне насичене моноциклічне або поліциклічне кільце або 5-10-членне гетероарильне кільце, де згадані насичене і гетероарильне кільця, необов'язково, включають 1 або 2 гетероатоми, що вибирають з О, S і -N(R 6 )-, на додаток до атому азоту, до якого приєднані R і R2, згадана -N(R 6 )- є, необов'язково, =N- або -N=, де R1 і R2 узяті разом у вигляді згаданої гетероарильної групи, згадане насичене кільце, необов'язково, може бути частково ненасиченим, включаючи 1 або 2 подвійних вуглець-вуглецевих зв'язки, і згадані насичене і гетероарильне кільця, включаючи R6 групу згаданої -N(R 6 )-, необов'язково, заміщені від 1 до З R4 групами, R є Н, С-і-С-ю алкілом, Сг-С-ю алкенілом, Сг-С-ю алкінілом, -(СНгМСб-С-ю арилом), або -(СЬЬМб-Ючленним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R3 групи, необов'язково, приконденсовані до Сє-С-ю арильної групи, Cs-Cs насиченої циклічної групи або 5-10-членноі гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, -(Cbbjt- замісники вищезгаданих R3 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t є цілим числом, що знаходиться в інтервалі від 2 до 5, і вищезгадані R3 групи, необов'язково, заміщені від 1 до 5 R групами, кожну R 4 незалежно вибирають з С-і-Сю алкілу, С-АС-іо алкенілу, Сг-Сю алкінілу, галогену, ціано, нітро, О ю (О CO О (О 60365 трифторметилу, трифторметокси, азидо, -OR , C(O)R 5 , -C(O)OR 5 , -NR 6 C(O)OR 5 -OC(O)R 5 , NR 6 SO 2 R 5 , -SO 2 NR 5 R 6 , -NR 6 C(O)R, -C(O)NR 5 R 6 , NR 5 R 6 , -S(O),R , де j є цілим числом, що знаходиться в інтервалі від 0 до 2, -SO3H, NR 5 (CR 6 R 7 ) t OR 6 , -(CH 2 )t(C 6 -Cio арилу), S0 2 (CH 2 )t(C6-Cio арилу), -S(CH 2 ) t (C 6 -Ci 0 арилу), 0(CH 2 ) t (C 6 -Cio арилу), -(CH 2 ) t (5-10-4neHHoro гетероциклу) і -(CR 6 R 7 ) m OR 6 , де m є цілим числом, що знаходиться в інтервалі від 1 до 5 і t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R4 групи, необов'язково, приконденсовані до Сє-С-ю арильної групи, Cs-Cs насиченої циклічної групи або 5-10-членноі гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, і алкільний, арильний і гетероциклічний замісники вищезгаданих R4 груп, необов'язково, заміщені від 1 до 3 замісниками, що незалежно вибирають з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, NR 6 SO 2 R 5 , -SO 2 NR 5 R 6 , -C(O)R 5 -C(O)OR , OC(p)R 5 , -NR 6 C(O)R 5 , -C(O)NR 5 R 6 , -NR 5 R 6 , (CR R 7 ) m OR 6 , де m є цілим числом, що знаходиться в інтервалі від 1 до 5, -OR 5 і замісників, вказаних для значень R5, кожну R5, незалежно, вибирають з Н, С-і-С-ю алкілу, -(СНгМСб-Сю арилу) і -(СН 2 )і(5-10-членного гетероциклу), де t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R групи, необов'язково, приконденсовані до Сб-Сю арильної групи, Cs-Cs насиченої циклічної групи, або 5-10-членноі гетероциклічної групи, і 5 вищезгадані R замісники, за винятком Н, необов'язково, заміщені від 1 до 3 замісниками, незалежно вибраними з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -C(O)R 6 , 6 6 6 C(O)OR , -CO(O)R , -NR C(O)R, -C(O)NR 6 R 7 , NR 6 R 7 , гідрокси, С-і-Сб алкілу і С-і-Сє алкокси, і кожна R і R7, незалежно, є Н або С-і-Сє алкілом, за умови, що згаданою сполукою формули 1 не є 1-метил-3-(4-карбамоіл-3-етокси-5ізотіазоліл)сечовина, 1,1-диметил-3-(4-карбамоіл3-етокси-5-ізотіазоліл)сечовина, 1-метил-3-(4карбамоіл-3-пропокси-5-ізотіазоліл)сечовина, 1метил-3-(4-карбамоіл-3-(метилтю)-5ізотіазоліл)сечовина, 1-метил-3-(4-карбамоіл-3(етилтю)-5-ізотіазоліл)-сечовина, 1,1-диметил-3-(4карбамоіл-3-(етилтю)-5-ізотіазоліл)сечовина, 1метил-3-(4-карбамоіл-3-(пропілтю)-5ізотіазоліл)сечовина, 1,1-диметил-3-(4-карбамоіл3-(пропілтю)-5-ізотіазоліл)сечовина або 1-метил-З(4-карбамоіл-3-(ізопропілтю)-5ізотіазоліл)сечовина 2 ПОХІДНІ ізотіазолу згідно з пунктом 1, в яких R2 є Н і R1 є С-і-С-ю алкілом, необов'язково, заміщеним 1 або 2 замісниками, що незалежно вибирають з NR 6 R 7 , -NR 5 (CR 6 R 7 ) t OR 6 і -(СНЩб-Ю-членного гетероциклу), де t є цілим числом, що знаходиться в інтервалі від 0 до 5 3 ПОХІДНІ ізотіазолу згідно з пунктом 2, в яких R1 вибирають з пропілу, бутилу, пентилу і гексилу, і згадані R1 групи, необов'язково, заміщені диметиламіно, гідрокси, піролідинілом, морфоліно і етил(2-пдроксіетил)амшо 4 ПОХІДНІ ізотіазолу згідно з пунктом 1, в яких R2 є Н і R1 є -(СН 2 )і(5-10-членним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана гетероциклічна група є, необов'язково, приконденсованою до Сє-С-ю арильної групи, Cs-Cs насиченої циклічної групи або 5-10-членноі гетероциклічної групи, і згадана R1 група, включаючи, необов'язково, приконденсовану частину згаданої R1 групи, є, необов'язково, заміщеною 1 або 2 замісниками, що незалежно вибирають з С1-С4 алкілу, гідрокси і гідро кс и метил у 5 ПОХІДНІ ізотіазолу згідно з пунктом 4, в яких гетероциклічні замісники згаданої Ri групи вибирають з морфоліно, піролідинілу, імідазолілу, піперазинілу, піперидинілу і 2,5-діазабіцикло[2 2 1]гепт-2илу, t змінюється у згаданій R1 групі в інтервалі від 2 до 5, і згадана R1 група, необов'язково, заміщена гідрокси, пдроксиметилом і метилом 6 ПОХІДНІ ізотіазолу згідно з пунктом 1, в яких R3 є -(СНгМСб-Сю арилом), де t є цілим числом, що знаходиться в інтервалі від 1 до 3, і згадана R3 група є, необов'язково, заміщеною від 1 до 4 R4 групами 7 ПОХІДНІ ізотіазолу згідно з пунктом 6, в яких R3 є бензилом, необов'язково, заміщеним від 1 до 4 замісниками, незалежно вибраними з галогену і С1-С4 алкілу 8 ПОХІДНІ ізотіазолу згідно з пунктом 7, в яких R3 є бензилом, необов'язково, заміщеним від 1 до 4 замісниками, незалежно вибраними з метилу, фтору, хлору і брому 9 ПОХІДНІ ізотіазолу згідно з пунктом 1, що вибирають з групи, яка містить наступні сполуки Мезилатна сіль 3-(4-Бром-2,6-дифторбензилокси)5-[3-(4-піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксаміду, 5-{3-(3-(4-Метилпіперазин-1-іл)пропіл]уреідо}-3(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилоксі)-5-(3-{4-[етил-(2пдроксіетил)амшо]бутил}-уреідо)ізотіазол-4карбоксамід, 3-(2-Фтор-4-метилбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-(3-{4-[4-(2пдроксіетил)піперазин-1-іл]-бутил}уреідо)ізотіазол4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-[3-(6диметиламшогексил)уреідо]ізотіазол-4карбоксамід, 3-(2-Фтор-4-метилбензилоксі)-5-[3-(5ізопропіламінопентил)уреідо]ізотіазол-4карбоксамід, Гідрохлоридна сіль 3-(4-Бром-2,6дифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреідо]ізотіазол-4-карбоксаміду, 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4 карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[2-(1метилпіролідин-2-іл)етил]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-(3-{4-[4-(2пдроксіетил)піперазин-1-іл]бутил}-уреідо)ізотіазол4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3-пдрокси5-піролідин-1-ілпентил)уреідо]-ізотіазол-4карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3,4дипдроксипіролідин-1-іл]бутил]-уреідо}ізотіазол-4карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(3,4дипдроксипіролідин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(2пдроксиметилпіролідин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(2пд роксиметил пірол ідин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3пдроксипіролідин-1-іл)бутил]-уреідо}ізотіазол-4карбоксамід, 3-(4-Бром-2,6-дифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4пдрокси-5-піперидин-1-ілпентил)уреідо]-ізотіазол4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3пдрокси-5-піперидин-1-іл)пентил]уреідо}ізотіазол4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(2пд роксиметил піперидин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-(3-{4-[етил(2-пдроксіетил)амшо]бутил}-уреідо)ізотіазол-4карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(5-пдрокси6-піперидин-1-іл)гексил)уреідо}-ізотіазол-4карбоксамід, 3-(4-Бром-2,3,6-трифторбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]-уреідо}ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3пдрокси-5-піролідин-1-ілпентил)уреідо]-ізотіазол-4карбоксамід, 5-[3-(4-Піролідин-1-ілбутил)уреідо]-3-(2,3,6трифтор-4-метилбензилоксі)ізотіазол-4карбоксамід, 5-[3-(3-Гідрокси-5-піролідин-1-ілпентил)уреідо]-3(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(5-метил2,5-діазабіцикло[2 2 1]гепт-2 60365 ил)пропіл)уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[3-(5метил-2,5-діазабіцикло[2 2 1]гепт-2ил)пропіл]уреідо)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[2-(1метилпіролідин-2-іл)етил]уреідо}-ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[4-(2пдроксиметилпіролідин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 5-{3-[2-(1 -Метил піролід ин-2-іл)-етил]уреідо}-3(2,3,6-трифтор-4-метилбензилоксі)-ізотіазол-4карбоксамід, 5-[3-(4-Диметиламшобутил)уреідо]-3-(2,3,6трифтор-4-метилбензилоксі)ізотіазол-4карбоксамід, 5-[3-(3-Диметиламшопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилоксі)ізотіазол-4карбоксамід, 5-[3-(3-Гідроксі-5-ізопропіламінопентил)уреідо]-3(2,3,6-трифтор-4-метилбензилоксі)ізотіазол-4карбоксамід, 5-[3-(3-Ізопропіламшопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилоксі)ізотіазол-4карбоксамід, 5-{3-[4-(4-Метилпіперазин-1-іл)бутил]уреідо}-3(2,3,6-трифтор-4-метилбензилоксі)-ізотіазол-4карбоксамід, 5-(3-{4-[4-(2-Пдроксіетил)піперазин-1іл]бутил}уреідо)-3-(2,3,6-трифтор-4метилбензилоксі)ізотіазол-4-карбоксамід, 5-[3-(3-Піролідин-1-ілпропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилоксі)ізотіазол-4карбоксамід, 5-[3-(4-Гідрокси-5-піперидин-1-ілпентил)уреідо]-3(2,3,6-трифтор-4метилбензилоксі)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилоксі)-5-[3-(4-імідазол1-ілбутил)уреідо]ізотіазол-4-карбоксамід, 5-(3-{4-[Етил-(2-пдроксіетил)амшо]бутил}уреідо)-3(2,3,6-трифтор-4-метил-бензилоксі)ізотіазол-4карбоксамід, 3-(4-Хлор-(2,3,6-трифторбензилокси)-5-{3-[4-(2пдроксиметилпіперидин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-[3-(3пдрокси-5-піролідин-1-ілпентил)-уреідо]ізотіазол-4карбоксамід, 3-(4-Бром-2,6-дифторбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[2-(1метилпіролідин-2-іл)етил]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4диметиламшобутил)уреідо]ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3диметиламшопропіл)уреідо]ізотіазол-4карбоксамід, 3-(4-Бром-2,3,6-трифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилоксі)-5-[3-(4імідазол-1-ілбутил)уреідо]ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилоксі)-5-(3-{3-[етил(2-пдроксіетил)амшо]пропіл}-уреідо)ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилоксі)-5-(3-{3-[етил(2-пдроксиетил)амшо]пропіл}-уреідо)ізотіазол-4карбоксамід 5-[3-(3-Метиламшопропіл)уреідо]-3-(2,3,6-трифтор4-метилбензилоксі)ізотіазол-4-карбоксамід, 5-[3-(3-Амшопропіл)-3-метилуреідо]-3-(2,3,6трифтор-4-метилбензилоксі)ізотіазол4-карбоксамід, 5-[3-(4-Діетиламшобутил)уреідо]-3-(2,3,6-трифтор4-метилбензилоксі)ізотіазол-4-карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3піролідин-1-ілпропіл)уреідо]ізотіазол-4карбоксамід, 3-(3-Хлор-2,6-дифтор-4-метилбензилокси)-5-[3-(4диметиламшобутил)уреідо]-ізотіазол-4карбоксамід, 5-(3-{4-[Біс(2-пдроксіетил)амшо]бутил}уреідо)-3(2,6-дифтор-4-метилбензилоксі)-ізотіазол-4карбоксамід, фармацевтично прийнятні солі, проліки і сольвати згаданих сполук 10 Фармацевтична композиція для лікування пперпроліферативного захворювання у ссавця, яка 60365 8 тиметаболіти, штеркалюючі антибіотики, інгібітори фактору росту, інгібітори клітинного циклу, ензими, інгібітори топоізомерази, модифікатори біологічної ВІДПОВІДІ, антигормони, антагоніст рецептора NK1, антагоніст 5-НТз рецептора, інгібітори СОХ-2, інгібітор EGFR і антиандрогени 19 Сполука, що вибрана з групи, яка містить (2,6дифтор-4-метилфеніл)метанол, (2,3,6-трифтор-4метилфеніл)метанол, (4-бром-2,6дифторфеніл)метанол, (4-бром-2,3,6трифторфеніл)метанол, (4-хлор-2,6дифторфеніл)метанол, (З-хлор-2,6дифторфеніл)метанол і (4-хлор-2,3,6трифторфеніл)метанол 20 Сполука, що вибрана з групи, яка містить 4Н $Н О ' ^ O P h включає терапевтично ефективну КІЛЬКІСТЬ ПОХІД НОЇ ізотіазолу згідно з пунктом 1 і фармацевтично прийнятний носій 11 Фармацевтична композиція згідно з пунктом 10, де згаданим пперпроліферативним захворюванням є рак, такий як рак мозку, легенів, лусочкових клітин, міхура, шлунка, підшлункової залози, грудей, голови, шиї, нирки, яєчника, простати, прямої кишки, стравоходу, гінекологічний або рак щитовидної залози 12 Фармацевтична композиція згідно з пунктом 10, де згаданим захворюванням є неракове пперпроліферативне захворювання 13 Фармацевтична композиція згідно з пунктом 12, де згаданим захворюванням є доброякісна гіперплазія шкіри або простати 14 Спосіб лікування пперпроліферативного захворювання у ссавця, при якому згаданому ссавцеві вводять терапевтично ефективну КІЛЬКІСТЬ похідної ізотіазолу згідно з пунктом 1 15 Спосіб згідно з пунктом 14, де згаданий спосіб використовують для лікування раку, такого як рак мозку, лусочкових клітин, міхура, шлунка, підшлункової залози, грудей, голови, шиї, стравоходу, простати, прямої кишки, легенів, нирки, яєчника, гінекологічного або раку щитовидної залози 16 Спосіб згідно з пунктом 14, де згаданий спосіб використовують при лікуванні неракового пперпроліферативного захворювання 17 Спосіб згідно з пунктом 16, де згаданий спосіб використовують при лікуванні доброякісної гіперплазії шкіри або простати 18 Спосіб лікування пперпроліферативного захворювання у ссавця, при якому згаданому ссавцеві вводять терапевтично ефективну КІЛЬКІСТЬ похідної ізотіазолу згідно з пунктом 1 в комбінації з антипухлинним агентом, що вибирають з групи, що містить інгібітори мітозу, алкілувальні агенти, ан 21 Сполука, що вибрана з групи, яка містить NH 11 ВпО ВпО '0 н OPh OPft 0 НО У -ынг NH О CN 23 v 22 \ RJO о N ІГ—NH, 24 OPh та "OPh де R6 є Н, С-і-С-ю алкілом, Сг-С-ю алкенілом, Сг-С-ю алкінілом, -(СНгМСб-С-ю арилом), або -(СЬЬМб-Ючленним гетероциклом), де t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R3 групи, необов'язково, приконденсовані до Сє-Сю арильної групи, Cs-Cs насиченої циклічної групи або 5-10-членноі гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, -(Cbbjt- замісники вищезгаданих R3 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'я 60365 зок, де t є цілим числом, що знаходиться в інтер3 валі від 2 до 5, і вищезгадані R групи, необов'язково, заміщені від 1 до 5 R групами, 4 кожну R незалежно вибирають з С-і-Сю алкілу, С 2 алкенілу, алкінілу, галогену, ціано, нітро, 55 трифторметилу, трифторметокси, азидо, -OR , 5 5 6 5 5 C(O)R , -C(O)OR -NR C(O)OR -OC(O)R , 6 5 5 6 5 6 NR SO 2 R , -SO 2 NR R , - N R X ( O ) R , -C(O)NR R , 5 6 7 NR R , -S(O),R , де j є цілим числом, що знаходиться в інтервалі від 0 до 2, -SO3H, 5 5 6 6 NR (CR R ) t OR , -(CH 2 )t(C 6 -Cio арилу), S0 2 (CH 2 )t(C6-Cio арилу), -S(CH 2 ) t (C 6 -Ci 0 арилу), 0(CH 2 ) t (C 6 -Cio арилу), -(CH 2 ) t (5-10-4neHHoro гете6 7 6 роциклу) і -(CR R ) m OR , де m є цілим числом, що знаходиться в інтервалі від 1 до 5, і t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R4 групи, необов'язково, приконденсовані до Сє-С-ю арильної групи, Cs-Cs насиченої циклічної групи, або 5-10-членноі гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, і алкільний, арильний і гетероциклічний замісники вищезгаданих R4 груп, необов'язково, заміщені від 1 до 3 замісниками, що незалежно вибирають з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо,NR 6 SO 2 R 5 , -SO 2 NR 5 R 6 , -C(O)R 5 -C(O)OR , 5 6 5 OC(O)R , -NR C(O)R , -C(O)NR 5 R 6 , -NR 5 R 6 , (CR 6 R 7 ) m OR 6 , де m є цілим числом, що знаходиться в інтервалі від 1 до 5, -OR 5 і замісників, вказаних для значень R5, кожну R5, незалежно, вибирають з Н, С-і-С-ю алкілу, -(СНгМСб-Сю арилу) і -(СН 2 )і(5-10-членного гетероциклу), де t є цілим числом, що знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R6)-, за умови, що два атоми О, два атоми S або атоми О і S не зв'язані безпо Цей винахід стосується нових похідних ізотіазолу, що використовуються при лікуванні пперпроліферативних захворювань, таких як рак, у ссавців Цей винахід також стосується способу використання таких сполук при лікуванні пперпроліферативних захворювань у ссавців, особливо людей, і до фармацвтичних композицій, що містять такі сполуки Відомо, ЩО клітина може ставати раковою внаслідок перетворення частини її ДНК в онкоген (тобто, ген, активація якого приводить до утворення злоякісних пухлинних клітин) Багато онкогенів кодують протеїни, які є аберрантними тірозинкіназами, що здатні трансформувати клітину Альтернативно, надмірна експресія нормальної протоонкогенної тірозинкінази може також приводити до проліферативних захворювань, що ІНОДІ є результатом злоякісного фенотипу Показано, що деякі тірозинкінази можуть мутувати або над 10 середньо один з одним, згадані арильна і гетероциклічна R групи, необов'язково, приконденсовані до Сб-Сю арильної групи, Cs-Cs насиченої циклічної групи, або 5-10-членноі гетероциклічної групи, і вищезгадані R5 замісники, за винятком Н, необов'язково, заміщені від 1 до 3 замісниками, незалежно вибраними з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, -C(O)R , C(O)OR6, -CO(O)R6, -NR6C(O)R, -C(O)NR6R7, NR5R6, гідрокси, С-і-Сб алкілу і С-і-Сє алкокси, і кожна R , R7, незалежно, є Н або С-і-Сє алкілом 22 Спосіб одержання похідних ізотіазолу згідно з пунктом 1, при якому або (а) сполуку формули 18 вводять у взаємодію зі сполукою формули R3-X, в якій X є галогеном і R3 є такою, як зазначено в пункті 1, і одержану сполуку обробляють сполукою формули R1R NH, в якій R1 і R2 є такими, як зазначено в пункті 1, або (б) сполуку формули 25 R3O в якій R3 є такою, як зазначено в пункті 1, вводять у взаємодію зі сполукою формули R1R2NH, в якій R1 і R2 є такими, як зазначено в пункті 1 мірно експресувати в багатьох людських ракових клітинах, таких як клітини мозку, легенів, лусочкові клітини, клітини міхура, шлунку, грудей, голови і шиї, стравоходу, гінекологічних клітинах і клітинах щитовидної залози В подальшому, надмірна експресія ліганда для рецептора тірозинкінази може приводити до підвищення порогу активування рецептору, що приводить до проліферації клітин пухлини або ендотеліальних клітин Таким чином, зрозуміло, що інгібітори рецептору тірозинкінази, такі як сполуки представленого винаходу можуть бути використані в якості селективних інгібіторів росту ракових клітин у ссавців Відомо, ЩО поліпептид фактору росту, такий як васкулярний ендотеліальний фактор росту (ВЕФР) має високу спорідненість до людського рецептору вставляємоі-домен-вмісноікінази (РДК) або рецептору мишиної ембріональної кі 11 нази печінки (ЕКП-1), зв'язаного з проліферацією ендотеліальних клітин і більшої частини васкулогенезису і анпогенезису Дивіться міжнародну заявку опубліковану під номером РСТ WO 95/21613 (що опублікована 17 серпня 1995) Агенти, такі як сполуки представленого винаходу, що здатні зв'язувати або модулювати РДК/ЕКП-1 рецептор можуть бути використані при лікуванні захворювань що належать до вас кул о генезису і анпогенезису, таких як діабет, діабетична ретінопатія, гемангіома, гліома, меланома, саркома Капосіса і рак яєчників, грудей, легенів, підшлункової залози, простати, товстої кишки і епідермію ПОХІДНІ ізотіазолу, що використовуються в якості гербіцидів описані в патентах US 4059433 та 4057416, що належать ФМК Корпорейшн Представлений винахід стосується сполук формули 1 їх фармацевтично прийнятних солей, проліків, сольватів, в яких X 1 є О або S, R1 є Н, С-і-С-ю алкілом, С 2 -Сю алкенілом, С 2 С-іо алкінілом, -С(О)(Сі-Сю алкілом), -(СНгМСєС-іо арилом), -(CH2)t(4-10 членним гетероциклом), -C(0)(CH 2 )t(C 6 -Cio арилом), або -C(O)(CH 2 )t(5-10 членним гетероциклом), де t знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R 6 )-, при умові, що два атоми О, два атоми S або атом О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R групи, необов'язково, приконденсовані до Сб-Сю арильної групи, Cs-Cs насиченої циклічної групи, або 5-10 членної гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, -(CH2)t- замісники, вищезгаданих R груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t знаходиться в інтервалі від 2 до 5, і вищезгадані R1 групи, за винятком Н, необов'язково, заміщені від 4 1 до З R груп, R2 вибирають з переліку замісників передбачених наступними значеннями R1, -SO 2 (CH 2 )t(C6С-іо арил), -SO2(CH2)t(5-10 членний гетероцикл) і OR 5 , t знаходиться в інтервалі від 0 до 5, -(CH2)tзамісники, вищезгаданих R2 груп, необов'язково, включають подвійний або потрійний вуглецьвуглецевий зв'язок, де t знаходиться в інтервалі від 2 до 5, і вищезгадані R2 групи, необов'язково, заміщені від 1 до З R4 груп, або R1 і R2 можуть бути взяті разом з атомом вуглецю до якого вони приєднані утворюючи 4-10 членне насичене моноциклічне або поліциклічне кільце або 5-10 членне гетероарильне кільце, де згадані насичене і гетероарильне кільця, необов'язково, включають 1 або 2 гетероатоми, що вибирають з О, S і -N(R 6 )-, на додаток до атому азоту до якого приєднані R1 і R , згадана -N(R 6 ) 60365 12 1 2 є, необов'язково, =N- або -N=, де R і R узяті разом, у вигляді згаданої гетероарильної групи, згадане насичене кільце, необов'язково, може бути частково ненасиченим включаючи 1 або 2 два подвійних вуглець-вуглецевих зв'язки, і згадані насичене і гетероарильне кільця, включаючи 6 R групу, згаданої -N(R )-, необов'язково, заміще4 ні від 1 до З R груп, 3 R є Н, С-і-С-ю алкілом, С 2 -Сю алкенілом, С 2 С-іо алкінілом, -(СНгМСб-С-ю арилом), або (CH 2 )t(5-10 членним гетероциклом), де t знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетероза6 місники, що вибирають з О, S і -N(R )-, при умові, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані 3 арильна і гетероциклічна R групи, необов'язково, приконденсовані до Сє-С-ю арильної групи, Cs-Cs насиченої циклічної групи або 5-10 членної гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, -(CH2)t- замісники, вищезгаданих R3 груп, необов'язково, включають подвійний або потрійний вуглець-вуглецевий зв'язок, де t знаходиться в інтервалі від 2 до 5, і вищезгадані R3 групи, необов'язково, заміщені від 1 до 5 R4 груп, кожну R4 незалежно вибирають з С-і-С-ю алкілу, С 2 -Сю алкенілу, С 2 -Сю алкінілу, галогену, ціано, нітро трифторметилу, трифторметокси, азидо, - O R , -C(O)R 5 , -C(O)OR 5 -NR 6 C(O)OR 5 OC(O)R , -NR U SO 2 R -SO 2 NR°R L -NR U C(O)R , C(O)NR 5 R 6 , -NR 5 R 6 , -S(O),R Де J знаходиться інтервалі від 0 до 2, -SO 3 H, -NR D (CR D R') t OR D , (CH 2 ) t (C 6 -Cio арил), -S0 2 (CH 2 ) t (C 6 -Cio арил), S(CH 2 ) t (C 6 -Cio арил), -0(CH 2 ) t (C 6 -Cio арил), (CH 2 ) t (5-10 членний гетероцикл), і -(CR 6 R 7 ) m OR 6 , де m знаходиться в інтервалі від 1 до 5 і t знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R 6 )-, при умові, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R4 групи, необов'язково, приконденсовані до Сє-С-ю арильної групи, Cs-Cs насиченої циклічної групи, або 5-10 членної гетероциклічної групи, 1 або 2 атоми вуглецю у згаданих гетероциклічних замісниках, необов'язково, заміщені оксо (=0) замісником, і алкільний, арильний і гетероциклічний замісники, вищезгаданих R4 груп, необов'язково, заміщені від 1 до 3 замісників, що незалежно вибирають з галогену, ціано, нітро, трифторметилу, трифторметокси, азидо, NR 6 SO 2 R 5 , -SO 2 NR 5 R 6 , -C(O)R 5 -C(O)OR , OC(p)R 5 , -NR 6 C(O)R 5 , -C(O)NR 5 R 6 , -NR 5 R 6 , (CR R 7 ) m OR 6 , де m знаходиться в інтервалі вщ 1 до 5, -OR 5 1 замісників вказаних для значень R , кожну R5, незалежно, вибирають з Н, С-і-Сю алкілу, -(СНгМСб-Сю арилу), і -(CH 2 )t(5-10 членного гетероциклу), де t знаходиться в інтервалі від 0 до 5, згадана алкільна група, необов'язково, включає 1 або 2 гетерозамісники, що вибирають з О, S і -N(R 6 )-, при умові, що два атоми О, два атоми S або атоми О і S не зв'язані безпосередньо один з одним, згадані арильна і гетероциклічна R4 групи, необов'язково, приконденсовані до 13 Сб-Сю арильної групи, Cs-Cs насиченої циклічної групи, або 5-10 членної гетероциклічної групи, і 5 вищезгадані R замісники, за винятком Н, необов'язково, заміщені від 1 до 3 замісників, незалежно вибраних з галогену, ціано, нітро, трифторме6 6 тилу, трифторметокси, азидо, -C(O)R , -C[O)OR , 6 6 7 6 7 6 -CO(O)R , -NR C(O)R , -C(O)NR R , - N R R , гідрокси, С-і-Сб алкіл, і Сі-Сб алкокси, 6 7 і, кожна R 1 R , незалежно, Н або С-і-Сє алкіл, при умові, що згаданою сполукою формули 1 не є 1-метил-3-(4-карбамоіл-3-етокси-5ізотіазоліл)сечовина, 1,1-диметил-3-(4-карбамоіл3-етокси-5-ізотіазоліл)сечовина, 1-метил-3-(4карбамоіл-3-пропокси-5-ізотіазоліл)сечовина, 1метил-3-(4-карбамоіл-3-(метилтю)-5ізотіазоліл)сечовина, 1-метил-3-(4-карбамоіл-3(етилтю)-5-ізотіазоліл)-сечовина, 1,1-диметил-З(4-карбамоіл-3-(етилтю)-5-ізотіазоліл)сечовина, 1-метил-3-(4-карбамоіл-3-(пропілтю)-5ізотіазоліл)сечовина, 1,1-диметил-3-(4-карбамоіл3-(пропілтю)-5-ізотіазоліл)сечовина або 1-метил3-(4-карбамоіл-3-(ізопропілтю)-5ізотіазоліл)сечовина Переважні сполуки формули 1 включають такі, в яких R2 є Н і R є С-і-С-ю алкілом, необов'язково, заміщеним 1 або 2 замісниками, що незалежно вибирають з -NR 5 R 6 , -NR 5 (CR 6 R 7 ) t OR 6 і (CH2)t(5-10 членного гетероциклу), де t знаходиться в інтервалі від 0 до 5 Специфічно переважні R1 групи включають пропіл, бутил, пентил і гексил, необов'язково, заміщений диметиламшо, гідрокси, пірол ІДИНІЛ, морфоліно, і етил-(2пдроксиетил)амшо Інші переважні сполуки формули 1 включають такі, в яких R2 є Н і R1 є -(CH2)t(5-10 членного гетероциклу), де t знаходиться в інтервалі від 0 до 5, згадана гетероциклічна група є, необов'язково, приконденсованою до Сє-С-ю арильної групи, Сб-Св насиченої циклічної групи або 5-10 членної гетероциклічної групи, і згадана R1 група, включає, необов'язково, приконденсовану части1 ну згаданої R групи, є, необов'язково, заміщеною 1 або 2 замісниками, що незалежно вибирають з С1-С4 алкілу, гідрокси і пдроксиметилу Специфічно, переважними гетероциклічними групами згаданої R1 групи є морфоліно, піролідиніл, імідазоліл, піперазиніл, піперидиніл, і 2,5діазабіцикло[2 2 1]гепт-2-ил, t змінюється у згаданій R1 групі в інтервалі від 2 до 5, і згадані гетероциклічні групи, необов'язково, заміщені гідрокси, пдроксиметилом і метилом Інші переважні сполуки формули 1 включають такі, в яких R3 є -(СНгМСб-С-ю) арилом), де t знаходиться в інтервалі від 1 до 3 і згадана R3 група є необов'язково заміщеною від 1 до 4 R4 груп Специфічно переважні R3 групи включають бензил, необов'язково, заміщений від 1 до 4 замісників, незалежно вибраних з галогену і С1-С4 алкілу Більш специфічно, переважні R3 групи включають бензил заміщений від 1 до 4 замісників, незалежно вибраних з метилу, фтору, хлору і брому Специфічні втілення представленого винаходу включають наступні сполуки 5-{3-[3-(4-Метилпіперазин-1-іл)пропіл]уреідо}3-(2,3,6-трифтор-4-метил-бензилокси)ізотіазол-4 60365 14 карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-(3-{4[етил(2-пдроксиетил)амшо]бутил}уреідо)ізотіазол-4-карбоксамід, 3-(2-Фтор-4-метилбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-(3-{4-[4(2-пдроксиетил)піперазин-1-іл]бутил}уреідо)ізотіазол-4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-[3-(6диметиламшогексил)уреідо]ізотіазол-4карбоксамід, 3-(2-Фтор-4-метилбензилокси)-5-[3-(5ізопропіламінопентил)уреідо]ізотіазол-4карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(1метилпіролідин-2-іл)етил]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-(3-{4-[4(2-пдроксиетил)піперазин-1-іл]бутил}уреідо)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3пдрокси-5-піролідин-1-іл)пентил]уреідо}-ізотіазол4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4(3,4-дипдроксипіролідин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(3,4дипдроксипіролідин-1-іл)бутил]-уреідо}ізотіазол4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(2пд роксиметил пірол ід ин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(2пд роксиметил пірол ід ин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3пдроксипіролідин-1-іл)бутил]-уреідо}ізотіазол-4карбоксамід, 3-(4-Бром-2,6-дифторбензилокси)-5-(3-(4піролідин-1-ілбутил)уреідо)ізотіазол-4карбоксамід, Мезилатна сіль 3-(4-бром-2,6дифторбензилокси)-5-[3-(4-піролідин-1-ілбутил)уреідо]ізотіазол-4-карбоксаміду, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4пдрокси-5-піперидин-1-ілпентил)уреідо]-ізотіазол4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(3пдрокси-5-піперидин-1-іл)пентил]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[4-(2пд роксиметил піперидин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(2,5-Дифтор-4-метилбензилокси)-5-(3-{4[етил(2-пдроксиетил)амшо]бутил} 60365 15 уреідо)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(5пдрокси-6-піперидин-1-іл)гексил)уреідо}ізотіазол-4-карбоксамід, 3-(4-Бром-2,3,6-трифторбензилокси)-5-{3-[3(4-метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[3-(4метилпіперазин-1)-ілпропіл]уреідо}-ізотіазол-4карбоксамід, Гідрохлоридна сіль 3-(4-бром-2,6дифторбензилокси)-5-{3-(4-піролідин-1-ілбутил)уреідо}ізотіазол-4-карбоксаміду, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3пдрокси-5-піролідин-1-ілпентил)уреідо]-ізотіазол4-карбоксамід, 5-[3-(4-Піролідин-1-ілбутил)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 5-[3-(3-Гідрокси-5-піролідин-1 ілпентил)уреідо]-3-(2,3,6-трифтор-4-метилбензилокси)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(5метил-2,5-діазабіцикло[2 2 1]гепт-2іл)пропіл]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[3(5-метил-2,5-діазабіцикло[2 2 1]гепт-2іл)пропіл]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[2(1-метил пірол ід ин-2-іл)етил]уреідо}-ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-{3-[4(2-пдроксиметилпіролідин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід, 5-{3-[2-(1-Метил піролід ин-2-іл)етил]уреідо}-3(2,3,6-трифтор-4-метилбензилокси)-ізотіазол-4карбоксамід, 5-[3-(4-Диметиламшобутил)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 5-[3-(3-Диметиламінопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 5-[3-(3-Гідрокси-5ізопропропіламінопентил)уреідо]-3-(2,3,6трифтор-4-метил-бензилокси)ізотіазол-4карбоксамід, 5-[3-(3-Ізопропіламшопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 5-{3-[4-(4-Метилпіперазин-1-іл)бутил]уреідо}3-(2,3,6-трифтор-4-метилбензилокси)-ізотіазол-4карбоксамід, 5-(3-{4-[4-(2-Гідроксиетил)піперазин-1іл]бутил}уреідо)-3-(2,3,6-трифтор-4-метилбензилокси)ізотіазол-4-карбоксамід, 5-[3-(3-Піролідин-1-ілпропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 5-[3-(4-Пдрокси-5-піперидин-1 ілпентил)уреідо]-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(4 16 імідазол-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 5-(3-{4-[Етил-(2пдроксиетил)аміно]бутил}уреідо)-3-(2,3,6трифтор-4-метил-бензилокси)ізотіазол-4карбоксамід, 3-(4-Хлор-(2,3,6-трифторбензилокси)-5-{3-[4(2-пдроксиметилпіперидин-1іл)бутил]уреідо}ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифтор-бензилокси)-5-[3-(3пдрокси-5-піролідин-1-ілпентил)-уреідо]ізотіазол4-карбоксамід, 3-(4-Бром-2,6-дифторбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[2-(1метилпіролідин-2-іл)етил]уреідо}-ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4диметиламшобутил)уреідо}ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3диметиламшопропіл)уреідо]ізотіазол-4карбоксамід, 3-(4-Бром-2,3,6-трифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-[3-(4імідазол-1-ілбутил)уреідо]ізотіазол-4карбоксамід, 3-(4-Хлор-2,3,6-дифторбензилокси)-5-(3-{3(етил(2-пдроксиетил)амшо]пропіл}уреідо)ізотіазол-4-карбоксамід, 3-(4-Хлор-2,3,6-трифторбензилокси)-5-(3-{3[етил(2-пдроксиетил)амшо]пропіл}уреідо)ізотіазол-4-карбоксамід, 5-[3-(3-Метиламшопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 5-[3-(3-Амінопропіл)-3-метилуреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 5-[3-(4-Діетиламшобутил)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід, 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3піролідин-1-ілпропіл)уреідо]ізотіазол-4карбоксамід, 3-(3-Хлор-2,6-дифтор-4-метилбензилокси)-5[3-(4-диметиламшобутил)уреідо]-ізотіазол-4карбоксамід, 5-(3-{4-[Біс-(2пдроксиетил)амшо]бутил}уреідо)-3-(2,6-дифтор4-метилбензилокси)-ізотіазол-4-карбоксамід, і фармацевтично прийнятні солі і гідрати вказаних вище сполук Винахід також стосується фармацевтичної композиції для лікування пперпроліферативного захворювання у ссавця, яка включає терапевтично ефективну КІЛЬКІСТЬ сполуки формули 1, або м фармацевтично прийнятної солі або и гідрату, і фармацевтично прийнятний носій В одному з втілень, згадана фармацевтична композиція придатна для лікування раку, такого як рак мозку, легенів, лусочкових клітин, міхура, шлунку, підшлункової залози, грудей, голови, шиї, нирки, простати, прямої кишки, стра 60365 18 17 воходу, гінекологічних (таких як яєчників) або антиандрогени раку щитовидної залози В іншому втіленні, згаВинахід також стосується способу лікування дана фармацевтична композиція придатна для панкреатиту або захворювання нирок у ссавця, лікування неракового пперпроліферативного заякий включає призначення згаданому ссавцю хворювання, такого як легка гіперплазія шкіри терапевтично ефективної КІЛЬКОСТІ сполуки фор(наприклад, псоріаз) або простати (наприклад, мули 1, або и фармацевтично прийнятної солі легка гіпертрофія простати (ЛГП)) або и гідрату Винахід також стосується фармацевтичної Винахід також стосується способу поперекомпозиції для лікування панкреатиту або захводження бластоциту імплантанту у ссавця, який рювання нирок (включаючи проліферативні глувключає призначення згаданому ссавцю терапемеронефрити і діабетвикликані захворювання втично ефективної КІЛЬКОСТІ сполуки формули 1, нирок) у ссавця, яка включає терапевтично ефекабо и фармацевтично прийнятної солі або и гідтивну КІЛЬКІСТЬ сполуки формули 1, або и фармарату цевтично прийнятної солі або и гідрату, і фармаВинахід також стосується способу лікування цевтично прийнятний носій захворювання, що залежать від васкулогенезу або анпогенезу у ссавця, який включає признаВинахід також стосується фармацевтичної чення згаданому ссавцю терапевтично ефективкомпозиції для попередження бластоциту імпланної КІЛЬКОСТІ сполуки формули 1, або її фармацетанту у ссавця, яка включає терапевтично ефеквтично прийнятної солі або її гідрату В одному з тивну КІЛЬКІСТЬ сполуки формули 1, або и фармавтілень, згаданий спосіб придатний для лікування цевтично прийнятної солі або и гідрату, і фармазахворювання, що вибирають з групи що містить цевтично прийнятний носій анпогенез пухлини, хронічні запальні захворюВинахід також стосується фармацевтичної вання, такі як ревматоїдний артрит, атеросклекомпозиції для лікування захворювання, що зароз, захворювання шкіри, такі як псоріаз, екзема і лежать від васкулогенезу або анпогенезу у ссавсклеродерма, діабет, діабетична ретінопатія, пеця, яка включає терапевтично ефективну КІЛЬредчасна ретінопатія, дегенерація м'язів виклиКІСТЬ сполуки формули 1, або и фармацевтично кана віком, гемангіома, гліома, меланома, саркоприйнятної солі або и гідрату, і фармацевтично ма Капосіса і яєчників, рак грудей, легенів, страприйнятний носій В одному з втілень, згадана воходу, простати, товстої кишки і епідермоіду фармацевтична композиція придатна для лікування захворювання, що вибирають з групи що В подальшому, сполуки представленого вимістить анпогенез пухлини, хронічні запальні занаходу можуть бути використані в якості контрахворювання, такі як ревматоїдний артрит, атероцептивів для ссавців склероз, захворювання шкіри, такі як псоріаз, Пацієнти, що можуть лікуватись сполуками екзема і склеродерма, діабет, діабетична ретіноформули 1, і фармацевтично прийнятними соляпатія, передчасна ретінопатія, дегенерація м'язів ми і гідратами згаданих сполук, згідно з способавикликана віком, гемангіома, гліома, меланома, ми цього винаходу включають, наприклад, пацієсаркома Капосіса і яєчників, рак грудей, легенів, нтів для яких був поставлений діагноз псоріаз, стравоходу, простати, товстої кишки і епідермоіЛГП, рак легенів, рак кісток, рак підшлункової залози, рак шкіри, рак голови і шиї, меланома ДУ шкіри або внутрішньоочна меланома, рак череВинахід також стосується способу лікування вини, рак яєчників, рак прямої кишки або рак пперпроліферативного захворювання у ссавця, анальної області, рак шлунку, рак товстої кишки, який включає призначення згаданому ссавцю рак грудей, гінекологічні пухлини (наприклад, терапевтично ефективної КІЛЬКОСТІ сполуки форсаркома черевини, карцинома фалопієвих труб, мули 1, або и фармацевтично прийнятної солі карцинома ендометрію, карцинома шийки, карциабо и гідрату В одному з втілень, згаданий спосіб нома вапни або карцинома вульви), хвороба Ходстосується лікування раку, такого як рак мозку, гкінса, рак стравоходу, рак малої кишки, рак енлегенів, лусочкових клітин, міхура, шлунку, піддокринної системи (наприклад, рак щитовидної шлункової залози, грудей, голови, шиї, нирки, залози, паращитовидної або надниркових залоз), простати, прямої кишки, стравоходу, гінекологічсаркома м'яких тканин, рак уретри, рак пенісу, рак них (таких як яєчників) або раку щитовидної запростати, хронічна або гостра лейкемія, тверді лози В іншому втіленні, згаданий спосіб стосупухлини в дитинстві, лімфоназа лімфоцитів, рак ється лікування неракового пперпроліферативноміхура, рак нирок або мочеточнику (наприклад, го захворювання, такого як доброякісна гіперплакарцинома клітин нирок, карцинома ниркової лозія шкіри (наприклад, псоріаз) або простати ханки) або неоплазми центральної нервової сис(наприклад, легка прпертрофія простати (ЛГП)) теми (наприклад, первинна лімфома ЦНС, пухВинахід також стосується способу лікування лина спинальної ВІСІ, гліома стволу мозку або пперпроліферативного захворювання у ссавця, пітуїтарна аденома) який включає призначення згаданому ссавцю терапевтично ефективної КІЛЬКОСТІ сполуки форПредставлений винахід також стосується мули 1, або и фармацевтично прийнятної солі проміжних сполук, що вибирають з групи, яка або и гідрату, в комбінації з антипухлинним агенмістить (2,6-дифтор-4-метилфеніл)метанол, том, що вибирають з групи, що містить інгібітори (2,3,6-трифтор-4-метилфеніл)метанол, (4-броммітотику, алкілуючі агенти антиметаболіти, анти2,6-дифторфеніл)метанол, (4-бром-2,3,6біотики вставки, інгібітори фактору росту, інгібітотрифторфеніл)метанол, (4-хлор-2,6ри циклу клітин, ензими, інгібітори топоізомерази, дифторфеніл)метанол, (З-хлор-2,6модифікатори біологічної ВІДПОВІДІ, антигормони і дифторфеніл)метанол і (4-хлор-2,3,6 60365 19 трифторфеніл)-метанол Представлений винахід також стосується проміжних сполук, що вибирають з групи, яка містить SH О н,со Представлений винахід також стосується проміжних сполук, що вибирають з групи, яка містить ВпО. ,CN S 7 2 3 в якій R є такими як зазначено вище Представлений винахід також стосується способу одержання сполуки формули 1, який включає або (а) взаємодію сполуки формули 18 о l з сполукою формули R3-X, в якій X є галогеном і R3 є такою як зазначено вище, і одержану сполуку обробляють сполукою формули R1R2NH, в якій R1 і R є такими як зазначено вище, або, (б) взаємодію сполуки формули 25 о R3O в якій R3 є такою як зазначено вище, з сполукою формули R1R2NH, в якій R1 і R2 є такими як зазначено вище Термін "галоген", що використовується тут, якщо не вказано інше, включає фтор, хлор, бром та йод Переважно галогеном є фтор, хлор або бром Термін "алкіл", що використовується тут, як 20 що не вказано інше, включає насичені моновалентні вуглеводневі радикали, які мають лінійну, розгалужену або циклічну структуру Зрозуміло, що у випадку циклічної структури, згадана алкільна група, має принаймні три атоми вуглецю Термін "алкеніл", що використовується тут, якщо не вказано інше, включає моновалентні вуглеводневі радикали, які мають принаймні один вуглець-вуглецевий подвійний зв'язок і також має лінійну, розгалужену або циклічну структуру, як передбачено вище для значень "алкіл" Термін "алкініл", що використовується тут, якщо не вказано інше, включає моновалентні вуглеводневі радикали, які мають принаймні один вуглець-вуглецевий потрійний зв'язок і також має лінійну, розгалужену або циклічну структуру, як передбачено вище для значень "алкіл" Термін "алкокси", що використовується тут, якщо не вказано інше, включає -О-алкільні групи, в якій "алкіл" такий, як зазначено вище Термін "арил", що використовується тут, якщо не вказано інше, включає органічний радикал, похідне від ароматичних вуглеводнів у якому відсутній один водень, такий як, феніл або нафтил Термін "4-10 членний гетероцикл", що використовується тут, якщо не вказано інше, включає ароматичну гетероциклічну групу, що містить один або більшу КІЛЬКІСТЬ гетероатомів, кожен вибраний з О, S і N, в якій кожна гетероциклічна група має містити 4-10 атомів в цій ЦИКЛІЧНІЙ системі Неароматичні гетероциклічні групи включають групи, що мають 4 атоми в їх ЦИКЛІЧНІЙ системі, але ароматичні гетероциклічні групи повинні містити принаймні 5 атомів в їх ЦИКЛІЧНІЙ системі Гетероциклічні групи включають бензоконденсовані ЦИКЛІЧНІ системи і ЦИКЛІЧНІ системи заміщені одним або більшою КІЛЬКІСТЮ оксозамісників Прикладом 4 членних гетероциклічних груп є азетидиніл (похідне від азетидину) Прикладом 5 членних гетероциклічних груп є тіазоліл і прикладом 10 членних гетероциклічних груп є ХІНОЛІНІЛ Прикладами неароматичних гетероциклічних груп є піролідиніл, тетрапдрофураніл, тетрапдротієніл, тетрапдропіраніл, тетрапдротюпіраніл, піперидино, морфоліно, тюморфоліно, тюксаніл, піперазиніл, азетидініл, оксетаніл, тієтаніл, гомопіперидиніл, оксепаніл, тієпаніл, оксазепініл, діазеПІНІЛ, тіазепініл, 1,2,3,6-тетрапдропіридиніл, 2піроліл, 3-піроліл, ІНДОЛІЛ, 2Н-піраніл, 4Н-піраніл, дюксаніл, 1,3-дюксоланіл, піразолініл, дитіаніл, дитюланіл, дипдропіраніл, дипдротієніл, дипдрофураніл, піразолідиніл, імідазолініл, імідазолідиніл, 3-азабіцикло[31 0]гексаніл, Зазабіцикло[4 1 0]гептаніл, ЗН-індоліл і ХІНОЛІЗИНІЛ Прикладами ароматичних груп є піридиніл, імідазоліл, піримідиніл, піразоліл, тіазоліл, піразиніл, тетразоліл, фурил, ТІЄНІЛ, ізоксазоліл, тіазоліл, оксазоліл, ізотіазоліл, піроліл, ХІНОЛІНІЛ, ІЗОХІНОЛІНІЛ, ІНДОЛІЛ, бензімідазоліл, безофураніл, циноліл, індазоліл, ІНДОЛІЗИНІЛ, фталазиніл, піридазиніл, тіазиніл, ІЗОІНДОЛІЛ, птеридиніл, пуриніл, оксадіазоліл, тіадіазолініл, фуразаніл, бензофуразаніл, безотюфеніл, бензотіазоліл, бензоксазоліл, хіназолініл, хіноксалініл, нафтиридиніл і фуропіридиніл Згадані вище групи, які одержуються з сполук переврахованих вище, можуть бути при 60365 21 єднані, як це можливо, по атомам С або N Наприклад, група, що одержується з піролу може бути пірол-1-іл (N-приєднана) або пірол-3-іл (Сприєднана), Фраза "фармацевтично прийнятна СІЛЬ(СОЛІ)", що використовується тут, якщо не вказано інше, включає солі кислотних або основних груп, що можуть бути присутні в сполуках формули І Сполуки формули 1, що є основними за природою, здатні до утворення широкого переліку солей з різноманітними неорганічними і органічними кислотами Кислоти, що можуть використовуватись для одержання фармацевтично прийнятних кислотноадитивних солей основних сполук формули 1 з утворенням не токсичних кислотноадитивних солей, наприклад, солей, що містять фармакологічно прийнятні аніони, такі як пдрохлоридні, пдробромідні, пдройодидні, нітратні, сульфатні, бісульфатні, фосфатні, кислофосфатні, ізонікотинатні, ацетатні, лактатні, саліцилатні, цитратні, кисло-цитратні, тартратні, пантотенатні бітартратні, аскорбатні, сукцинатні, малеатні, гентисинатні, фумаратні, глюконатні, глукоранатні, сахаратні, форміатні, бензоатні, глутаматні, метансульфонатні, етансульфонатні, бензолсульфонатні, п-толуолсульфонатні та памоатні (наприклад, 1,1'-метилен-біс-(2-пдрокси-3нафтоат)) солі Сполуки формули 1, що є кислими за природою, здатні утворювати солі з різноманітними фармакологічно прийнятними катіонами Приклади таких солей включають солі лужних і лужноземельних металів і, зокрема, солі натрію і калію Деякі сполуки формули 1 можуть мати асиметричний центр і існувати в різноманітних енантюмерних формах Цей винахід стосується використання всіх оптичних ізомерів і стерюїзомерів сполук формули 1 і їх сумішей Сполуки формули 1 можуть також існувати у вигляді таутомеріє Цей винахід стосується використання всіх таких таутомеріє і їх сумішей В об'єкти винаходу також еключені ІЗОТОПМІчені сполуки і їх фармацевтично прийнятні солі, які подібні до представлених формулою 1, але в яких один або більша КІЛЬКІСТЬ атомів замінена атомами, що мають атомну масу або масове число, що відрізняється від атомної маси або атомного числа, що звичайно зустрічаються у природі Прикладами ІЗОТОПІВ, ЩО можуть бути введені у сполуки винаходу включають ізотопи водню, вуглецю, азоту, кисню, фосфору, фтору і хлору, такі яЛ, 3 Н, 13С, 14С, Ч 18 O, i f O, 35S *8F і 36СІ, від повідно Сполуки представленого винаходу, їх проліки, і фармацевтично прийнятні солі згаданих сполук або згадані проліки, які містять вищезгадані ізотопи і/або ІНШІ ізотопи інших атомів входять в рамки цього винаходу Деякі ізотопмічені сполуки представленого винаходу, наприклад, ті що містять включений радіоактивний ізотоп, такий як 3Н і 14С, використовуються в якості ЛІКІВ і/або субстрату в дослідженнях розподілення в тканинах Тритійовані, тобто, 3 Н, і вуглець-14, тобто, 14 С, ізотопи є, зокрема, переважними, в зв'язку з легкістю їх одержання і детектування В подальшому, заміна більш тяжкими ізотопами, такими як дейтерій, тобто, 2 Н, може представляти 22 деякі терапевтичні переваги, що витікають з більшої метаболічної стабільності, наприклад, підвищується in vivo час напіврозкладу або зменшення потрібної дози, і ВІДПОВІДНО, можуть бути переважними при деяких обставинах Ізотопмічені сполуки формули 1 цього винаходу і їх проліки, можуть бути одержані, в основному, використовуючи методики описані в Схемах і/або в Прикладах і Приготуваннях нижче, шляхом заміщення легкодосяжного ізотопміченого реагенту неїзотопміченим реагентом Цей винахід також включає фармацевтичні композиції, що містять і способи лікування бактеріальних інфекцій, шляхом призначення проліків сполук формули 1 Сполуки формули 1, що мають вільну аміно, амідо, гідрокси або карбоксильну групу можуть бути перетворені у проліки Проліки включають сполуки, в яких амінокислотні залишки, або поліпептидні ланцюги з двома або більшою КІЛЬКІСТЮ (наприклад, два, три або чотири) амінокислотних залишків є ковалентно з'єднаним через амідний або естерний зв'язок з вільною аміно, гідрокси або карбоксильною групою сполуки формули 1 Амінокислотий залишок включає але не обмежується 20 амінокислотами, що зустрічаються у природі, що звичайно позначається за допомогою трилітерних символів і також включає 4-пдроксипролін, пдроксилізин, демозин, ізодемозин, 3-метил гістидин, норвалін, бета-аланш, гамма-амінобутанову кислоту, цитрулін гомоцистеш, гомосерш, орнітин і метіонін сульфон Додаткові види проліків також включені Наприклад, вільна карбоксильна група може бути перетворена у амід або алкіловий естер Амідний і естерний замісник можуть включати групи, що включають, але не обмежуються естерами, амінами і функціональними похідними карбонової кислоти ВІЛЬНІ пдроксигрупи можуть бути перетворені з використанням груп, що включають, але не обмежуються гемісукцинатами, фосфатестерами, диметиламіноацетатами і фосфорилоксиметилоксикарбонілами, як показано D Fleisher, R Bong, В Н Stewart, Advanced Drug Delivery Reviews (1996) 19, 115 Проліки у вигляді карбаматів гідрокси і аміно груп також включені в рамки винаходу, також як і карбонати, і сульфати пдроксигруп Одержання похідних пдроксигруп, таких як (ацилокси)метил і (ацилокси)етил естери, в яких ацильна група може бути алкіловим естером, небов'язково, заміщеним групою, що включає, але не обмежується естером, аміном і функціональним похідним карбонової кислоти, або в яких ацильна група є амінокислотним естером, як описано вище, є також включеними Проліки цього типу описані R P Robinson et al , J Medicinal Chemistry (1996) 39, 10 Сполуки формули 1 і їх фармацевтично прийнятні солі і сольвати можуть бути одержані, як описано вище Якщо не вказано інше, R1, R2 і R3 такі як зазначено вище 24 60365 23 Є .CN Схема З NC, о 1 + ^y o II RVN-""^!* 3 \ NaS Na 2 HS / NH .CN J l О 1 Na'O\ CN l 1 7Ґ 4 ^ NR'R1 ,CN 12 5 " 1 R3O NR'R2 хема2 NH NC C N H,C0 NH 5 SH О V / NH f s 15 H,C0 осн3сн3 H,CO HS X J 16 * CN V-OFh о H$ 17 0" NR'R' ffS "ORi 25 60365 Схема 5 и P h o A 1 9 NH формули 5 R3-BMICHHM електрофілом, таким як 8nO 21 20 галоїд, переважно хлоридом, бромідом або йодидом такої сполуки, в полярному розчиннику, переважно тетрапдрофуран (ТГФ) або N,Nдиметилформамід (ДМФА), використовуючи приблизно від 1 до 5 еквівалентів, переважно невеликий надлишок в 1 еквівалент, і основу, таку як третинний амін, переважно дмзопропілетиламін, протягом часу від приблизно 12 до 48 годин, переважно приблизно 24 години, при температурі, що лежить в інтервалі від 0°С до 80°С, переважно приблизно при 25°С На стадії 4 Схема 1, сполука формули 1 (в якій X1 є S) може бути одержана обробкою сполука формули 6 в присутності сильної кислоти, такої як концентрована сірчана кислота, протягом часу від приблизно 1 до 12 годин, переважно приблизно 1,5 годин, при температурі, що лежить в інтервалі від 25°С до 100°С, переважно приблизно при 25°С, або в присутності основи, такої як водний гідроксид натрію (10%), протягом часу від приблизно 6 до 24 годин при температурі, що лежить в інтервалі від 25°С до 120°С, переважно приблизно при 100°С NCS 3 BnO' | ,CN J g -N'^'^OPh H Схема 5 продовження У—NH. НО X L 3 ВпО CN NH 24 У— NH, RO X 26 часу від 12 до 24 годин На стадії 2 Схема 1, сполука формули 5 може бути одержана обробкою сполуки формули 4 сіркою (приблизно 1 еквівалентним надлишком) в полярному розчиннику, такому як спирт, переважно, метанолі, при температурі, що лежить в інтервалі від 25°С до 80°С, переважно приблизно при 65°С, протягом часу від приблизно 12 до 48 годин, переважно приблизно 24 години На стадії 3 Схема 1, сполука формули 6 може бути одержана обробкою сполуки L 23 3 RO NH 25 О' OPh NR'R' Сполуки представленого винаходу легко одержуються використовуючи методики приведені на Схемах, що приведені вище і звичайні синтетичні методики ВІДОМІ спеціалістам в цій галузі Схема 1 розкриває конденсування малонітрилу з ізоціантом, окислення сірки, алкілування R3 вмісної сполуки і гідрування нітрилу, що приводить до кінцевої сполуки На стадії 1 Схема 1, сполука формули 4 може бути одержана обробкою сполуки формули 3 і сполуки формули (R1 і R2 не є Н, але ІНШІ ніж зазначено вище) з придатною сильною основою, такою як алкоксид основи, переважно, етоксид натрію, в протонному розчиннику, такому як спирт, переважно, етанолі, при температурі що лежить в інтервалі від -20°С до 50°С, переважно від 0°С до 25°С, протягом Схема 2 розкриває інший спосіб одержання сполук формули і, в яких X1 є S На стадії 1 Схема 2, сполука формули 7 може бути одержана конденсуванням сполуки формули 3 з алкоксикарбонілізотюціанатом, таким як етоксикарбонілізотюціантом, в присутності сильної основи, такої як алкоксид основи, переважно етоксиду натрію, в полярному розчиннику, такому як спирт, переважно, етанолі, протягом часу від приблизно 12 до 24 годин, при температурі, що лежить в інтервалі від приблизно 0°С до 30°С На стадії 2 Схема 2, сполука формули 8 може бути одержана окисною циклізацією сполуки формули 7 шляхом обробки сполуки формули 7 приблизно 1 еквівалентом сірки в спирті, такому як метанол, при температурі, що лежить в інтервалі від приблизно 50°С до 80°С, переважно приблизно при 65°С, протягом часу від приблизно 24 до 48 годин На стадії З Схема 2, сполука формули 9 може бути одержана обробкою сполуки формули 8 R3-BMICHHM електрофілом, таким як галоїд, переважно хлоридом, бромідом або йодидом такої сполуки, в полярному розчиннику, такому як ТГФ, при температурі, що лежить в інтервалі від 25°С до 40°С, протягом часу від приблизно 12 до 24 годин На стадії 4 Схема 2, сполука формули 10 може бути одержана гідролізом сполуки формули 9 придатною сильною основою, такою як концентрована сірчана кислота, при температурі, що лежить в інтервалі від 80°С до 120°С, протягом часу від приблизно 6 до 18 годин На стадії 5 Схема 2, сполука формули 11 (в якій Рп є фенілом) може бути 27 одержана обробкою сполуки формули 10 арилабо алкіл-хлорформіатом, таким як фенілхлорформіат, і прийнятною сильною основою, такою як піридин, в полярному апротонному розчиннику, переважно ТГФ або СН2СІ2, при температурі, що лежить в інтервалі від 25°С до 40°С протягом часу від приблизно 12 до 24 годин На стадії 6 Схема 2, сполука формули 1 (в якій X1 є S) може бути одержана обробкою сполуки формули 11 надлишком (приблизно від 1,1 до 6 еквівалентів) первинного або вторинного аміну формули R1R2NH в полярному апротонному розчиннику, такому як ТГФ або суміш ТГФ/ДМФА, при температурі, що лежить в інтервалі від 23°С до 60°С протягом часу від приблизно 6 до 24 годин Схема 3 розкриває спосіб одержання сполуки формули 1, в якій X1 є О Вихідна сполука формули 4 може бути одержана як описано вище, з посиланням на Схему 1 На стадії 1 Схема З, розчин солі сполуки формули 4 в інертному розчиннику, що містить воду або, переважно, у воді обробляли окислюючим агентом, переважно пероксидом водню Суміш витримували при температурі і протягом часу достатньому для розчинення і циклізації, переважно при КИП'ЯТІННІ протягом приблизно 15 хвилин, і потім охолоджували для одержання сполуки формули 12 На стадії 2 Схема 3, сполуку формули 12 додавали до кислого розчину, переважно концентрованої сірчаної кислоти, після чого додавали воду в КІЛЬКОСТІ достатній для ефективної гідратації, переважно приблизно 10 еквівалентів, і перемішували при температурі, що лежить в інтервалі від -20°С і 100°С, переважно при кімнатній температурі, протягом часу достатнього для ефективної гідратації, переважно протягом ночі Суміш потім обробляли водою або, переважно, льодом для одержання сполуки формули 13 На стадії 3 Схема З, сполуку формули 13 обробляли основою, переважно трет-бутоксидом калію, в інертному розчиннику, переважно ДМФА, при температурі, що лежить в інтервалі від -78°С до 100°С, переважно при кімнатній температурі До цієї суміші додавали R3 вмісний електрофіл, такий як R3 вмісний алкілгалоїд або сульфонат, переважно йодид або бромід такої сполуки Суміш перемішували до завершення реакції, що визначали за допомогою ТШХ, одержуючи сполуку формули 1 (в якій X1 є О) Схема 4 розкриває інший спосіб одержання сполуки формули 1, в якій X1 є S На стадії 1 Схема 4, використовували методику запропоновану М Yokoyama і К Sato, Synthesis, 813 (1988) ВІДПОВІДНО З нею, сполуку формули 3 обробляли алкілтюлом, таким як 4-метоксибензилмеркаптан і прийнятною сильною основою, такою як гідроксид натрію, в полярному розчиннику, такому як суміш спирт/вода, переважно 1 1 етанол/вода, при температурі, що лежить в інтервалі від -10°С до 30°С, переважно приблизно при 0°С, протягом часу від 2 до 6 годин, переважно приблизно З години, одержуючи сполуку формули 14 На стадії 2 Схема 4, сполука формули 15 (Рп є фенілом) може бути одержана обробкою сполуки формули 14 алкоксикарбонілізотюціанатом, таким як феносикарбонілізотюціанат, в апротонному роз 60365 28 чиннику, такому як етилацетат, приблизно при 0°С протягом від приблизно 12 до 36 годин На стадії 3 Схема 4, сполука формули 16 може бути одержана обробкою сполуки формули 15 окислюючим агентом, таким як бром або йод, переважно йод, і основою середньої сили, таким як піридин, в полярному розчиннику, такому як ацетонітрил, протягом приблизно 1 години, приблизно при 0°С На стадії 4 Схема 4, сполука формули 17 може бути одержана зняттям 4метоксибензильної захисної групи, шляхом обробки сполуки формули 16 ацетатом ртуті, приблизно 1 еквівалентом, в присутності кислоти, переважно трифтороцтової кислоти (ТФК), в присутності надлишку анізолу, переважно 10 еквівалентів, при температурі, що лежить в інтервалі від 0°С до кімнатної температури, протягом часу від 10 до 24 годин На стадії 5 Схема 4, сполука формули 18 може бути одержана гідратацією сполуки формули 17 прийнятною сильною кислотою, такою як концентрована сірчана кислота, при температурі, що лежить в інтервалі від 15°С до 80°С, переважно при кімнатній температурі, протягом часу від 12 до 24 годин, переважно 18 годин На стадії 6 Схема 4, сполука формули 1 може бути одержана обробкою сполуки формули 18 R3-BMICHHM електрофілом, таким як галоїд, переважно хлоридом, бромідом або йодидом такої сполуки, і придатною сильною основою, такою як дмзопропілетиламін, в полярному розчиннику, переважно ДМФА, при температурі, що лежить в інтервалі від 0°С до 50°С, переважно при 25°С, протягом часу від 12 до 24 годин Одержану сполуку тоді обробляють первинним або вторинним аміном формули R1R2H (приблизно від 1,1 до 6 еквівалентів) в суміші ТГФ/ДМФА при температурі, що лежить в інтервалі від 25°С до 65°С, протягом часу від 18 до 36 годин Схема 5 розкриває інший спосіб одержання сполуки формули 1, в якій X1 є О На стадії 1 Схема 5, суміш солі тюціанату, переважно тюціанату калію, в інертному розчиннику, переважно етилацетаті, перемішували, переважно інтенсивно, в інертній атмосфері, протягом ночі до утворення порошку солі Цю суміш обробляли арилхлорформіатом формули 19 (Рп є фенілом) і одержану суміш перемішували при температурі, що лежить в інтервалі від -40°С до кімнатної температури, переважно приблизно при 5°С, протягом часу, що потрібен для протікання реакції, переважно приблизно 8 годин Твердий біпродукт фільтрували і продукт зберігали в холодному МІСТІ, переважно при температурі не вище кімнатної Продукт розчиняли в придатному інертному розчиннику, переважно ефірі, і видаляли додатково утворившийся біпродукт Після концентрування продукт знову розчиняли в придатному інертному розчиннику, переважно гексані, і видаляли додатково утворившийся біпродукт Тоді видаляли сполуку формули 20 На стадії 2 Схема 5, кислий розчин, переважно ефірний НСІ, обробляли сполукою формули 3 Після розчинення, розчин охолоджували, переважно до 10°С, і обробляли спиртом, переважно бензиловим спиртом Після перемішування, суміш витримували при цій температурі, переважно приблизно при 5°С, протя 29 гом часу, що достатньо для завершення реакції, звичайно приблизно 4 дні, одержували сполуку формули 21 На стадії 3 Схема 5, розчин сполуки формули 21 в прийнятному інертному розчиннику, переважно ацетонітрилі, при температурі, що лежить в інтервалі від -40°С до кімнатної температури, переважно при 0°С, обробляли розчином сполуки формули 20 в придатному інертному розчиннику, переважно ацетонітрилі Реакційну суміш витримували при температурі, що лежить в інтервалі від 0°С до кімнатної температури, переважно при кімнатній температурі, до завершення реакції Реакційну суміш тоді витримували при прийнятній температурі до підвищення затвердіння продукту, переважно приблизно при 5°С, протягом часу достатнього для максимізацм виходу, переважно приблизно 2 дні Сполуку формули 22 (Вп є бензиллом) виділяли На стадії 4 Схема 5, сполуку формули 22 брали в придатному інертному розчиннику, переважно ацетонітрилі, при температурі, що лежить в інтервалі від 40°С до 40°С, переважно 0°С, і обробляли основою, переважно піридином, і окислюючим агентом, переважно розчином брому або йоду в придатному інертному розчиннику, переважно ацетонітрилі Суміш потім перемішували при температурі, що достатня для протікання реакції, переважно при 0°С протягом приблизно 1 години з наступним витримуванням протягом години при кімнатній температурі Суміш залишали стояти при температурі достатній для підвищення затвердіння продукту, переважно при 5°С, протягом достатнього періоду часу, переважно на ніч Сполуку формули 23 тоді виділяли На стадії 5 Схема 5, гідратацію і зняття захисту з сполуки формули 23 здійснювали шляхом обробки и кислотою, переважно концентрованою сірчаною кислотою Якщо сполука формули 23 достатньо волога після попередньої стадії, додаткову воду не додають Якщо сполука формули 23 суха, тоді додають воду, переважно приблизно 10 еквівалентів Реакцію проводять при температурі, що лежить в інтервалі від -20°С до 100°С, переважно при кімнатній температурі, протягом часу, достатнього для завершення реакції, звичайно це характеризується повним розчиненням і переважно складає приблизно 3 години Після завершення реакції, додають додаткову порцію сірчаної кислоти для повного перетворення Суміш потім обробляють водою або, переважно, льодом Сполуку формули 24 виділяють На стадії 6 Схема 5, сполуку формули 24 піддають реакції з тривалентним фосфіном, переважно трифенілфосфшом, і R3 вмісним спиртом, і обробляють похідним азодікарбоксилату, переважно дмзопропілазодикарбоксилатом, і реакційну суміш перемішують протягом принаймні 1 хвилини Сполуку формули 25 виділяють На стадії7 Схема 5 суміш сполуки формули 25 в придатному інертному розчиннику, переважно ТГФ, обробляли бажаним аміном формули R1R2NH і витримували при температурі достатній для протікання реакції, звичайно від 0°С до 100°С, переважно від 50°С до 70°С, протягом часу від 1 години до 48 годин, переважно протягом ночі Сполуку формули 1 (в якій X1 є О) ВИДІЛЯЛИ 60365 ЗО Сполуки представленого винаходу можуть мати асиметричний атом вуглецю Такі діастереомерні суміші можуть бути розділені на окремі діастереомери використовуючи їхні фізико-хімічні ВІДМІННОСТІ, за методиками, що добре ВІДОМІ спе ціалістам в цій галузі, наприклад, хроматографією або фракційною кристалізацією Енантюмери можуть бути розділенні перетворенням енантюмерної суміші у діастерюмерну суміш взаємодією з придатною оптично-активною сполукою (наприклад, спиртом), розділенням діастерюмерів і перетворенням (наприклад, гідролізом) індивідуальних діастерюмерів у ВІДПОВІДНІ ЧИСТІ енантюмери Всі такі ізомери, включаючи діастерюмерні суміші і чисті енантюмери розглядається як частина представленого винаходу Сполуки формули 1 основної природи здатні утворювати широкий спектр різноманітних солей з різними неорганічними і органічними кислотами Хоча, такі солі повинні бути фармацевтично прийнятними для призначення тваринам, також бажано з практичної точки зору, спочатку виділити сполуки формули 1 з реакційної суміші у вигляді фармацевтично неприйнятної солі і потім просто перетворити сполуку у вільну основу обробляючи лужним реагентом і надалі перетворити вільну основу у фармацевтично прийнятну кислотноадитивну сіль Кислотноадитивні солі сполук цього винаходу основної природи легко одержується взаємодією основної сполуки з прийнятною еквівалентною КІЛЬКІСТЮ вибраної мінеральної або органічної кислоти у водному середовищі або прийнятному органічному розчиннику, такому як, метанол або етанол Шляхом обережного випарювання розчинника легко одержується бажана тверда сіль Бажана кислотна сіль може також бути одержана з розчину вільної основи в органічному розчиннику додаванням до розчину прийнятної мінеральної або органічної кислоти Сполуки формули 1 кислої природи здатні утворювати основні солі з різноманітними фармацевтично прийнятними катіонами Прикладами основних солей є солі лужних і лужноземельних металів і особливо, натрієві, аміні і калієві солі Такі солі можуть бути одержані за ВІДПОВІДНИМИ методиками В якості реагентів при одержанні фармацевтично прийнятних основних солей цього винаходу, використовують ХІМІЧНІ ОСНОВИ, ЩО утворюють нетоксичні основні солі з сполуками формули 1, що мають кислу природу Такими нетоксичними основними солями є наступні фармацевтично прийнятні катіони, як натрій, калій, кальцій, магній, та ш Ці солі можуть легко утворюватись внаслідок взаємодії відповідної кислотної сполуки з водним розчином, що містить бажаний фармацевтично прийнятний катіон, і подальшим випарюванням одержаного розчину досуха, переважно, під вакуумом Альтернативно, вони можуть також бути одержані змішуванням нижче спиртового розчину, кислої сполуки і бажаного алкоголяту лужного металу і подальшим упарюванням одержаного розчину досуха за умов, що приведені вище В будь якому випадку, краще використовувати стехіометричні КІЛЬКОСТІ реагенту для гарантування повного закінчення реакції і одержання максимального виходу бажа 60365 31 ного продукту В рамки представленого винаходу включені сполуки ідентичні сполукам формули 1 за умови, що один або більша КІЛЬКІСТЬ атомів водню або вуглецю замінені їх ізотопами Такі сполуки використовуються в якості дослідницького і діагностичного інструментарію вивчення фармокшетики метаболізму і досліджень по зв'язуванню Специфічне використання у дослідженнях включає дослідження по зв'язуванню радюліганда, ауторадюграфічні дослідження і дослідження зв'язування in vivo В число радюмічених форм сполук формули 1 включені їх трітієві і С 14 ізотопи In vitro активність сполук формули 1 у інгібуванні РДК/ВЕФР рецептору може бути визначена наступним чином Здатність сполук представленого винаходу інгібувати тірозинкіназу може бути виміряна використовуючи рекомбінантний ензим у дослідженнях по вимірюванню здатності сполук інгібувати фосфорилювання субстрату екзогену, поліCluTyr (ПГТ, Sigma™, 4 1) Домен кінази рецептору людини РДК/ВЕФР (амінокислоти 805-1350) експресують в Sf9 клітинах комах, як глутатюн Sтрансферази (СЗТ)-конденсуючого протеїни, що використовуються в бациловірусній експресійній системі Протеїн очищається з лізату цих клітин, використовуючи глутатюн агароза споріднені колонки Дослідження ензиму проводили використовуючи 96-коміркову платівку, що містить ПГТ субстрат (0,625пг ПГТ на комірку) Сполуки, що піддавались тестуванню, розводили в диметилсульфоксиді (ДМСО) і потім додавали до ПГТ платівок, так що кінцева концентрація ДМСО в дослідженні складала 1,6% (в/в) Рекомбінатний пептид розводили фосфорилюючим буфером (50мМ Гепес, рН 7,3, 125мМ NaCI, 24мМ МдСІ2) Реакцію ініціювали додаванням АТР з кінцевою концентрацією ЮцМ Після збовтування протягом ЗО хвилин при кімнатні температурі, реакційну суміш видаляли і платівки промивали промивним буфером (ЕБС-вмісним 0,1% Твін-20) КІЛЬКІСТЬ фосфорильованого РГТ визначали шляхом інкубування ПХЗ-кон'югованого (ПХЗ є пероксидазою хріну звичайного) PY-54 антитіла (Transduction Labs), одержаного з ТМБ пероксидази (ТМБ є 3,3',5,5'-тетраметилбензидином) і реакційну суміш досліджували за допомогою BioRad™ Microplate лічильника при 450нМ Інгібування ензиматичної активності кінази, сполуками що піддавались тестуванню, визначали, як зменшення поглинання, і по концентрації сполуки, що потрібна для 50% інгібування сигналу, що позначали, як ICso Для вимірювання здатності сполук інгібувати активність РДК тірозинкінази можна використати білок з повною довжиною, що присутній в КЛІТИННІЙ оболонці, клітин свинячого аортального ендотелію (РАЕ) трансфікованих людськими РДК (Waltenberger et al , J Biol Chem 269 26988, 1994) Клітини поміщали на платівки і додавали до 96-комірок платівки в тому ж самому середовищі (Ham's F12), що містило 10% ЕБС (ембріональну бичачу сироватку) Клітини потім промивали і знову додавали збіднену сироватку, що містила 0,1% (в/в) сироватку бичачого альбуміну 32 (СБА), і витримували протягом 24 годин Відразу відмірювали першу дозу сполуки, клітини підживлювали сироваткою із збідненим середовищем (без СБА) Тестуємі сполуки, розчиняли в ДМСО, розводили в середовищі (кінцева концентрація ДМСО 0,5% (в/в)) В КІНЦІ другої години інкубації, до середовища додавали ВЕФР135 (50нг/мл кінцева) і шкубували протягом 8 хвилин Клітини промивали і лізували в ХНТГ буфері (20мМ Хепес, рН 7,5, 150мМ NaCI, 0,2% Трітон™ Х-100, 10% гліцерол, 0,2мМ ФМСФ (фенілметилсульфонілфторид), 1пг/мл пепстатин, 1пг/мл леупептин, 1цГ/мл апротонін, 2мМ пірофосфат натрію, 2мМ ортованадат натрію) Ступень фосфорилювання РДК вимірювали використовуючи дослідження ELISA До 96-комірковоі платівки додавали 1цг на комірку козлиного антикролячого антитіла Незв'язане антитіло вимивали з платівок і місця, що залишилися блокували буфером Суперблок (Pierce) спочатку додаючи анти-флк-1 С-20 антитіло (0,5пг на платівку, Санта Круз) Всі незв'язані антитіла вимивали з платівок додаючи клітинний лізат Після 2 годин інкубування лізату з флк-1 антитілом, підраховували КІЛЬКІСТЬ РДК зв'язаного фосфотірозину шляхом розвитку HRPкон'югованого PY-54 антитіла і ТМВ, як описано вище Здатність сполук інгібувати на 50% ВЕФРстимулювання реакції аутофосфорилювання, ВІДПОВІДНО до контрольного ВЕФР-стимульованого, позначали як ICso Здатність сполук інгібувати мітогенез в ендотеліальних клітинах людини вимірювали по їх здатності інгібувати 3 Н-ТІМІДИН, що присутній в ЛЕПВ клітинах (людських ендотеліальних клітинах пупочних вен, Clonetics™) Це дослідження добре описано в літературі (Waltenberger J et al J Biol Chem 269 26988 1994, Cao Y et al J Biol Chem 271 3154, 1996) Коротко, 104 клітин поміщали в колаген ВМІСНІ 24-коміркові платівки і дозволяли приєднатися Клітини підживлювали сироватко-вільним середовищем і 24 години по тому обробляли різними концентраціями сполуки (одержували в ДМСО, кінцева концентрація в ДМСО в дослідженнях складала 0,2% в/в), і 230нг/мл ВЕФРіб5 Протягом 3 години після обробки сполукою, клітини пульсували 3Н-ТІМІДИНОМ (NEN, 1цСі на комірку) Середовище видаляли і клітини інтенсивно промивали охолодженим збалансованим сольовим розчином Ханка, і потім 2 рази охолодженою трихлороцтовою кислотою (10% в/в) Клітини лізували додаючи 0,2мл 0,1 N NaOH, і лізат поміщали в СЦИНТИЛЯЦІЙНІ пляшечки Комірки потім промивали 0,2мл 0,1 N НСІ, і цей промитий розчин переносили до пляшечок Ступень зв'язування 3Н-тімідину вимірювали шляхом підрахунку КІЛЬКОСТІ СЦИНТИЛЯЦІЙ Здатність сполук на 50% інгібувати зв'язування, відносно до контрольного (ВЕФР обробленого тільки ДМСО) позначали як ICso Активність сполук формули 1, in vivo, може бути визначена по ступеню інгібування росту пухлини сполуками, що піддаються тестуванню, порівняно з контрольними Ефективність інгібування росту пухлини різноманітними сполуками вимірювали згідно до методів описаних Corbett T Н , et al "Tumor induction Relationships in 33 Development of Transplantable Cancers of the Colon in Mice for Chemotherapy Assays, with a Note on Carcinogen Structure", Cancer Res 35, 2434-2439 (1975) та Corbett, T H et al , "A Mouse Colon-tumor Model for Experimental Therapy", Cancer Chemother Rep (Part 2)", 5, 169-186 (1975), з незначними модифікаціями Виникнення пухлини ініціювали шляхом підшкірної ін'єкції 1x106 лаго фазної культури пухлинних клітин суспендованих в 0,1-0,2мл ЕБС Після проходження часу достатнього для того, щоб пухлина стала відчутною на дотик (5-6мм в діаметрі), тварин, що досліджували (атимічні миші) обробляли активною сполукою (у вигляді розчину в придатному розчиннику, наприклад, воді або 5% Gelucire™ 44/14 в ЕБС шляхом внутрішньобрюшинного (вб) або орального (op) введення один або ДВІЧІ на день протягом 5-10 наступних днів ВІДПОВІДНИМ чином вимірювали антипухлинний ефект, вимірюючи в міліметрах ширину двох діаметрів пухлини використовуючи кронциркуль Верн'є і об'єм пухлини (мм3) розраховували використовуючи формулу Вага пухлини=(довжина х [ширина]2)/2, згідно з методом Geran, R І , el al "Protocols for Screening Chemical Agents і Natural Products Against Animal Tumors і Other Biological Systems", Third Edition, Cancer Chemother Rep, 3, 1-104 (1972) Місце імплантації пухлини на боку забезпечує відтворюємий доза/відповіь ефект для різних хемотерапевтичних агентів і метод вимірювання (діаметр пухлини) є надійним методом для дослідження швидкостей росту пухлин Призначення сполук представленого винаходу (далі "активної сполук(и)") може бути здійснено будь яким способом, що дає можливість ввести сполуки до місця дії Ці способи включають оральні шляхи, дуоденальні шляхи, парентеральні ін'єкції (включаючи внутрішньовенні, підшкірні, внутрішньом'язові, внутрішньосудинні або вливання), місцеве і ректальне призначення КІЛЬКІСТЬ активної сполуки буде залежати від суб'єкту, який піддається лікуванню, серйозності захворювання або стану, шляху призначення і рішення лікаря, що лікує Однак, ефективна доза лежить в інтервалі від приблизно 0,001 до приблизно 100мг на кг ваги тіла в день, переважно приблизно від 1 до приблизно 35мг/кг/день, в одиничній або розподілений дозах Для людини з вагою 70кг, ця КІЛЬКІСТЬ знаходиться в межах від приблизно 0,05 до приблизно 7г/день, переважно від приблизно 0,2 до приблизно 2,5г/день В деяких випадках, рівні доз нижче нижньої границі вищезгаданого діапазону може бути більш ніж адекватною, в той же час в інших випадках ще більші дози можуть бути використані без будь яких сторонніх небажаних ефектів, при умові, що такі більші дози спочатку розділяються на декілька менших доз для призначення протягом дня Активна сполука може бути використовуватись індивідуально або може використовуватись в комбінації з одним або більшою КІЛЬКІСТЮ ІНШИХ антиракових речовин, наприклад, таких що вибирають з, наприклад, мітотичних інгібіторів, наприклад, вінбластину, алкілуючих агентів, наприклад, цис-платін, карбоплатін і циклофосфамід, антиметаболітів, наприклад, 5-фторурацил, цитозин, 60365 34 арабшозид і пдроксисечовина, або, наприклад, один з переважних анти-метаболітів описаний в Європейський заявці на патент №239362, такий як N-(5-[N-(3,4-flHnflpo-2-MeTHn-4-OKCoxma3oniH-6ілметил)-^метиламіно]-2-теноіл)-І_-глутамінова кислота, інгібітори фактору росту, інгібітори циклу клітин, штеркалаційні антибіотики, наприклад, адріаміцин і блеоміцин, ферменти, наприклад, інтерферон, і антигормони, наприклад, антиестрогени, такі як Нолвадекс™ (тамоксифен) або, наприклад, антиандрогени, такі як Касодекс™ (4іціано-3-(4-фторфенілсульфоніл)-2-пдрокси-2метил-3'-(трифторметил)пропюанілід) Таке комбінаційне лікування може бути досягнуто шляхом одночасного, послідовного або роздільного введення індивідуальних лікувальних компонентів Фармацевтична композиція може, наприклад, бути у формі придатної для орального призначення, у вигляді таблетки, капсули, пігулки, порошку, рецептури з пролонгованим вивільненням, розчину, суспензії, для парентеральної ін'єкції, у вигляді стерильного розчину, суспензії або емульсії, для місцевого призначення, у вигляді мазі або крему або для ректального призначення, у вигляді супозиторію Фармацевтична композиція може бути у формі одиничної дози придатної для одиничного призначення визначеної дози Фармацевтична композиція буде включати звичайні фармацевтичні носи або ексципієнти і сполуку згідно з винаходом, в якості активного інгредієнти На додаток, вона може включати ІНШІ медичні і фармацевтичні агенти, носи, розчинники і таке інше Приклади парентерально призначаємих форм включають розчини або суспензії активних сполук в стерильному водному розчині, наприклад, водні розчини пропілен гліколю або декстрози Такі дозовані форми при бажанні можуть бути придатно забуферені Придатні фармацевтичні носи включають інертні розріджувачі або наповнювачі, воду і різні органічні розчинники Фармацевтичні композиції можуть, при бажанні, містити додаткові інгредієнти, такі як смакові додатки, зв'язуючі, ексципієнти і їм подібні Таким чином, таблетки для орального призначення містять різноманітні ексципієнти, такі як лимонна кислота, може бути використана з різноманітними дисінтеграторами, такими як крохмаль, альпнова кислоти і деякі комплекси силікатів і зв'язуючі агенти, такі як цукроза, желатин і акація На додаток, для таблетування часто використовуються змащуючі агенти, такі як стеарат магнію, лаурилсульфат натрію і тальк Тверді композиції подібного типу можуть також бити використані у м'яких або твердих желатинових капсулах Переважні матеріали, включають, лактозу або молочний цукор і високомолекулярні поліетіленгліколі Коли для орального призначення бажані водні суспензії або елексири активної сполуки вони можуть бути об'єднані з різноманітними підсолоджувачами або смаковими агентами, барвниками або забарвлюючими агентами і, при бажанні, емульсифікаторами або суспендуючими агентами, разом з розріджувачами, такими як вода, етанол, пропіленгліколь, гліцерин або їх комбінація 35 Способи одержання різноманітних фармацевтичних композицій з визначеною КІЛЬКІСТЮ активної сполуки ВІДОМІ, або будуть очевидні для середнього фахівця в цій галузі Наприклад, дивіться Remington's Pharmaceutical Sciences Mack Publishing Company, Easter, Pa, 15th Edition (1975) Приклади і приготування приведені далі нижче розкривають і представляють сполуки представленого винаходу і способи одержання таких сполук Зрозуміло, що рамки представленого винаходу ні в якому разі не обмежуються наступними прикладами і приготуваннями Приготування 1 Диметилкарбамоілізотюціанат У трилітрову трьохгорлу колбу, що споряджена механічною мішалкою завантажували диметилкарбамілхлорид (250мл, 2,70моль) в безводному ацетонітрилі (1,5л) і нагрівали із зворотнім холодильником Потім обережно порціями протягом 1 години додавали тюціанат калію (270г, 2,8моль, висушували при 160°С при низькому тиску 3 годин), так щоб реакційна суміш сильно кипіла після кожного додавання Після завершення додавання, суміш нагрівали із зворотнім холодильником ще протягом 1 години Нагріваючий прилад прибирали і суміш перемішували при кімнатній температурі ще протягом 2,5 годин і потім залишали в холодильнику на ніч Суміш фільтрували видаляючи небажані тверді речовини і фільтрат концентрували До одержаного масла додавали ефір (1л) і твердий і густий матеріал відокремлювали Фільтрат знову концентрували одержуючи бажаний матеріал у вигляді блідооранжевого масла (204г, 1,57моль, 58%) 1Н ЯМР (400МГц, CDCI3) 5 2,90 (с, ЗН), 2,98 (с, ЗН) м ч Натрію 2,2-диціано-1-(3,3диметилуреідо)етентюлат До 1М розчину етоксиду натрію в етанолі (одержували обробляючи 110мл безводного етанолу 2,5г (0,11 моль) натрію) додавали малононітрил (7,2г, 0,11 моль) при 0°С Додавали диметилкарбамоілізотюціанат (14,3г, 0,110моль), і одержану суміш залишали при кімнатній температурі на ніч Суміш концентрували під вакуумом Залишок очищали з гексаном і концентрували під вакуумом одержуючи тверду речовину Залишок розтирали з гексаном, відокремлювали за допомогою фільтрування і сушили під вакуумом одержуючи 20г (83%) натрію, 2,2-диціано-1-(3,3диметилуреідо)етентюлат у вигляді безбарвної твердої речовини 1Н ЯМР (400МГц, flMCO-d6) 5 8,40 (с, 1Н), 2,78 (с, 6Н) м ч , 13С ЯМР (100МГц, ДМСО-de) 5 189,9, 154,3, 121,4, 118,7, 57,9, 36,5 м ч 3-(4-Ціано-3-меркаптоізотіазол-5-іл)-1,1диметилсечовина Суміш натрію, 2,2-диціано-1-(3,3диметилуреідо)етентюлату (5,0г, 23ммоль), сірку (0,734г, 23ммоль) і 46мл метанолу перемішували при КИП'ЯТІННІ ІЗ зворотнім холодильником протягом 24 годин Суміш фільтрували і фільтрат концентрували під вакуумом Залишок розводили водою і одержану суміш ДВІЧІ екстрагували етилацетатом Водний шар підкислювали 1М НСІ (вод) і екстрагували в етилацетат Органічний 60365 36 шар сушили над ІЧагЗСч, фільтрували і концентрували Твердий залишок збирали і сушили під вакуумом одержуючи 2,0г (40%) 3-(4-ціано-3меркаптоізотіазол-5-іл)-1,1-диметилсечовини у 1 вигляді жовтої твердої речовини Н ЯМР (400МГц, ДМСО-de) 5 2,97 (с, 6Н) м ч , МС (АРСІ, + m/z) 227 [М-Н] Основна методика алкілування 3-(4-ціано-3меркаптоізотіазол-5-іл)-1,1-диметилсечовини До суміші 3-(4-ціано-3-меркаптоізотіазол-5іл)-1,1-диметилсечовини (0,20г, 0,88ммоль), підходячий алкілхлорид, алкілбромід або алкілйодид (0,90ммоль) і ТГФ або ДМФА додавали дмзопропілетиламін (0,116г, 0,90ммоль) Одержану суміш перемішували протягом 24 годин при кімнатній температурі Суміш розділяли між 1М водним розчином НСІ і етилацетатом Органічний шар видаляли і водний шар три рази екстрагували етилацетатом Об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом Залишок фільтрували крізь тонкий шар силікагелю використовуючи в якості елюенту етил ацетат-гексан (1 1) одержуючи алкілований продукт 3-(4-Ціано-3-гексилсульфанілізотіазол-5-іл)1,1-диметилсечовина Слідуючи вищеописаній загальній методиці в якості алкіл йод йду використовували йод гексан (0,19г, 0,90ммоль) одержуючи 0,14г (51%) 3-(4ціано-3-гексилсульфанілізотіазол-5-іл)-1,1диметилсечовину у вигляді безбарвної твердої речовини 1Н ЯМР (400МГц, ацетон-de) 5 9,82 (шс, 1Н), 3,20 (т, 2Н, и=7,2Гц), 3,11 (с, 6Н), 1,71 (п, 2Н, и=7,2Гц), 1,43 (м, 2Н), 1,31 (м, 4Н), 0,88 (т, ЗН, и=6,0Гц) м ч , МС (АРСІ, m/z) 313 [М+Н]+ ПРИКЛАД 1 5-(3,3-Диметилуреідо)-3гексилсульфанілізотіазол-4-карбоксамід Суміш 3-(4-ціано-3-гексилсульфанілізотіазол5-іл)-1,1-диметилсечовини (0,09г, 0,29ммоль) і концентровану сірчану кислоту (0,18мл) перемішували при кімнатній температурі протягом 1,5 годин Суміш розводили холодною водою, три рази екстрагували в етилацетат Об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом одержуючи 0,076г (78%) 5-(3,3-диметилуреідо)-3гексилсульфанілізотіазол-4-карбоксаміду у вигляді безбарвної твердої речовини 1Н ЯМР (300МГц, ацетон-de) 5 7,08 (шс, 2Н), 3,20 (т, 2Н, и=7,2Гц), 3,02 (с, 6Н), 1,63 (п, 2Н, и=7,2Гц), 1,35 (м, 2Н), 1,23 (м, 4Н), 0,78 (т, ЗН, и=6-9Гц) м ч , МС (АРСІ, m/z) 331 [М+Н]+ ПРИГОТУВАННЯ 2 Натрію, 2,2-диціано-1етоксикарбоніламшоетентюлат Металічний натрій (1,01г, 44ммоль) розчиняли в 40мл етанолу при кімнатній температурі Одержаний розчин охолоджували на льодяній бані і додавали малононітрил (2,91г, 44ммоль) Льодяну баню видаляли і суміш перемішували при кімнатній температурі протягом ЗО хвилин Після охолодження до 0°С, додавали етоксикарбонілізотюціанат (5,77г, 44ммоль) і суміш залишали при кімнатній температурі на ніч Суміш концентрували під вакуумом, і затвердівший за 37 лишок знов розчиняли в гексані і концентрували під вакуумом Одержану жовту тверду речовину збирали і сушили під вакуумом, одержуючи 10,74г (100%) натрію, 2,2-диціано-1етоксикарбоніламшо-етентюлату у вигляді світложовтої твердої речовини, що містила 0,5 мольних еквівалентів етанолу, як показав 1Н ЯМР спектроскопія 1Н ЯМР (300МГц, ДМСО-de) 5 4,36 (т, 0,5 Н, и=5,0Гц (ЕЮН)), 4,03 (к, 2Н, и=7,1Гц), 3,43 (дк, 1Н, J=5,0, 6,7Гц (ЕЮН)), 1,26 (т, ЗН, и=7,ЗГц), 1,06 (т, 1,5Н, и=7,0Гц (ЕЮН)) м ч , МС (АРСІ, m/z) 197[M-Na] Натрію 4-ціано-5етоксикарбоніламіноізотіазол-3-тюлат Суміш натрію, 2,2-диціано-1етоксикарбоніламшоетентюлату (3,3г, 15ммоль), сірку (0,48г, 15ммоль) і метанол (ЗОмл) нагрівали із зворотнім холодильником протягом 24 годин Суміш фільтрували і концентрували під вакуумом і гумоподібний залишок ДВІЧІ розтирали з 10 1 ефір-етилацетат одержуючи 2,6г (69%) натрію, 4ціано-5-етоксикарбоніламіноізотіазол-З-тюлату у вигляді жовтої твердої речовини 1Н ЯМР (400МГц, ДМСО-de) 5 3,99 (к, 2Н, и=6,8Гц), 1,16 (т, ЗН, J=7,2I~4) м ч , МС (АРСІ, m/z) 228 [M-Na] (4-Ціано-3-пентилсульфанілізотіазол-5іл)карбамшовоі кислоти етиловий естер Суміш натрію, 4-ціано-5етоксикарбоніламіноізотіазол-3-тюлату (5,0г, 20ммоль), 1-йодпентану (4,0г, 20ммоль) і тетрапдрофурану (20мл) перемішували при кімнатній температурі протягом 16 годин Потім концентрували під вакуумом Залишок розділяли між етилацетатом і насиченим водним розчином хлориду натрію Водний шар три рази екстрагували етилацетатом і об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом Залишок фільтрували крізь шар силікагелю використовуючи в якості елюенту 1 1 етилацетат-гексан Фільтрат концентрували і залишок перекристалізували з холодного водного розчину метанолу, одержуючи 2,5г (42%) (4ціано-З-пентилсульфанілізотіазол-5іл)карбамшовоі кислоти етиловий естер у вигляді безбарвної твердої речовини Додаткову порцію 0,5г (8,4%) одержували концентруванням маточного розчину і очищали за допомогою радіальної хроматографії (платівка 4мм, 4 1 гексанетилацетат) 1Н ЯМР (400МГц, ацетон-de) 5 11,1 (шс, 1Н), 4,32 (к, 2Н, J=7,2I~4), 3,21 (т, 2Н, J=7,2I~4), 1,73 (п, 2Н, J=6,8I~4), 1,44-1,28 (м, 7Н), 0,90 (т, ЗН, J=7,6I~4) м ч , МС (АРСІ, m/z) 312 [M+Na] 5-Амшо-3-пентилсульфанілізотіазол-4карбоксамід Суміш (4-ціано-З-пентилсульфанілізотіазол5-іл)карбамшовоі кислоти етилового естеру (2,7г, 9,0ммоль) і концентрованої сірчаної кислоти (5мл) нагрівали при 100°С протягом 6 годин Після охолодження при кімнатній температурі, суміш розводили холодною водою, три рази екстрагували етилацетатом, і об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом, одержуючи 2,2г (100%) 5-аміноЗ-пентилсульфанілізотіазол-4-карбоксаміду, у вигляді жовтого масла 1Н ЯМР (400МГц, CDCI3) 5 60365 38 3,26 (т, 2Н, J=7,2I~4), 1,71 (м, 2Н), 1,43-1,19 (м, 4Н), 0,88 (т, ЗН, J=6,8I~4) м ч (4-Карбамоіл-3-пентилсульфанілізотіазол-5іл)карбамшовоі кислоти феніловий естер До розчину 5-амшо-Зпентилсульфанілізотіазол-4-карбоксаміду (2,2г, 9,0ммоль) в Збмл тетрапдрофурану додавали піридин (0,90г, 11 ммоль) і фенілхлорформіат (1,7г, 11 ммоль) Після перемішування протягом З годин, ще додавали піридин (0,15г, 1,9ммоль) і фенілхлорформіат (0,29г, 1,9ммоль) і суміш перемішували при кімнатній температурі протягом ночі Суміш концентрували під вакуумом, розводили водою і екстрагували 2х СН2СІ2, 1х етилацетатом Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили над MgSO4, фільтрували і концентрували під вакуумом Залишок розтирали протягом 12 годин з сумішшю ефір-гексан і одержану тверду речовину збирали і сушили під вакуумом, одержуючи 2,6г (79%) (4-карбамоіл-Зпентилсульфаніл-ізотіазол-5-іл)карбамшовоі кислоти фенілового естеру у вигляді безбарвної твердої речовини 1Н ЯМР (300МГц, CDCI3) 5 7,41 (т, 2Н, J=7,3I~4), 7,29-7,20 (м, ЗН), 3,31 (т, 2Н, J=7,3I~4), 1,72 (м, 2Н), 1,50-1,30 (м, 4Н), 0,90 (т, ЗН, J=7,1I~4) м ч , МС (АРСІ, m/z) 366 [М+Н]+ ПРИКЛАД 2 3-Пентилсульфаніл-5-[3-(3-піролідин-1ілпропіл)уреідо]ізотіазол-4-карбоксамід До суміші (4-карбамоіл-Зпентилсульфанілізотіазол-5-іл)карбамшовоі кислоти фенілового естеру (0,10г, 0,27ммоль) і 1мл тетрапдрофурану додавали N-3амінопропілпіролідин (0,175г, 1,4ммоль) Після перемішування протягом 72 годин при кімнатній температурі, суміш виливали в 1М NaOH, ДВІЧІ екстрагували етилацетатом і об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували Залишок очищали за допомогою радіальної хроматографії (платівка 2мм, 3% етанолСН2СІ2-30% етанол-СН2СІ2 містить 0,5% NH4OH), наступним концентруванням і розтиранням залишку з сумішшю ефір-гексан одержували 0,076г (78%) 3-пентилсульфаніл-5-[3-(3-піролідин-1ілпропіл)уреідо]ізотіазол-4-карбоксаміду у вигляді безбарвної твердої речовини 1Н ЯМР (400МГц, CDCI3) 5 7,57 (шс, 1Н), 7,06 (шс, 2Н), 3,35 (м, 2Н), 3,26 (м, 2Н), 2,53 (т, 2Н, и=6,8Гц), 2,47 (м, 4Н), 1,73 (м, 8Н), 1,4-1,2 (м, 4Н), 0,88 (т, ЗН, и=7,2Гц) м ч , МС (АРСІ, m/z) 400 [М+Н]+ ПРИГОТУВАННЯ З 3-(4-иіано-3-пдроксиізотіазол-5-іл)-1,1диметилсечовина (натрієва сіль) Розчин 3-(2,2-диціано-1-меркаптовшіл)-1,1диметилсечовини (натрієва сіль) (30г, 137ммоль) у воді (ЗООмл) обробляли при кімнатній температурі пероксидом водню (14мл 10М розчин) Реакційну суміш нагрівали і тверду густу речовину, що утворилася очищали виливаючи у воду (ЮОмл) Суміш нагрівали із зворотнім холодильником протягом 15 хвилин, до повного розчинення і потім охолоджували при кімнатній температурі Після стояння 1 годину при кімнатній температурі, суміш концентрували до постійної ваги (35г, >100% внаслідок вмісту води) і зразу ж викорис 39 товували на наступній стадії 5-(3,3-Диметилуреідо)-3-пдроксиізотіазол-4карбоксамід Тверду речовину одержану на попередній стадії (35г) додавали до концентрованої сірчаної кислоти (150мл) і потім воду (5мл) і перемішували при кімнатній температурі протягом ночі Суміш очищали з льодом (500г) і перемішували 2 годин Суміш фільтрували і крізь залишок протягом ночі просмоктували повітря Тверду речовину розтирали у ступці пестиком і витримували при високому вакуумі до постійної ваги (21,7г, 94,2ммоль, 69% після двох стадій) ПРИКЛАД З 5-(3,3-Диметилуреідо)-3-гептилоксиізотіазол4-карбоксамід Суспензію 5-(3,3-диметилуреідо)-3пдроксиізотіазол-4-карбоксаміду (200мг, 0,87ммоль) в ДМФА (5мл) обробляли KOtBu (107мг, 0,96ммоль) при кімнатній температурі, що приводило до повного розчиння Потім додавали 1-йодгептан (1мл) і реакційну суміш перемішували при кімнатній температурі до повного зникнення вихідних компонентів, наявність яких контролювали за допомогою ТШХ, використовуючи в я кості ел юенту сум і ш гексан/етилацетат/метанол/оцтова кислота (48/48/2/2) Реакційну суміш потім концентрували на роторному випаровувачі під високим вакуумом Залишок розчиняли в етилацетаті і метанолі, і потім очищали за допомогою радіальної хроматографії (2мм платівка) використовуючи той же самий елюент, що і при ТШХ, одержуючи два компоненти Більш полярний продукт ідентифікували як N-алкілований адукт (102мг, 0,311 ммоль, 36%) 1Н ЯМР (400МГц, CDCI3) 5 0,86 (т, J=6,7I~4, ЗН), 1,25-1,31 (м, 8Н), 1,64-1,70 (м, 2Н), 3,07 (с, 6Н), 3,68 (т, J=7,2I~4, 2Н), 5,40 (с, 1Н), 8,86 (с, 1Н), 12,1 (с, 1Н) м ч , 13С ЯМР (101МГц, CDCI3) 5 13,94, 22,45, 26,48, 28,74, 29,52, 31,52, 36,11, 42,54, 166,99 м ч , МС (АРСІ, m/z) 329 [М+Н]+ Менш полярний продукт О-алкілований адукт 1 (134мг, 0,408ммоль, 48%) Н ЯМР (400МГц, CDCI3) 5 0,88 (т, и=6,8Гц, ЗН), 1,24-1,50 (м, 8Н), 1,75-1,88 (м, 2Н), 3,07 (с, 6Н), 4,43 (т, и=6,7Гц, 2Н), 5,42 (с, 1Н), 7,25 (с, 1Н спостерігається накладення піку CDCI3), 11,6 (с, 1Н) м ч , 13С ЯМР (101МГц, CDCI3) 5 13,94, 22,45, 25,86, 28,83, 31,60, 36,11, 68,69, 97,69, 154,15, 162,27, 166,20, 169,45 м ч , МС (АРСІ, m/z) 329 [М+Н]+ ПРИГОТУВАННЯ 4 2-Ціанотюаиетамідноі кислоти 4метоксибензиловий естер До розчину гідроксиду натрію (13г, 0,32моль) в 750мл 1 1 етанол-вода при 0°С додавали 4метоксибензилмеркаптан (50г, 0,324моль) і малононітрил (21г, 0,324моль) Після перемішування протягом 3 годин при 0°С, суміш розводили 500мл насиченого водного розчину NH4CI, розводили 4л води і фільтрували Тверді речовини промивали ефіром і фільтрат розводили еквівалентним об'ємом гексану і фільтрували Об'єднані тверді речовини сушили під вакуумом, одержуючи 43г (60%) 2-ціано-тюацетамідноі кислоти 4-метоксибензилового естеру у вигляді безбарвної твердої речовини 1Н ЯМР (400МГц, CDCI3) 5 60365 40 7,22 (д, 2Н, и=7,6Гц), 6,84 (д, 2Н, и=8,8Гц), 4,74 (шс, 1Н), 3,98 (с, 2Н), 3,78 (с, ЗН) м ч , МС (АРСІ, + m/z) 221 [М+Н] 2-Ціано-З-меркапто-Зфеноксикарбоніламшотюацетамідної кислоти 4метокси-бензиловий естер До розчину 2-ціанотюацетамідноі кислоти 4метоксибензилового естеру (42г, 0,19моль) в 191мл етилацетату при 0°С додавали феноксикарбонілізотюціанат (34г, 0,19моль) і суміш перемішували при 0°С протягом 24 годин Суміш розводили ефіром і фільтрували Тверду речовину промивали ефіром, збирали і сушили під вакуумом, одержуючи 56г (73%) 2-ціано-З-меркапто-Зфеноксикарбоніламшотюакрілімідної кислоти 4метоксибензилового естеру у вигляді жовтої тве1 рдої речовини Н ЯМР (400МГц, CDCI3) 5 12,81 (с, 1Н), 9,01 (с, 1Н), 8,68 (с, 1Н) 7,28-6,99 (м, 7Н), 6,69 (д, 2Н, и=8,8Гц), 4,17 (с, 2Н), 3,64 (с, ЗН) м ч , МС (АРСІ, m/z) 400 [М+Н]+ [4-Ціано-3-(4-метокси-бензилсульфаніл)ізотіазол-5-іл]карбамшовоі кислоти феніловий естер До суміші 2-ціано-З-меркапто-Зфеноксикарбоніламшотюакрілімідної кислоти 4метоксибензилового естеру (11г, 28ммоль) і етилацетату (250мл) додавали при 0°С піридин (4,4г, 55ммоль) Протягом 1 години по краплям додавали розчин йоду (7,0г, 28ммоль) в 350мл етилацетату Одержану суспензію перемішували протягом 1 години, обробляли 200мл 1М НСІ і фільтрували, одержуючи 7,0г (64%) [4-ціано-3-(4метокси-бензилсульфаніл)ізотіазол-5іл]карбамшовоі кислоти фенілового естеру у вигляді безбарвної твердої речовини Фільтрат екстрагували 1л етилацетату і органічну фазу промивали водним розчином ІЧаНСОз, сушили над Na2SO4, фільтрували і концентрували, одержуючи ще 2,8г (26%) [4-ціано-3-(4метоксибензилсульфаніл)ізотіазол-5іл]карбамшовоі кислоти фенілового естеру 1Н ЯМР (400МГц, CDCI3) 5 11,95 (с, 1Н), 7,35 (т, 2Н, и=8,4Гц), 7,20 (м, ЗН), 7,13 (д, 2Н, и=8,0Гц), 6,78 (т, 2Н, и=8,6Гц), 4,34 (с, 2Н), 3,73 (с, ЗН) м ч , МС (АРСІ, m/z) 398 [М+Н]+ (4-Ціано-3-меркаптоізотіазол-5іл)карбамшовоі кислоти феніловий естер До суміші [4-ціано-3-(4метоксибензилсульфаніл)ізотіазол-5іл]карбамшовоі кислоти фенілового естеру (1,0г, 2,5ммоль), трифтороцтової кислоти (26мл) і анізолу (2,7г, 25ммоль) при 0°С додавали ацетат ртуті (0,80г, 2,5ммоль) Суміш залишали при кімнатній температурі на ніч Потім концентрували під вакуумом, суміш розводили 100мл води і ЮОмл етилацетату Повільно барботували сульфід водню до повного випадіння осаду солі ртуті Суміш розводили насиченим водним розчином хлориду натрію, екстрагували Зх200мл етилацетату, і об'єднані органічні шари фільтрували крізь целіт, сушили над Na2SO4, фільтрували і концентрували під вакуумом, одержуючи 0,70г (100%) (4-ціано-3-меркаптоізотіазол-5-іл)карбамшовоі кислоти фенілового естеру у вигляді безбарвної твердої речовини 1Н ЯМР (400МГц, ацетон-с^) 5 7,47 (т, 2Н, и=7,6Гц), 7,35-7,30 (м, ЗН) м ч , МС 41 (APCI, m/z) 276 [M-H] (4-Карбамоіл-3-меркаптоізотіазол-5іл)карбамшовоі кислоти феніловий естер Суміш (4-ціано-3-меркаптоізотіазол-5іл)карбамшовоі кислоти фенілового естеру (0,70г, 2,5ммоль), 2,6-ди-трет-бутил-4-метилфенол (ВНТ) (один кристал) і концентровану сірчану кислоту (Змл) перемішували протягом 18 годин при кімнатній температурі Суміш розводили холодною водою, екстрагували Зх етилацетатом і об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом Залишок розчиняли в Юмл етанол при 0°С і обробляли 0,096г (2,5ммоль) ЫаВЬЦ Після перемішування протягом ЗО хвилин, суміш підкислювали 1М НСІ, екстрагували в етилацетат, сушили над Na2SO4, фільтрували і концентрували під вакуумом, одержуючи 0,60г (81%) (4-карбамоіл-Змеркаптоізотіазол-5-іл)карбамшовоі кислоти феніловий естер у вигляді жовтої твердої речовини 1 Н ЯМР (400МГц, ацетон-de) 5 13,0 (с, 1Н), 11,010,9 (шс, 1Н), 10,3 (с, 1Н), 7,47 (т, 2Н, и=6,8Гц), 7,37 - 7,30 (м, 4Н) м ч , МС (APCI, m/z) 296 [М+Н]+ ПРИКЛАД 4 5-[3-(3-Хлор-4-фтор-бензил)уреідо]-3-(4метил-бензилсульфаніл)ізотіазол-4-карбоксамід До суміші (4-карбамоіл-З-меркаптоізотіазол5-іл)карбамшовоі кислоти фенілового естеру (0,075г, 0,25ммоль) в 0,5мл ДМФА додавали 4метилбензилхлорид (0,036г, 0,25ммоль), потім г\І,г\І-діізопропілетиламін (0,033г, 0,25ммоль) Після перемішування протягом 18 годин при кімнатній температурі, додавали тетрапдрофуран (1 мл), потім З-хлор-4-фторбензиламш (0,081 г, 0,51ммоль) Після перемішування протягом 24 годин при 45°С, суміш розводили 1М НСІ, екстрагували Зх етилацетатом, і об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом Залишок очищали за допомогою радіальної хроматографії на силікагелі використовуючи в якості елюенту етилацетат-гексан, одержуючи 26мг 5-[3-(3-хлор-4-фторбензил)уреідо]-3-(4-метилбензилсульфаніл)ізотіазол-4-карбоксаміду у вигляді безбарвної твердої речовини ВЕРХ час утримання 4,9 хвилини 1Н ЯМР (400МГц, ацеTOH-d6) 5 7,95 (шс, 1Н), 7,54 (дд, 1Н, J=2, 7,2Гц), 7,39 (м, 1Н), 7,31-7,25 (м, ЗН), 7,11 (д, 2Н, J=8,0l~4), 7,01 (шс, 2Н), 4,48 (м, 4Н), 2,28 (с, ЗН) м ч , МС (APCI, m/z) 465 [М+Н]+ ПРИГОТУВАННЯ 5 2-Ціаноацетамідноі кислоти бензиловий естер До розчину ефіру насиченого НСІ (4,00л, 1М, 4,00моль) додавали нагрітий (рідкий) малононітрил (252мл, 4,00моль) Після розчинення, розчин охолоджували до 10°С Потім додавали бензиловий спирт (414мл, 4,00моль) і суміш перемішували при 10°С протягом 0,5 години Колбу з реакційною сумішшю поміщали у холодильник і залишали стояти при 5°С на 4 дні Одержану тверду речовину фільтрували холодною, промивали холодним ефіром (1,5л) і сушили під вакуумом (40мм Нд) протягом 1 години одержуючи 545г (2,59моль, 65%) адукту Пінера, у вигляді білої 60365 42 твердої речовини Нейтралізацію цієї НСІ солі проводили як описано далі Одержували розчин карбонату калію (359г, 2,59моль) у воді (700мл) і охолоджували до 5°С Розчин виливали у воронку для розділення разом з ефіром (2л) і ТГФ (500мл) Далі воронку для розділення поміщали на льодяну баню до температури екстрактанту 5°С Потім ДО воронки для розділення додавали адукт Пінера (545г, 2,59моль) і воронку інтенсивно збовтували протягом 5 хвилин Водний шар відкидали і органічний шар збирали в подальшому відфільтровуючи суспендовані частки Органічний шар знову поміщали у воронку для розділення, збовтували з насиченим водним розчином хлориду натрію і дозволяли повне віртуальне виділення шару насиченого водного розчину хлориду натрію Органічний шар концентрували на роторному випаровувачі і нестабільний продукт (327г, 1,88ммоль, 73%) миттєво використовували на наступній стадії Феноксикарбонілізотюціанат Суспензію KSCN (80г, 823ммоль, з свіжої заздалегідь відкритої пляшки) в етилацетаті (2л, сухому) інтенсивно перемішували протягом ночі в атмосфері азоту до утворення порошку KSCN Суспензію тоді обробляли фенілхлорформіатом (ЮОмл, 800ммоль), який додавали по краплям протягом 1 години Реакційну суміш перемішували протягом ночі при кімнатній температурі і потім перемішували при 5°С протягом 8 годин КСІ, що утворився відфільтровували і розчинник видаляли на роторному випаровувачі не допускаючи нагрівання продукту вище кімнатної температури Продукт розчиняли в ефірі (2л), додатковий осад, що утворився видаляли фільтруванням і відкидали, і ефірний розчин продукту знову концентрували при пониженому тиску не допускаючи нагрівання продукту вище кімнатної температури Продукт розчиняли в гексані (2л), додатковий осад, що утворився видаляли фільтруванням і відкидали, і ефірний розчин продукту знову концентрували при пониженому тиску не допускаючи нагрівання продукту вище кімнатної температури Одержаний таким чином високочистий продукт (101г, 564ммоль, 68%) міг зберігатися при -5°С протягом наступних декільком днів, або при кімнатній температурі протягом декількох годин, але звичайно його використовували швидко, в данному прикладі 1Н ЯМР (400МГц, CDCI3) 5 7,107,21 (м, 2Н), 7,21-7,31 (м, 1Н), 7,31-7,45 (м, 2Н) м ч , ЪС ЯМР (101МГц, CDCI3) 5 120,75, 126,77, 129,65, 150,46 м ч , ІЧ (ЧІТКІ) 1190, 1232, 1491, 1590,1751,1960см1 2-Ціано-З-меркапто-Зфеноксикарбоніламшоакрілімідєвої кислоти бензиловий естер До перемішуємого 0°С розчину 2ціаноацетамідної кислоти бензилового естеру (327г, 1,88моль) в ацетонітрилі (1л) додавали 0°С розчин феноксикарбонілізотюціанату (353г, 1,97моль) в ацетонітрилі (1л) Реакційну суміш залишали нагріватись при кімнатній температурі і перемішували протягом ночі Суміш потім поміщали в холодильник і витримували при 5°С протягом 48 годин Твердий продукт фільтрували, віджимали і промивали 20°С ацетонітрилом 43 (Зх200мл) Потім крізь відносне стабільне тверде тіло при високому вакууму продували повітря одержуючи жовту тверду речовину (282г, 1 798ммоль, 42%) Н ЯМР (400МГц, ДМСО) 5 5,39 (с, 2Н), 7,11-7,19 (м, 2Н), 7,20-7,24 (м, 1Н), 7,367,46 (м, 7Н), 10,23 (шс, 4Н), 10,67 (с, 1Н), 12,19 + (шс,1Н) м ч , МС (АРСІ, m/z) 354 [М+Н] (3-Бензилокси-4-ціаноізотіазол-5іл)карбамшовоі кислоти феніловий естер До 0°С суспензії адукту, 2-ціано-З-меркапто3-феноксикарбоніламшакрілімідієвоі кислоти бензилового естеру (282г, 798ммоль) в ацетонітрилі (2л) додавали піридин (129мл, 1,60моль) Потім протягом 15 хвилин додавали розчин брому (41,1мл, 798ммоль) в ацетонітрилі (200мл) Реакційну суміш перемішували при 0°С протягом ще 1 години і потім при кімнатній температурі протягом 2 години Суміш поміщали в холодильник і тримали при 5°С протягом ночі Твердий продует фільтрували і промивали 0°С ефіром (1л), сушили на тому ж самому фільтрі продуваючи крізь тверду речовину повітря протягом 4 годин Тверду речовину додавали у воду (1л), інтенсивно перемішували протягом 1 години, фільтрували і сушили на тому ж самому фільтрі продуваючи крізь тверду речовину повітря протягом ночі одержуючи білу тверду речовину (320г чистого, при тому що міститься деяка КІЛЬКІСТЬ ВОДИ), ЩО використовували в такому вигляді на наступній стадії 1Н ЯМР (400МГц, ДМСО) 5 5,35 (с, 2Н), 7,257,45 (м, 10Н), 13,20 (шс, 1Н) м ч , МС (АРСІ, m/z) 350[М-Н] (4-Карбамоіл-3-пдрокси-ізотіазол-5іл)карбамшовоі кислоти феніловий естер Мокру тверду речовину, (З-бензилокси-4ціаноізотіазол-5-іл)карбамшовоі кислоти феніловий естер, (320г) повільно додавали до концентрованої сірчаної кислоти (650мл) протягом 1,5 годин Додавали додаткову порцію концентрованої сірчаної кислоти (ЮОмл) і суміш перемішували наступні 3 години В'язкий розчин розводили повільно додаючи лід (2000г) з наступним інтенсивним перемішуванням протягом ще 2 годин Кислоту частково видаляли розділяючи суспензію на ВІСІМ частин, які поміщали у контейнери, що поміщали у центрифугу, центрифугували при 3000об/хв протягом 45 хвилин при 21 °С Водний шар зливали, додавали чисту воду, залишок ресуспендували, і процес повторювали Після декількох циклів розведення/центрифугування/повторного розведення, рН водного шару підвищувався до - 4 і тверду речовину збирали і сушили пропускаючи повітря крізь залишок на фільтрі протягом 2 днів Менш вологу тверду речовину розтирали, знову поміщали на фільтр, і знову пропускали повітря крізь тверду речовину протягом наступного дня Цей процес повторювали до одержання сухої твердої речовини жовто-коричневого кольору (234г, 105% після двох стадій, наявність незначних кількостей домішок суттєво не вплинуло на наступні стадії) 1 Н ЯМР (400МГц, ДМСО) 5 7,00 (шс, 1 Н), 7,277,31 (м, ЗН), 7,40-7,45 (м, 2Н), 7,89 (с, 1 Н), 8,08 (с, 1 Н), 11,92 (с, 1Н), МС (АРСІ, m/z) 184 [М-(Н і РпОН)] [4-Карбамоіл-3-(2,6-дифтор-4 60365 44 метилбензилокси)-ізотіазол-5-іл]карбамшовоі кислоти феніловий естер До суспензії (4-карбамоіл-З-пдроксиізотіазол5-іл)карбамшовоі кислоти фенілового естеру (1,77г, 6,23ммоль), трифеніфосфіну (1,99г, 7,59ммоль), о,о'-дифтор-п-метилбензилового спирту (1,00г, 6,32ммоль) в ТГФ (21 мл) трохи швидше, ніж по краплях додавали дмзопропілазодикарбоксилат (ДИАД, 1,49мл, 7,59ммоль) Реакційну суміш нагрівали і вона ставали прозорою Після перемішування протягом 15 хвилин, більшу частину ТГФ видаляли на роторному випаровувачі і неочищену суміш очищали на силікагелі використовуючи в якості елюенту суміш хлороформ/ацетон/оцтова кислота (98,5/0,75/0,75), одержуючи білу тверду речовину (802мг, 1,91ммоль, 30%) Приклад 5 3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл}уреідо}-ізотіазол-4карбоксамід До суспензії [4-карбамоіл-3-(2,6-дифтор-4метилбензилокси)-ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру (125мг, 0,298ммоль) в ТГФ (1 мл) додавали 1 -(3-амшопропіл)-4метилпіперазин (70мг, 0,45ммоль) Суміш збовтували при 50°С протягом ночі, охолоджували при кімнатній температурі і очищали за допомогою радіальною хроматографії використовуючи в якості елюенту суміш хлороформ/метанол/ концентрований гідроксид амонію (50/5/1) одержуючи білу тверду речовину (121мг, 0,251 ммоль, 84%) 1Н ЯМР (400МГц, CDCI3) 5 1,72 (т, и=5,81Гц, 2Н), 2,20-2,85 (м, 10Н), 2,28 (с, ЗН перекривається мультиплетом 2,20-2,85), 2,35 (с, ЗН перекривається мультиплетом 2,20-2,85), 3,39 (т, и=5,4Гц, 2Н), 5,51 (с, 2Н), 5,74 (шс, 1Н), 6,74 (д, и=8,ЗГц, 2Н), 7,05 (с, 1Н), 7,58 (шс, 1Н), 11,01 (шс, 1Н) м ч , МС (APCf, m/z) 483 [М+Н] Синтез зразку фтортолуолпохідних G 1,3-Дифтор-5-метилбензол (G = Н) Суміш 1-бромметил-3,5-дифторбензолу (75г, 0,362моль), Pd/C (5%, 5г), і ацетатнатрію (208г, 2,54моль) в ефірі (ЗООмл) обробляли воднем (50псі) в апараті Парра протягом 2 днів Суміш фільтрували крізь целіт і органічний розчин три рази промивали насиченим водним розчином бікарбонату натрію Водні шари промивали ефіром і об'єднані органічні шари сушили (МдБОД фільтрували, і частково концентрували випарюванням використовуючи баню з холодною водою Одержували леткий продукт у вигляді суміші з ефіром у співвідношенні (~3 2, ефір продукт, г г) розрахунок грунтувався на 1Н ЯМР інтеграції, визначаючи фактичний вихід (45,5г, 0,355моль, 98%) продукту шляхом розрахунку реагентів потрібних для наступної реакції 1Н ЯМР (400МГц, CDCI3) 5 2,25 (с, ЗН), 6,51-6,56 (м, 1Н), 6-58-6,60 (м, 2Н) м ч 1,2,5-Трифтор-З-метилбензол (G = F) 45 Вказану в заголовку сполуку одержували з 1бромметил-2,3,5-трифторбензолу використовуючи методику подібну до тієї, що приведена для 1 3,5-дифтортолуолу, вище Н ЯМР (400МГц, + CDCI3) 5 м ч , МС (АРСІ, m/z) [M+H] Синтез зразку бензилових спиртів для перетворення у R G (2,6-Дифтор-4-метилфеніл)метанол (G = Н, 1 G = Me, G" = F) Розчин 1,3-дифтор-5-метилбензолу (45,5г, 0,355моль, змішували з маленьким об'ємом ефіру) в сухому ТГФ (1,77л) охолоджували до -78°С в атмосфері азоту і і по краплям додавали H-BuLi (142мл, 2,5М розчин в гексані, 0,355моль) Розчин перемішували ще 25 хвилин і потім обробляли ДМФА (27,5мл, 0,355моль) Після перемішування протягом 45 хвилин, розчин обробляли оцтовою кислотою (40,6мл, 0,71 моль) і колбу прибирали з -78°С бані Суміш перемішували при кімнатній температурі протягом 2 годин і потім послідовно обробляли водою (ЗООмл) і МеОН (ЗООмл) Потім порціями додавали NaBbU (26,8г, 0,71 моль) після чого перемішували суміш протягом 1 години Колбу охолоджували на льодяній бані і суміш обробляли 6 N НСІ до рН - 5 Суміш концентрували на роторному випаровувачі до видалення ТГФ і МеОН і продукт екстрагували ефіром і промивали декілька разів малими об'ємами води і один раз насиченим водним розчином хлориду натрію Ефірний шар сушили (MgSO4), фільтрували, і концентрували одержуючи масло (45г, 0,285моль, 80%), що тверділо при охолодженні 1Н ЯМР (400МГц, CDCI3) 5 1,75 (т, и=6,5Гц, 1Н), 2,32 (с, ЗН), 4,72 (д, и=6,4Гц, 2Н), 6,69 (д, и=7,9Гц, 2Н) м ч (2,3,6-Трифтор-4-метилфеніл)метанол (G = F, G' = Me, G" = F) Вказану в заголовку сполуку одержували з 1,2,5-трифтор-З-метилбензолу використовуючи методику подібну до тієї, що приведена для (2,6дифтор-4-метилфеніл)метанолу, вище 1Н ЯМР (400МГц, CDCI3) 5 1,87 (шс, 1Н), 2,28 (д, J=1,9I~4, ЗН), 4,74 (с, 2Н), 6,68-6,72 (м, 1Н) м ч (4-Бром-2,6-дифторфеніл)метанол (G = Н, G' = Вг, G" = F) Вказану в заголовку сполуку одержували з 1бром-3,5-дифторбензолу використовуючи методику подібну до тієї, що приведена для (2,6дифтор-4-метилфеніл)-метанолу, вище, з наступним виключенням замість H-BULI використовували дизопропіламідлітію (ДАЛ) і час депротонування складав 45 хвилин 1Н ЯМР (400МГц, CDCI3) 5 1,91 (т, и=6,5Гц, 1Н), 4,71 (д, и=6,4Гц, 2Н), 7,06-7,12 (м, 2Н) мч (4-Бром-2,3,6-трифторфеніл)метанол (G = F, G' = Br, G" = F) Вказану в заголовку сполуку одержували з 1бром-2,3,5-трифторбензолу використовуючи методику подібну до тієї, що приведена для (2,6 60365 46 дифтор-4-метилфеніл)-метанолу, вище, з наступним виключенням замість H-BULI використовували дизопропіламідлітію (ДАЛ) і час депротону1 вання складав 45 хвилин Н ЯМР (400МГц, CDCI3) 5 1,89 (т, и=6,5Гц, 1Н), 4,75 (д, и=6,4Гц, 2Н), 7,11-7,15 (м, 1Н) мч (3-Хлор-2,6-дифторфеніл)метанол (G = СІ, G' = H, G"= F) Вказану в заголовку сполуку одержували з 1хлор-2,4-дифторбензолу використовуючи методику подібну до тієї, що приведена для (2,61 дифтор-4-метилфеніл)-метанолу, вище Н ЯМР (400МГц, CDCI3) 5 1,90 (т, и=6,4Гц, 1Н), 4,78 (д, и=6,4Гц, 2Н), 6,87 (дод дт, J=1,8, 8,9Гц, 1Н), 7,32 (дод дт, J=5,8, 2,8Гц, 1Н) м ч (2-Фтор-4,6-диметилфеніл)метанол (G = Н, 1 G = Me, G"= Me) Розчин М,М,М',М'-тетраметилетилендіамін (13,4мл, 88,6ммоль) в ТГФ (115мл) охолоджували до -78°С і обробляли втор-BuLi (68,2мл 1,ЗМ розчин в циклогексані, 88,6ммоль) Одержаний жовтий розчин перемішували протягом 20 хвилин при -78°С і потім обробляли розчином 1-фтор3,5-диметилбензолу (10,0г, 80,5ммоль) в ТГФ (56мл) Суміш перемішували протягом 1 години при -78°С і потім обробляли розчином ДМФА (6,86мл, 88,6ммоль) в ТГФ (26мл) Краснуватокоричневу суміш перемішували 1 годину, і потім обробляли НОАс (Юмл) і водою (200мл) Суміш нагрівали до кімнатної температури, екстрагували ефіром (500мл) і водний шар екстрагували ефіром (2х300мл) Об'єднані органічні екстракти об'єднували і послідовно промивали 0,2М НСІ (2х200мл), водою (500мл) і насиченим водним розчином хлориду натрію (ЗООмл) Органічний шар сушили (MgSO4) і концентрували одержуючи альдегід, у вигляді прозорого масла (11,9г, 78,2ммоль, 97%) Альдегід розчиняли в ТГФ (ЮОмл), МеОН (ЮОмл) і воді (ЮОмл) і обробляли NaBH4 (2,96г, 78,2ммоль) додаючи його порціями Суміш перемішували при кімнатній температурі протягом 1 години і потім концентрували при пониженому тиску видаляючи ТГФ і МеОН Шар водного розчину, що залишився ДВІЧІ екстрагували ефіром (600мл і 200мл) і об'єднані органічні шари послідовно промивали 0,1 М НСІ (ЗООмл), водою (ЗООмл) і насиченим водним розчином хлориду натрію (ЗООмл) Органічний шар сушили (MgSO4) і концентрували одержуючи масло (10,8г, 70,4ммоль, 90%) 1Н ЯМР (400МГц, CDCI3) 5 2,28 (с, ЗН), 2,38 (с, ЗН), 4,70 (с, 2Н), 6,71 (д, и=10,6Гц, 1Н), 6,79 (с, 1Н)мч (2-Фтор-4-метилфеніл)метанол (G = Н, G' = Me, G" = Н) Розчин 4-бром-З-фтортолуолу (12,2г, 64,7ммоль) в ТГФ (170мл) охолоджували до 78°С і порціями додавали H-BuLi (25,9мл, 2,5М розчин в гексані, 65ммоль) Після перемішування протягом 1 години, розчин обробляли N,Nдиметилформамідом (ДМФА) (5,5мл, 71ммоль) і перемішували ЗО хвилин після чого додавали оцтову кислоту (12мл) Колбу прибирали з охолоджувальної бані і залишали нагріватися до кімнатної температури Потім додавали воду і продукт екстрагували ефіром Органічний шар послідовно промивали розведеною НСІ і насиче 47 ним водним розчином хлориду натрію і потім сушили (MgSO4) і концентрували Процедуру повторювали (використовуючи 11,8г 4-бром-Зфтортолуолу) і об'єднаний матеріал піддавали наступному відновленню Альдегід (17,6г, 127ммоль) розчиняли в ТГФ (165мл), МеОН (165мл) і воді (165мл) Потім порціями протягом декількох хвилин додавали NaBbU (5,3г, 140ммоль) (кипіння, екзотермічна) і перемішували вміст колби протягом 2 годин Реакційну суміш розводили великою КІЛЬКІСТЮ ефіру і гасили обробляючи розведеною НСІ Шари розділяли і органічний шар сушили (MgSO4) і концентрували одержуючи продукт у вигляді масла (17,0г, Г 121ммоль, 95%) Н ЯМР (400МГц, CDCI3) 5 2,33 (с, ЗН), 4,69 (с, 2Н), 6,86 (д, J=11,2I~4, 1Н), 6,93 (д, J=7,9I~4, 1Н), 7,24-7,28 (м, 1Н) м ч (4-Хлор-2,5-дифторфеніл)метанол До суміші 4-хлор-2,5-дифторбензойноі кислоти (15г, 78ммоль), тетрапдрофурану (ТГФ) (75мл) і триметилборату (26мл, 230ммоль) додавали борметилсульфідний комплекс (86мл, 86ммоль, 10М розчин в ДМСО) і суміш перемішували протягом 18 годин при кімнатній температурі Для завершення протікання реакції ще додавали борметилсульфідний комплекс (2,47мл, 24,7ммоль) Суміш виливали в 1М водний розчин NaOH, екстрагували Зх ефіром, і об'єднані органічні шари сушили над безводним MgSC^, фільтрували і концентрували під вакуумом Розтирали твердий залишок з сумішшю ефір-гексан одержували 14г (4-хлор-2,5-дифторфеніл)метанолу у вигляді безбарвної твердої речовини 1Н ЯМР (400МГц, CDCI3) 5 7,26 (дд, 1Н, J=6, 8,8Гц), 7,11 (дд, 1Н, J=6, 9,2Гц), 4,71 (д, 2Н, и=6,0Гц), 1,80 (т, 1Н, и=6,0Гц) м ч трет-Бутил-(2,3дифторбензилокси)диметилсилан До розчину (2,3-дифторфеніл)метанолу (5,0г, 35ммоль), імідазолу (4,9г, 72ммоль) і ДМФА (40мл) додавали трет-бутилдиметилхлорсилан (5,4г, Збммоль) Після перемішування при кімнатній температурі протягом 24 годин, суміш розділяли між 400мл ефіру і ЮОмл води Органічний шар ДВІЧІ промивали водою, сушили над MgSO4, фільтрували і концентрували під вакуумом, одержуючи 6,8г трет-бутил(2,3дифторбензилокси)диметилсилану, у вигляді безбарвного масла 1Н ЯМР (400МГц, CDCI3) 5 7,22 (м, 1Н), 7,04 (м, 2Н), 4,79 (с, 2Н), 0,91 (с, 9Н), 0,12 (с, 6Н) мч трет-Бутил(2,3-дифтор-4метилбензилокси)диметилсилан До розчину ТМЕДА (3,9мл, 3,0г, 26ммоль) в ТГФ (ЗЗмл) при -78°С додавали втор-бутиллітію (20мл, 1,ЗМ в гексані, 26ммоль) Після перемішування протягом 20 хвилин по краплям додавали розчин трет-бутил(2,3дифторбензилокси)диметилсилану (6,0г, 23ммоль) в 17мл ТГФ Після перемішування протягом 1 години, до розчину по краплям додавали розчин метилйодиду (8мл) в ТГФ (40мл) при 20°С Після перемішування протягом 18 годин, суміш гасили насиченим водним розчином ІЧЬЦСІ, екстрагували Зх в ефір, і об'єднані органічні шари сушили над MgSO4, фільтрували і концентрували 60365 48 під вакуумом, одержуючи 6,6г трет-бутил(2,3дифтор-4-метилбензилокси)диметилсилан, у ви1 гляді світло-жовтого масла Н ЯМР (400МГц, CDCI3) 5 7,07 (дод т, 1Н, и=7,2Гц), 6,89 (дод т, 1Н, и=7,ЗГц), 4,74 (с, 2Н), 2,26 (д, ЗН, и=1,9Гц), 0,87 (с, 9Н), 0,07 (с, 6Н) м ч (2,3-ДиФтор-4-метилФеніл)метанол До розчину трет-бутил(2,3-дифтор-4метилбензилокси)диметилсилану (6,5г, 24ммоль) в ТГФ (24мл) додавали тетрабутиламоніифторид (24мл, 1М розчин в ТГФ, 24ммоль) Після перемішування при кімнатній температурі протягом 1 години, суміш виливали у воду, підкислювали 1М водним розчином НСІ, екстрагували Зх етилацетатом, і об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом Залишок очищали хроматографією на силікагелі (10 1 до 2 1 гексан-етилацетат), одержуючи (2,3-дифтор-4-метилфеніл)метанол, у вигляді світло-жовтого масла 1 -Бром-2,5-дифтор-4-метилбензол Суміш 2,5-дифтортолуолу (25г, 0,20моль) і порошку заліза (11г, 0,2моль) охолоджували до 5°С По краплям додавали бром, так щоб температура реакційної суміші не підіймалася вище 0°С Після перемішування протягом 3 годин, суміш розводили ефіром, фільтрували і промивали розчин водним розчином тіосульфату натрію Водний шар екстрагували ефіром, і об'єднані органічні шари сушили над MgSC^, фільтрували і концентрували під вакуумом Після перегонки при атмосферному тиску одержували 34г 1-бром-2,5дифтор-4-метилбензолу, у вигляді безбарвного масла (Ткип 180°С) 1Н ЯМР (400МГц, CDCI3) 5 7,20 (дд, 1Н, J=6,0, 8,5Гц), 6,93 (м, 1Н), 2,23 (с, ЗН) мч (2,5-Дифтор-4-метилфеніл)метанол Суміш 1-бром-2,5-дифтор-4-метилбензолу (3,3г, Ібммоль) і ефіру (75мл) охолоджували до 78°С, і по краплям додавали розчин н-бутиллітію в гексані (5,4мл, 2,5М, 13,5ммоль) Після перемішування протягом 1 години, додавали диметилформамід (1,1мл, 14ммоль) і суміш перемішували протягом 1 години Суміш обробляли 1М НСІ і водою, нагрівали при кімнатній температурі і екстрагували Зх ефіром Об'єднані органічні шари сушили над MgSO4, фільтрували і концентрували під вакуумом Залишок розводили тетрапдрофураном (50мл) і суміш обробляли борпдридом натрію (0,50г, 13,5ммоль) і етанолом (2мл) Після перемішування протягом ЗО хвилин, суміш обережно розводили з 0,5М водним розчином НСІ, екстрагували Зх етилацетатом, і об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували під вакуумом Залишок перекристалізували з гексану одержували 1,24г (54%) (2,5дифтор-4-метилфеніл)-метанолу у вигляді безбарвної твердої речовини 1Н ЯМР (400МГц, CDCI3) 5 7,05 (дд, 1Н, J=6,0, 9,2Гц), 6,84 (дд, 1Н, J=6,4, 10Гц), 4,68 (д, 2Н, и=6,0Гц), 2,23 (с, ЗН), 1,76 (т, 1Н, и=6,0Гц) мч (5-Хлор-2-фтор-4-метилфеніл)метанол (5-Хлор-2-фтор-4-метилфеніл)метанол одержували за алогічною методикою що і (2,5дифтор-4-метилфеніл)метанол використовуючи в якості вихідного матеріалу 2-хлор-5-фтортолуол 49 60365 50 лоти феніловий естер Н ЯМР (400МГц, CDCI3) 5 7,38 (д, 1Н, и=6,8Гц), 6,92 (д, 1Н, J=10F4), 4,69 (с, 2Н), 2,34 (с, ЗН) м ч Одержували вказану у заголовку сполуку як описано в Прикладі 3 використовуючи в якості 4-Хлор-2,6-дифторбензальдепд вихідного матеріалу (2,3-дифтор-4До розчину 3,5-дифтор-1-хлорбензолу (5,0г, метилфеніл)метанол, одержуючи 1,7г (57%) [434ммоль) в тетрапдрофурані (70мл) при -78°С карбамоіл-3-(2,3-дифтор-4додавали розчину н-бутиллгпю в гексані (12,1мл, 2,5М, ЗОммоль) Після перемішування протягом 1 метилбензилокси)ізотіазол-5-іл]карбамшовоі кисгодини, додавали диметилформамід (5,2мл, лоти фенілового естеру у вигляді безбарвної 67ммоль) і суміш перемішували протягом 1,5 готвердої речовини ВЕРХ час утримання 4,8 хви1 дин Суміш нагрівали при кімнатній температурі, лин Н ЯМР (400МГц, CDCI3) 5 11,38 (с, 1Н), 7,40 розводили ефіром і виливали в 150мл 0,5М вод(т, 2Н, и=8,0Гц), 7,26 (т, 1Н, и=7,2Гц), 7,20 (д, 1Н, ного розчину НСІ Водний розчин екстрагували Зх и=8,4Гц), 7,14 (д, 1Н), 7,11 (т, 1Н, и=7,6Гц), 6,94 в ефір, і об'єднані органічні шари сушили над (т, 1Н, и=7,2Гц), 5,6 (д, 1Н), 5,52 (с, 2Н), 2,31 (д, MgSO4, фільтрували і концентрували під вакууЗН, и=1,7Гц) мч мом, одержуючи 5,72г (96%) 4-хлор-2,6[4-Карбамоіл-3-(2,5-дифтор-4дифторбензальдепду у вигляді безбарвної тверхлорбензилокси)ізотіазол-5-іл]карбамшовоі кис1 дої речовини Н ЯМР (400МГц, CDCI3) 5 10,27 (с, лоти феніловий естер 1Н), 7,04 (д, 2Н, и=7,9Гц) мч Одержували вказану у заголовку сполуку як описано в Прикладі 3 використовуючи в якості (4-Хлор-2,6-дифторфеніл)метанол вихідного матеріалу (2,5-дифтор-4До суміші 4-хлор-2,6-дифторбензальдепду хлорфеніл)метанол, одержуючи 0,86г (26%) [4(5,7г, 32ммоль), тетрапдрофурану (150мл) і етакарбамоіл-3-(2,5-дифтор-4-хлорбензилокси)нолу (20мл) додавали борпдрид натрію (1,2г, ізотіазол-5-іл]карбамшовоі кислоти фенілового 32ммоль) при 0°С Суміш перемішували протягом естеру у вигляді безбарвної твердої речовини ЗО хвилин, нагрівали при кімнатній температурі, і ВЕРХ час утримання 4,8 хвилин 1Н ЯМР для завершення протікання реакції додавали (400МГц, ДМСО-de) 5 11,73 (с, 1Н), 8,04 (с, 1Н), борпдрид натрію (0,40г, 11ммоль) (ТШХ) Суміш 7,77 (м, 2Н), 7,51 (м, 2Н), 7,36 (м, ЗН), 7,23 (с, концентрували під вакуумом, розводили ефіром і 1Н), 5,51 (с, 2Н) мч обережно обробляли 1М водним розчином НСІ Водний розчин екстрагували Зх ефіром, і об'єд[4-Карбамоіл-3-(2,6-дифтор-4нані органічні шари сушили над MgSC^, фільтрухлорбензилокси)ізотіазол-5-іл]карбамшовоі кисвали і концентрували Залишок розтирали з пенлоти феніловий естер таном одержуючи 4,8г (83%) (4-хлор-2,6Одержували вказану у заголовку сполуку як дифторфеніл)метанолу у вигляді безбарвної твеописано в Прикладі 3 використовуючи в якості 1 рдої речовини Н ЯМР (300МГц, CDCI3) 5 7,04 (д, вихідного матеріалу (2,6-дифтор-4-хлор2Н, и=7,1Гц), 4,73 (с, 2Н) мч феніл)метанол, одержуючи 0,86г (26%) [4карбамоіл-3-(2,6-дифтор-4Загальна методика одержання ізотіазолфеніхлорбензилокси)ізотіазол-5-іл]карбамшовоі кислкарбаматів лоти фенілового естеру у вигляді безбарвної [4-Карбамоіл-3-(2,5-дифтор-4твердої речовини ВЕРХ час утримання 4,5 хвиметилбензилокси)ізотіазол-5-іл]карбамшовоі кислин 1Н ЯМР (400МГц, CDCI3, CD3OD) 5 7,31 (т, лоти феніловий естер 2Н, и=8,0Гц), 7,18 (т, 1Н, и=7,6Гц), 7,10 (д, 2Н, До суміші (4-карбамоіл-3-пдроксиізотіазол-5и=7,6Гц), 6,92 (д, 2Н, и=7,2Гц), 5,45 (с, 2Н) м ч іл)карбамшовоі кислоти фенілового естеру (2,1г, 7,6ммоль), (2,5-дифтор-4-метилфеніл)метанолу Загальна методика одержання ізотіазолсечо(1,2г, 7,6ммоль), трифенілфосфіну (2,1г, вин 8,0ммоль) і тетрапдрофурану (19мл) додавали Приклад 6 діетилазодикарбоксилат (1,3мл, 8,0ммоль) Після 3-(2,5-Дифтор-4-метилбензилокси)-5-[3-(4перемішування протягом 16 годин при кімнатній піролідин-1-ілбутил)уреідо]ізотіазол-4температурі, ще додавали (2,5-дифтор-4карбоксамід метилфеніл)метанолу (0,24г, 1,5ммоль), трифеСуміш [4-карбамоіл-3-(2,5-дифтор-4нілфосфш (0,42г, 1,6ммоль) і діетилазодікарбокметилбензилокси)ізотіазол-5-іл]карбамшовоі киссилат (0,30мл, 1,8ммоль) і суміш перемішували лоти фенілового естеру (0,34г, 0,81ммоль), 4протягом 1 години Після концентрування під вапіролідинобутиламш (0,12г, 0,81ммоль) і тетрапкуумом, суміш очищали хроматографією на силідрофуран (2,8мл) збовтували при 45-50°С протякагелі використовуючи в якості елюенту суміш гом 24 годин Суміш концентрували і очищали за ацетон-оцтова кислота-метиленхлорид (0,5%, допомогою радіальної хроматографії (4мм платі0,5%, 99%), одержуючи, після розтирання з сумівка, CH3OH-CHCI3-NH4OH (10 89 1) до (15 84 1)), шшю ефір-гексан, 1,1г (35%) [4-карбамоіл-3-(2,5одержуючи 0,31г вказаної у заголовку сполуки у дифтор-4-метилбензилокси)-ізотіазол-5вигляді безбарвної твердої речовини Матеріал іл]карбамшовоі кислоти фенілового естеру у вирозчиняли в Юмл 4 1 суміші метанол-хлороформ гляді безбарвної твердої речовини ВЕРХ час при -10°С і обробляли розчином метансульфоноутримання 4,8хв 1Н ЯМР (400МГц, CD3OD) 5 воі кислоти (0,043мл в 0,5мл СНзОН) Після пе7,40 (т, 2Н, и=8,0Гц), 7,27 (т, 1Н, и=7,2Гц), 7,20 (д, ремішування протягом 5 хвилин, суміш концент2Н, и=8,4Гц), 7,17 (дд, 1Н, J=6,0, 9,2Гц), 7,00 (дд, рували під вакуумом, і залишок розтирали з су1Н, J=6,4, 10Гц), 5,49 (с, 2Н), 2,24 (с, ЗН) м ч мішшю метанол-ефір, одержуючи 0,35г вказаної у заголовку сполуки (82%) у вигляді безбарвної [4-Карбамоіл-3-(2,3-дифтор-4твердої речовини ВЕРХ час утримання 3,3 хвиметилбензилокси)ізотіазол-5-іл]карбамшовоі кис1 60365 52 51 1 (м, 2Н), 2,24 (д, ЗН, и=1,6Гц), 2,02 (м, 1Н), 1,88лин Н ЯМР (400МГц, D2O) 5 6,74 (дд, 1Н, J=6,0, + 1,56 (м, 7Н) м ч , МС (АРСІ, m/z) 498 [М+Н] 9,6Гц), 6,63 (дд, 1Н, J=6,4, 10,4Гц), 4,61 (с, 2Н), Приклад 11 3.44 (м, 2Н), 3,05-2,98 (м, 4Н), 2,98-2,81 (м, 2Н), 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(32,62 (с, ЗН), 1,95-1,93 (м, 4Н), 1,83-1,80 (м, 2Н), пдрокси-піперидин-1-іл)бутил]уреідо}ізотіазол-41,6-1,5 (м, 2Н), 1,4-1,3 (м, 2Н) м ч , МС (АРСІ, + карбоксамід m/z) 468 [М+Н] Вказану в заголовку сполуку одержували з [4Приклад 7 карбамоіл-3-(2,5-дифтор-43-(2,5-Дифтор-4-метилбензилокси)-5-[3-(4метилбензилокси)ізотіазол-5-іл]карбамшовоі киспдрокси-5-піперидин-1-ілпентил)уреідо]-ізотіазоллоти фенілового естеру і 1 -(44-карбоксамід амшобутил)піперидин-3-олу за методикою аналоВказану в заголовку сполуку одержували з [4гічною описаній в Прикладі 6 ВЕРХ час утриманкарбамоіл-3-(2,5-дифтор-41 ня 3,3 хвилин Н ЯМР (400МГц, CD3OD) 5 7,18 метилбензилокси)ізотіазол-5-іл]карбамшовоі кис(дд, 1Н, J=6,8, 9,6Гц), 7,04 (дд, 1Н, J=5,6, 10Гц), лоти фенілового естеру і 5-амшо-1-піперидин-15,45 (с, 2Н), 3,64 (м, 1Н), 3,24-3,22 (м, 2Н), 2,90 ілпентан-2-олу за методикою аналогічною описа(м, 1Н), 2,73 (м, 1Н), 2,37 (м, 2Н), 2,25 (д, ЗН, ній в Прикладі 6 ВЕРХ час утримання 3,3 хви1 и=1,6Гц), 1,99-1,87 (м, ЗН), 1,74 (м, 1Н), 1,74-1,53 лин Н ЯМР (400МГц, CD3OD) 5 7,18 (дд, 1Н, (м, 6Н) м ч , МС (АРСІ, m/z) 498 [М+Н]+ J=6,0, 9,2Гц), 7,05 (дд, 1Н, J=6,0, 10Гц), 5,47 (с, 2Н), 3,80 (м, 1Н), 3,23 (т, 2Н, и=6,4Гц), 2,7-2,4 (м, Приклад 12 7Н), 2,25 (с, ЗН), 1,8-1,4 (м, пН) м ч , МС (АРСІ, 3-(2,5-Дифтор-4-метилбензилокси)-5-[3-(5m/z) 512[M+H] + ізопропіламінопентил)уреідо]ізотіазол-4карбоксамід Приклад 8 Вказану в заголовку сполуку одержували з [4(Р)-3-(2,5-Дифтор-4-метилбензилокси)-5-{3карбамоіл-3-(2,5-дифтор-4[4-(3-пдрокси-піролідин-1іл)бутил]уреідо}ізотіазол-4-карбоксамід метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і І\І1-ізопропілпентан-1,5Вказану в заголовку сполуку одержували з [4діаміну за методикою аналогічною описаній в карбамоіл-3-(2,5-дифтор-4Прикладі 6 ВЕРХ час утримання 3,4 хвилин 1Н метилбензилокси)ізотіазол-5-іл]карбамшовоі кисЯМР (400МГц, CD3OD) 5 7,20 (дд, 1Н, J=5,7, лоти фенілового естеру і (R)-1 -(49,0Гц), 7,06 (дд, 1Н, J=6,3, 10Гц), 5,47 (с, 2Н), 3,23 амшобутил)піролідин-3-олу за методикою анало(т, 2Н, и=6,6Гц), 2,93 (с, 1Н, и=6,ЗГц), 2,70 (м, 2Н), гічною описаній в Прикладі 6 ВЕРХ час утриман2,27 (д, ЗН, и=1,8Гц), 1,7-1,5 (м, 4Н), 1,5-1,3 (м, ня 3,2 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,19 2Н), 1,11 (д, 6Н, и=6,6Гц) м ч , МС (АРСІ, m/z) (дд, 1Н, J=6,0, 9,2Гц), 7,04 (дд, 1Н, J=6,0, 10Гц), 470 [М+Н]+ 5.45 (с, 2Н), 4,34 (м, 1Н), 3,23 (м, 2Н), 2,86 (дд, 1Н, J=6,0, 10,4Гц), 2,78 (м, 1Н), 2,65-2,54 (м, 4Н), 2,25 (с, ЗН), 2,14 (м, 1Н), 1,73 (м, 1Н), 1,56 (м, 4Н) м ч , МС (АРСІ, m/z) 484 [М+Н]+ Приклад 9 3-(2,5-Дифтор-4-метилбензилокси)-5-[3-(6диметиламшогексил)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4-метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і г\І1,г\І1-диметилгексан-1,6-діаміну за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,4 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,18 (дд, 1Н, J=6,0, 9,2Гц), 7,03 (дд, 1Н, J=6,4, 10Гц), 5,45 (с, 2Н), 3,19 (т, 2Н, и=7,2Гц), 2,28 (м, 2Н), 2,24 (с, ЗН), 2,22 (с, 6Н), 1,55-1,45 (м, 4Н), 1,35-1,33 (м, 4Н) м ч , МС (АРСІ, m/z) 470 [М+Н]+ Приклад 10 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4-(2пдроксиметилпіролідин-1іл)бутил]уреідо}ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і (S)-[1 -(4амшобутил)піролідин-2-іл]метанолу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,2 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,18 (дд, 1Н, J=6,0, 9,2Гц), 7,04 (дд, 1Н, J=6,4, 10Гц), 5,45 (с, 2Н), 3,62-3,56 (м, 2Н), 3,29-3,23 (м, 2Н), 3,02 (м, 1Н), 2,78 (м, 1Н), 2,83 (м, 1Н), 2,51 Приклад 13 3-(2,3-Дифтор-4-метилбензилокси)-5-{3-[4(3,4-дипдрокси-піролідин-1іл)бутил]уреідо}ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1 -(4амінобутил)піролідин-3,4-дюлу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,1 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,17 (т, 1Н, и=7,6Гц), 7,03 (т, 1Н, и=7,ЗГц), 5,49 (с, 2Н), 4,01 (с, 2Н), 3,21 (с, 2Н), 2,93 (м, 2Н), 2,48 (м, 4Н), 2,29 (с, ЗН), 1,54 (шс, 4Н) м ч , МС (АРСІ, m/z) 500 [М+Н]+ Приклад 14 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3пдрокси-5-піролідин-1-ілпентил)уреІдо]-ізотіазол4-карбоксамід - Метансульфонатна сіль Вказану в заголовку сполуку одержували з (4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-амшо-5-піролідин-1ілпентан-3-олу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,1 хвилин 1Н ЯМР (400МГц, D2O) 5 6,81 (д, 2Н, и=7,2Гц), 5,17 (с, 2Н), 3,61 (шм, 1Н), 3,47 (шм, 2Н), 3,2-3,0 (м, 4Н), 2,89 (м, 2Н), 2,62 (с, ЗН), 1,94 (м, 2Н), 1,85-1,2 (м, 6Н) м ч , МС (АРСІ, m/z) 518 [М+Н]+ Приклад 15 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3 53 пдрокси-5-піролідин-1-ілпентил)уреідо]-ізотіазол4-карбоксамід - Метансульфонатна сіль Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-амшо-5-піролідин-1ілпентан-3-олу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,3 хви1 лин Н ЯМР (400МГц, CD3OD) 5 7,17 (д, 2Н, и=6,4Гц), 5,51 (с, 2Н), 3,64 (шм, 1Н), 3,24 (т, 2Н, и=6,0Гц), 2,92 (м, 1Н), 2,72 (м, 1Н), 2,39 (м, 2Н), 1,98 (м, 1Н), 1,87 (м, 2Н), 1,75 (м, 1Н), 1,54 (м, + 4Н), 1,22 (м, 2Н) м ч , МС (АРСІ, m/z) 517 [М+Н] Приклад 16 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3пдрокси-5-піролідин-1-ілпентил)уреідо]-ізотіазол4-карбоксамід - Метансульфонатна сіль Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-амшо-5-піролідин-1ілпентан-3-олу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,3 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,17 (д, 2Н, и=6,4Гц), 5,51 (с, 2Н), 3,64 (шм, 1Н), 3,24 (т, 2Н, и=6,0Гц), 2,92 (м, 1Н), 2,72 (м, 1Н), 2,39 (м, 2Н), 1,98 (м, 1Н), 1,87 (м, 2Н), 1,75 (м, 1Н), 1,54 (м, 4Н), 1,22 (м, 2Н) м ч , МС (АРСІ, m/z) 517 [М+Н]+ Приклад 17 5-(3-{4-[Біс-(2пдроксиетил)амшо]бутил}уреідо)-3-(2,5-дифтор4-метилбензилокси)-ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-[(4-амшобутил)-(2пдроксиетил)амшо]етанолу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,1 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,20 (дд, 1Н, J=6,0, 9,2Гц), 7,04 (дд, 1Н, J=6,8, 9,6Гц), 5,45 (с, 2Н), 3,63 (т, 4Н, и=5,6Гц), 3,28 (т), 2,74 (м, 4Н), 2,68 (м, 2Н), 2,25 (д, ЗН, и=2,0Гц), 1,56 (м, + 4Н) м ч , МС (АРСІ, m/z) 502 [М+Н] Приклад 18 3-(2,5-Дифтор-4-метилбензилокси)-5-{3-[4(3,4-дипдроксипіролідин-1-іл)бутил]уреідо}ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1 -(4амінобутил)піролідин-3,4-дюлу за методикою аналогічною описаній в Прикладі 8 ВЕРХ час утримання хвилини 1Н ЯМР (400МГц, CD3OD) 5 7,20 (дд, 1Н, J=6,0, 9,2Гц), 7,04 (дд, 1Н, J=6,8, 9,6Гц), 5,45 (с, 2Н), 3,63 (т, 4Н, и=5,6Гц), 3,28 (м), 2,74 (м, 4Н), 2,68 (м, 2Н), 2,25 (д, ЗН, и=2,0Гц), 1,56 (м, 4Н) м ч Приклад 19 5-[3-(4-трет-Бутиламшо-3-пдроксибутил)уреідо]-3-(2,5-дифторметилбензилокси)ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 4-амшо-1-трет 60365 54 бутиламінобутан-2-олу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання, 1 3,3 хвилин Н ЯМР (400МГц, CD3OD) 5 7,18 (дд, 1Н, J=6,8, 9,6Гц), 7,04 (дд, 1Н, J=6,4, 10Гц), 5,45 (с, 2Н), 3,66 (м, 1Н), 3,34 (т, 2Н, и=7,6Гц), 2,58 (м, 2Н), 2,25 (с, ЗН), 1,69-1,60 (м, 2Н), 1,12 (с, 9Н) + м ч , МС (АРСІ, m/z) 486 [М+Н] Приклад 20 3-(4-Хлор-2,6-дифторбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід-пдрохлоридна сіль Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4хлорбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 3-(4-метилпіперазин-1іл)пропіламшу за методикою аналогічною описа1 ній в Прикладі 6 Н ЯМР (400МГц, D2O) 5 6,86 (шм, 2Н), 5,20 (с, 2Н), 3,4-2,6 (шм, 8Н), 3,10 (б, 2Н), 2,63 (б, 5Н), 1,67 (м, 2Н) м ч , МС (АРСІ, m/z) 503 [М+Н]+ Приклад 21 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3пдрокси-5-ізопропіламінопентил)уреідо]ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4хлорбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-аміно-5ізопропіламінопентан-3-олу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,2 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,17 (д, 1Н, и=7,6Гц), 5,52 (с, 2Н), 3,69 (м, 1Н), 3,34 (т, 2Н, и=6,4Гц), 2,80 (с, 1Н, и=6,0Гц), 2,73 (м, 2Н), 1,68-1,58 (м, 4Н), 1,06 (д, 6Н, и=6,0Гц) м ч , МС (АРСІ, m/z) 506 [М+Н]+ Приклад 22 3-(4-Хлор-2,6-дифторбензилокси)-5-[3-(3пдрокси-5-ізопропіламінопентил)уреідо]ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4хлорбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-аміно-5ізопропіламінопентан-3-олу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,2 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,17 (д, 1Н, и=7,6Гц), 5,52 (с, 2Н), 3,69 (м, 1Н), 3,34 (т, 2Н, и=6,4Гц), 2,80 (с, 1Н, и=6,0Гц), 2,73 (м, 2Н), 1,68-1,58 (м, 4Н), 1,06 (д, 6Н, и=6,0Гц) м ч , МС (АРСІ, m/z) 506 [М+Н]+ Приклад 23 3-(2,5-Дифтор-4-метилбензилокси)-5-(3-{6-[4(2-пдроксиетил)піперазин-1-іл]гексил)уреідо)ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-[4-(6амшогексил)піперазин-1-іл]етанолу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,0 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,17 (д, 1Н, J=6,4, 9,6Гц), 7,01 (м, 1Н), 5,44 (с, 2Н), 3,64 (т, 2Н, и=5,6Гц), 3,18 (т, 2Н, и=6,8Гц), 2,7-2,4 (шм, 8Н), 2,50 (т, 2Н, и=6,0Гц), 2,33 (м, 2Н), 2,23 (с, ЗН), 1,50 (м, 4Н), 1,35 (м, 4Н) м ч , МС (АРСІ, m/z) 555 [М+Н]+ 55 Приклад 24 3-(4-Хлор-2,5-дифторбензилокси)-5-[3-(6диметиламшогексил)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,5-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-[4-(6амшогексил)піперазин-1-іл]етанолу за методикою аналогічною описаній в Прикладі 6 ВЕРХ час утримання 3,0 хвилин 1Н ЯМР (400МГц, CD3OD) 5 7,17 (д, 1Н, J=6,4, 9,6Гц) 7,01 (м, 1Н), 5,44 (с, 2Н), 3,64 (т, 2Н, и=5,6Гц), 3,18 (т, 2Н, и=6,8Гц), 2,7-2,4 (шм, 8Н), 2,50 (т, 2Н, и=6,0Гц), 2,33 (м, 2Н), 2,23 (с, ЗН), 1,50 (м, 4Н), 1,35 (м, 4Н) м ч , МС (АРСІ, m/z) 555 [М+Н]+ Приклад 25 5-[3-[3-(4-Метилпіперазин-1-іл)пропіл]уреідо}3-(2,3,6-трифтор-4-метил-бензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 3-(4-метилпіперазин-1іл)пропіламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 501 [М+Н]+ Приклад 26 3-(2-Фтор-4-метилбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2-фтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 3-(4-метилпіперазин-1іл)пропіламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 465 [М+Н]+ Приклад 27 3-(2-Фтор-4-метилбензилокси)-5-[3-(5ізопропіламінопентил)уреідо]-ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2-фтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і ІЧ-ізопропіл-пентан-1,5діаміну за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 452 [М+Н]+ Приклад 28 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 4-піролідин-1ілбутиламшу за методикою аналогічною описаній в Прикладі 1 1Н ЯМР (400МГц, CDCI3) 5 1,63 (шс, 4Н), 1,83 (шс, 4Н), 2,34 (с, ЗН), 2,46-2,52 (м, 6Н), 3,28 (с, 2Н), 5,40 (с, 1Н), 5,50 (с, 2Н), 6,74 (д, и=8,ЗГц, 2Н), 6,98 (с, 1Н), 7,94 (шс, 1Н), 10,83 (шс, 1Н) м ч , МС (АРСІ, m/z) 468 [М+Н]+ Приклад 29 3-(2,6-Дифтор-4-метилбензилокси)-5-(3-{4-[4(2-пдроксиетил)піперазин-1-іл]бутил}уреідо)ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4 60365 56 метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-[4-(4амшобутил)піперазин-1-іл]етанолу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 527 [М+Н]+ Приклад ЗО 3-(4-Бром-2,6-дифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [3(4-бром-2,6-дифторбензилокси)-4карбамоілізотіазол-5-іл]карбамшовоі кислоти фенілового] естеру і 4-піролідин-1-ілбутиламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 532 і 534 [М+Н]+ Приклад 31 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4пдрокси-5-піперидин-1-ілпентил)уреідо]-ізотіазол4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 5-амшо-1-піперидин-1ілпентан-2-олу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ m/z) 512[М+Н]+ Приклад 32 3-(4-Бром-2,3,6-трифторбензилокси)-5-{3-[3(4-метилпіперазин-1-іл)пропіл]-уреідо}ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [3(4-бром-2,3,6-трифторбензилокси)-4карбамоілізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 3-(4-метилпіперазин-1іл)пропіламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 565 і 567 [М+Н]+ Приклад 33 3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 3-(4-метилпіперазин-1іл)пропіламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 483 [М+Н]+ Приклад 34 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3пдрокси-5-піролідин-1-ілпентил)уреідо]-ізотіазол4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-амшо-5-піролідин-1ілпентан-3-олу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 498 [М+Н]+ Приклад 35 5-[3-(4-Піролідин-1-ілбутил)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 4-піролідин-1ілбутиламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 486 [М+Н]+ Приклад 36 57 5-[3-(3-Пдрокси-5-піролідин-1 ілпентил)уреідо]-3-(2,3,6-трифтор-4-метилбензилокси)ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-амшо-5-піролідин-1ілпентан-3-олу за методикою аналогічною описа+ ній в Прикладі 1 МС (АРСІ, m/z) 516[M+H] Приклад 37 5-{3-[2-(1-Метил піролід ин-2-іл)етил]уреідо}-3(2,3,6-трифтор-4-метилбензилокси)-ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-(1-метилпіролідин-2іл)етиламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 472 [М+Н]+ Приклад 38 5-[3-(4-Диметиламшобутил)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і г\І,г\І-диметилбутан-1,4діаміну за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 460 [М+Н]+ Приклад 39 5-[3-(3-Диметиламшопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і І\І,г\І-диметилпропан-1,3діамін за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 446 (М+Н]+ Приклад 40 5-[3-(3-Гідрокси-5ізопропіламінопентил)уреідо]-3-(2,3,6-трифтор-4метил-бензилокси)ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 1-аміно-5ізопропіламінопентан-3-олу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 504 [М+Н]+ Приклад 41 5-[3-(3-Ізопропіламшопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4-метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти феніловиого естеру і N-ізопропілпропан-і ,3-діамшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 460 [М+Н]+ Приклад 42 5-{3-[4-(4-Метилпіперазин-1-іл)бутил]уреідо}3-(2,3,6-трифтор-4-метилбензилокси)-ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4 60365 58 метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 4-(4-метилпіперазин-1іл)бутиламшу за методикою аналогічною описа+ ній в Прикладі 1 МС (АРСІ, m/z) 515[M+H] Приклад 43 5-(3-{4-[4-(2-Гідроксиетил)піперазин-1іл]бутил}уреідо)-3-(2,3,6-трифтор-4-метилбензилокси)ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-[4-(4амшобутил)піперазин-1-іл]етанолу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, + m/z) 545 [М+Н] Приклад 44 5-[3-(3-Піролідин-1-ілпропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і З-піролідин-1ілпропіламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 472 [М+Н]+ Приклад 45 5-[3-(4-Гідрокси-5-піперидин-1 ілпентил)уреідо]-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 5-амшо-1-піперидин-1ілпентан-2-олу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 530 [М+Н]+ Приклад 46 5-(3-{4-[Етил-(2пдроксиетил)амшо]бутил}уреідо)-3-(2,3,6трифтор-4-метил-бензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-[(4амінобутил)етиламшо]етанолу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 504 [М+Н]+ Приклад 47 3-(4-Бром-2,6-дифторбензилокси)-5-{3-[3-(4метилпіперазин-1-іл)пропіл]уреідо}-ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [3(4-бром-2,6-дифторбензилокси)-4карбамоілізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 3-(4-метилпіперазин-1іл)пропіламшу за методикою аналогічною описаній в Прикладі 1 МС (АРСІ, m/z) 547 і 549 [М+Н]+ Приклад 48 3-(2,6-Дифтор-4-метилбензилокси)-5-{3-[2-(1метилпіролідин-2-іл)етил]уреідо}-ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-(1-метилпіролідин-2іл)етиламшу за методикою аналогічною описаній 59 в Прикладі 1 МС (APCI, m/z) 454 (M+H]+ Приклад 49 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(4диметиламшобутил)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і г\І,г\І-диметилбутан-1,4діаміну за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 442 [М+Н]+ Приклад 50 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3диметиламшопропіл)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з (4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і г\І,І\І-диметилпропан-1,3діаміну за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 428 [М+Н]+ Приклад 51 3-(4-Бром-2,3,6-трифторбензилокси)-5-[3-(4піролідин-1-ілбутил)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [3(4-бром-2,3,6-трифторбензилокси)-4карбамоілізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 4-піролідин-1-ілбутиламшу за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 550 і 552 [М+Н]+ Приклад 52 5-[3-(3-Метиламшопропіл)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і N-метилпропан-І.Здіаміну за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 432 [М+Н]+ Приклад 53 5-[3-(3-Амшопропіл)-3-метилуреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і N-метилпропан-І.Здіаміну за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 432 [М+Н]+ Приклад 54 5-[3-(4-Діетиламшобутил)уреідо]-3-(2,3,6трифтор-4-метилбензилокси)ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,3,6-трифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і г\І,г\І-діетилбутан-1,4діаміну за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 488 [М+Н]+ Приклад 55 3-(2,6-Дифтор-4-метилбензилокси)-5-[3-(3піролідин-1-ілпропіл)уреідо]ізотіазол-4карбоксамід Вказану в заголовку сполуку одержували з [4 60365 60 карбамоіл-3-(2,6-дифтор-4метипбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і З-піролідин-1ілпропіламшу за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 454 [М+Н]+ Приклад 56 3-(3-Хлор-2,6-дифтор-4-метилбензилокси)-5[3-(4-диметиламшобутил)-уреідо]ізотіазол-4карбоксамід Вказану у заголовку сполуку одержували з [4карбамоіл-3-(3-хлор-2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і г\І,г\І-діетилбутан-1,4діаміну за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 476 [М+Н]+ Приклад 57 5-(3-{4-[Біс-(2пдроксиетил)амшо]бутил)уреідо)-3-(2,6-дифтор4-метилбензилокси)-ізотіазол-4-карбоксамід Вказану в заголовку сполуку одержували з [4карбамоіл-3-(2,6-дифтор-4метилбензилокси)ізотіазол-5-іл]карбамшовоі кислоти фенілового естеру і 2-[(4-амшобутил)-(2пдроксиетил)амшо]етанолу за методикою аналогічною описаній в Прикладі 1 МС (APCI, m/z) 502 [М+Н]+ Наступні індивідуальні сполуки одержували використовуючи загальні синтетичні методики описані вище з посиланням на Схеми 1-5 і характерні синтетичні методики, що описані вище в Приготуваннях і Прикладах (3-трет-Бутилізотіазол-5-іл)-(6,7диметоксихінолін-4-іл)амш, 3-Етилсульфаніл-5-(3-гексилуреідо)ізотіазол4-карбоксамід, 5-(3-Бензилуреідо)-3-етилсульфанілізотіазол4-карбоксамід, 3-Етилсульфаніл-5-(3-етилуреідо)ізотіазол-4карбоксамід, 3-Етилсульфаніл-5-[(піролідин-1карбоніл)амшо]ізотіазол-4-карбоксамід, 5-(3-Бутилуреідо)-3-етилсульфанілізотіазол4-карбоксамід, 5-(3,3-Диметилуреідо)-3пропілсульфанілізотіазол-4-карбоксамід, 5-(3-Метилуреідо)-3пропілсульфанілізотіазол-4-карбоксамід, 5-(3-Бутилуреідо)-3пропілсульфанілізотіазол-4-карбоксамід, 5-(3-Метилуреідо)-3пентилсульфанілізотіазол-4-карбоксамід, 5-(3,3-Диметилуреідо)-3пентилсульфанілізотіазол-4-карбоксамід, 5-(3,3-Диметилуреідо)-3ізопропілсульфанілізотіазол-4-карбоксамід, 3-Пентилсульфаніл-5уреідоізотіазол-4карбоксамід, 3-Бензилсульфаніл-5-(3,3диметилуреідо)ізотіазол-4-карбоксамід, 5-(3,3-Диметилуреідо)-3-пропоксиізотіазол-4карбоксамід, (3-Бутокси-4-карбамоілізотіазол-5іл)карбамшовоі кислоти етиловий естер, 5-(3,3-Диметилуреідо)-3фенетилсульфанілізотіазол-4-карбоксамід, 5-(3,3-Диметилуреідо)-3
ДивитисяДодаткова інформація
Назва патенту англійськоюIsothiazole derivatives, a method for preparing thereof, a pharmaceutical composition and a method for treatment of hyperproliferative disease of mammal
Автори англійськоюNoe Mark Carl
Назва патенту російськоюПроизводные изотиазола, способ их получения, фармацевтическая композиция и способ лечения гиперпролиферативного заболевания у млекопитающего
Автори російськоюНоэ Марк Карл
МПК / Мітки
МПК: C07D 417/12, A61K 31/425, A61K 31/496, A61K 45/00, A61K 31/454, A61P 13/08, C07C 33/00, A61P 43/00, C07C 323/60, A61P 35/00, C07D 487/08, A61K 31/427, C07C 327/00, C07D 521/00, C07D 275/00, A61P 17/00
Мітки: лікування, спосіб, ссавця, похідні, гіперпроліферативного, одержання, ізотіазолу, фармацевтична, захворювання, композиція
Код посилання
<a href="https://ua.patents.su/54-60365-pokhidni-izotiazolu-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-likuvannya-giperproliferativnogo-zakhvoryuvannya-u-ssavcya.html" target="_blank" rel="follow" title="База патентів України">Похідні ізотіазолу, спосіб їх одержання, фармацевтична композиція та спосіб лікування гіперпроліферативного захворювання у ссавця</a>
Попередній патент: Тверда лікарська форма гатофлоксацину мультифазної структури для орального застосування і спосіб її одержання
Наступний патент: Механізм узгодження приймача із захисним модулем
Випадковий патент: Спосіб прогнозування перебігу гострого інфаркту міокарда