Проліки збуджувальних амінокислот
Номер патенту: 80280
Опубліковано: 10.09.2007
Автори: Бланко-Ургоіті Хайме Гонсало, Монн Джеймс Аллен, Колладо Кано Айвен, Моер Ерік Дейвід, Педрегал-Терсеро Консепсьйон
Формула / Реферат
1. Сполука формули І
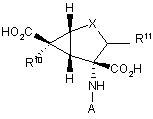 , (I)
, (I)
де:
A - H-(Q)p-;
Q незалежно у кожному випадку вибраний з групи аміноацильних похідних амінокислоти, вибраної з групи, яку складають природні та штучні амінокислоти, вибрані з групи, яку складають D-ізомери природних a-амінокислот; Aib (аміномасляна кислота), bAib (3-аміноізомасляна кислота), Nva (норвалін), b-Ala, Aad (2-аміноадипінова кислота), bAad (3-аміноадипінова кислота), Abu (2-аміномасляна кислота), Gaba (g-аміномасляна кислота), Acp (6-амінокапронова кислота), Dbu (2,4-діаміномасляна кислота), a-амінопімелінова кислота, TMSA (триметилсиліл-Ala), alle (allo-ізолейцин), Nle (норлейцин), трет-Leu, Cit (цитрулін), Orn, Dpm (2,2'-діамінопімелінова кислота), Dpr (2,3-діамінопропіонова кислота), a- або b-Nal, Cha (циклогексил-Ala), гідроксипролін, Sar (саркозин), O-метилтирозин, фенілгліцин; циклічні амінокислоти; Na-алкіловані амінокислоти, де Na-алкілованою амінокислотою є Na-(С1-С10)-алкіламінокислота, наприклад MeGly (Na-метилгліцин), EtGly (Na-етилгліцин) та EtAsn (Na-етиласпарагін), та амінокислоти, в яких a-вуглець заміщений двома боковими ланцюгами;
p - ціле число від 1 до 10;
X - SO2;
R10 - водень або фтор; та
R11 - водень, фтор або гідроксил;
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука або фармацевтично прийнятна сіль за п. 1, де p - ціле число від 1 до 3.
3. Сполука або фармацевтично прийнятна сіль за п. 1, де p - 1.
4. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-3, де Q - аміноацильна похідна природної амінокислоти.
5. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-4, де Q - гліцил, аланіл, валіл, лейцил, ізолейцил, проліл, фенілаланіл, тирозил, триптофіл, метіоніл, лізил або сериніл.
6. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-5, де Q - метіоніл.
7. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-5, де R10 - водень.
8. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-6, де R11 - водень.
9. Сполука або фармацевтично прийнятна сіль за п. 1, де сіль є сіллю кислоти, одержаною з кислотою, яка забезпечує фармацевтично прийнятний аніон; сіллю основи, одержаною з основою, яка забезпечує фармацевтично прийнятний катіон для сполуки, яка містить кислотну групу; або цвітер-іонною сполукою, яка містить протилежно заряджені групи.
10. Сполука за п. 1, де
A - H-(Q)p-;
Q - L-аланіл;
p - 1;
X - SO2;
R10 - водень; та
R11 - водень;
або гідрохлорид, тозилат, мезилат, езилат, безилат або мононатрієва сіль цієї сполуки.
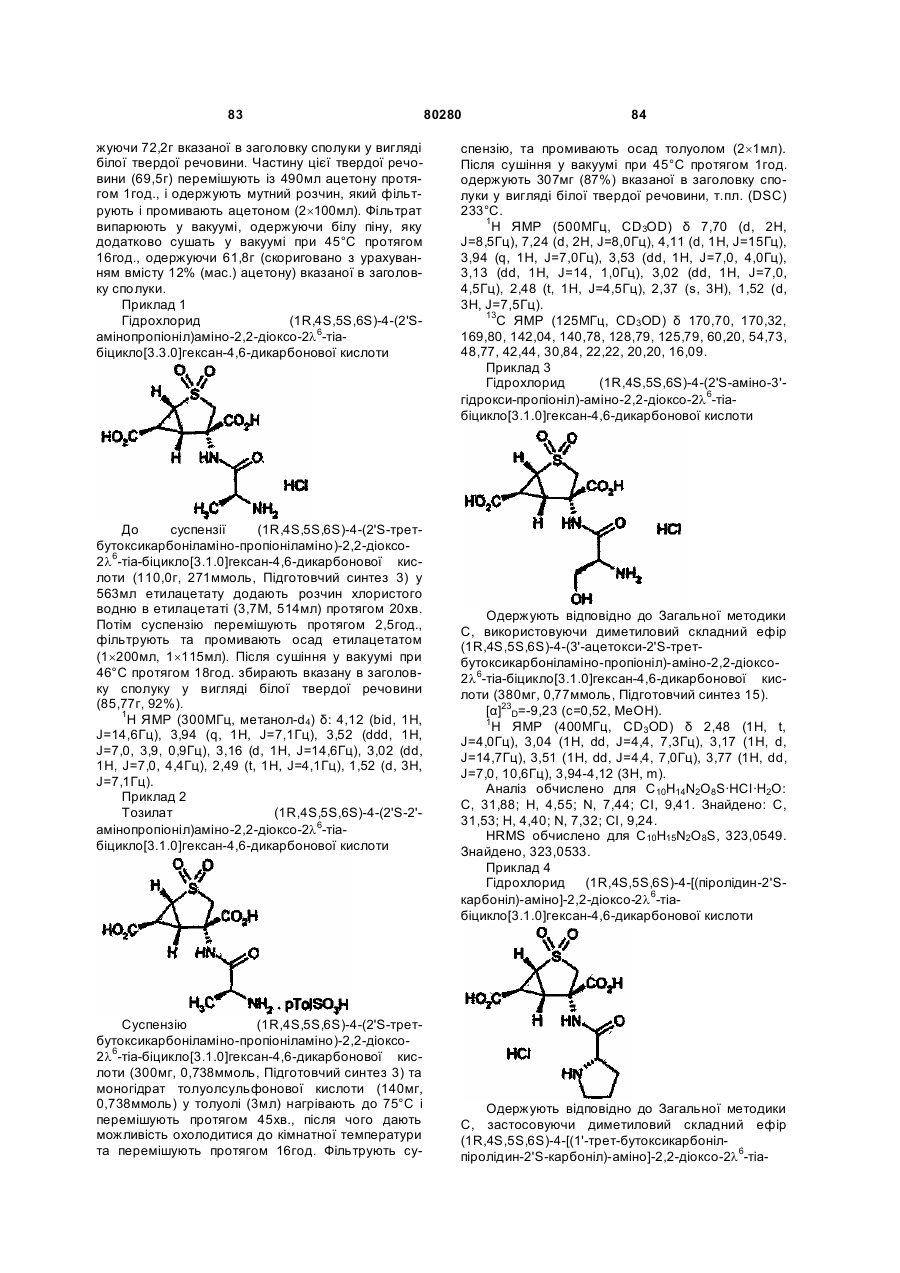
11. Сполука або армацевтично прийнятна сіль за п. 10, яка є гідрохлоридом (1R,4S,5S,6S)-4-(2¢S-амінопропіоніл)аміно-2,2-діоксо-2l6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти або тозилатом (1R,4S,5S,6S)-4-(2'S-2'-амінопропіоніл)аміно-2,2-діоксо-2l6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти.
12. Сполука за п. 1, яка є (1R,4S,5S,6S)-4-(2'S-4'-метилтіо-2'-амінобутаноніл)аміно-2,2-діоксо-2l6-тіа-біцикло[3.1.0]гексан-4,6-дикарбоновою кислотою або фармацевтично прийнятною сіллю цієї сполуки.
13. Сполука за п. 12, яка є моногідратом (1R,4S,5S,6S)-4-(2'S-4'-метилтіо-2'-амінобутаноніл)аміно-2,2-діоксо-2l6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти.
14. Спосіб одержання сполуки формули I або фармацевтично прийнятної солі цієї сполуки за п. 1, який включає ацилювання сполуки формули (ii)
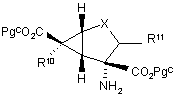 (ii)
(ii)
відповідним аміноацилом Формули III
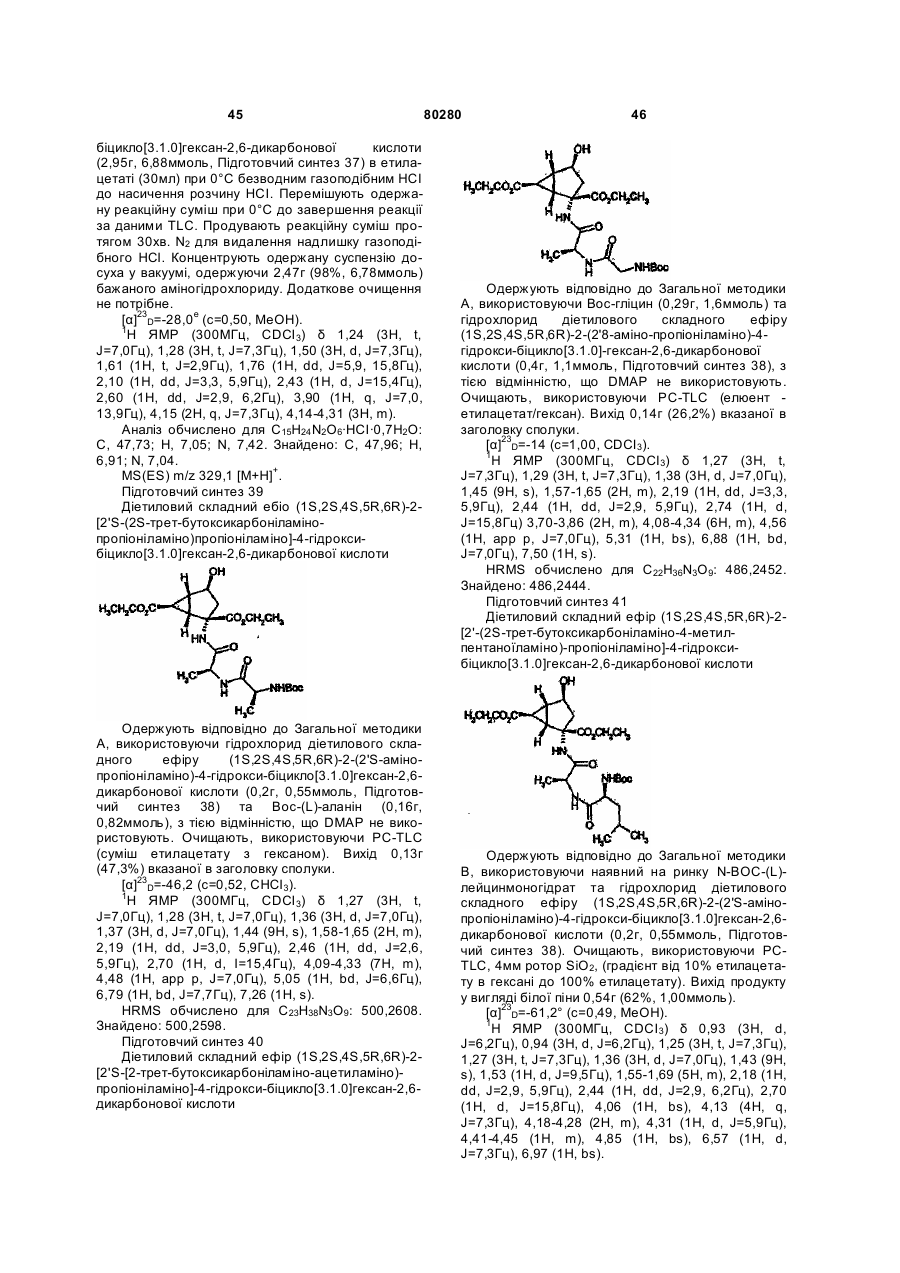
PgN-A- (III),
де PgN - група захисту азоту;
після чого, за будь-якою з вищезгаданих методик, в разі, якщо функціональна група захищена групою захисту, видалення згаданої групи захисту;
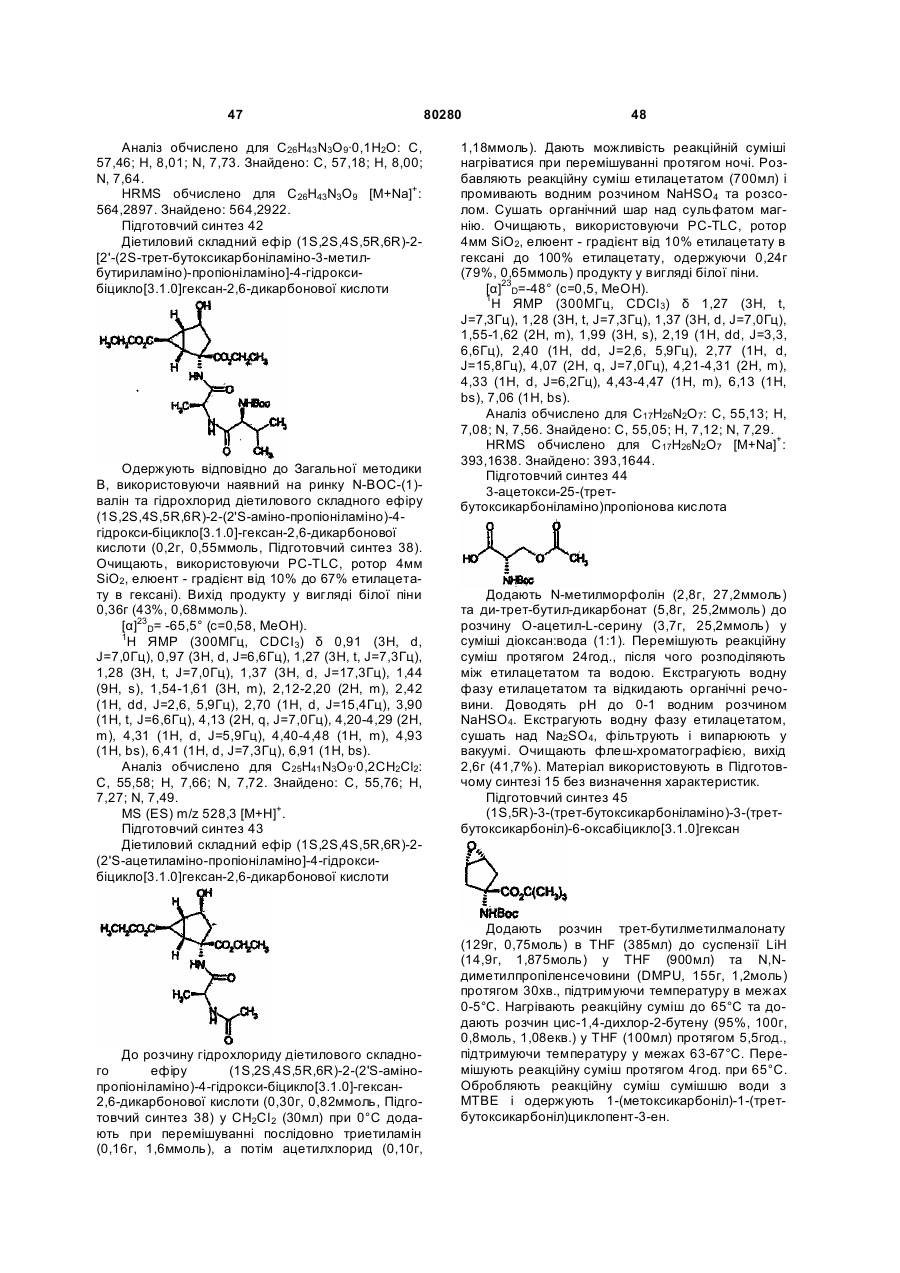
після чого, за будь-якою з вищезгаданих методик: в разі, якщо потрібною є фармацевтично прийнятна сіль сполуки Формули I, проведення реакції основної форми такої сполуки Формули I з кислотою, яка постачає фармацевтично прийнятний протиіон; або, в разі, якщо сполука Формули I містить кислотну групу, проведення реакції кислотної форми такої сполуки Формули I з основою, яка постачає фармацевтично прийнятний катіон; або, в разі, якщо сполука Формули I є цвітер-іонною сполукою, нейтралізацію солі такої сполуки Формули I з кислотою або солі такої сполуки Формули I з основою; або будь-яку іншу звичайну процедуру.
15. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-13, для застосування в терапії.
16. Застосування сполуки за п. 1 для виготовлення лікарського засобу для введення в організм ефективної кількості сполуки Формули II
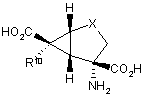 , (II)
, (II)
де X, R10 та R11 відповідають визначенням за п. 1.
17. Застосування сполуки за п. 1 для виготовлення лікарського засобу для лікування неврологічного розладу в пацієнта.
18. Застосування за п. 17, причому згаданим неврологічним розладом є ураження головного мозку, що виникає після аорто-коронарного шунтування та трансплантацій; церебральна ішемія; травма спинного мозку; травма голови; хвороба Альцгеймера; хорея Гантінгтона; аміотропний бічний склероз; деменція, спричинена СНІДом; перинатальна гіпоксія; гіпоглікемічне пошкодження нейронів; пошкодження ока та ретинопатія; розлади пізнавальної здатності; паркінсонізм ідіопатичного та наркотичного походження; м’язові спазми; мігрені; нетримання сечі; толерантність до лікарських засобів, синдроми абстиненції, припинення вживання наркотиків та потяг до них; припинення куріння; блювання; набряк мозку; хронічні болі; розлади сну; конвульсії; синдром Туретта; дефіцит уваги та пізня дискінезія.
19. Застосування за п. 18, причому згаданим неврологічним розладом є толерантність до лікарських засобів, синдроми абстиненції, припинення вживання наркотиків та потяг до них або припинення куріння.
20. Застосування сполуки за п. 1 для виготовлення лікарського засобу для лікування психічного розладу в пацієнта.
21. Застосування за п. 20, причому згаданим психічним розладом є шизофренія, стан неспокою, страху або тривоги та аналогічні розлади, депресія, біполярні розлади, психози та обсесивні компульсивні розлади.
22. Застосування за п. 21, причому згаданим психічним розладом є стан неспокою, страху або тривоги.
23. Застосування за п. 21, яке відрізняється тим, що згаданим психічним розладом є шизофренія.
24. Фармацевтична композиція, яка містить сполуку Формули I за п. 1 або її фармацевтично прийнятну сіль у поєднанні з фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
Текст
1. Сполука формули І H X HO2C R11 (19) (21) 20041210148 (22) 06.06.2003 (24) 10.09.2007 (86) PCT/US03/15405, 06.06.2003 (31) 02380120.2 (32) 11.06.2002 (33) EP (31) 02380121.0 (32) 11.06.2002 (33) EP (31) 60/415,936 (32) 03.10.2002 (33) US (31) 60/415,937 (32) 03.10.2002 (33) US (46) 10.09.2007, Бюл. № 14, 2007 р. (72) Моер Ерік Дейвід, US, Монн Джеймс Аллен, US, Педрегал-Терсеро Консепсьйон , ES, Колладо Кано Айвен, ES, Бланко-Ургоіті Хайме Гонсало, ES (73) ЕЛІ ЛІЛЛІ ЕНД КОМПАНІ, US (56) SANCHEZ J.P. ET AL: "QUINOLONE ANTIBACTERIAL AGENTS. SYNTHESIS AND STRUCTURE-ACTIVITY RELATIONSHIPS OF A SERIES OF AMINO ACID PRODRUGS OF RACEMIC AND CHIRAL 7-(3-AMINO-1PYRROLIDINYLQUINOLONES, HIGHLY SOLUBLE QUINOLONE PRODRUGS WITH IN VIVO PSEUDOMONAS ACTIVITY" JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY, vol. 35, no. 10, 15 May 1992, P. 17641773 OHSUMI K. ET AL: "SYNTHESIS AND ANTITUMOR ACTIVITIES OF AMINO ACID PRODRUGS OF AMINO-COMBRETASTATINS" ANTI-CANCER DRUG DESIGN, vol. 14, 1999, P. 539-548 BRADSHAW T.D. ET AL: "Preclinical evaluation of amino acid prodrugs of novel antitumor 2-(4-amino-3methylphenyl)benzothiazoles" MOLECULAR CANCER THERAPEUTICS, vol. 1, no. 4, February 2002, P. 239-246 WO, 03/061698, A1, 2003 2 3 кислоти, в яких a-вуглець заміщений двома боковими ланцюгами; p – ціле число від 1 до 10; X – SO2; R10 – водень або фтор; та R11 – водень, фтор або гідроксил; або фармацевтично прийнятна сіль цієї сполуки. 2. Сполука або фармацевтично прийнятна сіль за п. 1, де p – ціле число від 1 до 3. 3. Сполука або фармацевтично прийнятна сіль за п. 1, де p – 1. 4. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-3, де Q – аміноацильна похідна природної амінокислоти. 5. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-4, де Q – гліцил, аланіл, валіл, лейцил, ізолейцил, проліл, фенілаланіл, тирозил, триптофіл, метіоніл, лізил або сериніл. 6. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-5, де Q – метіоніл. 7. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-5, де R10 – водень. 8. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-6, де R11 – водень. 9. Сполука або фармацевтично прийнятна сіль за п. 1, де сіль є сіллю кислоти, одержаною з кислотою, яка забезпечує фармацевтично прийнятний аніон; сіллю основи, одержаною з основою, яка забезпечує фармацевтично прийнятний катіон для сполуки, яка містить кислотну групу; або цвітеріонною сполукою, яка містить протилежно заряджені групи. 10. Сполука за п. 1, де A – H-(Q)p-; Q – L-аланіл; p – 1; X – SO2; R10 – водень; та R11 – водень; або гідрохлорид, тозилат, мезилат, езилат, безилат або мононатрієва сіль цієї сполуки. 11. Сполука або армацевтично прийнятна сіль за п. 10, яка є гідрохлоридом (1R,4S,5S,6S)-4-(2¢Sамінопропіоніл)аміно-2,2-діоксо-2l 6тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти або тозилатом (1R,4S,5S,6S)-4-(2'S-2'амінопропіоніл)аміно-2,2-діоксо-2l 6тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти. 12. Сполука за п. 1, яка є (1R,4S,5S,6S)-4-(2'S-4'метилтіо-2'-амінобутаноніл)аміно-2,2-діоксо-2l 6тіа-біцикло[3.1.0]гексан-4,6-дикарбоновою кислотою або фармацевтично прийнятною сіллю цієї сполуки. 13. Сполука за п. 12, яка є моногідратом (1R,4S,5S,6S)-4-(2'S-4'-метилтіо-2'амінобутаноніл)аміно-2,2-діоксо-2l 6тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти. 14. Спосіб одержання сполуки формули I або фармацевтично прийнятної солі цієї сполуки за п. 1, який включає ацилювання сполуки формули (ii) 80280 4 H X PgCO2C R11 R10 H NH2 CO2 (ii) PgC відповідним аміноацилом Формули III PgN-A- (III), де PgN – група захисту азоту; після чого, за будь-якою з вищезгаданих методик, в разі, якщо функціональна група захищена групою захисту, видалення згаданої групи захисту; після чого, за будь-якою з вищезгаданих методик: в разі, якщо потрібною є фармацевтично прийнятна сіль сполуки Формули I, проведення реакції основної форми такої сполуки Формули I з кислотою, яка постачає фармацевтично прийнятний протиіон; або, в разі, якщо сполука Формули I містить кислотну групу, проведення реакції кислотної форми такої сполуки Формули I з основою, яка постачає фармацевтично прийнятний катіон; або, в разі, якщо сполука Формули I є цвітер-іонною сполукою, нейтралізацію солі такої сполуки Формули I з кислотою або солі такої сполуки Формули I з основою; або будь-яку іншу звичайну процедуру. 15. Сполука або фармацевтично прийнятна сіль за будь-яким із пп. 1-13, для застосування в терапії. 16. Застосування сполуки за п. 1 для виготовлення лікарського засобу для введення в організм ефективної кількості сполуки Формули II H X HO2C (II) R10 H CO2 H NH2 , де X, R та R відповідають визначенням за п. 1. 17. Застосування сполуки за п. 1 для виготовлення лікарського засобу для лікування неврологічного розладу в пацієнта. 18. Застосування за п. 17, причому згаданим неврологічним розладом є ураження головного мозку, що виникає після аорто-коронарного шунтування та трансплантацій; церебральна ішемія; травма спинного мозку; травма голови; хвороба Альцгеймера; хорея Гантінгтона; аміотропний бічний склероз; деменція, спричинена СНІДом; перинатальна гіпоксія; гіпоглікемічне пошкодження нейронів; пошкодження ока та ретинопатія; розлади пізнавальної здатності; паркінсонізм ідіопатичного та наркотичного походження; м’язові спазми; мігрені; нетримання сечі; толерантність до лікарських засобів, синдроми абстиненції, припинення вживання наркотиків та потяг до них; припинення куріння; блювання; набряк мозку; хронічні болі; розлади сну; конвульсії; синдром Туретта; дефіцит уваги та пізня дискінезія. 19. Застосування за п. 18, причому згаданим неврологічним розладом є толерантність до лікарських засобів, синдроми абстиненції, припинення вживання наркотиків та потяг до них або припинення куріння. 10 11 5 80280 6 20. Застосування сполуки за п. 1 для виготовлення лікарського засобу для лікування психічного розладу в пацієнта. 21. Застосування за п. 20, причому згаданим психічним розладом є шизофренія, стан неспокою, страху або тривоги та аналогічні розлади, депресія, біполярні розлади, психози та обсесивні компульсивні розлади. 22. Застосування за п. 21, причому згаданим психічним розладом є стан неспокою, страху або тривоги. 23. Застосування за п. 21, яке відрізняється тим, що згаданим психічним розладом є шизофренія. 24. Фармацевтична композиція, яка містить сполуку Формули I за п. 1 або її фармацевтично прийнятну сіль у поєднанні з фармацевтично прийнятним носієм, розріджувачем або наповнювачем. Цей винахід пропонує синтетичні проліки збуджувальних амінокислот (сполуки Формули І) та способи їх одержання. Крім того, цей винахід стосується способів застосування сполук Формули І та фармацевтичних композицій, що містять сполуки Формули І, для лікування неврологічних розладів та психічних розладів. Лікування неврологічних або психічних розладів, наприклад, розладів неспокою, страху або тривоги, пов'язане з селективною активацією метаботропних рецепторів збуджувальних амінокислот. Наприклад, (+)-4-аміно-2сульфонілбіцикло[3.1.0]гексан-4,6-дикарбонова кислота описана як активний агоніст рецептора mGluR2 [у патенті США №5,688,826 (далі патент '826), виданому 18 листопада 1997р.]. Крім того, (+)-2-аміно-4-фторбіідокло[3.1.0]гексан-2,6дикарбонову кислоту розкрито як активний агоніст рецептора mGluR2 [у патенті США №5,958,960 (далі патент '960), виданому 28 вересня 1999р.]. Цей винахід пропонує проліки сполук - агоністів рецептора mGluR2, які підвищують ефективність in vivo відповідних вихідних сполук та забезпечують посилення впливу вихідних сполук при пероральному застосуванні. Сполуки за цим винаходом забезпечують оптимальний спосіб збереження безпечності та ефективності розкритих раніше агоністів рецептора mGluR2 з підвищеною біодоступністю при пероральному застосуванні. Синтетичні проліки збуджувальних амінокислот та способи їх одержання розкрито [в міжнародних заявках PCT/US01/45866 та PCT/US02/00488]. Цей винахід пропонує сполуку Формули І: =NOR7 або =CR8R9; або один із R3 або R4 є аміногрупа, а інший є карбоксил; або R3 - N3, (CH2)mCOOR5a, (CH2)mPO3R6a2, NHCONHR5b або NHSO2R5c і R4 - водень; або R3 та R4 спільно є =CHCOOR5b, =CHPO3R6a2 або =CHCN; X' - зв'язок, СН2 або CO; m - ціле число від 1 до 3; R5, R5a, R5b, R5c, R7, R8 та R9 незалежно один від одного є атом водню; факультативно заміщений (С1-С6)-алкіл; факультативно заміщений (С2С6)-алкеніл; факультативно заміщений (С2-С6)алкініл; факультативно заміщена ароматична група; факультативно заміщена гетероароматична група; неароматична карбоциклічна група; неароматична гетероциклічна група; неароматична моноциклічна карбоциклічна група, конденсована з однією або двома моноциклічними ароматичними або гетероароматичними групами; або неароматична моноциклічна гетероциклічна група, конденсована з однією або двома моноциклічними ароматичними або гетероароматичними групами; R6 та R6a незалежно один від одного є водень або (С1-С6)-алкіл; R10 - водень або фтор; та R11 - водень, фтор або гідроксил; або фармацевтично прийнятну сіль цієї сполуки. Цей винахід пропонує також сполуку формули І, причому замісники відповідають вищенаведеним визначенням, за умови, що ця сполука не є сполукою, в якій X - CR3R4, де R3 - фтор та R4 - водень, р - 1 та Q - L-аланіл; або фармацевтично прийнятну сіль цієї сполуки. Цей винахід пропонує також сполуку Формули І, де А - H-(Q)p-; Q незалежно у кожному випадку вибраний з групи аміноацилів; р - ціле число від 1 до 3; X - О, S, SO, SO2 або CR3R4; R3 - фтор або гідроксил та R4 - водень; або R3 та R4 спільно є =О; R10 - водень або фтор; та R11 - водень, фтор або гідроксил; або фармацевтично прийнятну сіль цієї сполуки. Цей винахід пропонує також сполуку Формули І, де А - H-(Q)p-; Q - L-аланіл; р - 1; X - CR3R4; R3 фтор та R4 - водень; R10 - водень; та R11 - водень; або фармацевтично прийнятну сіль цієї сполуки. Мається на увазі, що сполуки Формули І містять щонайменше чотири асиметричних вуглецевих атоми. Цей винахід охоплює всі стереоізомерні форми сполук Формули І, в тому числі кожний з індивідуальних енантіомерів та їх суміші, наприклад, пролікові форми сполук, розкритих у [патенті '826], наприклад, 1SR,4RS,5RS,6RS-4-aмінo-(2 (I) де: А - H-(Q)p-; Q незалежно у кожному випадку вибраний з групи аміноацилів; р - ціле число від 1 до 10; X - О, S, SO, SO2 або CR3R4; R3 - фтор, X'OR5, SO3H, тетразол-5-іл, CN, PO3R62, гідроксил або NO2 та R4 - водень; або кожний з R3 та R4 - фтор; або R3 та R4 спільно є =О, 7 cyльфoнiлбщиклo[3.1.0]гeкcaн)-4,6-дикарбонової кислоти. За подальшим аспектом, цей винахід пропонує фармацевтичну композицію, яка містить сполуку Формули І або фармацевтично прийнятну сіль цієї сполуки у поєднанні з фармацевтично прийнятним носієм, розріджувачем або наповнювачем. За подальшим аспектом, цей винахід пропонує спосіб впливу на пов'язані з циклічним аденозинмонофосфатом (сАМР) рецептори метаботропних глутаматів в організмі пацієнта, який включає введення в організм пацієнта, котрий потребує модулювання нейротрансмісії збуджувальних амінокислот, фармацевтично ефективної кількості сполуки Формули І. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для впливу на пов'язані з циклічним аденозинмонофосфатом (сАМР) рецепторами метаботропних глутаматів в організмі пацієнта. За подальшим аспектом, цей винахід пропонує спосіб введення в організм ефективної кількості сполуки Формули II, який включає введення в організм пацієнта, котрий потребує модулювання нейротрансмісії збуджувальних амінокислот, фармацевтично ефективної кількості сполуки Формули І. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для введення в організм ефективної кількості сполуки Формули II. За подальшим аспектом, цей винахід пропонує спосіб лікування неврологічного розладу в пацієнта, який включає введення в організм пацієнта, котрий потребує лікування такого розладу, фармацевтично ефективної кількості сполуки Формули І. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для лікування неврологічного розладу в пацієнта. За подальшим аспектом, цей винахід пропонує спосіб лікування психічного розладу в пацієнта, який включає введення в організм пацієнта, котрий потребує лікування такого розладу, фармацевтично ефективної кількості сполуки Формули І. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для лікування психічного розладу в пацієнта. Сполуки Формули І можна одержати за способом, аналогічним відомому в хімічній практиці способу одержання структурно аналогічних гетероциклічних сполук, або за новим способом, описаним у цьому документі. Такі способи та проміжні продукти, корисні при одержанні сполуки Формули І, що відповідає поданому вище визначенню, ілюстровано поданими нижче методиками, в описах яких значення вихідних радикалів відповідають поданим у цьому описі визначенням, якщо не зазначено інше. Цей винахід пропонує спосіб одержання сполук Формули І, який включає ацилювання сполуки Формули (іі): 80280 8 (ii) відповідним аміноацилом Формули III PgN-A(III) де PgN - група захисту азоту, а А відповідає вищенаведеному визначенню; після чого, за будь-якою з вищезгаданих методик, в разі, якщо функціональна група, захищена групою захисту, видалення згаданої групи захисту; після чого, за будь-якою з вищезгаданих методик: в разі, якщо потрібною є фармацевтично прийнятна сіль сполуки Формули І, проведення реакції основної форми такої сполуки Формули І з кислотою, яка постачає фармацевтично прийнятний протиіон; або, в разі, коли сполука Формули І містить кислотну групу, проведення реакції кислотної форми такої сполуки Формули І з основою, яка постачає фармацевтично прийнятний катіон; або, в разі, коли сполука Формули І є цвітеріонною сполукою, нейтралізацію солі такої сполуки Формули І з кислотою або солі такої сполуки Формули І з основою; або будь-яку іншу звичайну процедуру. Цей винахід пропонує також сполуки Формули І, де X є СН2, R10 є фтор та інші радикали відповідають поданим вище визначенням. З'ясовано, що сполуки за цим винаходом є корисними проліками сполук, котрі є селективними агоністами рецепторів метаботропних глутаматів, і тому є корисними при лікуванні захворювань центральної нервової системи, наприклад, неврологічних захворювань, наприклад, нейродегенеративних захворювань, та як протипсихотичні засоби, транквілізатори, засоби для зняття синдромів наркотичної абстиненції, антидепресанти, протисудомні засоби, аналгетики та протиблювотні засоби. Мається на увазі, що сполуки Формули І містять щонайменше чотири асиметричних вуглецевих атоми, з яких три входять до складу циклопропанової групи і один є α-атомом вуглецю амінокислотної групи. Відповідно, сполуки за цим винаходом можуть існувати та бути виділені в енантіомерно чистих формах, у рацемічній формі або у вигляді суміші діастереоізомерів. Амінокислотна група за варіантом, якому віддається перевага, має конфігурацію природної амінокислоти, тобто L-конфігурацію відносно Dгліцеринового альдегіду. Цей винахід охоплює фармацевтично прийнятні солі сполук Формули І. Ці солі можуть утворюватися у сполученні з кислотним або основним фрагментами молекули та можуть існувати у формі солей кислот, первинного, вторинного, третинного або четвертинного амонію, солей лужних металів або лужноземельних металів. Як правило, солі з кислотами (солі кислот) можна одержати шляхом проведення реакції кислоти зі сполукою Формули І. За альтернативним варіантом, солі з кислотами можна одержати шляхом проведення реакції сполуки-попередника (захищеного проміжного продукту) з відповідною еквівалентною кількі 9 стю кислоти, необхідною для одержання відповідної солі, яку, в свою чергу, можна вводити в реакції для одержання сполуки Формули І або інших солей. Солі лужних металів та лужноземельних металів одержують, як правило, шляхом проведення реакції гідроксиду бажаного металу зі сполукою Формули І. Деякі конкретні солі забезпечують певні переваги при виготовленні лікарських форм внаслідок їхньої кристалічної форми. Некристалічні аморфні форми сполук можуть бути гігроскопічними. Кристалічні форми фармацевтичних сполук іноді є більш бажаними, оскільки вони виявляють сприятливі властивості твердих речовин. До кислот, які звичайно застосовують для одержання таких солей, належать неорганічні кислоти, наприклад, хлористоводнева, бромистоводнева, азотна, сірчана або фосфорна кислоти, або органічні кислоти, наприклад, органічні карбонові кислоти, наприклад, гліколева, малеїнова, гідроксималеїнова, фумарова, яблучна, винна, лимонна, саліцилова, о-ацетоксибензойна, або органічні сульфонові кислоти, наприклад, 2гідроксіетансульфонова, толуол-п-сульфонова, метансульфонова, нафталін-2-сульфонова, бензолсульфонова або етансульфонова кислоти. Крім фармацевтично прийнятних солей, цей винахід охоплює інші солі. Вони можуть застосовуватися як проміжні продукти при очищенні сполук або при одержанні інших фармацевтично прийнятних солей з кислотами, або є корисними для ідентифікації, визначення характеристик або очищення. Сполуки Формули І за цим винаходом включають сольвати цих сполук. Зокрема, сполуки Формули І включають гідрати цих сполук. Крім того, цей винахід має на увазі проліки фторованих сполук, розкритих [у міжнародних заявках PCT/JP99/03984, PCT/JP99/00324 та PCT/JP01/05550]. [Дивись відповідно публікації WO/0012464, WO/9938839 та WO/0200605.] Наприклад, цей винахід має на увазі проліки 1S,2R,5S,6S-2-aмінo-6-фтор-4оксобщикло[3.1.0]гексан-2,6-дикарбонової кислоти; 1S,2R,4S,5S,6S-2-аміно-6-фтор-4гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти; 1S,2R,3S,5S,6S-2-аміно-3фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти та 1S,2R,3S,5S,6S-2-аміно-6-фтор-3гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти. Показано, що надлишкова або невідповідна стимуляція передачі збуджувальних амінокислот впливає на різноманітні фізіологічні функції. Вважається, що сполуки Формули І за цим винаходом придатні для лікування різноманітних неврологічних розладів у ссавців, поєднаних із таким станом, в тому числі гострих неврологічних розладів, наприклад, ураження головного мозку, що виникають після аорто-коронарного шунтування та трансплантацій, інсульту, церебральної ішемії, травм спинного мозку, травм голови, перинатальної гіпоксії, зупинки серця та гіпоглікемічного пошкодження нейронів. Вважається, що сполуки Формули І придатні для лікування різноманітних хронічних не 80280 10 врологічних розладів, наприклад, хвороби Альцгеймера, хореї Гантінгтона, аміотропного бічного склерозу, деменції, спричиненої СНІДом, пошкоджень ока та ретинопатії, розладів пізнавальної здатності, а також паркінсонізму ідіопатичного та наркотичного походження. Цей винахід пропонує також способи лікування згаданих розладів, які включають введення в організм пацієнта, котрий потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. Сполуки Формули І за цим винаходом здатні лікувати різноманітні інші неврологічні розлади у пацієнтів, пов'язані з глутаматною дисфункцією, в тому числі м'язові спазми, конвульсії, мігрені, нетримання сечі, болі, передменструальнний дисфоричний розлад (PDD), психози (наприклад, шизофренію), толерантність до лікарських засобів, синдроми абстиненції, припинення вживання наркотиків та потяг до них (наприклад, до нікотину, опіатів, кокаїну, бензодіазепінів та етанолу), розлад неспокою, страху або тривоги та аналогічні розлади, блювання, набряк мозку, хронічні болі та пізню дискінезію. Сполуки Формули І є також корисними як антидепресанти та анальгетики. Тому цей винахід пропонує також способи лікування згаданих розладів, які включають введення в організм пацієнта, котрий потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. Подані нижче визначення характеризують значення та обсяг різноманітних термінів, що застосовуються в цьому документі. Загальні терміни застосовуються в цьому документі у своїх звичайних значеннях. Термін "діючий" стосується сполуки Формули II, яка діє як агоніст на рецептор збуджувальної амінокислоти. Термін "рецептор збуджувальної амінокислоти" стосується метаботропного глутаматного рецептора, тобто рецептора, сполученого з клітинними ефекторами через протеїни, що зв'язують GTP. Термін "метаботропний глутаматний рецептор, зв'язаний з сАМР" стосується метаботропного рецептора, пов'язаного з інгібуванням активності аденілатциклази. Термін "неврологічний розлад" стосується як гострих, так і хронічних нейродегенеративних станів, в тому числі уражень головного мозку, що виникають після аорто-коронарного шунтування та трансплантацій, церебральної ішемії (наприклад, інсульту, що є наслідком зупинки серця), травм спинного мозку, травм голови, хвороби Альцгеймера, хореї Гантінгтона, аміотропного бічного склерозу, деменції, спричиненої СНІДом, перинатальної гіпоксії, гіпоглікемічного пошкодження нейронів, пошкоджень ока та ретинопатії, розладів пізнавальної здатності, а також паркінсонізму ідіопатичного та наркотичного походження. Цей термін охоплює також інші неврологічні розлади, спричинені глутаматною дисфункцією, в тому числі м'язові спазми, мігрені, нетримання сечі, толерантність до лікарських засобів, синдроми абстиненції, припинення вживання наркотиків та потяг до них (наприклад, до опіатів, бензодіазепінів, нікотину, кокаїну або етанолу), припинення куріння, 11 блювання, набряк мозку, хронічні болі, розлади сну, конвульсії, синдром Туретта, дефіцит уваги та пізню дискінезію. Термін "психічний розлад" стосується як гострих, так і хронічних психічних станів, в тому числі шизофренії, розладу неспокою, страху або тривоги та аналогічних розладів (наприклад, панічних нападів та серцево-судинних розладів, пов'язаних зі стресами), депресії, біполярних розладів, психозів, обсесивних компульсивних розладів, розладу генералізованої тривоги, гострого стресового розладу та панічного розладу. У значенні, вживаному в цьому описі, термін "ефективна кількість" означає кількість або дозу сполуки, яка при введенні в організм пацієнта у вигляді однієї або кількох доз забезпечує бажаний ефект для пацієнта, котрий піддається діагностиці або лікуванню. Ефективну кількість може легко визначити лікар-куратор як фахівець шляхом застосування відомих способів та спостереження результатів, досягнутих за аналогічних обставин. При визначенні ефективної кількості або дози застосовуваної сполуки лікар-куратор бере до уваги численні фактори, в тому числі (але не тільки) вид ссавця; його розмір, вік та загальний стан здоров'я; конкретне захворювання, що підлягає лікуванню; ступінь розвитку або поширення чи тяжкості захворювання; індивідуальну реакцію пацієнта; конкретну сполуку, яка вводиться в організм; спосіб введення; характеристики біодоступності застосовуваного препарату; обраний режим дозування; застосування комплексної терапії; та інші релевантні обставини. Наприклад, типова добова доза може містити від приблизно 5мг до приблизно 300мг активного інгредієнта. Згадані сполуки можна вводити в організм різноманітними шляхами, в тому числі пероральним, ректальним, черезшкірним, підшкірним, внутрішньовенним, внутрішньом'язовим, букальним або назальним. Альтернативним варіантом є введення сполуки шляхом безперервної інфузії. У значенні, вживаному в цьому описі, термін "пацієнт" означає ссавця, наприклад, мишу, морську свинку, пацюка, собаку або людину. Мається на увазі, що пацієнтом, якому віддається перевага, є людина. Термін "лікування" (або "лікувати") у значенні, вживаному в цьому описі, включає його загальновживане значення, яке охоплює протидію, профілактику, обмеження захворювання та сповільнення, припинення або зміну на протилежний напрямку розвитку спричиненого захворюванням симптому. Таким чином, способи за цим винаходом охоплюють як терапевтичне, так і профілактичне застосування. Загальні хімічні терміни, вживані в цьому описі, мають свої звичайні значення. Наприклад, термін "(С1-С6)-алкіл" означає нормальну або розгалужену групу. До прикладів значень (С1-С6)-алкілів належать (С1-С4)-алкіли, наприклад, метил, етил, пропіл, ізопропіл, бутил та ізобутил. Термін "(С2С6)-алкеніл" охоплює (С2-С4)-алкеніл, наприклад, аліл. Термін "(C2-С6)-алкініл" охоплює (С2-С4)алкеніл, наприклад, пропініл. 80280 12 Термін "факультативно заміщений," який уживається в складі термінів "факультативно заміщений (С1-С6)-алкіл," "факультативно заміщений (C2C6)-алкеніл" та "факультативно заміщений (С2-С6)алкініл," у цьому описі означає можливість присутності одного або кількох замісників, за варіантом, якому віддається перевага, від одного до трьох, причому згадані замісники вибрані з атомів та груп, які, в разі їх присутності у сполуці Формули І, не перешкоджають сполуці Формули І модулювати функцію метаботропного глутаматного рецептора. До прикладів атомів та груп, які можуть бути присутніми у факультативно заміщеному (С1-С6)алкілі, факультативно заміщеному (С2-С6)-алкенілі або факультативно заміщеному (С2-С6)-алкінілі, належать факультативно заміщена ароматична група, факультативно заміщена гетероароматична група, неароматична карбоциклічна група, неароматична гетероциклічна група, неароматична моноциклічна карбоциклічна група, конденсована з однією або двома моноциклічними ароматичними або гетероароматичними групами, та неароматична моноциклічна гетероциклічна група, конденсована з однією або двома моноциклічними ароматичними або гетероароматичними групами. Термін "гетероароматична група" охоплює ароматичний 5-6-членний цикл, що містить від одного до чотирьох гетероатомів, вибраних з групи, до якої входять кисень, сірка та азот, та ароматичну біциклічну групу, яка включає 5-6-членний цикл, що містить від одного до чотирьох гетероатомів, вибраних з групи, до якої входять кисень, сірка та азот, конденсований з бензольним циклом або 5-6-членним циклом, що містить від одного до чотирьох гетероатомів, вибраних з групи, до якої входять кисень, сірка та азот. Прикладами гетероароматичних груп є фурил, тіофеніл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, імідазоліл, піримідил, бензофурил, бензотіофеніл, бензимідазоліл, бензоксазоліл, бензотіазоліл та індоліл. Термін "ароматична група" охоплює феніл та поліциклічний ароматичний карбоцикл, наприклад, нафтил. Термін "факультативно заміщений," який уживається в складі термінів "факультативно заміщена гетероароматична група" та "факультативно заміщена ароматична група," у цьому описі означає можливість присутності одного або кількох замісників, причому згадані замісники вибрані з атомів та груп, які, у разі їх присутності у сполуці Формули І, не перешкоджають сполуці Формули І модулювати функцію метаботропного глутаматного рецептора. До прикладів атомів та груп, які можуть бути присутніми у факультативно заміщеній гетероароматичній або факультативно заміщеній ароматичній групі належать аміногрупа, гідроксил, нітрогрупа, галоген, (С1-С6)-алкіл, (С1-С6)-алкоксигрупа, (С1-С6)алкілтіогрупа, карбоксил, (С1-С6)алкоксикарбоніл, карбамоїл, (С1-С6)алканоїлaмінoгрупа, (С1-С6)-алкілсульфоніл, (С1С6)-алкілсульфоніламіногрупа, факультативно заміщений феніл, фенокси-, фенілтіогрупа, фенілсульфоніл, фенілсульфоніламіно-, толуолсульфоніламіногрупа, (С1-С6)-фторалюл та (С1-С6) 13 фторалкоксигрупа. До прикладів конкретних значень належать аміногрупа, гідроксил, фтор, хлор, бром, йод, метил, метокси-, метилтіогрупа, карбоксил, ацетиламіногрупа, метансульфоніл, нітрогрупа, ацетил, фенокси-, фенілтіогрупа, фенілсульфоніл, метансульфоніламіногрупа та трифторметил. До прикладів значень факультативно заміщеної ароматичної групи належать 1-нафтил, 2нафтил, феніл, 2-біфеніл, 3-біфеніл, 4-біфеніл, 2гідроксифеніл, 3-гідроксифеніл, 4-гідроксифеніл, 2фторфеніл, 3-фторфеніл, 4-фторфеніл, 2,4дифторфеніл, 3,4-дифторфеніл, пентафторфеніл, 2-хлорфеніл, 3-хлорфеніл, 4-хлорфеніл, 2,4дихлорфеніл, 3,4-дихлорфеніл, 3-хлор-4фторфеніл, 3,5-дихлорфеніл, 2-бромфеніл, 3бромфеніл, 4-бромфеніл, 2-метилфеніл, 3метилфеніл, 4-метилфеніл, 2-метоксифеніл, 3метоксифеніл, 4-метоксифеніл, 2,3диметоксифеніл, 2,5-диметоксифеніл, 3,4диметоксифеніл, 3,5-диметоксифеніл, 2трифторметилфеніл, 3-трифторметилфеніл, 4трифторметил феніл, 2-фтор-3трифторметилфеніл, 3-трифторметил-4фторфеніл, 3-трифторметил-5-фторфеніл, 2-фтор5-трифторметилфеніл, 2-феноксифеніл, 3феноксифеніл, 3-карбоксифеніл та 4карбоксифеніл. Термін "неароматична карбоциклічна група" охоплює моноциклічну групу, наприклад (С3-С10)циклоалкіл, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононіл або циклодецил та конденсовану поліциклічну групу, наприклад, 1-адамантил або 2адамантил, 1-декаліл, 2-декаліл, 4а-декаліл, біцикло[3.3.0]окт-1-іл, -2-іл або -3-іл, біцикло[4,3,0]нон1-іл, -2-іл, -3-іл або -7-іл, біцикло[5,3,0]дец-1-іл, -2іл, -3-іл, -4-іл, -8-іл або -9-іл та біцикло[3,3,1]нон-1іл,-2-іл,-3-іл або 9-іл. Термін "неароматична гетероциклічна група" охоплює 4-7-членний цикл, що містить один або два гетероатоми, вибрані з групи, до якої входять кисень, сірка та азот, наприклад, азетидин-1-іл або -2-іл, піролідин-1-іл, -2-іл або -3-іл, піперидин-1-іл, -2-іл, -3-іл або -4-іл, гексагідроазепін-1-іл, -2-іл, -3іл або -4-іл, оксетан-2-іл або -3-іл, тетрагідрофуран-2-іл або -3-іл, тетрагідропіран-2-іл, -3-іл або -4іл, гексагідрооксепін-2-іл, -3-іл або -4-іл, тіетан-2-іл або -3-іл, тетрагідротіофен-2-іл або -3-іл, тетрагідротіопіран-2-іл, -3-іл або -4-іл, гексагідротієпін-2-іл, -3-іл або -4-іл, піперазин-1-іл або -2-іл, морфолін1-іл, -2-іл або -3-іл, тіоморфолін-1-іл, -2-іл або -3іл, тетрагідропіримідин-1-іл, -2-іл, -4-іл або -5-іл, імідазолін-1-іл, -2-іл або -4-іл, імідазолідин-1-іл, -2іл або -4-іл, оксазолін-2-іл, -3-іл, -4-іл або -5-іл, оксазолідин-2-іл, -3-іл, -4-іл або -5-іл, тіазолін-2-іл, -3-іл, -4-іл або -5-іл та тіазолідин-2-іл, -3-іл, -4-іл або -5-іл. Термін "неароматична моноциклічна карбоциклічна група, конденсована з однією або двома моноциклічними ароматичними або гетероароматичними групами" охоплює (С3-С10)-циклоалкіл, конденсований з бензольним циклом або ароматичним 5-6-членним циклом, що містить від одного до чотирьох гетероатомів, вибраних з групи, до 80280 14 якої входять кисень, сірка та азот, наприклад, інданіл, 1,2,3,4-тетрагідронафт-1-іл або -2-іл, 5,6,7,8-тетрагідрохінолін-5-іл, -6-іл, -7-іл або 8-іл, 5,6,7,8-тетрагідроізохінолін-5-іл, -6-іл, -7-іл або 8іл, 4,5,6,7-тетрагідробензотіофен-4-іл, -5-іл, -6-іл або -7-іл, дибензо[2,3,6,7]циклогептан-1-іл або -4іл, дибензо[2,3,6,7]циклогепт-4-ен-1-іл або -4-іл, та 9-флуореніл. Термін "неароматична моноциклічна гетероциклічна група, конденсована з однією або двома моноциклічними ароматичними або гетероароматичними групами" охоплює 4-7-членний цикл, що містить один або два гетероатоми, вибрані з групи, до якої входять кисень, сірка та азот, конденсований з бензольним циклом або ароматичним 5-6членним циклом, що містить від одного до чотирьох гетероатомів, вибраних з групи, до якої входять кисень, сірка та азот, наприклад, 2,3дигідробензопіран-2-іл, -3-іл або -4-іл, ксантен-9-іл, 1,2,3,4-тетрагідрохінолін-1-іл, -2-іл, -3-іл або -4-іл, 9,10-дигідроакридин-9-іл або -10-іл, 2,3дигідробензотіопіран-2-іл, -3-іл або -4-іл, та дибензотіопіран-4-іл. Термін "група захисту азоту" у значенні, вживаному в цьому описі, позначений символом "PgN," стосується груп, призначених для захисту або блокування азотвмісної групи проти небажаних реакцій під час синтезу. Добір придатних груп захисту азоту залежить від умов подальших реакційних стадій, де такий захист є необхідним, як відомо пересічному фахівцеві. Загальновживані групи захисту азоту [описано в монографії T.W. Greene and P.G.M. Wuts, Protective Groups In Organic Synthesis, 3rd Ed. (John Wiley & Sons, New York (1999))]. Перевага серед груп захисту азоту віддається трет-бутоксикарбонілу. Термін "група захисту карбоксилу" у значенні, вживаному в цьому описі, позначений символом "PgC", стосується складноефірної похідної відповідної карбонової кислоти, яка звичайно застосовується для блокування або захисту цієї групи карбонової кислоти при проведенні реакцій за участю інших функціональних груп сполуки. До конкретних значень належать, наприклад, метил, етил, mpe/wбутил, бензил, метоксиметил, триметилсиліл тощо. Подальші приклади таких груп можна знайти [у монографії T.W. Greene and P.G.M. Wuts, Protecting Groups in Organic Synthesis, 3 rd Ed. (John Wiley & Sons, New York (1999))]. Перевага серед груп захисту карбоксилу віддається метилу та етилу. Такий складний ефір розкладають, застосовуючи звичайну методику, яка не впливає на інші фрагменти молекули. Термін "група захисту гідроксилу" означає групу, відому фахівцям з органічної хімії, типу, описаного в Розділі 2 вищезгаданої монографії Greene and Wuts. До типових груп захисту гідроксилу належать, наприклад, групи простого ефіру, групи заміщеного етилового простого ефіру, групи ізопропілового простого ефіру, групи фенілового та заміщеного фенілового простого ефіру, бензилового та заміщеного бензилового простого ефіру, групи алкілсилілового простого ефіру, складноефірні групи захисту тощо. Тип застосовуваної групи захисту гідроксилу не має істотного значення за 15 умови, що дериватизований гідроксил залишається стабільним в умовах проведення подальших реакцій при інших положеннях молекули проміжної сполуки і може бути селективно розщеплений на відповідній стадії без порушення залишку молекули, в тому числі будь-якої іншої групи або груп захисту гідроксилу. Термін "аміноацил" означає aмінoацильну похідну амінокислоти, вибраної з групи, до якої входять природні та штучні амінокислоти, визначені у цьому описі. Природні амінокислоти можуть бути нейтральними, позитивними або негативними, залежно від замісників у боковому ланцюгу. "Нейтральна амінокислота" означає амінокислоту, яка містить незаряджені замісники у боковому ланцюгу. До прикладів нейтральних амінокислот належать аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, триптофан, метіонін, гліцин, серин, треонін, цистеїн, глутамін та аспарагін. "Позитивна амінокислота" означає амінокислоту, в якій замісники у боковому ланцюгу при фізіологічному рН заряджені позитивно. До прикладів позитивних амінокислот належать лізин, аргінін та гістидин. "Негативна амінокислота" означає амінокислоту, в якій замісники у боковому ланцюгу при фізіологічному рН несуть залишковий негативний заряд. До прикладів негативних амінокислот належать аспарагінова кислота та глутамінова кислота. Амінокислотами, яким віддається перевага, є αамінокислоти. Амінокислотами, яким віддається найбільша перевага, є α-амінокислоти, які мають стереохімічну L-конфігурацію при α-вуглеці. До прикладів природних α-амінокислот належать валін, ізолейцин, пролін, фенілаланін, триптофан, метіонін, гліцин, серин, треонін, цистеїн, тирозин, аспарагін, глутамін, лізин, аргінін, гістидин, аспарагінова кислота та глутамінова кислота. "Штучна амінокислота" означає амінокислоту, для якої не існує кодону нуклеїнової кислоти. До прикладів штучних амінокислот належать, наприклад, D-ізомери вищезазначених природних αамінокислот; Aib (аміномасляна кислота), βAib (3аміноізомасляна кислота), Nva (норвалін), β-Ala, Aad (2-аміноадипінова кислота), βAad (3аміноадипінова кислота), Abu (2-аміномасляна кислота), Gaba (g-аміномасляна кислота), Аср (6амінокапронова кислота), Dbu (2,4-діаміномасляна кислота), α-амінопімелінова кислота, TMSA (триметилсиліл-Аlа), alle (аIlо-ізолейцин), Nle (норлейцин), трет-Leu, Cit (цитрулін), Orn, Dpm (2,2'діамінопімелінова кислота), Dpr (2,3діамінопропіонова кислота), а- або β-Nal, Cha (циклогексил-Аlа), гідроксипролін, Sar (саркозин), Ометилтирозин, фенілгліцин тощо; циклічні амінокислоти; Nα-алкіловані амінокислоти, де Nαалкілованою амінокислотою є Nα-(С1-С10)алкіламінокислота, наприклад, MeGly (Nαметилгліцин), EtGly (Nα-етилгліцин) та EtAsn (Nαетиласпарагін) та амінокислоти, в яких α-вутлець заміщений двома боковими ланцюгами. До прикладів штучних α-амінокислот належать D-аланін, D-лейцин та фенілгліцин. Назви природних та штучних амінокислот та їхніх залишків, застосовувані в цьому описі, відповідають правилам номенклатури, запропонованим Об'єднаною комісією з 80280 16 біологічної номенклатури (JCBN) Міжнародного союзу чистої та прикладної хімії та Міжнародного союзу біології (IUPAC-IUB) і опублікованим під назвою ["Nomenclature and Symbolism для Amino Acids and Peptides (Recommendations, 1983)", European Journal of Biochemistry, 138, 9-37 (1984)]. У випадках, коли назви та абревіатури амінокислот та їхніх залишків, застосовувані в цьому описі та формулі винаходу, відрізняються від вищезгаданих, такі відмінні назви та абревіатури будуть спеціально пояснені. Хоча як активні агоністи рецептора mGluR2 придатні всі сполуки Формули І, певним сполукам віддається перевага. У поданому нижче переліку вказано класи, яким віддається перевага. A) Q - гліцил, аланіл, валіл, лейцил, ізолейцил, проліл, фенілаланін, тирозил, триптофіл, метіонін, лізил, або сериніл. B) Q - аланіл. C) Q - метіонін. D) p=1. Ε) p=2. F) X - SO2. G) Χ - CR3R4. Η) R3 - фтор та R4 - водень. I) R3 - гідроксил та R4 - водень. J) R3 та R4 спільно є =О. К) R10 - водень. L) R10- фтор. Μ) R11 - водень. Ν) Сполука є вільною основою. О) Сполука є сіллю. Р) Сполука є гідрохлоридом. Q) Сполука є мезилатом. R) Сполука є езилатом. S) Сполука є тозилатом. Перелічені вище пункти можна комбінувати і визначати таким чином додаткові класи сполук, яким віддається перевага. Сполуки Формули І корисні для лікування розладів у ссавців, причому ссавцем, якому віддається перевага, є людина. Сполуки за цим винаходом можна одержати різноманітними способами; деякі з них ілюстровано схемами, поданими нижче. Конкретний порядок стадій, необхідний для одержання сполук Формули І, залежить від конкретної сполуки, синтез якої здійснюється, вихідної сполуки та відносної лабільності заміщених фрагментів. У поданих нижче схемах деякі замісники можуть бути не вказані з міркувань ясності, і їх не слід розглядати як такі, що будь-яким чином обмежують представлену на схемах інформацію. Для пересічного фахівця ясно, що замісники R15 та R16 означають відповідні бокові ланцюги, необхідні для утворення бажаного аміноацилу. У випадках, коли вихідні матеріали, необхідні для здійснення синтезу за поданими нижче схемами, не є комерційно доступними, їх можна одержати за методиками, вибраними з групи, до якої входять стандартні методики органічної хімії та хімії гетероциклічних сполук, котрі є аналогічними методам синтезу відомих сполук аналогічної структури, та за методиками, представленими в описах 17 підготовчих синтезів та прикладів, в тому числі за новими методиками. Сполуки Формули І перетворюють шляхом ферментації або гідролізу in vivo з утворенням сполук Формули II, як показано вище на Схемі 1. Зокрема, кристалічну форму сполуки Формули І можна одержати способом, показаним нижче на Схемі 2. 80280 18 Наприклад, захищена пептидильна сполука з двома кислотними групами формули (iv) при обробленні газоподібним хлороводнем у придатному розчиннику дає гідрохлорид, від якого відщеплені групи захисту, у вигляді аморфної твердої речовини. Цей аморфний гідрохлорид потім можна перекристаліаувати з ацетону та води, одержуючи кристалічний гідрохлорид. У випадку безпосереднього утворення кристалічної твердої речовини кристалічну сіль можна одержати фільтруванням реакційної суміші. Цвітер-іонну сполуку одержують шляхом оброблення кристалічного гідрохлориду гідроксидом натрію; в альтернативних варіантах оброблення мезилату або тозилату гідроксидом натрію також забезпечує одержання цвітер-іонної сполуки. Для фахівця зрозуміло, що сполуку Формули І можна одержати за методикою, в якій вищевказані проміжні продукти не виділяються. Складний діефір формули (іі) ацилюють сполукою формули III, використовуючи придатний агент сполучення, і одержують захищену пептидильну сполуку формули (ііі), яка містить дві складноефірні групи. За альтернативним варіантом, це перетворення можна здійснити, використовуючи хлорангідрид сполуки Формули III. До придатних реагентів пептидного сполучення належать дициклогексилкарбодіімід (DCC), 1-(3диметиламінопропіл)-3-етилкарбодіімід (EDC), ізобутилхлорформіат, дифеніл-хлорфосфат, 2хлор-4,6-диметокси-1,3,5-триазин (CDMT), хлорангідрид біс(2-оксо-3-оксазолідиніл)фосфінової кислоти та гексафторфосфат бензотриазол-1ілокситрис(диметиламіно)фосфонію. Шляхом гідролізу захищеної пептидильної сполуки формули (ііі), яка містить дві складноефірні групи, придатною основою, наприклад, гідроксидом літію або гідроксидом натрію, у придатному розчиннику, наприклад, THF або суміші THF/вода, одержують захищену пептидильну сполуку з двома кислотними групами формули (iv). Від сполуки формули (iv) можна відщепити групу захисту дією придатної кислоти у придатному розчиннику. В таких умовах можна одержати сіль пептидильної дикислоти з відповідною кислотою, позначену як сіль сполуки Формули І, у вигляді аморфної твердої речовини або безпосередньо кристалічної твердої речовини, де X" - відповідний аніон. У випадку аморфного продукту можна виконати подальшу кристалізацію з придатного розчинника. Солі карбонових кислот можна одержати, вводячи в реакцію катіон у формі реагенту, наприклад, ацетату натрію. Нарешті, можна одержати цвітер-іонну сполуку шляхом дії придатної основи на кристалічну сіль. За поданою вище Схемою 4, сполуку Формули II, яка є дикислотою, обробляють придатним агентом захисту карбоксилу, наприклад, каталітичною кількістю хлористоводневої кислоти або тіонілхло 19 риду та метанолом або етанолом, одержуючи відповідний складний діефір формули (іі). За альтернативним варіантом, сполуку Формули II можна спочатку обробити агентом захисту азоту, наприклад, ВОС2О, одержуючи сполуку формули (і) із захищеним атомом азоту. Потім сполуку формули (і) можна обробити агентом захисту карбоксилу, наприклад, метилйодидом, у присутності основи, наприклад, карбонату калію, а потім агентом відщеплення групи захисту азоту, наприклад, хлористоводневою кислотою або трифтороцтовоюкислотою, і одержати сполуку формули (іі). Крім того, для пересічного фахівця зрозуміло, що, залежно від X, може виявитися необхідним застосування придатного захисного агента. Наприклад, якщо X - CR3R4, де R3 - гідроксил та R4 водень, то для фахівця ясно, що перед проведенням синтезу за будь-якою з поданих вище схем може виявитися необхідним введення групи захисту гідроксилу. Сполуки Формули II відомі в галузі. Наприклад, способи одержання цих сполук можна знайти [в патентах США №5,688,826 (патент '826) та №5,958,960 (патент '960)]. У способи синтезу сполук Формули II внесено різноманітні вдосконалення у порівнянні з розкритими раніше способами. Ці вдосконалення стосуються окиснення сірки та спирту, а також оптичного розділення різних проміжних продуктів, як описано нижче. Перше вдосконалення стосується перетворення, [описаного у патенті '826, колонка 8, рядки 22-34, та колонка 7, починаючи з рядка 33] (Формула V), в тому числі окиснення сполуки формули VII [патенту '826] для одержання сполуки формули V [патенту '826] Виявлено, що серед численних відомих у галузі способів окиснення можна віддати перевагу застосуванню комплексу триоксиду сірки з піридином або трифтороцтовому ангідриду в комбінації з DMSO. По-друге, щодо розділення сполуки Формули IIІ [патенту '826] де R2 -карбоксил, згаданого [в колонці 8, рядки 3-7, та в колонці 6, починаючи з рядка 1] (Формула III), з'ясовано, що перевагу слід віддати (R)-α 80280 20 метилбензиламіну та хініну. Особливу перевагу слід віддати (R)-α-метилбензиламіну. Далі, виявлено, що при окисненні сульфіду сполуки Формули III [патенту '826], де X - сірка, для одержання сполуки Формули III [патенту '826], де X - сульфоніл, як вказано [в патенті '826, колонка 8, рядки 39-53], перевагу слід віддавати застосуванню основної системи на водній основі та пероксиду водню в комбінації з каталізатором. Подані нижче Приклади додатково ілюструють сполуки за цим винаходом та способи їх синтезу. Ці Приклади не слід розглядати як такі, що обмежують будь-яким чином обсяг винаходу. Усі експерименти виконувалися під надлишковим тиском сухого азоту або аргону. Усі розчинники та реагенти були придбані на ринку та застосовані без додаткової підготовки, якщо не вказано інше. Безводний тетрагідрофуран (THF) можна одержати дистиляцією над натрієм або бензофенонкетилом натрію перед застосуванням. Спектри протонного магнітного резонансу (1Н ЯМР) одержані на приладах Bruker Avance II bay-500 при 500МГц, Bruker Avance 1 bay-200 при 200МГц або Varian Inova/Varian 300/Varian 400 при 500МГц. Macспектроскопія з електророзпиленням (ESI) виконувалася на приладі Agilent MSD/B із застосуванням суміші ацетонітрилу та водного розчину ацетату амонію як рухомої фази. Mac-спектроскопія з бомбардуванням вільними атомами (FABMS) виконувалася на приладі VG ZAB-2SE. Mac-спектроскопія з польовою десорбцією (FDMS) виконувалася із застосуванням приладів або VG 70SE, або Varian MAT 731. Оптичне обертання вимірювалося із застосуванням поляриметра Perkin-Elmer 241. Хроматографічне розділення здійснювалося, як правило, на рідинному хроматографі Waters Prep 500 LC з застосуванням лінійного градієнта розчинників, вказаних у тексті. Завершення реакцій контролювали, як правило, використовуючи хроматографію в тонкому шарі (TLC). Хроматографію в тонкому шарі виконували із застосуванням пластин Е. Merck Kieselgel 60 F254 розміром 5´10см, товщиною 0,25мм. Для детектування плям використовували комбінацію УФ та хімічного детектування (пластини занурювали у розчин церійамоніймолібденату [75г молібденату амонію та 4г сульфату церію (IV) у 500мл 10% водного розчину сірчаної кислоти], а потім нагрівали на гарячій плитці). Флеш-хроматографію виконували, [як описано Стілом та ін., Still, Kahn, Mitra, J. Org. Chem., 43, 2923 (1978)]. Елементний аналіз на вуглець, водень та азот виконували на аналізаторі Control Equipment Corporation 440 Elemental Analyzer або проводили в лабораторії Universidad Complutense Analytical Centre (Facultad de Farmacia, Madrid, Spain). Температури плавлення визначали у відкритому скляному капілярі на приладі Gallenkamp із повітряною банею або на приладі Buechi, і їх значення вказані без поправок. Абревіатури, символи та терміни, вживані в прикладах, мають вказані нижче значення. Ас= ацетил Аналіз:= елементний аналіз ATR= ослаблене загальне внутрішнє відбиття Вn або Bzl= бензил 21 Вu= бутил ВОС= трет-бутоксикарбоніл обчисл.= обчислено D2O = оксид дейтерію (важка вода) DCC= дициклогексилкарбодіімід DCM= 1,2-дихлорметан DIBAL-H= діізобутил-алюміній-гідрид DMAP= 4-диметиламінопіридин DMF= диметилформамід DMSO= диметилсульфоксид DSC= диференційна сканувальна калориметрія EDC= N-етил-N'N'-диметиламінопропіл карбодііміду гідрохлорид ES= іонізація іонним струменем Et= етил EtOH= етанол FAB= іонізація бомбардуванням швидкими атомами (мас-спектрометрія) FDMS= мас-спектр з польовою десорбцією FTIR= інфрачервона Фур'є-спектрометрія HOAt= 1-гідрокси-7-азабензотриазол HOBt= 1-гідроксибензотриазол HPLC= рідинна хроматографія високої ефективності HRMS= мас-спектр високого розрізнення і-РrОН= ізопропанол ІЧ= інфрачервоний спектр л= літр Me= метил МеОН= метанол MPLC= рідинна хроматографія під помірним тиском Т.пл.= температура плавлення МТВЕ= метал-трет-бутиловий простий ефір NBS= N-бромсукцинімід ЯМР= ядерно-магнітний резонанс PC-TLC= препаративна хроматографія в тонкому шарі з центрифугуванням Ph= феніл р.о.= пероральне введення і-Рr= ізопропіл Сегнетова сіль (Rochelle's Salt)= виннокислий калій-натрій rt= кімнатна температура SM= вихідний матеріал TBS= трет-бутилдиметилсиліл TEA= триетиламін Темп.= температура TFA= трифтороцтова кислота THF= тетрагідрофуран TLC= хроматографія в тонкому шарі t-BOC= трет-бутоксикарбоніл Загальна методика А Сполучення амінів з N-ВОС-(L)амінокислотами із застосуванням EDC Суспендують вихідний складний ефір діалкіламіну (сполука формули іі, Схема 3) (1,0екв.) у безводному дихлорметані в атмосфері азоту. Послідовно додають відповідні N-Вос-(L)амінокислоту (1,5-2,0екв.), EDC (1,5-2,0екв.), HOBt (1,5-2,0екв.) та диметиламінопіридин (DMAP, 0,10,2екв.). Перемішують реакційну суміш при кімнатній температурі до завершення реакції за даними TLC, якщо не обумовлено інше. Розбавляють реа 80280 22 кційну суміш етилацетатом і промивають послідовно насиченим водним розчином NаНСО3 та/або водним розчином NaHSO4, а потім розсолом. Після висушування над сульфатом натрію та випарювання у вакуумі неочищений залишок (сполуку формули ііі) очищають хроматографією на силікагелі, застосовуючи придатний елюент (у типовому випадку суміш етилацетату з гексаном). Загальна методика В Ангідридне сполучення аміну з ізобугиловим ангідридом N-BOC-(L)-амінокислоти До розчину відповідної N-Вос-(L)-амінокислоти (1,5екв.) у безводному дихлорметані (10мл) при 20°С додають а атмосфері азоту Nметилморфолін (NMM, 1,5екв., у 1мл СН2СІ 2), після чого краплями додають ізобутил-хлорформіат (IBCF, 1,5екв., у 5мл СН2СІ 2) з такою швидкістю, щоб внутрішня температура реакційної суміші не перевищувала -15°С. Перемішують одержану реакційну суміш при -20°С протягом 30хв., потім додають охолоджений до -20°С розчин гідрохлориду діетилового складного ефіру (1S,2S,4S,5R,6R)-2(2'-аміно-пропіоніламіно)-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (1,0екв.) у дихлорметані (10мл) із такою швидкістю, щоб внутрішня температура реакційної суміші не перевищувала -15°С. Після завершення додавання відстороняють охолоджувальну баню, і перемішують реакційну суміш при кімнатній температурі до завершення реакції за даними TLC. Розбавляють реакційну суміш етилацетатом і послідовно промивають насиченим водним розчином NaHCO3, водним розчином NaHSO4 і розсолом. Після висушування над сульфатом магнію та випарювання у вакуумі неочищений залишок очищають хроматографією на силікагелі, застосовуючи придатний елюент (у типовому випадку суміш гексану і етилацетату). Загальна методика С Послідовне відщеплення N-Boc та складноефірних захисних груп Перемішують відповідну пептидну похідну NBoc складного діефіру (сполука формули ііі, Схема 2) (1,0екв.) у суміші (1:1) THF/2,5-h. LiOH (1020екв.) при кімнатній температурі протягом 4год. Розбавляють реакційну суміш Н2О та промивають етилацетатом. Відкидають органічний шар. Доводять водну фазу до рН 2 за допомогою 1-н. НСl (за потреби додають до водної фази NaCl для підвищення здатності до екстрагування) і повністю екстрагують етилацетатом N-boc-дикарбонову кислоту (сполука формули iv). Об'єднують всі органічні шари, промивають розсолом, сушать над MgSO4 та випарююють досуха у вакуумі, одержуючи бажаний карбоксилатний продукт у вигляді пінистої твердої речовини. Розчиняють в етилацетаті і охолоджують до 0°С. Продувають реакційну суміш безводним газоподібним НСl до насичення HCl. Перемішують одержану реакційну суміш при 0°С протягом 4 год. Виділяють пептидну похідну, від якої повністю відщеплені групи захисту (сполука Формули І), у вигляді її гідрохлориду фільтруванням в атмосфері N2 або концентруванням реакційної суміші досуха з подальшим розтиранням з етилацетатом або Et2O та концентруванням до 23 одержання білого порошку. Факультативно, з метою видалення залишкового розчинника та надлишку НСl, розчиняють продукти в Н2О, заморожують, після чого ліофілізують і одержують бажані продукти у формі гідрохлоридів. Підготовчий синтез 1 Діетиловий складний ефір (1R,4S,5S,6S)-4аміно-2,2-діоксо-2l 6-тiaбіцикло[3.1.0]гексан-4,6дикарбонової кислоти До суспензії (1R,48,58,68)-4-аміно-2,2-діоксо2l 6-тiaбіцикло[3.1.0]-гексан-4,6-дикарбонової кислоти (10г, 42,5ммоль, [патент США №5,688,826] у 100мл етанолу кваліфікації 2В при кімнатній температурі додають тіонілхлорид (15,5мл, 212,6ммоль) краплями протягом 20хв., після чого промивають 40мл етанолу. Нагрівають суспензію зі зворотним холодильником та перемішують протягом ночі. Аналіз методом 1Н ЯМР (500МГц, CD3OD) концентрованої аліквоти посвідчив повне витрачання вихідного матеріалу та проміжного складного моноефіру. Дають можливість одержаному розчину охолодитися до кімнатної температури, після чого концентрують і одержують желеподібний залишок. Додають EtOAc (50мл) до цього залишку, який потім концентрують з одержанням твердої речовини, після чого розбавляють додатково 94мл EtOAc. До суміші повільно додають 15% водний розчин карбонату натрію (70мл) при збовтуванні вручну до поступового розчинення, одержуючи кінцевий рН=7,95. Фільтрують одержаний осад карбонату натрію, після чого екстрагують шари. Екстрагують водний шар EtOAc (2´100мл). Промивають об'єднані органічні екстракти розсолом (1´100мл), сушать (MgSO4), фільтрують і концентрують у вакуумі, одержуючи блідо-жовте масло, що твердне, утворюючи вказану в заголовку сполуку у вигляді жовтуватої твердої речовини (11,71г, вихід 95%). Перекристалізація Суміш вказаної в заголовку сполуки (200мг) з ЕtOАс (800мкл) нагрівають до 56"С до повного розчинення. Після перемішування протягом 15хв. при 56°С до розчину додають краплями гептан (1мл). Нагрівання припиняють. Дають можливість розчину охолодитися до 52°С, при цьому випадає осад. При охолодженні та додатковому розбавленні гептаном (600мкл) утворюється суспензія. Перемішують одержану суспензію при кімнатній температурі протягом 1год., після чого фільтрують, промивають гептаном (2x500мкл) та сушать при 45°С протягом ночі, одержуючи 145мг (вихід по добуванню 73%) вказаної в заголовку сполуки у вигляді білої твердої речовини, т.пл. 80-83°С. [α]25D=-57,7° (с 1,04, СН3ОН). 500МГц 1H ЯМР (CD3CI 3) δ 4,31 (q, 2Н, J=7,0Гц), 4,20 (m, 2H), 3,78 (d, 1Н, J=15,0Гц), 3,36 (dd, 1H, J=4,0, 7,0Гц), 2,93 (dd, 1H, J=4,0, 7,0Гц), 80280 24 2,81 (d, 1H, J=15,0Гц), 2,46 (t, 1H, J=4,0), 1,34 (t, 3H, J=7,0), 1,30 (t, 3H, J=7,0). 13C ЯМР (125МГц, CD3CI 3) δ 171,68, 168,57, 63,26, 62,42, 59,96, 56,06, 43,78, 32,25, 22,49, 14,31, 14,25. FTIR (ATR) 3364,15 (s), 1725,95 (s), 1304,91 (s), 1259,24 (s), 1200,84 (s), 1104,91 (s), 1022,99 (s), 896,45 (s), 851,21 (s)см-1. Аналіз обчислено для C11H17NO6S: С, 45,35; Η, 5,88; Ν, 4,81. Знайдено: С, 45,02; Η, 5,75; Ν, 4,82. Підготовчий синтез 2 Діетиловий складний ефір (1R,4S,5S,6S)-4(2'S-трет-бутоксикарбоніламіно-пропіоніламіно)2,2-діоксо-2l 6-тіа-біцикло[3.1.0]гексан-4,6дикарбонової кислоти До розчину N-Boc-L-аланіну (43,52г, 230ммоль) та N-метилморфоліну (25,5мл, 232ммоль) у 457мл метиленхлориду при -30°С в атмосфері азоту краплями протягом 10хв. додають ізобутилхлорформіат (30,4мл, 234ммоль). Перемішують одержану рідку суспензію при температурі від -25°С до -30°С протягом 30хв., після чого додають протягом 25хв. розчин діетилового складного ефіру (1R,4S,5S,6S)-4-аміно-2,2-діоксо2l 6-тіа-біцикло[3.1.0]гексан-4,6-дикарбонової кислоти (63,90г, 219ммоль, Підготовчий синтез 1) у 213мл метиленхлориду з такою швидкістю, щоб температура реакційної суміші не перевищувала 25°С. Після завершення додавання відстороняють охолоджувальну баню та дають можливість нагріватися при перемішуванні до температури навколишнього середовища протягом 60хв., при цьому температура реакційної суміші досягає 19°С, а її колір стає слабо-оранжевим. Обробляють реакційну суміш 350мл 1-н. НСI та розділяють шари. Промивають органічний шар насиченим водним розчином NaHCO3 (1´350мл) та розсолом (1x350мл), сушать (Na2SO4), фільтрують та випарюють у вакуумі, одержуючи білу піну (105,2г, 104%). 1 H ЯМР (300МГц, CDCI 3) δ: 7,62 (brs, 1H), 4,90 (brd, 1H, J=7,1Гц), 4,34-4,10 (m, 6H), 3,39 (ddd, 1H, J=7,2, 3,9, 1,0Гц), 3,00 (dd, 1H, J=7,1, 3,9Гц), 2,90 (brd, 1H, J=14,9Гц), 2,43 (t, 1H, J=4,1Гц), 1,46 (s, 9H), 1,31 (m, 9H). 13 C ЯМР (75МГц, CDCI 3) δ: 173,0, 168,6, 167,6, 80,9, 76,5, 63,3, 62,3, 59,9, 55,7, 42,8, 31,5, 28,2, 22,7, 16,6, 14,0, 13,9. MS (ES) m/z 461,0 [M-H]- . Підготовчий синтез 3 (1R,4S,5S,6S)-4-(2'S-третбутоксикарбоніламіно-пропіоніламіно)-2,2-діоксо2l 6-тіа-біцикло[3.1.0]гексан-4,6-дикарбонова кислота 25 До розчину діетилового складного ефіру (1R,4S,5S,6S)-4-(2'S-трет-бутоксикарбоніламінопропіоніламіно)-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (181,4г, 392ммоль теоретично, Підготовчий синтез 2) у 292мл THF при кімнатній температурі додають 490мл (980ммоль) 2-н. гідроксиду натрію. Одержану двофазну суміш інтенсивно перемішують при кімнатній температурі протягом 1,25 год; за цей час реакційна суміш стає однорідною. Розбавляють суміш 490мл етилацетату та розділяють шари. Розбавляють водний шар 490мл етилацетату та знижують рН суміші до 1,5 концентрованою НСI. Розділяють шари, і екстрагують водний шар 245мл етилацетату. Сушать об'єднані органічні шари (Na2SO4), фільтрують і концентрують, одержуючи 167,9г (105%) вказаної в заголовку сполуки у вигляді білої піни. Цей матеріал використовують без визначення характеристик в Прикладах 1 та 2. Підготовчий синтез 4 Диметиловий складний ефір (3R,4S,5S,6S)-4аміно-2,2-діоксо-2l 6-тіа-біцикло[3.1.0]гексан-4,6дикарбонової кислоти Додають тіонілхлорид (6,2мл, 85,0ммоль) краплями при інтенсивному перемішуванні до суспензії (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (10,0г, 42,5ммоль, [патент США №5,688,826) у МеОН (170мл, 5°С). Після завершення додавання дають можливість реакційній суміші повільно нагрітися до кімнатної температури, після чого нагрівають зі зворотним холодильником протягом 48год. Видаляють леткі фракції під зниженим тиском, і розподіляють залишок між насиченим розчином NаНСО3 (200мл) та етилацетатом (400мл). Розділяють шари, і екстрагують водний шар етилацетатом (2´400мл). Сушать об'єднані органічні шари над K2СО3 і концентрують під зниженим тиском, одержуючи 8,10г (30,8ммоль) вказаної в заголовку сполуки (вихід 72%). [α]23D=-84°(с=0,5,МеОН). Аналіз обчислено для C9H13NO6S: С, 41,06; Η, 4,98; Ν, 5,32. Знайдено: С, 40,94; Η, 4,93; Ν, 5,30. MS (ES) m/z 264,0 [M+H]+. Підготовчий синтез 5 Диметиловий складний ефір (1R,4S,5S,6S)-4(2'S-трет-бутоксикарбоніламіно-3'-фенілпротоніламіно)-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти 80280 26 Одержують відповідно до Загальної методики А, використовуючи наявний на ринку N-ВОС-(L)фенілаланін та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (Підготовчий синтез 4). Нагрівають реакційну суміш зі зворотним холодильником протягом ночі. Очищають, використовуючи PC-TLC, 4мм ротор з SiO2, елюент - градієнт від 10% етилацетату в гексані до 100% етилацетату. Вихід продукту у вигляді білої піни 0,85г (88%, 1,67ммоль). [α]23D=-35,2° (с=0,45, СНСI 3). 1 Н ЯМР (300МГц, CDCI 3) δ 1,43 (9Н, s), 2,382,40 (1H, m), 2,86 (1H, d, J=15,0Гц), 2,91 (1H, dd, J=4,4, 7,3Гц), 3,04 (2H, d, J=7,3Гц), 3,35-3,39 (1H, m), 3,77 (3H, s), 3,84 (3H, s), 4,11 (1H, d, J=14,3Гц), 4,30 (1H, app. q, J=7,3Гц), 4,96 (1H, bd, J=6,6Гц), 6,96 (1H, bs), 7,22-7,36 (5H, m). Аналіз обчислено для C23H30N2O9S·0,1H2O: С, 53,92; Η, 5,94; Ν, 5,47. Знайдено: С, 53,62; Η, 5,90; Ν, 5,28. MS (ES) m/z 509,16 [M-H]-; 411,2 [M-Boc]+. Підготовчий синтез 6 Диметиловий складний ефір (1R,4S,5S,6S)-4(2'S-трет-бутоксикарбоніламіно-3'S-метилпентаноїламіно)-2,2-діоксо-2l6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи наявний на ринку N-ВОС-(L)ізолейцин та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (Підготовчий синтез 4). Нагрівають реакційну суміш зі зворотним холодильником протягом ночі. Очищають, використовуючи PC-TLC, .ротор 4мм SіO2, елюент - градієнт від 10% етилацетату в гексані до 100% етилацетату. Вихід продукту у вигляді білої піни 0,75г (83%, 1,57ммоль). [α]23D=-32,65° (c=0,49, СНСI 3). 1 Н ЯМР (300МГц, CDCI 3) δ 0,91 (3Н, t, J=7,3Гц), 0,93 (3H, d, J=6,6Гц), 1,10-1,18 (1Н, m), 1,46 (9H, s), 1,42-1,52 (1Н, m), 1,81-1,86 (1H, bm), 2,51 (1H, t, J=4,0Гц), 2,95 (1H, d, J=15,0Гц), 3,06 (1H, dd, J=4,4, 7,3Гц), 3,43 (3Н, dd, J=3,7, 7,0Гц), 3,78 (3Н, s), 3,85 (3Н, s), 3,82-3,90 (1H, m), 4,20 (1H, d, J=14,7Гц), 4,94 (1H, d, J=8,4Гц), 7,19 (1H, bs). 27 Аналіз обчислено для C20H32N2O9S: С, 50,41; Η, 6,77; Ν, 5,88. Знайдено: С, 50,32; Η, 6,92; Ν, 5,76. MS(ES) m/z 475,1 [M-Η]- . Підготовчий синтез 7 Диметиловий складний ефір (1R,4S,5S,6S)-4(2'S-трет-бутоксикарбоніламіно-3'-метилбутириламіно)-2,2-діоксо-2l 6-тіабіцикло[3.1.01гексан-4.6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи наявний на ринку N-ВОС-(L)валін та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (Підготовчий синтез 4). Нагрівають реакційну суміш зі зворотним холодильником протягом ночі. Очищають, використовуючи PC-TLC, ротор 4мм SіO2, елюент — градієнт від 10% етилацетату в гексані до 100% етилацетату. Вихід продукту у вигляді білої піни 0,41г (47%, 0,89ммоль). [α]23D=-35,36e (c=0,51, СНСI 3). 1 Н ЯМР (300МГц, CDCI 3) δ 0,93 (3Н, d, J=7,0Гц), 0,96 (3Н, d, J=6,6Гц), 1,46 (9Н, s), 2,062,13 (1Н, m), 2,50 (1H, t, J=4,0Гц), 2,94 (1H, d, J=15,0Гц), 3,04 (1H, dd, J=4,4, 7,3Гц), 3,43 (1H, dd, J=3,3, 6,6Гц), 3,78 (3Н, s), 3,80-3,86 (1H, m), 3,86 (3H, s), 4,24 (1H, d, J=15,0Гц), 4,94 (1H, d, J=8,1Гц), 7,15 (1H, bs). Аналіз обчислено для C9H30N2O9S: С, 49,34; Η, 6,54; Ν, 6,06. Знайдено: С, 49,33; Η, 6,44; Ν, 6,05. MS(ES) m/z 461,2 [M-Η]- . Підготовчий синтез 8 Диметиловий складний ефір (1R,4S,5S,6S)-4(2'S-трет-бутоксикарбоніламіно-4'-метилпентаноїламіно)-2,2-діоксо-2l6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи наявний на ринку моногідрат NВОС-(L)-лейцину та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (Підготовчий синтез 4). Нагрівають реакційну суміш зі зворотним холодильником протягом ночі. Очищають, використовуючи PC-TLC, ротор 4мм SіO2, елюент - градієнт від 10% етилацетату в гексані до 100% етилацетату. Вихід продукту у вигляді білої піни 0,85г (94%, 1,78ммоль). 80280 28 [α]23D=-46,15e (c=1,04, СНСI 3). Н ЯМР(300МГц, CDCI 3) δ 0,92 (3Н, d, J=6,2Гц), 0,95 (3Н, d, J=6,6Гц), 1,47 (9Н, s), 1,421,47 (1Н, m), 1,63-1,67 (1Н, m), 2,46 (1H, t, J=3,7Гц), 2,87 (1H, d, J=15,0Гц), 3,04 (1H, dd, J=4,4, 7,3Гц), 3,41 (1H, dd, J=3,7, 7,0Гц), 3,78 (3Н, s), 3,86 (3Н, s), 4,00-4,05 (1H, m), 4,20 (1H, d, J=15,0Гц), 4,75 (1H, d, J=6,6Гц), 7,43 (1H, bs). Аналіз обчислено для C20H32N2O9S: С, 50,41; Η, 6,77; Ν, 5,88. Знайдено: С, 50,30; Η, 6,82; Ν, 5,75. MS (ES) m/z 475,2 [M-Η] -. Підготовчий синтез 9 Диметиловий складний ефір (1R,4S,5S,6S)-4(2'S,6'-біс-трет-бутоксикарбоніламіногексаноїламіно)-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти 1 Одержують відповідно до Загальної методики А, використовуючи наявний на ринку N-BOCLys(BOC)-OH та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-дюксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (Підготовчий синтез 4). Нагрівають реакційну суміш зі зворотним холодильником протягом ночі. Очищають, використовуючи PC-TLC, ротор 4мм SіO2, елюент - градієнт від 10% етилацетату в гексані до 100% етилацетату. Вихід продукту у вигляді білої піни 1,04г (93%, 1,76ммоль). [α]23D=-32,0° (c=0,5, СНСI3). 1 Н ЯМР (300МГц, CDCI 3) δ 1,44 (9Н, s), 1,46 (9Н, s), 1,39-1,53 (3Н, m), 1,56-1,65 (1Н, m), 1,771,84 (2H, m), 2,50 (1H, t, J=4,4Гц), 2,98-3,20 (4H, m), 3,42 (1H, dd, J=3,7, 7,0Гц), 3,76 (3Н, s), 3,86 (3Н, s), 4,01 (1H, dd, J=7,7, 13,2Гц), 4,09-4,19 (1Н, m), 4,71 (1H, t, J=7,3Гц), 5,13 (1H, bs), 7,59 (1H, bs). Аналіз обчислено для C25H41N3O11S: С, 50,75; Η, 6,98; Ν, 7,10. Знайдено: С, 50,36; Η, 6,99; Ν, 6,87. MS (ES) m/z 590,2 [M-H] -. Підготовчий синтез 10 Диметиловий складний ефір (1R,4S,5S,6S)-4[2'S-трет-бутоксикарбоніламіно-4'-(тритилкарбамоїл)-бутириламіно]-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти 29 Одержують відповідно до Загальної методики А, використовуючи наявний на ринку N-ВОС-(1)глутамін (Trt)-OH та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (Підготовчий синтез 4). Нагрівають реакційну суміш зі зворотним холодильником протягом ночі. Очищають, використовуючи PC-TLC, ротор 4мм SiO2, елюент - градієнт від 10% етилацетату в гексані до 100% етилацетату. Вихід продукту у вигляді білої піни 0,53г (48%, 0,72ммоль). [α]23D=-8,0e (c=0,50, МеОН). 1 Н ЯМР (300МГц, CDCI 3) δ 1,42 (9Н, s), 1,831,88 (1Н, m), 2,03-2,18 (1H, m), 2,16 (1H, t, J=4,0Гц), 2,57-2,64 (1H, m), 2,60 (1H, d, J=15,0Гц), 2,64-2,80 (1H, m), 2,88 (1H, dd, J=4,4, 7,3Гц), 3,26 (1H, dd, J=4,0, 7,0Гц), 3,47 (3H, s), 3,76-3,90 (1H, m), 3,81 (3H, s), 4,05 (1H, d, J=15,0Гц), 5,47 (1H, bs), 7,02 (1H, bs), 7,20-7,35 (15H, m), 8,68 (1H, bs). Аналіз обчислено для C38H43N3O10S: С, 62,20; Η, 5,91; Ν, 5,73. Знайдено: С, 61,83; Η, 6,09; Ν, 5,57. MS (ES) m/z 731,9 [M-Η] -; HRMS обчислено для С38Н43Н3О10S [M+Na]+, 756,2567. Знайдено, 756,2585. Підготовчий синтез 11 Диметиловий складний ефір (1R,4S,5S,6S)-4[(1'-трет-бутоксикарбоніл-піролідин-2'S-карбоніл)аміно]-2,2-діоксо-2l 6-тіа-біцикло[3.1.0]гексан-4,6дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи наявний на ринку Вос-(L)пролін (0,61г, 2,9ммоль) та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (0,5г, 1,9ммоль, Підготовчий синтез 4). Очищають, використовуючи PC-TLC (елюент - суміш етилацетату з гексаном). Одержують 0,87г (99,2%) вказаної в заголовку сполуки. [α]23D=-61,2 (c=0,49, СНСI 3). 1 Н ЯМР (300МГц, CDCI 3) δ 1,51 (9Н, s), 1,751,98 (3H,m), 2,35-2,5 (2H, m), 2,84 (1H, d, J=14,7Гц), 2,9-3,03 (1H, m), 3,25-3,4 (1H, m), 3,3-4,1 (2H, m), 3,76 (3H, s), 3,86 (3H, s), 4,14-4,31 (2H, m), 8,66 (1H, s). MS (ES) m/z 459,2 [M-1]-. Підготовчий синтез 12 Диметиловий складний ефір (1R,4S,5S,6S)-4(2'S-трет-бутоксикарбоніламіно-4'мeтилcульфaнiл-бутиpилaмінo)-2,2-дioкco-2l 6-тiaбіциклo[3.1.0]гeкcaн-4,6-дикарбонової кислоти 80280 30 Одержують відповідно до Загальної методики А, використовуючи наявний на ринку Вос-(L)метіонін (0,71г, 2,9ммоль) та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (0,5г, 1,9ммоль, Підготовчий синтез 4). Очищають, використовуючи PC-TLC (елюент - суміш етилацетату з гексаном). Вихід 0,85г (90,5%) вказаної в заголовку сполуки. [α]23D=-20,4 (с=0,49, СНСI 3). 1 Н ЯМР (300МГц, CDCI 3) δ 1,46 (9Н, s), 1,69 (1Н, s), 1,8-2,05 (2H, m), 1,9-2,0 (1H, m), 1,95-2,3 (3H, bs), 2,0-2,2 (1H, m), 2,4-2,8 (2H, m), 2,48 (1H, t, J=4,0Гц), 2,58 (1H, bs), 2,92 (1H, d, J=14,7Гц), 3,01 (1H, dd, J=4,4, 7,0Гц), 3,42 (1H, dd, J=3,7, 7,3Гц), 3,78 (3H, s), 3,87 (3H, s), 4,22-4,24 (2H, m), 5,06 (1H, d, J=7,7Гц), 7,27 (1H, s). MS (ES) m/z 493,1 [M-1]-. Підготовчий синтез 13 Диметиловий складний ефір (1R,4S,5S,6S)-4[2'S-трет-бутоксикарбоніламіно-3'-(1-третбутоксикарбоніл-1Η-індол-3-іл)-пропіоніламіно]2,2-діоксо-2l 6-тіа-біцикло[3.1.0]гексан-4,6дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи наявний на ринку Вос-(L)триптофан(Вос) (1,1г, 2,8ммоль) та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо2l 6-тіа-біцикло[3.1.0]гексан-4,6-дикарбонової кислоти (0,5г, 1,9ммоль, Підготовчий синтез 4). Очищають, використовуючи PC-TLC (елюент етилацетат/гексан). Вихід 0,7г (56,7%) вказаної в заголовку сполуки. 1 Н ЯМР (300МГц, CDCI 3) δ 1,44 (9Н, s), 1,67 (9Н, s), 2,37 (1Н, bs), 2,86 (1Н, d, J=15,0Гц), 2,88 (1H, t, J=4,4Гц), 3,15 (2H, d, J=6,6Гц), 3,39 (1H, dd, J=3,7, 7,0Гц), 3,73 (3H, s), 3,83 (3H, s), 4,18 (1H, d, J=14,7Гц), 4,37-4,44 (1H, m), 5,01 (1H, bd, J=8,1Гц), 7,11 (1H, bs), 7,25-7,59 (4H, m), 8,14 (1H, bd, J=8,4Гц). [α]23D=-19,6 (c=0,51,CHCl3). Аналіз обчислено для С30Н39N3О11S·1,0 С4Н8О2: С, 55,35; Н, 6,42; N, 5,70. Знайдено: С, 54,98; Н, 6,09; N, 6,07. 31 HRMS обчислено для С30Н39N3О11Na1S, 672,2203. Знайдено, 672,2180. Підготовчий синтез 14 Диметиловий складний ефір (1R,4S,5S,6S)-4[2'S-трет-бутоксикарбоніламіно-3'-(4-третбутоксикарбонілокси-феніл)-пропіоніламіно]-2,2діоксо-2l6-тіа-біцикло[3.1.0]гексан-4,6дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи наявну на ринку 2S-третбутоксикарбоніламіно-3-(4-третбутоксикарбонілокси-феніл)-пропіонову кислоту (1,1г, 2,9ммоль) та диметиловий складний ефір (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (0,5г, 1,9ммоль, Підготовчий синтез 4). Очищають, використовуючи PC-TLC (елюент - суміш етилацетату з гексаном). Вихід 0,94г (79,0%) вказаної в заголовку сполуки. [α]23D=+4 (с=1,00, СН3ОН). 1 Н ЯМР (300МГц, CDCI 3) δ 1,44 (9Н, s), 1,56 (9Н, s), 2,44 (1Н, t, J=4,0Гц), 2,88 (1H, d, 3=14,7Гц), 2,98 (1H, dd, J=4,4, 7,3Гц), 3,04 (2H, d, J=7,3Гц), 3,38 (1H, dd, J=4,0, 7,3Гц), 3,77 (3H, s), 3,83 (3H, s), 4,11 (1H, d, J=14,3Гц), 4,22-4,29 (1H, app q, J=7,3Гц), 4,92 (1H, bd, J=7,7Гц), 7,07 (1H, bs), 7,17,26 (4H, m). HRMS обчислено для C28H38N2O12SNa: 649,2043. Знайдено: 649,2001. Підготовчий синтез 15 Диметиловий складний ефір (1R,4S,5S,6S)-4(3'-ацетокси-2'S-трет-бутоксикарбоніламінопропіоніл)аміно-2,2-діоксо-2l 6тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи 3-ацетокси-28-(третбутоксикарбоніламіно)пропіонову кислоту (0,25г, 1,0ммоль, Підготовчий синтез 44) та диметиловий складний ефір (1R,4S,5S,6S)-4-aмінo-2,2-дioкco2l 6-тia-біциклo[3.1.0]гeкcaн-4,6-дикapбoнoвoї кислоти (0,2г, 0,8ммоль, Підготовчий синтез 4), з тим винятком, що DMAP не використовують. Очищають, використовуючи PC-TLC (елюент - суміш етилацетату з гексаном). Вихід 0,19г (48,2%) вказаної в заголовку сполуки. [α]23D=-24 (c=1,0, СН3ОН). 1 Н ЯМР (300МГц, CDCl3) δ 1,47 (9Н, s), 2,10 (3Н, s), 2,51 (1Н, t, J=4,4Гц), 2,99-3,07 (2H, m), 3,43 80280 32 (1H, dd, 3-4,0, 7,3Гц), 3,77 (3Н, s), 3,86 (3Н, s), 4,144,40 (4H, m), 5,29 (1H, bd, J=7,3Гц), 7,64 (1H, bs). HRMS обчислено для C19H28N2O17SNa: 515,1312. Знайдено: 515,1305. Підготовчий синтез 16 Діетиловий складний ефір (lR,2S,4R,5R,6R)-2аміно-4-фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти До суспензії (1R,2S,4R,5R,6R)-2-аміно-4фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (14,45г, 71,12ммоль, патент США №5,958,960) у 202мл абсолютного етанолу при кімнатній температурі додають краплями тіонілхлорид (26мл, 356ммоль) протягом 20хв. Нагрівають суспензію зі зворотним холодильником при перемішуванні протягом 3год. Дають охолодитися до кімнатної температури і перемішують протягом ночі. Концентрують одержаний розчин у вакуумі, а залишок потім розбавляють 136мл етилацетату та обробляють 306мл 10% водного розчину карбонату натрію протягом 15хв. із збовтуванням вручну так, щоб кінцевий рН становив 10. Розділяють шари та промивають водний шар етилацетатом (1´136мл). Промивають об'єднані органічні екстракти розсолом (1´136мл), сушать (MgSO4), фільтрують і концентрують у вакуумі, одержуючи 17,07г (93%) вказаної в заголовку сполуки у вигляді білої твердої речовини. [α]23D=+20,37° (c=1,1, МеОН). Т.пл.=64-66°С. 1 Н ЯМР (400МГц, CDCI 3) δ 1,28 (3Н, t, J=7,3Гц), 1,31 (3Н, t, J=6,8Гц), 1,34-1,45 (1Н, m), 1,85 (2H, bs), 2,17-2,21 (2H, m), 2,32-2,34 (1Н, m), 2,49 (1H, dd, J=7,8, 14,1Гц), 4,24 (2H, dq, J=l,5, 7,3Гц), 5,33-5,52 (1H, m). Аналіз обчислено, для C12H18FNO4: С, 55,59; Η, 7,00; Ν, 5,40. Знайдено: С, 55,29; Η, 6,75; Ν, 5,45. MS (ES) m/z знайдено 260,3 [M+H]+. Підготовчий синтез 17 Діетиловий складний ефір (1R,2S,4R,5R,6R)-2[2'S-(трет-бутоксикарбоніламіно)пропіоніл]аміно-4фторбіцикло[3.1,0]гексан-2,6-дикарбонової кислоти До розчину N-Boc-L-аланіну (38,62г, 204ммоль) у 396мл метиленхлориду при -22°С у атмосфері азоту додають N-метилморфолін (22,44мл, 204ммоль), після чого краплями додають ізо-бутилхлорформіат (26,48мл, 204ммоль) протягом 15хв. так, щоб температура реакційної суміші не перевищувала -18°С. Перемішують одержану рідку суспензію при -20°С протягом 30хв., після чого додають розчин діетилового складного 33 ефіру (1R,2S,4R,5R,6R)-2-аміно-4фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (49,46г, 191ммоль, Підготовчий синтез 16) у 247мл метиленхлориду протягом 40хв. так, щоб температура реакційної суміші не перевищувала -16°C. Після завершення додавання відстороняють охолоджувальну баню, і перемішують реакційну суміш при температурі навколишнього середовища протягом 70хв., при цьому температура реакційної суміші досягає 15°С, а колір стає слабооранжевим. Обробляють реакційну суміш 408мл 1н. НСI та перемішують протягом 5хв., після чого розділяють шари. Промивають органічний шар насиченим водним розчином бікарбонату натрію (1´408мл), сушать (Na2SO4), фільтрують та випарюють у вакуумі, одержуючи білу піну (88,16г). Аналіз обчислено для C20H31FN2O7·0,1 СН2Сl2: С, 55,00; Н, 7,16; N, 6,38. Знайдено: С, 55,18; Н, 7,18; N, 6,49. MS (ES) m/z 431,3 [М+Н]+, 331,2 [М+Н-Вос]+. Підготовчий синтез 18 (1R,2S,4R,5R,6R')-2-[2'S-(третбутоксикарбоніламіно)пропіоніл]:aміно-4фторбіцикло[3.1.0]гексан-2,6-дикарбонова кислота До розчину діетилового складного ефіру (1R,2S,4R,5R,6R)-2-[2'S-(третбутоксикарбоніламіно)пропіоніл]-аміно-4фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (88,16г, 191ммоль, Підготовчий синтез 17) у 238мл THF при кімнатній температурі додають 238мл (477ммоль) 2-н. гідроксиду натрію. Інтенсивно перемішують одержану двофазну суміш при кімнатній температурі протягом 2,5 год; за цей час реакційна суміш стає однорідною. Розбавляють суміш 238мл метил-трет-бутилового простого ефіру, після чого перемішують та розділяють шари. Додатково розбавляють водний шар 238мл води та фільтрують для видалення дрібнодисперсної твердої речовини. Факультативно обробляють одержаний розчин концентрованою НСI (42,9мл, 515ммоль) протягом 30хв., після чого вносять затравку вказаної в заголовку сполуки та перемішують протягом 1год. Фільтрують одержану суспензію, промивають водою (2´100мл) і сушать у вакуумі при 45°С протягом 40год., одержуючи 72,2г вказаної в заголовку сполуки у вигляді білої твердої речовини. Перемішують частину цієї твердої речовини (69,5г) із 490мл ацетону протягом 1год., одержуючи мутний розчин; фільтрують і промивають ацетоном (2´100мл). Концентрують фільтрат у вакуумі, одержуючи білу піну, яку додатково сушать у вакуумі при 45°С протягом 16год. до одержання 61,8г (86%, з поправкою на 12% (мас.) ацетону) вказаної 80280 34 в заголовку сполуки. Цей матеріал використовують в Прикладах 14-18 без визначення характеристик. Підготовчий синтез 19 Діетиловий складний ефір (1S,2S,4S,5R,6R)-4ацетилокси-2-(третбутоксикарбоніл)амінобіцикло[3.1.0]гексан-2,6дикарбонової кислоти До розчину діетилового складного ефіру (1S,2S,4S,5R,6R)-2-(трет-бутоксикарбоніл)аміно-4гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (1,50г, 4,20ммоль, [патент США №5,958,960]), піридину (0,365мл, 4,62ммоль) та DMAP (0,513г, 4,20ммоль) у дихлорметані (40мл) додають в атмосфері азоту оцтовий ангідрид (0,514мл, 5,0ммоль). Перемішують при кімнатній температурі протягом 16год., розбавляють дихлорметаном і виливають у 10% водний розчин лимонної кислоти (50мл). Промивають органічний шар водою (50мл) та розсолом (50мл). Сушать над MgSO4, фільтрують та випарюють у вакуумі, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини (1,295г, 75%). LCMS: m/z 400 [М+Н]+ та m/z 300 [М+Н СО2tВи]+, RT=1,39хв. Підготовчий синтез 20 Діетиловий складний ефір (1S,2S,4S,5R,6R)-4ацетилокси-2-амінобіцикло[3.1.0]гексан-2,6дикарбонової кислоти Розчиняють діетиловий складний ефір (1S,2S,4S,5R,6R)-4-ацетилокси-2-(третбутоксикарбоніл)амінобіцикло-[3.1.0]гексан-2,6дикарбонової кислоти (1,25г, 3,13ммоль, Підготовчий синтез 19) у розчині 95% TFA у дихлорметані (60мл) та перемішують в атмосфері азоту при кімнатній температурі протягом 5 хв. Після цього видаляють суміш TFA з дихлорметаном у вакуумі. Розчиняють неочищений продукт у суспензії NaHCО3 (1,00г) у дихлорметані (50мл) та перемішують протягом 30хв. Фільтрують суспензію, промивають дихлорметаном (3x25мл) та випарюють у вакуумі, одержуючи 916мг (98%) продукту у вигляді жовтого масла. LCMS: m/z 300 [М+Н]+, RT=0,92хв. Підготовчий синтез 21 Діетиловий складний ефір (1S,2S,4S,5S,6S)-4ацетилокси-2-[2'S-(третбутокси)карбоніламінопропіоніл]амінобіцикло[3.1.01гексан-2,6-дикарбонової кислоти 35 До суспензії діетилового складного ефіру (1S,2S,4S,5R,6R)-4-ацетилокси-2амінобіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (0,80г, 1,94ммоль, Підготовчий синтез 20) та Boc-L-Ala (0,477г, 2,52ммоль) у безводному дихлорметані (50мл) в атмосфері азоту послідовно додають EDC (0,519г, 2,72ммоль), HOBt (0,314г, 2,32ммоль), каталітичну кількість DMAP (0,024г, 0,19ммоль) та триетиламін (1,08мл, 7,76ммоль). Після перемішування при кімнатній температурі протягом приблизно 15хв. вихідна біла суспензія повністю розчиняється. Перемішують реакційну суміш протягом 16год., розбавляють дихлорметаном та промивають насиченим водним розчином NаНСО3 (50мл), 1,0-н. водним розчином НСI (3´20мл) та концентрованим сольовим розчином (40мл). Сушать органічний шар над MgSO4, фільтрують та випарюють у вакуумі. Очищають одержаний неочищений амід хроматографією на колонці, використовуючи як елюент суміш етилацетату та гексану (4:1). Вихід продукту у вигляді білої твердої речовини 638мг (75%). 1 Н ЯМР (CD3OD)*: δ 5,05 (1Н, d, 5,7Гц), 4,09 (2H, q, 7,3Гц), 4,02 (2Н, q, 7,3Гц), 4,01-3,94 (1Н, m), 2,65-2,59 (2Н, m), 2,38 (1Н, d, 14Гц), 2,10-2,03 (3Н, m), 1,91 (3Н, s), 1,78 (1Н, dd, 5,9Гц, 16Гц), 1,59 (1Н, br s), 1,34 (9Н, s), 1,16 (6Н, 2´t, 7,3Гц); *Примітка: Кількість замінюваних протонів, що не спостерігаються ЯМР=2. LCMS: m/z 471 [М+Н]+ та m/z 371 [М+Н СО2tВu]+, RT=1,30хв. Rf=0,50 (елюент - 80% етилацетат:гептан). Підготовчий синтез 22 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2аміно-4-гідроксибіцикло[3.1.0]гексан-2,6дикарбонової кислоти Охолоджують розчин діетилового складного ефіру (1S,2S,4S,5R,6R)-2-третбутоксикарбоніламіно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (5,0г, 14,0ммоль, [патент США №5,958,960]) у етилацетаті до 0°С. Барботують через розчин безводний газоподібний НСI до насичення та перемішують протягом 0,5год. Дають можливість реакційній суміші нагрітися до кімнатної температури та перемішують протягом 1год. Концентрують реакційну суміш, і розподіляють залишок між етилацетатом та Н2О. Обробляють водний шар водним розчином NаНСО3 та екстрагують етилацетатом. Сушать органічну фазу K2СО3 та 80280 36 концентрують, одержуючи 2,2г (59,7%) білої твердої речовини. [α]23D=-30,8 (c=0,52, СН3ОН). 1 Н ЯМР (300МГц, CDCI 3) δ 1,26 (3Н, t, J=7,33Гц), 1,36 (3H, t, 7,33Гц), 1,60 (1Н, dd, J=5,87, 15,40Гц), 1,64 (1Н, t, J=2,93Гц), 2,27 (2Н, bs), 2,152,29 (3Н, m), 3,93 (1Н, bs), 4,13 (2H, q, J=6,97Гц), 4,27-4,36 (3Н, m). Аналіз обчислено для C12H19NO5: С, 56,02; Η, 7,44; Ν, 5,44. Знайдено: С, 55,75; Η, 7,36; Ν, 5,40. MS (ES) m/z 258,1 [M+H]+. Підготовчий синтез 23 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2(2'-бутокси-карбоніламіно-ацетиламіно)-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Вос-гліцин (458 мг, 2,62ммоль, Aldrich) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (450мг, 1,75ммоль, Підготовчий синтез 22). Очищають на силікагелі (35г), елюювання з градієнтом від 50/50 до 20/80 гексану в етилацетаті. Вихід: 560мг (77%). 1 Н ЯМР (400МГц, CDCI 3) δ 1,28 (3Н, t, J=7,3Гц), 1,29 (3H, t, J=7,3Гц), 1,48 (9H, s), 1,57 (2Н, m), 2,21 (1Н, m), 2,41 (1H, dd, J=2,9, 5,8Гц), 2,81 (1H, d, J=15,6Гц), 3,76 (1H, d, J=5,8Гц), 4,104,18 (3Н, m), 4,26 (2H, q, J=7,3Гц), 4,33 (3Н, m), 5,10 (1H, bs), 6,86 (1H,bs). Аналіз обчислено для C19H30N2O8: С, 55,06; Η, 7,30; Ν, 6,76. Знайдено: С, 55,24; Η, 7,50; Ν, 6,76. MS (ES) m/z 415,2 [M+H]+, 437,2 [M+Na]+. Підготовчий синтез 24 Діетиловий складний ебір (1S,2S,4S,5R,6R)-2(2'S-трет-бутоксикарбоніламіно-3'-метилбутириламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-валін (569мг, 2,62ммоль, Sigma) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (450мг, 1,75ммоль, Підготовчий синтез 22). Очищають неочищений матеріал на силікагелі (35г); елюювання з градієнтом від 70/30 до 20/80 гексану в етилацетаті. Вихід: 694мг (87%) у вигляді білої піни. 37 1 Н ЯМР (400МГц, CDCI 3) δ 0,95 (3Н, d, J=6,8Гц), 1,00 (3Н, d, J=6,8Гц), 1,29 (6Н, t, J=7,3Гц), 1,45 (9Н, s), 1,52-1,60 (2Н, m), 2,08 (1Н, m), 2,20 (1H, m), 2,42 (1H, m), 2,81 (1H, d, J=15,6Гц), 3,86 (1Н, dd, J=6,3, 8,8Гц), 4,14 (2H, q, J=7,3Гц), 4,214,32 (4H, m), 5,00 (1H, d, J=8,3Гц), 6,63 (1H, s). Аналіз обчислено для C22H36N2O8: С, 57,88; Н, 7,95; N, 6,14. Знайдено: С, 57,87; Н, 8,03; N, 6,12. MS (ES) m/z 457,2 [М+Н]+, 479,2 [M+Na]+. Підготовчий синтез 25 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'S-трет-бутоксикарбоніламіно-4'-метилпентаноїламіно)-4-гідрокси-біцикло[3.1.0]гексан2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-лейцин (606 мг, 2,62ммоль, Chemlog) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (450мг, 1,75ммоль, Підготовчий синтез 22). Очищають неочищений матеріал на силікагелі (35г); елюювання з градієнтом від 70/30 до 20/80 гексану в етилацетаті. Вихід 689мг (84%) у вигляді білої піни. 1 Н ЯМР (400МГц, CDCI 3) δ 0,96 (6Н, m), 1,28 (3Н, t, J=7,3Гц), 1,29 (3H, t, J=7,3Гц), 1,46 (9H, s), 1,45-1,73 (5Н, m), 2,20 (1Н, m), 2,42 (1H, m), 2,80 (1H, d, J=16,1Гц), 4,07-4,35 (7H, m), 4,81 (1H, bd), 6,86 (1H, bs). Аналіз обчислено для C23H38 N2O8·0,1H2O: С, 58,48; Η, 8,15; Ν, 5,93. Знайдено: С, 58,22; Η, 7,94; Ν, 5,92. MS (ES) m/z 471,2 [M+H]+, 493,2 [M+Na]+. Підготовчий синтез 26 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'S-трет-бутоксикарбоніламіно-3>8-метилпентаноїламіно)-4-гідрокси-біцикло[3.1.0]гексан2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-ізолейцин (606 мг, 2,62ммоль, Aldrich) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідрокси 80280 38 біцикло[3.1.0]гексан-2,6-дикарбонової кислоти (450мг, 1,75ммоль, Підготовчий синтез 22). Очищають неочищений матеріал на силікагелі (35г), елюювання з градієнтом від 70/30 до 20/80 гексану в етилацетаті. Вихід: 731мг (89%). 1 Н ЯМР (400МГц, CDCI 3) δ 0,92 (3Н, t, J=7,3Гц), 0,97 (3Н, d, J=6,8Гц), 1,17 (1Н, m), 1,29 (6H, t, J=6,8Гц), 1,46 (9H, s), 1,53 (1H, dd, J=5,8, 15,6Гц), 1,58 (1H, t, J=2,4Гц), 1,74 (1H, m), 1,83 (1H, m), 2,20 (1H, m), 2,43 (1H, m), 2,80 (1H, d, J=15,6Гц), 3,88 (1H, dd, J=7,3, 8,8Гц), 4,12-4,32 (6H, m), 4,98 (1H, d, J=7,3Гц), 6,60 (1H, s). Аналіз обчислено для C23H38 N2O8·0,2H2O: С, 58,25; Η, 8,16; Ν, 5,91. Знайдено: С, 58,17; Η, 8,11;Ν, 5,91. MS (ES) m/z 471,2 [M+H]+, 493,2 [M+Na]+. Підготовчий синтез 27 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'-(2-трет-бутоксикарбоніламіно-ацетиламіно)ацетиламіно]-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Вос-Gly-Gly (474мг, 2,04ммоль) та гідрохлорид діетилового складного ефіру (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (400мг, 1,36ммоль, Підготовчий синтез 22 без обробки основою) з такими відмінностями: не .використовують DMAP. Додають 1екв. триетиламіну. Очищають неочищений матеріал на силікагелі (35г); елюювання етилацетатом. Вихід: 517мг (81%). [α]23D=-18,18 (c=0,55, МеОН). 1 Н ЯМР (300МГц, CDCI 3) δ 1,26 (3Н, t, J=6,8Гц), 1,27 (1Н, t, J=7,3Гц), 1,28 (3Н, t, J=6,8Гц), 1,46 (9H, s), 1,59 (1Н, t, J=3,4Гц), 1,62 (1H, dd, J=6,3, 16,1Гц), 2,21 (1H, dd, J=2,9, 5,8Гц), 2,46 (1H, dd, J=2,4, 5,8Гц), 2,73 (1H, d, J=15,6Гц), 3,78-3,91 (3Н, m), 4,01-4,15 (3Н, m), 4,24 (2H, q, J=6,8Гц), 4,32 (1H, d, J=5,8Гц), 5,28 (1H, b), 6,87 (1H, bt, J=4,9Гц), 7,39 (1H, bs). HRMS обчислено для C21H34N3O9: 472,2295. Знайдено: 472,2303. HPLC: 16,755хв. Колонка: Symmetry C18, 3,5мкм, 4,6´150мм. l=230нм. Швидкість потоку: 1мл/хв. Градієнт складу елюента: від 10% до 50% ACN/вода з домішкою 0,1%TFA протягом 25хв. Підготовчий синтез 28 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'-(2S-трет-бутоксикарбоніламіно-пропіоніламіно)ацетиламіно]-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти 39 Одержують відповідно до Загальної методики А, використовуючи Вос-Ala-Gly (502мг, 2,04ммоль) та гідрохлорид діетилового складного ефіру (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (400мг, 1,36ммоль, Підготовчий синтез 22 без обробки основою) з такими відмінностями: не використовують DMAP. Додають 1екв. триетиламіну. Очищають неочищений матеріал на силікагелі (35г), елюювання етилацетатом. Вихід: 500мг (76%). [α]23D=-31,37 (c=0,55, МеОН). 1 Н ЯМР (300МГц, CDCI 3) δ 1,27 (3Н, t, J=6,8Гц), 1,28 (3H, t, J=6,8Гц), 1,42 (3Н, d, J=6,8Гц), 1,45 (9H, s), 1,58 (1Н, t, J=3,4Гц), 1,64 (1H, dd, J=5,8, 15,6Гц), 2,23 (1H, dd, J=3,4, 5,8Гц), 2,50 (1H, dd, J=2,9, 6,3Гц), 2,69 (1H, d, J=15,6Гц), ABq дублетов (2Н, vA=3,87, vB=3,98 Jab=17,1Гц, Jd=6,3Гц), 3,92 (1H, m), 4,07-4,16 (3H, m), 4,24 (2H, q, J=7,3Гц), 4,32 (1H, b), 5,08 (1H, b), 6,84 (1H, bt, J=4,88Гц), 7,14 (1H, bs). HRMS обчислено для С22Н36N3О9: 486,2452. Знайдено: 486,2451. Підготовчий синтез 29 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2-(2'-трет-бутоксикарбоніламіно-3'-фенілпропіоніламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-фенілаланін (772мг, 2,91ммоль) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (480мг, 1,94ммоль, Підготовчий синтез 22). Концентрують неочищену реакційну суміш, розчиняють залишок у дихлорметані, пропускають через коротку колонку із силікагелем, елюент етилацетат/DCM (1:1), та випарюють у вакуумі з одержанням жовтого масла. Додатково очищають матеріал хроматографією на силікагелі з елююванням градієнтом від 30% до 80% етилацетату в гексані, одержуючи 852мг (87%) вказаної в заголовку сполуки. [α]23D=-23,66 (c=0,93, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,22-1,30 (6Н, m), 1,35 (9Н, s), 1,59 (1Н, t, J=2,9Гц), 1,70 (1H, dd, J=5,5, 15,4Гц), 2,06 (1H, m), 2,40 (1H, d, J=15,4Гц), 80280 40 2,63 (1Н, dd, J=2,9, 5,9Гц), 2,76 (1H, dd, J=9,2, 13,9Гц), 4,08-4,33 (6H, m), 7,20-7,29 (5H, m). MS знайдено: 505,0 [M+H]+. HRMS обчислено для C26H36N2O8: 505,2550. Знайдено: 505,2559. Підготовчий синтез 30 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'-трет-бутоксикарбоніламіно-4'-(тритилкарбамоїл)-бутириламіно]-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-глутамін(тритил)-ОН (1,40г, 2,86ммоль) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (490мг, 1,90ммоль, Підготовчий синтез 22), з тією відмінністю, що DMAP не використовують. Концентрують неочищену реакційну суміш, розчиняють залишок у дихлорметані, пропускають через коротку колонку із силікагелем, елюент - етилацетат, та випарюють у вакуумі з одержанням жовтого масла. Додатково очищають хроматографією на силікагелі з елююванням градієнтом від 30% етилацетату в гексані до 100% етилацетату, одержуючи 1,3г (94%) вказаної в заголовку сполуки. [α]23D=-21,28 (c=0,94, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,18-1,26 (6Н, m), 1,44 (9Н, s), 1,62-1,74 (3Н, m), 1,91-2,00 (1Н, m), 2,05 (1H, m), 2,38-2,48 (3H, m), 2,54 (1H, m), 4,004,27 (6H, m), 7,18-7,30 (15H, m). MS знайдено: 728,2 [M+H]+. HRMS обчислено для C41H49N3O9: 728,3547. Знайдено: 728,3533. Підготовчий синтез 31 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2(2'S,6'-біс-трет-бутоксикарбоніламіногексаноїламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-лізин(Вос)-ОН (910мг, 2,63ммоль) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0.]гексан-2,6-дикарбонової кислоти (450мг, 1,75ммоль, Підготовчий синтез 22), з тією 41 відмінністю, що DMAP до реакційної суміші не додають. Концентрують неочищену реакційну суміш, розчиняють залишок у дихлорметані, пропускають через коротку колонку із силікагелем, елюент етилацетат, та випарюють у вакуумі з одержанням жовтого масла. Додатково очищають матеріал хроматографією на силікагелі з елююванням сумішшю етилацетат/гексан (1:1), одержуючи 800мг (78%) вказаної в заголовку сполуки. [α]23D=-30,19 (с=0,53, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,21-1,24 (6Н, m), 1,26-1,77 (27Н, m), 2,07 (1Н, m), 2,42 (1H, d, J=15,8Гц), 2,59 (1H, dd, J=2,6, 5,5Гц), 3,03 (1H, t, J=6,2Гц), 3,99 (1H, m), 4,07-4,28 (5H, m). MS знайдено: 586,1 [M+H]+. HRMS обчислено для C28H47N3O10: 586,3340. Знайдено: 586,3348. Підготовчий синтез 32 Діетиловий складний edtip (1S,2S,4S,5R,6R)-2[2'-трет-бутоксикарбоніламіно-3'-тритилкарбамоїл)-пропіоніламіно]-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-аспарагін(тритил)-ОН (1,35г, 2,84ммоль) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (476мг, 1,85ммоль, Підготовчий синтез 22), з тією відмінністю, що DMAP до реакційної суміші не додають. Концентрують неочищену реакційну суміш, розчиняють залишок у дихлорметані, пропускають через коротку колонку із силікагелем, елюент етилацетат, та випарюють у вакуумі з одержанням жовтого масла. Додатково очищають матеріал хроматографією на силікагелі з елююванням градієнтом від 20% до 50% етилацетату в гексані, одержуючи 1,07г (81%) вказаної в заголовку сполуки. [α]23D=-25,45 (с=0,55, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,19-1,26 (6Н, m), 1,45 (9Н, s), 1,61-1,69 (2Н, m), 2,05 (1Н, m), 2,44 (1H, d, J=15,4Гц), 2,51-2,72 (3H, m), 4,02-4,21 (4H, m), 4,25 (1H, d, J=5,5Гц), 4,36 (1H, dd, J=4,8, 8,8Гц), 7,18-7,30 (15H, m). MS знайдено: 714,1 [M+H]+. HRMS обчислено для C40H47N3O9: 714,3391. Знайдено: 714,3380. Підготовчий синтез 33 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'-трет-бутоксикарбоніламіно3'-(1'-трет-бутоксикарбоніл-1H-індол-3'-iл)пpoпіoнiлaмінo]-гiдpoкcи-біцикло[3.1.0]гексан-2,6дикарбонової кислоти 80280 42 Одержують відповідно до Загальної методики А, використовуючи Boc-L-триптофан(Вос)-ОН (1,18г, 2,91ммоль) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0.]гексан-2,6-дикарбонової кислоти (520 мг, 1,90ммоль, Підготовчий синтез 22). Концентрують неочищену реакційну суміш, розчиняють у дихлорметані, пропускають через коротку колонку із силікагелем, елюент - етилацетат, та випарюють у вакуумі з одержанням жовтого масла. Додатково очищають матеріал хроматографією на силікагелі з елююванням етилацетатом/DCM (1:1), одержуючи 1,2г (92%) вказаної в заголовку сполуки. [α]23D=-12,5 (c=0,96, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,18-1,27 (6Н, m), 1,34 (9Н, s), 1,62 (1Н, t, J=2,9Гц), 1,67 (9H, s), 1,74 (1H, dd, J=5,9, 15,2Гц), 2,07 (1H, m), 2,46 (1H, d, J=15,7Гц), 2,60 (1H, d, J=2,9, 5,9Гц), 2,89 (1H, dd, J=9,3, 15,0Гц), 3,16 (1H, dd, J=4,9, 15,2Гц), 4,044,12 (2H, m), 4,18-4,24 (2H, m), 4,27 (1H, d, J=5,4Гц), 4,43 (1H, dd, J=5,4, 9,3Гц), 7,26 (2H, m), 7,52 (1H, s), 7,64 (1H, d, J=7,3Гц), 8,10 (1H, d, J=8,3Гц). MS знайдено: 644,8 [M+H]+, 666,8 [M+Na]+. HRMS обчислено для C33H44N3O10: 666,3002. Знайдено: 666,2988. Підготовчий синтез 34 Діетиловий складний ефір (lS,2S,4S,5R,6R)-2(1'-трет-бутоксикарбоніл-піролідин-2'S-карбоніл)-4гідрокси-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи Boc-L-пролін та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4гідрокси-біцикло[3.1.0.]гексан-2,6-дикарбонової кислоти (Підготовчий синтез 22). Очищають неочищений матеріал на системі ISCO із силікагелем (110г) з елююванням градієнтом від 80% етилацетату в гексані до 100% етилацетату, одержуючи 699мг (84%) вказаної в заголовку сполуки. [α]23D=-52,53 (c=0,99, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,26 (6Н, m), 1,44 (9Н, s), 1,62 (1Н, m), 1,73 (1H, dd, J=5,4,15,3Гц), 1,84 (1H, m), 1,97 (1H, m), 2,07 (4H, m), 2,41 (1H, d, 43 J= 15,3Гц), 2,50 (1H, m), 2,59 (1H, m), 4,12 (2H, m), 4,20 (1H, q, J=7,4Гц), 4,27 (1H, d, J=5,4Гц). MS знайдено: 454,9 [M+H]+, 476,8 [M+Na]+. HRMS обчислено C22H34N2O8Na: 477,2213. Знайдено: 477,2210. Підготовчий синтез 35 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'S-трет-бутоксикарбоніламіно-3'-(4-третбутоксикарбонілокси-феніл)-пропіоніламіно]-4гідрокси-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують вказану в заголовку сполуку відповідно до Загальної методики А, використовуючи 28-тре/и-бутоксикарбоніламіно-3-(4-третбутоксикарбонілокси-феніл)-пропіонову кислоту та діетиловий складний ефір (1S,2S,4S,5R,6R)-2аміно-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти (Підготовчий синтез 22). Очищають неочищений матеріал на системі ISCO із силікагелем (110г) з елююванням градієнтом від 60% до 90% етилацетату в гексані, одержуючи 1,09г (91%) вказаної в заголовку сполуки. [α]23D=-12 (c=l,0, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,25 (6Н, m), 1,37 (9Н, s), 1,52 (9Н, s), 1,68 (1Н, dd, J=5,4, 15,3Гц), 2,06 (1H, m), 2,38 (1H, d, J=15,3Гц), 2,64 (1H, m), 2,79 (1H, dd, J=8,4, 13,9Гц), 3,05 (1H, dd, J=5,4, 13,9Гц), 4,20 (6H, m), 7,04 (2H, d, J=8,4Гц), 7,26 (2H, d, J=8,4Гц). MS знайдено 621,8 [M+H]+, 643,8 [M+Na]+. HRMS обчислено для C31H44 N2O11Na: 643,2843. Знайдено: 643,2845. Підготовчий синтез 36 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2(2'8-трет-бутоксикарбоніламіно-4'-метилсиланілбутириламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти Вказану в заголовку сполуку одержують відповідно до Загальної методики А, використовуючи (Boc-L-метіонін) та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3,1.0]гексан-2,6-дикарбонової кислоти 80280 44 (Підготовчий синтез 22). Неочищений матеріал очищають на системі ISCO із силікагелем (110г) з елююванням градієнтом від 80% етилацетату в гексані до 100% етилацетату, одержуючи 1,0г (92%) вказаної в заголовку сполуки. [α]23D=-30 (с=1,0, МеОН). 1 Н ЯМР (400МГц, CD3OD) δ 1,26 (6Н, m), 1,43 (9Н, s), 1,84 (6Н, m), 2,06 (1Н, m), 2,2 (1Н, m), 2,48 (1H, m), 2,61 (1H, m), 3,37 (1H, m), 2,49 (1H, m), 4,2 (6H, m). MS знайдено: 488,8 [M+H]+, 510,8 [M+Na]+. HRMS обчислено для C22H36N2O8SNa: 511,2090. Знайдено: 511,2071. Підготовчий синтез 37 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2(2'S-трет-бутоксикарбоніламіно-пропіоніламіно)-4гідрокси-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи наявний на ринку N-ВОС-(І)аланін та діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (Підготовчий синтез 22). Нагрівають реакційну суміш зі зворотним холодильником протягом ночі. Очищають препаративною HPLC, колонка 1´500г SiO2, елюент - градієнт від 10% етилацетату в гексані до 100% етилацетату. Вихід 3,0г (90%, 7,0йммоль) у вигляді білої піни. [α]23D=-32,31e (c=0,37, СНСI 3). 1 Н ЯМР (300МГц, CDCI 3) δ 1,28 (6Н, t, J=7,3Гц), 1,34 (3H, d, J=7,3Гц), 1,46 (9H, s), 1,511,58 (2Н, m), 1,64 (1Н, s), 2,19 (1H, dd, J=3,3, 6,2Гц), 2,40 (1H, dd, J=2,9, 6,2Гц), 2,80 (1H, d, J=15,8Гц), 4,10-4,36 (6H, m), 4,92 (1H, bs), 6,94 (1H, bs). Аналіз обчислено для C20H32 N2O8·0,1H2O: С, 55,83; Η, 7,54; Ν, 6,51. Знайдено: С, 55,57; Η, 7,64; Ν, 6,44. MS (ES) m/z 429,2 [M+H]+, 329,1 [M-Bo]+. Підготовчий синтез 38 Гідрохлорид діетилового складного ефіру (1S,2S,4S,5R,6R)-2-[2'S-аміно-пропіоніламіно)-4гідрокси-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти Продувають розчин діетилового складного ефіру (1S,2S,4S,5R,6R)-2-(2'S-третбутоксикарбоніламіно-пропіоніламіно)-4-гідрокси 45 біцикло[3.1.0]гексан-2,6-дикарбонової кислоти (2,95г, 6,88ммоль, Підготовчий синтез 37) в етилацетаті (30мл) при 0°С безводним газоподібним НСI до насичення розчину НСI. Перемішують одержану реакційну суміш при 0°С до завершення реакції за даними TLC. Продувають реакційну суміш протягом 30хв. N2 для видалення надлишку газоподібного НСI. Концентрують одержану суспензію досуха у вакуумі, одержуючи 2,47г (98%, 6,78ммоль) бажаного аміногідрохлориду. Додаткове очищення не потрібне. [α]23D=-28,0e (с=0,50, МеОН). 1 Н ЯМР (300МГц, CDCI 3) δ 1,24 (3Н, t, J=7,0Гц), 1,28 (3H, t, J=7,3Гц), 1,50 (3Н, d, J=7,3Гц), 1,61 (1H, t, J=2,9Гц), 1,76 (1H, dd, J=5,9, 15,8Гц), 2,10 (1Н, dd, J=3,3, 5,9Гц), 2,43 (1Н, d, J=15,4Гц), 2,60 (1Н, dd, J=2,9, 6,2Гц), 3,90 (1Н, q, J=7,0, 13,9Гц), 4,15 (2H, q, J=7,3Гц), 4,14-4,31 (3H, m). Аналіз обчислено для С15Н24 N2О6·НСI·0,7Н2О: С, 47,73; Η, 7,05; Ν, 7,42. Знайдено: С, 47,96; Η, 6,91; Ν, 7,04. MS(ES) m/z 329,1 [Μ+Η]+. Підготовчий синтез 39 Діетиловий складний ебіо (1S,2S,4S,5R,6R)-2[2'S-(2S-трет-бутоксикарбоніламінопропіоніламіно)пропіоніламіно]-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики А, використовуючи гідрохлорид діетилового складного ефіру (1S,2S,4S,5R,6R)-2-(2'S-амінопропіоніламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти (0,2г, 0,55ммоль, Підготовчий синтез 38) та Boc-(L)-аланін (0,16г, 0,82ммоль), з тією відмінністю, що DMAP не використовують. Очищають, використовуючи PC-TLC (суміш етилацетату з гексаном). Вихід 0,13г (47,3%) вказаної в заголовку сполуки. [α]23D=-46,2 (c=0,52, СНСІ 3). 1 Н ЯМР (300МГц, CDCI 3) δ 1,27 (3Н, t, J=7,0Гц), 1,28 (3H, t, J=7,0Гц), 1,36 (3Н, d, J=7,0Гц), 1,37 (3Н, d, J=7,0Гц), 1,44 (9H, s), 1,58-1,65 (2Н, m), 2,19 (1Н, dd, J=3,0, 5,9Гц), 2,46 (1H, dd, J=2,6, 5,9Гц), 2,70 (1H, d, І=15,4Гц), 4,09-4,33 (7H, m), 4,48 (1H, app p, J=7,0Гц), 5,05 (1H, bd, J=6,6Гц), 6,79 (1H, bd, J=7,7Гц), 7,26 (1H, s). HRMS обчислено для С23Н38N3О9: 500,2608. Знайдено: 500,2598. Підготовчий синтез 40 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'S-[2-трет-бутоксикарбоніламіно-ацетиламіно)пропіоніламіно]-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти 80280 46 Одержують відповідно до Загальної методики А, використовуючи Вос-гліцин (0,29г, 1,6ммоль) та гідрохлорид діетилового складного ефіру (1S,2S,4S,5R,6R)-2-(2'8-аміно-пропіоніламіно)-4гідрокси-біцикло[3.1.0]-гексан-2,6-дикарбонової кислоти (0,4г, 1,1ммоль, Підготовчий синтез 38), з тією відмінністю, що DMAP не використовують. Очищають, використовуючи PC-TLC (елюент етилацетат/гексан). Вихід 0,14г (26,2%) вказаної в заголовку сполуки. [α]23D=-14 (c=1,00, CDCI 3). 1 H ЯМР (300МГц, CDCI 3) δ 1,27 (3Н, t, J=7,3Гц), 1,29 (3H, t, J=7,3Гц), 1,38 (3Н, d, J=7,0Гц), 1,45 (9H, s), 1,57-1,65 (2Н, m), 2,19 (1Н, dd, J=3,3, 5,9Гц), 2,44 (1H, dd, J=2,9, 5,9Гц), 2,74 (1H, d, J=15,8Гц) 3,70-3,86 (2H, m), 4,08-4,34 (6H, m), 4,56 (1H, app p, J=7,0Гц), 5,31 (1H, bs), 6,88 (1H, bd, J=7,0Гц), 7,50 (1H, s). HRMS обчислено для С22Н36N3О9: 486,2452. Знайдено: 486,2444. Підготовчий синтез 41 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'-(2S-трет-бутоксикарбоніламіно-4-метилпентаноїламіно)-пропіоніламіно]-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики В, використовуючи наявний на ринку N-ВОС-(L)лейцинмоногідрат та гідрохлорид діетилового складного ефіру (1S,2S,4S,5R,6R)-2-(2'S-амінопропіоніламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6дикарбонової кислоти (0,2г, 0,55ммоль, Підготовчий синтез 38). Очищають, використовуючи PCTLC, 4мм ротор SіO2, (градієнт від 10% етилацетату в гексані до 100% етилацетату). Вихід продукту у вигляді білої піни 0,54г (62%, 1,00ммоль). [α]23D=-61,2° (c=0,49, МеОН). 1 Н ЯМР (300МГц, CDCI 3) δ 0,93 (3Н, d, J=6,2Гц), 0,94 (3H, d, J=6,2Гц), 1,25 (3Н, t, J=7,3Гц), 1,27 (3Н, t, J=7,3Гц), 1,36 (3Н, d, J=7,0Гц), 1,43 (9H, s), 1,53 (1Н, d, J=9,5Гц), 1,55-1,69 (5H, m), 2,18 (1Н, dd, J=2,9, 5,9Гц), 2,44 (1H, dd, J=2,9, 6,2Гц), 2,70 (1H, d, J=15,8Гц), 4,06 (1H, bs), 4,13 (4H, q, J=7,3Гц), 4,18-4,28 (2H, m), 4,31 (1H, d, J=5,9Гц), 4,41-4,45 (1H, m), 4,85 (1H, bs), 6,57 (1H, d, J=7,3Гц), 6,97 (1H, bs). 47 Аналіз обчислено для С26H43 N3O9·0,1H2O: С, 57,46; Η, 8,01; Ν, 7,73. Знайдено: С, 57,18; Η, 8,00; Ν, 7,64. HRMS обчислено для C26H43N3O9 [M+Na]+: 564,2897. Знайдено: 564,2922. Підготовчий синтез 42 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2[2'-(2S-трет-бутоксикарбоніламіно-3-метилбутириламіно)-пропіоніламіно]-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти Одержують відповідно до Загальної методики В, використовуючи наявний на ринку N-ВОС-(1)валін та гідрохлорид діетилового складного ефіру (1S,2S,4S,5R,6R)-2-(2'S-аміно-пропіоніламіно)-4гідрокси-біцикло[3.1.0]-гексан-2,6-дикарбонової кислоти (0,2г, 0,55ммоль, Підготовчий синтез 38). Очищають, використовуючи PC-TLC, ротор 4мм SiO2, елюент - градієнт від 10% до 67% етилацетату в гексані). Вихід продукту у вигляді білої піни 0,36г (43%, 0,68ммоль). [α]23D= -65,5° (с=0,58, МеОН). 1 Н ЯМР (300МГц, CDCI 3) δ 0,91 (3Н, d, J=7,0Гц), 0,97 (3H, d, J=6,6Гц), 1,27 (3Н, t, J=7,3Гц), 1,28 (3Н, t, J=7,0Гц), 1,37 (3Н, d, J=17,3Гц), 1,44 (9H, s), 1,54-1,61 (3Н, m), 2,12-2,20 (2Н, m), 2,42 (1Н, dd, J=2,6, 5,9Гц), 2,70 (1H, d, J=15,4Гц), 3,90 (1H, t, J=6,6Гц), 4,13 (2H, q, J=7,0Гц), 4,20-4,29 (2H, m), 4,31 (1H, d, J=5,9Гц), 4,40-4,48 (1H, m), 4,93 (1H, bs), 6,41 (1H, d, J=7,3Гц), 6,91 (1H, bs). Аналіз обчислено для С25H41 N3O9·0,2CH2Cl2: С, 55,58; Η, 7,66; Ν, 7,72. Знайдено: С, 55,76; Η, 7,27; Ν, 7,49. MS (ES) m/z 528,3 [M+H]+. Підготовчий синтез 43 Діетиловий складний ефір (1S,2S,4S,5R,6R)-2(2'S-ацетиламіно-пропіоніламіно]-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти До розчину гідрохлориду діетилового складного ефіру (1S,2S,4S,5R,6R)-2-(2'S-амінопропіоніламіно)-4-гідрокси-біцикло[3.1.0]-гексан2,6-дикарбонової кислоти (0,30г, 0,82ммоль, Підготовчий синтез 38) у СН2СІ 2 (30мл) при 0°С додають при перемішуванні послідовно триетиламін (0,16г, 1,6ммоль), а потім ацетилхлорид (0,10г, 80280 48 1,18ммоль). Дають можливість реакційній суміші нагріватися при перемішуванні протягом ночі. Розбавляють реакційну суміш етилацетатом (700мл) і промивають водним розчином NaHSO4 та розсолом. Сушать органічний шар над сульфатом магнію. Очищають, використовуючи PC-TLC, ротор 4мм SiO2, елюент - градієнт від 10% етилацетату в гексані до 100% етилацетату, одержуючи 0,24г (79%, 0,65ммоль) продукту у вигляді білої піни. [α]23D=-48° (c=0,5, МеОН). 1 Н ЯМР (300МГц, CDCI 3) δ 1,27 (3Н, t, J=7,3Гц), 1,28 (3H, t, J=7,3Гц), 1,37 (3Н, d, J=7,0Гц), 1,55-1,62 (2H, m), 1,99 (3Н, s), 2,19 (1Н, dd, J=3,3, 6,6Гц), 2,40 (1H, dd, J=2,6, 5,9Гц), 2,77 (1H, d, J=15,8Гц), 4,07 (2H, q, J=7,0Гц), 4,21-4,31 (2H, m), 4,33 (1H, d, J=6,2Гц), 4,43-4,47 (1H, m), 6,13 (1H, bs), 7,06 (1H, bs). Аналіз обчислено для С17Н26N2О7: С, 55,13; Η, 7,08; Ν, 7,56. Знайдено: С, 55,05; Η, 7,12; Ν, 7,29. HRMS обчислено для С17Н26N2О7 [M+Na]+: 393,1638. Знайдено: 393,1644. Підготовчий синтез 44 3-ацетокси-25-(третбутоксикарбоніламіно)пропіонова кислота Додають N-метилморфолін (2,8г, 27,2ммоль) та ди-трет-бутил-дикарбонат (5,8г, 25,2ммоль) до розчину О-ацетил-L-серину (3,7г, 25,2ммоль) у суміші діоксан:вода (1:1). Перемішують реакційну суміш протягом 24год., після чого розподіляють між етилацетатом та водою. Екстрагують водну фазу етилацетатом та відкидають органічні речовини. Доводять рН до 0-1 водним розчином NaHSO4. Екстрагують водну фазу етилацетатом, сушать над Na2SO4, фільтрують і випарюють у вакуумі. Очищають флеш-хроматографією, вихід 2,6г (41,7%). Матеріал використовують в Підготовчому синтезі 15 без визначення характеристик. Підготовчий синтез 45 (1S,5R)-3-(трет-бутоксикарбоніламіно)-3-(третбутоксикарбоніл)-6-оксабіцикло[3.1.0]гексан Додають розчин трет-бутилметилмалонату (129г, 0,75моль) в THF (385мл) до суспензії LiH (14,9г, 1,875моль) у THF (900мл) та Ν,Νдиметилпропіленсечовини (DMPU, 155г, 1,2моль) протягом 30хв., підтримуючи температуру в межах 0-5°С. Нагрівають реакційну суміш до 65°С та додають розчин цис-1,4-дихлор-2-бутену (95%, 100г, 0,8моль, 1,08екв.) у THF (100мл) протягом 5,5год., підтримуючи температуру у межах 63-67°С. Перемішують реакційну суміш протягом 4год. при 65°С. Обробляють реакційну суміш сумішшю води з МТВЕ і одержують 1-(метоксикарбоніл)-1-(третбутоксикарбоніл)циклопент-3-ен. 49 1 Н ЯМР (300МГц, CDCI 3) δ 5,57 (s, 2H, CH=CH), 3,71 (s, 3Н, СН3), 2,95 (s, 4H, 2СН2), 1,42 (s, 9H, С(СН3)3). ІЧ (плівка) 1734 (С=0), 1646, 1268, 1149см-1. Охолоджують реакційний розчин, що містить 1-(метоксикарбоніл)-1-(третбутоксикарбоніл)циклопент-3-ен, до 10-15°С та додають до охолодженого розчину (10-15°С) 1-н. NaOH (1,3л, 1,3моль) протягом 30хв. Перемішують реакційний розчин при 25°С протягом 24год. та контролюють хід реакції газовою хроматографією. Після завершення реакції гідролізу додають до реакційної суміші МТВЕ (645мл), та перемішують одержаний розчин протягом 5хв. Дають можливість шарам осісти та розділитися. Відкидають органічний шар. Додають 1,5Μ розчин NaHSO4 (1470мл) для надання водному шару кислої реакції (рН 2-3). Додають МТВЕ (1,3л) та розділяють шари. Екстрагують водний шар МТВЕ (385мл) та промивають об'єднані органічні шари 5% розчином LiСІ. Концентрують органічний шар у вакуумі, та розбавляють залишок гептаном (780мл). Концентрують одержаний розчин до об'єму приблизно 500мл, і перемішують одержану суспензію 1год. при температурі навколишнього середовища. Відфільтровують тверду речовину, промивають гептаном (250мл) і сушать у вакуумі при 35°С, одержуючи 103,29г (вихід 61%) 1-(карбонова кислота)1-(трет-бутоксикарбоніл)-циклопент-3-ену у вигляді білої твердої речовини. Т.пл.=119оС. 1 Н ЯМР (300МГц, CDCI 3), δ 5,61 (s, 2H, CH=CH), 3,00 (s, 4Н, 2СН2), 1,46 (s, 9H, С(СН3)3). ІЧ: 3800-3000 (br, СООН), 1741 (CO2R), 1705 (СО2Н), 1283), 1149см-1. Розчиняють 1-(карбонова кислота)-1-(третбутоксикарбоніл)циклопент-3-ен (50г, 236ммоль) у 850мл суміші толуол:МТВЕ (70:30) в атмосфері азоту у колбі місткістю 1л, обладнаній механічною мішалкою. Додають тіонілхлорид (33,6г, 283ммоль, 1,2екв.) до перемішуваної реакційної суміші, підтримуючи температуру 23°С. Охолоджують реакційний розчин до 0-5°С, та додають краплями триетиламін (32,2г, 318ммоль, 1,35екв.) протягом 30хв. Нагрівають реакційну суміш до 23°С і перемішують протягом 1год. Додають реакційну суміш швидко краплями до деіонізованої води (625мл), підтримуючи температуру у межах 20-25°С. Розділяють шари, та промивають органічний шар 500мл 1Μ розчину NaHCO3. Концентрують органічний шар, одержуючи 1-(хлоркарбоніл)-1-(третбутоксикарбоніл)циклопент-3-ен у вигляді світложовтої рідини. 1 Н ЯМР (300МГц, CDCI 3) δ 5,61 (s, 2H, CH=CH), 3,04 (арр q, J=15,1Гц, 4Н, 2СН2), 1,49 (s, 9H, С(СН3)3). ІЧ (плівка) 1796 (СОСІ), 1743 (CO2R), 1274,1233, 1158см-1. Додають розчин гідросульфату тетрабугаламонію (0,81г, 2,4ммоль) у деіонізованій воді (700мл) до азиду натрію (20,16г, 310ммоль). Додають розчин 1-(хлоркарбоніл)-1-(третбутоксикарбоніл)циклопент-3-ену у суміші МТВЕ/толуол до розчину азиду протягом 45хв. Перемішують реакційну суміш протягом 3год. при 23°С до повного витрачання 1-(хлоркарбоніл)-1 80280 50 (трет-бутоксикарбоніл)циклопент-3-ену, що посвідчує газохроматографічний аналіз реакційного розчину. Розділяють шари та промивають органічний шар 1Μ NaHCO3 (540мл) та деіонізованою водою (540мл, потім 270мл). Сушать органічний шар Na2SO4 та фільтрують. Концентрують одержаний розчин у вакуумі, і одержують 1-(ацилазид)1-(трет-бутоксикарбоніл)циклопент-3-ен у вигляді масла. 1 Н ЯМР (300МГц, CDCI 3) δ 5,58 (s, 2H, CH=CH), 2,96 (арр t, J=2,3Гц, 4Н, 2СН2), 1,46 (s, 9H, С(СН3)3). ІЧ (плівка) 2137 (CON3), 1720 (CO2R), 1246 (s, 1185, 1136см-1. Додають розчин 1-(ацилазид)-1-(третбутоксикарбоніл)циклопент-3-ену протягом 1год. до 110мл толуолу при 95°С. В цих умовах вивільнення газоподібного азоту регулюють швидкістю додавання. Дистилюють МТВЕ з реакційної суміші протягом додавання. Перемішують реакційну суміш протягом 1год. при 95°С і дають можливість охолодитися до 23°С протягом ночі. Випарюють розчинник у вакуумі, одержуючи 1-(ізоціанат)-1(трет-бутоксикарбоніл)циклопент-3-ен у вигляді масла. 1 Н ЯМР (300МГц, CDCI 3) δ 5,67 (s, 2H, CH=CH), 3,01 (d, J=15,6Гц, 2H), 2,61 (d, J=15,6Гц, 2H), 1,50 (s, 9Н, С(СН3)3). ІЧ (плівка) 2258 (-NCO), 1732 (-CO2R), 1157см-1. Додають трет-бутанол (35г, 471ммоль) до розчину трет-бутилату натрію (1M в THF, 471мл, 471ммоль) у атмосфері азоту. Охолоджують реакційний розчин до 0-5°С та додають розчин толуолу, що містить 1-(ізоціанат)-1-(третбутоксикарбоніл)циклопент-3-ен, протягом 60хв., підтримуючи температуру у межах 0-10°С. Нагрівають реакційну суміш до 23°С, перемішують протягом 2год., і пересвідчуються газохроматографічним аналізом у зникненні ізоціанатного вихідного матеріалу. Додають реакційну суміш до суміші деіонізованої води (1,2л) та МТВЕ (1,2л) при 15°С. Перемішують одержаний розчин протягом 20хв. та розділяють шари. Промивають органічний шар 20% сольовим розчином (250мл), та розділяють шари. Відділяють органічний шар і концентрують його дистиляцією до об'єму приблизно 250мл. Додають гептан (500мл), і концентрують одержаний розчин до загального об'єму 250мл. Охолоджують одержану суспензію до 0°С, перемішують протягом 2год. і фільтрують. Промивають осад на фільтрі холодним гептаном (2´100мл) і сушать у вакуумі, одержуючи 34,54г 1-(третбутоксикарбоніламіно)-1-(третбутоксикарбоніл)циклопент-3-ен у вигляді білої твердої речовини (вихід в розрахунку на 1(карбонова кислота)-1-(третбутоксикарбоніл)циклопент-3-ен 52%) Т.пл. 87-89°С. 1 Н ЯМР (500МГц, CDCI 3) δ 5,63 (s, 2H, CH=CH), 5,1 (bs, 1Н, NH), 2,99 (d, J=17,2Гц, 2H), 2,57 (d, J=16,OГц, 2Н), 1,46 (s, 9H), 1,44 (s, 9H). 13 С ЯМР (CDCI 3) δ 173,3, 154,9, 127,7, 81,1, 64,5, 44,8, 28,3, 27,8. 51 ІЧ (KВr): 3451, 2981, 2932, 1712, 1489, 1369, 1154см-1. MS (FIA) m/e (% відносної інтенсивності) 284,2 (M++1,56), 228,2 (73), 172,1 (97), 128,0 (100). Додають розчин 1-(третбутоксикарбоніламіно)-1-(третбутоксикарбоніл)циклопент-3-ену (20,00г, 71ммоль) у 100мл EtOAc до суміші гідросульфату тетрабутиламонію (4,08г, 10ммоль, 0,17екв.), гідрату монопероксифталату магнію (ММРА, 52,4г, 4,76% активного кисню=2,1екв.) та деіонізованої води (100мл). Перемішують реакційну суміш протягом 19 год. Додають до реакційної суміші розчин сульфіту натрію (18г) у деіонізованій воді (100мл) протягом 30хв. Розбавляють суміш 100мл EtOAc та розділяють шари. Промивають органічний шар деіонізованою Н2О (100мл), 2-н. NaOH (2´100мл) та деіонізованою Н2О (2´100мл). Дистилюють органічний шар при 75-90°С під атмосферним тиском до об'єму залишку 40мл. Охолоджують одержаний розчин до 75°С та додають гарячий гептан (120мл). Охолоджують розчин до 65°С та факультативно вносять затравку бажаного продукту. Дають можливість одержаній суспензії охолодитися до температури навколишнього середовища і потім охолоджують на водяній бані протягом 1 год. Відфільтровують продукт і промивають 80мл холодної суміші гептан: EtOAc (4:1), після чого сушать у вакуумі при 40°С, одержуючи 15,45г (вихід 73%) вказаної в заголовку сполуки у вигляді білої твердої речовини. Сполука може бути додатково очищена перекристалізацією із суміші ізопропанол:вода (2:1), т.пл. 130-133°С. 1 Н ЯМР (500МГц, CDCI 3) δ 5,0 (bs, 1H), 3,58 (s, 2H), 2,41 (d, J=15,3Гц, 2H), 2,20 (d, J=15,2Гц, 2H), 1,43 (s, 9H), 1,40 (s, 9H). 13 C ЯМР (CDCI 3) δ 171,3, 154,3, 81,2, 79,5, 62,8, 57,0, 38,6, 28,3, 27,7. ІЧ (KBr): 3453, 2982, 2932, 1726, 1708, 1489, 1369, 1293, 1156, 840см-1. MS (FIA) m/e (% відносної інтенсивності) 300,3 (Μ++1,65), 244,4 (68), 188,2 (100) 144,1 (99). Підготовчий синтез 46 Дигідрохлорид (1R,3R)-1,3ди(метилбензиламіно)пропану Нагрівають (R)-α-метилбензиламін (98% ее, 121г, 1моль) до 100°С у атмосфері азоту. Додають краплями дибромпропан (25,4мл, 50,5г, 250ммоль) протягом 70хв. Нагрівають суміш протягом додаткових 3год. і потім охолоджують до 80°С. Додають краплями концентрований (50%) розчин NaOH (30мл) протягом 10хв. Додають воду (30мл) для розчинення твердої фази, і дають суміші можливість охолодитися до кімнатної температури протягом 30хв. Додають МТВЕ (100мл). Розчиняють осад доданням 100мл води, і розділяють шари. Промивають органічний шар 50мл розсолу, сушать (Na2SO4), і випарюють у вакуумі з одержанням 126,0г світло-жовтого масла. Дистилюють одержане масло у вакуумі при 70°С (температура головки 80280 52 колонки), використовуючи 12-дюймову колонку, для видалення надлишку (R)-α-метилбензиламіну. Розчиняють кубовий залишок (68г неочищеного діаміну) в 1л і-РrОН у колбі місткістю 2л, обладнаній механічною мішалкою. Додають краплями концентровану НСI (12М, 45мл, 540ммоль) протягом 10хв. Додають додатково 100мл i-РrОН для забезпечення ефективного перемішування густої суспензії. Перемішують суміш протягом 90хв. і фільтрують. Промивають осад i-РrОН і сушать у вакуумі при 40°С, одержуючи 64,32г (вихід 72% в розрахунку на дибромпропан) вказаної в заголовку сполуки у вигляді білої твердої речовини. 1 Н ЯМР (500МГц, DMSO-d6) δ 9,93 (bs, 2H), 9,47 (bs, 2H), 7,56 (d, J=7,0Гц, 4Н), 7,37 (m, 6H), 4,27 (m, 2H), 2,84 (m, 2H) 2,48 (m, 2H), 2,1 (m, 2Н), 1,56 (d, J=6,7Гц, 6Н). Підготовчий синтез 47 (1S)-1-трет-бутоксикарбоніламіно)-1-(третбутоксикарбоніл)-циклопент-4-ен-3-он Розчиняють дигідрохлорид (1R,3R)-1,3ди(метилбензиламіно)пропану (24,65г, 69,3ммоль, Підготовчий синтез 46) у 150мл води при перемішуванні. Додають до розчину 35мл (175ммоль) 5н. розчину NaOH, потім 150мл МТВЕ. Після перемішування протягом 15хв. розділяють шари та екстрагують водний шар 100мл МТВЕ. Промивають об'єднані органічні шари 100мл розсолу, сушать (Na2SO4) та випарюють у вакуумі, одержуючи 18,06г (вихід 92%) 1R,3Rди(метилбензиламіно)пропану у вигляді безбарвного масла. У чотиригорлій колбі місткістю 500мл, обладнаній введеною зверху мішалкою, розчиняють 20,59г (73,5ммоль) 1R,3R-ди(метилбензиламіно)пропану у суміші безводного МТВЕ та THF (по 30мл кожного) при продуванні азотом. Охолоджують розчин до -45°С, і додають краплями протягом 17хв. 59мл (147ммоль) розчину n-BuLi (2,5Μ у гексані). Перемішують світло-жовтий розчин протягом 2год. при -45°С. Додають краплями розчин (1S,3S,5R)-3-(трет-бутоксикарбонілiаміно)-3-(третбутоксикарбоніл)-6-оксабіцикло[3.1.0]гексану (10,00г, 33,4ммоль) у 55мл безводного THF протягом 28хв., підтримуючи температуру нижче -40°С. Ополіскують крапельну лійку додатковими 5мл THF. Перемішують реакційну суміш протягом 18год. при -45°С і потім гасять доданням краплями 4-н. водного розчину сірчаної кислоти (75мл). Відстороняють охолоджувальну баню після завершення додання кислоти. Розділяють шари та екстрагують водний шар 50мл МТВЕ. Промивають об'єднані органічні шари водою та розсолом (по 50мл кожного), сушать Na2SO4 і випарюють у вакуумі, одержуючи 9,78г неочищеної сполуки 578242 у вигляді білої твердої речовини. Розчиняють цю тверду речовину в 33мл гарячого МТВЕ, і додають порціями гептан (66мл). Дають можливість перемішуваному розчину охолодитися до кімнатної 53 температури, після чого перемішують суміш протягом 1год. при 0°С. Відфільтровують тверду речовину, промивають 2´10мл холодної суміші гептан:МТВЕ (2:1) і сушать у вакуумі протягом 4год. при 35°С, одержуючи 8,52г (вихід 85%) (18,ЗК)-1(трет-бутоксикарбоніламіно)-1-(третбутоксикарбоніл)-3-гідроксициклопент-4-ену у вигляді білої твердої речовини. Т.пл. 111-112°С. Чистота за даними HPLC на хіральному сорбенті: 99,7% ее. [α]D=+114 (c 1, MeOH). 1 Н ЯМР (500МГц, CDCI 3) δ 6,1 (bs, 1H), 5,9 (bs, 1H), 5,55 (d, J=5,0Гц, 1H), 4,8 (m, 1H), 4,44 (d, J=10,5Гц, 1Н), 2,87 (dd, J=14,5, 7,5Гц, 1Н), 2,00 (d, J=14,5Гц, 1H), 1,45 (s, 9H), 1,42 (s, 9H). ІЧ (KBr): 3413, 2983, 1703, 1491, 1370, 1309, 1255, 1155, 1055см-1. MS (FIA) m/e (% відносної інтенсивності) 300,3 (М++1,15), 226,2 (29), 170,1 (100), 126,1 (89), 108,3 (20). Додають 2,2,6,6-тетраметил-1-піперидинілокси (вільний радикал) (TEMPO) (0,84г, 5,3ммоль) та KВr (0,63г, 5,3ммоль, у 2мл води) до розчину (1S,3R)-1-(трет-бутоксикарбоніламіно)-1-(третбутоксикарбоніл)-3-гідроксициклопент-4-ену (20г, 66,8ммоль) в МТВЕ (200мл). Охолоджують реакційну суміш до 0°С, і додають краплями розчин NaOCl (3,14%, 240г, 100ммоль), що містить NаНСО3 (8,4г), підтримуючи температуру нижче 5°С. Перемішують реакційну суміш 1год. при 0°С та дають можливість нагрітися до кімнатної температури. Розділяють шари, та екстрагують водний шар МТВЕ (2´200мл). Промивають об'єднані органічні шари 200мл 1-н. розчину НСI, що містить 2,21г ΚΙ, потім 10% розчином Na2SO3 (200мл). Промивають органічний шар водою (2´200мл) та випарююють досуха у вакуумі. Розчиняють неочищений продукт в МТВЕ (60мл) при 50°С та кристалізують доданням гептану (200мл) протягом 1год. Охолоджують суміш до 0°С протягом 2год. і потім фільтрують. Промивають осад на фільтрі 100мл холодної суміші гептан:МТВЕ (65:35) і сушать у вакуумі, одержуючи 16,99г (вихід 89%) вказаної в заголовку сполуки у вигляді білої твердої речовини, т.пл. 116-118°С. [α]D=+123 (с 1, MeOH). 1 Н ЯМР (500МГц, CDCI 3) δ 7,4 (bs, 1Η), 6,32 (d, J=5,5Гц, 1H), 5,6 (bs, 1H), 2,87 (d, J=18,2Гц, 1H), 2,9 (d, J=18,2Гц, 1H), 1,43 (s, 18H). 13 C ЯМР (CDCI 3) δ 206,1, 170,2, 160,8, 154,9, 136,1, 84,5, 66,1, 46,6, 28,9, 28,4. ІЧ (KВr): 3419, 2983, 1722, 1487, 1730, 1300, 1259, 1151, 1012см-1. MS (FIA) m/e (% відносної інтенсивності) 254,2 (М++1,11), 242,3 (18), 228,2 (13), 186,1 (76), 143,2 (11), 242,3 (100). Підготовчий синтез 48 Бромід 1-(2-трет-бутокси-2оксоетил)тетрагідротіофенію 80280 54 У скляному апараті місткістю 22л додають протягом 30-60хв. трет-бутилбромацетат (2,44л, 16,52моль, 1екв.) до розчину тетрагідротіофену (2,19л, 24,8моль, 1,5екв.) в ацетоні (11,38л), підтримуючи температуру у межах 15-25°С за допомогою водяної бані. Перемішують реакційну суміш протягом 22год., і досліджують пробу методом 1Н ЯМР для підтвердження завершення реакції. Відфільтровують осад, промивають ацетоном (2л) і сушать у вакуумі протягом 3 діб при 28-33°С, одержуючи 4,328кг (вихід 92,5%) вказаної в заголовку сполуки. 1 Н ЯМР (500МГц, DMSO d6) δ 4,40 (s, 1H), 3,51 (m, 2H), 3,48 (m, 2H), 2,23 (m, 2H), 2,13 (m, 2H), 1,42 (s, 9H). Підготовчий синтез 49 Ди-трет-бутиловий складний ефір (1S,2S,5R,6R)-2-(трет-бутоксикарбоніламіно)-4оксо-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти Додають KOtBu (трет-бутилат калію (42мл, 42ммоль, 1Μ розчин в THF, 2,5екв.) до охолодженого до 0°С розчину броміду 1-(2-трет-бутокси-2оксоетил)тетрагідротіофенію (11,9г, 42ммоль, 2,5екв., Підготовчий синтез 48) в ацетонітрилі (30мл) у атмосфері N2 протягом 10хв., підтримуючи температуру нижче 5°С. Перемішують молочнобілий розчин в холодному стані протягом 1,5год. Додають краплями трифторетанол (6,9г, 69ммоль, 4,1екв.). Додають розчин (1S)-1-(третбутоксикарбоніламіно)-1-(трет-бутокси-карбоніл)циклопент-4-ен-3-ону (5г, 16,8ммоль, Підготовчий синтез 47) та трифторетанол (13,3г, 132ммоль, 7,9екв.) в ацетонітрилі (20мл) протягом 5хв., підтримуючи температуру у межах 3-5°С. Перемішують розчин протягом 4,5год. при 0-5°С. Додають МТВЕ (155мл) та H2О (80мл) до холодної реакційної суміші. Розділяють шари, і промивають органічний шар Н2О (50мл), потім 20% розсолом (50мл). Концентрують органічний шар дистиляцією під атмосферним тиском до приблизно 30мл. Додають гептан (100мл), і концентрують розчин. В разі потреби додають додаткову кількість гептану, доки температура парів дистиляту не досягне 93°С. Додають THF (65мл), і одержують розчин вказаної в заголовку сполуки. Підготовчий синтез 50 Ди-трет-бутиловий складний ефір (1S,2S,5R,6R)-2-(трет-бутоксикарбоніламіно)-4оксо-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти Додають 1,7л насиченого водного розчину K2СО3 до охолодженого до 0°С розчину броміду 1(2-трет-бутокси-2-оксоетил)тетрагідротіофенію (757г, 2,67моль, Підготовчий синтез 48) у 2,2л СН2СІ 2, підтримуючи температуру нижче 10°С. Після перемішування двофазної суміші протягом 1,5год., додають порціями 223мл 50% розчину NaOH, підтримуючи температуру нижче 5°С. Перемішують суміш протягом 3год. і фільтрують. Промивають сіль СН2СІ 2. Розділяють шари, та екстрагують водний шар 600мл СН2СІ 2. Сушать 55 об'єднані органічні шари над твердим K2СО3 і випарюють у вакуумі, одержуючи 533,3г (вихід 98%) (2-трет-бутокси-2-оксоетил)тетрагідротіофенію у вигляді блідо-жовтого масла. При зберіганні у холодильнику одержане масло кристалізується, утворюючи жовтувату тверду речовину, т.пл. 4850°С. 1 H ЯМР (500МГц, CDCI 3) δ 3,12 (m, 2H), 3,00 (m, 2H), 2,85 (s, 1H), 2,41 (m, 2H), 1,84 (m, 2H), 1,38 (s, 9H). Додають 474мл (6,5моль, 10екв.) трифторетанолу до охолодженого до 0°С розчину (1S)-1-(третбутоксикарбоніламіно)-1-(трет-бутоксикарбоніл)циклопент-4-ен-З-ону (194г, 653ммоль) у 650мл СН2СІ 2. Додають краплями розчин (2-трет-бутокси2-оксоетил)тетрагідротіофенію (396г, 1,96моль) у 325мл СН2СІ 2 протягом 40хв., підтримуючи температуру нижче 10°С. Відстороняють льодяну баню через 1год. Додають деіонізовану воду (680мл), та розділяють шари. Екстрагують водний шар 400мл СН2СІ 2. Промивають об'єднані органічні шари 500мл розсолу, сушать Na2SO4 та випарюють у вакуумі, одержуючи 587г маслянистої твердої речовини бурштинового кольору. Розчиняють цю тверду речовину в 400мл СН2СІ 2 та пропускають через шар силікагелю (1,6кг), використовуючи як елюент суміш 5:1:1 гексан:метил-трет-бутиловий простий ефір:СН2СІ 2; одержують елюат у загальній кількості 13,2л. Випарюють елюат, одержуючи 398,7г білої твердої речовини. Розчиняють цю тверду речовину в 3л суміші 70:30 гексан:МТВЕ при кипінні. Дають можливість розчину охолодитися до кімнатної температури протягом ночі, після чого охолоджують на льодяній бані протягом 1год. Відфільтровують тверді речовини, промивають холодним розчинником (приблизно 700мл), і сушать у вакуумі при 35°С, одержуючи 173г (вихід 64%) ди-трет-бутилового складного ефіру (1S,2S,5R,6R)-2-(трет-бутоксикарбоніламіно)-4оксо-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти у вигляді білої твердої речовини. Т.пл. 144-146°С. [α]D=+30,5 (с 1, СНСI 3). 1 Н ЯМР (500МГц, CDCI 3) δ 5,36 (d, 1H), 2,88 (m, 1H), 2,64 (dd, J=5,2, 3,2Гц, 1H), 2,37 (d, J=2,7Гц, 1H), 2,23 (bs, 1H), 1,45 (s, 9H), 1,43 (s, 18H). 13 C ЯМР (125МГц, CDCI 3) δ 206,2, 171,2, 168,5, 155,3, 83,4, 82,7, 80,7, 61,2, 43,2, 36,0, 34,3, 28,4, 28,2, 28,0, 25,3. ІЧ (CHCI 3): 2982, 1744, 1719, 1485, 1394, 1309см-1. MS (ES+) m/e (% відносної інтенсивності) 412,2 (M++1, 79), 356,2 (50), 300,1 (97), 276,1 (68), 244,1 (100). Аналіз обчислено для C21H33NO7 (411,29): С, 61,30; Н, 8,08; N, 3,40. Знайдено: С, 61,32; Н, 8,04; N, 3,51. Підготовчий синтез 51 Ди-трет-бутиловий складний ефір (1S,2S,4S,5R,6R)-2-(трет-бутоксикарбоніламіно)-4гідрокси-біцикло[3.1.01гексан-2,6-дикарбонової кислоти 80280 56 Охолоджують розчин із Підготовчого синтезу 49 до 0°С у атмосфері азоту і додають краплями три-втор-бутилборгідрид літію (L-Selectride, 1Μ у THF, 21мл, 21ммоль). Перемішують реакційну суміш протягом 45хв. при 0°С. Додають краплями 2Μ розчин карбонату натрію (31мл), підтримуючи температуру нижче 8°С. Додають розчин 30% Н2О2 (7,15г, 63ммоль) у 20мл води, підтримуючи температуру нижче 15°С. Після перемішування протягом 10хв. додають МТВЕ (210мл) та деіонізовану воду (100мл). Розділяють шари, і промивають органічний шар насиченим розчином Nа2SО3 (40мл) та 1Μ розчином NaHSO4 (40мл). Концентрують органічний шар дистиляцією під атмосферним тиском до об'єму приблизно 90мл. Продовжують дистиляцію та додають гептан для підтримування постійного об'єму. Коли температура парів дистиляту досягне 93°С, охолоджують цей розчин до 70°С, і додають 7мл THF. Охолоджують розчин до 0°С і перемішують протягом 1год. Відфільтровують тверду речовину, промивають холодним гептаном (10мл) і сушать у вакуумі при 50°С, одержуючи 4,68г (вихід 67%) ди-трет-бутилового складного ефіру (1S,2S,4S,5R,6R)-2-(третбутоксикарбоніламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти у вигляді білої твердої речовини. Т.пл. 187-88°С. 1 Н ЯМР (CDCI 3, 500МГц) δ 5,31 (bs, 1H), 4,38 (d, JАВ=10,5Гц, 1H), 4,30 (dd, J=11,0, 6,0Гц, 1H), 2,68 (d, J=15,3Гц, 1H), 2,17 (m, 1H), 2,07 (m, 1H), 1,58 (m, J=15,2Гц, 1H), 1,45 (s, 9H), 1,44 (s, 9H)S 1,43 (s, 9H). 13 C ЯМР (75МГц, CDCI 3) δ 175,2, 170,5, 155, 83,2, 81,3, 80,1, 73,7, 66,9, 43,1, 36,0, 34,4, 29,3, 28,3, 28,1, 27,4, 22,1. ІЧ (CHCI 3): 3445, 2982, 1714, 1485, 1361см-1. MS (ES+) m/e (% відносної інтенсивності) 414,2 (M++1, 58), 358,1 (75), 302,1 (78), 246,0 (100). [α]D=-28,6 (с 1, MeOH). Підготовчий синтез 52 (1R,2S,4R,5R,6R)-2-(2'S-2'-(третбутоксикарбоніламіно)пропіоніл)аміно-4-фторбіцикло[3.1.0]гексан-2,6-дикарбонова кислота Додають розчин ди-трет-бутилового складного ефіру (1S,2S,4S,5R,6R)-2-(третбутоксикарбоніламіно)-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (25,00г, 60,5ммоль, Підготовчий синтез 51) у СН2СІ 2 (230мл) до охолодженого до -78°С розчину реактиву Deoxofluor™ (16,05г, 72,6ммоль, 1,2екв.) 57 у СН2СІ 2 (105мл) протягом 2год. Перемішують реакційну суміш протягом 1,5год. та додають додатково 1,66г реактиву Deoxofluor™. Перемішують розчин 30хв. та дають можливість нагрітися до 10°С. Додають краплями насичений розчин NаНСО3 (105мл) протягом 20хв., підтримуючи температуру нижче 5°С. Доводять рН водного шару до 7 доданням 160мл насиченого розчину NаНСО3. Дають можливість суміші нагрітися до температури навколишнього середовища, і розділяють шари. Екстрагують водний шар 100мл СН2СІ 2. Промивають об'єднані органічні шари 250мл розсолу, після чого сушать Na2SO4. Видаляють розчинник у вакуумі, і додають до неочищеного продукту гептан (75мл). Нагрівають одержану суміш при 50°С до повного розчинення твердої речовини, і розчин перемішують при температурі навколишнього середовища протягом 24 год. Охолоджують суміш до 0°С на льодяній бані та фільтрують. Промивають одержаний продукт холодним гептаном і сушать у вакуумі, одержуючи 20,23г (вихід 80%) ди-трет-бутилового складного ефіру (1R,2S,4R,5R,6R)-2-(трет-бутоксикарбоніламіно)-4фтор-біцикло[3.1.0]гексан-2,6-дикарбонової кислоти у вигляді білої твердої речовини. Т.пл. 140-143°С. [α]D=+20,6 (с 1, СНСІ 3). 1 Н ЯМР (CDCI 3, 500МГц) δ 5,45 (dd, JH-F=56, JHН=4,8Гц, 1H), 5,28 (bs, 1H), 3,00 (m, 1H), 2,23 (bs, 1H), 2,11 (m, 1H), 2,08 (m, 1H), 1,46 (s, 9H), 1,45 (s, 9H), 1,43 (s, 9H), 1,37 (m, 1H). 13 C ЯМР (CDCI 3, 75МГц) δ 177,7, 170,5, 155,0, 94,4, 92,0, 82,2, 81,5, 80,2, 64,7, 37,7, 33,2, 29,7, 29,3, 28,3, 28,1, 27,8, 20,4. MS (ES+) m/e (% відносної інтенсивності) 416,2 (M++1,66), 360,1 (67), 304,1 (100), 248,0 (60). ІЧ (СНСІ 3): 3444, 2981, 1715, 1485, 1369см-1. Додають краплями SOCI 2 (21,29г, 13,05мл, 0,179моль, 5екв.) до розчину ди-трет-бутилового складного ефіру (1R,2S,4R,5R,6R)-2-(третбутоксикарбоніламіно)-4-фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (14,87г, 0,036моль) у EtOH (абсолютному, 149мл) протягом 10хв. без охолодження для підтримання легкого кипіння розчину. Нагрівають розчин із зворотним холодильником протягом ночі. Видаляють розчинник із реакційної суміші у вакуумі. Розчиняють залишок у ЕtOАс (150мл), і додають краплями 10% розчин Nа2СО3 (75мл) протягом 5-10хв. при перемішуванні. Розділяють шари, та екстрагують водний шар EtOAc (50мл). Промивають об'єднані органічні екстракти розсолом (1´50мл), сушать над Na2SO4, фільтрують і концентрують у вакуумі, одержуючи продукт - діетиловий складний ефір (1S,2S,4S,5R,6R)-2-аміно-4-фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (11,02г) у вигляді густої рідини, яка твердне при відстоюванні. Додають N-метилморфолін (22,44мл, 204ммоль) до розчину N-Boc-L-аланіну (38,62г, 204ммоль) у 396мл метиленхлориду при -22°С у атмосфері азоту, після чого краплями додають ізобутилхлорформіат (26,48мл, 204ммоль) протягом 15хв. так, щоб температура реакційної суміші не перевищувала -18°С. Перемішують одержану 80280 58 рідку суспензію при -20°С протягом 30хв., потім додають розчин діетилового складного ефіру (1S,2S,4S,5R,6R)-2-аміно-4-фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (49,46г, 191ммоль) у 247мл метиленхлориду протягом 40хв. так, щоб температура реакційної суміші не перевищувала -16°С. Відстороняють охолоджувальну баню, і перемішують суміш при температурі навколишнього середовища протягом 70хв. Додають 408мл 1-н. хлористоводневої кислоти, перемішують протягом 5хв. та розділяють шари. Промивають органічний шар насиченим водним розчином бікарбонату натрію (1´408мл), сушать (Na2SO4), фільтрують і концентрують у вакуумі, одержуючи продукт - діетиловий складний ефір (1R,2S,4R,5R,6R)-2-(2'S-2'-(третбутоксикарбоніламіно)пропіоніл)аміно-4-фторбіцикло[3.1.0]-гексан-2,6-дикарбонової кислоти у вигляді білої піни (88,16г). Додають 46,7мл (93,4ммоль) 2-н. гідроксиду натрію до розчину неочищеного діетилового складного ефіру (1R,2S,4R,5R,6R)-2-(2'S-2'-(третбутоксикарбоніламіно)пропіоніл)аміно-4-фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (17,5г, теоретично 37,3ммоль) у 46,6мл тетрагідрофурану при кімнатній температурі. Інтенсивно перемішують двофазну суміш при кімнатній температурі до досягнення однорідності, після чого перемішують ще протягом 1год. (разом 3 год). Розбавляють суміш 46мл метил-трет-бутилового простого ефіру, після чого перемішують протягом 10хв., і розділяють шари. В окрему колбу додають 93мл води, а потім 8,4мл (101ммоль) концентрованої НСI. Факультативно додають затравочні кристали (1R,2S,4R,5R,6R)-2-(2'S-2'-(третбутоксикарбоніламіно)-пропіоніл)аміно-4-фторбіцикло[3.1.0]гексан-2,6-дикарбонової кислоти до розчину кислоти, після чого водний шар, одержаний з реакційної маси, як описано вище. Додають водний шар спочатку повільно, так що утворюється помірно густа суспензія. Потім збільшують швидкість додавання (загальний час додавання 40хв). Ополіскують крапельну лійку водою (16мл). Переміщують одержану суспензію протягом 2год., фільтрують, промивають водою (2´32мл) і сушать у вакуумі при 45°С до незмінної маси, одержуючи 13,9г (99%) вказаної в заголовку сполуки у вигляді білої твердої речовини. Підготовчий синтез 53 Діетиловий складний ефір (1R,4S,5S,6S)-4аміно-2,2-діоксо-2l 6-тіа-біцикло[3.1.0]гексан-4,6дикарбонової кислоти Додають краплями тіонілхлорид до суспензії (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (10г, 42,5ммоль, [патент США №5,688,826)] у 100мл етанолу сорту 2В при кімнатній температурі (15,5мл, 212,6ммоль) протягом 20хв., після чого ополіскують склянку з-під суспензії 40мл етанолу. Нагрівають суспензію зі зворотним холодильником 59 та перемішують протягом ночі. Охолоджують одержаний розчин до кімнатної температури і концентрують, одержуючи желеподібний залишок. Додають до цього залишку етилацетат (50мл), після чого розбавляють додатковими 94мл етилацетату. Повільно додають до суміші 15% водний розчин карбонату натрію (70мл) при збовтуванні вручну для поступового розчинення, одержуючи кінцевий рН7,95. Фільтрують та розділяють шари. Екстрагують водний шар етилацетатом (2´100мл). Промивають об'єднані органічні екстракти розсолом (1´100мл), сушать (MgSO4), фільтрують та випарюють у вакуумі, одержуючи вказану в заголовку сполуку у вигляді блідо-жовтого масла, яке твердне, утворюючи жовтувату тверду речовину (11,71г, 95% вихід). Т.пл. 80-83°С. [α]25D=-57,7 (с 1,04, СН3ОН). 500МГц 1H ЯМР (CDCI 3) δ 4,31 (q, 2Η, J=7,0Гц), 4,20 (m, 2H), 3,78 (d, 1Н, J=15,0Гц), 3,36 (dd, 1H, J=4,0, 7,0Гц), 2,93 (dd, 1H, J=4,0, 7,0Гц), 2,81 (d, 1H, J=15,0Гц), 2,46 (t, 1H, J=4,0), 1,34 (t, 3H, J=7,0), 1,30 (t, 3H, J=7,0). 13 C ЯМР (125МГц, CD3CI 3) δ 171,68, 168,57, 63,26, 62,42, 59,96, 56,06, 43,78, 32,25, 22,49, 14,31, 14,25. FTIR (ATR) 3364,15 (s), 1725,95 (s), 1304,91 (s), 1259,24 (s), 1200,84 (s), 1104,91 (s), 1022,99 (s), 896,45 (s), 851,21 (s) см-1. Аналіз обчислено для C11H17NO6S: С, 45,35; Η, 5,88; Ν, 4,81. Знайдено: С, 45,02; Η, 5,75; Ν, 4,82. Підготовчий синтез 54 Діетиловий складний ефір (1R,4S,5S,6S)-4(2'S-4'-метилтіо-2'-(третбутоксикарбоніламінобутаноніл)аміно-2,2-діоксо2l 6-тіа-біцикло[3.1.0]гексан-4,6-дикарбонової кислоти Додають N-метилморфолін (14,4мл, 130,9ммоль) до прозорого розчину N-Boc-Lметіоніну (32,64г, 130,9ммоль) у 110мл метиленхлориду при -22°С у атмосфері азоту, після чого додають краплями ізо-бутилхлорформіат (17мл, 130,9ммоль) протягом 7хв., підтримуючи температуру реакційної суміші -22°С. Після завершення додавання утворюється рідка суспензія. Перемішують її при температурі від -22°С до -26°С протягом 30хв. Додають розчин діетилового складного ефіру (1R,4S,5S,6S)-4-аміно-2,2-діоксо-2l 6-тіабіцикло[3.1.0]гексан-4,6-дикарбонової кислоти (35,65г, 122,4ммоль, Підготовчий синтез 53) у 107мл метиленхлориду протягом 15хв., після чого ополіскують склянку з-під розчину 36мл метиленхлориду. Відстороняють охолоджувальну баню та перемішують суміш при кімнатній температурі протягом 70хв. Додають 51мл 5-н. хлористоводневої кислоти до розчину, після чого розділяють шари. Водний шар екстрагують метиленхлоридом (2´107мл). Промивають об'єднані органічні шари 80280 60 насиченим водним розчином бікарбонату натрію (1´107мл), сушать (MgSO4), фільтрують та випарюють у вакуумі, одержуючи 65,82г (вихід за масою 103%) вказаної в заголовку сполуки у вигляді білої піни. [α]25D=-12,7 (с 1,2, СН3ОН). 500МГц 1Н ЯМР (CDCI 3) δ 7,53 (s, 1H), 5,06 (d, 1H, J=8,0Гц), 4,34-4,20 (m, 6H), 3,41 (dd, 1H, J=4,0, 7,0), 2,97-2,89 (m, 2H), 2,64-2,59 (m, 2H, J=4,0), 2,12-1,89 (m, 5H), 1,47 (s, 9H), 1,32 (t, 6H, J=7,0). 13 C ЯМР (125МГц, CD3OD) δ 172,53, 169,03, 167,88, 156,00, 80,62, 63,45, 62,56, 60,20, 55,33, 52,78, 42,81, 31,52, 31,38, 30,12, 28,49, 22,69, 15,44, 14,23, 14,143. FTIR (ATR) 3341,88 (w), 2979,38 (s), 1733,03 (s), 1674,92 (s), 1514,58 (s), 1315,80 (s), 1255,15 (s), 1161,47 (s), 1142,63 (s), 1025,68 (s), 854,85 (s), 763,53 (s) см-1. Підготовчий синтез 55 Мононатрієва сіль (1R,4S,5S,6S)-4-(2'S-4'метилтіо-2'-(третбутоксикарбоніл)амінобутаноніл)аміно-2,2-діоксо2l 6-тіа-біцикло[3.1.0]гексан-4,6-дикарбонової кислоти Додають 141мл (282ммоль) 2-н. гідроксиду натрію до розчину діетилового складного ефіру (1Н,48,58,68)-4-(2'8-4'-метилтіо-2'-(третбутоксикарбоніл)амінобутаноніл)аміно-2,2-діоксо2l 6-тіа-біцикло[3.1.0]гексан-4,6-дикарбонової кислоти (58,95г, теоретично 112,8ммоль, Підготовчий синтез 54) у 141мл тетрагідрофурану при кімнатній температурі. Інтенсивно перемішують суміш при кімнатній температурі протягом 2 хв. Розбавляють розчин 141мл метил-трет-бутилового простого ефіру, після чого розділяють шари. Додатково розбавляють водний шар 141мл води, і додають краплями концентровану хлористоводневу кислоту для зниження рН до 4,46. Перемішують протягом 10хв., одержуючи рідку суспензію. Додають додаткову кількість концентрованої хлористоводневої кислоти до суспензії для зниження рН до 1,4 (загальна кількість використаної концентрованої НСI 17мл, 204ммоль). Після перемішування протягом 2год. фільтрують суспензію. Промивають осад водою (2´118мл) та сушать у вакуумі при 45°С протягом 1год., після чого переносять у чашку для зважування. Сушать осад знову у вакуумі при 45°С протягом 16год. та при 58°С протягом 5год., одержуючи 52,96г (вихід за масою 96%) вказаної в заголовку сполуки у вигляді білої твердої речовини. Т.пл. (з розкладом) 258°С. [α]25D=-25,2 (с 1,03, Н2О). 500МГц 1H ЯМР (D2O) δ 4,07-4,01 (m, 2H), 3,45-3,43 (m, 1H), 3,11 (d, 1H, J=15,0Гц), 2,85 (m, 1H), 2,71 (s, 3H), 2,47-2,35 (m, 3H), 1,96-1,90 (m, 4H), 1,78-1,72 (m, 1H), 1,28 (s, 9H). 13 С ЯМР (125МГц, CD3OD) δ 174,45, 173,58, 172,80, 157,46, 81,71, 61,41, 55,04, 53,24, 42,29, 31,71, 30,85, 29,41, 27,79, 23,65, 14,41. FTIR (ATR) 3287,62 (s), 1698,00 (s), 1528,91 (s), 1327,36 (s), 1283,74 (s), 1245,90 (s), 1174,81 (s), 1109,06 (s), 1053,05 (s), 874,27 (s), 808,95 (s) см-1. Підготовчий синтез 56 (1R,4S,5S,6S)-4-(2'S-4'-метилтіо-2'-(третбутоксикарбоніл)амінобутаноніл)аміно-2,2-діоксо
ДивитисяДодаткова інформація
Назва патенту англійськоюProdrugs of excitatory amino acids
Автори англійськоюMoher Eric David, Monn James Allen, Pedregal-Tercero Concepcion, Collado Cano Ivan, Blanco-Urgoiti Jaime Gonzalo
Назва патенту російськоюПролекарства возбуждающих аминокислот
Автори російськоюМоэр Эрик Дейвид, Монн Джеймс Аллен, Педрегал-Терсеро Консепсьйон, Колладо Кано Айвен, Бланко-Ургоити Хайме Гонсало
МПК / Мітки
МПК: A61K 38/05, C07K 5/06, C07K 5/068, C07K 5/062, C07K 5/065
Мітки: збуджувальних, проліки, амінокислот
Код посилання
<a href="https://ua.patents.su/58-80280-proliki-zbudzhuvalnikh-aminokislot.html" target="_blank" rel="follow" title="База патентів України">Проліки збуджувальних амінокислот</a>
Попередній патент: Хопер-вагон з шиберними розвантажувальними пристроями
Наступний патент: Пристрій для випаровування (варіанти)