Спосіб одержання естерів амінокислот, ацильованих піридинкарбоновими кислотами
Номер патенту: 52444
Опубліковано: 16.12.2002
Автори: Грень Андрій Янович, Ляхов Сергій Анатолійович, Литвинова Людмила Олександрівна, Ляхова Олена Анатоліївна, Андронаті Сергій Андрійович
Формула / Реферат
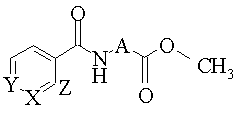
Спосіб одержання естерів амінокислот, ацильованих піридинкарбоновими кислотами формули
 ,
,
де Х = CH, Y = N; Z = СН (10-12); X = N, Y = CH; Z = CH (13-15); X = R; Y = CH; Z = N (16-20); X = N, Y = R; Z = CH (21-23);
R = -CO-NH-A-СООСН3 (10-23);
A = -СH2- (10, 13, 16, 21); -(СН2)2-(11, 14, 17, 22); -(СН2)5- (12, 15, 18, 23); -СН(СН3)- (19); -СНСН2(4-НОС6Н4)-(20),
що включає ацилювання естеру амінокислоти відповідним хлорангідридом в присутності основи, який відрізняється тим, що ацилювання здійснюють в гетерофазному водно-органічному середовищі при охолодженні, при цьому як основу використовують водний розчин карбонату і бікарбонату натрію, а як органічну фазу - суміш хлористого метилену з діетиловим етером.
Текст
Спосіб одержання естерів амінокислот, ацильованих піридинкарбоновими кислотами формули Винахід відноситься до органічної хімії, зокрема до одержання естерів амінокислот, ацильованих піридин карбоновими кислотами загальної формули О де Х = С Н , Y = N, Z = CH (10- 12), Х = N, Y = СН, Z = CH (13-15), Х = R, Y - C H , Z = N(16-20),X = N,Y= R, Z = CH (21-23) R = -CO-NH-A-СООСНз (10 - 23) A = -CH2-(10, 13, 16, 21), -(CH2)2-(11, 14, 17, 22), -(CH2)5- (12, 15, 18, 23), -CH(CH3)-(19), CHCH2(4-HOC6H4)-(20) Вказані сполуки можуть бути цінними напівпродуктами при синтезі біологічно активних речовин Відомо спосіб отримання диетилового естеру бензоіламшомалонової кислоти [ВейгандХильгетаг Методы эксперимента в органической д е Х = С Н , Y= N, Z = CH (10-12), Х = N, Y = C H , Z = СН (13-15), Х = R, Y = CH, Z = N (16-20), Х = N, Y = R, Z = CH (21-23) R = -CO-NH-A-СООСНз (10-23) A = -CH2- (10, 13, 16, 21), -(CH2)2-(11, 14, 17, 22), (CH2)5- (12, 15, 18, 23), -СН(СНз)- (19), -CHCH2(4HOC6H4)-(20) що передбачає ацилювання естера амінокислоти ВІДПОВІДНИМ хлорангідридом в присутності основи, який відрізняється тим, що ацилювання здійснюють в гетерофазному водно-органічному середовищі при охолодженні, при цьому як основу використовують водний розчин карбонату і бікарбонату натрію, а як органічну фазу - суміш хлористого метилену з діетиловим етером химии / -М Химия, 1969, - 434с] ВІДПОВІДНО ДО вказаного способу до суміші 58г диетилового естеру аміномалонової кислоти, 50мл піридину та 250мл води додають по краплях при температурі не більше 50°С і перемішуванні 48 5г бензоілхлориду Суміш охолоджують до кімнатної температури, відфільтровують осад, що випав, висушують його у вакуумі і розчиняють у мінімальній КІЛЬКОСТІ бензолу 3 одержаного розчину осаджують цільовий продукт повільним додаванням шостикратного об'єму петролейного естеру Вихід 92 4г (90% від теоретичного) ТПЛавл 73 - 74°С Даний спосіб обрано прототипом Прототип збігається з винаходом тому, їло містить СПІЛЬНІ ознаки - ацилювання естера амінокислоти ВІДПОВІДНИМ хлорангидрилом, - здійснення ацилювання у присутності основи Але недоліками цього способу є - необхідність застосування основи естеру амінокислоти, що може приводити до утворення ю 52444 продуктів самоконденсацм сетерів, - застосування піридину як основи, внаслідок його високої нуклеофільності чревато рацемізацією хіральних естерів ациламшокислот Крім того, при ацилюванш пдрохлоридів метилових сетерів амінокислот загальної формули U О де А= -СН2-(5), -(СН2)2-(6), -(СН2)5- (7), СН(СНз)- (8), СНСН2(4-НОС6Н4)-(9) хлорангідридами піридинкароонових кислот формули -а U /4s Сі " X It у водному піридині, ЦІЛЬОВІ продукти (10 - 23) утворюються ч невеликими виходами (таблиця), містять велику КІЛЬКІСТЬ домішок Недоліком цього методу є також використання коштовного та екологічно небезпечного піридину В основу винаходу поставлена .задача створити спосіб одержання сетерів амінокислот, ацилюваних піридинкарбоновими кислотами, в якому шляхом зміни умов ацилювання і реагентів забезпечити одержання цільових продуктів з більшими виходами та зменшити трудомісткість, вартість та екологічну небезпеку процесу Поставлена задача вирішена в способі одержання естері в амідокислот формули О о де X = СН, Y = N, Z = СН (10-12), X = N, Y = СН, Z = СН (13 - 15), X = R, Y = СН, Z = N (16 20), X = N, Y = R, Z = СН(21 - 23) R = -CO-NH-A-СООСНз (10 - 23) А = -СН2-(10, 13, 16, 21), -(СН2)2-(11, 14, 17, 22), -(СН2)5- (12, 15, 18, 23), -СН(СН3)-(19), СНСН2(4-НОС6Н4)-(20) що включає ацилювання пдрохлорида естера амінокислоти ВІДПОВІДНИМ хлорангідридом в присутності основи тим, що ацилювання здійснюють в гетерофазному водно-органічному середовищі при охолодженні, при цьому, як основу, використовують водний розчин карбонату і бікарбонату натрію, а як органічну фазу - суміш хлористого метилену з діетиловим етером Новим у винаході, що заявляється, є наявність наступних ознак - проведення ацилювання в гетерофазному водно-органічному середовищі, - проведення процесу ацилювання при низькій температурі, - використання як основи водного розчину карбонату та бікарбонату натрію, - використання суміші хлористого метилену з діетиловим етером як органічної фази Причино-наслідковий зв'язок між сукупністю ознак, що заявляються і досягнутим результатом можна пояснити наступним 1 Значення рН водного середовища ( 9 - 9 5) є достатньо великим щоб ефективно переноводити пдрохлориди естерів амінокислот до основної форми, водночас досить низьким для гідролізу реагентів Крім того це значення рН є достатньо низьким щоб активувати ІНШІ реакційноздатні функціональні групи, що підтверджується виключним ацилюванням аміногрупи метилового естера тірозина з високим виходом Використання карбонат-бікарбонатного буферного розчину дозволяє підтримувати це значення рН на постійному рівні впродовж усього часу синтезу 2 Висока іонна сила водного середовища також запобігає гідролізу хлорангідриду та забезпечує ефективний перенос естеру амінокислоти в органічну фазу Запобігає гідролізу також і те, що хоранпдрид знаходиться переважно у органічній фазі 3 Усі побічні продукти добре розчинні у водній фазі, що значно спрощує виділення основного продукту реакцій з високим виходом 4 Використання суміші хлорорганічного розчинника з діетиловим етером зближує ЩІЛЬНОСТІ органічної та водної фаз настільки, що впродовж синтезу вони утворюють дуже стійку емульсію, що в свою чергу сприяє швидкому перебігу реакції Ця емульсія дуже легко розшаровується додаванням одного з компонентів органічної фази (у наведеному прикладі - хлористого метилену) Крім того, діетиловий етер значно підвищує розчинність хлорангідридів піридинкарбонових кислот, що забезпечує використання відносно невеликого об'єму органічних розчинників Спосіб здійснюється у такий спосіб До суміші карбонату та бікарбонату натрію додають воду, після повного розчинення суміші додають по черзі хлористий метилен та діетиловий етер Суміш охолоджують до О °С та додають до неї пдрохлорид метилового естеру амінокислоти Після ретельного перемішування додають хлорангідрид піридинкарбонової кислоти у ротний в суміші хлористого метилену та діетилового етеру при тій же температурі Після цього підіймають температуру до кімнатної, перемішують, додають хлористий метилен та розділяють фази Органічну фазу промивають, висушують та випаровують у вакуумі Залишок розчиняють у мінімальній КІЛЬКОСТІ хлористого метилену та додають п'ятикратний об'єм діетилового етеру та залишають на добу Кристалічний цільовий продукт відфільтровують та промивають діетиловим етером Приклад 1 Отримання {[6-( Метоксикарбонілметилкарбамоіл)-піридин-2-карбоніл]амшо} оцтової кисло 52444 ти метилового естеру (16) До 50мл водного розчину, що вміщує карбо тер (15), Приклад 8 3-{[6-(2Метоксикарбонілетилкарбамоіл)-піридин-2карбоніл]амшо} пропюнової кислоти метиловий естер (17) Приклад 9 -{[6-(5-Метоксикарбонілпентилкарбамоіл>-піридин-2-карбоніл]амшо} гексанової кислоти метиловий естер (18), Приклад 10 2-{[6-( 1 -Метоксикарбонілетилкарбамоіл)-піридин-2-карбоніл ]амшо) пропіонової кислоти метиловий естер (19), Приклад 11 -2({6-[1-Метоксикарбоніл-2-(4гидрокси-фенил)етилкарбамоіл]-піридин-2карбоніл]амшо)-3-(4-гидрокси-фенил)пропюновоі кислоти метиловий естер (20), Приклад 12 {[5(Метоксикарбоніл метил карбамоіл)-піридин-2карбоніл]амшо}оцтовоі кислоти метиловий естер (21) Приклад 13 3-{[5-(2-Метоксикарбонілетилкарбамоіл)-піридин-2карбоніл]амшо}пропюновоі кислоти метиловий естер (22), Приклад 14 6-{[5-(5-Метоксикарбонілпентилкарбамоіл)-піридин-2-карбоніл]амшо} гексанової кислоти метиловий естер (23) Приклад 15 Отримання 1 (піридин-3карбоніл)амшо]оцтовоі кислоти метилового естеру (13) за способом-прототипом До суміші Юмл піридину та 50мл води та 1 25г (0 01 моль) гідрохлориду метилового естеру амінооцтової кислоти додають потрохи 1 415г (0 01 моль) хлорангідриду піридин-3-карбоновоі кислоти) такою швидкістю, щоб температура не сягала вище 50°С Після додавання усієї КІЛЬКОСТІ хлорангідриду суміш витримують ЗО хвилин Реакційну суміш охолоджують до кімнатної температури, осад, що випав відфільтровують, висушують ретельно у вакумі, розчиняють у мінімальній КІЛЬКОСТІ (25 -ЗОмл) бензолу та додають потрохи петролейний етер Кристалічний осад, що випав, відфільтровують, промивають холодним петролейним етером Вихід 0 35г (18%) нат та бікарбонат натрію (2М та 1М, ВІДПОВІДНО) додають 20мл хлористого метилену і 20мл діетилового етеру Суміш при перемішуванні охолоджують до 0°С і вносять 3 77г (10 ммоль) пдрохлориду метилового естеру амінооцтової кислоти Реакційну суміш при цій же температурі інтенсивно перемішують 20 хвилин і додають по краплях розчин 2 04г (Юммоль) хлорангідриду піридин2,6-дн-карбоновоі кислоти в суміші 20мл хлористого метилену і 20мл діетилового етеру з такою швидкістю, щоб температура не піднімалася вище 0°С По закінченню додавання дають температурі піднятися до кімнатної і перемішують ще 6 годин Зупиняють мішалку, додають 100мл хлористого метилену і струшують у ДІЛИЛЬНІЙ ЛІЙЦІ Органічний шар відокремлюють, промивають дистильованою водою (3 х ЮОмл), висушують сульфатом натрію, розчинник випарюють у вакуумі Залишок розчиняють у мінімальній КІЛЬКОСТІ хлороформу, додають п'ятикратну КІЛЬКІСТЬ (за об'єму) діетилового етеру і залишають на добу при кімнатній температурі Кристалічний осад, що випав, відфільтровують, промивають холодним діетиловим етером Вихід 7 52г (81%) Аналогічним способом одержували ІНШІ сполуки Дані наведені в таблиці Приклад 2 [(Піридин-4карбоніл)амшо]оцтовоі кислоти метиловий естер (10) Приклад 3 3-[(Піридин-4-карбиніл )аміно]пропюновоі кислоти метиловий естер (11), Приклад 4 6-|(Піридин-4карбоніл)амшо]гексановоі кислоти метиловий естер (12), Приклад 5 [(Піридин-3карбоніл)амшо]оцтовоі кислоти метиловий естер (13), Приклад 6 3-[(Піридин-3карбоніл)амшо]пропюновоі кислоти метиловий естер (14), Приклад 7 6-[(Піридин-3карбоніл)амшо]гексановоі кислоти метиловий ес Таблицяі Аналітичні данні та виходи за методом, що з'являється, та методом- прототипом естерів амінокислот, ацильованих піридинкорбоновими кислотами Приклад Сполука 2 3 4 5 6 7 1 8 9 10 11 10 11 12 13 14 15 16 17 18 19 20 Знайдено,% С 55 53 57 50 62 43 55 80 57 51 62 49 50 39 53 25 59 96 53 48 62 34 Н N 5 38 5 72 7 34 514 5 72 717 5 03 5 78 7 38 5 79 5 31 14 46 13 27 11 06 14 45 13 44 11 24 13 73 12 42 9 99 12 41 7 98 Молекулярна вага 194 19 208 22 250 30 194 19 208 22 250 30 309 28 337 34 421 50 337 34 521 53 Емпірична формула C9H10N2O3 C10H12N2O3 C13H18N2O3 C9H10N2O3 C10H12N2O3 C13H18N2O3 C13H15N3O6 C15H19N3O6 C21H31N3O6 C15H19N3O6 C27H27N3O8 Продовження табл 1 52444 Приклад Сполука 12 13 14 21 22 23 С 50 39 53 25 59 96 Знайдено,% Н 5 03 5 78 7 38 N 13 73 12 42 9 99 Молекулярна вага 309 28 337 34 421 50 Емпірична формула C13H15N3O6 C15H19N3O6 C21H31N3O6 Таблиця 2 Приклад 2 3 4 5 6 7 1 8 9 10 11 12 13 14 Сполука 10 11 12 13 14 15 16 17 18 19 20 21 22 23 С 55 67 57 69 62 38 55 67 57 69 62 38 50 49 53 41 59 84 53 41 62 18 50 49 53 41 59 84 Обчислено,% Н 519 5 81 7 25 519 5 81 7 25 4 89 5 68 7 41 5 68 5 22 4 89 5 68 7 41 N 14 43 13 45 11 19 14 43 13 45 11 19 13 59 12 46 9 97 12 46 8 06 13 59 12 46 9 97 Вихід,% 1Б 2В 85 15 68
ДивитисяДодаткова інформація
Назва патенту англійськоюA method of producing esters of amino acids acylated by pyridine carboxylic acids
Автори англійськоюLiakhova Olena Anatoliivna, Liakhov Serhii Anatoliiovych, Andronati Serhii Andriiovych
Назва патенту російськоюСпособ получения эстеров аминокислот, ацилированных пиридинкарбоновими кислотами
Автори російськоюЛяхова Елена Анатольевна, Ляхов Сергей Анатольевич, Андронати Сергей Андреевич
МПК / Мітки
МПК: C07D 213/30
Мітки: естерів, кислотами, одержання, піридинкарбоновими, спосіб, ацильованих, амінокислот
Код посилання
<a href="https://ua.patents.su/4-52444-sposib-oderzhannya-esteriv-aminokislot-acilovanikh-piridinkarbonovimi-kislotami.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання естерів амінокислот, ацильованих піридинкарбоновими кислотами</a>
Попередній патент: Спосіб виготовлення покривних знімних пластинкових зубних протезів
Наступний патент: Дигідразиди та їх похідні, які інгібують матричні функції днк
Випадковий патент: Спосіб зниження корозійної активності металевих виробів