N6 гетероциклічні заміщені похідні аденозину
Номер патенту: 62936
Опубліковано: 15.01.2004
Автори: Нелсон Марек Г., Уік Майкл М., Скоу Стівен Р., Лам Роберт Т., Пфістер Юрг Р., Шрайнер Джордж Ф.
Формула / Реферат
1. N6 гетероциклічні заміщені похідні аденозину формули
,
де R1 - незаміщена або заміщена моноциклічна гетероциклічна група, яка складається з 3-15 атомів, щонайменше один з яких вибрано з групи, яка складається з N, О та S-(O)0-2, причому R1 не є моноциклічним лактамом або імідом, і R1 не включає епоксидної групи.
2. Сполуки за п. 1, де R1 є моно- або полізаміщеною одним або декількома замісниками, вибраними з групи, яка включає галоїд, оксогрупу, гідроксил, нижчий алкіл, заміщений нижчий алкіл, алкоксигрупу, арил, ацил, арилоксигрупу, карбоксил, заміщений арил, гетероцикл, гетероарил, заміщений гетероарил, циклоалкіл, заміщений циклоалкіл, нітрогрупу, ціаногрупу та їх комбінації.
3. Сполуки за п. 1, де R1 є моноциклічною, біциклічною або трициклічною циклоалкільною групою, яка складається з 3-15 атомів, щонайменше один з яких вибрано з групи, яка складається з О або S-(O)0-2.
4. Сполуки за п. 3, де R1 є моно- або полізаміщеною одним або декількома замісниками, вибраними з групи, яка включає галоїд, оксогрупу, гідроксил, нижчий алкіл, заміщений нижчий алкіл, алкоксигрупу, арил, ацил, арилоксигрупу, карбоксил, заміщений арил, гетероцикл, гетероарил, заміщений гетероарил, циклоалкіл, заміщений циклоалкіл, нітрогрупу, ціаногрупу та їх комбінації.
5. Сполуки за п. 1, де R1 вибрано з групи, яка складається з:
,
де кожен R незалежно вибрано з групи, яка складається з Н, нижчого алкілу та заміщеного нижчого алкілу, і де Χ - О або S(-O)0-2.
6. Сполуки за п. 1, де R1 вибрано з групи, до якої входять 3-тетрагідрофураніл, 3-тетрагідротіофураніл, 4-піраніл та 4-тіопіраніл.
7. Агоніст рецептору аденозину типу 1, який включає сполуку за п. 1.
8. Спосіб стимулювання активності коронарних судин у ссавця, що страждає на електричний розлад коронарних судин, який може лікуватись шляхом стимулювання клітин серцевого Α1 рецептора аденозину, при якому вводять в організм даного ссавця терапевтично ефективну кількість сполуки за п.1.
9. Спосіб за п. 8, який відрізняється тим, що вказана терапевтично ефективна кількість становить від приблизно 0,01 мг/кг маси згаданого ссавця до приблизно 100мг/кг маси згаданого ссавця.
10. Спосіб за п. 8, який відрізняється тим, що згадану сполуку вводять ссавцю, який страждає на електричний розлад коронарних судин, який вибрано з групи, яка складається з суправентрикулярної тахікардії, фібриляції передсердь, тріпотіння передсердь та атріовентрикулярної пароксизмальної тахікардії.
11. Спосіб за п. 10, який відрізняється тим, що згаданим ссавцем є людина.
12. Фармацевтична композиція, яка містить ефективну кількість сполуки за п. 1 та один або декілька фармацевтичних наповнювачів.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що вона має форму розчину.
14. Фармацевтична композиція за п. 12, яка відрізняється тим, що вона має форму таблетки.
Текст
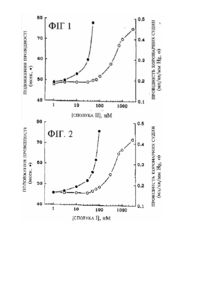
Цей винахід охоплює оптимально заміщені N6-окса, тіа, тіокса га азациклоалкіл заміщені похідні аденозину, які є вибірковими агоністами рецептору аденозину типу 1 і, як такі, є потенційно придатними засобами для лікування серцево-судинних захворювань та розладів центральної нервової системи. У серці існує два підтипи рецепторів аденозину: А1 та А2. Кожен підтип здійснює різні фізіологічні функції. Стимулювання А1 рецептору аденозину викликає дві різні фізіологічні реакції. Першою з них є пригнічення стимулювальних ефектів катехоламіну. Цей ефект опосередковується через пригнічення синтезу циклічного аденозинмонофосфату (цАМФ). Другим згаданим ефектом, який опосередковується А 1 рецепторами, є уповільнення частоти серцевих скорочень та поширення імпульсу через атріовевдрикулярний вузол. Згаданий ефект не залежить від метаболізму цАМФ і є пов'язаним з активацією А1 рецептору аденозину довнутрішнього очищувального К+ каналу. Цей ефект є притаманним тільки А 1 рецептору; А2 рецептор у модулюванні функціонування цього каналу ніякої ролі не відіграє. Стимулювання A1 рецептору аденозину, відповідно, скорочує тривалість та підвищує амплітуду потенціалу дії клітин атріовентрикулярного вузла та, внаслідок цього, подовжує рефракторний період згаданих клітин. Наслідками цих ефектів є обмеження кількості імпульсів, які проводяться з передсердя до шлуночків. Це утворює основу клінічної придатності агоністів А1 рецептору для лікування суправентрикулярної тахікардії, у тому числі, фібриляції передсердь, тріпотіння передсердь та атріовентрикулярної пароксизмальної тахікардії. Таким чином, клінічна придатність А1 агоністів полягає у лікуванні гострих та хронічних розладів серцевого ритму, особливо тих захворювань, які характеризуються великою частотою серцевих скорочень, де згадана частота обумовлена аномальними станами передсердь. До згаданих розладів належать, але ними не обмежуються, фібриляція передсердь, суправентрикулярна тахікардія та тріпотіння передсердь. Дія А1 агоністів викликає зниження частоти серцевих скорочень та врегулювання аномального серцевого ритму, завдяки чому відновлюється поліпшений гемодинамічний кровотік. А1 агоністи, завдяки своїй здатності до пригнічення викликаного катехоламіном підвищення цАМФ, повинні мати благотворний ефект у разі серцевої недостатності, де підвищений тонус симпатичної нервової системи, який викликає підвищення цАМФ, пов'язується з підвищеною ймовірністю шлуночкових екстрасистолій та раптової смерті. Метою цього винаходу є нові гетероциклічні заміщені похідні аденозину. Іншою метою цього винаходу є нові гетероциклічні заміщені похідні аденозину, які є придатними, як агоністи А1 рецептору. Ще іншою метою цього винаходу є нові гетероциклічні заміщені похідні аденозину, які є придатними для лікування суправентрикулярних тахікардій, які включають фібриляцію передсердь, тріпотіння передсердь та атріовентрикулярну пароксизмальну тахікардію. За одним з варіантів втілення, цей винахід є сполукою, яка має формулу: де R1 є моноциклічною або поліциклічною гетероциклічною групою, яка складається з 3-15 атомів, одним з яких, як мінімум, є N, О, S, Ρ та де R1 може бути моно або полізаміщеним однією або декількома сполуками, які вибирають з групи, до складу якої входить галоген, оксо, гідроксил, нижчий алкіл, заміщений нижчий алкіл, алкокси, арил, ацил, арилокси, карбоксил, заміщений арил, гетероцикл, гетероарил, заміщений гетероарил, циклоалкіл, заміщений циклоалкіл, нітро, ціано та їх суміші, де R1 не включає епоксидної групи. За іншим варіантом втілення, цей винахід є способом стимулювання активності коронарних судин у ссавця, у якого спостерігається електричний розлад серцевої діяльності, який може лікуватись стимулюванням серцевого Α1 рецептору аденозину шляхом введення згаданому ссавцеві терапевтично ефективної кількості композиції, розкритої перед тим. За ще іншим варіантом втілення, цей винахід є фармацевтичною лікарською формою, до складу якої входить сполука за цим винаходом та один або декілька фармацевтичних наповнювачів. Опис фігур Фігура 1 - крива впливу концентрації сполуки II Прикладу 2 на провідність атріовентрикулярного вузла для А1 рецептору аденозину (-·-) та для А2 рецептору аденозину (-о-). Фігура 2 - крива впливу концентрації сполуки І Прикладу 2 на провідність атріовентрикулярного вузла і, зокрема, на реакцію А1 рецептору аденозину (-·-) та на реакцію А2 рецептору аденозину (-о-). Опис варіантів втілення винаходу Цей винахід включає похідні аденозину, які є вибірковими агоністами рецептору аденозину типу 1. Згадані композиції є оптимально заміщеними, як описано у подальшому. де: R1 є циклоалкільною групою, яка складається з 3-15 атомів моноциклічних або поліциклічних гетероциклічних груп, одним з яких, як мінімум, є гетероатом, який обирають з групи, яка складається з Ν, Ο, Ρ та S-(O)0-2 R1, у свою чергу, може бути, факультативно, моно або полізаміщеним галогеном, оксо, гідроксилом, нижчим алкілом, заміщеним нижчим алкілом, алкокси, арилом, ацилом, арилокси, карбоксилом, заміщеним арилом, гетероциклом, гетероарилом, заміщеним гетероарилом, циклоалкілом, заміщеним циклоалкілом, нітро та ціано. R1, однак, не включає епоксидної групи. R1, у переважному варіанті, є моноциклічною, біциклічною або трициклічною групою, яка складається з 3-15 атомів, один з яких, як мінімум, вибирають з групи, яка складається з О або S-(О)0-2, де R1 може бути моно або полізаміщеним однією або декількома сполуками, які вибирають з групи, до складу якої входить галоген, гідроксил, нижчий алкіл, заміщений нижчий алкіл, алкокси, арил, ацил, арилокси, карбоксил, заміщений арил, гетероцикл, гетероарил, заміщений гетероарил, циклоалкіл, заміщений циклоалкіл, нітро, ціано та їх суміші. У більш переважному варіанті втілення R1 є: , де R1’, R1’’, R1’’’ та R1’’’’ у індивідуальному порядку вибирають з групи, до складу якої входить галоген, оксо, гідроксил, нижчий алкіл, заміщений нижчий алкіл, алкокси, арил, ацил, арилокси, карбоксил, заміщений арил, гетероцикл, гетероарил, заміщений гетероарил, циклоалкіл, заміщений циклоалкіл, нітро, ціано та їх суміші, та X - О або S(-O)0-2. У переважному варіанті втілення, R1’, R1’’, R1’’’ та R1’’’’ у індивідуальному порядку вибирають з групи, до складу якої входить Н, нижчий алкіл, заміщений нижчий алкіл, алкокси, арил та заміщений арил. Вираз "у індивідуальному порядку вибирають" означає, що кожен з R1', R1’’, R1’’’ та R1’’’’ може бути іншим компонентом, кожен з них може бути одним і тим же самим компонентом, наприклад, воднем, або деякі зі згаданих компонентів можуть бути одними і тими ж, а деякі іншими. У найпереважнішому варіанті, у разі, коли R1 є композицією, згаданою перед тим, тоді R1', R1’’, R1’’’ та R1’’’’ у індивідуальному порядку вибирають з групи, до складу якої входить Н, нижчий алкіл та заміщений нижчий алкіл. R1’’’ та R1’’’’ можуть також бути окремим атомом кисню. У альтернативному варіанті втілення R1 вибирають з групи, до складу якої входить: або де кожний R може у індивідуальному порядку вибиратись з групи, до складу якої входить Н, нижчий алкіл та заміщений нижчий алкіл і де X - О або S(-O)0-2. У більш переважному варіанті втілення, R1 вибирають з групи, до складу якої входить 3-тетрагідрофураніл, 3-тетрагідротіофураніл, 4-піраніл та 4тіопіраніл. Наведені далі визначення відносяться до термінів, які використано у цьому описі. Згаданий термін "галоген" означає атоми фтору, брому, хлору або йоду. Згаданий термін "оксо" означає =О. Згаданий термін "гідроксил" означає групу -ОН. Згаданий термін "нижчий алкіл", означає циклічну алкільну групу з розгалуженим або прямим ланцюгом, який складається з одного-десяти атомів вуглецю. Як додаткові приклади до пояснення цього терміну, наводяться такі групи, як метил, етил, n-пропіл, i-пропіл, n-бутил, t-бутил, i-бутил (або 2-метилпропіл), циклопропілметил, i-аміл, n-аміл, гексил і т.ін. Згаданий термін "заміщений нижчий алкіл" означає нижчий алкіл, опис якого було наведено перед тим, який включає одну або декілька таких груп, як гідроксил, тіол, алкілтіол, галоген, алкокси, аміно, амідо, карбоксил, циклоалкіл, заміщений циклоалкіл, гетероцикл, циклогетероалкіл, заміщений циклогетероалкіл, ацил, карбоксил, арил, заміщений арил, арилокси, гетарил, заміщений гетарил, аралкіл, гетероаралкіл, алкілалкеніл, алкілалкініл, алкілциклоалкіл, алкілциклогетероалкіл та ціано. Ці групи можуть приєднуватись до будь-якого атому вуглецю нижчої алкільної складової. Згаданий термін "алкокси" означає групу -OR, де R - нижчий алкіл, заміщений нижчий алкіл, ацил, арил, заміщений арил, аралкіл, заміщений аралкіл, гетероалкіл, гетероарилалкіл, циклоалкіл, заміщений циклоалкіл, циклогетероалкіл або заміщений циклогетероалкіл, як визначається далі. Згаданий термін "ацил" означає групи -C(O)R, де R - водень, нижчий алкіл, заміщений нижчий алкіл, арил, заміщений арил, аміно і т.ін., як визначається далі. Згаданий термін "арилокси" означає групи -ОАr, де Аr - арил, заміщений арил, гетероарил або заміщена гетероарильна група, як визначається далі. Згаданий термін "аміно" означає групу NR2R2', де R2 та R2' можуть, незалежно, бути воднем нижчим алкілом, заміщеним нижчим алкілом, арилом, заміщеним арилом, гетарилом або заміщеним гетарилом, як визначається у цьому описі. Згаданий термін "карбоксил" означає групу -C(O)OR, де R може бути, незалежно, воднем, нижчим алкілом, заміщеним нижчим алкілом, арилом, заміщеним арилом, гетарилом, заміщеним гетарилом і т.ін., як визначається у цьому описі. Згаданий термін "арил" або "Аr" означає ароматичну карбоциклічну групу, яка має, як мінімум, одне ароматичне кільце (наприклад, феніл або дифеніл), або численні сконденсовані кільця, з-посеред яких, як мінімум, одне кільце є ароматичним (наприклад, 1,2,3,4-тетрагідронафтил, нафтил, антрил або фенантрил). Згаданий термін "заміщений арил" означає арил, факультативно заміщений однією або декількома функціональними групами, наприклад, галогеном, нижчим алкілом, нижчим алкокси, нижчим алкілтіо, трифторметилом, аміно, амідо, карбоксил, гідроксил, арил, арилокси, гетероциклом, гетарил, заміщеним гетарил, нітро, ціано, алкілтіо, тіолсульфамідо і т.ін. Згаданий термін "гетероцикл" означає насичену, ненасичену або ароматичну карбоциклічну групу, яка має одне кільце (наприклад, морфоліно, піридил або фурил) або численні сконденсовані кільця (наприклад, нафтопіридил, хіноксаліл, хінолініл, індолізиніл або бензо[b]тієніл) та, як мінімум, один гетероатом, наприклад, N, О або S у згаданому кільці, який може, факультативно, бути незаміщеним або заміщеним, наприклад, галогеном, нижчим алкілом, нижчим алкокси, нижчим алкілтіо, трифторметилом, аміно, амідо, карбоксилом, гідроксилом, арилом, арилокси, гетероциклом, гетарилом, заміщеним гетарилом, нітро, ціано, алкілтіо, тіолом, сульфамідо і т.ін. Згаданий термін "гетероарил" або "гетар" означає гетероцикл, у якому, як мінімум, одне гетероциклічне кільце є ароматичним. Згаданий термін "заміщений гетероарил" означає гетероцикл, факультативно, моно або полізаміщений однією або декількома функціональними групами, наприклад, галогеном, нижчим алкілом, нижчим алкокси, нижчим алкілтіо, трифторметилом, аміно, амідо, карбоксилом, гідроксилом, арилом, арилокси, гетероциклом, гетарилом, заміщеним гетарилом, нітро, ціано, алкілтіо, тіолом, сульфамідо і т.ін. Згаданий термін "циклоалкіл" означає двовалентну циклічну або поліциклічну алкільну групу, до складу якої входить від 3 до 15 атомів вуглецю. Згаданий термін "заміщений циклоалкіл" означає циклоалкільну групу, яка включає один або декілька замісників, наприклад, галоген, нижчий алкіл, заміщений нижчий алкіл, алкокси, алкілтіо, арил, арилокси, гетероцикл, гетарил, заміщений гетарил, нітро, ціано, алкілтіо, тіол, сульфамідо і т.ін. Згадані композиції за цим винаходом є придатними, як агоністи А1 рецептору для лікування електричних розладів серцевої діяльності, наприклад, суправентрикулярних тахікардій, у тому числі, фібриляцій передсердь, тріпотіння передсердь та атріовентрикулярних пароксизмальних тахікардій. Згадані композиції можуть вводитись перорально, інтравенозно, через епідерміс або за допомогою будь-яких інших способів, відомих у цій галузі техніки для введення терапевтичних засобів. Згаданий спосіб лікування включає введення ефективної кількості обраної сполуки, у переважному варіанті, диспергованої у фармацевтичному носії. Дози згаданого активного інгредієнту, як правило, вибирають у діапазоні від 0,01мт/кг до 100мг/кг, однак, вони будуть легко визначатись фахівцем у цій галузі у залежності від шляху введення, віку та стану пацієнта. Ці дози повинні вводитись від одного до десяти разів на день у разі гострих або хронічних розладів. Ніякі неприйнятні токсикологічні ефекти не очікуються у разі, якщо сполуки за цим винаходом вводяться у відповідності до цього винаходу. Якщо до складу кінцевої сполуки за цим винаходом входить основна група, перевага може надаватись солі, одержаній доданням кислоти. Солі, одержані доданням кислоти, одержують стандартним чином у придатному розчиннику з вихідної сполуки та з надлишком кислоти, наприклад, хлористоводневої, бромистоводневої, сірчаної, фосфорної, оцтової, малеїнової, бурштинової або метансульфонової. Особливо прийнятною є хлористоводнева сіль. Якщо згадана кінцева сполука вміщує кислотну групу, можуть бути одержані катіонні солі. У типовому випадку, вихідну сполуку обробляють надлишком лужного реактиву, наприклад, гідроксиду, карбонату або алкоксиду, до складу якого входить відповідний катіон. Такі катіони, як Na+, K+, Са+2 та NH4+, є прикладами катіонів, присутніх у фармацевтично прийнятних солях. Певні зі згаданих сполук утворюють внутрішньокомплексні солі або цвітер-іони, які також можуть бути прийнятними. Фармацевтичні композиції, до складу яких входять згадані сполуки за цим винаходом та/або їх похідні, можуть виготовлятись у вигляді розчинів або ліофілізованих порошків для парентерального введення. Порошки можуть відновлюватись шляхом додання придатного розчинника або іншого фармацевтично прийнятного носія перед використанням. У разі застосування у рідкій формі, згадані композиції за цим винаходом, у переважному варіанті, включають до складу забуференого ізотонічного водного розчину. Прикладами придатних розріджувачів є нормальні ізотонічні фізіологічні розчини, стандартний 5% розчин декстрози у воді та забуферений розчин ацетату натрію або амонію. Такі рідкі лікарські форми є придатними для парентерального введення, однак, їх можна використовувати також для перорального введення. Може виникнути необхідність додання до фармацевтичних композицій, які включають сполуки за цим винаходом, наповнювачів, наприклад, полівінілпіролідону, желатини, гідроксильної целюлози, аравійської камеді, поліетиленгліколю, маніту, хлориду натрію, цитрату натрію або будь-якого іншого наповнювача, відомого фахівцю у цій галузі техніки. У альтернативному варіанті, згадані фармацевтичні сполуки можуть інкапсулюватись, таблетуватись або виготовлятись у формі емульсії або сиропу для перорального введення. Фармацевтично прийнятні тверді або рідкі носії можуть додаватись для підсилення або стабілізування згаданої композиції або для полегшення виготовлення згаданої композиції. До рідких носіїв належать сироп, арахісова олія, оливкова олія, гліцерин, фізрозчин, спирти та вода. До твердих носіїв належать крохмаль, лактоза, сульфат кальцію, дигідрат, teffa alba, стеарат магнію або стеаринова кислота, тальк, пектин, аравійська камедь, агар або желатина. Згадані носії можуть включати також матеріал уповільненого виділення, наприклад, моностеарат гліцерину або дистеарат гліцерину, самостійно або у суміші з воском. Кількість твердого носія змінюється але, у переважному варіанті, становить, приблизно, від 20мг, приблизно, до 1г на дозу. Фармацевтичні дозовані форми виготовляють за допомогою традиційних способів, наприклад, помелом, змішуванням, гранулюванням та пресуванням, за потребою, у разі таблетованих форм; або помелом, змішуванням та заповненням твердих желатинових капсульованих форм. У разі використання рідкого носія, згадана лікарська форма буде мати вигляд сиропу, еліксиру, емульсії або водної/неводної суспензії. Такі рідкі лікарські форми можуть вводитись безпосередньо або заливатись до м'яких желатинових капсул. Наведені далі Приклади служать для ілюстрування цього винаходу. Згадані Приклади ні у якому разі не призначені для обмеження обсягу цього винаходу, але мають на меті лише демонстрацію того, яким чином одержувати та використовувати згадані сполуки за цим винаходом. У згаданих Прикладах усі температури наведено у градусах за Цельсієм. ПРИКЛАД 1 Сполуки за цим винаходом можна одержувати традиційними способами органічної хімії. Наведена далі послідовність реакцій є загальним способом, придатним для одержання сполук за цим винаходом. За цим способом, оксациклоалкілкарбонову кислоту нагрівають у суміші діоксану, дифенілфосфоразиду та триетиламіну впродовж 1 години. До цієї суміші додають бензиловий спирт і одержану реакційну суміш додатково нагрівають впродовж ночі для одержання проміжної сполуки 1. Сполуку 1 розчиняють у метанолі. Після цього додають концентровану НСІ, Pd/C і одержану суміш вміщують до атмосфери водню під тиском 1атм. Згадану суміш перемішують впродовж ночі при кімнатній температурі та фільтрують. Одержаний залишок перекристалізовують з одержанням проміжної сполуки 2. Додають 6-хлорпуринрибозид і згадану суміш зі сполукою 2 розчиняють у метанолі та обробляють триетиламіном. Згадану реакційну суміш нагрівають до 80°С впродовж 30 годин. Шляхом виділення та очищення одержують Сполуку 3. ПРИКЛАД 2 Сполуки за цим винаходом, які було одержано за згаданим способом Прикладу 1, випробували на двох функціональних моделях, специфічних для функціонування агоністу А 1 рецептору аденозину. Першою згаданою моделлю було опосередковане Α1 рецептором пригнічення стимульованого ізопротеренолом накопичення цАМФ у DDT клітинах. ЕС50 кожної похідної наведено у Таблиці. У Таблиці, крім того, вказана здатність кожної похідної до стимулювання продукування цАМФ у PC12 клітинах, тобто функція агоністичного стимулювання А2 рецепторів аденозину. Коефіцієнт відносної активності кожної сполуки щодо стимулювання А1 рецептору або A2 рецептору називають вибірковістю кожної сполуки відносно А 1 рецептору. Як показано у Таблиці, кожна похідна є відносно вибірковою, як агоніст А1 рецептору. Застосування вимірювання метаболізму цАМФ, як проби на функціонування А 1 рецептору аденозину, було описано раніше (Скаммелс П. (Scammells P), Бейкер С. (Baker S), Белардінеллі Л. (Belardinelli L.) та Олссон Р. (Olsson R), 1994, Substituted 1,3-dipropylxanthines as irreversible antagonists of A 1 adenosiae receptors. J. Med. Chem. 37:2794-2712, 1994). Таблиця Сполука R I II III IV V 4-амінопіран (±)-3-амінотетрагідрофуран (R)-3-амінотетрагідрофуран (1)-капролактам (S)-3-амінотетрагідрофуран EC50 (нМ), DDT клітини 12 13 1,08 161 3,40 EC50 (нМ), PC12 клітини 970 1400 448 181 7680 A1/A2 A2/A1 0,012 0,0093 0,0024 0,889 0,00044 80,0 107,6 414 1,12 2258 Сполуки було випробувано також на цілоорганній моделі активації А 1 рецептору відносно функції передсердь та атріовентрикулярного вузлу. На цій моделі, серця морських свинок виділяли та піддавали перфузії фізрозчином, до складу якого входила згадана сполука, у той час як частота скорочень передсердя та час провідності атріовентрикулярного вузлу визначали шляхом електрографічного вимірювання тривалості циклу передсердь та інтервалів атріовентрикулярного вузлу, як докладно описано у роботі Белардінеллі Л., Лу Дж. (Lu J.), Денніса Д. (Dennis D.), Мартена Дж. (Martens J.), Шрока Дж. (Shryock J.) (1994); The cardiac effects of a novel A1-adenosine receptor agonist in guinea pig isolated heart. J. Pharm. Exp. Therap. 271:1371-1382 (1994). Як показано на Фігурі 1, кожна похідна була ефективною відносно уповільнення частоти скорочень передсердь та подовження часу провідності атріовентрикулярного вузлу серця, яке ритмічно скорочувалось, залежним від концентрації чином, що, тим самим, демонструвало їх ефективність, як агоністів A1 рецептору аденозину на інтактному серці. ПРИКЛАД 3 Одержання N-бензилоксикарбоніл-4-амінопірану. Суміш 4-піранілкарбонової кислоти (2,28г, 20ммоль), дифенілфосфорилазиду (4,31мл, 20ммоль), триетиламіну (2,78мл, 20ммоль) у діоксані (40мл) нагрівали на масляній бані (100°С) у атмосфері сухого азоту впродовж 1 години. Додавали бензиловий спирт (2,7мл, 26ммоль) і нагрівання продовжували при 100°С впродовж 22 годин. Одержану суміш охолоджували, відфільтровували від осаду білого кольору та концентрували. Одержаний залишок розчиняли у 2N НСІ та двічі екстрагували EtOAc. Одержані екстракти промивали водою, бікарбонатом натрію, розсолом, після чого сушили над MgSO4 та концентрували до одержання масла, яке стверджувалось при відстоюванні. Згадане масло хроматографували (30%-60% ЕtOАс/Нех) з одержанням 1,85г твердої речовини білого кольору (40%). Одержання 4-амінопірану. N-бензилоксикарбоніл-4-амінопіран (1,85г, 7,87ммоль) розчиняли у МеОН (50мл) разом з концентрованою НСI та Pd-C (10%, 300мг). До реактору нагнітали водень під тиском у 1атм. і згадану суміш перемішували впродовж 18 годин при кімнатній температурі. Згадану суміш фільтрували через шар целіту та концентрували. Одержаний залишок двічі випарювали разом з МеОН/ЕtOАс та перекристалізовували з MeOH/EtOAc з одержанням 980мг (91%) голчатих кристалів білого кольору (температура розтоплення 228230°С). Одержання 6-(4-амiнопіран)-пуринрибозиду. Суміш 6-хлорпуринрибозиду (0,318г, 1,1ммоль), 4-амінопіран-НСІ (0,220мг, 1,6ммоль) та триетиламіну (0,385мл, 2,5ммоль) у метанолі (10мл) нагрівали до 80°С впродовж 30 годин. Одержану суміш охолоджували, концентрували і одержаний залишок хроматографували (90:10:1, CH2Cl2/MeОH/PrNH2). Відповідні фракції збирали та піддавали повторному хроматографуванню за допомогою хроматрону (2мм пластинка, 90:10:1, СН2СІ 2/МеОН/PrNH2) з одержанням піни не зовсім білого кольору (0,37г, 95%), ПРИКЛАД 4 Одержання N-бензилоксикарбоніл-3-амінотетрагідрофурану Суміш 3-тетрагідрофуранкарбонової кислоти (3,5г, 30ммоль), дифенілфосфорилазиду (6,82мл, 32ммоль), триетиламіну (5мл, 36ммоль) у діоксані (35мл) перемішували при кімнатній температурі впродовж 20 хвилин з наступним нагріванням на масляній бані при 100°С у атмосфері сухого азоту впродовж 2 годин. Додавали бензиловий спирт (4,7мл, 45ммоль) і нагрівання продовжували при 100°С впродовж 22 годин. Одержану суміш охолоджували, відфільтровували від осаду білого кольору та концентрували. Одержаний залишок розчиняли у 2N НСІ та двічі екстрагували EtOAc. Одержані екстракти промивали водою, бікарбонатом натрію, розсолом, після чого сушили над MgSO4 та концентрували до одержання масла, яке стверджувалось при відстоюванні. Згадане масло хроматографували (30%-60% ЕtOАс/Нех) з одержанням 3,4г масла (51%). Одержання 3-амінотетрагідрофурану. N-бензилоксикарбоніл-3-амінотетрагідрофуран (3,4г, 15ммоль) розчиняли у МеОН (50мл) разом з концентрованою НСI та Pd-C (10%, 300мг). До реактору нагнітали водень під тиском у 1атм. і згадану суміш перемішували впродовж 18 годин при кімнатній температурі. Згадану суміш фільтрували через шар целіту та концентрували. Одержаний залишок двічі випарювали разом з MeOH/EtOAc та перекристалізовували з MeOH/EtOAc з одержанням 1,9г твердої речовини жовтого кольору. Одержання 6-(3-амінотетрагірофураніл)-пуринрибозвду. Суміш 6-хлорпуринрибозиду (0,5г, 1,74ммоль), 3-амінотетрагідрофурану (0,325г, 2,6ммоль) та триетиламіну (0,73мл, 5,22ммоль) у метанолі (10мл) нагрівали до 80°С впродовж 40 годин. Одержану суміш охолоджували та концентрували. Одержаний залишок фільтрували через коротку силікагелеву колонку з елююванням 90/10/1 (СН2СІ2/МеОН/PrNH2), фракції, до складу яких входив продукт, об'єднували та концентрували. Одержаний залишок хроматографували на хроматроні (2мм пластинка, 92,5/7,5/1, СН2СІ 2/МеОН/PrNH2). Одержану тверду речовину білого кольору перекристалізовували з MeOH/EtOAc з одержанням 0,27г кристалів білого кольору (температура розтоплення 128-130°С). ПРИКЛАД 5 Розділення 3-амінотетрагідрофурану гідрохлориду Суміш 3-амінотетрагідрофурану гідрохлориду (0,5г, 4ммоль) та (S)-(+)-10-камфорсульфонілхлориду (1,1г, 4,44ммоль) у піридині (10мл) перемішували впродовж 4 годин при кімнатній температурі, після чого концентрували. Одержаний залишок розчиняли у EtOAc та промивали 0,5N HCІ, бікарбонатом натрію та розсолом. Одержаний органічний шар сушили над MgSO4, фільтрували та концентрували з одержанням 1,17г масла брунатного кольору (97%), яке хроматографували на силікагелі (від 25% до 70% EtOAc/Hex). Одержану тверду речовину білого кольору піддавали повторній перекристалізації з ацетону, одержані кристали та супернатант змішували доти, доки не було досягнуто підсилення, яке перевищувало 90% за даними 1Н ЯМР. Одержання 3-(S)-амінотетрагідрофурану гідрохлориду Сульфонамід (170мг, 0,56ммоль) розчиняли у суміші концентрованої НСІ/АсОН (по 2мл кожного компоненту), перемішували впродовж 20 годин при кімнатній температурі, тричі промивали СН2СІ 2 (10мл) та концентрували до сухості з одержанням 75мг (у кількісн. відношенні) твердої речовини білого кольору. Одержання 6-(3-(S)-амінотетрагідрофураніл)пуринрибозиду. Суміш 6-хлорпуринрибозиду (30мг, 0,10ммоль), 3-(S)-амінотетрагідрофурану гідрохлориду (19мг, 0,15ммоль) та триетиламіну (45мл, 0,32ммоль) у метанолі (0,5мл) нагрівали до 80°С впродовж 18 годин. Одержану суміш охолоджували, концентрували та хроматографували за допомогою 95/5 (СН2СІ 2/МеОН) з одержанням 8мг (24%) твердої речовини білого кольору.
ДивитисяДодаткова інформація
Назва патенту англійськоюN6 heterocyclic substituted adenosine derivatives
Назва патенту російськоюN6 гетероциклические замещенные производные аденозина
МПК / Мітки
МПК: A61K 31/00, A61K 31/7052, A61P 9/06, C07H 19/16, A61P 43/00, A61K 31/70, A61K 31/7064, A61P 5/24, A61K 31/7076, C07H 19/167, A61K 31/7042, A61K 31/706
Мітки: заміщені, похідні, аденозину, гетероциклічні
Код посилання
<a href="https://ua.patents.su/6-62936-n6-geterociklichni-zamishheni-pokhidni-adenozinu.html" target="_blank" rel="follow" title="База патентів України">N6 гетероциклічні заміщені похідні аденозину</a>
Попередній патент: Заміщені піридини, фармацевтична композиція на їх основі та спосіб лікування опосередкованих циклооксигеназою захворювань
Наступний патент: Спосіб визначення коефіцієнта екстинкції
Випадковий патент: Спосіб реагентного пом'якшення води