Спосіб одержання циталопраму
Формула / Реферат
1. Спосіб одержання циталопраму, який включає взаємодію сполуки формули
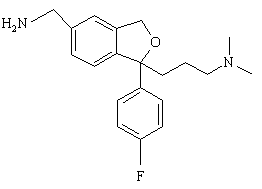 (IV)
(IV)
з окиснювальним агентом з утворенням циталопраму
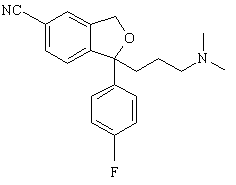 , (I)
, (I)
який виділяють у виді основи або його фармацевтично прийнятної солі.
2. Спосіб за п. 1, який відрізняється тим, що проміжну сполуку формули IV одержують активацією спирту формули VIII
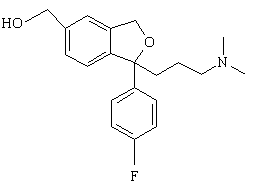 (VIII)
(VIII)
заміщеним сульфонатом або перетворенням спирту в бензилгалогенід або інше активоване похідне з наступним амінолізом з утворенням сполуки формули IV
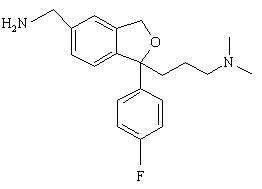 (IV).
(IV).
3. Спосіб за п. 2, який відрізняється тим, що проміжну сполуку формули VIII одержують взаємодією сполуки формули VII
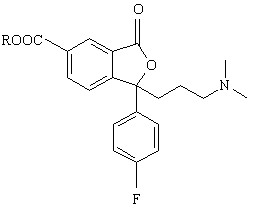 (VIІ)
(VIІ)
з відновлювальним агентом.
4. Спосіб за п. 3, який відрізняється тим, що проміжну сполуку формули VII одержують алкілуванням сполуки формули VI
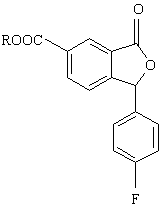 , (VI)
, (VI)
необов'язково, ступінчастим алкілуванням.
5. Спосіб за п. 4, який відрізняється тим, що проміжну сполуку формули VI одержують взаємодією сполуки формули V
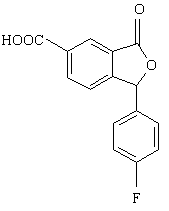 (V)
(V)
зі спиртом R-OH у присутності дегідратуючого агента.
6. Спосіб за п. 1, який відрізняється тим, що проміжну сполуку формули IV одержують взаємодією сполуки формули Х
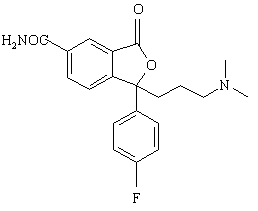 (X)
(X)
з відновлювальним агентом з наступною циклізацією з утворенням сполуки формули IV
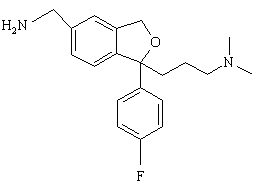 (IV).
(IV).
7. Спосіб за п. 6, який відрізняється тим, що проміжну сполуку формули Х одержують алкілуванням сполуки формули IX
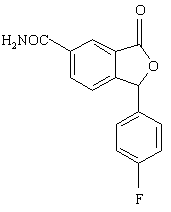 , (IX)
, (IX)
необов'язково, ступінчастим алкілуванням.
8. Спосіб за п. 7, який відрізняється тим, що проміжну сполуку формули IX одержують взаємодією сполуки формули V
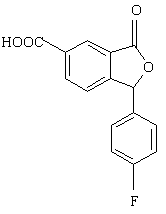 (V)
(V)
з дегідратуючим агентом, таким як тіонілхлорид, з наступним амінолізом одержаного активованого похідного кислоти.
9. Спосіб за п. 1, який відрізняється тим, що проміжну сполуку формули IV одержують взаємодією сполуки формули XII
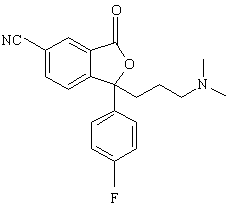 (XII)
(XII)
з відновлювальним агентом з наступною циклізацією з утворенням сполуки формули IV
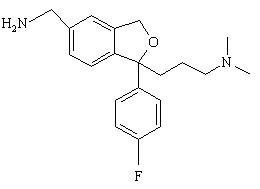 (IV).
(IV).
10. Спосіб за п. 9, який відрізняється тим, що проміжну сполуку формули XII одержують алкілуванням сполуки формули XI
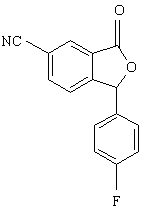 , (XI)
, (XI)
необов'язково, ступінчастим алкілуванням.
11. Спосіб за п. 10, який відрізняється тим, що проміжну сполуку формули XI одержують перетворенням сполуки формули V
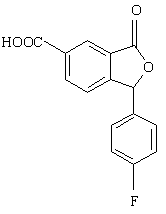 (V)
(V)
у відповідну ціанозаміщену сполуку.
12. Сполука формули V
 (V).
(V).
13. Спосіб одержання проміжної сполуки по пункту 12, який включає реакцію циклізації сполуки формули XIII
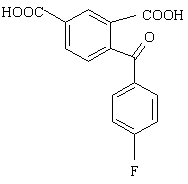 (XIII)
(XIII)
придатним відновлювальним агентом.
14. Спосіб за п. 13, де відновлювальним агентом є Zn у кислоті, переважно оцтовій кислоті.
15. Спосіб за п. 1, який відрізняється тим, що проміжну сполуку формули IV одержують алкілуванням сполуки формули XVII
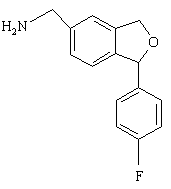 , (XVII)
, (XVII)
необов'язково, ступінчастим алкілуванням з утворенням сполуки формули IV
 (IV).
(IV).
16. Спосіб за п. 15, який відрізняється тим, що проміжну сполуку формули XVII одержують амінолізом сполуки формули XVI
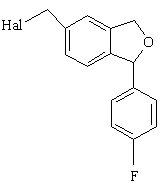 (XVI).
(XVI).
17. Спосіб за п. 16, який відрізняється тим, що проміжну сполуку формули XVI одержують активацією спирту формули XV
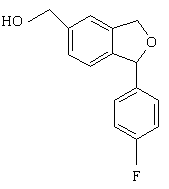 (XV)
(XV)
заміщеним сульфонатом або перетворенням цього спирту в бензилгалогенід або інше активоване похідне.
18. Спосіб за п. 17, який відрізняється тим, що проміжну сполуку формули XV одержують взаємодією кетону формули XIII
 (XIII)
(XIII)
з відновлювальним агентом з наступною циклізацією з утворенням сполуки формули XV.
Текст
Цей винахід відноситься до способу одержання добре відомого антидепресивного лікарського засобу циталопраму, 1-[3-(диметиламіно)пропіл]-1-(4-фторфеніл)-1,3-дигідро-5-ізобензофуранкарбонітрилу. Циталопрам є добре відомим антидепресивним лікарським засобом, що є у продажу вже протягом декількох років і має наступну стр уктуру: Він є селективним, що впливає на центральну нервову систему, інгібітором зворотного захоплення серотоніну (5-гідрокситриптаміну; 5-НТ) і, відповідно, виявляє антидепресивну активність. Про антидепресивну активність даної сполуки повідомлялося в ряді публікацій, наприклад, J. H yttel, Prog. Neuro-Psychopharmacol. & Biol. Psychiat, 1982, 6, 277-295 та A. Gra vem, Ada Psychiatr. Scand., 1987, 75, 478-486. Зазначену сполуку додатково розкрито у ЕР-А474580, де описується її дія при лікуванні деменції та цереброваскулярних порушень. Циталопрам був уперше розкритий у DE2657013, що відповідає US4136193. Зазначена патентна публікація описує одержання циталопраму одним із способів і надає у загальних рисах інший метод, який може використовуватися для одержання циталопраму. Згідно з описаним способом відповідний 1-(4-фторфеніл)-1,3-дигідро-5-ізобензофуранкарбонітрил піддають реакції з 3-(N,N-диметиламіно)пропіл-хлоридом у присутності метилсульфінілметиду в якості конденсуючого агента. Початковий матеріал одержують з відповідного 5-бромопохідного реакцією з ціанідом міді. У відповідності зі способом, який охарактеризований тільки в загальних рисах, циталопрам можна одержати циклізацією сполуки: у присутності дегідратуючого агента та наступним обміном групи 5-бром з ціанідом міді(І). Вихідний матеріал формули II одержують з 5-бромфталіду двома послідовними реакціями Гріньяра, тобто з 4фтор фенілмагнійхлоридом і Ν,Ν-диметиламінопропілмагнійхлоридом, відповідно. Новий і несподіваний спосіб одержання циталопраму та проміжну сполуку описано в патенті США №4650884, згідно з яким проміжну сполуку формули піддають реакції циклізації дегідратацією сильною сірчаною кислотою для одержання циталопраму. Проміжну сполуку формули III одержують з 5-ціанофталіду двома послідовними реакціями Гріньяра, тобто з 4хлорфенілмагній-галогенідом і Ν,Ν-диметиламінопропілмагнійгалогенідом, відповідно. Подальші способи описані в міжнародних патентних публікаціях №№WO98019511, WO98019512 і WO98019513. WO98019512 і WO98019513 відносяться до способів, у яких 5-аміно-, 5-карбокси- або 5-(втор. амінокарбоніл)фталід піддають двом послідовним реакціям Гріньяра, циклізації і перетворенню утвореного похідного 1,3-дигідроізобензофурану у відповідну 5-ціаносполуку, тобто циталопрам. У міжнародній патентній публікації №WO98019511 описано спосіб одержання циталопраму, у якому сполуку (4-заміщений-2гідроксиметилфеніл-(4-фторфеніл)метанол піддають циклізації й утворений 5-заміщений 1-(4-фторфеніл)-1,3дигідроізобензофуран перетворюють у відповідне 5-ціанопохідне, яке алкілують (3диметиламіно)пропілгалогенідом для одержання циталопраму. Нарешті, способи одержання індивідуальних енантіомерів циталопраму описано в патенті СЩА №4943590, з якого також випливає, що циклізацію проміжної сполуки формули III можна проводити через лабільний складний ефір основою. Тепер несподівано було виявлено, що циталопрам можна виготовити новим зручним і безпечним способом з використанням загальноприйнятих ви хідних матеріалів. Відповідно до цього, цей винахід відноситься до нового способу одержання циталопраму, який містить взаємодію сполуки формули IV з придатним окиснювальним агентом, таким як мідь(І) і О2; або NiSO4 і К2S 2О 8, з одержанням циталопраму який виділяють у виді основи або його фармацевтично прийнятної солі. В іншому аспекті винахід відноситься до способів одержання проміжної сполуки формули IV. Ще в одному аспекті цей винахід відноситься до антидепресивної фармацевтичної композиції, яка містить циталопрам у виді основи або його будь-якої придатної солі, одержаної за способом винаходу. Крім того, відповідно до винаходу, сполуку формули IV можна одержати різними способами. Один з цих способів включає наступні стадії: 6-карбокси-3-(4-фторфеніл)фталід піддають взаємодії зі спиртом R-OH, де R являє собою, переважно, нижчий алкіл, найбільш переважно, Me, у присутності дегідратуючого агента, переважно, SOCl2. Утворену в результаті сполуку формули VI алкілують де X являє собою груп у, що видаляється, у присутності придатної основи. X, переважно, являє собою галоген або сульфонат. Реакція алкілування, необов'язково, є ступінчастим алкілуванням. У цьому випадку утворену сполуку формули VI алкілують сполукою, що має формулу де X’ являє собою придатну груп у, що видаляється, і R’ являє собою –СН2-О-Рg, -CH2-NPg1Pg2, -CON(CH3)2, -CH(OR 1)(OR2), -C(OR4)(OR5)(OR6) або COOR3, де Pg являє собою захисну груп у для спиртової групи, Рg1 і Рg2 є захисними групами для аміногрупи, R1 і R2 являють собою алкільні групи або R1 і R2 разом утворюють ланцюг з 2-4 атомів вуглецю, і R 3, R4, R5 і R6 являють собою алкіл, алкеніл, алкініл, арил або аралкіл; з утворенням сполуки формули XVIII де R’ має зазначені вище значення, з наступним перетворенням групи R' у диметиламінометильну груп у. Утворену сполуку формули VII піддають взаємодії з відновлювальним агентом, таким як LiAIH4, червонийАІ, АІН3 або активовані форми NaBH4, наприклад, NaBH4, Me2SO 4; NaBH 4, l2 ; NaBH 4, BF 3, Et2 O; або В2Н6, з наступною обробкою кислотою або іншим дегідратуючим агентом для проведення циклізації з утворенням сполуки формули VIII. Спирт формули VIII придатним способом активують тозилхлоридом або мезилхлоридом з утворенням відповідного заміщеного сульфонату або спирт перетворюють у відповідний бензилгалогенід. Перетворення, переважно, проводять SOBr2 або SOCI2. Відповідний сульфонат або галогенід або перетворюють безпосередньо в сполуку формули IV шля хом взаємодії з рідким аміаком; або шляхом взаємодії із металевою сіллю фталіміду, переважно, фталімідом калію, з наступною обробкою NH2NH2 або обробкою аміном у спирті, тобто R8NH2 /R9-OH, де R8 і R 9 являють собою нижчий алкіл, переважно, метил або етил, наприклад, метиламіном у етанолі; або взаємодією з азидом металу, MN3, причому М, переважно, являє собою Na або К; з наступною обробкою відновлювальним агентом, таким як Pd/C і Н2 або гідридне джерело, таке як LiAIH4 або NaBH4 або його активована форма. Інший спосіб одержання сполуки формули IV включає наступні стадії: 6-карбокси-3-(4-фторфеніл)фталід придатним чином піддають взаємодії з дегідратуючим агентом, таким яктіонілхлорид, з наступним амінолізом утвореного активованого похідного кислоти. Утворену сполуку формули IX алкілують де X являє собою груп у, що видаляється, у присутності придатної основи. X, переважно, являє собою галоген або сульфонат. Реакція алкілування, необов'язково, є ступінчастим алкілуванням, аналогічним описаному вище ступінчастому алкілуванню. Утворену сполуку X піддають взаємодії з відновлювальним агентом, таким як LiAIH4, червоний-АІ, АІН3 або активовані форми NaBH4, наприклад, NaBH4, Me2SO 4; NaBH 4, I 2; NaBH 4, BF3*Et 2O; або В2Н6 ; з наступною обробкою кислотою або іншим дегідратуючим агентом для проведення циклізації з утворенням сполуки формули IV. Відповідно до третього способу одержання сполуки формули IV, одержують відповідне 6-ціанозаміщене похідне 6-карбокси-3-(4-фторфеніл)фталіду. Карбоксипохідне або піддають взаємодії з SOCl2 з наступною обробкою аміаком і, нарешті, дегідратуючим агентом, таким як SOCI2, з одержанням ціанопохідного формули XI; або піддають взаємодії зі спиртом R-OH у присутності кислоти з наступною обробкою аміаком і, нарешті, піддають взаємодії з SOCl2; або піддають взаємодії в одному резервуарі, наприклад, з SO2(NH2)2, SOCI2 і сульфоланом або з mpem-бутиламіном, дегідратуючим агентом, таким як РОСІ3, і придатним розчинником, таким як толуол. Утворену сполуку формули XI алкілують де X являє собою груп у, що видаляється, у присутності придатної основи. X, переважно, являє собою галоген або сульфонат. Реакція алкілування, необов'язково, є ступінчастим алкілуванням, аналогічним описаному вище ступінчастому алкілуванню. Утворену сполуку формули XII піддають взаємодії з відновлювальним агентом, таким як LіАІН4, червонийАІ, АІН 3 або активовані форми NaBH4, наприклад, NaBH4, Me2SO4; NaBH 4, I 2, NaBH 4, BF3*Et 2O; або В2Н6; з наступною обробкою кислотою для проведення циклізації з утворенням сполуки формули IV. Інші умови взаємодії, розчинники тощо для описаних вище реакцій є загальноприйнятими умовами для таких взаємодій, та їх може легко визначити фа хівець у даній галузі. В іншому аспекті цей винахід відноситься до нової проміжної сполуки формули V. У наступному аспекті винахід відноситься до способів одержання проміжної сполуки формули V. Один ступінчастий спосіб одержання проміжної сполуки формули V ілюструється нижче: м-ксилол і п-фторбензоїлхлорид, які є комерційно доступними сполуками, піддають взаємодії в присутності АІСl3, одержуючи при цьому сполуку формули XIV. Це сполуку окиснюють перманганатом, переважно, КМnО4 або NaMnO4, одержуючи при цьому сполуку формули XIII, яку, нарешті, піддають взаємодії придатним способом з Zn у кислоті, переважно, в оцтовій кислоті. В альтернативному випадку сполуку формули IV одержують із сполуки формули XIII наступним ступінчастим способом: Сполуку формули XIII піддають взаємодії з відновлювальним агентом, таким як LіАІН4, червоний-АІ, АІН3 або активовані форми NaBH4, наприклад, NaBH4, Me2SO 4; NaBH 4, I2, NaBH4, BF 3*Et2O; або В2Н6; з наступною обробкою кислотою для проведення циклізації з утворенням сполуки формули XV. Спирт формули XV загальноприйнятим способом активують тозилхлоридом або мезилхлоридом з утворенням відповідно заміщеного сульфонату; або спирт перетворюють у відповідний бензилхлорид. Це перетворення, переважно, проводять SOBr2 або SOCl2. Відповідний сульфонат або галогенід або перетворюють безпосередньо в сполуку формули XVII взаємодією з рідким аміаком; або взаємодією з металевою сіллю фталіміду, переважно, фталімідом калію, з наступною обробкою NH2NH2 або обробкою аміном у спирті, наприклад, R8NH2/R9-OH, де R8 і R9 являють собою нижчий алкіл, переважно, метил або етил, переважно, метиламіном у етанолі; або взаємодією з азидом металу МN3, причому, М, переважно, являє собою Na або К; з наступною обробкою відновлювальним агентом, таким як Pd/C і Н2 або гідридне джерело, таке як LiAIH4 або NaBH4 або його активована форма. Утворену сполуку формули XVII алкілують де X являє собою груп у, що видаляється, у присутності придатної основи. X, переважно, являє собою галоген або сульфонат. Реакція алкілування, необов'язково, є ступінчастим алкілуванням, аналогічним описаному вище ступінчастому алкілуванню. Стадії алкілування та перетворення в ціанопохідне, необов'язково, проводять у зворотному порядку, так що перетворення в ціанопохідне проводять до алкілування. Скрізь в описі та формулі винаходу терміни "алкіл" та "С1-6-алкіл" відносяться до розгалуженої або нерозгалуженої алкільної групи, що має від одного до шести атомів вуглецю включно, такої як метил, етил, 1пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-2-пропіл, 2,2-диметил-1-етил і 2-метил-1-пропіл. Аналогічно, терміни "алкеніл" і "алкініл" позначають, відповідно, такі групи, що містять від двох до шести атомів вуглецю і включають один подвійний зв'язок і потрійний зв'язок, відповідно, такі як етеніл, пропеніл, бутеніл, етиніл, пропініл, бути ніл. Термін "арил" відноситься до моно- або біциклічних карбоциклічних ароматичних груп, таких як феніл і нафтил, особливо, як феніл. Термін "аралкіл" відноситься до арилалкільної групи, де арил і алкіл є такими, як визначено вище. "Галоген" означає хлор, бром або йод. Сполуку загальної формули І можна використовувати у виді вільної основи або у виді її фармацевтично прийнятної кислотно-адитивної солі. У якості кислотно-адитивних солей можуть бути використані солі, утворені органічними або неорганічними кислотами. Прикладами таких солей органічних кислот є солі малеїнової, фумарової, бензойної, аскорбінової, бурштинової, ща влевої, біс-метиленсаліцилової, метансульфонової, етандисульфонової, оцтової, пропіонової, винної, саліцилової, лимонної, глюконової, молочної, яблучної, мигдалевої, коричної, цитраконової, аспарагінової, стеаринової, пальмітинової, ітаконової, гліколевої, п-амінобензойної, глютамінової, бензолсульфонової і теофіліноцтової кислот, а також утворені з 8галогентеофілінами, наприклад, 8-бромотеофіліном. Прикладами адитивних солей неорганічних кислот є солі хлористоводневої, бромистоводневої, сірчаної, сульфамінової, фосфорної і азотної кислот. Кислотно-адитивні солі сполук можуть бути одержані за відомими способами. Основу піддають реакції або з розрахованою кількістю кислоти в розчиннику, який змішується з водою, такому як ацетон або етанол, з наступним виділенням солі концентруванням і охолодженням, або з надлишком кислоти в розчиннику, який не змішується з водою, такому як етиловий ефір, етилацетат або дихлорометан, при цьому виділення солі здійснюється спонтанно. Фармацевтичні композиції за винаходом можуть вводитися будь-яким придатним способом і в будь-якій придатній формі, наприклад, перорально у формі таблеток, капсул, порошків або сиропів або парентерально у формі звичайних стерильних розчинів для ін'єкцій. Фармацевтичні форми за винаходом можуть бути приготовлені за звичайними способами, відомими в практиці. Наприклад, таблетки можуть бути приготовлені змішанням активних інгредієнтів зі звичайними ад'ювантами та/або розріджувачами і наступним пресуванням суміші в звичайній таблетувальній машині. Приклади ад'ювантів або розріджувачів включають кукурудзяний крохмаль, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, смоли тощо. Будь-які інші ад'юванти або добавки, барвники, ароматизатори, консерванти тощо можуть використовуватися за умови їхньої сумісності з активними інгредієнтами. Розчини для ін'єкцій можуть бути приготовлені розчиненням активного інгредієнта і можливих добавок у частині розчинника для ін'єкцій, переважно, стерильної води, доведенням розчину до потрібного об'єму, стерилізацією розчину і заповненням їм придатних ампул або пляшечок. Можуть бути додані будь-які придатні добавки, звичайно використовувані в практиці, такі як засоби для досягнення ізотонічності, консерванти, антиоксиданти тощо. Приклади Винахід далі ілюструється наступними прикладами. Приклад 1 5-амінометил-1-(3-диметиламінопропіл)-1-(4-фторфеніл)-1,3-дигідроізобензофуран 1-(3-Диметиламінопропіл)-1-(4-фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонітрил (5,4г, 16,2ммоль) розчиняють у сухому ТГФ (5мл) і розбавляють сухим ефіром (50мл). Цей розчин додають по краплях до киплячої у колбі зі зворотним холодильником суспензії алюмогідриду літію (2,5г, 65ммоль) у сухому ефірі (150мл) протягом 10-15 хвилин, після чого утворену суспензію нагрівають при кип'ятінні зі зворотним холодильником протягом додаткових 4 годин. Розчин залишають для охолодження до кімнатної температури та перемішують при кімнатній температурі протягом ночі. Реакційну суміш гасять мінімальною кількістю води і утворений розчин/суспензію сушать над безводним сульфатом магнію. Суміш фільтрують і твердий корж промивають ТГФ. Об'єднані фільтрати випарюють, одержуючи при цьому олію. Олію розчиняють у толуолі (200 мл) і перемішують з водним розчином сірчаної кислоти (10мл, 70об./об. %) протягом 3 годин. Суміш розбавляють водою і рН доводять до більше ніж 9 додаванням водного розчину аміаку (25 мас/об. %). Толуол відокремлюють і водну фазу екстрагують наступною порцією толуолу. Об'єднані толуолові екстракти сушать над безводним сульфатом магнію, фільтрують і випарюють, одержуючи при цьому зазначену в заголовку сполуку у вигляді жовтої олії (4,4г, 84%). 1Н ЯМР (CDCl3): d 1,25-1,40 (м, 1Н), 1,40-1,55 (м, 1Н), 2,11 (ддд, 1Н), 2,13 (т, 3Н), 2,15 (ддд, 1Н), 2,21 (т, 2Н), 3,85 (с, 2Н), 5,11 (д, 1Н), 5,14 (д, 1Н), 6,96 (т, 2Н), 7,15 (с, 1Н), 7,21 (д, 1Н), 7,22 (д, 1Н), 7,45 (дд, 2Н). Приклад 2 Циталопрам, НВr Суміш 5-амінометил-1-(3-диметиламінопропіл)-1-(4-фторфеніл)-1,3-дигідроізобензофурану (10г, 30ммоль) і молекулярних сит 5А (24г) у піридині (150мл) перемішують при 60°С в атмосфері кисню. Додають хлорид міді(І) (1,8г, 1,8ммоль) і суміш перемішують протягом 3 годин. Додають наступну порцію хлориду міді(І) (1,8г, 1,8ммоль) і суміш перемішують протягом ночі. Суміш виливають на лід і рН суміші доводять до більш ніж 9 додаванням водного розчину аміаку (25мас/об. %). Розчин розбавляють толуолом і фільтрують. Органічну фазу відокремлюють і водну фазу промивають додатковим толуолом. Об'єднані органічні екстракти промивають водою, сушать над безводним сульфатом натрію й випарюють. Залишок обробляють гептаном і випарюють, одержуючи при цьому олію (11,1г). Цю олію розчиняють в ацетоні й обробляють водною бромистоводневою кислотою (7мл, 47мас/об. %). Розчин випарюють і залишок розчиняють у ізопропанолі (100 мл). Розчин перемішують протягом ночі. Одержаний осад відфільтровують і сушать, одержуючи при цьому сіль циталопраму з НВr у вигляді білого порошку (8,2г, 66%). Фільтрат випарюють і маслянистий залишок струшують з ефіром і залишають на ніч. Фільтрування розчину дає додаткову сіль циталопраму з НВr у вигляді коричневої твердої речовини (1,7г, 14%). 1Н ЯМР (d6-ДMCO): d 1,35-1,50 (м, 1Н), 1,50-1,60 (м, 1Н), 2,25 (т, 2Н), 2,69 (с, 3Н), 3,00-3,10 (м, 2Н), 5,17 (д, 1Н), 5,25 (д, 1Н), 7,18 (τ, 2Η), 7,61 (дд, 2Н), 7,77 (д, 1Н), 7,82 (д, 1Н), 7,83 (с, 1Н), 9,27 (шир.с, 1Н). Приклад 3 Метиловий ефір 1-(4-фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонової кислоти Суспензію, що перемішується, 1-(4-фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонової кислоти (1г, 3,7ммоль) у тіонілхлориді (25мл) нагрівають при кип'ятінні зі зворотним холодильником протягом 25хв., під час такого кип'ятіння тверда речовина розчиняється. Тіонілхлорид потім випарюють і залишок розчиняють в толуолі та знову випарюють. Залишок перемішують у метанолі (25мл) протягом ночі, під час перемішування утворюється важкий осад. Розчинник випарюють, і залишок розподіляють між водним розчином аміаку (25мас/об. %) і толуолом. Органічну фазу відокремлюють, суша ть над сульфатом магнію й випарюють, одержуючи при цьому зазначену в заголовку сполуку у вигляді білої твердої речовини (0,97г, 92%). 1Н ЯМР (d6-ДMCO): d 3,92 (с, 3Н), 6,85 (с, 1Н), 7,26 (т, 2Н), 7,42 (дд, 2Н), 7,61 (д, 1Н), 8,31 (дд, 1Н), 8,36 (с, 1Н). Приклад 4 Амід 1-(4-фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонової кислоти Суспензію, що перемішується, 1-(4-фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонової кислоти (1г, 3,7ммоль) у тіонілхлориді (25мл) нагрівають при кип'ятінні зі зворотним холодильником протягом 25хв., під час кип'ятіння тверда речовина розчиняється. Тіонілхлорид потім випарюють і залишок розчиняють у толуолі та знову випарюють. Залишок розчиняють у толуолі (15мл) і обробляють розчином аміаку в ефірі, в результаті чого утворюється важкий осад. Суміш перемішують протягом ночі, розбавляють толуолом і водним розчином аміаку і фільтрують. Осад сушать, одержуючи при цьому зазначену в заголовку сполуку у вигляді білої твердої речовини (0,80г, 80%). 1Н ЯМР (d6-ДМСО): d 6,81 (с, 1Н), 7,25 (т, 2Н), 7,40 (дд, 2Н), 7,54 (д, 1Н), 7,59 (шир.с, 1Н), 8,24 (шир.с, 1Н), 8,24 (дд, 1Н), 8,42 (с, 1Н). Приклад 5 1-(4-Фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонітрил Суспензію аміду 1-(4-фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонової кислоти (13,6г, 0,05моль) у тіонілхлориді (40мл) і ДМФ (0,25мл) нагрівають при кип'ятінні зі зворотним холодильником протягом 2 годин. Тіонілхлорид потім випарюють і залишок розчиняють у гарячому ІРА (100мл). Після охолодження утворюються кристали зазначеної в заголовку сполуки. Вихід: 7,8г (62%). 1Н Я МР (d 6-ДMCO): d 6,87 (с, 1 Η), 7,26 (т, 2Η), 7,42 (дд, 2Η), 7,58 (д, 1Н),8,18(дд, 1Н),8,48(с, 1Н). Приклад 6 5-бромометил-1-(4-фторфеніл)-1,3-дигідроізобензофуран Суспензію 5-гідроксиметил-1-(4-фторфеніл)-1,3-дигідроізобензофурану (2г, 8,2ммоль) у толуолі (20мл) нагрівають до розчинення твердої речовини. Нагрівання потім припиняють. Додають тіонілбромід (2,2г, 10,6ммоль) і суміш перемішують протягом години. Додають діоксид кремнію (25г) та суміш фільтрують і залишок промивають розчином 1:1 (об./об.) етилацетату і гептану. Фільтрат випарюють, одержуючи при цьому зазначену в заголовку сполуку у вигляді червоно-оранжевої олії. (2,6г, 90%). 1Н ЯМР (d6-ДMCO): d 4,72 (с, 2Н), 5,11 (д, 1Н), 5,28 (д, 1Н), 6,17 (с, 1Н), 7,04 (д, 1Н), 7,17 (т, 2Н), 7,33 (д, 1Н), 7,38 (дд, 2Н),7,45(с, 1Н). Приклад 7 5-амінометил-1-(4-фторфеніл)-1,3-дигідроізобензофуран Суспензію 5-бромометил-1-(4-фторфеніл)-1,3-дигідроізобензофурану (1,96г, 6,4 ммоль) перемішують у рідкому повторно перегнаному аміаку (200мл) в атмосфері азот/аміак при -33°С протягом 2% днів. Аміаку дають можливість випаритися і залишок перемішують із сумішшю етилацетату і водної сірчаної кислоти (2М). Водну фазу відокремлюють і промивають ефіром. Водну фазу потім підлужують до рН більш ніж 9 з використанням водного розчину гідроксиду амонію (25мас/об. %) і екстрагують толуолом. Толуолові екстракти сушать над безводним сульфатом магнію й випарюють, одержуючи при цьому зазначену в заголовку сполуку у ви гляді жовто-оранжевої олії (0,63г, 40%). 1Н ЯМР (d6-ДMCO): d 3,72 (с, 2Н), 5,09 (д, 1Н), 5,25 (дд, 1Н), 6,14 (с, 1Н), 6,96 (д, 1Ή), 7,17 (т, 2Η), 7,20 (д, 1Н), 7,32 (с, 1Н), 7,36 (дд, 2Н). Приклад 8 Циталопрам До розчину, що перемішується, 5-амінометил-1-(3-диметиламінопропіл)-1-(4-фторфеніл)-1,3дигідроізобензофурану (0,5г, 1,5ммоль) у дихлорометані (10мл) додають водний розчин бісульфату калію і гідроксиду натрію (19мл, 0,2Μ в K2S 2O 8, 3,8ммоль; 0,4Μ в NaOH, 7,6ммоль) з наступним додаванням водного розчину сульфату нікелю (1,5мл, 40мм, 61мкмоль). Суміш енергійно перемішують протягом 4 днів і потім фільтрують крізь броунмілерит. Фільтрат розподіляють між водною сірчаною кислотою (2М) і толуолом. Водний шар відокремлюють і рН суміші доводять до більш ніж 9 додаванням водного розчину аміаку (25мас/об. %). Розчин екстрагують толуолом і цей останній толуоловий екстракт сушать над сульфатом магнію й випарюють, одержуючи при цьому вільну основу циталопраму у вигляді дуже блідо-жовтої олії (0,35г, 70%). Приклад 9 1-(4-Фторфеніл)-3-оксо-1,3-дигідроізобензофуран-5-карбонова кислота Цинк (38г, 0,58моль) суспендують в оцтовій кислоті (400мл). Суміш нагрівають до 60°С, порціями по 5 грамів додають 2,4-дикарбокси-4'фторбензофенон (21г, 0,075моль). Після додавання реакційну суміш нагрівають при температурі флегми протягом двох годин. Суспензію фільтрують, поки вона залишається ще гарячою. Фільтрат додають до суміші лід-вода (1кг) і зазначену в заголовку сполук у виділяють фільтруванням. Вихід 17,8г (90%). 1Н ЯМР (d6-ДМСО): d 6,84 (с, 1Н), 7,17 (т, 2Н), 7,43 (дд, 2Н), 7,59 (д, 1Н), 8,31 (д, 1Н), 8,35 (с, 1Н).
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of citalopram
Автори англійськоюPetersen Hans, Dancer Robert
Назва патенту російськоюСпособ получения циталопрама
Автори російськоюПетерсен Ханс, Дансер Роберт
МПК / Мітки
МПК: A61P 25/24, C07D 307/87, A61K 31/343, C07D 307/88
Мітки: одержання, спосіб, циталопраму
Код посилання
<a href="https://ua.patents.su/6-72039-sposib-oderzhannya-citalopramu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання циталопраму</a>
Попередній патент: Пристрій двовимірного перетворення хаара
Наступний патент: Спосіб синтезу n-[(s)-1-карбоксибутил]-(s)-аланінових ефірів та їх застосування у синтезі периндоприлу
Випадковий патент: Тримач мобільного пристрою на опорі










