Конденсовані похідні амінодигідротіазину, корисні як інгібітори васе
Номер патенту: 109927
Опубліковано: 26.10.2015
Автори: Кастро Пінейро Хосе Луіс, Фартінг Крістофер Нейл, Холл Адріан
Формула / Реферат
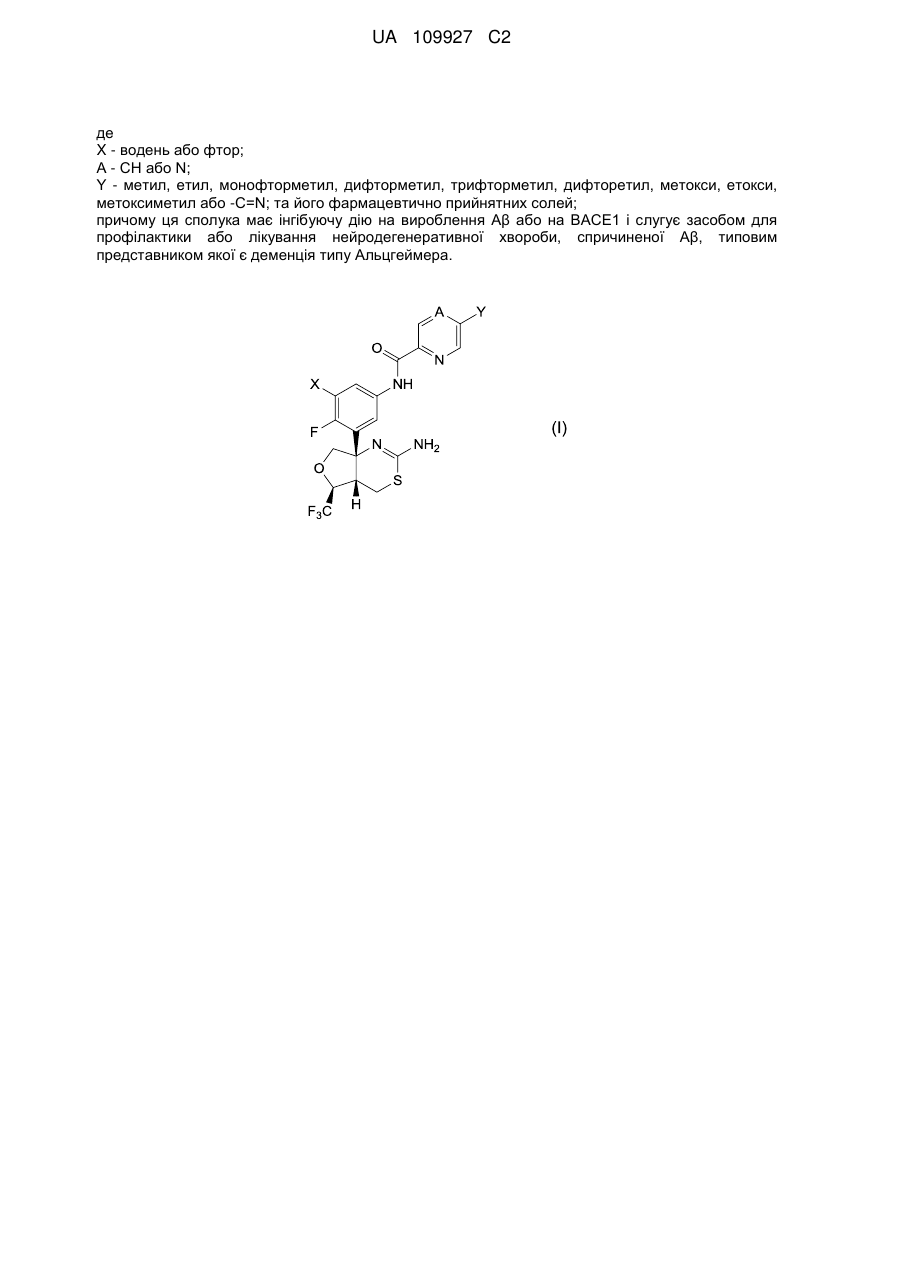
1. Сполука формули (І)
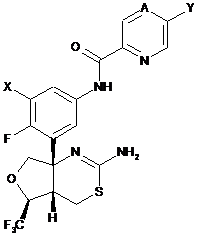 (I)
(I)
або її фармацевтично прийнятна сіль, де
X - водень або фтор;
А - СН або N;
Υ - метил, етил, монофторметил, дифторметил, трифторметил, дифторетил, метокси, етокси, метоксиметил або -C=N.
2. Сполука, як заявлено у п.1, де X - водень, або її фармацевтично прийнятна сіль.
3. Сполука, як заявлено у п. 1 або п. 2, де А - N, або її фармацевтично прийнятна сіль.
4. Сполука, як заявлено у пп. 1-3, де Υ - метил, монофторметил, дифторметил, трифторметил або метокси, або її фармацевтично прийнятна сіль.
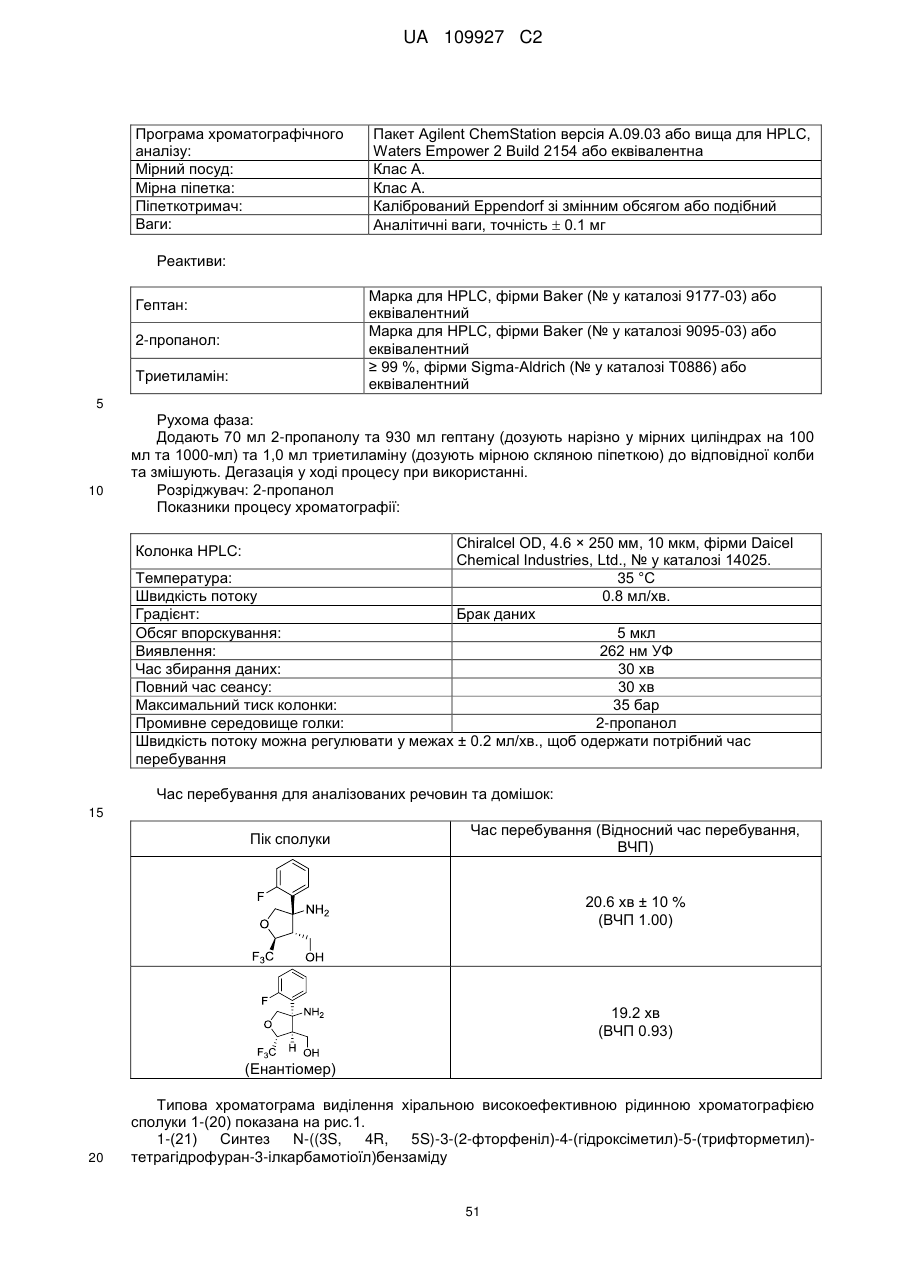
5. Сполука як заявлено у пп. 1-4, вибрана з-поміж наступних:
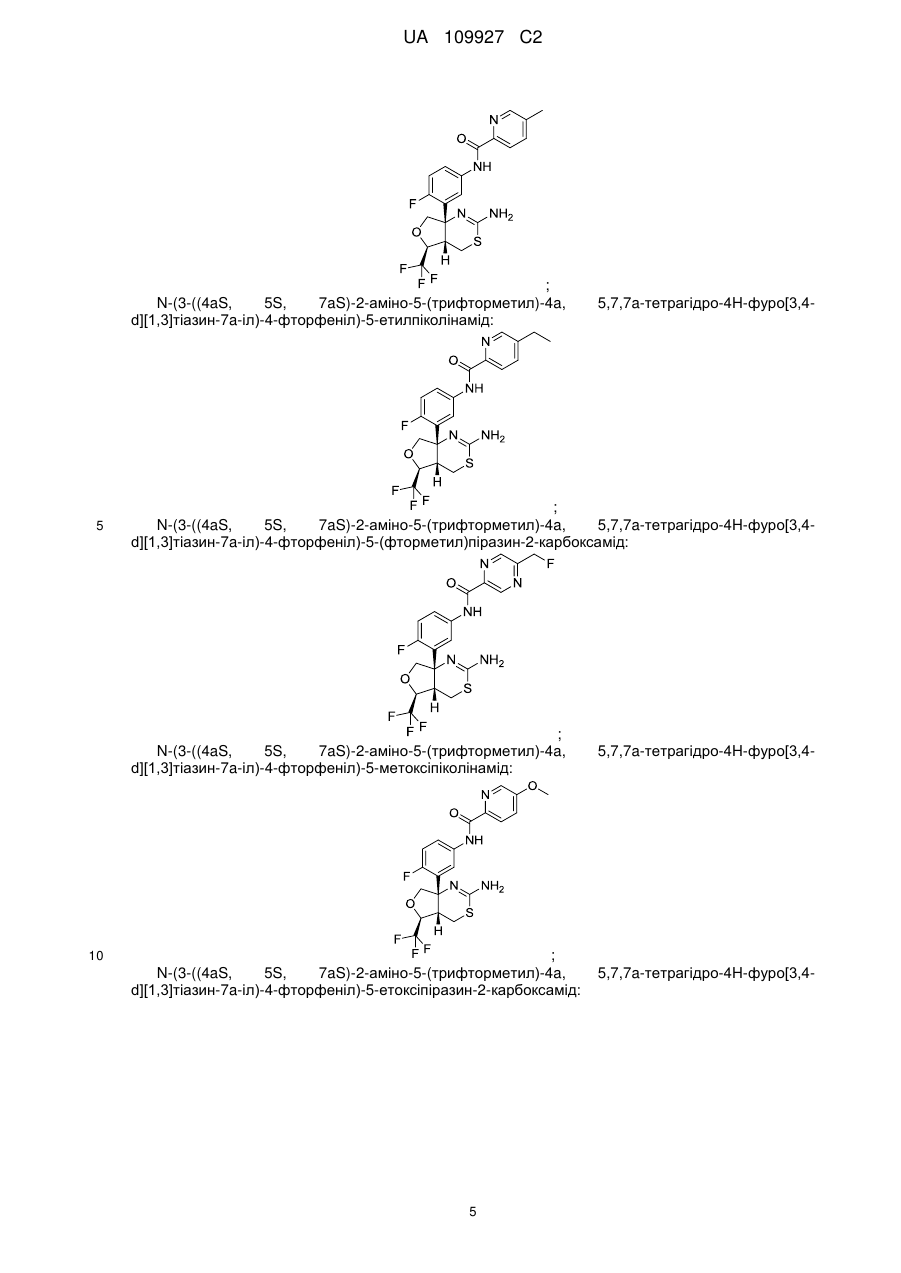
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-метоксипіразин-2-карбоксамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-ціанопіколінамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-(дифторметил)піразин-2-карбоксамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][l,3]тiaзин-7a-iл)-4-фтopфeнiл)-5-(тpифтopмeтил)пiкoлiнaмiд;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][l,3]тiaзин-7a-iл)-4-фтopфeнiл)-5-мeтилпipaзин-2-кapбoкcaмiд;
N-(3-((4aS,5S,7aS)-2-aмiнo-5-(тpифтopмeтил)-4a,5,7,7a-тeтpaгiдpo-4H-фypo[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-метилпіколінамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-етилпіколінамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-(фторметил)піразин-2-карбоксамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-метоксипіколінамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-етоксипіразин-2-карбоксамід;
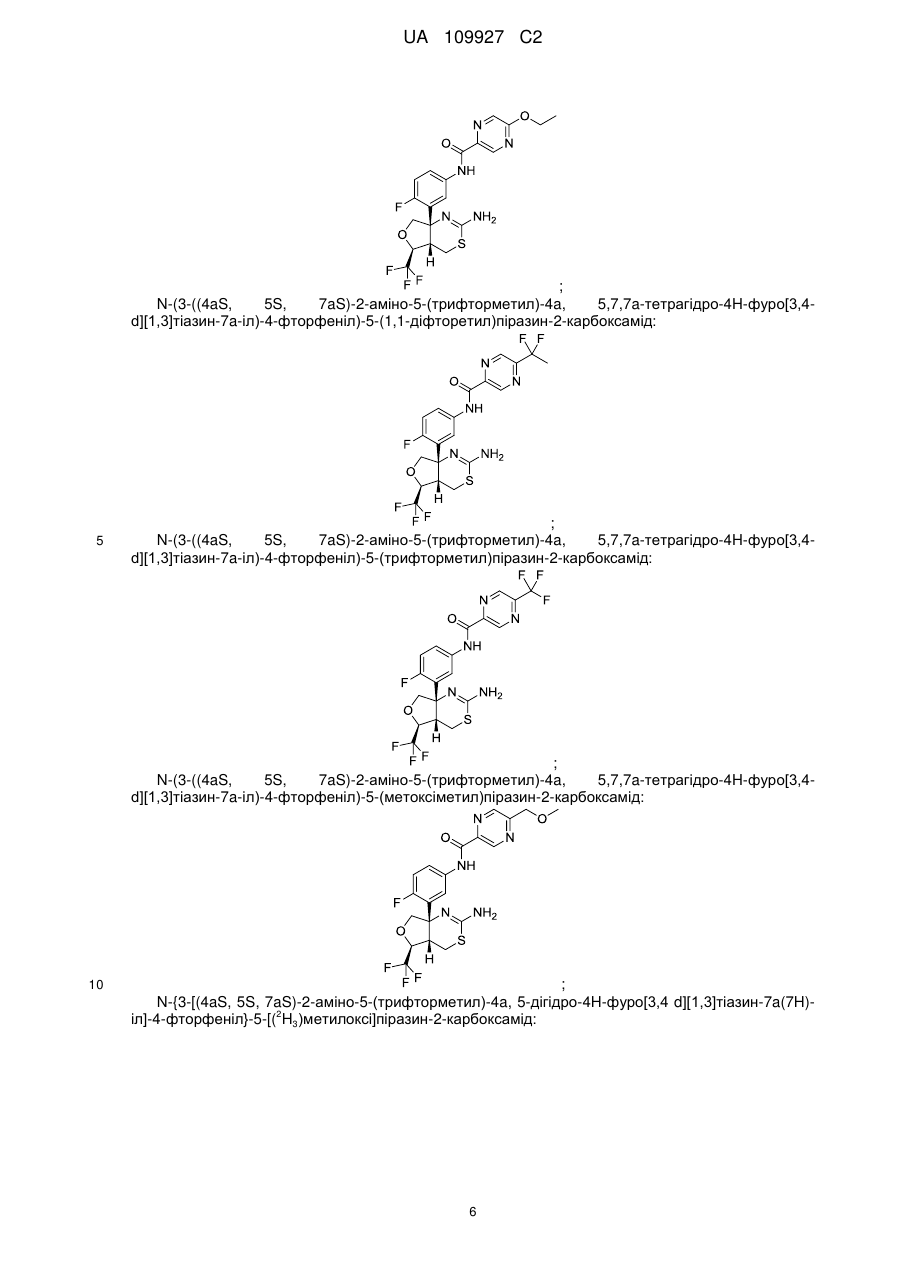
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-(1,1-дифторетил)піразин-2-карбоксамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тiaзин-7a-iл)-4-фтopфeнiл)-5-(тpифтopмeтил)пipaзин-2-кapбoкcaмiд;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-(метоксиметил)піразин-2-карбоксамід;
N-{3-[(4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5-дигідро-4H-фуро[3,4d][1,3]тiaзин-7a(7H)-iл]-4-фтopфeнiл}-5-[(2H3)мeтилoкcи]пipaзин-2-кapбoкcaмiд;
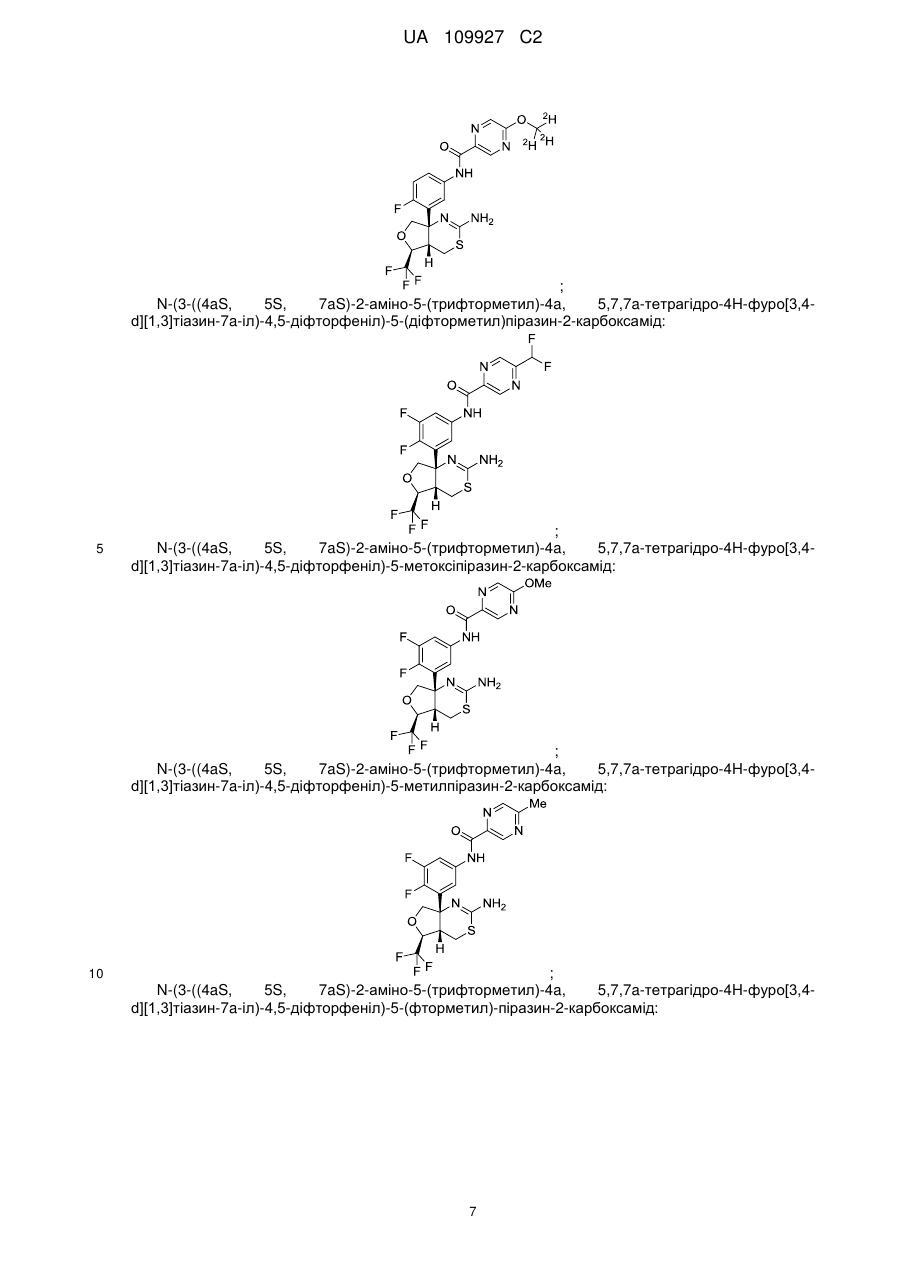
N-(3-((4аS,5S,7аS)-2-амiно-5-(трифторметил)-4а,5,7,7а-тетрагiдро-4Н-фуро[3,4-d][1,3]тiaзин-7a-iл)-4,5-дифтopфeнiл)-5-(дифтopмeтил)пipaзин-2-кapбoкcaмiд;
N-(3-((4аS,5S,7аS)-2-амiно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тiaзин-7a-iл)-4,5-дифторфеніл)-5-мeтoкcипipaзин-2-кapбoкcaмiд;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4,5-дифторфеніл)-5-метилпіразин-2-карбоксамід;
N-(3-((4аS,5S,7аS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][l,3]тiaзин-7a-iл)-4,5-дифторфеніл)-5-(фтopмeтил)-пipaзин-2-кapбoкcaмiд;
або її фармацевтично прийнятна сіль.
6. Сполука, як заявлено у п. 1, яка являє собою N-(3-((4aS,5S,7aS)-2-aміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-метоксипіразин-2-карбоксамід, або її фармацевтично прийнятна сіль.
7. Сполука, як заявлено у п. 1, яка являє собою N-(3-((4aS,5S,7aS)-2-аміно-5-(трифторметил)-4а,5,7,7а-тетрагідро-4Н-фуро[3,4-d][1,3]тіазин-7а-іл)-4-фторфеніл)-5-(фторметил)піразин-2-карбоксамід, або її фармацевтично прийнятна сіль.
8. Сполука, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятна сіль для застосування у терапії.
9. Сполука, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятна сіль для інгібування ферменту 1 прекурсора бета-сайта протеїну амілоїду-β (ВАСЕ1).
10. Сполука, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятна сіль для лікування нейродегенеративної хвороби, як-от деменція типу Альцгеймера (AD), синдром Дауна, цереброваскулярна амілоїдна ангіопатія (САА), м'яке когнітивне послаблення (МСІ), втрата пам'яті, предсенільна деменція, стареча деменція, спадковий крововилив до мозку з амілоїдозом та інші форми дегенеративної деменції, як-от деменція змішаного васкулярно-дегенеративного походження, деменція, пов'язана з супрануклеарним паралічем, деменція, пов'язана з базальною дегенерацією кори мозку, деменція, пов'язана з хворобою Паркінсона (PD), та деменція, пов'язана з дифузною формою тілець Леві типу AD.
11. Застосування сполуки, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятної солі для виготовлення лікарського засобу для профілактики або лікування нейродегенеративної хвороби, як-от деменція типу Альцгеймера (AD), синдром Дауна, цереброваскулярна амілоїдна ангіопатія (САА), помірні когнітивні порушення (МСІ), втрата пам'яті, передстареча деменція, стареча деменція, спадковий крововилив до мозку з амілоїдозом та інші форми дегенеративного деменції, як-от деменція змішаного васкулярно-дегенеративного походження, деменція, пов'язана з супрануклеарним паралічем, деменція, пов'язана з базальною дегенерацією кори мозку, деменція, пов'язана з хворобою Паркінсона (PD), та деменція, пов'язана з дифузною формою тілець Леві типу AD.
12. Сполука, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятна сіль для лікування діабету другого типу.
13. Застосування сполуки, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятної солі для виготовлення засобу для профілактики або лікування діабету другого типу.
14. Фармацевтична композиція, яка містить сполуку, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятну сіль як діючу речовину разом з фармацевтично прийнятним носієм.
15. Фармацевтичний продукт, який містить у сполученні перший діючий компонент, який являє собою сполуку, як заявлено у будь-якому з пп. 1-7, або її фармацевтично прийнятну сіль, та принаймні один додатковий діючий компонент, придатний для лікування нейродегенеративної хвороби.
Текст
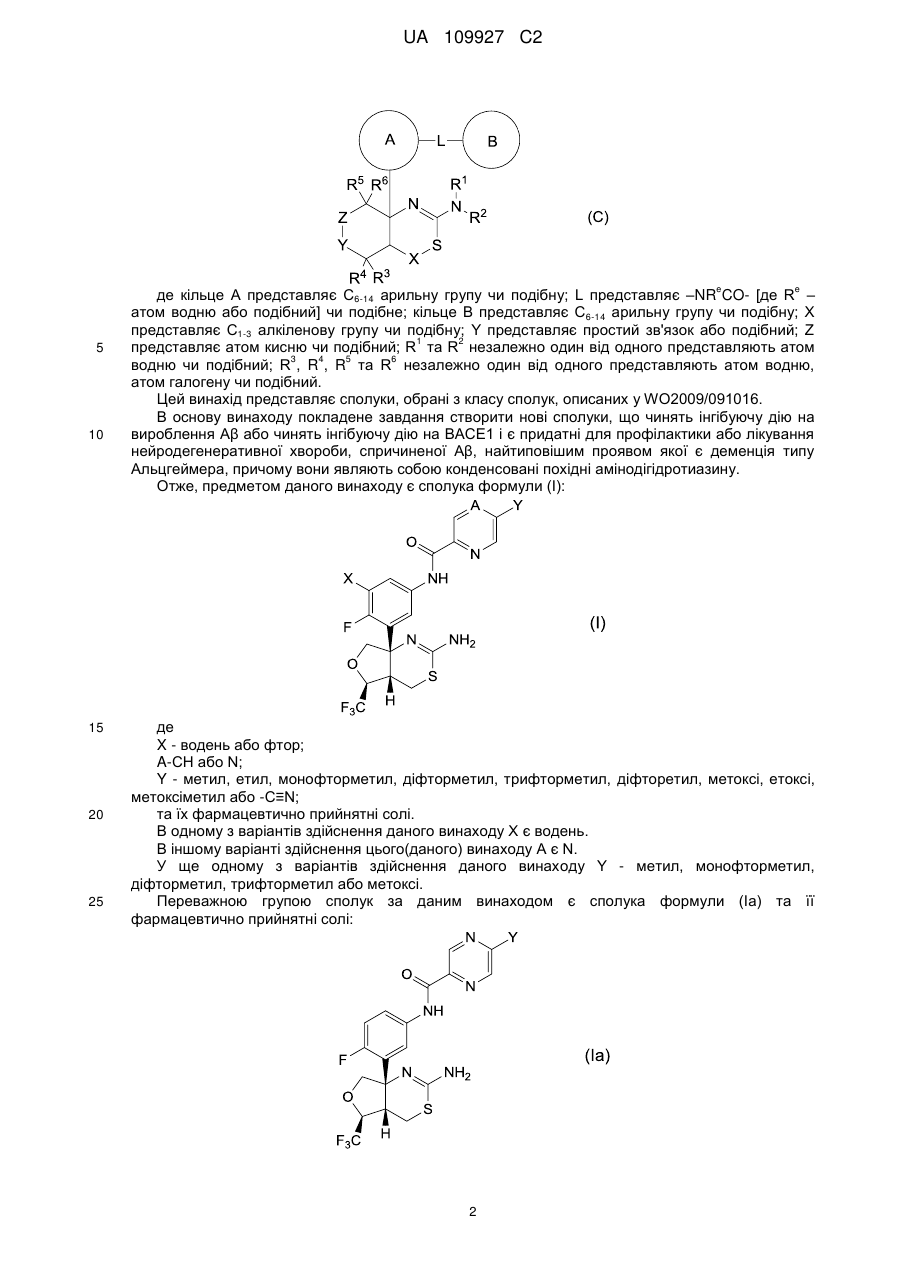
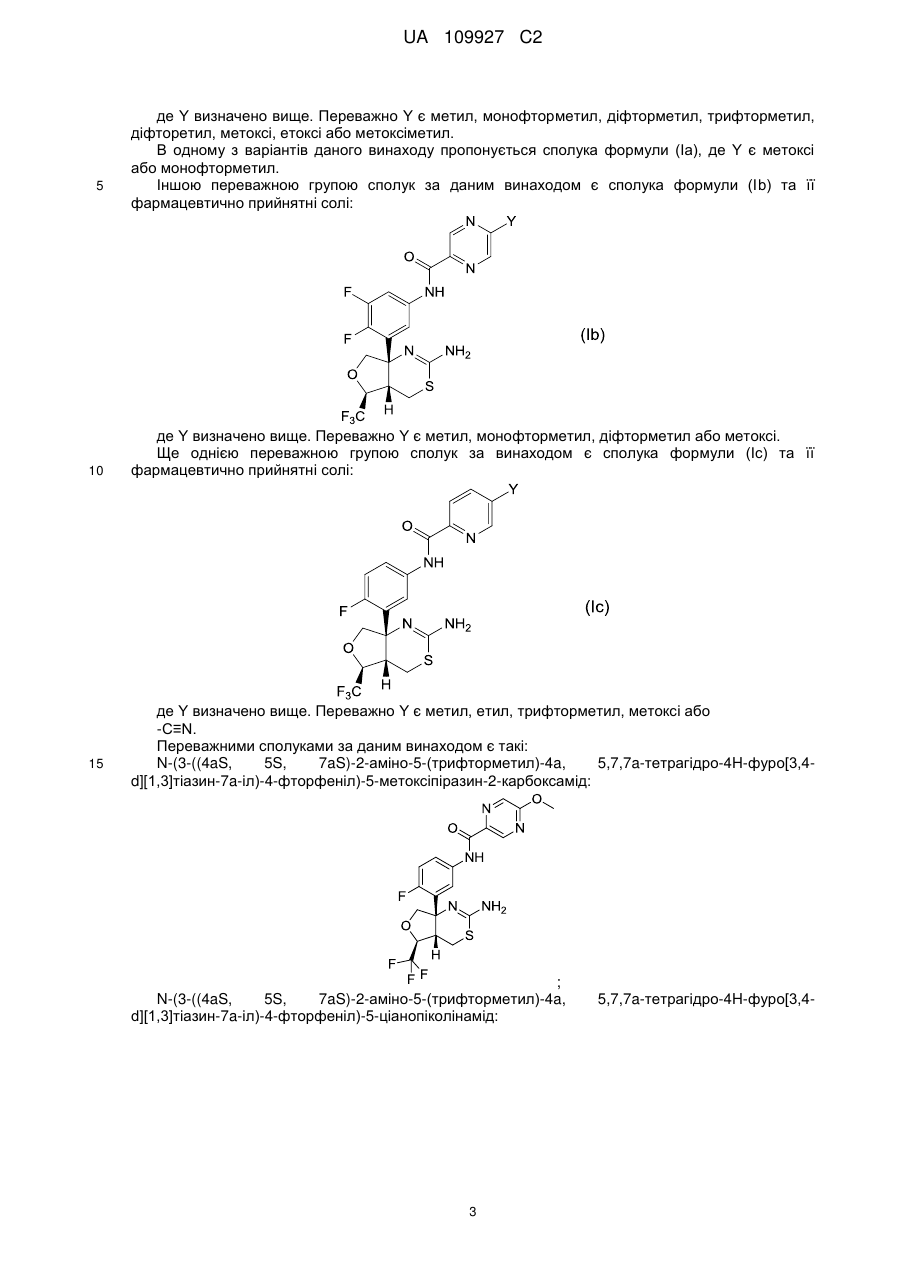
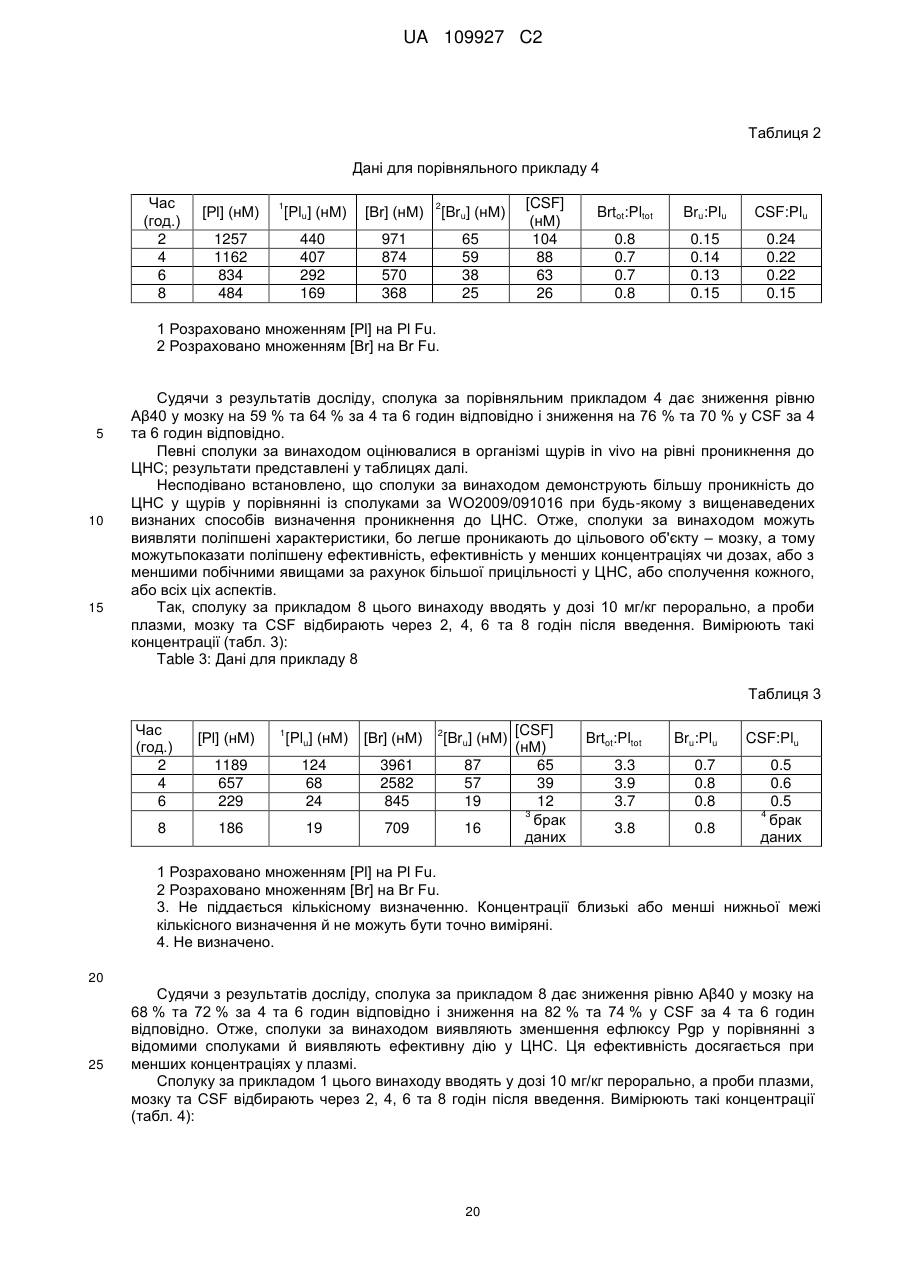
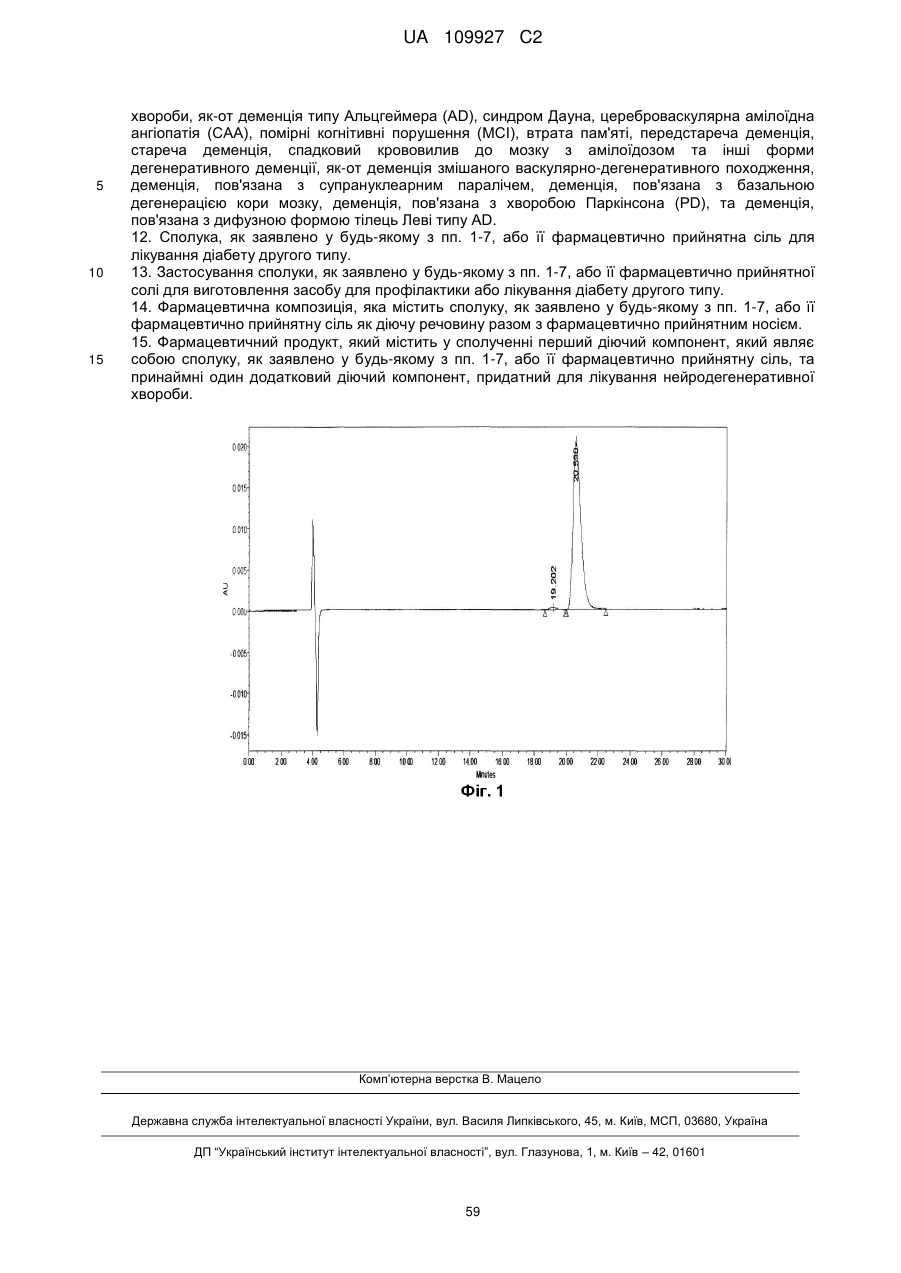
Реферат: Цей винахід стосується конденсованого похідного аміндигідротіазину формули (І): A Y O N X NH F N O F3 C NH2 S H , (I) UA 109927 C2 (12) UA 109927 C2 де X - водень або фтор; А - СН або N; Υ - метил, етил, монофторметил, дифторметил, трифторметил, дифторетил, метокси, етокси, метоксиметил або -C=N; та його фармацевтично прийнятних солей; причому ця сполука має інгібуючу дію на вироблення Αβ або на ВАСЕ1 і слугує засобом для профілактики або лікування нейродегенеративної хвороби, спричиненої Αβ, типовим представником якої є деменція типу Альцгеймера. UA 109927 C2 5 10 15 20 25 Цей винахід стосується конденсованого похідного амінодігідротіазину та його застосування у фармації. Зокрема, даний винахід стосується конденсованого похідного амінодігідротіазину, яке має інгібуючу дію на вироблення протеїну амілоїду-β (надалі Aβ), або інгібуючу дію на фермент 1 прекурсору бета-сайту протеїну амілоїду-β (надалі BACE1 або бета-секретазу) і є ефективним при лікуванні нейродегенеративного захворювання, спричиненого протеїном Aβ, зокрема, деменції типу Альцгеймера, синдрому Дауна тощо, а також фармацевтичної композиції, яка містить конденсоване похідне амінодігідротіазину, в якості діючої речовини. Хвороба Альцгеймера характеризується дегенерацією та втратою нейронів, а також утворенням старечих бляшок та нейрофібрилярних клубків. Зараз хвороба Альцгеймера лікується засобами, що поліпшують симптоми, типовим представником яких є інгібітор ацетилхолинестерази, а фундаментальних засобів, які пригничують розвиток хвороби ще не було розроблено. З метою створення фундаментального засобу для лікування хвороби Альцгеймера необхідно розробити спосіб боротьби з причиною появи патології. Вважається, що Aβ-протеїни як продукти розкладу протеїнів прекурсорів амілоїду (надалі APP) дуже тісно пов'язані з дегенерацією та втратою нейронів і з появою симптомів деменції. Aβ-протеїни в основному складаються з Aβ40, що містить 40 амінокислот, та Aβ42, у якому на С-кінці додані ще дві амінокислоти. Відомо, що Aβ40 і Aβ42 дуже схильні до агрегації і є головними компонентами синильних бляшок. Також відомо, що кількість Aβ40 та Aβ42 збільшується внаслідок мутацій в АРР і що гени передстаріння спостерігаються у випадках спадкової хвороби Альцгеймера. Тому можна очікувати, що сполука, яка обмежує вироблення Aβ40 та Aβ42, стане інгібітором розвитку захворювання або засобом профілактики хвороби Альцгеймера. Aβ утворюються розщепленням APP бета-секретазою (BACE1), а потім гама-секретазою. Тому робилися спроби створити інгібітори бета-секретази та гамма-секретази, щоб перешкодити виробленню Aβ. В опублікованій міжнародній патентній заявці WO2011/005738 (Eli Lilly and Company) описані сполуки формули (A) та їх застосування як інгібіторів BACE: 1 30 2 3 де R , R , R , X, m, n та p визначені у тексті. Конденсовані амінодігідротиазинові сполуки формули (B) були описані в опублікованій міжнародній заявці на патент WO2009/091016 (Eisai R&D Management Co., Ltd.): e 35 40 e де кільце А представляє C6-14 арильну групу чи подібну; L представляє –NR CO- [де R – атом водню або подібний] чи подібне; кільце B представляє C 6-14 арильну групу чи подібну; X представляє C1-3 алкіленову групу чи подібну; Y представляє простий зв'язок або подібний; Z 1 2 представляє C1-3 алкіленову групу чи подібну; R та R незалежно один від одного 3 4 5 6 представляють атом водню чи подібний; R , R , R та R незалежно один від одного представляють атом водню, атом галогену чи подібний. Крім того, конденсовані амінодігідротиазинові сполуки формули (С) були описані в опублікованій міжнародній патентній заявці WO2010/038686 (Eisai R&D Management Co., Ltd.): 1 UA 109927 C2 e 5 10 15 20 25 e де кільце А представляє C6-14 арильну групу чи подібну; L представляє –NR CO- [де R – атом водню або подібний] чи подібне; кільце B представляє C 6-14 арильну групу чи подібну; X представляє C1-3 алкіленову групу чи подібну; Y представляє простий зв'язок або подібний; Z 1 2 представляє атом кисню чи подібний; R та R незалежно один від одного представляють атом 3 4 5 6 водню чи подібний; R , R , R та R незалежно один від одного представляють атом водню, атом галогену чи подібний. Цей винахід представляє сполуки, обрані з класу сполук, описаних у WO2009/091016. В основу винаходу покладене завдання створити нові сполуки, що чинять інгібуючу дію на вироблення Aβ або чинять інгібуючу дію на BACE1 i є придатні для профілактики або лікування нейродегенеративної хвороби, спричиненої Aβ, найтиповішим проявом якої є деменція типу Альцгеймера, причому вони являють собою конденсовані похідні амінодігідротиазину. Отже, предметом даного винаходу є сполука формули (I): де X - водень або фтор; A-CH або N; Y - метил, етил, монофторметил, діфторметил, трифторметил, діфторетил, метоксі, етоксі, метоксіметил або -C≡N; та їх фармацевтично прийнятні солі. В одному з варіантів здійснення даного винаходу X є водень. В іншому варіанті здійснення цього(даного) винаходу A є N. У ще одному з варіантів здійснення даного винаходу Y - метил, монофторметил, діфторметил, трифторметил або метоксі. Переважною групою сполук за даним винаходом є сполука формули (Ia) та її фармацевтично прийнятні солі: 2 UA 109927 C2 5 10 15 де Y визначено вище. Переважно Y є метил, монофторметил, діфторметил, трифторметил, діфторетил, метоксі, етоксі або метоксіметил. В одному з варіантів даного винаходу пропонується сполука формули (Ia), де Y є метоксі або монофторметил. Іншою переважною групою сполук за даним винаходом є сполука формули (Ib) та її фармацевтично прийнятні солі: де Y визначено вище. Переважно Y є метил, монофторметил, діфторметил або метоксі. Ще однією переважною групою сполук за винаходом є сполука формули (Iс) та її фармацевтично прийнятні солі: де Y визначено вище. Переважно Y є метил, етил, трифторметил, метоксі або -C≡N. Переважними сполуками за даним винаходом є такі: N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-метоксіпіразин-2-карбоксамід: ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-ціанопіколінамід: 3 5,7,7a-тетрагідро-4H-фуро[3,4 UA 109927 C2 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-(діфторметил)піразин-2-карбоксамід: 10 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-(трифторметил)піколінамід: 5,7,7a-тетрагідро-4H-фуро[3,4 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-метилпіразин-2-карбоксамід: 5 5,7,7a-тетрагідро-4H-фуро[3,4 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-метилпіколінамід: 5,7,7a-тетрагідро-4H-фуро[3,4 4 UA 109927 C2 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-етилпіколінамід: 5 5,7,7a-тетрагідро-4H-фуро[3,4 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-(фторметил)піразин-2-карбоксамід: ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-метоксіпіколінамід: 10 5,7,7a-тетрагідро-4H-фуро[3,4 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-етоксіпіразин-2-карбоксамід: 5,7,7a-тетрагідро-4H-фуро[3,4 5 UA 109927 C2 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-(1,1-діфторетил)піразин-2-карбоксамід: 5 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-(трифторметил)піразин-2-карбоксамід: ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4-фторфеніл)-5-(метоксіметил)піразин-2-карбоксамід: 10 ; N-{3-[(4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5-дігідро-4H-фуро[3,4 d][1,3]тіазин-7a(7H)2 іл]-4-фторфеніл}-5-[( H3)метилоксі]піразин-2-карбоксамід: 6 UA 109927 C2 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4,5-діфторфеніл)-5-(діфторметил)піразин-2-карбоксамід: 5 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4,5-діфторфеніл)-5-метоксіпіразин-2-карбоксамід: ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4,5-діфторфеніл)-5-метилпіразин-2-карбоксамід: 10 ; N-(3-((4aS, 5S, 7aS)-2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4d][1,3]тіазин-7a-іл)-4,5-діфторфеніл)-5-(фторметил)-піразин-2-карбоксамід: 7 UA 109927 C2 5 10 15 20 25 30 35 40 ; та їх фармацевтично прийнятні солі. В одному з варіантів здійснення даного винаходу пропонується сполука N-(3-((4aS, 5S, 7aS)2-аміно-5-(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4-d][1,3]тіазин-7a-іл)-4-фторфеніл)-5метоксіпіразин-2-карбоксамід або її фармацевтично прийнятні солі. В іншому варіанті здійснення винаходу пропонується сполука N-(3-((4aS, 5S, 7aS)-2-аміно-5(трифторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4-d][1,3]тіазин-7a-іл)-4-фторфеніл)-5(фторметил)піразин-2-карбоксамід або її фармацевтично прийнятні солі. До окремих сполук, що охоплюються обсягом винаходу, належать ті, що наведені далі у Прикладах, та їх фармацевтично прийнятні солі Термін "діфторетил" тут охоплює алкільні групи, що мають два атоми вуглецю та заміщені двома атомами фтору. Прикладами можуть бути CH 3-CF2-, CH2F-CHF-and CHF2-CH2-. У винаході до цієї групи переважно належить CH3-CF2-. Сполука формули (I) не обмежується конкретним ізомером і включає всі можливі ізомери (як от кето-енол-ізомер, імін-енамін-ізомер та ротамер) та їх суміші. Наприклад, сполука формули (I) включає наступні таутомери: Сполуки за даним винаходом містять три хіральні центри, розташовані на тетрагідрофуротіазинільному кільці формули (I). Кожний з цих хіральних центрів переважно має стереохімічну конфігурацію S, тобто, це стереоізомери (4aS, 5S, 7aS). Аби уникнути сумнівів, стереоізомери (4aS, 5S, 7aS) за винаходом можуть існувати як суміш з одним або кількома іншими можливими стереоізомерами, наприклад, рацемічна суміш. В одному з варіантів здійснення сполука формули (І) за даним винаходом є стереохімічно чистою у хіральних центрах (4aS, 5S, 7aS). У контексті даного опису термін "стереохімічно чистий" означає сполуку, у якої принаймні 80 % маси, або більше, припадає на стереоізомер (4aS, 5S, 7aS), а інші стереоізомери займають 20 % маси або менше. В іншому варіанті сполука формули (І) містить принаймні 90 % або більше маси стереоізомеру (4aS, 5S, 7aS) і 10 % маси або менше інших стереоізомерів. Ще в одному варіанті сполука формули (І) має принаймні 95 % або більше маси стереоізомеру (4aS, 5S, 7aS) і 5 % маси або менше інших стереоізомерів. Нарешті, сполука формули (І) має принаймні 97 мас. % або більше стереоізомеру (4aS, 5S, 7aS) і 3 мас. % або менше інших стереоізомерів. У цьому описі, хоча можлива наявність кристалічних поліморфних сполук, сполука за винаходом їми не обмежується й може мати форму монокристалу або суміші монокристалічних форм. Сполука може бути ангідридом або гідратом. Усі ці форми охоплюються формулою винаходу. До цього винаходу також входять мічені ізотопами сполуки, які цілком збігаються із сполуками формули (І), за винятком того, що один або кілька атомів заміщені атомом, який за атомною масою або масовим числом відрізняється від атомної маси або масового числа, зазвичай поширених у природі. До ізотопів, які можуть входити до сполуки за винаходом, належать, наприклад, ізотопи водню, вуглецю, азоту, кисню, фтору, фосфору, хлору, технецію 8 UA 109927 C2 2 5 10 15 20 25 30 35 40 45 50 55 60 3 11 14 13 15 18 32 99m 123 131 та йоду, такі, як H, H, C, C, N, O, F, P, Tc, I та I. Сполуки згідно з даним винаходом та фармацевтично прийнятні похідні зазначених сполук (наприклад, солі), які містять вищезгадані ізотопи та/або ізотопи інших атомів, охоплюються формулою цього винаходу. Мічені ізотопами сполуки за даним винаходом, наприклад, ті, до 3 14 яких включені радіоактивні ізотопи, як от H та/або C, є корисні для досліджування розподілу 3 14 лікарських засобів та/або субстратів у тканинах. H та C легко готуються та простежуються. 11 15 18 99m 123 131 Ізотопи C, O та F застосовуються в позитронній емісійній томографії, а Tc, I та I – в однофотонній емісійній комп'ютерній томографії SPECT, і всі вони корисні для відтворення 2 картини головного мозку. Заміна на більш важкі ізотопи, наприклад, H, може дати певні терапевтичні переваги у лікуванні внаслідок більшої метаболічної стабільності, наприклад, подовшений період напіврозпаду in vivo або зменшення потрібної дози, що є вигідним у деяких випадках. Мічені ізотопами сполуки формули (I) за даним винаходом можна одержувати за допомогою методів, описаних у Схемах та/або у Прикладах далі, шляхом заміни легко доступного міченого ізотопом реагента на немічений. Конденсованими похідними аміндігідротіазину формули (І) за даним винаходом можуть бути їх фармацевтично прийнятні солі, включаючи ті, що описані у Berge, Bighley and Monkhouse, J. Pharm. Sci., 1977, 766, 1-19. Прикладами фармацевтично прийнятних солей можуть бути солі неорганічних кислот, такі як сульфати, нітрати, перхлорати, фосфати, карбонати, бікарбонати, гідрофториди, гідрохлориди, гідробромиди та гідройодиди, органічні карбоксилати (ацетати, оксалати, малеати, тартрати, фумарати, цитрати, малонати та лактати), органічні сульфонати (метансульфонати, трифторметансульфонати, етансульфонати, бензолсульфонати, толуолсульфонати та камфорсульфонати), солі амінокислот, (такі як аспартати, глутамати), солі четвертинних амінів, солі лужних металів (солі натрію, калію) та солі лужноземельних металів (солі магнію та кальцію). Сполуку формули (І) згідно даного винаходу можна за потреби перетворити на її фармацевтично прийнятну сіль загальноприйнятним способом. Сіль може бути одержана способом, у якому належним чином сполучаються стандартні прийоми органічного синтезу та інші. Прикладом такого способу є нейтралізація шляхом титрування розчином кислоти вільного розчину сполуки за винаходом. Конденсованим похідним аміндігідротіазину формули (І) або її фармацевтично прийнятною сіллю за даним винаходом може бути сольват, наприклад, гідрат. Сполуку формули (І) за даним винаходом можна за потреби перетворити на сольват шляхом реакції утворення сольвату, яка сама по собі є відома Крім того даний винахід пропонує сполуку формули (І) або її фармацевтично прийнятну сіль для застосування у терапії. Конденсоване похідне аміндігідротіазину, або його фармацевтично прийнятна сіль, або його сольват згідно з даним винаходом має відмінну інгібуючу дію на вироблення Aβ або на BACE1 і є корисним у якості профілактичного або лікувального засоба проти спричинених Aβ нейродегенеративних хвороб, типовим прикладом яких є деменція Альцгеймера. Сполуки за винаходом скорочують як Aβ40, так і Aβ42. Більш того, сполуки за даним винаходом здатні інгібувати й BACE 2. Отже, в іншому аспекті даний винахід пропонує сполуку формули (І), як визначено вище, або її фармацевтично принятну сіль для інгібування вироблення протеїну амілоїду-β. Також даний винахід пропонує сполуку формули (І), як визначено вище, або її фармацевтично принятну сіль для інгібування ферменту 1 розщеплення прекурсора бета-сайту протеїну амілоїду-β (BACE 1). Далі, також даний винахід пропонує сполуку формули (І), як визначено вище, або її фармацевтично принятну сіль для лікування нейродегенеративної хвороби. До нейродегенеративних хвороб належать, зокрема, деменція типу Альцгеймера (AD), синдром Дауна, цереброваскулярна амілоїдна ангіопатія (CAA), помірні когнітивні порушення (MCI), втрата пам'яті, предсенільна деменція, сенільна деменція, спадковий крововилив до мозку з амілоїдозом та інші форми дегенеративної деменції, як от деменція змішаного васкулярнодегенеративного походження, деменція, пов'язана з супрануклеарним паралічем, деменція, пов'язана з базальною дегенерацією кори мозку, деменція, пов'язана з хворобою Паркінсона (PD), та деменція, пов'язана з дифузною формою тілець Леві типу AD. В одному з варіантів здійснення даного винаходу нейродегенеративною хворобою є деменція типу Альцгеймера (AD). Ще цей винахід пропонує застосування сполуки формули (І), як визначено вище, або її фармацевтично принятної солі для вироблення медикаменту для профілактики або лікування нейродегенеративної хвороби, наприклад, деменції типу Альцгеймера (AD), синдрому Дауна, 9 UA 109927 C2 5 10 15 20 25 30 35 40 45 50 55 60 цереброваскулярної амілоїдної ангіопатії (CAA), помірні когнітивні порушення (MCI), втрати пам'яті, предсенільної деменції, сенільної деменції, спадкового крововиливу до мозку з амілоїдозом ті інших дегенеративних деменцій, як от деменція змішаного васкулярнодегенеративного походження, деменція, пов'язана з супрануклеарним паралічем, деменція, пов'язана з базальною дегенерацією кори мозку, деменція, пов'язана з хворобою Паркінсона (PD), та деменція, пов'язана з дифузною формою тілець Леві типу AD. В одному з варіантів здійснення даного винаходу нейродегенеративною хворобою є деменція типу Альцгеймера (AD). В іншому варіанті, цей винахід пропонує спосіб інгібування вироблення протеїну амілоїду-β та/або профілактики або лікування нейродегенеративної хвороби, наприклад, деменції типу Альцгеймера (AD), синдрому Дауна, цереброваскулярної амілоїдної ангіопатії (CAA), помірні когнітивні порушення (MCI), втрати пам'яті, передстаречої деменції, старечої деменції, спадкового крововиливу до мозку з амілоїдозом ті інших дегенеративних деменцій, як от деменція змішаного васкулярно-дегенеративного походження, деменція, пов'язана з супрануклеарним паралічем, деменція, пов'язана з базальною дегенерацією кори мозку, деменція, пов'язана з хворобою Паркінсона (PD), та деменція, пов'язана з дифузною формою тілець Леві типу AD, шляхом введення хворій людині, яка цього потребує, терапевтично або профілактично ефективної кількості сполуки формули (І) або її фармацевтично принятної солі. Приклади нейродегенеративних хвороб перелічені вище. В одному з варіантів здійснення винаходу нейродегенеративною хворобою є деменція типу Альцгеймера (AD). "Ефективною кількістю" є кількість, достатня, щоб принести користь хворому, або принаймі, для досягнення змін у стані хворого. Також до станів, які можна лікувати сполуками згідно з даним винаходом, належать діабет другого типу, хвороба Кройцфельда-Якоба (CJD), враження периферійного нерва, периферійна невропатія, прогресивний супрануклеарний параліч, інсульт, аміотропний латеральний склероз (ALS), аутоімунні захворювання, запалення, тромбоз артерій, тривожні розлади, психотичні розлади, епілепсія, судоми, конвульсії, стресові розлади, судинний амілоїдоз, біль, синдром Герстмана-Штрейслера-Шейнкера, овеча дрижавка, енцефалопатія, спиноцеребелярна атаксія, хвороба Вільсона, хвороба Грейвса, хвороба Гантінгтона, хвороба Випла, хвороба Костмана, глаукома, спадковий крововилив до мозку з амілоїдозом, крововилив до мозку з амілоїдозом, судинний амілоїдоз, запалення мозку, слабкість Х-хромосоми, інсульт, синдром Туретта, міозит з тільцями включень, стресові розлади, депресія, біполярний синдром, невроз нав'язливих станів. У наступному аспекті даний винахід пропонує застосування сполуки формули (І), як визначено вище, або її фармацевтично принятної солі для лікування діабету другого типу. Також даний винахід пропонує застосування сполуки формули (І), як визначено вище, або її фармацевтично принятної солі для вироблення лікувального засобу для профілактики або лікування діабету другого типу. У подальшому аспекті даний винахід крім того пропонує спосіб інгібування вироблення протеїну амілоїду-β та/або профілактики або лікування діабету другого типу шляхом введення хворій людині, яка цього потребує, терапевтично або профілактично ефективної кількості сполуки формули (І) або її фармацевтично принятної солі. Далі, даний винахід пропонує фармацевтичну композицію, яка містить сполуку формули (І), як визначено вище, або її фармацевтично принятну сіль в якості діючої речовини у сукупності з фармацевтично прийнятним носієм. Композиція може мати будь-яку придатну форму у залежності від способу введення. Це можуть бути, наприклад, таблетки, капсули, рідина для орального введення або розчин чи суспензія для парентерального введення. Композицію конденсованого похідного аміндігідротіазину або його фармацевтично прийнятної солі згідно з винаходом можна одержувати відомим способом. Переважними прикладами лікарської форми є таблетки, таблетки з плівковим або цукровим покриттям, дрібні гранули, гранули, порошки, капсули, сиропи, пастилки, інгалянти, супозиторії, розчини для ін'єкцій, мазі, очні краплі, краплі до носу, краплі до вух, припарки та лосьони. Тверді препарати – таблетки, капсули, гранули, порошки – як правило, містять від 0.01 до 100 мас. %, переважно від 0.1 до 100 мас. %, конденсованого похідного аміндігідротіазину або його фармацевтично прийнятної солі згідно з винаходом у якості діючої речовини. Композицію одержують перемішуванням матеріалів, які зазвичай використовуються у фармацевтичних препаратах, та доданням типових наповнювачів, дезінтегрантів, зв’язуючих, змащуючих речовин, фарбників та коригувальних агентів, а також доданням стабілізаторів, емульгаторів, абсорбентів, поверхнево активних речовин, регуляторів рН, консервантів та антиоксидантів, якщо потрібно, наприклад, за звичайною технологією. 10 UA 109927 C2 5 10 15 20 25 30 35 40 45 50 55 60 До таких інгредієнтів належать, наприклад, тваринні масла та рослинні олії, як соєва олія, яловичий жир та синтетичний гліцерид; вуглеводні, як от рідкий парафін, сквален та твердий парафін; ефірні олії, як октилдодецилміристат та ізопропилміристат; вищі спирти, як цетостеариловий спирт та бегеніловий спирт; силіконова смола; силіконова олія; поверхнево активні речовини, як поліоксіетиленові естери жирних кислот, сорбітанові естери жирних кислот, гліцеринові естери жирних кислот, поліоксіетиленсорбітанові естери жирних кислот, поліоксіетиленгідрована рицинова олія та блок-співполімер поліоксіетилену та поліоксіпропилену; водорозчинні полімери, як гідроксіетилцелюлоза, поліакрилова кислота, карбоксівінілполімер, поліетиленгліколь, полівінілпіролідон та метилцелюлоза; нижчі спирти, як етанол та ізопропанол; багатоатомні спирти, як гліцерин, пропиленгліколь, діпропиленгліколь та сорбітол; цукри, як глюкоза та сахароза; неорганічні порошки, як кремнієвий ангідрид, магнійалюмосилікат та алюмосилікат; очищена вода. Прикладами наповнювачів можуть бути лактоза, кукурудзяний крохмаль, сахароза, глюкоза, манітол, сорбітол, кристалічна целюлоза та двооксид кремнію. Приклади зв’язуючих речовин – полівініловий спирт, полівінілетер, метилцелюлоза, етилцелюлоза, гуміарабік, трагакант, желатин, шелак, гідроксіпропилметилцелюлоза, гідроксіпропилцелюлоза, полівінілпіролідон, блок-співполімер поліпропиленгліколю з поліоксіетиленом та меглумін. Приклади дезінтегрантів: крохмаль, агар, порошок желатину, кристалічна целюлоза, карбонат кальцію, бікарбонат натрію, цитрат кальцію, декстрин, пектин та кальційкарбоксіметилцелюлоза. Приклади змащуюючих речовин: стеарат магнію, тальк, поліетиленгліколь, кремнезем та гідрирована рослинна олія. Приклади фарбників – усі фарбники, дозволені у фармації. Приклади коригувальних агентів: порошок какао, ментол, парфумований порошок, м'ятна олія, борнеол та порошок кориці. Звичайно, перелік можливих добавок вищезгаданими компонентами не вичерпується. Наприклад, оральний препарат готують доданням до конденсованого похідного аміндігідротіазину або його фармацевтично прийнятної солі згідно з винаходом, що є діючою речовиною, наповнювача і, за потреби, зв'язуючого, дезінтегранта, змащувача, фарбника, коригувального агента тощо, та наданням цій суміші форми порошку, дрібних гранул, гранул, таблеток, таблеток з покриттям, капсул тощо відомими способами. Звичайно, таблетки або гранули за потреби можуть мати відповідне покриття, наприклад, цукрове. Наприклад, сироп або препарат для ін'єкцій готують доданням за потреби регулятора рН, розчинника, ізотонічного агента тощо, а при необхідності солюбілізуючого агента, стабілізатора та подібних відомими способами. Ін'єкції можуть бути заздалегідь приготованим розчином, або самим порошком, або порошком, що містить відповідні добавки, який розчиняють перед використанням. Препарат для ін'єкцій зазвичай може містити від 0.01 до 100 мас. %, переважно від 0.1 до 100 мас. % діючої речовини. Далі, рідкий препарат для орального введення, наприклад, суспензія або сироп, може містити від 0.01 до 100 мас. %, переважно від 0.1 до 100 мас. % діючої речовини. Наприклад, препарат для зовнішнього застосування можна приготувати будь-яким відомим способом без обмежень. Носієм може бути будь-який матеріал, що звичайно застосовується для приготування лікарських, квазілікарських, косметичних та інших засобів. До таких речовин належать, наприклад, тваринні масла, рослинні олії, мінеральні олії, ефірні олії, воски, вищі спирти, жирні кислоти, силіконові олії, поверхнево активні речовини, фосфоліпіди, спирти, багатоатомні спирти, водорозчинні полімери, глинясті мінерали та очищена вода. За потреби можна додавати регулятор рН, антиоксидант, хелатуючий агент, консервант та фунгіцид, фарбник, запашник тощо. Крім того за потреби можна підмішувати інгредієнти, такі, як інгредиєнт, що спричинює диференціацію, активатор кровотоку, бактерицидний засіб, протизапальний засіб, клітинний активатор, вітамін, амінокислоту, зволожувач та кератолітичний агент. Дозування конденсованого похідного аміндігідротіазину або його фармацевтично прийнятної солі згідно з винаходом розрізняється у залежності від гостроти симптомів, віку, статі, маси тіла, способу введення, типу солі та характеру хвороби. Звичайно оральна доза для дорослого становить від біля 30 мкг до 10 г, переважно від 100 мкг до 5 г, краще від 100 мкг до 1 г на добу, тоді як ін'єкційна доза для дорослого становить від біля 30 мкг до 1 г, переважно від 100 мкг до 500 мг, краще від 100 мкг до 300 мг на добу за один або кілька прийомів. Сполуки формули (I) можна використовувати у комбинації з іншими лікарськими засобами, що як, вважається, модифікують хворобу або лікують симптоми нейродегенеративної хвороби, як от хвороба Альцгеймера. Отже, даний винахід пропонує фармацевтичний продукт, який містить у сполученні першу діючу речовину, якою є сполука формули (І) або її фармацевтично прийнятна сіль, та принаймні одну іншу діючу речовину, придатну для лікування нейродегенеративної хвороби. В одному з варіантів здійснення винаходу нейродегенеративною 11 UA 109927 C2 5 10 15 20 25 30 35 40 45 50 55 60 хворобою є деменція типу Альцгеймера (AD). Прикладами таких додаткових діючих речовин можуть бути симптоматичні агенти, які, зокрема, модифікують передачу холінергину, як от агоністи мускаринових рецепторів М1 та М3 або алостеричні модулятори, антагоністи мускарину М2, агоністи мускарину М4 або позитивні алостеричні модулятори (PAM), інгібітори ацетилхолінестерази (наприклад, тетрагідроамінакридин, донепезила гідрохлорид та рівастигмін), агоністи нікотинових рецепторів або алостеричні модулятори (як от агоністи α7 або алостеричні модулятори чи агоністи α4β2 або алостеричні модулятори), агоністи PPAR (наприклад, агоністи PPARγ), агоністи або часткові агоністи рецепторів 5-HT4, антагоністи гістаміну H3, антагоністи рецепторів 5-HT6 або ліганди рецепторів 5HT 1A та антагоністи або модулятори рецепторів NMDA, антагоністи 5-HT2A, антагоністи 5-HT7, агоністи D1 або PAM, агоністи D4 або PAM, агоністи D5 або PAM, зворотні агоністи GABA-A α5 або негативні алостеричні модулятори (NAM), агоністи GABA-A α2/3 або PAM, модулятори mGluR2 (PAM або NAM), mGluR3 PAM, mGluR5 PAM, інгібітори PDE 1, інгібітори PDE 2, інгібітори PDE 4, інгібітори PDE 5, інгібітори PDE 9, інгібітори PDE 10, інгібітори GlyT1, інгібітори DAAO, інгібітори ASC1, модулятори AMPA, активатори або інгібітори SIRT1, антагоністи AT4, антагоністи GalR1, ліганди GalR3, антагоністи аденозину A1, антагоністи аденозину A2a, антагоністи або агоністи α2A, селективні та неселективні інгібітори зворотного засвоєння норадреналіну (SNRI), або потенційні модифікатори хвороби, у тому числі інгібітори або модулятори гамма-секретази, активатори або модулятори альфа-секретази, інгібітори агрегації амілоїдів, амілоїдні антитіла, інгібітори тау-агрегації або інгібітори тау-фосфорилювання/кінази, активатори таудефосфорилювання/ фосфатази, інгібітори мітоген активованої протеїнкінази кінази 4 (MKK4/MEK4/MAP2K4), інгібітори c-Jun N-терміналкінази (JNK), інгібітори казеїнкінази, інгібітори MK2 (мітоген активованої протеїнкінази-активованої протеїнкінази 2), інгібітори MARK (кінази, що регулює мікротубулярну спорідненість), інгібітори CDK5 (циклінзалежної кінази 5), інгібітори GSK-3 (глікогенсинтази кінази-3) та інгібітори тау-тубулинкінази-1 (TTBK1). Також такими лікарськими засобами можуть бути блокатори кальцієвих каналів, інгібітори HMG-CoA (3гідроксі-3-метил-глутарил-CoA)-редуктази (статини) та засоби зниження ліпідів, імітатори (фактору зросту нервів) NGF, антиоксиданти, ліганди GPR3, активатори плазмину, активатори NSAID), неприлізину (NEP), активатори IDE (ферменту розкладу інсуліну), агоністи мелатонину MT1 та/або MT2, ліганди TLX/NR2E1 (безхвостого рецептора Х), ліганди GluR1, антагоністи RAGE (рецептора кінцевих продуктів просунутої глікації), інгібітори EGFR (рецептора фактору епідермального зросту), ліганди FPRL-1 (схожого на формилпептид рецептора-1), антагоністи GABA та інгібітори MICAL (молекули, взаємодіючої з casL), наприклад, інгібітори оксоредуктази, антагоністи/зворотні агоністи CB1, нестероїдні протизапальні засоби (NSAIDs), протизапальні засоби (наприклад, такі, що лікують нейрозапалення, збільшуючи або зменшуючи його), ліганди протеїну прекурсору амілоїду (APP), протиамілоїдні вакцини та/або антитіла, засоби, які сприяють або підсилюють видтік та/або виведення амілоїду, інгібітори гістондеацетилази (HDAC), антагоністи EP2, інгібітори 11-бета HSD1 (гідроксістероїдної дегідрогенази), агоністи рецептора Х печінки (LXR) або PAM, імітатори пов'язаного з рецептором ліпопротеїну протеїну (LRP) та/або його ліганди, та/або підсилювачі, та/або інгібітори, інгібітори бутирилхолінестерази, інгібітори кінуринової кислоти та/або інгібітори кінуренінамінотрансферази (KAT), антагоністи орфанін FQ / ноцицептин (NOP) /рецептора опіоїдного типу 1 (ORL1), ліганди транспортера збуджуючої амінокислоти (EAAT) (активатори або інгібітори), та інгібітори активатора-інгібітора1 плазминогену (PAI-1), агоністи ніацину та/або GPR109 або PAM у сполученні із засобами зниження холестерину та/або інгібіторами HMGCoA-редуктази (статинами), дімеболином або подібними засобами, антигістамінними засобами, засобами, зв'язуючими метали, хелатуючими засобами, що створюють хелатні сполуки, антибіотиками, стимуляторами секреції гормону зросту, засобами зниження холестерину, вітаміном Е, інгібіторами засвоєння холестерину, стимуляторами та/або активаторами видтоку холестерину та стимуляторами підвищення інсуліну. В одному з варіантів здійснення даного винаходу фармацевтичний продукт, який містить у сполученні першу діючу речовину, якою є сполука формули (І) або її фармацевтично прийнятна сіль, та принаймні одну другу діючу речовину, обрану з-поміж: інгібіторів холінестерази, наприклад, донепезилу, галантаміну, рівастігамін тетрагідроамінакрідіну та їх фармацевтично прийнятних солей, - антагоністів 5-HT6, наприклад, SB-742457, та їх фармацевтично прийнятних солей, - інгібіторів HMGCoA-редуктази, наприклад, ловастатину, росувастатину, аторвастатину, сімвастатину, флувастатину, пітавастатину, правастатину та їх фармацевтично прийнятних солей. Окремі компоненти таких сполучень можна вводити послідовно або одночасно нарізно або у 12 UA 109927 C2 5 10 15 20 25 30 35 40 45 50 55 60 складі комбінованих фармацевтичних препаратів. Отже, фармацевтичний продукт може являти собою, наприклад, фармацевтичну композицію – суміш першої та інших діючих речовин. Або ж фармацевтичний продукт може містити першу та інші діючі речовини у вигляді окремих фармацевтичних препаратів, призначених для одночасного, послідовного або нарізного введення хворим, які їх потребують. Зазначені вище комбінації можуть бути зручно представлені для використання у вигляді фармацевтичних композицій і такі фармацевтичні препарати, що містять вищезазначену комбінацію разом з фармацевтично прийнятним носієм або наповнювчем становлять ще один аспект винаходу. Коли сполука формули (I) або її фармацевтично прийнятна сіль застосовується у комбінації з іншим лікарським засобом, дозування кожного з компонентів може відрізнятися від випадку, коли вони застосовуються кожний сам по собі. Фахівці зможуть легко визначити відповідні дози. Отже, у наступному аспекті винахід пропонує спосіб виготовлення фармацевтиної композиції, у якому змішують принаймні одну сполуку формули (I), як визначено вище, або її фармацевтично прийнятну сіль, з одним або кількома фармацевтично прийнятними ад'ювантами, розріджувачами або носіями та/або з одним або кількома іншими терапевтично або профілактично активними засобами. В одному з варіантів здійснення винаходу пропонується фармацевтична композиція, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, один або кілька засобів для лікування хвороби Альцгеймера, наприклад, агоніст мускаринових рецепторів М1 і М3 або алостеричний модулятор, антагоніст мускарину М2, інгібітор ацетилхолінестерази, агоніст або алостеричний модулятор рецептора нікотину, агоніст PPAR, агоніст або частковий агоніст рецептора 5-HT4, антагоніст гістаміну H3, антагоніст рецептора 5-HT6, ліганд рецептора 5HT1A, агоніст або модулятор рецептора NMDA, антагоніст 5-HT2A, антагоніст 5-HT7, агоніст D1 або позитивний алостеричний модулятор (PAM), агоніст D4 або PAM, зворотний агоніст або негативний алостеричний модулятор GABA-A α5 (NAM), агоніст GABA-A α2/3 або PAM, модулятор mGluR2 (PAM або NAM), mGluR3 PAM, mGluR5 PAM, інгібітор PDE 1, інгібітор PDE 2, інгібітор PDE 4, інгібітор PDE 5, інгібітор PDE 9, інгібітор PDE 10, інгібітор GlyT1, інгібітор DAAO, інгібітор ASC1, модулятор AMPA, активатор або інгібітор SIRT1, антагоніст AT4, антагоніст GalR1, ліганд GalR3, антагоніст аденозину A1, антагоніст аденозину A2a, антагоніст або агоніст α2A, селективний або неселективний інгібітор зворотнього засвоєння пресинаптичним нервовим закінченням норадреналіну (SNRI), інгібітор або модулятор гамма-секретази, активатор або модулятор альфа-секретази, інгібітор агрегації амілоїда, протиамілоїдне антитіло, інгібітор тауагрегації, інгібітори тау-фосфорилювання, інгібітори МК2 (активованої мітогенами протеїнкіназаактивована протеїнкіназа 2), інгібітор MARK (кіназа, що регулює мікротубулярну спорідненість), інгібітор CDK5 (циклінзалежної кінази 5), інгібітор GSK-3 (глікогенсинтази кінази-3), блокатор кальцієвих каналів, інгібітор HMG-CoA (3-гідроксі-3-метил-глутарил-CoA)-редуктази (статин) та засоб зниження ліпідів, імітатор фактору зросту нервів (NGF), антиоксидант, ліганд GPR3, активатор плазмину, активатор неприлізину (NEP), активатор IDE (ферменту розкладу інсуліну), агоніст мелатонину MT1 та/або MT2, ліганд TLX/NR2E1 (безхвостого рецептора Х), ліганд GluR1, антагоніст RAGE (рецептора кінцевих продуктів просунутої глікації), інгібітор EGFR (рецептора фактору епідермального зросту), ліганд FPRL-1 (схожого на формилпептид рецептора-1), антагоніст GABA або інгібітор MICAL (молекули, взаємодіючої з casL), наприклад, інгібітор оксоредуктази, у сполученні з фармацевтично прийнятним носієм. У подальшому варіанті здійснення винаходу пропонується сполучення, яке включає сполуку формули (I)або її фармацевтично принятну сіль, як описано вище, разом з іншим лікарським засобом, як зазначено тут, для послідовного або одночасного введення нарізно або у складі фармацевтичних композицій. В іншому аспекті винахід пропонує спосіб інгібування вироблення протеїну амілоїду-β та/або профілактики або лікування нейродегенративної хвороби, як от деменція типу Альцгеймера (AD), синдром Дауна, цереброваскулярна амілоїдна ангіопатія (CAA), помірні когнітивні порушення (MCI), втрата пам'яті, предсенільна деменція, стареча деменція, спадковий крововилив до мозку з амілоїдозом та інші форми дегенеративного деменції, як от деменція змішаного васкулярно-дегенеративного походження, деменція, пов'язане з супрануклеарним паралічем, деменція, пов'язана з базальною дегенерацією кори мозку, деменція, пов'язана з хворобою Паркінсона (PD), та деменція, пов'язана з дифузною формою тілець Леві типу AD, у якому хворій людині, що страждає від такого стану, вводять профілактично або терапевтично ефективну кількість описаної вище фармацевтичної композиції або сполуки формули (I), як описано вище, або її фармацевтично прийнятної солі. "Ефективною кількістю" є така, що достатня принести користь хворому або принаймні спричинити зміну стану хворого. 13 UA 109927 C2 5 10 15 20 25 30 35 40 45 50 55 60 Хвороба Альцгеймера (AD) з точки зору патології характеризується наявністю нейрофібрилярних клубків (NFTs) та бляшок, що складаються з пептидів амілоїду (Aβ) різної довжини, наприклад, з 42 амінокислот (Aβ42) та з 40 амінокислот (Aβ40). На додаток до цих патологічних маркерів очевидною є атрофія мозку. Вважається, що бляшки утворюються завдяки агрегації пептидів Aβ Пептиди Aβ утворюються у мозку внаслідок послідовного розщеплення протеїну прекурсору амілоїду (APP) β-секретазою (BACE-1) та γ–секретазою. Отже, потенційні лікувальні засоби проти AD, спрямовані на інгібування амілоїдного утворення шляхом інгібування BACE-1 або γ-секретази, мають бути спроможні на достатнє накопичення у мозку, щоб чинити вплив на AD. Хоча BACE-1 являє собою привабливу мету, щоб зупинити або уповільнити вироблення амілоїдних пептидів, різним групам дослідників не вдавалося знайти інгібітор BACE-1, який міг би проникати до центральної нервової системи (CNS) і таким чином інгібувати фермент на місці його дії. Мозок захищають кілька бар'єрів, у тому числі гематоенцефалічний бар'єр (BBB) та транспортери (Hitchcock and Pennington, J Med Chem 2006, 29, 7559; Ueno, Curr. Med. Chem. 2007, 14, 1199; Gloor et al., Brain Res. Rev. 2001, 36, 258). Відомі кілька транспортерів ефлюксу, які протидіють проникненню речовин до мозку. Одним з найвідоміших та найефективніших у недопущенні ксенобіотиків до ЦНС є P-глікопротеїн (Pgp) (Kusuhara and Sugiyama, Drug Discovery Today, 2001, 6, 150; Mahar Doan et al., J. Pharm. Expt. Ther. 2002, 303, 1029; Lin, Drugs of Today 2004, 40, 5; Lin & Yamazaki, Clin Pharmacokinet. 2003, 42, 59; Schinkel, Adv. Drug Deliv. Rev. 1999, 36, 179). Було показано, що ефлюкс Pgp є важливим для інгібіторів BACE-1 (Hussain et al., J. Neurochem. 2007, 100, 802). Отже, важливим є подолання ефлюксу Pgp. Фахівцям зрозуміло, що існують кілька шляхів вимірювання або прогнозування проникнення до ЦНС in vitro або in vivo. Потенціал проникнення до ЦНС можна оцінити in vitro, визначивши, чи здатна сполука опиратися ефлюксу Pgp, тобто виконавши аналіз in vitro на Pgp. Фахівцям зрозуміло, що можна використовувати різні лінії клітин і що ці лінії здатні або не здатні впливати на результати аналізу. Далі описується приклад такого аналізу (Cyprotex UK). Аналіз MDR-1 MDCK, що описується далі, був спрямований на визначення ефлюксу Pgp. Аналіз був виконаний Cyprotex Discovery Ltd. 15 Beech Lane, Macclesfield, Cheshire, UK, SK10 2DR Проникність MDR1-MDCK (двоспрямована; pH 7.4/pH 7.4) Протокол виконання MDCK – це лінія епітеліальних клітин, що походить з собачих нирок. Ці клітини можна трансфектувати для постійної експресії активного Р-глікопротеїну (MDR1-MDCK), й вони ідеально підходять для вивчення ефлюксу лікарських засобів. Випробувану речовину додають до апікальної або базолатеральної сторони злитого моношару MDR1-MDCK клітини й вимірюють проникність, відслідковуючи появу тестованої речовини на протилежному боці мембрани з використанням LC-MS/MS (рідинної хроматографії-мас-спектрометрії). З цього вимірюють або розраховують коефіцієнт ефективної проникності (P app)та співвідношення ефлюксу. Мета досліду Виміряти проникність тестованої речовини у напрямках від апікальної до базолатеральної поверхні (A-B) та від базолатеральної до апікальної поверхні (B-A) крізь клітини MDR1-MDCK. Розраховується співвідношення проникностей B-A та A-B (співвідношення ефлюксу, щоб виявити, чи піддається сполука ефлюксу Р-глікопротеїну. Сполуки використовують у вигляді розчину 200 мкл 10 мМ випробуваної сполуки у ДМСО. Методика експерименту Використовують клітини MDR1-MDCK, одержані з Національного інституту охорони здоров'я у Роквіллі, штат Меріленд, США. Одержавши злиті культури, готують моношари, двічі промиваючи апікальну та базолатеральну поверхні буферним розчином з pH 7.4 при 37 °C. Далі клітини інкубують з буферним розчином з pH 7.4 в апікальному та базолатеральному відділах 40 хвилин для стабілізації фізіологічних параметрів. Після того видаляють буферний розчин з pH 7.4 з апікального відділу й заміняють його дозувальними розчинами тестованої речовини. Ці розчини готують розбавленням 10 мМ дослідної речовини у ДМСО з буфером, одержуючи кінцеву концентрацію дослідної речовини 10 мкМ (кінцева концентрація у ДМСО, приведена до 1 %). Також до дозувального розчину додають флуоресцентний маркер Lucifer yellow. Вставки до апікального відділу далі вміщують до "супутніх" планшетів, які містять свіжий буферний розчин з pH 7.4. З дозувальних розчинів готують аналітичні стандартні розчини. В експериментах з напрямком від базолатеральної до апікальної поверхонь (B-A) спочатку 14 UA 109927 C2 5 10 15 20 25 30 замінюють буфер у вставках, а потім вміщують їх до супутніх планшетів, які містять дозувальні розчини. Інкубацію ведуть 60 хвилин в атмосфері з 5 % CO2 при відносній вологості 95 % і температурі 37 °C. Після інкубаційного періоду супутній планшет видаляють, а апікальні та базолатеральні зразки розбавляють для аналізу LC-MS/MS. Проникність дослідної сполуки визначають двічі. На кожному планшеті проганяють сполуки з відомими характеристиками проникності як контрольні. Дослідні та контрольні сполуки визначають кількісно касетним аналізом рідинної хроматографії-мас-спектрометрії з калібруванням за 5 точками при відповідному розбавленні проб. Використовують режим аналізу генериків Cyprotex.Стартову концентрацію (C 0) визначають з дозувального розчину, а одержаний в експерименті вихід розраховують з C 0 та концентрацій у апікальному та базолатеральному відділах. Цілісність моношарів протягом експерименту перевіряють, відслідковуючи проникнення Lucifer yellow за допомогою флуорометричного аналізу. Проникнення Lucifer yellow низьке, якщо моношари не пошкоджені. Якщо значення Lucifer yellow Papp вище межі QC (контролю якості) в одній окремій дучці дослідної речовини, то визначають n=1. Якщо значення P app Lucifer yellow вище межі QC в обох парних дучках для дослідної сполуки, то її випробують повторно. Якщо у повторному досліді спостерігається висока проникність Lucifer yellow в обох дучках, оцінюють токсичність або власну флуоресценцію дослідної сполуки. Ніякі подальші експерименти не проводяться у даному випадку Аналіз даних Коефіцієнт проникності для кожної сполуки (Papp) розраховують з наступного рівняння: Papp = (dQ ÷ dt) ÷ (C0 x A) де dQ/dt – швидкість проникнення лікарського засобу крізь клітини, C 0 – концентрація у донорському відділенні на початок відліку часу, А – площа клітинного моношару. C0 визначають аналізом дозувального розчину на початку експерименту. Крім того, розраховують швидкість ефлюксу (ER) з середніх даних A-B та B-A. Його одержують з: ER = ((Papp (B – A)) ÷ ((Papp (A – B)) Поряд з дослідними сполуками піддають скринінгу дві контрольні сполуки – пропранолол (з високою проникністю) та празосин (субстрат для Р-глікопротеїну). Несподівано виявилося, що сполуки за даним винаходом мають меншу швидкість ефлюксу Pgp, ніж сполуки наведені у WO2009/091016, отже, вони мають більший потенціал проникнення до ЦНС. Дані для деяких прикладів наведені у таблиці 1. Таблиця 1 Дані MDR-1 MDCK аналізу для Pgp Приклад Порівняльний приклад 1 Порівняльний приклад 2 Порівняльний приклад 3 Порівняльний приклад 4 2 3 4 1 Порівняльний приклад 5 Порівняльний приклад 6 10 5 6 7 8 9 11 12 13 15 Pgp ER 26.2 16.6 24.0 20.7 1.7 1.4 1.0 0.7 4.7 4.5 0.6 1.5 1.0 0.8 1.7 1.2 1.0 0.8 1.7 1.6 35 15 UA 109927 C2 Приклад 16 17 18 5 10 15 20 25 30 35 40 45 50 55 Pgp ER 1.1 1.4 1.1 Примітка: Приклад 14 не включений навмисно. Порівняльні приклади 1-6 взято з опублікованої міжнародної патетної заявки WO2009/091016; порівняльні прикладі 1-4 наведені у заявці WO2009/091016 як приклади 32, 35, 54 та 73 відповідно. Порівняльні приклади 5 та 6: N-(3-((4aS, 5S, 7aS)-2-аміно-5-(фторметил)-4a, 5,7,7a-тетрагідро-4H-фуро[3,4-d][1,3]тіазин7a-іл)-4-фторфеніл)-5-етоксіпіколінамід, та N-(3-((4aS, 5R, 7aS)-2-аміно-5-метил-4a, 5,7,7a-тетрагідро-4H-фуро[3,4-d][1,3]тіазин-7a-іл)-4фторфеніл)-5-етоксіпіколінамід відповідно. Ці дані доводять, що сполуки за винаходом, зокрема, приклади 1-13 та 15 - 18, мають меншу швидкість ефлюксу Pgp, а відтак потенційно краще проникають до ЦНС, ніж показані сполуки за WO2009/091016, згідно з вищеописаною визнаною методикою оцінки проникнення до ЦНС. Наприклад, у сполук за порівняльними прикладами 1-6 швидкість ефлюксу Pgp більше, ніж у сполук за винаходом. Більш того, у порівняльних прикладах 5 та 6 швидкість ефлюксу Pgp вище, ніж у близького аналога за прикладом 10 цього винаходу, що чітко доводить сприятливу дію, яку чинить трифторметильна група на тетрагідрофуранове кільце при ефлюксі Pgp, тобто, трифторметильна група зменшує ефлюкс Pgp. Фахівцям зрозуміло, що вищеописаний аналіз in vitro Pgp дозволяє передбачити результати випробування проникнення до ЦНС in vivo. Отже, дуже доцільно, щоб зменшення Pgp ефлюксу також мало місце in vivo. Фахівцям відомо, що існує багато способів оцінки проникнення сполук до ЦНС in vivo. Наприклад, можна кількісно визначити концентрації сполуки у крові або плазмі й мозку та розрахувати співвідношення мозок: кров (Br:Bl) або мозок: плазма (Br:Pl). Цей спосіб існує давно й широко використовується при визначенні проникнення до ЦНС (Summerfield et al., J Pharmacol. Expt. Ther. 2007, 322, 205). Фахівцям відомо, що таку оцінку можна проводити у стійкому стані, в одній точці часу, кількох точках часу або визначенням співвідношень площ під кривою. Всі ці методики рівноцінні, але кожна має свої недоліки, про що фахівці також добре знають. Нещодавні публікації звертають увагу на те, що важливо брати до уваги вільні концентрації in vivo і що за відсутності ефлюксу з мозку вільна концентрація у плазмі має дорівнювати вільній концентрації у мозку (Kalvass and Maurer, Biopharmaceutics & Drug Disposition 2002, 23, 327; Mauer et al, Drug Metab. Disposition 2005, 33, 175; Trainor Expert Opin. Drug Discov. 2007, 2, 51). Отже, якщо сполука може вільно проникати до мозку й не піддається активному ефлюксу, наприклад, з участю Pgp або іншого транспортера, то співвідношення вільних концентрацій мозок: плазма (Brfr: Plfr) або незв'язаних концентрацій мозок: плазма (Br u: Plu) становить приблизно 1:1. Фахівцям відомо, що вільні або незв'язані концентрації можна розрахувати, помноживши загальну концентрацію у плазмі або у мозку на незв'язану частку у мозковій тканині або плазмі, яку можна визначити наведеним вище аналізом. Також фахівці знають, що незв'язана частка може змінюватися у залежності від умов експерименту, а саме концентрації, температури тощо. Фахівці можуть врахувати це й обрати найбільш оптимальні умови. Вони розуміють, що поки умови лишаються однаковими для кожної досліджуваної сполуки, аналіз дасть стабільні результати для випробуваної серії сполук, зводячи розходження до мінімуму. Також припускається, що концентрації лікарського засобу у спинномозковій рідині (CSF) еквівалентні вільним концентраціям у мозку для сполук, які не видаляються активно з мозку (He et al., Xenobiotica 2009, 39, 687). Отже, іншим способом визначення проникності до ЦНС є оцінка співвідношення CSF:вільна плазма (CSF: Plfr) або CSF:незв'язана плазма (CSF: Plu). Якщо вільний лікарський засіб у плазмі здатен проникати до ЦНС і не піддається активному притоку чи ефлюксу, то CSF:Plfr або CSF:Plu має становити приблизно 1:1. Фахівці розуміють ускладнення, пов'язані з визначенням концентрації лікарського засобу у CSF та екстракцією CSF, наприклад, те, що CSF може бути забруднена кров'ю, залежно від способу виводу і що визначення концентрацій у CSF може бути не дуже точним у залежності від застосованої дози. Так, було показано, що інгібітор BACE фірми GlaxoSmithKline (GSK188909), BACE-1 IC50 5nM, що має низьку експозицію у ЦНС, не показав ефективність у зменшенні вироблення Aβ40 у K595N/M596I мозку мишей TASTPM (де має місце надпродукція як людського APPswe , так і PSM146V 1 ) при введенні у великій дозі (Hussain et al., J. Neurochem. 2007, 100, 802 – 809). Після оральної дози 250 мг/кг концентрація GSK188909 у мозку мишей TASTPM становить 0.62 мкМ. При введенні інгібітора Pgp (GF120918) за 5 годин до орального прийому GSK188909, 16 UA 109927 C2 5 10 15 20 25 30 35 концентрація у мозку GSK188909 становила 5.43 мкМ посля оральної дози 250 мг/кг, тобто при спільному введенні з інгібітором Pgp проникнення до ЦНС збільшилося майже у 9 разів, показуючи, що ефлюкс Pgp є важливим механізмом недопущення проникнення інгібіторів BACE до ЦНС. Більш того, за відсутності інгібітора Pgp оральна доза 250 мг/кг GSK188909 ніяк не діє на рівні Aβ40 у мозку мишей TASTPM, тоді як спільне введення з інгібітором Pgp (за 5 годин до прийому GSK188909) знижує рівні Aβ40 у мозку на 68 % у порівнянні з контрольними мишами. В іншій праці повідомляється про подібні результати з трьома інгібіторами BACE-1 фірми Bristol-Myers Squibb (Meredith et al., J. Pharm. Expt. Ther. 2008, 326, 502-513). Йдеться про три сполуки – субстрати Pgp in vitro. При введенні мишам ці три сполуки слабо проникали до ЦНС і не знижували рівнів амілоїдів у мозку, але у плазмі знизили ці рівні. Коли ті самі три сполуки давали мишам, які не мають експресії Pgp (KO), проникнення до ЦНС посилилося, і сполуки змогли знизити рівні амілоїдів у мозку. Публікації дослідників фірми Schering-Plough (Iserloh et al., Bioorg. Med. Chem. Lett. 2008, 18, 418) також показують, що що інгібітори BACE-1 з їх серії (приклад 11 у цій публікації) піддаються впливу ефлюксу Pgp, внаслідок чого ця сполука показала низький Br:Pl (
ДивитисяДодаткова інформація
Назва патенту англійськоюFused aminodihydrothiazine derivatives useful as bace inhibitors
Автори англійськоюHall, Adrian, Farthing, Christopher Neil, Castro Pineiro, Jose, Luis
Назва патенту російськоюКонденсированные производные аминодигидротиазина, полезные как ингибиторы васе
Автори російськоюХолл Адриан, Фартинг Кристофер Нэйл, Кастро Пинэйро Хосе Луис
МПК / Мітки
МПК: A61P 3/00, A61P 25/00, C07D 513/04, A61K 31/542
Мітки: інгібітори, васе, конденсовані, амінодигідротіазину, корисні, похідні
Код посилання
<a href="https://ua.patents.su/61-109927-kondensovani-pokhidni-aminodigidrotiazinu-korisni-yak-ingibitori-vase.html" target="_blank" rel="follow" title="База патентів України">Конденсовані похідні амінодигідротіазину, корисні як інгібітори васе</a>
Попередній патент: Межовий ультразвуковий ідентифікатор положення координат
Наступний патент: Зворотний канал користувацького введення для бездротових дисплеїв
Випадковий патент: Установка для диспергування мінеральних речовин