Сполуки, які інгібують активність катехол-о-метилтрансферази
Номер патенту: 112697
Опубліковано: 10.10.2016
Автори: Паюнен Тайна, Дін Белл Девід, Вайсмаа Матті, Тіайнен Ейя, Алмарк Марко, Пюстюнен Ярмо, Луйро Анне, Мессінгер Йозеф, Кауппала Міка
Формула / Реферат
1. Сполука формули І
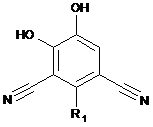 , I
, I
дe
R1 являє собою (С1-С6)алкіл, (С2-С6)алкеніл, (С2-С6)алкініл, (С3-С7)циклоалкіл, (С4-С10)циклоалкеніл, арил, (R2)2C=C-, галоген, гідрокси, (C1-С6)алкокси, (C1-С6)алкіл-S-, (С4-С10)циклоалкенілокси, (С4-С10)циклоалкеніл-S-, арилокси, арил-S-, гетероарилокси, гетероарил-S-, (R3)2N-, (R4)2C=N-, гетероцикліл, гетероарил, арил(С1-С6)алкіл, (1-аміно-1-карбоксиметил)-(С1-С6)алкіл, галоген(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкіл-S-(С1-С6)алкіл, (R3)2N-(С1-С6)алкіл, гетероцикліл(C1-С6)алкіл, карбоксі(С2-С6)алкеніл, (С3-С7)циклоалкіл(С2-С6)алкеніл, арил(С2-С6)алкеніл, (С1-С6)алкоксі(С2-С6)алкеніл, гетероцикліл(С2-С6)алкеніл, гетероарил(С2-С6)алкеніл, карбоксі(С2-С6)алкініл, (С3-С7)циклоалкіл(С2-С6)алкініл, арил(С2-С6)алкініл, (С1-С6)алкоксі(С2-С6)алкініл, гетероцикліл(С2-С6)алкініл, гетероарил(С2-С6)алкініл, галоген(С1-С6)алкокси, гідроксі(С1-С6)алкокси, (С1-С6)алкоксі(С1-С6)алкокси, (С1-С6)алкіл-(С=О)-О-, R5-(S=O)-, R5-(O=S=O)-, гідроксі(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкоксі-(С=О)-(С2-С6)алкеніл або (С1-С6)алкіл-(С=О)-О-(С1-С6)алкіл, де зазначений (С4-С10)циклоалкеніл, арил, гетероцикліл, гетероарил або (С3-С7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6;
R2 у кожному випадку присутності незалежно являє собою карбокси або арил, де зазначений арил у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6;
R3 у кожному випадку присутності незалежно являє собою Н, (С1-С6)алкіл, (С3-С7)циклоалкіл, арил, (С3-С7)циклоалкіл(С1-С6)алкіл, гідроксі(С1-С6)алкіл або (С1-С6)алкоксі(С1-С6)алкіл, де зазначений (С3-С7)циклоалкіл або арил сам по собі або як частина іншої групи у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл, галоген, гідрокси, (С1-С6)алкокси або гідроксі(С1-С6)алкіл;
R4 у кожному випадку присутності незалежно являє собою Н або арил, де зазначений арил у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл, галоген або (С1-С6)алкокси;
R5 являє собою (С1-С6)алкіл, арил, гідрокси або (С1-С6)алкокси, де зазначений арил є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, (С2-С6)алкеніл, карбокси, ціано, арил, галоген, гідрокси, (С1-С6)алкокси, (С1-С6)aлкiл-S-, (С4-С10)циклоалкенілокси, (С4-С10)циклоалкеніл-S-, арилокси, арил-S-, гетероарилокси, гетероарил-S-, (R7)2N-, гетероарил, карбоксі(С1-С6)алкіл, арил(С1-С6)алкіл, галоген(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, гетероцикліл(С1-С6)алкіл, (С1-С6)алкіл-(С=О)-, (С1-С6)алкокси-(С=О)-, гетероцикліл-(С=О)-, (R7)2N-(C=O)-, галоген(С1-С6)алкокси, R8-(S=O)-, R8-(O=S=O)-, (С1-С6)алкоксі-(С=О)-(С1-С6)алкіл, (R7)2N-(С=O)-(С1-С6)алкіл або (С1-С6)алкоксі(С1-С6)алкокси-(С=О)-, де зазначений арил, гетероарил або гетероцикліл сам по собі або як частина іншої групи в кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл;
або R6 і R6, обидва приєднані до того самого кільцевого вуглецевого атома, утворюють разом з кільцевим вуглецевим атомом, до якого вони приєднані, -(С=О)-групу;
R7 у кожному випадку присутності незалежно являє собою Н, (С1-С6)алкіл, (С3-С7)циклоалкіл або карбоксі(С1-С6)алкіл, де зазначений (С3-С7)циклоалкіл у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл;
R8 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, гідрокси, (С1-С6)алкокси або (R9)2N-;
R9 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл;
або її фармацевтично прийнятна сіль або ефір.
2. Сполука за п. 1, де
R1 являє собою (С1-С6)алкіл, (С2-С6)алкеніл, (С2-С6)алкініл, (С4-С10)циклоалкеніл, арил, галоген, гідрокси, (С4-С10)циклоалкенілокси, арилокси, арил-S-, гетероарил-S-, (R3)2N-, (R4)2C=N-, гетероцикліл, гетероарил, арил(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (R3)2N-(С1-С6)алкіл, гетероцикліл(С1-С6)алкіл, карбоксі(С2-С6)алкеніл, (С3-С7)циклоалкіл(С2-С6)алкеніл, арил(С2-С6)алкеніл, (С1-С6)алкоксі(С2-С6)алкеніл, гетероарил(С2-С6)алкеніл, арил(С2-С6)алкініл, (С1-С6)алкоксі(С2-С6)алкініл, R5-(S=O)-, R5-(O=S=O)- або (С1-С6)алкоксі-(С=О)-(С2-С6)алкеніл, де зазначений (С4-С10)циклоалкеніл, арил, гетероцикліл, гетероарил або (С3-С7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6;
R3 у кожному випадку присутності незалежно являє собою Н, (С1-С6)алкіл, (С3-С7)циклоалкіл, арил, (С3-С7)циклоалкіл(С1-С6)алкіл, гідроксі(С1-С6)алкіл або (С1-С6)алкоксі(С1-С6)алкіл, де зазначений (С3-С7)циклоалкіл або арил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл;
R4 у кожному випадку присутності незалежно являє собою Н або арил, де зазначений арил у кожному випадку присутності незалежно заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл, галоген або (С1-С6)алкокси;
R5 являє собою арил, де зазначений арил заміщений за допомогою 1 замісника R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, (С2-С6)алкеніл, карбокси, ціано, арил, галоген, гідрокси, (С1-С6)алкокси, (С1-С6)алкіл-S-, арилокси, гетероарил, карбоксі(С1-С6)алкіл, арил(С1-С6)алкіл, галоген(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, гетероцикліл(С1-С6)алкіл, (С1-С6)алкіл-(С=О)-, (С1-С6)алкокси-(С=О)-, гетероцикліл-(С=О)-, (R7)2N-(C=O)-, галоген(С1-С6)алкокси, R8-(O=S=O)-, (С1-С6)алкоксі-(С=О)-(С1-С6)алкіл, (R7)2N-(C=O)-(C1-C6)aлкiл або (С1-С6)алкоксі(С1-С6)алкокси-(С=О)-, де зазначений арил, гетероарил або гетероцикліл сам по собі або як частина іншої групи в кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл;
або R6 і R6, обидва приєднані до того самого кільцевого вуглецевого атома, утворюють разом з кільцевим вуглецевим атомом, до якого вони приєднані, -(С=О)-групу;
R7 у кожному випадку присутності незалежно являє собою Н, (С1-С6)алкіл, (С3-С7)циклоалкіл або карбоксі(С1-С6)алкіл, де зазначений (С3-С7)циклоалкіл є незаміщеним;
R8 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл або (R9)2N-;
R9 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл.
3. Сполука за п. 2, де
R1 являє собою (С1-С6)алкіл, (С2-С6)алкеніл, (С2-С6)алкініл, (С4-С10)циклоалкеніл, арил, галоген, (С4-С10)циклоалкенілокси, арилокси, арил-S-, гетероарил-S-, (R3)2N-, (R4)2C=N-, гетероцикліл, гетероарил, арил(С1-С6)алкіл, (R3)2N-(C1-C6)aлкіл, карбоксі(С2-С6)алкеніл, (С3-С7)циклоалкіл(С2-С6)алкеніл або арил(С2-С6)алкеніл, де зазначений (С4-С10)циклоалкеніл, арил, гетероцикліл, гетероарил або (С3-С7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6;
R3 у кожному випадку присутності незалежно являє собою Н, (С1-С6)алкіл або (С1-С6)алкоксі(С1-С6)алкіл;
R4 у кожному випадку присутності незалежно являє собою Н або арил, де зазначений арил у кожному випадку присутності незалежно заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл, галоген або (С1-С6)алкокси;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, ціано, арил, галоген, гідрокси, (С1-С6)алкокси, (С1-С6)алкіл-S-, карбоксі(С1-С6)алкіл, арил(С1-С6)алкіл, галоген(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, гетероцикліл-(С=О)-, (R7)2N-(C=O)-, R8-(O=S=O)- або (С1-С6)алкоксі-(С=О)-(С1-С6)алкіл, де зазначений арил або гетероцикліл сам по собі або як частина іншої групи є незаміщеним;
R7 у кожному випадку присутності незалежно являє собою Н, (С1-С6)алкіл або (С3-С7)циклоалкіл, де зазначений (С3-С7)циклоалкіл є незаміщеним;
R8 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл або (R9)2N-;
R9 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл.
4. Сполука за п. 3, де
R1 являє собою (С1-С6)алкіл, (С2-С6)алкеніл, арил, галоген, арилокси, арил-S-, (R3)2N-, (R4)2C=N-, гетероцикліл, гетероарил, арил(С1-С6)алкіл, (С3-С7)циклоалкіл(С2-С6)алкеніл або арил(С2-С6)алкеніл, де зазначений арил, гетероцикліл, гетероарил або (С3-С7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6;
R3 у кожному випадку присутності незалежно являє собою Н або (С1-С6)алкіл;
R4 у кожному випадку присутності незалежно являє собою Н або арил, де зазначений арил у кожному випадку присутності незалежно заміщений за допомогою 1 замісника, яким є (С1-С6)алкіл, галоген або (С1-С6)алкокси;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, ціано, арил, галоген, гідрокси, (С1-С6)алкокси, (С1-С6)алкіл-S-, карбоксі(С1-С6)алкіл, галоген(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, гетероцикліл-(С=О)-, (R7)2N-(C=O)- або R8-(O=S=O)-, де зазначений арил або гетероцикліл сам по собі або як частина іншої групи є незаміщеним;
R7 у кожному випадку присутності незалежно являє собою Н або (С1-С6)алкіл;
R8 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл.
5. Сполука за п. 4, де
R1 являє собою (С1-С6)алкіл, (С2-С6)алкеніл, арил, галоген, арилокси, арил-S-, (R3)2N-, гетероцикліл, гетероарил, арил(С1-С6)алкіл або арил(С2-С6)алкеніл, де зазначений арил, гетероцикліл або гетероарил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6;
R3 у кожному випадку присутності незалежно являє собою Н або (С1-С6)алкіл;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, галоген, гідрокси, (С1-С6)алкокси, карбоксі(С1-С6)алкіл, галоген(С1-С6)алкіл або (R7)2N-(C=O)-;
R7 у кожному випадку присутності незалежно являє собою Н або (С1-С6)алкіл.
6. Сполука за п. 5, де
R1 являє собою (С2-С6)алкеніл, арил, галоген, арилокси, арил-S-, (R3)2N-, гетeроарил, арил(С1-С6)алкіл або арил(С2-С6)алкеніл, де зазначений арил або гетероарил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1 або 2 замісників R6;
R3 у кожному випадку присутності незалежно являє собою Н або (С1-С6)алкіл;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, галоген, (С1-С6)алкокси, карбоксі(С1-С6)алкіл або галоген(С1-С6)алкіл.
7. Сполука за п. 6, де
R1 являє собою (С2-С6)алкеніл, арил, галоген, арил-S-, гетероарил або арил(С1-С6)алкіл, де зазначений арил або гетероарил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, галоген або (С1-С6)алкокси.
8. Сполука за п. 7, де
R1 являє собою (С2-С6)алкеніл, галоген, арил-S- або арил(С1-С6)алкіл, де зазначений арил як частина іншої групи є незаміщеним або заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, галоген або (С1-С6)алкокси.
9. Сполука за п. 7, де
R1 являє собою (С2-С6)алкеніл, арил, арил-S-, гетероарил або арил(С1-С6)алкіл, де зазначений арил або гетероарил сам по собі або як частина іншої групи заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл або (С1-С6)алкокси.
10. Сполука за п. 9, де
R1 являє собою (С2-С6)алкеніл, арил-S- або арил(С1-С6)алкіл, де зазначений арил як частина іншої групи заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл або (С1-С6)алкокси.
11. Сполука за п. 7, де R1 являє собою (С2-С6)алкеніл.
12. Сполука за п. 7, де
R1 являє собою арил, де зазначений арил є незаміщеним або заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, галоген або (С1-С6)алкокси.
13. Сполука за п. 7, де
R1 являє собою арил-S-, де зазначений арил є незаміщеним або заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, галоген або (С1-С6)алкокси.
14. Сполука за п. 7, де
R1 являє собою гетероарил, де зазначений гетероарил є незаміщеним або заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл, галоген або (С1-С6)алкокси.
15. Сполука за п. 7, де
R1 являє собою арил(С1-С6)алкіл, де зазначений арил заміщений за допомогою 1 або 2 замісників R6;
R6 у кожному випадку присутності незалежно являє собою (С1-С6)алкіл або (С1-С6)алкокси.
16. Сполука за п. 1, де сполука являє собою 2-бром-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(фенілетиніл)ізофталонітрил, 4,5-дигідрокси-2-(пропе-1-ніл)ізофталонітрил, 4,5-дигідрокси-2-(1-метил-1Н-пірол-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(тіофен-2-іл)ізофталонітрил, 2-(фуран-2-іл)-4,5-дигідроксіізофталонітрил, 3',4',5'-трифтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(нафталін-1-іл)ізофталонітрил, 4'-трет-бутил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4'-(гідроксиметил)біфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(нафталін-2-іл)ізофталонітрил, 3,4-дигідроксі-4'-(ізопропілтіо)біфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4'-(метилтіо)біфеніл-2,6-дикарбонітрил, 3,4-дигідроксі-4'-ізопропоксибіфеніл-2,6-дикарбонітрил, 4'-(етилтіо)-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідроксі-4'-ізопропокси-3',5'-диметилбіфеніл-2,6-дикарбонітрил, 4'-бутил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-2',4',5'-триметилбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-2',5'-диметилбіфеніл-2,6-дикарбонітрил, 2-циклогексеніл-4,5-дигідроксіізофталонітрил, 3'-етил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідроксибіфеніл-2,4',6-трикарбонітрил, 3,4-дигідроксі-4'-(ізопропілсульфоніл)біфеніл-2,6-дикарбонітрил, 2',6'-диціано-3',4'-дигідрокси-N,N-диметилбіфеніл-4-сульфонамід, (Е)-4,5-дигідрокси-2-(пент-1-еніл)ізофталонітрил, 2',6'-диціано-3',4'-дигідроксибіфеніл-3-карбонову кислоту, 3,4-дигідрокси-4'-(1-метоксіетил)біфеніл-2,6-дикарбонітрил, (Е)-2-(3,3-диметилбут-1-еніл)-4,5-дигідроксіізофталонітрил, 3,4-дигідрокси-2'-метилбіфеніл-2,6-дикарбонітрил, (Е)-2-(2-циклогексилвініл)-4,5-дигідроксіізофталонітрил, (Z)-4,5-дигiдpoкcи-2-(пpoп-1-еніл)ізофталонітрил, 3-(2',6'-диціано-3',4'-дигідроксибіфеніл-4-іл)пропанову кислоту, 3,4-дигідрокси-3'-(гідроксиметил)біфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3'-(метоксиметил)біфеніл-2,6-дикарбонітрил, 2',6'-диціано-3',4'-дигідрокси-N,N-дипропілбіфеніл-4-карбоксамід, (Е)-4,5-дигідрокси-2-(проп-1-еніл)ізофталонітрил, 3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3',4'-дихлор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3'-(трифторметил)біфеніл-2,6-дикарбонітрил, 2-(фуран-3-іл)-4,5-дигідроксіізофталонітрил, 3,4-дигідрокси-4'-(трифторметил)біфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(тіофен-3-іл)ізофталонітрил, 4,5-дигідрокси-2-(5-метилфуран-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(5-метилтіофен-2-іл)ізофталонітрил, 2-бензил-4,5-дигідроксіізофталонітрил, 2-(бензофуран-2-іл)-4,5-дигідроксіізофталонітрил, 2-(5-хлортіофен-2-іл)-4,5-дигідроксіізофталонітрил, 2-(бензо[b]тіофен-2-іл)-4,5-дигідроксіізофталонітрил, (Е)-4,5-дигідрокси-2-стирилізофталонітрил, 4'-етил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3',5'-диметилбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(фенілтіо)ізофталонітрил, 4,5-дигідрокси-2-(п-толілтіо)ізофталонітрил, 4,5-дигідрокси-2-(4-метилбензил)ізофталонітрил, 2-(4-фторбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4-гідроксибензил)ізофталонітрил, 4,5-дигідрокси-2-(2-метоксибензил)ізофталонітрил, 4,5-дигідрокси-2-(4-(трифторметокси)бензил)ізофталонітрил, 2-(3-фтор-4-метоксибензил)-4,5-дигідроксіізофталонітрил, 2-(2-фторбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(2-метилбензил)ізофталонітрил, 2-(2,5-диметилбензил)-4,5-дигідроксіізофталонітрил, 2-(3-фтор-5-метилбензил)-4,5-дигідроксіізофталонітрил, 3-(2,6-диціано-3,4-дигідроксибензил)бензойну кислоту, 2-(4-фтор-3-метилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(3-метилбензил)ізофталонітрил, 2-(5-фтор-2-метоксибензил)-4,5-дигідроксіізофталонітрил, 2-(3,5-диметилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідроксі-2-(4-ізопропілбензил)ізофталонітрил, 2-(4-етилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(нафталін-1-ілметил)ізофталонітрил, 5-(2,6-диціано-3,4-дигідроксибензил)-2-гідроксибензойну кислоту, 2-(2,4-диметилбензил)-4,5-дигідроксіізофталонітрил, 2-(3,6-дигідро-2Н-піран-4-іл)-4,5-дигідроксіізофталонітрил, 2-циклопентеніл-4,5-дигідроксіізофталонітрил, (Е)-3-(2,6-диціано-3,4-дигідроксифеніл)акрилову кислоту, (Е)-4,5-дигідрокси-2-(3-метоксипроп-1-еніл)ізофталонітрил, 4,5-дигідрокси-2-(5-(морфолінометил)тіофен-2-іл)ізофталонітрил, 3,4-дигідрокси-4'-(морфолін-4-карбоніл)біфеніл-2,6-дикарбонітрил, 2-(5'-гексил-2,2'-бітіофен-5-іл)-4,5-дигідроксіізофталонітрил, 2-(1-бензил-1Н-піразол-4-іл)-4,5-дигідроксіізофталонітрил, 2-(5-гексилтіофен-2-іл)-4,5-дигідроксіізофталонітрил, (Z)-2-(бyт-2-eнiл)-4,5-дигiдpoкciiзoфтaлoнiтpил, 4,5-дигідрокси-2-(3-метилбут-2-еніл)ізофталонітрил, (Е)-2-(бут-2-еніл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-метилізофталонітрил, 4,5-дигідрокси-2-(2-метилпроп-1-еніл)ізофталонітрил, 3,4-дигідрокси-3'-метилбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-вінілізофталонітрил, 4,5-дигідрокси-2-(проп-1-ен-2-іл)ізофталонітрил, 2-(2-етокситіазол-5-іл)-4,5-дигідроксіізофталонітрил, 2-аліл-4,5-дигідроксіізофталонітрил, 3'-(трет-бутоксиметил)-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, трет-бутил-2',6'-диціано-3',4'-дигідроксибіфеніл-3-карбоксилат, 3,4-дигідроксибіфеніл-2,3',6-трикарбонітрил, 2',6'-диціано-3',4'-дигідрокси-N,N-дипропілбіфеніл-3-карбоксамід, 2',6'-диціано-N-циклогексил-3',4'-дигідроксибіфеніл-4-карбоксамід, 2',6'-диціано-N-циклогексил-3',4'-дигідроксибіфеніл-3-карбоксамід, 2',6'-диціано-N,N-діетил-3',4'-дигідроксибіфеніл-4-карбоксамід, 2',6'-диціано-N,N-діетил-3',4'-дигідроксибіфеніл-3-карбоксамід, 2',6'-диціано-N-етил-3',4'-дигідроксибіфеніл-3-карбоксамід, 2',6'-диціано-3',4'-дигідрокси-N,N-диметилбіфеніл-3-карбоксамід, 4'-фтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3',4'-дифтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 4'-фтор-3,3',4-тригідроксибіфеніл-2,6-дикарбонітрил, (Е)-4,5-дигідрокси-2-(3-фенілпроп-1-еніл)ізофталонітрил, 4'-фтор-3,4-дигідрокси-3'-метоксибіфеніл-2,6-дикарбонітрил, 5-(2,6-диціано-3,4-дигідроксифеніл)тіофен-2-карбонову кислоту, 3,4-дигідрокси-4'-(метилсульфоніл)біфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4'-пропоксибіфеніл-2,6-дикарбонітрил, 2',6'-диціано-3',4'-дигідроксибіфеніл-4-карбонову кислоту, 4'-хлор-3,4-дигідрокси-3'-метилбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(5-фенілтіофен-2-іл)ізофталонітрил, 3,4-дигідроксі-4'-ізопропілбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4'-пропілбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(1-фенілвініл)ізофталонітрил, 2',6'-диціано-3',4'-дигідроксибіфеніл-2-карбонову кислоту, 4-(2,6-диціано-3,4-дигідроксибензил)бензойну кислоту, (Е)-4,5-дигідрокси-2-(4-метоксистирил)ізофталонітрил, 3,4-дигідрокси-3',4'-диметилбіфеніл-2,6-дикарбонітрил, (Е)-4,5-дигідрокси-2-(4-метилстирил)ізофталонітрил, 4,5-дигідрокси-2-(6-гідроксинафталін-2-іл)ізофталонітрил, 4'-фтор-3,4-дигідрокси-3'-метилбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(3-метилбут-2-ен-2-іл)ізофталонітрил, 2-(2,5-диметилтіофен-3-іл)-4,5-дигідроксіізофталонітрил, 2-(2,3-дифтор-4-метилбензил)-4,5-дигідроксіізофталонітрил, 2-(4-(2,6-диціано-3,4-дигідроксибензил)феніл)пропанову кислоту, (Е)-2-(3-циклопентилпроп-1-еніл)-4,5-дигідроксіізофталонітрил, 4,5-дигідроксі-2-(1-ізобутил-1Н-піразол-4-іл)ізофталонітрил, 2-(4-(2,6-диціано-3,4-дигідроксифеніл)-1Н-піразол-1-іл)оцтову кислоту, 4,5-дигідрокси-2-(1-метил-1Н-піразол-4-іл)ізофталонітрил, 4,5-дигідрокси-2-(3-метоксипроп-1-ініл)ізофталонітрил, (Е)-4,5-дигідрокси-2-(2-(тіофен-3-іл)вініл)ізофталонітрил, (Е)-2-(2-циклопропілвініл)-4,5-дигідроксіізофталонітрил, 2',6'-диціано-3',4'-дигідроксибіфеніл-4-карбоксамід, 3,4-дигідрокси-3',4'-диметоксибіфеніл-2,6-дикарбонітрил, 3,4-дигідроксі-3'-ізопропілбіфеніл-2,6-дикарбонітрил, 2-(2,3-дигідробензофуран-5-іл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(6-метоксинафталін-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(4-(гідроксиметил)бензил)ізофталонітрил, 2-(2,6-дифтор-3-метилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4-(трифторметил)фенілтіо)ізофталонітрил, 2-(2,4-диметилфенілтіо)-4,5-дигідроксіізофталонітрил, метил-3-(4-(2,6-диціано-3,4-дигідроксифенілтіо)феніл)пропаноат, 4,5-дигідрокси-2-(п-толілоксі)ізофталонітрил, (Е)-2-(2,4-дифторстирил)-4,5-дигідроксіізофталонітрил, (Е)-4,5-дигідрокси-2-(3-(трифторметил)стирил)ізофталонітрил, (Е)-4,5-дигідрокси-2-(4-метилпент-1-еніл)ізофталонітрил, (Е)-2-(3,5-дифторстирил)-4,5-дигідроксіізофталонітрил, 2-(4-(2,6-диціано-3,4-дигідроксибензил)феніл)оцтову кислоту, 2-(4-хлорбензил)-4,5-дигідроксіізофталонітрил, 3,4-дигідрокси-4'-метилбіфеніл-2,6-дикарбонітрил, 3-(4-(2,6-диціано-3,4-дигідроксибензил)феніл)пропанову кислоту, 4,5-дигідрокси-2-(4-(трифторметил)бензил)ізофталонітрил, (Е)-4,5-дигідрокси-2-(4-(трифторметил)стирил)ізофталонітрил, 4,5-дигідрокси-2-(п-толілсульфініл)ізофталонітрил, 4-(2,6-диціано-3,4-дигідроксифенілтіо)бензойну кислоту, 2-(4-етилфенілтіо)-4,5-дигідроксіізофталонітрил, 2-(4-хлорфенілтіо)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(о-толілтіо)ізофталонітрил, метил 4-(2,6-диціано-3,4-дигідроксифенілтіо)бензоат, 2-(2-хлорфенілтіо)-4,5-дигідроксіізофталонітрил, метил-2-(2,6-диціано-3,4-дигідроксифенілтіо)бензоат, 2-(4-(2,6-диціано-3,4-дигідроксифенілтіо)феніл)оцтову кислоту, 2-(2,6-диціано-3,4-дигідроксифенілтіо)бензойну кислоту, 3-(4-(2,6-диціано-3,4-дигідроксифенілтіо)феніл)пропанову кислоту, 4,5-дигідрокси-2-(4-метоксифенілтіо)ізофталонітрил, метил-2-(4-(2,6-диціано-3,4-дигідроксибензил)феніл)ацетат, 4,5-дигідрокси-2-(3-метоксифенілтіо)ізофталонітрил, метил-4-(2,6-диціано-3,4-дигідроксифенокси)бензоат, 4,5-дигідрокси-2-(піридин-4-ілтіо)ізофталонітрил, 3-(2,6-диціано-3,4-дигідроксифенілтіо)бензойну кислоту, 2-(4-ціанофенілтіо)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(нафталін-2-ілтіо)ізофталонітрил, 2-(4-(2,6-диціано-3,4-дигідроксибензил)феніл)-N,N-діетилацетамід, 2-(4-етилфенокси)-4,5-дигідроксіізофталонітрил, 2-(4-ацетилфенокси)-4,5-дигідроксіізофталонітрил, 4,5-дигідроксі-2-(1-оксо-2,3-дигідро-1Н-інден-5-ілоксі)ізофталонітрил, 2-(2',6'-диціано-3',4'-дигідроксибіфеніл-4-іл)оцтову кислоту, 2-(2,4-диметилфенокси)-4,5-дигідроксіізофталонітрил, 2-(4-хлорфенокси)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4-(трифторметил)феноксі)ізофталонітрил, 4,5-дигідроксі-2-(1Н-інден-3-іл)ізофталонітрил, 4,5-дигідрокси-2-(морфолінометил)ізофталонітрил, 2-((діетиламіно)метил)-4,5-дигідроксіізофталонітрилу гідрохлорид, 4,5-дигідрокси-2-(((2-гідроксіетил)аміно)метил)ізофталонітрилу гідрохлорид (1:1), 4,5-дигідрокси-2-(3-гідроксипропіл)ізофталонітрил, 2-аміно-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(піролідин-1-іл)ізофталонітрил, 2-(2,6-диметилморфоліно)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-морфоліноізофталонітрил, 4,5-дигідроксі-2-(ізопропіламіно)ізофталонітрил, 4,5-дигідрокси-2-(3-метоксипропіламіно)ізофталонітрил, 2,4,5-дигідроксіізофталонітрил, 2-етил-4,5-дигідроксіізофталонітрил, 3,4-дигідрокси-4'-метоксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3'-(морфолін-4-карбоніл)біфеніл-2,6-дикарбонітрил, N-бутил-2',6'-диціано-3',4'-дигідроксибіфеніл-4-карбоксамід, 2-(3,3-диметилбутил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(піперидин-1-іл)ізофталонітрил, 2-(гексиламіно)-4,5-дигідроксіізофталонітрил, 2-(циклогексиламіно)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(2-метоксіетиламіно)ізофталонітрил, 2-(4-бензилпіперидин-1-іл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(пентан-3-іламіно)ізофталонітрил, (Е)-2-(4-етилбензиліденаміно)-4,5-дигідроксіізофталонітрил, (Е)-4,5-дигідрокси-2-(4-метоксибензиліденаміно)ізофталонітрил, (Е)-2-(4-фторбензиліденаміно)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-тозилізофталонітрил, 4-(2,6-диціано-3,4-дигідроксифенокси)бензойну кислоту, 2-(бензо[d]тіазол-2-ілтіо)-4,5-дигідроксіізофталонітрил, 2-(4-фторфенілтіо)-4,5-дигідроксіізофталонітрил, 2-(біфеніл-4-ілметил)-4,5-дигідроксіізофталонітрил, 2-(4-хлор-2-метилбензил)-4,5-дигідроксіізофталонітрил, 2-(2-етилбензил)-4,5-дигідроксіізофталонітрил, 2-(2,3-дигідро-1Н-інден-5-ілокси)-4,5-дигідроксіізофталонітрил, енантіомер А 4,5-дигідрокси-2-(п-толілсульфініл)ізофталонітрилу, енантіомер В 4,5-дигідрокси-2-(п-толілсульфініл)ізофталонітрилу, 2-((циклогексилметил)аміно)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4-феноксифенілтіо)ізофталонітрил, 4,5-дигідрокси-2-(піридин-3-іл)ізофталонітрил, 4,5-дигідрокси-2-(4-(2,2,2-трифторетил)бензил)ізофталонітрил, 4,5-дигідрокси-2-(4-метил-2-(трифторметил)бензил)ізофталонітрил, 4,5-дигідрокси-2-((4-(морфолін-4-карбоніл)феніл)тіо)ізофталонітрил, 4,5-дигідрокси-2-(метил(п-толіл)аміно)ізофталонітрил або 4,5-дигідрокси-2-((6-метоксинафталін-2-іл)метил)ізофталонітрил.
17. Сполука за п. 11, де сполука являє собою (Е)-4,5-дигідрокси-2-(пент-1-еніл)ізофталонітрил, (Е)-2-(3,3-диметилбут-1-еніл)-4,5-дигідроксіізофталонітрил, (Z)-4,5-дигідрокси-2-(проп-1-еніл)ізофталонітрил, (Е)-4,5-дигідрокси-2-(проп-1-еніл)ізофталонітрил, (Z)-2-(бут-2-еніл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(3-метилбут-2-еніл)ізофталонітрил, (Е)-2-(бут-2-еніл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(2-метилпроп-1-еніл)ізофталонітрил, 4,5-дигідрокси-2-вінілізофталонітрил, 4,5-дигідрокси-2-(проп-1-ен-2-іл)ізофталонітрил, 2-аліл-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(3-метилбут-2-ен-2-іл)ізофталонітрил або (Е)-4,5-дигідрокси-2-(4-метилпент-1-еніл)ізофталонітрил.
18. Сполука за п. 12, де сполука являє собою 4,5-дигідрокси-2-(нафталін-1-іл)ізофталонітрил, 4'-трет-бутил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(нафталін-2-іл)ізофталонітрил, 3,4-дигідроксі-4'-ізопропоскибіфеніл-2,6-дікарбонітрил, 4'-бутил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-2',5'-диметилбіфеніл-2,6-дикарбонітрил, 3'-етил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-2'-метилбіфеніл-2,6-дикарбонітрил, 3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3',4'-дихлор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 4'-етил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3',5'-диметилбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3'-метилбіфеніл-2,6-дикарбонітрил, 4'-фтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3',4'-дифтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 4'-фтор-3,4-дигідрокси-3'-метоксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4'-пропоксибіфеніл-2,6-дикарбонітрил, 4'-хлор-3,4-дигідрокси-3'-метилбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4'-ізопропілбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4'-пропілбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3',4'-диметилбіфеніл-2,6-дикарбонітрил, 4'-фтор-3,4-дигідрокси-3'-метилбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3',4'-диметоксибіфеніл-2,6-дикарбонітрил, 3,4-дигідроксі-3'-ізопропілбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(6-метоксинафталін-2-іл)ізофталонітрил, 3,4-дигідрокси-4'-метилбіфеніл-2,6-дикарбонітрил або 3,4-дигідрокси-4'-метоксибіфеніл-2,6-дикарбонітрил.
19. Сполука за п. 13, де сполука являє собою 4,5-дигідрокси-2-(фенілтіо)ізофталонітрил, 4,5-дигідрокси-2-(п-толілтіо)ізофталонітрил, 2-(2,4-диметилфенілтіо)-4,5-дигідроксіізофталонітрил, 2-(4-етилфенілтіо)-4,5-дигідроксіізофталонітрил, 2-(4-хлорфенілтіо)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(о-толілтіо)ізофталонітрил, 2-(2-хлорфенілтіо)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4-метоксифенілтіо)ізофталонітрил, 4,5-дигідрокси-2-(3-метоксифенілтіо)ізофталонітрил або 2-(4-фторфенілтіо)-4,5-дигідроксіізофталонітрил.
20. Сполука за п. 14, де сполука являє собою 4,5-дигідрокси-2-(1-метил-1Н-пірол-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(тіофен-2-іл)ізофталонітрил, 2-(фуран-2-іл)-4,5-дигідроксіізофталонітрил, 2-(фуран-3-іл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(тіофен-3-іл)ізофталонітрил, 4,5-дигідрокси-2-(5-метилфуран-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(5-метилтіофен-2-іл)ізофталонітрил, 2-(бензофуран-2-іл)-4,5-дигідроксіізофталонітрил, 2-(5-хлортіофен-2-іл)-4,5-дигідроксіізофталонітрил, 2-(бензо[b]тіофен-2-іл)-4,5-дигідроксіізофталонітрил, 2-(5-гексилтіофен-2-іл)-4,5-дигідроксіізофталонітрил, 2-(2-етокситіазол-5-іл)-4,5-дигідроксіізофталонітрил, 2-(2,5-диметилтіофен-3-іл)-4,5-дигідроксіізофталонітрил, 4,5-дигідроксі-2-(1-ізобутил-1Н-піразол-4-іл)ізофталонітрил, 4,5-дигідрокси-2-(1-метил-1Н-піразол-4-іл)ізофталонітрил або 4,5-дигідрокси-2-(піридин-3-іл)ізофталонітрил.
21. Сполука за п. 15, де сполука являє собою 4,5-дигідрокси-2-(4-метилбензил)ізофталонітрил, 4,5-дигідрокси-2-(2-метоксибензил)ізофталонітрил, 4,5-дигідрокси-2-(2-метилбензил)ізофталонітрил, 2-(2,5-диметилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(3-метилбензил)ізофталонітрил, 2-(3,5-диметилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідроксі-2-(4-ізопропілбензил)ізофталонітрил, 2-(4-етилбензил)-4,5-дигідроксіізофталонітрил, 2-(2,4-диметилбензил)-4,5-дигідроксіізофталонітрил, 2-(2-етилбензил)-4,5-дигідроксіізофталонітрил або 4,5-дигідрокси-2-((6-метоксинафталін-2-іл)метил)ізофталонітрил.
22. Сполука за будь-яким із пп. 1-21 для застосування як лікарського засобу.
23. Сполука за 6удь-яким із пп. 1-21 для лікування захворювання або стану, при якому запропоноване застосування інгібітора катехол-О-метилтрансферази.
24. Сполука за п. 23, де захворювання являє собою хворобу Паркінсона.
25. Застосування сполуки за будь-яким із пп. 1-21 для одержання лікарського препарату для лікування захворювання або стану, при якому запропоноване застосування інгібітора катехол-О-метилтрансферази.
26. Застосування за п. 25, де захворювання являє собою хворобу Паркінсона.
27. Спосіб лікування захворювання або стану, при якому запропоноване застосування інгібітора катехол-О-метилтрансферази, що включає введення ссавцю, якщо таке лікування йому необхідне, ефективної кількості щонайменше однієї сполуки за будь-яким із пп. 1-21.
28. Спосіб за п. 27, де захворювання являє собою хворобу Паркінсона.
29. Спосіб за п. 28, де потенціюється терапія на основі леводопи.
30. Фармацевтична композиція, яка містить як активний інгредієнт щонайменше одну сполуку за будь-яким із пп. 1-21 і фармацевтично прийнятний носій, розріджувач, допоміжну речовину або їхню суміш.
31. Фармацевтична композиція за п. 30, де композиція додатково містить щонайменше один інший активний інгредієнт.
32. Фармацевтична композиція за п. 30, де композиція містить леводопу і карбідопу.
Текст
Реферат: Сполуки формули І UA 112697 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 112697 C2 OH HO N R1 N ,I де R1 визначений у пунктах формули винаходу, виявляють інгібуючу активність відносно ферменту катехол-О-метилтрансферази і завдяки цьому застосовуються як інгібітори катехолО-метилтрансферази. UA 112697 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід стосується фармакологічно активних 2-заміщених 4,5дигідроксіізофталонітрилів або їх фармацевтично прийнятних солей і ефірів, а також фармацевтичних композицій, які їх містять, і їх застосування як інгібіторів ферменту катехол-Oметилтрансферази (COMT). РІВЕНЬ ТЕХНІКИ У мозку пацієнтів, що страждають на хворобу Паркінсона, спостерігається дефіцит допаміну. При лікуванні хвороби Паркінсона застосовують перорально леводопу. Леводопа являє собою попередник допаміну, що перетворюється в допамін у мозку. Однак тільки невелика частина перорально введеної леводопи досягає мозку, тому що леводопа піддається метаболізму в периферичній системі під впливом катехол-O-метилтрансферази (COMT), а також допадекарбоксилази (DDC). Катехол-О-метилтрансфераза метаболізує леводопу шляхом її перетворення в 3-O-метилдопу, що є терапевтично неефективною й здійснює шкідливий вплив у результаті конкуренції з леводопою. Було показано, що інгібітори катехол-Oметилтрансферази є ефективними при клінічному використанні для лікування хвороби Паркінсона як допоміжний засіб при терапії леводопою. Звичайно вважають, що концентрація леводопи в плазмі відображає рівні леводопи в мозку. Тому бажано досягнення високої концентрації леводопи в плазмі. Однак оптимальна концентрація леводопи в плазмі не досягається, наприклад, при використанні в даний час інгібітора катехол-О-метилтрансферази ентакапону. Було також зазначено, що інгібітори катехол-О-метилтрансферази можуть застосовуватися при лікуванні, наприклад, гіпертензії, серцевої недостатності і депресивного стану (патентний документ US 5446194), а також як інгібітори для запобігання діабетичним судинним порушенням (патентний документ WO 98/27973). Була також описана можливість застосування інгібіторів катехол-О-метилтрансферази для лікування або зняття болю (патентний документ WO 01/68083), а також для лікування синдрому втомлених ніг (RLS), що також відомий як синдром Екбома (патентний документ WO 2006/051154). Синдром втомлених ніг характеризується нездоланним прагненням рухати ногами, супроводжуваним іншими неприємними відчуттями глибоко усередині ніг. У техніці відомий ряд сполук з інгібуючою активністю відносно катехол-Ометилтрансферази. Похідні ізофлавону як інгібітори катехол-О-метилтрансферази розкриті в патентних документах US 3974184 і CN 101643465 A. Похідні катехолу як інгібітори катехол-Oметилтрансферази розкриті в патентних документах US 5236952, US 5446194, WO 96/37456, WO 00/37423, WO 01/98250, WO 01/98251, WO 02/02548, WO 02/22551, WO 2004/112729, WO 2005/058228, WO 2007/010085, WO 2007/013830, WO 2007/063789, WO 2007/117165, JP 2008308493, JP 2008308494, JP 2008308495, EP 2246338 A1, WO 2009/081892, EP 2305633 A1, JP 2011021010, JP 2012051884, і JP 2012051885. Похідні 3-гідроксипіридин-4(1H)-ону, похідні 3гідроксипіридин-2(1H)-ону і похідні 5-гідроксипіримідин-4(3H)-ону як інгібітори катехол-Oметилтрансферази розкриті в патентних документах WO 2011/109254, WO 2011/109261 і WO 2011/109267, відповідно. Похідні флавону як інгібітори катехол-O-метилтрансферази розкриті в патентному документі CN 102755312 A. СУТЬ ВИНАХОДУ Метою даного винаходу є створення додаткових інгібіторів ферменту катехол-Ометилтрансферази, які можуть бути використані для лікування захворювань або станів, при яких застосовують інгібування катехол-О-метилтрансферази. Відповідно, задачею даного винаходу є розробка додаткових сполук, які можуть бути використані як засоби, що інгібують катехол-Ометилтрансферазу, при лікуванні ссавців, у тому числі людей і тварин. Крім того, винахід пропонує фармацевтичні композиції, які містять дані сполуки. Інгібітори катехол-O-метилтрансферази винаходу при терапії леводопою забезпечують підвищену концентрацію леводопи в плазмі. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід стосується сполук, які мають загальну формулу I, 1 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 , де R1 являє собою (C1-C6)алкіл, (C2-C6)алкеніл, (C2-C6)алкініл, (C3-C7)циклоалкіл, (C4C10)циклоалкеніл, арил, (R2)2C=C-, галоген, гідрокси, (C1-C6)алкокси, (C1-C6)алкіл-S-, (C4C10)циклоалкенілокси, (C4-C10)циклоалкеніл-S-, арилокси, арил-S-, гетероарилокси, гетероарилS-, (R3)2N-, (R4)2C=N-, гетероцикліл, гетероарил, арил(C1-C6)алкіл, (1-аміно-1-карбоксиметил)(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-S(C1-C6)алкіл, (R3)2N-(C1-C6)алкіл, гетероцикліл(C1-C6)алкіл, карбоксі(C2-C6)алкеніл, (C3C7)циклоалкіл(C2-C6)алкеніл, арил(C2-C6)алкеніл, (C1-C6)алкоксі(C2-C6)алкеніл, гетероцикліл(C2C6)алкеніл, гетероарил(C2-C6)алкеніл, карбоксі(C2-C6)алкініл, (C3-C7)циклоалкіл(C2-C6)алкініл, арил(C2-C6)алкініл, (C1-C6)алкоксі(C2-C6)алкініл, гетероцикліл(C2-C6)алкініл, гетероарил(C2C6)алкініл, галоген(C1-C6)алкокси, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкокси, (C1C6)алкіл-(C=O)-O-, R5-(S=O)-, R5-(O=S=O)-, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C=O)-(C2-C6)алкеніл або (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, де зазначений (C4-C10)циклоалкеніл, арил, гетероцикліл, гетероарил або (C3-C7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6; R2 у кожному випадку присутності незалежно являє собою карбокси або арил, де зазначений арил у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6; R3 у кожному випадку присутності незалежно являє собою H, (C1-C6)алкіл, (C3-C7)циклоалкіл, арил, (C3-C7)циклоалкіл(C1-C6)алкіл, гідроксі(C1-C6)алкіл або (C1-C6)алкоксі(C1-C6)алкіл, де зазначений (C3-C7)циклоалкіл або арил сам по собі або як частина іншої групи у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (C1-C6)алкіл, галоген, гідрокси, (C1-C6)алкокси або гідроксі(C1-C6)алкіл; R4 у кожному випадку присутності незалежно являє собою H або арил, де зазначений арил у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (C1-C6)алкіл, галоген або (C1-C6)алкокси; R5 являє собою (C1-C6)алкіл, арил, гідрокси або (C1-C6)алкокси, де зазначений арил є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, (C2-C6)алкеніл, карбокси, ціано, арил, галоген, гідрокси, (C1-C6)алкокси, (C1-C6)алкіл-S-, (C4C10)циклоалкенілокси, (C4-C10)циклоалкеніл-S-, арилокси, арил-S-, гетероарилокси, гетероарилS-, (R7)2N-, гетероарил, карбоксі(C1-C6)алкіл, арил(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, гетероцикліл(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1C6)алкокси-(C=O)-, гетероцикліл-(C=O)-, (R7)2N-(C=O)-, галоген(C1-C6)алкокси, R8-(S=O)-, R8(O=S=O)-, (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл, (R7)2N-(C=O)-(C1-C6)алкіл або (C1-C6)алкоксі(C1C6)алкокси-(C=O)-, де зазначений арил, гетероарил або гетероцикліл сам по собі або як частина іншої групи в кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (C1-C6)алкіл; або R6 і R6, обоє приєднані до того самого кільцевого вуглецевого атома, утворюють разом з кільцевим вуглецевим атомом, до якого вони приєднані, -(C=O)- групу; R7 у кожному випадку присутності незалежно являє собою H, (C 1-C6)алкіл, (C3-C7)циклоалкіл або карбоксі(C1-C6)алкіл, де зазначений (C3-C7)циклоалкіл у кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (C 1-C6)алкіл; R8 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, гідрокси, (C1C6)алкокси або (R9)2N-; R9 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл; або їх фармацевтично прийнятних солей або ефірів. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C1-C6)алкіл, (C2-C6)алкеніл, (C2-C6)алкініл, (C4-C10)циклоалкеніл, арил, галоген, гідрокси, (C4-C10)циклоалкенілокси, арилокси, арил-S-, гетероарил-S-, (R3)2N-, 2 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 (R4)2C=N-, гетероцикліл, гетероарил, арил(C1-C6)алкіл, гідроксі(C1-C6)алкіл, (R3)2N-(C1-C6)алкіл, гетероцикліл(C1-C6)алкіл, карбоксі(C2-C6)алкеніл, (C3-C7)циклоалкіл(C2-C6)алкеніл, арил(C2C6)алкеніл, (C1-C6)алкоксі(C2-C6)алкеніл, гетероарил(C2-C6)алкеніл, арил(C2-C6)алкініл, (C1C6)алкоксі(C2-C6)алкініл, R5-(S=O)-, R5-(O=S=O)- або (C1-C6)алкоксі-(C=O)-(C2-C6)алкеніл, де зазначений (C4-C10)циклоалкеніл, арил, гетероцикліл, гетероарил або (C3-C7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6; R3 у кожному випадку присутності незалежно являє собою H, (C1-C6)алкіл, (C3-C7)циклоалкіл, арил, (C3-C7)циклоалкіл(C1-C6)алкіл, гідроксі(C1-C6)алкіл або (C1-C6)алкоксі(C1-C6)алкіл, де зазначений (C3-C7)циклоалкіл або арил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1 замісника, яким є (C 1-C6)алкіл; R4 у кожному випадку присутності незалежно являє собою H або арил, де зазначений арил у кожному випадку присутності незалежно заміщений за допомогою 1 замісника, яким є (C 1C6)алкіл, галоген або (C1-C6)алкокси; R5 являє собою арил, де зазначений арил заміщений за допомогою 1 замісника R 6; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, (C2-C6)алкеніл, карбокси, ціано, арил, галоген, гідрокси, (C1-C6)алкокси, (C1-C6)алкіл-S-, арилокси, гетероарил, карбоксі(C1-C6)алкіл, арил(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкіл, (C1C6)алкоксі(C1-C6)алкіл, гетероцикліл(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси-(C=O)-, гетероцикліл-(C=O)-, (R7)2N-(C=O)-, галоген(C1-C6)алкокси, R8-(O=S=O)-, (C1-C6)алкоксі-(C=O)(C1-C6)алкіл, (R7)2N-(C=O)-(C1-C6)алкіл або (C1-C6)алкоксі(C1-C6)алкокси-(C=O)-, де зазначений арил, гетероарил або гетероцикліл сам по собі або як частина іншої групи в кожному випадку присутності незалежно є незаміщеним або заміщений за допомогою 1 замісника, яким є (C 1C6)алкіл; або R6 і R6, обоє приєднані до того самого кільцевого вуглецевого атома, утворюють разом з кільцевим вуглецевим атомом, до якого вони приєднані, -(C=O)- групу; R7 у кожному випадку присутності незалежно являє собою H, (C 1-C6)алкіл, (C3-C7)циклоалкіл або карбоксі(C1-C6)алкіл, де зазначений (C3-C7)циклоалкіл є незаміщеним; R8 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл або (R9)2N-; R9 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C1-C6)алкіл, (C2-C6)алкеніл, (C2-C6)алкініл, (C4-C10)циклоалкеніл, арил, галоген, (C4-C10)циклоалкенілокси, арилокси, арил-S-, гетероарил-S-, (R3)2N-, (R4)2C=N-, гетероцикліл, гетероарил, арил(C1-C6)алкіл, (R3)2N-(C1-C6)алкіл, карбоксі(C2-C6)алкеніл, (C3C7)циклоалкіл(C2-C6)алкеніл або арил(C2-C6)алкеніл, де зазначений (C4-C10)циклоалкеніл, арил, гетероцикліл, гетероарил або (C3-C7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6; R3 у кожному випадку присутності незалежно являє собою H, (C1-C6)алкіл або (C1C6)алкоксі(C1-C6)алкіл; R4 у кожному випадку присутності незалежно являє собою H або арил, де зазначений арил у кожному випадку присутності незалежно заміщений за допомогою 1 замісника, яким є (C 1C6)алкіл, галоген або (C1-C6)алкокси; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, ціано, арил, галоген, гідрокси, (C1-C6)алкокси, (C1-C6)алкіл-S-, карбоксі(C1-C6)алкіл, арил(C1-C6)алкіл, галоген(C1C6)алкіл, гідроксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, гетероцикліл-(C=O)-, (R7)2N-(C=O)-, R8(O=S=O)- або (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл, де зазначений арил або гетероцикліл сам по собі або як частина іншої групи є незаміщеним; R7 у кожному випадку присутності незалежно являє собою H, (C1-C6)алкіл або (C3C7)циклоалкіл, де зазначений (C3-C7)циклоалкіл є незаміщеним; R8 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл або (R9)2N-; R9 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C1-C6)алкіл, (C2-C6)алкеніл, арил, галоген, арилокси, арил-S-, (R3)2N-, (R4)2C=N-, гетероцикліл, гетероарил, арил(C1-C6)алкіл, (C3-C7)циклоалкіл(C2-C6)алкеніл або арил(C2-C6)алкеніл, де зазначений арил, гетероцикліл, гетероарил або (C 3-C7)циклоалкіл сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R6; R3 у кожному випадку присутності незалежно являє собою H або (C 1-C6)алкіл; 3 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 R4 у кожному випадку присутності незалежно являє собою H або арил, де зазначений арил у кожному випадку присутності незалежно заміщений за допомогою 1 замісника, яким є (C 1C6)алкіл, галоген або (C1-C6)алкокси; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, ціано, арил, галоген, гідрокси, (C1-C6)алкокси, (C1-C6)алкіл-S-, карбоксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, гетероцикліл-(C=O)-, (R7)2N-(C=O)- або R8-(O=S=O)-, гетероцикліл-(C=O)-, (R7)2N-(C=O)- або R8-(O=S=O)-, де зазначений арил або гетероцикліл сам по собі або як частина іншої групи є незаміщеним; R7 у кожному випадку присутності незалежно являє собою H або (C 1-C6)алкіл; R8 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C1-C6)алкіл, (C2-C6)алкеніл, арил, галоген, арилокси, арил-S-, (R3)2N-, гетероцикліл, гетероарил, арил(C1-C6)алкіл або арил(C2-C6)алкеніл, де зазначений арил, гетероцикліл або гетероарил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1, 2 або 3 замісників R 6; R3 у кожному випадку присутності незалежно являє собою H або (C 1-C6)алкіл; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, галоген, гідрокси, (C1-C6)алкокси, карбоксі(C1-C6)алкіл, галоген(C1-C6)алкіл або (R7)2N-(C=O)-; R7 у кожному випадку присутності незалежно являє собою H або (C 1-C6)алкіл. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C2-C6)алкеніл, арил, галоген, арилокси, арил-S-, (R3)2N-, гетероарил, арил(C1-C6)алкіл або арил(C2-C6)алкеніл, де зазначений арил або гетероарил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1 або 2 замісників R6; R3 у кожному випадку присутності незалежно являє собою H або (C 1-C6)алкіл; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, галоген, (C1C6)алкокси, карбоксі(C1-C6)алкіл або галоген(C1-C6)алкіл. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C2-C6)алкеніл, арил, галоген, арил-S-, гетероарил або арил(C1-C6)алкіл, де зазначений арил або гетероарил сам по собі або як частина іншої групи є незаміщеним або заміщений за допомогою 1 або 2 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл, галоген або (C1C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C2-C6)алкеніл, галоген, арил-S- або арил(C1-C6)алкіл, де зазначений арил як частина іншої групи є незаміщеним або заміщений за допомогою 1 або 2 замісників R 6; R6 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл, галоген або (C1C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C2-C6)алкеніл, арил, арил-S-, гетероарил або арил(C1-C6)алкіл, де зазначений арил або гетероарил сам по собі або як частина іншої групи заміщений за допомогою 1 або 2 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл або (C1-C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою (C2-C6)алкеніл, арил-S- або арил(C1-C6)алкіл, де зазначений арил як частина іншої групи заміщений за допомогою 1 або 2 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл або (C1-C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R 1 являє собою (C2-C6)алкеніл. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою арил, де зазначений арил є незаміщеним або заміщений за допомогою 1 або 2 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл, галоген або (C1C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою арил-S-, де зазначений арил є незаміщеним або заміщений за допомогою 1 або 2 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C 1-C6)алкіл, галоген або (C1C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де 4 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 R1 являє собою гетероарил, де зазначений гетероарил є незаміщеним або заміщений за допомогою 1 або 2 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл, галоген або (C1C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де R1 являє собою арил(C1-C6)алкіл, де зазначений арил заміщений за допомогою 1 або 2 замісників R6; R6 у кожному випадку присутності незалежно являє собою (C1-C6)алкіл або (C1-C6)алкокси. В одному варіанті здійснення винаходу винахід стосується сполук формули I, де сполука являє собою 2-бром-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2(фенілетиніл)ізофталонітрил, 4,5-дигідрокси-2-(проп-1-ніл)ізофталонітрил, 4,5-дигідрокси-2-(1метил-1H-пірол-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(тіофен-2-іл)ізофталонітрил, 2-(фуран-2іл)-4,5-дигідроксіізофталонітрил, 3",4",5’-трифтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 4,5дигідрокси-2-(нафталін-1-іл)ізофталонітрил, 4’-трет-бутил-3,4-дигідроксибіфеніл-2,6дикарбонітрил, 3,4-дигідрокси-4’-(гідроксиметил)біфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2(нафталін-2-іл)ізофталонітрил, 3,4-дигідроксі-4’-(ізопропілтіо)біфеніл-2,6-дикарбонітрил, 3,4дигідрокси-4’-(метилтіо)біфеніл-2,6-дикарбонітрил, 3,4-дигідроксі-4’-ізопропоксибіфеніл-2,6дикарбонітрил, 4’-(етилтіо)-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідроксі-4’ізопропокси-3",5’-диметилбіфеніл-2,6-дикарбонітрил, 4’-бутил-3,4-дигідроксибіфеніл-2,6дикарбонітрил, 3,4-дигідрокси-2",4",5’-триметилбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-2",5’диметилбіфеніл-2,6-дикарбонітрил, 2-циклогексеніл-4,5-дигідроксіізофталонітрил, 3’-етил-3,4дигідроксибіфеніл-2,6-дикарбонітрил, 3,4-дигідроксибіфеніл-2,4",6-трикарбонітрил, 3,4дигідроксі-4’-(ізопропілсульфоніл)біфеніл-2,6-дикарбонітрил, 2",6’-диціано-3",4’-дигідрокси-N,Nдиметилбіфеніл-4-сульфонамід, (E)-4,5-дигідрокси-2-(пент-1-ніл)ізофталонітрил, 2",6’-диціано3",4’-дигідроксибіфеніл-3-карбонову кислоту, 3,4-дигідрокси-4’-(1-метоксіетил)біфеніл-2,6дикарбонітрил, (E)-2-(3,3-диметилбут-1-еніл)-4,5-дигідроксіізофталонітрил, 3,4-дигідрокси-2’метилбіфеніл-2,6-дикарбонітрил, (E)-2-(2-циклогексилвініл)-4,5-дигідроксіізофталонітрил, (Z)4,5-дигідрокси-2-(проп-1-еніл)ізофталонітрил, 3-(2",6’-диціано-3",4’-дигідроксибіфеніл-4іл)пропанову кислоту, 3,4-дигідрокси-3’-(гідроксиметил)біфеніл-2,6-дикарбонітрил, 3,4дигідрокси-3’-(метоксиметил)біфеніл-2,6-дикарбонітрил, 2",6’-диціано-3",4’-дигідрокси-N,Nдипропілбіфеніл-4-карбоксамід, (E)-4,5-дигідрокси-2-(проп-1-еніл)ізофталонітрил, 3,4дигідроксибіфеніл-2,6-дикарбонітрил, 3",4’-дихлор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4дигідрокси-3’-(трифторметил)біфеніл-2,6-дикарбонітрил, 2-(фуран-3-іл)-4,5дигідроксіізофталонітрил, 3,4-дигідрокси-4’-(трифторметил)біфеніл-2,6-дикарбонітрил, 4,5дигідрокси-2-(тіофен-3-іл)ізофталонітрил, 4,5-дигідрокси-2-(5-метилфуран-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(5-метилтіофен-2-іл)ізофталонітрил, 2-бензил-4,5-дигідроксіізофталонітрил, 2(бензофуран-2-іл)-4,5-дигідроксіізофталонітрил, 2-(5-хлортіофен-2-іл)-4,5дигідроксіізофталонітрил, 2-(бензо[b]тіофен-2-іл)-4,5-дигідроксіізофталонітрил, (E)-4,5дигідрокси-2-стирилізофталонітрил, 4’-етил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 3,4дигідрокси-3",5’-диметилбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2-(фенілтіо)ізофталонітрил, 4,5-дигідрокси-2-(п-толілтіо)ізофталонітрил, 4,5-дигідрокси-2-(4-метилбензил)ізофталонітрил, 2(4-фторбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4гідроксибензил)ізофталонітрил, 4,5-дигідрокси-2-(2-метоксибензил)ізофталонітрил, 4,5дигідрокси-2-(4-(трифторметокси)бензил)ізофталонітрил, 2-(3-фтор-4-метоксибензил)-4,5дигідроксіізофталонітрил, 2-(2-фторбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(2метилбензил)ізофталонітрил, 2-(2,5-диметилбензил)-4,5-дигідроксіізофталонітрил, 2-(3-фтор-5метилбензил)-4,5-дигідроксіізофталонітрил, 3-(2,6-диціано-3,4-дигідроксибензил)бензойну кислоту, 2-(4-фтор-3-метилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(3метилбензил)ізофталонітрил, 2-(5-фтор-2-метоксибензил)-4,5-дигідроксіізофталонітрил, 2-(3,5диметилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідроксі-2-(4ізопропілбензил)ізофталонітрил, 2-(4-етилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси2-(нафталін-1-ілметил)ізофталонітрил, 5-(2,6-диціано-3,4-дигідроксибензил)-2-гідроксибензойну кислоту, 2-(2,4-диметилбензил)-4,5-дигідроксіізофталонітрил, 2-(3,6-дигідро-2H-піран-4-іл)-4,5дигідроксіізофталонітрил, 2-циклопентеніл-4,5-дигідроксіізофталонітрил, (E)-3-(2,6-диціано-3,4дигідроксифеніл)акрилову кислоту, (E)-4,5-дигідрокси-2-(3-метоксипроп-1-еніл)ізофталонітрил, 4,5-дигідрокси-2-(5-(морфолінометил)тіофен-2-іл)ізофталонітрил, 3,4-дигідрокси-4’-(морфолін-4карбоніл)біфеніл-2,6-дикарбонітрил, 2-(5’-гексил-2,2’-бітіофен-5-іл)-4,5дигідроксіізофталонітрил, 2-(1-бензил-1H-піразол-4-іл)-4,5-дигідроксіізофталонітрил, 2-(5гексилтіофен-2-іл)-4,5-дигідроксіізофталонітрил, (Z)-2-(бут-2-еніл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(3-метилбут-2-еніл)ізофталонітрил, (E)-2-(бут-2-еніл)-4,5-дигідроксіізофтало 5 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 нітрил, 4,5-дигідрокси-2-метилізофталонітрил, 4,5-дигідрокси-2-(2-метилпроп-1еніл)ізофталонітрил, 3,4-дигідрокси-3’-метилбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2вінілізофталонітрил, 4,5-дигідрокси-2-(проп-1-ен-2-іл)ізофталонітрил, 2-(2-етокситіазол-5-іл)-4,5дигідроксіізофталонітрил, 2-аліл-4,5-дигідроксіізофталонітрил, 3’-(трет-бутоксиметил)-3,4дигідроксибіфеніл-2,6-дикарбонітрил, трет-бутил 2",6’-диціано-3",4’-дигідроксибіфеніл-3карбоксилат, 3,4-дигідроксибіфеніл-2,3",6-трикарбонітрил, 2",6’-диціано-3",4’-дигідрокси-N,Nдипропілбіфеніл-3-карбоксамід, 2",6’-диціано-N-циклогексил-3",4’-дигідроксибіфеніл-4карбоксамід, 2",6’-диціано-N-циклогексил-3",4’-дигідроксибіфеніл-3-карбоксамід, 2",6’-диціаноN,N-діетил-3",4’-дигідроксибіфеніл-4-карбоксамід, 2",6’-диціано-N,N-діетил-3",4’дигідроксибіфеніл-3-карбоксамід, 2",6’-диціано-N-етил-3",4’-дигідроксибіфеніл-3-карбоксамід, 2",6’-диціано-3",4’-дигідрокси-N,N-диметилбіфеніл-3-карбоксамід, 4’-фтор-3,4-дигідроксибіфеніл2,6-дикарбонітрил, 3",4’-дифтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил, 4’-фтор-3,3",4тригідроксибіфеніл-2,6-дикарбонітрил, (E)-4,5-дигідрокси-2-(3-фенілпроп-1-еніл)ізофталонітрил, 4’-фтор-3,4-дигідрокси-3’-метоксибіфеніл-2,6-дикарбонітрил, 5-(2,6-диціано-3,4дигідроксифеніл)тіофенe-2-карбонову кислоту, 3,4-дигідрокси-4’-(метилсульфоніл)біфеніл-2,6дикарбонітрил, 3,4-дигідрокси-4’-пропоксибіфеніл-2,6-дикарбонітрил, 2",6’-диціано-3",4’дигідроксибіфеніл-4-карбонову кислоту, 4’-хлор-3,4-дигідрокси-3’-метилбіфеніл-2,6дикарбонітрил, 4,5-дигідрокси-2-(5-фенілтіофен-2-іл)ізофталонітрил, 3,4-дигідроксі-4’ізопропілбіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-4’-пропілбіфеніл-2,6-дикарбонітрил, 4,5дигідрокси-2-(1-фенілвініл)ізофталонітрил, 2",6’-диціано-3",4’-дигідроксибіфеніл-2-карбонову кислоту, 4-(2,6-диціано-3,4-дигідроксибензил)бензойну кислоту, (E)-4,5-дигідрокси-2-(4метоксистирил)ізофталонітрил, 3,4-дигідрокси-3",4’-диметилбіфеніл-2,6-дикарбонітрил, (E)-4,5дигідрокси-2-(4-метилстирил)ізофталонітрил, 4,5-дигідрокси-2-(6-гідроксинафталін-2іл)ізофталонітрил, 4’-фтор-3,4-дигідрокси-3’-метилбіфеніл-2,6-дикарбонітрил, 4,5-дигідрокси-2(3-метилбут-2-ен-2-іл)ізофталонітрил, 2-(2,5-диметилтіофен-3-іл)-4,5-дигідроксіізофталонітрил, 2-(2,3-дифтор-4-метилбензил)-4,5-дигідроксіізофталонітрил, 2-(4-(2,6-диціано-3,4дигідроксибензил)феніл)пропанову кислоту, (E)-2-(3-циклопентилпроп-1-еніл)-4,5дигідроксіізофталонітрил, 4,5-дигідроксі-2-(1-ізобутил-1H-піразол-4-іл)ізофталонітрил, 2-(4-(2,6диціано-3,4-дигідроксифеніл)-1H-піразол-1-іл)оцтову кислоту, 4,5-дигідрокси-2-(1-метил-1Hпіразол-4-іл)ізофталонітрил, 4,5-дигідрокси-2-(3-метоксипроп-1-инил)ізофталонітрил, (E)-4,5дигідрокси-2-(2-(тіофен-3-іл)вініл)ізофталонітрил, (E)-2-(2-циклопропілвініл)-4,5дигідроксіізофталонітрил, 2",6’-диціано-3",4’-дигідроксибіфеніл-4-карбоксамід, 3,4-дигідрокси3",4’-диметоксибіфеніл-2,6-дикарбонітрил, 3,4-дигідроксі-3’-ізопропілбіфеніл-2,6-дикарбонітрил, 2-(2,3-дигідробензофуран-5-іл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(6метоксинафталін-2-іл)ізофталонітрил, 4,5-дигідрокси-2-(4-(гідроксиметил)бензил)ізофталонітрил, 2-(2,6-дифтор-3-метилбензил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4(трифторметил)фенілтіо)ізофталонітрил, 2-(2,4-диметилфенілтіо)-4,5-дигідроксіізофталонітрил, метил 3-(4-(2,6-диціано-3,4-дигідроксифенілтіо)феніл)пропаноат, 4,5-дигідрокси-2-(птолілоксі)ізофталонітрил, (E)-2-(2,4-дифторстирил)-4,5-дигідроксіізофталонітрил, (E)-4,5дигідрокси-2-(3-(трифторметил)стирил)ізофталонітрил, (E)-4,5-дигідрокси-2-(4-метилпент-1ніл)ізофталонітрил, (E)-2-(3,5-дифторстирил)-4,5-дигідроксіізофталонітрил, 2-(4-(2,6-диціано3,4-дигідроксибензил)феніл)оцтову кислоту, 2-(4-хлорбензил)-4,5-дигідроксіізофталонітрил, 3,4дигідрокси-4’-метилбіфеніл-2,6-дикарбонітрил, 3-(4-(2,6-диціано-3,4дигідроксибензил)феніл)пропанову кислоту, 4,5-дигідрокси-2-(4(трифторметил)бензил)ізофталонітрил, (E)-4,5-дигідрокси-2-(4-(трифторметил)стирил)ізофталонітрил, 4,5-дигідрокси-2-(п-толілсульфініл)ізофталонітрил, 4-(2,6-диціано-3,4дигідроксифенілтіо)бензойну кислоту, 2-(4-етилфенілтіо)-4,5-дигідроксіізофталонітрил, 2-(4хлорфенілтіо)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(о-толілтіо)ізофталонітрил, метил 4-(2,6-диціано-3,4-дигідроксифенілтіо)бензоат, 2-(2-хлорфенілтіо)-4,5-дигідроксіізофталонітрил, метил 2-(2,6-диціано-3,4-дигідроксифенілтіо)бензоат, 2-(4-(2,6-диціано-3,4дигідроксифенілтіо)феніл)оцтову кислоту, 2-(2,6-диціано-3,4-дигідроксифенілтіо)бензойну кислоту, 3-(4-(2,6-диціано-3,4-дигідроксифенілтіо)феніл)пропанову кислоту, 4,5-дигідрокси-2-(4метоксифенілтіо)ізофталонітрил, метил 2-(4-(2,6-диціано-3,4-дигідроксибензил)феніл)ацетат, 4,5-дигідрокси-2-(3-метоксифенілтіо)ізофталонітрил, метил 4-(2,6-диціано-3,4дигідроксифенокси)бензоат, 4,5-дигідрокси-2-(піридин-4-ілтіо)ізофталонітрил, 3-(2,6-диціано-3,4дигідроксифенілтіо)бензойну кислоту, 2-(4-ціанофенілтіо)-4,5-дигідроксіізофталонітрил, 4,5дигідрокси-2-(нафталін-2-ілтіо)ізофталонітрил, 2-(4-(2,6-диціано-3,4-дигідроксибензил)феніл)N,N-діетилацетамід, 2-(4-етилфенокси)-4,5-дигідроксіізофталонітрил, 2-(4-ацетилфенокси)-4,5дигідроксіізофталонітрил, 4,5-дигідроксі-2-(1-оксо-2,3-дигідро-1H-інден-5-ілоксі)ізофталонітрил, 2-(2",6’-диціано-3",4’-дигідроксибіфеніл-4-іл)оцтову кислоту, 2-(2,4-диметилфенокси)-4,5 6 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 дигідроксіізофталонітрил, 2-(4-хлорфенокси)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4(трифторметил)феноксі)ізофталонітрил, 4,5-дигідроксі-2-(1H-інден-3-іл)ізофталонітрил, 4,5дигідрокси-2-(морфолінометил)ізофталонітрил, гідрохлорид 2-((діетиламіно)метил)-4,5дигідроксіізофталонітрилу, гідрохлорид 4,5-дигідрокси-2-(((2гідроксіетил)аміно)метил)ізофталонітрилу (1:1), 4,5-дигідрокси-2-(3-гідроксипропіл)ізофталонітрил, 2-аміно-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(піролідин-1іл)ізофталонітрил, 2-(2,6-диметилморфоліно)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2морфоліноізофталонітрил, 4,5-дигідроксі-2-(ізопропіламіно)ізофталонітрил, 4,5-дигідрокси-2-(3метоксипропіламіно)ізофталонітрил, 2,4,5-тригідроксіізофталонітрил, 2-етил-4,5дигідроксіізофталонітрил, 3,4-дигідрокси-4’-метоксибіфеніл-2,6-дикарбонітрил, 3,4-дигідрокси-3’(морфолін-4-карбоніл)біфеніл-2,6-дикарбонітрил, N-бутил-2",6’-диціано-3",4’-дигідроксибіфеніл4-карбоксамід, 2-(3,3-диметилбутил)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(піперидин1-іл)ізофталонітрил, 2-(гексиламіно)-4,5-дигідроксіізофталонітрил, 2-(циклогексиламіно)-4,5дигідроксіізофталонітрил, 4,5-дигідрокси-2-(2-метоксіетиламіно)ізофталонітрил, 2-(4бензилпіперидин-1-іл)-4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(пентан-3іламіно)ізофталонітрил, (E)-2-(4-етилбензиліденаміно)-4,5-дигідроксіізофталонітрил, (E)-4,5дигідрокси-2-(4-метоксибензиліденаміно)ізофталонітрил, (E)-2-(4-фторбензиліденаміно)-4,5дигідроксіізофталонітрил, 4,5-дигідрокси-2-тозилізофталонітрил, 4-(2,6-диціано-3,4дигідроксифенокси)бензойну кислоту, 2-(бензо[d]тіазол-2-ілтіо)-4,5-дигідроксіізофталонітрил, 2(4-фторфенілтіо)-4,5-дигідроксіізофталонітрил, 2-(біфеніл-4-ілметил)-4,5дигідроксіізофталонітрил, 2-(4-хлор-2-метилбензил)-4,5-дигідроксіізофталонітрил, 2-(2етилбензил)-4,5-дигідроксіізофталонітрил, 2-(2,3-дигідро-1H-інден-5-ілокси)-4,5дигідроксіізофталонітрил, енантіомер A 4,5-дигідрокси-2-(п-толілсульфініл)ізофталонітрилу, енантіомер B 4,5-дигідрокси-2-(п-толілсульфініл)ізофталонітрилу, 2-((циклогексилметил)аміно)4,5-дигідроксіізофталонітрил, 4,5-дигідрокси-2-(4-феноксифенілтіо)ізофталонітрил, 4,5дигідрокси-2-(піридин-3-іл)ізофталонітрил, 4,5-дигідрокси-2-(4-(2,2,2-трифторетил)бензил)ізофталонітрил, 4,5-дигідрокси-2-(4-метил-2-(трифторметил)бензил)ізофталонітрил, 4,5дигідрокси-2-((4-(морфолін-4-карбоніл)феніл)тіо)ізофталонітрил, 4,5-дигідрокси-2-(метил(птоліл)аміно)ізофталонітрил або 4,5-дигідрокси-2-((6-метоксинафталін-2-іл)метил)ізофталонітрил. Використовувані у винаході терміни мають зазначені нижче значення. Термін "щонайменше один", використовуваний у значеннях нижче, стосується одного або декількох, таких, як один. Наприклад, термін "щонайменше одна гідроксі(C1-C6)алкоксильна група" стосується однієї або декількох гідроксі(C1-C6)алкоксильних груп, таких, як одна гідроксі(C1-C6)алкоксильна група. Використовуваний у винаході термін "(C1-C6)алкіл" сам по собі або як частина іншої групи стосується лінійної або розгалуженої насиченої вуглеводневої групи, що має 1, 2, 3, 4, 5 або 6 вуглецевих атомів. Типові приклади (C1-C6)алкілу включають, але цим не обмежуючись, метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пент-3-іл, гексил і 3,3-диметилбутил. Використовуваний у винаході термін "(C2-C6)алкеніл" сам по собі або як частина іншої групи стосується лінійної або розгалуженої вуглеводневої групи, що має 2, 3, 4, 5 або 6 вуглецевих атомів і, щонайменше, один подвійний зв'язок вуглець-вуглець. Типові приклади (C2-C6)алкенілу включають, але цим не обмежуючись, вініл, проп-1-ен-1-іл, проп-1-ен-2-іл, аліл, бут-2-ен-1-іл, 2метилпроп-1-ен-1-іл, пент-1-ен-1-іл, 3-метилбут-2-ен-1-іл, 3-метилбут-2-ен-2-іл, 4-метилпент-1ен-1-іл і 3,3-диметилбут-1-ен-1-іл. Використовуваний у винаході термін "(C2-C6)алкініл" сам по собі або як частина іншої групи стосується лінійної або розгалуженої вуглеводневої групи, що має 2, 3, 4, 5 або 6 вуглецевих атомів і, щонайменше, один потрійний зв'язок вуглець-вуглець. Типові приклади (C2-C6)алкінілу включають, але цим не обмежуючись, етиніл, проп-1-ін-1-іл і 3,3-диметилбут-1-ін-1-іл. Використовуваний у винаході термін "(C3-C7)циклоалкіл" сам по собі або як частина іншої групи стосується насиченої циклічної вуглеводневої групи, що має 3, 4, 5, 6 або 7 вуглецевих атомів. Типові приклади (C3-C7)циклоалкілу включають, але цим не обмежуючись, циклопропіл, циклопентил і циклогексил. Використовуваний у винаході термін "(C4-C10)циклоалкеніл" сам по собі або як частина іншої групи стосується моноциклічної вуглеводневої групи, що має 3, 4, 5, 6 або 7 вуглецевих атомів і, щонайменше, один подвійний зв'язок вуглець-вуглець, або 8, 9 або 10 членної частково ненасиченої біциклічної вуглеводневої групи. Коли (C 4-C10)циклоалкенільна група являє собою 8, 9 або 10 членну частково ненасичену біциклічну вуглеводневу групу, одне з кілець є необов'язково ароматичним. Типові приклади (C4-C10)циклоалкенілу включають, але цим не обмежуючись, циклопент-1-ен-1-іл, циклогекс-1-ен-1-іл і 2,3-дигідро-1H-інден-5-іл. 7 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний у винаході термін "арил" сам по собі або як частина іншої групи стосується ароматичної моноциклічної вуглеводневої групи, що має 6 вуглецевих атомів, або ароматичної біциклічної вуглеводневої групи, що має 10 вуглецевих атомів. Типові приклади арилу включають, але цим не обмежуючись, феніл і нафталін-2-іл. Використовуваний у винаході термін "галоген" сам по собі або як частина іншої групи стосується фтору, хлору, брому або йоду. Використовуваний у винаході термін "гідрокси" сам по собі або як частина іншої групи стосується -OH групи. Використовуваний у винаході термін "(C1-C6)алкокси" сам по собі або як частина іншої групи стосується обумовленої у винаході (C 1-C6)алкільної групі, приєднаної до основного молекулярного фрагмента через атом кисню. Типові приклади (C 1-C6)алкокси включають, але цим не обмежуючись, метокси, етокси, пропокси, ізопропокси, трет-бутокси і неопентилокси. Використовуваний у винаході термін "(C4-C10)циклоалкенілокси" стосується обумовленої у винаході (C4-C10)циклоалкенільної групи, приєднаної до основного молекулярного фрагмента через атом кисню. Типові приклади (C4-C10)циклоалкенілокси включають, але цим не обмежуючись, циклопент-1-ен-1-ілокси і 2,3-дигідро-1H-інден-5-ілокси. Використовуваний у винаході термін "арилокси" стосується обумовленої у винаході арильної групи, з'єднаної з основним молекулярним фрагментом через атом кисню. Типові приклади арилокси включають, але цим не обмежуючись, фенокси і нафталін-1-ілокси. Використовуваний у винаході термін "гетероарил" сам по собі або як частина іншої групи стосується 5, 6 або 7 членної ароматичної моноциклічної групи, що містить 1, 2, 3 або 4 кільцеві гетероатоми, кожний з яких незалежно вибраний з N, O і S, або 8, 9 або 10 членної ароматичної біциклічної групи, що містить 1, 2, 3 або 4 кільцеві гетероатоми, кожний з яких незалежно вибраний з N, O і S. Типові приклади гетероарилу включають, але цим не обмежуючись, 1Hпірол-2-іл, фуран-2-іл, тіофен-2-іл, тіофен-3-іл, 1H-піразол-4-іл, тіазол-5-іл, бензофуран-2-іл, бензо[b]тіофен-2-іл і бензо[d][1,3]діоксол-5-іл. Використовуваний у винаході термін "гетероарилокси" стосується обумовленої у винаході гетероарильної групи, приєднаної до основного молекулярного фрагмента через атом кисню. Типові приклади гетероарилокси включають, але цим не обмежуючись, піридин-4-ілокси і бензо[d][1,3]діоксол-5-ілокси. Використовуваний у винаході термін "гетероцикліл" сам по собі або як частина іншої групи, стосується 5, 6 або 7 членної насиченої або частково ненасиченої моноциклічної групи, що містить 1 або 2 кільцеві гетероатоми, кожний з яких незалежно вибирають з N, O і S, або 8, 9 або 10 членної насиченої або частково ненасиченої біциклічної групи, що містить 1 або 2 кільцеві гетероатоми, кожний з яких незалежно вибирають з N, O і S. Коли гетероциклільна група являє собою 8, 9 або 10 членну частково ненасичену біциклічну групу, одне з кілець є необов'язково ароматичним. Типові приклади гетероциклілу включають, але цим не обмежуючись, піролідин-1-іл, піперидин-1-іл, 3,6-дигідро-2H-піран-4-іл, морфоліно і 2,3дигідробензофуран-5-іл. Використовуваний у винаході термін "арил(C1-C6)алкіл" стосується обумовленої у винаході арильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкільну групу. Типові приклади арил(C1-C6)алкілу включають, але цим не обмежуючись, бензил, 2-фенетил і 3-фенілпропіл. Використовуваний у винаході термін "галоген(C1-C6)алкіл" стосується, щонайменше, одного обумовленого у винаході галогену, приєднаного до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкільну групу. Коли є кілька галогенів, галогени можуть бути приєднані до того самого або до іншого вуглецевого атома, і галогени можуть бути однаковими або такими, які відрізняються один від одного. Типові приклади галоген(C 1-C6)алкілу включають, але цим не обмежуючись, трифторметил і 3-бромпропіл. Використовуваний у винаході термін "гідроксі(C1-C6)алкіл" стосується, щонайменше, однієї обумовленої у винаході гідроксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкільну групу. Коли є кілька гідроксильних груп, гідроксильні групи можуть бути приєднані до того самого або до іншого вуглецевого атома. Типові приклади гідроксі(C1-C6)алкілу включають, але цим не обмежуючись, гідроксиметил, 2гідроксіетил, і 3-гідроксипропіл. Використовуваний у винаході термін "(C1-C6)алкоксі(C1-C6)алкіл" сам по собі або як частина іншої групи стосується, щонайменше, однієї обумовленої у винаході (C 1-C6)алкоксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C 1C6)алкільну групу. Коли є декілька (C1-C6)алкоксильних груп, (C1-C6)алкоксильні групи можуть бути приєднані до того самого або іншого вуглецевого атома, і (C 1-C6)алкоксильні групи можуть 8 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути однаковими або такими, які відрізняються один від одного. Типові приклади (C1C6)алкоксі(C1-C6)алкілу включають, але цим не обмежуючись, метоксиметил, 1-метоксіетил, 2метоксіетил, 3-метоксипропіл і трет-бутоксиметил. Використовуваний у винаході термін "гетероцикліл(C 1-C6)алкіл" стосується обумовленої у винаході гетероциклільної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкільну групу. Типові приклади гетероцикліл(C 1-C6)алкілу включають, але цим не обмежуючись, морфолінометил і 3-(піролідин-1-іл)пропіл. Використовуваний у винаході термін "карбокси" сам по собі або як частина іншої групи стосується -COOH групи. Використовуваний у винаході термін "карбоксі(C2-C6)алкеніл" стосується обумовленої у винаході карбоксильної групи,приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкенільну групу. Типові приклади карбоксі(C2-C6)алкенілу включають, але цим не обмежуючись, 2-карбоксивініл і 2-карбоксіаліл. Використовуваний у винаході термін "(C3-C7)циклоалкіл(C2-C6)алкеніл" стосується обумовленої у винаході (C3-C7)циклоалкільної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкенільну групу. Типові приклади (C3C7)циклоалкіл(C2-C6)алкенілу включають, але цим не обмежуючись, 2-циклопропілвініл, 2циклогексилвініл і 3-циклопентилпроп-1-ен-1-іл. Використовуваний у винаході термін "арил(C2-C6)алкеніл" стосується обумовленої у винаході арильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкенільну групу. Типові приклади арил(C 2-C6)алкенілу включають, але цим не обмежуючись, стирил, 1-фенілвініл і 3-фенілпроп-1-ен-1-іл. Використовуваний у винаході термін "(C1-C6)алкоксі(C2-C6)алкеніл" стосується, щонайменше, однієї обумовленої у винаході (C1-C6)алкоксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C 2-C6)алкенільну групу. Коли є декілька (C1-C6)алкоксильних груп, (C1-C6)алкоксильні групи можуть бути приєднані до того самого або до іншого вуглецевого атома, і (C 1-C6)алкоксильні групи можуть бути однаковими або такими, які відрізняються одна від одної. Типові приклади (C 1-C6)алкоксі(C2C6)алкенілу включають, але цим не обмежуючись, 3-метоксипроп-1-ен-1-іл і 3-етоксипроп-1-ен2-іл. Використовуваний у винаході термін "гетероцикліл(C 2-C6)алкеніл" стосується обумовленої у винаході гетероциклільної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкенільну групу. Типові приклади гетероцикліл(C 2-C6)алкенілу включають, але цим не обмежуючись, 4-(піролідин-1-іл)бут-2-ен-1-іл і 3-метил-4-морфолінобут2-ен-2-іл. Використовуваний у винаході термін "гетероарил(C2-C6)алкеніл" стосується обумовленої у винаході гетероарильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкенільну групу. Типові приклади гетероарил(C2-C6)алкенілу включають, але цим не обмежуючись, 2-(тіофен-3-іл)вініл і 3-метил-4-(1H-піразол-4-іл)бут-2-ен2-іл. Використовуваний у винаході термін "карбоксі(C2-C6)алкініл" стосується обумовленої у винаході карбоксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкінільну групу. Типові приклади карбоксі(C2-C6)алкінілу включають, але цим не обмежуючись, карбоксіетиніл і 3-карбоксипроп-1-ін-1-іл. Використовуваний у винаході термін "(C3-C7)циклоалкіл(C2-C6)алкініл" стосується обумовленої у винаході (C3-C7)циклоалкільної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкінільну групу. Типові приклади (C3C7)циклоалкіл(C2-C6)алкінілу включають, але цим не обмежуючись, циклопропілетиніл і 3циклопентилпроп-1-ін-1-іл. Використовуваний у винаході термін "арил(C2-C6)алкініл" стосується обумовленої у винаході арильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкінільну групу. Типові приклади арил(C 2-C6)алкінілу включають, але цим не обмежуючись, фенілетиніл і 3-(нафталін-1-іл)проп-1-ін-1-іл. Використовуваний у винаході термін "(C1-C6)алкоксі(C2-C6)алкініл" стосується, щонайменше, однієї обумовленої у винаході (C1-C6)алкоксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C 2-C6)алкінільну групу. Коли є декілька (C1-C6)алкоксильних груп, (C1-C6)алкоксильні групи можуть бути приєднані до того самого або до іншого вуглецевому атома, і (C1-C6)алкоксильні групи можуть бути однаковими або такими, які відрізняються одна від одної. Типові приклади (C1-C6)алкоксі(C2-C6)алкінілу включають, але цим не обмежуючись, трет-бутоксіетиніл і 3-метоксипроп-1-ін-1-іл. 9 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний у винаході термін "гетероцикліл(C2-C6)алкініл" стосується обумовленої у винаході гетероциклільної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкінільну групу. Типові приклади гетероцикліл(C 2-C6)алкінілу включають, але цим не обмежуючись, морфоліноетиніл і 3-(піперидин-1-іл)проп-1-ін-1-іл. Використовуваний у винаході термін "гетероарил(C 2-C6)алкініл" стосується обумовленої у винаході гетероарильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C2-C6)алкінільну групу. Типові приклади гетероарил(C2-C6)алкінілу включають, але цим не обмежуючись, тіофен-3-ілетиніл і 3-(1H-піразол-4-іл)проп-1-ін-1-іл.Використовуваний у винаході термін "галоген(C1-C6)алкокси" стосується, щонайменше, одного обумовленого у винаході галогену, приєднаного до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкоксильну групу. Коли є кілька галогенів, галогени можуть бути приєднані до того самого або до іншого вуглецевого атома, і галогени можуть бути однаковими або такими, які відрізняються один від одного. Типові приклади галоген(C 1C6)алкокси включають, але цим не обмежуючись, трифторметокси і 1,1,2,2-тетрафторетокси. Використовуваний у винаході термін "гідроксі(C1-C6)алкокси" сам по собі або як частина іншої групи, стосується, щонайменше, однієї обумовленої у винаході гідроксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C 1C6)алкоксильну групу. Коли є кілька гідроксильних груп, гідроксильні групи можуть бути приєднані до того самого або до іншого вуглецевого атома. Типові приклади гідроксі(C1C6)алкокси включають, але цим не обмежуючись, гідроксиметокси і 3-гідрокси-2,2диметилпропокси. Використовуваний у винаході термін "(C1-C6)алкоксі(C1-C6)алкокси" сам по собі або як частина іншої групи, стосується, щонайменше, однієї обумовленої у винаході (C 1C6)алкоксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкоксильну групу. (C1-C6)алкоксильні групи можуть бути однаковими або такими, які відрізняються одна від одної. Коли є декілька (C 1-C6)алкоксильних груп, приєднаних до основного молекулярного фрагмента через (C1-C6)алкоксильну групу, (C1-C6)алкоксильні групи можуть бути приєднані до того самого або до іншого вуглецевого атома. Типові приклади (C1-C6)алкоксі(C1-C6)алкокси включають, але цим не обмежуючись, 2-метоксіетокси і 3-метокси2,2-диметилпропокси. Використовуваний у винаході термін "гідроксі(C1-C6)алкоксі(C1-C6)алкіл" стосується, щонайменше, однієї обумовленої у винаході гідроксі(C1-C6)алкоксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C 1-C6)алкільну групу. Коли є декілька гідроксі(C1-C6)алкоксильних груп, гідроксі(C1-C6)алкоксильні групи можуть бути приєднані до того самого або до іншого вуглецевого атома, і гідроксі(C1-C6)алкоксильні групи можуть бути однаковими або такими, які відрізняються одна від одної. Типові приклади гідроксі(C1-C6)алкоксі(C1-C6)алкілу включають, але цим не обмежуючись, (3-гідрокси-2,2диметилпропокси)метил і 2-(гідроксиметокси)проп-2-іл. Використовуваний у винаході термін "(C3-C7)циклоалкіл(C1-C6)алкіл" стосується обумовленої у винаході (C3-C7)циклоалкільної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкільну групу. Типові приклади (C3-C7)циклоалкіл(C1C6)алкілу включають, але цим не обмежуючись, циклогексилметил і 2-циклопентилетил. Використовуваний у винаході термін "ціано" стосується -CN групи. Використовуваний у винаході термін "карбоксі(C1-C6)алкіл" стосується обумовленої у винаході карбоксильної групи, приєднаної до основного молекулярного фрагмента через обумовлену у винаході (C1-C6)алкільну групу. Типові приклади карбоксі(C1-C6)алкілу включають, але цим не обмежуючись, карбоксиметил, 1-карбоксіетил і 2-карбоксіетил. Використовуваний у винаході термін "(C1-C5)алкіл" стосується лінійної або розгалуженої насиченої вуглеводневої групи, що має 1, 2, 3, 4 або 5 вуглецевих атомів. Типові приклади (C 1C5)алкілу включають, але цим не обмежуючись, метил, етил, пропіл, ізопропіл, пентил і неопентил. Фармацевтично прийнятні солі, наприклад, солі металів і солі приєднання кислот, як органічних кислот, так і неорганічних кислот, добре відомі у фармацевтиці. Типові приклади фармацевтично прийнятних солей металів включають, але цим не обмежуючись, солі літію, натрію, калію, кальцію, магнію, алюмінію і цинку. Типові приклади фармацевтично прийнятних солей приєднання кислот включають, але цим не обмежуючись, хлориди, броміди, сульфати, нітрати, фосфати, сульфонати, метансульфонати, форміати, тартрати, малеати, цитрати, бензоати, саліцилати й аскорбати. Фармацевтично прийнятні ефіри гідроксильних груп можуть бути отримані відомими методами, використовуючи фармацевтично прийнятні карбонові кислоти, що звичайно 10 UA 112697 C2 5 10 15 20 25 30 застосовують у фармацевтиці. Типові приклади фармацевтично прийнятних ефірів гідроксильних груп включають, але цим не обмежуючись, ефіри, утворені з масляною кислотою і пентановою кислотою. Фармацевтично прийнятні ефіри карбоксильних груп можуть бути отримані відомими методами, використовуючи фармацевтично прийнятні спирти, що звичайно застосовують у фармацевтиці. Типові приклади фармацевтично прийнятних ефірів карбоксильних груп включають, але цим не обмежуючись, ефіри, утворені з пропан-1-олом, бутан-1-олом і 2метилпропан-1-олом. Винахід включає у свій об'єм усі можливі геометричні ізомери, наприклад, Z і E ізомери (цисі транс- ізомери), сполук, також як усі можливі оптичні ізомери, наприклад, діастереомери і енантіомери, сполук. Крім того, винахід включає у свій об'єм як індивідуальні ізомери, так і їхні будь-які суміші, наприклад, рацемічні суміші. Індивідуальні ізомери можуть бути отримані, використовуючи відповідні ізомерні форми вихідної речовини, або вони можуть бути розділені після одержання кінцевої сполуки за допомогою відповідних традиційних методів поділу. Для виділення оптичних ізомерів, наприклад, енантіомерів, з їхньої суміші можуть бути використані традиційні методи поділу, наприклад, фракційна кристалізація. Винахід включає у свій об'єм усі можливі таутомери сполук або їхні рівноважні суміші. У таутомерах водень мігрує від одного атома сполуки до іншого атома сполуки. Типові приклади таутомерів включають, але цим не обмежуючись, кето/енол і нітрозо/оксим. Сполуки формули I можуть бути отримані за допомогою різних синтетичних підходів, що аналогічні методам або відповідають відомим у літературі методам, використовуючи придатні вихідні речовини. Незважаючи на те, що відомо багато загальних методів утворення ціаногрупи, більшість з них не можна прямо використовувати в галузі хімічних перетворень катехолу. Наприклад, реакція Зандмейєра приводить до утворення як проміжної сполуки винятково реакційноздатного катехоламіну, що створює серйозні препаративні проблеми. Деякі методи, застосовувані для одержання сполук формули I, описані нижче. Диціанове угруповання може бути ефективно утворене, використовуючи прості вихідні реагенти, в основному, двома способами, або синтезом двох формільних груп одночасно, або формуванням другої формільної групи на похідному бензальдегіду. В обох випадках, формільні групи потім перетворюють з високим виходом у ціаногрупи. Наступні перетворення дозволяють одержати корисну проміжну сполуку, з якої може бути отримана множина кінцевих продуктів. Схема 1. Виходячи з 2-метокси-5-метилфенолу . 35 40 На схемі 1, 2-метокси-5-метилфенол піддають формілуванню за допомогою гексаметилентетраміну в придатному розчиннику, наприклад, оцтовій кислоті. 4-Гідрокси-5метокси-2-метилізофталевий альдегід перетворюють у 4-гідрокси-5-метокси-2метилізофталонітрил за допомогою гідрохлориду гідроксиламіну у відповідному розчиннику, наприклад, мурашиній кислоті. 4-гідрокси-5-метокси-2-метилізофталонітрил бромують за допомогою N-бромсукциніміду у відповідному розчиннику, наприклад, дихлорметані, з 11 UA 112697 C2 5 одержанням 2-(бромметил)-4-гідрокси-5-метоксіізофталонітрилу. Атом брому потім перетворюють у необхідну функціональну групу, і одержують необхідний продукт шляхом проведення деметилювання за допомогою кислоти Льюїса у відповідному розчиннику, наприклад, за допомогою хлориду алюмінію в ацетонітрилі або за допомогою триброміду бору в дихлорметані. Схема 2. Виходячи з 2-бром-4-гідрокси-5-метоксибензальдегіду . 10 15 20 На схемі 2 R1 визначений вище. 2-Бром-4-гідрокси-5-метоксибензальдегід піддають формілуванню за допомогою гексаметилентетраміну у відповідному розчиннику, наприклад оцтовій кислоті. 2-Бром-4-гідрокси-5-метоксіізофталевий альдегід перетворюють у 2-бром-4гідрокси-5-метоксіізофталонітрил за допомогою гідрохлориду гідроксиламіну у відповідному розчиннику, наприклад, мурашиній кислоті. Атом брому заміщають на замісник R 1, наприклад, реакцій крос-сполучення Сузукі. 2-Бром-4-гідрокси-5-метоксіізофталонітрил піддають взаємодії з придатним похідним боронової кислоти у відповідному розчиннику, наприклад, суміші 1,4діоксан/вода. Отриману проміжну сполуку IX потім деметилюють. Як варіант, деметилювання проводять перед заміщенням атома брому на замісник R1. Деметилювання проводять за допомогою кислоти Льюїса у відповідному розчиннику, наприклад, за допомогою хлориду алюмінію в ацетонітрилі або за допомогою триброміду бору в дихлорметані. Проміжну сполуку IX немає необхідності виділяти з реакційної суміші. Інший варіант для конверсії 2-бром-4гідрокси-5-метоксіізофталевого альдегіду в продукт I зображений на схемі 5. Схема 3. Виходячи із 5-заміщеного 2-метоксифенолу 12 UA 112697 C2 . 5 10 На схемі 3 R1 визначений вище. Сполуку XI диформілують, наприклад, за допомогою гексаметилентетраміну у відповідному розчиннику, такому, як оцтова кислота або трифтороцтова кислота, або дибромують, наприклад, за допомогою брому у відповідному розчиннику, такому, як суміш дихлорметану й оцтової кислоти. Диціанове похідне IX одержують шляхом реакції диформільного похідного XII з гідроксиламіну гідрохлоридом у відповідному розчиннику, такому, як мурашина кислота, або шляхом реакції дибромного похідного XIII з ціанідом міді(I) у відповідному розчиннику, такому, як N,N-диметилформамід. Диціанове похідне IX деметилюють за допомогою кислоти Льюїса у відповідному розчиннику, наприклад, за допомогою хлориду алюмінію в ацетонітрилі, або за допомогою триброміду бору в дихлорметані. Схема 4. Виходячи з 3-бензилокси-4-метоксибензальдегіду 13 UA 112697 C2 . 5 10 15 На схемі 4 Bn являє собою бензил, R" являє собою, наприклад, (C 1-C5)алкіл або арил, R’’ являє собою, наприклад, (C1-C5)алкіл, R’’’ являє собою, наприклад, арил, і X являє собою галоген. 3-Бензилокси-4-метоксибензальдегід перетворюють у спирт XV, використовуючи придатний реактив Гриньяра. Сполуку XVI одержують шляхом гідрування спирту XV. Коли R" являє собою, наприклад, (C1-C5)алкіл, сполука XVI може бути диформілована, наприклад, за допомогою гексаметилентетраміну у відповідному розчиннику, такому, як оцтова кислота або трифтороцтова кислота. Коли R' являє собою, наприклад, арил, сполука XVI може бути дибромована, наприклад, за допомогою брому, у відповідному розчиннику, такому, як суміш дихлорметану й оцтової кислоти. Диціанове похідне XIX одержують шляхом реакції диформільного похідного XVII з гідрохлоридом гідроксиламіну у відповідному розчиннику, такому, як мурашина кислота, або шляхом реакції дибромованого похідного XVIII з ціанідом міді(I) у відповідному розчиннику, такому, як N,N-диметилформамід. Диціанове похідне XIX деметилюють за допомогою кислоти Льюїса у відповідному розчиннику, наприклад, за допомогою хлориду алюмінію в ацетонітрилі або за допомогою триброміду бору в дихлорметані. Схема 5. Перетворення 2-бром-4-гідрокси-5-метоксіізофталевого альдегіду 14 UA 112697 C2 . 5 10 15 20 25 30 На схемі 5 Ac являє собою ацетил, і R'''' являє собою, наприклад, арил-S- або гетероарилS-. 2-Бром-4-гідрокси-5-метоксіізофталевий альдегід, що може бути отриманий, як показано на схемі 2, перетворюють у (1E,1’E)-2-бром-6-гідрокси-3-((E)-(гідроксііміно)метил)-5метоксибензальдегіду оксим за допомогою гідрохлориду гідроксиламіну у відповідному розчиннику, наприклад, тетрагідрофурані. Обробка (1E,1’E)-2-бром-6-гідрокси-3-((E)(гідроксііміно)метил)-5-метокси-бензальдегіду оксиму за допомогою оцтового ангідриду дає 3бром-2,4-диціано-6-метоксифенілацетат. Диціанове похідне IX одержують шляхом реакції 3бром-2,4-диціано-6-метоксифенілацетату з придатним тіолом у відповідному розчиннику, наприклад, N,N-диметилформаміді. Диціанове похідне IX деметилюють за допомогою кислоти Льюїса у відповідному розчиннику, наприклад, за допомогою хлориду алюмінію в ацетонітрилі або за допомогою триброміду бору в дихлорметані. Для фахівця в цій галузі техніки є очевидним, що будь-яка вихідна речовина або проміжна сполука в описаних вище реакціях, за необхідності, можуть бути захищені добре відомим в хімії методом. Наприклад, етилванілін може бути використаний замість ваніліну. З будь-якої захищеної функціональності потім захист може бути знятий відомим у хімії методом. Можуть бути використані постадійні синтези. Наприклад, цільова диціанова сполука може бути отримана з придатної вихідної сполуки в наступній послідовності: 1) монобромування, 2) моноформілування, 3) перетворення CHO у CN, і 4) перетворення Br у CN. Порядок усіх цих окремих стадій бромінування, формілування, перетворення CHO у CN і перетворення Br у CN може бути необов'язково змінений. Наприклад, можна почати з формілування. Аналогічним чином, якщо потрібно, перетворення Br у CN може бути проведене перед перетворенням CHO у CN. Передбачається, що описані вище методи синтезу ілюструють одержання сполук формули I, і це одержання ні в якій мірі не обмежується цими методами синтезу, тобто, існують також інші можливі методи синтезу, що відомі звичайному фахівцю в галузі органічного синтезу. Наприклад, формілування може здійснюватися також через літіювання ароматичного метоксигалогеніду, наприклад, ароматичного метоксиброміду, або ароматичного метоксидигалогеніду, наприклад, ароматичного метоксидиброміду, окислювання метильної групи або відновлення карбоксильної групи. Ароматична формільна група може бути перетворена в гідроксильну групу за допомогою реакції Декіна. 15 UA 112697 C2 5 Сполуки формули I можуть бути перетворені, якщо потрібно, у їх фармацевтично прийнятну сіль або ефірну форму, використовуючи добре відомі в хімії методи. Далі даний винахід буде більш докладно роз'яснений за допомогою наступних прикладів. Приклади наводяться тільки для ілюстрації, і вони не обмежують об'єм винаходу, що визначається пунктами формули винаходу. Якщо не зазначено, то усі вихідні речовини купувалися у фірм-виробників і використовувалися без додаткового очищення. Скорочені найменування мають значення, зазначені нижче. AcOH AIBN DBU DCM DIPEA DMAP DMF DMSO DPEPhos EtOAc mCPBA NBS Pd(dppf)Cl2 Pd2(dba)3 TFA THF оцтова кислота 2,2’-азобісизобутиронітрил 1,8-діазабіцикло[5,4,0]ундец-7-ен дихлорметан N,N-діізопропілетиламін 4-диметиламінопіридин N,N-диметилформамід диметилсульфоксид (оксибіс(2,1-фенілен))біс(дифенілфосфін) етилацетат м-хлорпероксибензойна кислота N-бромсукцинімід (1,1’-біс(дифенілфосфіно)фероцен)паладію дихлорид трис(дибензиліденацетон)дипаладій(0) трифтороцтова кислота тетрагідрофуран 10 15 20 25 30 35 40 Одержання проміжних сполук Проміжна сполука A1: 4-Гідрокси-5-метокси-2-метил-ізофталонітрил 4-Гідрокси-5-метокси-2-метилізофталевий альдегід 2-Метокси-5-метилфенол (11,0 г) і гексаметилентетрамін (23,8 г) у AcOH (280 мл) кип'ятили зі зворотним холодильником протягом 15 годин. Додавали концентровану HCl (20 мл), і суміш кип'ятили зі зворотним холодильником протягом 3 годин. Об'єм розчинника зменшували до 4050 мл. Суміш охолоджували протягом 1 години на крижаній бані. Осад відфільтровували і промивали етанолом. Додавали до фільтрату воду, і суміш екстрагували три рази за допомогою DCM. Об'єднані органічні фази сушили (Na2SO4) і випаровували досуха. Залишок розтирали з етанолом і охолоджували на крижаній бані. Тверду речовину відфільтровували і промивали етанолом. До твердої речовини додавали концентровану HCl (45 мл) і кип'ятили зі зворотним холодильником протягом 1 години. Реакційну суміш охолоджували на крижаній бані, фільтрували і промивали етанолом (5 мл). Вихід - 2,9 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 12,02 (с, 1H) 10,48 (с, 1H) 10,28 (с, 1H) 7,56 (с, 1H) 2,79 (с, 3H). 4-Гідрокси-5-метокси-2-метилізофталонітрил 4-Гідрокси-5-метокси-2-метилізофталевий альдегід (5,2 г), гідрохлорид гідроксиламіну (5,58 г) і безводний ацетат натрію (8,79 г) у мурашиній кислоті (30 мл) кип'ятили зі зворотним холодильником протягом 5 годин. Реакційну суміш охолоджували на крижаній бані, і осад відфільтровували і промивали водою. Вихід - 4,6 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,47 (шир. с, 1H) 7,55 (с, 1H) 3,88 (с, 3H). Проміжна сполука A2: 2-Бром-4-гідрокси-5-метоксі-ізофталонітрил 2-Бром-4-гідрокси-5-метоксіізофталевий альдегід 2-Бром-4-гідрокси-5-метоксибензальдегід (0,75 г) і гексаметилентетрамін (0,91 г) у AcOH (30 мл) кип'ятили зі зворотним холодильником протягом 4 годин. AcOH випаровували і додавали 4M HCl (30 мл). Суміш спочатку кип'ятили зі зворотним холодильником протягом 2 годин і перемішували протягом ночі при кімнатній температурі. Твердий продукт фільтрували, промивали водою і сушили. Вихід - 0,38 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 10,37 (с, 1H) 10,24 (с, 1H) 7,50 (с, 1H) 3,90 (с, 3H). 2-Бром-4-гідрокси-5-метоксіізофталонітрил 2-Бром-4-гідрокси-5-метоксіізофталевий альдегід (11,6 г) і гідрохлорид гідроксиламіну (9,3 г) розчиняли в гарячій мурашиній кислоті (155 мл). Розчин нагрівали до температури кипіння і потім додавали безводний ацетат натрію (22,0 г). Суміш кип'ятили зі зворотним холодильником протягом 2 годин. До гарячої реакційної суміші додавали по краплях оцтовий ангідрид (18,2 г) і 16 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 кип'ятили зі зворотним холодильником протягом 4 годин. Суміш охолоджували до кімнатної температури протягом ночі і потім перемішували на крижаній бані. Тверду речовину фільтрували, промивали крижаною водою (20 мл) і сушили. Вихід - 10,6 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 12,10 (шир. с, 1H) 7,75 (с, 1H) 3,91 (с, 3H). Проміжна сполука A3: 2-Бром-4,5-дигідроксіізофталонітрил Одержання 2-бром-4-гідрокси-5-метоксіізофталонітрилу описане вище. Висушений на молекулярному ситі ацетонітрил (75 мл) охолоджували на крижаній бані. У розчинник повільно додавали хлорид алюмінію (3,16 г) так, щоб температура підтримувалася нижче 30 °C. Суміш перемішували при кімнатній температурі протягом 10 хвилин. Додавали йодид натрію (2,4 г), і розчин перемішували протягом 15 хвилин. Додавали 2-бром-4-гідрокси-5-метоксіізофталонітрил (2,0 г), і реакційну суміш нагрівали при 70 °C протягом 5 годин, після чого перемішували при кімнатній температурі протягом ночі. Для охолодження реакційної суміші послідовно додавали 4 M HCl (20 мл) і розчин сульфату натрію (1,3 г) у воді (40 мл). Суміш екстрагували три рази за допомогою EtOAc (50 мл), і об'єднані органічні фази промивали 2 M HCl (50 мл), водою (50 мл) і сольовим розчином (50 мл). Промиту органічну фазу сушили (Na2SO4), фільтрували і випаровували досуха. Вихід - 1,89 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,15 (шир. с, 2H) 7,32 (с, 2H). Проміжна сполука A4: 4-Бром-3,5-диціано-1,2-фенілену діацетат Одержання 2-бром-4,5-дигідроксіізофталонітрилу описане вище. 2-Бром-4,5дигідроксіізофталонітрил (1,80 г), оцтовий ангідрид (10 мл) і сірчану кислоту (20 мкл) перемішували при кімнатній температурі протягом ночі. Реакційну суміш виливали повільно в крижану воду (50 мл), перемішуючи одночасно водну суміш. Продукт фільтрували, промивали водою і сушили під вакуумом (30 °C). Вихід - 2,19 г. 1 H ЯМР (400 МГц, хлороформ-d) м. ч. 7,79 (с, 1H) 2,43 (с, 3H) 2,34 (с, 3H). Проміжна сполука A5: 2-Бром-4,5-діізопропоксі-ізофталонітрил Одержання 2-бром-4,5-дигідроксіізофталонітрилу описане вище. До підігрітої суміші 2-бром4,5-дигідроксіізофталонітрилу (10,0 г) і карбонату калію (23,1 г) у DMF (160 мл) додавали по краплях 2-йодпропан (16,7 мл) протягом 1 години. Реакційну суміш нагрівали при 85 °C протягом 6 годин, після чого її виливали в холодну воду і доводили величину рН до 12. Осад фільтрували, промивали водою і сушили під вакуумом. Вихід - 9,3 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 8,00 (с, 1H) 4,85 (м, 1H) 4,82 (м, 1H) 1,32 (с, 6H) 1,30 (с, 6H). Проміжна сполука A6: 3-Бром-2,4-диціано-6-метокси-фенілацетат (1E,1’E)-2-Бром-6-гідрокси-3-((E)-(гідроксііміно)метил)-5-метоксибензальдегіду оксим Одержання 2-бром-4-гідрокси-5-метоксіізофталевого альдегіду описано вище. 2-Бром-4гідрокси-5-метоксіізофталевий альдегід (15,9 г) і гідрохлорид гідроксиламіну (17,0 г) розчиняли в THF (500 мл). Додавали піридин (19,9 мл). Розчин нагрівали при 90 °C протягом 3 годин. Після концентрування до половини вихідного об'єму додавали лід і 4M розчин HCl (40 мл). Суміш перемішували протягом 30 хвилин. Тверду речовину фільтрували, промивали 1M HCl і крижаною водою і сушили. Вихід - 17,4 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 12,10 (шир. с, 1H) 7,75 (с, 1H) 3,91 (с, 3H). 3-Бром-2,4-диціано-6-метоксифенілацетат (1E,1’E)-2-Бром-6-гідрокси-3-((E)-(гідроксііміно)метил)-5-метоксибензальдегіду оксим (15,0 г) розчиняли в оцтовому ангідриді (96 мл). Суміш кип'ятили зі зворотним холодильником протягом 2 годин. Суміш охолоджували до кімнатної температури протягом ночі. Додавали толуол і воду, і розчинники випаровували. Після перемішування з крижаною водою протягом 30 хвилин тверду речовину фільтрували, промивали крижаною водою і сушили. Вихід - 11,0 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 8,19 (с, 1H) 3,92 (с, 3H) 2,44 (с, 3H). Проміжна сполука A7: 3-Бром-2,4-диціано-6-метокси-фенілтрет-бутилкарбонат Одержання 2-бром-4-гідрокси-5-метоксіізофталонітрилу описане вище. До перемішуваного розчину 2-бром-4-гідрокси-5-метоксіізофталонітрилу (5,57 г) в ацетонітрилі (200 мл) додавали однією порцією DMAP (1,3 г) і ди-трет-бутилдикарбонат (33,6 г). Після кип'ятіння зі зворотним холодильником протягом 4 годин суміш охолоджували на крижаній бані, фільтрували і випаровували досуха. Додавали EtOAc, і суміш фільтрували через силікагель. Фільтрат випаровували досуха. Вихід - 4,79 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,98 (с, 1H) 3,88 (с, 3H) 1,42 (с, 9H). Проміжна сполука A8: 5-(Бензилокси)-2-бром-4-гідроксіізофталонітрил Одержання 2-бром-4,5-дигідроксіізофталонітрилу описане вище. 2-бром-4,5дигідроксіізофталонітрил (450 мг) розчиняли в DMF (7 мл). Додавали карбонат цезію (1,84 г) і бензилхлорид (0,46 мл) і перемішували при 70 °C протягом 1,5 години. Реакцію зупиняли 17 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 крижаною водою, і суміш перемішували протягом 10 хвилин. Осаджену тверду речовину фільтрували, промивали водою і сушили під вакуумом. Вихід - 520 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,31-7,40 (м, 5H) 6,78 (с, 1H) 4,94 (с, 2H). Одержання сполук винаходу Приклад 1: 2-Бром-4,5-дигідроксіізофталонітрил Одержання названої сполуки описано вище. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,15 (шир. с, 2H) 7,32 (с, 2H). Приклад 2: 4,5-Дигідрокси-2-(фенілетиніл)ізофталонітрил 2,6-Ди-трет-бутил-4-метилфенол (13,6 мг) і тетракис(трифенілфосфін)паладій (28,6 мг) додавали до розчину 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) у сухому толуолі (18 мл). До реакційної суміші додавали розчин фенілетинілтри-н-бутилолова (315 мг) у сухому толуолі (2 мл) в атмосфері азоту. Реакційну суміш кип'ятили зі зворотним холодильником протягом 6 годин. Суміш фільтрували через целіт. Фільтрат випаровували досуха. До отриманого продукту додавали THF (30 мл) і 1M NaOH (40 мл), і розчин перемішували протягом 1 години. Розчин промивали три рази толуолом (10 мл). Водну фазу підкисляли 4M HCl при охолодженні. Продукт фільтрували, промивали водою і сушили при 40 °C під вакуумом. Вихід 45 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,54-7,60 (м, 2H) 7,47-7,53 (м, 3H) 7,35 (с, 1H). Приклад 3: 4,5-Дигідрокси-2-(проп-1-ніл)ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методу Прикладу 2, використовуючи трибутилпропінілстанан (254 мг) замість фенілетинілтри-н-бутилолова. Вихід - 78 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,40 (шир. с, 2H) 7,25 (с, 1H) 2,18 (с, 3H). Приклад 4: 4,5-Дигідрокси-2-(1-метил-1H-пірол-2-іл)ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (500 мг) за допомогою методу Прикладу 2, використовуючи 1-метил-2-(трибутилстаніл)-1H-пірол (716 мг) замість фенілетинілтри-н-бутилолова. Вихід - 280 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,39 (шир. с, 2H) 7,33 (с, 1H) 6,94-6,97 (м, 1H) 6,20 (м, J=3,50, 1,80 Гц, 1H) 6,12 (м, J=3,50, 2,80 Гц, 1H) 3,47 (с, 3H). Приклад 5: 4,5-Дигідрокси-2-(тіофен-2-іл)ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методу Прикладу 2, використовуючи 2-(трибутилстаніл)тіофен (462 мг) замість фенілетинілтри-н-бутилолова. Вихід - 60 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,41 (шир. с, 2H) 7,80 (дд, J=5,0, 1,3 Гц, 1H) 7,31-7,36 (м, 2H) 7,22 (дд, J=3,8 Гц, 1H). Приклад 6: 2-(Фуран-2-іл)-4,5-дигідроксіізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методу Прикладу 2, використовуючи 2-(трибутилстаніл)фуран (442 мг) замість фенілетинілтри-н-бутилолова. Вихід - 100 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,43 (шир. с, 2H) 7,94 (шир. с, 1H) 7,34 (с, 1H) 6,88-7,08 (м, 1H) 6,72 (шир. с, 1H). Приклад 7: 3",4",5’-Трифтор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил До розчину 4-бром-3,5-диціано-1,2-фенілендіацетату (500 мг) в ацетонітрилі (3 мл), воді (4 мл) і етанолі (3 мл) у флаконі додавали 3,4,5-трифторфенілборонову кислоту (354 мг), біс(трифенілфосфін)паладію(II) хлорид (61 мг) і карбонат натрію (492 мг). Реакційну суміш піддавали мікрохвильовому опроміненню протягом 60 хвилин при 130 °C. Суміш фільтрували через фільтр фірми Pall, підлуговували 2M NaOH (50 мл), промивали толуолом (50 мл). Водну фазу потім підкисляли 4M HCl при охолодженні. Продукт фільтрували, промивали водою і перекристалізовували із суміші вода/етанол 10/2. Вихід - 140 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,38 (шир. с, 2H) 7,58-7,69 (м, 2H) 7,36 (с, 1H). Приклад 8: 4,5-Дигідрокси-2-(нафталін-1-іл)ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і нафталін1-боронової кислоти (149 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Вихід - 126 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,47 (шир. с, 2H) 8,08 (дд, J=1,00 Гц, 2H) 7,56-7,67 (м, 2H) 7,49-7,56 (м, 2H) 7,43 (с, 1H) 7,37 (д, J=1,00 Гц, 1H). Приклад 9: 4’-трет-бутил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (300 мг) і 4-третбутилфенілборонової кислоти (248 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 20 хвилин при 150 °C. Вихід - 115 мг. 18 UA 112697 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,67 (шир. с, 1H) 11,06 (шир. с, 1H) 7,52-7,59 (м, 2H) 7,397,43 (м, 2H) 7,34 (с, 1H) 1,34 (с, 9H). Приклад 10: 3,4-Дигідрокси-4’-(гідроксиметил)біфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (1 г) і 4(гідроксиметил)бензолборонової кислоти (564 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 30 хвилин при 130 °C. Вихід - 639 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,34 (шир. с, 1H) 7,44 (м, J=8,10, 8,10, 8,10 Гц, 4H) 7,34 (с, 1H) 5,33 (шир. с, 1H) 4,59 (с, 2H). Приклад 11: 4,5-Дигідрокси-2-(нафталін-2-іл)ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і нафталін2-боронової кислоти (138 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Вихід - 160 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,77 (шир. с, 1H) 11,06 (шир. с, 1H) 7,98-8,11 (м, 4H) 7,567,67 (м, 3H) 7,40 (с, 1H). Приклад 12: 3,4-Дигідроксі-4’-(ізопропілтіо)біфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг і 4ізопропілтіофенілборонової кислоти (158 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 45 хвилин при 150 °C. Вихід - 135 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,72 (шир. с, 1H) 11,08 (шир. с, 1H) 7,45-7,49 (м, 2H) 7,407,44 (м, 2H) 7,35 (с, 1H) 3,64 (м, J=13,30, 6,70, 6,70 Гц, 1H) 1,30 (д, J=6,78 Гц, 6H). Приклад 13: 3,4-Дигідрокси-4’-(метилтіо)біфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 4(метилтіо)фенілборонової кислоти (135 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Вихід - 151 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,32-12,19 (м, 1H) 10,74-11,28 (м, 1H) 7,36-7,44 (м, 4H) 7,34 (с, 1H) 2,54 (с, 3H). Приклад 14: 3,4-Дигідроксі-4’-ізопропоксибіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (600 мг) і 4ізопропоксифенілборонової кислоти (334 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 365 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,25 (шир. с, 1H) 7,25-7,44 (м, 3H) 7,03 (д, J=8,03 Гц, 2H) 4,65-4,76 (м, 1H) 1,31 (д, J=5,77 Гц, 6H). Приклад 15: 4’-(Етилтіо)-3,4-дигідроксибіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 4(етилтіо)бензолборонової кислоти (146 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Вихід - 143 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,76 (шир. с, 1H) 11,05 (шир. с, 1H) 7,41 (с, 4H) 7,34 (с, 1H) 3,07 (м, J=7,30, 7,30, 7,30 Гц, 2H) 1,29 (т, J=7,28 Гц, 3H). Приклад 16: 3,4-Дигідроксі-4’-ізопропокси-3",5’-диметил-біфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 3,5диметил-4-ізопропоксифенілборонової кислоти (167 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Вихід - 109 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,63 (шир. с, 1H) 10,98 (шир. с, 1H) 7,31 (с, 1H) 7,11 (с, 2H) 4,22-4,30 (м, 1H) 2,26 (с, 6H) 1,26 (д, J=6,27 Гц, 6H). Приклад 17: 4’-Бутил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 4-нбутилбензолборонової кислоти (143 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 88 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,28 (шир. с, 2H) 7,29-7,41 (м, 5H) 2,66 (т, J=7,65 Гц, 2H) 1,61 (м, J=7,70, 7,70 Гц, 2H) 1,29-1,40 (м, 2H) 0,92 (т, J=7,40 Гц, 3H). Приклад 18: 3,4-Дигідрокси-2",4",5’-триметилбіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 2,4,5триметилфенілборонової кислоти (132 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 122 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,37 (шир. с, 2H) 7,33 (с, 1H) 7,13 (с, 1H) 6,96 (с, 1H) 2,25 (с, 3H) 2,21 (с, 3H) 2,00 (с, 3H). Приклад 19: 3,4-Дигідрокси-2",5’-диметилбіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 2,5диметилбензолборонової кислоти (121 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 102 мг. 19 UA 112697 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (400 МГц, DMSO-d6) м. ч. 10,37-12,37 (м, 2H) 7,35 (с, 1H) 7,23-7,27 (м, 1H) 7,18-7,23 (м, 1H) 7,00-7,04 (м, 1H) 2,31 (с, 3H) 2,03 (с, 3H). Приклад 20: 2-Циклогексеніл-4,5-дигідроксіізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і циклогексен-1-ілборонової кислоти (94 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 112 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 10,57-11,63 (м, 2H) 7,21 (с, 1H) 5,78 (шир. с, 1H) 2,22 (шир. с, 2H) 2,15 (шир. с, 2H) 1,72 (м, J=4,30 Гц, 2H) 1,63 (м, J=4,50 Гц, 2H). Приклад 21: 3’-Етил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (250 мг) і 3етилфенілборонової кислоти (116 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 204 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 10,86-11,94 (м, 2H) 7,42 (с, 1H) 7,29-7,37 (м, 3H) 7,28 (с, 1H) 2,68 (д, J=7,53 Гц, 2H) 1,22 (т, J=7,65 Гц, 3H). Приклад 22: 3,4-Дигідроксибіфеніл-2,4",6-трикарбонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 4ціанофенілборонової кислоти (109 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 45 хвилин при 150 °C. Вихід - 127 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,49 (шир. с, 2H) 8,00-8,04 (м, 2H) 7,69-7,74 (м, 2H) 7,39 (с, 1H). Приклад 23: 3,4-Дигідроксі-4’-(ізопропілсульфоніл)біфеніл-2,6-дикарбонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 4(ізопропілсульфонілфеніл)боронової кислоти (169 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 45 хвилин при 150 °C. Вихід - 148 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 10,83-12,08 (м, 2H) 7,95-8,07 (м, 2H) 7,75-7,83 (м, 2H) 7,39 (с, 1H) 3,48-3,60 (м, 1H) 1,19 (д, J=6,78 Гц, 6H). Приклад 24: 2",6’-Диціано-3",4’-дигідрокси-N,N-диметил-біфеніл-4-сульфонамід Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і N,Nдиметил-4-боронобензол-сульфонаміду (170 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 159 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,51 (шир. с, 2H) 7,88-7,93 (м, 2H) 7,75-7,80 (м, 2H) 7,40 (с, 1H) 2,67 (с, 6H). Приклад 25: (E)-4,5-Дигідрокси-2-(пент-1-ніл)ізофталонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 1пентенілборонової кислоти (85 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 150 °C. Вихід - 100 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,18 (шир. с, 2H) 7,25 (с, 1H) 6,44-6,50 (м, 2H) 2,21-2,28 (м, 2H) 1,49 (м, 2H) 0,95 (т, J=7,40 Гц, 3H). Приклад 26: 2",6’-Диціано-3",4’-дигідроксибіфеніл-3-карбонова кислота Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 3карбоксифенілборонової кислоти (308 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 30 хвилин при 130 °C. Вихід - 388 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 13,20 (шир. с, 1H) 11,47 (шир. с, 2H) 8,08 (д, J=7,78 Гц, 1H) 8,01 (с, 1H) 7,75 (д, J=7,80 Гц, 1H) 7,67 (т, J=7,65 Гц, 1H) 7,37 (с, 1H). Приклад 27: 3,4-Дигідрокси-4’-(1-метоксіетил)біфеніл-2,6-дикарбонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (250 мг) і (4-(1метоксіетил)феніл)боронової кислоти (139 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 130 °C. Вихід - 63 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,21 (шир. с, 2H) 7,45 (с, 4H) 7,34 (с, 1H) 3,18 (с, 3H) 1,39 (д, J=6,27 Гц, 3H). Приклад 28: (E)-2-(3,3-Диметилбут-1-еніл)-4,5-дигідроксі-ізофталонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (500 мг) і 3,3диметил-1-бутенілборонової кислоти (297 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 20 хвилин при 150 °C. Вихід - 280 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,13 (шир. с, 2H) 7,23 (с, 1H) 6,47 (д, J=16,31 Гц, 1H) 6,36 (д, J=16,31 Гц, 1H) 1,11 (с, 9H). Приклад 29: 3,4-Дигідрокси-2’-метилбіфеніл-2,6-дикарбонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (250 мг) і отолілборонової кислоти (105 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 20 хвилин при 150 °C. Вихід - 17 мг. 20 UA 112697 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,00-7,87 (м, 4H) 7,27 (с, 1H) 2,51 (с, 3H). Приклад 30: (E)-2-(2-Циклогексилвініл)-4,5-дигідроксі-ізофталонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 2циклогексилетенілборонової кислоти (95 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 15 хвилин при 130 °C. Вихід - 92 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,62 (шир. с, 1H) 10,92 (шир. с, 2H) 7,24 (с, 1H) 6,43 (д, J=2,26 Гц, 2H) 2,17-2,27 (м, 1H) 1,68-1,81 (м, 4H) 1,63 (д, J=11,54 Гц, 1H) 1,13-1,37 (м, 5H). Приклад 31: (Z)-4,5-Дигідрокси-2-(проп-1-еніл)ізофталонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (2 г) і (Z)-проп-1енілборонової кислоти (744 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 20 хвилин при 120 °C. Вихід - 990 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,21 (шир. с, 2H) 11,19 (шир. с, 1H) 7,28 (с, 1H) 6,40-6,53 (м, 1H) 6,05-6,17 (м, 1H) 1,63 (д, J=7,03 Гц, 3H). Приклад 32: 3-(2",6’-Диціано-3",4’-дигідроксибіфеніл-4-іл)-пропанова кислота Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) і 4-(2карбоксіетил)бензолборонової кислоти (144 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 30 хвилин при 130 °C. Вихід - 33 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,89-12,43 (м, 1H) 10,78-11,86 (м, 2H) 7,38 (с, 4H) 7,33 (с, 1H) 2,91 (т, J=7,65 Гц, 2H) 2,61 (т, J=7,65 Гц, 2H). Приклад 33: 3,4-Дигідрокси-3’-(гідроксиметил)біфеніл-2,6-дикарбонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (500 мг) і 3(гідроксиметил)бензолборонової кислоти (282 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 30 хвилин при 130 °C. Вихід - 256 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,36 (шир. с, 2H) 7,42-7,52 (м, 2H) 7,38 (с, 1H) 7,29-7,36 (м, 2H) 5,30 (шир. с, 1H) 4,58 (с, 2H). Приклад 34: 3,4-Дигідрокси-3’-(метоксиметил)біфеніл-2,6-дикарбонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (500 мг) і 3метоксіетилфенілборонової кислоти (308 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 30 хвилин при 150 °C. Вихід - 370 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,35 (шир. с, 2H) 7,48-7,54 (м, 1H) 7,42-7,48 (м, 1H) 7,357,42 (м, 3H) 4,49 (с, 2H) 3,31 (с, 3H). Приклад 35: 2",6’-Диціано-3",4’-дигідрокси-N,N-дипропіл-біфеніл-4-карбоксамід Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (300 мг) і 4(дипропілкарбамоїл)фенілборонової кислоти (301 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 10 хвилин при 150 °C. Вихід - 150 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,38 (шир. с, 2H) 7,50-7,56 (м, 2H) 7,43-7,50 (м, 2H) 7,36 (с, 1H) 3,39 (шир. с, 2H) 3,11 (шир. с, 2H) 1,62 (шир. с, 2H) 1,49 (шир. с, 2H) 0,92 (шир. с, 3H) 0,65 (шир. с, 3H). Приклад 36: (E)-4,5-Дигідрокси-2-(проп-1-еніл)ізофталонітрил Названу сполуку одержували із 4-бром-3,5-диціано-1,2-фенілендіацетату (1 г) і транспропенілборонової кислоти (372 мг) замість 3,4,5-трифторфенілборонової кислоти, як описано в Прикладі 7. Реакційні умови: 20 хвилин при 150 °C. Продукт перекристалізовували з розчину етанол-вода. Вихід - 564 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,24 (с, 1H) 6,38-6,61 (м, 2H) 1,93 (д, J=4,02 Гц, 3H). Приклад 37: 3,4-Дигідроксибіфеніл-2,6-дикарбонітрил 3-Гідрокси-4-метоксибіфеніл-2,6-дикарбонітрил До суміші 2-бром-4-гідрокси-5-метоксіізофталонітрилу (0,25 г) і фенілборонової кислоти (0,15 г) у етанолі (1 мл) і воді (5 мл) додавали тетракис(трифенілфосфін)паладій (0,04 мг) і 2M карбонат натрію (1,63 мл). Перемішувану реакційну суміш кип'ятили зі зворотним холодильником протягом 3 годин. Гарячу реакційну суміш фільтрували через фільтр фірми Pall. Після охолодження, отриманий осад підкисляли 2M HCl (5 мл), фільтрували, промивали водою і сушили з одержанням 3-гідрокси-4-метоксибіфеніл-2,6-дикарбонітрилу.Вихід - 0,14 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,49 (с, 1H) 6,96-7,24 (м, 4H) 3,94 (с, 3H). 3,4-Дигідроксибіфеніл-2,6-дикарбонітрил До сухої суміші 3-гідрокси-4-метоксибіфеніл-2,6-дикарбонітрилу (141 мг) у DCM (5 мл) в атмосфері азоту додавали 1M розчин триброміду бору в DCM (2,82 мл) при 0 °C. Реакційну суміш повільно підігрівали до кімнатної температури при перемішуванні протягом 3½ годин. Реакційну суміш виливали в суміш метанол (5 мл)/лід. Після випаровування розчинника додавали воду (10 мл), і суміш перемішували протягом 1 години, потім фільтрували, промивали водою і сушили під вакуумом з одержанням названої сполуки. Вихід - 115 мг. 21 UA 112697 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,35 (шир. с, 2H) 7,84 (д, J=2,01 Гц, 1H) 7,82 (д, J=8,28 Гц, 1H) 7,51 (дд, J=8,28 2,26 Гц, 1H) 7,35 (с, 1Н). Приклад 38: 3",4’-Дихлор-3,4-дигідроксибіфеніл-2,6-дикарбонітрил Використовуючи методику, описану в Прикладі 37, 3",4’-дихлор-3-гідрокси-4-метоксибіфеніл2,6-дикарбонітрил (107 мг), отриманий з 3,4-дихлорфенілборонової кислоти і 2-бром-4-гідрокси5-метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 96 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,38 (шир. с, 2H) 7,84 (д, J=2,01 Гц, 1H) 7,82 (д, J=8,28 Гц, 1H) 7,55 (дд, J=8,28, 8,26 Гц, 1H) 7,35 (с, 1Н). Приклад 39: 3,4-Дигідрокси-3’-(трифторметил)біфеніл-2,6-дикарбонітрил Використовуючи методику, описану в Прикладі 37, 3-гідрокси-4-метокси-3’(трифторметил)біфеніл-2,6-дикарбонітрил (320 мг), отриманий з 3(трифторметил)фенілборонової кислоти і 2-бром-4-гідрокси-5-метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 239 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,19 (шир. с, 2H) 7,87-7,92 (м, 2H) 7,75-7,85 (м, 2H) 7,36 (с, 1H). Приклад 40: 2-(Фуран-3-іл)-4,5-дигідроксіізофталонітрил Використовуючи методику, описану в Прикладі 37, 2-(фуран-3-іл)-4-гідрокси-5метоксіізофталонітрил (60 мг), отриманий з фуран-3-боронової кислоти і 2-бром-4-гідрокси-5метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 56 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,68 (шир. с, 1H) 11,15 (шир. с, 1H) 8,00-8,12 (м, 1H) 7,827,91 (м, 1H) 7,33 (с, 1H) 6,75-6,84 (м, 1H). Приклад 41: 3,4-Дигідрокси-4’-(трифторметил)біфеніл-2,6-дикарбонітрил Використовуючи методику, описану в Прикладі 37, 3-гідрокси-4-метокси-4’(трифторметил)біфеніл-2,6-дикарбонітрил (145 мг), отриманий з 4три(фторметил)фенілборонової кислоти і 2-бром-4-гідрокси-5-метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 139 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,41 (шир. с, 2H) 7,92 (д, J=8,03 Гц, 2H) 7,74 (д, J=8,03 Гц, 2H) 7,38 (с, 1H). Приклад 42: 4,5-Дигідрокси-2-(тіофен-3-іл)ізофталонітрил Використовуючи методику, описану в Прикладі 37, 4-гідрокси-5-метокси-2-(тіофен-3іл)ізофталонітрил (210 мг), отриманий з тіофен-3-боронової кислоти і 2-бром-4-гідрокси-5метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 110 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,56 (шир. с, 1H) 11,12 (шир. с, 1H) 7,83 (дд, J=3,0, 1,2 Гц, 1H) 7,72 (дд, J=5,0 Гц, 1H) 7,33 (с, 1H) 7,30 (дд, 1H). Приклад 43: 4,5-Дигідрокси-2-(5-метилфуран-2-іл)ізофтало-нітрил Використовуючи методику, описану в Прикладі 37, 4-гідрокси-5-метокси-2-(5-метилфуран-2іл)ізофталонітрил (150 мг), отриманий з 5-метилфуран-2-боронової кислоти і 2-бром-4-гідрокси5-метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 90 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,39 (шир. с, 2H) 7,31 (с, 1H) 6,88 (д, J=3,3 Гц, 1H) 6,216,48 (м, 1H) 2,35 (с, 3H). Приклад 44: 4,5-Дигідрокси-2-(5-метилтіофен-2-іл)ізофтало-нітрил Використовуючи методику, описану в Прикладі 37, 4-гідрокси-5-метокси-2-(5-метилтіофен-2іл)ізофталонітрил (250 мг), отриманий з 5-метилтіофен-2-боронової кислоти і 2-бром-4-гідрокси5-метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 130 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,41 (шир. с, 2H) 7,31 (с, 1H) 7,13 (д, J=3,5 Гц, 1H) 6,886,95 (м, 1H) 2,52 (шир. с, 3H). Приклад 45: 2-Бензил-4,5-дигідроксіізофталонітрил 2-Бензил-4-гідрокси-5-метоксіізофталонітрил До суміші 2-бром-4-гідрокси-5-метоксіізофталонітрилу (1,0 г) і бензилборонової кислоти пінаколового ефіру (0,53 мл) у 1,4-діоксані (5 мл) і воді (5 мл) додавали комплекс Pd(dppf)Cl 2 з CH2Cl2 (1:1) (0,260 г) і карбонат цезію (3,8 г). Перемішувану реакційну суміш опромінювали мікрохвильовим випромінюванням при 120 °C протягом 30 хвилин. Гарячу реакційну суміш фільтрували через фільтр фірми Pall. Після охолодження отриманий осад підкисляли 2M HCl (5 мл), фільтрували, промивали водою і сушили з одержанням 2-бензил-4-гідрокси-5метоксіізофталонітрилу.Вихід - 0,77 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,49 (с, 1H) 6,96-7,24 (м, 4H) 3,94 (с, 3H). 2-Бензил-4,5-дигідроксіізофталонітрил 2-Бензил-4-гідрокси-5-метоксіізофталонітрил (1,5 г) деметилювали, використовуючи трибромід бору, як описано в Прикладі 37, з одержанням названої сполуки. Вихід - 0,77 г. 1 H ЯМР (DMSO-d6) м. ч. 10,8-11,6 (шир., 2H) 7,29 (с, 1H) 7,15-7,35 (м, 5H) 4,16 (с, 2H). 22 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 46: 2-(Бензофуран-2-іл)-4,5-дигідроксіізофталонітрил Використовуючи методику, описану в Прикладі 37, 2-(бензофуран-2-іл)-4-гідрокси-5метоксіізофталонітрил (320 мг), одержаний із 2-бензофуранборонової кислоти і 2-бром-4гідрокси-5-метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 200 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,60 (шир. с, 2H) 7,80 (д, J=7, 8 Гц, 1H) 7,68 (д, J=8, 3 Гц, 1H) 7,40-7,48 (м, 3H) 7,32-7,39 (м, 1H). Приклад 47: 2-(5-Хлортіофен-2-іл)-4,5-дигідроксіізофтало-нітрил Використовуючи методику, описану в Прикладі 37, 2-(5-хлортіофен-2-іл)-4-гідрокси-5метоксіізофталонітрил (27 мг), одержаний із 5-хлортіофен-2-боронової кислоти і 2-бром-4гідрокси-5-метоксіізофталонітрилу, деметилювали з одержанням названої сполуки. Вихід - 20 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,35 (шир. с, 2H) 7,34 (с, 1H) 7,27 (д, J=3,9 Гц, 1H) 7,24 (д, 1H). Приклад 48: 2-(Бензо[b]тіофен-2-іл)-4,5-дигідроксіізофтало-нітрил Використовуючи методику, описану в Прикладі 37, 2-(бензо[b]тіофен-2-іл)-4-гідрокси-5метоксіізофталонітрил (70 мг), одержаний із 2-бром-4-гідрокси-5-метоксіізофталонітрилу і тіанафтен-2-боронової кислоти, деметилювали з одержанням названої сполуки. Вихід - 50 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 10,43-12,58 (м, 2H) 8,04-8,11 (м, 1H) 7,94-8,01 (м, 1H) 7,67 (с, 1H) 7,44-7,51 (м, 2H) 7,39 (с, 1H). Приклад 49: (E)-4,5-Дигідрокси-2-стирилізофталонітрил Використовуючи методику, описану в Прикладі 37, (E)-4-гідрокси-5-метокси-2стирилізофталонітрил (100 мг), одержаний із 2-бром-4-гідрокси-5-метоксіізофталонітрилу і транс-2-феніл-вінілборонової кислоти, деметилювали з одержанням названої сполуки. Вихід 79 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,61 (д, J=7,28 Гц, 2H) 7,41-7,48 (м, 2H) 7,21-7,41 (м, 4H). Приклад 50: 4’-Етил-3,4-дигідроксибіфеніл-2,6-дикарбонітрил Використовуючи методику, описану в Прикладі 37, 4’-етил-3-гідрокси-4-метоксибіфеніл-2,6дикарбонітрил (150 мг), одержаний із 2-бром-4-гідрокси-5-метоксіізофталонітрилу і 4етилбензолборонової кислоти, деметилювали з одержанням названої сполуки. Вихід - 100 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,33-7,41 (м, 5H) 2,70 (м, J=7,50, 7,50, 7,50 Гц, 2H) 1,25 (т, J=7,53 Гц, 3H). Приклад 51: 3,4-Дигідрокси-3",5’-диметилбіфеніл-2,6-дикарбонітрил Використовуючи методику, описану в Прикладі 37, 3-гідрокси-4-метокси-3",5’диметилбіфеніл-2,6-дикарбонітрил (115 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 3,5-диметилбензолборонової кислоти, деметилювали з одержанням названої сполуки. Вихід - 70 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,32 (с, 1H) 7,14 (с, 1H) 7,04 (с, 2H) 2,33 (с, 6H). Приклад 52: 4,5-Дигідрокси-2-(фенілтіо)ізофталонітрил 4-Гідрокси-5-метокси-2-(фенілтіо)ізофталонітрил До суміші 2-бром-4-гідрокси-5-метоксіізофталонітрилу (0,5 г) у THF (8 мл) додавали фенілдисульфід (0,26 г) і комплекс Pd(dppf)Cl2 з CH2Cl2 (1:1) (0,13 г). Перемішувану реакційну суміш кип'ятили зі зворотним холодильником протягом 24 годин. Гарячу реакційну суміш фільтрували через фільтр фірми Pall. Після охолодження отриманий осад підкисляли 2M HCl (5 мл), фільтрували, промивали водою і сушили з одержанням 4-гідрокси-5-метокси-2(фенілтіо)ізофталонітрилу.Вихід - 0,45 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,29 (с, 1H) 7,01-7,18 (м, 4H) 3,68 (с, 2H). 4,5-Дигідрокси-2-(фенілтіо)ізофталонітрил 4-Гідрокси-5-метокси-2-(фенілтіо)ізофталонітрил (400 мг) деметилювали, використовуючи трибромід бору, як описано в Прикладі 37, з одержанням названої сполуки. Вихід - 164 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,25-7,40 (м, 6H). Приклад 53: 4,5-Дигідрокси-2-(п-толілтіо)ізофталонітрил 4-Гідрокси-5-метокси-2-(п-толілтіо)ізофталонітрил (400 мг), що одержували, як описано в Прикладі 52, за винятком того, що п-толілдисульфід використовували замість фенілдисульфіду, деметилювали, використовуючи трибромід бору, як описано в Прикладі 37, з одержанням названої сполуки. Вихід - 65 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,45 (шир. с, 2H) 7,36 (с, 1H) 7,17 (д, J=8,28 Гц, 2H) 7,12 (д, J=8,28 Гц, 2H) 2,27 (с, 3H). Приклад 54: 4,5-Дигідрокси-2-(4-метилбензил)ізофталонітрил 4-Гідрокси-5-метокси-2-(4-метилбензил)ізофталонітрил 23 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 До суміші 2-бром-4-гідрокси-5-метоксіізофталонітрилу (1,00 г) і 4,4,5,5-тетраметил-2-(4метилбензил)-1,3,2-діоксаборолану (1,38 г) у етанолі (2,5 мл) і воді (22 мл) додавали комплекс Pd(dppf)Cl2 з CH2Cl2 (1:1) (0,26 г) і гідрокарбонат натрію (1,32 г). Перемішувану реакційну суміш кип'ятили зі зворотним холодильником протягом 3 годин. Гарячу реакційну суміш фільтрували через фільтр фірми Pall. Після охолодження отриманий осад підкисляли 2M HCl (10 мл), фільтрували, промивали водою і сушили з одержанням 4-гідрокси-5-метокси-2-(4метилбензил)ізофталонітрилу.Вихід - 0,53 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,66 (с, 1H) 6,96-7,24 (м, 4H) 4,13 (с, 2H) 3,90 (с, 3H) 2,26 (с, 3H). 4,5-Дигідрокси-2-(4-метилбензил)ізофталонітрил 4-Гідрокси-5-метокси-2-(4-метилбензил)ізофталонітрил (1,00 г) в ацетонітрилі (15 мл) повільно додавали до розчину хлориду алюмінію (0,95 г) і йодиду натрію (1,07 г) в ацетонітрилі (15 мл) 0 °C. Реакційну суміш нагрівали при 50 °C протягом 3 годин. Додавали метанол (50 мл), і розчин випаровували досуха. Додавали 2M NaOH (10 мл)і толуол (20 мл), і суміш перемішували протягом 1 години. Водну фазу промивали два рази толуолом (10 мл) і підкисляли концентрованою HCl при 0 °C. Продукт фільтрували, промивали водою і сушили з одержанням названої сполуки. Вихід - 0,90 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,29 (с, 1H) 6,92-7,21 (м, 4H) 4,10 (с, 2H) 2,25 (с, 3H). Приклад 55: 2-(4-Фторбензил)-4,5-дигідроксіізофталонітрил 2-(4-Фторбензил)-4-гідрокси-5-метоксіізофталонітрил 2-(4-Фторбензил)-4-гідрокси-5-метоксіізофталонітрил одержували із 2-бром-4-гідрокси-5метоксіізофталонітрилу (1,00 г) і 2-(4-фторбензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану (1,30 г) замість 4,4,5,5-тетраметил-2-(4-метилбензил)-1,3,2-діоксаборолану, використовуючи методику, аналогічну методиці Прикладу 54. Вихід - 0,53 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,68 (с, 1H) 7,04-7,29 (м, 4H) 4,18 (с, 2H) 3,90 (с, 3H). 2-(4-Фторбензил)-4,5-дигідроксіізофталонітрил 2-(4-Фторбензил)-4-гідрокси-5-метоксіізофталонітрил (200 мг) перетворювали в названу сполуку, використовуючи методику, аналогічну методиці Прикладу 54. Вихід - 96 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,29 (с, 1H) 7,12-7,23 (м, 4H) 4,14 (с, 2H). Приклад 56: 4,5-Дигідрокси-2-(4-гідроксибензил)ізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 4-гідрокси-5-метокси-2-(4метоксибензил)ізофталонітрил (250 мг), одержаний із 4-метоксибензилборонової кислоти пінаколового ефіру і 2-бром-4-гідрокси-5-метоксіізофталонітрилу (1,00 г), деметилювали з одержанням названої сполуки. Вихід - 96 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,37 (с, 1H) 6,96 (д, J=1,00 Гц, 2H) 6,69 (д, J=1,00 Гц, 2H) 4,01 (с, 2H). Приклад 57: 4,5-Дигідрокси-2-(2-метоксибензил)ізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 4-гідрокси-5-метокси-2-(2метоксибензил)ізофталонітрил (116 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-(2-метоксибензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 17,6 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,28 (с, 1H) 7,23 (т, J=7,28 Гц, 1H) 6,99 (д, J=8,28 Гц, 1H) 6,84 (т, J=7,40 Гц, 1H) 6,70 (д, J=7,28 Гц, 1H) 4,07 (с, 2H) 3,81 (с, 3H). Приклад 58: 4,5-Дигідрокси-2-(4-(трифторметокси)бензил)-ізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 4-гідрокси-5-метокси-2-(4(трифторметокси)бензил)ізофталонітрил (260 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 4-(трифторметокси)бензилборонової кислоти пінаколового ефіру, деметилювали з одержанням названої сполуки. Вихід - 130 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,25-7,36 (м, 5H) 4,18 (с, 2H). Приклад 59: 2-(3-Фтор-4-метоксибензил)-4,5-дигідроксі-ізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 2-(3-фтор-4-метоксибензил)4,5-дигідроксіізофталонітрил (600 мг), одержаний із 2-бром-4-гідрокси-5-метоксіізофталонітрилу і 2-(3-фтор-4-метоксибензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 175 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,36 (с, 1H) 7,11 (т, J=8,78 Гц, 1H) 7,01 (дд, J=1,00 Гц, 1H) 6,91 (шир. д, J=1,00 Гц, 1H) 4,09 (с, 2H) 3,80 (с, 3H). Приклад 60: 2-(2-Фторбензил)-4,5-дигідроксіізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 2-(2-фторбензил)-4-гідрокси-5метоксіізофталонітрил (200 мг), одержаний із 2-бром-4-гідрокси-5-метоксіізофталонітрилу і 2-(2 24 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 фторбензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 86 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,27-7,34 (м, 2H) 7,16-7,24 (м, 1H) 7,13 (т, J=7,53 Гц, 1H) 6,95 (т, J=7,53 Гц, 1H) 4,17 (с, 2H). Приклад 61: 4,5-Дигідрокси-2-(2-метилбензил)ізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 4-гідрокси-5-метокси-2-(2метилбензил)ізофталонітрил (550 мг), одержаний із 2-бром-4-гідрокси-5-метоксіізофталонітрилу і 4,4,5,5-тетраметил-2-(2-метилбензил)-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 152 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,33 (с, 1H) 7,22 (д, J=7,07 Гц, 1H) 7,12 (д, J=7,07 Гц, 1H) 7,07 (д, J=7,58 Гц, 1H) 6,47 (д, J=7,58 Гц, 1H) 4,10 (с, 2H) 2,38 (с, 3H). Приклад 62: 2-(2,5-Диметилбензил)-4,5-дигідроксіізофтало-нітрил Використовуючи методику, аналогічну методиці Прикладу 54, (2,5-диметилбензил)-4гідрокси-5-метоксіізофталонітрил (578 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-(2,5-диметилбензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 39 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,33 (с, 1H) 7,10 (д, J=7,28 Гц, 1H) 6,93 (д, J=7,03 Гц, 1H) 6,28 (шир. с, 1H) 4,06 (шир. с, 2H) 2,32 (с, 3H) 2,13 (с, 3H). Приклад 63: 2-(3-Фтор-5-метилбензил)-4,5-дигідроксіізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 2-(3-фтор-5-метилбензил)-4гідрокси-5-метоксіізофталонітрил (600 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-(3-фтор-5-метилбензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 91 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,30 (с, 1H) 6,91 (д, J=9,79 Гц, 1H) 6,80 (с, 1H) 6,75 (д, J=9,79 Гц, 1H) 4,13 (с, 2H) 2,27 (с, 3H). Приклад 64: 3-(2,6-Диціано-3,4-дигідроксибензил)бензойна кислота Використовуючи методику, аналогічну методиці Прикладу 54, 3-(2,6-диціано-3-гідрокси-4метоксибензил)бензойну кислоту (300 мг), одержану із 2-бром-4-гідрокси-5метоксіізофталонітрилу і метил 3-((4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)метил)бензоату, деметилювали з одержанням названої сполуки. Вихід - 43 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,75 (с, 1H) 7,26-7,56 (м, 4H) 4,22 (с, 2H). Приклад 65: 2-(4-Фтор-3-метилбензил)-4,5-дигідроксіізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 2-(4-фтор-3-метилбензил)-4гідрокси-5-метоксіізофталонітрил (600 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-(4-фтор-3-метилбензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 24 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,29 (с, 1H) 7,03-7,12 (м, 2H) 6,99 (шир. с, 1H) 4,10 (шир. с, 2H) 2,19 (шир. с, 3H). Приклад 66: 4,5-Дигідрокси-2-(3-метилбензил)ізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 4-гідрокси-5-метокси-2-(3метилбензил)ізофталонітрил (600 мг), одержаний із 2-бром-4-гідрокси-5-метоксіізофталонітрилу і 4,4,5,5-тетраметил-2-(3-метилбензил)-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 43 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,57 (шир. с, 1H) 10,93 (шир. с, 1H) 7,29 (шир. с, 1H) 7,19 (шир. с, 1H) 6,79-7,09 (м, 3H) 4,11 (с, 2H) 2,26 (с, 3H). Приклад 67: 2-(5-Фтор-2-метоксибензил)-4,5-дигідроксі-ізофталонітрил Використовуючи методику, аналогічну методиці Прикладу 54, 2-(5-фтор-2-метоксибензил)-4гідрокси-5-метоксіізофталонітрил (400 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-(5-фтор-2-метоксибензил)-4,4,5,5-тетраметил-1,3,2-діокса-боролану, деметилювали з одержанням названої сполуки. Вихід - 7 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,09 (шир. с, 1H) 10,95 (шир. с, 1H) 7,29 (с, 1H) 6,92-7,11 (м, 2H) 6,55 (д, J=9,03 Гц, 1H) 4,06 (с, 2H) 3,79 (с, 3H). Приклад 68: 2-(3,5-Диметилбензил)-4,5-дигідроксіізофтало-нітрил Використовуючи методику, аналогічну методиці Прикладу 54, 2-(3,5-диметилбензил)-4гідрокси-5-метоксіізофталонітрил (578 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-(3,5-диметилбензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 120 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,30 (с, 1H) 6,86 (с, 1H) 6,76 (с, 2H) 4,07 (с, 2H) 2,21 (с, 6H). Приклад 69: 4,5-Дигідроксі-2-(4-ізопропілбензил)ізофтало-нітрил 25 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуючи методику, аналогічну методиці Прикладу 54, 4-гідроксі-2-(4ізопропілбензил)-5-метоксіізофталонітрил (600 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-(4-ізопропілбензил)-4,4,5,5-тетраметил-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 21 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,28 (с, 1H) 7,18 (д, J=1,00 Гц, 2H) 7,10 (д, J=1,00 Гц, 2H) 4,10 (с, 2H) 2,79-2,88 (м, 1H) 1,17 (д, J=6,78 Гц, 6H). Приклад 70: 2-(4-Етилбензил)-4,5-дигідроксіізофталонітрил 2-(4-Етилбензил)-4-гідрокси-5-метоксіізофталонітрил До суміші 2-бром-4-гідрокси-5-метоксіізофталонітрилу (2,57 г) і 2-(4-етилбензил)-4,4,5,5тетраметил-1,3,2-діоксаборолану (3,75 г) у етанолі (5 мл) і воді (40 мл) додавали комплекс Pd(dppf)Cl2 з CH2Cl2 (1:1) (0,67 г) і гідрокарбонат натрію (3,40 г). Перемішувану реакційну суміш кип'ятили зі зворотним холодильником протягом 3 годин. Гарячу реакційну суміш фільтрували через фільтр фірми Pall. Після охолодження отриманий осад підкисляли 2M HCl (20 мл), фільтрували, промивали водою і сушили з одержанням 2-(4-етилбензил)-4-гідрокси-5метоксіізофталонітрилу. Вихід - 2,31 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,41 (с, 1H) 7,08-7,17 (м, 4H) 4,08 (с, 2H) 3,82 (с, 3H) 2,55 (кв., J=7,61 Гц, 2H) 1,14 (т, J=7,53 Гц, 3H). 2-(4-Етилбензил)-4,5-дигідроксіізофталонітрил Використовуючи методику, описану в Прикладі 54, 2-(4-етилбензил)-4-гідрокси-5метоксіізофталонітрил (2,31 г) перетворювали в названу сполуку. Вихід - 2,15 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,28 (с, 1H) 7,12-7,17 (м, 2H) 7,07-7,12 (м, 2H) 4,11 (с, 2H) 2,53-2,59 (м, 2H) 1,14 (т, J=7,65 Гц, 3H). Приклад 71: 4,5-Дигідрокси-2-(нафталін-1-ілметил)ізофтало-нітрил Використовуючи методику, аналогічну методиці Прикладу 54, 4-гідрокси-5-метокси-2(нафталін-1-ілметил)ізофталонітрил (100 мг), одержаний із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 4,4,5,5-тетраметил-2-(нафталін-1-ілметил)-1,3,2-діоксаборолану, деметилювали з одержанням названої сполуки. Вихід - 40 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 8,50-6,50 (м, 8H) 4,72 (м, 2H). Приклад 72: 5-(2,6-Диціано-3,4-дигідроксибензил)-2-гідроксибензойна кислота Використовуючи методику, аналогічну методиці Прикладу 54, 5-(2,6-диціано-3-гідрокси-4метоксибензил)-2-гідроксибензойну кислоту (300 мг), одержану із 2-бром-4-гідрокси-5метоксіізофталонітрилу і 2-гідрокси-5-((4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)метил)бензойної кислоти, деметилювали з одержанням названої сполуки. Вихід - 38 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,29-11,80 (м, 1H) 10,95 (шир. с, 1H) 7,33 (с, 1H) 7,10 (д, J=7,78 Гц, 1H) 6,93 (д, J=7,78 Гц, 1H) 6,27 (с, 1H) 4,06 (с, 2H).Приклад 73: 2-(2,4-Диметилбензил)-4,5-дигідроксіізофтало-нітрил 2-(2,4-Диметилбензил)-4-гідрокси-5-метоксіізофталонітрил До суміші 2-бром-4-гідрокси-5-метоксіізофталонітрилу (0,86 г) і 2-(2,4-диметилбензил)4,4,5,5-тетраметил-1,3,2-діоксаборолану (1,13 г) у етанолі (2,5 мл) і воді (22 мл) додавали комплекс Pd(dppf)Cl2 з CH2Cl2 (1:1) (0,21 г) і гідрокарбонат натрію (1,10 г). Перемішувану реакційну суміш кип'ятили зі зворотним холодильником протягом 3 годин. Гарячу реакційну суміш фільтрували через фільтр фірми Pall. Після охолодження отриманий осад підкисляли 2M HCl (10 мл), фільтрували, промивали водою і сушили з одержанням 2-(2,4-диметилбензил)-4гідрокси-5-метоксіізофталонітрилу. Вихід - 0,43 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,70 (с, 1H) 7,04 (с, 1H) 6,87 (д, J=7,78 Гц, 1H) 6,34 (д, J=7,78 Гц, 1H) 4,08 (с, 2H) 3,93 (с, 3H) 2,34 (с, 3H) 2,22 (с, 3H). 2-(2,4-Диметилбензил)-4,5-дигідроксіізофталонітрил Використовуючи методику, описану в Прикладі 54, 2-(2,4-диметилбензил)-4-гідрокси-5метоксіізофталонітрил (0,43 г) перетворювали в названу сполуку. Вихід - 0,40 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,31 (с, 1H) 7,02 (с, 1H) 6,86 (д, J=8,03 Гц, 1H) 6,34 (д, J=7,78 Гц, 1H) 4,04 (с, 2H) 2,33 (с, 3H) 2,21 (с, 3H). Приклад 74: 2-(3,6-Дигідро-2H-піран-4-іл)-4,5-дигідроксі-ізофталонітрил Розчин 3,6-Дигідро-2H-піран-4-боронової кислоти пінаколовий ефір (156 мг), біс(трифенілфосфін)паладію(II) хлорид (24 мг) і карбонат натрію (197 мг) у воді (2 мл) додавали до розчину 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг), етанолу (2 мл) і ацетонітрилу (2 мл). Реакційну суміш піддавали впливу мікрохвильового випромінювання протягом 15 хвилин при 130 °C. Реакційну суміш виливали в крижану воду і додавали 2M NaOH (15 мл) і толуол (20 мл). Суміш перемішували протягом напівгодини. Водну фазу промивали толуолом (20 мл) і потім підкисляли шляхом додавання 4M HCl (10 мл) при охолодженні. Продукт фільтрували, промивали водою і сушили з одержанням названої сполуки. Вихід - 133 мг. 26 UA 112697 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,26 (с, 1H) 5,95 (шир. с, 1H) 4,21 (д, J=2,51 Гц, 2H) 3,81 (т, J=5,14 Гц, 2H) 2,30-2,37 (м, 2H). Приклад 75: 2-Циклопентеніл-4,5-дигідроксіізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент 1циклопентенілборонової кислоти пінаколовий ефір (144 мг) замість 3,6-дигідро-2H-піран-4боронової кислоти пінаколового ефіру. Реакційні умови: 0,4 години при 130 °C. Вихід - 114 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,25 (с, 1H) 6,02 (шир. с, 1H) 2,60-2,76 (м, 2H) 2,10-2,30 (м, 2H) 1,92-2,08 (м, 2H). Приклад 76: (E)-3-(2,6-Диціано-3,4-дигідроксифеніл)акрилова кислота Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (500 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент 2(етоксикарбоніл)вінілборонової кислоти пінаколовий ефір (420 мг) замість 3,6-дигідро-2H-піран4-боронової кислоти пінаколового ефіру. Реакційні умови: 0,4 години при 150 °C. Вихід - 260 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,65 (д, J=16,31 Гц, 1H) 7,32 (с, 1H) 6,74 (д, J=16,06 Гц, 1H). Приклад 77: (E)-4,5-Дигідрокси-2-(3-метоксипроп-1-еніл)-ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент транс-3метокси-1-пропенілборонової кислоти пінаколовий ефір (147 мг) замість 3,6-дигідро-2H-піран-4боронової кислоти пінаколового ефіру. Реакційні умови: 30 хвилин при 130 °C. Вихід - 70 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,26 (с, 1H) 6,40-6,77 (м, 2H) 4,02-4,20 (м, 2H) 3,33 (с, 3H). Приклад 78: 4,5-Дигідрокси-2-(5-(морфолінометил)тіофен-2-іл)ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент 5(морфолінометил)-2-тіофенeборонової кислоти пінаколовий ефір (249 мг) замість 3,6-дигідро2H-піран-4-боронової кислоти пінаколового ефіру. Реакційні умови: 10 хвилин при 150 °C. Вихід - 80 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,48 (д, J=3,51 Гц, 1H) 7,45 (с, 1H) 7,36 (д, J=3,76 Гц, 1H) 4,64 (с, 2H) 3,87 (шир. с, 4H) 3,18 (шир. с, 4H). Приклад 79: 3,4-Дигідрокси-4’-(морфолін-4-карбоніл)біфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (300 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент (4(морфолін-4-карбоніл)феніл)боронової кислоти пінаколовий ефір (383 мг) замість 3,6-дигідро2H-піран-4-боронової кислоти пінаколового ефіру. Реакційні умови: 10 хвилин при 140 °C. Вихід - 120 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,99-8,12 (м, 2H) 7,58-7,68 (м, 2H) 7,37 (с, 1H) 3,16-3,74 (м, 4H). Приклад 80: 2-(5’-Гексил-2,2’-бітіофен-5-іл)-4,5-дигідроксіізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент 5’-гексил2,2’-бітіофен-5-боронової кислоти пінаколовий ефір (303 мг) замість 3,6-дигідро-2H-піран-4боронової кислоти пінаколового ефіру. Реакційні умови: 10 хвилин при 140 °C. Вихід - 22 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,33 (с, 1H) 7,30 (д, J=3,76 Гц, 1H) 7,27 (д, J=1,00 Гц, 1H) 7,20 (д, J=3,51 Гц, 1H) 6,84 (д, J=3,26 Гц, 1H) 2,80 (т, J=7,28 Гц, 2H) 1,58-1,68 (м, 2H) 1,23-1,39 (м, 6H) 0,81-0,91 (м, 3H). Приклад 81: 2-(1-Бензил-1H-піразол-4-іл)-4,5-дигідроксі-ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (300 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент 1-бензил4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол (317 мг) замість 3,6-дигідро-2Hпіран-4-боронової кислоти пінаколового ефіру. Реакційні умови: 10 хвилин при 140 °C. Вихід - 82 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 8,37 (с, 1H) 7,88 (с, 1H) 7,33-7,50 (м, 6H) 5,54 (с, 2H). Приклад 82: 2-(5-Гексилтіофен-2-іл)-4,5-дигідроксіізофтало-нітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетат (300 мг) за допомогою методики, аналогічної методиці Прикладу 74, використовуючи як реагент 5-гексил-2тіофенборонової кислоти пінаколовий ефір (355 мг) замість 3,6-дигідро-2H-піран-4-боронової кислоти пінаколового ефіру. Реакційні умови: 10 хвилин при 140 °C. Вихід - 40 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,31 (с, 1H) 7,14 (д, J=1,00 Гц, 1H) 6,93 (шир. с, 1H) 2,84 (т, J=7,15 Гц, 2H) 1,61-1,70 (м, 2H) 1,23-1,36 (м, 6H) 0,86 (шир. с, 3H). 27 UA 112697 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 83: (Z)-2-(Бут-2-еніл)-4,5-дигідроксіізофталонітрил цис-Кротилборонової кислоти пінаколовий ефір (99 мг), біс(трифенілфосфін)паладію(II) хлорид (29 мг) і карбонат натрію (133 мг) додавали в розчин 2-бром-4,5дигідроксіізофталонітрилу (100 мг), що містить етанол (1 мл), ацетонітрил (1 мл) і воду (1 мл) як розчинник. Реакційну суміш перемішували і піддавали впливу мікрохвильового випромінювання протягом 45 хвилин при 120 °C. Реакційну суміш фільтрували через целіт і виливали в крижану воду. Додавали 2M NaOH (15 мл) і толуол (20 мл). Суміш перемішували протягом півгодини. Водну фазу промивали два рази толуолом (20 мл) і підкисляли шляхом додавання 4M HCl, підтримуючи температуру при 0-5 °C. Твердий продукт фільтрували, промивали водою і толуолом і сушили. Вихід - 36,6 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,5 (с, 1H) 5,92 (дд, J=10,29, 5,77 Гц, 1H) 5,54 (дд, J=10,42, 5,65 Гц, 1H) 3,73-3,74 (д, J=5,00 Гц, 2H) 1,68 (д, J=5,02 Гц, 3H). Приклад 84: 4,5-Дигідрокси-2-(3-метилбут-2-еніл)ізофтало-нітрил 3-Метил-2-бутенілборонової кислоти пінаколовий ефір (392 мг), біс(трифенілфосфін)паладію(II) хлорид (47 мг) і карбонат натрію (426 мг) додавали в розчин 2бром-4,5-дигідроксіізофталонітрилу (320 мг), що містить етанол (5 мл), ацетонітрил (5 мл) і воду (5 мл) як розчинник. Реакційну суміш перемішували і піддавали впливу мікрохвильового випромінювання протягом 60 хвилин при 120 °C. Реакційну суміш фільтрували через целіт, і органічні розчинники випаровували. Додавали 0,1 M NaOH, і суміш промивали толуолом і EtOAc. Водну фазу підкисляли шляхом додавання HCl. Твердий продукт фільтрували, промивали водою і толуолом, і сушили. Вихід - 306 мг. 1 H ЯМР (400 МГц, DMSO-d6) d м. ч. 7,23 (с, 1H) 5,09 (т, J=7,03 Гц, 1H) 3,49 (д, J=7,03 Гц, 2H) 1,75 (с, 3H) 1,68 (с, 3H). Приклад 85: (E)-2-(Бут-2-еніл)-4,5-дигідроксіізофталонітрил Названу сполуку одержували з 2-бром-4,5-дигідроксіізофталонітрилу (100 мг), як описано в Прикладі 83, використовуючи транс-кротилборонової кислоти пінаколовий ефір (99 мг) замість цис-кротилборонової кислоти пінаколового ефіру. Реакційні умови: 60 хвилин при 120 °C. Вихід 30 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 7,5 (с, 1H) 5,92 (дд, J=10,29, 5,77 Гц, 1H) 5,56 (дд, J=10,42, 5,65 Гц, 1H) 3,73-3,75 (д, J=5,00 Гц, 2H) 1,72 (д, J=5,02 Гц, 3H). Приклад 86: 4,5-Дигідрокси-2-метилізофталонітрил До суміші 4-гідрокси-5-метокси-2-метилізофталонітрилу (565 мг), DCM (30 мл) і ацетонітрилу (30 мл) в атмосфері азоту додавали 1M розчин триброміду бору в DCM (6,0 мл) при -20 °C. Реакційну суміш підігрівали протягом ночі до кімнатної температури. Додавали воду (0,3 мл) до реакційної суміші, потім додавали метанол доти, поки реакційна суміш не ставала прозорою. Суміш випаровували досуха, і залишок піддавали хроматографії на силікагелі за допомогою суміші розчинників EtOAc/AcOH. Вихід - 0,27 г. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 10,97 (шир. с, 2H) 7,17 (с, 1H) 2,44 (с, 3H). Приклад 87: 4,5-Дигідрокси-2-(2-метилпроп-1-еніл)ізофтало-нітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (395 мг) за допомогою методу Прикладу 2, використовуючи 2-метилпропен-1-трибутилстанан (528 мг) замість фенілетинілтри-н-бутилолова. Вихід - 198 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,20 (шир. с, 2H) 7,27 (с, 1H) 6,20-6,26 (м, 1H) 1,92 (д, J=1,25 Гц, 3H) 1,62 (д, J=1,00 Гц, 3H). Приклад 88: 3,4-Дигідрокси-3’-метилбіфеніл-2,6-дикарбонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (352 мг) за допомогою методу Прикладу 2, використовуючи трибутил(м-толіл)станан (235 мг) замість фенілетинілтри-н-бутилолова. Вихід - 273 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,31 (шир. с, 2H) 7,37-7,44 (м, 1H) 7,29-7,36 (м, 2H) 7,217,29 (м, 2H) 2,38 (с, 3H). Приклад 89: 4,5-Дигідрокси-2-вінілізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (200 мг) за допомогою методу Прикладу 2, використовуючи трибутил(вініл)станан (255 мг) замість фенілетинілтри-н-бутилолова. Вихід - 50 мг. 1 H ЯМР (400 МГц, DMSO-d6) м. ч. 11,30 (шир. с, 2H) 7,28 (с, 1H) 6,83 (дд, J=17,57, 11,54 Гц, 1H) 6,03 (д, J=17,57 Гц, 1H) 5,78 (д, J=11,54 Гц, 1H). Приклад 90: 4,5-Дигідрокси-2-(проп-1-ен-2-іл)ізофталонітрил Названу сполуку одержували з 4-бром-3,5-диціано-1,2-фенілендіацетату (500 мг) за допомогою методу Прикладу 2, використовуючи 2-(трибутилстаніл)пропен (641 мг) замість фенілетинілтри-н-бутилолова. Вихід - 210 мг. 28
ДивитисяДодаткова інформація
Автори англійськоюAhlmark, Marko, Din Belle, David, Kauppala, Mika, Luiro, Anne, Pajunen, Taina, Pystynen, Jarmo, Tiainen, Eija, Vaismaa, Matti, Messinger, Josef
Автори російськоюАлмарк Марк, Дин Белл Девид, Кауппала Мика, Луйро Анне, Паюнен Тайна, Пюстюнен Ярмо, Тиайнен Эйя, Вайсмаа Матти, Мессингер Йозеф
МПК / Мітки
МПК: C07C 311/29, C07C 255/57, A61K 31/277, C07D 207/08, C07C 317/22, C07D 265/30, C07D 333/60, C07C 321/24, C07C 255/54, C07D 277/30, C07C 255/53, C07D 333/24, C07D 207/337
Мітки: інгібують, катехол-о-метилтрансферази, сполуки, активність
Код посилання
<a href="https://ua.patents.su/70-112697-spoluki-yaki-ingibuyut-aktivnist-katekhol-o-metiltransferazi.html" target="_blank" rel="follow" title="База патентів України">Сполуки, які інгібують активність катехол-о-метилтрансферази</a>
Попередній патент: Фрикційний диск
Наступний патент: Спектрометр з просторовим модулятором світла
Випадковий патент: Скіп шахтний












