Похідні індолу як агоністи рецептора s1p1
Номер патенту: 102508
Опубліковано: 25.07.2013
Автори: Ахмед Махмуд, Нортон Девід, Міатт Джеймс, Ріверз Дін Ендрю
Формула / Реферат
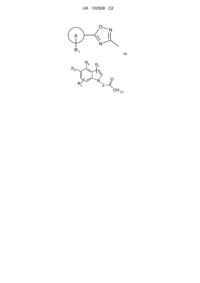
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
 , (І)
, (І)
де
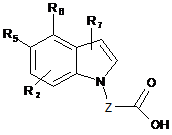
один з R5 і R6 являє собою водень або R2, а другий являє собою групу (а)
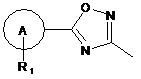 , (a)
, (a)
А являє собою феніл, тіоніл або піридил;
R1 являє собою водень або до трьох замісників, незалежно вибраних із групи, що містить галоген, С(1-6)алкіл, С(3-6)циклоалкіл, С(1-6)алкоксигрупу, С(3-6)циклоалкілоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил, ціаногрупу, нітрогрупу, необов'язково заміщений піперидин, необов'язково заміщений піролідин, необов'язково заміщений феніл і необов'язково заміщені 5- або 6-членні гетероарильні кільця;
коли R1 являє собою феніл, піперидин, піролідин або 5- або 6-членне гетероарильне кільце, він може бути заміщений аж до трьох замісниками, вибраними з групи, що містить галоген, С(1-6)алкіл, С(1-6)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, С(3-6)циклоалкіл, трифторметил і ціаногрупу;
R2 являє собою водень або до трьох замісників, незалежно вибраних із групи, що містить галоген, С(1-4)алкіл, С(1-4)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил і ціаногрупу;
R7 являє собою водень або галоген;
Ζ являє собою С(1-4)алкіл.
2. Сполука формули (І) або її фармацевтично прийнятна сіль, де:
R5 являє собою водень, і R6 являє собою групу (а); і/або
А являє собою тієніл, піридил або феніл; і/або
R1 являє собою до трьох замісників, вибраних із групи, що містить галоген, С(1-6)алкоксигрупу або трифторметил, необов'язково заміщений феніл, необов'язково заміщений циклогексил, ціаногрупу, трифторметоксигрупу, необов'язково заміщений піперидин, необов'язково заміщений піролідин, С1-6алкіл і NO2, і/або
R2 являє собою водень; і/або
R7 являє собою водень або галоген; і/або
Ζ являє собою С(1-4)алкіл.
3. Сполука, вибрана з:
3-(5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-[5-(5-{3-хлор-4[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-[3-хлор-5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-(3-хлор-5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-(4-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-[4-(5-{3-хлор-4-[(трифторметил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-[4-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-[4-(5-{5-хлор-6-[(1-метилетил)окси]-3-піридиніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
(5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)оцтової кислоти;
3-[3-бром-5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
5-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пентанової кислоти;
4-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]бутанової кислоти;
(2S)-3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]-2-метилпропанової кислоти;
2,2-диметил-3-(5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]-2,2,3-трифторпропанової кислоти;
4-[4-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]бутанової кислоти;
3-[5-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-[4-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-(4-{5-[2-(трифторметил)-4-біфеніліл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-(4-{5-[4-циклогексил-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-(4-{5-[4-[(1-метилетил)окси]-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
[4-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]оцтової кислоти;
[4-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]оцтової кислоти;
3-(4-{5-[2'-фтор-2-(трифторметил)-4-біфеніліл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
4-[4-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]бутанової кислоти;
4-[4-(5-{3-хлор-4-[(трифторметил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]бутанової кислоти;
4-[4-(5-{5-хлор-6-[(1-метилетил)окси]-3-піридиніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]бутанової кислоти;
4-(4-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)бутанової кислоти;
4-(4-{5-[2-(трифторметил)-4-біфеніліл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)бутанової кислоти;
3-(4-{5-[4-(метилокси)-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
4-{4-[5-(3-ціано-4-{[(1R)-1-метилпропіл]окси}феніл)-1,2,4-оксадіазол-3-іл]-1Н-індол-1-іл}бутанової кислоти;
4-{4-[5-(3-ціано-4-{[(1S)-1-метилпропіл]окси}феніл)-1,2,4-оксадіазол-3-іл]-1Н-індол-1-іл}бутанової кислоти;
3-(4-{5-[3-етил-4-(1-піперидиніл)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-{4-[5-(4-циклогексил-3-етилфеніл)-1,2,4-оксадіазол-3-іл]-1Н-індол-1-іл}пропанової кислоти;
3-(4-{5-[5-хлор-6-(1-піролідиніл)-3-піридиніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
4-[4-(5-{3-бром-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]бутанової кислоти;
4-(4-{5-[3-хлор-4-(2-метилпропіл)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)бутанової кислоти;
3-(4-{5-[4-(2-метилпропіл)-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
4-(4-{5-[3-ціано-4-(2-метилпропіл)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)бутанової кислоти;
4-{4-[5-(2-ціано-4-біфеніліл)-1,2,4-оксадіазол-3-іл]-1Н-індол-1-іл}бутанової кислоти;
3-(3-хлор-4-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-[3-хлор-5-(5-{3-хлор-4-[(трифторметил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-(3-хлор-5-{5-[3-хлор-4-(пропілокси)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-(3-хлор-5-{5-[3-хлор-4-(метилокси)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-(3-хлор-5-{5-[4-(метилокси)-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-(3-хлор-5-{5-[3-хлор-4-(етилокси)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-[3-хлор-5-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-(3-хлор-5-{5-[4-нітро-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-[3-хлор-5-(5-{4-хлор-3-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1Н-індол-1-іл]пропанової кислоти;
3-(3-хлор-5-{5-[6-(метилокси)-3-біфеніліл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти;
3-(5-{5-[6-(трифторметил)-3-біфеніліл]-1,2,4-оксадіазол-3-іл}-1Н-індол-1-іл)пропанової кислоти
і їх фармацевтично прийнятних солей.
4. Застосування сполуки за будь-яким з пп. 1-3 для лікування станів або розладів, опосередковуваних рецепторами S1P1.
5. Застосування за п. 4, де станом або розладом є розсіяний склероз, аутоімунні захворювання, хронічні запальні розлади, астма, запальні невропатії, артрит, трансплантація, хвороба Крона, виразковий коліт, червоний вовчак, псоріаз, ішемічне-реперфузійне ушкодження, солідні пухлини і пухлинні метастази, захворювання, пов'язані з ангіогенезом, судинні захворювання, стани болю, гострі вірусні захворювання, запальні стани кишечнику, інсулінозалежний та інсулінонезалежний діабет.
6. Застосування за п. 4, де станом є розсіяний склероз.
7. Застосування сполуки за будь-яким з пп. 1-3 для виробництва лікарського засобу для лікування станів або розладів, опосередковуваних рецепторами S1P1.
8. Застосування за п. 7, де станом або розладом є розсіяний склероз, аутоімунні захворювання, хронічні запальні розлади, астма, запальні невропатії, артрит, трансплантація, хвороба Крона, виразковий коліт, червоний вовчак, псоріаз, ішемічне-реперфузійне ушкодження, солідні пухлини і пухлинні метастази, захворювання, пов'язані з ангіогенезом, судинні захворювання, стани болю, гострі вірусні захворювання, запальні стани кишечнику, інсулінозалежний та інсулінонезалежний діабет.
9. Застосування за п. 7, де станом є розсіяний склероз.
10. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-3 та фармацевтично прийнятний носій.
Текст
Реферат: Даний винахід стосується сполук формули (І), де один з R5 і R6 являє собою водень або R2, і інший являє собою групу (а), способів їх одержання, фармацевтичних композицій, що їх містять, і їх застосування для лікування станів або розладів, що опосередковуються рецептором S1P1. R6 R5 R2 R7 N O Z OH (I) UA 102508 C2 (12) UA 102508 C2 O N A N R1 (a) UA 102508 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до нових похідних оксадіазолу, що володіють фармакологічною активністю, способів їх одержання, фармацевтичних композицій, що містять їх, і їх застосування для лікування різних розладів. Сфінгозин-1-фосфат (S1P) є біоактивним ліпідним медіатором, утвореним фосфорилюванням сфінгозину сфінгозинкіназами; його високі рівні знаходять у крові. Він продукується і секретується рядом типів клітин, включаючи клітини гемопоетичного походження, такі як тромбоцити і тучні клітини (Okamoto et al 1998 J Biol Chem 273(42):27104; Sanchez and Hla 2004, J Cell Biochem 92:913). Він має широкий діапазон біологічних ефектів, включаючи регуляцію проліферації, диференціації, рухливості клітин, регуляцію васкуляризації й активацію клітин вогнища запалення і тромбоцитів (Pyne and Pyne 2000, Biochem J. 349: 385). Описано п'ять підтипів рецепторів, чутливих до S1P: S1P1 (Edg-1), S1P2 (Edg-5), S1P3 (Edg-3), S1P4 (Edg-6) і S1P5 (Edg-8), що утворюють частину сімейства рецепторів гена ендотеліальної диференціації, зв'язаного з G-білком (Chun et al 2002 Pharmacological Reviews 54:265, Sanchez and Hla 2004 J Cellular Biochemistry, 92:913). Ці п'ять рецепторів показують різну експресію мРНК; причому найбільш широко експресований S1P1-3; S1P4 експресований у лімфоїдних і кровотворних тканинах, і S1P5 експресований, насамперед у мозку й у меншому ступені в селезінці. Вони передають сигнали через різні підгрупи G-білків, викликаючи різні біологічні реакції (Kluk and Hla 2002 Biochim et Biophysica Acta 1582:72, Sanchez and Hla 2004, J Cellular Biochem 92:913). Передбачувані ролі для рецептора S1P1 включають міграцію лімфоцитів, індукцію/супресію цитокінів і ефекти на ендотеліальні клітини (Rosen and Goetzl 2005 Nat Rev Immunol. 5:560). Агоністи рецептора S1P1 застосовували в ряді аутоімунних і трансплантаційних моделей тварин, включаючи моделі розсіяного склерозу, засновані на експериментальному аутоімунному енцефаломієліті (ЕАЕ), для ослаблення важкості індукованого захворювання (Brinkman et al 2003 JBC 277:21453; Fujino et al 2003 J Pharmacol Exp Ther 305:70; Webb et al 2004 J Neuroimmunol 153:108; Rausch et al 2004 J Magn Reson Imaging 20:16). Повідомлялося, що така активність опосередковується ефектом агоністів S1P1 на циркуляцію лімфоцитів через систему лімфи. Обробка агоністами S1P1 приводить до секвестрації лімфоцитів у вторинних лімфоїдних органах, таких як лімфатичні вузли, викликаючи оборотну периферійну лімфопенію на моделях тварин (Chiba et al 1998, J Immunology 160:5037, Forrest et al 2004 J Pharmacol Exp Ther 309:758; Sanna et al 2004 JBC 279:13839). Опубліковані дані про агоністи свідчать, що обробка даними сполуками викликає зникнення рецептора S1P1 з поверхні клітин за допомогою інтерналізації (Graler and Goetzl 2004 FASEB J 18:551; Matloubian et al 2004 Nature 427:355; Jo et al 2005 Chem Biol 12:703) і що саме це зменшення кількості рецепторів S1P1 на імунних клітинах вносить свій внесок у зменшення виходу Т-клітин з лімфатичних вузлів назад у кровоток. Делеція гена S1P1 викликає загибель ембріону. Експерименти по дослідженню ролі рецептора S1P1 у міграції лімфоцитів і їхньому транспорті включали адоптивне перенесення мічених S1P1-дефіцитних Т-клітин в опромінених мишей дикого типу. Ці клітини показали знижений вихід із вторинних лімфоїдних органів (Matloubian et al 2004 Nature 427:355). Рецепторові S1P1 також приписували роль у модулюванні контактів ендотеліальних клітин (Allende et al 2003 102:3665, Blood; Singelton et al 2005 FASEB J 19:1646). У відношенні такої ендотеліальнї дії повідомляли, що агоністи S1P1 чинять деякий ефект на ізольовані лімфатичні вузли, який може вносити визначений вклад у їхню роль, модулюючу імунні розлади. Агоністи S1P1 викликали закриття ендотеліальних стромальних "воріт" лімфатичних синусів, що дренують лімфатичні вузли і запобігають виходу лімфоцитів (Wei wt al 2005, Nat. Immunology 6:1228). Було показано, що імуносупресивна сполука FTY720 (JP1 1080026-A) знижує рівень циркулюючих лімфоцитів у тварин і людини, володіє модулюючою активністю при захворюваннях на моделях імунних розладів у тварин і знижують ступінь ремісії при рецидивуючому перемежованому розсіяному склерозі (Brinkman et al 2002 JBC 277: 21453, Mandala et al 2002 Science 296:346, Fujino et al 2003 J Pharmacology and Experimental Therapeutics 305: 45658, Brinkman et al 2004 American J Transplantation 4: 1019, Webb et al 2004 J Neuroimmunology 153: 108, Morris et al 2005 Eur J Immunol 35: 3570, Chiba 2005 Pharmacology and Therapeutics 108: 308, Kahan et al 2003, Transplantation 76: 1079, Kappos et al 2006 New Eng J Medicine 335:1124). Дана сполука є проліками, які фосфорилюються in vivo сфінгозинкіназами, утворюючи молекулу, що має активність агоніста рецепторів S1P1, S1P3, S1P4 і S1P5. Клінічні дослідження продемонстрували, що лікування сполукою FTY720 приводить до брадикардії протягом перших 24 годин лікування (Kappos et al 2006 New Eng J Medicine 335:1124). Ґрунтуючись на ряді експериментів, проведених на клітинах і з тваринами, вважають, що 1 UA 102508 C2 5 10 15 20 25 30 35 40 45 брадикардія є наслідком агонізму рецептора S1P3. Дані експерименти включають використання тварин з нокаутованим S1P3, що, на відміну від мишей дикого типу, не демонстрували брадикардії після введення FTY720, і застосування S1P1-селективних сполук. (Hale et al 2004 Bioorganic and Medicinal Chemistry Letters 14:3501, Sanna et al 2004 JBC 279:13839, Koyrakh et al 2005 American J Transplantation 5:529). Тому існує потреба в сполуках, що є агоністами рецептора S1P1, селективність яких у відношенні даного рецептора перевищує їх селективність у відношенні рецептора S1P3, від яких можна було б очікувати зниженої тенденції до індукції брадикардії. Наступні патентні заявки описують похідні оксадіазолу як агоністи S1P1: WO03/105771, WO05/058848, WO06/047195, WO06/100633, WO06/115188, WO06/131336, WO07/024922 і WO07/116866. Наступна патентна заявка описує похідні індолоксадіазолу як засоби проти пікорнавірусів: WO96/009822. Наступні патентні заявки описують похідні індолкарбонових кислот як антагоністів рецепторів лейкотрієнів, пестицидів і агрохімічних фунгіцидів, відповідно: WO06/090817, EP 0439785 і DE 3939238. В даний час знайдений структурно новий клас сполук, що надає агоністів рецептора S1P1. Таким чином, даний винахід надає сполуки (I) або їх фармацевтично прийнятну сіль де один з R5 і R6 являє собою водень або R2, і інший являє собою групу (а) A являє собою феніл або 5- або 6-членне гетероарильне кільце; R1 являє собою водень або до трьох замісників, незалежно обраних з групи, що включає галоген, C(1-6)алкіл, C(3-6)циклоалкіл, C(1-6)алкоксигрупу, C(3-6)циклоалкілоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил, ціаногрупу, нітрогрупу, необов'язково заміщений піперидин, необов'язково заміщений піролідин, необов'язково заміщений феніл і необов'язково заміщені 5- або 6-членні гетероарильні кільця; коли R1 являє собою феніл, піперидин, піролідин або 5- або 6-членне гетероарильне кільце, він може бути заміщений аж до трьох замісниками, обраними з групи, що включає галоген, C (1C(1-6)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, C 3-6циклоалкіл, 6)алкіл, трифторметил і ціаногрупу; R2 являє собою водень або до трьох замісників, незалежно обраних із групи, що включає галоген, C(1-4)алкіл, C(1-4)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил і ціаногрупу; R7 являє собою або галоген; Z являє собою C(1-4)алкіл, що необов'язково перерваний N або O і необов'язково заміщений галогеном або метилом. В одному варіанті здійснення, коли A являє собою феніл або піридил, R 1 являє собою два замісники в пара- і метаположеннях на А відносно кільця оксадіазолу. В одному варіанті здійснення, коли A являє собою тієніл, R1 являє собою два замісники в положеннях 4 і 5. В одному варіанті здійснення дійсного винаходу R5 являє собою водень, і R6 являє собою групу (a); і/або A являє собою тієніл, піридил або феніл; і/або R1 являє собою до трьох замісників, обраних із групи, що включає галоген, C 1-6алкоксигрупу або трифторметил, необов'язково заміщений феніл, необов'язково заміщений циклогексил, 2 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 ціаногрупу, трифторметоксигрупу, необов'язково заміщений піперидин, необов'язково заміщений піролідин, C1-6алкіл і NO2; і/або R2 являє собою водень; і/або R7 являє собою водень або галоген; і/або Z являє собою C(1-4)алкіл, що необов'язково перерваний N або O і необов'язково заміщений фтором або метилом. В одному варіанті здійснення дійсного винаходу R5 являє собою водень, і R6 являє собою групу (a); і/або A являє собою піридил або феніл; і/або R1 являє собою до двох замісників, обраних із групи, що включає галоген, C 1-6алкоксигрупу або трифторметил, необов'язково заміщений феніл, необов'язково заміщений циклогексил, ціаногрупу, трифторметоксигрупу, необов'язково заміщений піперидин, необов'язково заміщений піролідин, C1-6алкіл і NO2; і/або R2 являє собою водень; і/або R7 являє собою водень, хлор або бром; і/або Z являє собою незаміщений C(2-3)алкіл. В одному варіанті здійснення дійсного винаходу R5 являє собою водень, і R6 являє собою групу (а); і/або A являє собою піридил або феніл; і/або R1 являє собою до двох замісників, обраних із групи, що включає хлор, бром, метоксигрупу, пропоксигрупу, ізопропоксигрупу, трифторметил, галоїдозаміщений феніл, феніл, циклогексил, ціаногрупу, трифторметоксигрупу, піперидин, піролідин, етил або NO 2; і/або R2 являє собою водень; і/або R7 являє собою водень, хлор або бром; і/або Z являє собою незаміщений C(2-3)алкіл. В одному варіанті здійснення дійсного винаходу R5 являє собою водень, і R6 являє собою групу (а); і/або A являє собою піридил або феніл; і/або R1 являє собою до двох замісників, обраних із хлору, ізопропоксигрупи і ціаногрупи; і/або R2 являє собою водень; і/або R7 являє собою водень; і/або Z являє собою незаміщений C(2-3)алкіл. В одному варіанті здійснення дійсного винаходу R5 являє собою групу (a), і R6 являє собою водень. A являє собою необов'язково заміщений тіофен або феніл; і/або R1 являє собою водень, галоген, C1-4алкоксигрупу або трифторметил; і/або R2 являє собою водень; і/або Z являє собою етилен. В іншому варіанті здійснення дійсного винаходу R5 являє собою групу (а), і R6 являє собою водень; і/або A являє собою тіофен, заміщений фенілом; і/або R1 являє собою водень, галоген, C1-4алкоксигрупу або трифторметил; і/або R2 являє собою водень; і/або Z являє собою етилен. Коли R1 являє собою феніл або 5- або 6-членне гетероарильне кільце, він може бути заміщений аж до трьох замісниками, обраними з групи, що включає галоген, C(1-4)алкіл, C(14)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил і ціаногрупу. Даний винахід тому також надає сполуки формули (IA) або їх фармацевтично прийнятну сіль де: один з R5 і R6 являє собою водень або R2, і інший являє собою групу (а) 3 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 55 A являє собою феніл або 5- або 6-членне гетероарильне кільце; R1 являє собою водень або до трьох замісників, незалежно обраних із групи, що включає галоген, C(1-4)алкіл, C(1-4)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил, ціаногрупу, необов'язково заміщений феніл і необов'язково заміщені 5- або 6членні гетероарильні кільця; R2 являє собою водень або до трьох замісників, незалежно обраних із групи, що включає галоген, C(1-4)алкіл, C(1-4)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил і ціаногрупу; R3, R3', R4 і R4', кожен незалежно, обраний з водню, галогену і метилу; R7 являє собою водень або галоген; X являє собою NH, необов'язково заміщений метилом, O, CH 2, необов'язково заміщений фтором або метилом, або прямий зв'язок; m дорівнює 0-2; і n дорівнює 0-4. Коли R1 являє собою феніл або 5- або 6-членне гетероарильне кільце, він може бути заміщений аж до трьох замісниками, обраними з групи, що включає галоген, C (1-4)алкіл, C(14)алкоксигрупу, трифторметоксигрупу, дифторметоксигрупу, трифторметил і ціаногрупу. Коли Х являє собою NH, він може бути заміщений метилом. Коли Х являє собою CH2, він може бути заміщений фтором або метилом. В одному варіанті здійснення дійсного винаходу A являє собою необов'язково заміщений тіофен або феніл; R1 являє собою водень, галоген, C1-4алкоксигрупу або трифторметил; R2, R3 і R4, кожний являє собою водень; X являє собою прямий зв'язок; m дорівнює 2; і n дорівнює 0. В іншому варіанті здійснення дійсного винаходу A являє собою тіофен, заміщений фенілом; R1 являє собою водень, галоген, C1-4алкоксигрупу або трифторметил; R2, R3 і R4, кожний являє собою водень; X являє собою прямий зв'язок; m дорівнює 2; і n дорівнює 0. Термін "алкіл" як група або частина групи, наприклад, алкоксигрупи або гідроксіалкілу, відноситься до прямої або розгалуженої алкільної групи у всіх ізомерних формах. Термін "C (16)алкіл" відноситься до алкільної групи, як визначено вище, що містить щонайменше 1 і щонайбільше 6 атомів вуглецю. Приклади таких алкільних груп включають метил, етил, пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил або трет-бутил. Приклади таких алкоксигруп включають метоксигрупу, етоксигрупу, пропоксигрупу, ізопропоксигрупу, бутоксигрупу, ізобутоксигрупу, втор-бутоксигрупу і трет-бутоксигрупу. Підходящі C(3-6)циклоалкільні групи включають циклопропіл, циклобутил, циклопентил і циклогексил. Підходящі C(3-6)циклоалкілоксигрупи включають циклопропоксигрупу, циклобутоксигрупу, циклопентоксигрупу і циклогексилоксигрупу. Використовуваний у дійсному описі термін "галоген" відноситься до фтору (F), хлору (Cl), брому (Br) або йоду (I), і термін "галоїд" відноситься до галогену (як замісника): фтор- (-F), хлор(-Cl), бром- (-Br) і йод- (-I). Термін "гетероарил" представляє ненасичене кільце, що містить один або більше гетероатомів. Коли термін "гетероарил" представляє 5-членну групу, вона містить гетероатом, обраний з O, N або S, і може необов'язково містити додатково від 1 до 3 атомів азоту. Коли гетероарил являє собою 6-членну групу, вона містить від 1 до 3 атомів азоту. Приклади таких 5або 6-членних гетероарильних кілець включають піроліл, триазоліл, тіадіазоліл, тетразоліл, імідазоліл, піразоліл, ізотіазоліл, тіазоліл, ізоксазоліл, оксазоліл, оксадіазоліл, фуразаніл, фураніл, тієніл, піридил, піримідиніл, піразиніл, піридазиніл і триазиніл. 4 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 55 У деяких сполуках формули (I), залежно від природи замісника, маються хіральні атоми вуглецю, і тому сполуки формули (I) можуть існувати у вигляді стереоізомерів. Даний винахід поширюється на всі оптичні ізомери, такі як стереоізомерні форми сполук формули (I), включаючи енантіомери, діастереомери і їх суміші, такі як рацемати. Різні стереоізомерні форми можна розділити або відокремити одну від іншої традиційними способами, або даний ізомер можна одержати традиційним стереоселективним або асиметричним синтезом. Деякі сполуки згідно із дійсним винаходом можуть існувати в різних таутомерних формах, і варто розуміти, що даний винахід охоплює всі такі таутомерні форми. Підходящими сполуками згідно із дійсним винаходом є: 3-(5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]пропанова кислота; 3-[3-хлор-5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]пропанова кислота; 3-(3-хлор-5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 3-(4-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-[4-(5-{3-хлор-4-[(трифторметил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]пропанова кислота; 3-[4-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]пропанова кислота; 3-[4-(5-{5-хлор-6-[(1-метилетил)окси]-3-піридиніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]пропанова кислота; 3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]пропанова кислота; (5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)оцтова кислота; 3-[3-бром-5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]пропанова кислота; 5-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]пентанова кислота; 4-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]бутанова кислота; 4-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]бутанова кислота; (2S)-3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]-2метилпропанова кислота; 2,2-диметил-3-(5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]-2,2,3трифторпропанова кислота; 4-[4-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]бутанова кислота; 3-[5-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]пропанова кислота; 3-[4-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]пропанова кислота; 3-(4-{5-[2-(трифторметил)-4-біфеніліл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-(4-{5-[4-циклогексил-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 3-(4-{5-[4-[(1-метилетил)окси]-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; [4-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]оцтова кислота; [4-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]оцтова кислота; 5 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 55 60 3-(4-{5-[2'-фтор-2-(трифторметил)-4-біфеніліл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 4-[4-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]бутанова кислота; 4-[4-(5-{3-хлор-4-[(трифторметил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]бутанова кислота; 4-[4-(5-{5-хлор-6-[(1-метилетил)окси]-3-піридиніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]бутанова кислота; 4-(4-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)бутанова кислота; 4-(4-{5-[2-(трифторметил)-4-біфеніліл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)бутанова кислота; 3-(4-{5-[4-(метилокси)-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 4-{4-[5-(3-ціано-4-{[(1R)-1-метилпропіл]окси}феніл)-1,2,4-оксадіазол-3-іл]-1H-індол-1іл}бутанова кислота; 4-{4-[5-(3-ціано-4-{[(1S)-1-метилпропіл]окси}феніл)-1,2,4-оксадіазол-3-іл]-1H-індол-1іл}бутанова кислота; 3-(4-{5-[3-етил-4-(1-піперидиніл)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-{4-[5-(4-циклогексил-3-етилфеніл)-1,2,4-оксадіазол-3-іл]-1H-індол-1-іл}пропанова кислота; 3-(4-{5-[5-хлор-6-(1-піролідиніл)-3-піридиніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 4-[4-(5-{3-бром-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1-іл]бутанова кислота; 4-(4-{5-[3-хлор-4-(2-метилпропіл)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)бутанова кислота; 3-(4-{5-[4-(2-метилпропіл)-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 4-(4-{5-[3-ціано-4-(2-метилпропіл)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)бутанова кислота; 4-{4-[5-(2-ціано-4-біфеніліл)-1,2,4-оксадіазол-3-іл]-1H-індол-1-іл}бутанова кислота; 3-(3-хлор-4-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 3-[3-хлор-5-(5-{3-хлор-4-[(трифторметил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]пропанова кислота; 3-(3-хлор-5-{5-[3-хлор-4-(пропілокси)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-(3-хлор-5-{5-[3-хлор-4-(метилокси)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-(3-хлор-5-{5-[4-(метилокси)-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 3-(3-хлор-5-{5-[3-хлор-4-(етилокси)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-[3-хлор-5-(5-{3-ціано-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]пропанова кислота; 3-(3-хлор-5-{5-[4-нітро-3-(трифторметил)феніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропанова кислота; 3-[3-хлор-5-(5-{4-хлор-3-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]пропанова кислота; 3-(3-хлор-5-{5-[6-(метилокси)-3-біфеніліл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-(5-{5-[6-(трифторметил)-3-біфеніліл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-{5-[5-(4-феніл-2-тієніл)-1,2,4-оксадіазол-3-іл]-1H-індол-1-іл}пропанова кислота; 3-{3-хлор-5-[5-(4-циклогексилфеніл)-1,2,4-оксадіазол-3-іл]-1H-індол-1-іл}пропанова кислота; 3-(3-хлор-5-{5-[6-(4-фторфеніл)-3-піридиніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота; 3-(3-хлор-5-{5-[6-(4-фторфеніл)-3-піридиніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1-іл)пропанова кислота або їх фармацевтично прийнятні солі. 6 UA 102508 C2 5 10 15 20 25 30 35 40 Фармацевтично прийнятні похідні сполук формули (I) включають будь-яку фармацевтично прийнятну сіль, складний ефір або сіль такого складного ефіру сполуки формули (I), які після введення реципієнтові здатні надавати (прямо або побічно) сполуку формули (I) або її активний метаболіт або залишок. Сполуки формули (I) можуть утворювати солі. Варто розуміти, що для застосування в медицині солі сполук формули (I) повинні бути фармацевтично прийнятними. Підходящі фармацевтично прийнятні солі відомі фахівцям у даній галузі; вони включають солі, описані в J. Pharm. Sci, 1977, 66, 1-19, такі як кислотно-адитивні солі, утворені неорганічними кислотами, наприклад, хлористоводневою, бромистоводневою, сірчаною, азотною або фосфорною кислотою; і органічними кислотами, наприклад, бурштиновою, малеїновою, оцтовою, фумаровою, лимонною, винною, бензойною п-толуолсульфоновою, метансульфоновою або нафталінсульфоновою кислотою. Деякі сполуки формули (I) можуть утворювати кислотноадитивні солі з одним або більше еквівалентами кислоти. Даний винахід включає у свій обсяг усі можливі стехіометричні і нестехіометричні форми. Солі можна також одержати з фармацевтично прийнятних основ, включаючи неорганічні основи й органічні основи. Солі, що є похідними неорганічних основ, включають солі алюмінію, амонію, кальцію, міді, заліза (III), заліза (II), літію, магнію, марганцю, калію, натрію, цинку і т.п. Солі, що є похідними фармацевтично прийнятних органічних основ, включають солі первинних, вторинних і третинних амінів; заміщених амінів, включаючи природні заміщені аміни; і циклічні аміни. Конкретні фармацевтично прийнятні органічні основи включають аргінін, бетаїн, кофеїн, холін, N, N’-дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетил, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, прокаїн, пурини, теобромін, триметиламін, триметиламін, трипропіламін, тріс(гідроксиметил)амінометан (TRIS, трометанол) і т.п. Солі також можуть бути утворені з іонообмінних смол основних іонів, наприклад, поліамінових смол. Коли сполука згідно із дійсним винаходом є основною, солі можна одержати з фармацевтично прийнятних кислот, включаючи неорганічні й органічні кислоти. Такі кислоти включають оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, етансульфонову, етандисульфонову, фумарову, глюконову, глутамову, бромистоводневу, хлористоводневу, ізетіонову, молочну, малеїнову, яблучну, мигдальну, метансульфонову, слизьову, памову, пантотенову, фосфорну, пропіонову, бурштинову, сірчану, винну, п-толуолсульфонову кислоту і т.п. Сполуки формули (I) можна одержати в кристалічній або некристалічній формі, і, якщо вони є кристалічними, вони необов'язково можуть бути гідратованими або сольватованими. Даний винахід включає у свій обсяг стехіометричні гідрати або сольвати, а також сполуки, що містять перемінні кількості води і/або розчинника. В обсяг дійсного винаходу включені всі солі, сольвати, гідрати, комплекси, поліморфи, проліки, радіоактивно мічені похідні, стереоізомерий оптичні ізомери сполук формули (I). У наступному аспекті даний винахід надає способи одержання сполуки формули (I). В одному аспекті сполуку формули (I) можна одержати за допомогою способу, представленого на схемі I, де А, Z, R1, R2, R7 є такими, як визначено у формулі (I). Схема I 7 UA 102508 C2 5 10 15 20 25 30 Першу стадію процесу (сполуку II у сполуку III) проводять у підходящому розчиннику, такому як метанол або етанол, і нагрівають до такої температури, як 50-80 °C. На другій стадії процесу (сполуку III у сполуку V) підходящі реагенти включають EDC∙ HCl і HOBt у розчиннику, такому як ДМФА, при температурі в діапазоні від кімнатної до 90 °C або, альтернативно, з PyBOP у ДМФА. Альтернативно, сполуку (III) можна перетворити в сполуку (V) обробкою складним ефіром карбонової кислоти сполуки (IV) і етоксидом натрію в етанолі в мікрохвильовому реакційному нагрівачі при такій температурі, як 120 °C. На третій стадії (сполуку V у сполуку VII) використовують основу, таку як карбонат цезію або, альтернативно, карбонат калію, і реакційну суміш нагрівають або традиційним чином, або використовуючи мікрохвильовий реактор, до такої температури, як 140 °C. Четверту стадію процесу (сполуку VII у сполуку I) проводять у підходящому розчиннику, такому як метанол або, альтернативно, етанол; її можна також проводити або при кімнатній температурі, або при підвищеній температурі, такій як 40 або 50 °C. Сполуки формули (IV) є або комерційно доступними, або можуть бути одержані із застосуванням способів, описаних у літературі, або можуть бути одержані, як описано в експериментальному розділі. Броміди формули (VI) є або комерційно доступними, або можуть бути одержані із застосуванням способів, описаних у літературі, або способами, розкритими в дійсному описі. В іншому препаративному аспекті сполука формули (I) може бути одержана способом, представленим на схемі II, де A, Z, R1, R2, R7 є такими, як визначено у формулі (I). На першій стадії реакцію (сполуку II у сполуку VIII) можна нагрівати до 80 °C. Другу стадію процесу (сполуку VIII у сполуку IX) проводять у підходящому розчиннику, такому як етанол або метанол. Третя стадія даного процесу (сполуку IX у сполуку VII) вимагає реагенти амідної конденсації, такі як EDC∙ HCl і HOBt, у розчиннику, такому як ДМФА, при температурі в діапазоні від кімнатної температури до 120 °C. Четверту стадію процесу проводять у підходящому розчиннику, такому як етанол або метанол. Сполуки формули (IV) є або комерційно доступними, або можуть бути одержані із застосуванням способів, описаних у літературі, або можуть бути одержані так, як описано в експериментальному розділі. Броміди формули VI є або комерційно доступними, або можуть бути одержані із застосуванням способів, описаних у літературі, або способів, розкритих у дійсному описі. Схема II 8 UA 102508 C2 5 10 15 У випадках, коли замісник R7 у формулі (I) є атомом хлору, приєднаним до C-3 індольного кільця, його можна ввести декількома шляхами. Проміжну сполуку (V) на схемі I, де R 7 є Н і R1, R2 і A є такими, як визначено у формулі (I), можна обробляти N-хлорсукцинімідом у дихлорметані з утворенням 3-хлор-заміщеної сполуки (Va), яку потім можна перетворити в сполуку (I), як описано на схемі I (схема III) Схема III Альтернативно, проміжну сполуку (II), де R7 є Н, можна хлорувати шляхом обробки Nхлорсукцинімідом в ДМФА з утворенням 3-хлоріндолу (IIa), який можна перетворити в сполуку структури (I), як описано на схемі II (схема IV). Схема IV коли R7=Br, проміжна сполука (V), де R7 є Н. і A, R1 і R2 є такими, як визначено у формулі (I), може бути бромована шляхом обробки бромом (Br2) у ДМФА з утворенням (Vb), де R7 є Br (схема V). Схема V 9 UA 102508 C2 5 10 15 20 25 30 У випадках, де R1 являє собою фенільну групу, дану групу можна ввести за реакцією перехресного сполучення сполуки структури VII з утворенням сполуки VIIa (схема VI), де A, Z, R2 і R7 є такими, як визначено у формулі (I), і Ar являє собою необов'язково заміщений феніл, з наступним гідролізом до сполуки I. У даному перетворенні М являє собою групу, таку як B(OH) 2, що уможливлює здійснення реакції перехресного сполучення, Y являє собою групу, таку як бром, йод або трифторметансульфонат, і каталізатор являє собою паладієвий каталізатор, такий як тетракистрифенілфосфінпаладій(0). Такі реакції звичайно проводять при підвищеній температурі. Схема VI У випадках, де R1 являє собою алкоксигрупу, таку як O-етил або O-ізопропіл, алкільний замісник можна ввести в сполуку формули VII, де R1 означає OH, і A, Z, R7 і R2 є такими, як визначено у формулі (I), з утворенням сполуки формули VIIb, де R 1 означає O-алкіл (схема VII). У цьому випадку, Y являє собою галоген, такий як йод. Реакцію можна проводити в полярному розчиннику, такому як ДМФА, у присутності основи, такої як карбонат калію. Схема VII У деяких випадках можна алкілувати проміжний індол (V), де R 1, R2, R7 і A є такими, як визначено у формулі (I), безпосередньо алкілбромідом, заміщеним карбоновою кислотою, з утворенням кінцевої сполуки (I), не прибігаючи до стадії гідролізу (схема VIII). Підходящою основою для такого перетворення є карбонат цезію. Схема VIII Фармацевтично прийнятні солі можна одержати традиційним способом за реакцією з відповідною кислотою або похідною кислоти. Силу й ефективність сполук згідно із дійсним винаходом для рецептора S1P1 можна визначити за допомогою GTPγS-тесту, проведеного з клонованим людським рецептором, або за допомогою тесту зв'язування дріжджів, також описаних у дійсному описі. Сполуки формули (I) продемонстрували активність агоністів рецептора S1P1 у функціональних дослідженнях, описаних у дійсному описі. 10 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки формули (I) і їх фармацевтично прийнятні солі тому можна застосовувати для лікування станів або розладів, опосередковуваних рецептором S1P1. Зокрема, сполуки формули (I) і їх фармацевтично прийнятні солі можна застосовувати для лікування розсіяного склерозу, аутоімунних захворювань, хронічних запальних розладів, астми, запальних невропатій, артриту, трансплантації, хвороби Крона, виразкового коліту, червоного вовчаку, псоріазу, ішемічного-реперфузійного ушкодження, солідних пухлин і метастазів пухлин, захворювань, пов'язаних з ангіогенезом, судинних захворювань, станів болю, гострих вірусних захворювань, запальних станів кишечнику, інсулінзалежного та інсуліннезалежного діабету (далі в дійсному описі називаних "розладами згідно із дійсним винаходом"). Варто розуміти, що використовуваний у дійсному описі термін "лікування" включає і профілактику, а також ослаблення встановлених симптомів. Таким чином, даний винахід також надає сполуку формули (I) або її фармацевтично прийнятну сіль для застосування як лікарського засобу, зокрема, для лікування станів або розладів, опосередковуваних рецептором S1P1. Зокрема, даний винахід надає сполуку формули (I) або її фармацевтично прийнятну сіль для застосування як лікарського засобу для лікування розсіяного склерозу, аутоімунних захворювань, хронічних запальних розладів, астми, запальних невропатій, артриту, трансплантації, хвороби Крона, виразкового коліту, червоного вовчаку, псоріазу, ішемічного-реперфузійного ушкодження, солідних пухлин і метастазів пухлин, захворювань, пов'язаних з ангіогенезом, судинних захворювань, станів болю, гострих вірусних захворювань, запальних станів кишечнику, інсулінзалежного та інсуліннезалежного діабету. Крім того, даний винахід надає спосіб лікування станів або розладів у ссавців, включаючи людей, що можуть бути опосередковані рецептором S1P1, що включає введення пацієнтові терапевтично безпечної й ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. В іншому аспекті даний винахід надає сполуку формули (I) або її фармацевтично прийнятну сіль для застосування при виробництві лікарського засобу для застосування при лікуванні станів або розладів, опосередковуваних рецептором S1P1. Для застосування сполук формули (I) і їх фармацевтично прийнятних солей у терапії їх звичайно складають у фармацевтичні композиції відповідно до стандартної фармацевтичної практики. Даний винахід також представляє фармацевтичну композицію, що містить сполуку формули (I) або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій або ексципієнт. У наступному аспекті даний винахід надає спосіб одержання фармацевтичної композиції, що включає змішування сполуки формули (I) або її фармацевтично прийнятної солі і фармацевтично прийнятного носія або ексципієнта. Фармацевтична композиція згідно із дійсним винаходом, яку можна одержати змішуванням, як правило, при температурі навколишнього середовища й атмосферному тиску, звичайно пристосована для перорального, парентерального або ректального введення, і, як така, може бути у формі таблеток, капсул, рідких препаратів для перорального введення, порошків, гранул, коржів, відновлюваних порошків, ін'єкційних або інфузійних розчинів або суспензій, або супозиторіїв. Як правило, кращими є композиції, що вводяться перорально. Таблетки і капсули для перорального введення можуть бути в одиничній дозованій формі і можуть містити традиційні ексципієнти, такі як сполучні (наприклад, попередньо желатинізований кукурудзяний крохмаль, полівінілпіролідон або гідроксипропілметилцелюлоза); наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза або гідрофосфат кальцію); лубриканти для таблетування (наприклад, стеарат магнію, тальк або кремнезем); дезінтегранти (наприклад, картопляний крохмаль або натрієва сіль гліколята крохмалю); і прийнятні зволожувачі (наприклад, лаурилсульфат натрію). Таблетки можуть бути покриті оболонкою відповідно до способів, добре відомих у звичайній фармацевтичній практиці. Рідкі препарати для перорального введення можуть бути у формі, наприклад, водної або масляної суспензії, розчинів, емульсій, сиропів або еліксирів або можуть бути у формі сухого продукту для відновлення з водою або іншим підходящим наповнювачем безпосередньо перед застосуванням. Такі рідкі препарати можуть містити традиційні добавки, такі як суспендуючі засоби (наприклад, сироп сорбіту, похідні целюлози або гідровані харчові жири), емульгатори (наприклад, лецитин або камедь акації), неводні наповнювачі (які можуть включати харчові олії, наприклад, мигдальну олію, складні масляні ефіри, етиловий спирт або фракціоновані рослинні олії), консерванти (наприклад, метил- або пропіл-п-гідроксибензоати або сорбінову кислоту) і, якщо бажано, традиційні віддушки і барвні речовини, буферні солі і відповідні підсолоджувачі. Препарати для перорального введення можуть бути підходящим чином приготовлені для одержання контрольованого вивільнення активної сполуки. 11 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 55 Для парентерального введення рідкі одиничні дозовані форми одержують, використовуючи сполуки згідно із дійсним винаходом або їх фармацевтично прийнятні солі і стерильний носій. Сполуки для ін'єкцій можуть бути представлені в одиничній дозованій формі, наприклад в ампулах, або в множинних дозах, із застосуванням сполуки згідно із дійсним винаходом або її фармацевтично прийнятних похідних і стерильного носія, необов'язково з доданим консервантом. Композиції можуть приймати такі форми, як суспензії, розчини або емульсії в масляних або водних носіях і можуть містити допоміжні агенти, такі як суспендуючі, стабілізуючі та/або диспергуючі засоби. Альтернативно, активний інгредієнт може бути у формі порошку для відновлення підходящим носієм, наприклад, стерильною апірогенною водою, безпосередньо перед застосуванням. Сполука, залежно від носія і використовуваної концентрації, може бути або суспендована, або розчинена в носії. При готуванні розчинів сполука може бути розчинена для ін'єкцій і стерилізована фільтруванням у підходящий флакон або ампулу і герметизована. Переважно в носії розчиняють допоміжні засоби, такі як місцеві анестетики, консерванти і буферні речовини. Для підвищення стабільності, композицію можна заморожувати після розфасовки по флаконах і видаляти воду у вакуумі. Парентеральні суспензії готують істотно в такий же спосіб, за тим виключенням, що сполуку суспендують у носії, а не розчиняють у ньому; крім того, у цьому випадку неможлива стерилізація за допомогою фільтрування. Сполуку можна стерилізувати впливом етиленоксиду перед суспендуванням у стерильному носії. Переважно, для полегшення створення однорідного розподілу, у композицію включають поверхнево-активну речовину й зволожувач. Лосьйони можна одержати на водній або масляній основі; звичайно вони також містять не менше одного емульгатора, стабілізаторів, диспергуючих засобів, суспендуючих агентів, загусників або зафарбовуючих засобів. Краплі можна одержати на водній або неводній основі, що також містить один або більше з диспергуючих засобів, стабілізатори, солюбілізатори або суспендуючі засоби. Вони також можуть містити консервант. Сполука формули (I) або її фармацевтично прийнятні солі можуть бути одержані у вигляді ректальних композицій, таких як супозиторії або утримуючі клізми, наприклад, що містять традиційні основи для супозиторіїв, такі як олія какао або інші гліцериди. Сполуки формули (I) або їх фармацевтично прийнятні солі можна також одержати у вигляді препаратів депо. Такі сполуки тривалої дії можна вводити за допомогою імплантації (наприклад, підшкірно або внутрішньом'язово) або за допомогою внутрішньом'язової ін'єкції. Так, наприклад, сполуки згідно із дійсним винаходом можна одержати з підходящими полімерними або гідрофобними матеріалами (наприклад, у вигляді емульсії в прийнятній олії) або з іонообмінними смолами, або у вигляді важкорозчинних похідних, наприклад, у вигляді важкорозчинної солі. Для інтраназального введення сполуки формули (I) або їх фармацевтично прийнятні солі, можна одержати у вигляді розчинів для введення за допомогою відповідного дозуючого пристрою або пристрою, що надає одиничні дози, або, альтернативно, у вигляді порошкоподібної суміші з відповідним носієм для введення, використовуючи відповідний пристрій для доставки. Таким чином, сполуки формули (I) або їх фармацевтично прийнятні солі можуть бути одержані для перорального, букального, парентерального, місцевого (включаючи офтальмологічне та інтраназальне), депо або ректального введення або у формі, що підходить для введення за допомогою інгаляції або вдмухування (через рот або ніс). Сполуки формули (I) або їх фармацевтично прийнятні солі можуть бути одержані для місцевого введення у формі мазей, кремів, гелів, лосьйонів, песаріїв, аерозолів або крапель (наприклад, краплі для очей, вух або для носа). Мазі і креми можна готувати, наприклад на водній або масляній основі з додаванням підходящого загусника і/або желюючих засобів. Мазі для введення в очі можна готувати стерильно, використовуючи стерилізовані компоненти. Композиція може містити від 0,1 % до 99 % за масою, переважно, від 10 до 60 % за масою активного інгредієнта, залежно від способу введення. Дозу сполуки, застосовуваної для лікування вищевказаних розладів, будуть змінювати звичайним чином залежно від серйозності розладів, маси тіла пацієнта й інших подібних факторів. Однак, як правило, підходящі одиничні дози можуть складати від 0,05 до 1000 мг, від 1,0 до 500 мг або від 1,0 до 200 мг і такі одиничні дози можна вводити більше одного разу в день, наприклад, два або три рази в день. Сполуки формули (I) або їх фармацевтично прийнятні солі можна застосовувати в комбінованих препаратах. Наприклад, сполуки згідно із дійсним винаходом можна застосовувати в комбінації з циклоспорином А, метотрексатом, стероїдами, рапаміцином, інгібіторами запальних цитокінів, імуномодуляторами, включаючи біологічні або інші терапевтично активні сполуки. 12 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід також включає ізотопно-мічені сполуки, що ідентичні до сполук, зазначених у формулі (I) і наступних формулах, за винятком того, що один або більше атомів замінені атомом, що має атомну масу або масовий номер, відмінні від атомної маси або атомного номера, що звичайно зустрічаються в природі. Приклади ізотопів, які можна вводити в сполуки згідно із дійсним винаходом, включають ізотопи водню, вуглецю, азоту, кисню, фосфору, фтору, 3 11 14 18 123 125 йоду і хлору, такі як H, C, C, F, I і I. Сполуки згідно із дійсним винаходом і фармацевтично прийнятні солі зазначених сполук, що містять вищевказані ізотопи і/або інші ізотопи інших атомів, входять в обсяг дійсного винаходу. Ізотопно-мічені сполуки згідно із дійсним винаходом, наприклад, сполуки, у які введені 3 14 радіоактивні ізотопи, такі як H, C, використовують при дослідженнях розподілу лікарського 3 засобу і/або субстрату по тканинах. Особливо кращі ізотопи тритію, тобто H, і вуглецю-14, 14 11 8 тобто C, оскільки вони прості в одержанні і детектуванні. Ізотопи C і F особливо корисні при 125 РЕТ (позитрон-емісійної томографії), і ізотопи I особливо корисні при SPECT (однофотонної емісійної комп'ютерної томографії) для візуалізації мозку. Крім того, заміна більш важкими 2 ізотопами, такими як дейтерій, тобто H, може надати визначену терапевтичну користь, внаслідок більшої метаболічної стабільності, наприклад, збільшення періоду напівжиття in vivo або зниження необхідних доз; тому в деяких обставинах вони можуть виявитися кращими. Ізотопно-мічені сполуки формули (I) і наступних формул згідно із дійсним винаходом можна, як правило, одержувати, здійснюючи методики, розкриті нижче на схемах і/або прикладах, заміняючи легко доступним ізотопно-міченим реагентом реагент, не мічений ізотопом. Усі публікації, включаючи патенти і заявки на патент, приведені в дійсному описі, але, не обмежуючись ними, включені в дійсний опис за допомогою посилання, як ніби кожна індивідуальна публікація була конкретно й індивідуально зазначена як включена в дійсний опис за допомогою посилання. Наступні описи і приклади ілюструють одержання сполук згідно із дійсним винаходом. Умови, устаткування і програмне забезпечення для аналітичних систем РХМС Устаткування Градієнтний насос AgIIent 1100 Автосемплер AgIIent 1100 Детектор AgIIent 1100 DAD Дегазатор AgIIent 1100 Термостат AgIIent 1100 Контролер AgIIent 1100 Система підготовки розчинників Waters Acquity Binary Solvent Manager Система підготовки зразків Waters Acquity Sample Manager Матричний фотодіодний детектор Waters Acquity PDA Мас-спектрометр Waters ZQ Sedere Sedex 55, Sedere Sedex 85, Sedere Sedex 75 або Polymer Labs PL-ELS-2100 Програмне забезпечення Waters MassLynx версії 4,0 SP2 або версії 4,1 Для 5-хвилинного способу Колонка Використовують колонку Waters Atlantis, з розмірами 4,6 мм×50 мм. Розмір частинок стаціонарної фази 3 мкм. Розчинники A: водний розчинник=вода+0,05 % мурашиної кислоти B: органічний розчинник=ацетонітрил+0,05 % мурашиної кислоти Методика У стандартній методиці використовують 5-хвилинні хроматограми. Час (хв) %B 0 3 0,1 3 4 97 4,8 97 4,9 3 5,0 3 Швидкість потоку У вищевказаному способі використовують швидкість потоку, що дорівнює 3 мл/хв. Для 2-хвилинного способу Програмне забезпечення 13 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 Waters MassLynx версії 4,1 Колонка Використовують колонку Waters Acquity BEH UPLC C18, з розмірами 2,1 мм×50 мм. Розмір часинок стаціонарної фази 1,7 мкм. Розчинники A: водний розчинник=вода+0,05 % мурашиної кислоти B: органічний розчинник=ацетонітрил+0,05 % мурашиної кислоти Слабке промивання=1:1 метанол:вода Сильне промивання=вода Методика У стандартній методиці використовують 2-хвилинні хроматограми. Час (хв) %B 0 3 0,1 3 1,5 97 1,9 97 2,0 3 У вищевказаному способі використовують швидкість потоку, що дорівнює 1 мл/хв. У стандартній методиці ін'єкований об'єм складає 0,5 мкл. Температура колонки складає 40 °C Діапазон детектування в УФ-області складав від 220 до 330 нм. Масова направлена автопрепаративна система відкритого доступу (MDAP) Устаткування Набір інструментів для масової направленої препаративної системи відкритого доступу складається з наступних компонентів: 1 градієнтний насос Waters 600 1 інжектор/колектор Waters 2767 1 система для обробки реагентів Waters Reagent manager 1 мас-спектрометр MicroMass ZQ 1 колектор скидання GIIson Aspec 1 післяфракційний УФ-детектор GIIson 115 1 комп'ютерна система. Програмне забезпечення MicroMass MassLynx v. 4,0 Колонка Звичайно використовують колонку Supelco LCABZ++ із внутрішнім діаметром 20 мм і довжиною 100 мм. Розмір частинок стаціонарної фази складав 5 мкм. Розчинники A: водний розчинник=вода+0,1 % мурашиної кислоти B: органічний розчинник=MeCN/вода 95/5+0,05 % мурашиної кислоти Допоміжний розчинник=MeOH/вода 80/20+50 мМ ацетат амонію Розчинник для промивання голки=MeOH/вода/ДМСО 80/10/10 Методики Залежно від аналітичного часу утримування сполуки, що представляє інтерес, можна застосовувати одну з п'яти методик. Усі вони виконують 15-хвилинні хроматографічні цикли, що складаються з 10-хвилинного градієнта, з наступним 5-хвилинним промиванням колонки і стадією повторного урівноважування. MDP 1,5-2,2=0-30 % B MDP 2,0-2,8=5-30 % B MDP 2,5-3,0=15-55 % B MDP 2,8-4,0=30-80 % B MDP 3,8-5,5=50-90 % B Швидкість потоку В усіх вищевказаних методиках швидкість потоку складає 20 мл/хв. Альтернативна система: Устаткування модуль формування бінарного градієнта Waters 2525 допоміжний насос Waters 515 контрольний модуль для насосів Waters Pump Control Module 14 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 55 60 інжектор/колектор Waters 2767 система керування потоком для колонок Waters Column Fluidics Manager фотодіодний матричний детектор Waters 2996 мас-спектрометр Waters ZQ колектор фракцій GIIson 202 колектор скидання GIIson Aspec Програмне забезпечення Waters MassLynx версії 4 SP2 Колонка Використовували колонки Waters Atlantis з розмірами 19 мм×100 мм (малий масштаб) і 30 мм×100 мм (великий масштаб). Розмір частинок стаціонарної фази складав 5 мкм. Розчинники A: водний розчинник=вода+0,1 % мурашиної кислоти B: органічний розчинник=ацетонітрил+0,1 % мурашиної кислоти Допоміжний розчинник=метанол:вода 80:20 Розчинник для промивання голки=метанол Методики Існує п'ять способів, застосовуваних залежно від аналітичного часу втримання сполуки, що представляє інтерес. Вони виконують 13,5-хвилинні хроматографічні цикли, що складаються з 10-хвилинного градієнта, з наступним 3,5-хвилинним промиванням колонки і стадією повторного урівноважування. Великий/малий масштаб 1,0-1,5=5-30 % B Великий/малий масштаб 1,5-2,2=15-55 % B Великий/малий масштаб 2,2-2,9=30-85 % B Великий/малий масштаб 2,9-3,6=50-99 % B Великий/малий масштаб 3,6-5,0=80-99 % B (через 6 хвилин після цього слідує 7,5-хвилинне промивання і повторне урівноважування) Швидкість потоку В усіх вищевказаних методиках швидкість потоку складає 20 мл/хв (при малому масштабі) або 40 мл/хв (при великому масштабі). Градієнти Великомасштабний, від 1,5 до 2,3 хв=13-29 % B Великомасштабний, від 1,9 до 2,3 хв=25-41 % B Великомасштабний, від 2,3 до 2,6 хв=37-53 % B Великомасштабний, від 2,6 до 3,1 хв=49-65 % B Великомасштабний, від 3,1 до 3,6 хв=61-77 % B Умови, використовувані для ЯМР Устаткування Спектрометр Bruker 400 Мгц Ultrashield Автосемплер Bruker B-ACS60 Консоль Bruker Advance 400 Bruker DPX250 Bruker AVANCE 500 Bruker DRX600 Програмне забезпечення Користувальницький інтерфейс - NMR Kiosk Керуюче програмне забезпечення - XWin NMR версії 3,0 Хроматографія Якщо не зазначене інше, усю хроматографію проводили, використовуючи колонки з діоксидом кремнію. Скорочення: г - грами мг - міліграми мл - мілілітри мкл - мікролітри MeCN - ацетонітрил MeOH - метанол EtOH – етанол Et2O - діетиловий ефір EtOAc - етилацетат 15 UA 102508 C2 5 10 15 20 25 30 35 40 45 50 DCM - дихлорметан DIAD - діізопропілазодикарбоксилат DME-1,2-біс(метилокси)етан ДМФА - N, N-диметилформамід ДМСО - диметилсульфоксид EDAC - гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодііміду EDC - гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодііміду EDCl - гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодііміду HOBT/HOBt - гідроксибензотриазол PA - ізопропіловий спирт NCS-N-хлорсукцинімід PyBOP - гексафторфосфат бензотриазол-1-іл-окситрипіролідинофосфонію ТГФ - тетрагідрофуран dba - дибензиліденацетон КТ - кімнатна температура °C - градуси Цельсію M - Молярна концентрація Н - протон с - синглет д - дуплет т - триплет кв - квартет Мгц - мегагерц MeOD - дейтерований метанол РХМС - рідинна хроматографія з мас-спектрометрією РХ/МС - рідинна хроматографія з мас-спектрометрією МС - мас-спектрометрія ES - електроспрей (іонізація розпиленням в електричному полі) + + MH - масовий іон + Н MDAP - масова направлена автоматична препаративна рідинна хроматографія нас. - насичений Загальний хімічний розділ Проміжні сполуки для одержання сполук у прикладах необов'язково одержували з конкретних описаних партій. Опис для D1 N-Гідрокси-1H-індол-5-карбоксімідамід (D1) 5-Ціаноіндол (1,00 г), гідроксиламін∙ HCl (978 мг) і NaHCO3 (2,95 г) розчиняли/суспендували в MeOH (14 мл), нагрівали до 50 °C і перемішували протягом ночі. РХМС-аналіз показав, що після цього часу реакція не була завершена, і реакційну температуру підвищували до 80 °C. Реакція завершилася через 4 години. Реакційну суміш охолоджували до КТ і випарювали досуха при зниженому тиску. Залишок обробляли 1М водної HCl (50 мл) і екстрагували EtOAc (2×50 мл). При цьому не вдавалося екстрагувати продукт із водного розчину, тому його обробляли 2М водним NaOH, доводячи pН близько 7, після чого повторно екстрагували EtOAc (3×50 мл). Об'єднані органічні розчини промивали насиченим розчином солі (30 мл), сушили над MgSO4, фільтрували і випарювали досуха, одержуючи сполуку, зазначена в заголовку (1,36 г), у вигляді коричневої олії. δH (MeOD, 400 МГц) 6,50 (1H, с), 7,27 (1H, с), 7,36-7,45 (2H, м), 7,88 (1H, + с). МС (ES): C9H8N3O обчислено 175; знайдено 176 (MH ). Опис для D2 5-{5-[4-Феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол (D2) 16 UA 102508 C2 5 10 15 20 25 30 35 40 45 Змішували сполуку D1 (174 мг) і метил-4-феніл-5-(трифторметил)-2-тіофенкарбоксилат (286 мг), обробляли етоксидом натрію (21 % за масою в EtOH, 411 мкл) і нагрівали до 120 °C у мікрохвильовому реакторі протягом 30 хвилин. РХМС-аналіз показав, що реакція не була завершена, тому мікрохвильове нагрівання продовжували протягом наступних двох періодів по 30 хвилин. Потім реакційну суміш охолоджували до КТ, гасили H 2O (2 мл) і випарювали досуха при зниженому тиску, одержуючи неочищений продукт (411 мг) у вигляді коричневої олії. Неочищений залишок очищали на картриджі 40+S Biotage, елюючи сумішшю 0-50 % Et2O з петролейним ефіром. Одержували сполуку, зазначену в заголовку (122 мг), у вигляді ясно-сірої твердої речовини. δH (CDCl3, 400 МГц): 6,68 (1H, с), 7,30 (1H, т), 7,41-7,55 (6H, м), 7,92 (1H, с), 7,99 (1H, д), 8,36 (1H, шир.с), 8,50 (1H, с). МС (ES): C 21H12F3N3OS обчислено 411; знайдено 410 + (M-Н ). Опис для D3 Етил-3-(5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропаноат (D3) Сполуку D2 (100 мг) розчиняли в ДМФА (1,2 мл), обробляли K2CO3 (50 мг), потім етил-3бромпропіонатом (90 мг) і нагрівали при 130 °C протягом ночі. Після цього часу РХМС-аналіз показав, що реакція не була завершена, тому додатково додавали етил-3-бромпропіонат (45 мг) і перемішування продовжували при 130 °C протягом 2 годин. РХМС-аналіз показав відсутність змін, тому реакційну суміш випарювали, потім розподіляли між DCM і H 2O. Органічний шар видаляли, водний розчин екстрагували DCM. Об'єднані органічні розчини сушили над MgSO4, фільтрували і випарювали, одержуючи неочищений продукт (148 мг). Продукт очищали на картриджі з діоксидом кремнію (25+S), елюючи сумішшю 0-30 % EtOAc з петролейним ефіром, з одержанням сполуки MF105672-144A3, зазначеної в заголовку (38 мг), у вигляді білої твердої речовини. δH (CDCl3, 400 МГц): 1,21 (3H, т), 2,85 (2H, т), 4,12 (2H, кв), 4,50 (2H, т), 6,60 (1H, д), + 7,21 (1H, д), 7,42-7,52 (6H, м), 7,91 (1H, с), 8,00 (1H, д), 8,46 (1H, с). МС (ES ): C26H20F3N3O3S + обчислено 511; знайдено 512 (MH ). Опис для D3 (альтернативна методика) Етил-3-(5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол-1іл)пропаноат (D3) 5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол (D2) (600 мг), етил3-бромпропаноат (374 мкл), карбонат цезію (950 мг) і ДМФА нагрівали при 140 °C протягом 1 години в мікрохвильовому реакторі. Додавали додатково 1 екв. етил-3-бромпропаноату (187 мкл) і суміш нагрівали протягом 30 хвилин. Реакційну суміш потім випарювали, розчиняли в DCM і фільтрували, одержуючи сполуку, зазначену в заголовку (650 мг), у вигляді коричневої твердої речовини. δH (CDCl3, 400 МГц): 1,21 (3H, т), 2,85 (2H, т), 4,13 (2H, кв), 4,50 (2H, т), 6,61 (1H, д), 7,22 (1H, д), 7,44-7,52 (6H, м), 7,89-7,92 (1H, м), 7,98-8,02 (1H, м), 8,45-8,46 (1H, м). МС + (ES): C26H20F3N3O3S обчислено 511; знайдено 512 (MH ). Опис для D4 3-хлор-4-[(1-метилетил)окси]бензойна кислота (D4) Пропан-2-ол (2,45 мл) і PPh3 (1,18 г) розчиняли в ТГФ (30 мл), охолоджували до 0 °C, обробляли метил-3-хлор-4-гідроксибензоатом (6,00 г), потім по краплях додавали DIAD (9,44 мл) і перемішували при КТ протягом ночі. Реакційну суміш потім випарювали й очищали на картриджах з діоксидом кремнію (4×100 г), елюючи сумішшю 0-40 % EtOAc з пентаном, з одержанням неочищеного продукту (7,00 г) у вигляді безбарвної олії. Одержану олію розчиняли в MeOH (30 мл) і 2М водному NaOH (30 мл) і перемішували при КТ протягом вихідних днів. 17 UA 102508 C2 5 10 15 20 25 30 35 40 45 Реакційну суміш потім випарювали і повторно розчиняли в H 2O. Одержаний розчин промивали Et2O, підкисляли до pН 1 і екстрагували Et2O. Останні екстракти сушили над MgSO4, фільтрували і випарювали, одержуючи сполуку, зазначену в заголовку (4,16 г), у вигляді білої твердої речовини. δH (MeOD, 400 МГц): 1,37 (6H, д), 4,77 (1H, септет), 7,12 (1H, д), 7,90 (1H, д), + 7,98 (1H, с). МС (ES): C10H11Cl3 обчислено 214; знайдено 215 (MH ). Альтернативний синтез: 3-хлор-4-[(1-метилетил)окси]бензойна кислота (D4) Метил-4-гідрокси-3-хлорбензоат (13,4 г) розчиняли в ДМФА (150 мл), обробляли K 2CO3 (19,9 г), потім ізопропілбромідом (13,5 мл), одержану суміш нагрівали до 70 °C і перемішували протягом ночі. Реакційну суміш потім охолоджували до КТ, випарювали досуха, повторно розчиняли в EtOH, фільтрували і випарювали ще раз, що давало проміжний складний ефір (22,2 г) у вигляді білої твердої речовини. Одержана сполука була сумішшю етилового і метилового складних ефірів; її використовували в неочищеному вигляді в наступній реакції. Неочищену проміжну сполуку (22,2 г) розчиняли в MeOH (75 мл), обробляли 2М водним NaOH (75 мл), нагрівали до 60 °C і перемішували протягом 2 годин. Реакційну суміш потім охолоджували до КТ, випарювали MeOH і водний розчин, що залишився, підкисляли 5М водної HCl (30 мл). Осад відфільтровували і сушили, одержуючи сполуку, зазначену в заголовку (15,1 г), у вигляді білої твердої речовини. δH (CDCl 3, 400 МГц): 1,42 (6H, д), 4,70 (1H, септет), 6,97 + (1H, д), 7,97 (1H, д), 8,12 (1H, с). МС (ES): C10H11Cl3 обчислено 214; знайдено 213 (M-Н ). Опис для D5 MF105672-175A2 5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол (D5) Сполуку D1 (500 мг), D4 (611 мг) і PyBOP (1,66 г) розчиняли в ДМФА і перемішували протягом ночі. Реакційну суміш потім випарювали і розподіляли між EtOAc і H 2O. Органічний шар промивали H2O (×2), потім насиченим розчином солі, сушили над MgSO4, фільтрували і випарювали, одержуючи неочищений продукт. Продукт очищали на картриджі з діоксидом кремнію, елюючи сумішшю 0-50 % Et2O з гексаном, з одержанням сполуки, зазначеної в заголовку (120 мг), у вигляді білої твердої речовини. δH (CDCl3, 400 МГц): 1,43 (6H, д), 4,69 (1H, септет), 6,92 (1H, с), 7,04 (1H, д), 7,25 (1H, с), 7,48 (1H, д), 8,00 (1H, д), 8,07 (1H, д), 8,25 (1H, с), + 8,39 (1H, шир.с), 8,50 (1H, с). МС (ES): C19H16Cl3O2 обчислено 353; знайдено 354 (MH ). Опис для D5 (альтернативна методика) 5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол (D5) Суміш 5-ціаноіндолу (5,00 г), NH2OH∙ HCl (6,11 г) і NaHCO3 (14,77 г) в EtOH (176 мл) нагрівали при 70 °C в атмосфері Ar протягом ночі і потім при 80 °C протягом 2,5 годин. Реакційну суміш потім фільтрували і випарювали, одержуючи жовто-помаранчеву тверду речовину (неочищений продукт D1). Сполуку D4 (7,55 г), HOBT (5,23 г) і EDCl (7,42 г) розчиняли в ДМФА (88 мл). Одержану суміш перемішували протягом 10 хвилин і потім додавали зазначену вище жовто-помаранчеву тверду речовину (6,16 г), розчинену в ДМФА (88 мл). Реакційну суміш нагрівали до 80 °C протягом ночі, потім випарювали і розподіляли між EtOAc і H2O. Розділяли фази і водний розчин екстрагували двома додатковими порціями EtOAc. Об'єднані органічні розчини сушили і випарювали. Частину неочищеного залишку очищали на картриджі 40+M Biotage, елюючи сумішшю 5-30 % EtOAc з гексаном. Одержували сполуку, зазначену в заголовку (1,45 г), у вигляді ясно-сірої твердої речовини. δH (CDCl3, 400 МГц): 1,45 (6H, д), 4,72 (1H, септет), 6,666,69 (1H, м), 7,06 (1H, д), 7,29 (1H, видимий триплет або дд), 7,50 (1H, д), 8,01 (1H, дд), 8,08 (1H, + дд), 8,27 (1H, д), 8,49-8,52 (1H, м). МС (ES): C19H16Cl3O2 обчислено 353; знайдено 354 (MH ). Неочищений залишок, що залишився, розтирали з холодним МеОН, з одержанням сполуки, 18 UA 102508 C2 5 10 15 20 25 30 35 40 зазначеної в заголовку (3,54 г), у вигляді ясно-сірої твердої речовини. МС-дані є такими, як зазначено вище. Опис для D6 Етил-3-[5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол-1іл]пропаноат (D6) Сполуку D5 (100 мг) розчиняли в ДМФА (1,5 мл). До одержаного розчину додавали K 2CO3 (58 мг) і етил-3-бромпропіонат (72 мкл), суміш перемішували і нагрівали до 100 °C. Через 1 годину за допомогою РХМС встановили, що перетворення пройшло тільки на 5 %, тому додавали додаткові порції K2CO3 (97 мг) і етил-3-бромпропіонату (72 мкл). Через 3 години реакційну суміш випарювали, потім розподіляли між DCM і H 2O. Водний шар екстрагували DCM, потім об'єднані розчини в DCM промивали насиченим розчином солі, сушили над MgSO 4, фільтрували і випарювали, одержуючи неочищений продукт. Продукт очищали на картриджі з діоксидом кремнію, елюючи сумішшю 0-50 % Et2O з петролейним ефіром. Одержували сполуку, зазначену в заголовку (40 мг), у вигляді білої твердої речовини. δH (CDCl 3, 400 МГц): 1,21 (3H, т), 1,45 (6H, д), 2,85 (2H, т), 4,13 (2H, кв), 4,51 (2H, т), 4,71 (1H, септет), 6,60 (1H, д), 7,07 (1H, д), 7,21 (1H, д), 7,45 (1H, д), 8,02 (1H, д), 8,08 (1H, д), 8,27 (1H, с), 8,47 (1H, с). МС (ES): C24H24Cl3O4 + обчислено 453; знайдено 454 (MH ). Опис для D7 3-хлор-5-(5-{3-хлор-4-[(1-метилетил)окси]феніл}-1,2,4-оксадіазол-3-іл)-1H-індол (D7) Сполуку D5 (300 мг) і NCS (113 мг) розчиняли в DCM (4,2 мл) і перемішували протягом ночі при кімнатній температурі. Реакційну суміш потім розбавляли DCM і промивали H 2O. Водний розчин екстрагували двома додатковими порціями DCM і об'єднані органічні розчини випарювали досуха. Неочищений продукт розтирали з метанолом, одержуючи сполуку, зазначену в заголовку (42 мг), у вигляді коричневої твердої речовини. Метанол потім випарювали й одержану коричневу тверду речовину розтирали з DCM, одержуючи другу порцію сполуки, зазначеної в заголовку (205 мг), у вигляді коричневої твердої речовини. δH (d 6-ДМСО, 400 МГц): 1,37 (6H, д), 4,89 (1H, септет), 7,45 (1H, д), 7,62 (1H, д), 7,70 (1H, с), 7,93 (1H, д), 8,15 35 (1H, д), 8,24 (1H, с), 8,25 (1H, с), 11,77 (1H, с). МС (ES): C 19H15 Cl2N3O2 обчислено 387; знайдено + 388 (MH ). Опис для D8 3-хлор-5-{5-[4-феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол (D8) Сполуку D2 (200 мг) і NCS (65 мг) розчиняли в DCM (5 мл) і перемішували протягом ночі при кімнатній температурі. Реакційну суміш потім розподіляли між DCM і H 2O. Розчин у DCM випарювали досуха й очищали на картриджі з діоксидом кремнію Biotage, елюючи сумішшю 2575 % діетилового ефіру з гексаном. Одержували сполуку, зазначену в заголовку (36 мг), у вигляді коричневої твердої речовини. Другу порцію сполуки, зазначеної в заголовку, також одержували при даному очищенні (86 мг) у вигляді коричневої твердої речовини. δH (CDCl 3, 400 МГц): 7,28 (1H, м), 7,45-7,54 (6H, м), 7,93 (1H, с), 8,05 (1H, д), 8,28 (1H, шир.с), 8,49 (1H, с). МС + (ES): C21H11Cl3N3OS обчислено 445; знайдено 444 (M-Н ). Опис 9 N-Гідрокси-1H-індол-4-карбоксімідамід (D9) 45 19 UA 102508 C2 5 10 15 20 25 30 35 40 4-Ціаноіндол (850 мг) розчиняли в EtOH (25 мл). До одержаного розчину додавали NaHCO 3 (2,51 г) і NH2OH∙ HCl (831 мг). Суміш нагрівали до 70 °C і перемішували протягом ночі. Реакція була незавершеною, тому нагрівали при 80 °C протягом додаткових 4 годин. Реакційну суміш фільтрували і випарювали, одержуючи сполуку, зазначену в заголовку (980 мг), у вигляді жовтої напівтвердої речовини. Очищення не робили. Опис для D9 (альтернативна методика) N-Гідрокси-1H-індол-4-карбоксімідамід (D9) Суміш 4-ціаноіндола (5,0 г, 35,2 ммоль), гідрокарбонату натрію (8,9 г, 105,6 ммоль) і гідрохлориду гідроксиламіну (4,9 г, 70,4 ммоль) у етанолі (200 мл) нагрівали при 55 °C протягом ночі. Додавали гідрокарбонат натрію (5,9 г, 70 ммоль) і гідрохлорид гідроксиламіну (4,9 г, 70,4 ммоль). Суміш нагрівали протягом 4 днів, доки не залишилася тільки дуже мала кількість вихідного матеріалу. Неорганічні речовини відфільтровували, ретельно промиваючи тверду речовину етанолом, і розчинник випарювали. Залишок розтирали з діетиловим ефіром, одержуючи 5,8 г ясно-сірої речовини. δH (400 МГц, метанол-d4) 6,76-6,78 (1H, м), 7,12 (1H, т), 7,24 (1H, дд), 7,29-7,33 (1H, м) 7,46 (1H, дд). Опис для D10 4-{5-[4-Феніл-5-(трифторметил)-2-тієніл]-1,2,4-оксадіазол-3-іл}-1H-індол (D10) 4-Феніл-5-(трифторметил)-2-тіофенкарбонову кислоту (310 мг), HOBT (170 мг) і EDCl∙ HCl (242 мг) розчиняли в ДМФА (3 мл) і перемішували при кімнатній температурі протягом 20 хвилин. Сполуку D9 (200 мг) розчиняли в ДМФА (3 мл) і додавали до одержаного вище розчину і перемішування продовжували при кімнатній температурі протягом двох годин. Реакційну суміш потім нагрівали до 90 °C, охолоджували до КТ, залишали стояти протягом ночі, повторно нагрівали до 80 °C і перемішували протягом 3 годин, охолоджували до кімнатної температури і випарювали досуха. Залишок повторно розчиняли в H2O, екстрагували EtOAc (×3) і об'єднані органічні екстракти випарювали досуха. Залишок очищали флеш-хроматографією на діоксиді кремнію, елюючи сумішшю 25-75 % діетилового ефіру з гексаном, з одержанням сполуки, зазначеної в заголовку (265 мг), у вигляді коричневої твердої речовини. Зразок одержаної сполуки (100 мг) очищали MDAP, одержуючи сполуку, зазначену в заголовку (62 мг), у вигляді ясно-сірої твердої речовини. δH (CDCl3, 400 МГц): 7,33-7,36 (2H, м), 7,41-7,42 (1H, м), 7,46-7,52 (5H, м), 7,61 (1H, д), 7,94 (1H, с), 8,06 (1H, д), 8,46 (1H, шир.с). МС (ES): C 21H12F3N3OS + обчислено 411; знайдено 412 (MH ). Опис для D11 Етил-3-бром-2,2-диметилпропаноат (D11) 3-Бром-2,2-диметилпропанову кислоту (200 мг) розчиняли в EtOH (5 мл) і обробляли концентрованою H2SO4 (0,4 мл). Одержану суміш нагрівали при кип'ятінні зі зворотним холодильником протягом ночі, потім випарювали. Залишок екстрагували EtOAc з H 2O (×2) і об'єднані органічні розчини сушили і випарювали, одержуючи сполуку, зазначену в заголовку (316 мг), у вигляді прозорої олії. δH (CDCl3, 400 МГц) 1,20 (3H, т), 1,32 (6H, с), 3,51 (2H, с), 4,18 (2H, кв). Опис для D12 3-Етил-4-(1-піперидиніл)бензонітрил (D12) 20 UA 102508 C2 5 10 15 20 25 30 35 40 4-Аміно-3-етилбензонітрил (3,0 г, 20,5 ммоль), 1,5-дибромпентан (11,1 мл, 82,1 ммоль), карбонат калію (5,67 г, 41,0 ммоль) і воду (39,6 мл) розділяли нарівно по десятьох мікрохвильових флаконах, кожний з яких нагрівали при 160 °C протягом 1 год. Усі реакційні суміші поєднували і двічі екстрагували етилацетатом (40 мл), об'єднані органічні фракції сушили (з роздільником фаз) і концентрували у вакуумі. Додавали дихлорметан і потім суміш фільтрували, фільтрат очищали хроматографією на діоксиді кремнію, елюючи сумішшю 2-5 % етилацетату c гексаном, з одержанням сполуки, зазначеної в заголовку, у вигляді безбарвної олії (823 мг, 3,85 ммоль). Аналіз показав, що одержана сполука містила невелику кількість домішки дибромпентану. δH (метанол-d4, 400 МГц) 7,52 (1H, дд), 7,47 (1H, дд), 7,13 (1H, д), 2,89 (4H, дд), 2,71 (2H, кв), 1,76-1,71 (4H, м), 1,64-1,56 (2H, м), 1,25 (3H, т). МС (ES): C14H18N2 + обчислено 214; знайдено 215 (MH ). Опис для D13 3-Етил-4-(1-піперидиніл)бензойна кислота (D13) 3-Етил-4-(1-піперидиніл)бензонітрил (D12) (817 мг, 3,82 ммоль) і гідроксид калії (2,14 г, 38,2 ммоль) у етанолі (35 мл) і воду (8 мл) нагрівали до 90 °C (температура блоку) протягом 9 год. Додатково додавали гідроксид калію (2,14 г, 38,2 ммоль) і воду (8 мл) і реакційну суміш нагрівали протягом наступних 18 год. Реакційній суміші давали можливість остудитися і нейтралізували водною HCl. Білу тверду речовину відокремлювали фільтруванням і починали спробу очистити фільтрат, використовуючи картридж SCX, але вона виявилася невдалою. Поєднували тверду речовину і продукт, зібраний з SCX, додавали метанол і потім суміш підкисляли оцтовою кислотою. Суміш фільтрували для одержання фільтрату, який потім уловлювали на картриджі SCX, промивали метанолом і елюювали 2М аміаком у метанолі. В експериментальному масштабі це давало сполуку, зазначену в заголовку, у вигляді білої твердої речовини (96 мг, 0,41 ммоль), і продукт, що залишився, давав безбарвну олію (563 мг, 2,41 ммоль). δH (метанол-d4, 400 МГц): 7,85 (1H, д), 7,74 (1H, дд), 7,03 (1H, д), 2,85 (4H, дд), 2,73 (2H, кв), 1,72 (4H, м), 1,61 (2H, м), 1,25 (3H, т) м.д. МС (ES): C 14H19NO2 обчислено 233; знайдено + 234 (MH ). Опис для D14 Етил-5-хлор-6-(1-піролідиніл)-3-піридинкарбоксилат (D14) Суміш етилового ефіру 5,6-дихлорнікотинової кислоти (1,00 г, 4,57 ммоль), піролідину (325 мг, 4,57 ммоль), карбонату калію (632 мг, 4,57 ммоль) і порошку міді (34 мг) у ДМФА (6,8 мл) нагрівали при 130 °C у мікрохвильовому нагрівачі протягом 20 хв. Додатково додавали піролідин (163 мг, 2,29 ммоль) і реакційну суміш нагрівали при 130 °C протягом 20 хв. Додавали воду (7 мл) і суміш екстрагували етилацетатом (2×14 мл). Об'єднані органічні екстракти промивали водою (7 мл) і насиченим розчином солі (7 мл), потім сушили (з роздільником фаз) і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді олії жовтогарячого кольору (1,06 г, 4,17 ммоль). δH (метанол-d4, 400 МГц): 8,45 (1H, д), 7,98 (1H, д), 21 UA 102508 C2 4,31 (2H, кв), 3,82-3,75 (4H, м), 2,0-1,93 (4H, м), 1,36 (3H, т) м.д. МС (ES): C 12H15Cl2O2 обчислено + 254, 256; знайдено 255, 257 (MH ). Опис для D15 5-Хлор-6-(1-піролідиніл)-3-піридинкарбонова кислота (D15) 5 10 15 20 25 30 35 40 Етил-5-хлор-6-(1-піролідиніл)-3-піридинкарбоксилат (D14) (1,06 г, 4,16 ммоль) у етанолі (20 мл) і водний гідроксид натрію (2М, 2,08 мл, 4,16 ммоль) нагрівали при 40 °C протягом 18 год. Реакційній суміші давали можливість остудитися і нейтралізували 2М HCl (водн.). Сполука, зазначена в заголовку, утворювалася у вигляді білої твердої речовини, яку відфільтровували і промивали метанолом, одержуючи сполуку SJ 108923-113A3, зазначену в заголовку (243 мг, 1,08 ммоль). Фільтрат пропускали через колонку SCX, елюювали 2М аміаком у метанолі, одержуючи додаткову кількість сполуки, зазначеної в заголовку, у вигляді твердої речовини жовтогарячого кольору (467 мг, 2,07 ммоль). δH (метанол-d4, 400 МГц): 8,55 (1H, д), 8,03 (1H, д), 3,76-3,70 (4H, м), 1,96-1,90 (4H, м). МС (ES): C10H11Cl2O2 обчислено 226, 228; знайдено 227, 229 + (MH ). Опис для D16 3-Етил-4-йодбензонітрил (D16) До 4-аміно-3-етилбензонітрилу (2,50 г, 17,1 ммоль), що перемішується у воді (14 мл) при 0 °C, по краплях додавали концентровану хлористоводневу кислоту (7,80 мл, 257 ммоль), з наступним додаванням по краплях розчину нітриту натрію (1,24 г, 18,0 ммоль) у воді (3,43 мл). Одержану суміш перемішували протягом 15 хвилин і потім протягом 15 хвилин додавали розчин йодиду калію (2,98 г, 18,0 ммоль) у воді (6,0 мл) при 0 °C. Суміш перемішували при кімнатній температурі протягом 2 год. Суміш екстрагували етилацетатом (3×100 мл) і об'єднані органічні фракції промивали насиченим розчином солі (100 мл), сушили (з роздільником фаз) і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді коричневої твердої речовини (4,21 г, 16,4 ммоль). δH (метанол-d4, 400 МГц): 8,02 (1H, д), 7,61 (1H, д), 7,24 (1H, дд), 2,80 (2H, кв), 1,21 (3H, т). МС (ES): Іон із шуканою масою не спостерігали. Опис для D17 4-(1-циклогексен-1-іл)-3-етилбензонітрил (D17) Суміш 3-етил-4-йодбензонітрилу (D16) (1,23 г, 4,80 ммоль), 1-циклогексен-1-ілборонової кислоти (907 мг, 7,20 ммоль), метоксиду натрію (778 мг, 14,4 ммоль) і хлориду біс(трифенілфосфін)паладію(II) (337 мг, 0,48 ммоль) у безводному метанолі (12 мл) нагрівали при 80 °C протягом 10 хвилин у мікрохвильовому нагрівачі. Реакційну суміш розподіляли між етилацетатом (40 мл) і водою (40 мл), потім органічний шар додатково промивали водою (40 мл), сушили (з роздільником фаз) і концентрували у вакуумі. Неочищений продукт очищали хроматографією на діоксиді кремнію, елюючи сумішшю 0-5 % EtOAc з гексаном протягом 30 хвилин, з одержанням сполуки, зазначеної в заголовку, у вигляді жовтої олії (824 мг, 3,91 ммоль). δH (метанол-d4, 400 МГц) 7,56 (1H, д), 7,46 (1H, дд), 7,19 (1H, д), 5,61-5,56 (1H, м), 2,68 22 UA 102508 C2 (2H, квартет), 2,23-2,16 (4H, м), 1,85-1,68 (4H, м), 1,20 (3H, т). МС (ES): Іон із шуканою масою не спостерігали. Опис для D18 4-(1-циклогексен-1-іл)-3-етилбензойна кислота (D18) 5 10 15 20 25 30 35 4-(1-циклогексен-1-іл)-3-етилбензонітрил (D17) (824 мг, 3,91 ммоль) і гідроксид калію (2,19 г, 39,1 ммоль) у етанолі (36 мл) і воду (8 мл) нагрівали при 90 °C (температура блоку) протягом 20 год. Реакційну суміш концентрували у вакуумі і залишок розподіляли між етилацетатом (120 мл) і водною хлористоводневою кислотою (2М, 50 мл), потім органічну фазу додатково промивали хлористоводневою кислотою (2М, 50 мл), сушили (з роздільником фаз) і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді жовтої олії (808 мг, 3,51 ммоль). δH (метанол-d4, 400 МГц) 7,87 (1H д), 7,76 (1H дд), 7,11 (1H, д), 5,59-5,54 (1H, м), 2,68 (2H, кв), 2,25-2,15 (4H, м), 1,84-1,67 (4H, м), 1,20 (3H, т). РХМС (ES): C15H18O2 обчислено 230; знайдено + 229 (M-Н ). Опис для D19 4-циклогексил-3-етилбензойна кислота (D19) 4-(1-циклогексен-1-іл)-3-етилбензойну кислоту (D18) (803 мг, 3,49 ммоль) розчиняли в метанолі (70 мл) і гідрували в апараті H-Cube, використовуючи картридж із паладієм на вуглеці. Розчин продукту концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді білої твердої речовини (792 мг, 3,41 ммоль). δH (метанол-d4, 400 МГц): 7,82-7,68 (2H, м), 7,33 (1H, д), 2,83 (1H, м), 2,73 (2H, кв), 1,87 (2H, м), 1,85-1,70 (3H, м), 1,58-1,30 (5H, м), 1,22 (3H, т). РХМС (ES): Іон із шуканою масою не спостерігали. Опис для D20 1-Метилетил-3-бром-4-[(1-метилетил)окси]бензоат (D20) Суміш 3-бром-4-гідроксибензойної кислоти (2,00 г, 9,22 ммоль), 2-йодпропану (1,85 мл, 18,4 ммоль) і карбонату калію (2,55 г, 18,4 ммоль) у ДМФА (175 мл) нагрівали при кипінні зі зворотним холодильником протягом 5 год. Реакційній суміші давали можливість остудитися і суміш фільтрували. Фільтрат концентрували у вакуумі і залишок розподіляли між етилацетатом (150 мл) і водою (150 мл), яку підлужували 2М розчином NaOH. Органічну фазу сушили (з роздільником фаз) і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді жовтої олії (2,36 г, 7,84 ммоль). δH (метанол-d4, 400 МГц): 8,05 (1H, д), 7,90 (1H, дд), 7,25 (1H, д), 5,10 (1H, септет), 4,81 (1H, септет), 1,32 (6H, д), 1,31 (6H, д) м.д. МС (ES): Іон із шуканою масою не спостерігали. 23 UA 102508 C2 Опис для D21 3-Бром-4-[(1-метилетил)окси]бензойна кислота (D21) 5 10 15 20 25 30 35 Розчин 1-метилетил-3-бром-4-[(1-метилетил)окси]бензоату (D20) (2,36 г, 7,84 ммоль) у етанолі (100 мл) і водний гідроксид натрію (2M, 39 мл) нагрівали при кипінні зі зворотним холодильником протягом 5 год. Реакційну суміш концентрували у вакуумі і розподіляли між етилацетатом (125 мл) і водою (125 мл), останню підкисляли 2М розчином HCl (40 мл). Водний шар екстрагували додатковим етилацетатом (70 мл), об'єднані органічні екстракти сушили (з роздільником фаз) і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді ясно-сірої твердої речовини (1,83 г, 7,06 ммоль). δH (метанол-d4, 400 МГц): 8,05 (1H, д), 7,89 (1H, дд), 7,23 (1H, д), 4,79 (1H, септет), 1,32 (6H, д). МС (ES): C 10H11Br3 обчислено 258, 260; + знайдено 257, 259 (M-Н ). Опис для D22 Етил-4-бром-3-хлорбензоат (D22) До суспензії 4-бром-3-хлорбензойної кислоти (5,00 г, 21,2 ммоль) у етанолі (50 мл) додавали сірчану кислоту (5 мл) і одержану суміш нагрівали при кипінні зі зворотним холодильником протягом 60 год. Реакційну суміш розподіляли між етилацетатом (50 мл) і водою (50 мл). Водний шар екстрагували додатковим етилацетатом, об'єднані органічні фракції сушили (з роздільником фаз) і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді коричневої олії/твердої речовини (5,09 г, 19,3 ммоль). δH (d 6-ДМСО, 400 МГц): 8,06 (1H, д), 7,96 (1H, д), 7,80 (1H, дд), 4,33 (2H, кв), 1,33 (3H, т). МС (ES): Іон із шуканою масою не спостерігали. Опис для D23 Етил-3-хлор-4-(2-метилпропіл)бензоат (D23) Розчин броміду ізобутилцинку в ТГФ (0,5М, 30 мл, 15,0 ммоль) додавали в атмосфері аргону до етил-4-бром-3-хлорбензоату (D22) (2,00 г, 7,60 ммоль) і потім додавали комплекс 1,1'біс(дифенілфосфіно)фероценпаладій(II)дихлориду з дихлорметаном (930 мг, 1,14 ммоль). Реакційну суміш нагрівали при кипінні зі зворотним холодильником протягом 4,5 год. Суміш концентрували у вакуумі і залишок розподіляли між етилацетатом (125 мл) і водою (125 мл). Утворювалася тверда речовина, яку відфільтровували і відкидали. Органічний шар промивали водою (100 мл), сушили (з роздільником фаз) і концентрували у вакуумі. Неочищений продукт очищали хроматографією на діоксиді кремнію, елюючи 0-5 % EtOAc у гексані протягом 30 хвилин, з одержанням сполуки, зазначеної в заголовку, у вигляді безбарвної олії (1,76 г, 7,33 ммоль). δH (d6-ДМСО, 400 МГц): 7,91 (1H, д), 7,80 (1H, дд), 7,46 (1H, д), 4,30 (2H, кв), 2,66 (2H, д), 1,88-2,01 (1H, м), 1,32 (3H, т), 0,89 (6H, д). МС (ES): Іон із шуканою масою не спостерігали. Опис для D24 3-хлор-4-(2-метилпропіл)бензойна кислота (D24) 24 UA 102508 C2 5 10 15 20 25 30 35 Розчин етил-3-хлор-4-(2-метилпропіл)бензоату (D23) (1,76 г, 7,33 ммоль) і водного гідроксиду натрію (2М, 3,70 мл, 7,4 ммоль) у етанолі (30 мл) нагрівали при 40 °C протягом 3 год. Реакційну суміш концентрували у вакуумі і залишок розподіляли між етилацетатом (100 мл) і водою (100 мл), яку підкисляли 2М HCl (4 мл). Водний шар екстрагували етилацетатом (100 мл), об'єднані органічні екстракти сушили (з роздільником фаз) і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді білої твердої речовини (1,35 г, 6,36 ммоль). δH (d6-ДМСО, 400 МГц): 13,20 (1H, шир.с), 7,89 (1H, д), 7,82 (1H, дд), 7,44 (1H, д), 2,64 35 + (2H, д), 1,94 (1H, м), 0,89 (6H, д). МС (ES): C11H13 Cl2 обчислено 212; знайдено 211 (M-Н ). Опис для D25 Метил-3-ціано-4-{[(трифторметил)сульфоніл]окси}бензоат (D25) До розчину метил-3-ціано-4-гідроксибензоату (3 г, 16,93 ммоль) і триетиламіну (3,54 мл, 25,4 ммоль) у сухому дихлорметані (60 мл) при 0 °C у потоці аргону повільно по краплях додавали трифторметансульфоновий ангідрид (3,15 мл, 18,63 ммоль). Реакційній суміші давали можливість нагрітися до кімнатної температури й одержану суміш перемішували протягом 1 год. Реакційну суміш промивали 10 % водним карбонатом калію (2×50 мл) і потім водною HCl (2М, 2×50 мл), потім органічну фазу сушили (з роздільником фаз) і розчинник видаляли у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді темно-коричневої олії (5,165 г, 16,70 ммоль). δH (CDCl3, 400 МГц): 8,44 (1H, д), 8,38 (1H, дд), 7,60 (1H, д), 3,99 (3H, с). МС (ES): Іон із шуканою масою не спостерігали. Опис для D26 Метил 2-ціано-4-біфенілкарбоксилат (D26) Наступну реакційну суміш розділяли на дві порції з половинними кількостями: метил-3-ціано4-{[(трифторметил)сульфоніл]окси}бензоат (D25) (1,5 г, 4,85 ммоль), фенілборонову кислоту (1,183 г, 9,70 ммоль), карбонат калію (2,011 г, 14,55 ммоль) і тетракістрифенілфосфінпаладій(0) (0,561 г, 0,485 ммоль) розчиняли в ДМФА (24 мл) і суміш нагрівали в мікрохвильовому нагрівачі протягом 30 хв при 150 °C. Поєднували дві реакційні суміші, розбавляли етилацетатом (50 мл) і суміш фільтрували через кізельгур для видалення залишків паладію. Фільтрат концентрували у вакуумі для зменшення кількості ДМФА і потім залишок розподіляли між насиченим водним бікарбонатом натрію (50 мл) і етилацетатом (50 мл). Органічну фазу промивали додатковим бікарбонатом натрію (50 мл) і потім водою (50 мл), потім сушили (MgSO 4), фільтрували і розчинник видаляли у вакуумі. Коричневу тверду речовину очищали хроматографією на діоксиді кремнію, елюючи 0-25 % EtOAc у ізогексані протягом 35 хвилин, з одержанням сполуки, 25 UA 102508 C2 5 10 15 20 25 30 35 зазначеної в заголовку, у вигляді білої твердої речовини (935 мг, 3,94 ммоль). δH (d 6-ДМСО, 400 МГц): 8,42 (1H, д), 8,29 (1H, дд), 7,81 (1H, д), 7,65 (2H, м), 7,60-7,50 (3H, м), 3,92 (3H, с). МС (ES): Іон із шуканою масою не спостерігали. Опис для D27 2-Ціано-4-біфенілкарбонова кислота (D27) До метил-2-ціано-4-біфенілкарбоксилату (D26) (935 мг, 3,94 ммоль) додавали етанол (18 мл), але розчинення не відбувалося, тому додавали дихлорметан (10 мл). Потім додавали гідроксид натрію (2 мл, 4,00 ммоль) і реакційну суміш перемішували протягом 2 год. До суміші додавали дихлорметан (20 мл) і 2М водну HCl (10 мл). Розділяли шари і водний шар екстрагували додатковим дихлорметаном (20 мл). Об'єднану органічну фазу сушили (з роздільником фаз) і розчинник видаляли у вакуумі, одержуючи білу тверду речовину, яку розчиняли в метанолі (30 мл), і додавали водний гідроксид натрію (2М, 3 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 год., потім додавали воду (20 мл). Реакційну суміш перемішували протягом однієї наступної години. Додавали дихлорметан (60 мл), суміш струшували і розділяли шари. Водну фазу екстрагували додатковим дихлорметаном (50 мл), потім об'єднану органічну фазу сушили (з роздільником фаз) і розчинник видаляли у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді білої твердої речовини (849 мг, 3,80 ммоль). δH (d6-ДМСО, 400 МГц): 13,60 (1H, шир.с), 8,38 (1H, д), 8,28 (1H, дд), 7,78 (1H, д), + 7,63 (2H, м), 7,60-7,50 (3H, м). МС (ES): C14H9NO2 обчислено 223; знайдено 222 (M-Н ). Опис для D28 Етил-4-хлор-3-(трифторметил)бензоат (D28) 4-хлор-3-(трифторметил)бензойну кислоту (1 г, 4,45 ммоль) розчиняли в етанолі (3 мл) і додавали концентровану сірчану кислоту (0,15 мл). Суміш нагрівали в мікрохвильовому нагрівачі при 100 °C протягом 5 хвилин і потім при 120 °C протягом 15 хвилин. Розчинник видаляли у вакуумі і залишок розподіляли між насиченим водним бікарбонатом натрію (50 мл) і етилацетатом (50 мл). Водний шар екстрагували додатковим EtOAc (50 мл), органічні фази поєднували, сушили з роздільником фаз і концентрували у вакуумі, одержуючи сполуку, зазначену в заголовку (1,026 г) (DN108121-148A3), у вигляді безбарвної олії. δH (метанол-d4, 400 МГц) 1,40 (3H, т), 4,41 (2H, кв), 7,76 (1H, д), 8,21 (1H, дд), 8,33 (1H, д). МС (ES): Іон із шуканою масою не спостерігали. Опис для D29 2-(Трифторметил)-4-біфенілкарбонова кислота (D29) Реакційну суміш розділяли на 4 частини, використовуючи чверть реагентів у кожній з них: до суміші 4-бром-3-(трифторметил)бензонітрилу (4 г, 16,00 ммоль), фенілборонової кислоти (3,90 26 UA 102508 C2 5 10 15 20 25 30 35 40 г, 32,0 ммоль) і карбонату калію (6,63 г, 48,0 ммоль) у N, N-диметилформаміді (ДМФА) (64 мл) додавали тетракістрифенілфосфінпаладій(0) (1,849 г, 1,600 ммоль). Кожну реакційну суміш нагрівали в мікрохвильовому нагрівачі при 150 °C протягом 30 хвилин. Об'єднані реакційні суміші фільтрували через цілит, промивали етилацетатом і розчинник видаляли у вакуумі. Залишок розподіляли між етилацетатом (100 мл) і водою (100 мл) і органічну фазу промивали розчином бікарбонату натрію (100 мл). Органічну фазу сушили (MgSO 4), фільтрували і розчинник видаляли у вакуумі. Коричневу олію розтирали з дихлорметаном і фільтрували, одержуючи блідо-жовту тверду речовину, 2-(трифторметил)-4-біфенілкарбоксамід (2,47 г), яку використовували без подальшого очищення. До 2-(трифторметил)-4-біфенілкарбоксаміду (2 г, 7,54 ммоль) у етанолі (80 мл) додавали гідроксид калію (4,23 г, 75 ммоль) і воду і суміш нагрівали до 90 °C протягом 18 год. Реакційну суміш концентрували у вакуумі і залишок розподіляли між дихлорметаном (100 мл) і 2М HCl (100 мл). Органічну фазу відокремлювали, сушили (з роздільником фаз) і розчинник видаляли у вакуумі, одержуючи неочищений продукт. Очищення проводили, використовуючи картридж зі зверненою фазою Biotage Horizon, елюючи 5-100 % MeCN у воді, з одержанням сполуки, зазначеної в заголовку, у вигляді ясно-сірої твердої речовини (960 мг) (N2123-46-A5). МС (ES): C14H9F3O2 обчислено 266; знайдено 265 (M+ Н ). Опис для D29 (альтернативна методика) 2-(Трифторметил)-4-біфенілкарбонова кислота (D29) Порція A: Суміш сполуки D98 (1,0 г, 3,96 ммоль), фенілборонової кислоти (724 мг, 5,94 ммоль), ацетату паладію (44 мг), (дициклогексилфосфіно)біфенілу (140,2 мг) і фториду калію (689 мг, 11,9 ммоль) у ТГФ (8 мл) нагрівали в мікрохвильовому нагрівачі при 120 °C у цілому протягом 40 хвилин. Порція B: Суміш D28 (500 мг, 1,98 ммоль), фенілборонової кислоти (290 мг, 2,38 ммоль), ацетату паладію (2,2 мг), (дициклогексилфосфіно)біфенілу (7 мг) і фториду калію (344 мг, 5,8 ммоль) у ТГФ (4 мл) нагрівали в мікрохвильовому нагрівачі при 120 °C протягом 20 хвилин. Реакційні суміші з порцій A і B поєднували, фільтрували і фільтрат концентрували у вакуумі. Залишок очищали флеш-хроматографією (0-5 % EtOAc у гексані), одержуючи суміш вихідного продукту і продукту конденсації. Одержаний продукт розчиняли в етанолі (10 мл) і 2М NaOH (водн.) (5 мл) і потім нагрівали при кипінні зі зворотним холодильником протягом 3 год. Розчинник видаляли у вакуумі і залишок розподіляли між DCM і 2М водн. HCl. Водну фазу екстрагували додатковим DCM. Органічні фази поєднували і концентрували у вакуумі. Неочищений продукт очищали хроматографією зі зверненою фазою на картриджі Horizon, елюючи 5-100 % MeCN у воді, з одержанням сполуки, зазначеної в заголовку, у вигляді білої твердої речовини (367 мг). δH (d6-ДМСО, 400 МГц) 7,31-7,40 (2H, м), 7,44-7,52 (3H, м), 7,57 (1H, д), 8,24 (1H, дд), 8,29 (1H, д), 13,57 (1H, шир.с). МС (ES): C 14H9F3O2 обчислено 266; знайдено + 265 (M-Н ). Опис для D30 2'-Фтор-2-(трифторметил)-4-біфенілкарбонова кислота (D30) Зазначену сполуку одержували, застосовуючи спосіб, подібно до описаного для сполуки D29, використовуючи (2-фторфеніл)боронову кислоту і сполуку D98, з тим виключенням, що 27 UA 102508 C2 проводили тільки одну реакцію конденсації, подібно до описаної для порції А, і нагрівали + протягом 20 хвилин. МС (ES): C14H8F4O2 обчислено 284; знайдено 283 (M-Н ). Опис для D31 Метил-3-ціано-4-(2-метилпропіл)бензоат (D31) 5 10 15 20 25 30 35 До метил-3-ціано-4-{[(трифторметил)сульфоніл]окси}бензоату (D25) (1,5 г, 4,85 ммоль) додавали бром(2-метилпропіл)цинк (48,5 мл, 24,25 ммоль) у тетрагідрофурані (50 мл) в атмосфері аргону. До розчину потім додавали комплекс 1,1'біс(дифенілфосфіно)ферроцендихлорпаладію(II) і дихлорметану (0,355 г, 0,485 ммоль) і реакційну суміш нагрівали при кипінні зі зворотним холодильником протягом 6 год. Суміш гасили водою (2 мл) і потім фільтрували через цілит, промиваючи етилацетатом. Розчинник видаляли у вакуумі. Залишок розподіляли між етилацетатом (50 мл) і водою (50 мл), органічну фазу сушили (з роздільником фаз) і розчинник видаляли у вакуумі. Залишок очищали хроматографією на діоксиді кремнію, елюючи 0-15 % EtOAc у ізогексані протягом 40 хв. Збирали дві порції, одна з яких була сполукою, зазначеною в заголовку, у вигляді безбарвної олії (233 мг, 1,072 ммоль). δH (CDCl3, 400 МГц): 8,28 (1H, д), 8,15 (1H, дд), 7,38 (1H, д), 3,94, 3H, с), 2,78 (2H, д), 2,02 (1H, м), 0,96 (6H, д). Опис для D32 3-Ціано-4-(2-метилпропіл)бензойна кислота (D32) Метил-3-ціано-4-(2-метилпропіл)бензоат (D31) (233 мг, 1,072 ммоль) розчиняли в етанолі (4 мл) і додавали 2М водний гідроксид натрію (1 мл, 2 ммоль). Реакційну суміш перемішували протягом 1 год. Додавали 2М водну HCl (10 мл) і суміш екстрагували дихлорметаном (20 мл+10 мл). Органічні фази відокремлювали, сушили роздільником фаз і поєднували, потім розчинник видаляли у вакуумі, одержуючи сполуку, зазначену в заголовку, у вигляді білої твердої речовини (203 мг, 0,999 ммоль). δH (d6-ДМСО, 400 МГц) 13,43 (1H, шир.с), 8,29 (1H, д), 8,14 (1H, дд), 7,59 (1H, д), 2,74 (2H, д), 1,96 (1H, м), 0,91 (6H, д). МС (ES): C 12H13NO2 обчислено 203; + знайдено 202 (M-Н ). Опис для D33 4-(2-Метилпропіл)-3-(трифторметил)бензамід (D33) До розчину 4-бром-3-трифторметилбензонітрилу (1,25 г, 5,0 ммоль) і броміду ізобутилцинку (25 ммоль) в ТГФ (50 мл, 25 ммоль) в атмосфері аргону додавали комплекс 1,1'біс(дифенілфосфіно)фероцендихлорпаладію(II) і дихлорметану (612 мг, 0,75 ммоль) і реакційну суміш нагрівали при кип'ятінні зі зворотним холодильником протягом 5 год. Суміш концентрували у вакуумі і залишок розподіляли між етилацетатом (80 мл) і водою (80 мл). Тверду речовину, що утворилася, відфільтровували і відкидали. Органічний шар промивали 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole derivatives as s1p1 receptor agonists
Автори англійськоюAhmed, Mahmood, Myatt, James, Norton, David, Rivers, Dean, Andrew
Назва патенту російськоюПроизводные индола как агонисты рецептора s1p1
Автори російськоюАхмед Махмуд, Миатт Джеймс, Нортон Дэвид, Риверз Дин Эндрю
МПК / Мітки
МПК: A61K 31/405, C07D 413/04, C07D 413/14, A61P 37/00
Мітки: похідні, агоністи, рецептора, індолу
Код посилання
<a href="https://ua.patents.su/75-102508-pokhidni-indolu-yak-agonisti-receptora-s1p1.html" target="_blank" rel="follow" title="База патентів України">Похідні індолу як агоністи рецептора s1p1</a>
Попередній патент: Спосіб поліпшення здоров’я рослин
Наступний патент: Спосіб одержання 4,4′-(1-метил-1,2-етандіїл)-біс-(2,6-піперазиндіону)
Випадковий патент: Фотоелектричний перетворювач переміщення у код