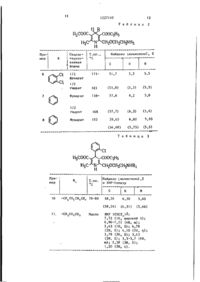
Спосіб одержання похідних 1,4-дігідропірідінів або їх фармацевтично прийнятних солей
Номер патенту: 7082
Опубліковано: 30.06.1995
Автори: Сімон Фразер Кемпбелл, Джон Кендрік Стаббз, Пітер Едвард Кросс
Текст
1. Способ получения п р о и з в о д ных і ,4-дигидроітиридинов общей фор мулы Н R или СНгСНСН3; где X - -(СИ ) R • незамещенный йенил или фения, одно- или двузамещенный атон галогена или трифторметильной группой, или смесью этих групп; R, - атом водорода или г руппа -СИ, где R, С^ -С, -алкокси или окси где Кь и К^ каждый независимо один от другого атом водорода или С^-С^-алкил или их фармацевтически приемлемых солей с кислотами, о т л и ч а ю щ и й с я тем, что азид общей формулы г * » R и X имеют указанные значения, д= восстанавливают и при необходимости образовавшееся соединение подвергают взаимодействию с соединением общей формулы (IT1) HaICF 2 C00(C 1 -С^-алкил) f где НаЕ - атом хлора или брома, и полученное соединение общей формулы 5 (1), где Я 1 -СН 2 С00(С 1 -С 1( ~алкил), выделяют или подвергают взаимодействию с амином общей формулы IV R3R,,NH или гидролизуют с последующим выделе'і-шем целевого продукта в свободном виде или в виде соли с фармацевтически приемлемой кислотой. 2. Способ по п. 1, о т л и ч а ю щ и й с я тем, что восстановление ведут водородом в присутствии палладиевого катализатора или цинком в соляной кислоте. 1227 10 Изобретение относится к способу получения 1,4-дигидропиридинов общей формулы Н R где X - - ( С Н 2 ) а - или -CF ^ R - незамещенный фенил или фенил одно- или двузамещенный атомом галогена или трифторметильной группой, или смесью этих групп; R, - атом водорода или группа -CH 3 COR\ где R* - окси, С.-С^-алкокси или NR 3 R^, где R 3 и К^ каждый независимо'один от другого атом водорода или С^-С^-алкил, или их фармацевтически приемлемых аддитивных солей. Цель изобретения - разработка на основе известных методов способа получения новых соединений, которые могут быть использованы в качестве антагонистов кальция. П р и м е р 1. 2-(2-Азидоэтокси) метил-4-(2-хлорфенил)-3-этоксикарбонил~5-метоксикарбонил-6-метил-1,4-дигидропиридин. Раствор 2-азидоэтанола (160 г) в тетрагидрофуране (300 мл) добавляют в течение 40 мин к суспензии гидрида натрия (114 г, 80%-ная дисперсия в масле) в тетрагидрофуране (500 м л ) . Смесь перемешивают при комнатной температуре 1 ч, затем охлаждают в ледяной воде и обрабатывают по каплям раствором этил-4-хлорацетоацетата (276 г) в тетрагидрофуране (250 мл в течение 2 ч. Смесь перемешивают при комнатной температуре 16 ч, разбавляют этанолом (150 мл) и рН доводят до 6-7 < М хлористоводород^ ной кислотой. Для растворения имеющегося в наличии твердого вещества добавляют достаточное количество воды и слои разделяют. Органический сЛой выпаривают, остаток разбавляют водой (600 мл) и выпаривают. Остаток распределяют между этилацетатом и водой, причем водный слой экстрагируют дважды этилацетатом. Объединенные этилацетатные экстракты высушивают над сульфатом магния и выпаривают, что дает этил-4-(2-азидоэтокси) ацетоацетат в виде коричневого масла, степень чистоты 73%. t o 25 30 35 40 45 55 * Смесь этого неочищенного продукта с ацетатом аммония (92,3 г) в э т а ноле (600 мл) нагревают с обратным холодильником 1 ч , дают-остыть до комнатной температуры и обрабатывают метил-2-(2-хлорбензилиден)-ацетоацетатом (286,6 г ) . Смесь нагревают с обратным холодильником 5,5 ч , затем выпаривают. Остаток перемешивают с метанолом (1,5 л) 16 ч . Полученное твердое вещество собирают, промывают дважды метанолом, высушивают и перекристаллизовывают из метанола. В р е зультате получают целевое соединение (78 г ) , т . п л . 145-146°С. Найдено, %\ С 55,39; Н 5,37; N 13,01 ^ ^ ^ Вычислено, %: С 55,23; Н 5,33; N 12,88Аналогично получают азиды 2-4 f приведенные в табл. \. П р и м е р 2. Получение 2-(2-азидоэтокси)метил-4-(2~хлорфенил)-З-этоксикарбонил-5-метоксикарбонил-б-метил-1,4-дигидропиридина. Этил 4-(2-азидоэтокси)-ацетоацетат (46,4 г ) , полученный из 2-азидоэтанола подобно указаниям, описанным в примере 1, подвергают реакции с метил-3-аминокротонатом (24,8 г) и 2-хлорбензальдегидом (30,3 г) в метаноле (150 мл) при действии обратного холодильника 13 ч. После охлаждения до комнатной температуры по лученное твердое вещество собирают, промывают дважды метанолом и высушивают. В результате получают целевое соединение (28 г ) . Продукт может кристаллизоваться из метанола, ацетона и зтилацетата. Применяют его непосредственно. П р и м е р 3. Получение этил-4-(2-азидопроп-1-окси)ацетоацетата. ^ Смесь 2-бромпропан-!-ола (19,75 г) и азида натрия (10.0 г) нагревают на паровой бане 4 дня, дают остыть до комнатной температуры, затем четырехкратно промывают простым эфиром. Объединенные эфирные промывные жидкости фильтруют и выпаривают, что дает 2-азидопропан-1-ол (12,3) в виде светло-коричневого масла, имеющего 98%-ную степень чистоты по данным тех. Раствор 2-аэидопропан-1-ола (10,1 г) в тетрагидрофуране (100 мл)добавляют в течение 2 мин и пере З 1227 10 4 Соответствующие фракции объедимешиваемой, охлаждаемой льдом сусняют и превращают в соль малеиновой пензии гидрида натрия (6,6 г; 80%-ная кислоты в среде этилацетата. Передисперсия в масле) в тетрагидрофукристаллизация из ацетона и этилацеране (50 мл). Смесь перемешивают 15 мин при охлаждении льдом, затем j тата (1:1) дает целевое соединение (соль малеиновой кислоты , 190 мг обрабатывают в течение 20 мин раст1%-ный выход из 2-азидоэтанола в вором этил-4-хлорацетоацетата виде твердого белого вещества, т.пл. (16,4 г) в тетрагидрофуране (150 мл). 169°С. Смесь перемешивают при комнатной температуре 16 ч и выпаривают. Осіо Найдено, %: С 54,8; Н 5,55; таток разбавляют водой, промывают N 5,3.. дважды простым эфиром, подкисляют Вычислено, %: С 54,9; Н 5,6; 2М хлористоводородной кислотой и N 5,3 экстрагируют трехкратно, переводя П р и м е р 5- Получение 2-[(2ЦеЛеВОЙ ПРОДУКТ В Э(ЬИр . Объединен-J5 -аминоэтокси)метил]-4-(2~хлорфенил)-З-этоксикарбонил-5-метоксикарбонилные эфирные экстракты высушивают -б-метил-1,4-дигидропиридинмалеата. над сульфатом натрия и выпаривают. Суспензию 2-(2-азидоэтокси)метилПолучают 20 г неочищенного 4 - ( 2 -4-(2-хлорфенил-3-этоксикарбонил-5-азидопроп-1-окси)ацетоацетата. П р и м е р 4 . Получение малеата20 -метоксикарбонил-6-метил-1,4-дигидропиридина (103 г) в этаноле (2,5 л) - 2 - £(2-аминоэтокси)метил]-2(2-хлорперемешивают 16 ч при комнатной темфенил)-З-этокси-карбонил-5-метоксипературе в атмосфере водорода в прикарбонил—6-метил-I,4-дигидропиридисутствии 5Z палладия на углекислом на. 25 кальции (40 г ) . Реакционную смесь 2-Азидоэтанол (3 г) превращают фильтруют и выпаривают, остаток обрав этил 4- (2-азидоэтокси)ацетоацетат батывают раствором малеиновой кислосоответственно способу, описанному ты (22 г) в этаноле (100 мл). Реакв примере 3, с применением этил ционную смесь перемешивают при ком4—клорацетата, и неочищенный сложный датной температуре 2 ч, после чего кетоэфир (не охарактеризован) примеполученное твердое вещество собирают, няют для реакции по Ганчу, используя промывают этанолом и высушивают, что способ по примеру 1, т.е. подвергая дает целевое соединение (100 г ) , сложный эфир реакции с метил 3-амит.пл. 1б9-]70,5°С. нокротонатам и 2-хлорбензольдегидом. Найдено, %: С 54,82; Н 5,62; Неочищенный продукт по Ганчу (не 5,46 [охарактеризован) растворяют в метаС1вНг5СШг05С,Н1А ноле (250 мл) и 3 н. хлористоводородВычислено, %: С 5 4 , 9 1 ; Н 5,57; ной кислоте (200 мл), и перемешиN 5,34. вают на водяной бане при комнатной П р и м е р ы 6-8. Соединения, температуре, причем добавляют порция- 40 приведенные в табл. 2, приготовлены ми цинковую пыль (15 г) в течение аналогично примеру 5 из соответст10 мин. После дополнительного 14 мин вующего азида в атмосфере водорода перемешивания раствор декантируют в присутствии палладия. от избытка цинка, метанол выпариП р и м е р 9. Метил N-[2-$L4вают и водный кислотный остаток про- 45 -(2,3-дихлорфенил)-3-этоксикарбонилмывают толуолом (100 мл) и подщело-5-метоксикарбонил~6-метил-1,4-дигидченным концентрированным аммиаком, ропиридин-2-ил)метокси|этил] аминозатем экстрагируют метиленхлоридом ацетат. (2-100 мл). Экстракты высушивают Раствор метилбромацетата (1,53 г) (Na^COj),фильтруют и выпаривают дов ацетонитриле (20 мл) добавляют суха. Остаток в толуоле хроматогракаплями в течение 30 мин к перемешифируют на колонке среднего давления, ваемой, нагреваемой при действии обзаполненной двуокисью кремния для ратного холодильника смеси 2-[(2-амитонкослойной хроматографии) 7 г .Для отноэтокси)метил]-4-(2,3-дихлорфенил)55 -З-этоксикарбонил-5-метоксикарбонилмывки сорбента используют сначала толуол, постепенно заменяемый мети-б-метил-1,4-дигидропиридина (5,01 г) ленхлоридом, затем метиленхлоридом и карбоната калия (2,76 г) в ацетос 3% метанола. нитриле (60 мл). Затем смесь нагре 1227U0 вают с обратным холодильником 3 ч, фильтруют и выпаривают. Остаток распределяют между этилацетатом и водой. Органический слой промывают водой, высушивают над сульфатом натрия и 3 выпаривают. Остаток хроматографируют на двуокиси кремния (40 г ) . Для от' мывки с адсорбента применяют дихлоргде R^ CH^CONHCH,, с т.пл. = 123метан с 0-3% метанола. Надлежащие 10 124°С. фракции объединяют и выпаривают, Найдено, %: С 57,80; Н 6,55; что дает целевое соединение (2,10 г ) , N 8,73. т.пл. 96-98°С. Вычислено, %: С 57,56; Н 6,30; Найдено, %: С 53,25; Н 5,49; N 8,76. N 5,48 15 П р и м е р 14. N-(2-{[4-(2-xnopфенил)-З-этоксикарбонил-5-метоксиВычислено, X: С 53,60; Н 5,48; карбонил-6-метил-1,4-дигидропирид-2N 5,44' -ил]метокся|этил)аминоуксусная кисП р и м е р ы 10 и 11. Соединения, лота. приведенные в табл. 3, получают по 20 Раствор метил^-{2-[4-(2-дихлорспособу, описанному в примере 9, с фенил-З-этоксикарбонил-5-метоксикарприменением соответствующих исходных бонил-6-метил-1,4-дигидропирид-2-ил) материалов. метокси]этил1аминоацетата (2,40 г) П р и м е р 12. 2-(2-[[4-(2-Хлор-. •в диоксане (80 мл) обрабатывают 1 М фенил)-З-этоксикарбонил-5-метокси25 водным раствором гидрата окиси наткарбонил-6-метил-!,4-дигидропиридрия (10 мл) и смесь перемешивают при -2-ил)]метокси[ этиламино ацетамид. комнатной температуре 2 ч, затем Этил К-(2-{[4-(2-хлорфенил)-3выпаривают. Остаток очищают ионо-этоксикарбонил~5-метоксикарбонилобменной хроматографичей (Био-Рад, -б-метил-1,4-дигидропирид-2-ил]мет- 30 200-400 меш, катионная форма, 40 г ) , окси}этиламино)ацетат (2,50 г) в отмывая с адсорбента сначала диоксасмеси с этанолом (40 мл) и 0,880 ном, затем 2%-ныи раствором пиридиводным раствором аммиака (30 мл). на в воде. Надлежащие фракции объеперемешивают при комнатной темперадиняют и выпаривают, что дает целетуре 4 дня, затем выпаривают. Остаток распределяют между этилацетатом 35 вое соединение в форме полугидрата (0,56 г ) , т.пл. !40-150°С (с рази водой, органический слой промывают ложением) . водой, высушивают над сульфатом магНайдено, %: С 55,52; Н 5,95; ния и выпаривают. Остаток хроматограN 5,92, фируют над двуокисью кремния (для . 1/2 Н 3 0 тонкослойной хроматографии, (30 г) 40 t и отмывают с адсорбента дихлорметаВычислено, %: С 55,52; Н 5,93; ном в смеси с 0-5% метанола. НадлеN 5,89. жащие фракции объединяют и выпариП р и м е р 15. Получение 2-(2вают . Остаток растворяют с этилаце-аминопроп-1-оксиметил)-4-(2-хлортатом, полученное твердое вещество • 45 фенил)-3-этоксикарбонил~5-метоксисобирают, промывают этилацетатом и карбонил-б-метил-1,4-дигидропиридин высушивают, что дает целевое соедигемифумарата гемигидрата. нение (1,23 г ) , т.пл. 126-129"С. Смесь этил 4-(2-азидопроп-1-окси) • Найдено, %: С 56,78; Н 6,06; ацетацетата (13,05 г) 2-хлорбензаль50 цегида (8,3 г) и метил 3-аминокротоN 8,68 ната (6,8 г) в метаноле (80 мл) на, а 3 6 г 2 гревают с обратным холодильником Вычислено, %\ С 56,71; Н 6,06; 19 ч, сокращают объем наполовину и N 9,02. охлаждают всю ночь при минус 20 о С. П р и м е р 13. Согласно способу, 55 Полученный осадок собирают, промыописанному в примере 12, с применевают небольшим количеством холоднонием одних и тех же дигидропиридина го метанола и высушивают, что дает и метиламина получают соединение об2-(2-азидопрол-}-оксиметил)-3-этокщей формулы н соос 1227110 сикарбонил-5-метоксикарбонил-б-метил-1,4-дигидропиридин (4,0 г) в виде светло-желтого твердого вещества» т.пл. 115*С, охарактеризованного спектроскопически.. Суспензию указанного продукта (4,0 г) ~в метаноле (100 мл) перемешивают в атмосфере водорода при комнатной температуре в присутствии палладия на карбонате кальция (1,0 г) 18 ч. Затем смесь фильтруют через материал Солкафлок и выпаривают. Остаток растворяют в метаноле (20 мл), обрабатывают теплым раствором фуt5 маровой кислоты (1,00 г) в метаноле (10 мл) и хранят всю ночь при 0°. Полученное твердое вещество собирают, перекристаллиэовывают из этанола и высушивают, что дает це20 левой гемифумарат гемигидрат в (2,4 г ) , т.пл. 180-!83 С. Найдено, %: С 56,46; Н 63; И 5,68, іцОі.1/2 Н а О 25 Вычислено^ %: С 56,38; Н 6,17; N 5,72Используя предлагаемый процесс, также получены следующие соединения: 30 1$-\2-[4-(2-хлорфенил)-3-этоксикарбонил-5-метоксикарбонил-б-метиЛ'-1,4-дигидропирид-2-ил]-метокси J . этиламин, т.пл. 169°С; метил-Ы~(2-{[4-(2,3-диxлopфeнил)-3-этoкcикapбoнил-'5--мeтoкcикapбoнил-б-метил-1,4-дигидропирид-2-ил]-мет~ окси].этил)аминоацетат, т.пл. 96-9.8еС; • этил-М-(2-[4-(2-хлорфенил)-3-этоксикарбонил-5-метоксикарбонил-б-ме- 40 тил-1 ,4-дигидропирид-2-ил] метокси}этил)аминоацетат, т.пл. 78-80 °С; метил^-(2-^4-(2-хлорфенил)-3-этоксикарбонил-5-метоксикарбонил.-б-метил-1,4-дигидропирид-2-ил]мет- ,е окси]этил)аминоацетат. ЯМР (CDCT3)i :7,72 (1Н широкий S ) ; - 6,96-7,51 (4Н, т); 5,543 (1Н, S ) ; 4,78 (2Н, S ) ; 4,10 (2Н, q ) ; 3,78 (ЗН, S) 3,63 (ЗН, S ) ; 3,33,7 (6Н, ш ) ; 2,38 (ЗН, S ) ; 1,20 (ЗН, С). 55 2-{2-[4-(2-хлорфенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропирид-2-ил]метоксиэтиламино]ацетамин, т.пл. 126-128"С; 8 -Ы" -(2- £[4-(2-хлорфенил) -З-эт-оксикарбонил-5-метоксикарбонил-6-метил-1, 4--дигидpoлиpид-2~шf}мeт~ Р oкcи}этилaминoaцeтaт , т.пл. 124 — 124 С; Ы-(2-{[4-(2-хлорфенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-I,4 дигидропирид-2-ил]метокси|этиламиноуксусная кислота полугидрат, т.пл. 140-150-°С; 2-[(2-аминоэтокси)метил]-4-[2-хлор-3-трифторметилфенил]-3-этоксикарбонил-5-метоксикарбонил-б-^іетил-1,4~дигидропиридин, т.пл. 122 С. Способность соединений ингибиров'ать перемещение кальция в клетку показано за счет его эффективного действия при понижении ответной реакции изолированной ткани сердечной мышцы на возрастание концентрации ионов кальция при опытах, прово-, димых in vitro. Испытание проводят^ со спиральными полосками, вырезанными иа аорты крысы, посредством закрепления одного конца полоски наглухо, а другого конца полоски на передатчике силового воздействия. Ткань погружают в ванну с физиологическим солевым раствором, содержащим ионы калия при концентрации,0,0045 М при отсутствии кальция. Хлорид кальция добавляют в ванну пипеткой с таким расчетом, чтобы получить 0,002 М окончательную концентрацию ионов кальция . Отмечают изменение напряжения, вызываемое полученным в итоге, сокращением ткани. Затем ванне дают стечь, заменяют ее свежим раствором соли и через 45 мин испытание повторяют в присутствии конкретного испытуемого соединения в солевом растворе. Регистрируют концентрацию соединения, требуемую для снижения ответной реакции, на 50%. Активность соединения, характеризуемая снижением повышенного кровяного давления, оценивают также после введения через рот путем снижения давления у крыс с присущей им гипертонией или у собак с гипертонией, вызванной за счет воздействия на почки. Для приема через рот взрослым пациентам (средний вес 70 кг) для лечения или профилактики заболеваний сердечной мышцы и гипертонии ежедневные суточные дозировки соединений должны быть 2-50 мг. Таким образом, для типичного взрослого пациента отдельные таблетки или капсулы долж 1227110 ны содержать 3 — JO мг активного соединения в среде подходящего и пригодного в фармацевтическом отношении индифферентного материала или носителя. Дозировки для внутривенного введения должны быть, в зависимости от потребности, 1-10 мг для единичной дозы, В табл. 4 приведены молярные кон- ю центрации соединений, требуемые для снижения ответной реакции на 50% при испытании, приведенном в описании (ТС 50 -значения; Ш=1 г- моль/л). Чем меньше концентрация соединения, тем 15 более активным оно является, т.е. наиболее активными соединениями служат продукты по примерам 1 и 2. Показатели выведения t,^ получены для нифедипина, верацимила и соедине- 2 0 ння А: Использована следующая методика. *л Изучаемое соединение смешивают с индифферентной основой (лактоза, кукурузный крахмал, лаурилсульфат натрия) и используют для заполнения желатиновых капсул. Капсулы вводят орально находящимся в сознании собакам (1 капсула на живот), берут пробы крови по 5 мл ежечасно в течение HR первых 6 ч, а затем по состоянию на 8 ч, 18 ч и 24 ч после введения дозы. Пробы крови переносят в литийгепариновые пробирки, центрифугируют с получением прозрачной плазмы, а затем хранят в замороженном состоянии при -20 С до проведения анализа. Концентрацию препарата в плазме крови измеряют с применением газохроматографического метода с детектированием методом захвата электронов, который позволяет количественно определять с точностью до 10 нг сухого вещества на миллилитр плазмы. КонІцентрации препарата определяют измерением флюоресценции па яластннках тонкослойной хроматографии с использованием прибора Vitaton TLD Densitometr с VVB и интерференционным фильтрами 434 нм. Концентрации определяют по калибровочным кривым, используя три стандарта, для каждой пластинки ТСХ. После определения концентрации препарата в каждой пробе крови рассчитывают полупериод выведения t . . Получают следующие показатели выведения Ц ^ , ч: Нифедипин 1,2 Берапимил 0,8 Соединение А 30 Соединение А растворимо в деионизованной воде в количестве 3,5 мг/мл и стабильно при продолжительном экспонировании (1-2 недели) солнечным светом. Таблица I п. Т.пл., Азид R *с Haftдено (вычислено) • 1 С N 1 4,78 (4,73) 11 ,73 (1 1,94) 59,64 Ь,\\ 13,96 (59,99) (6,04) (13,99) 141 50 ,88 (51 ,18) (24 129-130 ЯМР (5Н, 4,80 (2Н, 3,62 S); (CDCI ) $ ! - 7 , 1 4 « ) ; 5 , 2 8 (1Н, S ) ; (2Н, S ) ; 4,04 q ) ; 3 , 6 5 (АН, т ) ; (ЭН, S ) ; 2,35 (ЗН, 1,20 (ЗН, Ї) , п 1227110 12 Т а б л и ц а нв 2 н При Охарактеризованная форма R мер Т.пл., °С 1/2 фумарат Найдено (вычислено), % 8 171 51,7 5,3 5,5 1/2 гидрат 183 (51,8) (5,3) (5,5) 158 57,6 6,2 5,8 168 (57,7) (6,3) (5,6) Фумарат 152 59,65 6,02 5,93 (56,68) Й N 1/2 гидрат С1 Н Фумар ат С1 С (5,75) (5,5) Т а б л и ц а 3 н 3 соос Пример Найдено (вычислено),% и ЯМР-спектр н 10 -СН г СО,СН 3 Масло 58,26 6,30 5,65 (58,24) 11 -СН С0 г СН 2 СН 3 78-80 (6,31) (5,66) ЯМР ( C D C F J $ : 7,72 (1Н, широкий S ) ; 6 , 9 6 - 7 , 5 1 (4Н, ш ) ; 5 , 4 3 (1Н, S ) ; 4 , 7 8 (2Н, S ) ; А . І 0 (2Н, q ) ; 3,78 (ЗН, S ) ; 3 , 6 3 (ЗН, S ) ; 3 , 3 - 3 , 7 (6Н, т ) ; 2 , 3 8 (ЗН, 5 ) ; 1,20 (ЗН, t ) . /4 1227П0 Т а б л и ц а Соединение по примеру ЇС' М 4 Продолжение табл.4 1 значения, 7 4 3.2.,0-* 5 6,3«10* 9 8 Редактор Н. Бобкоза 1,3-10^ 12 3,2
ДивитисяДодаткова інформація
Автори англійськоюPeter Edward Cross
Автори російськоюПитер Едвард Кросс
МПК / Мітки
Мітки: одержання, спосіб, солей, похідних, 1,4-дігідропірідінів, фармацевтично, прийнятних
Код посилання
<a href="https://ua.patents.su/8-7082-sposib-oderzhannya-pokhidnikh-14-digidropiridiniv-abo-kh-farmacevtichno-prijjnyatnikh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 1,4-дігідропірідінів або їх фармацевтично прийнятних солей</a>
Попередній патент: Безтрансформаторний пристрій для живлення ламп низької напруги
Наступний патент: Пристрій для насаджування поперечних ребер на гладкі труби
Випадковий патент: Відцентрова ливарна машина