Бензиламіни, спосіб їх одержання і їх застосування як протизапальних засобів
Номер патенту: 97806
Опубліковано: 26.03.2012
Автори: Бергер Маркус, Дамен Ян, Шеке Хайке, Ревінкель Хартмут, Ярох Штефан
Формула / Реферат
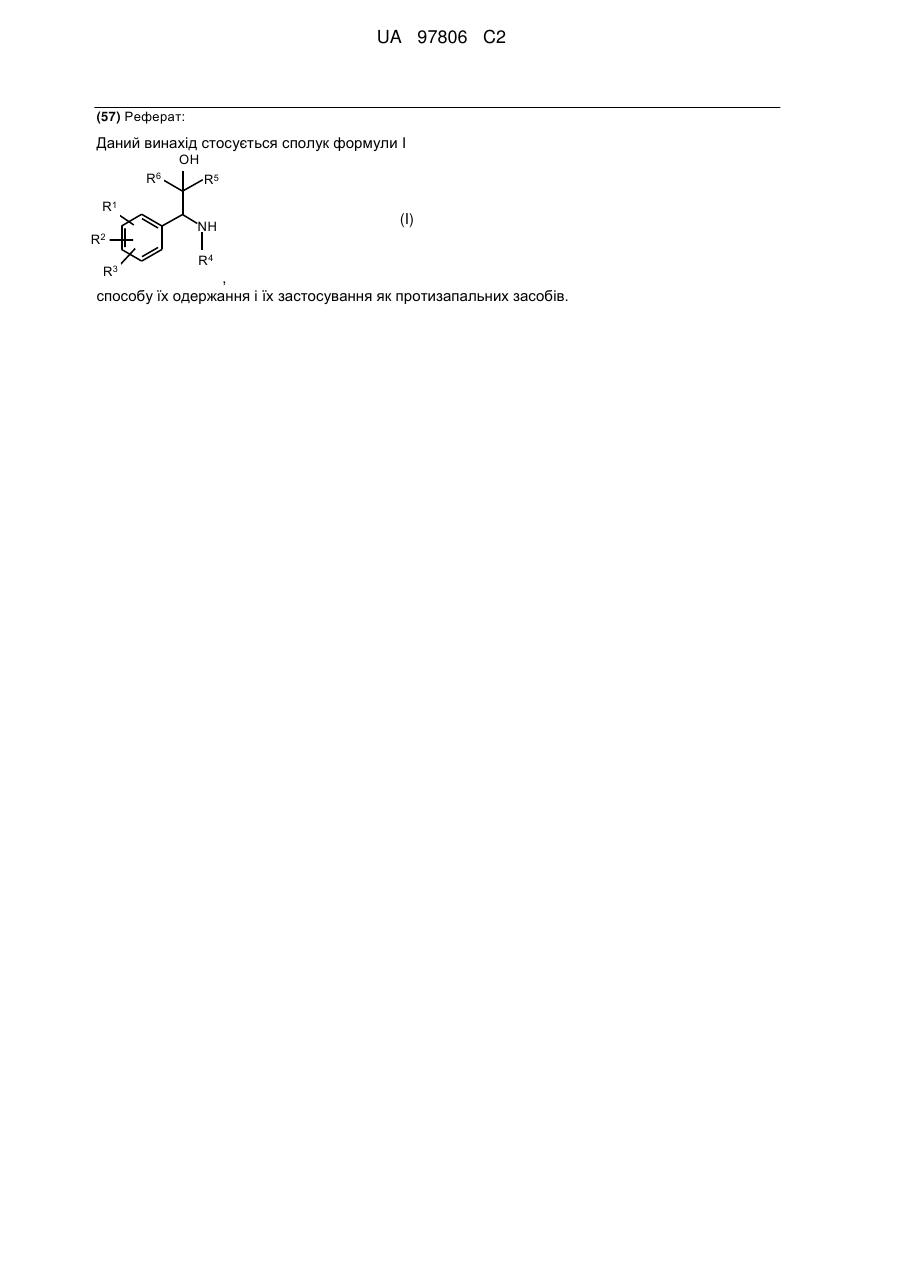
1. Сполуки загальної формули І
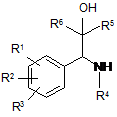 ,
,
де
R1 і R2, незалежно один від одного, означають атом водню, гідроксигрупу, атом галогену, необов'язково заміщену (С1-С10)-алкільну групу, необов'язково заміщену (С1-С10)-алкоксигрупу, (С1-С10)-алкілтіогрупу, (С1-С5)-перфтороалкільну групу, ціаногрупу, нітрогрупу, або R1 і R2 разом означають групу, яка вибрана з груп -О-(СН2)р-О-, -О-(СН2)р-СН2-, -О-СН=СН-, -(СН2)р+2-, -NH-(CH2)p+1, -N(C1-C3-алкіл)-(CH2)p+1 і -NH-N=CH-,
де р = 1 або 2, і термінальні атоми кисню і/або атоми вуглецю, і/або атоми азоту зв'язані з безпосередньо примикаючими циклічними атомами вуглецю,
або NR7R8,
де R7 і R8, незалежно один від одного, означають водень, С1-С5-алкіл або (СО)-(С1-С5)-алкіл,
R3 означає атом водню, гідроксигрупу, атом галогену, ціаногрупу, необов'язково заміщену (С1-С10)-алкільну групу, (С1-С10)-алкоксигрупу, (С1-С10)-алкілтіогрупу або (С1-С5)-перфтороалкільну групу,
R4 означає моноциклічну або біциклічну, ароматичну, частково ароматичну або неароматичну циклічну систему, яка необов'язково містить 1-4 атоми азоту, 1-2 атоми кисню і/або 1-2 атоми сірки, і необов'язково заміщену в одному або декількох місцях радикалом, вибраним з групи, що включає карбоніл, галоген, гідроксигрупу або (С1-С5)-алкіл, який необов'язково може бути заміщений 1-3 гідроксигрупами, 1-3 (С1-С5)-алкоксигрупами і/або 1-3 COOR6 групами, (С1-С5)-алкоксигрупами, (С1-С5)-алкілтіогрупами, (С1-С5)-перфтороалкілом, ціаногрупою, нітрогрупою, або
два замісники разом формують групу, яка вибрана з груп
-О-(СН2)р-О-, -О-(СН2)р-СН2-, -О-СН=СН-, -(СН2)р+2-, -NH-(CH2)p+1, -N(С1-С3-алкіл)-(СН2)р+1 і -NH-N=CH-,
де р = 1 або 2, і термінальні атоми кисню і/або атоми вуглецю, і/або атоми азоту зв'язані з безпосередньо примикаючими циклічними атомами вуглецю,
NR7R8, де R7 і R8, незалежно один від одного, можуть означати водень, С1-С5-алкіл або (СО)-С1-С5-алкіл,
(CO)NR11R12, де R11 і R12, незалежно один від одного, означають водень або С1-С5-алкільну групу, або (С1-С5-алкілен)-О-(СО)-(С1-С5)-алкільну групу,
R5 означає частково або повністю фторовану С1-С3-алкільну групу,
R6 означає групу, вибрану з
-(С1-С10)-алкілу, який частково або повністю галогенований,
(С2-С10)-алкінілу,
(С1-С8)-алкіл-(С3-С7)-циклоалкілу,
(С2-С8)-алкеніл-(С3-С7)-циклоалкілу,
-(С1-С8)-алкілгетероциклілу,
-(С2-С8)-алкенілгетероциклілу,
-R9,
-(С1-С8)-алкіл-R9,
-(С2-С8)-алкеніл-R9,
-(С2-С8)-алкініл-R9,
-СН2-S-(С1-С10)-алкілу,
-CH2-S-R9,
-CH2-SO2-R9,
-(CH2)n-R9,
-СН2-SO2-(С1-С10)-алкілу,
-(CH2)n-CN,
-(CH2)n-Hal, де Hal означає F, Сl або І,
-СН2-О-(С1-С10)-алкілу,
(CH2)n-NR7R8, де R7, R8 мають значення, визначені вище,
CH2-O-R9,
де
R9 означає арил, який може необов'язково бути заміщений 1-3 алкілами, гідроксигрупами, галогенами, ціаногрупами або С1-С5-алкоксигрупами, або
гетероарильною групою, де гетероарильна група може містити 1-3 гетероатоми, яка може необов'язково бути заміщена 1-3 алкілами, гідроксигрупами, галогенами, ціаногрупами або С1-С5-алкоксигрупами,
n означає ціле число, вибране з 1, 2, 3, 4, 5.
2. Сполуки за п. 1, де щонайменше один з R1-R3 вибраний з групи, що включає С1-С5-алкіл, С1-С5-алкоксигрупу, С1-С5-алкілтіогрупу, С1-С5-перфтороалкіл, галоген, гідроксигрупу, ціаногрупу, нітрогрупу, -О-(СН2)р-О-, -О-(СН2)р-СН2-, -О-СН=СН-, -(СН2)р+2-, -NH-(CH2)р+1, N(С1-С3-алкіл)-(СН2)р+1 або -NH-N=CH-,
де р = 1 або 2, і термінальні атоми кисню і/або атоми вуглецю зв'язані з безпосередньо примикаючими циклічними атомами вуглецю,
або NR7R8,
де R7 і R8, незалежно один від одного, можуть бути воднем, С1-С5-алкілом або (СО)-С1-С5-алкілом.
3. Сполуки за п. 1, де щонайменше один з R1-R3 вибраний з групи, що включає гідроксигрупу, метоксигрупу, фтор, хлор, або де 2 зв'язані групи R1-R3 утворюють -О-СН2-О-, -СН2-СН2-О- або -СН2-С(СН3)2-О- групу.
4. Сполуки за п. 1, де R4 означає необов'язково заміщену фталідильну, індолільну, ізоіндолільну, дигідроіндолільну, дигідроізоіндолільну, дигідроізохінолінільну, дигідрохінолінільну, тіофталідильну, бензоксазинонільну, фталазинонільну, хінолінільну, ізохінолінільну, хінолонільну, ізохінолонільну, індазолільну, бензотіазолільну, хіназолінільну, хіноксалінільну, цинолінільну, фталазинільну, 1,7- або 1,8-нафтиридинільну, індолонільну, ізоіндолонільну, дигідроіндолонільну, дигідроізоіндолонільну, бензімідазольну, кумаринільну, ізокумаринільну, піразолопіримідинільну або індолільну групу, яка зв'язана за допомогою будь-якого положення.
5. Сполуки за п. 1, де циклічна система, що міститься в R4, заміщена 1-3 однаковими або різними радикалами з групи, що включає С1-С3-алкіл, гідроксигрупу, карбоніл або галоген.
6. Сполуки за п. 5, де циклічна система, що міститься в R4, заміщена метилом, хлором або фтором.
7. Сполуки за п. 5, де R4 означає феніл, нафтил, хінолін-5-іл, фталазиніл, хіназолініл, який може бути необов'язково заміщений незалежно 1-3 радикалами, вибраними з групи, що включає карбоніл, С1-С3-алкіл, хлор або фтор.
8. Сполуки за п. 1, де R5 вибраний з -CF3 і -C2F5.
9. Сполуки за п. 1, де R6 вибраний з бензилу, пропілу, хлорометилу, бромометилу, етилсульфанілметилу, (імідазол-2-іл)-сульфанілметилу, (імідазол-2-іл)-сульфонілметилу, 1,2,4-триазол-3-ілсульфанілметилу, (1-метилімідазол-2-іл)-сульфанілметилу, (1Н-імідазол-2-іл)-сульфанілметилу, піримідин-2-ілсульфанілметилу, 2-пропілсульфанілметилу, ціанометилу, метилсульфанілметилу, диметиламінометилу, метоксиметил-, гідроксиметилу, етоксиметилу.
10. Сполуки за п. 1, де
щонайменше один з R1, R2, R3 вибраний з
метоксигрупи, гідроксигрупи, фтору, хлору, метилу,
або R1 і R2 разом означають групу -О-СН2-О-, -СН2-СН2-О- або -СН2-С(СН3)2-O- (утворюючи разом з фенільною групою, до якої вони приєднані, п'ятичленне кільце),
R4 вибраний з хінолін-5-ілу, фталазинілу, хіназолінілу, який може бути заміщений незалежно один раз або двічі карбонілом, метилом або фтором,
R5 означає -CF3,
R6 вибраний з
бензилу, хлорометилу, бромометилу, етилсульфанілметилу, (імідазол-2-іл)-сульфанілметилу, (імідазол-2-іл)-сульфонілметилу, 1,2,4-триазол-3-ілсульфанілметилу, (1-метилімідазол-2-іл)-сульфанілметилу, (1Н-імідазол-2-іл)-сульфанілметилу, піримідин-2-ілсульфанілметилу, 2-пропілсульфанілметилу, ціанометилу, метилсульфанілметилу, диметиламінометилу, метоксиметил-, гідроксиметилу, етоксиметилу.
11. Сполуки за будь-яким з пп. 1-10 в енантіомерно чистій формі.
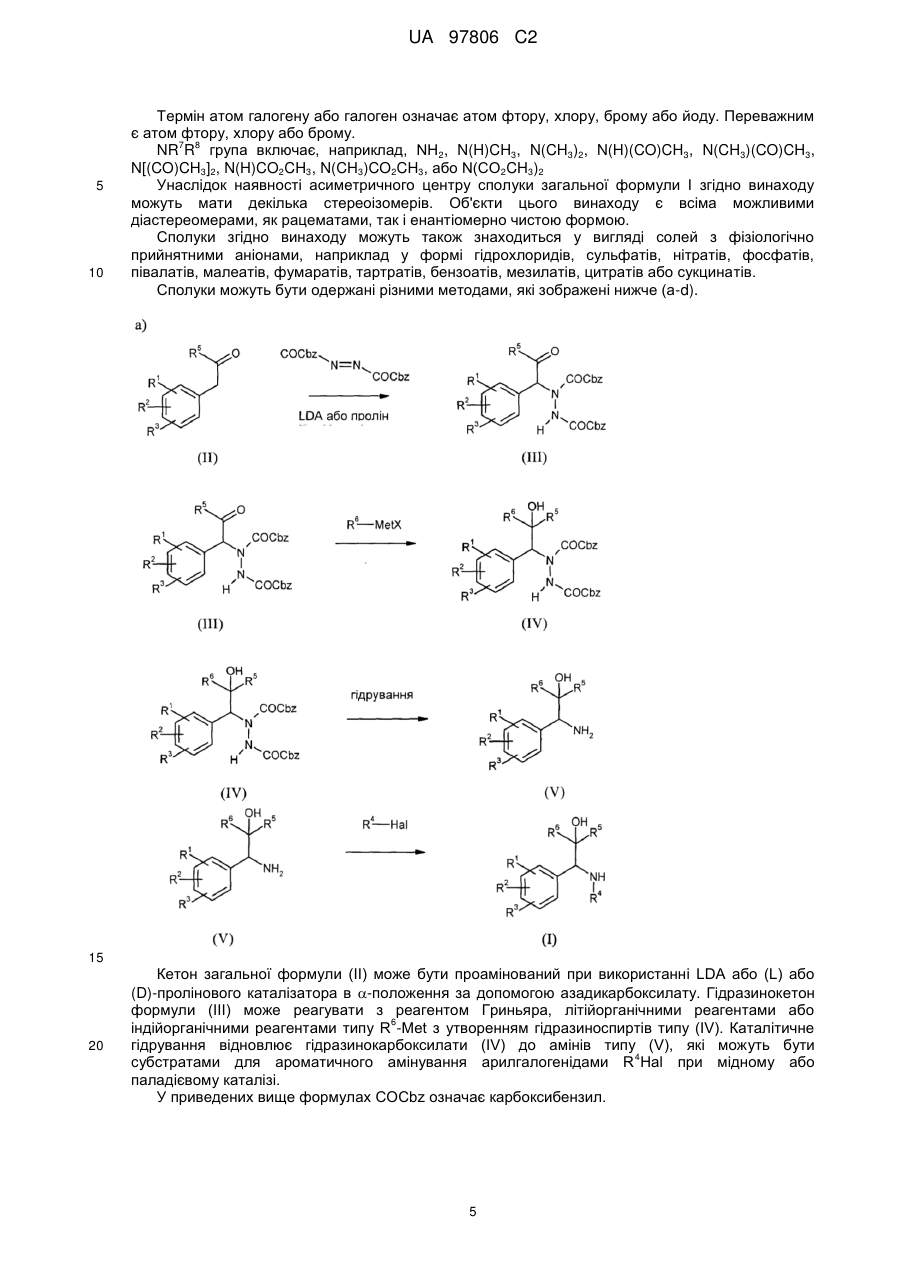
12. Сполуки загальної формули V або X
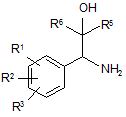 ,
,  ,
,
(V)
(X)
де
R1 і R2, незалежно один від одного, означають атом водню,
гідроксигрупу, атом галогену, необов'язково заміщену (С1-С10)-алкільну групу, необов'язково заміщену (С1-С10)-алкоксигрупу, (С1-С10)-алкілтіогрупу, (С1-С5)-перфтороалкільну групу, ціаногрупу, нітрогрупу,
або R1 і R2 разом означають групу, яка вибрана з груп
-О-(СН2)р-О-, -О-(СН2)р-СН2-, -О-СН=СН-, -(СН2)р+2-, -NH-(CH2)р+1, -N(С1-С3-алкіл)-(СН2)р+1 і -NH-N=CH-,
де р = 1 або 2, і термінальні атоми кисню і/або атоми вуглецю, і/або атоми азоту зв'язані з безпосередньо примикаючими циклічними атомами вуглецю,
або NR7R8,
де R7 і R8, незалежно один від одного, означають водень, С1-С5-алкіл або (СО)-(С1-С5)-алкіл,
R3 означає атом водню, гідроксигрупу, атом галогену, ціаногрупу, необов'язково заміщену (С1-С10)-алкільну групу, (С1-С10)-алкоксигрупу, (С1-С10)-алкілтіогрупу або (С1-С5)-перфтороалкільну групу,
R4 означає моноциклічну або біциклічну, ароматичну, частково ароматичну або неароматичну циклічну систему, яка необов'язково містить 1-4 атоми азоту, 1-2 атоми кисню і/або 1-2 атоми сірки, і необов'язково заміщену в одному або декількох місцях радикалом, вибраним з групи, що включає карбоніл, галоген, гідроксигрупу або (С1-С5)-алкіл, який необов'язково може бути заміщений 1-3 гідроксигрупами, 1-3 (С1-С5)-алкоксигрупами і/або 1-3 COOR6 групами, (С1-С5)-алкоксигрупами, (С1-С5)-алкілтіогрупами, (С1-С5)-перфтороалкілом, ціаногрупою, нітрогрупою, або
два замісники разом формують групу, яка вибрана з груп
-О-(СН2)р-О-, -О-(СН2)р-СН2-, -О-СН=СН-, -(СН2)р+2-, -NH-(CH2)p+1, -N(С1-С3-алкіл)-(СН2)р+1 і -NH-N=CH-,
де р = 1 або 2, і термінальні атоми кисню і/або атоми вуглецю, і/або атоми азоту зв'язані з безпосередньо примикаючими циклічними атомами вуглецю,
NR7R8, де R7 і R8, незалежно один від одного, можуть бути воднем, С1-С5-алкілом або (СО)-С1-С5-алкілом,
(CO)NR11R12, де R11 і R12, незалежно один від одного, означають водень або С1-С5-алкільну групу, або (С1-С5-алкілен)-О-(СО)-(С1-С5)-алкільну групу,
R5 означає частково або повністю фторовану С1-С3-алкільну групу,
R6 означає групу, вибрану з
-(С1-С10)-алкілу, який може бути необов'язково частково або повністю галогенований,
-(С2-С10)-алкенілу,
-(С2-С10)-алкінілу,
-(С1-С8)-алкіл-(С3-С7)-циклоалкілу,
-(С2-С8)-алкеніл-(С3-С7)-циклоалкілу,
-(С1-С8)-алкілгетероциклілу, -(С2-С8)-алкенілгетероциклілу,
-R9,
-(С1-С8)-алкіл-R9,
-(С2-С8)-алкеніл-R9,
-(С2-С8)-алкініл-R9,
-СН2-S-(С1-С10)-алкілу,
-CH2-S-R9,
-CH2-SO2-R9,
-(CH2)n-R9,
-СН2-SO2-(С1-С10)-алкілу,
-(CH2)n-CN,
-(CH2)n-Hal, де Hal означає F, Сl або І,
-СН2-О-(С1-С10)-алкілу,
-(CH2)n-NR7R8, де R7, R8 мають значення, визначені вище,
-CH2-O-R9,
за виключенням -СН2-СН(СН3)2, -СН=С(СН3)2 або -СН2-С(СН3)=СН2,
де
R9 означає арил, який може необов'язково бути заміщений 1-3 алкілами, гідроксигрупами, галогенами, ціаногрупами або С1-С5-алкоксигрупами, або
гетероарильну групу, де гетероарильна група може містити 1-3 гетероатоми, яка може необов'язково бути заміщена 1-3 алкілами, гідроксигрупами, галогенами, ціаногрупами або С1-С5-алкоксигрупами,
n означає ціле число, вибране з 1, 2, 3, 4, 5.
13. Сполуки загальної формули V за п. 12
 ,
,
(V)
де
щонайменше один з R1, R2, R3 вибраний з
метоксигрупи, гідроксигрупи, фтору, хлору, метилу,
або R1 і R2 разом означають групу -О-СН2-О-, -СН2-СН2-О- або -СН2-С(СН3)2-О- (утворюючи разом з фенільною групою, до якої вони приєднані, п'ятичленне кільце),
R5 означає -CF3,
R6 вибраний з
бензилу, пропілу, хлорометилу, бромометилу, етилсульфанілметилу, (імідазол-2-іл)-сульфанілметилу, (імідазол-2-іл)-сульфонілметилу, 1,2,4-триазол-3-ілсульфанілметилу, (1-метилімідазол-2-іл)-сульфанілметилу, (1Н-імідазол-2-іл)-сульфанілметилу, піримідин-2-ілсульфанілметилу, 2-пропілсульфанілметилу, ціанометилу, метилсульфанілметилу, диметиламінометилу, метоксиметил-, гідроксиметилу, етоксиметилу.
14. Сполуки загальної формули X за п. 12
 , (X)
, (X)
де
щонайменше один з R1, R2, R3 вибраний з метоксигрупи, гідроксигрупи, фтору, хлору, метилу,
або R1 і R2 разом означають групу -О-СН2-О-, -СН2-СН2-О- або -СН2-С(СН3)2-О- (утворюючи разом з фенільною групою, до якої вони приєднані, п'ятичленне кільце),
R4 вибраний з хінолін-5-ілу, фталазинілу, хіназолінілу, який може бути заміщений незалежно один раз або двічі карбонілом, метилом або фтором,
R5 означає -CF3.
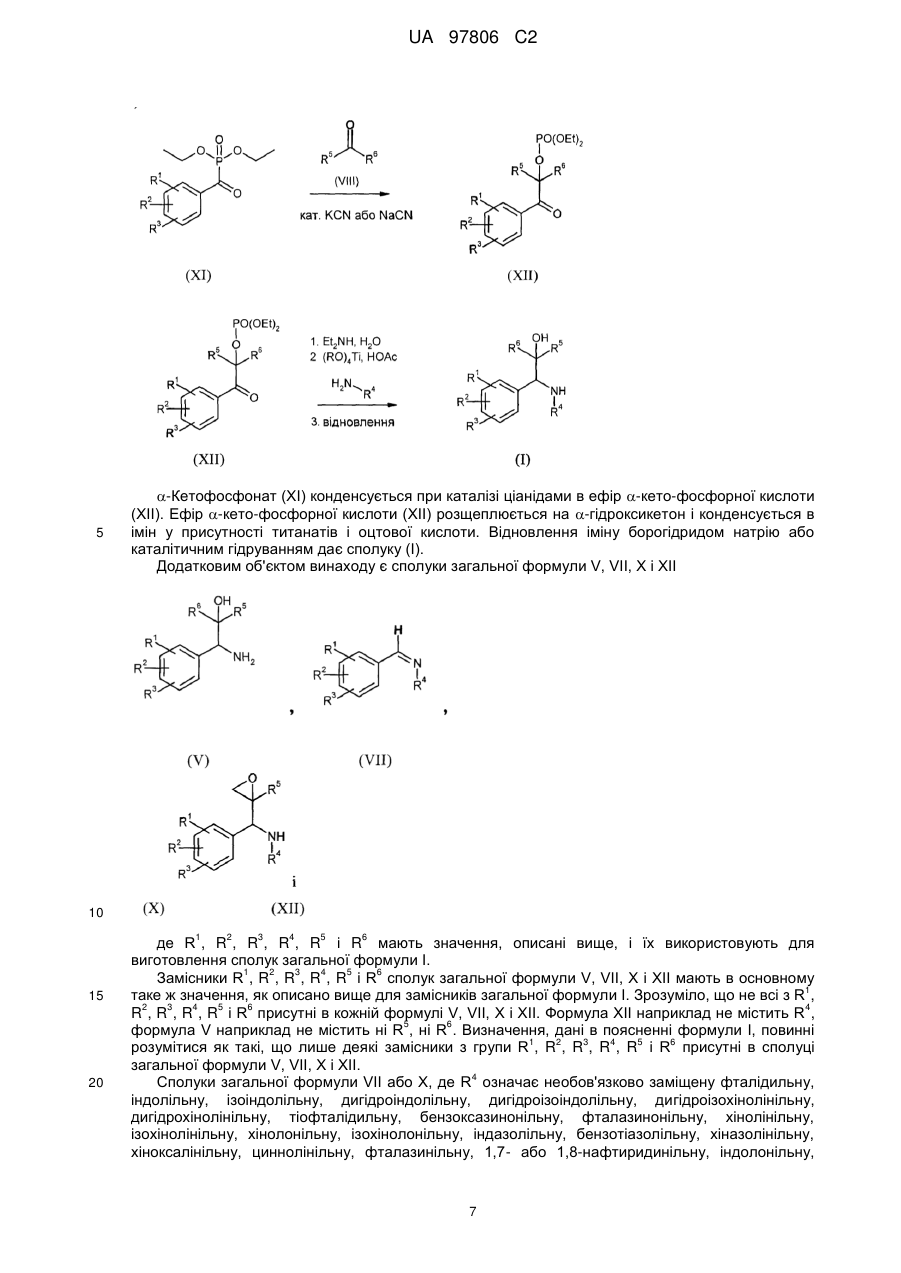
15. Сполуки загальної формули XII
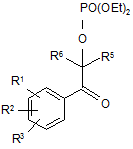 ,
,
(XII)
де
щонайменше один з R1, R2, R3 вибраний з
метоксигрупи, гідроксигрупи, фтору, хлору, метилу,
або R1 і R2 разом означають групу -О-СН2-О-, -СН2-СН2-О- або -СН2-С(СН3)2-О- (утворюючи разом з фенільною групою, до якої вони приєднані, п'ятичленне кільце),
R5 означає -CF3,
R6 вибраний з
бензилу, пропілу, хлорометилу, бромометилу, етилсульфанілметилу, (імідазол-2-іл)-сульфанілметилу, (імідазол-2-іл)-сульфонілметилу, 1,2,4-триазол-3-ілсульфанілметилу, (1-метилімідазол-2-іл)-сульфанілметилу, (1Н-імідазол-2-іл)-сульфанілметилу, піримідин-2-ілсульфанілметилу, 2-пропілсульфанілметилу, ціанометилу, метилсульфанілметилу, диметиламінометилу, метоксиметил-, гідроксиметилу, етоксиметилу.
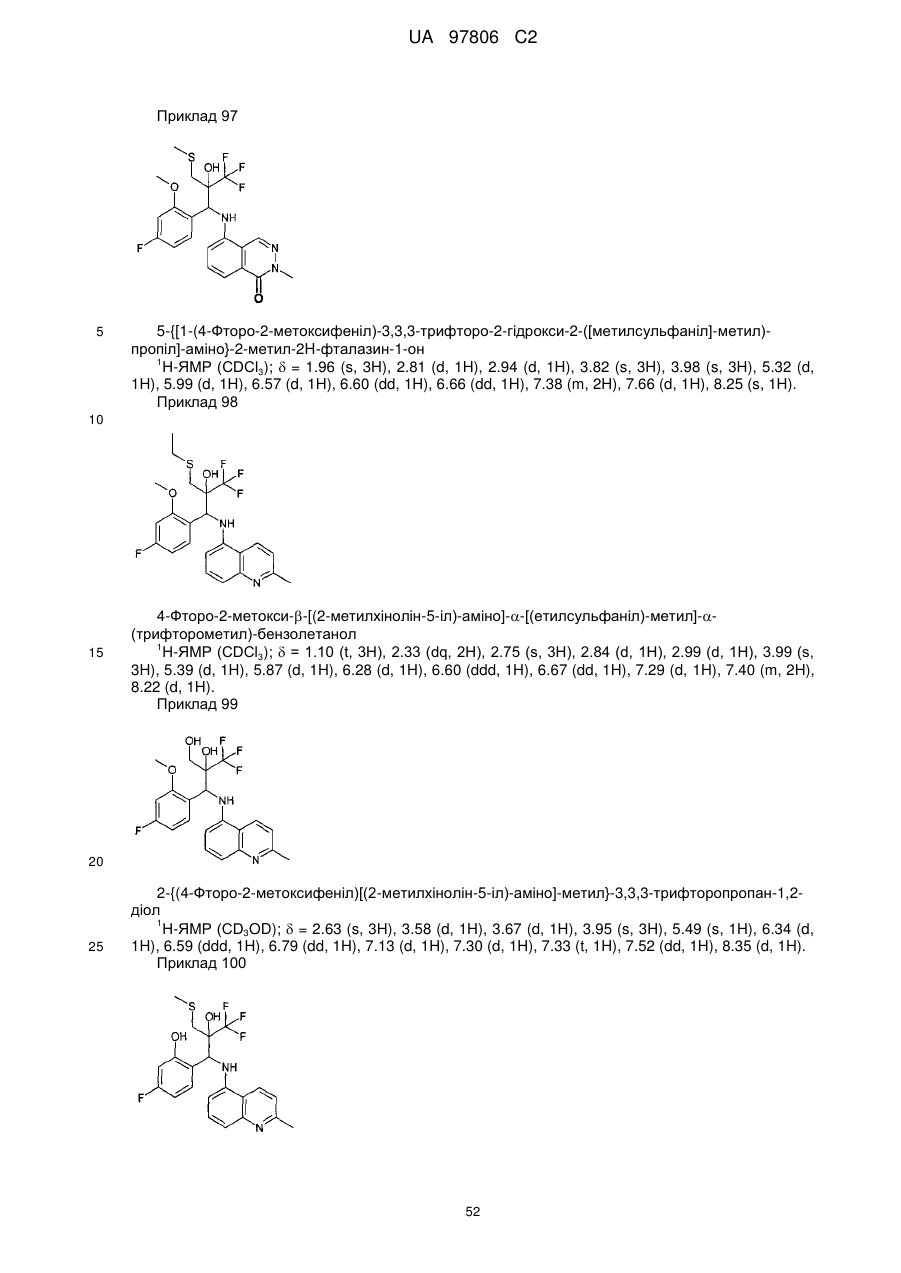
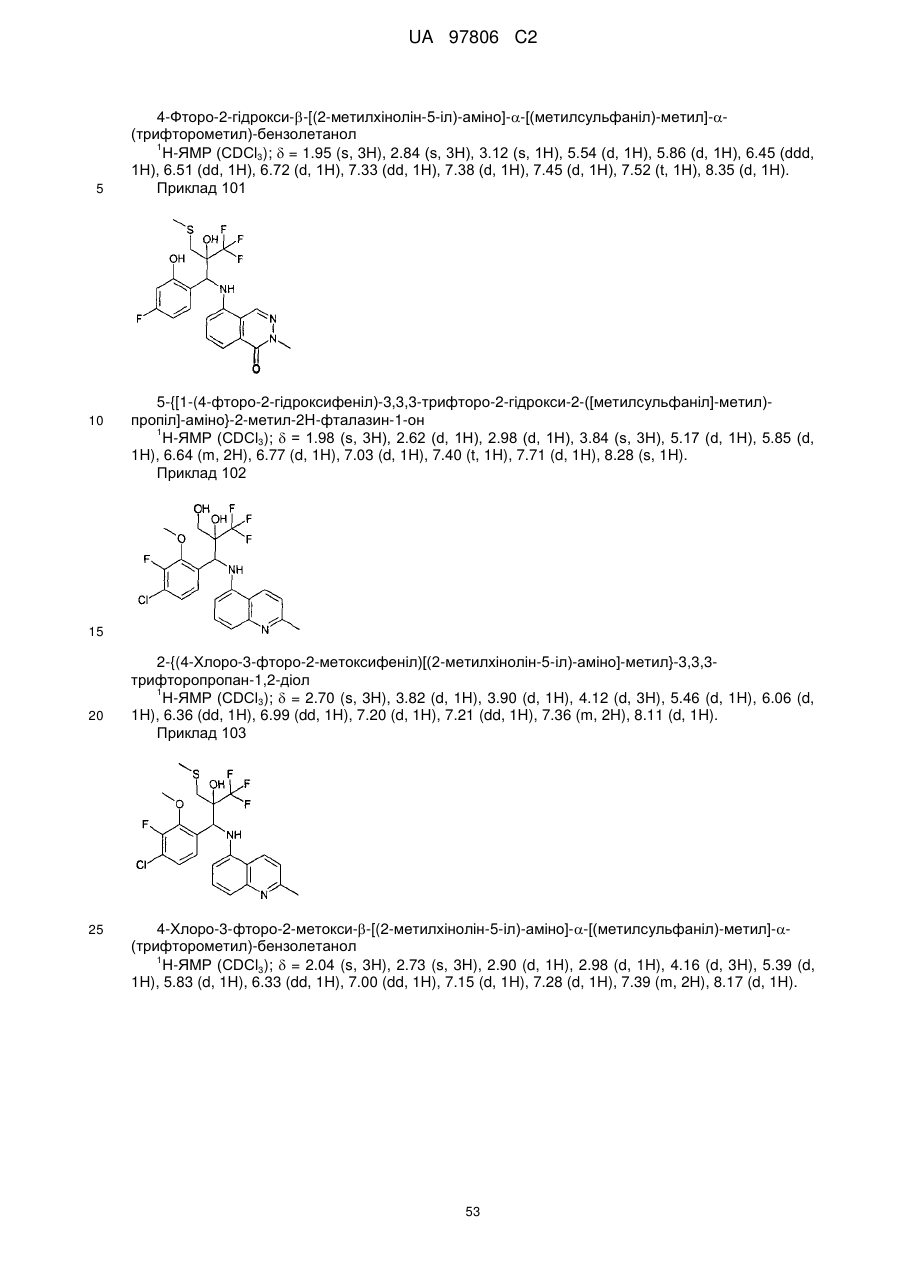
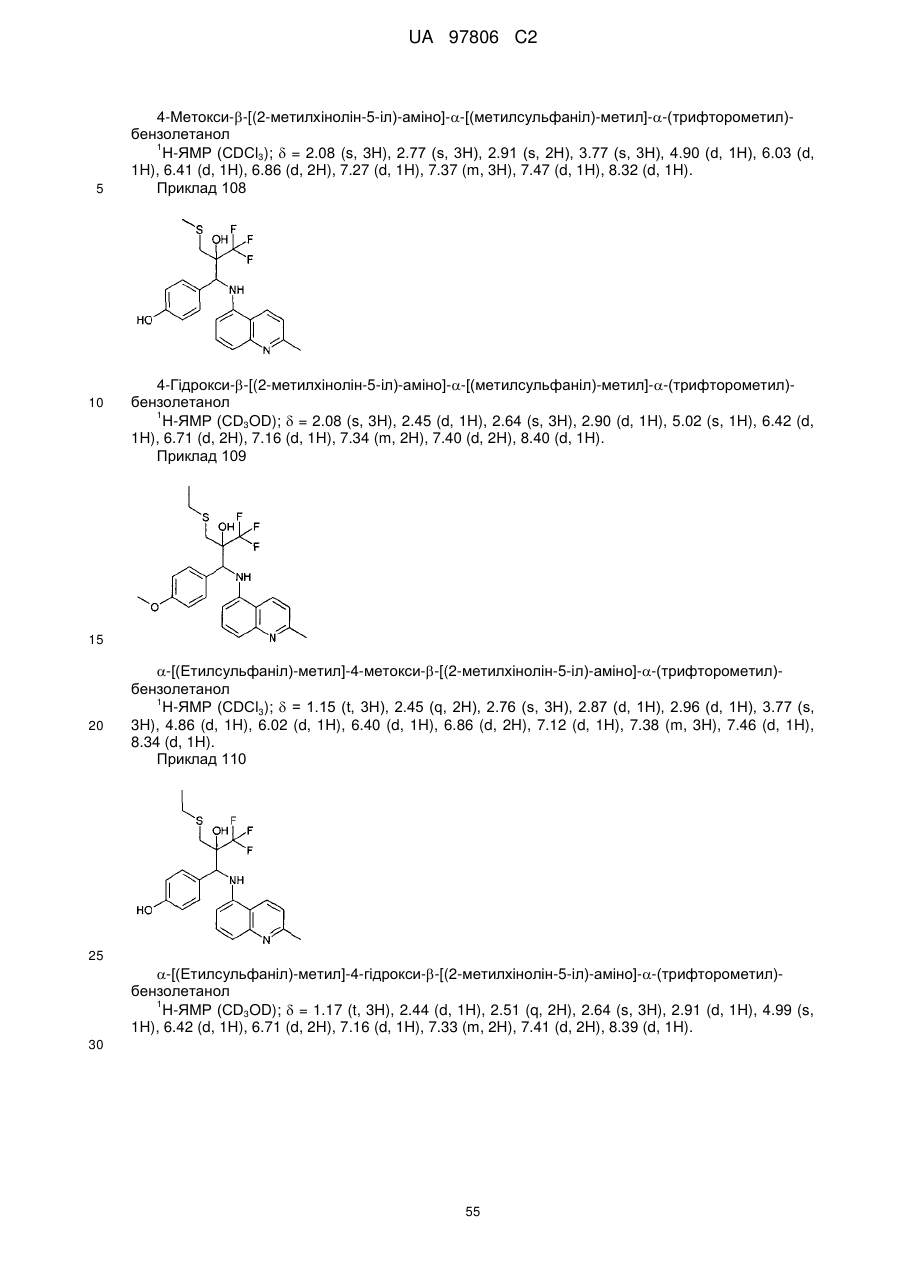
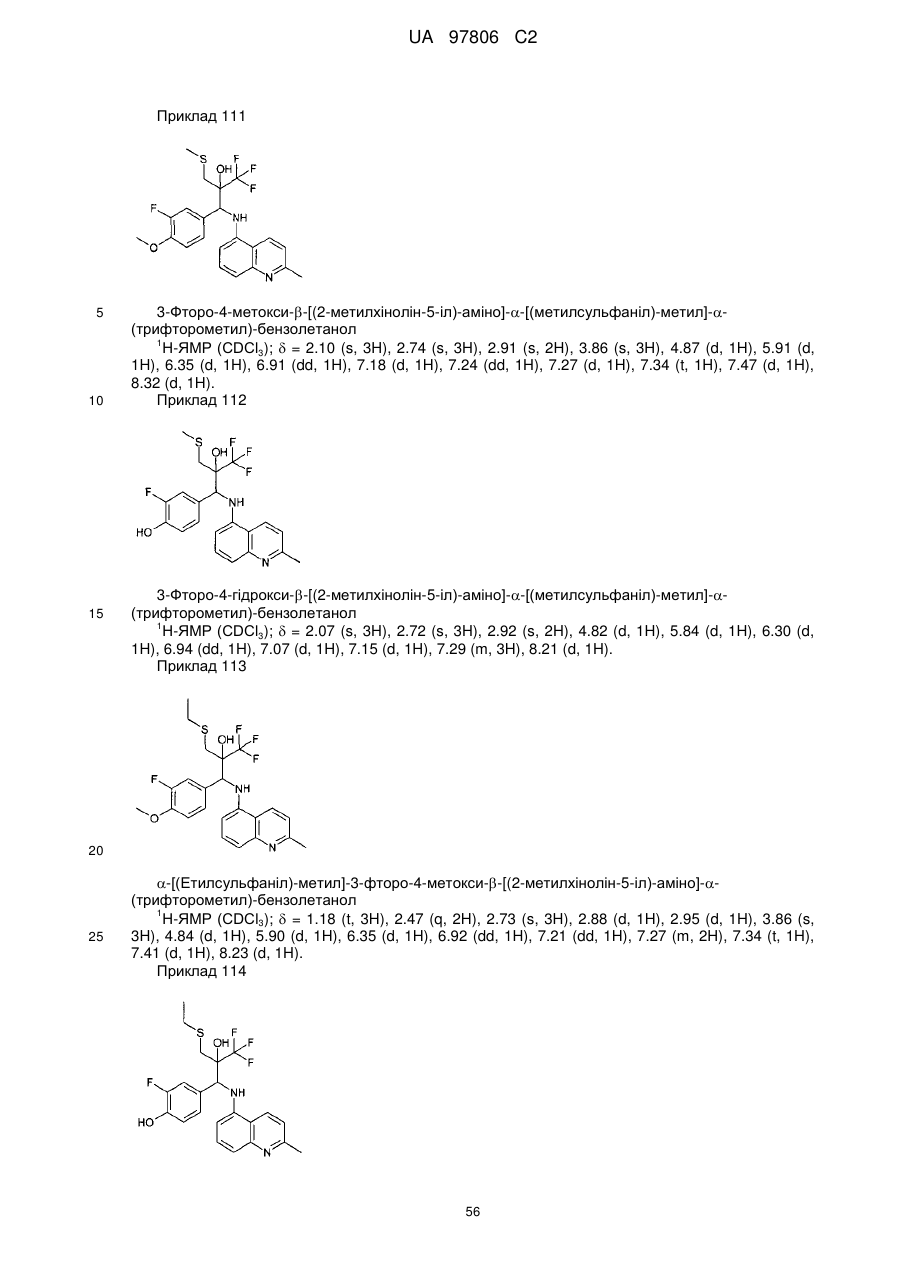
Текст
Реферат: Даний винахід стосується сполук формули І OH R6 R5 R1 R2 R3 NH (I) R4 , способу їх одержання і їх застосування як протизапальних засобів. UA 97806 C2 5 Дійсний винахід відноситься до сполук формули І, способу їх одержання і їх застосовуванню як протизапальні засоби. Ця формула заявки на патент має пріоритет згідно з Паризькою конвенцією європейської патентної заявки № ЕР 06014665.1, поданої 14 липня 2006 року, так само як і попередньої заявки US 60/830,671, поданої 14 липня 2006 року. З попереднього рівня техніки DE 10038639 і WO 02/10143, відомі протизапальні засоби наступної загальної формули , 10 15 20 25 30 у якій Аr радикал включає фталіди, тіофталіди, бензоксазинони або фталазинони. На практиці, ці сполуки показують дисоціацію дії між протизапальною і небажаною метаболічною дією і є кращими в порівнянні з раніше описаними нестероїдними глюкокортикоїдами або показують щонайменше таку ж дію. Сполуки, схожі за структурою з описаними в цій патентній заявці, розкриті в WO 2005/035518. Внаслідок промислових способів ці сполуки завжди містять групу де зв'язок між а і b або між b і с може бути ненасиченим (іншими словами вони містять -СН2СН(СН3)2, -СН=С(СН3)2 або -СН2-С(СН3)=СН2 групу). Сполуки такої композиції виключаються конкретною вказівкою в дійсній заявці. Подальші посилання, які могли б бути релевантними для дійсної заявки, процитовані нижче: G. Bartoli, et al., "Asymmetric aminolysis of aromatic epoxides: a facile catalytic enantioselective synthesis of anti-beta-aminoalcohols" Organic Letters, vol. 6, No. 13, 2004, pages 2173-2176; 1 WO 00/10977 A (Scripps Research Inst.) 1 US 2005/131226 A (Rehwinkel et al.)· He дивлячись на всі зусилля, селективність сполук попереднього рівня техніки по відношенню до глюкокортикоїдного рецептора (ГР) в порівнянні з іншими стероїдними рецепторами все ще вимагає удосконалення. Виходячи з цього, завдання дійсного винаходу створити доступні сполуки, селективність яких по відношенню до глюкокортикоїдного рецептора (ГР) є покращеною в порівнянні з іншими стероїдними рецепторами. Це завдання було вирішене за допомогою сполук згідно формули винаходу. Цей винахід, виходячи з цього відноситься до стереоізомерів загальної формули І 35 40 45 50 де 1 2 R і R незалежно один від одного, означають атом водню, гідроксигрупу, атом галогену, необов'язково заміщену (С1-С10)-алкільну групу, необов'язково заміщену (С 1-С10)-алкоксигрупу, (С1-С10)-алкілтіогрупу, (С1-С5)-перфтороалкільну групу, ціаногрупу, нітрогрупу, 1 2 або R і R разом означають групу, яка вибрана з груп -О-(СН2)р-О-, -О-(СН2)р-СН2-, - О-СНСН-, -(СН2)р+2-, -NH-(CH2)p+1, -N(С1-С3-алкіл)-(CH2)p+1, і -NH-N=CH-, де p=1 або 2, і термінальні атоми кисню і/або атоми вуглецю і/або атоми азоту зв'язані з безпосередньо примикаючими циклічними атомами вуглецю, 7 8 або NR R , 7 8 де R і R , незалежно один від одного, означають водень, С1-С5-алкіл або (СО)-(С1-С5)-алкіл, 3 R означає атом водню, гідроксигрупу, атом галогену, ціаногрупу, або необов'язково заміщену (С1-С10)-алкільну групу, (С1-С10)-алкоксигрупу, (С1-С10)-алкілтіогрупу, або (С1-С5)-перфтороалкільну групу, 1 UA 97806 C2 4 5 10 15 20 25 30 35 40 45 50 55 60 R означає моноциклічну, або біциклічну, ароматичну, частково ароматичну, або неароматичну циклічну систему, яка необов'язково містить 1-4 атоми азоту, 1-2 атоми кисню і/або 1-2 атоми сірки і необов'язково заміщену в одному або декількох місцях радикалом, вибраним з групи, що включає карбоніл, галоген, гідрокси, або (С 1-С5)-алкіл, який необов'язково 6 може бути заміщений 1-3 гідроксигрупами, 1-3 (С1-С5)-алкоксигрупами, 1-3 COOR групами, 1-3 СООН групами, 1-3 (С1-С5)-алкоксигрупами, 1-3 (С1-С5)-алкілтіогрупами, 1-3 (С1-С5)перфтороалкілами, 1-3 ціаногрупами і/або 1-3 нітрогрупами, або два замісники разом формують групу, яка вибрана з груп -О-(СН2)р-О-, -О-(СН2)р-СН2-, -О-СН=СН-, -(СН2)р+2-, -NH-(CH2)p+1-, -N(С1-С3-алкіл)-(СН2)р+1-, і NH-N=CH-, де p=1 або 2, і термінальні атоми кисню і/або атоми вуглецю і/або атоми азоту зв'язані з безпосередньо примикаючими циклічними атомами вуглецю, 7 8 7 8 NR R де R і R , незалежно один від одного, можуть означати водень, С1-С5-алкіл або (СО)С1-С5-алкіл, 11 12 11 12 (CO)NR R , де R і R , незалежно один від одного, означають водень або С 1-С5-алкільну групу, або (С1-С5-алкілен)-О-(СО)-(С1-С5)-алкільну групу, 5 R означає частково або повністю фторовану С1-С3-алкільну групу, 6 R означає групу, вибрану з -(С1-С10)-алкілу, який може бути необов'язково частково або повністю галогенований, (С2-С10)-алкенілу, (С2-С10)-алкінілу, (С1-С8)-алкіл-(С3-С7)-циклоалкілу, (С2-С8)-алкеніл-(С3-С7)-циклоалкілу, (С1-С8)-алкілгетероциклілу, (С2-С8)-алкенілгетероциклілу, 9 R, 9 -(С1-С8)-алкіл-R , 9 -(С2-С8)-алкеніл-R , 9 -(С2-С8)-алкініл-R , -СН2-S-(С1-С10)-алкілу, 9 -CH2-S-R , 9 -CH2-SO2-R , 9 -(CH2)n-R , -СН2-SО2-(С1-С10)-алкілу, -(CH2)n-CN, -(CH2)n-Hal, де Hal означає F, СІ, або І, -СН2-О-(С1-С10)-алкілу, 7 8 7 8 (CH2)n-NR R , де R , R мають значення, визначені вище, 9 CH2-O-R , за виключенням -СН2-СН(СН3)2, -СН=С(СН3)2 або -СН2-С(СН3)=СН2, де 9 R означає арил, який може необов'язково бути заміщений 1-3 алкілами, гідроксигрупами, галогенами, ціаногрупами або С1-С5-алкоксигрупами або гетероарильною групою, де гетероарильна група може містити 1-3 гетероатоми, яка може необов'язково бути заміщена 1-3 алкілами, гідроксигрупами, галогенами, ціаногрупами або С 1С5-алкоксигрупами, n означає ціле число, вибране з 1, 2, 3, 4, 5. 1 2 3 Сполуки загальної формули І, де щонайменше один з R , R або R є відмінним від водню, є 4 переважним варіантом здійснення винаходу. Крім того, сполуки загальної формули І, де R є відмінним від фенілу або нафтилу в незаміщеній формі, є іншим переважним варіантом здійснення винаходу. 1 2 Особливим об'єктом винаходу є сполуки загальної формули І, де R і R означають атоми вуглецю, зв'язані з суміжним кільцем, і разом означають О-(СН2)р-О-, -О-(СН2)р-СН2-, -ОСН=СН-, -(СН2)р+2-, -NH-(CH2)p+1-, N(С1-С3-алкіл)-(СН2)р+1-, або -NH-N=CH- (де p=1 або 2) і таким чином утворюють конденсовану циклічну систему. Термін "частково ароматична циклічна система" відноситься до біциклічних систем, які містять ароматичне кільце і неароматичне кільце, таким як, наприклад, бензоксазинони або дигідроіндолон. 4 Сполуки загальної формули І, де R означає необов'язково заміщену фталідильну, індолільну, ізоіндолільну, дигідроіндолільну, дигідроізоіндолільну, дигідроізохінолінільну, 2 UA 97806 C2 5 10 15 20 25 30 35 40 45 50 55 60 дигідрохінолінільну, тіофталідильну, бензоксазинонільну, фталазинонільну, хінолінільну, ізохінолінільну, хінолонільну, ізохінолонільну, індазолільну, бензотіазолільну, хіназолінільну, хіноксалінільну, циннолінільну, фталазинільну, 1,7- або 1,8-нафтиридинільну, індолонільну, ізоіндолонільну, дигідроіндолонільну, дигідроізоіндолонільну, бензімідазолільну, кумаринільну, ізокумаринільну, піразолопіримідинільну або індолільну групу, яка зв'язана за допомогою будьякого положення. Вони є іншим об'єктом винаходу, якщо ці гетероциклічні системи заміщені. Вони є іншим об'єктом винаходу, якщо вони заміщені 1-3 однаковими або різними радикалами, вибраними з групи, що включає С1-С3-алкіл, гідрокси, карбоніл або галоген, особливо, якщо вони заміщені метилом, хлором або фтором. 4 Іншим об'єктом винаходу є сполуки загальної формули І, де R означає феніл, нафтил, хінолін-5-іл, фталазиніл, хіназолініл, який може бути необов'язково заміщений незалежно 1-3 радикалами, вибраними з групи, що включає карбоніл, С 1-С3-алкіл, хлор або фтор. 4 Переважно лише одна карбонільна група знаходиться в R . 4 Іншим об'єктом винаходу є сполуки загальної формули І, де R означає хінолін-5-іл, фталазиніл, хіназолініл, який може бути необов'язково заміщений незалежно 1-3 радикалами, вибраними з групи, що включає карбоніл, С 1-С3-алкіл, хлор або фтор. 4 Іншим об'єктом винаходу є сполуки загальної формули І, де R означає феніл, нафтил, хінолін-5-іл, фталазиніл, хіназолініл, який може бути необов'язково заміщений незалежно один раз або двічі карбонілом, метилом або фтором. 4 Іншим об'єктом винаходу є сполуки загальної формули І, де R означає хінолін-5-іл, фталазиніл, хіназолініл, який може бути заміщений незалежно один раз або двічі карбонілом або метилом. 4 Іншим об'єктом винаходу є сполуки загальної формули І, де R означає феніл, нафтил, 2метилхінолін-5-іл, хінолін-5-іл, 2-метил-фталазин-1-он-іл, 2-метил-2Н-фталазин-1-он-іл, 7фторо-2-метил-хіназолін. 4 Ще іншим об'єктом винаходу є сполуки загальної формули І, де R означає 2-метилхінолін-5іл, хінолін-5-іл, 2-метил-фталазин-1-он-іл, 2-метил-2Н-фталазин-1-он-іл, 7-фторо-2-метилхіназолін. 4 Однією групою сполук загальної формули І є така, де R означає гетероцикл, що містить один або більше атомів азоту, такий як піридин, піримідин, індолізин, індол або ізоіндол, піразол, імідазол, триазол, хінолін, ізохінолін, циннолін, фталазин, або хіназолін. Іншою групою 4 сполук загальної формули І є така, де R означає кисневмісний гетероцикл, такий як кумарон 4 (бензофуран) або хроман. Додатковою групою сполук загальної формули І є така, де R означає гетероцикл, що містить один або більше різних гетероатомів, такий як тіазол, ізотіазол, оксазол або бензотіазол. 4 Сполуки формули І, які як R несуть кумаринільний або ізокумаринільний радикал, зокрема ізокумаринільний радикал, який необов'язково може бути заміщений 0-3 однаковими або різними радикалами з групи, що включає С1-С3-алкіл, гідрокси, карбоніл або галоген, зокрема метилом, хлором або фтором, є додатковим об'єктом винаходу. 4 R може бути заміщений в одному або більшому положеннях радикалом, вибраним з групи, що включає карбонільну групу, галоген, гідроксигрупу, (С 1-С5)-алкіл, (С1-С5)-алкоксигрупу, (С17 8 9 7 8 С5)-алкілтіогрупу, (С1-С5)-перфтороалкіл, ціаногрупу, нітрогрупу, NR R COOR (CO)NR R або (С1-С5-алкілен)-О-(СО)-(С1-С5)-алкільну групу, переважно з групи, що включає С1-С3-алкіл, С1С3-алкокси, гідрокси, галоген, або карбоніл; переважно метилом, хлором або фтором. Замісники можуть бути однаковими або різними. 4 Карбонільний замісник для групи R має бути визначений так, щоб карбонільний атом вуглецю був атомом вуглецю кільця, з яким атом кисню зв'язаний подвійним зв'язком. 4 Сполуки загальної формули І, де радикал R незаміщений або заміщений одним або декількома однаковими або різними радикалами з групи, що включає С 1-С3-алкіл, С1-С3-алкокси, гідрокси, галоген, або карбоніл, переважно незаміщений або заміщений одним або декількома однаковими або різними радикалами з групи, що включає С 1-С3-алкіл, гідрокси, карбоніл або галоген, зокрема одним або декількома однаковими або різними радикалами з групи метил, хлор або фтор, особливо метилом, хлором або фтором, є об'єктом винаходу. 4 Необов'язково атом азоту радикалу R загальної формули за п. 1 (такий як в індазолі, хінолоні, ізохінолоні і фталазині) може також бути алкілований С1-С3-алкільною групою. 4 Сполуки загальної формули І, де R означає моноциклічну 5- або 6-членну циклічну систему, яка зв'язана за допомогою будь-якого положення, таку як, наприклад, фуран або тіофен, є об'єктом винаходу. 4 Сполуки загальної формули І, де R означає заміщене фенільне кільце або заміщене нафтильне кільце, є об'єктом винаходу. 3 UA 97806 C2 4 2 R. 5 10 15 20 25 30 35 40 45 50 55 1 Як замісники для кілець, що містяться в R , підходящими є такі ж, які вже розкриті для R і 5 Сполуки за п. 1, де R означає трифторометил або пентафтороетил, є окремим об'єктом винаходу. Сполуки загальної формули І, де фенільна група заміщена 1-3 однаковими або різними замісниками, вибраними з групи, що включає карбоніл, С1-С3-алкокси, гідрокси, і галоген, зокрема карбонілом, метоксигрупою, гідроксигрупою, фтором, хлором, або бромом, і де 4 R означає дигідроізоіндолоніл, ізохінолоніл, хіназолініл, індазоліл, кумариніл, ізокумариніл, який може бути заміщений 0-2 замісниками, які вибрані з групи, що включає карбоніл, С 1-С3алкіл і галоген, зокрема метилом і фтором 5 і R означає CF3 або C2F5, зокрема CF3, є переважним об'єктом винаходу. Найбільш переважний варіант здійснення такий, де: 1 2 3 І) щонайменше один з R , R , R вибраний з метоксигрупи, гідроксигрупи, фтору, хлору, 1 2 метилу, або R і R разом означають групу -О-СН2-О-, -СН2-СН2-О- або -СН2-С(СН3)2-О(утворюючи разом з фенільною групою, до якої вони приєднані, п'ятичленне кільце), 4 II) R вибраний з хінолін-5-ілу, фталазинілу, хіназолінілу, який може бути заміщений незалежно один раз або двічі карбонілом, метилом або фтором, 5 III) R означає -CF3, 6 IV) R вибраний з бензилу, пропілу, хлорометилу, бромометилу, етилсульфанілметилу, (імідазол-2-іл)сульфанілметилу, (імідазол-2-іл)-сульфонілметилу, 1,2,4-триазол-3-ілсульфанілметилу, (1метил-імідазол-2-іл)-сульфанілметилу, (1Н-імідазол-2-іл)-сульфанілметилу, піримідин-2-ілсульфанілметилу, 2-пропілсульфанілметилу, ціанометилу, метилсульфанілметилу, диметиламінометилу, етоксиметил-, гідроксиметилу, етоксиметилу, і всі комбінації I-IV. До того ж, винахід відноситься до застосування сполук загальної формули І для виготовлення фармацевтичних агентів, так само як і їх застосовування для виготовлення фармацевтичних агентів для лікування запальних захворювань. Якщо не відмічено інакше, термін "алкіл" відноситься до нерозгалужених або розгалужених похідних. Наприклад, термін пропіл включає н-пропіл і iзо-пропіл, термін бутил включає н-бутил, iзо-бутил і трет-бутпл. С1-С5-алкільні групи можуть бути нерозгалуженими або розгалуженими і означають метильну, етильну, н-пропільну, iзо-пропільну, н-бутил, ізо-бутильну, трет-бутильну або нпентильну групу, або 2,2-диметилпропіл, 2-метилбутил або 3-метилбутил. Переважними є метильна або етильна групи. Вони необов'язково можуть бути заміщені 1-3 гідроксигрупами, 1-3 6 С1-С5-алкоксигрупами і/або 1-3 COOR групами. Переважними є гідроксигрупи. 1 2 3 4 С1-С5-алкоксигрупи в R , R , R і R можуть бути нерозгалуженими або розгалуженими і означають метоксигрупу, етоксигрупу, н-пропоксигрупу, ізо-пропоксигрупу, н-бутоксигрупу, ізобутоксигрупу, трет-бутоксигрупу або н-пентоксигрупу, 2,2-диметилпропоксигрупу, 2метилбутоксигрупу або 3-метилбутоксигрупу. Метоксигрупа або етоксигрупа є переважними. С1-С5-алкілтіогрупи можуть бути нерозгалуженими або розгалуженими і означають метилтіогрупу, етилтіогрупу, н-пропілтіогрупу, ізо-пропілтіогрупу, н-бутилтіогрупу, ізобутилтіогрупу, трет-бутилтіогрупу або н-пентилтіогрупу, 2,2-диметилпропілтіогрупу, 2метилбутилтіогрупу або 3-метилбутилтіогрупу. Метилтіогрупа або етилтіогрупа є переважними. Для частково або повністю галогенованої С 1-С10-алкільної групи, наступні частково або повністю галогеновані групи включають, наприклад: фторометил, дифторометил, трифторометил, фтороетил, 1,1-дифтороетил, 1,2-дифтороетил, 1,1,1-трифтороетил, тетрафтороетил, і пентафтороетил, хлорометил, дихлорометил, трихлорометил, хлороетил, 1,1-дихлороетил, 1,2-дихлороетил, 1,1,1-трихлороетил, 1,1,1-трихлоропропіл, хлоропропіл, бромометил, дибромометил, бромоетил, 1,1-дибромоетил, 1,2-дибромоетил, бромопропіл, бромобутил, і бромопентил, йодометил, дийодометил, йодоетил, 1,1-дийодоетил, 1,2дийодоетил, йодопропіл, йодобутил, і йодопентил. Переважними варіантами втілення є: фторометил, трифторометил, фтороетил, 1,1,1-трифтороетил, пентафтороетил, хлорометил, хлороетил, хлоропропіл, бромометил, бромоетил, бромопропіл. Для частково або повністю фторованої С1-С3-алкільної групи, можуть враховуватися наступні частково або повністю фторовані групи: фторометил, дифторометил, трифторометил, фтороетил, 1,1-дифтороетил, 1,2-дифтороетил, 1,1,1-трифтороетил, тетрафтороетил, і пентафтороетил. З останнього, трифторометильна група або пентафтороетильна група є переважними. 4 UA 97806 C2 5 10 Термін атом галогену або галоген означає атом фтору, хлору, брому або йоду. Переважним є атом фтору, хлору або брому. 7 8 NR R група включає, наприклад, NH2, N(H)CH3, N(CH3)2, N(H)(CO)CH3, N(CH3)(CO)CH3, N[(CO)CH3]2, N(H)CO2CH3, N(CH3)CO2CH3, або N(CO2CH3)2 Унаслідок наявності асиметричного центру сполуки загальної формули І згідно винаходу можуть мати декілька стереоізомерів. Об'єкти цього винаходу є всіма можливими діастереомерами, як рацематами, так і енантіомерно чистою формою. Сполуки згідно винаходу можуть також знаходиться у вигляді солей з фізіологічно прийнятними аніонами, наприклад у формі гідрохлоридів, сульфатів, нітратів, фосфатів, півалатів, малеатів, фумаратів, тартратів, бензоатів, мезилатів, цитратів або сукцинатів. Сполуки можуть бути одержані різними методами, які зображені нижче (a-d). 15 20 Кетон загальної формули (II) може бути проамінований при використанні LDA або (L) або (D)-пролінового каталізатора в -положення за допомогою азадикарбоксилату. Гідразинокетон формули (III) може реагувати з реагентом Гриньяра, літійорганічними реагентами або 6 індійорганічними реагентами типу R -Met з утворенням гідразиноспиртів типу (IV). Каталітичне гідрування відновлює гідразинокарбоксилати (IV) до амінів типу (V), які можуть бути 4 субстратами для ароматичного амінування арилгалогенідами R Hal при мідному або паладієвому каталізі. У приведених вище формулах COCbz означає карбоксибензил. 5 UA 97806 C2 4 5 Бензальдегіди типу (VI) можуть конденсуватися з амінами типу R -NH2 з утворенням імінів типу (VII), використовуючи алкоголяти титану або органічні кислоти як реагенти. Іміни типу (VII) взаємодіють з кетоном типу (VIII) в перехресному пінакольному сполученні (Tetrahedron.Lett. 1992, 33, 1285-8; J.Am.Chem.Soc 1956, 78, 2268; Tetrahedron 1964, 20, 2163), із застосуванням солей металів (солі перехідних металів в низькому ступені валентності) як, наприклад, NbCl 3 або Sml2 з утворенням бензил-1-аміно-2-олів формули (І). 10 15 20 Іміни типу (VII), зображені в b), обробляють при низьких температурах від -80° до -100°С літійованим епоксидом (IX) з утворенням сполук типу (X). Епоксиди (X) можуть бути розкриті 6' нуклеофілами типу R -Met' з утворенням сполуки (І*). Можливими нуклеофілами є алкілкупрати, вінілкупрати, тіоли, алілсилани, вінілсилани, вінілстанани, реагенти Гриньяра, у присутності кислоти Льюїса, такої як BF3 або АlМе3, АlСl3, ціаніди, аміни, спирти і тіоспирти. Цей процес, описаний вище, може бути проведений енантіоселективно за допомогою застосування енантіочистих епоксидів формули (IX) з утворенням енантіочистих сполук формули (X) і (І*). Для фахівця в даній галузі техніки ясно, що при використанні цього синтетичного шляху 6 може бути синтезована лише підгрупа групи R як позначено в п. 1. Цим сполукам потрібна 6 метиленова група (-СН2-) як перший елемент в групі R . Різні варіанти, які можливі, визначені у 6' формулі винаходу як -CH2-R . 6 UA 97806 C2 5 -Кетофосфонат (XI) конденсується при каталізі ціанідами в ефір -кето-фосфорної кислоти (XII). Ефір -кето-фосфорної кислоти (XII) розщеплюється на -гідроксикетон і конденсується в імін у присутності титанатів і оцтової кислоти. Відновлення іміну борогідридом натрію або каталітичним гідруванням дає сполуку (І). Додатковим об'єктом винаходу є сполуки загальної формули V, VII, X і XII 10 1 15 20 2 3 4 5 6 де R , R, R , R , R і R мають значення, описані вище, і їх використовують для виготовлення сполук загальної формули І. 1 2 3 4 5 6 Замісники R , R , R , R , R і R сполук загальної формули V, VII, X і XII мають в основному 1 таке ж значення, як описано вище для замісників загальної формули І. Зрозуміло, що не всі з R , 2 3 4 5 6 4 R , R , R , R і R присутні в кожній формулі V, VII, X і XII. Формула XII наприклад не містить R , 5 6 формула V наприклад не містить ні R , ні R . Визначення, дані в поясненні формули І, повинні 1 2 3 4 5 6 розумітися як такі, що лише деякі замісники з групи R , R , R , R , R і R присутні в сполуці загальної формули V, VII, X і XII. 4 Сполуки загальної формули VII або X, де R означає необов'язково заміщену фталідильну, індолільну, ізоіндолільну, дигідроіндолільну, дигідроізоіндолільну, дигідроізохінолінільну, дигідрохінолінільну, тіофталідильну, бензоксазинонільну, фталазинонільну, хінолінільну, ізохінолінільну, хінолонільну, ізохінолонільну, індазолільну, бензотіазолільну, хіназолінільну, хіноксалінільну, циннолінільну, фталазинільну, 1,7- або 1,8-нафтиридинільну, індолонільну, 7 UA 97806 C2 5 10 15 20 25 30 35 40 45 50 55 ізоіндолонільну, дигідроіндолонільну, дигідроізоіндолонільну, бензімідазолільну, кумаринільну, ізокумаринільну, піразолопіримідинільну або індолільну групу, яка зв'язана за допомогою будьякого положення. Вони є іншим об'єктом винаходу, якщо ці гетероциклічні системи заміщені. Вони є іншим об'єктом винаходу, якщо вони заміщені 1-3 однаковими або різними радикалами з групи, що включає С1-С3-алкіл, гідрокси, карбоніл або галоген, особливо, якщо вони заміщені метилом, хлором або фтором. 4 Іншим об'єктом винаходу є сполуки загальної формули VII або X, де R означає феніл, нафтил, хінолін-5-іл, фталазиніл, хіназолініл, який може бути необов'язково заміщений незалежно 1-3 радикалами, вибраними з групи, що включає карбоніл, С 1-С3-алкіл, хлор або фтор. 4 Переважно лише одна карбонільна група знаходиться в R . 4 Іншим об'єктом винаходу є сполуки загальної формули VII або X, де R означає, хінолін-5-іл, фталазиніл, хіназолініл, який може бути необов'язково заміщений незалежно 1-3 радикалами, вибраними з групи, що включає карбоніл, С 1-С3-алкіл, хлор або фтор. 4 Іншим об'єктом винаходу є сполуки загальної формули VII або X, де R означає феніл, нафтил, хінолін-5-іл, фталазиніл, хіназолініл, який може бути необов'язково заміщений незалежно один раз або двічі карбонілом, метилом або фтором. 4 Іншим об'єктом винаходу є сполуки загальної формули VII або X, де R означає хінолін-5-іл, фталазиніл, хіназолініл, який може бути заміщений незалежно один раз або двічі карбонілом, метилом або фтором. 4 Іншим об'єктом винаходу є сполуки загальної формули VII або X, де R означає феніл, нафтил, 2-метилхінолін-5-іл, хінолін-5-іл, 2-метил-фталазин-1-он-іл, 2-метил-2Н-фталазин-1-оніл, 7-фторо-2-метил-хіназолін. 4 Ще іншим об'єктом винаходу є сполуки загальної формули VII або X, де R означає 2метилхінолін-5-іл, хінолін-5-іл, 2-метил-фталазин-1-он-іл, 2-метил-2Н-фталазин-1-он-іл, 7фторо-2-метил-хіназолін. 4 Однією групою сполук загальної формули І є така, де R означає гетероцикл, що містить один або більше атомів азоту, такий як піридин, піримідин, індолізин, індол або ізоіндол, піразол, імідазол, триазол, хінолін, ізохінолін, циннолін, фталазин, або хіназолін. Іншою групою 4 сполук загальної формули VII або X є така, де R означає кисневмісний гетероцикл, такий як кумарон (бензофуран) або хроман. Додатковою групою сполук загальної формули VII або X є 4 така, де R означає гетероцикл, що містить один або більше різних гетероатомів, такий як тіазол, ізотіазол, оксазол або бензотіазол. 4 Сполуки формули VII або X, які як R несуть кумаринільний або ізокумаринільний радикал, зокрема ізокумаринільний радикал, який необов'язково може бути заміщений 0-3 однаковими або різними радикалами з групи, що включає С1-С3-алкіл, гідрокси, карбоніл або галоген, зокрема метилом, хлором або фтором, є додатковим об'єктом винаходу. 4 R в сполуках загальної формули VII або X може бути заміщений в одному або більшому положеннях радикалом, вибраним з групи, що включає карбоніл, галоген, гідрокси, (С 1-С5)-алкіл, 7 8 9 7 8 (С1-С5)-алкокси, (С1-С5)-алкілтіо, (С1-С5)-перфтороалкіл, ціано, нітро, NR R COOR (CO)NR R або (С1-С5-алкілен)-О-(СО)-(С1-С5)-алкільна група, переважно з групи, що включає С1-С3-алкіл, С1-С3-алкокси, гідрокси, галоген, або карбоніл; переважно метилом, хлором або фтором. Замісники можуть бути однаковими або різними. 4 Карбонільний замісник для групи R в сполуках формули VII або X має бути визначений так, щоб карбонільний атом вуглецю був атомом вуглецю кільця, з яким атом кисню зв'язаний подвійним зв'язком. 4 Сполуки загальної формули VII або X, де радикал R незаміщений або заміщений одним або декількома однаковими або різними радикалами з групи, що включає С 1-С3-алкіл, С1-С3-алкокси, гідрокси, галоген, або карбоніл, переважно незаміщений або заміщений одним або декількома однаковими або різними радикалами з групи, що включає С1-С3-алкіл, гідрокси, карбоніл або галоген, зокрема одним або декількома однаковими або різними радикалами з групи метил, хлор або фтор, особливо метилом, хлором або фтором, є об'єктом винаходу. 4 Необов'язково атом азоту радикалу R формул VII або X у формулі винаходу (такий як в індазолі, хінолоні, ізохінолоні і фталазині) може також бути алкілований С 1-С3-алкільною групою. 4 Сполуки загальної формули VII або X, де R означає моноциклічну 5- або 6-членну циклічну систему, яка зв'язана за допомогою будь-якого положення, таку як, наприклад, фуран або тіофен, є об'єктом винаходу. 4 Сполуки загальної формули VII або X, де R означає заміщене фенільне кільце або заміщене нафтильне кільце, є об'єктом винаходу. 8 UA 97806 C2 4 2 1 Як замісники для кілець, що містяться в R , підходящими є такі ж, які вже розкриті для R і R. 5 10 15 20 25 30 35 40 45 50 55 60 Особливо переважними є сполуки загальної формули V, VII, X і XII де 1 2 3 І) щонайменше один з R , R , R вибраний з метоксигрупи, гідроксигрупи, фтору, хлору, 1 2 метилу, або R і R разом означають групу -О-СН2-О-, -СН2-СН2-О- або -СН2-С(СН3)2-О(утворюючи разом з фенільною групою, до якої вони приєднані, п'ятичленне кільце), 4 II) R вибраний з хінолін-5-ілу, фталазинілу, хіназолінілу, який може бути заміщений незалежно один раз або двічі карбонілом, метилом або фтором, 5 III) R означає -CF3, 6 IV) R вибраний з бензилу, пропілу, хлорометилу, бромометилу, етилсульфанілметилу, (імідазол-2-іл)сульфанілметилу, (імідазол-2-іл)-сульфонілметилу, 1,2,4-триазол-3-ілсульфанілметилу, (1метил-імідазол-2-іл)-сульфанілметилу, (1Н-імідазол-2-іл)-сульфанілметилу, піримідин-2-ілсульфанілметилу, 2-пропілсульфанілметилу, ціанометилу, метилсульфанілметилу, диметиламінометилу, етоксиметил-, гідроксиметилу, етоксиметилу, і всі комбінації I-IV. Якщо різні сполуки згідно винаходу присутні як рацемічні суміші, вони можуть бути розділені на чисті, оптично активні форми згідно методам розділення рацематів, які знайомі фахівцеві в даній галузі техніки. Наприклад, рацемічні суміші можуть бути розділені хроматографією на оптично активному носієві (CHIRALPAK AD) на чисті ізомери. Також можливо естерифікувати вільну гідроксигрупу в рацемічній сполуці загальної формули І за допомогою оптично активної кислоти і розділити діастереоізомерні ефіри, що досягається фракційною кристалізацією або хроматографією, і гідролізувати розділені ефіри в кожному випадку на оптично чисті ізомери. Як оптично активна кислота можуть бути застосовані, наприклад, мигдалева кислота, камфорсульфокислота або винна кислота. Зв'язування речовин глюкокортикоїдним рецептором і іншими рецепторами стероїдних гормонів (мінеральний кортикоїдний рецептор (МР), прогестероновий рецептор (ПР) і андрогеновий рецептор (АР)) перевірене за допомогою рекомбінантно створених рецепторів. Для вивчення зв'язування застосовувалися цитозольні препарати клітин Sf9, які були заражені 3 рекомбінантними бакуловірусами, кодовані для GR. Порівняно з контрольною речовиною [ Н]дексаметазоном, речовини показують від високої до дуже високої афінність до GR. IC 50(GR)=64 нМ була виміряна таким чином для сполуки Прикладу 3. Як молекулярний механізм для протизапальної дії глюкортикоїдів, розглянуто GR-проміжне інгібування транскрипції цитокінів, адгезійних молекул, ферментів і інших протизапальних чинників. Цей інгібітор може вироблятися шляхом взаємодії GR з іншими чинниками транскрипцій, напр., АР-1 і NF-kappa-B (для огляду, дивися Cato, А. С. В., and Wade, E., BioEssays 18,371-378, 1996). Сполуки загальної формули І згідно винаходу інгібують секрецію цитокіна IL-8 в людській моноцитарній клітинній лінії ТНР-1, яка ініційована ліпополісахаридом (ЛПС). Концентрація цитокінів була визначена в супернатанті за допомогою комерційно доступних ELISA наборів. Сполуки Прикладу 3 показали інгібування ІС50(IL8)=25 нмоль. Протизапальну дію сполук загальної формули І перевіряли в експериментах з тваринами за допомогою аналізу запалення, викликаного кротоновим маслом, у щурів і мишей (J. Exp. Med. (1995), 182, 99-108). З цією метою, кротонове масло в етанольному розчині застосовували локально на вухах тварин. Досліджувані речовини були також застосовані локально або систематично в той же час або за дві години до кротонового масла. Після 16-24 годин вимірювали вагу вуха як критерій запального набряку, пероксидну активність як критерій інвазії гранулоцитів, і еластазну активність як критерій інвазії нейтрофільних гранулоцитів. У цьому тесті, сполуки загальної формули І інгібують три вище згаданих параметра запалення, як після локального введення, так і після систематичного введення. Однією з найбільш частих небажаних дій глюкокортикоїдної терапії є так званий "стероїдний діабет" [напр., Hatz, Η. J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien [Glucocorticoids: Immunological Bases, Pharmacology and Therapy Guidelines], Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998]. Причиною цього є стимуляція глюконеогенезу в печінці індукцією ферментів, відповідальних в цьому відношенні і вільними амінокислотами, які продукуються з розкладання протеїнів (катаболічна дія глюкокортикоїдів). Ключовим ферментом катаболічного метаболізму в печінці є тирозинамінотрансфераза (ТАТ). Активність цього ферменту може бути визначена з гомогенатів печінки шляхом фотометрії і є хорошим показником небажаних метаболічних дій глюкокортикоїдів. Для вимірювання індукції ТАТ, тварин убивали через 8 годин після того, як було введено досліджувану речовину, печінки 9 UA 97806 C2 5 10 15 20 25 30 35 40 45 50 55 видаляли, і активність ТАТ вимірювали в гомогенаті. У цьому тесті, сполуки загальної формули І при дозах, в яких вони мають протизапальну дію, стимулюють малу кількість або відсутність тирозинамінотрансферази. Внаслідок їх протизапальної і, крім того, протиалергічної, імуносуппресорної і антипроліферативної дії, сполуки загальної формули І відповідно винаходу можуть бути застосовані як лікарські засоби для лікування або профілактики наступних патологічних станів у ссавців і людей: В цьому випадку, термін "ЗАХВОРЮВАННЯ" означає наступні ознаки: (і) Захворювання легені, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Хронічні, обструктивні захворювання легені будь-якого походження, головним чином бронхіальна астма - Бронхіти будь-якого походження - Всі форми рестриктивних захворювань легені, головним чином алергічні альвеоліти - Всі форми набряку легенів, головним чином токсичний набряк легенів - Саркоїдози і гранулематози, головним чином хвороба Бека (іі) Ревматичні захворювання/аутоімунні захворювання/захворювання суглобів, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Всі форми ревматичних захворювань, особливо ревматоїдні артрити, ревматичний поліартрит, ревматична поліміалгія - Реактивні артрити - Запальні захворювання м'яких тканин - Симптоми артричних захворювань суглобів у пацієнтів з дегенеративними захворюваннями суглобів (артроз) - Травматичні ураження шкіри ревматичного походження - Колагенози будь-якого походження, напр., системні червоні вовчаки, склеродермії, поліміозити, дерматоміозити, синдром Шегрена, синдром Стіла, синдром Ферті (ііі) Алергії, які супроводжуються запальними, і/або проліферативними процесами: - Всі форми алергічних реакцій, напр., набряк Квінке, сінна лихоманка, укуси комах, алергічні реакції на фармацевтичні агенти, похідні крові, контрастні середовища тощо, анафілактичний шок, уртикарія, контактні дерматити (iv) Судинні запалення (васкуліти): - Нодозний панартеріїт, темпоральний артеріїт, нодозна еритема (ν) Захворювання шкіри, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Атопічні дерматити (головним чином у дітей) - Псоріаз - Червоний волосистий пітиріаз - Ерітемні захворювання, викликані різними згубними для здоров'я чинниками, напр., радіація, хімічні речовини, опіки тощо Бульозні дерматози - Захворювання ліхеноїдної групи - Свербіння (напр., алергічної природи) - Себорейна екзема - Розацеа - Звичайна пухирчатка - Еритема ексудативна багато формна - Баланіти - Вульвіти - Випадання волосся, таке як осередкова алопеція - Шкірна Т-клітинна лімфома (vi) Захворювання нирки, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Нефротичний синдром - Всі нефрити (vii) Захворювання печінки, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Гостре розкладання клітин печінки - Гострий гепатит різної природи, напр., вірусний, токсичний, викликаний фармацевтичними агентами - Хронічний агресивний гепатит і/або хронічний інтермітуючий гепатит 10 UA 97806 C2 5 10 15 20 25 30 35 40 45 50 55 60 (viii) Шлунково-кишкові захворювання, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Регіонарний ентерит (хвороба Крону) - Виразковий коліт - Гастрит - Рефлюксний езофагіт - Виразковий коліт іншої природи, напр., природний спру (іх) Проктологічні захворювання, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Анальна екзема - Тріщини - Геморої - Ідіопатичний проктит (х) Очні захворювання, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Алергічний кератит, увеїт, ірит - Кон'юнктивіт - Блефарит - Неврит зорового нерва - Хоріоїдит - Симпатична офтальмія (хі) Захворювання області вуха-носа-горла, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Алергічний риніт, сінна лихоманка - Отит зовнішнього вуха, напр., викликаний контактним дерматитом, інфекцією тощо. - Отит середнього вуха (хіі) Неврологічні захворювання, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Церебральний набряк, головним чином церебральний набряк, викликаний пухлиною - Множинний склероз - Гострий енцефаломієліт - Менінгіт - Різні форми конвульсій, напр., дитячі кивательні судоми (хііі) Захворювання крові, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Набута гемолітична анемія - Ідіопатична тромбоцитопенія (xiv) Пухлинні захворювання, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Гострий лімфолейкоз - Злоякісна лімфома - Лімфогранулематози - Лімфосаркома - Екстенсивні метастази, в основному рак грудей, бронхів і простати (xv) Ендокринні захворювання, які супроводжуються запальними, алергічними і/або проліферативними процесами: - Ендокринна орбітопатія - Тиреотоксичний криз - Гранулематозний гігантоклітинний тиреоїдит - Тиреоїдит Хашимото - Базедова хвороба (xvi) Трансплантація органів і тканин, реакція "трансплантант проти господаря" (xvii) Важкі шокові патологічні стани, напр., анафілактичний шок, систематичний викликаючий запальну реакцію синдром (SIRS) (xviii) Замісна терапія при: - Природженій первинній наднирковій недостатності, напр., природжений адреногенітальний синдром І - Набутій первинній наднирковій недостатності, напр., хвороба Аддісона, аутоімунний адреналіт, мета-інфекційні пухлини, метастази тощо - Природженій вторинній наднирковій недостатності, напр., природжений гіпопітуїтаризм 11 UA 97806 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Набутій вторинній наднирковій недостатності, напр., мета-інфекційні пухлини тощо (хіх) Блювота, яка супроводжується запальними алергічними і/або проліферативними процесами: - напр., в комбінації з 5-НТЗ антагоністами при блювоті, викликаної цитостатиком (хх) Болі запальної природи, напр., люмбаго. Окрім цього, сполуки загальної формули І згідно винаходу можуть застосовуватися для лікування і профілактики додаткових патологічних станів, які не згадувалися вище, для яких зараз застосовуються синтетичні глюкокортикоїди (дивися в цьому аспекті Hatz, Η. J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998). Всі раніше згадані показання з (і) по (хх) описані детальніше в Hatz, Η. J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998. Для терапевтичної активності у вищезазначених патологічних захворюваннях, підходяща доза змінюється і залежить від, наприклад, активної сили сполуки загальної формули І, носія захворювання, типу введення, і типу і важкості захворювань, які лікуються, також як і від мети застосування: як профілактичний агент або як терапевтичний агент. До того ж, винахід передбачає: (і) Застосування однієї із сполук формули І згідно винаходу або їх суміші для виробництва лікарського засобу для лікування ЗАХВОРЮВАННЯ; (іі) Спосіб лікування ЗАХВОРЮВАННЯ, згаданий спосіб включає введення кількості сполуки згідно винаходу, в якому кількість пригнічує захворювання і в якому кількість сполуки дають пацієнтові, який потребує такого лікування; (ііі) Фармацевтичну композицією для лікування ЗАХВОРЮВАННЯ, згадане лікування охоплює одну із сполук згідно винаходу або їх суміш і щонайменше один фармацевтичний ад'ювант і/або наповнювач. Як правило, задовільні результати можна чекати у тварин коли денні дози охоплюють інтервал від 1 мкг до 100,000 мкг сполуки згідно винаходу на кг маси тіла. В разі крупного ссавця, наприклад людини, рекомендована денна доза лежить в інтервалі від 1 мкг до 100,000 мкг на кг маси тіла. Переважною є доза від 10 до 30,000 мкг на кг маси тіла, і переважнішою є доза від 10 до 10,000 мкг на кг маси тіла. Наприклад, ця доза відповідним чином вводиться кілька разів щодня. Для лікування гострого шоку (напр., анафілактичний шок), можуть даватися індивідуальні дози, які значно більше вищезазначених доз. Приготування фармацевтичних препаратів на основі нових сполук здійснюють шляхом, який відомий в рівні техніки, при цьому активний компонент переробляють з наповнювачами, які широко використовуються в галенових препаратах, з наповнювачами, речовинами, які викликають декомпозицію, зв'язуючими агентами, зволожувачами, лубрикантами, абсорбентами, розчинниками, коректувальниками аромату, барвниками тощо, і перетворюють на форму, потрібну для введення. В цьому випадку, посилання зроблене на Remington's Pharmaceutical Science, 15th Edition, Mack Publishing Company, East Pennsylvania (1980). Для перорального введення особливо підходящими є таблетки, таблетки з оболонкою, капсули, пілюлі, порошки, гранули, пастили, суспензії, емульсії або розчини. Для парентерального введення можливими є ін'єкційні і інфузійні препарати. Для внутрішньосуглобової ін'єкції можуть застосовуватися відповідно приготовані кристалічні суспензії. Для внутрішньом'язової ін'єкції можуть застосовуватися водні і масляні ін'єкційні розчини або суспензії і відповідні препарати пролонгованої дії. Для ректального введення, нові сполуки можуть застосовуватися у формі супозиторіїв, капсул, розчинів (напр., у формі клізми) і мазей як для систематичного так і для локального лікування. Для пульмонального введення нових сполук, останні можуть застосовуватися у формі аерозолів і інгаляторів. Для локального застосування на очі, зовнішні вушні канали, середнє вухо, носові канали, і навколоносові пазухи, нові сполуки можуть застосовуватися у вигляді крапель, мазей і настойок у відповідних фармацевтичних композиціях. Для місцевого застосування, можливі композиції в гелях, мазях, жирних мазях, кремах, пастах, порошках, молочку і настойках. Дозування сполук загальної формули І в цих препаратах може складати 0.01%-20%, для досягнення достатньої фармацевтичної дії. Винахід також охоплює сполуки загальної формули І згідно винаходу як терапевтично активні компоненти. 12 UA 97806 C2 5 10 15 20 25 30 35 Крім того, сполуки загальної формули І згідно винаходу є частиною винаходу як терапевтично активні компоненти разом з фармацевтично сумісними і прийнятними ад'ювантами і наповнювачами. Винахід також охоплює фармацевтичну композицію, яка містить одну з фармацевтично активних сполук згідно винаходу або її суміші або ї фармацевтично сумісну сіль і фармацевтично сумісну сіль або фармацевтично сумісні ад'юванти і наповнювачи. Сполуки загальної формули (І) згідно винаходу можуть також необов'язково бути складені і/або введені в комбінації з іншими активними компонентами. Отже, винахід також відноситься до комбінаційних терапій або комбінованих композицій, в яких сполуку загальної формули (І) або її фармацевтично прийнятну сіль, або фармацевтичну композицію, яка містить сполуку загальної формули (І) або її фармацевтично прийнятну сіль, вводять або одночасно (необов'язково в такій же композиції) або в послідовності разом з одним або більше фармацевтичними агентами для лікування одного з вище згаданих патологічних станів. Наприклад, для лікування ревматоїдного артриту, остеоартриту, ХОЗЛ (хронічне обструктивне захворювання легені), астми або алергічного риніту, сполука загальної формули (І) цього винаходу може бути скомбінована з одним або більше фармацевтичними агентами для лікування такого захворювання. Коли така комбінація вводиться шляхом інгаляції, фармацевтичний агент, який комбінується, може бути вибраний з наступного списку: - Інгібітор PDE4, що включає ізоформу інгібітора PDE4D; - Селективний антагоніст .sub2. адреноцептора, такий як, наприклад, метапротеренол (алупент), ізопротеренол, ізопреналін, альбутерол, сальбутамол, формотерол, салметерол, тербуталін, орципреналін, бітолтерол мезилат, пірбутерол або індакатерол; - Антагоніст рецептора мускарину ( наприклад, антагоніст M1, М2 або М3, такий як, наприклад, більш селективний антагоніст М3), такий як, наприклад, іпратропій бромід, тіотропій бромід, окситропій бромід, пірензепін або телензепін; - Модулятор функції рецептора цитокінів (такий як, наприклад, антагоніст рецептора CCR1); або - Інгібітор функції р38 кінази. Для іншого завдання цього винаходу, така комбінація із сполукою загальної формули (І) або його фармацевтично прийнятною сіллю застосовується для лікування ХОЗЛ, астми або алергічного риніту і може бути введена шляхом інгаляції або орально в комбінації з ксантином (таким як, наприклад, амінофілін або Теофілін), яка також може бути введена шляхом інгаляції або орально. Експериментальна частина: Різні аспекти винаходу, описані в даній заявці, проілюстровані наступними прикладами, які аж ніяк не обмежують даний винахід. Приклад 1 40 45 50 -Бензил--[(феніл)-аміно)--(трифторометил)-бензолетанол N-{Феніл-[2-(трифторометил)-оксираніл]-метил}-анілін 0.63 мл (7.4 ммоль) 1,1,1-трифтороепоксипропану в 35 мл THF охолоджували до -104°С і додавали 5.1 мл 1.6M розчину н-бутиллітію в гексані протягом 3 годин, тоді як температура не перевищувала -99°С. Через 10 хв. після повного додавання додавали 2.0 г (11 ммоль) нбензиліденаніліну в 10 мл THF протягом 0.5 годин, тоді як температура не перевищувала -99°С. Після 10 хв. при -100°С додавали 7.4 мл діетилового ефіру і реакційну суміш нагрівали до 20°С протягом однієї години. Реакцію зупиняли додаванням насиченого розчину хлориду амонію. Фази розділяли і водний шар двічі екстрагували діетиловим ефіром, об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і потім упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 30%-40%) дає 1.8 г бажаного епоксиду. 13 UA 97806 C2 Н-ЯМР (CDCl3); = 2.58 (m, 1Н), 3.06 (d, 1H), 3.77 (s, 3H), 4.42 (d, 1H), 5.06 (d, 1H), 6.56 (d, 2H), 6.71 (t, 1H), 7.09-7.56 (m, 5H), 7.89 (d, 2H). До 0.49 г (3.9 ммоль) хлористого алюмінію в 3 мл бензолу при 5°С додавали 0.9 мг (3.1 ммоль) н-{феніл-[2-(трифторометил)-оксираніл]-метил}-аніліну в 3 мл бензолу. Реакційну суміш перемішували 2 години при 25°С і потім виливали в насичений розчин гідрокарбонату натрію з льодом. Суміш енергійно перемішували, шари розділяли, водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (етилацетат в гексані 25%) дає 250 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CD3OD); = 3.59 (d, 1Н), 3.76 (d, 1Н), 4.77 (br, 1H), 4.96 (s, 1H), 6.65 (d, 2H), 6.75 (t, 1H), 7.10-7.20 (m, 4H), 7.30-7.42(m, 6H), 7.46 (d, 2H). Приклад 2 1 5 10 15 20 25 30 35 40 45 -Пропіл--[(феніл)-аміно)--(трифторометил)-бензолетанол До 175 мг (0.92 ммоль) йодиду міді(І) в 4 мл THF при -30°С додавали 4 мл 3M етилмагнійброміду в діетиловому ефірі. Через 30 хв. при -30°С додавали 0.9 г (3.1 ммоль) н{феніл-[2-(трифторометил)-оксираніл]-метил}-аніліну в 3 мл THF. Реакційну суміш перемішували 4 години при -30°С і потім виливали в насичений розчин хлориду амонію. Фази розділяли і водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (етилацетат в гексані 5%-30%) дає 335 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CD3OD); = 0.86 (t, 3H), 1.44-1.53 (m, 3H), 1.70 (ddd, 1Н), 4.65 (d, 1H), 4.72 (d, 1H), 6.58 (d, 2H), 6.68 (t, 1H), 7.07 (d, 2H), 7.26-7.57(m, 5H). Приклад 3 -Хлорометил-2-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)-бензолетанол {[3-Метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5-амін До 1.17 г (7.4 ммоль) 5-аміно-2-метилхіноліну і 1 г (7.4 ммоль) 3-метоксибензальдегіду в 39 мл толуолу додавали 1 мл оцтової кислоти. Суміш нагрівали протягом 3 годин при кипінні до тих пір, поки вода не збереться в насадці Діна-Старка. Розчинник упарювали і залишок двічі азеотропно упарювали з невеликими порціями толуолу. Як продукт одержали 2.1 г [(3метоксифеніл)-метилен]-2-метилхінолін-5-аміну. 0.31 мл (3.6 ммоль) 1,1,1трифтороепоксипропану в 17 мл THF охолоджували до -104°С і додавали 1.59 мл 2.5M розчину н-бутиллітію в гексані протягом 3 годин, тоді як температура не перевищувала -99°С. Через 10 хв. після повного додавання додавали 1.5 г (5.4 ммоль) [(3-метоксифеніл)-метилен]-2метилхінолін-5-аміну у 5 мл THF протягом 0.5 годин, тоді як температура не перевищувала 99°С. Через 0.5 години при -100°С додавали 4 мл діетилового ефіру і реакційну суміш нагрівали до 20°С протягом однієї години. Реакцію зупиняли додаванням насиченого розчину хлориду амонію. Шари розділяли і водний шар двічі екстрагували діетиловим ефіром, об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і потім упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 30%-40%) дає 800 мг бажаного епоксиду. 14 UA 97806 C2 Н-ЯМР (CDCl3); = 2.64 (m, 1Н), 2.72 (s, 3H), 3.13 (d, 1Н), 3.77 (s, 3H), 5.14 (d, 1H), 5.20 (d, 1H), 6.38 (d, 1H), 6.84 (d, 1H), 6.90 (s, 1H), 6.95 (d, 1H), 7.26-7.29 (m, 2H), 7.35 (t, 1H), 7.41 (d, 1H), 8.19 (d, 1H). До 128 мг (0.96 ммоль) хлористого алюмінію в 4 мл бензолу при 5°С додавали 310 мг (0.8 ммоль) {[3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5-аміну у 2 мл бензолу. Реакційну суміш перемішували 3 години при 25°С і потім виливали в насичений розчин гідрокарбонату натрію. Суміш енергійно перемішували, шари розділяли, водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 0%-35%) дає 140 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CD3OD); = 2.65 (s, 3H), 3.13 (dq, 1Н), 3.68 (d, 1H), 3.73 (s, 3H), 5.12 (s, 1H), 6.49 (d, 1H), 6.85 (d, 1H), 7.18-7.24 (m, 4H), 7.35 (d, 1H), 7.36 (t, 1H), 8.42 (d, 1H). Приклад 4 1 5 10 15 20 25 30 35 -Бромометил-3-метокси--[(нафт-1-іл)-аміно]--(трифторометил)-бензолетанол {(3-Метоксифеніл)[2-(трифторометил)-оксираніл]-метил}-нафталін-1-амін Аналогічно Прикладу 3, відповідний імін одержаний виходячи з 5.0 г (34.9 ммоль) 1амінонафталіну і 4.24 мл (34,9 ммоль) 3-метоксибензальдегіду в толуолі. До 2.11 г (8.1 ммоль) [(3-метоксифеніл)-метилен]-нафталін-1-аміну у THF додавали 0.63 мл (7.4 ммоль) літійованого 1,1,1-трифтороепоксипропану при -100°С аналогічно Прикладу 3. Звичайна обробка і хроматографічне очищення на силікагелі (етилацетат в гексані 5%) дають 1.29 г {[3метоксифеніл][2-(трифторометил)-оксираніл]-метил}-нафталін-5-аміну у вигляді жовтого масла. 1 Н-ЯМР (CDCl3); = 2.68 (m, 1Н), 3.14 (d, 1H), 3.77 (s, 3H), 5.22 (s, 2H), 6.40 (d, 1H), 6.84 (d, 1H), 6.94 (s, 1H), 6.99 (d, 1H), 7.16-7.28 (m, 3H), 7.50 (m, 2H), 7.79 (d, 1H), 7.95 (d, 1H). До 30 мг (0.16 ммоль) йодиду міді(І) в 2 мл THF при -30°С додавали 0.71 мл 3M етилмагнійброміду в діетиловому ефірі. Через 30 хв. при -30°С додавали 200 мг (0.54 ммоль) {[3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-нафталін-5-аміну у 0.5 мл THF. Реакційну суміш перемішували 2 години при 0°С, 14 годин при 25°С і потім виливали в насичений розчин хлориду амонію. Фази розділяли і водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (етилацетат в гексані 5%) дає 50 мг бажаної сполуки і 4 мг -хлорометил-3-метокси--[(нафт-1-іл)-аміно]--(трифторометил)-бензолетанолу (приклад 6). 1 Н-ЯМР (CDCl3); = 3.57 (d, 1Н), 3.77 (d, 1H), 3.78 (s, 3H), 5.15 (s, 1H), 5.55 (br, 1H), 6.52 (d, 1H), 6.86 (d, 1H), 7.11 (s, 1H), 7.14 (m, 2H), 7.28 (m, 2H), 7.50 (m, 2H), 7.79 (d, 1H), 7.98 (d, 1H). Приклад 5 40 45 -Бромометил-3-гідрокси--[(нафт-1-іл)-аміно]--(трифторометил)-бензолетанол До 20 мг (0.04 ммоль) -бромометил-3-метокси--[(нафт-1-іл)-аміно]--(трифторометил)бензолетанолу в 2 мл дихлорометану при -20°С додавали 0.44 мл 1M розчину триброміду бору в дихлорометані під аргоном. Реакційну суміш перемішували 16 годин в інтервалі температур між 0°С і 25°С. Реакційну суміш перемішували при 0°С з насиченим розчином бікарбонату натрію. Після розбавлення етилацетатом суміші дали нагрітися до кімнатної температури, 15 UA 97806 C2 5 перемішували 10 хв. і екстрагували двічі етилацетатом. Об'єднані органічні екстракти промивали насиченим розчином NaCl і сушили над сульфатом натрію. Розчинник упарювали і залишок очищали за допомогою препаративної тонкошарової хроматографії на силікагелі (етилацетат в гексані 33%). Одержували 6.5 мг бажаної сполуки. 1 Н-ЯМР (CDCl3); = 3.56 (d, 1Н), 3.77 (d, 1H), 4.98 (br, 1H), 5.14 (s, 1H), 6.48 (d, 1H), 6.78 (d, 1H), 7.02 (s, 1H), 7.14-7.30 (m, 4H), 7.50 (m, 2H), 7.79 (d, 1H), 7.96 (d, 1H). Приклад 6 10 15 20 25 30 35 40 -Хлорометил-3-метокси--[(нафт-1-іл)-аміно]--(трифторометил)-бензолетанол Виділений як побічний продукт в прикладі 4. 1 Н-ЯМР (CDCl3); = 3.76 (s, 3H), 3.80 (d, 1Н), 4.87 (d, 1H), 5.35 (s, 1H), 6.54 (d, 1H), 6.86 (d, 1H), 7.09 (s, 1H), 7.10 (d, 1H), 7.16-7.28 (m, 3H), 7.50 (m, 2H), 7.85 (d, 1H), 8.07 (d, 1H). Приклад 7 1-(2-Метоксифеніл-1-[(нафт-1-іл)-аміно]-2-(трифторометил)-пентан-2-ол {[2-Метоксифеніл][2-(трифторометил)-оксираніл]-метил}-нафталін-1-амін Аналогічно Прикладу 3, відповідний імін одержаний виходячи з 1-амінонафталіну і 2метоксибензальдегіду в толуолі. До 2.11 г (8.1 ммоль) [(2-метоксифеніл)-метилен]-нафталін-1аміну у THF додавали 0.63 мл (7.4 ммоль) літійованого 1,1,1-трифтороепоксипропану при 100°С аналогічно Прикладу 3. Звичайна обробка і хроматографічне очищення на силікагелі (етилацетат в гексані 10%-20%) дають 438 мг {[2-метоксифеніл][2-(трифторометил)-оксираніл]метил}-нафталін-5-аміну у вигляді жовтого масла. 1 Н-ЯМР (CDCl3); = 2.40 (m, 1Н), 3.08 (d, 1H), 3.95 (s, 3H), 5.23 (d, 1H), 5.78 (d, 1H), 6.33 (d, 1H), 6.82 (t, 1H), 6.92-7.05 (m, 2H), 7.20 (m, 2H), 7.28 (m, 1H), 7.50 (m, 2H), 7.84 (d, 1H), 7.98 (d, 1H). До 30 мг (0.16 ммоль) йодиду міді(І) в 2 мл THF при -30°С додавали 0.71 мл 3M етилмагнійброміду в діетиловому ефірі. Через 30 хв. при -30°С додавали 200 мг (0.54 ммоль) {[2-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-нафталін-5-аміну у 0.5 мл THF. Реакційну суміш перемішували 2 години, поки не нагрілось до -10°С і потім виливали в насичений розчин хлориду амонію. Фази розділяли і водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (етилацетат в гексані 10%-50%) дає 12 мг бажаної сполуки. 1 Н-ЯМР (CDCl3); = 0.84 (t, 1Н), 1.44 (m, 1H), 1.61 (m, 2H), 1.83 (ddd, 1H), 3.98 (s, 3H), 5.37 (s, 1H), 5.67 (br, 1H), 6.39 (m, 1H), 6.91 (t, 1H), 6.95 (d, 1H), 7.18 (m, 2H), 7.26 (d, 1H), 7.40 (d, 1H), 7.49 (m, 2H), 7.76 (d, 1H), 7.91 (d, 1H). 16 UA 97806 C2 Приклад 8 5 10 15 20 25 30 -Хлорометил-3,5-дифторо-2-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол {[3,5-Дифторо-2-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5-амін До 2.0 г (12.6 ммоль) 5-аміно-2-метилхіноліну і 2.2 г (12,6 ммоль) 3,5-дифторо-2метоксибензальдегіду в 38 мл толуолу додавали 0.1 мл оцтової кислоти і 5 г молекулярних сит. Суміш нагрівали протягом 5 годин при кипінні і після охолодження фільтрували через цеоліти. Розчинник упарювали і залишок двічі азеотропно упарювали з невеликими порціями толуолу. Одержували 3,43 г [(3,5-дифторо-2-метоксифеніл)-метилен]-2-метилхінолін-5-аміну у вигляді жовтого порошку. 1,93 мл (22.3 ммоль) 1,1,1-трифтороепоксипропану в 40 мл THF і 10 мл гексану охолоджували до -100°С і додавали 14 мл 1,6M розчину н-бутиллітію в гексані протягом 2 годин, тоді як температура не перевищувала -96°С. Через 10 хв. після повного додавання додавали 3,44 г (11.2 ммоль) [(3,5-дифторо-2-метоксифеніл)-метилен]-2-метилхінолін-5-аміну у 50 мл THF протягом 1.5 годин, тоді як температура не перевищувала -95°С. Через одну годину при -100°С реакційну суміш нагрівали до 0°С протягом двох годин. Реакцію зупиняли додаванням насиченого розчину хлориду амонію. Шари розділяли і водний шар двічі екстрагували діетиловим ефіром, об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і потім упарювали. Флеш хроматографія на силікагелі (ізопропанол в гексані 5%-20%) дає 1,68 г бажаного епоксиду. 1 Н-ЯМР (CDCl3); = 2.48 (m, 1Н), 2.75 (s, 3H), 3.17 (d, 1H), 4.07 (s, 3H), 5.08 (d, 1H), 5.68 (d, 1H), 6.31 (d, 1H), 6.73 (dd, 1H), 6.83 (ddd, 1H), 7.31 (d, 1H), 7.40 (t, 1H), 7.46 (d, 1H), 8.20 (d, 1H). До 94 мг (0.74 ммоль) хлористого алюмінію в 3 мл бензолу при 5°С додавали 250 мг (0.59 ммоль) {[3,5-дифторо-2-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5аміну у 2 мл бензолу. Реакційну суміш перемішували 3 години при 25°С і потім виливали в насичений розчин гідрокарбонату натрію. Суміш енергійно перемішували, шари розділяли, водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 20%-50%) дає 53 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.73 (s, 3H), 3.70 (d, 1Н), 3.81 (d, 1H), 4.04 (s, 3H), 5.50 (d, 1H), 5.55 (d, 1H), 6.44 (d, 1H), 6.85 (ddd, 1H), 7.06 (dd, 1H), 7.30 (d, 1H), 7.41 (t, 1H), 7.44 (d, 1H), 8.13 (d, 1H). Приклад 9 35 40 -Хлорометил-2,4-дифторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол {[2,4-Дифторо-3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5-амін 17 UA 97806 C2 5 10 15 20 25 До 2.0 г (12,6 ммоль) 5-аміно-2-метилхіноліну і 2,18 г (13,6 ммоль) 2,3-дифторо-3метоксибензальдегіду в 38 мл толуолу додавали 36 мкл оцтової кислоти і 5 г молекулярних сит. Суміш нагрівали протягом 4 годин при кипінні і після охолодження фільтрували через цеоліти. Розчинник упарювали і залишок двічі азеотропно упарювали з невеликими порціями толуолу. Одержували 3,74 г [(2,4-дифторо-3-метоксифеніл)-метилен]-2-метилхінолін-5-аміну у вигляді жовтого порошку. 2,06 мл 1,1,1-трифтороепоксипропану в 35 мл THF і 10 мл гексану охолоджували до -100°С і додавали 15 мл 1,6M розчину н-бутиллітію в гексані протягом 2 годин, тоді як температура не перевищувала -95°С. Через 10 хв. після повного додавання додавали 3,74 г (12 ммоль) [1-(2,4-дифторо-3-метоксифеніл)-метилен]-2-метилхінолін-5-аміну у 45 мл THF протягом однієї години, тоді як температура не перевищувала -95°С. Через одну годину при 100°С додавали 11 мл діетилового ефіру і реакційну суміш нагрівали до -10°С протягом однієї години. Реакцію зупиняли додаванням насиченого розчину хлориду амонію. Шари розділяли і водний шар двічі екстрагували діетиловим ефіром, об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і потім упарювали. Флеш хроматографія на силікагелі (етилацетат в гексані 10%-50%) дає 3,66 г {[2,4-дифторо-3-метоксифеніл][2-(трифторометил)оксираніл]-метил}-2-хінолін-5-аміну у вигляді жовтого порошку. 1 Н-ЯМР (CDCl3); = 2.60 (m, 1Н), 2.74 (s, 3H), 3.20 (d, 1Н), 4.06 (s, 3H), 5.03 (d, 1H), 5.60 (d, 1H), 6.36 (d, 1H), 6.81 (dd, 1H), 6.89 (dd, 1H), 7.30 (d, 1H), 7.40 (t, 1H), 7.45 (d, 1H), 8.18 (d, 1H). До 98 мг (0.74 ммоль) хлористого алюмінію в 3 мл бензолу при 5°С додавали 261 мг {(2,4дифторо-3-метоксифеніл)[2-(трифторометил)-оксираніл]-метил}-(2-метилхінолін-5-іл)-аміну в 2 мл бензолу. Реакційну суміш перемішували 16 годин при 25°С і потім виливали в насичений розчин гідрокарбонату натрію. Суміш енергійно перемішували, шари розділяли, водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 10%) дає 184 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.72 (s, 3H), 3.76 (d, 1Н), 3.85 (d, 1H), 4.02 (s, 3H), 5.42 (d, 1Н), 5.56 (s, 1H), 6.46 (d, 1H), 6.86 (dd, 1H), 7.20 (dd, 1H), 7.27 (d, 1H), 7.39 (t, 1H), 7.43 (d, 1H), 8.13 (d, 1H). Приклад 10 30 35 40 45 50 -Хлорометил-2,4-дифторо-3-гідрокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол До 50 мг (0.11 ммоль) -хлорометил-2,4-дифторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]-(трифторометил)-бензолетанолу в 4.9 мл дихлорометану при 0°С додавали 2.1 мл 1M розчину триброміду бору в дихлорометані під аргоном. Реакційну суміш перемішували 16 годин в інтервалі температур між 0°С і 25°С. Реакційну суміш перемішували при 0°С з насиченим розчином бікарбонату натрію. Після розбавлення етилацетатом суміші дали нагрітися до кімнатної температури, перемішували 10 хв. і екстрагували двічі етилацетатом. Об'єднані органічні екстракти промивали насиченим розчином NaCl і сушили над сульфатом натрію. Розчинник частково упарювали і залишок пропускали через коротку колонку з силікагелем (етилацетат 100%). Одержували 43 мг бажаної сполуки. 1 Н-ЯМР (CD3OD); = 2.65 (s, 3H), 3.25 (d, 1Н), 3.72 (d, 1H), 5.45 (s, 1Н), 6.53 (d, 1H), 6.85 (dd, 1H), 7.13 (ddd, 1H), 7.24 (d, 1H), 7.35 (d, 1H), 7.41 (t, 1H), 8.39 (d, 1H). Приклад 11 -Хлорометил-4-фторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол {[4-Фторо-3-метоксифеніл])[2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5-амін Аналогічно Прикладу 9, відповідний імін одержаний виходячи з 2.0 г (12,6 ммоль) 5-аміно-2метилхіноліну і 1.95 г (13,6 ммоль) 4-фторо-3-метоксибензальдегіду в толуолі. До 3.49 г [(4 18 UA 97806 C2 5 10 15 фторо-3-метоксифеніл)-метилен]-2-метилхінолін-5-аміну у THF додавали 2.04 мл літійованого 1,1,1-трифтороепоксипропану при -100°С аналогічно Прикладу 9. Звичайна обробка і хроматографічне очищення на силікагелі (ізопропанол в гексані 10%-20%) дають 3.59 г {(4фторо-3-метоксифеніл)[2-(трифторометил)-оксираніл}-метил]-хінолін-5-іламіну у вигляді жовтого порошку. 1 Н-ЯМР (CDCl3); = 2.63 (m, 1Н), 2.77 (s, 3H), 3.16 (d, 1H), 3.84 (s, 3H), 5.14 (d, 1H), 5.17 (d, 1H), 6.34 (d, 1H), 6.92 (ddd, 1H), 6.96 (dd, 1H), 7.06 (dd, 1H), 7.29 (d, 1H), 7.35 (t, 1H), 7.42 (d, 1H), 8.18 (d, 1H). До 98 мг (0.74 ммоль) хлористого алюмінію в 3 мл бензолу при 5°С додавали 250 мг (0.62 ммоль) {[4-фторо-3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-(2-метилхінолін-5-іл)аміну в 2 мл бензолу. Реакційну суміш перемішували 16 годин при 25°С і потім виливали в насичений розчин гідрокарбонату натрію. Суміш енергійно перемішували, шари розділяли, водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 10%) дає 125 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.69 (s, 3H), 3.49 (d, 1Н), 3.79 (d, 1H), 3.87 (s, 3H), 5.09 (d, 1H), 5.78 (d, 1H), 6.43 (d, 1H), 7.06 (dd, 1H), 7.10 (m, 2H), 7.21 (d, 1H), 7.36 (t, 1H), 7.38 (d, 1H), 8.29 (d, 1H). Приклад 12 20 35 -Хлорометил-4-фторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол До 50 мг (0.11 ммоль) -хлорометил-4-фторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]-(трифторометил)-бензолетанолу в 5.1 мл дихлорометану при -20°С додавали 1.9 мл 1M розчину триброміду бору в дихлорометані під аргоном. Реакційну суміш перемішували 16 годин в інтервалі температур між -20°С і 25°С. Реакційну суміш перемішували при 0°С з насиченим розчином бікарбонату натрію. Після розбавлення етилацетатом суміші дали нагрітися до кімнатної температури, перемішували 15 хв. і екстрагували двічі етилацетатом. Об'єднані органічні екстракти промивали насиченим розчином NaCl і сушили над сульфатом натрію. Розчинник упарювали і залишок очищали за допомогою препаративної тонкошарової хроматографії на силікагелі (ацетон в гексані 50%). Одержували 19 мг бажаної сполуки. 1 Н-ЯМР (CD3OD); = 2.67 (s, 3H), 3.14 (d, 1Н), 3.70 (d, 1H), 5.06 (s, 1H), 6.48 (d, 1H), 7.00 (dd, 1H), 7.08 (m, 1H), 7.20 (d, 2H), 7.36 (d, 1H), 7.37 (t, 1H), 8.42 (d, 1H). Приклад 13 40 -Хлорометил-4-хлоро-2-фторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]-(трифторометил)-бензолетанол 25 30 19 UA 97806 C2 5 10 15 20 {[4-Хлоро-2-фторо-3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5амін Аналогічно Прикладу 9, відповідний імін одержаний виходячи з 0.84 г (5.3 ммоль) 5-аміно-2метилхіноліну і 1.0 г (5.0 ммоль) 4-хлоро-2-фторо-3-метоксибензальдегіду в толуолі. 1.35 г [(4хлоро-2-фторо-3-метоксифеніл)-метилен]-2-метилхінолін-5-аміну у THF додавали до 0.71 мл літійованого 1,1,1-трифтороепоксипропану при -100°С аналогічно Прикладу 9. Звичайна обробка і хроматографічне очищення на силікагелі (етилацетат в гексані 10%-50%) дають 1.11 г {[4-хлоро-2-фторо-3-метоксифеніл][2-(трифторометил)-оксираніл}-метил]-хінолін-5-іламіну у вигляді жовтого порошку. 1 Н-ЯМР (CDCl3); = 2.63 (m, 1Н), 2.74 (s, 3H), 3.21 (d, 1H), 4.02 (s, 3H), 5.04 (d, 1H), 5.61 (d, 1H), 6.34 (d, 1H), 6.91 (dd, 1H), 7.07 (d, 1H), 7.29 (d, 1H), 7.40 (t, 1H), 7.46 (d, 1H), 8.17 (d, 1H). До 90 мг (0.68 ммоль) хлористого алюмінію в 2.8 мл бензолу при 5°С додавали 250 мг (0.57 ммоль) {(4-хлоро-2-фторо-3-метоксифеніл)[2-(трифторометил)-оксираніл]-метил}-(2метилхінолін-5-іл)-аміну в 2 мл бензолу. Реакційну суміш перемішували 4 години при 25°С і потім виливали в насичений розчин гідрокарбонату натрію. Суміш енергійно перемішували, шари розділяли, водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 10%) дає 115 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.72 (s, 3H), 3.81 (s, 2Н), 3.98 (s, 3H), 5.45 (d, 1Н), 5.56 (d, 1H), 6.46 (d, 1H), 7.12 (dd, 1H), 7.22 (d, 1H), 7.28 (d, 1H), 7.40 (t, 1H), 7.44 (d, 1H), 8.13 (d, 1H). Приклад 14 25 30 35 -Бромометил-3,5-дифторо-2-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол До 151 мг (0.57 ммоль) броміду алюмінію в 2.3 мл бензолу при 5°С додавали 200 мг (0.47 ммоль) {[3,5-дифторо-2-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5аміну у 2 мл бензолу. Реакційну суміш перемішували 3 години при 25°С і потім виливали в насичений розчин гідрокарбонату натрію. Суміш енергійно перемішували, шари розділяли, водний шар двічі екстрагували етилацетатом. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 20%-50%) дає 44 мг бажаного продукту у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.75 (s, 3H), 3.63 (d, 1Н), 3.72 (d, 1H), 4.07 (s, 3H), 5.51 (d, 1H), 5.56 (d, 1H), 6.42 (d, 1H), 6.83 (ddd, 1H), 7.04 (d, 1H), 7.28 (d, 1H), 7.42 (t, 1H), 7.46 (d, 1H), 8.15 (d, 1H). Приклад 15 40 -Бромометил-2,6-дифторо--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)-бензолетанол {(2,6-Дифторофеніл)[2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5-амін 20 UA 97806 C2 5 10 15 20 25 Аналогічно Прикладу 9, відповідний імін одержаний виходячи з аміно-2-метилхіноліну і 2,6дифторобензальдегіду в толуолі. До 3.08 г (10.9 ммоль) [(2,6-дифторофеніл)-метилен]-2метилхінолін-5-аміну у THF додавали 1.88 мл (21.8 ммоль) літійованого 1,1,1трифтороепоксипропану при -100°С аналогічно Прикладу 9. Звичайна обробка і хроматографічне очищення на силікагелі (етилацетат в гексані 10%-50%) дають 3.1 г {[2,6дифторофеніл][2-(трифторометил)-оксираніл]-метил}-хінолін-5-аміну у вигляді коричневого порошку. 1 Н-ЯМР (CDCl3); = 2.72 (s, 3H), 2.86 (m, 1Н), 3.21 (d, 1H), 5.05 (d, 1H), 5.17 (d, 1H), 5.87 (d, 1H), 6.64 (dd, 1H), 6.90 (d, 1H), 6.92 (d, 1H), 7.26 (m, 2H), 7.46 (m, 2H), 8.12 (d, 1H). Аналогічно Прикладу 14 250 мг (0.63 ммоль) {[2,4-дифторофеніл][2-(трифторометил)оксираніл]-метил}-2-метилхінолін-5-аміну взаємодіє з 203 мг (0.76 ммоль) броміду алюмінію в бензолі. Звичайна обробка після 3 годин і хроматографія на силікагелі (ацетон в гексані 10%50%) дає 141 мг бажаної сполуки у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.75 (s, 3H), 3.85 (d, 1Н), 3.96 (d, 1H), 5.60 (d, 1H), 5.71 (d, 1H), 6.63 (d, 1H), 6.88 (dd, 1H), 6.93 (m, 2H), 7.26 (m, 2H), 7.46 (t, 1H), 7. 51 (d, 1H) 8.15 (d, 1H). Приклад 16 -Бромометил-4-фторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол Аналогічно Прикладу 13 250 мг (0.62 ммоль) {[4-фторо-3-метоксифеніл][2-(трифторометил)оксираніл]-метил}-2-метилхінолін-5-аміну взаємодіє з 197 мг (0.74 ммоль) броміду алюмінію в бензолі. Звичайна обробка після 3 годин і хроматографія на силікагелі (ацетон в гексані 10%50%) дає 112 мг бажаної сполуки у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.71 (s, 3H), 3.37 (d, 1Н), 3.66 (d, 1H), 3.88 (s, 3H), 5.11 (d, 1H), 5.77 (d, 1H), 6.44 (d, 1H), 7.06 (dd, 1H), 7.13 (m, 1H), 7.24 (d, 1H), 7.27 (m, 1H), 7.36 (t, 1H), 7.42 (d, 1H), 8.33 (d, 1H). Приклад 17 30 35 40 -Бромометил-2,4-дифторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]--(трифторометил)бензолетанол Аналогічно Прикладу 14 261 мг (0.63 ммоль) {[2,4-дифторофеніл][2-(трифторометил)оксираніл]-метил}-2-метилхінолін-5-аміну взаємодіє з 197 мг (0.76 ммоль) броміду алюмінію в бензолі. Звичайна обробка після 3 годин і хроматографія на силікагелі (ізопропанол в гексані 5%-20%) дає 121 мг бажаної сполуки у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.74 (s, 3H), 3.67 (s, 2Н), 4.02 (s, 3H), 5.45 (d, 1Н), 5.58 (d, 1H), 6.46 (d, 1H), 6.86 (dd, 1H), 7.20 (m, 1H), 7.27 (d, 1H), 7.42 (t, 1H), 7.43 (d, 1Н)8.17(d, 1H). 21 UA 97806 C2 Приклад 18 5 10 -Бромометил-4-хлоро-2-фторо-3-метокси--[(2-метилхінолін-5-іл)-аміно]-(трифторометил)-бензолетанол Аналогічно Прикладу 14 250 мг (0.57 ммоль) {[4-хлоро-2-фторофеніл][2-(трифторометил)оксираніл]-метил}-2-метилхінолін-5-аміну взаємодіє з 181 мг (0.68 ммоль) броміду алюмінію в бензолі. Звичайна обробка після 3 годин і хроматографія на силікагелі (ізопропанол в гексані 10%-50%) дає 129 мг бажаної сполуки у вигляді окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.74 (s, 3H), 3.67 (s, 2Н), 4.02 (s, 3H), 5.45 (d, 1Н), 5.58 (d, 1H), 6.46 (d, 1H), 6.86 (dd, 1H), 7.20 (m, 1H), 7.27 (d, 1H), 7.42 (t, 1H), 7.43 (d, 1Н) 8.17(d, 1H). Приклад 19 15 20 25 30 35 -[(Етилсульфаніл)-метил]-2-фторо-3-метокси--[(хінолін-5-іл)-аміно)--(трифторометил)бензолетанол {[2-Фторо-3-метоксифеніл] [2-(трифторометил)-оксираніл]-метил}-хінолін-5-амін Аналогічно Прикладу 9, відповідний імін одержаний виходячи з 2.0 г (12,6 ммоль) 5амінохіноліну і 1.95 г (13,6 ммоль) 2-фторо-2-метоксибензальдегіду в толуолі, який взаємодіє з літійованим 1,1,1-трифтороепоксипропаном при -100°С. 1 Н-ЯМР (DMSO-d6); = 2.92 (m, 1Н), 3.29 (d, 1Н), 3.85 (s, 3H), 5.64 (d, 1H), 6.53 (d, 1H), 6.59 (d, 1H, NH), 7.07-7.23 (m, 3H), 7.31 (d, 1H), 7.45 (t, 1H), 7.49 (d, 1H), 8.76 (dm, 1H), 8.83 (dd, 1H). [(2-Фторо-3-метоксифеніл)-2-(2-трифторометил-оксираніл)-етил]-хінолін-5-іл-амін (97 мг, 0.25 ммоль) розчиняли в DMF (0.5 мл). Додавали карбонат цезію (161 мг, 0.5 ммоль), а потім етантіол (75 мкл, 1 ммоль). Суміш інтенсивно перемішували при кімнатній температурі протягом 90 хв. Реакційну суміш розподіляли між діетиловим ефіром і водою. Органічний шар промивали двічі водою і потім розсолом і упарювали. Залишок розчиняли в хлористому метилені, фільтрували через скловолокно для видалення залишкового NaCl і знову упарювали. Сирий продукт розчиняли в хлористому метилені і флеш-хроматографували на колонці з силікагелем, використовуючи градієнт гептан-етилацетат (10>90% етилацетату) і одержували бажаний продукт (60 мг, 53%) у вигляді аморфного порошку. 1 Н-ЯМР (DMSO-d6); =1.09 (t, 3H), 2.47 (dd, 1Н), 2.93 (d, 1H), 3.82, (s, 3H), 5.43 (d, 1H), 6.39 (d, 1H, NH), 6.47 (d, 1H), 7.04-7.12 (m, 3H, incl. OH), 7.24 (d, 1H), 7.30 (m, 1H), 7.45 (t, 1H), 7.50 (dd, 1H), 8.55 (d, 1H), 8.83 (dd, 1H). 19 F-ЯMP (DMSO-d6); -72.8, -137.8 22 UA 97806 C2 Приклад 20 5 10 15 20 25 30 2-Фторо--{[(імідазол-2-іл)-сульфаніл]-метил)-3-метокси--[(хінолін-5-іл)-аміно)-(трифторометил)-бензолетанол {[2-(2-Фторо-3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-хінолін-5-амін (100 мг, 0.25 ммоль) розчиняли в DMF (0.5 мл). Додавали карбонат цезію (136 мг, 0.4 ммоль), а потім 1Н-імідазол-2-тіол (98 мг, 0.5 ммоль). Суміш перемішували протягом 90 хв. і потім розподіляли між етилацетатом і водою. Органічний шар промивали водою, потім розсолом і потім упарювали. Флеш хроматографія із застосуванням SiO 2 і градієнта гептан-етилацетат (10>90% етилацетату) дає злегка брудний бажаний продукт (113 мг). Частину речовини (75 мг) піддали препаративній HPLC (RP С-18 колонка, градієнт СН3СN/Вода, 0.1% трифторооцтової кислоти), і подальша ліофілізація дає чисту, аморфну бажану сполуку у вигляді ди-трифторооцтовокислої солі у вигляді окремого діастереомеру (77 мг, 55%). 1 Н-ЯМР (DMSO-d6, з додаванням D2O); = 3.42 (d, 1Н), 3.72 (d, 1H), 3.81 (s, 3H), 5.40 (s, 1H), 6.62, (d, 1H), 7.07 (s, 1H), 7.09 (m, 1H), 7.26 (m, 2H), 7.38 (d, 1H), 7.46 (s, 2H), 7.75 (t, 1H), 7.85 (d, 1H), 9.08 (dd, 1H), 9.20 (m, 1H) 19 F-ЯMP (DMSO-d6, з додаванням D2O); = -73.2, -74.1, -138.5. Приклад 21 -{[(Імідазол-2-іл)-сульфаніл]-метил}--(феніламіно)--(трифторометил)-бензолетанол N-{Феніл-[2-(трифторометил)-оксираніл]-метил}-анілін (73 мг, 0.25 ммоль) розчиняли в DMF (0.5 мл). Додавали карбонат цезію (135 мг, 0.4 ммоль) і 1Н-імідазол-2-тіол (100 мг, 0.5 ммоль), суміш перемішували протягом 90 хв. при кімнатній температурі і потім розподіляли між етилацетатом і водою. Органічний шар промивали водою, потім розсолом і потім упарювали, одержуючи чисту бажану сполуку у вигляді білого аморфного порошку (діастереомерна суміш, співвідношення 1:3.3). 1 Н-ЯМР (DMSO-d6); = 3.19 (d, 1Н), 3.49 (d, 0.77H), 3.82 (d, 0.23H), 4.86 (d, 1H), 5.95 (d, 0.77H, NH), 6.14 (d, 0.23H, NH), 6.48 (t, 1H), 6.59-6.67 (m, 2H), 6.88-7.02 (m, 3H), 7.04-7.31 (m, 4H), 7.49 (t, 1H), 8.48 (d, 1H), 8.43 (s, 0.77H), 8.54 (s, 0.23H), 12.44 (s, 1H). 19 F-ЯMP (DMSO-d6, з додаванням D2O); = -72.2, -72.5. 35 23 UA 97806 C2 Приклад 22 5 10 15 -{[(Імідазол-2-іл)-сульфоніл]-метил}--[(феніл)-аміно)--(трифторометил)-бензолетанол -{[(Імідазол-2-іл)-сульфаніл]-метил}--(феніламіно)--(трифторометил)-бензолетанол (діастереомерна суміш 1:3.3, 50 мг, 0.13 ммоль) розчиняли в етилацетаті (10 мл). Додавали насичений водний гідрокарбонату натрію (2.4 мл), а потім м-хлоронадбензойну кислоту (74%, 70 мг, 0.3 ммоль). Суміш перемішували при кімнатній температурі протягом 1 години і потім додавали диметилсульфід (100 мкл). Перемішування продовжували ще декілька хв. і потім шари розділяли. Органічний шар промивали двічі водою, розсолом і потім упарювали. Флеш хроматографія (SiO2, градієнт гептан-етилацетат) дає чисту бажану сполуку у вигляді блідожовтого порошку (45 мг, 83%, діастереомерне співвідношення 1:3.3). 1 Н-ЯМР (DMSO-d6); = 3.41 (d, 0.77H), 3.68 (d, 0.23H), 3,88 (d, 0.77H), 4.41 (d, 0.23Н), 5.09 (d, 0.23Н), 5.29 (d, 0.77Н), 6.08 (d, 0.8Н, NH), 2.09 (d, 0.2H, NH), 6.46-6.55 (m, 1H), 6.64 (t, 2H), 7.00 (m, 3H), 7.16-7.64 (m, 6H), 13.81 (s, 1H). 19 F-ЯMP (DMSO-d6); = -71.5, -71.7. Приклад 23 20 25 30 35 -[(Етилсульфоніл)-метил]-2-фторо-3-метокси--[(хінолін-5-іл)-аміно)--(трифторометил)бензолетанол -[(Етилсульфаніл)-метил]-2-фторо-3-метокси--[(хінолін-5-іл)-аміно)--(трифторометил)бензолетанол (36 мг, 0.08 ммоль) розчиняли в етилацетаті (15 мл). Додавали насичений водний гідрокарбонат натрію (2.5 мл), а потім м-хлоронадбензойну кислоту (74%, 51 мг, 0.22 ммоль). Суміш перемішували при кімнатній температурі протягом 2.5 год. і додавали диметилсульфід (100 мкл). Перемішування продовжували протягом 20 хв. і потім шари розділяли. Органічний шар промивали двічі водою, розсолом і потім упарювали. Флеш хроматографія (SiO 2, градієнт гептан-етилацетат) і ліофілізація з діоксану дає бажану сполуку у вигляді окремого діастереомеру (15 мг, 39%). 1 Н-ЯМР (DMSO-d6); = 1.24 (t, 3H), 3.72 (s, 2Н), 3.83 (s, 3H), 5.52 (d, 1Н), 6.36 (d, 1H), 6.79 (d, 1H), 7.06-7.16 (m, 2H), 7.21 (dd, 1H), 7.28 (d, 1H), 7.46 (t, 1H), 7.55 (dd, 1H), 7.62 (s, 1H), 8.68 (d, 1H), 8.86 (dd, 1H). 1 Н-ЯМР (DMSO-d6), з додаванням D2O); = 1.19 (t, 3H), 3.29 (m, 2H), 3.67 (s, 2H), 3.83 (s, 3H), 5.53 (s, 1H), 6.37 (d, 1H), 7.03-7.21 (m, 3H), 7.27 (d, 1H), 7.44 (t, 1H), 7.52 (dd, 1H), 8.62 (d, 1H), 8.80 (dd, 1H). 19 F-ЯMP (DMSO-d6, з додаванням D2O); = -73.7, -138.0. 24 UA 97806 C2 Приклад 24 5 10 15 20 25 30 35 2-Фторо--([(імідазол-2-іл)-сульфоніл]-метил)-3-метокси--[(хінолін-5-іл)-аміно)-(трифторометил)-бензолетанол Ди-трифторооцтовокислу сіль 2-фторо--{[(імідазол-2-іл)-сульфаніл]-метил}-3-метокси-[(хінолін-5-іл)-аміно)--(трифторометил)-бензолетанолу (52 мг, 0.07 ммоль) розчиняли в етилацетаті (10 мл). Додавали насичений водний гідрокарбонат натрію (2.5 мл) і суміш охолоджували до 0°С. Додавали м-хлоронадбензойну кислоту (74%, 35 мг, 0.15 ммоль) і суміш перемішували при 0°С 1 годину і потім додавали диметилсульфід (100 мкл). Баню, що охолоджує, видаляли і перемішування продовжували додатково 10 хв. Додавали етилацетат і шари розділяли. Органічний шар промивали двічі водою, розсолом і потім упарювали. Флеш хроматографія (SiO2, градієнт гептан-етилацетат) і ліофілізація з діоксану дає бажану сполуку у вигляді окремого діастереомеру (24 мг, 63%). 1 Н-ЯМР (DMSO-d6); = 3.83 (s, 3H), 3.86 (d, 1Н), 4.27 (d, 1H), 5.45 (d, 1H), 6.37 (d, 1H), 6.40 (d, 1H, NH), 7.03-7.14 (m, 2H), 7.15-7.59 (7H), 8.71 (d, 1Н), 8.85 (dd, 1Н), 13.74 (s, 1H, імідазол NH). 19 F-ЯMP (DMSO-d6); = -74.6, -137.9. Приклад 25 -[(Етилсульфоніл)-метил]--(феніламіно)--(трифторометил)-бензолетанол -[(Етилсульфаніл)-метил]--[(феніл)-аміно)--(трифторометил)-бензолетанол (46 мг, 0.13 ммоль, діастереомерна суміш, співвідношення 1:5) розчиняли в етилацетаті (10 мл). Додавали насичений водний гідрокарбонат натрію (2.5 мл) і потім м-хлоронадбензойну кислоту (74%, 70 мг, 0.3 ммоль). Після перемішування протягом 70 хв. при кімнатній температурі, додавали додаткову кількість м-хлоронадбензойної кислоти (10 мг) і суміш додатково перемішували 10 хв. Додавали диметилсульфід (100 мкл) і перемішування продовжували ще 5 хв. Шари розділяли і органічний шар промивали двічі водою, розсолом і потім упарювали. Флеш хроматографія (SiO2, градієнт гептан-етилацетат) дає бажану сполуку у вигляді діастереомерної суміші (19 мг, 38%, діастереомерне співвідношення 1:5). 1 Н-ЯМР (DMSO-d6); = 1.03 (t, 0.5Н), 1.12 (t, 2.5Н), 3.01-3.22 (m, 3H), 3.64 (d, 0.84H), 4.01 (d, 0.16H), 5.12 (d, 0.16H), 5.22 (d, 0.84H), 6.07 (d, 0.16H), 6.13 (d, 0.84Н), 6.46-6.56 (m, 1Н), 6.58-6.68 (m, 2H), 6.96-7.05 (m, 3H), 7.20-7.37 (m, 3H), 7.49 (d, 0.3H), 7.57 (d, 1.7H). 19 F-ЯMP (DMSO-d6); = -70.9, -71.7. 25 UA 97806 C2 Приклад 26 5 10 15 2,4-Дифторо--{[(імідазол-2-іл)-сульфаніл]-метил|-3-метокси--[(хінолін-5-іл)-аміно)-(трифторометил)-бензолетанол 200 мг (0.47 ммоль) {[2,4-дифторо-3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2хінолін-5-аміну (приклад 9) розчиняли в 2.0 мл DMF. Додавали 307 мг (0.94 ммоль) карбонату цезію, а потім 189 мг (1.89 ммоль) 2-меркаптоімідазолу. Суміш енергійно перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш розподіляли між етилацетатом і водою. Органічний шар промивали водою і розсолом і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 10%-50%) дає 132 мг бажаної сполуки у вигляді одного окремого діастереомеру. 1 Н-ЯМР (CDCl3); = 2.71 (s, 3H), 3.24 (d, 1Н), 3.43 (d, 1H), 4.00 (s, 3H), 5.30 (d, 1H), 5.95 (d, 1H), 6.32 (d, 1H), 6.80 (t, 1H), 6.99 (s, 2H), 7.20 (dd, 1H), 7.26 (d, 1H), 7.35 (t, 1H), 7.38 (d, 1H), 8.21 (d, 1H). Приклад 27 20 25 30 2,4-Дифторо--([(імідазол-2-іл)-сульфоніл]-метил|-3-метокси--[(хінолін-5-іл)-аміно)-(трифторометил)-бензолетанол 30 мг (0.06 ммоль) 2,4-дифторо--{[(імідазол-2-іл)-сульфаніл]-метил}-3-метокси--[(2метилхінолін-5-іл)-аміно)--(трифторометил)-бензолетанолу розчиняли в 6 мл етилацетату, після чого додавали 1.5 мл насиченого водного гідрокарбонату натрію, а потім 32 мг (0.14 ммоль) м-хлоронадбензойної кислоти. Двофазну суміш інтенсивно перемішували одну годину при кімнатній температурі. Реакцію розбавляли водою, шари розділяли, і органічний шар промивали водою і розсолом. Після упарювання залишок очищали за допомогою препаративної тонкошарової хроматографії на силікагелі (етилацетат/гексан/метанол 4:4:1), одержавши 3 мг бажаного сульфону у вигляді аморфного порошку. 1 Н-ЯМР (CD3OD); = 2.67 (s, 3H), 3.93 (d, 1Н), 3.93 (s, 3H), 5.50 (s, 1H), 6.30 (d, 1H), 6.93 (dd, 1H), 7.28 (s, 1H), 7.38 (t, 1H), 7.42 (d, 1H), 7.52 (dd, 1H), 7.88 (d, 1H), 7.94 (s, 1H), 8.65 (d, 1H). 26 UA 97806 C2 Приклад 28 5 10 15 20 25 2,4-Дифторо--{[(1,2,4-триазол-3-іл)-сульфаніл]-метил|-3-метокси--[(хінолін-5-іл)-аміно)-(трифторометил)-бензолетанол 200 мг (0.47 ммоль) {[2,4-дифторо-3-метоксифеніл][2-(трифторометил)-оксираніл]-метил}-2метилхінолін-5-аміну (приклад 9) розчиняли в 2.0 мл DMF. Додавали 307 мг (0.94 ммоль) карбонату цезію, а потім 190 мг (1.89 ммоль) 3-меркапто-1,2,4-триазолу. Суміш енергійно перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш розподіляли між етилацетатом і водою. Органічний шар промивали водою і розсолом і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 10%-50%) дає 66 мг бажаної сполуки у вигляді одного окремого діастереомеру. 1 Н-ЯМР (DMSO d6); = 2.57 (s, 3H), 3.35 (d, 1Н), 3.67 (d, 1H), 3.81 (s, 3H), 5.31 (d, 1H), 6.29 (d, 1H), 6.33 (d, 1H), 7.06 (dd, 1H), 7.14 (d, 1H), 7.35 (d, 1H), 7.36 (t, 1H), 8.38 (s, 1H), 8.45 (d, 1H). Приклад 29 2,4-Дифторо-3-метокси--{[(1,2,4-триазол-3-іл)-сульфаніл]-метил}--[(2-метилхінолін-5-іл)аміно]--(трифторометил)-бензолетанол 50 мг (0.09 ммоль) 2,4-дифторо--{[(1,2,4-триазол-3-іл)-сульфаніл]-метил}-3-метокси--[(2метилхінолін-5-іл)-аміно)--(трифторометил)-бензолетанолу розчиняли в 10 мл етилацетату, після чого додавали 2.5 мл насиченого водного гідрокарбонату натрію, а потім 53 мг (0.24 ммоль) м-хлоронадбензойної кислоти. Двофазну суміш інтенсивно перемішували одну годину при кімнатній температурі. Реакцію розбавляли водою, шари розділяли, і органічний шар промивали водою і розсолом. Після упарювання залишок очищали за допомогою препаративної тонкошарової хроматографії на силікагелі (метанол в дихлорометані 10%) і одержували 6 мг бажаного сульфону у вигляді аморфного порошку. 1 Н-ЯМР (CD3OD); = 2.66 (s, 3H), 3.86 (d, 1Н), 3.92 (s, 3H), 3.95 (d, 1H), 5.51 (s, 1H), 6.36 (d, 1H), 6.92 (dd, 1H), 7.24 (d, 1H), 7.37 (t, 1H), 7.41 (d, 1H), 7.45 (dd, 1H), 8.00 (s, 1H), 8.66 (d, 1H). Приклад 30 30 35 40 -{[(Імідазол-2-іл)-сульфаніл]-метил}-3-метокси--[(хінолін-5-іл)-аміно)--(трифторометил)бензолетанол {(2-Метоксифеніл) [2-(трифторометил)-оксираніл]-метил}-2-метилхінолін-5-амін До 1.74 г (11 ммоль) 5-аміно-2-метилхіноліну і 1.33 мл (11 ммоль) 2-метоксибензальдегіду в 33 мл толуолу додавали 50 мкл оцтової кислоти і 2 г молекулярних сит. Суміш нагрівали протягом 2 годин при кипінні і після охолодження фільтрували через цеоліти. Розчинник упарювали і залишок двічі азеотропно упарювали з невеликими порціями толуолу. Одержували 3.6 г [1-(2-метоксифеніл)-метиліден]-(2-метилхінолін-5-іл)-аміну у вигляді жовтого масла. 2.25 мл (26 ммоль) 1,1,1-трифтороепоксипропану в 38 мл THF і 11 мл гексану охолоджували до 100°С і додавали 15 мл 1,6M розчину н-бутиллітію в гексані протягом однієї години, тоді як 27 UA 97806 C2 5 10 15 20 25 30 35 40 45 температура не перевищувала -95°С. Через 10 хв. після повного додавання додавали 3.6 г (11 ммоль) сирого [1-(2-метоксифеніл)-метиліден]-(2-метилхінолін-5-іл)-аміну в 49 мл THF протягом однієї години, тоді як температура не перевищувала -95°С. Через одну годину при -100°С додавали 12 мл діетилового ефіру і реакційну суміш нагрівали до -10°С протягом однієї години. Реакцію зупиняли додаванням насиченого розчину хлориду амонію. Шари розділяли і водний шар двічі екстрагували діетиловим ефіром, об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію і потім упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 0%-30%) дає 4.27 г {(2-метоксифеніл)[2-(трифторометил)-оксираніл]-метил}-2метилхінолін-5-аміну у вигляді суміші діастереомерів. 1 Діастереомер 1: Н-ЯМР (CDCl3); = 2.38 (m, 1Н), 2.74 (s, 3H), 3.09 (d, 1H), 3.95 (s, 3H), 5.15 (d, 1Н), 5.74 (d, 1H), 6.31 (d, 1H), 6.84 (t, 1H), 6.94 (d, 1H), 7.16 (d, 1H), 7.28 (d, 1H), 7.29 (t, 1H), 7.36 (t, 1H), 7.40 (d, 1H), 8.23 (d, 1H). 1 Діастереомер 2: Н-ЯМР (CDCl3); = 2.74 (s, 3H), 3.03 (m, 1H), 3.12 (d, 1H), 3.89 (s, 3H), 4.79 (d, 1H), 5.65 (d, 1H), 6.56 (d, 1H), 6.93 (d, 1H), 6.96 (t, 1Н), 7.23 (d, 1H), 7.27-7.45 (m, 3H), 7.53 (d, 1Н), 8.05 (d, 1H). 260 мг (0.67 ммоль) [2-(2-метоксифеніл)-2-(2-трифторометилоксираніл)-етил]-(2метилхінолін-5-іл)-аміну розчиняли в 2.8 мл DMF. Додавали 436 мг (1.34 ммоль) карбонату цезію, а потім 268 мг (2.68 ммоль) 2-меркаптоімідазолу. Суміш енергійно перемішували при кімнатній температурі протягом 1.5 годин. Реакційну суміш розподіляли між етилацетатом і водою. Органічний шар промивали водою і розсолом і упарювали. Флеш хроматографія на силікагелі (ацетон в гексані 0%-65%) дає 286 мг бажаної сполуки у вигляді суміші діастереомерів, яка може бути розділена за допомогою тонкошарової хроматографії на силікагелі (етилацетат). 1 Діастереомер 1: Н-ЯМР (CDCl3); = 2.56 (s, 3H), 3.22 (s, 2Н), 3.89 (s, 3H), 5.40 (d, 1Н), 6.21 (d, 1H), 6.37 (d, 1H), 6.83 (t, 1H), 7.00 (s, 2H), 7.01-7.08 (m, 2H), 7.21 (t, 1H), 7.30 (m, 2H), 7.55 (d, 1H), 8.40 (d, 1H). 1 Діастереомер 2: Н-ЯМР (CDCl3); = 2.72 (s, 3H), 3.20 (d, 1H), 3.34 (d, 1H), 3.97 (s, 3H), 5.46 (d, 1H), 6.26 (d, 1H), 6.87 (t, 1H), 6.89 (d, 1H), 6.95 (s, 2H), 7.20-7.33 (m, 4H), 7.54 (d, 1H), 8.30 (s, 1H). Приклад 31 -{[(Імідазол-2-іл)-сульфаніл]-метил]-3-гідрокси--[(2-метилхінолін-5-іл)-аміно)-(трифторометил)-бензолетанол Аналогічно Прикладу 10 266 мг (0.54 ммоль) -{[(імідазол-2-іл)-сульфаніл]-метил}-3-метокси-[(2-метилхінолін-5-іл)-аміно)--(трифторометил)-бензолетанолу в 22 мл дихлорометану обробляли 4.3 мл 1M розчину триброміду бору в дихлорометані при -30°С. Звичайна обробка через 21 годину при кімнатній температурі і хроматографія на силікагелі (етилацетат 100%) дає 78 мг і 16 мг двох діастереомерів. 1 Діастереомер 1: Н-ЯМР (CD3OD); = 2.65 (s, 3H), 3.35 (s, 2Н), 5.44 (s, 1Н), 6.41 (d, 1H), 6.72 (t, 1H), 6.79 (d, 1H) 6.93 (s, 2H), 7.05 (t, 1H), 7.15 (d, 1H), 7.32 (t, 1H), 7.34 (d, 1H), 7.41, (d, 1H), 8.41 (d, 1H). 1 Діастереомер 2: Н-ЯМР (CD3OD); = 2.64 (s, 3H), 3.59 (d, 1H), 3.67 (d, 1H), 5.44 (s, 1H), 6.49 (d, 1H), 6.72 (t, 1H), 6.78 (d, 1H), 6.92 (s, 2H), 7.04 (t, 1H), 7.19 (d, 1H), 7.32 (d, 1H), 7.33 (d, 1H), 7.42 (d, 1H), 8.39 (d, 1H). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzyl amines, a process for their production and their use as anti-inflammatory agents
Автори англійськоюBerger Markus, Dahmen Jan, Schmees Norbert, Jaroch Stefan, Schaecke Heike
Назва патенту російськоюБензиламины, способ их получения и их применения в качестве противовоспалительных средств
Автори російськоюБергер Маркус, Дамен Ян, Ревинкель Хартмут, Ярох Штефан, Шеке Хайке
МПК / Мітки
МПК: C07C 215/28, A61K 31/136, C07D 405/12, C07D 405/14, C07C 217/78, C07D 401/12, C07D 215/38, C07D 303/08
Мітки: засобів, одержання, протизапальних, застосування, спосіб, бензиламіни
Код посилання
<a href="https://ua.patents.su/81-97806-benzilamini-sposib-kh-oderzhannya-i-kh-zastosuvannya-yak-protizapalnikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Бензиламіни, спосіб їх одержання і їх застосування як протизапальних засобів</a>
Попередній патент: Фільтр та спосіб його виготовлення
Наступний патент: Пристрій введення символів і спосіб його застосування
Випадковий патент: Система оцукрення замісу за одностадійною схемою