Тризаміщені 1,2,4-триазоли
Номер патенту: 95281
Опубліковано: 25.07.2011
Автори: Жуанг Вей, де Брюйн Марсел Франс Леопольд, Лесаж Анн Сімон Жозефін, ван Роосбрук Ів Еміль Марія, Даффі Джеймс Едвард Стюарт, ван ден Кейбус Франс Альфонс Марія, МакДональд Грегор Джеймс, Дінкло Теодорус, Тюрінг Йоханнес Вільгелмус Джон Ф.
Формула / Реферат
1. Сполука формули (І):
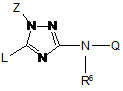 ,
,
включаючи всі її стереохімічно ізомерні форми, де
Z означає С1-6-алкіл або С1-6-алкіл, заміщений одним або більше замісниками, незалежно вибраними з групи, що складається з гідрокси, ціано, С1-6-алкіл-О-, R1R2N-С(=О)-, R7-O-C(=O)-NR8-, R10-O-C(=O)-, R3-C(=O)-NR4-, HO-N-C-(=NH)-, галогену, оксо, полігалоген-С1-6-алкілу і Het;
Q означає феніл, піридиніл, індолініл, бензодіоксоліл, 1,4-бензодіоксаніл, бензофураніл, 2,3-дигідробензофураніл, ізоксазоліл, оксазоліл, тіазоліл, ізотіазоліл, піримідиніл або піридазиніл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідроксилу, ціано, С1-6-алкілу, С1-6-алкіл-О-, С1-6-алкілтіо, С1-6-алкіл-О-С(=О)-, НО-С(=О)-С1-6-алкілу, Het, полігалоген-С1-6-алкілу, НО-С1-6-алкілу, полігалоген-С1-6-алкіл-О-, аміно, аміно-С1-6-алкілу, С1-6-алкіл-S(=О)2-, моно- або ді(С1-6-алкіл)аміно, форміламіно, С1-6-алкіл-С(=О)-NR11- і R12R13N-C(=O)-;
L означає С1-6-алкіл, необов'язково заміщений одним або, де можливо, двома або більше замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6-алкіл-О-, С1-6-алкілтіо, С1-6-алкіл-О-С(=О)-, полігалоген-С1-6-алкілу і полігалоген-С1-6-алкіл-О-; або
означає С3-6-циклоалкіл, феніл, піримідиніл, піридиніл, піримідазоліл, піридазиніл, тетрагідропіраніл, імідазотіазоліл, бензодіоксоліл, індолініл, ізоіндолініл, бензофураніл, хінолініл, ізохінолініл, бензоксазоліл, 5,6,7,8-тетрагідрохінолініл, 5,6,7,8-тетрагідроізохінолініл, 2,3-дигідропіролопіридиніл, фуропіридиніл, 2,3-дигідробензофураніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл і 3,4-дигідро-2Н-1,4-бензоксазиніл; де кожен з вищезгаданих радикалів необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи що складається з галогену, гідроксилу, ціано, С1-6-алкілу, С1-6-алкіл-О-, С1-6-алкілтіо, С1-6-алкіл-О-С(=О)-, НО-С(=О)-С1-6-алкілу, Het1, полігалоген-С1-6-алкілу, НО-С1-6-алкілу, полігалоген- С1-6-алкіл-О-, аміно, аміно- С1-6-алкіла, С1-6-алкіл-S(=O)2-, моно- або ді(С1-6-алкіл)аміно, форміламіно, С1-6-aлкiл-C(=O)-NR14-, R15R16N-С(=О)-, морфолінілу, СН3О-С1-6-алкіл-NH-, НО-С1-6-алкіл-NH-, бензилокси, С3-6-циклоалкілу, С3-6-циклоалкіл-NH-, С3-6-циклоалкіл-С1-6-алкіл-NН-, полігалоген-С1-6-алкіл-C(=O)-NR14-, С1-6-алкіл-С(=О)- і С1-6-алкіл-О-С1-6-алкілу
R1 і R2, кожен незалежно, означають водень, С1-6-алкіл, С3-6-циклоалкіл, С1-4-алкіл-О-С1-6-алкіл, Het2, НО-С1-6-алкіл, полігалоген-С1-6-алкіл, С3-6-циклоалкіл, заміщений С1-4-алкілом, С3-6-циклоалкіл-С1-6-алкіл, диметиламіно-С1-4-алкіл або 2-гідроксициклопентан-1-іл;
або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічний радикал, вианий з групи, що складається з піролідинілу, піперидинілу, піперазинілу, морфолінілу, тіоморфолінілу і піразолідинілу; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано і С1-6-алкілу;
R3 означає водень, С1-6-алкіл, С3-6-циклоалкіл, Het3 або С1-6-алкіл, заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано, С1-4-алкіл-О- і Het4;
R4 і R8, кожен незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-;
R6 означає водень, С1-6-алкіл або, коли Q означає феніл, R6 також може означати С2-6-алкандіїл, приєднаний до вищезгаданого фенільного циклу, утворюючи разом з атомом азоту, до якого він приєднаний, і вищезгаданим фенільним циклом конденсовану біциклічну систему, що містить 9-10 атомів циклу, таку як індолініл або тетрагідрохінолініл, причому кожен необов'язково заміщений трифторметилом;
R7 і R10, кожен незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано, С1-4-алкіл-О-, Het4 і NH2-C(CH3)=N-;
R11 і R14, кожен незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-;
R12 і R13, кожен незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано або С1-4-алкіл-О-; або R12 і R13 разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал, вибраний з групи, що складається з піролідинілу, піперидинілу, піперазинілу, морфолінілу, тіоморфолінілу і піразолідинілу; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу або полігалоген-С1-6-алкілу;
R15 і R16, кожен незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-; або R15 і R16 разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал, вибраний з групи, що складається з піролідинілу, піперидинілу, піперазинілу, морфолінілу, тіоморфолінілу і піразолідинілу; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6-алкілу;
Het і Het1, кожен незалежно, означають піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6-алкілу;
Het2 означає піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл, піразоліл або тетрагідрофураніл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6-алкілу;
Het3 означає піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6-алкілу;
Het4 означає піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано або С1-6-алкілу;
її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін;
за умови, що вищезгадана сполука не є N-(2-метоксифеніл)-1-метил-5-(2,4-дихлорфеніл)-1Н-1,2,4-триазол-3-амін.
2. Сполука формули (І) за п. 1, включаючи усі її стереохімічно ізомерні форми, яка відрізняється тим, що:
Z означає С1-6-алкіл або С1-6-алкіл, заміщений одним або більше замісниками, незалежно вибраними з групи, що складається з гідрокси, ціано, С1-6-алкіл-О-, R1R2N-С(=О)-, R7-O-C(=O)-NR8-, R10-O-C(=O)-, R3-C(=O)-NR4-, HO-N-C-(=NH)-, галогену, оксо, полігалоген-С1-6-алкілу і Het;
Q означає феніл, піридиніл, бензодіоксоліл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, ціано, С1-6-алкілу, С1-6-алкіл-О-, полігалоген-С1-6-алкілу, полігалоген-С1-6-алкіл-О- і моно- або ді(С1-6-алкіл)аміно;
L означає феніл, піридиніл, бензодіоксоліл, індолініл, хінолініл, 2,3-дигідропіролопіридиніл, фуропіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл, 3,4-дигідро-2Н-1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, ціано, С1-6-алкіла, С1-6-алкіл-О-, полігалоген-С1-6-алкілу, НО-С1-6-алкілу, полігалоген-С1-6-алкіл-О-, аміно-С1-6-алкілу, моно- або ді(С1-6-алкіл)аміно, R15R16N-C(=O)-, морфолінілу, СН3О-С1-6-алкіл-NH-, НО-С1-6-алкіл-NH-, бензилокси, С3-6-циклоалкілу, С3-6-циклоалкіл-NH-, С3-6-циклоалкіл-С1-6-алкіл-NH-, полігалоген-С1-6-алкіл-C(=O)-NR14-, С1-6-алкіл-С(=О)- і С1-6-алкіл-O-С1-6-алкілу;
R1 і R2, кожен незалежно, означають водень, С1-6-алкіл, С3-6-циклоалкіл, С1-4-алкіл-О-С1-6-алкіл, Het2, НО-С1-6-алкіл, полігалоген-С1-6-алкіл, С3-6-циклоалкіл, заміщений С1-4-алкілом, С3-6-циклоалкіл-С1-6-алкіл, диметиламіно-С1-4-алкіл або 2-гідроксициклопентан-1-іл;
або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи, що складається з піролідинілу і морфолінілу;
R3 означає водень, С1-6-алкіл, С3-6-циклоалкіл або Het3;
R4 і R8, кожен незалежно, означає водень або С1-6-алкіл;
R6 означає водень або, коли Q означає феніл, R6 також може означати С2-6-алкандіїл, приєднаний до вищезгаданого фенільного циклу, утворюючи разом з атомом азоту, до якого він приєднаний, і вищезгаданим фенільним циклом індолініл, заміщений трифторметилом;
R7 і R10, кожен незалежно, означають С1-6-алкіл або С3-6-циклоалкіл;
R11 і R14, кожен незалежно, означають водень або С1-6-алкіл;
R15 і R16, кожен незалежно, означають водень або С1-6-алкіл; або
R15 і R16 разом з атомом азоту, до якого вони приєднані, можуть утворювати піролідиніл;
Het і Het1, кожен незалежно, означають оксазоліл, необов'язково заміщений С1-6-алкілом;
Het2 означає тетрагідрофураніл;
Het3 означає оксазоліл;
її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін.
3. Сполука формули (І) за п. 1, включаючи усі її стереохімічно ізомерні форми, яка відрізняється тим, що:
Z означає С1-6-алкіл, заміщений гідрокси, R1R2N-C(=O)-, R3-C(=O)-NR4-;
Q означає феніл, піридиніл або бензодіоксоліл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6-алкілу, С1-6-алкіл-О-, полігалоген-С1-6-алкілу, полігалоген-С1-6-алкіл-О- і моно- або ді(С1-6-алкіл)аміно;
L означає феніл, піридиніл, бензодіоксоліл, індолініл, 2,3-дигідропіролопіридиніл, фуропіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл або 3,4-дигідро-2Н-1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, С1-6-алкілу, С1-6алкіл-О-, НО-С1-6-алкілу, моно- або ді(С1-6-алкіл)аміно, С3-6-циклоалкілу, С3-6-циклоалкіл-NH-, С3-6-циклоалкіл-С1-6-алкіл-NH- і С1-6-алкіл-О-С1-6-алкілу;
R1 і R2, кожен незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл;
R3 означає С1-6-алкіл;
R4 означає водень або С1-6-алкіл;
R6 означає водень;
її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін.
4. Сполука формули (І) за п. 1, включаючи всі її стереохімічно ізомерні форми, яка відрізняється тим, що
Z означає гідроксі-С2-3-алкіл або R1R2N-C(=O)-C1-3-алкіл;
Q означає феніл або піридиніл; де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6-алкілу, С1-6-алкіл-О-, полігалоген-С1-6-алкілу, полігалоген-С1-6-алкіл-О- і моно- або ді(С1-6-алкіл)аміно або 2,2-дифтор-1,3-бензодіоксол-5-ілу;
L означає феніл, піридиніл, індолініл, 2,3-дигідропіролопіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл або 3,4-дигідро-2Н-1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з фтору, хлору, С1-2-алкілу, С1-2-алкіл-О-, моно- або ді(С1-2-алкіл)аміно, циклопропілу, циклопропіл-NH-, циклопропілметил-NH- і метил-О-метилу;
R1 і R2, кожен незалежно, означають водень, С1-2-алкіл або С3-5-циклоалкіл;
R6 означає водень;
її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін.
5. Сполука за п. 1, яка відрізняється тим, що Z вибирають з групи, що складається з гідроксіетилу, 2-гідроксипропілу, ізопропілметил-NН-С(=О)-, метил-NH-С(=О)-метилу, етил-NН-С(=О)-метилу, диметиламіно-С(=О)-етилу, піролідиніл-С(=О)-етилу, ізопропіламіно-С(=О)-метилу і ізоксазолкарбоксамідпропілу, де вищезгаданий ізоксазольний цикл необов'язково заміщений метилом.
6. Сполука за п. 1, яка відрізняється тим, що Q є 2,2-дифтор-1,3-бензодіоксол-5-ілом.
7. Сполука за п. 1, яка відрізняється тим, що L вибирають з групи, що складається з фенілу, піридинілу або 1,4-бензодіоксанілу; де вищезгаданий L необов'язково заміщений одним або більше метильними або етиламінозамісниками
8. Сполука формули (І), включаючи всі її стереохімічно ізомерні форми, вибирана з групи, що складається з:
(S)-5-[2-(етиламіно)-4-піридиніл]-α-метил-3-[(3,4,5-трифторфеніл)аміно]-1Н-1,2,4-триазол-1-етанолу,
3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-N,N-диметил-5-(4-піридиніл)-1Н-1,2,4-триазол-1-пропанаміду,
3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-N-етил-5-(2-метил-4-піридиніл)-1Н-1,2,4-триазол-1-ацетаміду,
3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-N,N-диметил-5-(2-метил-4-піридиніл)-1Н-1,2,4-триазол-1-пропанаміду,
N-(циклопропілметил)-3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-5-(2-метил-4-піридиніл)-1Н-1,2,4-триазол-1-ацетаміду,
5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N-метил-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-ацетаміду,
5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N-(1-метилетил)-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-ацетаміду,
5-(4-піридиніл)-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-етанолу,
5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-етанолу,
5-(2-хлор-4-піридиніл)-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-етанолу,
N,N-диметил-5-(4-піридиніл)-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-пропанаміду,
5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N,N-диметил-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-пропанаміду,
5-метил-N-[3-[5-(4-піридиніл)-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1-іл]пропіл]-3-ізоксазолкарбоксаміду,
її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін.
9. Сполука за будь-яким з пп. 1-8 для застосування як лікарський засіб.
10. Застосування сполуки (формули І) для отримання лікарського засобу для запобігання або лікування або профілактики психотичних порушень, порушень відносно інтелектуального погіршення або захворювань чи станів, в разі яких корисна модуляція нікотинового α7-рецептора, де сполукою є сполука за будь-яким з пп. 1-8, включаючи сполуку N-(2-метоксифеніл)-1-метил-5-(2,4-дихлорфеніл)-1Н-1,2,4-триазол-3-амін.
11. Фармацевтична композиція, що містить фармацевтично прийнятний носій і, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-8, включаючи сполуку N-(2-метоксифеніл)-1-метил-5-(2,4-дихлорфеніл)-1Н-1,2,4-триазол-3-амін.
12. Спосіб отримання композиції за п. 11, який відрізняється тим, що фармацевтично прийнятний носій ретельно змішують з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-8, включаючи сполуку N-(2-метоксифеніл)-1-метил-5-(2,4-дихлорфеніл)-1Н-1,2,4-триазол-3-амін.
13. Продукт, що містить
(a) сполуку формули (І), і
(b) агоніст нікотинового α7-рецептора,
у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування при запобіганні або лікуванні захворювань, при яких корисна модуляція нікотинового α7-рецептора.
Текст
1. Сполука формули (І): 2 3 95281 14 С1-6-алкіл-NН-, полігалоген-С1-6-алкіл-C(=O)-NR -, С1-6-алкіл-С(=О)- і С1-6-алкіл-О-С1-6-алкілу 1 2 R і R , кожен незалежно, означають водень, С1-62 алкіл, С3-6-циклоалкіл, С1-4-алкіл-О-С1-6-алкіл, Het , НО-С1-6-алкіл, полігалоген-С1-6-алкіл, С3-6циклоалкіл, заміщений С1-4-алкілом, С3-6циклоалкіл-С1-6-алкіл, диметиламіно-С1-4-алкіл або 2-гідроксициклопентан-1-іл; 1 2 або R і R разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи, що складається з піролідинілу, піперидинілу, піперазинілу, морфолінілу, тіоморфолінілу і піразолідинілу; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано і С1-6-алкілу; 3 3 R означає водень, С1-6-алкіл, С3-6-циклоалкіл, Het або С1-6-алкіл, заміщений одним або більше замісниками, вибраними з групи, що складається з гід4 рокси, ціано, С1-4-алкіл-О- і Het ; 4 8 R і R , кожен незалежно, означають водень, С1-6алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-; 6 R означає водень, С1-6-алкіл або, коли Q означає 6 феніл, R також може означати С2-6-алкандіїл, приєднаний до вищезгаданого фенільного циклу, утворюючи разом з атомом азоту, до якого він приєднаний, і вищезгаданим фенільним циклом конденсовану біциклічну систему, що містить 9-10 атомів циклу, таку як індолініл або тетрагідрохінолініл, причому кожен необов'язково заміщений трифторметилом; 7 10 R і R , кожен незалежно, означають водень, С1-6алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з 4 гідрокси, ціано, С1-4-алкіл-О-, Het і NH2-C(CH3)=N-; 11 14 R і R , кожен незалежно, означають водень, С16-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-; 12 13 R і R , кожен незалежно, означають водень, С16-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що скла12 дається з гідрокси, ціано або С1-4-алкіл-О-; або R 13 і R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал, вибраний з групи, що складається з піролідинілу, піперидинілу, піперазинілу, морфолінілу, тіоморфолінілу і піразолідинілу; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу або полігалоген-С1-6алкілу; 15 16 R і R , кожен незалежно, означають водень, С16-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, вибраними з групи, що скла15 дається з гідрокси, ціано і С1-4-алкіл-О-; або R і 4 16 R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал, вибраний з групи, що складається з піролідинілу, піперидинілу, піперазинілу, морфолінілу, тіоморфолінілу і піразолідинілу; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6алкілу; 1 Het і Het , кожен незалежно, означають піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6алкілу; 2 Het означає піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл, піразоліл або тетрагідрофураніл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6-алкілу; 3 Het означає піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкілу і полігалоген-С1-6-алкілу; 4 Hetозначає піперидиніл, піперазиніл, піролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано або С1-6алкілу; її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін; за умови, що вищезгадана сполука не є N-(2метоксифеніл)-1-метил-5-(2,4-дихлорфеніл)-1Н1,2,4-триазол-3-амін. 2. Сполука формули (І) за п. 1, включаючи усі її стереохімічно ізомерні форми, яка відрізняється тим, що: Z означає С1-6-алкіл або С1-6-алкіл, заміщений одним або більше замісниками, незалежно вибраними з групи, що складається з гідрокси, ціано, С1-61 2 7 8 10 алкіл-О-, R R N-С(=О)-, R -O-C(=O)-NR -, R -O3 4 C(=O)-, R -C(=O)-NR -, HO-N-C-(=NH)-, галогену, оксо, полігалоген-С1-6-алкілу і Het; Q означає феніл, піридиніл, бензодіоксоліл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, ціано, С1-6-алкілу, С1-6-алкіл-О-, полігалоген-С1-6-алкілу, полігалоген-С1-6-алкіл-О- і моноабо ді(С1-6-алкіл)аміно; 5 L означає феніл, піридиніл, бензодіоксоліл, індолініл, хінолініл, 2,3-дигідропіролопіридиніл, фуропіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7азаіндолініл, 3,4-дигідро-2Н-1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, ціано, С1-6-алкіла, С1-6алкіл-О-, полігалоген-С1-6-алкілу, НО-С1-6-алкілу, полігалоген-С1-6-алкіл-О-, аміно-С1-6-алкілу, моно15 16 або ді(С1-6-алкіл)аміно, R R N-C(=O)-, морфолінілу, СН3О-С1-6-алкіл-NH-, НО-С1-6-алкіл-NH-, бензилокси, С3-6-циклоалкілу, С3-6-циклоалкіл-NH-, С3-6циклоалкіл-С1-6-алкіл-NH-, полігалоген-С1-6-алкіл14 C(=O)-NR -, С1-6-алкіл-С(=О)- і С1-6-алкіл-O-С1-6алкілу; 1 2 R і R , кожен незалежно, означають водень, С1-62 алкіл, С3-6-циклоалкіл, С1-4-алкіл-О-С1-6-алкіл, Het , НО-С1-6-алкіл, полігалоген-С1-6-алкіл, С3-6циклоалкіл, заміщений С1-4-алкілом, С3-6циклоалкіл-С1-6-алкіл, диметиламіно-С1-4-алкіл або 2-гідроксициклопентан-1-іл; 1 2 або R і R разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи, що складається з піролідинілу і морфолінілу; 3 R означає водень, С1-6-алкіл, С3-6-циклоалкіл або 3 Het ; 4 8 R і R , кожен незалежно, означає водень або С1-6алкіл; 6 6 R означає водень або, коли Q означає феніл, R також може означати С2-6-алкандіїл, приєднаний до вищезгаданого фенільного циклу, утворюючи разом з атомом азоту, до якого він приєднаний, і вищезгаданим фенільним циклом індолініл, заміщений трифторметилом; 7 10 R і R , кожен незалежно, означають С1-6-алкіл або С3-6-циклоалкіл; 11 14 R і R , кожен незалежно, означають водень або С1-6-алкіл; 15 16 R і R , кожен незалежно, означають водень або С1-6-алкіл; або 15 16 R і R разом з атомом азоту, до якого вони приєднані, можуть утворювати піролідиніл; 1 Het і Het , кожен незалежно, означають оксазоліл, необов'язково заміщений С1-6-алкілом; 2 Het означає тетрагідрофураніл; 3 Het означає оксазоліл; її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін. 3. Сполука формули (І) за п. 1, включаючи усі її стереохімічно ізомерні форми, яка відрізняється тим, що: 1 2 Z означає С1-6-алкіл, заміщений гідрокси, R R N3 4 C(=O)-, R -C(=O)-NR -; Q означає феніл, піридиніл або бензодіоксоліл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6-алкілу, С1-6-алкіл-О-, полігалоген-С16-алкілу, полігалоген-С1-6-алкіл-О- і моно- або ді(С16-алкіл)аміно; L означає феніл, піридиніл, бензодіоксоліл, індолініл, 2,3-дигідропіролопіридиніл, фуропіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7 95281 6 азаіндолініл або 3,4-дигідро-2Н-1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, С1-6-алкілу, С1-6алкіл-О-, НО-С1-6-алкілу, моно- або ді(С1-6-алкіл)аміно, С3-6циклоалкілу, С3-6-циклоалкіл-NH-, С3-6-циклоалкілС1-6-алкіл-NH- і С1-6-алкіл-О-С1-6-алкілу; 1 2 R і R , кожен незалежно, означають водень, С1-6алкіл або С3-6-циклоалкіл; 3 R означає С1-6-алкіл; 4 R означає водень або С1-6-алкіл; 6 R означає водень; її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін. 4. Сполука формули (І) за п. 1, включаючи всі її стереохімічно ізомерні форми, яка відрізняється тим, що 1 2 Z означає гідроксі-С2-3-алкіл або R R N-C(=O)-C1-3алкіл; Q означає феніл або піридиніл; де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6алкілу, С1-6-алкіл-О-, полігалоген-С1-6-алкілу, полігалоген-С1-6-алкіл-О- і моно- або ді(С1-6-алкіл)аміно або 2,2-дифтор-1,3-бензодіоксол-5-ілу; L означає феніл, піридиніл, індолініл, 2,3дигідропіролопіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл або 3,4-дигідро-2Н1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з фтору, хлору, С1С1-2-алкіл-О-, моноабо ді(С1-22-алкілу, алкіл)аміно, циклопропілу, циклопропіл-NH-, циклопропілметил-NH- і метил-О-метилу; 1 2 R і R , кожен незалежно, означають водень, С1-2алкіл або С3-5-циклоалкіл; 6 R означає водень; її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін. 5. Сполука за п. 1, яка відрізняється тим, що Z вибирають з групи, що складається з гідроксіетилу, 2-гідроксипропілу, ізопропілметил-NН-С(=О)-, метил-NH-С(=О)-метилу, етил-NН-С(=О)-метилу, диметиламіно-С(=О)-етилу, піролідиніл-С(=О)етилу, ізопропіламіно-С(=О)-метилу і ізоксазолкарбоксамідпропілу, де вищезгаданий ізоксазольний цикл необов'язково заміщений метилом. 6. Сполука за п. 1, яка відрізняється тим, що Q є 2,2-дифтор-1,3-бензодіоксол-5-ілом. 7. Сполука за п. 1, яка відрізняється тим, що L вибирають з групи, що складається з фенілу, піридинілу або 1,4-бензодіоксанілу; де вищезгаданий L необов'язково заміщений одним або більше метильними або етиламінозамісниками. 8. Сполука формули (І), включаючи всі її стереохімічно ізомерні форми, вибрана з групи, що складається з: (S)-5-[2-(етиламіно)-4-піридиніл]-α-метил-3-[(3,4,5трифторфеніл)аміно]-1Н-1,2,4-триазол-1-етанолу, 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-N,Nдиметил-5-(4-піридиніл)-1Н-1,2,4-триазол-1пропанаміду, 7 95281 8 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-Nетил-5-(2-метил-4-піридиніл)-1Н-1,2,4-триазол-1ацетаміду, 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-N,Nдиметил-5-(2-метил-4-піридиніл)-1Н-1,2,4-триазол1-пропанаміду, N-(циклопропілметил)-3-[(2,2-дифтор-1,3бензодіоксол-5-іл)аміно]-5-(2-метил-4-піридиніл)1Н-1,2,4-триазол-1-ацетаміду, 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N-метил-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1ацетаміду, 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N-(1метилетил)-3-[[3-(трифторметил)феніл]аміно]-1Н1,2,4-триазол-1-ацетаміду, 5-(4-піридиніл)-3-[[3-(трифторметил)феніл]аміно]1Н-1,2,4-триазол-1-етанолу, 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1етанолу, 5-(2-хлор-4-піридиніл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1етанолу, N,N-диметил-5-(4-піридиніл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1пропанаміду, 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N,N-диметил3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4триазол-1-пропанаміду, 5-метил-N-[3-[5-(4-піридиніл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1іл]пропіл]-3-ізоксазолкарбоксаміду, її N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін. 9. Сполука за будь-яким з пп. 1-8 для застосування як лікарський засіб. 10. Застосування сполуки (формули І) для отримання лікарського засобу для запобігання або лікування або профілактики психотичних порушень, порушень відносно інтелектуального погіршення або захворювань чи станів, в разі яких корисна модуляція нікотинового α7-рецептора, де сполукою є сполука за будь-яким з пп. 1-8, включаючи сполуку N-(2-метоксифеніл)-1-метил-5-(2,4дихлорфеніл)-1Н-1,2,4-триазол-3-амін. 11. Фармацевтична композиція, що містить фармацевтично прийнятний носій і, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-8, включаючи сполуку N-(2метоксифеніл)-1-метил-5-(2,4-дихлорфеніл)-1Н1,2,4-триазол-3-амін. 12. Спосіб отримання композиції за п. 11, який відрізняється тим, що фармацевтично прийнятний носій ретельно змішують з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-8, включаючи сполуку N-(2-метоксифеніл)-1-метил-5(2,4-дихлорфеніл)-1Н-1,2,4-триазол-3-амін. 13. Продукт, що містить (a) сполуку формули (І), і (b) агоніст нікотинового α7-рецептора, у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування при запобіганні або лікуванні захворювань, при яких корисна модуляція нікотинового α7-рецептора. Даний винахід відноситься до похідних 3анілін-5-арилтриазола і їх аналогів або їх фармацевтично прийнятних солей, способам їх отримання, фармацевтичним композиціям, що їх містять і їх застосуванню у терапії. Даний винахід, зокрема, відноситься до позитивних алостеричних модуляторів нікотинових рецепторів ацетилхоліну, таким як позитивні алостеричні модулятори, що мають здатність підсилювати ефективність агоністів нікотинового рецептора. У ЕР 1044970 описуються 3-алкіламіно-1,2,4триазоли у якості лігандів нейропептидного Yрецептора. У статті Makara G.M. і ін. (Organic Letters (2002), том 4 (10), cc. 1751-1754) описується твердофазовий синтез 3-алкіламіно-1,2,4триазолів і наводиться приклад невдалого синтезу N-(4-метоксифеніл)-1-метил-5-(4-метилфеніл)-1Н1,2,4-триазол-3-аміна [реєстраційний номер по CAS: 433710-55-5] і відсутні дані відносно потенційних терапевтичних застосувань цієї сполуки, зокрема, про її застосування у якості позитивного алостеричного модулятора нікотинового α7рецептора ацетилхоліну. Chen Chen та ін. у Bioorganic & Medicinal Chemistry Letters, 11 (2001), cc.3165-3168, описують синтез 1-алкіл-3-аміно-5-арил-1Н[1,2,4]триазолів, зокрема, N-(2-метоксифеніл)-1метил-5-(2,4-дихлорфеніл)-1Н-1,2,4-триазол-3 аміна, і їх застосування у якості антагоніста кортикотропінвивільняючого фактора-1 (CRF1). Холінергічні рецептори звичайно зв'язуються з ацетилхоліном (ACh) ендогенного нейромедіатора, таким чином ініціюючи відкриття іонних каналів. АСh-рецептори центральної нервової системи у ссавців можуть бути підрозділені на мускаринові (mAChR) і нікотинові (nAChR) підтипи, що базуються на агоністичних активностях мускарину і нікотину, відповідно. Нікотиновими рецепторами ацетилхоліну є керовані лігандами іонні канали, включаючи п'ять субодиниць. Члени сімейства генів з nAChR-субодиницею підрозділяли на дві групи, що базуються на їх амінокислотних послідовностях; одна група містить так звані βсубодиниці, а друга група містить α-субодиниці. Показано, що три типи α-субодиниць, α7, α8 і α9, утворюють функціональні рецептори, коли експресуються індивідуально, і, таким чином, передбачають утворення гомоолігомерних пентамерних рецепторів. Розроблена модель алостеричного перехідного стану nAChR, яка включає, щонайменше, стан спокою, активований стан і «десенсибілізований» стан закритого каналу, процес, за рахунок якого рецептори стають нечутливими до агоніста. Різні ліганди nAChR можуть стабілізувати конформаційний стан рецептора, з яким вони бажано зв'яза 9 ні. Наприклад, агоністи ACh і (-)-нікотина, відповідно, стабілізують активний і десенсибілізований стани. Зміни активності нікотинових рецепторів залучені в ряд захворювань. Деякі з них, наприклад, астенічний бульбарний параліч і аутосомнодомінантна нічна епілепсія лобової долі (ADNFLE), асоціюються із зменшеннями активності нікотинової трансмісії, або внаслідок зменшення кількості рецепторів, або внаслідок збільшення десенсибілізації. Також було передбачено, що зменшення у випадку нікотинових рецепторів опосередкують когнітивні розлади, що спостерігаються при захворюваннях, таких як хвороба Альцгеймера і шизофренія. Ефекти нікотину з тютюну також опосередковані нікотиновими рецепторами і, оскільки дія нікотину повинна стабілізувати рецептори в десенсибілізованому стані, активність нікотинових рецепторів, що збільшується, може зменшувати бажання палити. Сполуки, які зв'язуються з nAChR, пропонуються для лікування ряду порушень, включаючи послаблену холінергічну функцію, як, наприклад, дефіцит відносно навчання, когнітивний розлад, дефіцит уваги або втрата пам'яті. Вважають, що модуляція активності нікотинового α7-рецептора корисна у випадку ряду захворювань, включаючи хворобу Альцгеймера, деменцію, асоційовану з тільцями Леві, порушення гіперактивності відносно дефіциту уваги, занепокоєння, шизофренію, маніакальний синдром, маніакальну депресію, хворобу Паркінсона, хворобу Хантінгтона, хворобу Туретта, травму головного мозку або інші неврологічні, дегенеративні або психіатричні порушення, при яких відбувається втрата холінергічних синапсів, включаючи порушення біологічного ритму організму при перельоті через декілька часових поясів, згубну звичку до нікотину, біль. Проте, обробка агоністами нікотинового рецептора, які впливають на той же самий сайт, як і ACh, є проблематичною, тому що ACh не лише активує, але також і блокує активність рецептора за рахунок процесів, які включають десенсибілізацію і неконкуруючу блокаду. Крім того, виявляється, що пролонгована активація викликає персистуючу інактивацію. Отже, вважають, що агоністи ACh можуть знижувати активність, а також підсилювати її. Десенсибілізація нікотинових рецепторів, взагалі, і у випадку конкретної вказівки на нікотиновий α7-рецептор, обмежує тривалість дії використовуємого агоніста. Авторами даного винаходу несподівано виявлено, що деякі нові сполуки можуть збільшувати ефективність агоністів нікотинових рецепторів ацетилхоліну (nAChR). Сполуки, що мають такий тип дії (надалі згадувані як «позитивні алостеричні модулятори»), ймовірно, мають бути особливо придатні для лікування станів, пов'язаних із зниженнями нікотинової трансмісії. У терапевтичному плані, такі сполуки повинні відновлювати нормальну міжнейронну комунікацію без погіршення тимчасового профілю активації. Крім того, вважа 95281 10 ють, що позитивні алостеричні модулятори не викликають тривалої інактивації рецепторів, як це може відбуватись при пролонгованому вживанні агоністів. Позитивні nAChR-модуляторы згідно даного винаходу придатні для лікування або профілактики психотичних порушень, порушень відносно інтелектуального погіршення або захворювань або станів, у випадку яких корисна модуляція нікотинового α7-рецептора. Даний винахід відноситься до похідних 3анілін-5-арилтриазола, що має властивості позитивного алостеричного модулятора, зокрема, властивість підвищення ефективності агоністів нікотинового α7-рецептора. Даний винахід, далі, відноситься до способів їх отримання і фармацевтичним композиціям, що їх містять. Даний винахід також відноситься до застосування похідних 3анілін-5-арилтриазола для отримання лікарського засобу з метою лікування або профілактики психотичних порушень, порушень відносно інтелектуального погіршення або захворювань або станів, при яких корисна модуляція нікотинового α7рецептора. Сполуки згідно даного винаходу відрізняються структурно від сполук відомого рівня техніки і фармакологічно своєю активністю в якості позитивних алостеричних модуляторів нікотинового α7рецептора ацетилхоліну. Даний винахід відноситься до сполуки формули (І): (I) включаючи усі її стереохімічно ізомерні форми, де Ζ означає С1-6-алкіл або С1-6-алкіл, заміщений одним або більше є замісниками, незалежно обраними з групи, що складається з гідрокси, ціано, 1 2 7 8 10 С1-6-алкіл-О-, R R N-С(=О)-, R -O-C(=O)-NR -, R 3 4 O-C(=O)-, R -C(=O)-NR -, HO-N-C-(=NH)-, галогену, оксо, полігалоген-С1-6-алкіла і Het; Q означає феніл, піридиніл, індолініл, бензодіоксоліл, 1,4-бензодіоксаніл, бензофураніл, 2,3дигідробензофураніл, ізоксазоліл, оксазоліл, тіазоліл, ізотіазоліл, піримідиніл або піридазиніл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідроксила, ціано, С1-6-алкіла, С1-6-алкілО-, С1-6-алкілтіо, С1-6-алкіл-О-С(=О)-, НО-С(=О)-С1Het, полігалоген-С1-6-алкіла, НО-С1-66-алкіла, алкіла, полігалоген-С1-6-алкіл-О-, аміно, аміно-С1-6алкіла, С1-6-алкіл-S(=О)2-, моно- або ді(С1-611 алкіл)аміно, форміламіно, С1-6-алкіл-C(=O)-NR - і 12 13 R R N-C(=O)-; L означає С1-6-алкіл, необов'язково заміщений одним або, де можливо, двома або більше замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6-алкіл-О-, С1С1-6-алкіл-О-С(=О)-, полігалоген-С1-66-алкілтіо, алкіла і полігалоген-С1-6-алкіл-О-; або означає С3-6циклоалкіл, феніл, піримідиніл, піридиніл, піримі 11 дазоліл, піридазиніл, тетрагідропіраніл, імідазотіазоліл, бензодіоксоліл, індолініл, ізоіндолініл, бензофураніл, хінолініл, ізохінолініл, бензоксазоліл, 5,6,7,8-тетрагідрохінолініл, 5,6,7,8тетрагідроізохінолініл, 2,3дигідропірролопіридиніл, фуропіридиніл, 2,3дигідробензофураніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл і 3,4-дигідро-2Н-1,4бензоксазиніл; де кожен з вищезгаданих радикалів необов'язково заміщений одним або двома або більше є замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідроксила, ціано, С1-6-алкіла, С1-6-алкілО-, С1-6-алкілтіо, С1-6-алкіл-О-С(=О)-, НО-С(=О)-С11 6-алкіла, Het , полігалоген-С1-6-алкіла, НО-С1-6алкіла, полігалоген-С1-6-алкіл-О-, аміно, аміно-С1-6алкіла, С1-6-алкіл-S(=О)2-, моно- або ді(С1-614 алкіл)аміно, форміламіно, С1-6-алкіл-С(=О)-NR -, 15 16 R R N-C(=O)-, морфолініла, СН3О-С1-6-алкіл-NH-, НО-С1-6-алкіл-NH-, бензилокси, С3-6-циклоалкіла, С3-6-циклоалкіл-NH-, С3-6-циклоалкіл-С1-6-алкіл-NН14 , пoлiгaлoгeн-С1-6-aлкiл-C(=O)-NR -, С1-6-алкілС(=О)- і С1-6-алкіл-О-С1-6-алкіла; 1 2 R і R , кожен, незалежно, означають водень, С1-6-алкіл, С3-6-циклоалкіл, С1-4-алкіл-О-С1-6-алкіл, 2 Het , НО-С1-6-алкіл, полігалоген-С1-6-алкіл, С3-6циклоалкіл, заміщений С1-4-алкілом, С3-6циклоалкіл-С1-6-алкіл, диметиламіно-С1-4-алкіл або 2-гідроксициклопентан-1-іл; 1 2 або R і R разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічний радикал, обраний з групи, що складається з пірролідиніла, піперидиніла, піперазиніла, морфолініла, тіоморфолініла і піразолідиніла; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано і С1-6-алкіла; 3 R означає водень, С1-6-алкіл, С3-6-циклоалкіл, 3 Het або С1-6-алкіл, заміщений одним або більше замісниками, обраними з групи, що складається з 4 гідрокси, ціано, С1-4-алкіл-О- і Het ; 4 8 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більшеє замісниками, обраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-; 6 R означає водень, С1-6-алкіл, або, коли Q 6 означає феніл, R також може означати С2-6алкандіїл, приєднаний до вищезгаданого фенільного циклу, утворюючи разом з атомом азоту, до якого він приєднаний, і вищезгаданим фенільним циклом конденсовану біциклічну систему, що містить 9-10 атомів циклу, таку як індолініл або тетрагідрохінолініл, причому кожен необов'язково заміщений трифторметилом; 7 10 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більшеє замісниками, обраними з групи, що скла4 дається з гідрокси, ціано, С1-4-алкіл-О-, Het і NH2C(CH3)=N-; 11 14 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або 95281 12 більше замісниками, обраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-; 12 13 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більшеє замісниками, обраними з групи, що скла12 дається з гідрокси, ціано і С1-4-алкіл-О-; або R і 13 R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал, обраний з групи, що складається з пірролідиніла, піперидиніла, піперазиніла, морфолініла, тіоморфолініла і піразолідиніла; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла або полігалоген-С1-6алкіла; 15 16 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, обраними з групи, що скла15 дається з гідрокси, ціано і С1-4-алкіл-О-; або R і 16 R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал, обраний з групи, що складається з пірролідиніла, піперидиніла, піперазиніла, морфолініла, тіоморфолініла і піразолідиніла; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6алкіла; 1 Het і Het , кожен, незалежно, означають піперидиніл, піперазиніл, пірролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6-алкіла; 2 Het означає піперидиніл, піперазиніл, пірролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл, піразоліл або тетрагідрофураніл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6алкіла; 3 Het означає піперидиніл, піперазиніл, пірролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6-алкіла; 4 Het означає піперидиніл, піперазиніл, пірролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з 13 95281 групи, що складається з галогену, гідрокси, аміно, ціано або С1-6-алкіла; його N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін; за умови, що сполука не є N-(2-метоксифеніл)1-метил-5-(2,4-дихлорфеніл)-1Н-1,2,4-триазол-3амін. Даний винахід відноситься, особливо, до сполуки формули (І): (I) включаючи всі її стереохімічно ізомерні форми, де Ζ означає С1-6-алкіл або С1-6-алкіл, заміщений одним або більше замісниками, незалежно обраними з групи, що складається з гідрокси, ціано, С11 2 7 8 10 6-алкіл-О-, R R N-С(=О)-, R -O-C(=O)-NR -, R -O3 4 C(=O)- і R -C(=O)-NR -; Q означає феніл, піридиніл, індолініл, бензодіоксоліл, 1,4-бензодіоксаніл, бензофураніл, 2,3дигідробензофураніл, ізоксазоліл, оксазоліл, тіазоліл, ізотіазоліл, піримідиніл або піридазиніл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідроксила, ціано, С1-6-алкіла, С1-6-алкілО-, С1-6-алкілтіо, С1-6-алкіл-О-С(=О), -, НО-С(=О)С1-6-алкіла, Het, полігалоген- С1-6-алкіла, НО- С1-6алкіла, полігалоген-С1-6-алкіл-О-, аміно, аміно-С1-6алкіла, С1-6-алкіл-S(=О)2-, моно- або ді(С1-611 алкіл)аміно, форміламіно, С1-6-aлкiл-C(=O)-NR - і 12 13 R R N-C(=O)-; L означає С1-6-алкіл, необов'язково заміщений одним або, де можливо, двома або більше замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6-алкіл-О-, С1С1-6-алкіл-О-С(=О)-, полігалоген-С1-66-алкілтіо, алкіла і полігалоген-С1-6-алкіл-О-; або означає С3-6циклоалкіл, феніл, піримідиніл, піридиніл, піримідазоліл, піридазиніл, тетрагідропіраніл, імідазотіазоліл, бензодіоксоліл, індолініл, ізоіндолініл, бензофураніл, хінолініл, ізохінолініл, бензоксазоліл, 5,6,7,8-тетрагідрохінолініл, 5,6,7,8тетрагідроізохінолініл, 2,3дигідропірролопіридиніл, фуропіридиніл або 2,3дигідробензофураніл; де кожен з вищезгаданих радикалів необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідроксила, ціано, С1-6-алкіла, С1-6-алкіл-О-, С1-6-алкілтіо, С1-6-алкіл-О-С(=О)-, НО1 С(=О)-С1-6-алкіла, Het , полігалоген-С1-6-алкіла, НО-С1-6-алкіла, полігалоген-С1-6-алкіл-О-, аміно, аміно-С1-6-алкіла, С1-6-алкіл-S(=О)2-, моно- або ди(С1-6-алкіл) аміно, форміламіно, С1-6-алкіл14 15 16 С(=О)-NR - і R R N-C(=O)-; 1 2 R і R , кожен, незалежно, означають водень, С1-6-алкіл, С3-6-циклоалкіл, С1-4-алкіл-О-С1-6-алкіл 2 1 2 або Het ; або R і R разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічний радикал, обраний з групи, що складається з пірролідиніла, піперидиніла, піперазиніла, морфолініла, 14 тіоморфолініла і піразолідиніла; де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С16-алкіла; 3 R означає водень, С1-6-алкіл, С3-6-циклоалкіл, 3 Het або С1-6-алкіл, заміщений одним або більше замісниками, обраними з групи, що складається з 4 гідрокси, ціано, С1-4-алкіл-О- і Het ; 4 8 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл, де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, обраними з групи, що складається з гідрокси, ціано i С1-6-алкіл-О-; 6 R означає водень, С1-6-алкіл, або, коли Q 6 означає феніл, R також може означати С2-6алкандіїл, приєднаний до вищезгаданого фенільного циклу, утворюючи разом з атомом азоту, до якого він приєднаний, і вищезгаданим фенільним циклом конденсовану біциклічну систему, що містить 9-10 атомів циклу, таку як індолініл або тетрагідрохінолініл; 7 10 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл, де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, обраними з групи, що скла4 дається з гідрокси, ціано, С1-4-алкіл-О-1 Het ; 11 14 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл, де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками, обраними з групи, що складається з гідрокси, ціано і С1-4-алкіл-О-; 12 13 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл, де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками обраними з групи, що склада12 ється з гідрокси, ціано або С1-4-алкіл-О-, або R 1 13 R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал обраний з групи, що складається з пірролщиніла, піперидиніла, піперазиніла, морфолініла, тіоморфолініла i піразолідиніла, де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла або полігалоген-С1-6алкіла, 15 16 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл, де кожен з цих алкільних радикалів може бути заміщений одним або більше замісниками обраними з групи, що склада15 16 ється з гідрокси, ціано i С1-4-алкіл-О-, або R i R разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероциклічний радикал, обраний з групи, що складається з пірролідиніла, піперидиніла, піперазиніла, морфолініла, тіоморфолініла і піразолідиніла, де вищезгаданий гетероциклічний радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6алкіла; 1 Het і Het , кожен, незалежно, означають піперидиніл, піперазиніл, пірролідиніл, морфолініл, 15 95281 імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або З замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6-алкіла; 2 Het означає піперидиніл, піперазиніл, пірролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6-алкіла; 3 Het означає піперидиніл, піперазиніл, пірролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано, С1-6-алкіла і полігалоген-С1-6-алкіла; 4 Het означає піперидиніл, піперазиніл, пірролідиніл, морфолініл, імідазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, тіоморфолініл або піразоліл; де кожен радикал необов'язково заміщений 1, 2 або 3 замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, гідрокси, аміно, ціано або С1-6-алкіла; його N-оксиду, фармацевтично прийнятної аддитивної солі, сольвату або четвертинного аміну; за умови, що вищезгадана сполука не є N-(2метоксифеніл)-1-метил-5-(2,4-дихлорфеніл)-1Н1,2,4-триазол-3-амін і N-(4-метоксифеніл)-1-метил5-(4-метилфеніл)-1Н-1,2,4-триазол-3-амін. Окремою сполукою згідно даного винаходу є сполука формули (І): (I) включаючи усі її стереохімічно ізомерні форми, де Ζ означає С1-6-алкіл або С1-6-алкіл, заміщений одним або більше замісниками, незалежно обраними з групи, що складається з гідрокси, ціано, С11 2 7 8 10 6-алкіл-O-, R R N-С(=О) -, R -O-C(=O)-NR -, R -O3 4 C(=O) -, R -C(=O)-NR -, HO-N-C(=NH)-, галогену, оксо, полігалоген-Сі-6-алкіла і Het; Q означає феніл, піридиніл, бензодіоксоліл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, ціано, С1-6-алкіла, С1-6-алкіл-О-, полігалоген-С1-6-алкіла, полігалоген-С1-6-алкіл-О- і моноабо ді(С1-6-алкіл)аміно; L означає феніл, піридиніл, бензодіоксоліл, індолініл, хінолініл, 2,3-дигідропірролопіридиніл, фуропіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл, 3,4-дигідро-2Н-1,4бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісни 16 ками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, ціано, С1-6алкіла, С1-6-алкіл-О-, полігалоген-С1-6-алкіла, НОС1-6-алкіла, полігалоген-С1-6-алкіл-О-, аміно-С1-615 16 алкіла, моно- або ді(С1-6-алкіл)аміно, R R NC(=O)-, морфолініла, СН3О-С1-6-алкіл-NН-, HO-С16-алкіл-NH-, бензилокси, С3-6-циклоалкіла, С3-6циклоалкіл-NH-, С3-6-циклоалкіл-С1-6-алкіл-NH-, 14 пoлiгaлoгeн-С1-6-aлкiл-C(=O)-NR -, С1-6-алкілС(=О)- і С1-6-алкіл-О-С1-6-алкіла; 1 2 R і R , кожен, незалежно, означають водень, С1-6-алкіл, С3-6-циклоалкіл, С1-4-алкіл-О-С1-6-алкіл, 2 Het , НО-С1-6-алкіл, полігалоген-С1-6-алкіл, С3-6циклоалкіл, заміщений С1-4-алкілом, С3-6циклоалкіл-С1-6-алкіл, диметиламіно-С1-4-алкіл або 2-гідроксициклопентан-1-іл; 1 2 або R і R разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічний радикал, обраний з групи, що складається з пірролідиніла і морфолініла; 3 R означає водень, С1-6-алкіл, С3-6-циклоалкіл 3 або Het ; 4 8 R і R , кожен, незалежно, означають водень або С1-6-алкіл; 6 R означає водень або, коли Q означає феніл, 6 R також може означати С2-6-алкандіїл, приєднаний до вищезгаданого фенільного циклу, утворюючи разом з атомом азоту, до якого він приєднаний, і вищезгаданим фенільним циклом індолініл, заміщений трифторметилом; 7 10 R і R , кожен, незалежно, означають С1-6алкіл або С3-6-циклоалкіл; 11 14 R і R , кожен, незалежно, означають водень або С1-6-алкіл; 15 16 R і R , кожен, незалежно, означають водень 15 16 або С1-6-алкіл; або R і R разом з атомом азоту, до якого вони приєднані, можуть утворювати пірролідиніл; 1 Het i Het , кожен, незалежно, означають оксазоліл, необов'язково заміщений С1-6-алкілом; 2 Het означає тетрагідрофураніл; 3 Het означає оксазоліл; його N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін. Конкретніше, сполуками згідно даного винаходом є сполуки формули (І): (I) включаючи всі їх стереохімічно ізомерні форми, де Ζ означає С1-6-алкіл, заміщений гідрокси, 1 2 3 4 R R N-C(=O)-, R -C(=O)-NR -; Q означає феніл, піридиніл або бензодіоксоліл, де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С1-6-алкіла, С1-6-алкіл-О-, полігалоген-С1-6-алкіла, полігалоген-С1-6-алкіл-О- і моноабо ді(С1-6-алкіл)аміно; L означає феніл, піридиніл, бензодіоксоліл, індолініл, 2,3-дигідропірролопіридиніл, фуропіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7 17 95281 азаіндолініл або 3,4-дигідро-2Н-1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з галогену, С1-6-алкіла, С1-6-алкіл-О-, НО-С1-6-алкіла, моно- або ді(С1-6-алкіл)аміно, С3-6циклоалкіла, С3-6-циклоалкіл-NH-, С3-6-циклоалкілС1-6-алкіл-NH- і С1-6-алкіл-О-С1-6-алкіла; 1 2 R і R , кожен, незалежно, означають водень, С1-6-алкіл або С3-6-циклоалкіл; 3 R означає С1-6-алкіл; 4 R означає водень або С1-6-алкіл; 6 R означає водень; їх N-оксид, фармацевтично прийнятна адитивна сіль, сольват або четвертинний амін. Ще конкретніше, сполукою згідно даного винаходу є сполука формули (І): (I) включаючи усі його стереохімічно ізомерні форми, де 1 2 Ζ означає гїдрокси-С2-3-алкіл або R R N-С(=О)С1-3-алкіл; Q означає феніл або піридиніл; де кожен радикал необов'язково заміщений одним, двома або трьома замісниками, причому кожен незалежно вибирають з групи, що складається з галогену, С16-алкіла, С1-6-алкіл-О-, полігалоген-С1-6-алкіла, полігалоген-С1-6-алкіл-О- і моно- або ді(С1-6алкіл)аміно, або 2,2-дифтор-1,3-бензодіоксол-5іла; L означає феніл, піридиніл, індолініл, 2,3дигідропірролопіридиніл, бензодіоксаніл, дигідрофуропіридиніл, 7-азаіндолініл або 3,4-дигідро-2Н1,4-бензоксазиніл; де кожен радикал необов'язково заміщений одним або двома або більше замісниками, причому кожен замісник незалежно вибирають з групи, що складається з фтору, хлору, С1С1-2-алкіл-О-, моноабо ді(С1-22-алкіла, алкіл)аміно, циклопропіла, циклопропіл-NH-, циклопропілметил-NH- і метил-О-метила; 1 2 R і R , кожен, незалежно, означають водень, С1-2-алкіл або С3-5-циклоалкіл; 6 R означає водень; його N-оксид, фармацевтично прийнятну адитивну сіль, сольват або четвертинний амін. Відповідно до окремого втілення даного винаходу, Ζ вибирають з групи, що складається з гідроксиетилу, 2-гідроксипропілу, ізопропілметил-NНС(=O)-, метил-ΝΗ-С(=О)-метила, етил-NН-С(=О)метила, диметиламіно-С(=О)-етила, пірролідинілС(=О)-етила, Ізопропіламіно-С(=О)-метила і ізоксазолкарбоксамідпропіла, де вищезгаданий ізоксазольний цикл необов'язково заміщений метилом. Відповідно до іншого окремого втілення даного винаходу, Q означає 2,2-дифтор-1,3-бензодіоксол5-іл. Відповідно до іншого окремого втілення даного винаходу, L вибирають з групи, що складається з фенілу, піридиніла або 1,4-бензодіоксаніла; де вищезгаданий L необов'язково заміщений одним 18 або більше метильними або етиламінозамісниками. Особливо, L вибирають з 1,4бензодіоксаніла і піридиніла; усі з вищезгаданих радикалів, конкретніше, 4-піридиніл, заміщені одним метильним або одним етиламіно-замісником. Прикладами сполук згідно даного винаходу є: - (S)-5-[2-(етиламіно)-4-піридиніл]-α-метил-3[(3,4,5-трифторфеніл)аміно]-1Н-1,2,4-триазол-1етанол, - 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]N,N-диметил-5-(4-піридиніл)-1Н-1,2,4-триазол-1пропанамід, - 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]N-етил-5-(2-метил-4-піридиніл)-1Н-1,2,4-триазол-1ацетамід, - 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]N,N-диметил-5-(2-метил-4-піридиніл)-1Н-1,2,4триазол-1-пропанамід, N-(циклопропілметил)-3-[(2,2-дифтор-1,3бензодіоксол-5-іл)аміно]-5-(2-метил-4-піридиніл)1Н-1,2,4-триазол-1-ацетамід, включаючи усі їх стереохімічно ізомерні форми, N-оксиди, фармацевтично прийнятні адитивні солі, сольвати або четвертинні аміни. Іншими прикладами сполук згідно даного винаходу є: 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-Nметил-3-[[3-(трифторметил)феніл]аміно]-1Н-1,2,4триазол-1-ацетамід, 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N-(1метилетил)-3-[[3-(трифторметил)феніл]аміно]-1Н1,2,4-триазол-1-ацетамід, 5-(4-піридиніл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1етанол, 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1етанол, 5-(2-хлор-4-піридиніл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1етанол, N,N-диметил-5-(4-піридиніл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1пропанамід, 5-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N,Nдиметил-3-[[3-(трифторметил) феніл]аміно]-1Н1,2,4-триазол-1-пропанамід, 5-метил-N-[3-[5-(4-піридиніл)-3-[[3(трифторметил)феніл]аміно]-1Н-1,2,4-триазол-1іл]пропіл]-3-ізоксазолкарбоксамід, включаючи всі їх стереохімічно ізомерні форми, N-оксиди, фармацевтично прийнятні адитивні солі, сольвати або четвертинні аміни. Як зазначається у даному контексті вище або надалі, С1-4-алкіл як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-4 атомів вуглецю, такі як метил, етил, пропіл, 1метилетил, бутил; С1-6-алкіл як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-6 атомів вуглецю, такі як групи, описані для С1-4алкіла, і пентил, гексил, 2-метилбутил і тому подібне; С3-6-циклоалкіл є загальним терміном для циклопропіла, циклобутила, циклопентила і циклогексила. 19 Радикал L або Q, як описано вище для сполук формули (І), може бути приєднаний до залишку молекули згідно з формулою (І) по будь-якому атому вуглецю або гетероатому циклу, відповідно. Наприклад, коли L означає піридиніл, він може являти собою 2-піридиніл, 3-піридиніл або 4піридиніл. Лінії, накреслені в циклічних системах, вказують, що зв'язок може бути приєднаний до будьякого відповідного атома циклу. Коли циклічна система є біциклічною системою, зв'язок може бути приєднаний до будь-якого відповідного атома циклу одного з двох циклів. Як зазначається в даному контексті раніше, термін (=O) означає карбонільний залишок, коли приєднаний до атома вуглецю, сульфоксидний залишок, коли приєднаний до атома сірки, і сульфонільний залишок, де два з вищезгаданих термінів приєднані до атома сірки. Термін «галоген» означає фтор, хлор, бром і йод. Як зазначається раніше і надалі, полігалогенС1-6-алкіл, як група або частина групи, означає моно- або полігалогензаміщений С1-6-алкіл, наприклад, метил з одним або більше атомами фтору, наприклад, дифторметил або трифторметил, 1,1дифторетил і тому подібне. У випадку, коли більше ніж один атоми галогену приєднані до алкільної групи, у межах визначення полігалоген-С1-4-алкіла або полігалоген-С1-6-алкіла, причому вони можуть бути однаковими або різними. Мають на увазі, що гетероцикли, вказані в наведених вище визначеннях і надалі, включають усі їх можливі ізомерні форми, наприклад, пірроліл також включають 2Н-пірроліл; триазоліл включає 1,2,4-триазоліл і 1,3,4-триазоліл; оксадіазоліл включає 1,2,3-оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5-оксадіазоліл і 1,3,4-оксадіазоліл; тіадіазоліл включає 1,2,3-тіадіазоліл, 1,2,4-тіадіазоліл, 1,2,5тіадіазоліл і 1,3,4-тіадіазоліл; піраніл включає 2Нпіраніл і 4Н-піраніл; бензодіоксаніл включає 1,4- і 1,3-бензодіоксаніл; тетрагідрохінолініл включає 1,2,3,4-тетрагідрохінолініл і 5,6,7,8тетрагідрохінолініл. Коли будь-яка змінна зустрічається більше ніж один раз, у будь-якому компоненті, кожне визначення є незалежним. Повинно бути зрозуміло, що деякі із сполук формули (І) і їх N-оксиди, адитивні солі, сольвати, четвертинні аміни і стереохімічно ізомерні форми можуть містити один або більше центрів хіральності і існують у вигляді стереохімічно ізомерних форм. Термін «стереохімічно ізомерні форми», як зазначається раніше або надалі, означає всі можливі стереоізомерні форми, які можуть мати сполуки формули (І) і їх N-оксиди, адитивні солі, четвертинні аміни або фізіологічно функціональні похідні. За винятком інакше вказаного або згаданого, хімічна назва сполук означає суміш усіх можливих стереохімічно ізомерних форм, причому вищезгадані суміші містять усі діастереомери і енантіомери основної молекулярної структури, а також кожна з індивідуальних ізомерних форм згідно з формулою (І) і їх N-оксидів, солей, сольватів, четвертинних амінів, по суті, вільна, тобто асоційова 95281 20 на з менше ніж 10%, бажано, менше, ніж 5%, особливо, менше ніж 2%, і, більш бажано, менше ніж 1% інших ізомерів. Мають на увазі, що стереохімічно ізомерні форми сполук формули (І) входять у рамки даного винаходу. Для терапевтичного застосування, солі сполук формули (І) є такими, де протиіон є фармацевтично прийнятним. Проте, солі кислот і основ, які не є фармацевтично прийнятними, також можуть знаходити застосування, наприклад, при отриманні або очищенні фармацевтично прийнятної сполуки. Усі солі, чи фармацевтично прийнятні чи ні, входять у рамки даного винаходу. Мають на увазі, що фармацевтично прийнятні адитивні солі кислот і основ, як вказано раніше або надалі, включають терапевтично активні нетоксичні адитивні солеві форми з кислотами і основами, які здатні утворювати сполуки формули (І). Фармацевтично прийнятні адитивні солі кислот можна без зусиль отримати обробкою основної форми такою відповідною кислотою. Відповідні кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, соляна кислота або бромводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і тому подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова кислота, пропанова кислота, гідроксиоцтова кислота, молочна кислота, піровиноградна кислота, щавлева кислота (тобто, етандіова кислота), малонова кислота, бурштинова кислота (тобто, бутандіова кислота), малеїнова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, п-толуолсульфонова кислота, цикламенова кислота, саліцилова кислота, п-аміносаліцилова кислота, памоєва кислота і тому подібні кислоти. І навпаки, вищезгадані солеві форми обробкою відповідною основою можна перетворювати на вільну основну форму. Сполуки формули (І), що містять кислий протон, також можна перетворювати на їх нетоксичні адитивні солеві форми з металом або аміном обробкою відповідними органічними і неорганічними основами. Відповідні основні солеві форми включають, наприклад, солі амонія, солі лужних і лужноземельних металів, наприклад, солі літію, натрію, калія, магнію, кальцію і тому подібні, солі з органічними основами, наприклад, з первинними, вторинними і третинними аліфатичними і ароматичними амінами, такими як метиламін, етиламін, пропіламін, ізопропіламін, чотири ізомери бутиламіну, диметиламін, діетиламін, діетаноламін, дипропіламін, діізопропіламін, ді-n-бутиламін, піролідин, піперидин, морфолін, триметиламін, триетиламін, трипропіламін, хінуклідин, піридин, хінолін і ізохінолін; бензатин, N-метил-D-глюкамін, солі гідрабаміна, і солі з амінокислотами, такими як, наприклад, аргінін, лізин і тому подібні. І навпаки, солеві форми обробкою кислотою можна перетворювати на вільні кислотні форми. Термін «сольвати» відноситься до гідратів і алкоголятів, які можуть утворювати сполуки формули (І), а також їх солі. 21 Термін «четвертинний амін», як зазначається раніше, означає четвертинні амонієві солі, які здатні утворювати сполуки формули (І) взаємодією основного атома азоту сполуки формули (І) і відповідного кватернізуючого агента, такого як, наприклад, необов'язково заміщений алкілгалогенід, арилгалогенід або арилалкілгалогенід, наприклад, метилйодид або бензилйодид. Також можна використовувати інші реагенти з придатним чином видаляємими групами, як наприклад алкілтрифторметансульфонати, алкілметансульфонати і алкілр-толуолсульфонати. Четвертинний амін має позитивно заряджений атом азоту. Фармацевтично прийнятні протиіони включають, наприклад, хлор, бром, йод, трифторацетат і ацетат. Обраний протиіон можна отримати, використовуючи колонки з іонообмінною смолою. Мають на увазі, що N-оксидні форми сполук згідно даного винаходу включають сполуки формули (І), де один або декілька третинних атомів азоту окислено до так званого N-оксида. Деякі із сполук формули (І) також можуть існувати в їх таутомерній формі. Мають на увазі, що такі форми, хоча детально і не вказані у наведеній вище формулі, входять у рамки даного винаходу. Отримання сполук Сполуки згідно даного винаходу зазвичай можна отримати шляхом послідовності стадій, кожна з яких відома кваліфікованому фахівцеві у даній галузі. Особливо, сполуки згідно даної патентної заявки можна отримати відповідно до одного або більше з наступних способів отримання. На наступних схемах, і за винятком інакше вказаного, використовували усі змінні, як описано у формулі (І). Сполуки згідно даного винаходу можна отримати будь-яким з декількох стандартних способів синтезу, які зазвичай використовувалися кваліфікованим фахівцем у галузі органічної хімії, і, як правило, їх отримують відповідно до схеми 0, перетворенням похідного метилового ефіру Nацилкарбомімідотіонової кислоти загальної формули (V) на 1,2,4-триазоли формули (І), використовуючи відповідний гідразин (VI), за відомих умов. Це перетворення зазвичай здійснювали у протонному розчиннику, такому як метанол або вищий спирт, і потребує температури між кімнатною температурою і температурою 150°С. У конкретному втіленні, вищим спиртом є третинний бутиловий спирт і температура реакції складає від 70°С до 120°С, найбільш бажано, 100°С. Для цих реакцій, де гідразин (VI) використовували у вигляді солі з 95281 22 НСІ, бажане додавання стехіометричної кількості основи. Вищезгадана основа може бути неорганічною основою, такою як ацетат калія або карбонат калія, більш бажано, проте, вищезгадана основа є третинним аміном, таким як діізопропілетиламін або тому подібне (схема 0). Загальний проміжний продукт (V) у синтезі тризаміщених триазолів згідно даного винаходу зазвичай отримують згідно протоколу, який складається з 3 синтетичних перетворень (схема 1), виходячи з ацилхлорида загальної формули (II). Хлорангідрид кислоти (II) можна отримати обробкою карбонової кислоти (VII) надлишком оксалілхлорида, необов'язково у присутності ДМФА у якості каталізатора, при підвищеній температурі, зокрема, при температурі кипіння. Вищезгадане перетворення також можна здійснювати у присутності органічного розчинника, такого як дихлорметан або тому подібне На першій стадії, ацилюючий агент, такий як ацилхлорид (II), змішаний або симетричний ангідрид, ацилфторид і тому подібне, вводили у взаємодію з тіоціанатом одновалентного катіона (MNCS на схемі 1), таким як, наприклад, тіоціанат калія або тіоціанат амонія, з отриманням відповідного ацилізотіоціаната. Цю взаємодію, як правило, проводять, використовуючи ацетон у якості розчинника, і при температурі від 0°С до 70°С, бажано, при кімнатній температурі. Проміжний продукт ацилізотіоціанат не виділяють, а обробляли в подібному реакційному середовищі відповідним аміном (III), отримуючи Nацилтіосечовину загальної формули (IV). Цю реакцію перетворення зазвичай проводять при температурі від 0°С до 70°С, бажано, при кімнатній температурі. На кінцевій стадії, S-метилювання Nацилтіосечовини приводить до похідного метилового ефіру N-ацилкарбомімідотіонової кислоти загальної формули (V). Це завершальне перетворення вимагає присутності сильної основи, бажано, сильної неорганічної основи, такої як NAH, і воно повинне проводитися в апротонному розчиннику, такому як, наприклад, ДМФА, ТГФ і тому подібне, при температурі в діапазоні від -70°С до кімнатної температури, бажано, при температурі 0°С. 23 Сполуку загальної формули (I-а) можна гідролізувати до карбонової кислоти загальної формули (І-b). Це перетворення можна проводити використанням водного розчину сильної кислоти, як, наприклад, водний розчин НСІ, у присутності органічного співрозчинника, що змішується з водою, такого як ТГФ, метанол або, більш бажано, 1,4діоксан. Типова температура реакції знаходиться в діапазоні між кімнатною температурою і 100°С, бажано, складає 50°С. Альтернативно, вищезгаданий гідроліз можна проводити за допомогою обмилення, зазвичай, у присутності основи у вигляді гідроксиду, такого як LiOH або NaOH або тому подібної, у розчинювальній суміші з води і органічного співрозчинника, що змішується з водою, такого як ТГФ, метанол, 1,4-діоксан або їх суміші. Далі, конверсію карбонової кислоти в аміди формули (І-с) проводять, використовуючи відомі з рівня техніки способи, такі як, наприклад, обробка 95281 24 за допомогою первинного або вторинного аміну, як описано вище, у присутності HBTU (Обензотриазол-N,N,N',N'тетраметилуронійгексафторфосфат) або EDCI, в апротонному розчиннику, подібному СН2СІ2, або, більш бажано, у полярному апротонному розчиннику, подібному ДМФА, у присутності добавки основи у вигляді аміну, такого як діізопропілетиламін. У деяких випадках може бути переважним використання HOBt у якості добавки. У конкретному здійсненні даного винаходу, коли n=1 у сполуці загальної формули (I-а), утворення аміда (I-е) можна досягти, виходячи безпосередньо зі сполуки 1 (I-а), введенням його у взаємодію з аміном R -NH2 R у протонному розчиннику, такому як етанол або тому подібного. Цю взаємодію можна здійснювати при температурі від 20°С до 160°С, залежно від природи аміну. Зазвичай температура, що застосовується, складає 80°С (схема 2). 25 95281 26 Альтернативно, коли Ζ включає ціаногрупу, нітрил загальної формули (l-d) можна відновлювати до первинного аміна загальної формули (IX), використовуючи умови, відомі з рівня техніки, такі як, наприклад, газоподібний водень у присутності прийнятного гетерогенного каталізатора, такого як нікель Ренея, у розчинювальній системі, подібної до метанол-аміак і ТГФ. При ацилуванні аміну за гальної формули (IX) за допомогою ацилюючого агента (VIII), такого як, наприклад, 3ізоксазолкарбонілхлорид або ангідрид, у присутності основи у вигляді аміну, такого як триетиламін, у прийнятному розчиннику, такому як, наприклад, ТГФ або СН2СІ2, отримують ациламіни формули (I-е) (схема 3). Нуклеофільне ароматичне заміщення атома фтору в положенні 3 трифторованого анілінотриазола загальної формули (l-f) можна здійснювати шляхом розчинення сполуки (l-f) в спиртовому розчиннику, такому як етанол або тому подібному, у присутності первинного або вторинного алкіламіну 1 R-NH2 або R-NH-R , і шляхом нагрівання при високих температурах, таких як 160°С, у мікрохвильовій печі, з отриманням кінцевої сполуки (l-g) (схема 4). кою відповідного хлорпіридинільного попередника (I-h1) або (І-h2) за допомогою первинного (цикло)алкіламіну R-NH2 у спиртовому розчиннику, такому як етанол або 1-бутанол або тому подібному, необов'язково у присутності співрозчинника, такого як ТГФ або тому подібного, і при нагріванні при високих температурах, бажано, в діапазоні від 140°С до 160°С у мікрохвильовій печі, або при температурі 160-180°С в автоклаві. Вищезгадане перетворення можна здійснювати в м'яких умовах (нижча температура), виходячи з дихлорпіридинільної сполуки (l-h2), і особливо є сприятливим, коли нуклеофільність алкіламіну є низькою, такою, як у випадку циклопропіламіна. Атом хлору, що залишається, можна видаляти каталітично, в атмосфері водню і при використанні Pd/C у якості каталізатора, у присутності неорганічної основи, такої як ацетат калія, або основи у вигляді аміну, такої як триетиламін, або тому подібне (схема 5). Коли сполукою-мішенню є 3-алкіламінопіридин загальної формули (І-k), можна переважно вибирати відповідний 3-фторпіридин загальної формули (l-j) у якості вихідної речовини. При вищезгаданому перетворенні потрібне нагрівання сполуки (lj) у присутності надлишкової кількості алкіламіну R-NH2 у спиртовому розчиннику, такому як етанол, при температурі від 150°С до 200°С, такій як температура 180°С (схема 5). Синтез (цикло)алкіламінопіридинів загальної формули (І-i1) або (І-i2) можна здійснювати оброб В альтернативному втіленні даного винаходу, (цикло)алкіламінопіридини загальної формули (Ii1) можна отримати з відповідного хлорпіридинільного попередника (І-h1) і відповідного первинного 27 або вторинного алкіламіну R-NH2 або R-NH-R', використовуючи каталізатори на основі перехідного металу. Зокрема, в умовах Buchwald-Hartwig, при використанні Pd2(dba)3 і бідентатного фосфінового ліганда, такого як BINAP або тому подібного, у присутності сильної неорганічної основи, такої як трет-бутоксид калія або натрію, в ТГФ у якості розчинника, можна отримати сполуки загальної формули (І-i1). Типова температура реакції знаходиться в діапазоні від 100°С до 130°С, яку можна досягти шляхом нагрівання реакційній суміші в мікрохвильовій печі (схема 5а). Пірідодігідрофуран (l-m) можна отримати шляхом каталітичного гідрування піридофуранового попередника (I-1) при використанні Pd/C у якості каталізатора, в ацетоні у якості розчинника, або тому подібне (схема 6). Алкіл- або циклоалкілзаміщені піридини загальної формули (І-о) можна необов'язково отримати обробкою 2-хлорпіридинільного попередника (ln) надлишком (3-15 екв.) реактиву Гриньяра, R'MgBr, у присутності каталітичної кількості Fe(acac)3, у розчинювальній системі, що містить 85% ТГФ і 15% NMP. Вищезгадане перетворення можна здійснювати при температурі в діапазоні від 0°С до 50°С, більш бажано, при температурі 025°С (схема 7). 95281 28 динільного попередника (I-h1) алкоксидом натрію NAOR у спиртовому розчиннику HOR, наприклад, етанолі, коли R=Et, і нагрівання при високих температурах, бажано, при температурі 100-130°С, у трубці високого тиску або мікрохвильовій печі (схема 8). Альтернативно, можна переважно використовувати трет-бутоксид калія у якості основи. Аніліноацилтіосечовину загальної формули (XXV) можна отримати каталітичним гідруванням нітрофенільного попередника (XXVI), використовуючи Pd/C у якості каталізатора, у присутності тіофену і оксиду ванадію у ТГФ у якості розчинника, або тому подібне (схема 9). Ацетилзахищений азаіндолін загальної формули (XI) можна отримати нагріванням попередника загальної формули (X) в оцтовому ангідриді, потім обробкою неорганічною основою, такою як карбонат калія або тому подібної, у водному середовищі, бажано, у присутності органічного співрозчинника, такого як ТГФ або тому подібного, при температурі від 25°С до 80°С, бажано, при температурі 50°С (схема 10). Азаіндолін загальної формули (l-t) можна отримати обробкою ацетилзахищеного попередника загальної формули (l-s) неорганічною основою, такою як карбонат калія або тому подібною, у водному середовищі, бажано, у присутності органічного співрозчинника, такого як метанол або тому подібного, при температурі від 25°С до 80°С, бажано, при температурі 70°С (схема 11). Синтез 2-алкоксипохідного піридину (І-р) можна здійснювати обробкою відповідного хлорпіри 29 Пірідотриазол загальної формули (l-v) можна отримати каталітичним гідруванням хлорпіридинільного попередника (I-u), використовуючи Pd/C у якості каталізатора, у присутності тіофену і неорганічної основи, такої як ацетат калія або тому подібної, або основи у вигляді аміну, такої як триетиламін або тому подібної, у розчиннику, подібному до метанолу або ТГФ або тому подібному (схема 12). Альтернативно, коли або в разі замісника Ζ або в разі замісника Q містяться функціональні групи, які несумісні з умовами каталітичного гідрування, піридин загальної формули (I-х) можна отримати з хлорпіридина загальної формули (l-w) обробкою карбеноїдними каталізаторами, такими як каталізатор на основі Pd, [1,3-біс[2,6-біс(1метилетил)феніл]-2-імідазолідиніліден]хлор(η,3-2пропеніл)паладій ([478980-01-7]), у присутності сильної основи, такої як метоксид натрію, у суміші протонних розчинників, таких як метанол і 2пропанол або тому подібних. Вищезгадану взаємодію можна здійснювати при підвищеній температурі, такій як температура 120°С, у мікрохвильовій печі (схема 12а). Фторалкільну сполуку загальної формули (l-bb) можна отримати з відповідної гідроксильної сполуки (I-ba) обробкою фторуючим агентом, таким як DAST ((N-етилетанамінато)трифторсірка), у галогенованому розчиннику, такому як дихлорметан або тому подібне, при температурі від 0°С до 25°С (схема 13). 95281 30 Алкілкарбоксилат загальної формули (l-z) можна отримати з хлорпіридиніла загальної формули (I-у) реакцією введення CO. Прийнятними умовами є використання ацетату паладію у присутності ліганда, такого як 1,3-біс(дифенілфосфіно)пропан (DPPP), в атмосфері СО, при тиску, рівному 50 атм., і неорганічної основи, такої як ацетат калія або тому подібне. Для реакції, далі, потрібний полярний розчинник, такий як ТГФ і тому подібне, і відповідний спиртовий співрозчинник. Коли С1-6алкілом є метил, співрозчинником може бути метанол. Реакція якнайкраще протікає при високій температурі, такій як температура 150°С (схема 14). Синтез алкіламінокарбонілпіридинів загальної формули (І-аа) можна здійснити обробкою відповідного алкоксикарбонілпіридинового попередника (l-z) (цикло)алкіламіном R15R16NH, в полярному апротонному розчиннику, такому як ТГФ або тому подібне, і при нагріванні при високих температурах, бажано, при температурах у діапазоні від 80°С до 120°С, у мікрохвильовій печі (схема 15). Захищений параметоксибензилом (РМВ) вторинний амін загальної формули (XVI) можна отримати відновним амінуванням, використовуючи анілін загальної формули (XIV) і параметоксибензальдегід (XV), в атмосфері водню і в присутності прийнятного каталізатора, такого як паладій-навугіллі. Реакція найбільш переважно протікає у присутності розчину тіофену і в протонному розчиннику, такому як метанол або тому подібне (схема 16). 31 95281 32 подібне. Друга стадія включає циклізацію, з отриманням оксадіазолу загальної формули (І-ае), використовуючи прийнятний електрофіл, такий як оцтовий ангідрид або, більш бажано, ацетилхлорид, у полярному протонному розчиннику, такому як ТГФ або тому подібне, у присутності основи у вигляді аміну, такої як діізопропілетиламін. Вищезгадане перетворення якнайкраще здійснювали при використанні мікрохвильового нагріву, при температурі в діапазоні від 120°С до 170°С, бажано, при температурі 150°С (схема 19). Триазол загальної формули (XVIII) можна отримати обробкою попередника загальної формули (XVII) гідразингідратом, у протонному розчиннику, такому як трет-бутанол, при температурі від 70°С до 100°С. Дизаміщений триазол загальної формули (XVIII) можна алкілувати, використовуючи сильну основу, таку як гідрид натрію, у полярному апротонному розчиннику, такому як ТГФ або тому подібне, і відповідний алкілуючий агент. Для отримання триазолу загальної формули (XIX), алкілуючим агентом може бути метил-4-йодбутират і температура реакції складає 20°С (схема 17). Попередник загальної формули (XVII) отримують відповідно до схеми 1 при використанні вторинного аміну загальної формули (XVI). Триазол загальної формули (l-ab) можна отримати каталізуємим кислотою видаленням параметоксибензильної (РМВ) захисної групи в триазолі загальної формули (XX). Вищезгадане зняття захисту якнайкраще здійснювали, використовуючи ТФОК і протонний співрозчинник, такий як метанол або тому подібне (схема 18). 1,2,4-оксадіазол загальної формули (І-ае), зв'язаний у положенні 3 з триазольным ядром, можна отримати у 2 стадії, з відповідного нітрилу загальної формули (І-ас). Перша стадія включає утворення аміноксима загальної формули (l-ad). Цього можна досягти обробкою нітрилу (І-ас) за допомогою гідроксиламінгідрохлорида, у присутності неорганічної основи, такої як гідроксид натрію або тому подібне, у водному середовищі, бажано, у присутності органічного співрозчинника, що змішується з водою, такого як етанол або тому 1,2,4-оксадіазол загальної формули (І-аі), зв'язаний у положенні 5 з триазольним ядром, можна отримати у 3 стадії, з відповідного третбутилкарбоксилата загальної формули (l-af). Перша стадія включає видалення трет-бутильної складноефірної групи у сполуці (l-af), з отриманням карбонової кислоти загальної формули (l-ag). Це може бути здійснено обробкою сполуки (l-af) при використанні трифтороцтової кислоти у якості розчинника, при кімнатній температурі. Друга стадія включає конденсацію з амідоксимом, отримуючи проміжний продукт загальної формули (l-ah). Це може бути здійснено, використовуючи реагент конденсації, такий як діізопропілкарбодіімід (DIC) або тому подібне, у присутності каталізатора ацилювання, такого як гідроксибензотриазол (HOBt) або тому подібне. Прийнятними розчинниками є дихлорметан і ДМФА або їх суміші. Це перетворення може бути здійснене в діапазоні температур від -10°С до 25°С. Третя стадія включає циклізацію, з отриманням оксадіазолу загальної формули (І-аі). Прийнятним способом є використання дегідратуючого агента, такого як DIC або тому подібне, у полярному апротонному розчиннику, такому як ацетонітрил або тому подібне. Вищезгадане перетворення якнайкраще здійснювали, використовуючи мікрохвильовий нагрів, при температурі в діапазоні від 120°С до 170°С, бажано, при температурі 150°С (схема 20). Ціанопірідін загальної формули (l-z) можна отримати з хлорпіридиніла загальної формули (Iу). Прийнятними умовами є використання ціаниду цинку і цинкового пилу, при каталізі за допомогою Pd2(dba)3, у присутності ліганда, такого як dppf (1,1'-біс(дифенілфосфіно)ферроцен). Для здійс 33 95281 34 нення реакції, далі, потрібний полярний розчинник, такий як DMA або тому подібне, і якнайкраще її здійснювали при підвищеній температурі, такій як температура 100°С, у мікрохвильовій печі. Нітрил загальної формули (l-z) можна перетворити на амін загальної формули (l-aj), використовуючи атмосферу водню. Прийнятним каталізатором є нікель Ренея, і реакцію якнайкраще здійснювали в розчинювальній суміші, що містить метанол і аміак (схема 21). Трифторацетильовану сполуку загальної формули (І-аk) можна отримати шляхом нагрівання первинного аміну загальної формули (l-aj) у трифтороцтовій кислоті (схема 22). Етилкарбамат загальної формули (І-аn) можна отримати в 2 стадії, із захищеного аміну загальної формули (І-а1). На першій стадії, захисну групу Вос (трет-бутоксикарбоніл) видаляють обробкою сполуки (І-а1) надлишком трифтороцтової кислоти і прийнятним органічним співрозчинником, таким як дихлорметан або тому подібне. На другій стадії, амін загальної формули (l-am) вводили у взаємодію з етилхлорформіатом, у присутності основи у вигляді аміну, такої як триетиламін або тому подібної, у розчиннику, такому як дихлорметан або тому подібному. Вищезгадану взаємодію якнайкраще здійснювали при температурі від 0°С до 25°С. Амід загальної формули (І-ао) також можна отримати за допомогою аміну загальної формули (l-am). Це перетворення включає обробку аміну (lam) ацилюючим агентом, таким як оцтовий ангідрид, коли Р=метил, або хлорангідрид кислоти, у присутності основи у вигляді аміну, такої як триетиламін або тому подібної, у галогенованому розчиннику, такому як дихлорметан. Необов'язково використовували каталізатор ацилювання, такий як диметиламінопіридин (DMAP) або тому подібне (схема 23). Метоксиалкілтриазоли загальної формули (Іаr) можна отримати в 2 стадії, з відповідних гідроксилалкілтриазолів загальної формули (І-ар). На першій стадії, гідроксильну групу перетворюють на відповідну групу, що видаляється, таку як мезилат загальної формули (l-aq). Конкретніше, спирт (І-ар) обробляли мезилхлоридом у присутності основи у вигляді аміну, такого як триетиламін або тому подібне, у галогенованому розчиннику, такому як дихлорметан або тому подібне, при кімнатній температурі. На другій стадії, мезилат (l-aq) обробляли у метанолі у присутності каталітичної кількості карбонової кислоти, такий як оцтова кислота або тому подібне, i нагрівали при підвищених температурах у мікрохвильовій печі. Оптимальна температура реакції знаходиться в діапазоні 140-180°С, бажано, температура складає 160°С (схема 24). Гідразин загальної формули (XXII) можна отримати з акриламіда загальної формули (XXI) обробкою еквімолярною або надлишковою кількістю гідразингідрата у прийнятному протонному розчиннику, такому як метанол або тому подібне (схема 25). Діалкілкетони загальної формули (l-at) можна отримати обробкою диметиламідного попередника загальної формули (l-as) надлишком (15 екв.) реактиву Гриньяра, R'-MgBr, у присутності каталітичної кількості Fe(acac)3, у розчинюючій системі, що містить 85% ТГФ і 15% NMP. Вищезгадане перетворення можна здійснювати при температурі в діапазоні від 0°С до 50°С, більш бажано, при температурі від 0°С до 25°С (схема 26). 35 Суміш кетону загальної формули (l-av) і карбінолу загальної формули (l-aw) можна отримати із складного ефіру загальної формули (l-au). Перетворення включає обробку сполуки (l-au) надлишком алкіллітієвого реагенту в апротонному розчиннику, такому як ТГФ або тому подібне, при низькій температурі, бажано, при температурі -78°С (схема 27). Карбонова кислота (XXIV) може бути отримана з хлорпіридиніла (XXIII) реакцією введення CO. Прийнятними умовами є використання ацетату паладію у присутності ліганда, як наприклад 1,3біс(дифенілфосфіно) пропан (DPPP), в атмосфері СО при тиску 50 атм., і неорганічної основи, як наприклад ацетат калія або тому подібне. Для здійснення реакції, далі, потрібна вода і полярний органічний співрозчинник, такий як ТГФ і тому подібне. Реакція найкраще протікає при високій температурі, такій як 150°С (схема 28). Фармакологія Виявлено, що сполуки згідно даного винаходом є позитивними алостеричними модуляторами нікотинового α7-рецептора. Нікотиновий α7рецептор (α7 nAChR) належить до надсімейства цис-петлі іонотропних, керованих лігандами іонних каналів, яке включає сімейства 5-НТ3, GABAA і рецептора гліцину. Він активується ацетилхоліном і його продуктом розпаду холіном і головною особливістю α7 nAChR є його швидка десенсибілізація при постійній присутності агоніста Він є другим найбільше широко поширеним підтипом нікотинового рецептора в головному мозку i є важливим регулювальником вивільнення багатьох нейромедіаторів. Він має дискретний розподіл в окремих структурах головного мозку з релевантністю відносно асоційованих з увагою і когнітивних процесів, як наприклад гіпокамп і префронтальный кортекс, і бере активну участь у багатьох психіатричних і неврологічних порушеннях у людей. Генетична ознака його асоціації з шизофренією виявляється у формі міцного зв'язку між маркером шизофренії (розлад сенсорного воротного механізму) і α7-локусом у 15q13-14 і поліморфізмів в області корового промотора α7-гена. Патологічні дані свідчать про втрату α7імунореактивності і α-Btx-зв'язування у випадку 95281 36 гіпокампу, фронтального і поясного кортекса головного мозку хворих на шизофренію, у випадку хвороби Паркінсона і хвороби Альцгеймера і паравентрикулярному ядрі і повторних злиттях ядер у випадку аутизму. Фармакологічні дані, такі як виражена звичка до паління у хворих на шизофренію в порівнянні з нормальними людьми, інтерпретують як спробу пацієнтів до самолікування для компенсації дефіциту нікотинергічної α7-трансмісії. Тимчасову нормалізацію дефектів у сенсорному воротному механізмі (інгібування препульсації РРІ), у разі як тваринних моделей, так і людини, після введення нікотину і тимчасове відновлення нормального сенсорного воротного механізму у хворих на шизофренію, коли холінергічна активність переднього мозку низька (наприклад, сон фази 2), обидва, інтерпретують як результат тимчасової активації нікотинового α7-рецептора з подальшою десенсибілізацією. Таким чином, є придатний аргумент для припущення, що активація α7 nAChR може надавати терапевтично корисні дії на ряд (психіатричних і неврологічних) порушень центральної нервової системи (ЦНС). Як вже зазначалося, α7 nAChR швидко десенсибілізується при постійній присутності природнього нейромедіатора ацетилхоліну, а також екзогенних лігандов, таких, як нікотин. У десенсибілізованому стані рецептор залишається пов'язаним з лігандами, але функціонально неактивний. Це майже не є проблемою у випадку природних нейромедіаторів, таких, як ацетилхолін і холін, оскільки вони є субстратами для механізмів дуже сильного розпаду (ацетилхолінестераза) і кліренсу (транспортер холіну). Ці нейромедіаторні механізми розпад/кліренс, ймовірно, підтримують баланс між активуємими і десенсибілізованими α7 nAChR у фізіологічно придатному діапазоні. Проте, зрозуміло, що синтетичні агоністи, які не є субстратами для природних механізмів розпаду і кліренсу, повинні мати потенційну лабільність як для надстимуляції, так і також відносно зрушення рівноваги популяції α7 nAChR у напрямку до постійно десенсибілізованого стану, який є небажаним при порушеннях, у випадку яких грають роль дефіцити відносно експресії або функції α7 nAChR. Агоністи внаслідок своєї природи повинні мати мішенню Ach-зв'язуючу «кишеню», яка у високій мірі зберігається за рахунок різних підтипів нікотинового рецептора, приводячи до потенціалу відносно побічних реакцій внаслідок неспецифічної активації інших підтипів нікотинового рецептора. Отже, для уникнення цих потенційних лабільностей альтернативної терапевтичної стратегії у відношенні с-7агонізма потрібно підсилювати реактивність рецептора до природних агоністів за допомогою позитивного алостеричного модулятора (РАМ). РАМ визначають як агент, що зв'язується з сайтом, окремим від сайту зв'язування агоніста, і, отже, припускають, що не має агоністичних або десенсибілізуючих властивостей, але підсилює реактивність α7 nAChR до природнього нейромедіатора. Значення цієї стратегії полягає в тому, що для даної кількості нейромедіатора «розміри» відповіді 37 с-7 nAChR збільшуються у присутності РАМ співвідносно до рівня трансмісії, можливої при його відсутності. Так, у разі порушень, при яких є дефіцит білка α7 nAChR, може бути корисним індуковане РАМ збільшення нікотинергічної α7трансмісії. Оскільки РАМ залежить від присутності природнього трансміттера, потенціал відносно надстимуляції обмежений механізмами розпада/кліренса в разі природного трансміттера. Відповідно до об'єкту даного винаходу, він відноситься до способів лікування, які включають введення або позитивного алостеричного модулятора у якості єдиної активної речовини, таким чином модулюючи активність агоністів ендогенного нікотинового рецептора, таких, як ацетилхолін або холін, або введення позитивного алостеричного модулятора разом з агоністом нікотинового рецептора. У конкретній формі цього аспекту винаходу, спосіб лікування включає лікування за допомогою позитивного алостеричного модулятора нікотинового α7-рецептора, як описується в даному контексті, і агоніста або часткового агоніста нікотинового α7-рецептора. Приклади відповідних сполук з агоністичною активністю відносно нікотинового α7рецептора включають: - моногідрохлорид 4-бромфенілового ефіру 1,4-діазабіцикло[3.2.2]нонан-4-карбонової кислоти (SSR180711A); (-)-спіро[1-азабіцикло[2.2.2]октан-3,5'оксазолідин]-2'-он; 3-[(2,4диметокси)бензиліден]анабазеїндигідрохлорид (GTS-21); [N-[(3R)-1-азабіцикло[2.2.2]окт-3-іл]-4хлорбензамід-гідрохлорид] (PNU-282987). Позитивні nAChR-модулятори згідно даного винаходу придатні для лікування або профілактики психотичних порушень, порушень відносно інтелектуального погіршення або захворювань або станів, у випадку яких модуляція активності нікотинового α7-рецептора є корисною. Конкретним аспектом способу згідно даного винаходу є спосіб лікування порушення відносно навчання, когнітивного розладу, дефіциту уваги або втрати пам'яті, причому вважають, що модуляція активності нікотинового α7-рецептора має бути корисною у випадку ряду захворювань, включаючи хворобу Альцгеймера. деменцію, що асоціюється з тільцями Леві, порушення гіперактивності відносно дефіциту уваги, страх, шизофренію, маніакальний синдром, маніакальну депресію, хворобу Паркінсона, синдром Хантінгтона, хворобу Туретта, травму головного мозку або інші неврологічні, дегенеративні або психіатричні порушення, при яких відбувається втрата холінергічних синапсів, включаючи порушення біологічного ритму організму при перельоті через декілька часових поясів, згубну звичку до нікотину, біль. Зважаючи на вищеописані фармакологічні властивості, сполуки за формулою (І), або їх будьяка підгрупа, їх N-оксиди, фармацевтично прийнятні адитивні солі, четвертинні аміни і стереохімічно ізомерні форми, можуть бути використані у якості лікарського засобу. Зокрема, сполуки згідно даного винаходу можуть бути використані для отримання 95281 38 лікарського засобу в цілях лікування або профілактики психотичних порушень, порушень відносно інтелектуального погіршення або захворювань або станів, у випадку яких модуляція нікотинового α7рецептора є корисною. Зважаючи на корисність сполук за формулою (І), надається спосіб лікування теплокровних тварин, включаючи людей, що страждають, або спосіб запобігання теплокровних тварин, включаючи людей, від страждання, від захворювань, у разі яких модуляція нікотинового α7-рецептора є корисною, як наприклад шизофренія, маніакальний синдром і маніакальна депресія, страх, хвороба Альцгеймера, порушення відносно навчання, когнітивний розлад, дефіцит уваги, втрата пам'яті, деменція, що асоціюється з тільцями Леві, порушення гіперактивності відносно дефіциту уваги, хвороба Паркінсона, синдром Хантінгтона, хвороба Туретта, травма головного мозку, порушення біологічного ритму організму при перельоті через декілька часових поясів, згубну звичку до нікотину і біль. Вищезгадані способи включають введення, тобто, системне або локальне введення, бажано, пероральне введення, ефективної кількості сполуки формули (І), включаючи всі її стереохімічно ізомерні форми, й N-оксидну форму, фармацевтично прийнятну аддитивну сіль, сольват або четвертинний амін, теплокровним тваринам, включаючи людей. Фахівцеві в даній галузі зрозуміло, що терапевтично ефективною кількістю позитивних алостеричних модуляторів (РАМ) згідно даного винаходом є кількість, достатня для модуляції активності нікотинового α7-рецептора, і що ця кількість змінюється, між іншим, залежно від типа захворювання, концентрації сполуки в готовій лікарській формі i стану пацієнта. Взагалі, кількість РАМ, що вводиться у якості терапевтичного агенту для лікування захворювань, в разі яких модуляція нікотинового α7-рецептора є корисною, як наприклад шизофренія, маніакальний синдром i маніакальна депресія, страх, хвороба Альцгеймера, порушення відносно навчання, когнітивний розлад, дефіцит уваги, втрата пам'яті, деменція, що асоціюється з тільцями Леві, порушення гіперактивності відносно дефіциту уваги, хвороба Паркінсона, синдром Хантінгтона, хвороба Туретта, травма головного мозку, порушення біологічного ритму організму при перельоті через декілька часових поясів, згубну звичку до нікотину i біль має бути визначена залежно від випадку штатним лікарем. Взагалі, прийнятною дозою є така, яка призводить до концентрації РАМ на ділянці лікування в діапазоні від 0,5 нМ до 200 мкМ, і, більш звично, від 5 нМ до 50 мкМ. Для досягнення цих концентрацій в цілях лікування, пацієнтові, що потребує лікування має бути введена кількість сполуки, ймовірно, від 0,01 мг/кг до 2,50 мг/кг маси тіла, особливо, від 0,1 мг/кг до 0,50 мг/кг маси тіла. Кількість сполуки згідно даного винаходу, також визначаємої в даному контексті як активний інгредієнт, яка необхідна для досягнення терапевтичного ефекту, повинна, зрозуміло, варіюватися залежно від випадку, змінюючись залежно від конкретної сполуки, шляху введення, віку і стану реципієнта і 39 конкретного порушення або захворювання, що піддається лікуванню. Спосіб лікування також може включати введення активного інгредієнта в режимі між одним і чотирма прийомами на добу. У разі цих способів лікування, сполуки згідно даного винаходу переважно використовували для отримання готової до прийому лікарської форми. Як описується в даному контексті вище, прийнятні фармацевтичні готові лікарські форми готують відомими способами, використовуючи добре відомі і легкодоступні інгредієнти. Даний винахід також відноситься до композицій для запобігання або лікування захворювань, в разі яких модуляція нікотинового α7-рецептора є корисною, як наприклад шизофренія, маніакальний синдром і маніакальна депресія, страх, хвороба Альцгеймера, порушення відносно навчання, когнітивний розлад, дефіцит уваги, втрата пам'яті, деменція, що асоціюється з тільцями Леві, порушення гіперактивності відносно дефіциту уваги, хвороба Паркінсона, синдром Хантінгтона, хвороба Туретта, травма головного мозку, порушення біологічного ритму організму при перельоті через декілька часових поясів, згубну звичку до нікотину і біль. Вищезгадані композиції включають терапевтично ефективну кількість сполуки формули (І) і фармацевтично прийнятний носій або розчинник. Хоча можливе введення активного інгредієнта індивідуально, бажаним є введення його у вигляді фармацевтичної композиції. Відповідно, даний винахід відноситься, далі, до фармацевтичної композиції, що включає сполуку згідно даного винаходом разом з фармацевтично прийнятним носієм або розчинником. Носій або розчинник має бути «прийнятним» у сенсі сумісності з іншими інгредієнтами композиції і нешкідливим для його реципієнта. Фармацевтичні композиції згідно даного винаходу можуть бути отримані будь-якими способами, добре відомими у фармації, наприклад, використовуючи способи, описані Gennaro і ін. Remington's Pharmaceutical Sciences (18 видання, Mack Publishing Company, 1990, див. головним чином частина 8: Pharmaceutical preparations and their Manufacture). Терапевтично ефективна кількість конкретної сполуки, в основній формі або у формі аддитивної солі, у якості активного інгредієнта комбінують при ретельному змішуванні з фармацевтично прийнятним носієм, який може мати велику різноманітність форм залежно від форми препарату, бажаного для введення. Ці фармацевтичні композиції знаходяться бажано в унітарній лікарській формі, прийнятній, бажано, для системного введення, такого, як пероральне, трансдермальне або парентеральне введення; або локального введення, такого як за допомогою інгаляції, назального спрея, очних крапель або через крем, гель, шампунь або тому подібне. Наприклад, при приготуванні композицій у пероральній лікарській формі, може бути використане будь-яке із звичайних фармацевтичних середовищ, таке, як, наприклад, вода, гліколі, масла, спирти і тому подібне, в разі пероральних рідких препаратів, таких як суспензії, сиропи, еліксири і розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащувальні 95281 40 речовини, зв'язуючі речовини, дезінтегруючі агенти і тому подібне, в разі порошків, пілюль, капсул і пігулок. Унаслідок легкості їх введення, таблетки і капсули є найбільш сприятливою пероральною разовою лікарською формою, у випадку якої, очевидно, використовували тверді фармацевтичні носії. У разі парентеральних композицій, носій зазвичай включає стерильну воду, щонайменше, більшою частиною, хоча можуть бути включені інші інгредієнти, наприклад, для сприяння розчинності. Можуть бути приготовані, наприклад, розчини для ін'єкцій, в разі яких носій включає сольовий розчин, розчин глюкози або суміш сольового розчину і розчину глюкози. Також можуть бути приготовані суспензії, що ін'єктуються, в разі яких можуть бути використані відповідні рідкі носії, суспендуючі агенти, і тому подібне. У композиціях, придатних для підшкірного введення, носій необов'язково включає агент, що підсилює пенетрацію, і придатний змочувач, необов'язково комбіновані з придатними добавками будь-якої природи в незначних кількостях, причому добавки не провокують яких-небудь значних шкідливих дій на шкіру. Вищезгадані добавки можуть сприяти введенню в шкіру та/або можуть бути корисними для отримання бажаних композицій. Ці композиції можна вводити різними шляхами, наприклад, у вигляді трансдермального пластиру, у вигляді краплі, що наноситься точково, або у вигляді мазі. Це особливо сприятливо для отримання вищезгаданих фармацевтичних композицій в уніфікованій разовій лікарській формі для легкості їх введення і одноманітності дозування. Уніфікована разова лікарська форма, як використовується в описі і формулі винаходу даного контексту, відноситься до фізично дискретних одиниць, придатних у вигляді унітарних доз, причому кожна одиниця містить обумовлену кількість активного інгредієнта, розраховану для досягнення бажаного терапевтичного ефекту, у поєднанні з потрібним фармацевтичним носієм. Прикладами таких уніфікованих разових лікарських форм є таблетки (включаючи таблетки з насічкою або таблетки з покриттям), капсули, пілюлі, пакетовані порошки, облатки, розчини або суспензії для ін'єкцій, доза однієї чайної ложки, доза однієї столової ложки і тому подібне, і їх сегреговані множини. Сполуки згідно даного винаходу можна використовувати для системного введення, такого як пероральне, підшкірне або парентеральне введення; або локального введення, такого як за допомогою інгаляції, назального спрея, очних крапель або у вигляді крему, гелю, шампуня або тому подібне. Сполуки бажано вводили перорально. Точне дозування і частота введення залежать від використання конкретної сполуки формули (І), конкретного стану, який піддавали лікуванню, важкості стану, який піддавали лікуванню, віку, маси тіла, статі, міри порушення і загального фізичного стану конкретного пацієнта, а також від іншого медикаментозного лікування індивідуума, яке може проводитися, що добре відоме кваліфікованому фахівцеві у даній галузі. Крім того, очевидно, що вищезгадану ефективну добову кількість можна зменшувати або збільшувати залежно від відповіді 41 суб'єкта, що піддається лікуванню та/або залежно від оцінки лікаря, що прописує сполуки згідно даного винаходу. Сполуки формули (І) також можна використовувати в комбінації з іншими звичайними агоністами нікотинового α7-рецептора, такими як, наприклад: моногідрохлорид 4-бромфенілового ефіру 1,4-діазабіцикло[3.2.2]нонан-4-карбонової кислоти (SSR180711A); (-)-спіро[1-азабіцикло[2.2.2]октан3,5'-оксазолідин]-2'-он; 3-[(2,4диметокси)бензиліден]анабазеіндигідрохлорид (GTS-21); або [N-[(3R)-1-азабіцикло[2.2.2]окт-3-іл]4-хлорбензамідгідрохлорид] (PNU-282987). Таким чином, даний винахід також відноситься до комбінації сполуки формули (І) і агоніста нікотинового α7-рецептора. Таку комбінацію можна використовувати як лікарський засіб. Даний винахід також відноситься до продукту, що містить (а) сполуку формули (І) і (b) агоніст нікотинового α7рецептора, у вигляді комбінованого лікарського засобу для спільного, роздільного або послідовного використання в разі лікування захворювань, де корисна модуляція нікотинового α7-рецептора. Різні лікарські засоби можна комбінувати в одному препараті разом з фармацевтично прийнятними носіями. Експериментальна частина Надалі, термін «ТГФ» («THF») означає тетрагідрофуран, «ЕtOАс» означає етилацетат, «DIPE» означає діізопропіловий ефір, «СН2СІ2» означає дихлорметан, «НОАс» означає оцтову кислоту, «КОАс» означає ацетат калія, «HBTU» означає 1[біс(диметиламіно) метилен]-1Нбензотриазолійгексафторфосфат(1-)3-оксид, «ДМФА» означає Ν,Ν-диметилформамід, «DIPEA» означає N-етил-N-(1-метилетил)-2-пропанамін, «СН3СN» означає ацетонітрил, «СН3ОН» означає метанол, «Nа2СО3» означає динатрієву сіль вугільної кислоти, «NaH» означає гідрид натрію, «NH4HCO3» означає моноамонієву сіль вугільної кислоти, «NH4OAc» означає амонієву сіль оцтової кислоти, «CH3NH2» означає метанамін, «NH4CI» означає хлорид амонія, «NаНСО3» означає мононатрієву сіль вугільної кислоти, «t-BuOH» означає 2-бутил-2-пропанол, «HOBt» означає 1-гідрокси1H-бензотриазол, «EDCI» означає N'(етилкарбонімідоіл)-N,N-диметил-1,3пропандіамін-моногідрохлорид, «ТФОК» («TFA») означає трифтороцтову кислоту, «Pd(OAc)2» означає ацетат паладію, «Et3N» означає триетиламін, «Pd2(dba)3» означає трис[μ-[(1,2-η):4,5-η))-(1Е,4Е)1,5-дифеніл-1,4-пентадієн-3-он]]дипаладій, «CH3MgBr» означає метилмагнійбромщ, «Et2O» означає діетиловий ефір. Ряд сполук очищали за допомогою високоефективної рідинної хроматографії з оберненими фазами, використовуючи один з нижченаведенх способів (що вказуються у складеній методиці як спосіб А і спосіб В). Спосіб А, ВЕРХ Продукт очищали за допомогою високоефективної рідинної хроматографії (Shandon Hyperprep® C18 BDS (основний дезактивований діоксид кремнію), 8 мкм, 250 г, внутрішній діаметр 5 см). Використовували три рухливі фази (фаза А 95281 42 0,25%-й розчин NH4HCO3 у воді; фаза В: СН3ОН; фаза С: CH3CN). Спочатку, 75% А і 25% В, при об'ємній швидкості потоку 40 мл/хв, утримували протягом 0,5 хвилини. Потім, використовували градієнт 50% В і 50% С протягом 41 хвилини, при об'ємній швидкості потоку 80 мNхв. Після цього, використовували градієнт 100% С протягом 20 хвилин, при об'ємній швидкості потоку 80 мл/хв, i утримували протягом 4 хвилин. Спосіб В, ВЕРХ Продукт очищали за допомогою високоефективної рідинної хроматографії (Shandon Hyperprep® C18 BDS (основний дезактивований діоксид кремнію), 8 мкм, 250 г, внутрішній діаметр 5 см). Використовували три рухливі фази (фаза А: 90% 0,5%-го розчину NH4OAc у воді + 10% CH3CN; фаза В: СН3ОН; фаза С: CH3CN) Спочатку, 75% Α i 25% В, при об'ємній швидкості потоку 40 мл/хв, утримували протягом 0,5 хвилини Потім, використовували градієнт 50% В і 50% С протягом 41 хвилини, при об'ємній швидкості потоку 80 мл/хв Після цього, використовували градієнт 100% С протягом 20 хвилин, при об'ємній швидкості потоку 80 мл/хв, i утримували протягом 4 хвилин. А. Отримання проміжних продуктів Приклад А1 а) Отримання проміжного продукту 1 Суміш амонієвої солі тіоціанової кислоти (0,0164 моль) у 2-пропаноні (50 мл) перемішували при кімнатній температурі. Потім, у вигляді порцій, додавали 2,3-дигідро-1,4-бензодіоксин-6карбонілхлсрид (0,015 моль). Реакційну суміш кип'ятили протягом 15 хвилин. Потім до реакційної суміші по краплях додавали 3-(трифторметил) бензоламін (0,0125 моль) у 2-пропаноні (достатню кількість) при температурі кипіння із зворотним холодильником. Реакційну суміш перемішували при кип'ятінні із зворотним холодильником протягом 30 хвилин. Після цього реакційну суміш виливали у суміш льоду і Na2СО3 (достатня кількість). Осад фільтрували і висушували, отримуючи 4,90 г (вихід 100%) проміжного продукту 1. b) Отримання проміжного продукту 2 Взаємодію здійснювали у потоці азоту. Розчин 60%-го NaH (0,014 моль) у ТГФ (150 мл) перемішували на крижаній бані. Потім, у вигляді порцій, додавали проміжний продукт 1 (0,0125 моль). Реакційну суміш перемішували протягом наступних 30 хвилин при температурі 0°С. Потім до реакційної суміші додавали по краплях йодметан (0,014 ммоль) у ТГФ (достатня кількість). Реакційну суміш 43 залишали нагріватися до кімнатної температури. Реакційну суміш розкладали за допомогою води, і органічний розчинник випаровували. Водний концентрат екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили, фільтрували і розчинник випаровували. Залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН = 99/1 і 98/2). Фракції продукту збирали і розчинник випаровували, отримуючи 4,95 г (вихід 100%) проміжного продукту 2. Приклад А2 Отримання проміжного продукту 3 Гідразин (.х Н2О) (25 г) перемішували у герметично закритій пробірці при температурі 70°С. Повільно додавали (шприц) (2Р)-2(трифторметил)оксиран (2,0 г, 0,018 моль) в гідразині при температурі 60°С. Реакційну суміш перемішували протягом 4 годин при температурі 60°С. Розчинник випаровували (знижений тиск; 9 мм Hg/50°C). Утворюється тверда речовина білого кольору. Додавали толуол і знову випаровували (при температурі 50°С), отримуючи 2,6 г проміжного продукту 3 (сирий, використовувався як такий на наступній реакційній стадії). Приклад A3 a) Отримання проміжного продукту 4 Суміш амонієвої солі тіоціанової кислоти (0,081 моль) у 2-пропаноні (120 мл) перемішували протягом 1 години. Потім додавали 4піридинкарбонілхлоридпдрохлорид (0,074 моль). Реакційну суміш перемішували протягом 15 хвилин при температурі кипіння зі зворотним холодильником. Після цього по краплях додавали 3(трифторметил) бензоламін (0,062 моль) у 2пропаноні (достатня кількість) при температурі кипіння зі зворотним холодильником і реакційну суміш кип'ятили із зворотним холодильником протягом наступних 30 хвилин. Реакційну суміш виливали в суміш льоду і Nа2СО3. Осад фільтрували і потім висушували, отримуючи 9,28 г (вихід 46%) забрудненого проміжного продукту 4, який використовували як такий при подальших взаємодіях. b) Отримання проміжного продукту 5 Взаємодію здійснювали у потоці азоту. Розчин 60%-го NaH (0,03 моль) у ТГФ (300 мл) перемішували на крижаній бані. Потім, у вигляді порцій, додавали проміжний продукт 4 (0,027 моль). Реак 95281 44 ційну суміш перемішували протягом 30 хвилин при температурі 0°С. Потім до реакційної суміші додавали по краплях йодметан (0,03 ммоль) у ТГФ (достатня кількість). Реакційну суміш залишали нагріватися до кімнатної температури. Після цього реакційну суміш виливали у воду і ТГФ випаровували. Концентрат екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили, відфільтровували і розчинник випаровували. Залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН = 99/1 i 98/2) Фракції продукту збирали і розчинник випаровували, отримуючи 4 г (вихід 44%) забрудненого проміжного продукту 5, який використовували як такий у подальших взаємодіях. Приклад А5 a) Отримання проміжного продукту 10 Амонієву сіль тіоціанової кислоти (0,0873 моль) перемішували у 2-пропаноні (150 мл) при кімнатній температурі. У вигляді порцій, додавали 2-хлор-4-піридинкарбонілхлорид (0,080 моль) і суміш перемішували протягом 30 хвилин. По краплях додавали розчин 3-(трифторметил) бензоламіна (0,0727 моль) у невеликій кількості 2пропанона, і реакційну суміш перемішували протягом 4 годин. Розчинник випаровували. Залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: гексан/ЕtOАс = від 90/10 до 50/50). Фракції продукту збирали і розчинник випаровували до отримання осаду. Цей осад фільтрували і висушували, отримуючи 12,630 г (вихід 48,3%) проміжного продукту 10. b) Отримання проміжного продукту 11 Взаємодію здійснювали у потоці азоту. Перемішували розчин 60%-го NaH (0,0410 моль) у ТГФ (достатня кількість) протягом 30 хвилин, весь час охолоджуючи на крижаній бані. По краплях додавали розчин проміжного продукту 10 (0,0342 моль) у ТГФ (достатня кількість). Отриману реакційну суміш перемішували протягом 30 хвилин при температурі 0°С. Додавали по краплях йодметан (0,0342 ммоль) у ТГФ (достатня кількість). Реакційну суміш перемішували протягом 3 годин при кімнатній температурі. Реакцію гасили додаванням води. Органічний розчинник випаровували. Водний концентрат екстрагували за допомогою ЕtOАс. Використовуваний для екстракції розчинник випаровували. Залишок перемішували з DIPE, фільтрували і висушували, отримуючи 10,977 г (вихід 85,9%) проміжного продукту 11. Приклад А6 45 Отримання проміжного продукту 12 46 Суміш сполуки 64 (0,0006 моль) у суміші CH3OH/NH3 (40 мл) гідрували при температурі 14°С при використанні нікелю Ренея (каталітичні кількості) у якості каталізатора. Після поглинання водню (2 екв.), каталізатор відфільтровували і розчинник, що міститься у фільтраті, випаровували, отримуючи 0,2 г (вихід 100%) проміжного продукту 12, який використовували, як такий, на наступній реакційній стадії, без подальшого очищення. Приклад Α7 a) Отримання проміжного продукту 13 Суміш 4-фтор-3-(трифторметил)бензоламіна (0,055 моль) і 4-метоксибензальдегіда (7,5 г) у СН3ОН (200 мл) вводили у взаємодію при використанні 10%-го Pd/C (1 г) у якості каталізатора у присутності розчину тіофену (1 мл; 4%-й розчин у DIPE). Після поглинання водню (1 екв.), каталізатор фільтрували і фільтрат випаровували, отримуючи 16,45 г (вихід 100%) проміжного продукту 13. b) Отримання проміжного продукту 14 Суміш амонієвої солі тіоціанової кислоти (0,07 моль) у 2-пропаноні (100 мл) перемішували при кімнатній температурі. Додавали 2-хлор-4піридинкарбонілхлорид (0,063 моль) і суміш перемішували протягом 2 годин при кімнатній температурі. Додавали проміжний продукт 13 (0,06 моль) і суміш перемішували протягом 1 години при кімнатній температурі. Суміш виливали на лід і потім екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили (MgSO4), фільтрували і розчинник випаровували. До залишку додавали толуол і розчинник випаровували, отримуючи 29,8 г (вихід 100%) проміжного продукту 14. c) Отримання проміжного продукту 15 Суміш 60%-го NaH (0,07 моль) у ТГФ (200 мл) перемішували в атмосфері азоту на крижаній бані. 95281 46 Додавали проміжний продукт 14 (0,06 моль) і суміш перемішували протягом 1 години при температурі 0°С. Потім додавали йодметан (10 г, 0,07 моль) i крижану баню відстоювали. Додавали воду і реакційну суміш випаровували. До залишку додавали воду і цю суміш екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили (MgSO4), фільтрували і розчинник випаровували, отримуючи 30,7 г (вихід 100%) проміжного продукту 15. d) Отримання проміжного продукту 16 Суміш проміжного продукту 15 (0,06 моль) і гідразинмоногідрата (0,12 моль) в t-BuOH (200 мл) перемішували і кип'ятили із зворотним холодильником протягом 1 години. Розчинник випаровували і залишок обробляли водою. Суміш екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили (MgSO4), фільтрували i розчинник випаровували. Залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: спочатку, 1% СН3ОН в СН2СІ2, потім, 2% СН3ОН в СН2СІ2). Чисті фракції збирали і розчинник випаровували, отримуючи 15 г (вихід 52%) проміжного продукту 16. e) Отримання проміжного продукту 17 Взаємодію здійснювали в атмосфері азоту. 60%-й NaH (0,0057 моль) суспендували в ТГФ (40 мл) при кімнатній температурі. У вигляді порцій, додавали проміжний продукт 16 (0,0041 моль). Через 20 хвилин повільно додавали метиловий ефір 4-йодмасляної кислоти (0,0136 моль) і розчин перемішували при кімнатній температурі протягом 1 тижня. Потім суміш гасили насиченим розчином NH4CI i цю суміш екстрагували за допомогою ЕtOАс (2 рази). Відокремлений органічний шар промивали насиченим сольовим розчином, сушили (MgSO4), фільтрували і розчинник випаровували. Залишок очищали на колонці Biotage 40M SiO2, елююючи сумішшю від 20% ЕtOАс/гептан до 30% ЕtOАс/гептан, і нарешті, 50% ЕtOАс/гептан (найбільша кількість продукту елююється між 25% і 35%). Дві фракції збирали (чистий згідно ТСХ, 30% ЕtOАс/гептан). Розчинники обох фракцій випаровували, отримуючи 1,54 г небажаного регіоізомера і 0,638 г проміжного продукту 17. f) Отримання проміжного продукту 18 47 Розчин проміжного продукту 17 (0,0013 моль) і літійгідроксидмоногідрата (0,0062 моль) у ТГФ (20 мл), СН3ОН (5 мл) і воді (5 мл) перемішували при кімнатній температурі протягом 6 годин. Суміш гасили 1N розчином НСІ і осад збирали фільтрацією, промивали водою і CH3CN, і потім висушували, отримуючи 0,7 г проміжного продукту 18 у вигляді безбарвної твердої речовини. g) Отримання проміжного продукту 19 До розчину проміжного продукту 18 (0,00125 моль) у ДМФА (10 мл) додавали Nметилметанамінгідрохлорид (0,00250 моль), HOBt (0,00375 моль), EDCI (0,00375 моль) і DIPEA (0,00500 моль). Отриманий реакційний розчин перемішували при кімнатній температурі протягом 3 годин. Реакційну суміш гасили 1N розчином НСІ і екстрагували за допомогою ЕtOАс. Органічну фазу відокремлювали, промивали насиченим водним розчином МаНСО3 (2 рази) і сушили (Na2SO4), фільтрували і відфільтрований розчинник випаровували, отримуючи 0,550 г проміжного продукту 19 у вигляді безбарвного масла. Приклад А8 Отримання проміжного продукту 21 Суміш 4-хлор-6,7-дигідро-5Нциклопента[b]піридину (0,0520 моль), Pd(OAc) 2 (0,1 г), 1,3-біс(диф-фосфіно)пропана (0,4 г) і КОАс (10 г) у ТГФ (100 мл) і воді (20 мл) перемішували при тиску 50 атм. СО протягом 16 годин при температурі 150°С. Суміш випаровували і додавали воду. Осад фільтрували і висушували, отримуючи 9,20 г (вихід 100%) проміжного продукту 21. Приклад А9 Отримання проміжного продукту 22 95281 48 Суміш (0,036 моль) у ТГФ (300 мл) гідрували при кімнатній температурі при використанні 5%-го Pd/C і 0,5% V2O5 (4 г) у якості каталізатора, у присутності розчину тіофену (1 мл; 4%-й розчин у DIPE). Після поглинання водню (3 екв.), каталізатор фільтрували і фільтрат випаровували, отримуючи маслянистий залишок. Це масло кристалізували з 2-пропанолу. Осад фільтрували і висушували, отримуючи 8,0 г (вихід 60%) проміжного продукту 22. Приклад А10 Отримання проміжного продукту 23 Розчин сполуки 25 (0,0054 моль) в суміші CH3OH/NH3 (50 мл) гідрували при температурі 14°С при використанні нікеля Ренея (1/4 ложки) у якості каталізатора. Після поглинання водню (2 екв.), каталізатор фільтрували і фільтрат випаровували. Потім додавали воду. Суміш екстрагували за допомогою ЕtOАс. Відокремлений органічний шар сушили (MgSO4), фільтрували і розчинник випаровували, отримуючи 0,87 г проміжного продукту 23. Приклад А11 а) Отримання проміжного продукту 24 2-хлор-4-піридинкарбонілхлорид (0,16 ммоль) по краплях додавали до перемішуваної суміші амонієвої солі тіоціанової кислоти (0,175 моль) у 2пропаноні (250 мл) при кімнатній температурі і отриману суміш перемішували протягом 2 годин. Додавали 2,2-дифтор-1,3-бензодіоксол-5-амін (25 г, 0,145 моль) і реакційну суміш перемішували протягом ночі при кімнатній температурі. Потім суміш виливали на лід. Осад фільтрували і висушували, отримуючи проміжний продукт 24, який використовували як такий на наступній реакційній стадії. b) Отримання проміжного продукту 25 Взаємодію здійснювали у потоці азоту. 60%-й NaH (0,16 моль) перемішували в ТГФ (500 мл) на крижаній бані. Додавали проміжний продукт 24 (0,145 моль) і суміш перемішували протягом 2 го 49 дин при температурі 0°С. Додавали йодметан (0,16 моль) і реакційну суміш залишали взаємодіяти при кімнатній температурі. Реакційну суміш розкладали водою. Розчинник випаровували. До суміші додавали воду. Цю суміш екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили (MgSO4), фільтрували і розчинник випаровували. Залишок перемішували в DIPE. Осад фільтрували і висушували, отримуючи 30,4 г (вихід 54%) проміжного продукту 25. c) Отримання проміжного продукту 26 Проміжний продукт 25 (0,0036 моль) розчиняли в 2-метил-2-пропанолі (60 мл) і до розчину додавали 3-гідразино-N,N-диметилпропанамід (0,0072 моль). Реакційну суміш перемішували і кип'ятили із зворотним холодильником протягом 5 годин. Розчинник випаровували. Залишок спочатку очищали за допомогою колонкової флешхроматографії на силікагелі (система флешочистки Biotage; градієнт СН2СІ2/СН3OН = від 100/0 до 90/10). Бажані фракції збирали і розчинник випаровували. Залишок кристалізували з суміші CH2CI2/DIPE, отримуючи 0,69 г проміжного продукту 26. Приклад А12 а) Отримання проміжного продукту 27 Амонієву сіль тіоціанової кислоти (0,14 моль) перемішували в АсОН (180 мл) при кімнатній температурі. Додавали 2-хлор-4піридинкарбонілхлорид (0,11 моль) і суміш перемішували протягом 2 годин. Додавали 3,4,5трифторбензоламін (0,1 моль) і реакційну суміш перемішували протягом 1 години при кімнатній температурі. Потім суміш виливали на лід. Осад фільтрували і висушували, отримуючи 24,32 г (вихід 70%) проміжного продукту 27. b) Отримання проміжного продукту 28 60%-й NaH (0,075 моль) перемішували в ТГФ (500 мл) на крижаній бані, в атмосфері азоту. Додавали проміжний продукт 27 (0,07 моль) і потім суміш перемішували протягом 2 годин при температурі 0°С. Додавали йодметан (0,075 моль) і крижану баню відстоювали. Додавали воду і суміш 95281 50 випаровували. До залишку додавали воду і цю суміш екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили (MgSO4), фільтрували і розчинник випаровували. Залишок перемішували в Et2O. Осад фільтрували і висушували, отримуючи 17,51 г (вихід 70%) проміжного продукту 28. с) Отримання проміжного продукту 29 Суміш проміжного продукту 28 (0,0083 моль) (2S)-1-гідразино-2-пропанола (0,0167 моль) і 2метил-2-пропанолу (50 мл) перемішували і кип'ятили із зворотним холодильником протягом 2 годин. Потім розчинник випаровували і до залишку додавали воду. Суміш екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили (MgSO4), фільтрували і розчинник випаровували. Залишок кристалізували з СН2СІ2. Осад фільтрували і висушували, отримуючи 2,06 г (вихід 65%) проміжного продукту 29. Приклад А13 а) Отримання проміжного продукту 30 Суміш проміжного продукту 25 (0,0182 моль), гідрохлорида етилового ефіру 2-гідразинілоцтової кислоти (1:1) (0,0364 моль) і 2-метил-2-пропанолу (75 мл) в DIPEA (0,0364 моль) перемішували і кип'ятили із зворотним холодильником протягом 3 годин. Реакційну суміш охолоджували, осад фільтрували і висушували, отримуючи 2,98 г (вихід 37%) проміжного продукту 30. b) Отримання проміжного продукту 31 Суспензію проміжного продукту 30 (0,0159 моль) в етанаміні (2 Μ розчин у СН3ОН) (80 мл) нагрівали при температурі 70°С протягом 3 годин. Суміш спочатку ставала гомогенною і потім випадав осад. Цей осад збирали шляхом фільтрації, промивали етанолом і потім DIPE, і після цього 51 95281 52 висушували, отримуючи 4,94 г проміжного продукту 31. Приклад А14 а) Отримання проміжного продукту 32 2-метил-4-піридинкарбонілхлорид (0,1160 моль) розчиняли в 2-пропаноні (400 мл) при кімнатній температурі, додавали амонієву сіль тіоціанової кислоти (0,1300 моль). Реакційну суміш перемішували протягом 30 хвилин, потім повільно додавали 2,2-дифтор-1,3-бензодіоксол-5-амін (0,1160 моль) за допомогою краплинної воронки. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин, потім гасили водою (100 мл), екстрагували за допомогою СН2СІ2 (3 рази по 100 мл), об'єднану органічну фазу сушили (MgSO4), фільтрували і розчинник випаровували. Залишок очищали за допомогою колонкової флеш-хроматографії на силікагелі (градієнт: гептан/ЕtOАс = від 70/30 до 50/50). Фракції продукту збирали і розчинник випаровували, отримуючи 6,5 г проміжного продукту 32. b) Отримання проміжного продукту 33 Розчин 60% NaH у парафіні (0,018 моль) перемішували в ТГФ (100 мл) на крижаній бані, в атмосфері азоту. Додавали проміжний продукт 32 (0,0171 моль) і суміш перемішували протягом 1 години при температурі 0°С. Додавали йодметан (0,018 моль) і крижану баню відстоювали. Потім розчинник випаровували і до залишку додавали воду. Цю суміш екстрагували за допомогою СН2СІ2. Відокремлений органічний шар сушили (MgSO4), фільтрували і розчинник випаровували, отримуючи 4,5 г проміжного продукту 33, який використовували як такий у наступній взаємодії. c) Отримання проміжного продукту 34 Проміжний продукт 33 (0,0167 моль) розчиняли в 2-метил-2-пропанолі (150 мл). Потім додавали гідрохлорид етилового ефіру 2гідразинілоцтової кислоти (1:1) (0,0334 моль) і DIPEA (0,0334 моль). Реакційну суміш перемішували і кип'ятили із зворотним холодильником протягом 4 годин. Розчинник випаровували. Залишок використовували без подальшого очищення, отримуючи проміжний продукт 34. d) Отримання проміжного продукту 35 Суміш проміжного продукту 34 (0,0123 моль) і LiOH (0,01332 моль) у ТГФ (16 мл), СН3ОН (5 мл) і воді (5 мл) перемішували при кімнатній температурі протягом 1 години. Потім розчинники випаровували і залишок обробляли за допомогою 20 мл НСІ (1 N розчин). Осад фільтрували і висушували, отримуючи 0,940 г (вихід 100%) проміжного продукту 35. Приклад А15 Отримання проміжного продукту 36 Розчин сполуки 30 (0,0001 моль) в ТФОК (5 мл) струшували протягом ночі при температурі 40°С. Потім розчинник випаровували, отримуючи проміжний продукт 36 у вигляді солі ТФОК. В. Отримання сполук Приклад В1 Отримання сполуки 1 В ємність високого тиску вводили суміш сполуки 63 (0,000446 моль) в суміші CH3NH2/CH3OH (20 моль) і цю суміш перемішували протягом 16 годин при температурі 180°С. Розчинник випаровували. Залишок очищали за допомогою ВЕРХ за способом В. Бажані фракції продукту збирали і розчинник випаровували. До залишку додавали водний розчин Na2CO3 (1,5 мл) і СН2СІ2. Суміш фільтрували через фільтр Extrelute. Розчинник, що міститься у фільтраті, випаровували. Залишок висушували, отримуючи 0,096 г (вихід 50%) сполуки 1. Приклад В2 Отримання сполуки 2 Суміш проміжного продукту 5 (0,012 моль) і 2гідразиноетанолмоногідрохлорида (0,012 моль) в етанолі (100 мл) перемішували при температурі кипіння із зворотним холодильником протягом 2 годин. Потім розчинник випаровували і отриманий залишок очищали за допомогою ВЕРХ за способом А. Фракції продукту збирали і розчинник випа 53 95281 54 ровували. Залишок висушували, отримуючи 0,076 г сполуки 2. Приклад В3 Отримання сполуки 3 Суміш проміжного продукту 2 (0,0075 моль) і 2гідразиноетанолмоногідрохлорида (0,0075 моль) в етанолі (100 мл) перемішували при температурі кипіння із зворотним холодильником протягом 2 годин. Розчинник випаровували. Реакційну суміш кристалізували з СН3СN. Осад фільтрували і висушували, отримуючи 1,249 г (вихід 41%) сполуки 3. Приклад В4 Отримання сполуки 4 Суміш сполуки 65 (0,000242 моль), Nметилметанамінгідрохлорида (0,000242 моль) і HBTU (0,000363 моль) в DIPEA (0,0009687 моль) і СН2СІ2 (10 мл) перемішували протягом ночі при кімнатній температурі. Розчинник випаровували. Залишок очищали за допомогою ВЕРХ за способом А. Фракції продукту збирали і розчинник випаровували. Залишок висушували, отримуючи 0,003 г (вихід 3%) сполуки 4. Приклад В5 Отримання сполуки 5 У ємність високого тиску вводили суміш сполуки 63 (0,00089 моль) і 2-пропанаміна (1 г) в ТГФ (20 мл) і суміш нагрівали протягом 16 годин при температурі 175°С. Розчинник випаровували. Залишок очищали за допомогою ВЕРХ за способом А. Фракції продукту збирали і розчинник випаровували, отримуючи 0,084 г (вихід 20%) сполуки 5. Приклад В6 Отримання сполуки 6 Суміш сполуки 67 (0,00023 моль), Nметилметанамінгідрохлорида (0,00046 моль) і DIPEA (0,00092 моль) в ДМФА (5 мл) перемішували протягом 30 хвилин при кімнатній температурі. Додавали HBTU (0,00035 моль) і реакційну суміш перемішували протягом ночі при температурі 80°С. Розчинник випаровували. Залишок розподіляли між водним розчином Na2CO3 (1 мл) і СН2СІ2. Суміш зневоднювали при використанні Extrelute. Розчинник, що міститься у фільтраті, випаровували. Залишок очищали за допомогою ВЕРХ за способом А. Фракції продукту збирали і розчинник випаровували, отримуючи 0,062 г (вихід 58%) сполуки 6. Приклад В7 Отримання сполуки 7 Суміш проміжного продукту 11 (0,0094 моль) і 2-гідразиноетанолмоногідрохлорида (0,0112 моль) у 2-метил-2-пропанолі (60 мл) перемішували і кип'ятили із зворотним холодильником протягом 2 годин, потім залишали стояти протягом ночі при кімнатній температурі і отриманий осад фільтрували, промивали DIPE, потім висушували, отримуючи 2,31 г (вихід 64%) сполуки 7. Приклад В8 Отримання сполуки 8 Суміш проміжного продукту 12 (0,000552 моль), 5-метил-3-ізоксазолкарбонілхлорида (0,000552 моль) і Et3N (0,001104 моль) в СН2СІ2 (5 мл) перемішували протягом 1 години при кімнатній температурі. Розчинник випаровували. Потім до залишку додавали водний розчин Na2CO3 (1 мл) і СН2СІ2. Суміш фільтрували через фільтр Extrelute і розчинник, що міститься у фільтраті, випаровували. Залишок очищали за допомогою ВЕРХ за способом А. Фракції продукту збирали і розчинник випаровували. Залишок висушували, отримуючи 0,097 г (вихід 37%) сполуки 8. Нижче перераховані сполуки, які отримували відповідно до одного з вищезгаданих прикладів. 55 95281 56 57 95281 58 59 95281 60
ДивитисяДодаткова інформація
Назва патенту англійськоюTrisubstituted 1,2,4-triazoles
Автори англійськоюThuring Johannes Wilhelmus John F., Macdonald, Gregor, James, Lesage Anne Simone Josephine, Zhuang Wei, De Bruyn Marcel Frans Leopold, Van Den Keybus Frans Alfons Ma, Van Roosbroeck Yves Emiel Maria, Dinklo Theodorus, Duffy James Edward Stewart
Назва патенту російськоюТризамещенные 1,2,4-триазолы
Автори російськоюТюринг Йоханнес Вильгелмус Джон Ф., Макдональд Грегор Джеймс, Лесаж Анн Симон Жозефин, Жуанг Вей, де Брюйн Марсел Франс Леопольд, ван ден Кейбус Франс Альфонс Мария, ван Роосбрук Ив Эмиль Мария, Динкло Теодорус, Даффи Джеймс Эдвард Стюарт
МПК / Мітки
МПК: C07D 249/08, A61P 25/00, C07D 405/04, A61K 31/4196, C07D 401/04
Мітки: тризаміщені, 1,2,4-триазоли
Код посилання
<a href="https://ua.patents.su/73-95281-trizamishheni-124-triazoli.html" target="_blank" rel="follow" title="База патентів України">Тризаміщені 1,2,4-триазоли</a>
Попередній патент: Відсік інкубатора, який уможливлює курчатам доступ до корму в процесі виведення в інкубаторі без зниження виводжуваності або виживаності, та інкубатор
Наступний патент: Керування швидкістю передачі в багатоканальних системах зв’язку
Випадковий патент: Спосіб вимірювання опору розтіканню окремих взаємозв'язаних заземлювачів












