Гетероциклічні інгібітори мек та їх застосування
Номер патенту: 93678
Опубліковано: 10.03.2011
Автори: Сторі Річард Ентоні, Піттам Джон Девід, Ліссікатос Джозеф П., Воллес Ілай, Леонард Джон, Ян Гун Вун, Філдінґ Марк Річард, Сео Дзеонбеоб, Бус Ребекка Джейн, Блейк Джім, Марлоу Еллісон Л.
Формула / Реферат
1. Сполука, охоплюючи її таутомери, метаболіти, розділені енантіомери, діастереомери, сольвати та фармацевтично прийнятні солі, вказана сполука має формулу IV:
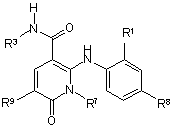 , IV
, IV
де:
R1 - Сl або F;
R3 - Н, метил, етил, ОН, МеО-, ЕtO-, НОСН2СН2О-, НОСН2С(Ме)2О-, (S)-МеСН(ОН)СН2О-, (R)-HOCH2CH(OH)CH2O-, циклопропіл-СН2О-, НОСН2СН2-,
![]() ,
, 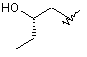 ,
, ![]() ,
, ![]() ,
, ![]() або
або ![]() ;
;
R7 - метил або етил, де вказані метил та етил є необов'язково заміщеними одним або більше атомами F;
R8 - Вr, І або SMe; та
R9 - Н, С1-С4алкіл, Сl або CN, де вказаний алкіл є необов'язково заміщеним одним або більше замісниками, незалежно вибраними з групи: F або CN,
за умови, що, коли
a) R1 - F, R8 - Br, R9 - Н та R7 - метил або етил, тоді R3 не може бути НОСН2СН2О;
b) R1 - F, R8 - І, R9 - Н та R3 - МеО, тоді R7 не може бути метилом;
c) R1 - F, R8 - метил, R9 - Н та R3 - НОСН2СН2О, тоді R7 не може бути метилом; та
d) R1 - F, R8 - Br, R9 - Н та R3 - циклопропіл-СН2O, тоді R7 не може бути метилом.
2. Сполука за п. 1, де R9 - Н, метил, етил, Сl або CN.
3. Сполука, що має формулу VI:
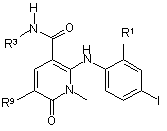 , VI
, VI
або її фармацевтично прийнятна сіль, де:
R1 - Сl або F;
R3 - Н, НОСН2СН2О або (S)-MeCH(OH)CH2O; та
R9 - Н, метил, F або Сl.
4. Сполука за п. 3, де R1 - F, R3 - НОСН2СН2О- та R9 - метил, або її фармацевтично прийнятна сіль.
5. Сполука за п. 3, де сполука є вибраною з групи:
2-(2-хлор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
(S)-2-(2-хлор-4-йодфеніламіно)-N-(2-гідроксипропокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
2-(2-флуор-4-йодфеніламіно)-1,5-диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
(S)-2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксипропокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
(S)-2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксипропокси)-1,5-диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
2-(2-хлор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
5-хлор-2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід;
(S)-2-(2-хлор-4-йодфеніламіно)-N-(2-гідроксипропокси)-1,5-диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід або
(S)-5-хлор-2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксипропокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід.
6. Сполука за п. 3, де сполука є вибраною з групи:
5-флуор-2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід та
(S)-5-флуор-2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксипропокси)-1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід.
7. Сполука за п. 3, де сполукою є 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід.
8. Кристалічна форма сполуки формули XI
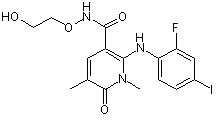 XI
XI
по суті у стані форми 2 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил-6-оксо-1,6-дигідропіридин-3-карбоксаміду.
9. Кристалічна форма сполуки формули XI за п. 8, яка відрізняється картиною рентгенівської дифракції, що має характеристичні піки приблизно при 9,5 та 12,6 на шкалі 2θ.
10. Кристалічна форма сполуки формули XI за п. 8, яка відрізняється картиною рентгенівської дифракції, що має характеристичні піки приблизно при 9,5, 12,6, 14,7 та 19,6 на шкалі 2θ.
11. Кристалічна форма сполуки формули XI за п. 8, яка відрізняється картиною рентгенівської дифракції, яка по суті є такою, як показана на Фіг. 10.
12. Кристалічна форма сполуки формули XI
 XI
XI
по суті у стані форми 1 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил-6-оксо-1,6-дигідропіридин-3-карбоксаміду.
13. Кристалічна форма сполуки формули XI за п. 12, яка відрізняється картиною рентгенівської дифракції, що має характеристичні піки приблизно при 9,2 та 13,0 на шкалі 2θ.
14. Кристалічна форма сполуки формули XI за п. 12, яка відрізняється картиною рентгенівської дифракції, що має характеристичні піки приблизно при 9,2, 13,0, 18,3, 21,0 та 21,7 на шкалі 2θ.
15. Кристалічна форма сполуки формули XI за п. 12, яка відрізняється картиною рентгенівської дифракції, яка по суті є такою, як показана на Фіг. 11.
16. Сполука за будь-яким з пп. 1, 3, 8, 12 для застосування як медикаменту.
17. Сполука за будь-яким з пп. 1, 3, 8, 12 для застосування як медикаменту для лікування гіперпроліферативного розладу або запального стану.
18. Застосування сполуки за будь-яким з пп. 1, 3, 8, 12 у виробництві медикаменту для лікування гіперпроліферативного розладу або запального стану.
19. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1, 3, 8, 12 в комбінації з фармацевтично прийнятним носієм.
Текст
1. Сполука, охоплюючи її таутомери, метаболіти, розділені енантіомери, діастереомери, сольвати та фармацевтично прийнятні солі, вказана сполука має формулу IV: H C2 2 (19) 1 3 93678 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)1-метил-6-оксо-1,6-дигідропіридин-3-карбоксамід; (S)-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід; (S)-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід; 2-(2-хлор-4-йодфеніламіно)-N-(2-гідроксіетокси)1,5-диметил-6-оксо-1,6-дигідропіридин-3карбоксамід; 5-хлор-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин3-карбоксамід; (S)-2-(2-хлор-4-йодфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід або (S)-5-хлор-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід. 6. Сполука за п. 3, де сполука є вибраною з групи: 5-флуор-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин3-карбоксамід та (S)-5-флуор-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід. 7. Сполука за п. 3, де сполукою є 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксамід. 8. Кристалічна форма сполуки формули XI H O N HO O F H N (XI) N I O по суті у стані форми 2 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. 9. Кристалічна форма сполуки формули XI за п. 8, яка відрізняється картиною рентгенівської диф Заявлений винахід стосується серії нових гетероциклічних сполук, котрі є корисними у лікуванні гіперпроліферативних хвороб, як-то рак та запалення, у ссавців. Цей винахід також стосується способу застосування таких сполук у лікуванні гіперпроліферативних хвороб у ссавців, особливо людей, та фармацевтичних композицій, що містять такі сполуки. Передача сигналу у клітинах через рецептори фактору росту та білкові кінази є важливим регулятором росту, проліферації та диференціації клітин. При нормальному рості клітин, фактори росту за допомогою активації рецепторів (тобто PDGF або EGF та інших), активують шляхи метаболізму МАР-кінази. Одним найбільш важливих та най 4 ракції, що має характеристичні піки приблизно при 9,5 та 12,6 на шкалі 2θ. 10. Кристалічна форма сполуки формули XI за п. 8, яка відрізняється картиною рентгенівської дифракції, що має характеристичні піки приблизно при 9,5, 12,6, 14,7 та 19,6 на шкалі 2θ. 11. Кристалічна форма сполуки формули XI за п. 8, яка відрізняється картиною рентгенівської дифракції, яка по суті є такою, як показана на Фіг. 10. 12. Кристалічна форма сполуки формули XI H O N HO O F H N (XI) N I O по суті у стані форми 1 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. 13. Кристалічна форма сполуки формули XI за п. 12, яка відрізняється картиною рентгенівської дифракції, що має характеристичні піки приблизно при 9,2 та 13,0 на шкалі 2θ. 14. Кристалічна форма сполуки формули XI за п. 12, яка відрізняється картиною рентгенівської дифракції, що має характеристичні піки приблизно при 9,2, 13,0, 18,3, 21,0 та 21,7 на шкалі 2θ. 15. Кристалічна форма сполуки формули XI за п. 12, яка відрізняється картиною рентгенівської дифракції, яка по суті є такою, як показана на Фіг. 11. 16. Сполука за будь-яким з пп. 1, 3, 8, 12 для застосування як медикаменту. 17. Сполука за будь-яким з пп. 1, 3, 8, 12 для застосування як медикаменту для лікування гіперпроліферативного розладу або запального стану. 18. Застосування сполуки за будь-яким з пп. 1, 3, 8, 12 у виробництві медикаменту для лікування гіперпроліферативного розладу або запального стану. 19. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1, 3, 8, 12 в комбінації з фармацевтично прийнятним носієм. більш добре зрозумілих шляхів метаболізму МАРкінази, що приймають участь у нормальному та неконтрольованому рості клітин є шляхи метаболізму Ras/Raf-кінази. Активна GTP-зв'язана Rasкіназа призводить до активації та непрямого фосфорилування Raf-кінази. Raf-кіназа тоді фосфорилує МЕК1 та 2 на двох серинових залишках (S218 та S222 для МЕК1 та S222 та S226 для МЕК2) (Ahn et al., Methods in Enzymology, 2001, 332, 417431). Активована МЕК тоді фосфорилує тільки свої відомі субстрати, МАР-кінази, ERК1 та 2. Фосфорилування ERК за допомогою МЕК відбувається на Y204 та Т202 для ERК1 та Y185 та Т183 для ERК2 (Ahn et al., Methods in Enzymology, 2001, 332, 417-431). Фосфорилована ERК димеризується та 5 тоді переміщується до ядра, де вона накопичується (Khokhlatchev et al., Cell, 1998, 93, 605-615). В ядрі ERК приймає участь у кількох важливих клітинних функціях, охоплюючи, але без обмеження, ядерний транспорт, трансдукцію сигналу, репарацію ДНК, комплектування та транслокація нуклеосом, та процесинг та трансляція мРНК (Ahn et al., Molecular Cell, 2000, 6, 1343-1354). Взагалі, обробка клітин факторами росту призводить до активації ERК1 та 2, котра призводить до проліферації, а у деяких випадках, диференціації (Lewis et al., Adv. Cancer Res., 1998, 74, 49-139). У проліферативних хворобах генетичні мутації та/або надекспресія рецепторів фактору росту, униз по ходу передачі сигналу білків, або білкових кіназ, що приймають участь у шляху метаболізму ERК-кінази, призводять до нерегульованої проліферації клітин та, кінець кінцем, пухлин утворення. Наприклад, деякі типи раку мають мутації, котрі призводять до безперервної активації цього шляху метаболізму внаслідок безперервного продукування факторів росту. Інші мутації можуть призводити до дефектів у дезактивації активованого GTP-зв'язаного Ras-комплексу, знов утвореного при активації шляху метаболізму МАР-кінази. Мутовані онкоангіогенні форми Ras-кінази знайдені у 50% типів раку ободової кишки та >90% підшлункової залози, а також багатьох інших типи типів раку (Kohl et al., Science, 1993, 260, 1834-1837). Нещодавно, ідентифіковано мутації bRaf у більше, ніж 60% злоякісної меланом (Davies, Η. et al., Nature, 2002, 417, 949-954). Ці мутації у bRaf призводять до конститутивно активного каскаду МАРкінази. Дослідження зразків первинних пухлин та ліній клітин також показали конститутивність або надактивацію шляху метаболізму МАР-кінази у типів раку підшлункової залози, ободової кишки, легень, яєчнику та нирок (Hoshino, R. et al., Oncogene, 1999, 18, 813-822). Звідси, існує сильна кореляція між типами раку та надактивним шляхом метаболізму МАР-кінази, утвореним від генетичних мутацій. Оскільки конститутивний або надактиваційний каскад МАР-кінази грає кардинальну роль у проліферації та диференціації клітин, інгібування цього шляху метаболізму, можна вважати, буде корисним при гіперпроліферативних хворобах. МЕК є ключовим гравцем у цьому шляху метаболізму, оскільки вона знаходиться униз по ходу стосовно Ras та Raf. Додатково, вона є привабливої терапевтичною метою внаслідок того, що відомими субстратами для фосфорилування МЕК є тільки МАР-кінази, ERК1 та 2. Інгібування МЕК, як пока 7 R - циклопропіл-СН2- або С1-С4 алкіл, де вказаний алкіл є необов'язково заміщеним одним або більше атомами F; R8 - Br, І або SMe; та R9 - СН3, CH2F, CHF2, CF3, F або СІ. 93678 6 зано у кількох дослідженнях, має потенційну терапевтичну корисність. Наприклад, інгібітори невеликої молекулярної маси МЕК показані для інгібування росту пухлин людини у ксенотрансплантатах голих мишей, (Sebolt-Leopold et al., NatureMedicine, 1999, 5 (7), 810-816; Trachet et al., AACR 6-10, 04 2002, Poster #5426; Tecle, H., IBC 2nd International Conference of Protein Kinases, September 9-10, 2002), блокування статичної алодинії у тварин (WO 01/05390) та інгібування росту клітин при гострій мієлоїдній лейкемії (Milella et al., J. Clin. Invest., 2001, 108(6), 851-859). Інгібітори МЕК невеликої молекулярної маси є розкритими, їх охоплюють патентні публікації США №№ 2003/0232869, 2004/0116710, та 2003/0216460, та заявки на патент США № 10/654,580 та 10/929,295, кожну з котрих уведено тут як посилання. Принаймні п'ятнадцять додаткових патентних заявках з'явилися у останні кілька років. Дивись, наприклад,: патент США № 5,525,625; WO 98/43960; WO 99/01421; WO 99/01426; WO 00/41505; WO 00/42002; WO 00/42003; WO 00/41994; WO 00/42022; WO 00/42029; WO 00/68201; WO 01/68619; WO 02/06213; WO 03/077914; та WO 03/077855. Цей винахід стосується нових гетероциклічних сполук, та їх фармацевтично прийнятних солей та проліків, котрі є корисними у лікуванні гіперпроліферативних хвороб. Виявлено, що сполуки 6-оксо1,6-дигідропіридазину та 6-оксо-1,6дигідропіридину, що мають певні замісники, які описано тут, є потужними інгібіторами ферменту МЕК. Більш конкретно, згідно з одним аспектом заявлений винахід стосується сполук, охоплюючи їх таутомери, метаболіти, розділені енантіомери, діастереоізомери, сольвати, та фармацевтично прийнятні солі, вказані сполуки мають формулу І: де: R1 - СІ або F; R3 - Н, метил, етил, ОН, МеО-, ЕtO-, НОСН2СН2О-, НОСН2С(Ме)2О-, (S)МеСН(ОН)СН2О-, (R)-HOCH2CH(OH)CH2O-, циклопропіл-СН2О-, НОСН2СН2-, Згідно з ще одним аспектом заявлений винахід стосується сполук, охоплюючи їх таутомери, метаболіти, розділені енантіомери, діастереоізомери, сольвати, та фармацевтично прийнятні солі, вказані сполуки мають формулу IV: 7 93678 8 де: R1 - СІ або F; R3 - Н, метил, етил, ОН, МеО-, EtO-, НОСН2СН2О-, НОСН2С(Ме)2О-, (S)МеСН(ОН)СН2О-, (R)-HOCH2CH(OH)CH2O-, циклопропіл-СН2О-, НОСН2СН2-, R7 - метил або етил, де вказані метил та етил є необов'язково заміщеними одним або більше атомами F; R8 - Br, І або SMe; та R9 - Н, С1-С4 алкіл, СІ або CN, де вказаний алкіл є необов'язково заміщеним одним або більше замісниками, незалежно вибраними з групи: F або CN, за умови, що: 1 8 9 3 a) коли R - F, R - Br, R - Н, та R 7 НОСН2СН2О, тоді R не може бути метилом або етилом; b) коли R1 - F, R8 є І, R9 - Н, та R3 - МеО, тоді R7 не може бути метилом; c) коли R1 - F, R8 - метил, R9 - Н, та R3 НОСН2СН2О, тоді R7 не може бути метилом та d) коли R1 - F, R8 - Br, R9 - Н, та R3 - циклопропіл-СН2О, тоді R7 не може бути метилом. У наступному аспекті заявлений винахід стосується двох кристалічних форм сполуки формули XI де дві кристалічні форм позначені, як Форма 1, 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)1,5-диметил-6-оксо-1,6-дигідропіридин-3карбоксаміду та Форма 2, 2-(2-флуор-4йодфеніламіно)-М-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. Також запропонованими є способи отримання Форми 1 та Форми 2 сполуки формули XI. У наступному аспекті заявлений винахід стосується композицій, що інгібують МЕК, які містять одну або більше сполук заявленого винаходу. Винахід також стосується способів одержання сполуки заявленого винаходу. У наступному аспекті заявлений винахід стосується способу застосування сполуки цього винаходу як медикаменті для лікування хвороби або медичного стану, опосередкованого МЕК. Наприклад, цей винахід стосується сполуки цього винаходу як медикаменту для лікування гіперпроліферативного розладу або запального стану у ссавця, що полягає у призначенні вказаному ссавцю одної або більше сполуки заявленого винаходу або її фармацевтично прийнятної солі або проліків у кількості, ефективній для лікування вказаного гіперпроліферативного розладу. У ще одному аспекті цей винахід стосується сполуки цього винаходу у виробництві медикаменту для лікування гіперпроліферативного розладу або запального стану. У наступному аспекті заявлений винахід стосується способу продукування МЕК-інгібіторної дії у теплокровної тварини, як-то людини, яка має необхідність у такому лікуванні, котрий полягає у призначенні вказаній тварині ефективної кількості сполуки цього винаходу. У наступному аспекті заявлений винахід стосується лікування або попередження МЕКопосередкованого стану, що полягає у призначенні людині або тварині, яка має необхідність у цьому, фармацевтичної композиції, що містить сполуку заявленого винаходу або її фармацевтично прийнятну сіль або in vivo здатні до розщеплення проліки у кількості, ефективній для лікування або попередження вказаного МЕК-опосередкованого стану. Патентоздатні сполуки можна також застосовувати переважно у комбінації з іншими відомими терапевтичними засобами. Винахід також стосується фармацевтичних композицій, що інгібують МЕК, що містить ефективну кількість сполуки, вибраної згідно із заявленим винаходом, або її фармацевтично прийнятних проліків, фармацевтично активних метаболітів, або фармацевтично прийнятних солей, вибраних згідно із заявленим винаходом. Додатковим аспектом винаходу є застосування заявленого винаходу в отриманні медикаменту для лікування або попередження хвороби або медичного стану, опосередкованих МЕК у теплокровної тварини, переважно ссавця, більш переважно людини, яка потерпає від такого розладу. Більш конкретно, винахід стосується застосування сполуки винаходу в отриманні медикаменту для лікування або попередження гіперпроліферативного розладу або запального стану у ссавця. Додаткові переваги та нові особливості цього винаходу будуть представленими частково в описі, що нижченаведено, та частково повинні стати зрозумілими спеціалістам з наступного опису або можуть бути зрозумілими при виконанні винаходу на практиці. Переваги винаходу можуть бути реалізованими та досягнутими за допомогою інструментарію, комбінацій, композицій та способів, особливо представлених у доданій формулі винаходу. 9 Додані фігури, котрі є уведеними тут, та утворюють частину опису, ілюструють необмежувальні втілення заявленого винаходу, та разом з описом пояснюють основи винаходу. На фігурах: Фіг.1 показує схему реакцій для синтезу сполуки формули 96. Фіг.2 показує схему реакцій для синтезу сполук 96, 100, 101 та 102. Фіг.3 показує схему реакцій для синтезу сполук 109, 110 та 111. Фіг.4 показує альтернативну схему реакцій для синтезу сполук 109, 110 та 111. Фіг.5 показує схему реакцій для синтезу сполук 119, 120 та 121. Фіг.6 показує схему реакцій для синтезу сполук 124 та 125. Фіг.7 показує схему реакцій для синтезу сполук 128, 129 та 130. Фіг.8 показує схему реакцій для синтезу сполук 145 та 146. Фіг.9 показує альтернативну схему реакцій для синтезу сполуки формули 145. Фіг.10 показує картину рентгенівської дифракції від порошку для форми 2, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміди отриманого згідно з прикладом 16А, етап 3. Фіг.11 показує картину рентгенівської дифракції від порошку для форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду, отриманого згідно з прикладом 16А, етап 4. Фіг.12 показує картину рентгенівської дифракції від порошку для форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду, отриманого згідно з прикладом 16В. Фіг.13 показує картину рентгенівської дифракції від порошку для форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил R7 - циклопропіл-СН2- або С1-С4 алкіл, де вказаний алкіл є необов'язково заміщеним одним або більше атомами F; R8 - Br, І або SMe; та R9 - СН3, CH2F, CHF2, CF3, F або СІ. В одному втіленні винахід стосується сполук, охоплюючи їх таутомери, метаболіти, розділені енантіомери, діастереоізомери, сольвати, та фармацевтично прийнятні солі, що мають формулу ІА: 93678 10 6-оксо-1,6-дигідропіридин-3-карбоксаміду, отриманого згідно з прикладом 16D. Фіг.14 показує термограму диференційної сканувальної калориметрії для форми 2, 2-(2-флуор4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3карбоксаміду. Фіг.15 показує термограму диференційної сканувальної калориметрії для форми 1, 2-(2-флуор4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3карбоксаміду. Патентоздатні сполуки заявленого винаходу та їх таутомери, метаболіти, розділені енантіомери, діастереоізомери, сольвати та фармацевтично прийнятні солі та проліки є корисними у лікуванні гіперпроліферативних хвороб. Загалом, згідно з ще одним аспектом заявлений винахід стосується сполуки заявленого винаходу, що діє як МЕКінгібітори. Більш конкретно, згідно з одним аспектом заявлений винахід стосується сполук, охоплюючи їх таутомери, метаболіти, розділені енантіомери, діастереоізомери, сольвати, та фармацевтично прийнятні солі, вказані сполуки мають формулу І: де: R1 - СІ або F; R3 - Н, метил, етил, ОН, МеО-, EtO-, НОСН2СН2О-, НОСН2С(Ме)2О-, (S)МеСН(ОН)СН2О-, (R)-HOCH2CH(OH)CH2O-, циклопропіл-СН2О-, НОСН2СН2-, де: R1 - СІ або F, R3- Η, метил, ОН, МеО, EtO, НОСН2СН2О, МеОСН2СН2О, НОСН2СН2СН2, 11 R7 - циклопропіл-СН2- або С1-С4 алкіл, де вказаний алкіл є необов'язково заміщеним одним або більше атомами F; R8 - Br, І або SMe; та R9 - СН3, CH2F, CHF2, CF3, F або СІ. В одному втіленні у сполуках формул І або ІА, R7 - циклопропіл-СН2- або метил. У ще одному втіленні R9 - СН3, F або СІ. У ще одному втіленні запропоновано сполуку формули II або її фармацевтично прийнятну сіль, де: R3 - H, МеО, НОСН2СН2О, МеОСН2СН2О, НОСН2СН2СН2, R9 - H, СН3, F або СІ. Сполуки формули II, що мають метальний замісник у N1-положенні та специфічні групи R3 та R9, є потужними МЕК-інгібіторами. Конкретні нові сполуки винаходу охоплюють будь-яку одну з групи: 4-(2-флуор-4-(метилтіо)феніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-(метилтіо)феніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; N-(циклопропілметокси)-4-(2-флуор-4(метилтіо)феніламіно)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-(метилтіо)феніламіно)-N-(2метоксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; R8 - Br aбo І; та R9 - СН3, F, СІ або Br. 93678 12 4-(2-флуор-4-(метилтіо)феніламіно)-Nметокси-1,5-диметил-6-оксо-1,6-дигідропіридазин3-карбоксамід; (S)-4-(2-флуор-4-(метилтіо)феніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-(метилтіо)феніламіно)-1,5диметил-6-оксо-1,6-дигідропіридазин-3карбоксамід; 5-флуор-4-(2-флуор-4-(метилтіо)феніламіно)N-(2-гідроксіетокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (S)-5-флуор-4-(2-флуор-4(метилтіо)феніламіно)-N-(2-гідроксипропокси)-1метил-6-оксо-1,6-дигідропіридазин-3-карбоксамід; 5-хлор-4-(2-флуор-4-(метилтіо)феніламіно)-N(2-гідроксіетокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (S)-5-хлор-4-(2-флуор-4(метилтiо)феніламiно)-N-(2-гідроксипропокси)-1метил-6-оксо-1,6-дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-(метилтiо)феніламіно)-N-(3гідроксипропіл)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; та (S)-N-(2,3-дигідроксипропіл)-4-(2-флуор-4(метилтіо)феніламіно)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід. У ще одному втіленні запропоновано сполуку формули III: або її фармацевтично прийнятну сіль, де: R1 - СІ або F; R3 Η, метил, МеО, НОСН2СН2О, НОСН2СН2СН2, НОСН2СН2, Сполуки формули III, що мають метальний замісник у N1-положенні та специфічні групи R1, R3R8 та R9, є потужними МЕК-інгібіторами. 13 93678 14 Конкретні нові сполуки винаходу охоплюють будь-яку одну з групи: 5-бром-4-(4-бром-2-флуорфеніламіно)-N(циклопропілметокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (R)-N-(2,3-Дигідроксипропокси)-4-(2-флуор-4йодфеніламіно)-1,5-диметал-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-йодфеніламіно)-N-метокси-1,5диметил-6-оксо-1,6-дигідропіридазин-3карбоксамід; N-(циклопропілметокси)-4-(2-флуор-4йодфеніламіно)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (S)-4-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-хлор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (S)-4-(2-хлор-4-йодфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(4-бром-2-хлорфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (S)-4-(4-бром-2-хлорфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(4-бром-2-флуорфеніламіно)-1,5-диметил-6оксо-1,6-дигідропіридазин-3-карбоксамід; (R)-4-(4-бром-2-флуорфеніламіно)-N-(2,3дигідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(4-бром-2-флуорфеніламіно)-N-(1-гідрокси-2метилпропан-2-ілокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-йодфеніламіно)-1,5-диметил-6оксо-1,6-дигідропіридазин-3-карбоксамід; 4-(4-бром-2-флуорфеніламіно)-5-флуор-N-(2гідроксіетокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-йодфеніламіно)-N,1,5-триметил6-оксо-1,6-дигідропіридазин-3-карбоксамід; N-(циклопропілметил)-4-(2-флуор-4йодфеніламіно)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-йодфеніламіно)-N-(3гідроксипропіл)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 5-флуор-4-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 4-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетил)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; N-(2,3-дигідроксипропіл)-4-(2-флуор-4йодфеніламіно)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 5-хлор-4-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (S)-5-хлор-4-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; 5-хлор-4-(2-флуор-4-йодфеніламіно)-1-метил6-оксо-1,6-дигідропіридазин-3-карбоксамід; 5-хлор-N-(2,3-дигідроксипропіл)-4-(2-флуор-4йодфеніламіно)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід; (S)-N-(2,3-дигідроксипропіл)-4-(2-флуор-4йодфеніламіно)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; та (S)-5-хлор-N-(2,3-дигідроксипропіл)-4-(2флуор-4-йодфеніламіно)-1-метил-6-оксо-1,6дигідропіридазин-3-карбоксамід. Конкретні нові сполуки винаходу також охоплюють нижченаведені сполуки: 4-(4-бром-2-флуорфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід; та (S)-4-(4-бром-2-флуорфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридазин-3-карбоксамід. Згідно з ще одним аспектом заявлений винахід стосується сполук, охоплюючи їх таутомери, метаболіти, розділені енантіомери, діастереоізомери, сольвати, та фармацевтично прийнятні солі, вказані сполуки мають формулу IV: R7 - метил або етил, де вказані метил та етил є необов'язково заміщеними одним або більше атомами F; R8 - Br, І або SMe; та R9 - Н, С1-С4 алкіл, СІ або CN, де вказаний алкіл є необов'язково заміщеним одним або більше замісниками, незалежно вибраними з групи: F або CN, за умови, що, коли: де: R1 - СІ або F; R3 - Н, метил, етил, ОН, МеО-, EtO-, НОСН2СН2О-, НОСН2С(Ме)2О-, (S)МеСН(ОН)СН2О-, (R)-HOCH2CH(OH)CH2O-, циклопропіл-СН2O-, НOСН2СН2-, 15 a) R1 - F, R8 - Br, R9 - Н, та R7 - метил або етил, тоді R3 не може бути НОСН2СН2О; b) R1 - F, R8 є І, R9 - Н, та R3 - МеО, тоді R7 не може бути метилом; 1 8 9 3 c) R - F, R - метил, R - Н, та R 7 НОСН2СН2О, тоді R не може бути метилом: та d) R1 - F, R8 - Br, R9 - H, та R3 - циклопропілСН2O, тоді R7 не може бути метилом. В одному втіленні у сполуках формул IV, R9 - Н, метил, етил, СІ або CN. В одному втіленні сполуки згідно з винаходом мають формулу V: або її фармацевтично прийнятну сіль, де: R3 НОСН2СН2О або (S)-MeCH(OH)CH2O; та R9-H, СН3, F або СІ, за умови, що, коли R1 - F, R8 - SMe, R9 - СІ, та 7 R - метил, тоді R3 не може бути НОСН2СН2О. Сполуки формули V, де R3 - НОСН2СН2О або (S)-MeCH(OH)CH2O, є потужними МЕКінгібіторами. Конкретні нові сполуки винаходу охоплюють будь-яку одну з групи: 2-(2-флуор-4-(метилтіо)феніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин3-карбоксамід; (S)-2-(2-флуор-4-(метилтіо)феніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід; 2-(2-флуор-4-(метилтіо)феніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід; (S)-2-(2-флуор-4-(метилтіо)феніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід; 5-флуор-2-(2-флуор-4-(метилтіо)феніламіно)N-(2-гідроксіетокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід; (S)-5-флуор-2-(2-флуор-4(метилтіо)феніламіно)-N-(2-гідроксипропокси)-1метил-6-оксо-1,6-дигідропіридин-3-карбоксамід; та (S)-5-хлор-2-(2-флуор-4(метилтіо)феніламіно)-N-(2-гідроксипропокси)-1метил-6-оксо-1,6-дигідропіридин-3-карбоксамід. В одному втіленні сполуки згідно з винаходом мають формулу VI: 93678 16 або її фармацевтично прийнятну сіль, де: R1 СІ або F; R3- Н, НОСН2СН2О або (S)-MeCH(OH)CH2O; та 9 R - Н, метил, F або СІ. Сполуки формули VI, де R1 - СІ, R3 НОСН2СН2О або (S)-MeCH(OH)CH2O, та R9 -Н, є потужними МЕК-інгібіторами. Сполуки формули VI, де R1 - F, R3 - Η та R9 метил, є потужними МЕК-інгібіторами. Сполуки формули VI, де R3 - НОСН2СН2О, або (S)-MeCH(OH)CH2O, є потужними МЕКінгібіторами. Сполука формули VI, де R1 - F, R3 НОСН2СН2О, та R9 - метил, є потужним МЕКінгібітором та також має гарну розчинність. Як застосовувано тут, термін "гарна розчинність" стосується сполуки, що має розчинність більше 50 мкг/мл, наприклад, розчинність приблизно від 50 до 270 мкг/мл, як визначено способом прикладу С. Конкретні нові сполуки формули VI згідно з винаходом охоплюють будь-яку одну з групи: 2-(2-хлор-4-йодфеніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин3-карбоксамід; (S)-2-(2-хлор-4-йодфеніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід; 2-(2-флуор-4-йодфеніламіно)-1,5-диметил-6оксо-1,6-дигідропіридин-3-карбоксамід; 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин3-карбоксамід; (S)-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід; (S)-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід; 2-(2-хлор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід; 5-хлор-2-(2-флуор-4-йодфенiламіно)-N-(2гідроксiетокси)-1-метил-6-оксо-1,6-дигідропіридин3-карбоксамід; (S)-2-(2-хлор-4-йодфеніламіно)-N-(2гідроксипропокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід; (S)-5-хлор-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід; 5-флуор-2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1-метил-6-оксо-1,6-дигідропіридин3-карбоксамід; та (S)-5-флуор-2-(2-флуор-4-йодфеніламіно)-N(2-гідроксипропокси)-1-метил-6-оксо-1,6дигідропіридин-3-карбоксамід. У ще одному втіленні запропоновано сполуку формули VI, де R1 - F, R3 -НОСН2СН2О та R9 - метил, або її фармацевтично прийнятну сіль. Було знайдено, що сполука формули XI 17 93678 18 Таблиця А Два-тета може існувати у двох кристалічних формах, позначених далі як Форма 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксамід та Форма 2, 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід та, що Форму 2 можна перетворювати у Форму 1. Зразки конкретної кристалічної форми сполуки формули XI були проаналізованими, застосовуючи комбінацію аналізу рентгенівською дифракцією від порошку та аналізу диференційною сканувальною калориметрією (ДСК), як описано у прикладах 16Е та 16F. Там, де встановлено, що заявлений винахід стосується кристалічної форми сполуки формули XI, ступінь кристалічності, як визначено за допомогою даних рентгенівської дифракції від порошку є придатно більше приблизно 60%, більш придатно більше приблизно 80%, переважно більше приблизно 90% та більш переважно більше приблизно 95%. Згідно з наступним аспектом винаходу запропоновано кристалічну форму сполуки формули XI по суті у стані форми 2, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. Згідно з наступним аспектом винаходу запропоновано кристалічну форму сполуки формули XI по суті у стані форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. Сполука формули XI у стані форми 2, 2-(2флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції, що має характеризувальні піки на шкалі 2-тета () приблизно при 9,5 та 12,6 Згідно з наступним аспектом винаходу запропоновано сполуку формули XI у стані форми 2, 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції, що має характеризувальні піки на шкалі 2-тета () приблизно при 9,5, 12,6 14,7 та 19,6. Форма 2, 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції, яку по суті показано на Фіг.10 тут далі, що має характеризувальні піки [на шкалі 2-тета ()] приблизно при положеннях, показаних у таблиці А. 9,54 10,24 12,62 13,86 14,67 15,65 16,62 17,15 17,36 17,54 17,86 18,72 19,00 19,63 20,04 20,47 22,02 22,40 22,97 23,54 Відносна інтеВідносна інтеДва-тета нсивність нсивність ДС 23,78 ДС С 24,54 С ДС 25,13 ДС С 25,60 С ДС 27,95 С С 28,72 ДС С 29,19 С С 29,67 С С 30,40 С С 30,65 ДС ДС 31,44 С С 31,75 ДС С 32,39 С ДС 33,48 С С 33,77 ДС ДС 34,94 С ДС 36,20 С С 38,70 С ДС 39,62 Π ДС Сполука формули XI у стані форми 1, 2-(2флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції, що має характеризувальні піки на шкалі 2-тета () приблизно при 9,2 та 13,0. Згідно з наступним аспектом винаходу запропоновано сполуку формули XI у стані форми 1, 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції, що має характеризувальні піки на шкалі 2-тета () приблизно при 9,2, 13,0, 18,3, 21,0 та 21,7. Форма 1, 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції по суті таку, як показано тут далі на Фіг.11 або 12, що має характеризувальні піки [на шкалі 2-тета ()] приблизно при положеннях, показаних у таблиці В. 19 93678 Таблиця В Два-тета 2,29 2,44 9,24 10,25 13,01 14,85 17,17 17,70 18,30 19,47 20,35 20,98 21,69 22,14 23,02 23,70 24,15 25,15 25,58 Відносна інтеДва-тета нсивність Π 25,86 Π 26,32 С 27,08 С 27,49 С 28,17 Π 28,61 Π 29,20 Π 30,65 С 32,15 Π 32,61 ДC 34,26 Π 34,90 С 35,51 Π 35,94 Π 36,74 Π 37,71 С 38,20 С 38,71 Π 39,78 Відносна інтенсивність Π Π Π Π С С Π С Π Π Π Π Π Π Π Π Π С Π Як згадано вище, інтенсивності піків у рентгенівській дифрактограмі від порошку можуть виявляти деяку непостійність, залежно від застосовуваних умов виміру. Відповідно, у Таблицях А та В та, на які будуть посилання тут далі, відносні інтенсивності не є встановленими чисельно. Правильніше, застосовувані наступні визначення для інтенсивності: % Відносна інтенсивність 25-100 10-25 3-10 1-3 Визначення ДС (дуже сильно) С (сильно) Π (помірно) Сл (слабко) де відносні інтенсивності є похідними від картини рентгенівської дифракції, виміряної з перемінними щілинами. Фіг.13 показує картину рентгенівської дифракції від порошку для форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду, отриманого згідно з прикладом 16D. Як треба розуміти, деякі з більш другорядних піків, присутніх у картинах рентгенівської дифракції на Фіг. від 10 до 13 видалено з Таблиць А та В. Сполука формули Х1 у стані форми 2, 2-(2флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції по суті таку, як показано на Фіг.10. Сполука формули Х1 у стані форми 1, 2-(2флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід, має картину рентгенівської дифракції по суті таку, як показано на Фіг.11 або 12. У попередніх розділах визначення піків рентгенівської дифрактограми від порошку для криста 20 лічної форми 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксаміду, термін "при приблизно" застосовувано у експресі "...на шкалі 2-тета () при приблизно.." свідчить, що точне положення піків (тобто перелічені значення кутів два-тета) не слід сприймати як абсолютні значення внаслідок того, як треба розуміти спеціалістам, що точне положення піків може слабко варіювати від одної апаратури до іншої, від одного зразку до іншого, або у результаті слабких варіацій в використовуваних умовах виміру. Також встановлено у попередніх розділах, що кристалічна форма 2-(2флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3-карбоксаміду дає картини рентгенівської дифракції від порошку "по суті" такі ж, як картини рентгенівської дифракції від порошку, як показані на Фіг. від 10 до 13, та мають по суті найбільш визначувані піки (значення кутів два-тета), показані у таблицях А та В, відповідно. Потрібно розуміти, що застосування терміну "по суті" у цьому контекст задумано також для позначення, що значення кутів два-тета картин рентгенівської дифракції від порошку можуть слабко варіювати від одної апаратури до іншої, від одного зразку до іншого, або у результаті слабких варіацій в використовуваних умовах виміру, такі положення піків, показані на Фіг. або представлені у таблицях А та В, знов не слід сприймати як абсолютні значення. Способи отримання сполук формули XI у будьякій з Форм 1 або 2 є тут розкритими. В одному аспекті запропоновано отримання спосіб сполуки формули XI по суті у стані форми 1, 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксiетокси)1,5-диметил-6-оксо-1,6-дигідропіридин-3карбоксаміду, котра містить: a) контактування 2-(2-флуор-4йодфеніламіно)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбонової кислоти (2вінілоксіетокси)-аміду з кислотною сумішшю протягом часу, достатнього для перетворення сполуки у 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)1,5-диметил-6-оксо-1,6-дигідропіридин-3карбоксамід; b) дозволяння матеріалу з етапу а) кристалізуватися з органічного розчиннику, що містить кристали затравки форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду; та c) виділення форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. В одному аспекті кислотна суміш на етапі а) може бути сумішшю неорганічних або органічних кислот. У ще одному аспекті етап а) може бути проведеним у двохфазній системі розчинників водна кислота-етилацетат. В одному аспекті органічним розчинником на етапі b) є етилацетат. У ще одному аспекті запропоновано отримання сполуки формули XI по суті у стані форми 1, 2(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)1,5-диметил-6-оксо-1,6-дигідропіридин-3карбоксаміду, котра містить: 21 a) перемішування форми 2, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду із невеликою кількістю форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропiридин-3-карбоксаміду в органічному розчиннику; та b) виділення форми 1, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. В одному аспекті кількість матеріалу форми 1, застосовуваного на етапі а) є приблизно 5% за масою. У ще одному аспекті етап а) є проведеним в етилацетаті при температурi слабко вище температури довкілля, як-то приблизно від 50 до 60°С. У ще одному аспекті винахід стосується способу отримання сполуки формули Х1 по суті у стані форми 2, 2-(2-флуор-4-йодфеніламіно)-N-(2гідроксіетокси)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбоксаміду за пунктом 1, котра містить: a) контактування 2-(2-флуор-4йодфеніламіно)-1,5-диметил-6-оксо-1,6дигідропіридин-3-карбонової кислоти (2вінілоксіетокси)-аміду з кислотною сумішшю протягом часу, достатнього для перетворення сполуки у 2-(2-флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)1,5-диметил-6-оксо-1,6-дигідропіридин-3карбоксамід; b) дозволяння матеріал з етапу а) кристалізуватися з органічного розчиннику; та c) виділення форми 2, 2-(2-флуор-4йодфеніламіно)-N-(2-гідроксіетокси)-1,5-диметил6-оксо-1,6-дигідропіридин-3-карбоксаміду. В одному аспекті органічний розчинник на етапі b) містить кристали затравки форми 2, 2-(2флуор-4-йодфеніламіно)-N-(2-гідроксіетокси)-1,5диметил-6-оксо-1,6-дигідропіридин-3-карбоксамід. Кислотна суміш на етапі а) може бути сумішшю неорганічних або органічних кислот, та етап а) може бути проведеним в органічному розчиннику, як-то тетрагідрофуран. В одному аспекті органічний розчинник на етапі b) може бути вибраним з етилацетату та метил-ізобутил-кетону, в обох випадках необов'язково у присутності ізогексану. Деякі сполуки цього винаходу можуть існувати як дві або більше таутомерні форми. "Таутомер" є одним з двох або більше структурних ізомерів, що існують у рівновазі та легко перетворюються від одної ізомерної форми до іншої, як-то структури, утвореної внаслідок переходу гідрогену від одної ділянки до іншої у межах тої ж молекули. Інші таутомери, що утворюють сполуки, можуть переходити один в одний, наприклад, внаслідок енолізації/деенолізації тощо. Відповідно, заявлений винахід стосується отримання усіх таутомерних форм сполук цього винаходу. Сполуки цього винаходу можуть виявляти один або більше асиметричних центрів; такі сполуки можуть внаслідок цього бути отриманими, як індивідуальні (R)- або (S)-стереоізомери або як їх суміші. Якщо не вказане інше, опис або назву конкретної сполуки в описі та формулі винаходу використано для позначення обох індивідуальних ена 93678 22 нтіомерів, суміші їх діастереоізомерів, рацемічної або інакше. Відповідно, цей винахід також стосується усіх таких ізомерів, охоплюючи діастереоізомерні суміші та відокремлені енантіомери сполук цього винаходу. Діастереоізомерні суміші можуть бути розділеними на їх індивідуальні діастереоізомери на основі їх фізико-хімічних відмінностей способами, відомими спеціалістам, наприклад, хроматографією або фракційною кристалізацією. Енантіомери можуть бути відокремлені перетворенням енантіомерної суміші у діастереоізомерну суміш реакцією з прийнятною оптично активною сполукою (наприклад, спиртом), розділенням діастереоізомерів та перетворенням (наприклад, гідролізуванням) індивідуальних діастереоізомерів до відповідних чистих енантіомерів Способи визначення стереохімії та відокремлення стереоізомерів добре відомі у попередньому рівні техніки (дивись обговоренняу Chapter 4 of "Advanced Organic Chemistry", 4th edition, J. March, John Wiley та Sons, New York, 1992). Цей винахід також стосується фармацевтичних композицій, що містять сполуку заявленого винаходу та способів лікування проліферативних розладів, або анормального росту клітин за допомогою призначення сполуки заявленого винаходу. Сполуки заявленого винаходу, що мають вільні аміногрупи, амідогрупи, гідроксильні або карбоксильні групи, можна перетворювати у фармацевтично прийнятні проліки. "Проліками" є сполука, що може перетворюватися у фізіологічних умовах або внаслідок сольволізу у визначену сполуку або до фармацевтично прийнятну сіль такої сполуки. Проліки охоплюють сполуки, де амінокислотний залишок, або поліпептидний ланцюг двох або більше (наприклад, двох, трьох або чотирьох) амінокислотних залишків є ковалентно приєднаними через амідний або естерний зв'язок до вільної аміногрупи, гідроксигрупи або групи карбонової кислоти сполуки заявленого винаходу. Амінокислотні залишки охоплюють але без обмеження, 20 існуючих у природі амінокислот, звичайно позначених за допомогою трьохлітерних символів та також охоплює 4гідроксипролін, гідроксилізин, демозин, ізодемозин, 3-метил гістидин, норвалін, бета-аланін, гамма-аміномасляну кислоту, цитрулін, гомоцистеїн, гомосерин, орнітин та метіонін-сульфон. Одними кращими проліками цього винаходу є сполука заявленого винаходу, ковалентно приєднана до залишку валіну. Додаткові типи проліків є охопленими також. Наприклад, вільні карбоксильні групи можуть бути дериватизованими як аміди або алкілові естери. Як ще один приклад, сполуки цього винаходу, що містять вільні гідроксильні групи, можуть бути дериватизованими як проліки перетворенням гідроксильної групи у фосфатний естер, гемісукцинат, диметиламіноацетат, або фосфорилоксиметилоксикарбоніл, як показано у Advanced Drug Delivery R eviews, 1996, 19, 115. Карбаматні проліки гідроксилу та аміногрупи є охопленими також, якими є карбонатні проліки, сульфонатні естери та сульфатні естери гідроксильної групи. Дериватизація гідроксильної групи, як (ацилокси)метиловим та 23 (ацилокси)етиловим етерами, де ацильна група може бути алкіловим естером, необов'язково заміщеним групами, охоплюючи, але без обмеження, етерні, амін та карбоново-кислотні функціональні групи, або ті, де ацильна група є амінокислотним естером, як описано вище, є охопленими також. Проліки цього типу є описаними у J. Med. Chem., 1996, 39, 10. Більш конкретні приклади охоплюють заміщення атома гідрогену спиртової групи такою групою, як (С1-С6)алканоїлоксиметил, 1-((С1С6)алканоїлокси)етил, 1-метил-1-((С1С6)алканоїлокси)етил, (С1С6)алкоксикарбонілоксиметил, N-(С1С6)алкоксикарбоніламінометил, сукциноїл, (С1С6)алканоїл, -аміно(С1-С4)алканоїл, арилацил та -аміноацил, або -аміноацил--аміноацил, де кожна -аміноацильна група є незалежно вибраною від існуючих у природі L-амінокислот, Р(О)(ОН)2, -Р(О)(О(С1-С6)алкіл)2 або глікозилу (радикалу, утвореного від усунення гідроксильної групи геміацетальної форми вуглеводу). Вільні аміни можуть також бути дериватизованими як аміди, сульфонаміди або фосфонаміди. Наприклад, проліки можуть бути утвореними за допомогою заміщення атома гідрогену в аміногрупі групою, як-то R-карбоніл, RO-карбоніл, NRR'карбоніл, де R та R', кожний незалежно, представляють (С1-С10)алкіл, (С3-С7)циклоалкіл, бензил, або R-карбоніл є природним -аміноацилом або природним альфа-аміноацилом-природним аміноацилом, -C(OH)C(O)OY, де Υ - Η, (С1-С6)алкіл або бензил, -C(OY0)Y1, де Y0 - (С1-С4) алкіл та Υ1 (С1-С6)алкіл, карбокси(С1-С6)алкіл, аміно(С1С4)алкіл або моно-Nабо ді-(N,N-(С1С6)aлкіламіноалкіл, -C(Y2)Y3, де Y2 - Η або метил та Υ3 - моно-N-або ді-Ν,Ν-(С1-С6)алкіламіно, морфоліно, піперидин-1-іл або піролідин-1-іл. Усі з цих частин проліків можуть охоплювати групи, охоплюючи, але без обмеження, етерні групи, аміногрупи та карбоново-кислотні функціональні групи. Проліки сполук заявленого винаходу можуть бути ідентифікованими, застосовуючи звичайні способи, відомі у попередньому рівні техніки. Різні форми проліків відомі у попередньому рівні техніки. Як приклади таких похідних проліків, дивись, наприклад, а) Design of Prodrugs, edited by Η. Bundgaard, (Elsevier, 1985) and Methods in Enzymology, Vol. 42, p. 309-396, edited by K. Widder, et al. (Academic Press, 1985); b) A Textbook of Drug Design and Development, edited by Krogsgaard-Larsen and H. Bundgaard, Chapter 5 "Design and Application of Prodrugs," by H. Bundgaard p. 113-191 (1991); с) Н. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992); d) H. Bundgaard, et al., Journal of Pharmaceutical Sciences, 77:285 (1988); та e) N. Kakeya, et al., Chem. Pharm. Bull., 32: 692 (1984), кожне з котрих уведено тут як посилання. На додаток, винахід також стосується сольватів, метаболітів та фармацевтично прийнятних солей сполук заявленого винаходу. Термін "сольват" стосується агрегації молекули з одною або більше молекулами розчиннику. 93678 24 "Метаболіт" є фармакологічно активним продуктом, отриманим внаслідок in vivo метаболізму в організмі визначеної сполуки або її солі. Такі продукти можуть утворюватися, наприклад, від окиснення, відновлення, гідролізу, амідування, дезамідування, естерифікаці, дезестерифікаці, ферментного розщеплення, тощо, застосовуваної сполуки. Відповідно, винахід стосується метаболітів сполук заявленого винаходу, охоплюючи сполуки, отримані способом, що містить контактування сполук цього винаходу з ссавцем протягом періоду часу, достатнього для утворення продукту їх метаболізму. Метаболіти звичайно ідентифікують отриманням радіомічених (наприклад, 14С або 3Н) ізотопами сполук винаходу, призначення їх парентерально у дозі, яку можна визначити (наприклад, більше приблизно 0,5 мг/кг), тварині, як-то щуру, миші, морській свинці, мавпі, або людині, даючи достатній час для того, щоб відбувся метаболізм (звичайно приблизно 30 секунд - 30 годин) та виділення продуктів його перетворювання з сечі, крові або інших біологічних зразків. Ці продукти легко виділяти оскільки вони є міченими (інші є виділеними застосуванням антитіл, здатних до зв'язування епітопів, що зберігаються як метаболіт). Метаболітні структури визначають у звичайним чином, наприклад, за допомогою аналізів МС, РХ/МС або ЯМР. Загалом, аналіз метаболітів роблять тим же шляхом, як дослідження метаболізму звичайних ліків, добре відомі спеціалістам. Метаболіти, оскільки їх інакше не знайти in vivo, є корисними у діагностичних дослідженнях для терапевтичного дозування сполук винаходу. "Фармацевтично прийнятна сіль", як застосовувано тут, якщо не вказане інше, охоплює солі, що зберігають біологічну ефективність вільної кислоти та основи визначеної сполуки та при цьому не є біологічно або інакше небажаними. Сполука винаходу може мати достатньо кислотні, достатньо основні, або обидві функціональні групи, та відповідно реагувати з будь-якою з ряду неорганічних або органічних основ, та неорганічних або органічних кислот, для утворення фармацевтично прийнятних солей. Приклади фармацевтично прийнятних солей охоплюють ті солі, що отримані реакцією сполуки заявленого винаходу із мінеральною або органічною кислотою або неорганічною основою, так солі, охоплюючи сульфати, піросульфати, гідросульфати, сульфіти, гідросульфіти, фосфати, моногідрогенфосфати, дигідрогенфосфати, метафосфати, пірофосфати, хлориди, броміди, йодиди, ацетати, пропіонати, деканоати, каприлати, акрилати, форміати, ізобутирати, капроати, гептаноати, пропіолати, оксалати, малонати, сукцинати, суберати, себацинати, фумарати, малеати, бутин-1,4-діоати, гексин-1,6-діоати, бензоати, хлорбензоати, метилбензоати, динітробензоати, гідроксибензоати, метоксибензоати, фталати, сульфонати, ксиленсульфонати, фенілацетати, фенілпропіонати, фенілбутирати, цитрати, лактати, -гідроксибутирати, гліколяти, тартрати, метансульфонати, пропансульфонати, нафталін-1сульфонати, нафталін-2-сульфонати, та манделати. Оскільки одинична сполука заявленого винахо 25 ду може містити більше одної кислотної або основної частини, сполуки заявленого винаходу можуть містити моно-, ді- або три-солі у одиничній сполуці. Якщо патентоздатною сполукою є основа, потрібна фармацевтично прийнятна сіль може бути отриманою будь-яким придатним способом доступним у попередньому рівні техніки наприклад, обробкою вільної основи кислотною сполукою, особливо неорганічною кислотою, як-то гідрохлоридна кислота, гідробромідна кислота, сульфатна кислота, нітратна кислота, фосфатна кислота тощо, або із органічна кислота, як-то оцтова кислота, малеїнова кислота, бурштинова кислота, мигдальна кислота, фумарова кислота, малонова кислота, пірувинна кислота, щавлева кислота, гліколева кислота саліцилова кислота, піранозидил кислот, як-то глюкуронова кислота або галактуронова кислота, альфа-гідроксикислотою, як-то лимонна кислота або винна кислота амінокислотою, як-то аспарагінова кислот або глутамінова кислота, ароматичною кислотою, як-то бензойна кислота або корична кислота, сульфоновою кислотою, якто пара-толуолсульфонова кислота або етансульфонова кислота, тощо. Якщо патентоздатною сполукою є кислота, потрібну фармацевтично прийнятну сіль можна отримувати будь-яким придатним способом, наприклад, обробкою вільної кислоти неорганічною або органічною основою. Кращі неорганічні солі є тими, які утворені з лужними та лужно-земельними металами, як-то літій, натрій, калій, барій та кальцій. Кращі солі органічних основ охоплюють, наприклад, солі вибраного з групи амоній, дибензиламоній бензиламоній, 2-гідроксіетиламоній, біс(2гідроксіетил)амоній фенілетилбензиламін, дибензилетилендіамін, тощо. Інші солі кислотних частин можуть містити, наприклад, такі солі, утворені з прокаїном, хініном та N-метилглюкозаміном, а також солі, утворені з основними амінокислотами, як-то гліцин, орнітин, гістидин фенілгліцин, лізин та аргінін. Способи виробництва сполук заявленого винаходу запропоновані як подальші особливості винаходу. Патентоздатні сполуки можуть бути отриманими, застосовуючи реакційні шляхи та схеми синтезу, які описано нижче, застосовуючи способи, доступні у попередньому рівні техніки, застосовуючи вихідні матеріали, котрі є легко доступними або їх можна синтезувати, застосовуючи способи, відомі у попередньому рівні техніки. Ілюстрації отримання сполук заявленого винаходу є показаними на Фіг.1-7. Отримання сполуки формули 96 є показаним на Фіг.1. Заміщений гідразин 28 можна перетворювати у пдразонопропаноат 29 за допомогою двостадійної процедури. На першому етапі, гідразин 28 конденсують з етил піруватом у стандартних умовах дегідрування, як-то у присутності магній сульфату у придатному органічному розчиннику, як-то хлороформ або метиленхлорид при температурах у межах від 0°C до температури довкілля. На другому етапі ацилування досягають обробкою основи при низькій температурі у придатному органічному розчиннику, як-то тетрагідрофуран, 93678 26 диметилформамід, діоксан або ацетонітрил, а потім додаванням метил малонілхлориду. В одному втіленні гідразон обробляють LiH у тетрагідрофурані при 0°C з наступним додаванням метил малонілхлориду та нагріванням до кімнатної температури. Гідроксипіридазинон 31 отримують від гідразонопропаноат 29 за допомогою циклізації у сильно основних умовах, а потім декарбоксилуванням. Циклізації можна досягти обробкою гідразонопропаноату 29 сильною основою, як-то DBU, LDA або натрій гідрид у придатному органічному розчиннику, як-то тетрагідрофуран або ацетонітрил при кімнатній температурі. В одному втіленні циклізації досягають за допомогою DBU в ацетонітрилі при кімнатній температурі. Декарбоксилування для утворення гідроксипіридазинону 31 можна досягти нагріванням частини метилового естеру піразинону у придатному органічному розчиннику, як-то діоксан або декалін або суміш діоксан/декалін, до високої температури у присутності концентрованої НСІ. Карбонова кислота 94 може бути отриманою з гідроксипіридазинону 31 двостадійним способом, тобто, хлоруванням а потім окисненням. Хлорування можна досягти обробкою РОСІ3, тіонілхлоридом, оксалілхлоридом або РСІ5. В одному втіленні цього перетворювання досягають за допомогою бездомішкового РОСІ3 при підвищеній температурі (приблизно 85°C). Після етапу хлорування карбонова кислота 94 може бути отриманою окисненням у стандартних умовах, охоплюючи, але без обмеження, KМnО4 у воді, SeO2 в органічному розчиннику, як-то діоксан, ксилен, або піридин, NaOCI/RuCI3, CrO3 у водній сульфатній кислоті, калій дихромат, та натрій дихромат у воді. В одному втіленні цього перетворювання досягають за допомогою суміші калій дихромат-сульфатна кислота. Карбонову кислоту 94 можна перетворювати у піридазиноновий естер 95 двостадійною процедурою, котра охоплює естерифікацію піридазинонової кислоти 94 а потім паладій-опосередковану реакцію перехресного сполучення. Естерифікація може бути проведеною у стандартних умовах, охоплюючи, але без обмеження, концентровану НСІ у метанолі, TMSCI у метанолі або TMSCHN2 у придатному органічному розчиннику, як-то етер/метанол, тетрагідрофуран/метанол або толуол/метанол. Паладій-опосередковану реакцію перехресного сполучення можна досягти стандартними способами, охоплюючи, але без обмеження, обробку піридазинонового естеру аніліном, паладієвим каталізатором, як-то Pd(OAc)2, PdCI2(dppf), Pd(Ph3P)4, або Pd2dba3, фосфіновим лігандом та основою у придатному органічному розчиннику, як-то тетрагідрофуран, диметилформамід, толуол, ДМЕ або ацетонітрил при підвищеній температурі. В одному втіленні реакція перехресного сполучення полягає у обробці естеру 94 Pd(OAc)2, рац-2,2біс(дифенілфосфіно)-1,1'диметилформамідафтилом та цезій карбонатом у толуолі при 70-100°C. У втіленні сполуки формули 95, де є потрібним R9=Br, бром-замісник може бути уведеним після реакції перехресного сполучення. Бромування піридазинону можна досягти за допомогою NBS у придатному органічному розчиннику, 27 як-то диметилформамід, ацетонітрил або змішані системи розчинників при кімнатній температурі. В одному втіленні бромування є проведеним у диметилформаміді. Гідроксамат 96 може бути отриманим обробкою піридазинонового естеру 95 прийнятним гідроксиламіном та амідною основою, як-то LDA, LiHMDS або NaHMDS у придатному органічному розчиннику, як-то тетрагідрофуран, при низькій температурі. В одному втіленні розчин LiHMDS додають до розчину піридазинонового естеру 95 та гідроксиламіну у тетрагідрофурані при 0°C. Реакційну суміш тоді нагрівають до кімнатної температури для утворення потрібного гідроксамату 96. У деяких обставинах гідроксиламін, застосовуваний у реакції сполучення, містить стандартну захисну групу. У цих випадках захисна група може бути видаленою у стандартних умовах, відомих у попередньому рівні техніки. Фіг.2 відображує синтез сполук 96, 100, 101 та 102. Заміщений гідразин 28 можна перетворювати у гідразономалонат 97 за допомогою одної з двох процедур. В одному втіленні конденсація заміщеного гідразину 28, а потім ацилування є особливо корисними для аналогів, де R9 - алкіл або галоген. У цьому втіленні гідразин 28 може бути конденсованим із діетил 2-оксомалонатом у стандартних умовах дегідратування, застосовуючи пастку Дина-Старка у придатному органічному розчиннику, як-то бензол або толуол, при температурах у межах від 80 до 120°C. Ацилування за допомогою реагенту, що поставляє ацильну групу для забезпечення гідразономалонату 97, досягають обробкою основою при прийнятній температурі у придатному органічному розчиннику, як-то тетрагідрофуран, диметилформамід, діоксан або ацетонітрил, а потім додаванням реагенту ацилування. Приклади реагентів ацилування добре відомі спеціалістам та охоплюють, але без обмеження, хлорангідриди кислоти, ангідриди кислот, та активовані естери. В одному втіленні гідразон обробляють LіН у тетрагідрофурані при 0°C з наступним додаванням хлорангідриду кислоти та перемішуванням при 25 до 60°C для забезпечення сполук 97. Альтернативний спосіб синтезу сполук 97, де R9 не є галогеном полягає в ацилуванні гідразину 28 за допомогою реагенту, що поставляє ацильну групу, а потім конденсації із діетил 2оксомалонатом для забезпечення гідразономалонату 97. Згідно з цим способом, заміщений гідразин 28 можна перетворювати у гідразид стандартними способами ацилування. В одному втіленні цього перетворювання досягають за допомогою прийнятного хлорангідриду кислоти у метиленхлориді при 0°C до температури довкілля. Отриманий гідразид конденсують з діетил-кетомалонатом у стандартних умовах дегідратування, застосовуючи пастку Дина-Старка у придатному органічному розчиннику, як-то бензол або толуол при температурі від 80 до 130°C. Піридазинон 99 отримують з гідразономалонату 97 за допомогою циклізації в основних умовах для забезпечення проміжної кислоти або естеру 98, а потім хлорування для забезпечення піридазинону 99. Циклізації можна досягти обробкою гідразономалонату 7 амідною основою, як-то LiHMDS, NaHMDS, KHMDS або 93678 28 LDA у придатному органічному розчиннику, як-то тетрагідрофуран або етер, при низькій температурі. В одному втіленні циклізації досягають за допомогою LiHMDS у тетрагідрофурані при низькій температурі (від -78 до -40°C), з наступною обробкою концентрованою НСІ для утворення естерного похідного 98 (R=етил). У ще одному втіленні кислотне похідне 98 (R=Н) отримують за допомогою омилення на місці піридазинонового естеру 98. Після завершення циклізації, реакційну суміш погашають водою при низьких температурах (від -78 до -40°C), тоді нагрівають до температури довкілля із перемішуванням, а потім підкисленням. Піридазинон 99 тоді отримують з піридазинонової кислоти або естеру 98 обробкою РОСІ3, тіонілхлоридом, оксалілхлоридом або РСІ5. В одному втіленні цього перетворювання досягають за допомогою бездомішкового РОСІ3 при підвищеній температурі (приблизно 85°C). Коли R9 не є атомом F, піридазинонову кислоту 99 (коли R=Н) можна тоді перетворювати у піридазинон 101. Уведення анілінової частини досягають за допомогою реакції SNAR у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи амідну основу, як-то LDA, LiHMDS, NaHMDS або KHMDS при прийнятній температурі (від -78°C до кімнатної температури). В одному втіленні анілін додають до LDA або LiHMDS у тетрагідрофурані при низькій температурі (-20 до -80°C). Піридазинонову кислоту 99 (R=Н) тоді додають та реакційну суміш нагрівають до кімнатної температури для створення карбонової кислоти 101. Гідроксамати 96 та аміди 102 можуть тоді бути отриманими з кислоти 101, застосовуючи стандартний реагент сполучення, як-то, але без обмеження, 1-(3диметиламінопропіл)-3-етилкарбодіімід гідрохлорид (EDCI), 1-гідроксибензотриазол-6сульфонамідометил гідрохлорид (HOBt), або бензотриазол-1-іл-окситрипіролідинофосфоній гексафлуорфосфат (РуВОР), та прийнятний амін або гідроксиламін у придатному органічному розчиннику, як-то диметилформамід, тетрагідрофуран або метиленхлорид. У деяких обставинах амін або гідроксиламін містить стандартну захисну групу. У цих випадках захисна група може бути видаленою у стандартних умовах, відомих у попередньому рівні техніки. Альтернативно, естер піридазинону 99 (R=етил) можна перетворювати у гідроксамат 96 через піридазиноновий естер 100 стандартними способами, описаними на Фіг.1. Коли є потрібним R8=Br або І, потрібний галоген може бути уведеним, застосовуючи NBS або NIS у придатному органічному розчиннику або змішаній системі розчинників, як-то диметилформамід, тетрагідрофуран-метанол, або АсОНтетрагідрофуран у присутності прийнятного кислотного каталізатору. На Фіг.3 наведено синтез сполук 109, 110 та 111, де застосовувано 2,6-дихлорнікотинову кислоту як вихідний матеріал. Нікотинову кислоту 103 перетворюють у монохлор-кислоту 104 кип'ятінням під зворотним холодильником у 2 Η водному розчині натрій гідроксиду виконанням процедури, описаної у патенті США № 3,682,932. Алкілування 104 для забезпечення 105 можна досягти за до 29 помогою стандартних основних умов алкілування, уводячи алкіл галогеніди, з двома еквівалентами прийнятного алкілгалогеніду та основою з утворенням суміші N-алкіл-піридонового естеру 105 та регіоізомерного О-алкіл-піридинового естеру, котрі легко відокремлювати хроматографією на колонці. Ці умови охоплюють, але без обмеження, калій карбонат в ацетоні або диметилформаміді при кімнатній температурі або підвищеній температурі або натрій гідрид у тетрагідрофурані при температурі довкілля або підвищеній температурі та тоді додавання алкілгалогеніду. У деяких втіленнях такого алкілування досягають за допомогою LiH у диметилформаміді при 0°C, з наступним додаванням алкілброміду або алкілйодиду та нагрівання до кімнатної температури. Бромування піридонового естеру 105 можна досягти з Br2 та оцтовою кислотою або NBS у придатному органічному розчиннику, як-то диметилформамід. У деяких втіленнях NBS додають до розчину піридонового естеру 105 у диметилформаміді для утворення 106. Перетворювання броміду 106 у сполуку 107 можна досягти, застосовуючи опосередковані паладієм умови перехресного сполучення. Коли R9=алкеніл або алкініл, вони можуть бути далі відновленими, застосовуючи прийнятний відновник для забезпечення алкільних замісників при R9. Загалом, цього хімічного перетворення можна досягти, застосовуючи широку різноманітність паладієвих каталізаторів та лігандів, з додаванням основи або без неї, у придатному органічному розчиннику, як-то диметилформамід, толуол, ДМЕ, тетрагідрофуран, ацетонітрил, при підвищеній температурі. Партнер сполучення залежатиме від природи R9. Наприклад, якщо є потрібним R9=CN, партнером сполучення є Zn(CN)2. Ця реакція може бути проведеною за допомогою Pd2dba3 та dppf у Nметилпіролідоні при 120°C. Ці опосередковані паладієм реакції перехресного сполучення є добре задокументованими у літературі та добре відомі спеціалістам. Уведення належним чином заміщеної анілінової частини для забезпечення 108 досягають за допомогою реакції SNAR. Це може бути зробленим у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи амідну основу, як-то LDA, LiHMDS, NaHMDS, або KHMDS, при прийнятних температурах (від -78°C до кімнатної температури). У деяких втіленнях анілін додають до LDA або LiHMDS у тетрагідрофурані при низькій температурі (від -20 до -80°C). Піридон 105 тоді додають та суміш перемішують при низькій температурі для створення естеру 108. Карбонова кислота 109 може тоді бути отриманою, застосовуючи стандартні умови омилення, як-то LiOH або натрій гідроксид у стандартних змішаних системах водноорганічних розчинників. Гідроксамат 110 та амід 111 можуть бути отриманими, застосовуючи стандартні процедури сполучення, за допомогою, але без обмеження, EDCI, HOBt, або РуВОР та прийнятного аміну або гідроксиламіну у придатному органічному розчинників, як-то диметилформамід, тетрагідрофуран, або метиленхлорид. У деяких втіленнях, сполучення досягають за допомогою HOBt та EDCI у диметилформаміді. У деяких обставинах амін або гідроксиламін, застосовувані у 93678 30 реакції сполучення, містять стандартні захисні групи. У цих випадках захисна група може бути видаленою у стандартних умовах, відомих у попередньому рівні техніки. Фіг.4 показує альтернативну схему реакцій для синтезу сполук 109, 110 та 111. Цей шлях є особливо корисним для аналогіів, де R7 не представляє метил або етил. Нікотинову кислоту 103 можна перетворювати у метиловий естер N-алкілпіридону 114 за допомогою процедури з семи етапів, де 2,6-дихлор-нікотинову кислоту 103 спершу перетворюють у метокси-піридинову кислоту, котру естерифікують з утворенням метилового естеру, та тоді позбавляють захисту для утворення моно хлор-естеру 112. У деяких втіленнях перетворювання у метокси-піридинову кислоту проводять додаванням калій трет-бутоксиду до розчину кислоти 103 у метанолі та цю суміш тоді нагрівають до температури кипіння під зворотним холодильником протягом кількох діб. Естерифікація з утворенням метилового естеру може бути проведеною у стандартних умовах, охоплюючи, але без обмеження, естерифікацію за Фішером (метанол, сульфатна кислота), TMSCI у метанолі або TMSCHN2 у придатному органічному розчиннику, як-то толуол/метанол. Деметилування метоксипіридину можна тоді досягти стандартними умовами, охоплюючи, але без обмеження, розчин НСІ при підвищеній температурі, розчин n-TsOH в оцтовій кислоті при підвищеній температурі та водний розчин НBr у метанолі при підвищеній температурі. Кращого деметилування з утворенням піридону 112 досягають обробкою метоксипіридину водним розчином НBr в оцтовій кислоті при підвищеній температурі (80 до 120°C). Алкілування 112 можна досягти за допомогою стандартних основних умов алкілування, уводячи алкілгалогеніди, з одним еквівалентом прийнятного алкілгалогеніду та основою з утворенням суміші Nалкіл-піридонового естеру 113 та регіоізомерного О-алкіл-піридинового естеру, котрі є легко відокремлюваними хроматографією на колонці. Ці умови охоплюють але без обмеження, калій карбонат в ацетоні або диметилформаміді при кімнатній температурі або підвищеній температурі, або натрій гідрид у тетрагідрофурані при температурі довкілля або підвищеній температурі, та тоді додавання алкілгалогеніду. У деяких втіленнях такого алкілування досягають за допомогою LіН у диметилформаміді при 0°C, з наступним додаванням алкілброміду або алкілйодиду та нагріванням до кімнатної температури. Бромування піридонового естеру 113 можна досягти за допомогою Br2 та оцтової кислоти або NBS у придатному органічному розчиннику, як-то диметилформамід. У деяких втіленнях NBS додають до розчину піридонового естеру 113 у диметилформаміді для утворення 114. Перетворювання броміду 114 у сполуку 115 можна досягти, застосовуючи опосередковані паладієм умови перехресного сполучення. Коли R9=алкеніл або алкініл, вони можуть бути далі відновленими, застосовуючи прийнятний відновник для забезпечення алкільних замісників при R9. Загалом, цього хімічного перетворення можна досягти, застосовуючи широку різноманітність пала 31 дієвих каталізаторів та лігандів, з додаванням основи або без неї, у придатному органічному розчиннику, як-то диметилформамід, толуол, ДМЕ, тетрагідрофуран, ацетонітрил при підвищеній температурі. Партнер сполучення залежатиме від природи R9. Ці опосередковані паладієм реакції перехресного сполучення є добре задокументованими у літературі та добре відомі спеціалістам. Уведення належним чином заміщеної анілінової частини для забезпечення 116 досягають за допомогою реакції SNAR. Це може бути зробленим у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи амідну основу, як-то LDA, LiHMDS, NaHMDS, або KHMDS при прийнятних температурах (від -78°C до кімнатної температури). У деяких втіленнях анілін додають до LDA або LiHMDS у тетрагідрофурані при низькій температурі (від -20 до -80°C). Піридон 115 тоді додають та суміш перемішують при низькій температурі для створення естеру 116. Перетворювання 116 у карбонову кислоту 109, а також гідроксамат 110 та амід 111 можна досягти, як описано для Фіг.3. Альтернативно, гідроксамат 110 може бути отриманим безпосередньо з метилового естеру 116 у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи прийнятний гідроксиламін та амідну основу, як-то LDA, LiHMDS, NaHMDS, або KHMDS при прийнятних температурах (від -78°C до кімнатної температури). У деяких втіленнях, розчин LiHMDS додають до розчину естеру 116 та гідроксиламіну у тетрагідрофурані при 0°C. Реакційну суміш тоді нагрівають до кімнатної температури для утворення потрібного гідроксамату 110. У деяких обставинах гідроксиламін, застосовуваний у реакції сполучення, містить стандартні захисні групи. У цих випадках захисна група може бути видаленою у стандартних умовах, відомих у попередньому рівні техніки. Фіг.5 показує схему реакцій для синтезу сполук 119, 120 та 121, де метиловий естер N-алкілпіридону 112 застосовувано, як вихідний матеріал. Утворення 117 можна досягти за допомогою уведення належним чином заміщеної анілінової частини за допомогою реакції SNAR. Це може бути зробленим у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи амідну основу, як-то LDA, LiHMDS, NaHMDS, або KHMDS при прийнятних температурах (від -78°C до кімнатної температури). У деяких втіленнях анілін додають до LDA або LiHMDS у тетрагідрофурані при низькій температурі (від -20 до -80°C). Піридон 112 тоді додають та суміш перемішують при низькій температурі для створення естеру 117. Це може бути зробленим у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи амідну основу, як-то LDA, LiHMDS, NaHMDS, або KHMDS при прийнятних температурах (від -78°C до кімнатної температури). Хлорування піридону 117 з утворенням піридону 118 можна досягти, застосовуючи стандартні умови, як-то NCS у придатному органічному розчиннику, як-то диметилформамід. Перетворювання 118 у карбонову кислоту 119, а також гідроксамат 120 та амід 121 можна досягти, як описано для Фіг.3 та 4. 93678 32 Фіг.6 показує схему реакцій для синтезу сполук 124 та 125. 4-Флуорпіридазинон 123 може бути отриманим з 4-хлорпіридазинону 122 обробкою KF або HF з основою, як-то Et3N або Me3N, або без неї у придатному органічному розчиннику, як-то ацетонітрил, тетрагідрофуран, диметилформамід, N-метилпіролідон або ДМСО. В одному втіленні цього перетворювання досягають за допомогою KF у ДМСО при підвищеній температурі (наприклад, 160°C). Піридазиноновий естер 123 (коли R=етил) можна перетворювати у піридазинон 124, де уведення анілінової частини досягають за допомогою реакції SNAR. Це може бути зробленим у придатному органічному розчиннику, як-то диметилформамід, етанол, ізопропанол, ацетонітрил або тетрагідрофуран, застосовуючи основу, як-то цезій карбонат, натрій гідрокарбонат, калій карбонат або натрій карбонат при температурі від 80 до 160°C. В одному втіленні анілін та цезій карбонат додають до розчину піридазинону 123 у диметилформаміді та реакційну суміш нагрівають до 80°C. Альтернативно, піридазинонову кислоту 123 (R=Н) можна перетворювати у піридазинон 125 стандартними способами, як-то тими, що описано на Фіг.2. Піридазинон 124 або 125 можна перетворювати у гідроксамати або аміди, як описано на Фіг.1 або 2. Фіг.7 показує схему реакцій для синтезу сполук 128, 129 та 130, де метиловий естер піридону 117 застосовано як вихідний матеріал. Бромування піридонового естеру 117 можна досягти із за допомогою Br2 та оцтової кислоти або NBS у придатному органічному розчиннику, як-то диметилформамід. Переважно NBS додають до розчину піридонового естеру 117 у диметилформаміді для утворення 126. Перетворювання броміду 126 у сполуку 127, де R9 - ціаногрупа, можна досягти, застосовуючи опосередковані паладієм умови перехресного сполучення. Загалом, цього хімічного перетворення можна досягти, застосовуючи широку різноманітність паладієвих каталізаторів та лігандів, з додаванням основи або без неї, у придатному органічному розчиннику, як-то диметилформамід, толуол, ДМЕ, тетрагідрофуран, ацетонітрил або N-метилпіролідон при підвищеній температурі. Переважно, цю реакцію проводять за допомогою Zn(CN)2 та Pd2dba3 та dppf у диметилформаміді при 120°C. Перетворювання 127 у карбонову кислоту 128, а також гідроксамат 129 та амід 130 можна досягти, як описано для Фіг.3 та 4. На Фіг.8, представлено синтез сполук формули V, де R9=Η або F, у котрому застосовано як вихідний матеріал 2,6-дихлор-нікотинову кислоту або 2,6-дихлор-5-флуор-нікотинову кислоту. Цей шлях є особливо корисним для аналогіів, де R7 метил. Нікотинову кислоту 140 перетворюють у монохлор-кислоту 141 кип'ятінням під зворотним холодильником у 2 Η водному розчині натрій гідроксиду виконанням процедури, описаної у патенті США 3682932 (1972). Алкілування 141 можна досягти за допомогою стандартних основних умов алкілування, уводячи алкілгалогеніди, з двома еквівалентами прийнятного алкілгалогеніду та основою з утворенням суміші N-алкіл-піридонового естеру та регіоізомерного О-алкіл-піридонового естеру, котрі є легко відокремлюваними хроматог 33 рафією на колонці. Ці умови охоплюють але без обмеження, додавання калій карбонату в ацетоні або диметилформаміді при кімнатній температурі або підвищеній температурі або натрій гідрид у тетрагідрофурані при температурі довкілля або підвищеній температурі та тоді додавання алкілгалогеніду. Переважно такого алкілування досягають за допомогою LiH у диметилформаміді при 0°C, з наступним додаванням алкілброміду або алкілйодиду танагріванням до кімнатної температури. Уведення належним чином заміщеної анілінової частини для забезпечення 143 досягають за допомогою реакції SNAR. Це може бути зробленим у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи амідну основу, якто LDA, LiHMDS, NaHMDS, або KHMDS при прийнятних температурах (від -78°C до кімнатної температури. Переважно анілін додають до LDA або LiHMDS у тетрагідрофурані при низькій температурі (від -20 до -80°C). Піридон тоді додають та суміш перемішують при низькій температурі для створення естеру 143. Карбонова кислота 144 може тоді бути отриманою, застосовуючи стандартні умови омилення, як-то LiOH або натрій гідроксид у стандартних змішаних системах водно-органічних розчинників. Гідроксамат 145 та амід 146 можуть бути отриманими, застосовуючи стандартні процедури сполучення, охоплюючи, але без обмеження, EDCI, HOBt, або РуВОР та прийнятний амін або гідроксиламін у придатному органічному розчиннику, як-то диметилформамід, тетрагідрофуран, або метиленхлорид. Переважно, сполучення досягають за допомогою HOBt та EDCI у диметилформаміді. У деяких обставинах амін або гідроксиламін, застосовуваний у реакції сполучення, містить стандартні захисні групи. У цих випадках захисна група може бути видаленою у стандартних умовах, відомих у попередньому рівні техніки. На Фіг.9, представлено альтернативний синтез сполук формули V, де R9=Η або F, у котрому застосовано як вихідний матеріал 2,6-дихлорнікотинову кислоту або 2,6-дихлор-5флуорнікотинову кислоту. Нікотинову кислоту 140 можна перетворювати у метиловий естер N-алкілпіридону 149 після процедури з п'яти етапів, де 2,6-дихлорнікотинову кислоту 140 спершу перетворюють у метокси-піридинову кислоту, котру естерифікують з утворенням метилового естеру та тоді позбавляють захисту для утворення моно хлор-естеру 147. Перетворювання у метоксипіридинову кислоту переважно проводять додаванням калій трет-бутоксиду до розчину кислоти 140 у метанолі, та цю суміш тоді нагрівають до температури кипіння під зворотним холодильником протягом кількох діб. Естерифікація з утворенням метилового естеру може бути проведеною у стандартних умовах, охоплюючи, але без обмеження, естерифікацію за Фішером (метанол, сульфатна кислота), TMSCI у метанолі або TMSCHN2 у придатному органічному розчиннику, як-то толуол/метанол. Деметилування метоксипіридину можна тоді досягти стандартними умовами, охоплюючи, але без обмеження, НСІ при підвищеній температурі, n-TsOH в оцтовій кислоті при підвищеній температурі та водний розчин НBr 93678 34 у метанолі при підвищеній температурі. Кращого деметилування з утворенням піридону 147 досягають обробкою метокси-піридину водним розчином НBr в оцтовій кислоті при підвищеній температурі (80 до 120°C). Алкілування 147 для забезпечення 148 можна досягти за допомогою стандартних основних умов алкілування, уводячи алкілгалогеніди, з одним еквівалентом прийнятного алкілгалогеніду та основою з утворенням суміші N-алкіл-піридонового естеру та регіоізомерного Оалкіл-піридонового естеру, котрі є легко відокремлюваними хроматографією на колонці. Ці умови охоплюють але без обмеження, калій карбонат в ацетоні або диметилформаміді при кімнатній температурі або підвищеній температурі або натрій гідрид у тетрагідрофурані при температурі довкілля або підвищеній температурі та тоді додавання алкілгалогеніду. Переважно такого алкілування досягають за допомогою LiH у диметилформаміді при 0°C, з наступним додаванням алкілброміду або алкілйодиду та нагріванням до кімнатної температури. Уведення належним чином заміщеної анілінової частини досягають за допомогою реакції SNAR. Це може бути зробленим у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи амідну основу, як-то LDA, LiHMDS, NaHMDS, або KHMDS при прийнятних температурах (від -78°C до кімнатної температури). Переважно анілін додають до LDA або LiHMDS у тетрагідрофурані при низькій температурі (від -20 до 80°C). Піридон тоді додають та суміш перемішують при низькій температурі для створення естеру 149. Гідроксамат 145 можуть бути отриманими безпосередньо з метилового естеру 149 у придатному органічному розчиннику, як-то тетрагідрофуран, застосовуючи прийнятний гідроксиламін та застосовуючи амідну основу, як-то LDA, LiHMDS, NaHMDS, або KHMDS при прийнятних температурах (від -78°C до кімнатної температури). Переважно, розчин LiHMDS додають до розчину метилового естеру 149 та гідроксиламіну у тетрагідрофурані при 0°C. Реакційну суміш тоді нагрівають до кімнатної температури для утворення потрібного гідроксамату 145. У деяких обставинах гідроксиламін, застосовуваний у реакції сполучення, містить стандартні захисні групи. У цих випадках захисна група може бути видаленою у стандартних умовах, відомих у попередньому рівні техніки. У наступному аспекті цей винахід стосується способу отримання сполуки формули ІА, вказаний спосіб полягає у наступному: реакція сполуки формули 100 або 101 з R3NH2 у присутності (і) реагенту сполучення, коли R3 є таким, як визначено у формулі ІА або (іі) 35 амідної основи, коли R3 є таким, як визначено у формулі ІА, за винятком того, що R3 не представляє Η або метил, для забезпечення отримання вказаної сполуки формули ІА. У наступному аспекті цей винахід стосується способу отримання сполуки формули IV, вказаний спосіб полягає у наступному: реакція сполуки формули 108 або 109 93678 36 у присутності паладієвого каталізатору, фосфінового ліганду, та амідної основи, для забезпечення отримання сполуки формули 108 (d) необов'язково гідролізування сполуки формули 108 в основних умовах для забезпечення отримання сполуки формули 109 з R3NH2, де R3 є таким, як визначено у формулі IV, у присутності (і) реагенту сполучення або (іі) амідної основи, коли R3 є таким, як визначено у формулі IV, за винятком того, що R3 не представляє Η або метил. У наступному аспекті цей винахід стосується способу отримання сполуки формули VI, вказаний спосіб полягає у наступному: (a) бромування сполуки, що має формулу 105 (e) реакція сполуки 108 або сполуки 109 з R3NH2 у присутності (і) реагенту сполучення, коли R3 є таким, як визначено у формулі VI або (іі) амідної основи, коли R3 є таким, як визначено у формулі VI, за винятком того, що R3 не представляє Н, для забезпечення отримання вказаної сполуки формули VI. В одному втіленні сполуку 105 отримують способом, що полягає у наступному: (a) реакція сполуки формули 103 де R - алкіл, для забезпечення отримання сполуки формули 106 з водним розчином натрій гідроксиду для забезпечення отримання сполуки формули 104 (b) реакція сполуки формули 106 з Zn(Me)2 у присутності паладієвого каталізатору та ліганду, та необов'язково у присутності основи, для забезпечення отримання сполуки формули 107 (c) реакція сполуки формули 107 з аніліном, що має формулу (b) реакція сполуки формули 104 з RX, де R метил та X - галогенід, у присутності основи для забезпечення отримання сполуки формули 105. У наступному аспекті цей винахід стосується способу отримання сполуки формули II, вказаний спосіб полягає у наступному: (a) реакція гідразину, що має формулу Me-NHNH2 із: (і) діетил 2-оксомалонатом, з наступною обробкою реагентом ацилування, що поставляє ацильну групу, що має формулу C(=O)CH2R9, де R9 є таким, як визначено у формулі II, або 37 (іі) реагентом ацилування, що поставляє ацильну групу, що має формулу C(=O)CH2R9, де R9 є таким, як визначено у формулі II, з наступною обробкою діетил-кетомалонатомом, для забезпечення отримання сполуки формули 97 93678 38 (a) реакція гідразину, що має формулу Me-NHNH2 із: (і) діетил 2-оксомалонатом, з наступною обробкою реагентом ацилування, що поставляє ациль9 9 ну групу, що має формулу C(=O)CH2R , де R - Н, метил, або СІ; або (іі) реагентом ацилування, що поставляє ацильну групу, що має формулу C(=O)CH2R9, де R9 Н, метил, або СІ, з наступною обробкою діетилкетомалонатом, для забезпечення отримання сполуки формули 97 (b) обробка сполуки формули 97 амідною основою при температурі нижче -40°C, з наступною обробкою концентрованою НСІ, для забезпечення отримання формули 98 (b) обробка сполуки формули 97 амідною основою при температурі нижче -40°C з утворенням сполуки формули 98 (c) хлорування сполуки формули 98 для забезпечення отримання сполуки формули 99 (c) хлорування сполуки формули 98 для забезпечення отримання сполуки формули 99 (d) реакція сполуки формули 99 з аніліном, що має формулу 40 (d) реакція сполуки формули 99 з аніліном, що має формулу у присутності паладієвого каталізатору, ліганду, та амідної основи, для забезпечення отримання сполуки формули 100 у присутності амідної основи, для забезпечення отримання сполуки формули 101 (e) реакція сполуки формули 100 із R3NH2 у присутності (і) реагенту сполучення, коли R3 є таким, як визначено у формулі II або (іі) амідної основи, коли R3 є таким, як визначено у формулі II, за винятком того, що R3 не представляє Н, для забезпечення отримання вказаної сполуки формули II. У наступному аспекті цей винахід стосується способу отримання сполуки формули II, де R9 - Н, метил, або СІ, вказаний спосіб полягає у наступному: та (e) реакція сполуки формули 101 із R3NH2 у присутності (і) реагенту сполучення, коли R3 є таким, як визначено у формулі II або (іі) амідної основи, коли R3 є таким, як визначено у формулі II, за винятком того, що R3 не представляє Н, для забезпечення отримання вказаної сполуки формули II. 39 У наступному аспекті цей винахід стосується способу отримання сполуки формули V, де R9 метил, вказаний спосіб полягає у наступному: (a) бромування сполуки, що має формулу 105 93678 40 та (e) реакція сполуки формули 108 або сполуки формули 109 із R3NH2, де R3 є таким, як визначено у формулі V, у присутності реагенту сполучення або амідної основи, для забезпечення отримання вказаної сполуки формули V. У наступному аспекті цей винахід стосується способу отримання сполуки формули V, де R9 - СІ, вказаний спосіб полягає у наступному: (а) реакція сполуки формули 112 де R - алкіл, для забезпечення отримання сполуки формули 106 з аніліном, що має формулу (b) реакція сполуки формули 106 із Zn(Me)2 у присутності паладієвого каталізатору та ліганду, та необов'язково у присутності основи, для забезпечення отримання сполуки формули 107 (с) реакція сполуки формули 107 з аніліном, що має формулу у присутності амідної основи, для забезпечення отримання сполуки формули 108 у присутності амідної основи для забезпечення отримання сполуки формули 117 (b) хлорування сполуки формули 117 для забезпечення отримання сполуки формули 118 та (с) необов'язково гідролізування сполуки формули 118 для забезпечення отримання сполуки формули 118А (d) необов'язково гідролізування сполуки формули 108 в основних умовах для забезпечення отримання сполуки формули 109 (d) реакція сполуки формули 118 або 118А із (S)-MeCH(OH)CH2ONH2 або HOCH2CH2ONH2 у присутності реагенту сполучення або амідної основи, для забезпечення отримання вказаної сполуки формули V. 41 У наступному аспекті цей винахід стосується способу отримання сполуки формули V, де R9 - Η або F, вказаний спосіб полягає у наступному: (а) обробка сполуки формули 140 де R9 - Η або F, водним розчином натрій гідроксиду для забезпечення отримання сполуки формули 141 (b) реакція сполуки формули 141 із СН3Х, де X - галогенід, у присутності основи для забезпечення отримання сполуки формули 142 (c) реакція сполуки формули 142 з аніліном, що має формулу у присутності амідної основи для забезпечення отримання сполуки формули 143 (d) необов'язково гідролізування сполуки формули 143 для забезпечення отримання сполуки формули 144 та (e) реакція сполуки формули 143 або 144 із R3NH2, де R3 є таким, як визначено у формулі V, у 93678 42 присутності реагенту сполучення або амідної основи, для забезпечення отримання вказаної сполуки формули V. В одному втіленні вищезазначених способів, засобом сполучення є 1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлорид, 1гідроксибензотриазол-6-сульфонамідометил гідрохлорид, або бензотриазол-1-ілокситрипіролідинофосфоній гексафлуорфосфат. У наступному аспекті заявлений винахід стосується способу застосування сполуки цього винаходу як медикаменту для лікування хвороб або медичних станів, опосередкованих МЕК. Наприклад, цей винахід стосується сполуки цього винаходу як медикаменту для лікування гіперпроліферативного розладу або запального стану у ссавця, що полягає у призначенні вказаному ссавцю одної або більше сполуки заявленого винаходу або її фармацевтично прийнятної солі або проліків у кількості, ефективній для лікування вказаного гіперпроліферативного розладу. У ще одному аспекті цей винахід стосується сполуки цього винаходу у виробництві медикаменту для лікування гіперпроліферативного розладу або запального стану. У наступному аспекті заявлений винахід стосується способу продукування МЕК-інгібіторної дії у теплокровної тварини, як-то людини, яка має необхідність у такому лікуванні, котрий полягає у призначенні вказаній тварині ефективної кількості сполуки цього винаходу. У наступному аспекті заявлений винахід стосується лікування або попередження МЕКопосередкованого стану, що полягає у призначенні людині або тварині, яка має необхідність у цьому, фармацевтичної композиції, що містить сполуку заявленого винаходу або її фармацевтично прийнятну сіль або in vivo здатні до розщеплення проліки у кількості, ефективній для лікування або попередження вказаного МЕК-опосередкованого стану. Винахід також стосується фармацевтичної композиції, що інгібує МЕК, що містить ефективну кількість сполуки, вибраної згідно із заявленим винаходом, або її фармацевтично прийнятних проліків, фармацевтично активних метаболітів, або фармацевтично прийнятних солей. Винахід також стосується фармацевтичної композиції для лікування гіперпроліферативного розладу у ссавця, котра містить терапевтично ефективну кількість сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату, та фармацевтично прийнятний носій. В одному втіленні вказана фармацевтична композиція є призначеною для лікування раку, як-то раку мозку, раку легень, сквамозних клітин, раку сечового міхура, раку шлунку, раку підшлункової залози, раку молочних залоз, раку голови, раку шиї, раку нирок, ренального раку, раку яєчнику, раку простати, раку ободової та прямої кишки, раку стравоходу, раку яєчок, гінекологічного раку або раку щитовидної залози. У ще одному втіленні вказана фармацевтична композиція є призначеною для лікування незлоякісного гіперпроліферативного розладу, як-то доброякісна гіперплазія шкіри (наприклад, псоріаз), рестеноз, або простати 43 (наприклад, доброякісна простатична гіпертрофія (ВРН)). Винахід також стосується фармацевтичної композиції для лікування панкреатиту або хвороби нирок (охоплюючи проліферативний гломерулонефрит та індуковану діабетом хворобу нирок) або лікування болю у ссавця, котра містить терапевтично ефективну кількість сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату, та фармацевтично прийнятний носій. Винахід також стосується фармацевтичної композиції для попередження бластоцитної імплантації у ссавця, котра містить терапевтично ефективну кількість сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату, та фармацевтично прийнятний носій. Винахід також стосується фармацевтичної композиції для лікування хвороби, спорідненої з утворенням та розвитком судин або ангіогенез у ссавця, котра містить терапевтично ефективну кількість сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату, та фармацевтично прийнятний носій. В одному втіленні вказана фармацевтична композиція є призначеною для лікування хвороби, вибраної з групи, що складається з пухлинного ангіогенезу, хронічної запальної хвороби або іншого запального стану, як-то ревматоїдний артрит, атеросклероз, запальна хвороба кишечнику, хвороби шкіри, як-то псоріаз, екзема, та склеродерма, діабет, діабетична ретинопатія, ретинопатія недоношених, пов'язана з віком дегенерація жовтої плями, гемангіома, гліома, меланома, саркома Капоші та саркома яєчнику, молочних залоз, легень, підшлункової залози, простати, ободової кишки та епідермоїдного раку. Винахід також стосується способу лікування гіперпроліферативного розладу у ссавця, що полягає у призначенні вказаному ссавцю терапевтично ефективної кількості сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату. В одному втіленні вказаний спосіб стосується лікування раку, як-то раку мозку, раку легень, сквамозних клітин, раку сечового міхура, раку шлунку, раку підшлункової залози, раку молочних залоз, раку голови, раку шиї, раку нирок, ренального раку, раку яєчнику, раку простати, раку ободової та прямої кишки, раку стравоходу, раку яєчок, гінекологічного раку або раку щитовидної залози. У ще одному втіленні вказана фармацевтична композиція є призначеною для лікування незлоякісного гіперпроліферативного розладу, якто доброякісна гіперплазія шкіри (наприклад, псоріаз), рестеноз, або простати (наприклад, доброякісна простатична гіпертрофія (ΒΡΗ)). Винахід також стосується способу лікування гіперпроліферативного розладу у ссавця, що полягає у призначенні вказаному ссавцю терапевтично ефективної кількості сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату, у комбінації з антипухлинним засобом, вибраним з групи, що складається з мітотичних інгібіторів, засобів алкілування, антиметаболітів, інтеркаляційних антибіотиків, інгібіторів факторів 93678 44 росту, інгібіторів клітинного циклу, інгібіторів ферментів, інгібіторів топоізомерази, засобів модифікування біологічних реакцій, антигормонів, інгібіторів ангіогенезу, та антіандрогенів. Винахід також стосується способу лікування панкреатиту або хвороби нирок у ссавця, який полягає у призначенні вказаному ссавцю терапевтично ефективної кількості сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату. Винахід також стосується способу попередження бластоцитної імплантації у ссавця, який полягає у призначенні вказаному ссавцю терапевтично ефективної кількості сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату. Винахід також стосується способу лікування хвороби, спорідненої з утворенням та розвитком судин або ангіогенезому ссавця, який полягає у призначенні вказаному ссавцю терапевтично ефективної кількості сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату. В одному втіленні вказаний спосіб є призначеним для лікування хвороби, вибраної з групи, що складається з пухлинного ангіогенезу, хронічної запальної хвороби, як-то ревматоїдний артрит, атеросклероз, запальна хвороба кишечнику, хвороби шкіри, як-то псоріаз, екзема, та склеродерма, діабет, діабетична ретинопатія, ретинопатія недоношених, пов'язана з віком дегенерація жовтої плями, гемангіома, гліома, меланом, саркома Капоші та саркома яєчнику, молочних залоз, легень, підшлункової залози, простати, ободової кишки та епідермоїдного раку. Винахід також стосується фармацевтичної композиції для лікування хвороби або стану, споріднених із запальною хворобою, автоімунною хворобою, деструктивними кістковими розладами, проліферативними розладами, інфекційною хворобою, вірусною хворобою, фібротичною хворобою або нейродегенеративною хворобою у ссавця, котра містить терапевтично ефективну кількість сполуки заявленого винаходу, або її фармацевтично прийнятних солі, проліків або гідрату, та фармацевтично прийнятний носій. Приклади вищезгаданих хвороб та/або станів охоплюють але без обмеження, ревматоїдний артрит, атеросклероз, запальну хворобу кишечнику, хвороби шкіри, як-то псоріаз, екзема, та склеродерма, діабет та діабетичні ускладнення, діабетичну ретинопатію, ретинопатію недоношених, пов'язану з віком дегенерацію жовтої плями, гемангіому, хронічну обструктивну хворобу легень, ідіопатичний легеневий фіброз, алергічні реакції, охоплюючи астму, алергічний риніт та атопічний дерматит, хворобу нирок та ниркову недостатність, полікістозну хворобу нирок, гострий коронарний синдром, застійну серцеву недостатністьа, остеоартрит, нейрофіброматоз, відторгнення трансплантату органу, кахексію та біль. Крім того запропонованою є сполука заявленого винаходу для застосування як медикаменту у лікуванні хвороб та станів, описаних вище, у теплокровної тварини, переважно ссавця, більш переважно людини, яка потерпає від такого розладу. 45 Також запропонованим є застосування сполуки заявленого винаходу в отриманні медикаменту для лікування хвороб та станів, описаних вище, у теплокровної тварини, переважно ссавця, більш переважно людини, яка потерпає від такого розладу. Пацієнти, яких можна лікувати сполуками заявленого винаходу, або фармацевтично прийнятними солями, проліками та гідратами вказаних сполук, способами цього винаходу охоплюють, наприклад, пацієнтів, що є діагнозованими як такі, що мають псоріаз, рестеноз, атеросклероз, доброякісну гіпертрофію простати, рак легень, рак кісток, CMML, рак підшлункової залози, рак шкіри, рак голови та шиї, меланому шкіри або внутрішньоочну меланому, рак матки, рак яєчнику, ректальний рак, рак анального регіону, рак шлунка, рак ободової кишки, рак молочних залоз, рак яєчок, гінекологічні пухлини (наприклад, саркоми матки, карциному фалопієвих труб, карциному ендометрію, карциному шийки матки, карциному вагіни або карциному вульви), хворобу Ходжкіна, рак стравоходу, рак тонкого кишечнику, рак ендокринної системи (наприклад, рак щитовидної залози, паращитовидної залози або надниркової залози), саркоми м'яких тканин, рак сечівнику, рак пеніса, рак простати, хронічну або гостру лейкемію, тверді пухлини дитячого віку, лімфоцитні лімфоми, рак сечового міхура, рак нирок або уретри (наприклад, карцинома клітин нирок, карцинома ниркової миски), або неоплазми центральної нервової системи (наприклад, первинна лімфома центральної нервової системи, пухлини хребетного стовпа, гліоми стовбуру мозку або гіпофізарні аденоми). Цей винахід також стосується фармацевтичної композиції для інгібування аномального росту клітин у ссавця, котра містить певну кількість сполуки заявленого винаходу, або її фармацевтично прийнятної солі або сольвату або проліків, у комбінації з кількістю хіміотерапевтичного засобу, де кількості сполуки, солі, сольвату, або проліків, та хіміотерапевтичного засобу є разом ефективними в інгібуванні аномального росту клітин. Багато хіміотерапевтичних засобів є зараз відомими у попередньому рівні техніки. В одному втіленні хіміотерапевтичний засіб є вибраним з групи, що складається з мітотичних інгібіторів, засобів алкілування, антиметаболітів, інтеркаляційних антибіотиків, інгібіторів факторів росту, інгібіторів клітинного циклу, ферментів, інгібіторів топоізомерази, засобів модифікування біологічних реакцій, антигормонів, інгібіторів ангіогенезу, та антіандрогенів. У наступному аспекті заявлений винахід стосується фармацевтичних композицій, що інгібують МЕК, які містять одну або більше сполук заявленого винаходу. Заявлений винахід крім того стосується способу інгібування аномального росту клітин у ссавця або лікування гіперпроліферативного розладу, цей спосіб полягає у призначенні ссавцю певної кількості сполуки заявленого винаходу, або її фармацевтично прийнятних солі або сольвату, або проліків, у комбінації з радіаційною терапією, де кількості сполуки, її солі або сольвату, або проліків, у комбінації з радіаційною терапією є ефектив 93678 46 ними у інгібуванні аномального росту клітин або лікуванні гіперпроліферативного розладу у ссавця. Способи радіаційної терапії відомі у попередньому рівні техніки, та ці способи можна застосовувати у комбінаційній терапії, описаній тут. Способи застосування сполуки винаходу у цій комбінаційній терапії можуть бути визначеними, як описано тут. Можна вважати, що сполуки заявленого винаходу можуть робити аномальні клітини більш чутливими до радіаційного лікування для призначення припинення та/або інгібування росту таких клітин. Відповідно, заявлений винахід крім того стосується способу сенсибілізації аномальних клітин у ссавця стосовно радіаційного лікування, котрий полягає у призначенні ссавцю певної кількості сполуки заявленого винаходу або її фармацевтично прийнятної солі або сольвату, або проліків, причому ця кількість є ефективною стосовно сенсибілізування аномальних клітин стосовно радіаційного лікування. Кількість сполуки, солі, або сольвату у цьому спосіб може бути визначеною згідно зі способами визначення ефективної кількості таких сполук, описаними тут. Патентоздатні сполуки можна також застосовувати переважно у комбінації з іншими відомими терапевтичними засобами. Наприклад, винахід також стосується способу та фармацевтичної композиції для інгібування аномального росту клітин у ссавця, котра містить певну кількість сполуки заявленого винаходу, або фармацевтично її прийнятних солі або сольвату, її проліки, або мічених ізотопами її похідних, та кількість одної або більше речовин, вибраних від антиангіогенезних засобів, інгібіторів трансдукції сигналу, та антипроліферативних засобів. Антиангіогенезні засоби, як-то інгібітори ММР2 (матриксної металопротеїнази 2), ММР-9 (матриксної металопротеїнази 9), та інгібітори СОХ-ІІ (циклооксигенази II), можна застосовувати у сполученні зі сполукою заявленого винаходу та її фармацевтичними композиціями, описаними тут. Приклади корисних інгібіторів СОХ-ІІ охоплюють CELEBREX (алекоксиб), вальдекоксиб, та рофекоксиб. Приклади корисних інгібіторів матриксної металопротеїнази описані у WO 96/33172, WO 96/27583, ЕР 818442, ЕР 1004578, WO 98/07697, WO 98/03516, WO 98/34918, WO 98/34915, WO 98/33768, WO 98/30566, ЕР 606,046, ЕР 931,788, WO 90/05719, WO 99/52910, WO 99/52889, WO 99/29667, WO 99/07675, ЕР 945864, патенті США № 5,863,949, патенті США № 5,861,510, та ЕР 780,386, усі які уведені тут як посилання у їх цілісності. Кращі інгібітори ММР-2 та ММР-9 є тими, що мають малу активність стосовно інгібування ММР1або не мають такої активності. Більш кращі є тими, що селективно інгібують ММР-2 та/або ММР-9 порівняно з іншими матриксними металопротеїназами (тобто, ММР-1, ММР-3, ММР-4, ММР-5, ММР6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12, та ММР-13). Терміни "аномальний ріст клітин" та "гіперпроліферативний розлад" застосовані поперемінно у цій заявці на патент. "Аномальний ріст клітин", як застосовувано тут, якщо не вказане інше, стосується росту клітин, 47 що є незалежним від нормальних регуляторних механізмів (наприклад, втрати контактного інгібування). Це охоплює, наприклад, аномальний ріст: (1) клітин пухлин (пухлин), що проліферуються експресуванням мутованої тирозин-кінази або надекспресією рецептору тирозин-кінази; (2) доброякісних та злоякісних клітин при інших проліферативних хворобах, у котрих відбувається відхилена від норми активація тирозин-кінази; (3) будь-яких пухлин, що проліферуються рецептором тирозинкінази; (4) будь-яких пухлин, що проліферуються внаслідок відхиленої від норми активації серин/тирозин-кінази; та (5) доброякісних та злоякісних клітин при інших проліферативних хворобах, у котрих відбувається відхилена від норми активація серин/тирозин-кінази. Термін "лікування", як застосовувано тут, якщо не вказане інше, означає реверсування, полегшення, інгібування прогресування або попередження розладу або стану, до котрих застосовувано такий термін, або одного або більше симптомів такого розладу або стану. Термін "лікування", як застосовувано тут, якщо не вказане інше, стосується ефекту лікування, це "лікування" визначене безпосередньо вище. Кількість наданого засобу, що відповідатиме такій кількості, повинна варіювати залежно від таких факторів, як конкретна сполука, стан хвороби та його суворість, ідентичність (наприклад, маса) ссавця, який потребує лікування, але може, незважаючи на це, бути легко визначеною спеціалістом. "Лікування" використано для позначення принаймні пом'якшення наслідків стану хвороби у ссавця, як-то людини, яка є ураженою, принаймні частково, внаслідок активності МЕК, та охоплює, але без обмеження, попередження стану хвороби у ссавця, особливо, коли ссавець є виявлений як схильний до того, щоб мати стан хвороби, але який ще не діагнозований як такий, що вже уражений хворобою; модулювання та/або інгібування стану хвороби; та/або полегшення стану хвороби. Для застосування сполуки заявленого винаходу або її фармацевтично прийнятної солі або проліків, для терапевтичного лікування (охоплюючи профілактичне лікування) ссавців, охоплюючи людей, її звичайно формують згідно зі стандартною фармацевтичною практикою як фармацевтичну композицію. Згідно з цим аспектом винаходу запропоновано фармацевтичну композицію, що містить сполуку заявленого винаходу, або її фармацевтично прийнятні сіль або проліки, які визначено тут раніше, в асоціації з фармацевтично прийнятним розріджувачем або носієм. Для отримання фармацевтичної композиції згідно з одним втіленням цього винаходу, терапевтично або профілактично ефективну кількість сполуки заявленого винаходу або її фармацевтично прийнятної солі, сольвату, метаболіту або проліків (поодинці або разом із додатковим терапевтичним засобом) тісно перемішують з фармацевтично прийнятним носієм згідно зі звичайними способами отримання дози фармацевтичної сполуки. Носій може мати широку різноманітність форм залежно від форми отримання, потрібної для застосування, наприклад, перорального або паре 93678 48 нтерального. Приклади придатних носіїв охоплюють будь-які та усі розчинники, дисперсійні середовища, ад'юванти, покриття, антибактеріальні та антигрибкові засоби, засоби регулювання ізотонічності та засоби затримки поглинання, засоби для підсолоджування, стабілізатори (для сприяння довготерміновому зберіганню), емульгувальні засоби, зв'язувальні засоби, засоби для загущення, солі, консерванти, розчинники, дисперсійні середовища, покриття, антибактеріальн та антигрибкові засоби, засоби регулювання ізотонічності та засоби затримки поглинання, засоби для поліпшення смаку, та різноманітні матеріали, як-то буфери та абсорбенти, що можуть бути необхідними для отримання конкретної терапевтичної композиції. Застосування таких середовищ та засобів з фармацевтично активними речовинами є добре відомим у попередньому рівні техніки. За винятком деякою мірою того, що розглянуто їх застосування у терапевтичних композиціях та препаратах, якщо будь-які звичайні середовища або засоби є несумісними зі сполукою заявленого винаходу. Додаткові активні інгредієнти можуть також бути уведеними у композиції та препарати, які описано тут. Композиції винаходу можуть бути у формі, придатній для перорального застосування (наприклад, як таблетки, капсули, м'які або тверді капсули, водні або олійні суспензії, емульсії, придатні для дисперсії порошків або гранул, сиропи або еліксири), для локального застосування (наприклад, як креми, мазі, гелі, або водні або олійні розчини або суспензії), для застосування інгаляціями (наприклад, як мілко подрібнений порошок або рідкий аерозоль), для застосування за допомогою вдування (наприклад, як мілко подрібнений порошок) або для парентерального застосування (наприклад, як стерильні водні або олійні розчини для внутрішньовенного, підшкірного, або внутрішньом'язового дозування, або як супозиторії для ректального дозування). Наприклад, композиції, призначені для перорального застосування можуть містити, наприклад, один або більше забарвлювальних засобів, засобів для підсолоджування, засобів для поліпшення смаку та/або консервантів. Придатні фармацевтично прийнятні наповнювачі для композиції таблеток охоплюють, наприклад, інертні розріджувачі, як-то лактоза, натрій карбонат, кальцій фосфат або кальцій карбонат, гранулювальні засоби та засоби для розкладання, як-то кукурудзяний крохмаль або альгінова кислота; зв'язувальні засоби, як-то крохмаль; мастильні засоби, як-то магній стеарат, стеаринова кислота або тальк; консерванти, як-то етил- або пропіл-пгідроксибензоат, та антіоксиданти, як-то аскорбінова кислота. Композиції таблеток можуть бути непокритими або покритими чи для модифікування їх розкладання та наступного поглинання активного інгредієнту у межах шлунково-кишкового тракту, або для поліпшення їх стабільності та/або зовнішнього вигляду, у або продукти конденсації етиленоксиду з довголанцюговими аліфатичними спиртами, наприклад, гептадекаетиленоксицетанолом, або продукти конденсації етиленоксиду з частковими естерами, похідними від жирних кислот та гекситолу, як-то поліоксіетилен-сорбітол 49 моноолеат, або продукти конденсації етиленоксиду з частковими естерами, похідними від жирних кислот та ангідридів гекситолу, наприклад, поліетилен-сорбітан-моноолеат. Водні суспензії можуть також містити один або більше консервантів (як-то етил- або пропіл-п-гідроксибензоат), антіоксиданти (як-то аскорбінова кислота), забарвлювальні засоби, засоби для поліпшення смаку, та/або засоби для підсолоджування (як-то сахароза, сахарин або аспартам). Олійні суспензії можуть бути сформованими за допомогою суспендувально активного інгредієнту у рослинній олії (як-то арахісова олія, оливкова олія, кунжутна олія або кокосова олія) або у мінеральній оливі (як-то рідкий парафін). Олійні суспензії можуть також містити засіб для загущення, як-то бджолиний віск, твердий парафін або цетиловий спирт. Засоби для підсолоджування, як-то ті, що перелічені вище, та засоби для поліпшення смаку можуть бути доданими для забезпечення приємного на смак перорального препарату. Ці композиції можуть бути консервованими додаванням антіоксиданту, як-то аскорбінова кислота. Придатні для дисперсії порошки та гранули, придатні для отримання водної суспензії додаванням води, загалом містять активний інгредієнт разом із диспергувальним або зволожувальним засобом, суспендувальним засобом та одним або більше консервантами. Придатні диспергувальні або зволожувальні засоби та суспендувальні засоби є представленими тими, що вже згадані вище. Додаткові наповнювачі, як-то засоби для підсолоджування, засоби для поліпшення смаку та забарвлювальні засоби, можуть бути присутніми також. Фармацевтичні композиції винаходу можуть також бути у формі емульсій олива-у-воді. Оливною фазою може бути рослинна олія, як-то оливкова олія або арахісова олія, або мінеральна олива, як-то, наприклад, рідкий парафін, або суміш будь-чого з цього. Придатними емульгувальними засобами можуть бути, наприклад, існуючі у природі камеді, як-то камедь гуміарабіку або камедь трагаканту, існуючі у природі фосфатиди, як-то фосфатиди бобів сої, лецитин, естери або часткові естери, похідні від жирних кислот та гекситолангідридів (наприклад, сорбітан моноолеату) та продукти конденсації вказаних часткових естерів з етиленоксидом, як-то поліоксіетилен-сорбітанмоноолеат. Емульсії можуть також містити засоби для підсолоджування, засоби для поліпшення смаку та консерванти. Сиропи та еліксири можуть бути сформованими із засобами для підсолоджування, як-то гліцерин, пропіленгліколь, сорбітол, аспартам або сахароза, та можуть також містити заспокійливий засіб, консервант, засіб для поліпшення смаку та/або забарвлювальний засіб. Фармацевтичні композиції можуть також бути у формі стерильних придатних для ін'єкції водних або оливних суспензій, котрі можуть бути сформованими згідно з відомими процедурами, застосовуючи один або більше прийнятних диспергувальних або зволожувальних засобів та суспендувальних засобів, котрі було згадано вище. 93678 50 Стерильним придатним для ін'єкції препаратом може також бути стерильний придатний для ін'єкції розчин або суспензія у нетоксичному парентерально-прийнятному розріджувачі або розчиннику, наприклад, розчин у 1,3-бутандіолі. Композиції супозиторіїв можуть бути отриманими змішуванням активного інгредієнту із придатним неподразнювальним наповнювачем, котрий є твердим при звичайних температурах але рідким при ректальній температурі та повинен внаслідок цього плавитися у прямій кишці з вивільненням ліків. Придатні наповнювачі охоплюють, наприклад, масло какао та поліетиленгліколі. Локальні композиції, як-то креми, мазі, гелі та водні або олійні розчини або суспензії, можуть загалом бути отриманими за допомогою формування активного інгредієнту зі звичайним, локально прийнятним середовищем або розріджувачем, застосовуючи звичайні процедури, добре відомі у попередньому рівні техніки. Композиції для застосування за допомогою вдування можуть бути у формі мілко подрібненого порошку, що містить частинки середнього діаметру, наприклад, 30 мкм або набагато менше, порошок сам по собі є таким, що містить тільки активний інгредієнт, або є розбавленим одним або більше фізіологічно прийнятними носіями, як-то лактозою. Порошок для вдування тоді зручно зберігати у капсулах, що містять, наприклад, 1-50 мг активного інгредієнту для застосування з турбоінгаляторним пристроєм, як-то застосовуваним для вдування відомого засобу натрій хромоглікату. Композиції для застосування інгаляціями можуть бути у формі звичайного герметизованого аерозолю під тиском, пристосованого для розпилення активного інгредієнту як аерозолю, що містить мілко подрібнений твердий матеріал або рідкі крапельки. Звичайні аерозольні пропеленти, як-то летючі вуглеводні або флуоровані вуглеводні, можна застосовувати та аерозольний пристрій можна зручно пристосувати для розпилення дозованої кількості активного інгредієнту. Стосовно додаткової інформації про композиції, дивись Chapter 25,2 in Volume 5 of Comprehensive Medicinal Chemistry (Corwin Hansch; Chairman of Editorial Board), Pergamon Press 1990, котре спеціально уведено тут як посилання. Кількість сполуки цього винаходу, що є комбінованою з одним або більше наповнювачами, щоб отримати одиничну дозовану форму, повинна обов'язково варіювати залежно від лікованої особини, суворості розладу або стану, частоти застосування, характеру сполуки та вибору та досвіду лікаря. Однак, ефективне дозування знаходиться у межах приблизно від 0,001 до приблизно 100 мг на кг маси тіла на добу, переважно приблизно 1 мг/кг/добу до приблизно 35 мг/кг/добу у одиничній або поділеній дозах. Для людини масою 70 кг це може бути кількістю приблизно 0,07 г/добу - 2,45 г/добу, переважно приблизно 0,05 г/добу - приблизно 1,0 г/добу. У деяких обставинах рівні дозування нижче нижчого обмеження вищезазначених меж можуть бути більш адекватними, тоді, як в інших випадках ще більші дози можуть бути засто 51 совуваними без виклику будь-якої шкідливої побічної дії, за умови, що такі більші дози спершу є поділеними на кілька невеликих доз для застосування протягом усієї доби. Стосовно додаткової інформації про шляхи застосування та режими дозування, дивись Chapter 25,3 in Volume 5 of Comprehensive Medicinal Chemistry (Corwin Hansch; Chairman of Editorial Board), Pergamon Press 1990, котре спеціально уведено тут як посилання. Розмір дози для терапевтичного або профілактичного призначення сполуки заявленого винаходу повинен, природно, варіювати залежно від природи та суворості станів, віку та статі тварини або пацієнта та шляху застосування, згідно з добре відомими основами медицини. Сполуки цього винаходу можна застосовувати поодинці або у комбінації з іншими ліками та способами терапії, застосовуваними у лікуванні станів хвороб, котрі могли б мати корисність від інгібування МЕК. Таке лікування може охоплювати, на додаток до сполуки винаходу, звичайні хірургічне втручання або радіаційну терапію чи хіміотерапію. У такій хіміотерапії можуть бути застосовуваними одне або більше з наступних категорій антипухлинних засобів: (і) антипроліферативні/антинеопластичні ліки та їх комбінації, які застосовувано у медичній онкології, як-то засоби алкілування (наприклад, цисплатин, оксаліплатин, карбоплатин, циклофосфамід, нітроген-іприт, мелфалан, хлорамбуцил, бусульфан, темозоламід та нітрозосечовини); антиметаболіти (наприклад, гемцитабін, антифолати, як-то флуорпіримідини типу 5-флуорурацилу та тегафуру, ралтитрексед, метотрексат, цитозин арабінозид, гідроксисечовина, або один з кращих антиметаболітів, розкритих у європейській заявці на патент № 239362, як-то N-(5-[N-(3,4-дигідро-2метил-4-оксохіназолін-6-ілметил)-N-метиламіно]-2теноїл)-L-глутамінова кислота); антипухлинні антибіотики (наприклад, антрацикліни типу адріаміцину, блеоміцину, доксорубіцину, дауноміцину, епірубіцину, ідарубіцину, мітоміцину-С, дактиноміцину та мітраміцину); антимітотичні засоби (наприклад, алкалоїди вінка типу вінкристин, вінбластин, віндезин та вінорелбін та таксоїди типу таксолу та таксотеру та інгібітори полокінази); та інгібіторів топоізомерази (наприклад, епіподофілотоксини типу ептопозид та теніпозид, амсакрин, топотекан та кампотецин); (іі) цитостатичні засоби, як-то антіестрогени (наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен та йодоксифен), даун-регулятори рецептору естрогену (наприклад, фулвесиратрант) антіандрогени (наприклад, бікалутамід, флутамід, нілутамід, ципроксерон ацетат та Casodex (4'ціано-3-(4-флуорфенілсульфоніл)-2-гідрокси-2метил-3'-(трифлуорметил)пропіонанілід)), антагоністи LHRH або агоністи LHRH (наприклад, госерелін, лейпорелін та бусерелін), прогестогени (наприклад, мегестрол ацетат), інгібітори ароматази (наприклад, азанастрозол, летрозол, воразол та екземестан) та інгібітори 5-редуктази, як-то фінастерид; 93678 52 (ііі) антиінвазивні засоби (наприклад, інгібітори родин c-Src-кіназ та інгібітори металопротеїнази типу маримастату, та інгібітори функції рецептору активатору урокіназного плазміногену або антитіла до гепаранази); (iv) інгібітори функції факторів росту типу фактору росту антитіл, рецептору фактору росту антитіл (наприклад, антитіл антиerbB2 трастумузаб [Herceptin], антитіл антиEGFR панітумумаб та антитіл антиerbB1 цетуксимаб [Erbitux C225]), та будь-якого фактору росту або рецептору фактору росту антитіл, розкритих у Stern et al. Critical Reviews у Oncology/Haematology, 2005, vol. 54, pp. 11-29): такі інгібітори охоплюють інгібітори тирозин-кінази (наприклад, інгібітори родини тирозинкіназ епідермального фактору росту, як-то N-(3хлор-4-флуорфеніл)-7-метокси-6-(3морфолінопропокси)хіназолін-4-амін (гефітиніб, AZD1839), N-(3-етинілфеніл)-6,7-біс(2метоксіетокси)хіназолін-4-амін (ерлотиніб, OSI774) та 6-акриламщо-N-(3-хлор-4-флуорфеніл)-7(3-морфолінопропокси)хіназолін-4-амін (СІ 1033)), інгібітори тирозин-кінази erbB2, як-то лапатиніб, інгібітори родини факторів росту гепатоцитів, інгібітори похідної від тромбоцитів родини факторів росту, як-то іматиніб, інгібітори серин/треонінкінази (наприклад, інгібітори передачі сигналу Ras/Raf, як-то інгібітори фарнезил-трансферази, наприклад, сорафеніб (BAY 43-9006)), інгібітори передачі сигналу у клітинах за допомогою кіназ МЕК та/або АКТ, інгібітори родини факторів росту гепатоцитів, інгібітори с-комплекту, інгібітори кінази abl, інгібітори кінази рецептору IGF (інсуліноподібного фактору росту); інгібітори кінази aurora (наприклад, AZD1152, РН739358, VX-680, MLN8054, R763, МР235, МР529, VX-528 ТА АХ39459) та інгібітори циклін-залежної кінази, як-то інгібітори CDK2 та/або CDK4; (ν) антиангіогенні засоби, як-то ті, котрі інгібують дію судинного ендотеліального фактору росту (наприклад, антитіло проти судинного ендотеліального фактору росту бевацизумаб [Avastin], та інгібітори тирозин-кінази рецептору VEGF, як-то 4(4-бром-2-флуораніліно)-6-метокси-7-(1метилпіперидин-4-ілметокси)хіназолін (ZD6474; Приклад 2 у WO 01/32651), 4-(4-флуор-2метиліндол-5-ілокси)-6-метокси-7-(3-піролідин-1ілпропокси)хіназолін (AZD2171; Приклад 240 у WO 00/47212), ваталаніб (РТК787; WO 98/35985) та SU11248 (сунітиніб; WO 01/60814), сполуки, як-то ті, що розкриті у публікації РСТ №№ WO 97/22596, WO 97/30035, WO 97/32856, та WO 98/13354) та сполуки, що діють за допомогою інших механізмів (наприклад, ліномід, інгібітори функції інтегрину ν3, інгібітори ММР, інгібітори СОХ-2 та ангіостатин); (vi) засоби пошкодження судин, як-то комбретастатин А4 та сполуки, розкриті у публікації РСТ №№ WO 99/02166, WO 0/40529, WO 00/41669, WO 01/92224, WO 02/04434, та WO 02/08213; (vii) антисмислові терапії (наприклад, ті, котрі є спрямованими на цілі, перераховані вище, як-то ISIS 2503, та антисмисловий антирас); (viii) підходи генної терапії, охоплюючи, наприклад, GVAX, підходи для заміни відхилених від 53 норми генів, як-то відхиленого від норми р53 або відхиленого від норми BRCA1 або BRCA2, GDEPT (ген-спрямована терапія проліками ферментів) підходи, як-то ті, де застосовують цитозиндеаміназу, тимідин-кіназу або бактеріальний фермент нітроредуктаза, та підходи для збільшення толерантності пацієнта до хіміотерапії або радіаційної терапії, як-то генна терапія при резистентності до багатьох ліків; (іх) інтерферон; та (х) підходи імунотерапії, охоплюючи, наприклад, підходи ex-vivo та in vivo стосовно збільшення імуногенності клітин пухлин пацієнта, як-то трансфекція цитокінами, як-то інтерлейкін 2, інтерлейкін 4 або колоніестимулювальний фактор гранулоцитів-макрофагів, підходи для зменшення анергії Т-клітин, підходи, застосовуючи трансфектовані імунні клітини, як-то цитокін-трансфектовані дендритні клітини, підходи, застосовуючи цитокінтрансфектовані лінії клітин пухлин та підходи, застосовуючи антиідіотипові антитіла. Такого консолідованого лікування можна досягти шляхом одночасного, послідовного або окремого дозування індивідуальних компонентів лікування. Такі комбіновані продукти мають сполуки цього винаходу у межах доз, описаних тут раніше та іншого фармацевтично активного засобу у межах його рекомендованих доз. Згідно з цим аспектом винаходу запропоновано фармацевтичний продукт, що містить сполуку заявленого винаходу, яку визначено тут, та додатковий антипухлинний засіб, що визначено тут раніше, для консолідованого лікування раку. Хоча сполуки заявленого винаходу є перш за все важливими як терапевтичні засоби для застосування у теплокровної тварини (охоплюючи людину), вони є також корисними, в усякому випадку, коли вони є потрібними для інгібування дії МЕК. Таким чином, вони є корисними, як фармакологічні стандарти для застосування у розроблюванні нових біологічних тестів та у дослідженні стосовно нових фармакологічних засобів. Репрезентативні сполуки заявленого винаходу, котрі є охопленими заявленим винаходом, стосуються, але без обмеження, сполук прикладів та їх фармацевтично прийнятних кислотно-адитивних або основно-адитивних солей або проліки. Приклади, представлені нижче, задумані для ілюстрації конкретного втілення винаходу, та не обмежують рамок опису або формули винаходу будь-яким шляхом. Розкриття у цій заявці на патент усіх публікацій та посилань, охоплюючи патенти, уведені тут як довідки. У ще одному втіленні винаходу, запропоновано предмет виробництва, або "комплект", що містить матеріали, корисні для лікування розладів, описаних вище. В одному втіленні комплект містить контейнер, що містить сполуку заявленого винаходу або її композицію. Комплект може також містити етикетку або вставку в упаковку контейнера або поєднану з контейнером. Термін "вставка в упаковку" стосується інструкції, звичайно уведеної у комерційні упаковки терапевтичних продуктів, що містять інформацію стосовно показань, викорис 93678 54 тання, дозування, застосування, протипоказань та/або попереджень стосовно застосування таких терапевтичних продуктів. Придатні контейнери охоплюють, наприклад, пляшки, пляшечки, шприци, блістерні упаковки, тощо. Контейнер може бути утвореним з великої різноманітності матеріалів, як-то скло або пластик. Контейнер утримує сполуку заявленого винаходу або її композицію, котра є ефективною для лікування стану, та може мати стерильний впускний отвір (наприклад, контейнер може бути балоном або пляшечкою з внутрішньовенним розчином, що має придатний для протикання за допомогою підшкірної ін'єкційної голки корок). Етикетка або вставка в упаковку може свідчити, що композицію переважно застосовують для лікування такого стану, як рак. В одному втіленні етикетка або вставка в упаковку свідчить, що сполуку заявленого винаходу або її композицію можна застосовувати для лікування хвороби або медичного стану, опосередкованих МЕК. На додаток, етикетка або вставка в упаковку може вказувати, що пацієнт, якого треба лікувати, є тим, що має хворобу або медичний стан, опосередкований МЕК, як-то гіперпроліферативний розлад або запальний стан. Етикетка або вставка в упаковку може також свідчити, що композицію можна застосовувати для лікування інших розладів. Альтернативно, або додатково, предмет виробництва може також містити другий контейнер, що містить фармацевтично прийнятний буфер, як-то бактеріостатична вода для ін'єкцій (BWFI), буферований фосфатом фізіологічний розчин, розчин Рингера та розчин декстрози. Це може крім того містити інші матеріали, бажані з комерційної точки зору та точки зору користувача, охоплюючи інші буфери, розріджувачі, фільтри, голки та шприци. У ще одному втіленні комплект може містити (а) перший контейнер зі сполукою заявленого винаходу або композицією, що там міститься; та необов'язково (b) другий контейнер з другою фармацевтичною композицією, що там міститься, де друга фармацевтична композиція містить другу сполук з антигіперпроліферативною або антизапальною активністю. Альтернативно, або додатково, предмет виробництва може також містити третій контейнер, що містить фармацевтично прийнятний буфер, як-то бактеріостатична вода для ін'єкцій (BWFI), буферований фосфатом фізіологічний розчин, розчин Рингера та розчин декстрози. Це може крім того містити інші матеріали, бажані з комерційної точки зору та точки зору користувача, охоплюючи інші буфери, розріджувачі, фільтри, голки та шприци. Комплект може також містити інструкції для застосування сполуки заявленого винаходу або її композиції та, якщо вона присутня, другої фармацевтичної композиції. Наприклад, якщо комплект містить сполуку заявленого винаходу або її композицію ("перша композиція") та другу фармацевтичну композицію, комплект може також містити інструкції для одночасного, послідовного або окремого застосування першої та другої фармацевтичних композицій до пацієнта, який має необхідність у цьому. 55 У ще одному втіленні комплекти є придатними для поставляння твердої пероральної форми сполуки заявленого винаходу, як-то таблетки або капсули. Такий комплект переважно містить набір одиниць дозування. Такі комплекти можуть містити формуляр, що показує дозування, орієнтоване у порядку його призначеного застосування. Прикладом такого комплекту є "блістерна упаковка". Блістерні упаковки добре відомі у пакувальному виробництві та є широко застосованими для пакування фармацевтичних одиничних дозованих форм. Якщо потрібно, може бути запропонованою пам'ятка, наприклад, у формі чисел, літер, або інших позначок, або з календарною вставкою, що відзначує доби у режимі лікуванні, у рамках котрого може бути призначеним дозування. У деяких інших втіленнях, де комплект містить сполуку заявленого винаходу або її композицію, та другий терапевтичний засіб, комплект може містити контейнер для того, щоб вміщувати окремі компоненти, як-то поділені пляшки або поділені пакети з фольги, однак, окремі композиції можуть також бути вміщеними у межах одиничного, неподіленого контейнеру. Звичайно, комплект містить інструкції для застосування окремих компонентів. Комплект є особливо переважним, коли окремі компоненти є переважно застосовуваними у відмінній дозованій формі (наприклад, пероральній та парентеральній), є застосовуваними при відмінних інтервалах дозування, або коли є потрібним титрування індивідуальних компонентів комбінації ведучим лікарем. Біологічні дослідження Наступні дослідження можна застосовувати для вимірювання дії сполук заявленого винаходу, як МЕК-інгібіторів. Приклад А Дослідження ферменту МЕК (тест 1а) Активність сполук заявленого винаходу може бути визначеною наступною процедурою. Мічений на N-кінці 6 залишками His конститутивно активний МЕК-1 (2-393) експресують у Е. coli та білок очищають звичайними способами (Ahn et al., Science 1994, 265, 966-970). Активність МЕК1 визначають вимірюванням уведення -33Р-фосфату з -33Р-АТФ на мічений на N-кінці 6 залишками His ERК2, котрий експресують у Е. coli та очищають звичайними способами, у присутності МЕК-1. Дослідження проводять у 96-лунковому поліпропіленовому планшеті. Інкубування суміші (100 мкл), що містить 25 мМ Гепес, рН 7,4, 10 мМ МgСІ2, 5 мМ гліцеринфосфату, 100 мкМ Na-ортованадату, 5 мМ DTT, 5 нМ МЕК1, та 1 мкМ ERК2. Інгібітори суспендують у ДМСО, та усі реакції, охоплюючи контрольні, проводять при кінцевій концентрації 1% ДМСО. Реакції ініціюють додаванням 10 мкМ АТФ (із 0,5 мкКі -33Р-АТФ/лунку) та інкубують при температурі довкілля протягом 45 хвилин. Рівний об'єм 25% ТСА додають для зупинки реакції та осадження білків. Осаджені білки збирають на скловолоконних фільтр-планшетах В, та надлишок міченого АТФ промивають, застосовуючи збирач Tomtec МАСH III. Планшети піддають повітряній сушці перед додаванням 30 мкл/лунку Packard 93678 56 Microscint 20, та планшети підраховують, застосовуючи Packard TopCount. Приклад В Дослідження фосфорилування клітинного ERК 1/2 (тест 1b) Властивості сполуки винаходу стосовно інгібування МЕК 1/2 можуть бути визначеними наступним клітинним дослідженням in vitro. Інгібування базального фосфорилування ERК1/2 було визначено інкубуванням клітин зі сполукою протягом одної години та підрахунком флуоресцентного сигналу pERК на закріплених клітинах та нормалізуванням відносно сумарного сигналу ERК. Матеріали та Способи: клітини Malme-3М були отриманими від АТСС та їх вирощували у середовищі RPMI-1640, доповненому 10% розчином сироватки коров'ячого зародка. Клітини були розміщені у 96-лункових планшетах при 15000 клітин/лунку та їм давали приєднуватися протягом 1-2 годин. Розбавлені сполуки були тоді доданими при кінцевій концентрації 1% ДМСО. Через 1 годину, клітини були промитими фосфатно-сольовим буферним розчином та закріпленими у 3,7% формальдегіді у фосфатно-сольовому буферному розчині протягом 15 хвилин. Це потім промивали фосфатно-сольовим буферним розчином/0,2% Triton X-100 та просочували у 100% метанолі протягом 15 хвилин. Клітини були блокованими у блокувальному буфері Odyssey (LI-COR Biosciences) протягом принаймні 1 години. Антитіла до фосфорилованого ERК 1/2 (Cell Signaling #9106, моноклональні) та сумарний ERК 12 (Santa Cruz Biotechnology #sc-94, поліклональний) додавали до клітин та це було інкубовано протягом принаймні 1 години. Після промивання фосфатносольовим буферним розчином/0,2% TritonX-100, клітини були інкубовані з флуоресцентно-міченими вторинними антитілами (козячий антикролячий lgG-IRDye800, Rockland та козячий антимишачий IgG-Alexa Fluor 680, Molecular Probes) протягом ще години. Клітини були тоді промитими та аналізованими на флуоресценцію при обох довжинах хвиль, застосовуючи систему Odyssey Infrared Imaging System (LI-COR Biosciences). Сигнал фосфорилованого ERК було нормалізовано відносно сумарного сигналу ERК. Приклад С Дослідження розчинності у воді Термодинамічну розчинність сполук у воді вимірювали, застосовуючи модифікований спосіб струшування колби. Кристалічність кожної сполуки підтверджено, застосовуючи поляризувальний світловий мікроскоп (Olympus BX51). Для кожної тестованої сполуки приблизно 0,5 мг сухої сполуки було зважено у пляшечки, які було застосовувано для створення стандартних розчинів. Приблизно 0,5 мг було також зважено у кілька пляшечок для водних невідомих, одна пляшечка для кожного рН, величину якого було тестовано. Для кожної водної невідомої 0,5 мл водного буферу (10 мМ калій фосфат) при потрібному рН додавали до 0,5 мг сухої сполуки. (Для рН 1,2, було застосовувано 0,1 Η НСІ.) Вище концентраційне обмеження для цього дослідження було, таким чином, 1 мг/мл. Кожну водну невідому тоді 57 крутили при 350 обертів/хвилину при кімнатній температурі протягом 24 годин, щоб надати адекватний час для урівноваження. Після кручення, кінцевий рН кожного зразку було перевірено та підтверджено. Аліквоти були далі видаленими та їх фільтрували у ВЕРХ-пляшечки для аналізу. Вихідний розчин було отримано для кожної сполук розбавленням 0,5 мг сполуки у сумарному об'ємі 1 мл метанол для вихідної концентрації 500 мкг/мл. Вихідний розчин було тоді серійно розбавлено для створення калібрувальної кривої від 5 до 250 мкг/мл. Зразки та стандарти були негайно аналізованими за допомогою РХ/УФ. Для кожного з водних зразків, два відмінні об'єми були уведеними у потроєнні. Для кожного зі стандартів два відмінні об'єми були уведеними поодинці. Зразки, що давали піки поза межами калібрування були серійно розбавленими та повторно аналізованими. Система ВЕРХ/PDA складалася з Alliance 2795 Separations System (Waters) або Acquity UPLC Separations System (Waters), комбінованої з детектором з набором фотодіодів 2996 Photodiode Array Detector (Waters). На системі Alliance, хроматографічного відокремлення аналіту досягали, застосовуючи колонку YMC ODS-Aq С18 (3,050 мм, розмір частинок 3 мкм, 120А, Waters) у сполученні з умовами градієнту, застосовуючи мобільні фази А (водна, 0,01% гептафлуормасляна кислот (HFBA), 1% ізопропіловий спирт) та В (0,01% HFBA та 1% ізопропіловий спирт в ацетонітрилі). Сумарний час перебігу, охоплюючи час повторного урівноваження для одиничної ін'єкції був 5 хвилин. Реакції аналітів вимірювали відстеженням поглинання при 220 нм та 254 нм. Обмеження визначення для більшості сполуки на цій системі було приблизно 1 мкг/мл. На системі Acquity, хроматографічного відокремлення аналіту досягали, застосовуючи колонку Acquity UPLC ВЕН, С18 (2,150 мм, розмір частинок 1,7 мкм, Waters) у сполученні з умовами градієнту, застосовуючи мобільні фази А (водна, 0,1% мурашина кислота (FA), 1% ізопропіловий спирт) та В (0,1% FA та 1% ізопропіловий спирт в ацетонітрилі). Сумарний час перебігу, охоплюючи час повторного урівноваження для одиничної ін'єкції був 3 хвилин. Реакції аналітів вимірювали відстеженням поглинання при 220 нм та 254 нм. Обмеження визначення для більшості сполуки на цій системі було приблизно 1 мкг/мл. На вихідному кінці системи Acquity знаходиться одиничний квадрупольний мас-спектрометр ZC1-2000 (Waters). Позитивну ІРЕ було застосовувано для ідентифікації маси вихідної сполуки. Дані були отриманими та обробленими, застосовуючи програмне забезпечення Waters Empower. Калібрування досягали за допомогою нанесенням на графік співвідношень площ піків аналіту, як функцію номінальної концентрації стандартних зразків. Калібрувальну модель було створено за допомогою лінійної регресії кривої калібрування. Модель було застосовувано для розрахунку концентрації в усіх водних зразках. Хоча фармакологічні властивості сполук формули І до VI варіюють із зміною структури, як очі 93678 58 кують, загалом активність та/або розчинність, виявлені сполукою можна продемонструвати при наступних концентраціях або дозах: Сполуки формули II: Тест 1а (ферментне дослідження): ІК50250 нМ, наприклад, 100 нМ, як наступний приклад 30 нМ. Тест 1b: (клітинне дослідження): ІК50180, наприклад, 80 нМ, як наступний приклад 10 нМ. Сполуки формули III: Тест 1а (ферментне дослідження): ІК50250 нМ, наприклад, 50 нМ, як наступний приклад
ДивитисяДодаткова інформація
Назва патенту англійськоюHeterocyclic inhibitors of mek and methods of use thereof
Автори англійськоюMarlow Allison L., Wallace Eli, Seo Jeongbeob, Lyssikatos Joseph P., Yang Hong Woon, Blake Jim, Storey Richard Anthony, Booth Rebecca Jane, Pittam John David, Leonard John, Fielding Mark Richard
Назва патенту російськоюГетероциклические ингибиторы mek и их применение
Автори російськоюМарлоу Эллисон Л., Воллес Илай, Сео Дзеонбеоб, Лиссикатос Джозеф П., Ян Гун Вун, Блейк Джим, Стори Ричард Энтони, Бус Ребекка Джейн, Питтам Джон Девид, Леонард Джон, Филдинг Марк Ричард
МПК / Мітки
МПК: A61K 31/44, C07D 213/63, C07D 213/84
Мітки: застосування, гетероциклічні, мек, інгібітори
Код посилання
<a href="https://ua.patents.su/86-93678-geterociklichni-ingibitori-mek-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні інгібітори мек та їх застосування</a>
Попередній патент: Способи і пристрій кодування і декодування частини мовного сигналу діапазону високих частот
Наступний патент: Сполуки, що модулюють активність c-kit і c-fms, та їх застосування
Випадковий патент: Піролізний твердопаливний апарат












