Синтетичний спосіб одержання сполуки ектеїнахідину
Номер патенту: 75597
Опубліковано: 15.05.2006
Автори: Гальєго Пілар, Франсесч Андрес, Перес Марта, Чічарро Хосе Луіс, Мант Саймон, Мансанарес Ігнасіо, Куевас Кармен, Мартін Марія Хесус, Сарсуело Марія, Фернандес Кароліна
Формула / Реферат
1. Спосіб одержання ектеїнасцидинової сполуки, де вказаний спосіб включає видалення захисних груп сполуки формули (A) шляхом видалення обох захисних груп в одну стадію з одержанням ![]() -амінолактону формули (35) відповідно до наступної схеми:
-амінолактону формули (35) відповідно до наступної схеми:
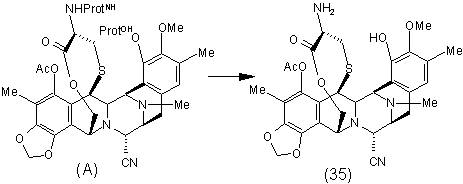 ,
,
де ProtNH являє собою амінозахисну групу, а ProtОН являє собою гідроксизахисну групу.
2. Спосіб за п. 1, де ProtNH являє собою трет-бутоксикарбоніл, і ProtОН являє собою метоксиметил.
3. Спосіб за п. 1, де ProtNH являє собою трет-бутоксикарбоніл, і ProtОН являє собою метоксіетоксиметил.
4. Спосіб за п. 1, що включає додаткову стадію окислення ![]() -амінолактону формули (35) у відповідний
-амінолактону формули (35) у відповідний ![]() -кетолактон формули (36) шляхом трансамінування:
-кетолактон формули (36) шляхом трансамінування:
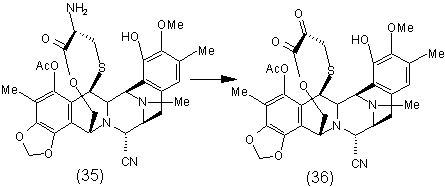 .
.
5. Спосіб за п. 4, що включає додаткову стадію стереоспецифічного утворення спіротетрагідроізохінолінової сполуки Et770 з ![]() -кетолактону формули (36) за реакцією Пікте-Шпенглера:
-кетолактону формули (36) за реакцією Пікте-Шпенглера:
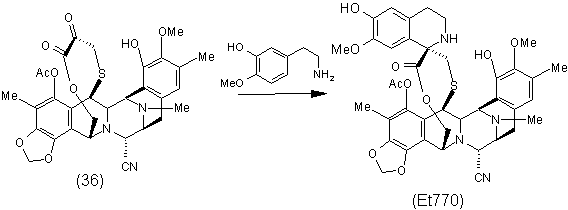 .
.
6. Спосіб за п. 5, що включає додаткову стадію заміщення нітрильної групи в положенні C-21 сполуки Et770 гідроксигрупою з одержанням сполуки Et743:
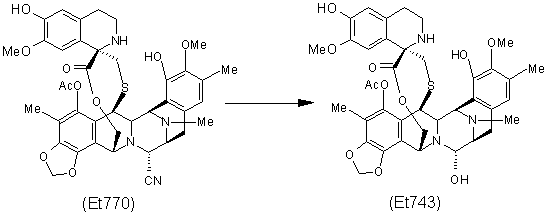 .
.
7. Спосіб одержання ектеїнасцидинової сполуки окисленням a-амінолактону формули (35) у відповідний ![]() -кетолактон формули (36) шляхом трансамінування:
-кетолактон формули (36) шляхом трансамінування:
 .
.
8. Спосіб за п. 7, що включає додаткову стадію стереоспецифічного утворення спіротетрагідроізохінолінової сполуки Et770 з ![]() -кетолактону формули (36) за реакцією Пікте-Шпенглера:
-кетолактону формули (36) за реакцією Пікте-Шпенглера:
 .
.
9. Спосіб за п. 8, що включає додаткову стадію заміщення нітрильної групи в положенні C-21 сполуки Et770 гідроксигрупою з одержанням сполуки Et743:
 .
.
10. Спосіб одержання ектеїнасцидинової сполуки стереоспецифічним утворенням спіротетрагідроізохінолінової сполуки Et770 з ![]() -кетолактону формули (36) за реакцією Пікте-Шпенглера:
-кетолактону формули (36) за реакцією Пікте-Шпенглера:
 .
.
11. Спосіб за п. 10, що включає додаткову стадію заміщення нітрильної групи в положенні C-21 сполуки Et770 гідроксигрупою з одержанням сполуки Et743:
 .
.
12. Проміжна сполука формули (35) для синтезу ектеїнасцидинової сполуки:
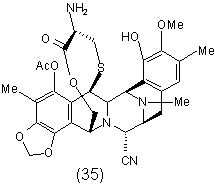 .
.
13. Проміжна сполука формули (36) для синтезу ектеїнасцидинової сполуки:
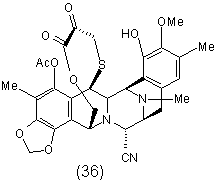 .
.
Текст
1. Спосіб одержання ектеїнасцидинової сполуки, де вказаний спосіб включає видалення захисних груп сполуки формули (A) шляхом видалення обох захисних груп в одну стадію з одержанням -амінолактону формули (35) відповідно до наступної схеми: 3 NH2 OMe HO O S Me AcO O Me N Me OMe HO O Me AcO 75597 4 луки Et770 гідроксигрупою з одержанням сполуки Et743: O O Me Me O O O . 8. Спосіб за п. 7, що включає додаткову стадію стереоспецифічного утворення спіротетрагідроізохінолінової сполуки Et770 з -кетолактону формули (36) за реакцією Пікте-Шпенглера: OMe HO Me AcO S HO MeO O N NH MeO O N Me CN O NH HO OMe NH MeO N O CN (35) . 13. Проміжна сполука формули (36) для синтезу ектеїнасцидинової сполуки: O HO O Me Me AcO N Me O Me N S N O O CN OMe S Me N O Me O O Me O N N OMe HO O AcO Me S O Me O CN HO HO O AcO S Me (Et770) . 9. Спосіб за п. 8, що включає додаткову стадію заміщення нітрильної групи в положенні C-21 сполуки Et770 гідроксигрупою з одержанням сполуки Et743: OMe Me AcO O (36) MeO HO O S N (Et743) NH2 O N O OH . 12. Проміжна сполука формули (35) для синтезу ектеїнасцидинової сполуки: Me Me Me O (Et770) OMe HO O AcO NH2 Me O CN HO O O N N O O Me S Me N (36) OMe O Me N HO O AcO S CN (35) NH MeO Me Me O CN OMe HO O AcO N O Me N OH (Et743) (Et770) . 10. Спосіб одержання ектеїнасцидинової сполуки стереоспецифічним утворенням спіротетрагідроізохінолінової сполуки Et770 з -кетолактону формули (36) за реакцією Пікте-Шпенглера: O O CN (36) . HO O OMe HO O Me AcO S HO MeO O Me NH MeO N N Me HO HO S N Me NH MeO Me N Me N CN (36) Me S O N O O OMe HO O AcO NH2 O O CN . 11. Спосіб за п. 10, що включає додаткову стадію заміщення нітрильної групи в положенні C-21 спо(Et770) Даний винахід відноситься до синтетичних способів, а зокрема, до синтетичних способів одержання сполук ектеїнасцидинів. Європейський патент 309477 відноситься до ектеїнасцидинів 729, 743, 745, 759А, 759В і 770. Описані сполуки ектеїнасцидинів, що володіють антибактеріальними та іншими корисними властивостями. У цей час проводяться клінічні випробування ектеїнасцидину 743 як протипухлинного агента. Ектеїнасцидин 743 має складну трис(тетрагідроізохінолінфенольну) структуру наступної формули (І): У наш час, ектеїнасцидини одержують шляхом виділення з екстрактів морських покривників (туникатів) Ecteinascidin turbinata. Цей спосіб дає низь 5 75597 6 кий вихід, і були зроблені пошуки альтернативних способів їх одержання. Синтетичний спосіб одержання сполук ектеїнасцидину описаний в патенті США 5721362, див. також WO 9812198, який у всій своїй повноті вводиться в даний опис за допомогою посилання. Заявлений спосіб є трудомістким і складним, і як ілюстрація приводяться 38 прикладів, в кожному з яких описана одна або декілька стадій послідовності реакцій синтезу, що приводить до ектеїнасцидину 743. У відомому способі синтезу, 1,4-місток утворюють з використанням (1-лабільний)-10-гідрокси(18-захищений гідрокси)-ді-6,8-єн-5-онУ ектеїнасцидинах 743 і 770, 1,4-місток має конденсованої циклічної сполуки. Як показано в структуру формули (IV): прикладі 33, сполуку (13) перетворюють в сполуку (14): Відповідно до відомого способу синтезу, на подальших стадіях, описаних в Прикладах 34-36, в 1,4-містку утворюється спірохінолін, і захисну групу 18-МОМ видаляють з одержанням ектеїнасцидину 770, який потім перетворюють в ектеїнасцидин 743. Пункт 25 формули винаходу патенту США 5721362 відноситься до проміжної фенольної сполуки вказаної формули (11), яку автори даної заявки також називають проміжною сполукою 11 або Int-11. Ця сполука має наступну біс(тетрагідроізохінолінфенольну) структуру (II): Іншими відомими ектеїнасцидинами є сполуки з іншою містковою циклічною кільцевою системою такою, як зустрічається в ектеїнасцидинах 722 і 736, де вказаний місток має структуру формули (V): в ектеїнасцидинах 583 і 597, де вказаний місток має структуру формули (VI): де MOM представляє метоксиметильний замісник, a TBDPS представляє третбутилдифенілсиліловий замісник. З проміжної сполуки 11 можна синтезувати інший протипухлинний агент, який представляє інтерес, фталасцидин, [див. Proc. Natl. Acad. Sci., USA, 96, 3496-3501, 1999]. Флатасцидин являє собою біс(тетрагідроізохінолінфенольне) похідне формули (III): в ектеїнасцидинах 594 і 596, де вказаний місток має структуру формули (VII): 7 75597 8 Chem., 1989, "Synthesis of Saframycins. Preparation of a Key tricyclic Lactam Intermediate to Saframycin A", vol.54, 5391; Still, et al., J. Org. Chem., 1978, "Rapid Chromatographic Technique for Preparative Separations with Moderate Resolution", vol.43, p.2923; Kofron, W.G.; Baclawski, L.M., J. Org. Chem., 1976, vol.41, 1879; Guan et al., J. Biomolec. Struc. & Dynam., vol.10, pp.793-817 (1993); Shamma et al., "Carbon-13 NMR Shift Assignments of Amines and Alkaloids", p.206 (1979); Lown et al., Biochemistry, 21, 419-428 (1982); Zmijewski et al., Повна структура цих і споріднених сполук приChem. Biol. Interactions, 52, 361-375 (1985); Ito, водиться в [J. Am. Chem. Soc.(1996) 118, 9017CRC Crit. Rev. Anal. Chem., 17, 65-143 (1986); 9023]. Ця стаття вводиться в даний опис за допоRinehart et al., "Topics in Pharmaceutical Sciences могою посилання. 1989", pp.613-626, D.D.Breimer, D. J. A. Cromwelin, Інша література, що відноситься до сполук екK. K. Midha, Eds., Amsterdam Medical Press B. V., теїнасцидинів, приводиться нижче: Noordwijk, The Netherlands (1989); Rinehart et al., [Corey, E.J., J. Am. Chem. Soc, 1996, 118 "Biological Mass Spectrometry", 233-258 eds. pp.9202-9203; Rinehart, et al., Journal of Natural Burlingame et al., Elsevier Amsterdam (1990); Guan Products, 1990, "Bioactive Compounds from Aquatic et al., Jour. Biomolec. Struct. & Dynam., vol.10 and Terrestrial Sources", vol.53, pp.771-792; Rinehart pp.793-817 (1993); Nakagawa et al., J. Am. Chem. et al., Pure and Appl. Chem., 1990, "Biologically Soc, 111: 2721-2722 (1989); Lichter et al., "Food and active natural products", vol.62, pp.1277-1280; Drags from the Sea Proceedings" (1972) / Marine Rinehart, et al., J. Org. Chem., 1990, "Ecteinascidins Technology Society, Washington, D.C. 1973, 117729, 743, 745, 759A, 759B, and 770: potent 127; Sakai et al., J. Am. Chem. Soc, 1996, 118, 9017; Antitumour Agents from the Caribbean Tunicate Garcia-Rocha et al., Brit. J. Cancerr 1996, 73: 875Ecteinascidia turninata", vol.55, pp.4512-4515; Wright 883; and Pommier et al., Biochemistry, 1996, 35: et al., J. Org. Chem., 1990, "Antitumour 13303-13309]. Tetrahydroisoquinoline Alkaloids from the Colonial Відомі й інші сполуки, у яких відсутня циклічна ascidian Ecteinascidia turbinata", vol.55, pp.4508кільцева система з містками. Такими сполуками є 4512; Sakai et al., Proc. Natl. Acad. Sci. USA 1992, протипухлинні-протимікробні "Additional anitumor ecteinascidins from a Caribbean біс(тетрагідроізохінолінхінон)-вмісні антибіотики tunicate: Crystal structures and activities in vivo", сафрацини і сафраміцини, і природні морські проvol.89, 11456-11460; Science 1994, "Chemical дукти ренієраміцини і ксестоміцини, виділені з куProspectors Scour the Seas for Promising Drugs", льтивованих мікробів або губок. Всі вони мають vol.266, pp.1324; Koenig, K.E., "Asymmetric спільний димерний тетрагідроізохінольний вуглеSynthesis", ed. Morrison, Academic Press, Inc., цевий каркас Ці сполуки можуть бути розділені на Orlando, FL, vol.5, 1985, p.71; Bart, et al., J. Chem чотири типи, типи I-IV, відповідно до характеру Soc. Perkin Trans., 1, 1982, "Synthesis and окислення ароматичних кілець. Properties of a Series of Sterically Hindered Димерні ізохінолінхінони типу І являють собою Guanidine bases", pp.2085; Fukuyama et al., J. Am. систему формули (VIII), що найчастіше зустрічаChem. Soc.r 1982, "Stereocontrolled Total Synthesis ється в сполуках цього класу, див. нижченаведену of (+)-Saframycin B", vol.104, pp.4957; Fukuyama et таблицю І. al., J. Am. Chem. Soc, 1990, "Total Synthesis of (+)Saframycin A", vol.112, p.3712; Saito, et al., J. Org. Таблиця І Структура сафраміцинових антибіотиків типу І Замісники Сполуки сафраміцин А сафраміцин В R14a Η Η R14b Η Η R21 CN Η R25a O O R25b O O R25c СН3 СН3 9 сафраміцин С сафраміцин G сафраміцин Η сафраміцин S сафраміцин Y3 сафраміцин Yd1 сафраміцин Ad1 сафраміцин Yd2 сафраміцин Y2b сафраміцин Y2b-d сафраміцин АН2 сафраміцин АН2Ас сафраміцин АН1 сафраміцин АН1Ас сафраміцин AR3 а b 75597 Η Η Η Η Η Η Η Η Η Η Η Η Η Η Η ОСН3 ОН Η Η Η Η Η Η Qb Qb Η Η Η Η Η Η CN CN ОН CN CN CN CN CN CN CN CN CN CN Η O O OH O NH2 NH2 O NH2 NH2 NH2 Ha Η OHa OAc Η 10 O O CH2COCH3 O Η Η О Η Η Η ОНа OAc На Η он СН3 СН3 СН3 СН3 СН3 С2Н5 С2Н5 Η СН3 С2Н5 СН3 СН3 СН3 СН3 СН3 вказані значення є взаємозамінними де група Q представляє групу формули (IX): Ароматичні кільця типу І спостерігаються в сафраміцинах А, В, і С; G і Н; і S, виділених з Streptomyces lavendulae, у вигляді мінорних (другорядних) компонентів. Ціанопохідне сафраміцину А, назване ціанохінонаміном, описане в [Japanese Kokai JP-A2 59/225189 і 60/084288]. Сафраміцини Y3, Yd1, Ad1 і Yd2 були продуковані S.lavendulae шляхом прямого біосинтезу при внесенні в культуральні середовища відповідних добавок. Димери сафраміцину Y2b і Y2b-d, утворені шляхом скріплення азоту у С-25 однієї ланки з С-14 іншої ланки, також були продуковані в культуральному середовищі S.lavendulae, в яке були введені добавки. Сафраміцин AR1(=AH2), продукт мікробного відновлення сафраміцину А у С-25, продукований Rhodococcus amidophilis, був також одержаний шляхом нестереоселективного хімічного відновлення сафраміцину А боргідридом натрію у вигляді суміші (1:1) епімерів, з подальшим хроматографічним розділенням [другий ізомер АН1 є менш полярним]. Інший продукт відновлення сафраміцин AR3, 21-деціано-25-дигідросафраміцин А (=25дигідросафраміцин В) був одержаний за допомогою того ж самого мікробного перетворення. Мікробне перетворення іншого типу сафраміцину А з використанням Nocardia приводило до продукування сафраміцину В, а подальше Mycobacteriumвідновлення приводило до продукування сафраміцину АН1Ас. 25-О-ацетати сафраміцину АН2 і АН1 були одержані також хімічним способом для біологічних досліджень. Сполуки типу Τ формули (X) були також виділені з морських губок, див. таблицю II. Таблиця II Структури сполук типу І з морських губок ренієраміцин А ренієраміцин В ренієраміцин С ренієраміцин D R14a ОН ОС2Н5 ОН ОС2Н5 Замісники R14b Η Η О О R21 Η Η O O R -C(CH3)=CH-CH3 -С(СН3)=СН-СН3 -С(СН3)=СН-СН3 -С(СН3)=СН-СН3 11 ренієраміцин Ε ренієраміцин F ксестоміцин 75597 Η ОСН3 ОСН3 Η Η Η Ренієраміцини A-D, поряд з біогенетично спорідненими мономерними ізохінолінами, ренієроном і спорідненими сполуками, були виділені з антимікробного екстракту губок виду Reniera, зібраних в Мексиці. Структура ренієраміцину А була спочатку віднесена до зверненої стереохімії при С3, С-11 і С-13. Однак, ретельна оцінка даних 1H ЯМР для нових споріднених сполук ренієраміцинів Ε і F, виділених з тих же самих губок, зібраних в Палау, виявила, що місце конденсації кілець ренієраміцинів ідентичне місцю конденсації кілець сафраміцинів. Цей результат дозволив зробити ви 12 -С(СН3)=СН-СН3 -С(СН3)=СН-СН3 -СН3 ОН ОН Η сновок, що спочатку певна стереохімія ренієраміцинів A-D повинна бути такою ж, як і у сафраміцинів. Ксестоміцин був виявлений в губках, виду Xestospongia, зібраних у водах, що омивають ШріЛанку. Сполуки типу II формули (XI) з відновленим гідрохіноновим кільцем являють собою сафраміцини D і F, виділені з S. lavendulae, і сафраміцини Мх-1 і Мх-2, виділені з Myxococcus xanthus. Див. таблицю III. Таблиця III Сполуки типу II Сполука сафраміцин D сафраміцин F сафраміцин Мх-1 сафраміцин Мх-2 R14a О О Η Η R14b О О ОСН3 ОСН3 Замісники R21 Η CN ОН Η Структура типу III була виявлена в антибіотиках сафрацинах А і В, виділених з Pseudomonas fluorescens. Ці антибіотики формули (XII) складаються з тетрагідроізохінолін-хінонової субодиниці і тетрагідроізохінолінфенольної субодиниці. де R21 представляє -Η в сафрацині А і -ОН в сафрацині В. Сафраміцин R - єдина сполука, класифікована як сполука структури типу IV, була також виділена з S.lavendulae. Ця сполука формули (XIII), що R25a О О Η Η R25b О О СН3 СН3 R25c СН3 СН3 NH2 NH2 складається з гідрохінонового кільця з бічним гліколевим складноефірним ланцюгом у одного з атомів кисню фенолу, може служити проліками сафраміцину А через його помірну токсичність. Всі ці відомі сполуки мають конденсовану систему з п'яти кілець (А)-(Е), як показано на представленій нижче структурі формули (XIV): 13 У ектеїнасцидинах і в деяких інших сполуках, кільця А і Ε є фенольними, тоді як в інших сполуках, а зокрема, в сафраміцинах, вказані кільця А і Ε є хінольними. У відомих сполуках, кільця В і D являють собою тетрагідро, а кільце С являє собою пергідро. Необхідність в розробці альтернативних способів синтезу сполук ектеїнасцидину і споріднених сполук залишається актуальною. Такі синтетичні шляхи одержання дадуть можливість розробити більш економічні способи одержання відомих протипухлинних агентів, а також дозволять одержати нові активні сполуки. Даний винахід відноситься до синтетичних способів одержання проміжних сполук, похідних і споріднених структур ектеїнасцидину або інших тетрагідроізохінолінфенольних сполук. У одному з своїх аспектів, даний винахід відноситься до способу одержання ектеїнасцидинового продукту зі спіроаміно-1,4-містком. Цей спосіб передбачає утворення 1,4 містка з використанням (1-лабільний)-10-гідрокси-(18-захищений гідрокси)ді-6,8-єн-5-он-конденсованої циклічної сполуки, де конденсоване кільце має формулу (XIV). У даному винаході, захист в положенні С-18 видаляють перед введенням спіроаміну. Придатними вихідними речовинами для нових синтетичних способів є сполуки, споріднені природним біс(тетрагідроізохінолін)алкалоїдам. Такі вихідні речовини можуть бути одержані з сафраміцинових або сафрацинових антибіотиків різних класів, доступних з різних культуральних бульйонів, як детально описано у WO 0069862, або іншими синтетичними або біохімічними способами. У зв'язку з цим, WO 0069862 у всій своїй повноті вводиться в даний опис за допомогою посилання. У даний заявці РСТ запитується пріоритет з дати подачі заявки PCT/GBOO/01852, яка була опублікована як WO 0069862. Автори даної заявки включають цей текст за допомогою посилання на ту частину опису винаходу, яка не присутня в описі даної заявки. У одному з своїх аспектів, даний винахід відноситься до використання проміжної сполуки 21 в ряді нових синтетичних способів для одержання ектеїнасцидину 743 і споріднених сполук 75597 14 Проміжна сполука 21 має 5-алілоксигрупу, де алільна група служить для захисту 5гідроксигрупи. Потрібно зазначити, що можуть бути також легко використані і інші захисні групи, і що даний винахід, в загальних рисах, відноситься до використання інших таких 5-захищених гідроксисполук. Одержання ектеїнасцидину 743 і споріднених сполук У загальних рисах, перетворення проміжної сполуки 21 або спорідненої сполуки в ектеїнасцидиновий продукт включає нижченаведені ключові стадії перетворень: (a) перетворення NH2 в ОН за допомогою реакції, наприклад, з нітритом натрію в оцтовій кислоті; (b) захисту Ε-кільцевого фенолу; (c) етерифікації шляхом захисту первинної функціональної 1-гідроксигрупи захищеним бічним ланцюгом цистеїну; (d) зняття захисту у алільної групи і окислення; (е) утворення кільця з містком за допомогою реакції циклізації; (f) зняття захисту у Ε-кільцевого фенолу і у цистеїнової групи; (g) введення хіноліну за допомогою трансамінування і реакції Пікге-Шпенглера. Велике число функціональних груп проміжних сполук вимагає використання захисних груп для Εкільцевого фенолу і для цистеїнового бічного ланцюга з метою попередження небажаних побічних реакцій. Число самих альтернативних проміжних сполук, яке може бути утворене, залежить від конкретного вибору захисних груп. Для комбінування вказаних перетворень можна використати інші можливі послідовності реакцій в залежності, головним чином, від захисних груп, вибраних для фенольного кільця і для аміну цистеїнового бічного ланцюга. Загальне число синтетичних перетворень також залежить від вибору захисних груп. Як ілюстрація нижче описане використання різних комбінацій захисних груп для шести типових шляхів одержання ЕТ-743 з проміжної сполуки 21, також названої тут SF21. 15 75597 16 послідовності стадій, а також одержані при цьому сполуки є частиною даного винаходу. Захист фе- Захист цис- Число стаШлях Крім того, інші стратегії з використанням захинолу теїну дій сних груп, які детально тут не описуються, також є 1 MOM Вос 12 частиною даного винаходу. 2 MEM Вос 10 Докладний опис шести типових синтетичних 3 MEM Cbz 11 шляхів 4 MOM Alloc 13 Повні реакційні схеми для кожного шляху син5 MEM Allос 13 тезу представлені в нижченаведених схемах 1-6. 6 MOM Cbz 15 Схема 1 - ЕТ-743: Напівсинтетичний альтернативний шлях 1 Як очевидно кожному фахівцеві, описані тут реакційні схеми можуть бути модифіковані і/або комбіновані різними способами, і альтернативні 17 75597 Схема 2 - ЕТ-743: Напівсинтетичний альтернативний шлях 2 18 19 75597 Схема 3 - ЕТ-743: Напівсинтетичний альтернативний шлях 3 20 21 75597 Схема 4 - ЕТ-743: Напівсинтетичний альтернативний шлях 4 22 23 75597 Схема 5 - ЕТ-743: Напівсинтетичний альтернативний шлях 5 24 25 75597 26 Схема 6 - ЕТ-743: Напівсинтетичний альтернативний шлях 6 У шляху синтезу 1, захист Е-кільцевого фенолу досягається в три стадії, що включають захист/зняття захисту аміну SF21 з використанням Тrос. В шляхах синтезу 1 і 2, захист цистеїнового бічного ланцюга групою Вос дозволяє знімати за 27 75597 28 хист у фенольних і цистеїнових груп в одну стадію, собу, Prot1 видаляють на тій же самій стадії, що і а не в дві окремі стадії. У інших шляхах синтезу С-18-захист. потрібна додаткова стадія зняття захисту. 1-лабільна група може бути генерована із 1Шлях синтезу 2 дозволяє уникнути утворення замісника формули: проміжної сполуки 25 завдяки використанню мето-CH2-O-CO-CNHProt1 CH2-S-Prot2. 2 дики прямої етерифікації і подальшого захисту У цій формулі Prot звичайно означає Fm, 9фенолу групою MEM. флуоренілметил. В шляхах синтезу 2 і 3, захист Ε-кільцевого 1-Замісник формули: фенолу здійснюють лише після стадій діазотуван-CH2-O-CO-CNHProt1-CHj-S-Prot2 ня і етерифікації, що, тим самим, дозволяє забезможе бути утворений за допомогою етерифіпечити захист фенолу в одну стадію, а не в три кації замісника СН2-О-Н. стадії, як в шляху реакцій 1. Така етерифікація може бути здійснена до або В шляхах синтезу 1, 2 і 3, пряма етерифікація після утворення 10-гідрокси-ді-6,8-єн-5-онпервинного спирту з використанням цистеїнового структури. похідного дозволяє уникнути непродуктивних стаУ одному з варіантів заявленого способу вихідій захисту/зняття захисту у первинного спирту з дною сполукою є 1-амінометилен-(5-захищений використанням силільної групи (шляхи 4 і 5), що гідрокси)-7,8-діоксиметилен-18-гідрокси-21тим самим укорочує цю послідовність реакцій на ціаноконденсована циклічна сполука. дві стадії. 1-амінометиленова група може бути тимчасоШлях 6 розглядається тут тільки як останні во захищена для можливості захисту 18стадії одержання із сполуки 161, яка може бути гідроксигрупи, а потім цей тимчасовий захист знілегко одержана з проміжної сполуки 21. мають. У шляхах 4 і 5, первинний спирт, що одержуАльтернативно, С-18 гідроксигрупа може бути ється на початковій стадії діазотування, захищазахищена після утворення 1-складноефірної фунють кремнієм, що дозволяє забезпечити селективкціональної групи. ний захист Ε-кільцевого фенолу і уникнути У іншому варіанті 1-амінометиленову групу утворення проміжної сполуки 25. Після модифікаперетворюють в 1-гідроксиметиленову групу і вкації Α-кільця (зняття захисту/окислення), кремнієву зану 1-гідроксиметиленову групу тимчасово захигрупу видаляють і первинний спирт етерифікують щають для можливості захисту 18-гідроксигрупи, а цистеїновим похідним. потім цей тимчасовий захист знімають. Ці зміни безпосередньо пов'язані з проблемаВідповідна конденсована кільцева структура ми, які в більш широкому масштабі виникали при має формулу: проведенні послідовності реакцій, описаних в WO 0069862. Внаслідок цих змін весь шлях реакцій 2 є коротшим на три стадії, а тому, він потенційно є більш придатним і/або таким, що менш дорого коштує для рутинного промислового виробництва. Таким чином, відповідно до шляхів синтезу 16, даний винахід відноситься до способу одержання ектеїнасцидинового продукту зі спіроаміно-1,4містком, причому, вказаний спосіб включає одержання 1,4-містка з використанням (1-лабільний)10-гідрокси-(18-захищений гідрокси)-ді-6,8-єн-5-онконденсованої циклічної сполуки, де захист в положенні С-18 видаляють перед введенням спіроаміну. особливо, де R15 представляє Н. Один або деВ одному з варіантів вказаного способу, ектеїкілька або всі інші замісники можуть бути такими, насцидиновий продукт має 21-гідроксигрупу, і цей як в ектеїнасцидині 743. спосіб передбачає перетворення 21-ціаногрупи в Напівсинтез 21-гідроксигрупу. Даний винахід дозволяє використати відому Звичайно спіроаміном є спірохінолін, а зокресполуку, сафрацин В, також названий хінонаміном, ма, спірохінолін ектеїнасцидину 743. в напівсинтетичному способі. У переважному способі, 18-захищену групу (1У більш загальних рисах, даний винахід віднолабільний)-10-гідрокси-(18-захищений гідрокси)-діситься до напівсинтетичного способу одержання 6,8-єн-5-он-конденсованої циклічної сполуки захипроміжних сполук, похідних і споріднених структур щають групою MOM, метоксиметилом або MEM, ектеїнасцидину або інших тетрагідроізохінолінфеметоксіетоксиметильною групою. нольних сполук з природних Відповідною 1-лабільною групою є Nбіс(тетрагідроізохінолін)алкалоїдів. Відповідними захищена цистеїнілоксиметиленова група формувихідними речовинами для напівсинтетичного споли собу є антибіотики класу сафраміцинів і сафраци1 -CH2-O-CO-CNProt -CH2-S-H. нів, доступні з різних культуральних бульйонів, і 1 У цій формулі Prot звичайно представляє: сполуки класу рейнераміцинів і ксестоміцинів, досВос, трет-бутоксикарбоніл; Тrос, 2,2,2тупних з морських губок. трихлоретилоксикарбоніл; Cbz, бензил оксикарбоЗагальна формула (XV) для вихідних сполук ніл; або АНос, алілоксикарбоніл. являє собою: У деяких варіантах здійснення вказаного спо 29 75597 30 рень з одержанням потрібного продукту. Кожна стадія, сама по собі, являє собою процес, здійснюваний відповідно до даного винаходу. Даний винахід не обмежується вказаними прикладами шляхів синтезу, і, при необхідності, можуть бути використані альтернативні шляхи синтезу, що передбачають, наприклад, зміну порядку проведення стадій перетворень, якщо це необхідне, або заміну захисних груп, що використовуються. Зокрема, даний винахід включає одержання де: вихідної 21-ціаноречовини загальної формули R1 представляє амідометиленову групу, таку (XVI): як -CH2-NH-CO-CR25aR25bR25c, де R25a і R25b утворюють кетогрупу, або один з них представляє -ОН, -NH2 або -ОСОСН3, а інший представляє СН2СОСН3, -Н, -ОН або -ОСОСН3, за умови, що якщо R25a представляє -ОН або -NH2, то R25b не є ОН, a R25c представляє -Н, -СН3 або -СН2СН3, або R1 представляє ацилоксиметиленову групу, таку як -СН2-О-СО-R, де R представляє -С(СН3)=СНСН3 або -СН3; R5 і R8 незалежно вибрані з -Н, -ОН або ОСОСН2ОН, або, обидва R5 і R8 представляють де R1, R5, R8, R14a, R14b, R15 і R18 визначені викето, а кільце А представляє п-бензохінонове кільще. це; Можливими вихідними речовинами можуть буR14a і R14b обидва представляють -Н, або один ти також інші сполуки формули (XVI) з різними з них представляє -Н, а інший представляє -ОН, замісниками в 21-положенні. У загальних рисах, ОСН3 або -ОСН2СН3, або R14a і R14b, взяті разом, кандидатом є будь-яке похідне, яке може бути утворюють кетогрупу; одержане нуклеофільним заміщенням 21R15 і R18 незалежно вибрані з -Н або -ОН, або 5 8 гідроксигрупи в сполуках формули (XV), де R21 R і R обидва представляють кето, а кільце А представляє гідроксигрупу. Прикладами відповідпредставляє п-бензохінонове кільце; і них 21-замісників є, але не обмежуються ними: R21 представляє -ОН або -CN. меркаптогрупа; Більш загальна формули для сполук цього алкілтіогрупа (алкільна група має від 1 до 6 класу представлена нижче: атомів вуглецю); арилтіогрупа (арильна група має від 6 до 10 атомів вуглецю і є незаміщеною або заміщеною 15 замісниками, вибраними, наприклад, з алкільної групи, що має 1-6 атомів вуглецю; алкоксигруп, що мають 1-6 атомів вуглецю; атомів галогену; меркаптогруп і нітрогруп); аміногрупа; моно- або діалкіламіногрупи (кожна з алкільних груп має від 1 до 6 атомів вуглецю); моно- або діариламіногрупи (кожна з арильних груп є такою, як вона була визначена вище для арилтіогруп); -карбонілалкільна група формули -C(Ra)(Rb)C(=O)Rc, де: де: кожна із замісних груп, визначених R1, R2, Ra і Rb вибрані з атомів водню, алкільних груп, R3, R4, R5, R6, R7,R8, R9, R10 незалежно вибрана з що мають від 1 до 20 атомів вуглецю, арильних групи, що складається з Н, ОН, ОСН3, CN, =O, груп (визначених вище у відношенні арилтіогруп) і СН3; аралкільних груп (в яких алкільна група, що має X представляє інші амідні або складноефірні від 1 до 4 атомів вуглецю, заміщена арильною функціональні групи, що містяться у вищезазначегрупою, визначеною вище у відношенні арилтіогних природних продуктах; і де кожне пунктирне руп), за умови, що один з Ra і Rb представляє атом кільце представляє один, два або три необов'язводню; кових подвійних зв'язки. Rc вибраний з атомів водню, алкільної групи, Таким чином, авторами даного винаходу були що має від 1 до 20 атомів вуглецю, арильних груп розроблені напівсинтетичні способи одержання (визначених вище у відношенні арилтіогруп) і арапроміжних сполук, включаючи проміжні сполуки 11 лкільних груп (в яких алкільна група, що має від 1 або 21, і способи одержання ектеїнасцидинових до 4 атомів вуглецю, заміщена арильною групою, сполук, а також фталасцидинових і інших сполук. визначеною вище у відношенні арилтіогруп); алкоКожний з напівсинтетичних способів даного винаксигруп, що мають від 1 до 6 атомів вуглецю, аміходу включає проведення ряду стадій перетвоногруп або моно- або діалкіламіногруп, визначених 31 75597 32 вище. тичного способу, де стадії перетворення застосоТаким чином, в своєму більш загальному асвують по відношенню до сафрацину В: пекті, даний винахід відноситься до способів, де першу стадію проводять для утворення 21похідного з використанням нуклеофільного реагенту. Автори даної заявки назвали такі сполуки 21Nuс-сполуками. Для деяких кінцевих продуктів, а зокрема, ектеїнасцидину 770 і фталасцидину необхідна присутність 21-ціаногрупи, тоді як в інших кінцевих продуктах вона діє як захисна група, яка може бути легко перетворена в інший замісник, такий як 21-гідроксигрупа ектеїнасцидину 743 або 21гідроксифталасцидину. Вибір 21-ціаносполуки як вихідної речовини дозволяє ефективно стабілізувати дану молекулу в процесі подальших стадій синтезу доти, поки вона, але необов'язково, не видалиться. Ці і інші переваги можна досягнути з використанням інших 21-Nuс-сполук. У одному з важливих аспектів свого здійсненСафрацин В ня, даний винахід відноситься до використання 21ціаносполуки загальної формули (XVI) для одерСафрацин В являє собою кільцеву систему, жання бісабо близькоспоріднену ектеїнасцидинам. Ця сполука трис(тетрагідроізохінолінфенольних) сполук. Промає ту ж саму пентациклічну структуру і той же тип дуктами, які можуть бути одержані таким чином, є заміщення в правому ароматичному кільці, кільці проміжні сполуки, такі як проміжна сполука 11 або Е. Крім того, сафрацин В має дуже велику схожість 21, і ектеїнасцидини, а також нові і відомі сполуки з деякими синтетичними проміжними сполуками в зі спорідненою структурою. загальному синтезі ЕТ-743, а зокрема, з проміжПереважними вихідними речовинами є сполуними сполуками 11 або 21. Така проміжна, сполука ки формули (XV) або (XVI), де R14a і R14b обидва може бути перетворена в Et-743 з використанням представляють водень. Переважними вихідними добре відомого способу. Тому, синтетичне перетречовинами також є сполуки формули (XV) або ворення сафрацину В у проміжні сполуки 11 або 15 (XVI), де R представляє водень. Крім того, пере21 дозволяє запропонувати напівсинтетичний споважними вихідними речовинами є сполуки формусіб одержання ЕТ-743. ли (XV) або (XVI), де Ε представляє фенольне Таким чином, з вказаної сполуки сафрацину В, кільце. Переважними вихідними речовинами також автори даного винаходу одержували проміжні є сполуки формули (XV) або (XVI), де, принаймні, сполуки 11 або 21, а з цих проміжних сполук 11 один, а краще два або три з R5, R8, R15 і R18 не є або 21 одержували конкретні сполуки, зокрема, воднем. ектеїнасцидини. Крім того, авторами даного винаПрикладами відповідних вихідних речовин даходу був одержаний фталасцидин з сафрацину В. ного винаходу є сафраміцин А, сафраміцин В, саДаний винахід також відноситься до використання фраміцин С, сафраміцин G, сафраміцин Н, сафсафрацину В для одержання проміжних сполук 11 раміцин S, сафраміцин Υ3, сафраміцин Yd1, або 21, сполук ектеїнасцидину і інших проміжних сафраміцин Ad1, сафраміцин Yd2, сафраміцин АН2, сполук даного винаходу. Даний винахід також відсафраміцин АН2Ас, сафраміцин АН1, сафраміцин носиться до описаних тут сполук, одержаних з АН1Ас, сафраміцин AR3, ренієраміцин А, ренієраінших вихідних речовин, що пропонуються, і до їх міцин В, ренієраміцин С, ренієраміцин D, ренієравикористання для одержання вказаних сполук. міцин Е, ренієраміцин F, ксестоміцин, сафраміцин Більш переважні вихідні речовини даного виD, сафраміцин F, сафраміцин Мх-1, сафраміцин находу мають 21-ціаногрупу. Найбільш переважМх-2, сафрацин А, сафрацин В і сафраміцин R. ною сполукою даного винаходу є сполука формули Переважні вихідні речовини мають ціаногрупу в 2. Цю сполуку одержують безпосередньо з сафраположенні 21, для групи R21. цину В і розглядають як ключову проміжну сполуку У особливо переважному аспекті свого здійсв даному напівсинтетичному способі. нення, даний винахід відноситься до напівсинте 33 75597 О-; сполука 2 У відповідному аспекті даного винаходу, авторами одержаний ціаносафрацин В шляхом ферментації штаму Pseudomonas fluorescens, що продукує сафрацин В, і обробки культивованого бульйону з використанням іонів ціаніду. Переважним штамом Pseudomonas fluorescens є штам А22, FERM ВР-14, який використали в процедурі, описаній в ЕР055299. Відповідним джерелом іонів ціаніду є ціанід калію. У типовій процедурі обробки, вказаний бульйон фільтрують і додають надлишок іонів ціаніду. Після перемішування протягом відповідного періоду часу, такого як 1 година, рН роблять лужним, тобто, рН 9,5, а після екстракції органічних речовин одержують неочищений екстракт, який може бути потім очищений з одержанням ціаносафрацину В. Щоб виключити всякі сумніви, потрібно зазначити, що стереохімічні структури, вказані в описі даної патентної заявки засновані на авторському представленні про точну стереохімію природних продуктів. Якщо брати до уваги той факт, що якщо виявлена помилка у відношенні стереохімії, то необхідно внести відповідну поправку в формули, представлені в описі даної заявки. Крім того, якщо врахувати, що вказані способи синтезу можуть бути модифіковані, то даний винахід розповсюджується і на стереоізомери. Продукти даного винаходу звичайно являють собою сполуки формули (XVIIb): де R1 і R4, взяті разом, утворюють групу формул (IV), (V), (VI) або (VlI): 34 R5 представляє -Н або -ОН; R7 і R8, взяті разом, утворюють групу -О-СН2 R14a і R14b, обидва представляють -Н, або один з них представляє -Н, а інший представляє -ОН, ОСН3 або -ОСН2СН3, або, R14a і R14b, взяті разом, утворюють кетогрупу; R15 представляє -Н або -ОН; R21 представляє -Н, -ОН або -CN; і похідні, включаючи їх ацильні похідні, а особливо, де R5 представляє ацетилокси або іншу ацилоксигрупу, що має аж до 4 атомів вуглецю. У формулі (XVIIb), група R1, звичайно разом з 4 R , утворює групу (IV) або (V). Група R18 звичайно є захищеною. R21 звичайно представляє ціано. R14a і R14b переважно представляють водень. 15 R переважно представляє водень. Відповідними О-ацильними похідними є алифатичні О-ацильні похідні, а зокрема, ацильні похідні з 1-4 атомами вуглецю, а звичайно О-ацетильна група, наприклад, в 5-положенні. Відповідними захисними групами для фенолів і гідроксигруп є простий і складний ефір, такий як алкіл, алкоксіалкіл, арилоксіалкіл, алкоксіалкоксіалкіл, алкілсилілалкоксіалкіл, алкілтіоалкіл, арилтіоалкіл, азидоалкіл, ціаноалкіл, хлоралкіл, гетероцикліл, арилацил, галогенарилацил, циклоалкілалкіл, алкеніл, циклоалкіл, алкіларилалкіл, алкоксіарилалкіл, нітроарилалкіл, галогенарилалкіл, алкіламінокарбоніларилалкіл, алкілсульфініларилалкіл, алкілсиліл і інший простий ефір, і арилацил, арилалкілкарбонат, аліфатичний карбонат, алкілсульфїніларилалкілкарбонат, алкілкарбонат, арилгалогеналкілкарбонат, арилалкенілкарбонат, арилкарбамат, алкілфосфініл, алкілфосфінотіоїл, арилфосфінотіоїл, арилалкілсульфонат і інший складний ефір. Такі групи можуть бути, але необов'язково, заміщені групами, згаданими раніше у визначенні R1. Відповідними захисними групами для амінів є карбамати, аміди або інші захисні групи, такі як алкіл, арилалкіл, сульфо- або галогенарилалкіл, галогеналкіл, алкілсилілалкіл, арилалкіл, циклоалкілалкіл, алкіларилалкіл, гетероциклілалкіл, нітроарилалкіл, ациламіноалкіл, нітроарилдитіоарилалкіл, дициклоалкілкарбоксамідоалкіл, циклоалкіл, алкеніл, арилалкеніл, нітроарилалкеніл, гетероциклілалкеніл, гетероцикліл, гідроксигетероцикліл, алкілдитіо, алкокси- або галоген- або алкілсульфініларилалкіл, гетероциклілацил і інші карбамати, і алканоїл, галогеналканоїл, арилалканоїл, алкеноїл, гетероциклілацил, ароїл, арилароїл, галогенароїл, нітроароїл і інші аміди, а також алкіл, алкеніл, алкілсилілалкоксіалкіл, алкоксіалкіл, ціаноалкіл, гетероцикліл, алкоксіарилалкіл, циклоалкіл, нітроарил, арилалкіл, алкокси- або гідроксіарилалкіл і багато які інші групи. Такі групи можуть бути, але 35 75597 необов'язково, заміщені групами, згаданими раніше у визначенні R1. Приклади таких захисних груп представлені в нижченаведених таблицях. захист для групи -ОН простий ефір позначення метил метоксиметил MOM бензилоксиметил BOM метоксіетоксиметил MEM 2-(триметилсиліл)етоксиметил SEM метилтіометил МТМ фенілтіометил РТМ азидометил ціанометил 2,2-дихлор-1,1-дифторетил 2-хлоретил 2-брометил тетрагідропіраніл ТНР 1-етоксіетил ЕЕ фенацил 4-бромфенацил циклопропілметил аліл пропаргіл ізопропіл циклогексил трет-бутил бензил 2,6-диметилбензил 4-метоксибензил МРМ або РМВ о-нітробензил 2,6-дихлорбензил 3,4-дихлорбензил 4-(диметиламіно)карбонілбензил 4-метилсульфінілбензил Msib 9-антрилметил 4-піколіл гептафтор-п-толіл тетрафтор-4-піридил триметилсиліл TMS трет-бутилдиметилсиліл TBDMS трет-бутилдифенілсиліл TBDPS триізопропілсиліл TIPS складний ефір арилформіат арилацетат ариллевулінат арилпівалоат ArOPv арилбензоат арил-9-фторкарбоксилат арилметилкарбонат 1-адамантилкарбонат трет-бутилкарбонат BOC-OAr 4-метилсульфінілбензилкарбонат Msz-Oar 2,4-диметилпент-3-ілкарбонат DOC-Oar арил-2,2,2-трихлоретилкарбонат арилвінілкарбонат арилбензилкарбонат арилкарбамат диметилфосфініл Dmp-OAr диметилфосфінотіоїл Mpt-OAr дифенілфосфінотіоїл Dpt-Oar арилметансульфонат арилтолуолсульфонат 36 арил-2-формілбензолсульфонат захист для групи -ΝΗ2 карбамати метил етил 9-флуоренілметил 9-(2-сульфо)флуоренілметил 9-(2,7-дибром)флуоренілметил 17тетрабензо[а,с,g,і]флуоренілметил 2-хлор-3-інденілметіл бенз[f]інден-3-метил 2,7-ді-трет-бутил[9-(10,10діоксо-10,10,10,10тетрагідротіоксантил)]метил 2,2,2-трихлоретил 2-триметилсилілетил 2-фенілетил 1-(1-адамантил)-1-метилетил 2-хлоретил 1,1-диметил-2-хлоретил 1,1-диметил-2-брометил 1,1 -диметил-2,2-диброметил 1,1-диметил-2,2,2-трихлоретил 1-метил-1-(4-біфеніл)етил 1-(3,5-ді-трет-бутилфеніл)1,1-метилетил 2-(2'- і 4'-піридил)етил 2,2-біс(4'-нітрофеніл)етил N-(2-півалоїламіно)1,1-диметилетил 2-[(2-нітрофеніл)дитіо]1-фенілетил 2-(N,Nдициклогексилкарбоксамідо)етил трет-бутил 1-адамантил 2-адамантил вініл аліл позначення Fmoc Tbfmoc Climoc Вітос DBD-Tmdc Troc Теос hZ Adpoc DB-t-BOC ТСВОС Врос t-Burmeoc Руос Вnреос NpSSPeoc BOC 1-Adoc 2-Adoc Voc Aloe або Alloc Іраос Соc Noc Раlос 1-ізопропілаліл цинаміл 4-нітроцинаміл 3-(3'-піридил)проп-2-єніл 8-хіноліл N-гідроксипіперидиніл алкілдитіо бензил Cbz або Ζ п-метоксибензил Μοz п-нітробензил ΡΝΖ п-бромбензил п-хлорбензил 2,4-дихлорбензил 4-метилсульфінілбензил Msz 9-антрилметил дифенілметил фенотіазиніл-(10)-карбоніл N'-п-толуолсульфоніламінокарбоніл N'-феніламінотіокарбоніл аміди формамід ацетамід хлорацетамід трифторацетамід TFA фенілацетамід 3-фенілпропанамід 37 75597 38 пент-4-єнамід піколінамід 3-піридилкарбоксамід бензамід п-фенілбензамід N-фталімід N-тететрахлорфталімід TCP 4-нітро-N-фталімід N-дитіасукцинімід Dts N-2,3-дифенілмалеімід де R1 і R4, взяті разом, утворюють групу форN-2,5-диметилпірол мул (IV), (V), (VI) або (VII): N-2,5біс(триізопропілсилоксил)пірол BIPSOP продукт приєднання N-1,1,4,4тетраметилдисилілазациклопентануSTABASE 1,1,3,3-тетраметил-1,3BSB дисилаізоіндолін спеціальні -NH-захисні групи N-метиламін N-трет-бутиламін N-аліламін N-[2(триметилсиліл)етокси]метиламін SEM а більш конкретно групу (IV) або (V); N-3-ацетоксипропіламін R21 представляє -Н, -ОН або -CN, а більш конN-ціанометиламін кретно -ОН або -CN; і їх ацильні похідні, а більш N-(1-ізопропіл-4-ніиро-2-оксо-3 конкретне 5-ацильні похідні, включаючи 5-піролін-3 -іл)амін ацетильне похідне. N-2,4-диметоксибензиламін Dmb У загальних рисах, перетворення вихідної 212-азанорборнени ціаносполуки в ектеїнасцидиновий продукт, наприN-2,4-динітрофеніламін клад, формули (XVTII) передбачає: N-бензиламін Вn a) перетворення, якщо це необхідне, хінонової N-4-метоксибензиламін МРМ системи для кільця Ε у фенольну систему; N-2,4-диметоксибензиламін DMPM b) перетворення, якщо це необхідне, хінонової N-2-гідроксибензиламін Hbn системи для кільця А у фенольну систему; N-(дифенілметил)аміно DPM c) перетворення фенольної системи для кільN-біс(4-метоксифеніл)метиламін ця А в метилендіоксифенольне кільце; N-5-дибензосубериламін DBS d) утворення місткової спіроциклічної системи N-трифенілметиламіно Тr формул (IV), (VI) або (VII) через 1-положення і 4N-[{4положення в кільці В; і метоксифеніл)дифенілметил]амін ММТr e) дериватизацію, таку як ацилювання, якщо N-9-фенілфлуореніламін Pf це необхідне. N-фероцинілметиламіно Fcm Стадія (а), перетворення, якщо це необхідне, N-2-піколіламіну N'-оксид хінонової системи для кільця Ε у фенольну систеΝ-1,1-диметилтіомеотиленамін му, може бути здійснена стандартними методами N-бензиліденамін відновлення. Відповідною системою реагентів є N-п-метоксибензилиденамін водень разом з каталізатором "паладій на вуглеці", N-дифенілметиленамін хоча можуть бути використані й інші системи відN-(5,5-диметил-3-оксо-1новлення. циклогексеніл)амін Стадія (b), перетворення, якщо це необхідне, N-нітроамін хінонової системи для кільця А у фенольну систеN-нітрозоамін му, аналогічна стадії (а) і не потребує більш додифенілфосфінамід Dpp кладного опису. диметилтіофосфінамід Mpt Стадія (с), перетворення фенольної системи дифенілтиофосфінамід Ppt для кільця А в метилендіоксифенольне кільце модибензилфосфорамідат же бути здійснено декількома способами, можли2-нітробензолсульфенамід Nps во, разом зі стадією (b). Так, наприклад, хінонове Ν-1-(2,2,2-трифтор-1,1кільце А може бути деметильоване за метоксизадифеніл)етилсульфенамід TDE місником в 7-положенні, відновлене до дигідрохі3-нітро-2-піридинсульфенамід Npys нону і акцептоване відповідним електрофільньм п-толуолсульфонамід Ts реагентом, таким як СН2Вr2, ВrСН2Сl або аналогічбензолсульфонамід ним двовалентним реагентом з одержанням безКонкретними ектеїнасцидиновими продуктами посередньо метилендіокси-циклічної системи, або даного винаходу є сполуки формули (XVIII): двовалентним реагентом, таким як тіокарбонілдіімідазол, з одержанням заміщеної метилендіоксициклічної системи, яка може бути перетворена в потрібне кільце. 39 75597 40 Стадію (d) звичайно здійснюють за допомогою в стовпці 8, стадія (1), і приклад 33 цього патенту відповідного заміщення в 1-положенні місткоутвоСША, і аналогічні уривки тексту. рюючим реагентом, який може сприяти формуванДериватизація на стадії (d) може включати ню потрібного містка з утворенням ексендохінонацилювання, наприклад, групою Ra-CO, де група метиду в 4-положенні і сприяє взаємодії метиду із Ra може представляти різні групи, такі як алкіл, 1-замісником, що приводить до утворення місткоалкокси, алкілен, арилалкіл, арилалкілен, амінокивої структури. Переважні місткоутворюючі реагенслота-ацил або гетероцикліл, кожний з яких нети мають формулу (XIX) обов'язково заміщений галогеном, ціано, нітро, карбоксіалкілом, алкокси, арилом, арилокси, гетероциклілом, гетероциклілокси, алкілом, аміно або заміщеним аміно. Іншими ацилюючими агентами є ізотіоціанати, такі як арилізотіоціанати, а зокрема, фенілізоціанат. Алкільна, алкокси або алкіленова групи Ra звичайно мають від 1 до 6 або 12 атомів вуглецю і можуть бути прямими, розгалуженими де Fu означає захищену функціональну групу, 4a 3 або циклічними. Арильними групами звичайно є таку як група -NHProt , Prot представляє захисну феніл, біфеніл або нафтил. Гетероциклічні групи групу, а пунктирна лінія означає необов'язковий можуть бути ароматичними, або частково або повподвійний зв'язок. ністю ненасиченими, і звичайно мають від 4 до 8 Звичайно, метид утворюється при першому атомів в кільці, а більш переважно, 5 або 6 атомів введенні гідроксигрупи в 10-положенні в місці конв кільці, з одним або декількома гетероатомами, денсації кілець А і В, внаслідок чого утворюється вибраними з азоту, сірки і кисню. неповна структура формули (XX): Не претендуючи на вичерпне визначення, можна указати, що типовими групами Ra є алкіл, галогеналкіл, алкоксіалкіл, галогеналкоксіалкіл, арилалкілен, галогеналкіларилалкілен, ацил, галогенацил, арилалкіл, алкеніл і амінокислота. Так, наприклад, Ra-CO може представляти ацетил, трифторацетил, 2,2,2-трихлоретоксикарбоніл, ізовалерилкарбоніл, транс-3(трифторметил)цинамоїлкарбоніл, гептафторбутирилкарбоніл; деканоїлкарбоніл, трансцинамоїлкарбоніл, бутирилкарбоніл, 3хлорпропіонілкарбоніл, гідроцинамоїлкарбоніл або або більш переважно, неповна структура фотранс-гексеноїлкарбоніл, або аланіл, аргініл, аспармули (XXI): ртил, аспарагіл, цистил, глутаміл, глутамініл, гліцил, гістидил, гідроксипропіл, ізолейцил, лейцил, лізил, метіоніл, фенілаланін, проліл, серил, треоніл, тіроніл, триптофіл, тирозил, валіл, а також інші менш відомі амінокислотні ацильні групи, а також фталімідо і інші циклічні аміди. Інші приклади можна знайти серед вищеперелічених захисних груп. Сполуки, де -CO-Ra походить від амінокислоти і включає аміногрупу, можуть самі утворювати ацильні похідні. Відповідними N-ацильними сполуками є дипептиди, які, в свою чергу, можуть утворювати N-ацильні похідні. де групу R вибирають для потрібної групи фоЯк приклад, можна зазначити, що ціаносафрармул (IV), (V), (VI) або (VII). Для перших двох таких цин В формули 2 доцільно перетворювати в ЕТгруп, група R" звичайно має форму -CHFu-CH2743 більш коротким і більш прямим шляхом, ніж в SProt3. Потім ці захисні групи можуть бути видалераніше описаних методах. ні і модифіковані, якщо це необхідне, з одержанРетросинтетичний аналіз для одержання ЕТням потрібної сполуки. 743 з використанням сполуки 29 проілюстрований Типова процедура стадії (d) описана в патенті на схемі І. США 5721362, який вводиться в даний опис за допомогою посилання. Більш конкретно, див. текст 41 75597 42 Схема І Відповідно до вищезгаданої схеми І можна одержати ЕТ-743 за 21 послідовну стадію. У цьому способі ціаносафрацин В перетворюють в проміжну сполуку 25 відповідно до послідовності реакцій, яка, по суті, включає (1) видалення метоксигрупи, присутньої в кільці А, (2) відновлення кільця А і утворення метилендіоксигрупи в одній посудині, (3) гідроліз амідної функціональної групи, присутньої у вуглеці 1, (4) перетворення одержаної амінової групи в гідроксильну групу. Крім того, цей спосіб дозволяє уникнути захисту і зняття захисту у первинної спиртової функціональної групи в положенні 1 кільця В сполуки 25, при використанні безпосередньо цистеїнового залишку 29 для утворення проміжної сполуки 27. Цистеїнове похідне 29 захищають за аміногрупою , , трихлоретоксикарбонільною захисною групою для того, щоб зробити її сумісною з присутньою алільною групою і групою MOM. Проміжну сполуку 27 піддають прямому окисленню і циклізації. Ці підходи, разом з іншою стратегією зняття захисту в останніх стадіях синтезу, роблять цей шлях реакцій новими і більш прийнятним для промислового застосування, ніж спосіб, описаний в патенті США 5721362. Перетворення 2-ціаносполуки в проміжну сполуку 25 звичайно включає нижченаведені стадії (див. схему II): утворення захищеної сполуки формули 14 за допомогою взаємодії сполуки 2 з третбутоксикарбонільним ангідридом; перетворення сполуки 14 в дизахищену сполуку формули 15 за допомогою її взаємодії з бромметилметиловим ефіром і діізопропілетиламіном в ацетонітрилі; селективного видалення метоксигрупи з хінонової системи в сполуці 15 за допомогою взаємодії з метанольним розчином гідроксиду натрію з одержанням сполуки формули 16; перетворення сполуки 16 в метилендіоксисполуку формули 18 відповідно до нижченаведеної переважної послідовності реакцій: (1) відновлення хінонової групи сполуки 16 в присутності 10% Pd/C в атмосфері водню; (2) перетворення гідрохінонової проміжної сполуки в метилендіоксисполуку формули 17 за допомогою взаємодії з бромхлорметаном і карбонатом цезію в атмосфері водню; (3) перетворення сполуки 17 в сполуку формули 18 за допомогою захисту вільної гідроксильної групи як група OCH2R. Цю реакцію взаємодії здійснюють з використанням BrCH2R і карбонату цезію, де R може представляти арил, СН=СН2, OR' і т.п.; видалення трет-бутоксикарбонільних і метоксиметильних захисних груп сполуки 18 за допомогою її взаємодії з розчином НСІ в діоксані з одержанням сполуки формули 19. Вказану реакцію взаємодії також здійснюють за допомогою змішування сполуки 18 з розчином трифтороцтової кислоти в дихлорметані; утворення тіосечовинної сполуки формули 20 за допомогою взаємодії сполуки 19 з фенілізотіоціанатом; перетворення сполуки формули 20 в амінову сполуку формули 21 за допомогою реакції з розчином хлористого водню в діоксані; перетворення сполуки формули 21 в N-Trocпохідне 22 за допомогою реакції з трихлоретилхлорформіатом і піридином; утворення захищеної гідроксисполуки формули 23 за допомогою взаємодії сполуки 22 з бром 43 75597 44 метилметиловим ефіром і діізопропілетиламіном; вої кислоти і ацетонітрилу з подальшою обробкою перетворення сполуки формули 23 в N-Hгідроксидом натрію. Крім того, може бути викориспохідне 24 за допомогою реакції з оцтовою кислотаний нітрит натрію в суміші оцтового ангідридутою і цинком; оцтової кислоти з подальшою обробкою гідроксиперетворення сполуки формули 24 в гідроксидом натрію. сполуку формули 25 за допомогою реакції з нітритом натрію в оцтовій кислоті. Альтернативно, може Схема II бути використаний тетроксид азоту в суміші оцто 45 75597 46 Ошибка! Перетворення проміжної сполуки 25 в сполуку ЕТ-743 з використанням цистеїнової сполуки 29, звичайно включає нижченаведені стадії (див. схему III): 47 Схема III 75597 48 49 перетворення сполуки формули 24 в похідне 30 шляхом захисту первинної гідроксильної функціональної групи (S)-N-2,2,2трихлоретоксикарбоніл-8-(9Н-флуорен-9 75597 50 ілметил)цистеїном 29; перетворення захищеної сполуки формули 30 в фенольне похідне 31 шляхом відщеплення алільної групи з використанням гідриду трибутилоло 51 75597 52 ва і дихлорпаліадій-біс(трифенілфосфіну); групи сполуки формули 34 в сполуку 35 за допомоперетворення фенольної сполуки формули 31 гою реакції з Zn/AcOH; в сполуку формули 32 шляхом окислення ангідриперетворення амінової сполуки 35 у відповідну дом бензолселенінової кислоти при низькій темпе-кетолактонову сполуку 36 за допомогою реакції ратурі; взаємодії з карбоксальдегідхлоридом Nперетворення гідроксисполуки формули 32 в метилпіридинію, а потім з DBU; лактон 33 відповідно до наступної послідовності утворення ЕТ-770 за допомогою реакції взаєреакцій: (1) взаємодії сполуки формули 32 з 2екв. модії сполуки формули 36 з 3-гідрокси-4ангідриду трифторметансульфонової кислоти і 5 метоксифенілетил аміном; екв. ДМСО, (2) подальшої взаємодії з 8екв. діізопперетворення ЕТ-770 в ЕТ-743 за допомогою ропілетиламіну, (3) подальшої взаємодії з 4екв. реакції взаємодії з нітратом срібла в суміші трет-бутилового спирту, (4) подальшої взаємодії з AcN/HaO. 7екв. 2-трет-бутил-1,1,3,3-тетраметилгуанідину, (5) Одержання проміжної сполуки 11 і споріднених подальшої взаємодії з 10екв. оцтового ангідриду; проміжних сполук перетворення лактонової сполуки 33 в гідрокРетросинтетичний аналіз проілюстрований на сильну сполуку 34 шляхом видалення захисної нижченаведеній реакційній схемі. групи MOM з використанням TMSI; відщеплення N-трихлоретоксикарбонільної У даному винаході, ключовий клас проміжних сполук включає проміжну сполуку 11 і має загальну формулу (XXI): де Prot1 і Prot2 представляють гідроксизахисні групи, переважно, різні. Для самої проміжної сполуки 11, група Prot1 представляє метоксиметильну групу, а Prot2 представляє третбутилдифенілсилільну групу. Перетворення 21-ціаносполуки в проміжну сполуку 11 або споріднену проміжну сполуку формули (XXI) звичайно включає наступні стадії: a) перетворення, якщо це необхідне, хінонової системи для кільця Ε у фенольну систему; b) утворення групи -OProt1 у 18-положенні кільця Е; c) утворення групи -CH2-OProt2 у 1-положенні кільця В; d) перетворення, якщо це необхідне, хінонової системи для кільця А у фенольну систему; e) перетворення вказаної фенольної системи кільця А в метилендіоксифенольне кільце. На стадії (b), утворення групи -OProt1 в 18положенні кільця Ε є типовою реакцією захисту для фенольної групи, і, в цьому випадку, якихнебудь конкретних коментарів не потрібно. Відповідні умови вибирають в залежності від природи захисної групи. Інші стадії аналогічні іншим реакціям. На стадії (с), утворення групи -CH2-OProt2 в 1положенні кільця В звичайно здійснюють за допомогою утворення групи -CH2NH2 в 1-положенні з подальшим перетворенням функціональної аміногрупи в функціональну гідроксигрупу і захистом. Таким чином, якщо вихідна речовина має групу R1, яка являє собою -CH2-NH-CO-CR25aR25bR25c, то потрібно видалити N-ацильну групу. Якщо вихідна речовина має групу R1, яка являє собою -CH2-OCO-R, то для одержання ектеїнасцидинового продукту, в якому R1 має те ж саме значення, якихнебудь змін не потрібно. Для одержання інших продуктів потрібно видалити О-ацильну групу. Для здійснення таких реакцій деацилювання існують різні способи. У одному варіанті, деацювання і перетворення у функціональну гідроксигрупу здійснюють в одну стадію. Потім, гідроксигрупа може бути ацильована або яким-небудь іншим способом перетворена у відповідну групу R1. У патенті США №5721362 описані синтетичні способи одержання ЕТ-743 за допомогою тривалого багатостадійного синтезу. Однією з проміжних сполук цього синтезу є проміжна сполука 11. Одержання проміжної сполуки 11 може бути досягнуте з використанням ціаносафрацину В як вихідної речовини, що дає більш короткий спосіб одержання такої проміжної сполуки, а тому дозволяє удосконалити спосіб одержання ЕТ-743. Ціаносафрацин В може бути перетворений в проміжну сполуку 25 описаними вище способами. 53 75597 54 З проміжної сполуки 25 можна одержати проміжну бутилдифенілсилілхлоридом в присутності основи; сполуку 11 з використанням нижченаведених стакінцевого відщеплення алільної групи під дією дій, див. схему VII: гідриду трибутилолова і дихлорпаладійутворення захищеної гідроксисполуки формубіс(трифенілфосфіну) в сполуці 26 з утворенням ли 26 за допомогою взаємодії сполуки 25 з третпроміжної сполуки 11. Схема VII Один з варіантів синтетичного способу даного винаходу для перетворення сафрацину В у проміжну сполуку 11 передбачає модифікацію і розширення схеми VIII і включає послідовні стадії: стереоспецифічного перетворення сполуки сафрацину В у сполуку формули 2 шляхом селективної заміни ОН на CN за допомогою взаємодії з KCN в кислому середовищі; утворення сполуки тіосечовини формули 3 внаслідок взаємодії сполуки формули 2 з фенілізотіоціанатом; перетворення сполуки тіосечовини формули 3 в ацетамід формули 5 шляхом гідролізу в кислому середовищі з подальшим додаванням оцтового ангідриду; причому, проміжна амінова сполука формули 4 може бути виділена шляхом гасіння гідролізу в кислому середовищі бікарбонатом натрію, але ця проміжна сполука є дуже нестабільною і швидко перетворюється в п'ятичленний циклічний імін, названий сполукою 6; утворення захищеної сполуки формули 7 за допомогою взаємодії з бромметилметиловим ефіром і діізопропілетиламіном в дихлорметані; селективного деметилювання метоксигрупи хінонової системи сполуки формули 7 за допомогою реакції з метанольним розчином гідроксиду натрію з одержанням сполуки формули 8; перетворення сполуки формули 8 в метилен діоксисполуку формули 9 відповідно до наступної переважної послідовності реакцій: (1) відновлення хінонової групи сполуки 8 з використанням 10% Pd/C в атмосфері водню; (2) перетворення гідрохінонової проміжної сполуки у метилендіоксисполуку формули 9 за допомогою взаємодії з бромхлорметаном і карбонатом цезію в атмосфері водню; (3) перетворення сполуки формули 9 в сполуку формули 10 шляхом захисту вільної гідроксильної групи як групи OCH2R за допомогою взаємодії з BrCH2R і карбонатом цезію, де R може представляти арил, СН=СН2, OR' і т.п.; перетворення ацетамідної групи сполуки формули 10 у відповідну гідроксильну групу формули 25 за допомогою взаємодії з тетроксидом азоту в суміші оцтової кислоти і ацетату оцтової кислоти, з подальшою обробкою гідроксидом натрію; альтернативно, може бути використаний нітрит натрію в суміші оцтового ангідриду і оцтової кислоти, з подальшою обробкою гідроксидом натрію; альтернативно, ацетамідна група сполуки формули 10 може бути перетворена в первинну амінову групу за допомогою взаємодії з гідразином або з Вос2О, DMAP, а потім з гідразином; причому, такий первинний амін може бути перетворений у відповідну гідроксильну групу (сполука формули 25) шляхом окислювального перетворення первинного аміну у відповідний альдегід з використанням бензолсу 55 75597 56 льфонату 4-форміл-1-метилпіридинію або іншого дином в дихлорметані (схема VII); іона піридинію, а потім з використанням DBU, або перетворення силілованої сполуки формули обробки іншою основою з подальшим гідролізом і 26 в проміжну сполуку 11 шляхом видалення захивідновленням альдегіду до відповідної гідроксильсної групи OCH2R і реакції в умовах відновлення ної групи з використанням алюмогідриду літію або або в кислих умовах. Звичайно, ці процедури здійіншого відновника; снюють з використанням паладієвої черні в атмоутворення захищеної сполуки формули 26 сфері водню або водній TFA або гідриду трибутивнаслідок взаємодії з третлолова і дихлорбіс(трифенілфосфінпаладію). бутилдифенілсилілхлоридом і диметиламінопіриСхема VIII 57 Ще в одному переважному варіанті даного винаходу, ціаносполука формули 2 може бути перетворена в проміжну сполуку 11 з використанням розширення схеми II, що включає додаткові стадії: утворення захищеної гідроксисполуки формули 26 за допомогою взаємодії сполуки 25 з третбутилдифенілсилілхлоридом в присутності основи; кінцевого відщеплення алільної групи під дією гідриду трибутилолова і дихлорпаладійбіс(трифенілфосфіну) в сполуці 26 з утворенням проміжної сполуки 11. Таким чином, ціаносафрацин В може бути перетворений в ряд проміжних сполук і похідних з потенційною протипухлинною терапевтичною активністю цими та іншими способами. Ці проміжні сполуки можуть бути одержані з вже описаних сполук або з використанням альтернативних способів. Нові проміжні сполуки Виходячи з вищенаведених пояснень очевидно, що даний винахід відноситься до нових проміжних сполук. В залежності від кільця А, цими сполуками є сполуки формули (ХХІІа): 75597 58 R5 представляє -ОН, або захищений або дериватизований варіант вказаної групи; R14a і R14b, обидва представляють -Н, або один з них представляє -Н, а інший представляє -ОН або захищений або дериватизований варіант вказаної групи, -ОСН3 або -ОСН2СН3, або, R14a і R14b, взяті разом, утворюють кетогрупу; R12 представляє -Н, -СН3 або -СН2СН3; R15 представляє -Н, -ОН, або захищений або дериватизований варіант вказаної групи; і R18 представляє -ОН, або захищений або дериватизований варіант вказаної групи. В одному з варіантів здійснення даного винаходу, принаймні, R1, R5, R14a, R14b, R15 або R18 переважно представляють захищену або дериватизовану групу. У одному з варіантів даного винаходу, група R1 не є трет-бутилдифенілсилільним замісником і/або група R18 не є метоксиметильною групою. R1 переважно представляє -CH2NH2 або СН2ОН, або захищений або дериватизований варіант вказаної групи, a R4 представляє -Н; або R1a і R4, взяті разом, утворюють групу або формули (ХХІІb): Переважно обидва R14a і R14b представляють Η. Один з переважних класів проміжних сполук включає сполуку, яка була ідентифікована як сполука 25, що має формулу: R представляє -CH2NH2 або -СН2ОН, або захищений або дериватизований варіант такої групи, a R4 представляє -Н; або R1a і R4, взяті разом, утворюють групу формул (IV), (V), (VI) або (VII): Переважний клас сполук має загальну формулу, де група MOM замінена будь-якою іншою захисною групою. Інші переважні проміжні сполуки включають сполуки, які автори винаходу ідентифікували як сполуки 45 і 43 (схема IX): 59 Інші N-ацильні похідні можуть бути легко одержані зі сполуки 45 і є важливою частиною даного винаходу. Відповідними ацильними групами є групи, згадані раніше. Також можуть бути використані відповідні 21-гідроксисполуки і сполуки з числа активних сполук, виявлених авторами даного винаходу. 75597 60 Нові активні сполуки Крім того, авторами даного винаходу було виявлено, що деякі сполуки даного винаходу, які спочатку були одержані як проміжні сполуки, володіють винятковою активністю при лікуванні ракових захворювань, таких як лейкоз, рак легень, рак товстої кишки, рак нирок і меланома.
ДивитисяДодаткова інформація
Назва патенту англійськоюA synthetic process for producing ecteinachidine compound
Назва патенту російськоюСинтетический способ получения соединения эктеинахидина
МПК / Мітки
МПК: C07D 515/00, C07D 491/22, C07D 471/18
Мітки: спосіб, сполуки, синтетичний, ектеїнахідину, одержання
Код посилання
<a href="https://ua.patents.su/94-75597-sintetichnijj-sposib-oderzhannya-spoluki-ektenakhidinu.html" target="_blank" rel="follow" title="База патентів України">Синтетичний спосіб одержання сполуки ектеїнахідину</a>
Попередній патент: Покриття для підлоги (варіанти) та панель для настилання покриття для підлоги
Наступний патент: Спосіб одержання 4-форміл-пара-терфенілу
Випадковий патент: Поворотно-фіксуючий механізм штанги обприскувача












