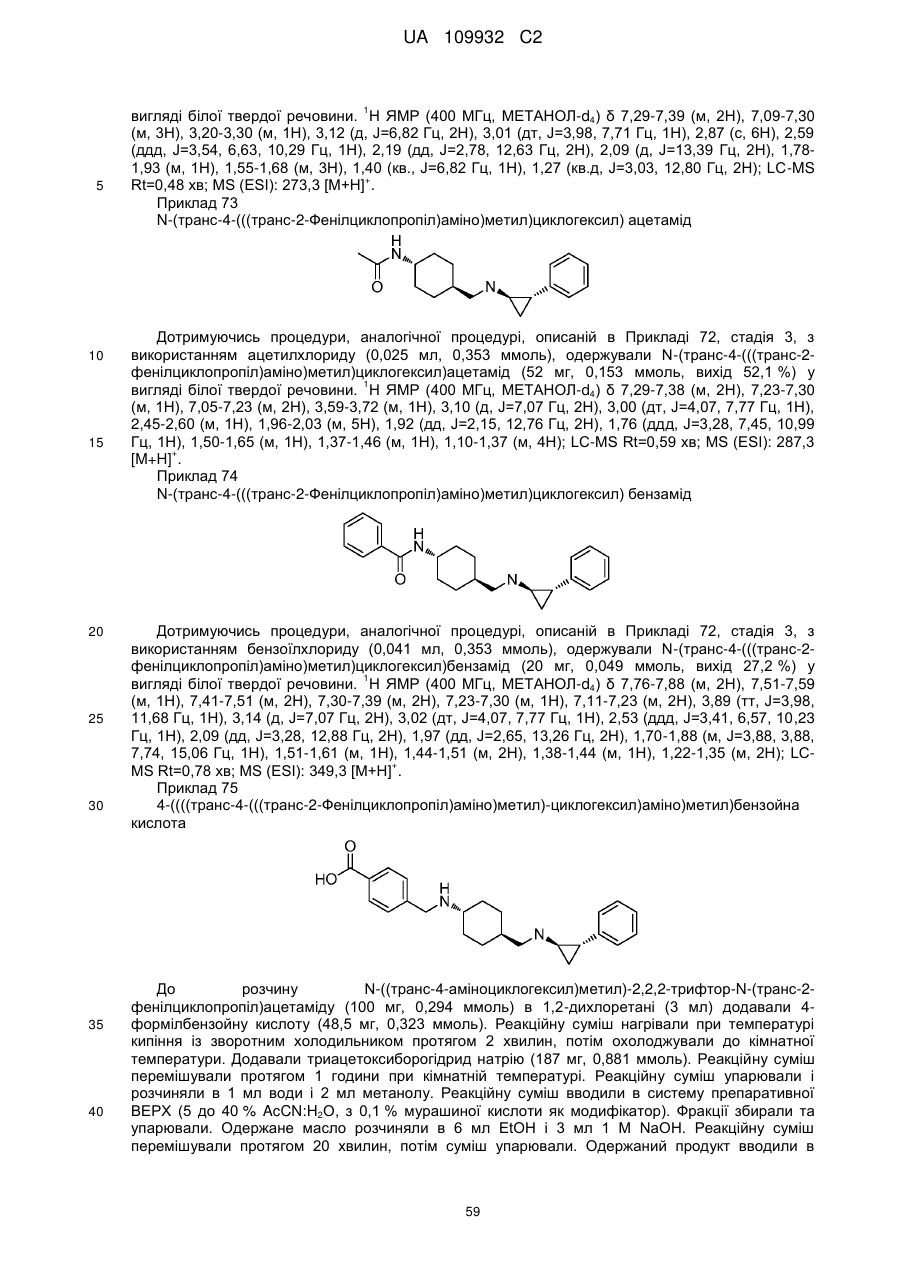
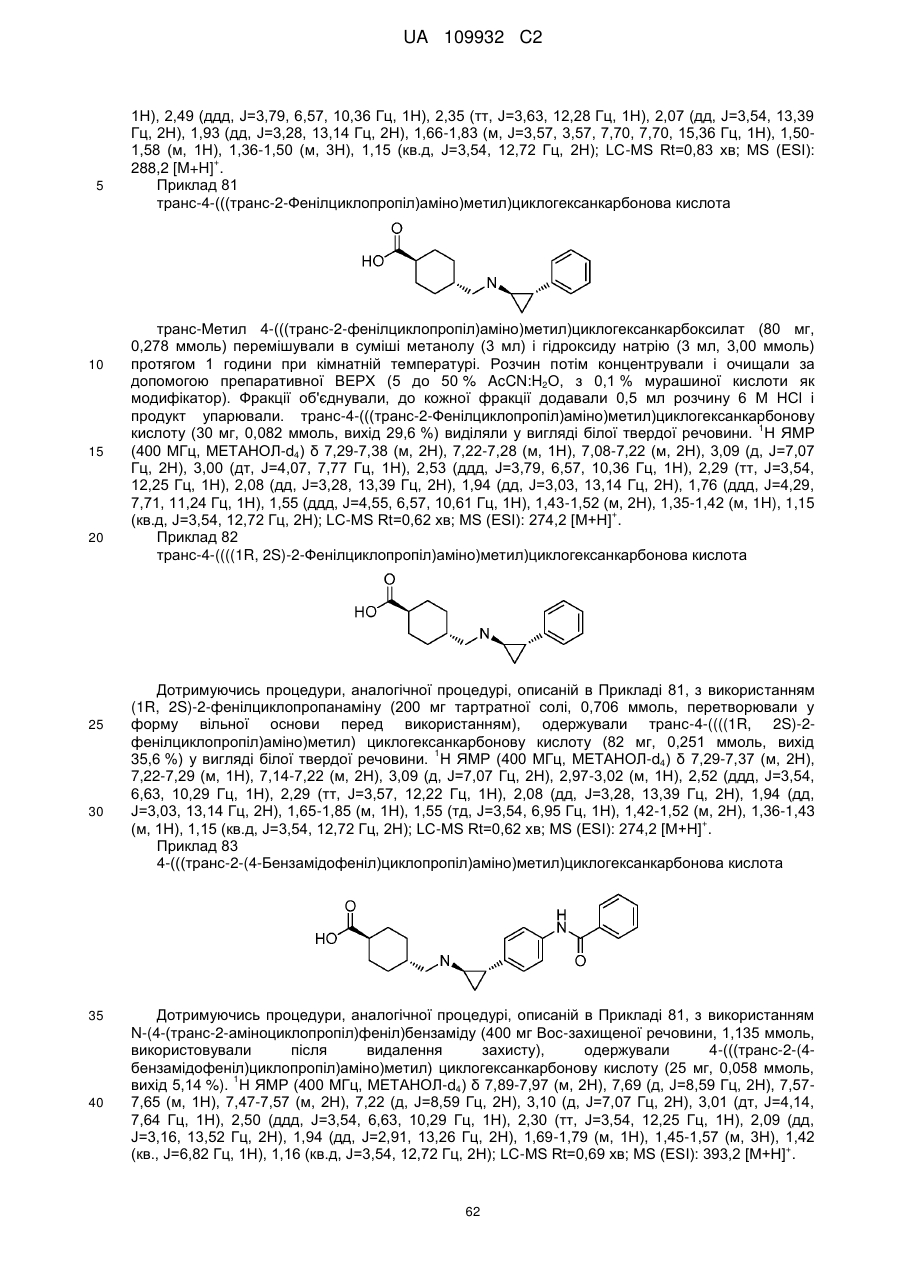
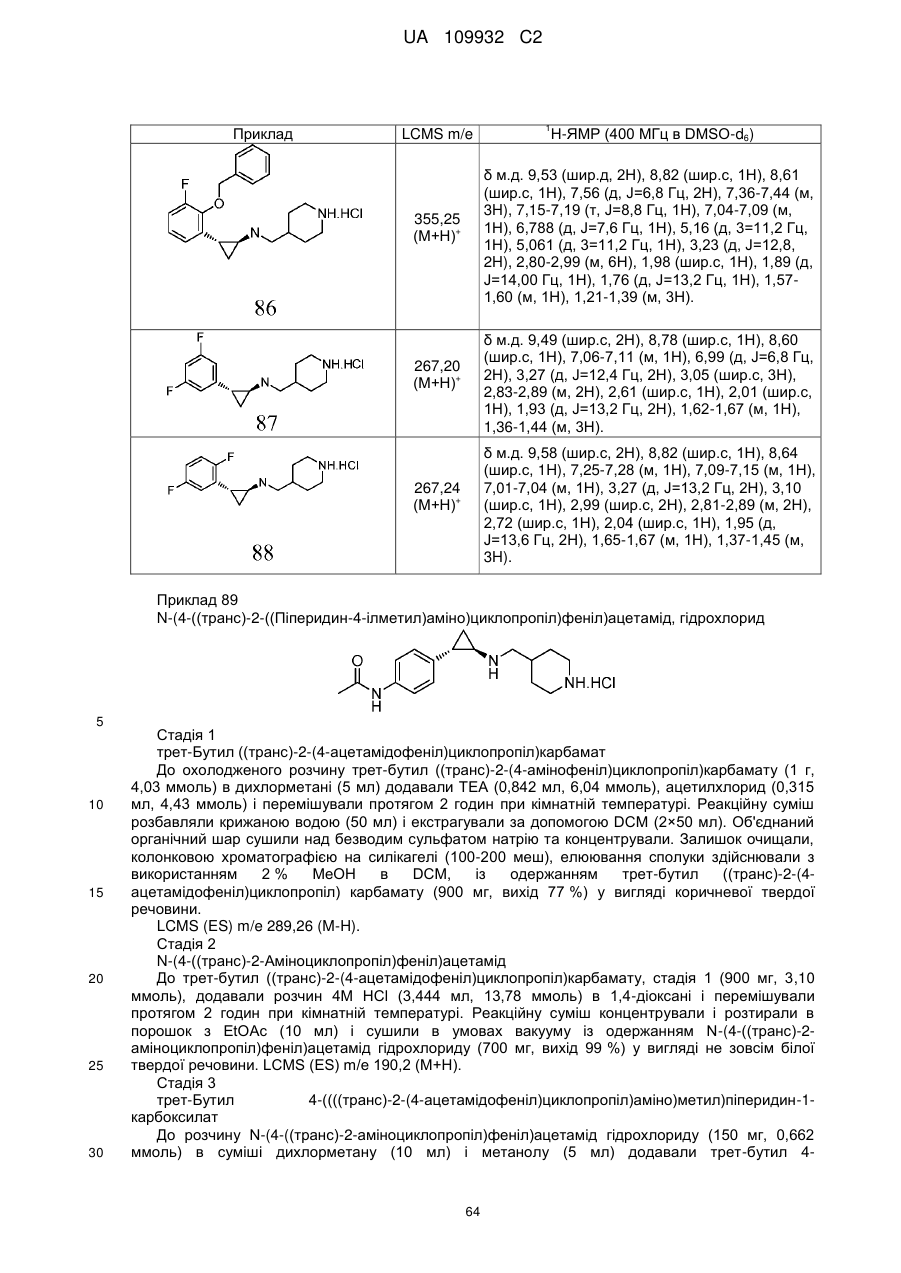
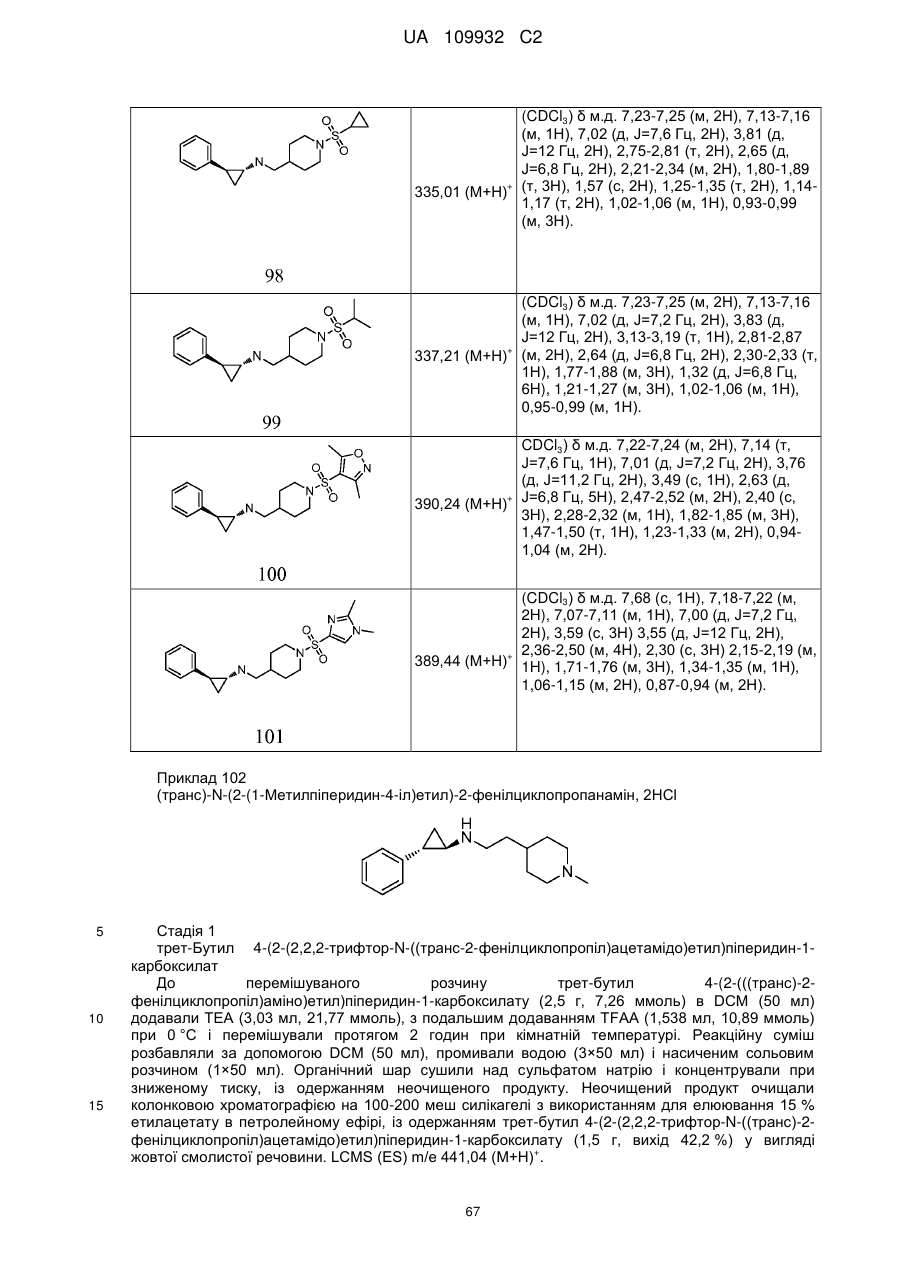
Циклопропіламіни як інгібітори lsd1
Номер патенту: 109932
Опубліковано: 26.10.2015
Автори: Каспарец Іржі, Джонсон Нейл В., Тянь Сіньжун, Міллер Вільям Генрі, Руз Меган Б., Суарез Домінік
Формула / Реферат
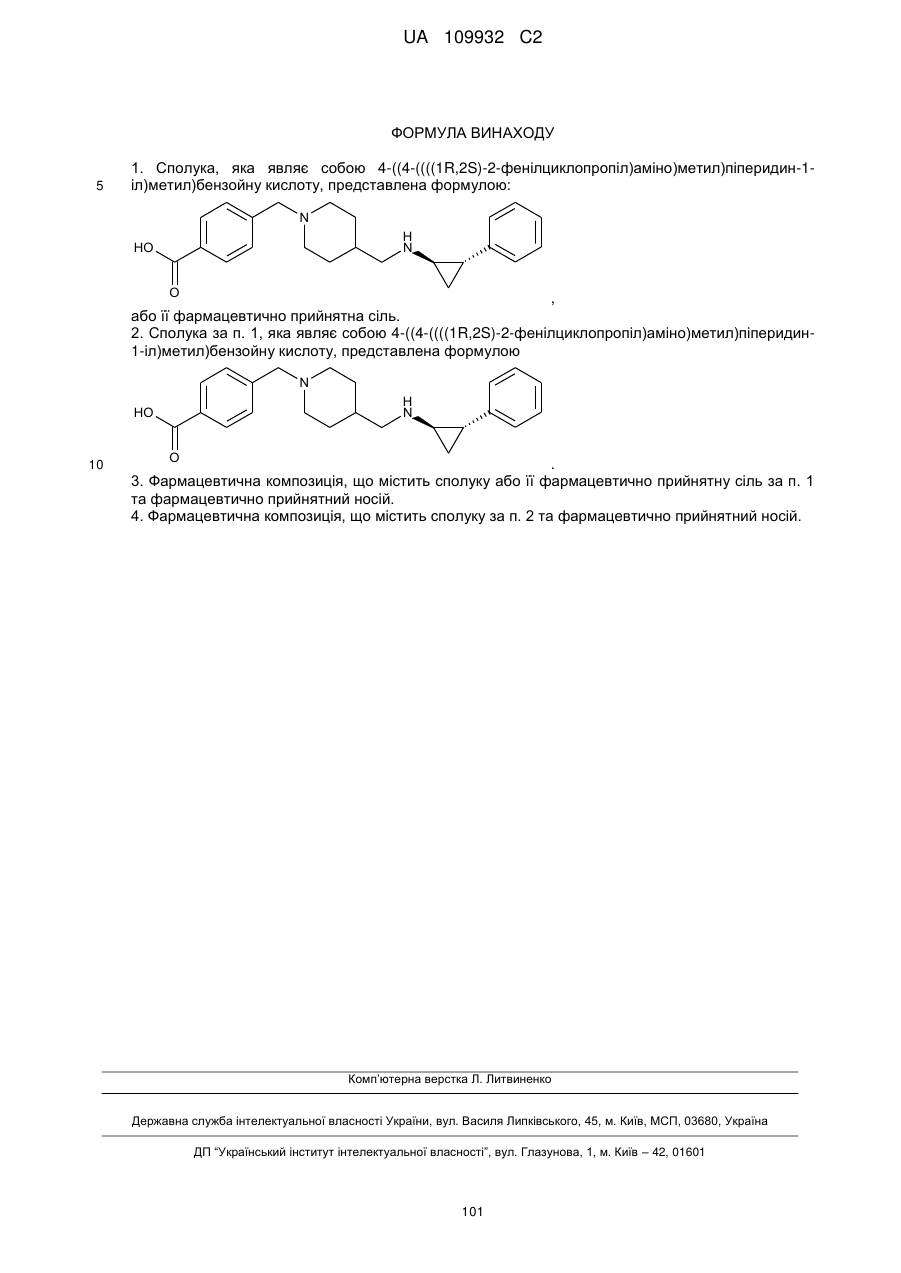
1. Сполука, яка являє собою 4-((4-((((1R,2S)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойну кислоту, представлена формулою:
 ,
,
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка являє собою 4-((4-((((1R,2S)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойну кислоту, представлена формулою
 .
.
3. Фармацевтична композиція, що містить сполуку або її фармацевтично прийнятну сіль за п. 1 та фармацевтично прийнятний носій.
4. Фармацевтична композиція, що містить сполуку за п. 2 та фармацевтично прийнятний носій.
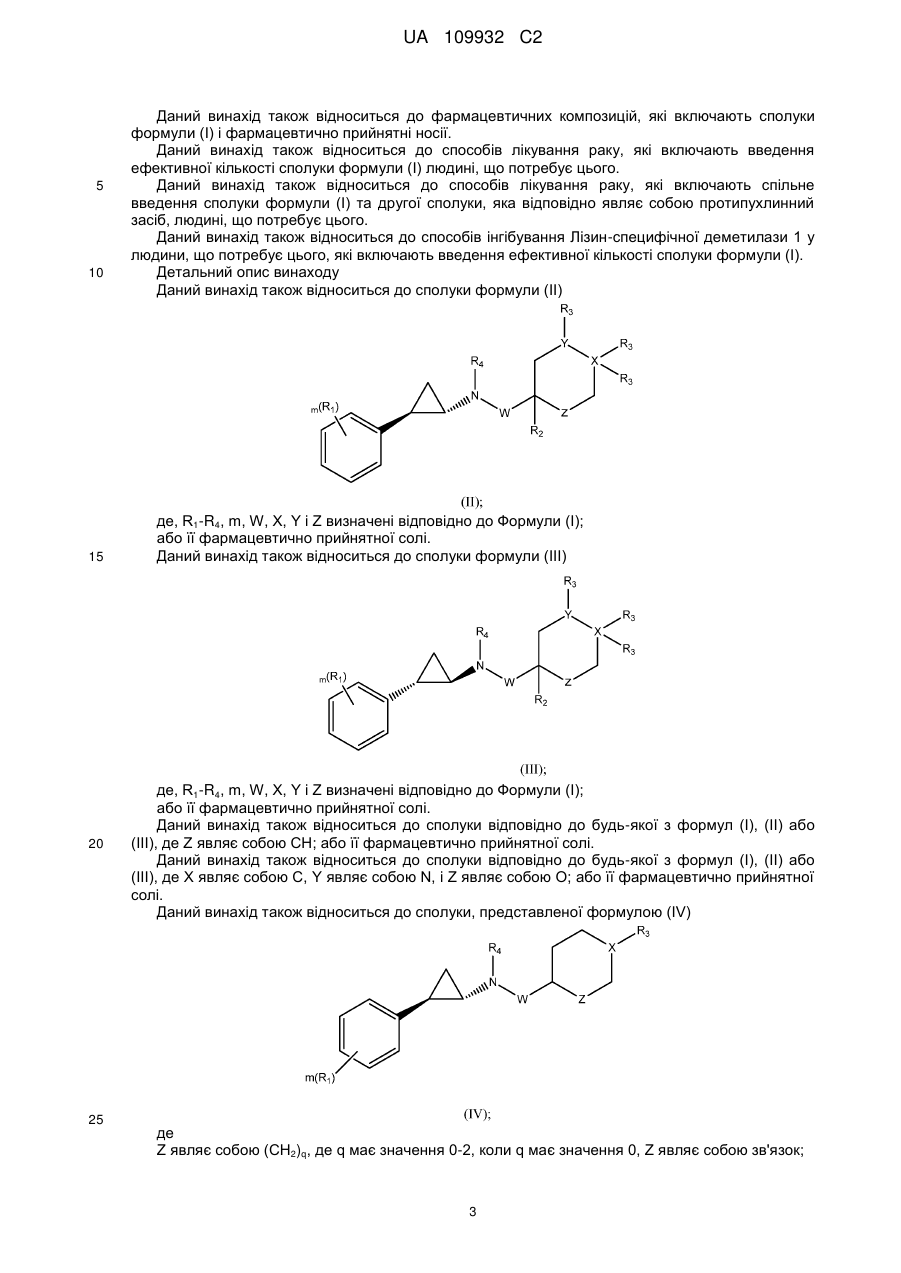
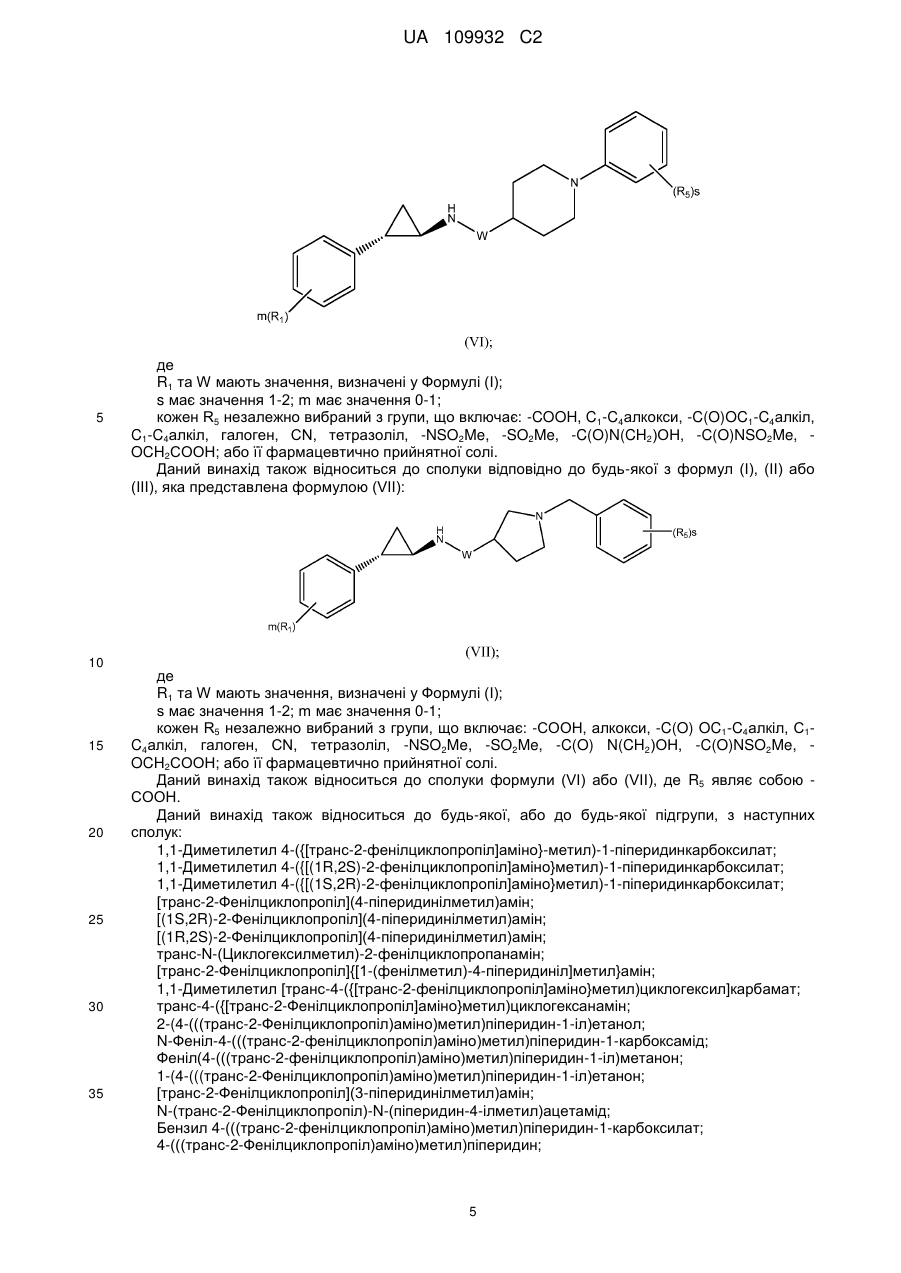
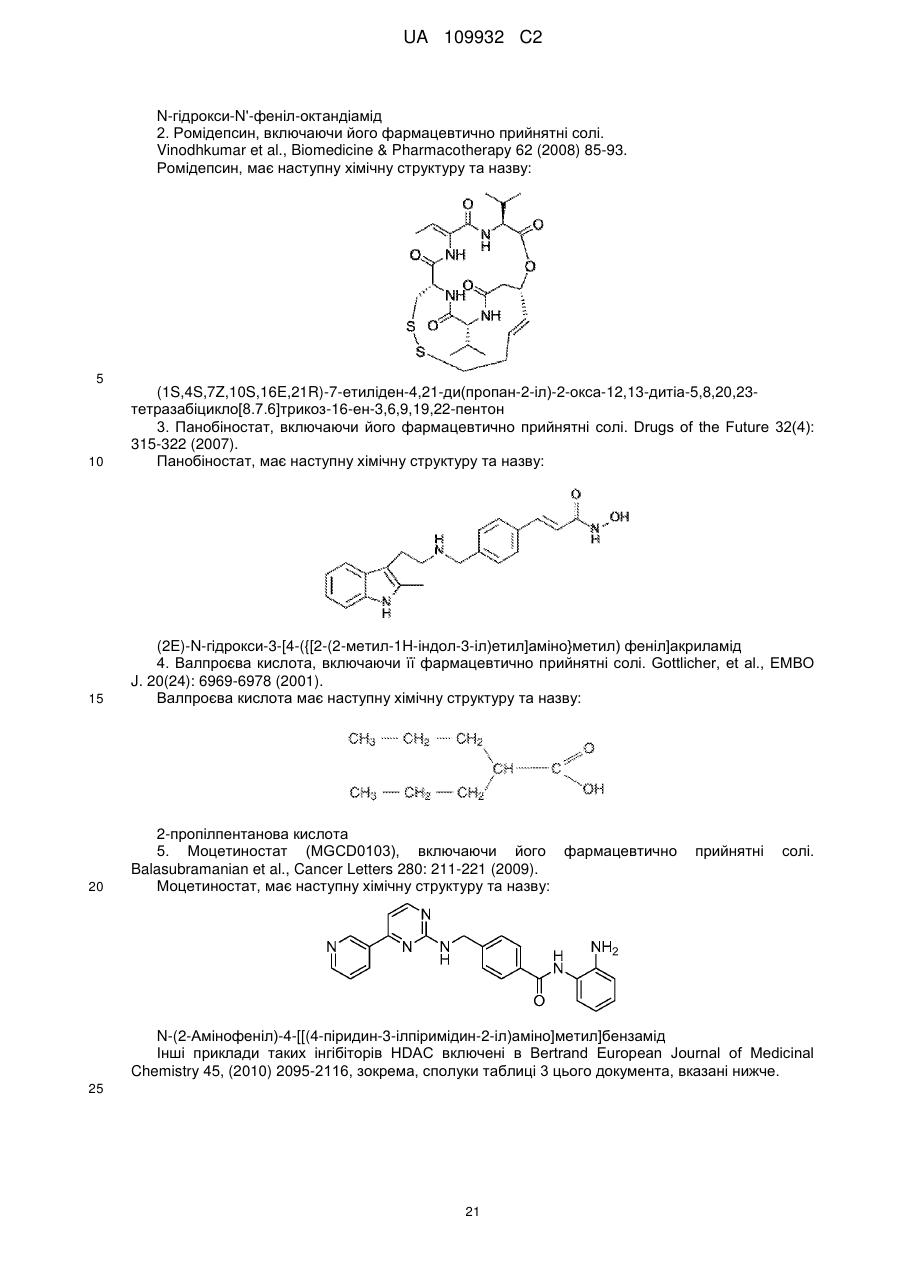
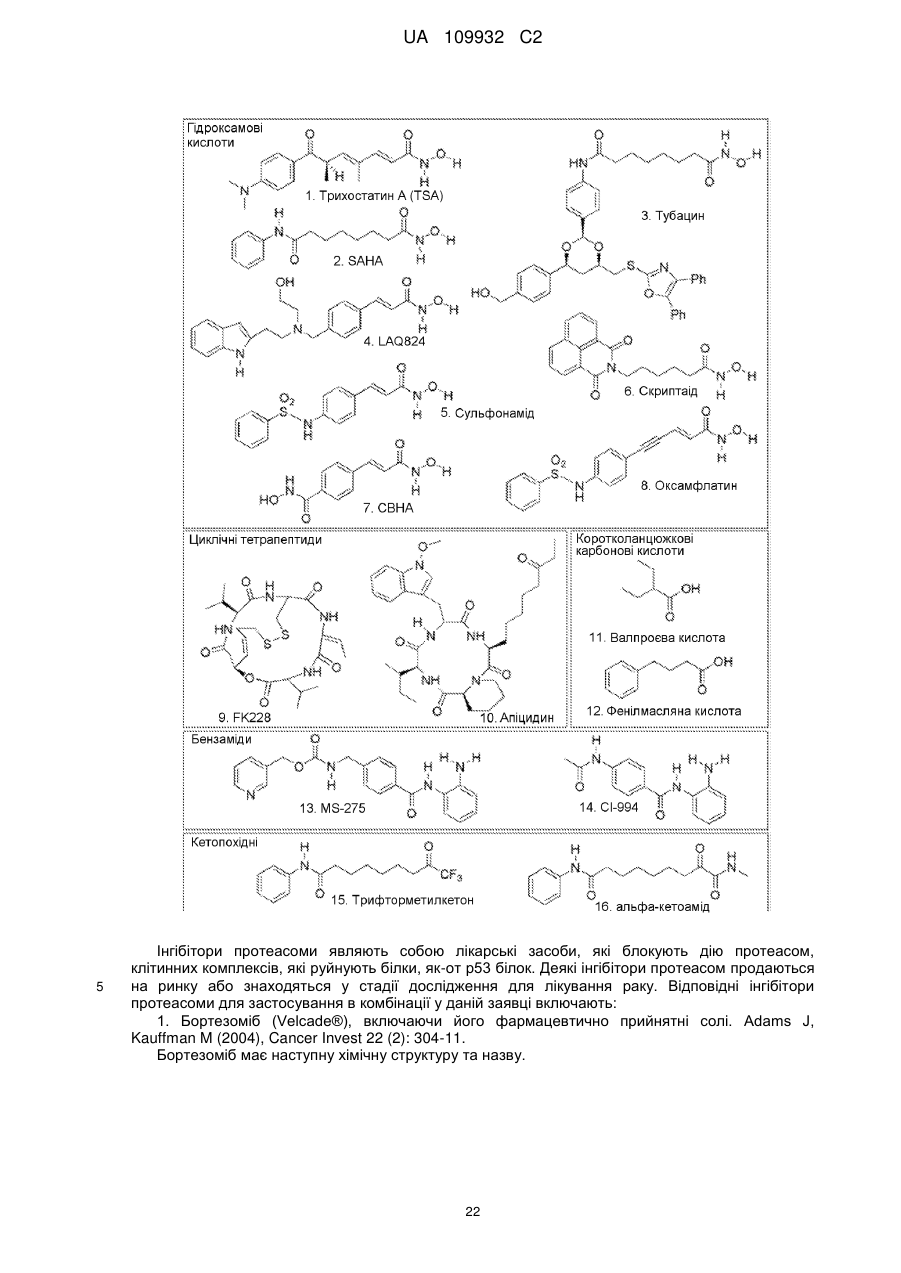
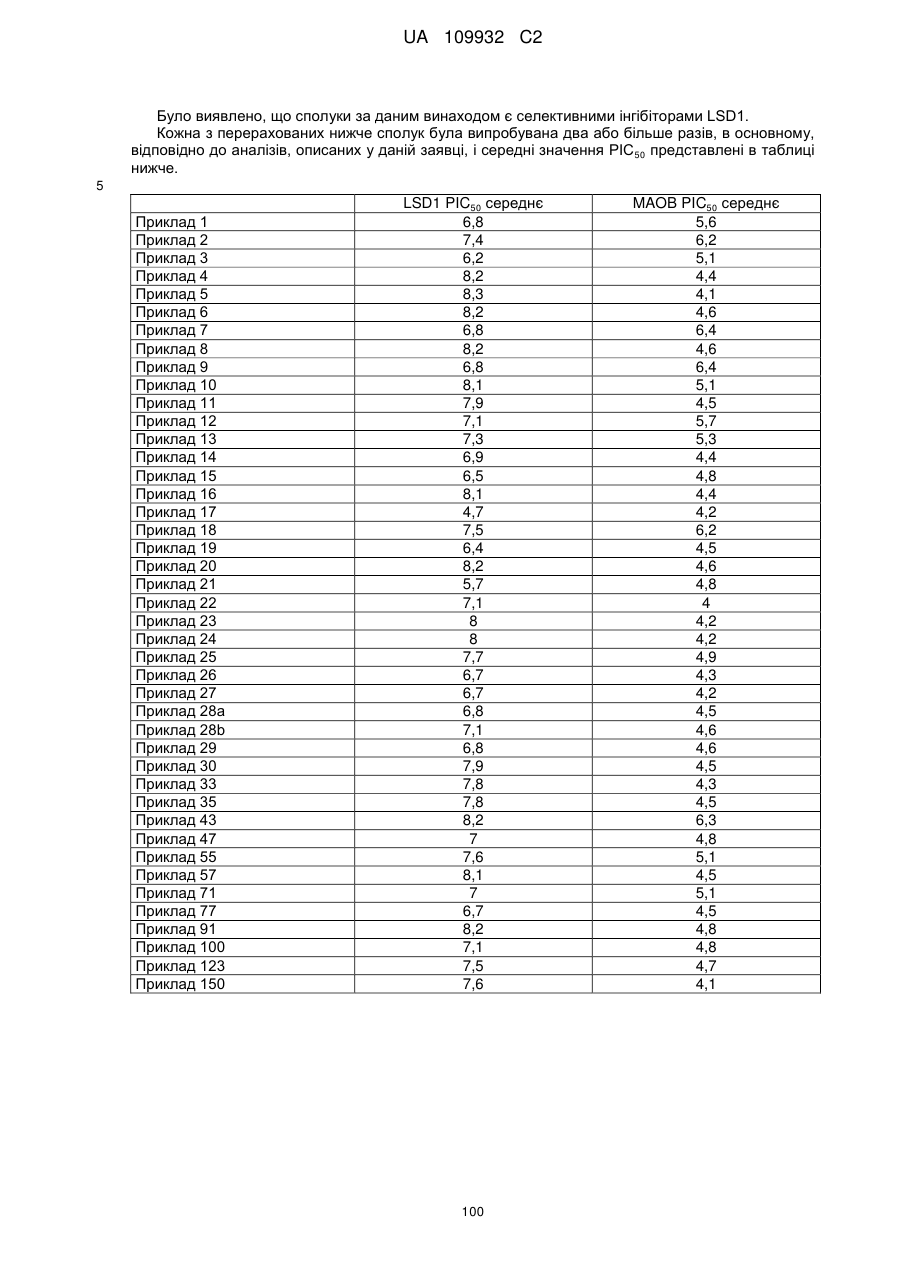
Текст
Реферат: Даний винахід стосується застосування циклопропіламінових похідних для модуляції, зокрема інгібування, активності лізинспецифічної деметилази 1(LSD1). Відповідно, даний винахід стосується застосування циклопропіламінів для лікування раку. UA 109932 C2 (12) UA 109932 C2 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід відноситься до нових циклопропіламінів, які є інгібіторами Лізин-специфічної деметилази 1 (LSD1; також відомої як BHC110), до фармацевтичних композицій, що їх містять, та до їх застосування в терапії для лікування раку. Передумови створення винаходу Модифікація хроматину грає істотну роль в регуляції транскрипції (T. Kouzarides, 2007, Cell 128: 693-705). Регуляція цих модифікацій, які включають метилування ДНК, ацетилювання гістону й метилування гістону, порушується в пухлині. Ця порушена епігенетична регуляція грає важливу роль в сайленсінгу супресорів пухлини і гіперекспресії онкогенів при раку (M. Esteller, 2008, N Engl J Med 358: 1148-59. P. Chi et al., 2010, Nat Rev Canc 10:457-469.). Ферменти, які регулюють метилування гістону, являють собою гістон-метилтрансферази та гістон-деметилази. Лізин-специфічна деметилаза 1п (LSD1; також відома як BHC110) являє собою гістонлізиндеметилазу, яка, згідно з повідомленнями, деметилує H3K4me1/2 (Y. Shi et al., 2004, Cell 119: 941-953) і H3K9me1/2 (R. Schule et al.,2005, Nature 437: 436-439). LSD1 надмірно експресується в багатьох типах раку людини, включаючи рак передміхурової залози, де він асоціюється з найбільш частими рецидивами (P. Kahl et al., 2006, Cane. Res. 66: 11341-11347), молочної залози (J. Kirfel et al., 2010, Carcinogenesis 31: 512-520), нейробластому (J. Kirfel et al, 2009, Canc. Res. 69: 2065-2071. G. Sun et al., 2010, Mol. Cell. Biol. 28: 1997-2000). LSD1 є істотним для регуляції транскрипції, опосередкованої декількома ядерними рецепторами гормонів, включаючи рецептор андрогена в раку передміхурової залози (R. Schuele et al., 2005, Nature 437: 436-439. R. Schuele et al., 2007, Nat. Cell Biol. 9: 347-353. R. Schuele et al., 2010, Nature 464: 792-796), рецептор естрогену в карциномах молочної залози (M.G. Rosenfeld et al., 2007, Cell 128: 505-518), та рецептор TLX в нейробластомі (S. Kato et al., 2008, Mol. Cell. Biol. 28: 3995-4003). Ці дослідження показали, що "нокдаун" експресії LSD1 призводить до зниження проліферації ракових клітін. Крім того, LSD1 надмірно експресується в багатьох типах раку, які є незалежними від ядерного рецептора гормону. Такі пухлини включають ER-негативну пухлину молочної залози (J. Kirfel et al., 2010, Carcinogenesis 31: 512-520), дрібноклітинний рак легені, сечового міхура, голови і шиї, товстої кишки, серозну пухлину яєчника та ниркову пухлину Вільмса. Тому сильні селективні малі молекули-інгібітори LSD1 можуть бути корисні для лікування типів раку, які є залежними від ядерного рецептора гормону та/або незалежними від ядерного рецептора гормону. Композиції та способи, представлені в даній заявці, потенційно можуть бути корисними для лікування раку, включаючи пухлини, як-от пухлини шкіри, молочної залози, головного мозку, цервікальні карциноми, тестикулярні карциноми і т.п. Конкретніше, типи раку, які можна лікувати композиціями та способами за даним винаходом, включають, але не обмежуються цим, такі типи пухлин, як астроцитні, молочної залози, цервікальні, колоректальні, ендометріальні, езофагеальні, гастральні, голови і шиї, гепатоцелюлярні, ларингеальні, легеневі, оральні, яєчників, передміхурової залози і щитовидної залози карциноми та саркоми. Конкретніше, ці сполуки потенційно можуть бути корисними для лікування пухлин: Сердечних: саркома (ангіосаркома, фібросаркома, рабдоміосаркома, ліпосаркома), міксома, рабдоміома, фіброма, ліпома і тератома; Легені: бронхіогенна карцинома (сквамозноклітинна, недиференційована дрібноклітинна, недиференційована крупноклітинна, аденокарцинома), альвеолярна (бронхіолярна) карцинома, бронхіальна аденома, саркома, лімфома, хондроматозна гамартома, мезотеліома; Шлунково-кишкових: стравоходу (сквамозноклітинна карцинома, аденокарцинома, лейоміосаркома, лімфома), шлунку (карцинома, лімфома, лейоміосаркома), підшлункової залози (дуктальна аденокарцинома, інсулінома, глюкагонома, гастринома, карциноїдні пухлини, віпома), тонкої кишки (аденокарцинома, лімфома, карциноїдні пухлини, саркома Капоші, лейоміома, гемангіома, ліпома, нейрофіброма, фіброма), товстої кишки (аденокарцинома, тубулярна аденома, ворсинчаста аденома, гамартома, лейоміома); Сечостатевих шляхів: нирки (аденокарцинома, пухлина Вільмса (нефробластома), лімфома, лейкоз), сечового міхура й уретри (сквамозноклітинна карцинома, перехідно-клітинна карцинома, аденокарцинома), передміхурової залози (аденокарцинома, саркома), чоловічих статевих залоз (семінома, тератома, ембріональна карцинома, тератокарцинома, хондриокарцинома, саркома, інтерстиціально-клітинна карцинома, фіброма, фіброаденома, аденоматоїдні пухлини, ліпома); Печінки: гепатома (гепатоцелюлярна карцинома), холангіокарцинома, гепатобластома, ангіосаркома, гепатоцелюлярна аденома, гемангіома; Кістки: остеогенна саркома (остеосаркома), фібросаркома, злоякісна фіброгістіоцитома, хондросаркома, саркома Евінга, злоякісна лімфома (ретикулярно-клітинна саркома), множинна мієлома, злоякісна гігантоклітинна пухлина хордома, остеохронфрома (кістково-хрящові екзостози), доброякісна хондрома, хондробластома, хондроміксофіброма, остеоїд-остеома й гігантоклітинні пухлини; 1 UA 109932 C2 5 10 15 20 25 30 35 40 45 Нервової системи: черепа (остеома, гемангіома, гранульома, ксантома, деформуючий остоз), м'яких мозкових оболонок (менінгіома, менінгіосаркома, гліоматоз), головного мозку (астроцитома, медулобластома, гліома, епендіома, гермінома (пінеалома), мультиформна гліобластома, олігодендрогліома, шванома, ретинобластома, вроджені пухлини), нейрофіброма, менінгіома, гліома, саркома спинного мозку); Гінекологічних: матки (ендометріальна карцинома), шийки матки (цервікальна карцинома, передпухлинна цервікальна дисплазія), яєчників (карцинома яєчників (серозна цистаденокарцинома, мукоїдна цистаденокарцинома, некласифікована карцинома), гранульозо-текалклітинні пухлини, СертоліЛейдига-клітинні пухлини, дисгермінома, злоякісна тератома), вульви (сквамозноклітинна карцинома, інтраєпітеліальна карцинома, аденокарцинома, фібросаркома, меланома), піхви (родоначально-клітинна карцинома, сквамозноклітинна карцинома, ботріоїдна саркома (ембріональна рабдоміосаркома), фаллопієвих труб (карцинома); Гематологічних: крові (мієлогенний лейкоз (гострий та хронічний), гострий лімфобластний лейкоз, хронічний лімфоцитарний лейкоз, мієлопроліферативні захворювання, множинна мієлома, мієлодиспластичний синдром), хвороба Ходжкіна, неходжкінська лімфома (злоякісна лімфома); Шкіри: злоякісна меланома, базальноклітинна карцинома, сквамозноклітинна карцинома, саркома Капоші, синдроми диспластичного невуса, ліпома, ангіома, дерматофіброма, келоїди, псоріаз; та Надниркових залоз: нейробластома. Таким чином, термін "ракова клітина", використовуваний в даній заявці, включає клітину, уражену будь-яким з вказаних вище, або родинних, станів. Короткий опис винаходу Даний винахід відноситься до сполуки формули (I) де R1 вибраний з групи, що включає: C1-C6алкіл, -NSO2Me, -NSO2Ph, арилалкокси, C3C7циклоалкіл, -NC(O)Ra, 1-метил-1Н-піразол-4-іл, гідроксил, C1-C4алкокси, галоген, амід, аміно, заміщений аміно та -C(O)ORa; R2 являє собою водень або COOH; кожен R3 незалежно вибраний з групи, що включає: арил, гетероарил, водень, C 1-C6алкіл, SO2Ra, -NC(O)Ra, -CH2C(O)ORa, -C(O)ORa, -C(O)Ra, -C(O) NRaRb, заміщений аміно, аміно, сечовина, амід, сульфонамід, арилалкіл та гетероарилалкіл; Ra являє собою водень, феніл, фенілметил, 3,5-диметилізоксазол-4-іл, 1,2-диметил-1Hімідазол-4-іл, C3-C7циклоалкіл, C1-C6алкіл, C1-C4алкокси, C1-C3алкіламіно або -NHPh; Rb являє собою водень або C1-C3алкіл; або коли вони зв'язані з одним і тим самим атомом, R a та Rb разом утворюють 5-або 6-членне гетероциклоалкільне кільце; R4 являє собою C1-C4алкіл, ацил, -C(O)CF3 або водень; W являє собою -(CH2)1-4 або -CH(Rс)(CH2)0-3, де Rc являє собою CN або C1-C4алкіл; Y являє собою N або C; X являє собою N або C; Z являє собою O або (CH2)q, де q має значення 0-2, коли q має значення 0, Z являє собою зв'язок; m має значення 0-3, n має значення 0-3; за умови, що, коли Z являє собою O, Y являє собою N і X являє собою C; також за умови, що, коли X являє собою C, щонайменше одна з R 3 груп, зв'язаних з X, не є воднем; або фармацевтично прийнятної солі такої сполуки. 2 UA 109932 C2 5 10 15 20 25 Даний винахід також відноситься до фармацевтичних композицій, які включають сполуки формули (I) і фармацевтично прийнятні носії. Даний винахід також відноситься до способів лікування раку, які включають введення ефективної кількості сполуки формули (I) людині, що потребує цього. Даний винахід також відноситься до способів лікування раку, які включають спільне введення сполуки формули (I) та другої сполуки, яка відповідно являє собою протипухлинний засіб, людині, що потребує цього. Даний винахід також відноситься до способів інгібування Лізин-специфічної деметилази 1 у людини, що потребує цього, які включають введення ефективної кількості сполуки формули (I). Детальний опис винаходу Даний винахід також відноситься до сполуки формули (II) де, R1-R4, m, W, X, Y і Z визначені відповідно до Формули (I); або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки формули (III) де, R1-R4, m, W, X, Y і Z визначені відповідно до Формули (I); або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до будь-якої з формул (I), (II) або (III), де Z являє собою CH; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до будь-якої з формул (I), (II) або (III), де X являє собою C, Y являє собою N, і Z являє собою O; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки, представленої формулою (IV) де Z являє собою (CH2)q, де q має значення 0-2, коли q має значення 0, Z являє собою зв'язок; 3 UA 109932 C2 m має значення 0-3, переважно 0-1; X являє собою C або N; W, R1, R3 та R4 визначені відповідно до Формули (I); або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки, представленої формулою (V) 5 10 15 20 25 30 35 40 де Z являє собою O або (CH2)q, де q має значення 0-2, коли q має значення 0, Z являє собою зв'язок; m має значення 0-3, переважно 0-1; X являє собою C або N; W, R1, R3 та R4 визначені відповідно до Формули (I); або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки формули (I), де одна, і лише одна, з двох R 3 груп, зв'язаних з X, являє собою водень. Даний винахід також відноситься до сполуки відповідно до будь-якої з представлених вище формул, де R4 являє собою H, і X являє собою N; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до будь-якої з представлених вище формул, де R1 являє собою F, Cl, C1-C4алкокси або C1-C4алкіл; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до будь-якої з представлених вище формул, де m має значення 0; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до будь-якої з представлених вище формул, де кожен R3 незалежно вибраний з групи, що включає: арил, арилалкіл, гетероарил, гетероарилалкіл, де вказані арил і гетероарил, кожен, необов'язково заміщені 1-3 групами, вибраними з групи, що включає:-COOH, C1-C4алкокси, -C(O)O C1-C4алкіл, C1-C4алкіл, галоген, CN, тетразоліл, -NSO2Me, -SO2Me, -C(O)N(CH2)ОН, -C(O)NSO2Me, -OCH2COOH; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до будь-якої з представлених вище формул, де кожен R3 незалежно вибраний з групи, що включає: водень, C1-C6алкіл, -SO2Ra, NC(O)Ra, -CH2C(O)ORa, -C(O)ORa-C(O)Ra, -C(O)NRaRb, заміщений аміно, аміно, сечовина, амід, сульфонамід, арилалкіл і гетероарилалкіл, де Ra являє собою феніл, фенілметил, C3C7циклоалкіл, C1-C6алкіл, C1-C4алкокси, C1-C3алкіламіно або -NHPh; Rb являє собою водень або C1-C4алкіл, або коли вони зв'язані з одним і тим самим атомом, R a і Rb разом утворюють 5-або 6-членне гетероциклоалкільне кільце, де вказаний феніл може бути заміщений однією-трьома групами, вибраними з групи, що включає: C1-C4алкіл, галоген та COOH; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до Формули (I), (II) або (III), де кожен R3 незалежно вибраний з групи, що включає: водень, C 1-C6алкіл, -SO2Ra, -NC(O)Ra, -C(O)ORaC(O)Ra, -C(O)NRaRb, заміщений аміно, аміно, сечовина, амід, сульфонамід, арилалкіл та гетероарилалкіл, де Ra являє собою феніл, фенілметил, C3-C7 циклоалкіл, C1-C6алкіл, C1C4алкокси, C1-C3алкіламіно або -NHPh; Rb являє собою водень або C1-C4алкіл; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки формули (VI): 4 UA 109932 C2 5 10 15 20 25 30 35 де R1 та W мають значення, визначені у Формулі (I); s має значення 1-2; m має значення 0-1; кожен R5 незалежно вибраний з групи, що включає: -COOH, C1-C4алкокси, -C(O)OC1-C4алкіл, C1-C4алкіл, галоген, CN, тетразоліл, -NSO2Me, -SO2Me, -C(O)N(CH2)ОН, -C(O)NSO2Me, OCH2COOH; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки відповідно до будь-якої з формул (I), (II) або (III), яка представлена формулою (VII): де R1 та W мають значення, визначені у Формулі (I); s має значення 1-2; m має значення 0-1; кожен R5 незалежно вибраний з групи, що включає: -COOH, алкокси, -C(O) OC1-C4алкіл, C1C4алкіл, галоген, CN, тетразоліл, -NSO2Me, -SO2Me, -C(O) N(CH2)ОН, -C(O)NSO2Me, OCH2COOH; або її фармацевтично прийнятної солі. Даний винахід також відноситься до сполуки формули (VI) або (VII), де R5 являє собою СООН. Даний винахід також відноситься до будь-якої, або до будь-якої підгрупи, з наступних сполук: 1,1-Диметилетил 4-({[транс-2-фенілциклопропіл]аміно}-метил)-1-піперидинкарбоксилат; 1,1-Диметилетил 4-({[(1R,2S)-2-фенілциклопропіл]аміно}метил)-1-піперидинкарбоксилат; 1,1-Диметилетил 4-({[(1S,2R)-2-фенілциклопропіл]аміно}метил)-1-піперидинкарбоксилат; [транс-2-Фенілциклопропіл](4-піперидинілметил)амін; [(1S,2R)-2-Фенілциклопропіл](4-піперидинілметил)амін; [(1R,2S)-2-Фенілциклопропіл](4-піперидинілметил)амін; транс-N-(Циклогексилметил)-2-фенілциклопропанамін; [транс-2-Фенілциклопропіл]{[1-(фенілметил)-4-піперидиніл]метил}амін; 1,1-Диметилетил [транс-4-({[транс-2-фенілциклопропіл]аміно}метил)циклогексил]карбамат; транс-4-({[транс-2-Фенілциклопропіл]аміно}метил)циклогексанамін; 2-(4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)етанол; N-Феніл-4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-карбоксамід; Феніл(4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метанон; 1-(4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)етанон; [транс-2-Фенілциклопропіл](3-піперидинілметил)амін; N-(транс-2-Фенілциклопропіл)-N-(піперидин-4-ілметил)ацетамід; Бензил 4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-карбоксилат; 4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин; 5 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 [(1-Метил-4-піперидиніл)метил][транс-2-фенілциклопропіл]амін; 1,1-Диметилетил 4-({[транс-2-фенілциклопропіл]аміно}метил)гексагідро-1H-азепін-1карбоксилат; або її фармацевтично прийнятної солі. N-(Гексагідро-1H-азепін-4-ілметил)-транс-2-фенілциклопропанамін; [транс-2-Фенілциклопропіл][2-(4-піперидиніл)етил]амін; [транс-2-Фенілциклопропіл][1-(4-піперидиніл)етил]амін; N-(2-Морфолінілметил)-транс-2-фенілциклопропанамін; 4-((4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 2-(4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)оцтова кислота; 4-{[(3R)-3-({[(1R,2S)-2-Фенілциклопропіл]аміно}метил)-1-піролідиніл]метил}бензойна кислота; 4-{[(3S)-3-({[(1R,2S)-2-Фенілциклопропіл]аміно}метил)-1-піролідиніл]метил}бензойна кислота; 4-((4-((((1R,2S)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-{3-[4-({[(1R,2S)-2-Фенілциклопропіл]аміно}метил)-1-піперидиніл]пропіл}бензойна кислота; транс-N-((1-Ізопропілпіперидин-4-іл)метил)-2-фенілциклопропанамін; транс-N-((1-(2-Метоксіетил)піперидин-4-іл)метил)-2-фенілциклопропанамін; транс-2-Феніл-N-((1-(піридин-4-ілметил)піперидин-4-іл)метил)циклопропанамін; транс-N-((1-(2-Фторбензил)піперидин-4-іл)метил)-2-фенілциклопропанамін; 1,1-Біс(2-фторбензил)-4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-ій хлорид; транс-N-((1-(3-Фторбензил)піперидин-4-іл)метил)-2-фенілциклопропанамін; 1,1-Біс(3-фторбензил)-4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-ій хлорид; транс-N-((1-(4-Фторбензил)піперидин-4-іл)метил)-2-фенілциклопропанамін; 1,1-біс(4-Фторбензил)-4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-ій хлорид; транс-N-((1-(2,4-Дифторбензил)піперидин-4-іл)метил)-2-фенілциклопропанамін; 1,1-Біс(2;4-дифторбензил)-4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-ій бромід; Етил 4-((4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензоат; транс-N-((1-(4-(Метилсульфоніл)бензил)піперидин-4-іл)метил)-2-фенілциклопропанамін; 1-(4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)бутан-2-ол; 2-((4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензонітрил; транс-2-Феніл-N-((1-(2-(трифторметил)бензил)піперидин-4-іл)метил)циклопропанамін; транс-N-((1-((5-Метилізоксазол-3-іл)метил)піперидин-4-іл)метил)-2-фенілциклопропанамін; транс-N-((1-((1H-Піразол-4-іл)метил)піперидин-4-іл)метил)-2-фенілциклопропанамін; транс-N-((1-Етилпіперидин-4-іл)метил)-2-фенілциклопропанамін; Діетил (3-(4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)пропіл)фосфонат; Діетил ((4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)фосфонат; 3-(4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)пропанoва кислота; 4-(4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)бутанoва кислота; N-(4-((4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил) феніл)ацетамід; 4-((4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензо[c][1,2]оксаборол1(3H)-ол; 5-((4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензо[c][1,2]оксаборол1(3H)-ол; (4-((4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)феніл)боронова кислота; 2-((4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 3-((4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-((4-(((транс-2-(4-Бромфеніл)циклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-((4-(((транс-2-(4-Хлорфеніл)циклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-((4-(((транс-2-(3,4-Дихлорфеніл)циклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-((4-(((транс-2-(4-(Трифторметил)феніл)циклопропіл)аміно)метил)піперидин-1іл)метил)бензойна кислота; 4-((4-(((транс-2-(3,4-Диметоксифеніл)циклопропіл)аміно)метил)піперидин-1іл)метил)бензойна кислота; 4-((4-(((транс-2-(4-Ацетамідофеніл)циклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-((4-(((транс-2-(4-Бензамідофеніл)циклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 6 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 1,1-Диметил-4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-ій йодид; транс-2-Феніл-N-((1-фенілпіперидин-4-іл)метил)циклопропанамін; Етил 4-(((транс-2-фенілциклопропіл)аміно)метил)піперидин-1-карбоксилат; транс-4-((4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин-1іл)метил)циклогексанкарбонова кислота; 3-(4-((((1R,2S)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)пропанoва кислота; транс-N,N-Диметил-4-(((транс-2-фенілциклопропіл)аміно)метил)циклогексанамін; N-(транс-4-(((транс-2-Фенілциклопропіл)аміно)метил)циклогексил)ацетамід; N-(транс-4-(((транс-2-Фенілциклопропіл)аміно)метил)циклогексил)бензамід; 4-(((транс-4-(((транс-2-Фенілциклопропіл)аміно)метил)циклогексил)аміно)метил)бензойна кислота; 4-(((транс-2-Фенілциклопропіл)аміно)метил)піперидин; транс-N-Метил-2-феніл-N-(2-(піперидин-4-іл)етил)циклопропанамін; транс-N-Метил-N-((1-метилпіперидин-4-іл)метил)-2-фенілциклопропанамін; транс-N-(1-Циклогексилетил)-2-фенілциклопропанамін; транс-Метил 4-(((транс-2-фенілциклопропіл)аміно)метил)циклогексанкарбоксилат; транс-4-(((транс-2-Фенілциклопропіл)аміно)метил)циклогексанкарбонова кислота; транс-4-((((1R,2S)-2-Фенілциклопропіл)аміно)метил) циклогексанкарбонова кислота; 4-(((транс-2-(4-Бензамідофеніл) циклопропіл)аміно)метил)циклогексанкарбонова кислота; 4-(((транс-2-(4-Ацетамідофеніл) циклопропіл)аміно)метил)циклогексанкарбонова кислота; транс-2-(3-Фтор-2-метоксифеніл)-N-(піперидин-4-ілметил)циклопропанамін; транс-2-(2-(бензилокси)-3-фторфеніл)-N-(піперидин-4-ілметил)циклопропанамін; транс-2-(3,5-дифторфеніл)-N-(піперидин-4-ілметил)циклопропанамін; транс-2-(2,5-дифторфеніл)-N-(піперидин-4-ілметил)циклопропанамін; N-(4-((транс)-2-((Піперидин-4-ілметил)аміно)циклопропіл)феніл)ацетамід; N-(4-((транс)-2-((піперидин-4-ілметил)аміно)циклопропіл)феніл)метансульфонамід; N-(4-((транс)-2-((піперидин-4-ілметил)аміно)циклопропіл)феніл)бензолсульфонамід; N-(4-((транс)-2-((піперидин-4-ілметил)аміно)циклопропіл)феніл)бензамід; (транс)-N-((1-(Метилсульфоніл)піперидин-4-іл)метил)-2-фенілциклопропанамін; N-етил-4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-карбоксамід; N-циклопропіл-4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-карбоксамід; N,N-диметил-4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-карбоксамід; (4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)(піролідин-1-іл)метанон; транс-N-((1-(циклопропілсульфоніл)піперидин-4-іл)метил)-2-фенілциклопропанамін; транс-N-((1-(ізопропілсульфоніл)піперидин-4-іл)метил)-2-фенілциклопропанамін; транс-N-((1-((3,5-диметилізоксазол-4-іл)сульфоніл)піперидин-4-іл)метил)-2фенілциклопропанамін; транс-N-((1-((1,2-диметил-1H-імідазол-4-іл)-сульфоніл)піперидин-4-іл)метил)-2фенілциклопропанамін; (транс)-N-(2-(1-Метилпіперидин-4-іл)етил)-2-фенілциклопропанамін; (транс)-2-Феніл-N-(2-(1-(піридин-2-іл)піперидин-4-іл)етил)циклопропанамін; 6-(4-(2-(((транс)-2-Фенілциклопропіл)аміно)етил)-піперидин-1-іл)нікотинова кислота; транс-2-феніл-N-(2-(1-(піридин-4-іл)піперидин-4-іл)етил)циклопропанамін; транс-2-феніл-N-(2-(1-(піримідин-4-іл)піперидин-4-іл)етил)циклопропанамін; транс-2-феніл-N-(2-(1-фенілпіперидин-4-іл)етил)циклопропанамін; транс-2-феніл-N-(2-(1-(піридин-3-іл)піперидин-4-іл)етил)циклопропанамін; транс-2-феніл-N-(2-(1-(піримідин-2-іл)піперидин-4-іл)етил)циклопропанамін; транс-N-(2-(1-(2-метоксіетил)піперидин-4-іл)етил)-2-фенілциклопропанамін; транс-N-(2-(1-ізопропілпіперидин-4-іл)етил)-2-фенілциклопропанамін; 3-Ціано-4-((4-((((транс)-2-фенілциклопропіл)-аміно)метил)піперидин-1-іл)метил)бензойна кислота; 2-фтор-4-((4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 3-фтор-4-((4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 3-хлор-4-((4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 3-метокси-4-((4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 7 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-хлор-4-((4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-(3-(4-(Ціано(((1R,2S)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)пропіл)бензойна кислота; 4-{3-[4-({[(транс))-2-фенілциклопропіл]аміно}метил)-1-піперидиніл]пропіл}бензойна кислота; 4-(4-(4-((((1R,2S)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)бутил)бензойна кислота; 4-(4-(4-(Ціано(((1R,2S)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)бутил)бензойна кислота; 4-(2-(4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)етил)бензойна кислота; 4-(2-(4-((((1R,2S)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)етил)бензойна кислота; 6-((4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)-2-нафтойна кислота; 6-((4-((((1R,2S)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)-2-нафтойна кислота; (транс)-N-((1-(4-(1H-Тетразол-5-іл)бензил)піперидин-4-іл)метил)-2-фенілциклопропанамін; 2-(4-((4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензамідо)оцтова кислота; N-(4-((4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1іл)метил)феніл)метансульфонамід; (транс)-N-((1-(3-(1H-Тетразол-5-іл)пропіл)піперидин-4-іл)метил)-2-фенілциклопропанамін; 4-((4-(2-(((транс)-2-Фенілциклопропіл)аміно)етил)піперидин-1-іл)метил)бензойна кислота; 2,2-Диметил-3-(4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)пропанова кислота; 6-((4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)нікотинова кислота; 2-(4-((4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)феніл)оцтова кислота; 2-((4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)оксазол-4-карбонова кислота; 2-(4-((4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)фенокси)оцтова кислота; N-(Метилсульфоніл)-4-((4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-1іл)метил)бензамід; 4-((4-((((транс)-2-(4-Йодфеніл)циклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 4-((транс)-2-(((1-Бензилпіперидин-4-іл)метил)аміно)циклопропіл)бензойна кислота; 4-((4-((((транс)-2-(4-(1-Метил-1Н-піразол-4-іл)феніл)циклопропіл)аміно)метил)піперидин-1іл)метил)бензойна кислота; 4-((4-((((транс)-2-(4-Циклопропілфеніл)циклопропіл)аміно)метил)піперидин-1іл)метил)бензойна кислота; 1-Метил-4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-4-карбонова кислота; 4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-4-карбонова кислота; 1-Бензил-4-((((транс)-2-фенілциклопропіл)аміно)метил)піперидин-4-карбонова кислота; 2-Хлор-4-((4-((((1R,2S)-2-фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)бензойна кислота; 3-(3-(4-((((транс)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)пропіл)бензойна кислота; 4-(3-(2-((((1R,2S)-2-Фенілциклопропіл)аміно)метил)морфолінo)пропіл)бензойна кислота; 4-((2-((((1R,2S)-2-фенілциклопропіл)аміно)метил)морфолінo)метил)бензойна кислота; 3-(3-((((1R,2S)-2-Фенілциклопропіл)аміно)метил)піролідин-1-іл)пропанoва кислота; 2-(4-((4-((((1R,2S)-2-Фенілциклопропіл)аміно)метил)піперидин-1-іл)метил)феніл)оцтова кислота; та 3-((R)-3-((((1R,2S)-2-Фенілциклопропіл)аміно)метил)піролідин-1-іл)пропанoва кислота; або фармацевтично прийнятних солей таких сполук. Даний винахід також відноситься до сполук, які представлені як приклади в Експериментальному розділі. Типово, але не абсолютно, солі за даним винаходом являють собою фармацевтично прийнятні солі. Солі, які охоплюються терміном "фармацевтично прийнятні солі" відносяться до нетоксичних солей сполук за даним винаходом. Солі сполук за даним винаходом можуть включати кислотно-адитивні солі. Як правило, солі одержують з фармацевтично прийнятних неорганічних і органічних кислот. Конкретніші приклади відповідних кислотних солей включають солі малеїнової, хлористоводневої, бромистоводневої, сірчаної, фосфорної, азотної, перхлорної, фумарової, оцтової, пропіонової, бурштинової, гліколевої, мурашиної, молочної, алеїнової, винної, лимонної, пальмової, малонової, гідроксималеїнової, фенілоцтової, 8 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 глутамінової, бензойної, саліцилової, фумарової, толуолсульфонової, метансульфонової (мезилат), нафталін-2-сульфонової, бензолсульфонової, гідроксинафтойної, йодистоводневої, яблучної, тероєвої, дубильної кислоти і т.п. Інші репрезентативні солі включають ацетат, бензолсульфонат, бензоат, бікарбонат, бісульфат, бітартрат, борат, едетат кальцію, камсилат, карбонат, клавуланат, цитрат, дигідрохлорид, едисилат, естолат, есилат, фумарат, глуцептат, глюконат, глутамат, гліколліларсанілат, гексилрезорцинат, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізетіонат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезилат, метилсульфат, монокалій малеат, муцинат, напсилат, нітрат, оксалат, памоат (ембонат), пальмітат, пантотенат, фосфат/дифосфат, полігалактуронат, саліцилат, стеарат, субацетат, сукцинат, сульфат, танат, тартрат, теоклат, тозилат, триетіодид та валерат. Сполука формули (I) або її сіль може існувати в стереоізомерних формах (наприклад, вона містить один або декілька асиметричних вуглецевих атомів). Індивідуальні стереоізомери (енантіомери і діастереомери) та їх суміші включені в обсяг даного винаходу. Винахід також охоплює індивідуальні ізомери сполуки або солі, представлених формулою (I), у вигляді сумішей з їх ізомерами, в яких один або декілька хіральних центрів є інвертованими. Так само, повинно бути зрозуміло, що сполука або сіль формули (I) може існувати в таутомерних формах, відмінних від тих, які показані у формулах, і вони також включені в обсяг даного винаходу. Повинно бути зрозуміло, що даний винахід включає всі комбінації і підгрупи конкретних груп, визначених в даній заявці вище. Обсяг даного винаходу включає суміші стереоізомерів, а також очищені енантіомери або енантіомерно/діастереомерно збагачені суміші. Також включені в обсяг даного винаходу індивідуальні ізомери сполуки, представленої формулою (I), а також будь-які їх повністю або частково врівноважені суміші. Даний винахід також включає індивідуальні ізомери сполуки або солі, представлених формулою (I), а також суміші з їх ізомерами, в яких один або декілька хіральних центрів є інвертованими. Повинно бути зрозуміло, що даний винахід включає всі комбінації і підгрупи конкретних груп, визначених в даній заявці вище. Визначення Терміни використовуються в обсязі їх загальноприйнятого значення. Наступні визначення представлені для уточнення, але не для обмеження, термінів, які визначені. Як використовується в даній заявці, термін "алкіл" (або "алкілен") відноситься до алкілу, що має лінійний або розгалужений ланцюг, що переважно містить від одного до дванадцяти атомів вуглецю, який може бути незаміщеним або заміщеним, насиченим або ненасиченим з багатократним заміщенням, переважно 1-3. Відповідні замісники вибрані з групи, що включає: галоген, аміно, заміщений аміно, сечовина, ціано, гідроксил, метокси, етокси, метилтіо, етилтіо, метилсульфоніл, етилсульфоніл, фосфонат, амідосульфоніл, карбонова кислота, ефір карбонової кислоти, карбоксамід, тетразоліл та амінокарбоніл. Приклади "алкілу", як використовується в даній заявці, включають метил, етил, пропіл, ізопропіл, ізобутил, н-бутил, трет-бутил, ізопентил, н-пентил та подібні, а також їх заміщені варіанти. Як використовується в даній заявці, термін "циклоалкіл" відноситься до незаміщеного або заміщеного моно- або поліциклічного неароматичного насиченого кільця, яке необов'язково включає алкіленовий лінкер, через який циклоалкіл може бути приєднаний. Приклади "циклоалкільних" груп включають, але не обмежуються цим, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і подібні, а також їх заміщені варіанти. Як використовується в даній заявці, термін "алкокси" відноситься до групи -ORa, де Ra являє собою незаміщений C1-C4алкіл або незаміщений C3-C7циклоалкіл, як визначено вище. Як використовується в даній заявці, термін "заміщений аміно" означає -NR'R", де кожен R' та R" незалежно вибраний з групи, що включає водень, незаміщений C 1-C6алкіл, ацил, незаміщений C3-C7циклоалкіл, де щонайменше один з R' та R" не є воднем. Приклади заміщеного аміно включають, але не обмежуються цим, алкіламіно, діалкіламіно, ациламіно та циклоалкіламіно. Як використовується в даній заявці, термін "гетероцикл" або "гетероцикліл" або "гетероциклоалкіл" відноситься до незаміщеної та заміщеної моно- або поліциклічної неароматичної кільцевої системи, що містить один або декілька гетероатомів. Переважні гетероатоми включають N, O та S, включаючи N-оксиди, оксиди сірки, а також діоксиди. Переважне кільце є трьох-восьми-членним і є або повністю насиченим, або містить одну або декілька ступенів ненасиченості. Багатократні заміщення включені в дане визначення. Приклади "гетероциклічних" груп включають, але не обмежуються цим, тетрагідрофураніл, піраніл, 1,4діоксаніл, 1,3-діоксаніл, піперидиніл, піролідиніл, морфолініл, азетидиніл, піперазиніл, піролідиноніл, піперазиноніл, піразолідиніл та їх різні таутомери, а також їх заміщені варіанти. 9 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як використовується в даній заявці, термін "арил", якщо не визначено інакше, означає ароматичну вуглеводневу кільцеву систему. Кільцева система може бути моноциклічною або конденсованою поліциклічною (наприклад, біциклічною, трициклічною і т.п.), заміщеною або незаміщеною. У різних варіантах утілення, моноциклічне арильне кільце являє собою C5-C10 або C5-C7 або C5-C6, де вказані кількості атомів вуглецю відносяться до кількості атомів вуглецю, які утворюють кільцеву систему. C6 кільцева система, тобто фенільне кільце, являє собою відповідну арильну групу. У різних варіантах втілення, поліциклічне кільце являє собою біциклічну арильну групу, де відповідні біциклічні арильні групи являють собою C 8-C12 або C9C10. Нафтильне кільце, яке містить 10 атомів вуглецю, являє собою відповідну поліциклічну арильну групу. Відповідні замісники для арилу описані у визначенні "необов'язково заміщений". Як використовується в даній заявці, термін "гетероарил", якщо не визначено інакше, означає ароматичну кільцеву систему, що містить атом(атоми) вуглецю і щонайменше один гетероатом. Гетероарил може бути моноциклічним або поліциклічним, заміщеним або незаміщеним. Моноциклічна гетероарильна група може містити від 1 до 4 гетероатомів у кільці, тоді як поліциклічний гетероарил може містити від 1 до 10 гетероатомів. Поліциклічне гетероарильне кільце може містити конденсовані, спіро або місточкові сполуки кілець, наприклад, біциклічний гетероарил являє собою поліциклічний гетероарил. Біциклічні гетероарильні кільця можуть містити від 8 до 12 атомних членів. Моноциклічні гетероарильні кільця можуть містити від 5 до 8 атомних членів (вуглецевих та гетероатомів). Приклади гетероарильних груп включають: бензофуран, бензотіофен, фуран, імідазол, індол, ізотіазол, оксазол, піразин, піразол, піридазин, піридин, піримідин, пірол, хінолін, хіназолін, хіноксалін, тіазол, гідрокси-1,3дигідробензо[c][1,2]оксаборол і тіофен. Відповідні замісники для гетероарилу описані у визначенні "необов'язково заміщений". Як використовується в даній заявці, термін "ціано" відноситься до групи -CN. Як використовується в даній заявці, термін "ацил" відноситься до групи -C(O)Rb, де Rb являє собою незаміщений C1-C6алкіл, незаміщений C3-C7циклоалкіл або незаміщений C3C6гетероцикліл, кожен з яких має значення, визначене в даній заявці. Як використовується в даній заявці, термін "арилокси" відноситься до групи -OC1C6алкіларил, де C1-C6алкіл, як правило, є незаміщеним, наприклад, фенілметокси, нафтилметокси. Як використовується в даній заявці, термін "арилалкіл" відноситься до групи -C1C6алкіларил, де C1-C6алкіл, як правило, є незаміщеним, наприклад, фенілметил, нафтилметил. Як використовується в даній заявці, термін "гетероарилалкіл" відноситься до групи - C1C6алкілгетероарил, де C1-C6алкіл, відповідно, є незаміщеним; наприклад, піридинілметил. Як використовується в даній заявці, термін "необов'язково" означає, що далі описувана подія(події) може відбуватися або не відбуватися, і включає як подію(події), яка відбувається, так і подію(події), яка не відбувається. Як використовується в даній заявці, якщо не визначено інакше, фраза "необов'язково заміщений", "заміщений" або її варіанти означає необов'язкове заміщення, включаючи декілька ступенів заміщення, одним або декількома замісниками, переважно одним-трьома, переважніше одним-двома. Цю фразу не слід інтерпретувати як дублюючу заміщення, які описані і показані в даній заявці. Приклади необов'язкових груп замісників включають ацил, C 1-C6алкіл, карбонову кислоту, боронову кислоту, C1-C3 алкілсульфоніл, C1-C4алкокси, C1-C4алкоксикарбоніл, ціано, галоген, C1-C6галогеналкіл, гідроксил, оксо, амід, сульфамід, сечовину, аміно, заміщений аміно, ациламіно, фенілкарбоніл, діалкіламіносульфонамід, морфолінo, сульфонамід, тіосечовину, тетразоліл та нітро. Винахід, крім того, забезпечує фармацевтичну композицію (також вказану як фармацевтичний склад), що містить сполуку формули (I) або її фармацевтично прийнятну сіль, та один або декілька ексципієнтів (також називані у фармацевтиці носіями та/або розчинниками). Ексципієнти є прийнятними в тому сенсі, що вони є сумісними з іншими інгредієнтами композиції і не є шкідливими для реципієнта (тобто пацієнта). Відповідно до іншого аспекту даного винаходу, забезпечується спосіб одержання фармацевтичної композиції, що включає змішування (або об'єднання) сполуки формули (I) або її солі зі щонайменше одним ексципієнтом. Сполуки формули I або їх солі, включаючи фармацевтично прийнятні солі, можуть існувати в твердій або рідкій формі. У твердому стані сполуки за даним винаходом можуть існувати в кристалічній або не-кристалічній формі або у вигляді їх суміші. Що стосується сполук за даним винаходом, які знаходяться в кристалічній формі, досвідченому фахівцеві повинно бути зрозуміло, що можуть бути утворені фармацевтично прийнятні сольвати, де молекули розчинника включені в кристалічну решітку в процесі кристалізації. Сольвати, де розчинником є 10 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 вода, яка включена в кристалічну решітку, типово називають "гідратами." Гідрати включають стехіометричні гідрати, а також композиції, що містять достатні для розчинення кількості води. Винахід включає всі такі сольвати. Фармацевтичні композиції Фармацевтичні композиції можуть бути в одиничній дозованій формі, що містить попередньо визначену кількість активного інгредієнта на одиничну дозу. Така одинична доза може містити терапевтично ефективну дозу сполуки формули (I) або її солі, або частину терапевтично ефективної дози, так щоб множинні одиничні дозовані форми можна було вводити через певний час для досягнення бажаної терапевтично ефективної дози. Переважні композиції, що містять одиничні дози, являють собою такі, які містять добову дозу або суб-дозу, вказані в даній заявці вище, або їх відповідну частину, активного інгредієнта. Крім того, такі фармацевтичні композиції можна одержати будь-яким способом, добре відомим у фармацевтиці. Фармацевтичні композиції можуть бути адаптовані для введення будь-яким відповідним шляхом, наприклад, пероральним (включаючи букальний або сублінгвальним), ректальним, назальним, місцевим (включаючи букальний, сублінгвальний або черезшкірний), вагінальним або парентеральним (включаючи підшкірний, внутрішньом'язовий, внутрішньовенний або внутрішньошкірний) шляхом. Такі композиції можна одержати будь-яким способом, відомим у фармацевтиці, наприклад, шляхом приведення активного інгредієнта в асоціацію з ексципієнтом(ексципієнтами). Коли вони адаптовані для перорального введення, фармацевтичні композиції можуть бути у вигляді дискретних одиниць, як-от таблетки або капсули; порошків або гранул; розчинів або суспензій у водних або не-водних рідинах; харчових піноподібних продуктів або збитих мас; рідких емульсій масло-у-воді або рідких емульсій вода-у-маслі. Сполука або її сіль за даним винаходом або фармацевтична композиція за даним винаходом також можуть бути включені в композиції льодяників, накладуваних на язик пластинок та/або смужок для введення у вигляді "швидкорозчинного" лікарського засобу. Наприклад, для перорального введення у формі таблетки або капсули, активний лікарський компонент можна об'єднати з пероральним нетоксичним фармацевтично прийнятним інертним носієм, таким як етанол, гліцерин, вода і т.п. Порошки або гранули одержують шляхом подрібнення сполуки до відповідних тонкодисперсних часток і змішування з подібним чином подрібненим фармацевтичним носієм, таким як харчовий вуглевод, наприклад, крохмаль або маніт. Також можуть бути присутніми віддушки, консерванти, диспергуючі речовини та фарбники. Капсули виготовляють шляхом одержання порошкоподібної суміші, як описано вище, і вміщення її в сформовані желатинові або не-желатинові оболонки. Агенти ковзання й лубриканти, як-от колоїдний діоксид кремнію, тальк, стеарат магнію, стеарат кальцію, твердий поліетиленгліколь, можуть бути додані до порошкоподібної суміші перед процедурою вміщення її в капсули. Дезінтегруючі або солюбілізуючі речовини, як-от агар-агар, карбонат кальцію або карбонат натрію, також можуть бути додані для поліпшення доступності лікарського засобу при прийомі капсул. Крім того, коли це є бажаним або необхідним, відповідні сполучні, лубриканти, дезінтегруючі агенти та фарбники також можуть бути включені в суміш. Відповідні сполучні включають крохмаль, желатин, природні цукру, як-от глюкоза або бета-лактоза, цукристі речовини з кукурудзи, природні і синтетичні смоли, як-от аравійська камедь, трагакант, альгінат натрію, карбоксиметилцелюлозу, поліетиленгліколь, воски і т.п. Лубриканти, використовувані в цих дозованих формах, включають олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію і т.п. Дезинтегранти включають, без обмеження, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь і т.п. Одержання таблеток включає, наприклад, одержання порошкоподібної суміші, гранулювання або грудкування зерен, додавання лубриканта і дезінтегранта та пресування в таблетки. Порошкоподібну суміш одержують шляхом змішування сполуки, відповідно подрібненої, з розчинником або основою, як описано вище, і необов'язково зі сполучною речовиною, як-от карбоксиметилцелюлоза та альгінат, желатин або полівінілпіролідон, що уповільнює розчинення, як-от парафін, прискорювачем всмоктування, як-от четвертинна сіль, та/або агентом абсорбції, як-от бентоніт, каолін або дикальцій фосфат. Порошкоподібну суміш можна гранулювати шляхом змочування сполучного, як-от сироп, крохмальна паста, клейка речовина з акації або розчини целюлозних або полімерних речовин, та пропускаючи через сито. Як альтернатива гранулюванню, порошкоподібну суміш можна пропустити через машину для таблетування, і в результаті неправильно сформовані грудочки розбиваються на гранули. Гранули можна змастити для запобігання їх прилипанню до таблетувального пресу шляхом 11 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 додавання стеаринової кислоти, стеаратної солі, тальку або мінерального масла. Змащену суміш потім пресують в таблетки. Сполуку або сіль за даним винаходом також можна об'єднати з вільно текучим інертним носієм і пресувати в таблетки безпосередньо, без використання стадій гранулювання або грудкування зерен. Може бути забезпечене світле непрозоре захисне покриття, що складається з ізолюючого прошарку з шелаку, покриття з цукру або полімерних речовин та глянсового покриття з воску. До цих покриттів можна додати фарбники, щоб помітити різні дози. Пероральні рідини, як-от розчини, сиропи й еліксири, можна одержати в одиничній дозованій формі, щоб дана кількість містила заздалегідь визначену кількість активного інгредієнта. Сиропи можна одержати шляхом розчинення сполуки або її солі за даним винаходом у відповідним чином ароматизованому водному розчині, тоді як еліксири одержують шляхом використання нетоксичного спиртового носія. Суспензії можна одержати шляхом диспергування сполуки або солі за даним винаходом в нетоксичному носієві. Солюбілізатори та емульгатори, як-от етоксильовані ізостеарилові спирти та ефіри поліоксіетиленсорбиту, консерванти, віддушки, якот масло перцевої м'яти, природні підсолоджувачі, сахарин або інші штучні підсолоджувачі, і подібні речовини також можуть бути додані. Якщо це є відповідним, композиції одиничних доз для перорального введення можуть бути мікроінкапсульованими. Композицію також можна одержати для пролонгування або уповільнення вивільнення, наприклад, з використанням покриття або вміщення дрібних часток речовини в оболонки з полімерів, воску або т.п. У даному винаході, таблетки й капсули є переважними для доставки фармацевтичної композиції. Як використовується в даній заявці, термін "лікування" включає профілактику і відноситься до полегшення вказаного стану, усунення або зменшення тяжкості одного або декількох симптомів стану, уповільнення або усунення прогресування стану і профілактики або відстрочення рецидиву стану у пацієнта або суб'єкта, в якого раніше мало місце або було діагностовано такий стан. Профілактику (або запобігання або відстрочення початку розвитку захворювання) типово здійснюють шляхом введення лікарського засобу таким самим або подібним чином, як пацієнтові, в якого відбувається розвиток захворювання або стану. Даний винахід забезпечує потенційне лікування ссавця, зокрема, людини, що страждає від хворобливих станів, які є мішенню для сполук за даним винаходом. Таке лікування включає стадію введення терапевтично ефективної кількості сполуки формули (I) або її солі вказаному ссавцеві, зокрема, людині. Лікування також може включати стадію введення терапевтично ефективної кількості фармацевтичної композиції, що містить сполуку формули (I) або її сіль, вказаному ссавцеві, зокрема, людині. Як використовується в даній заявці, термін "ефективна кількість" означає таку кількість лікарського засобу або фармацевтичного засобу, яка викликатиме біологічну або медичну відповідь тканини, системи, тварини або людини, якої добивається, наприклад, дослідник або клініцист. Термін "терапевтично ефективна кількість" означає будь-яку кількість, яка, в порівнянні з відповідним суб'єктом, який не приймав таку кількість, приводить до покращуваного лікування, загоєння, профілактики або зменшення інтенсивності симптомів захворювання, розладу або побічного ефекту, або зниження швидкості розвитку захворювання або розладу. Термін також охоплює кількості, ефективні для посилення нормальної фізіологічної функції. Для застосування в терапії, терапевтично ефективні кількості сполуки формули (I), а також її солей можна вводити окремо у вигляді хімічної речовини. Крім того, активний інгредієнт може бути представлений у вигляді фармацевтичної композиції. Хоча при застосуванні в терапії можливе окреме введення терапевтично ефективної кількості сполуки формули (I) або її солі у вигляді хімічної речовини, типово вона представлена у вигляді активного інгредієнта фармацевтичної композиції або складу. Точна терапевтично ефективна кількість сполуки або її солі за даним винаходом залежить від різних чинників, включаючи, але не обмежуючись цим, вік та масу тіла суб'єкта (пацієнта), що піддається лікуванню, конкретний розлад, що вимагає лікування, і його тяжкість, природу фармацевтичної композиції/складу і шлях введення, і, зрештою, залежить від думки лікаря або ветеринара. Типово, сполука формули (I) або її сіль застосовують для лікування у межах від близько 0,01 до 100 мг/кг маси тіла реципієнта (пацієнта, ссавця) в день, і типовіше в межах від 0,1 до 10 мг/кг маси тіла в день. Прийнятні добові дози можуть складати від близько 1 до близько 1000 мг/день, і переважно від біля від 1 до близько 100 мг/день. Цю кількість можна вводити у вигляді разової добової дози або у вигляді декількох (наприклад, двох, трьох, чотирьох, п'яти або більш) дрібних доз протягом дня, щоб загальна добова доза була такою ж. 12 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ефективну кількість солі такої сполуки можна визначити у вигляді пропорції ефективної кількості сполуки формули (I) per se. Подібні дози мають бути відповідними для лікування (включаючи профілактику) інших станів, які описані в даній заявці як такі, що підлягають лікуванню. Як правило, визначення відповідних для введення доз може легко визначити фахівець в галузі медицини або фармацевтики. Комбінації Коли сполуку формули (I) вводять для лікування раку, термін "спільне введення" та його похідні, як використовується в даній заявці, означає або одночасне введення, або будь-який спосіб роздільного послідовного введення інгібучої LSD1 сполуки, описаної в даній заявці, і додаткового активного інгредієнта або інгредієнтів, відомих як корисні для лікування раку, включаючи хіміотерапію та променеву терапію. Термін "додатковий активний інгредієнт або інгредієнти", як він використовується в даній заявці, включає будь-яку сполуку або терапевтичний засіб, відомий як такий, що має, або який демонструє, корисні властивості при введенні пацієнтові, що потребує лікування раку. Переважно, якщо введення не є одночасним, сполуки вводять з дуже невеликим інтервалом часу між введенням кожного з них. Крім того, не має значення в одній і тій самій лікарській формі вводять сполуки чи ні, наприклад, одну сполуку можна вводити місцевим шляхом, а іншу сполуку можна вводити перорально. Типово, будь-який протипухлинний засіб, який має активність проти чутливої до лікування пухлини, що підлягає лікуванню, можна використовувати в даному винаході для спільного введення для лікування раку. Приклади таких засобів можна знайти в Cancer Principles and Practice f Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Фахівцеві в даній галузі має бути зрозуміле, які комбінації засобів будуть корисними, на підставі конкретних характеристик лікарських засобів та конкретного типа раку. Типові протипухлинні засоби, корисні в даному винаході, включають, але не обмежуються цим, засоби проти мікротрубочок, як-от дитерпеноїди та алкалоїди барвінку; платинові координаційні комплекси; алкілувальні засоби, як-от азотні іприти, оксазафосфорини, алкілсульфонати, нітрозосечовини та триазени; антибіотики, як-от антрацикліни, актиноміцини і блеоміцини; інгібітори топоізомерази II, як-от епіподофілотоксини; антиметаболіти, як-от пуринові та піримідинові аналоги й анти-фолатні сполуки; інгібітори топоізомерази I, як-от камптотецини; гормони й гормональні аналоги; інгібітори шляху сигнальної трансдукції; інгібітори зв'язаних з ангіогенезом не-рецепторних тирозинкіназ; імунотерапевтичні засоби; проапоптичні засоби; і інгібітори передачі сигналів клітинного циклу. Прикладами додаткового активного інгредієнта або інгредієнтів для застосування в комбінації або для спільного введення із інгібуючими LSD1 сполуками за даним винаходом є хіміотерапевтичні засоби. Засоби проти мікротрубочок або антимітотичні засоби являють собою фаза-специфічні засоби, активні проти мікротрубочок пухлинних клітин у фазі M або мітозу клітинного циклу. Приклади засобів проти мікротрубочок включають, але не обмежуються цим, дитерпеноїди та алкалоїди барвінку. Дитерпеноїди, які виділяють з природних джерел, є фаза-специфічними протираковими засобами, які діють в G2/M фазах клітинного циклу. Вважається, що дитерпеноїди стабілізують β-тубулінову субодиницю мікротрубочок шляхом зв'язування з цим білком. Потім виявляється, що розупорядкування структури білка інгібується, при цьому мітоз зупиняється і відбувається клітинна загибель. Приклади дитерпеноїдів включають, але не обмежуються цим, паклітаксел та його аналог доцетаксел. Паклітаксел, 5β,20-епокси-1,2α,4,7β,10β,13α-гекса-гідрокситакс-11-ен-9-он 4,10-діацетат 2бензоат 13-ефір з (2R,3S)-N-бензоїл-3-фенілізосерином; являють собою природний дитерпеновий продукт, виділений з тихоокеанського тисового дерева Taxus brevifolia, і є комерційно доступним у вигляді розчину для ін'єкцій TAXOL®. Він є членом таксанового сімейства терпенів. Він був спочатку виділений в 1971 році, Wani et al. J. Am. Chem, Soc, 93:2325. 1971), де його структура була охарактеризована хімічними методами і методами рентгенівської кристалографії. Один механізм його активності відноситься до здатності паклітаксела зв'язуватися з тубуліном з інгібуванням, таким чином, зростання ракових клітин. Schiff et al., Proc. Natl. Acad. Sci. USA, 77: 1561-1565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol, Chem, 256: 10435-10441 (1981). Огляд синтезу і протиракової активності деяких похідних паклітаксела см.: D. G. I. Kingston et al., Studies in Organic Chemistry vol. 26, озаглавленому "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds. (Elsevier, Amsterdam, 1986) pp 219-235. Паклітаксел схвалений для клінічного застосування для лікування резистентного раку яєчників у США (Markman et al., Yale Journal of Biology і Medicine, 64:583, 1991; McGuire et al., 13 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ann. Intern, Med., 111:273,1989) і для лікування раку молочної залози (Holmes et al., J. Nat. Cancer Inst., 83: 1797, 1991). Він є потенційним кандидатом для лікування пухлин у шкірі (Einzig et. al., Proc. Am. Soc. Clin. Oncol., 20:46) і карцином голови та шиї (Forastire et. al., Sem. Oncol., 20:56, 1990). Сполука також демонструє потенціал для лікування полікістозного захворювання нирок (Woo et. al., Nature, 368:750. 1994), раку легені та малярії. Лікування пацієнтів паклітакселом приводить до супресії кісткового мозку (різні клітинні лінії, Ignoff, R.J. et. al., Cancer Chemotherapy Pocket Guide, 1998), пов'язаної з тривалістю введення вище порогової концентрації (50 нМ) (Kearns, CM. et. al., Seminars in Oncology, 3(6) p, 16-23, 1995). Доцетаксел (2R,3S)-N-карбокси-3-фенілізосерин, N-трет-бутиловий ефір, 13-ефір з 5β-20епокси-1,2α,4,7,10,13α-гексагідрокситакс-11-ен-9-он 4-ацетат 2-бензоат, тригідрат; є комерційно доступним у вигляді розчину для ін'єкцій як TAXOTERE®. Доцетаксел показаний для лікування раку молочної залози. Доцетаксел являє собою напівсинтетичне похідне паклітакселу (див. вище), одержане з використанням природного попередника, 10-деацетил-бакатину III, екстраговане з голок європейського тисового дерева. Дозо-обмежуючою токсичністю доцетаксела є нейтропенія. Алкалоїди барвінку є фаза-специфічними протипухлинними засобами, виділеними з рослини барвінку. Алкалоїди барвінку діють на M фазу (мітоз) клітинного циклу шляхом зв'язання специфічним чином з тубуліном. Відповідно, зв'язана молекула тубуліну нездатна полімеризуватися у мікротрубочки. Вважається, що мітоз зупиняється в метафазі з подальшою клітинною загибеллю. Приклади алкалоїдів барвінку включають, але не обмежуються цим, вінбластин, вінкристин та вінорелбин. Вінбластин, вінкалейкобластин сульфат, є комерційно доступним як VELBAN® у вигляді розчину для ін'єкцій. Хоча він має можливе показання як допоміжне лікування різних солідних пухлин, переважно він показаний для лікування тестикулярного раку і різних лімфом, включаючи хворобу Ходжкіна; і лімфоцитарних і гістіоцитарних лімфом. Мієлосупресія є дозообмежуючим побічним ефектом вінбластину. Вінкристин, вінкалейкобластин, 22-оксо-, сульфат, є комерційно доступним як ONCOVIN® у вигляді розчину для ін'єкцій. Вінкристин показаний для лікування гострих лейкозів і також знайшов застосування у схемах лікування ходжкінської та неходжкінської злоякісних лімфом. Алопеція і неврологічні ефекти є найчастішими побічними ефектами вінкристину та у меншій мірі виникають ефекти мієлосупресії та запалення шлунково-кишкових слизистих оболонок. Вінорелбін, 3',4'-дидегідро-4'-дезокси-C'-норвінкалейкобластин [R-(R*,R*)-2,3дигідроксибутандіоат (1:2)(сіль)], є комерційно доступним у вигляді розчину для ін'єкцій вінорелбіну тартрата (NAVELBINE®), являють собою напівсинтетичний алкалоїд барвінку. Вінорелбін показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами, як-от цисплатин, для лікування різних солідних пухлин, зокрема, недрібноклітинного раку легені, прогресуючого раку молочної залози та гормон-резистентного раку передміхурової залози. Мієлосупресія є найчастішим дозо-обмежуючим побічним ефектом вінорелбіну. Платинові координаційні комплекси являють собою не-фаза-специфічні протиракові засоби, які взаємодіють з ДНК. Платинові комплекси проникають у пухлинні клітини, піддаються гідратуванню і утворюють інтра- та інтерланцюжкові поперечні зв'язки з ДНК, викликаючи несприятливі біологічні ефекти для пухлини. Приклади платинових координаційних комплексів включають, але не обмежуються цим, цисплатин та карбоплатин. Цисплатин, цис-діаміндихлорплатина, є комерційно доступним як PLATINOL® у вигляді розчину для ін'єкцій. Цисплатин переважно показаний для лікування метастатичного тестикулярного раку та раку яєчників і прогресуючого раку сечового міхура. Основними дозообмежуючими побічними ефектами цисплатина є нефротоксичність, яку можна контролювати шляхом гідратації і діурезу, і ототоксичність. Карбоплатин, платина, діамін [1,1-циклобутан-дикарбоксилат(2-)-0,0'], є комерційно доступним як PARAPLATIN® у вигляді розчину для ін'єкцій. Карбоплатин переважно показаний для першочергового й допоміжного лікування прогресуючої карциноми яєчників. Дозообмежуючою токсичністю карбоплатину є супресія кісткового мозку. Алкілувальні засоби є не-фаза-специфічними протираковими засобами та сильними електрофілами. Типово, алкілувальні засоби утворюють ковалентні зв'язки, шляхом алкілування, з ДНК через нуклеофільні групи молекули ДНК, як-от фосфатні, аміно, сульфгідрильні, гідроксильні, карбоксильні та імідазольні групи. Таке алкілування руйнує функцію нуклеїнової кислоти, приводячи до клітинної загибелі. Приклади алкілувальних засобів включають, але не обмежуються цим, азотні іприти, як-от циклофосфамід, мелфалан та хлорамбуцил; алкілсульфонати, як-от бусульфан; нітрозосечовини, як-от кармустин; і триазени, як-от дакарбазин. 14 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 Циклофосфамід, 2-[біс(2-хлоретил)аміно]тетрагідро-2H-1,3,2-оксазафосфорин 2-оксид моногідрат, є комерційно доступним у вигляді розчину для ін'єкцій або пігулок як CYTOXAN®. Циклофосфамід показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування злоякісних лімфом, множинної мієломи і лейкозів. Алопеція, нудота, блювота і лейкопенія є найчастішими дозо-обмежуючими побічними ефектами циклофосфаміду. Мелфалан, 4-[біс(2-хлоретил)аміно]-1-фенілаланін, є комерційно доступним у вигляді розчину для ін'єкцій або таблеток як ALKERAN®. Мелфалан показаний для паліативного лікування множинної мієломи і неоперабельної епітеліальної карциноми яєчника. Супресія кісткового мозку є найчастішим дозо-обмежуючим побічним ефектом мелфалану. Хлорамбуцил, 4-[біс(2-хлоретил)аміно]бензолбутанова кислота, є комерційно доступним як таблетки LEUKERAN®. Хлорамбуцил показаний для паліативного лікування хронічного лімфатичного лейкозу і злоякісних лімфом, як-от лімфосаркома, гігантофолікулярної лімфоми і хвороби Ходжкіна. Супресія кісткового мозку є найчастішим дозо-обмежуючим побічним ефектом хлорамбуцилу. Бусульфан, 1,4-бутандіол диметансульфонат, є комерційно доступним як MYLERAN® у вигляді таблеток. Бусульфан показаний для паліативного лікування хронічного мієлогенного лейкозу. Супресія кісткового мозку є найчастішим дозо-обмежуючим побічним ефектом бусульфану. Кармустин, 1,3-[біс(2-хлоретил)-1-нітрозосечовина, є комерційно доступним у вигляді окремих флаконів ліофілізованої речовини як BiCNU®. Кармустин показаний для паліативного лікування як окремий засіб або у комбінації з іншими засобами для лікування пухлин головного мозку, множинної мієломи, хвороби Ходжкіна та неходжкінських лімфом. Сповільнена мієлосупресія є найчастішим дозо-обмежуючим побічним ефектом кармустину. Дакарбазин, 5-(3,3-диметил-1-триазено)-імідазол-4-карбоксамід, є комерційно доступним у вигляді окремих флаконів речовини як DTIC-Dome®. Дакарбазин показаний для лікування метастатичної злоякісної меланоми і в комбінації з іншими засобами для допоміжного лікування хвороби Ходжкіна. Нудота, блювота і анорексія є найчастішими дозо-обмежуючими побічними ефектами дакарбазину. Протипухлинні антибіотики являють собою не-фаза-специфічні засоби, які зв'язуються або інтеркалують з ДНК. Типово, така дія приводить до стабільних ДНК комплексів або розриву ланцюгів, що порушує звичайну функцію нуклеїнових кислот, приводячи до клітинної загибелі. Приклади протипухлинних засобів на основі антибіотиків включають, але не обмежуються цим, актиноміцини, як-от дактиноміцин, антроцикліни, як-от даунорубіцин і доксорубіцин; і блеоміцини. Дактиноміцин, також відомий як Актиноміцин D, є комерційно доступним у формі для ін'єкцій як COSMEGEN®. Дактиноміцин показаний для лікування пухлини Вільмса і рабдоміосаркоми. Нудота, блювота і анорексія є найчастішими дозо-обмежуючими побічними ефектами дактиноміцину. Даунорубіцин (8S-цис-)-8-ацетил-10-[(3-аміно-2,3,6-тридезокси-α-L-ліксогексопіранoзил)окси]-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12 нафтацендіон гідрохлорид, є комерційно доступним у ліпосомній формі для ін'єкцій як DAUNOXOME® у формі для ін'єкцій як CERUBIDINE®. Даунорубіцин показаний для індукції ремісії для лікування гострого не-лімфоцитарного лейкозу і прогресуючої ВІЛ-асоційованої саркоми Капоші. Мієлосупресія є найчастішим дозо-обмежуючим побічним ефектом даунорубіцину. Доксорубіцин (8S, 10S)-10-[(3-аміно-2,3,6-тридезокси-α-L-ліксо-гексопіранoзил)окси]-8гліколоїл, 7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12 нафтацендіон гідрохлорид, є комерційно доступним у формі для ін'єкцій як RUBEX® або ADRIAMYCIN RDF®. Доксорубіцин переважно показаний для лікування гострого лімфобластного лейкозу та гострого мієлобластного лейкозу, але також є корисним компонентом для лікування деяких солідних пухлин і лімфом. Мієлосупресія є найчастішим дозо-обмежуючим побічним ефектом доксорубіцину. Блеоміцин, суміш цитотоксичних глікопептидних антибіотиків, виділених з штаму Streptomyces verticillus, є комерційно доступним як BLENOXANE®. Блеоміцин показаний як паліативне лікування, як окремий засіб або у комбінації з іншими засобами, сквамозноклітинної карциноми, лімфом та тестикулярних карцином. Легеневі та шкіряні токсичності є найчастішими дозо-обмежуючими побічними ефектами блеоміцину. Інгібітори топоізомерази II включають, але не обмежуються цим, епіподофілотоксини. Епіподофілотоксини є фаза-специфічними протипухлинними засобами, виділеними з мандрагори. Епіподофілотоксини типово впливають на клітини в S і G2 фазах клітинного циклу 15 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом утворення тричленний комплекс з топоізомеразою II та ДНК, викликаючи розрив ланцюгів ДНК. Розриви ланцюгів накопичуються і відбувається клітинна загибель. Приклади епіподофілотоксинів включають, але не обмежуються цим, етопозид та теніпозид. Етопозид, 4'-деметил-епіподофілотоксин 9[4,6-O-(R)-етиліден-β-D-глюкопіранозид], є комерційно доступним у вигляді розчину для ін'єкцій або капсул як VePESID®, і широко відомий як VP-16. Етопозид показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування тестикулярного раку і недрібноклітинного раку легені. Мієлосупресія є найчастішим побічним ефектом етопозиду. Випадки виникнення лейкопенії зазвичай тяжчі, ніж випадки тромбоцитопенії. Теніпозид, 4'-деметил-епіподофілотоксин 9[4,6-O-(R)-теніліден-β-D-глюкопіранозид], є комерційно доступним у вигляді розчину для ін'єкцій як VUMON®, і широко відомий як VM-26. Теніпозид показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу у дітей. Мієлосупресія є найчастішим дозо-обмежуючим побічним ефектом теніпозиду. Теніпозид може індукувати як лейкопенію, так і тромбоцитопенію. Протипухлинні засоби, що являють собою антиметаболіти, є фаза-специфічними протипухлинними засобами, які діють на S фазу (синтез ДНК) клітинного циклу шляхом інгібування синтезу ДНК або шляхом інгібування синтезу пуринових або піримідинових основ, обмежуючи, таким чином, синтез ДНК. Відповідно, не відбувається розвиток S фази, та відбувається клітинна загибель. Приклади протипухлинних засобів-антиметаболітів включають, але не обмежуються цим, фторурацил, метотрексат, цитарабін, меркаптопурин, тіогуанін та гемцитабін. 5-фторурацил, 5-фтор-2,4-(1H,3H) піримідиндіон, є комерційно доступним як фторурацил. Введення 5-фторурацилу приводить до інгібування синтезу тимідилату, і він також упроваджується як у РНК, так і в ДНК. Результатом типово є клітинна загибель. 5-Фторурацил показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування карцином молочної залози, товстої кишки, прямої кишки, шлунку та підшлункової залози. Мієлосупресія та запалення слизистої оболонки є дозо-обмежуючими побічними ефектами 5-фторурацилу. Інші фторпіримідинові аналоги включають 5-фтор дезоксіуридин (флоксуридин) та 5-фтордезоксіуридин монофосфат. Цитарабін, 4-аміно-1-β-D-арабінофуранозил-2(1Н)-піримідинон, є комерційно доступним як CYTOSAR-U®, і широко відомий як Ara-C. Вважається, що цитарабін проявляє клітинну фазоспецифічність у S-фазі шляхом інгібування подовження ДНК ланцюга шляхом термінального упровадження цитарабіну в зростаючий ДНК ланцюг. Цитарабін показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу. Інші цитидинові аналоги включають 5-азацитидин і 2',2'-дифтордезоксицитидин (гемцитабін). Цитарабін індукує лейкопенію, тромбоцитопенію і запалення слизистої оболонки. Меркаптопурин, 1,7-дигідро-6H-пурин-6-тіон моногідрат, є комерційно доступним як PURINETHOL®. Меркаптопурин проявляє клітинну фаза-специфічність у S-фазі шляхом інгібування синтезу ДНК механізмом, який до теперішнього часу ще не визначений. Меркаптопурин показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу. Мієлосупресія і запалення шлунково-кишкових слизистих оболонок є очікуваними побічними ефектами меркаптопурину при високих дозах. Корисним аналогом меркаптопурину є азатіоприн. Тіогуанін, 2-аміно-1,7-дигідро-6H-пурин-6-тіон, є комерційно доступним як TABLOID®. Тіогуанін проявляє клітинну фаза-специфічність у S-фазі шляхом інгібування синтезу ДНК механізмом, який до теперішнього часу ще не визначений. Тіогуанін показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу. Мієлосупресія, включаючи лейкопенію, тромбоцитопенію і анемію, є найчастішим дозообмежуючим побічним ефектом введення тіогуаніну. Проте виникають шлунково-кишкові побічні ефекти, і вони можуть бути дозо-обмежуючими. Інші пуринові аналоги включають пентостатит, еритрогідроксиноніладенін, флударабін фосфат та кладрибін. Гемцитабін, 2'-дезокси-2',2'-дифторцитидин моногідрохлорид (β-ізомер), є комерційно доступним як GEMZAR®. Гемцитабін проявляє клітинну фаза-специфічність у S-фазі і шляхом блокування прогресії клітин через Gl/S межу. Гемцитабін показаний у комбінації і цисплатином для лікування локально прогресуючого недрібноклітинного раку легені і окремо для лікування локально прогресуючого раку підшлункової залози. Мієлосупресія, включаючи лейкопенію, тромбоцитопенію та анемію, є найчастішим дозо-обмежуючим побічним ефектом введення гемцитабіну. Метотрексат, N-[4[[(2,4-діаміно-6-птеридиніл)метил]метиламіно]бензоїл]-1-глутамінова кислота, є комерційно доступним як метотрексат натрій. Метотрексат проявляє клітинно-фазові 16 UA 109932 C2 5 10 15 20 25 30 35 40 45 ефекти специфічним чином S-фазі шляхом інгібування синтезу, репарації/або реплікації ДНК через інгібування дигідрофолева кислота-редуктази, яка необхідна для синтезу пуринових нуклеотидів та тимідилату. Метотрексат показаний як окремий засіб або у комбінації з іншими хіміотерапевтичними засобами для лікування хондріокарциноми, менінгеального лейкозу, неходжкінської лімфоми і карцином молочної залози, голови, шиї, яєчника та сечового міхура. Мієлосупресія (лейкопенія, тромбоцитопенія й анемія) та запалення слизистої оболонки є очікуваними побічними ефектами введення метотрексату. Камптотецини, включаючи, камптотецин та камптотецинові похідні, є доступними або знаходяться у процесі розробки як інгібітори топоізомерази I. Вважають, що цитотоксична активність камптотецинів пов'язана з їх активністю інгібування топоізомерази I. Приклади камптотецинів включають, але не обмежуються цим, іринотекан, топотекан та різні оптичні форми 7-(4-метилпіперазинo-метилен)-10,11-етилендіокси-20-камптотецину, описані нижче. Іринотекан HCl (4S)-4,11-діетил-4-гідрокси-9-[(4-піперидинoпіперидинo)карбонілокси]-1Hпіранo[3',4',6,7]індолізино[1,2-b]хінолін-3,14(4H, 12H)-діон гідрохлорид, є комерційно доступним у вигляді розчину для ін'єкцій CAMPTOSAR®. Іринотекан являє собою похідне камптотецину, яке зв'язується, разом з його активним метаболітом SN-38, з комплексом топоізомераза I-ДНК. Вважається, що цитотоксичність виникає як результат необоротних розривів подвійного ланцюга, викликаних взаємодією топоізомераза I: ДНК: іринотекан або тричленного комплексу SN-38 з реплікативними ферментами. Іринотекан показаний для лікування метастатичного раку товстої кишки або прямої кишки. Дозо-обмежуючими побічними ефектами іринотекану HCl є мієлосупресія, включаючи нейтропенію та шлунково-кишкові ефекти, включаючи діарею. Топотекан HCl (S)-10-[(диметиламіно)метил]-4-етил-4,9-дигідрокси-1Hпіранo[3',4',6,7]індолізино[1,2-b]хінолін-3,14-(4H, 12H)-діон моногідрохлорид, є комерційно доступним як розчин для ін'єкцій HYCAMTIN®. Топотекан являє собою похідне камптотецину, яке зв'язується комплексом топоізомераза I-ДНК і запобігає повторному зшиванню окремих розривів ланцюга, викликаних Топоізомеразою I у відповідь на деформацію при скручуванні молекули ДНК. Топотекан показаний для допоміжного лікування метастатичної карциноми яєчника та дрібноклітинного раку легені. Дозо-обмежуючим побічним ефектом топотекану HCl є мієлосупресія, переважно нейтропенія. Також представляє інтерес похідне камптотецину формули A, представленої нижче, яке в даній час знаходиться у процесі розробки, включаючи форму рацемічної суміші (R,S), а також R та S енантіомери: відоме під хімічною назвою "7-(4-метилпіперазинo-метилен)-10,11-етилендіокси-20(R,S)камптотецин (рацемічна суміш) або "7-(4-метилпіперазинo-метилен)-10,11-етилендіокси-20(R)камптотецин (R енантіомер) або "7-(4-метилпіперазинo-метилен)-10,11-етилендіокси-20(S)камптотецин (S енантіомер). Така сполука, а також споріднені сполуки описані, включаючи способи їх одержання, у патентах США №№ 6063923; 5342947; 5559235; 5491237 і в Патентній заявці США № 08/977217, що знаходиться на розгляді, поданій 24 листопада 1997 року. Гормони та гормональні аналоги є корисними сполуками для лікування тих типів раку, де існує взаємозв'язок між гормоном(гормонами) і зростанням та/або відсутністю зростання раку. Приклади гормонів та гормональних аналогів, корисних для лікування раку, включають, але не обмежуються цим, адренокортикостероїди, як-от преднізон та преднізолон, які є корисними для лікування злоякісної лімфоми і гострого лейкозу у дітей; аміноглутетимід і інші інгібітори ароматази, як-от анастрозол, летразол, воразол і екземестан, корисні для лікування адренокортикальної карциноми і гормонально-залежної карциноми молочної залози, що містить рецептори естрогену; прогестрини, як-от мегестрол ацетат, корисні для лікування гормональнозалежного раку молочної залози і ендометріальної карциноми; естрогени, андрогени і анті 17 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 60 андрогени, як-от флутамід, нілутамід, бікалутамід, ципротерон ацетат і 5α-редуктази, як-от фінастерид та дутастерид, корисні для лікування карциноми передміхурової залози і доброякісної гіпертрофії передміхурової залози; анті-естрогени, як-от тамоксифен, тореміфен, ралоксифен, дролоксифен, йодоксифен, а також селективні модулятори рецепторів естрогену (SERMS), такі, як описані в Патентах США №№ 5681835, 5877219 і 6207716, корисні для лікування гормонально-залежної карциноми молочної залози і інших чутливих до лікування типів раку; і гонадотропін-вивільнюючий гормон (GnRH) і його аналоги, які стимулюють вивільнення лютеїнізуючого гормону (LН) та/або фолікулостимулюючого гормону (FSH), для лікування карциноми передміхурової залози, наприклад, LHRH агоністи та антагоністи, як-от госерелін ацетат та лупролід. Інгібітори шляху сигнальної трансдукції являють собою такі інгібітори, які блокують або інгібують хімічний процес, який викликає внутріклітинну зміну. Як використовується в даній заявці, ця зміна являє собою клітинну проліферацію або диференціацію. Інгібітори сигнальної трансдукції, корисні в даному винаході, включають інгібітори рецепторних тирозинкіназ, нерецепторних тирозинкіназ, блокаторів SH2/SH3 домену, серинових/треонінових кіназ, фосфотидилінозит-3 кіназ, передачі сигналів Myo-інозиту та Ras онкогенів. Деякі тирозинові протеїнкінази каталізують фосфорилування специфічних тирозильних залишків в різних білках, залучених в регуляцію клітинного зростання. Такі тирозинові протеїнкінази можуть бути широко класифіковані як рецепторні або не-рецепторні кінази. Рецепторні тирозинові кінази являють собою трансмембранні білки, що містять позаклітинний ліганд-зв'язувальний домен, трансмембранний домен та тирозинкіназний домен. Рецепторні тирозинові кінази залучені у регуляцію клітинного зростання, і їх зазвичай називають рецепторами чинника зростання. Було показано, що невідповідна або неконтрольована активація багатьох з цих кіназ, тобто аберантна активність кінази рецептора чинника зростання, наприклад, шляхом надекспресії або мутації, приводить до неконтрольованого клітинного зростання. Відповідно, аберантну активність таких кіназ пов'язують із злоякісним зростанням тканини. Відповідно, інгібітори таких кіназ можуть забезпечити способи лікування раку. Рецептори чинників зростання включають, наприклад, рецептор епідермального ростового чинника (EGFr), рецептор чинника зростання, одержаного з тромбоцитів (PDGFr), erbB2, erbB4, рецептор чинника зростання судинного ендотелію (VEGFr), домени гомології тирозинкінази з імуноглобулін-подібним та епідермальним ростовим чинником (TIE-2), рецептор інсулінового ростового фактора-I (IGFI), макрофагальні колоніє-стимулювальний чинник (cfms), BTK, ckit, cmet, рецептори чинника зростання фібробластів (FGF), рецептори Trk (TRKA, TRKB і TRKC), рецептори ефрину (eph) і RET протоонкоген. Деякі інгібітори рецепторів чинників зростання знаходяться в процесі розробки і включають антагоністи лігандів, антитіла, інгібітори тирозинових кіназ та антисмислові олігонуклеотиди. Рецептори чинників зростання і засоби, які інгібують функцію рецепторів чинника зростання, описані, наприклад, в Kath, John C, Exp. Opin. Ther. Patents (2000) 10(6):803-818; Shawver et al. DDT Vol 2, No. 2 February 1997; і Lofts, F. J. et al., "Growth factor receptors as targets", New Molecular Targets for Cancer Chemotherapy, ed. Workman, Paul and Kerr, David, CRC press 1994, London. Тірозинові кінази, які не є кіназами рецепторів чинників зростання, називають нерецепторними тирозинкіназами. Не-рецепторні тирозинкінази, корисні у даному винаході, які є мішенями або потенційними мішенями для протиракових лікарських засобів, включають cSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (кінази фокальної адгезії), Brutons тирозинкінази і Bcr-Abl. Такі нерецепторні кінази і засоби, які інгібують функцію не-рецепторних тирозинкіназ, описані в Sinh, S. and Corey, S.J., (1999) Journal of Hematotherapy and Stem Cell Research 8 (5): 465-80; and Bolen, J.B., Brugge, J.S., (1997) Annual review of Immunology. 15: 371-404. Блокатори SH2/SH3 домену являють собою засоби, які розривають зв'язування SH2 або SH3 домену в різних ферментах або адапторних білках, включаючи PI3-K p85 субодиницю, кінази сімейства Src, адапторні молекули (She, Crk, Nek, Grb2) і Ras-GAP. SH2/SH3 домени як мішені для протиракових лікарських засобів обговорюються в Smithgall, T.E. (1995), Journal of Pharmacological and Toxicological Methods. 34(3) 125-32. Інгібітори Серинових/Треонінових Кіназ, включаючи блокатори каскаду MAP кіназ, які включають блокатори Raf кіназ (rafk), Мітоген або Позаклітинну Регульовану Кіназу (MEKs) і Позаклітинні Регульовані Кінази (ERKs); і блокатори членів сімейства протеїнкіназ C, включаючи блокатори PKCs (альфа, бета, гамма, епсилон, мю, лямбда, йота, зета). Сімейство IkB кіназ (IKKa, IKKb), сімейство PKB кіназ, члени сімейства AKT кіназ і кінази TGF бета рецепторів. Такі Серинові/Треонінові кінази та їх інгібітори описані в Yamamoto, T., Taya, S., Kaibuchi, K., (1999), Journal of Biochemistry. 126 (5) 799-803; Brodt, P, Samani, A. and Navab, R. (2000), Biochemical Pharmacology, 60. 1101-1107; Massague, J., Weis-Garcia, F. (1996) Cancer 18 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 Surveys. 27:41-64; Philip, P.A. and Harris, A.L. (1995), Cancer Threatment and Research. 78: 3-27, Lackey, K. et al. Bioorganic and Medicinal Chemistry Letters, (10), 2000, 223-226; Патенті США № 6268391; і Martinez-Iacaci, L., et al., Int. J. Cancer (2000), 88(1), 44-52. Інгібітори членів сімейства Фосфотидилінозит-3 Кіназ, включаючи блокатори PI3-кінази, АТМ, ДНК-РK і Ku, також є корисними у даному винаході. Такі кінази обговорюються в Abraham, R.T. (1996), Current Opinion in Immubology. 8 (3) 412-8; Canman, C.E., Lim, D.S. (1998), Oncogene 17 (25) 3301-3308; Jackson, S.P. (1997), International Journal of Biochemistry and Cell Biology. 29 (7):935-8; і Zhong, H. et al., Cancer res, (2000) 60(6), 1541-1545. Також корисними у даному винаході є інгібітори передачі сигналів Myo-інозиту, як-от блокатори фосфоліпази C й аналоги Myo-інозиту. Такі інгібітори сигналів описані в Powis, G. and Kozikowski A., (1994) New Molecular Targets for Cancer Chemotherapy ed., Paul Workman and David Kerr, CRC press 1994, London. Інша група інгібіторів шляху сигнальної трансдукції включає інгібітори Ras Онкогена. Такі інгібітори включають інгібітори фарнезилтрансферази, гераніл-геранілтрансферази і CAAX протеаз, а також антисмислові олігонуклеотиди, рибозими та імунотерапію. Було показано, що такі інгібітори блокують активацію ras в клітинах, що містять мутант ras дикого типу, діючи, таким чином, як антипроліферативні засоби. Інгібування Ras онкогена обговорюється в Scharovsky, O.G., Rozados, V.R., Gervasoni, S.I. Matar, P. (2000), Journal of Biomedical Science. 7(4) 292-8; Ashby, M.N. (1998), Current Opinion in Lipidology. 9 (2) 99-102; і BioChim. Biophys. Acta, (19899) 1423(3): 19-30. Як вказано вище, антагоністи на основі антитіл до зв'язування ліганда з кіназою рецептора також можуть служити як інгібітори сигнальної трансдукції. Ця група інгібіторів шляху сигнальної трансдукції включає застосування гуманізованих антитил до позаклітинного лігандзв'язувального домену рецепторних тирозинкіназ. Наприклад, Imclone C225 EGFR специфічне антитіло (див. Green, M.C. et al., Monoclonal Antibody Therapy for Solid Tumors, Cancer Treat. Rev., (2000), 26(4), 269-286); Herceptin® erbB2 антитіло (див. Tyrosine Kinase Signalling in Breast cancer:erbB Family Receptor Tyrosine Kniases, Breast cancer Res., 2000, 2(3), 176-183); і 2CB VEGFR2 специфічне антитіло (див. Brekken, R.A. et. al., Selective Ingibition of VEGFR2 Activity by а monoclonal ANTI-VEGF antibody blocks tumor growth in mice, Cancer Res. (2000) 60, 5117-5124). Інгібітори зв'язаних з ангіогенезом не-рецепторних кіназ також можуть знайти застосування у даному винаході. Інгібітори зв'язаних з ангіогенезом VEGFR та TIE2 обговорюються вище у зв'язку з інгібіторами сигнальної трансдукції (обидва рецептори є рецепторними тирозинкіназами). Ангіогенез, в основному, пов'язують з передачею сигналу erbB2/EGFR, оскільки було показано, що інгібітори erbB2 і EGFR інгібують ангіогенез, переважно VEGF експресію. Таким чином, комбінація інгібітора erbB2/EGFR з інгібітором ангіогенезу має сенс. Відповідно, інгібітори не-рецепторних тирозинкіназ можна використовувати у комбінації з інгібіторами EGFR/erbB2 за даним винаходом. Наприклад, анти-VEGF антитіла, які не розпізнають VEGFR (рецепторна тирозинкіназа), але зв'язуються з лігандом; малі молекулиінгібітори інтегрину (альфаv бета3), які інгібуватимуть ангіогенез; ендостатин та ангіостатин (неRTK) також можуть бути корисними в комбінації з розкритими інгібіторами erb сімейства. (Див. Bruns CJ et al. (2000), Cancer Res., 60: 2926-2935; Schreiber AB, Winkler ME and Derynck R. (1986), Science, 232: 1250-1253; Yen L et al. (2000), Oncogene 19: 3460-3469). Засоби, використовувані як імунотерапевтичні засоби, також можуть бути корисними в комбінації із сполуками формули (I). Існує ряд імунологічних стратегій для генерації імунної відповіді проти erbB2 або EGFR. Ці стратегії, в основному, знаходяться в межах вакцинації проти пухлин. Ефективність імунологічних підходів може бути істотно підвищена через спільне інгібування шляхів передачі сигналів erbB2/EGFR з використанням малої молекули-інгібітора. Обговорення підходу на основі імунологічної/протипухлинної вакцини проти erbB2/EGFR можна знайти в Reilly RT et al. (2000), Cancer Res. 60: 3569-3576; і Chen Y, Hu D, Eling DJ, Robbins J and Kipps TJ. (1998), Cancer Res. 58: 1965-1971. Засоби, використовувані як проапоптичні (наприклад, bcl-2 антисмислові олігонуклеотиди), також можна використовувати в комбінації за даним винаходом. Члени Bcl-2 сімейства білків блокують апоптоз. Активуючу регуляцію bcl-2 тому зв'язують з хіміорезистентністю. Дослідження показали, що епідермальний ростовий чинник (EGF) стимулює анти-апоптичні члени bcl-2 сімейства (тобто mcl-1). Тому стратегії, розроблені для даун-регуляції експресії bcl-2 в пухлині продемонстрували клінічну перевагу і в даній час знаходяться у Фазі II/III випробувань, а саме, Genta's G3139 bcl-2 антисмисловий олігонуклеотид. Такі проапоптичні стратегії з використанням стратегії антисмислових олігонуклеотидів для bcl-2 обговорюються в Water JS et al. (2000), J. Clin. Oncol. 18: 1812-1823; і Kitada S et al. (1994), Antisense Res. Dev. 4: 71-79. 19 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 55 Інгібітори сигналів клітинного циклу інгібують молекули, залучені в контроль клітинного циклу. Сімейство протеїнкіназ, називаних циклін-залежними кіназами (CDK), і їх взаємодію з сімейством білків, називаних циклінами, контролюють проходження через еукаріотичний клітинний цикл. Координувальна активація та інактивация різних циклін/CDK комплексів необхідна для нормального проходження через клітинний цикл. Деякі інгібітори сигналів клітинного циклу знаходяться в процесі розробки. Наприклад, приклади циклін-залежних кіназ, включаючи CDK2, CDK4 і CDK6, і інгібіторів таких кіназ описані, наприклад, в Rosania et al., Exp. Opin. Ther. Patents (2000) 10(2):215-230. Крім того, p21WAF1/CIP1 описаний як сильний і універсальний інгібітор циклін-залежних кіназ (Cdks) (Ball et al., Progress in Cell Cycle Res., 3: 125 (1997)). Сполуки, які відомі як індукуючі експресію p21WAF1/CIP1, залучені в супресію клітинної проліферації і мають активність супресії пухлини (Richon et al., Proc. Nat Acad. Sci. U.S.A. 97(18): 10014-10019 (2000)) і включені як інгібітори сигналів клітинного циклу. Модулятори Рецептора Ретиноєвої Кислоти використовують для лікування лейкозів. Патологія лейкозу асоціюється з аномальною акумуляцією незрілих клітин-попередників, які є чутливими до лікування ретиноєвою кислотою. У більшості випадків гострого промієлоцитарного лейкозу (APL), також називаного як гострий мієлогенний лейкоз підтип M3, має місце хромосомна транслокація хромосом 15 і 17, яка викликає генетичне злиття гена рецептора ретиноєвої кислоти (RAR) з геном промієлоцитарного лейкозу (PML). Цей гібридний PML-RAR білок є відповідальним за запобігання диференціації незрілих мієлоїдних клітин в зріліші клітини. Вважають, що це блокування диференціації і подальша акумуляція менш диференційованих клітин викликають лейкоз. ATRA, Tретиноїн, діє на PML-RAR, знімаючи це блокування, викликаючи диференціацію незрілих промієлоцитів в нормальні зрілі клітини крові, таким чином, зменшуючи кількість промієлоцитів і промотуючи популяцію кінець кінцем диференційованих клітин з обмеженою тривалістю життя. Талазорол являє собою експериментальний лікарський засіб того ж класу, що і Tретиноїн. Епігенетичні зміни залучені практично у всі типи раку людини. Рак-специфічні зміни часто асоційовані з сайленсингом пухлин-супресорних генів через модифікації гістонів і модифікації ДНК, включаючи гіперметилування ДНК. Епігенетичні фармацевтичні засоби контролюють регуляторні ділянки, асоційовані з пухлинсупресорними генами, викликаючи конформаційні зміни у гістонах і видаляючи репресивні модифікації для ДНК. Ці зміни безпосередньо впливають на утворення та прогресування раку. Приклади епігенетичних засобів включають інгібітори гістон-деацетилази та інгібітори метилування ДНК. Інгібітори гістон-деацетилази (інгібітори HDAC, HDI) являють собою клас сполук, які перешкоджають функції гістон-деацетилаз. Було показано, що інгібітори гістон-деацетилаз можуть бути корисними для лікування шкірної Т-клітинної лімфоми. У даний час вони проходять клінічні дослідження для інших різних типів пухлин. Приклади інгібіторів HDAC, схвалених для застосування, включають Вориностат та Ромідепсин. Вважається, що ці сполуки інгібують активність HDAC і приводять до акумуляції ацетилювання гістонів, промотуючих генну експресію. Азацитидин (INN) або 5-азацитидин, що продається під торговою назвою Vidаzа, являє собою хімічний аналог цитидину, нуклеозиду, присутнього в ДНК і РНК. Азацитидин і його дезокси-похідне децитабін (також відомий як 5-аза-2'дезоксицитидин), застосовують для лікування мієлодиспластичного синдрому, і у даний час вони знаходяться у стадії дослідження для іншихпоказань для лікування пухлин. Азацитидин діє як несправжній субстрат і сильний інгібітор ДНК-метилтрансфераз, призводячи до зниження метилування ДНК. ДНКметилтрансферази вводять азацитидин у ДНК в процесі реплікації і у РНК у процесі транскрипції в клітині. Інгібування метилування ДНК відбувається через утворення стабільних комплексів між молекулою та ДНК-метилтрансферазамі, насичуючи таким чином механізм клітинного метилування. Це приводить до втрати метилування ДНК і може впливати на те, яким чином білки клітинної регуляції, як-от транскрипційний механізм, здатні до асоціації з ДНК. Приклади таких інгібіторів HDAC включають: 1. Вориностат, включаючи його фармацевтично прийнятні солі. Marks et al., Nature Biotechnology 25, 84 to 90 (2007); Stenger, Community Oncology 4, 384-386 (2007). Вориностат має наступну хімічну структуру та назву: 20 UA 109932 C2 N-гідрокси-N'-феніл-октандіамід 2. Ромідепсин, включаючи його фармацевтично прийнятні солі. Vinodhkumar et al., Biomedicine & Pharmacotherapy 62 (2008) 85-93. Ромідепсин, має наступну хімічну структуру та назву: 5 10 (1S,4S,7Z,10S,16E,21R)-7-етиліден-4,21-ди(пропан-2-іл)-2-окса-12,13-дитіа-5,8,20,23тетразабіцикло[8.7.6]трикоз-16-ен-3,6,9,19,22-пентон 3. Панобіностат, включаючи його фармацевтично прийнятні солі. Drugs of the Future 32(4): 315-322 (2007). Панобіностат, має наступну хімічну структуру та назву: 15 (2E)-N-гідрокси-3-[4-({[2-(2-метил-1H-індол-3-іл)етил]аміно}метил) феніл]акриламід 4. Валпроєва кислота, включаючи її фармацевтично прийнятні солі. Gottlicher, et al., EMBO J. 20(24): 6969-6978 (2001). Валпроєва кислота має наступну хімічну структуру та назву: 20 2-пропілпентанова кислота 5. Моцетиностат (MGCD0103), включаючи його фармацевтично Balasubramanian et al., Cancer Letters 280: 211-221 (2009). Моцетиностат, має наступну хімічну структуру та назву: прийнятні солі. N-(2-Амінофеніл)-4-[[(4-піридин-3-ілпіримідин-2-іл)аміно]метил]бензамід Інші приклади таких інгібіторів HDAC включені в Bertrand European Journal of Medicinal Chemistry 45, (2010) 2095-2116, зокрема, сполуки таблиці 3 цього документа, вказані нижче. 25 21 UA 109932 C2 5 Інгібітори протеасоми являють собою лікарські засоби, які блокують дію протеасом, клітинних комплексів, які руйнують білки, як-от p53 білок. Деякі інгібітори протеасом продаються на ринку або знаходяться у стадії дослідження для лікування раку. Відповідні інгібітори протеасоми для застосування в комбінації у даній заявці включають: 1. Бортезоміб (Velcade®), включаючи його фармацевтично прийнятні солі. Adams J, Kauffman M (2004), Cancer Invest 22 (2): 304-11. Бортезоміб має наступну хімічну структуру та назву. 22 UA 109932 C2 5 10 15 20 [(1R)-3-метил-1-({(2S)-3-феніл-2-[(піразин-2ілкарбоніл)аміно]пропаноїл}аміно)бутил]боронова кислота 2. Дисулфірам, включаючи його фармацевтично прийнятні солі. Bouma et al. (1998). J. Antimicrob. Chemother. 42 (6): 817-20. Дисулфірам має наступну хімічну структуру та назву. 1,1",1",1"'-[дисульфандіілбис(карбонотіоілнітрило)]тетраетан 3. Епігалокатехін галат (EGCG), включаючи його фармацевтично прийнятні солі. Williamson et al., (December 2006), The Journal of Allergy and Clinical Immunology 118 (6): 1369-74. Епігалокатехін галат має наступну хімічну структуру та назву. [(2R, 3R)-5,7-дигідрокси-2-(3,4,5-тригідроксифеніл)хроман-3-іл]-3,4,5-тригідроксибензоат 4. Саліноспорамід A, включаючи його фармацевтично прийнятні солі. Feling et at., (2003), Angew. Chem. Int. Ed. Engl. 42 (3): 355-7. Саліноспорамід A має наступну хімічну структуру та назву. (4R,5S)-4-(2-хлоретил)-1-((lS)-циклогекс-2-еніл(гідрокси)метил)-5-метил-6-окса-2азабіцикло3.2.0гептан-3,7-діон 5. Карфілзоміб, включаючи його фармацевтично прийнятні солі. Kuhn DJ, et al., Blood, 2007, 110:3281-3290. Карфілзоміб має наступну хімічну структуру і назву. 23 UA 109932 C2 5 10 15 20 25 30 (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилоксиран-2-іл)-1-оксопентан-2-іл)аміно)-1оксо-3-фенілпропан-2-іл)-2-((S)-2-(2-морфолінoацетамідо)-4-фенілбутанамідо)пентанамід Білки теплового шоку 70 кілодальтон (Hsp70s) та білки теплового шоку 90 кілодальтон (Hsp90s) являють собою сімейства повсюдно експресованих білків теплового шоку. Надекспресія Hsp70s і Hsp90s має місце в деяких типах раку. Деякі інгібітори Hsp70s і Hsp90s знаходяться у стадії дослідження для лікування раку. Відповідні інгібітори Hsp70s і Hsp90s для застосування в комбінації у даній заявці включають: 1. 17-AAG(Гелданаміцин), включаючи його фармацевтично прийнятні солі. Jia W et al. Blood. 2003 Sep 1;102(5): 1824-32. 17-AAG(Гелданаміцин) має наступну хімічну структуру та назву. 17-(Алліламіно)-17-деметоксигелданаміцин 2. Радицикол, включаючи його фармацевтично прийнятні солі. (Lee et al., Mol Cell Endocrinol. 2002, 188,47-54) Радицикол має наступну хімічну структуру та назву. (1aR,2Z,4E,14R,15aR)-8-хлор-9, 11-дигідрокси-14-метил-15,15a-дигідро-1aHбензо[c]оксирено[2,3-до][1]оксациклотетрадецин-6,12(7H, 14H)-діон Інгібітори ракового метаболізму - Багато пухлинних клітин демонструють метаболізм, що істотно відрізняється від метаболізму нормальних тканин. Наприклад, швидкість гліколізу, метаболічного процесу, який перетворить глюкозу в піруват, підвищується, і піруват, що утворюється, відновлюється до лактату замість його подальшого окислення в мітохондріях через цикл трикарбонової кислоти (TCA). Цей ефект часто спостерігають навіть в аеробних умовах, і він відомий як Ефект Варбурга. Лактатдегідрогеназа A (LDH-A), ізоформа лактатдегідрогенази, експресованої в клітинах м'язів, грає центральну роль в метаболізмі пухлинних клітин, здійснюючи відновлення пірувату в лактат, який потім може експортуватися з клітини. Було показано, що цей фермент активується в багатьох типах пухлин. Зміна метаболізму глюкози, описана в Ефекті Варбурга, є критичною для зростання і проліферації ракових клітин, і було показано, що "нокаут" LDH-A з 24 UA 109932 C2 5 10 15 20 25 30 35 40 45 використанням РНК-i приводить до зменшення клітинної проліферації і зростання пухлини в моделях ксенотрансплантатів. D. A. Tennant et. al., Nature Reviews, 2010, 267. P. Leder, et. al., Cancer Cell, 2006, 9, 425. Високі рівні синтази жирних кислот (FAS) були виявлені в ураженнях, що передують раку. Фармакологічне інгібування FAS впливає на експресію ключових онкогенів, залучених як у розвиток, так і в підтримку стану раку. Alli et al. Oncogene (2005) 24, 39-46. doi: 10,1038 Інгібітори ракового метаболізму, включаючи інгібітори LDH-A, і інгібітори біосинтезу жирних кислот (або інгібітори FAS), є відповідними для використання у комбінації із сполуками за даним винаходом. В одному варіанті втілення, спосіб лікування раку відповідно до заявленого винаходу включає спільне введення сполуки формули (I) та/або її фармацевтично прийнятної солі і щонайменше одного протипухлинного засобу, такого як засіб, вибраний з групи, що включає засоби проти мікротрубочок, платинові координаційні комплекси, алкілувальні засоби, антибіотики, інгібітори топоізомерази II, антиметаболіти, інгібітори топоізомерази I, гормони і гормональні аналоги, інгібітори шляху сигнальної трансдукції, інгібітори зв'язаних з ангіогенезом не-рецепторних тирозинкіназ, імунотерапевтичні засоби, проапоптичні засоби, інгібітори передачі сигналів клітинного циклу; інгібітори протеасом; і інгібітори ракового метаболізму. Експериментальна частина Схеми Сполуки формули (I) можна одержати способами, показаними на Схемі 1 нижче. Формули та позначення R груп, використовувані в схемах нижче, призначені для використання лише в цьому розділі. Сполуки формули (II) і (III) є комерційно доступними, або їх можна синтезувати із використанням процедур, зазвичай використовуваних в даній галузі техніки. Фахівцям в даній галузі повинно бути зрозуміло, що проілюстровані нижче сполуки можуть існувати у формі гідрохлоридної солі, якщо використовують HCl на останній стадії одержання. Сполуки формули (II) і (III) можна піддати взаємодії в традиційних умовах відновного амінування із одержанням сполук формули (I). Реакцію приєднання типово здійснюють з використанням полярного апротонного розчинника, як-от дихлоретан або тетрагідрофуран, у присутності кислоти, як-от оцтова кислота. Кислота типово присутня в кількості 50-100 % моль щодо сполуки формули (I). Відновник типово являє собою борогідрид, як-от NаBH(OAc)3, але реакцію також можна здійснити в умовах каталітичного гідрування з використанням платинового, паладієвого або нікелевого каталізатора. Схема 1 Сполуки формули (I) легко можуть бути одержані способами, показаними на Схемі 2, виходячи з відповідного фенілциклопропіламіна (II) і відповідно захищеного альдегіду (V). Відновне амінування аміну (II) з використанням альдегіду (V) дає проміжну сполуку (VI). Амін потім може бути захищений. Потім можна видалити захист X або Y групи для забезпечення можливості функціоналізації з використанням відповідного замісника R 3 із одержанням сполук формули (VIII). Потім можна видалити захист аміну та здійснити функціоналізацію за допомогою групи R4. Схема 2 25 UA 109932 C2 5 Сполуки формули (II) і (IV) можна синтезувати, як показано на Схемі 3. Виходячи з цинамату, циклопропанування можна здійснити в стандартних умовах, як-от взаємодія діазометану з Pd(OAc)2, із одержанням сполук формули (X). Потім здійснюють омилення цього складного ефіру із одержанням кислот формули (XI), які потім піддають взаємодії в стандартних умовах перегрупування Курциуса, із одержанням бажаних сполук формули (IV). Сполуки формули (IV) можна перетворити в сполуки формули (II) в стандартних умовах. Схема 3 10 26 UA 109932 C2 5 10 15 20 25 30 35 40 45 50 Альтернативно, сполуки формули (II) і (IV) можна синтезувати, як показано на Схемі 4. Виходячи із стиролу, циклопропанування можна здійснити в стандартних умовах, як-от взаємодія діазометану з Pd(OAc)2, із одержанням сполук формули (IX). Ці сполуки потім можна модифікувати, як показано на Схемі 3. Схема 4 Наступні хімічні приклади показані лише для ілюстративних цілей, і вони не призначені для обмеження обсягу даного винаходу. Сполуки були названі з використанням програми ACD Name (Advanced Chemistry Development, www.acdlabs.com). Всі сполуки мають значення PIC50 більш ніж 4,7 для описаного вище біохімічного аналізу. PE Sciex API 150 одинарний квадрупольний мас-спектрометр (PE Sciex, Thornhill, Ontario, Canada) працював із використанням іонізації електроспреєм у режимі детекції позитивних іонів. Розпилювальний газ генерували з генератора, що не містить повітря, (Balston Inc., Haverhill, MA; 2 2 www.parker.com) і доставляли при 65 ф/дюйм (4,570 кг/см ), і використовуваний як завіса газ являв собою азот високої чистоти, що доставляється з резервуару рідкого азоту Dewar при 50 2 2 ф/дюйм (3,515 кг/см ). Напруга, що додається до голки електроспрея, складала 4,8 кВ. Отвір встановлювали при 25 В, і мас-спектрометр працював при швидкості сканування 0,5 скан/сек із використанням покрокової зміни маси 0,2 amu(атомних одиниць) і збору профільних даних. Спосіб A, LCMS. Зразки вводили в мас-спектрометр із використанням CTC PAL автоматичного пробовідбірника (LEAP Technologies, Carrboro, NC), забезпеченого 10-мкл шприцом Hamilton, який упорскує пробу у Valco інжекційний клапан з 10 отворами. Використовували ВЕРХ насос Shimadzu LC-10ADvp (Shimadzu Scientific Instruments, Columbia, MD), що працює при 0,3 мл/хв, і лінійний градієнт 4,5 % A до 90 % B протягом 3,2 хвилин з утримуванням 0,4 хв. Рухлива фаза складалася із 100 % (H2О 0,02 % TFA) в судині A і 100 % (CH3CN 0,018 % TFA) в судині B. Стаціонарна фаза являла собою Aquasil (C18), і розміри колонки були 1 мм × 40 мм. Детекциію здійснювали за допомогою УФ при 214 нм, випарного світлорозсіювання (ELSD) і MS. Спосіб B, LCMS. Альтернативно, використовували аналітичну ВЕРХ систему Agilent 1100 з LCMS і роботу здійснювали при 1 мл/хв з лінійним градієнтом 5 % A до 100 % B протягом 2,2 хвилин з утримуванням 0,4 хв. Рухлива фаза складалася з 100 % (H2О 0,02 % TFA) в судині A і 100 % (CH3CN 0,018 % TFA) в судині B. Стаціонарна фаза являла собою Zobax (C8) з розміром часток 3,5 мкм, і розміри колонки були 2,1 мм × 50 мм. Детекциію здійснювали за допомогою УФ при 214 нм, випарного світлорозсіювання (ELSD) і MS. Спосіб B, LCMS. Альтернативно, використовували систему MDSSCIEX API 2000, забезпечену капілярною колонкою (50×4,6 мм, 5 мкм). ВЕРХ здійснювали на системі Agilent1200 series UPLC, забезпеченій колонкою Zorbax SB-C18 (50×4,6 мм, 1,8 мкм), елюювання здійснювали з використанням CH3CN:амонійацетатного буфера. Реакції здійснювали в мікрохвильовому пристрої (CEM, Discover). Спектри 1H-ЯМР (далі "ЯМР") записували при 400 МГц із використанням пристрою Bruker AVANCE 400 МГц, керуючої програми ACD Spect, версія 10, для подальшої обробки даних. Мультиплетності вказували як: с=синглет, д=дублет, т=триплет, кв.=квартет, м=мультиплет, дд = дублет дублетів, дт=дублет триплетів і т.п., і шир. вказує широкий сигнал. Аналітична ВЕРХ: Продукти аналізували з використанням системи аналітичної хроматографії Agilent 1100, з колонкою Zorbax XDB-C18 4,5×75 мм (3,5 мкм), при швидкості потоку 2 мл/хв, з 4 хв градієнтом від 5 % CH3CN (0,1 % мурашиної кислоти) до 95 % CH3CN (0,1 % мурашиної кислоти) в H2О (0,1 % мурашиної кислоти) і утриманням 1 хв. Препаративна ВЕРХ: Продукти очищали з використанням системи препаративної хроматографії Gilson з колонкою YMC CombiPrep ODS-A 75×30 мм в.д. (5 мкм) (www.waters.com), при швидкості потоку 50 мл/хв, з 10 хв градієнтом від 5 % CH3CN (0,1 % мурашиної кислоти) до 95 % CH3CN (0,1 % мурашиної кислоти) в H2О (0,1 % мурашиної кислоти) і утриманням 2 хв; альтернативно, продукти очищали з використанням системи препаративної хроматографії Agilent 1100, з колонкою Gemini C18100 × 30 мм (5 мкм), при 27 UA 109932 C2 5 10 15 20 25 30 35 40 швидкості потоку 60 мл/хв, з 10 хв градієнтом від 5 % CH3CN (0,1 % мурашиної кислоти) до 95 % CH3CN (0,1 % мурашиної кислоти) в H2О (0,1 % мурашиної кислоти) і утриманням 2 хв. Препаративну хроматографію з нормальною фазою здійснювали з використанням системи Analogix IntelliFlash 280 або 310, з SuperFlash Sepra Si 50 колонками. Альтернативно, використовували систему ISCO Companion. Альтернативно, обернено-фазову ВЕРХ здійснювали на системі Agilent з використанням колонки Zorbax SB-C18 (21,2×250 мм, 7 мкм), елюювання здійснювали з використанням CH3CN:амонійацетатного буфера (10 мкМ) при pH 6,8. Приклад 1 1,1-Диметилетил 4-({[транс-2-фенілциклопропіл]аміно}метил)-1-піперидинкарбоксилат До розчину 1,1-диметилетил-4-форміл-1-піперидинкарбоксилату (1,2 г, 5,63 ммоль) в 1,2дихлоретані (DCE) (20 мл) і оцтовій кислоті (0,322 мл, 5,63 ммоль) додавали [транс-2фенілциклопропіл]амін (1,499 г, 11,25 ммоль). Реакційну суміш перемішували протягом 2 годин при кімнатній температурі, потім додавали триацетоксиборогідрид натрію (4,77 г, 22,51 ммоль) і реакційну суміш перемішували протягом 3 годин при кімнатній температурі. Реакційну суміш гасили насиченим розчином NH4Cl. Додавали воду (10 мл), з подальшим додаванням дихлорметану (20 мл). Шари розділяли і органічний шар промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і упарювали. Тверду речовину суспендували в суміші ацетонітрил/діетиловий ефір 1:1, обробляли ультразвуком, перемішували протягом 1 години при кімнатній температурі і фільтрували. 1,1-Диметилетил 4-({[транс-2фенілциклопропіл]аміно}метил)-1-піперидинкарбоксилат (1,1 г, 3,16 ммоль, вихід 56,2 %) 1 виділяли у вигляді білої твердої речовини. H ЯМР (400 МГц, МЕТАНОЛ-d4) δ 7,29-7,38 (м, 2H), 7,23-7,29 (м, 1H), 7,15-7,22 (м, 2H), 4,14 (д, J=12,38 Гц, 2H), 3,14 (д, J=7,07 Гц, 2H), 3,01 (дт, J=4,14, 7,64 Гц, 1H), 2,81 (т, J=2,02 Гц, 2H), 2,54 (ддд, J=3,54, 6,63, 10,29 Гц, 1H), 1,88-2,08 (м, J=3,54, 7,41, 7,41, 11,29, 11,29 Гц, 1H), 1,81 (д, J=12,38 Гц, 2H), 1,56 (ддд, 1H), 1,47 (с, 9H), 1,41 + (кв., J=6,82 Гц, 1H), 1,23 (кв.д, J=4,29, 12,46 Гц, 2H); LC-MS Rt=0,76 хв; MS (ESI): 331,2 [M+H] . Приклад 2 1,1-Диметилетил 4-({[(1R,2S)-2-фенілциклопропіл]аміно}-метил)-1-піперидинкарбоксилат Дотримуючись процедури, аналогічної процедурі, описаній в Прикладі 1, з використанням [(1R,2S)-2-фенілциклопропіл]аміну ((-) ізомер) (94 мг, 0,703 ммоль), одержували 1,1диметилетил 4-({[(1R,2S)-2-фенілциклопропіл]аміно}метил)-1-піперидинкарбоксилат (92 мг, 1 0,264 ммоль, вихід 56,4 %) у вигляді білої твердої речовини. H ЯМР (400 МГц, МЕТАНОЛ-d4) δ 7,29-7,37 (м, 2H), 7,23-7,28 (м, 1H), 7,17-7,22 (м, 2H), 4,14 (д, J=12,63 Гц, 2H), 3,14 (д, J=7,07 Гц, 2H), 3,01 (дт, J=4,14, 7,64 Гц, 1H), 2,81 (шир.с, 2H), 2,53 (ддд, J=3,54, 6,63, 10,29 Гц, 1H), 1,97 (ддд, 1H), 1,80 (д, J=12,13 Гц, 2H), 1,55 (ддд, J=4,29, 6,63, 10,55 Гц, 1H), 1,47 (с, 9H), 1,36-1,45 + (м, 1H), 1,23 (кв.д, J=4,29, 12,38 Гц, 2H); LC-MS Rt=0,78 хв; MS (ESI): 331,3 [M+H] . Приклад 3 1,1-Диметилетил 4-({[(1S,2R)-2-фенілциклопропіл]аміно}-метил)-1-піперидинкарбоксилат 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclopropylamines as lsd1 inhibitors
Автори англійськоюJohnson, Neil, W., Kasparec, Jiri, Miller, William, Henry, Rouse, Meagan, B., Suarez, Dominic, Tian, Xinrong
Назва патенту російськоюЦиклопропиламины как ингибиторы lsd1
Автори російськоюДжонсон Нейл В., Каспарец Иржи, Миллер Вильям Генри, Руз Меган Б., Суарез Доминик, Тянь Синьжун
МПК / Мітки
МПК: A61K 31/445
Мітки: інгібітори, циклопропіламіни
Код посилання
<a href="https://ua.patents.su/103-109932-ciklopropilamini-yak-ingibitori-lsd1.html" target="_blank" rel="follow" title="База патентів України">Циклопропіламіни як інгібітори lsd1</a>
Попередній патент: Піримідинциклогексильні модулятори глюкокортикоїдних рецепторів
Наступний патент: Застосування солей 3-карбоксі-n-етил-n,n-диметилпропан-1-амінію в лікуванні серцево-судинної хвороби
Випадковий патент: Спосіб діагностики фіброзу печінки у хворих на хронічні гепатити вірусної та вірусно-алкогольної етіології