Піперазинові проліки і заміщені піперидинові антивірусні засоби
Номер патенту: 88297
Опубліковано: 12.10.2009
Автори: Мінвелл Ніколас А., Лєвеск Катя, Уеда Ясутсугу, Пек Шон К., Ліхі Девід Кеннет, Тораваль Домінік, Сірар П'єр, Конноллі Тімоті П., Саундарараджан Начімуту, Кадоу Джон Ф., Жанг Жонксінг, Юнг Кап-Сун, Чен Чунг-Пін Х., Ванг Тао
Формула / Реферат
1. Сполука за Формулою І
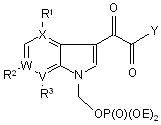 , I
, I
де
X являє собою С або N, за умови, коли X має значення N, R1 не існує;
W являє собою С або N, за умови, коли W має значення N, R2 не існує;
V являє собою С;
R1 являє собою водень, метокси або галоген;
R2 являє собою водень;
R3 являє собою метокси або гетероарил, кожен з яких може бути незалежно необов’язково заміщений одним замісником, вибраним з G; де гетероарил являє собою триазоліл, піразоліл або оксадіазоліл;
Е являє собою водень або фармацевтично прийнятну його моно- або бісіль;
Y вибирається з групи, що включає
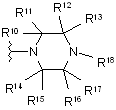 і
і 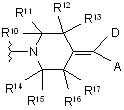 ;
;
R10, R11, R12, R13, R14, R15, R16, R17 кожен являє собою незалежно Н або метил, за умови, що не більше ніж два з-поміж R10-R17 являють собою метил;
R18 вибирається з групи, яка складається з С(О)-фенілу, С(О)-піридинілу, піридинілу, піримідинілу, хінолінілу, ізохінолінілу, хіназолінілу, хіноксалінілу, нафтиридинілу, фталазинілу, азабензофурилу і азаіндолілу, кожен з яких може незалежно необов’язково бути заміщений одним або двома членами, вибраними з групи, яка включає метил, -аміно, -NHMe, -NMe2, метокси, гідроксиметил і галоген;
D вибирається з групи, що складається з ціано, S(O)2R24, галогену, C(O)NR21R22, фенілу і гетероарилу; де вказаний феніл або гетероарил є незалежно необов’язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, вибраними з G; де гетероарил вибирається з групи, яка включає піридиніл і оксадіазоліл;
А вибирається з групи, яка включає феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл, де вказаний феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл є незалежно необов’язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, вибраними з G;
G вибирається з групи, що складається з (С1-6)алкілу, (С1-6)алкенілу, фенілу, гідрокси, метокси, галогену, -NR23C(O)-(C1-6)aлкілy, -NR24R25, -S(O)2NR24R25, COOR26 і -CONR24R25; де вказаний (С1-6)алкіл необов’язково заміщений гідрокси, диметиламіно або від одного до трьох однаковими або різними галогенами;
R26 вибирається з групи, що включає водень і (С1-6)алкіл;
R20, R21, R22, R23, R24, R25 незалежно вибираються з групи, яка включає водень, (С1-6)алкіл та -(CH2)nNR27R28;
n має значення 0-6, і
R27 тa R28 кожен незалежно є Н або метил.
2. Сполука за п. 1, яка відрізняється тим, що R1 являє собою метокси або фтор;
R18 вибирається з групи, яка складається з С(О)-фенілу, С(О)-піридинілу, ізохінолінілу, хіназолінілу та фталазинілу, де вказані ізохінолініл, хіназолініл або фталазиніл можуть незалежно необов’язково бути заміщені одним або двома членами, вибраними з групи, яка включає метил, -аміно, -NHMe, -NMe2, метокси, гідроксиметил і галоген;
D вибирається з групи, що складається з ціано, фенілу та гетероарилу; де вказаний гетероарил являє собою піридиніл або оксадіазоліл, причому феніл або гетероарил є незалежно необов’язково заміщений від одного до трьох однаковими або різними замісниками, вибраними з групи, яка включає (С1-6)алкіл, трифторметил, метокси та галоген;
А вибирається з групи, яка включає феніл, піридиніл, фурил, тієніл, ізоксазоліл або оксазоліл, де вказаний феніл, піридиніл, фурил, тієніл, ізоксазоліл або оксазоліл є незалежно необов’язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, вибраними з групи, яка включає метил, галоген, метокси та NH2; та
R10, R11, R12, R13, R14, R15, R16, R17 кожен являє собою незалежно Н або метил, за умови, що не більше ніж один з-поміж R10-R17 являє собою метил.
3. Сполука за п. 2, яка відрізняється тим, що:
X і W кожен являє собою N.
4. Сполука за п. 2, яка відрізняється тим, що:
X являє собою С; і
W являє собою N.
5. Сполука за п. 4, яка відрізняється тим, що:
R18 являє собою -C(O)-Ph; і
Y являє собою
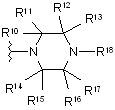 .
.
6. Сполука за п. 5, яка відрізняється тим, що:
R3 являє собою метокси або триазоліл; де вказаний триазоліл є необов’язково заміщений одним замісником, вибраним з G;
R10-R17 кожен є Н; і
G є метил.
7. Сполука за п. 6, яка відрізняється тим, що:
R1 є F, і R3 є 1,2,3-триазоліл, приєднаний у положенні N-1.
8. Сполука за п. 6, яка відрізняється тим, що:
R1 є метокси; і
R3 являє собою 3-метил-1,2,4-триазоліл, приєднаний у положенні N-1.
9. Сполука за п. 6, яка відрізняється тим, що:
R1 і R3 кожен являє собою метокси.
10. Сполука за п. 6, яка відрізняється тим, що:
сіль являє собою натрієву сіль, лізин або трометамін.
11. Фармацевтична композиція, яка містить антивірусну ефективну кількість сполуки за Формулою І за п. 1 та один або більше фармацевтично прийнятних носіїв, наповнювачів або розріджувачів.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що використовується для лікування ВІЛ-інфекції і додатково включає антивірусну ефективну кількість засобу для лікування СНІДу, вибраного з групи, яка включає:
(а) антивірусний засіб проти СНІДу;
(б) дезинфікуючий засіб;
(c) імуномодулятор; і
(d) інгібітори проникнення ВІЛ.
13. Спосіб лікування ссавців, інфікованих вірусом ВІЛ, який полягає у введенні вказаному ссавцеві антивірусної ефективної кількості сполуки за Формулою І за п. 1 з одним або більше фармацевтично прийнятними носіями, наповнювачами або розріджувачами.
14. Спосіб за п. 13, який відрізняється тим, що полягає у введенні зазначеному ссавцеві ефективної кількості антивірусної сполуки за Формулою І у поєднанні з антивірусною ефективною кількістю засобу для лікування СНІДу, вибраного з групи, яка включає противірусний засіб для лікування СНІДу, дезинфікуючий засіб, імуномодулятор і інгібітор проникнення ВІЛ.
15. Сполука за Формулою II
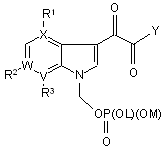 , ІІ
, ІІ
де
X являє собою С або N, за умови, коли X являє собою N, R1 не існує;
W являє собою С або N, за умови, коли W являє собою N, R2 не існує;
V являє собою С;
R1 являє собою водень, метокси або галоген;
R2 являє собою водень;
R3 являє собою метокси або гетероарил, кожен з яких може бути незалежно необов’язково заміщений одним замісником, незалежно вибраним з G; де гетероарил являє собою триазоліл, піразоліл або оксадіазоліл;
L і М є незалежно вибраними з-поміж групи, яка включає водень, С1-С6алкіл, феніл, бензил, триалкілсиліл, -2,2,2-трихлоретокси і 2-триметилсилілетокси, за умови, що не більше ніж один із L і М може бути воднем;
Y вибирається з групи, яка включає
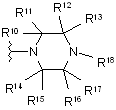 та
та  ;
;
R10, R11, R12, R13, R14, R15, R16, R17 кожен є незалежно Н або метил, за умови, що не більше ніж два з R10-R17 являють собою метил;
R18 вибирається з групи, яка включає С(О)-феніл, С(О)-піридиніл, піридиніл, піримідиніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, фталазиніл, азабензофурил і азаіндоліл, кожен яких може бути незалежно необов’язково заміщений одним або двома членами, вибраними з групи, яка включає метил, -аміно, -NHMe, -NMe2, метокси, гідроксиметил і галоген;
D вибирається з групи, яка складається з ціано, S(O)2R24, галогену, C(O)NR21R22, фенілу і гетероарилу; де вказаний феніл або гетероарил є незалежно необов’язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, вибраними з G; де гетероарил вибирається з групи, яка включає піридиніл і оксадіазоліл;
А вибирається з групи, яка включає феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл, де вказаний феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл є незалежно необов'язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, вибраними з G;
G вибирається з групи, яка включає (С1-6)алкіл, (С1-6)алкеніл, феніл, гідрокси, метокси, галоген, -NR23С(О)-(С1-6)алкіл, -NR24R25, -S(O)2NR24R25, COOR26 і -CONR24R25; де вказаний (С1-6)алкіл є необов'язково заміщений гідрокси, диметиламіно або від одного до трьох однаковими або різними галогенами;
R26 вибирається з групи, яка включає водень і (С1-6)алкіл;
R20, R21, R22, R23, R24, R25 незалежно вибираються з групи, яка включає водень, (С1-6алкіл і -(CH2)nNR27R28;
R27 і R28 кожен є незалежно Н або метил; і
n має значення 0-6.
16. Сполука за п. 7, яка відрізняється тим, що сіль являє собою лізин.
17. Сполука за п. 8, яка відрізняється тим, що сіль являє собою трометамін.
18. Сполука за п. 9, яка відрізняється тим, що сіль являє собою лізин.
19. Сполука за п. 1, яка відрізняється тим, що:
Y являє собою
 ,
,
R10, R11, R12, R13, R14, R15, R16, R17 кожен є незалежно Н або метил, за умови, що не більше ніж два з R10-R17 являють собою метил;
20. Сполука за п. 19, яка відрізняється тим, що:
R1 являє собою метокси або фтор;
D вибирається з групи, яка включає ціано, феніл і піридиніл, де вказаний феніл або піридиніл є незалежно необов’язково заміщений одним замісником, який вибирається з групи, яка включає метил і галоген; і
А вибирається з групи, яка складається з фенілу, піридинілу, де вказаний феніл або піридиніл є незалежно необов’язково заміщений одним замісником, вибраним з групи, яка включає метил і галоген.
21. Сполука за п. 20, яка відрізняється тим, що:
D являє собою ціано;
А вибирається з групи, яка включає феніл або піридиніл;
X являє собою С;
W являє собою N;
G являє собою метил;
R3 являє собою метокси або триазоліл, де вказаний триазоліл може бути незалежно необов’язково заміщений одним замісником, що вибирається з G; і
R10, R11, R12, R13, R14, R15, R16, R17 кожен являє собою Н.
22. Сполука за п. 20, яка відрізняється тим, що:
R1 являє собою метокси; і
R3 являє собою триазоліл, де вказаний триазоліл може незалежно необов’язково бути заміщений одним замісником, що вибирається з G.
23. Сполука за п. 1, яка відрізняється тим, що:
Y являє собою
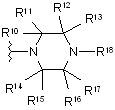 ; i
; i
R18 вибирається з групи, яка включає хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл або фталазиніл, кожен з яких може бути незалежно необов’язково заміщений одним або двома членами, вибраними з групи, яка включає метил, -аміно, -NHMe, -NMe2, метокси, гідроксиметил і галоген.
24. Сполука за п. 23, яка відрізняється тим, що:
R1 являє собою метокси або фтор;
R18 вибирається з групи, яка включає ізохінолініл, хіназолініл і фталазиніл; де вказаний ізохінолініл, хіназолініл або фталазиніл може бути необов’язково незалежно заміщений однією метильною групою або галогеном; і
R10, R11, R12, R13, R14, R15, R16, R17 кожен незалежно є Н.
25. Сполука за п. 24, яка відрізняється тим, що:
X являє собою С;
W являє собою N;
G являє собою метил; і
R3 являє собою метокси або триазоліл, де вкзаний триазоліл може бути незалежно необов’язково заміщений одним замісником, який вибирається з G.
26. Сполука за п. 25, яка відрізняється тим, що:
R1 являє собою метокси;
R3 являє собою триазоліл, де вказаний триазоліл може бути незалежно необов’язково заміщений одним замісником, який вибирається з G; і
R18 являє собою хіназолініл.
27. Сполука за п. 1, яка відрізняється тим, що:
R1 являє собою метокси або фтор;
R18 являє собою С(О)-феніл;
R10, R11, R12, R13, R14, R15, R16, R17 кожен є Н; і
G являє собою метил.
28. Сполука за п. 27, яка відрізняється тим, що:
X являє собою С; і
W являє собою N.
29. Спосіб одержання сполуки Iac, яка має структуру:
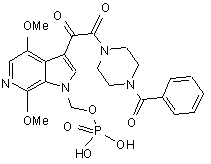 , Iac
, Iac
в якому здійснюють
(a) алкілування сполуки IVa, що має структуру
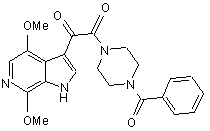 , IVa
, IVa
з використанням приблизно 1,2 моль-еквівалента ди-трет-бутил хлорметилфосфату на моль IVa, що має структуру Z
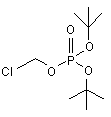 , (Z)
, (Z)
в присутності приблизно 2 моль-еквівалентів К2СО3 як основи, на моль сполуки IVa, і приблизно 5-10 мл N-метилпіролідинону як розчинника на грам IVa, при температурі реакції приблизно 30 °С, що приводить до утворення сполуки R, що має структуру
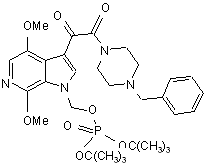 , (R)
, (R)
(b) депротектування при кімнатній температурі обох трет-бутильних груп сполуки R шляхом додавання до отриманої реакційної суміші на етапі (а) приблизно 10 мл розчинника дихлорметану на грам IVa і приблизно 15 моль-еквівалентів трифтороцтової кислоти на моль IVa; і
(c) відновлення сполуки Іас.
30. Спосіб одержання сполуки Іс, що має структуру
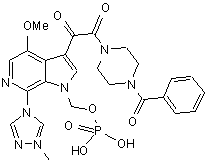 , (Iс)
, (Iс)
в якому здійснюють:
(а) алкілування сполуки IVc, що має структуру
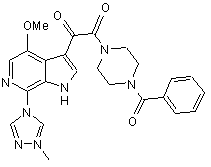 , (IVc)
, (IVc)
з використанням приблизно 2,5 моль-еквівалентів ди-трет-бутил хлорметилфосфату на моль IVc, що має структуру Z
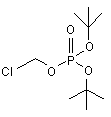 , (Z)
, (Z)
в присутності приблизно 2,5 моль-еквівалентів Cs2CO3 як основи на моль IVc, приблизно 2 моль-еквівалентів КІ на моль IVc, і приблизно 5-10 мл N-метилпіролідинону на грам IVc, при температурі реакції приблизно 25-30 °С, що дає сполуку IIс, яка має структуру
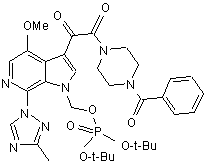 , (IIc)
, (IIc)
(b) депротектування при температурі приблизно 40 °С обох трет-бутильних груп сполуки ІІс при надлишку ацетону і води; і
(c) відновлення сполуки Іс.
31. Спосіб одержання сполуки Ibc, що має структуру
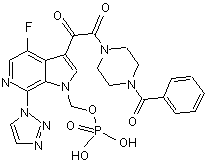 , (Ibc)
, (Ibc)
в якому здійснюють:
(а) алкілування сполуки IVb, що має структуру
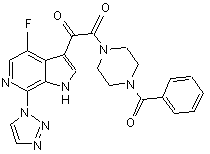 , (IVb)
, (IVb)
за допомогою приблизно 2 моль-еквівалентів ди-трет-бутил хлорметилфосфату на моль IVb, що має структуру Z
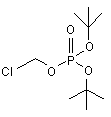 , (Z)
, (Z)
в присутності приблизно 2 моль-еквівалентів Cs2CO3 як основи на моль IVb, приблизно 2 моль-еквівалентів КІ на моль IVb, і приблизно 2,5 мл N-метилпіролідинону на грам IVb, при температурі реакційної суміші, приблизно 30 °С, що дає сполуку IIb, яка має структуру
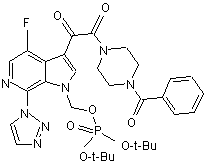 , (IIb)
, (IIb)
(b) депротектування при температурі приблизно 40 °С обох трет-бутильних груп сполуки IIb при надлишку ацетону і води; і
(c) відновлення Сполуки Іbс.
Текст
Діапазон -214 to+272 -35 to +47 Результати дослідження (для 18 з 24 пацієнтів, які отримували лікарський засіб ІVа) Сполука IVa Плацебо Максимальні зміни у ВІЛ РНК через >0.5 Іоg 10c/mL 8(67%) 0 14 днів n (%) >1.0 log 10c/mL 7 (58%) 0 >1.5 Іоg 10c/mL 3 (25%) 1. Як можна помітити з даних, отриманих при рівні дозування, що становив 800мг у поєднанні з харчуванням, яке включало високий вміст жирів, спостерігалась істотна антивірусна активність. Однак, лише 58% пацієнтів мали >1.0 log зниження вірусного навантаження. Більш яскраво виражена антивірусна реакція була помітна при режимі дозування 1800мг на фоні їжі з високим вмістом жи рів, при якому середнє значення реакції становило -96 Іоg 10 зниження навантаження віруса. Ці дані свідчать про те, що досліджувані ліки мають істотну антивірусну активність при режимах дозування 800мг і 1800мг (і, відповідно, при значеннях у цьому проміжку) через кожних 12 годин у поєднанні з високим вмістом жирів в їжі і, таким чином, вони можуть відігравати істотну роль у комбінаційній 25 терапії. Вичерпний конспект результатів, отриманих з використанням BMS-043 у людини, можна отримати, переглядаючи реферат або слайди з усного повідомлення: "Antiviral Activity, Safety, and Tolerability of a Novel, Oral Small-Molecule HIV-1 Attachment Inhibitor, BMS-488043, in HIV-1 - Infected Subjects" G. Hanna, J. Lalezari, J. Hellinger, D. Wohl, T. Masterson, W. Fiske, J. Kadow, P-F. Lin, M. Giordano, R. Colonno, D. Grasela. Abstract J-32, 02/11/2004, I Ith Conference on Retroviruses and Opportunistic Infections (CROI), San Francisco, CA. На жаль, з цілком очевидних причин, пов'язаних зі здоров'ям, зрозуміло, що неможливо приймати цей лікарський засіб постійно протягом багатьох місяців, включаючи прийом загалом по 9 капсул по 200мг кожна, двічі на день на фоні харчування з високим вмістом жиру, тому потрібна нова композиція, яка забезпечить зростання експозиції від нижчої дози, а також виключить потребу у споживанні їжі з високим вмістом жиру. Таким чином, клінічні дані показують, що необхідний спосіб для покращення експозиції цього лікарського засобу від нижчих доз і відсутність їжі з високим вмістом жиру. Таким чином, вихідні дані стосовно проліків цього винаходу неочікувано передбачують, що вони покращують експозицію молекули, такої як IVa, і забезпечують надходження вихідного лікарського засобу в концентраціях, що дадуть змогу використовувати ці ліки за відсутності їжі з високим вмістом жиру, з нижчою вагою капсули, і протягом тривалого проміжку часу як складової антиретровірусної терапії. Вихідні дані, отримані внаслідок призначення твердих капсул або проліків lab (сіль лізину) або твердої вихідної речовини (IVa) собакам, узагальнено на першій гістограмі Фіг.2А Фіг.2. Як можна побачити, після призначення проліків lab (моносіль лізину) собакам натщесерце або після прийому їжі з високим вмістом жиру, експозиція є надзвичайно високою у порівнянні з прийомом вихідної молекули. До того ж, залежність від прийому їжі (натщесерце або у голодному стані) є мінімальною, якщо будь-яка залежність взагалі існує, тоді як проліки виявляли очевидний вплив на експозицію після прийому твердої вихідної молекули. Таким чином, непередбачувано виявилось, що експозиція вихідної молекули після прийому проліків, не виявляла ніякої залежності від їжі з високим вмістом жиру, що дає підставу очікувати стабільних постійних рівнів експозиції після прийому у порівнянні з рівнями після прийому вихідної молекули. Гістограми на Фіг.2В узагальнюють попередньо обговорені дані, отримані при застосуванні щодо людини вихідної молекули IVa, і показують залежність експозиції для молекули на фоні високого вмісту жирів в їжі, і не прямо пропорційне зростання експозиції у порівнянні з дозою, і вищу експозицію при отриманні розчину, ніж твердої форми. Як обговорюється нижче, це представляє експозицію, обмежену швидкістю розчинення або адсорбції, які на преклінічних моделях, були істотно покращені за допомогою використання фосфатних проліків. Використання фосфатних проліків також підвищує експозицію у голодних собак у порівнянні з вихід 88297 26 ною молекулою для двох інших проліків. Деталі цих експериментів описано в експериментальному розділі. Крім того, деталі різних досліджень, проведених на щурах, собаках і мавпах, для двох додаткових прикладів проліків, і на щурах для інших двох проліків демонструють надзвичайну здатність цих проліків підвищувати експозицію у порівнянні із здатністю вихідної молекули, при аналогічних дозах, що, очевидно, є підставою для використання цих проліків для лікування і інгібування реплікації віруса ВІЛ. Перелік цитованої літератури патентні документи 1. Greenlee, W.J.; Srinivasan, P.C. Indole reverse transcriptase inhibitors. U.S. Patent 5,124,327. 2. Williams, T.M.; Ciccarone, T.M.; Saari, W. S.; Wai, J.S.; Greenlee, W.J.; Balani, S.K.; Goldman, M.E.; Theohrides, A.D. Indoles as inhibitors of HIV reverse transcriptase. European Patent 530907. 3. Romero, D.L.; Thomas, R.C.; Preparation of substituted indoles as anti-AIDS Pharmaceuticals. PCT WO 93 / 01181. 4. Boschelli, D.H.; Connor, D.T.; Unangst, P.C. lndole-2-carboxamides as inhibitors of cell adhesion. U.S. Patent 5,424,329. 5. (a) Mantovanini, M.; Melillo, G.; Daffonchio, L. Tropyl 7-azaindol-3- ylcarboxyamides as antitussive agents. PCT WO 95/04742 (Dompe Spa), (b) Cassidy, F.; Hughes, L; Rahman, S.; Hunter, D. J. Bisheteroaryl-carbonyl and carboxamide derivatives with 5HT 2C/2B antagonists activity. PCT WO 96/11929. (с) Scherlock, Μ. Η.; Tom, W. С. Substituted IH-pyrrolopyridine-3-carboxamides. U. S. Patent 5,023,265. (d) Hutchison, D. R.; Martinelli, M. J.; Wilson, Т. М. Preparation or pyrrolo[2,3d]pyrimidines as sPLA2 inhibitors PCT WO 00/00201. Інші публікації 6. Larder, ΒΑ; Kemp, S.D. Multiple mutations in the HIV-1 reverse transcriptase confer high-level resistance to zidovudine (AZT). Science, 1989, 246, 1155-1158. 7. Gulick, R.M. Current antiretroviral therapy. An overview. Quality of Life Research, 1997, 6, 471-474. 8. Kuritzkes, D.R. HIV resistance to current therapies. Antiviral Therapy, 1997, 2 (Supplement 3), 61-67. 9. Morris-Jones, S.; Moyle, G.; Easterbrook, P.J. Antiretroviral therapies in HIV-1 infection. Expert Opinion on Investigational Drugs, 1997,6(8), 10491061. 10. Schinazi, R.F.; Larder, B.A.; Mellors, J.W. Mutations in retroviral genes associated with drug resistance. International Antiviral News, 1997, 5, 129142. 11. Vacca, J.P.; Condra, J.H. Clinically effective HIV-1 protease inhibitors. Drug Discovery Today, 1997, 2, 261-272. 12. Flexner, D. HIV-protease inhibitors. Drug Therapy, 1998, 338, 1281-1292. 13. Berkhout, B. HIV-1 evolution under pressure of protease inhibitors: Climbing the stairs of viral fitness. J. Biomed. Sci, 1999, 6, 298-305. 27 14. Ren, S.; Lien, E. J. Development of HIV protease inhibitors: A survey. Prog. Drug Res., 1998, 51, 1-31. 15. Pedersen, O.S.; Pedersen, E.B. Nonnucleoside reverse transcriptase inhibitors: the NNRTI boom. Antiviral Chem. Chemother. 1999, 70, 285-314. 16. (a) De Clercq, E. The role of non-nucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV-1 infection. Antiviral Research, 1998, 35, 153-179. (b) De Clercq, E. Perspectives of nonnucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV infection. IL. Farmaco, 1999, 54, 26-45. 17. Font, M.; Monge, Α.; Cuartero, Α.; Elorriaga, Α.; Martinez-lrujo, J.J.; Alberdi, E.; Santiago, E.; Prieto, L; Lasarte, J.J.; Sarobe, P. and Borras, F. Indoles and pyrazino[4,5-b]indoles as nonnucleoside analog inhibitors of HIV-1 reverse transcriptase. Eur. J. Med. Chem., 1995, 30, 963-971. 18. Romero, D.L.; Morge, R.A.; Genin, M.J.; Biles, C; Busso, M,; Resnick, L.; Althaus, I.W.; Reusser, F.; Thomas, R.C and Tarpley, W.G. Bis(heteroaryl)piperazine (BHAP) reverse transcriptase inhibitors: structure-activity relationships of novel substituted indole analogues and the identification of 1-[(5-methanesulfonamido-1H-indol-2yl)-carbonyl]-4-[3-[1-methylethyl)arnino]pyridinyl]piperazine momomethansulfonate (U90152S), a second generation clinical candidate. J. Med. Chem., 1993, 36, 1505-1508. 19. Young, S.D.; Amblard, M.C.; Britcher, S.F.; Grey, V.E.; Tran, L.O.; Lumrna, W.C.; Huff, J.R.; Schleif, W.A.; Emini, E.E.; O'Brien, J.A.; Pettibone, D.J. 2- Heterocyclic indole-3-sulfones as inhibitors of HIV-reverse transcriptase. Bioorg. Med. Chem. Lett., 1995, 5, 491-496. 20. Genin, M.J.; Poel, T.J.; Yagi, Y.; Biles, C; Althaus, L; Keiser, B.J.; Kopta, L.A.; Friis, J.M.; Reusser, F.; Adams, W.J.; Olmsted, R.A.; Voorman, R.L.; Thomas, R.C. and Romero, D.L. Synthesis and bioactivity of novel bis(heteroaryl)piperazine (BHAP) reverse transcriptase inhibitors: structure-activity relationships and increased metabolic stability of novel substituted pyridine analogs. J. Med. Chem., 1996, 39, 5267-5275. 21. Silvestri, R.; Artico, M.; Bruno, В.; Massa, S.; Novellino, E.; Greco, G.; Marongiu, M.E.; Pani, Α.; De Montis, A and La Colla, P. Synthesis and biological evaluation of 5H-indolo[3,2-6][1,5]benzothiazepine derivatives, designed as conformationally constrained analogues of the human immunodeficiency virus type 1 reverse transcriptase inhibitor L-737,126. Antiviral Chem. Chemother. 1998, 9, 139-148. 22. Fredenhagen, Α.; Petersen, F.; TintelnotBlomley, M.; Rosel, J.; Mett, Η and Hug, P. J. Semicochliodinol A and B: Inhibitors of HIV-1 protease and EGF-R protein Tyrosine Kinase related to Astemquinones produced by the fungus Chrysosporium nerdarium. Antibiotics, 1997, 50, 395401. 23. (a) Kato, M.; Ito, K.; Nishino, S.; Yamakuni, H.; Takasugi, H. New 5-HT3 (Serotonin-3) receptor antagonists. IV. Synthesis and structure-activity relationships of azabicycloalkaneacetamide 88297 28 derivatives. Chem. Pharm. Bull., 1995, 43,13511357. (b) Levacher, V.; Benoit, R.; Duflos, J; Dupas, G.; Bourguignon, J.; Queguiner, G. Broadening the scope of NADH models by using chiral and non chiral pyrrolo [2,3-6] pyridine derivatives. Tetrahedron, 1991, 47, 429-440. 24. (a) Resnyanskaya, E. V.; Tverdokhlebov, A. V.; Volovenko, Y. M.; Shishkin, O. V.; Zubatyuk, R. I. A simple synthesis of 1-асуІ-3-аrуІ-3НруrrоІо[2',3':4,5]руrіmіdo[6,1-b]benzothiazol-6-ium-2olates: Betainic derivatives of a novel heterocyclic system. Synthesis, 2002, 18, 2717-2724. (b) Cook, P. D.; Castle, R. N. Pyrrolopyridazines. 1. Synthesis and reactivity of [2,3-d]pyridazine 5-oxides. J. Het. Chem. 1973,10(4), 551-557. 25. Shadrina, L.P.; Dormidontov, Yu.P.; Ponomarev, V.G.; Lapkin, LI. Reactions of organomagnesium derivatives of 7-aza- and benzoindoles with diethyl oxalate and the reactivity of ethoxalylindoles. Khim. Geterotsikl. Soedin., 1987, 1206-1209. 26. Sycheva, T.V.; Rubtsov, N.M.; Sheinker, Yu.N.; Yakhontov, LN. Some reactions of 5-cyano-6chloro-7-azaindoles and lactam-lactim tautomerism in 5- cyano-6-hydroxy-7-azaindolines. Khim. Geterotsikl. Soedin., 1987, 100-106. 27. (a) Desai, M.; Watthey, J.W.H.; Zuckerman, M. A convenient preparation of 1-aroylpiperazines. Org. Prep. Proced. Int., 1976, 8, 85-86. (b) Adamczyk, M.; Fino, J.R. Synthesis of procainamide metabolites. N-acetyl desethylprocainamide and desethylprocainamide. Org. Prep. Proced. Int. 1996, 28, 470-474. (c) Rossen, K.; Weissman, S.A.; Sager, J.; Reamer, R.A.; Askia, D.; Volante, R.P.; Reider, PJ. Asymmetrie Hydrogenation of tetrahydropyrazines: Synthesis of (S)-piperazine 2-tert-butylcarboxamide, an intermediate in the preparation of the HIV protease inhibitor Indinavir. Tetrahedron Lett., 1995, 36, 64196422. (d) Wang, Т.; Zhang, Z.; Meanwell, N.A. Benzoylation of Dianions: Preparation of monoBenzoylated Symmetric Secondary Diamines. J. Org. Chem., 1999, 64, 7661-7662. 28. Li, H.; Jiang, X.; Ye, Y.-H.; Fan, C; Romoff, Т.; Goodman, M. 3-(Diethoxyphosphoryloxy)-1,2,3benzotriazin-4(3H)-one (DEPBT): A new coupling reagent with remarkable resistance to racemization. Organic Lett., 1999, 1, 91-93. 29. Harada, N.; Kawaguchi, Т.; Inoue, I.; Ohashi, M.; Oda, K.; Hashiyama, Т.; Tsujihara, K. Synthesis and antitumor activity of quaternary salts of 2-(2'oxoalkoxy)-9-hydroxyellipticines. Chem. Pharm. Bull., 1997, 45, 134-137. 30. Schneller, S. W.; Luo, J.-K. Synthesis of 4arnino-IH-pyrrolo[2,3-o]pyridine (1,7-Dideazaadenine) and 1H-pyrrolo[2,3-o]pyridin-4-ol (1,7Dideazahypoxanthine). J. Org. Chem., 1980, 45, 4045-4048. 31. Shiotani, S.; Tanigochi, K. Furopyridines. XXII [1]. Elaboration of the C- substitutents alpha to the heteronitrogen atom of furo[2,3-b]-, -[3,2-b]-, -[2,3-c]and -[3,2-c]pyridine. J. Het. Chem., 1997, 34, 901907. 32. Minakata, S.; Komatsu, M.; Ohshko, Y. Regioselective functionalization of 1H-pyrrolo[2,3Z>]pyridine via its N-oxide. Synthesis, 1992, 661-663. 29 33. Klemm, L. H.; Hartling, R. Chemistry of thienopyridines. XXTV. Two transformations of thieno[2,3-6]pyridme 7-oxide (1). J. Het. Chem., 1976, 13, 1197-1200. 34. Antonini, L; Claudi, F.; Cristalli, G.; Franchetti, P.; Crifantini, M.; Martelli, S. Synthesis of 4-amino-l-βD-ribofuranosyl-1H-pyrrolo[2,3-6]pyridine (1Deazatubercidin) as a potential antitumor agent. J. Med. Chem., 1982, 25, 1258-1261. 35. (a) Regnouf De Vains, J.B.; Papet, A.L.; Marsura, A. New symmetric and unsymmetric polyfunctionalized 2,2'-bipyridines. J. Het. Chem., 1994, 31, 1069-1077. (b) Miura, Y.; Yoshida, M.; Hamana, M. Synthesis of 2,3-fused quinolines from 3substituted quinoline 1-oxides. Part II, Heterocycles, 1993, 36, 1005-1016. (с) Profit, V.E.; Rolle, W. Clber 4-merkaptoverbindungendes 2-methylpyridins. J. Prakt. Chem., 1960, 283 (I1), 22-34. 36. Nesi, R.; Giomi, D.; Turchi, S.; Tedeschi, P., Ponticelli, F. A new one step synthetic approach to the isoxazolo[4,5-o]pyridine system. Synth. Comm., 1992, 22, 2349-2355. 37. (a) Walser, Α.; Zenchoff, G.; Fryer, R.I. Quinazolines and 1,4- benzodiazepines. 75. 7Hydroxyaminobenzodiazepines and derivatives. J. Med. Chem., 1976, 19, 1378-1381. (b) Barker, G.; Ellis, G.P. Benzopyrone. Parti. 6- Amino- and 6hydroxy-2-subtituted chromones. J. Chem. Soc., 1970, 2230-2233. 38. Ayyangar, N.R.; Lahoti, R J.; Daniel, T. An alternate synthesis of 3,4-diaminobenzophenone and mebendazole. Org. Prep. Proced. Int., 1991, 23, 627631. 39. Mahadevan, I.; Rasmussen, M. Ambident heterocydic reactivity: The alkylation of pyrrolopyridines (azaindoles, diazaindenes). Tetrahedron, 1993, 49, 7337-7352. 40. Chen, B.K.; Saksela, K.; Andino, R.; Baltimore, D. Distinct modes of human immunodeficiency type 1 proviral latency revealed by superinfection of nonproductively infected cell lines with recombinant luciferase-encoding viruses. J. Virol, 1994, 68, 654-660. 41. Bodanszky, M.; Bodanszky, A. "The Practice of Peptide Synthesis " 2nd Ed., Springer-Verlag: Berlin Heidelberg, Germany, 1994. 42. Albericio, F. et al. J. Org. Chem. 1998, 63, 9678. 43. Knorr, R. et al. Tetrahedron Lett. 1989, 30, 1927. 44. (a) Jaszay Ζ. Μ. et al. Synth. Commun., 1998 28, 2761 and references cited therein; (b) Bemasconi, S. et al. Synthesis, 1980, 385. 45. (a) Jaszay Z. M. et al. Synthesis, 1989, 745 and references cited therein; (b) Nicolaou, K. С et al. Angew. Chem. Int. Ed 1999, 38, 1669. 46. Ooi, T. et al. Synlett. 1999, 729. 47. Ford, R. E. et al. J. Med. Chem. 1986, 29, 538. 48. (a) Yeung, K.-S. et al. Bristol-Myers Squibb Unpublished Results, (b) Wang, W. et al. Tetrahedron Lett. 1999, 40,2501. 49. Brook, M. A. et al. Synthesis, 1983, 201. 50. Yamazaki, N. et al. Tetrahedron Lett. 1972, 5047. 88297 30 51. Barry A. Bunin 'The Combinatorial Index" 1998 Academic Press, San Diego / London pages 7882. 52. Richard С Larock Comprehensive Organic Transormations 2nd Ed. 1999, John Wiley and Sons New York. 53. M.D. Mullican et al. J.Med. Chem. 1991, 34, 2186-2194. 54. Protective groups in organic synthesis 3rd ed. / Theodora W. Greene and Peter G.M. Wuts. New York: Wiley, 1999. 55. Katritzky, Alan R. Lagowski, Jeanne M. The principles of heterocyclic ChemistryNew York: Academic Press, 1968. 56. Paquette, Leo A. Principles of modern heterocyclic chemistry New York: Benjamin. 57. Katritzky, Alan R.; Rees, Charles W.; Comprehensive heterocyclic chemistry: the structure, reactions, synthesis, and uses of heterocyclic compounds 1st ed.Oxford (Oxfordshire); New York: Pergamon Press, 1984. 8 v. 58. Katritzky, Alan RHandbook of heterocyclic 1 st edOxford (Oxfordshire); New York: Pergamon Press, 1985. 59. Davies, David I Aromatic Heterocyclic Oxford; New York: Oxford University Press, 991. 60. Ellis, G. P. Synthesis of fused Chichester [Sussex]; New York: Wiley, c1987-c1992. Chemistry of heterocyclic compounds; v.47. 61. Joule, J. A Mills, K., Smith, G. F. Heterocyclic Chemistry, 3rd ed London; New York Chapman & Hall, 1995. 62. Katritzky, Alan R., Rees, Charles W., Scriven, Eric F. V. Comprehensive heterocyclic chemistry II: a review of the literature 1982-1995. 63. The structure, reactions, synthesis, and uses of heterocyclic compounds 1st ed. Oxford; New York: Pergamon, 1996.11 v. in 12: ill.; 28 cm. 64. Eicher, Theophil, Hauptmann, Siegfried. The chemistry of heterocycles: structure, reactions, syntheses, and applications Stuttgart; New York: G. Thieme, 1995. 65. Grimmett, M. R. Imidazole and benzimidazole Synthesis London; San Diego: Academic Press, 1997. 66. Advances in heterocyclic chemistry. Published in New York by Academic Press, starting in 1963-present. 67. Gilchrist, T. L. (Thomas Lonsdale) Heterocyclic chemistry 3rd ed. Harlow, Essex: Longman, 1997, 414 p: ill.; 24 cm. 68. Farina, Vittorio; Roth, Gregory P. Recent advances in the Stille reaction; Adv. Met-Org. Chem. 1996, 5, 1-53. 69. Farina, Vittorio; Krishnamurthy, Venkat; Scott, William J. The Stille reaction; Org. React. (Ν. Υ.) (1997), 50, 1-652. 70. Stille, J. K. Angew. Chem. Int. Ed. Engl. 1986, 25, 508-524. 71. Norio Miyaura and Akiro Suzuki Chem Rev. 1995, 95, 2457. 72. Home, DA Heterocycles 1994, 39, 139. 73. Kamitori, Y. et.al. Heterocycles, 1994, 37(7), 153. 31 74. Shawali, J. Heterocyclic Chem. 1976, 13, 989. 75. a) Kende, A.S. et al. Org. Photochem. Synth. 1972, 7, 92. b) Hankes, L.V.; Biochem. Prep. 1966, 11, 63. c) Synth. Meth. 22, 837. 76. Hulton et. al. Synth. Comm. 1979, 9, 789. 77. Pattanayak, B.K. et.al. Indian J. Chem. 1978, 16, 1030. 78. Chemische Behchte 1902, 35, 1545. 79. Chefnische Berichte Ibid 1911, 44, 493. 80. Moubarak, L, Vessiere, R. Synthesis 1980, Vol.I, 52-53. 81. IndJ. Chem. 1973, 71, 1260. 82. Roomi et. al. Can J. Chem. 1970, 48, 1689. 83. Sorrel, T.N. J. Org. Chem. 1994, 59, 1589. 84. Nitz, TJ. et. al. J. Org. Chem. 1994, 59, 58285832. 85. Bowden, K. et. al. J. Chem. Soc. 1946, 953. 86. Nitz, T.J. et. al. J. Org. Chem. 1994, 59, 5828-5832. 87. Scholkopf et. al. Angew. Int. Ed. Engl. 1971, 10(5), 333. 88. (a) Behun, J. D.; Levine, R.J. Org. Chem. 1961, 26, 3379. (b) Rossen, K.; Weissman, S.A.; Sager, J.; Reamer, R.A.; Askin, D.; Volante, R.P.; Reider, P.J. Asymmetrie Hydrogenation of tetrahydropyrazines: Synthesis of (S)-piperazine 2tert-butylcarboxamide, an intermediate in the preparation of the HIV protease inhibitor Indinavir. Tetrahedron Lett., 1995, 36, 6419-6422. (c) Jenneskens, L. W.; Many, J.; den Berg, E. M. M. de B.-v.; Van der Hoef, I.; Lugtenburg, J. Red. Trav. Chim. Pays-Bas 1995, 174, 97. 89. Wang, Т.; Zhang, Z.; Meanwell, N.A. Benzoylation of Dianions: Preparation of monoBenzoylated Symmetric Secondary Diamines. J. Org. Chem., 1999, 64, 7661-7662. 90. (a) Adamczyk, M.; Fino, J.R. Synthesis of procainamide metabolites. N-acetyl desethylprocainamide and desethylprocainamide. Org. Prep. Proced. Int. 1996, 28, 470-474. (b) Wang, Т.; Zhang, Z.; Meanwell, N.A. Regioselective monoBenzoylation of Unsymmetrical Piperazines. J. Org. Chem., in press. 91. Masuzawa, K.; Kitagawa, M.; Uchida, H. Bull Chem. Soc. Jpn. 1967, 40, 244-245. 92. Furber, M.; Cooper, Μ. Ε.; Donald, D. K. Tetrahedron Lett. 1993, 34, 1351-1354 93. Blair, Wade S.; Deshpande, Milind; Fang, Haiquan; Lin, Pin-fang; Spicer, Timothy P.; Wallace, Owen В.; Wang, Hui; Wang, Tao; Zhang, Zhongxing; Yeung, Kар-sun. Preparation of antiviral indoleoxoacetyl piperazine derivatives US patent 6,469,006. Preparation of antiviral indoleoxoacetyl piperazine derivatives. PCT Int. Appl. (PCT/US00/14359), WO 0076521 Al, filed May 24, 2000, published December 21, 2000. 94. Wang, Tao; Wallace, Owen В.; Zhang, Zhongxing; Meanwell, Nicholas Α.; Bender, John A. Antiviral azaindole derivatives. U.S. patent 6476034 and Wang, Tao; Wallace, Owen В.; Zhang, Zhongxing; Meanwell, Nicholas Α.; Bender, John A. Preparation of antiviral azaindole derivatives. PCT Int. Appl. (PCT/US01/02009), WO 0162255 Al, filed January 19, 2001, published August 30, 2001. 88297 32 95. Wallace, Owen В.; Wang, Tao; Yeung, КарSun; Pearce, Bradley C; Meanwell, Nicholas Α.; Qiu, Zhilei; Fang, Haiquan; Xue, Qiufen May; Yin, Zhiwei. Composition and antiviral activity of substituted indoleoxoacetic piperazine derivatives. Заявка на Патент США, серійний номер 10/027,612 подана 19 грудня, 2001; частково ця заявка є заявкою на Патент США, серійний номер 09/888,686, поданою 25 червня, 2001 (відповідає Міжнародній заявці PCT (PCT/US01/20300), WO 0204440 АІ, поданій 26 червня, 2001, опублікована 17 січня, 2002. 96. J. L. Marco, S. Т. Ingate, and P. Μ. Chinchon Tetrahedron 1999, 55, 7625-7644. 97. С Thomas, F. Orecher, and P.Gmeiner Synthesis 1998, 1491. 98. M. P. Pavia, S. J. Lobbestael, С P. Taylor, F. M. Hershenson, and D. W. Miskell. 99. Buckheit, Robert W., Jr. Expert Opinion on Investigational Drugs 2001, 10(8), 1423-1442. 100. Baizarini, J.; De Clercq, E.. Antiretroviral Therapy 2001, 31-62. 101. E. De clercq Journal of Clinical Virology, 2001, 22, 73-89. 102. Merour, Jean-Yves; Joseph, Benoit. Curr. Org. Chem. (2001), 5(5), 471-506. 103. T. W. von Geldern et al. J. Med. Chem 1996, 39, 968. 104. M. Abdaoui et al. Tetrahedron 2000, 56, 2427. 105. W. J. Spillane et al. J. Chem. Soc, Perkin Trans. 1, 1982, 3, 677. 106. Wang, Tao; Zhang, Zhongxing; Meanwell, Nicholas Α.; Kadow, John F.; Yin, Zhiwei; Xue, Qrufen May. (USA). Composition and antiviral activity of substituted azaindoleoxoaceticpiperazine derivatives. U.S. Pat. Appl. Publ. (2003), US 20030207910 Al published Nov 6, 2003 which is U.S. Patent Application Serial Number 10/214, 982 filed August 7, 2002, which is a continuation-in-part application of U.S. Serial Number 10/038, 306 filed January 2,2002 (corresponding to PCT Int. Appl. (PCT/US02/00455), WO 02/062423 A1, filed January 2, 2002, published August 15, 2002. 107. a) Nickel, Bemd; Szelenyi, Istvan; Schmidt, Jiirgen; Ernig, Peter; Reichert, Dietmar; Gunther, Eckhard; Brune, Kay. Preparation of indolylglyoxylamides as antitumor agents. PCT Int. Appl. (1999), 47,pp. CODEN: PIXXD2 WO 9951224 b) Emig, Peter; Bacher, Gerald; Reichert, Dietmar; Baasner, Silke; Aue, Beate; Nickel, Bemd; Guenther, Eckhard. Preparation of N-(6-quinolinyl)-3indolylglyoxylamides as antitumor agents. PCT Int. Appl. (2002), 4WO 2002010152A2 c) Nickel, Bernd; Kienner, Thomas; Bacher, Gerald; Beckers, Thomas; Emig, Peter; Engel, Juergen; Bruyneel, Erik; Kamp, Guenter; Peters, Kirsten. lndolyl-3-glyoxylic acid derivatives comprising therapeutically valuable properties. PCT Int. Appl. (2001), WO 2001022954A2. 108. Wang, Tao; Wallace, Owen В.; Meanwell, Nicholas Α.; Zhang, Zhongxing; Bender, John Α.; Kadow, John F.; Yeung, Кар-Sun. Preparation ofindole, azaindole, and related heterocyclic piperazinecarboxamides for treatment of AIDS. PCT Int. Appl. WO 2002085301A2. 33 109. Kadow, John F.; Xue, Qiufen May; Wang, Tao; Zhang, Zhongxing; Meanwell, Nicholas A. Preparation of indole, azaindole and related heterocyclic pyrrolidine derivatives as antiviral agents. PCT Int. Appl. WO 2003068221 Al. 110. Wang, Tao; Wallace, Owen В.; Meanwell, Nicholas Α.; Kadow, John F.; Zhang, Zhongxing; Yang, Zhong. Bicyclo 4.4.0 antiviral derivatives PCT Int. Appl. (2003), WO 2003092695A1. 111. Preparation of indolyl-, azaindolyl-, and related heterocyclic sulfonylureidopiperazines for treatment of HIV and AIDS. Kadow, John F.; Regueiro-Ren, Alicia; Xue, Qiufen May. PCT Int. Appl. (2003), WO2004000210 A2. 112. Composition and antiviral activity of substituted azaindoleoxoacetic piperazine derivatives. Wang, Tao; Zhang, Zhongxing; Meanwell, Nicholas Α.; Kadow, John F.; Yin, Zhiwei; Xue, Qiufen May; Regueiro-Ren, Alicia; Matiskella, JohnD.;Ueda,Yasutsugu. U.S. Pat. Appl. Publ. (2004), US 2004110785A1. Даний винахід включає сполуки Формули І, їх фармацевтичні композиції, і їх використання щодо пацієнтів, які потерпають від вірусу або сприйнятливі до нього, такого як ВІЛ. Сполуки Формули І, які включають нетоксичні фармацевтично прийнятні їх солі, мають формули і значення, як описано нижче. Даний винахід включає сполуку Формули І, де: X являє собою С або N, за умови, що коли X має значення N, R1 не існує; W являє собою С або N, за умови, що коли W має значення N, R2 не існує; V являє собою С; R1 являє собою водень, метокси або галоген; R2 являє собою водень; R3 - метокси або гетероарил, кожен з яких може бути незалежно необов'язково заміщений одним замісником, обраним з G; де гетероарил являє собою триазоліл, піразоліл або оксадіазоліл; Ε - водень або фармацевтично прийнятна його моно- або бісіль; Y обирається з групи, що включає R10, R11, R12, R13, R14, R15, R18, R17 кожен являє собою незалежно Η або метил, за умови, що не більше, ніж два з-поміж R10-R17 являють собою метил; R18 обирається з групи, яка складається з С(О)-фенілу, С(О)-піридинілу, піридинілу, піримідинілу, хінолінілу, ізохінолінілу, хіназолінілу, хінок 88297 34 салінілу, нафтиридинілу, фталазинілу, азабензофурилу і азаіндолілу, кожен з яких може незалежно необов'язково бути заміщений одним або двома членами, обраними з групи, яка включає метил, -аміно, -NHMe, -NMe2, метокси, гідроксиметил і галоген; D обирається з групи, що складається з ціано, S(O)2R24, галогену, C(O)NR21R22, фенілу і гетероарилу; де вказаний феніл або гетероарил являє собою незалежно необов'язково заміщений від одного до трьох однаковими або різними галогенами, або від одного до трьох однаковими або різними замісниками, обраними з G; де гетероарил обирається з групи, яка включає піридиніл і оксадіазоліл; А обирається з групи, яка включає феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл, де вказаний феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл є незалежно необов'язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, обраними з G; G обирається з групи, що складається з (С16алкілу, (С1-6алкенілу, фенілу, гідрокси, метокси, галогену, -NR23С(О)-(С1-6)алкілу, -NR24R25, S(O)2NR24R25, COOR26 і -CONR24R25; де вказаний (С1-6)алкіл необов'язково заміщений гідрокси, диметиламіно або від одного до трьох однаковими або різними галогенами; R26 обирається з групи, що включає водень і (С1-6)алкіл; R20, R21, R22, R23, R24, R25 є незалежно обраний з групи, що включає водень, (С1-6)алкіл і (CH2)nNR27R28; n має значення 0-6; і R27 і R28 кожен є незалежно Η або метил. Кращим втіленням сполук, наведених вище, є сполука, де: X і W кожен становить собою Ν; або наведені вище сполуки, де: X являє собою С; і W є N. Іншим кращим втіленням наведених вище сполуки є сполука, де: R18 являє собою -C(O)-Ph; і Υ являє собою Іншим кращим втіленням є сполуки, що описані вище, в яких: R3 - це метокси або триазоліл; де вказаний триазоліл є необов'язково заміщений одним замісником, обраним з G; R10-R17 кожен є Н; і G є метил. Іншим кращим втіленням є сполуки, що описані вище, в яких: R1 - це F, і R3 - це 1,2,3-триазоліл, приєднаний у положенні N-1. Іншим кращим втіленням є сполуки, що описані вище, в яких: 35 R1 - це ОМе, і R3 являє собою 3-метил-1,2,4триазоліл, приєднаний у положенні N-1. Іншим кращим втіленням є сполуки, що описані вище, в яких: R1 і R3 кожен є метокси. Іншим кращим втіленням є сполуки, що описані вище, в яких сіль є натрій, лізин або трометамін. Іншим кращим втілення винаходу є фармацевтична композиція, яка містить антивірусну ефективну кількість сполуки за Формулою І, включаючи фармацевтично прийнятні її солі, і один або два фармацевтично прийнятні носії, наповнювачі або розріджувачі. Іншим кращим втіленням є фармацевтична композиція з-поміж зазначених вище, яка використовується для лікування ВІЛ-інфекції, що, крім того, додатково включає антивірусну ефективну кількість засобу для лікування СНІДу, обраного з групи, яка включає: (a) антивірусний засіб проти СНІДу; (b) дезинфікуючий засіб; (c) імуномодулятор; і (d) інгібітори проникнення ВІЛ. Втілення також охоплюють спосіб для лікування ссавців, інфікованих вірусом ВІЛ, який полягає у введенні вказаному ссавцеві антивірусної ефективної кількості сполуки за Формулою І, що включає фармацевтично прийнятні її солі та один або більше фармацевтично прийнятних носії, наповнювачі або розріджувачі. Іншим втіленням є спосіб, описаний вище, який полягає у введенні зазначеному ссавцеві ефективної кількості антивірусної сполуки за Формулою І, що включає фармацевтично прийнятні ї солі, у поєднанні з антивірусною ефективною кількістю засобу для лікування СНІДу, обраного з групи, яка включає противірусний засіб для лікування СНІДу; дезинфікуючий засіб; імуномодулятор; і інгібітор проникнення ВІЛ. Іншим втіленням є проміжні сполуки Формули II, що використовуються при виготовленні сполук І, де: X являє собою С або N, за умови, що коли X це N, R1 не існує; W являє собою С або N, за умови, що коли W це N, R2 не існує; V являє собою С; R1 являє собою водень, метокси або галоген; R2 являє собою водень; R3 - це метокси або гетероарил, кожен з яких може бути незалежно необов'язково заміщений одним замісником, незалежно відібраним з G; де гетероарил - це триазоліл, піразоліл або оксадіазоліл; L і Μ є незалежно обрані з-поміж групи, яка включає водень, С1-С6алкіл, феніл, бензил, триалкілсиліл, -2,2,2-трихлоретокси і 2 88297 36 триметилсилілетокси, за умови, що не більше, ніж один L і Μ можуть бути воднем; Υ обирається з групи, яка включає R10, R11, R12, R13, R14, R15, R16, R17 кожен є незалежно Н або метил, за умови, що не більше, ніж два з R10-R17 - це метил; R18 обирається з групи, яка включає С(О)феніл, С(О)-піридиніл, піридиніл, піримідиніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, фталазиніл, азабензофурил і азаіндоліл, кожен яких може бути незалежно необов'язково заміщений одним або двома членами, обраними з групи, яка включає метил, -аміно, -NHMe, -NMe2, метокси, гідроксиметил і галоген; D обирається з групи, яка складається з ціано, S(O)2R24, галогену, C(O)NR21R22, фенілу і гетероарилу; де вказаний феніл або гетероарил є незалежно необов'язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, обраними з G; де гетероарил обирається з групи, яка включає піридиніл і оксадіазоліл; А обирається з групи, яка включає феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл, де вказаний феніл, піридиніл, фурил, тієніл, ізоксазоліл і оксазоліл є незалежно необов'язково заміщений від одного до трьох однаковими або різними галогенами або від одного до трьох однаковими або різними замісниками, обраними з G; G обирається з групи, яка включає (С1-6)алкіл, (С1-6)алкеніл, феніл, гідрокси, метокси, галоген, NR23С(О)-(С1-6)алкіл, -NR24R25, -S(O)2NR24R25, COOR26 і -CONR24R25; де вказаний (С1-6)алкіл є необов'язково заміщений гідрокси, диметиламіно або від одного до трьох однаковими або різними галогенами; R28 обирається з групи, яка включає водень і (С1-6)алкіл; R20, R21, R22, R23, R24, R25 незалежно обираються з групи, яка включає водень, (С1-6)алкіл і (CH2)nNR27R28; R27 і R28 коже є незалежно Η або метил; і n має значення 0-6. Фіг.1 представляє AUC (Area Under the Curve Площу Під Кривою) залежно від дозування у клінічному випробуванні на людині Сполуки IVa. Фіг.2 представляє AUC для Сполуки IVa і Проліків lab натщесерце і після їжі у дослідженнях на собаках та людині. Фіг.3 представляє AUC при пероральному (ПО) застосуванні сполуки IVc на щурах залежно від схеми дозування. Фіг.4 представляє Сmах IVc після ПО введення щурами залежно від схеми дозування. Фіг.5 представляє плазматичні профілі IVc у щурів після ПО застосування Іс. Фіг.6 наводить порівняння Сmах IVa і AUC у самців щурів, яким давали або IVa, або lab. 37 Фіг.7 представляє порівняння IVa Сmах і AUC у собак, яким давали IVa або lab. Фіг.8 представляє гідроліз lab в розчинах плацентарної лужної фосфатази (ЛФ) людини і утворення IVa. Фіг.9 представляє концентрацію lab і IVa у плазмі залежно від часу після внутрішньовенного (ВВ) і перорального (ПО) введення lab щурам і від контрольних даних IVa у щурів. Фіг.10 представляє концентрацію у плазмі залежно від профілів часу lab і IVa після внутрішньовенного і перорального введення lab собакам і від контрольних даних IVa у собак. Фіг.11 представляє концентрацію у плазмі залежно від профілів часу lab і IVa після ВВ і ПО lab мавпам і від контрольних даних IVa у мавп. Фіг.12 представляє порівняння Сmах IVb і AUC у самців щурів, яким давали IVb або Ibb. Фіг.13 представляє порівняння Сmах IVb і AUC у собак, яким давали IVb або Ibb. Фіг.14 представляє гідроліз Ibb у плацентарних розчинах ALP людини і утворення IVb. Фіг.15 представляє залежність концентрації у плазмі Ibb і IVb від профілів часу після ВВ і ПО введення Ibb щурам і контрольних даних IVb у щурів. Фіг.16 представляє залежність концентрації у плазмі Ibb і IVb від профілів часу після ВВ і ПО введення Ibb собакам і контрольних даних IVb у собак. Фіг.17 представляє залежність концентрації у плазмі Ibb і IVb від профілів часу після ВВ і ПО Ibb мавпам і контрольних даних IVb у мавп. Фіг.18 представляє порівняння Сmах IVc і AUC у самців щурів, яким давали IVc або Icb. Фіг.19 представляє порівняння Сmах IVc і AUC у собак, яким давали IVc або Icb. Фіг.20 представляє гідроліз Icb в розчинах плацентарного ALP людини і утворення IVc. Фіг.21 представляє залежність концентрації у плазмі Icb і IVc від профілів часу після внутрішньовенного і перорального введення Icb у щурів і контрольних даних IVc у щурів. Фіг.22 представляє залежність концентрації у плазмі Icb і IVc від профілів часу після внутрішньовенного і перорального введення Icb у собак і контрольних даних IVc у собак. Фіг.23 представляє залежність концентрації у плазмі Icb і IVc від профілів часу після внутрішньовенного і перорального введення Icb мавпам і контрольних даних IVc у мавп. Оскільки сполуки даного винаходу можуть мати асиметричні центри, а відповідно, зустрічаються як суміші діастереомерів і енантіомерів, даний винахід включає окремі діастереоізомерні та енантіомерні форми сполуки за Формулою І, а також їхні суміші. Визначення Термін "С1-6алкіл" як використовується у описі і у формулі винаходу (якщо не зазначено щось інше) означає пряму або розгалужену алкільну групу, таку як метил, етил, пропіл, ізопропіл, бутил, ізобутил, t-бутил, аміл, гексил тощо. "Галоген" означає хлор, йод або фтор. 88297 38 "Арильна" група належить до всіх вуглецевих моноциклічних або конденсованих кільцевих поліциклічних (тобто, до кілець, що спільно використовують суміжні пари атомів вуглецю) груп, що мають цілковито спряжену pі-електронну систему. Приклади, без обмеження, арильних груп являють собою феніл, нафталеніл і антраценіл. Арильна група може бути заміщеною або незаміщеною. Коли заміщують одну або більше замінних груп, переважно, вибирають з алкілу, циклоалкілу, арилу, гетероарилу, гетероаліциклілу, гідрокси, алкокси, арилокси, гетероарилокси, гетероаліциклокси, тіогідрокси, тіоарилокси, тіогетероарилокси, тіогетероаліциклокси, ціано, галогену, нітро, карбонілу, О-карбамілу, N-карбамілу, С-амідо, N-амідо, Скарбокси, О-карбокси, сульфінілу, сульфонілу, сульфонамідо, тригалогенметилу, уреїдо, аміно і NRxRy, де Rx і Ry незалежно обрані з групи, що складається з водню, алкілу, циклоалкілу, арилу, карбонілу, С-карбокси, сульфонілу, тригалогенметилу, і об'єднані в п'яти- або шестичленне гетероаліциклічне кільце. Термін "гетероарильна" група, як його використовують у даному описі, належить до моноциклічних або конденсованих кільцевих (тобто, кільця, які спільно використовують суміжну пару атомів) груп, що мають у кільці(ях) один або більше атомів, обраних із групи, що складається з азоту, кисню і сірки і, крім того, ці групи мають цілковито спряжену pί-електронну систему. Якщо інше не вказано, то гетероарильна група може бути приєднана або до атома вуглецю, або до атома азоту всередині гетероарильної групи. Слід зазначити, що термін "гетероарил" призначений, щобохопити N-оксид вихідного гетероарилу, якщо такий Nоксид може бути хімічно отриманий, як відомо пересічному фахівцю в даній галузі. Прикладами, без обмеження, гетероарильних груп є фурил, тієніл, бензотієніл, тіазоліл, імідазоліл, оксазоліл, оксадіазоліл, тіадіазоліл, бензотіазоліл, триазоліл, тетразоліл, ізоксазоліл, ізотіазоліл, піроліл, піраніл, тетрагідропіраніл, піразоліл, піридил, піримідиніл, хінолініл, ізохінолініл, пуриніл, карбазоліл, бензоксазоліл, бензимідазоліл, індоліл, ізоіндоліл, піразиніл, діазиніл, піразин, триазинілтриазин, тетразиніл і тетразоліл. При заміщенні одну або більше замінних груп(групу) переважно обирають з алкілу, циклоалкілу, арилу, гетероарилу, гетероаліциклілу, гідрокси, алкокси, арилокси, гетероарилокси, гетероаліциклокси, тіоалкокси, тіогідрокси, тіоарилокси, тіогетероарилокси, тіогетероаліциклокси, ціано, галогену, нітро, карбонілу, О-карбамілу, Nкарбамілу, С-амідо, N-амідо, С-карбокси, Окарбокси, сульфінілу, сульфонілу, сульфонамідо, тригалогенметилу, уреїдо, аміно, і -NRxRy, де Rx і Ry мають значення, як визначено вище. Як тут використовується, "гетероаліциклічна" група належить до моноциклічних або конденсованих кілець, які мають в кільці(ях) один або більше атомів, обраних з групи, яка складається з азоту, кисню і сірки. Кільця обираються серед тих кілець, що забезпечують стійке розташування зв'язків і не мають наміру охопити системи, які не могли б існувати. Кільця можуть також мати один або більше подвійних зв'язків. Однак, кільця не мають 39 повністю кон'югованої p-електронної системи. Приклади, без обмеження, гетероаліциклічних груп є азетидиніл, піперидил, піперазиніл, імідазолініл, тіазолідиніл, 3-піролідин-1-іл, морфолініл, тіоморфолініл і тетрагідропіраніл. При заміщенні замісна група(и), переважно одна або більше, обираються серед алкілу, циклоалкілу, арилу, гетероарилу, гетероаліциклічної групи, гідрокси, алкокси, арилокси, гетероарилокси, гетероаліциклокси, тіогідрокси, тіоалкокси, тіоарилокси, тіогетероарилокси, тіогетероаліциклокси, ціано, галогену, нітро, карбонілу, тіокарбонілу, О-карбамілу, N-карбамілу, Отіокарбамілу, N-тіокарбамілу, С-амідо, С-тіоамідо, N-амідо, С-карбокси, О-карбокси, сульфінілу, сульфонілу, сульфонамідо, тригалометансульфонамідо, тригалометансульфонілу, силілу, гуанілу, гуанідину, уреїдо, фосфонілу, аміно і -NRxRy, де Rxi Ry мають значення, як було визначено вище. "Алкільна" група належить до насиченого аліфатичного вуглеводню, включаючи прямий ланцюг і розгалужені ланцюгові групи. Переважно, алкільна група має від 1 до 20 атомів вуглецю (де б не наводився цифровий ряд, наприклад, "1-20", це означає, що група, у цьому випадку алкільна група, має включати 1 атом вуглецю, 2 атоми вуглецю, 3 атоми вуглецю, тощо, включаючи до 20 атомів вуглецю). Кращим є алкіл середнього розміру, який має від 1 до 10 атомів вуглецю. Ще краще, якщо це нижчий алкіл, який має від 1 до 4 атомів вуглецю. Алкільна група може бути заміщена або незаміщена. Якщо вона заміщена, група(и)замісник, переважно одна або більше, обирається окремо серед тригалоалкілу, циклоалкілу, арилу, гетероарилу, гетероаліциклічних сполук, гідрокси, алкокси, арилокси, гетероарилокси, гетероаліциклокси, тіогідрокси, тіоалкокси, тіоарилокси, тіогетероарилокси, тіогетероаліциклокси, ціано, гало, нітро, карбонілу, тіокарбонілу, О-карбамілу, Nкарбамілу, О-тіокарбамілу, N-тіокарбамілу, Самідо, С-тіоамідо, N-амідо, С-карбокси, Окарбокси, сульфінілу, сульфонілу, сульфонамідо, тригалометансульфонамідо, тригалометансульфонілу, і комбінованих, п'яти- або шестичленних гетероаліциклічних кілець. "Циклоалкільна" група належить до карбонових моноциклічних або конденсованих кільцевих (тобто, кілець, які поділяють сусідню пару атомів вуглецю) груп, де одне або більше кілець не мають повністю кон'югованої p-електронної системи. Прикладами, без обмеження, циклоалкільних груп є циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексадієн, циклогептан, циклогептатрієн і адамантан. Циклоалкільна група може бути заміщена або незаміщена. Якщо вона заміщена, група(и)-замісник, переважно одна або більше, обирається окремо серед алкілу, арилу, гетероарилу, гетероаліциклічних сполук, гідрокси, алкокси, арилокси, гетероарилокси, гетероаліциклокси, тіогідрокси, тіоалкокси, тіоарилокси, тіогетероарилокси, тіогетероаліциклокси, ціано, гало, нітро, карбонільної, тіокарбонільної, Окарбамільної, N-карбамільної, О-тіокарбамільної, N-тіокарбамільної, С-амідо, С-тіоамідо, N-амідо, Скарбокси, О-карбокси, сульфінільної, сульфонільної, сульфонамідо, тригалометансульфонамідо, 88297 40 тригалометансульфонільної, силільної, гуанільної, гуанідино, уреїдо, фосфонільної, аміно і -NRxRy з Rx і Ry, як було визначено вище. "Апкенільна" група належить до алкільної групи, як тут визначено, що включає щонайменше, два атоми вуглецю і, щонайменше, один вуглецьвуглецевий подвійний зв'язок. "Алкінільна" група належить до алкільної групи, як тут визначено, що включає щонайменше, два атоми вуглецю і, щонайменше, один вуглецьвуглецевий подтрійний зв'язок. "Гідроксильна" група належить до -ОН групи. "Алкокси" група належить як до -О-алкілу, так і -О-циклоалкільної групи, як тут визначено. "Арилокси" група належить як до -О-арильної, так і до -О-гетероарильної групи, як визначено у цьому описі. "Гетероарилокси" група належить до гетероарильної-О- групи з гетероарилом як визначено у даному описі. "Гетероаліцикпокси" група належить до гетероаліциклічної-О- групи з гетероаліциклічною групою, як визначено у даному описі. "Тіогідрокси" група належить до -SH групи. "Тіоалкокси" група належить як до S-алкільної, так і -S-циклоалкільної груп, як визначено у даному описі. "Тіоарилокси" група належить як до -Sарильної, так і -S-гетероарильної груп, як визначено у даному описі. "Тіогетероарилокси" група належить до гетероарильної -S- групи з гетероарилом, як визначено у даному описі. "Тіогетероаліциклокси" група належить до гетероаліциклічної -S- групи з гетероаліциклілом, як визначено у даному описі. "Карбонільна" група належить до -C(=O)-R" групи, де R" обирають із групи, що складається з водню, алкілу, алкенілу, алкінілу, циклоалкілу, арилу, гетеро арилу (зв'язаного через вуглецеве кільце) і гетероаліциклілу (зв'язаного через вуглецеве кільце), як кожний визначений у даному описі. "Альдегідна" група належить до карбонільної групи, де R" являє собою водень. "Тіокарбонільна" група належить до -C(=S)-R" групи, з R", як визначено у даному описі. "Кето" група належить до -СС(=О)С- групи, де вуглець в одній з двох або в обох позиціях С = О може бути алкілом, циклоалкілом, арилом або вуглецем гетероарильної або гетероаліациклічної групи. "Тригалогенметанкарбонільна" група належить до Z3CC(=O)- групи із зазначеним Z, що є галогеном. "С-карбокси" група належить до -C(=O)O-R" групи, з R", як визначено у даному описі. "О-карбокси" група належить до R"C(-O)Oгрупи, з R", як визначено у даному описі. Група "карбонової кислоти" належить до Скарбоксильної групи, у якій R" являє собою водень. "Тригалогенметильна" група належить до -CZ3 групи, де Ζ являє собою галогенову групу, як визначено у даному описі. 41 "Тригалогенметансульфонільна" група належить до Z3CS(=О)2- групи з Z, як визначено вище. "Тригалогенметансульфонамідо" група належить до Z3CS(=O)2NRX-групи з Ζ і Rx, як визначено у даному описі. "Сульфінільна" група належить до -S(=O)-R" групи, з R", як визначено в даному описі і, крім того, може стосуватись тільки зв'язку; тобто, S(O)-. "Сульфонільна" група належить до -S(=O)2R" групи, з R", як визначено в даному описі і, крім того, може стосуватись єдиного зв'язку; тобто, S(O)2-. "S-сульфонамідна" група належить до S(=O)2NRxRy, з Rx і Ry, як визначено в даному описі. "N-сульфонамідна" група належить до R"S(=O)2NRх- групи, з Rx, як визначено в даному описі. "О-карбамільна" група належить до OC(=O)NRxRy, як визначено в даному описі. "N-карбамільна" група належить до ROC(=O)NRy групи, з Rx і Ry, як визначено в даному описі. "О-тіокарбамільна" група належить до OC(=S)NRxRy групи, з Rx і Ry, як визначено в даному описі. "N-тіокарбамільна" група належить до RxOC(=S)NRy- групи, з Rx і Ry, як визначено в даному описі. "Аміно" група належить до -NH2 групи. "С-амідна" група належить до -C(=O)NRxRy групи, з Rx і Ry, як визначено в даному описі. "С-тіоамідна" група належить до -C(=S)NRxRy групи, з Rx і Ry, як визначено в даному описі. "N-амідна" група належить до RxC(=O)NRyгрупи, з Rx і Ry, як визначено в даному описі. "Уреїдна" група належить до -NRxC(=O)NRyRy2 групи, з Rx і Ry, як визначено в даному описі і R"2 визначений також, як Rx і Ry. "Тіоуреїдна" група належить до NRxC(=S)NRyRy2 групи, з Rx і Ry, як визначено в даному описі і Rу2 визначений також як Rx і Ry. "Гуанідино" група належить до RxNC(=N)NRyRy2 групи, з Rx, Ry і Ry2, як визначено в даному описі. "Гуанільна" група належить до RxRyNC(=N)групи, з Rx і RY, як визначено в даному описі. "Ціано" група належить до -CN групи. "Силільна" група належить до -Si(R")3, з R", як визначено в даному описі. "Фосфонільна" група належить до P(=O)(ORx)2 x з R , як визначено в даному описі. "Гідразино" група належить до -NRxNRyRy2 групи, з Rx, Ry і Ry2, як визначено в даному описі. Будь-які дві прилеглі R групи можуть об'єднуватись, утворюючи додаткове арильне, циклоалкільне, гетероарильне або гетероциклічне кільце, сконденсоване з кільцем, яке початково несе ці R групи. Пересічному фахівцю в даній галузі відомо, що атоми азоту в гетероарильній системі можуть "брати участь у гетероарильному кільцевому подвійному зв'язку", і це має відношення до форми подвійних зв'язків у двох таутомерних структурах, 88297 42 що включають п'ятичленне кільце гетероарильних груп. Це визначає положення, у якому атоми азоту можуть бути заміщені, що зрозуміло хімікам. Розкриття і формула даного винаходу ґрунтуються на загальновідомих принципах хімічного зв'язку. Зрозуміло, що формула винаходу не охоплює структури, що, як відомо, є нестійкими або не здатні до існування, виходячи з літературних даних. Фізіологічно прийнятні солі сполук проліків, що тут розкриваються, знаходяться в межах даного винаходу. Термін "фармацевтично прийнятна сіль", який використовується у даному описі і у формулі винаходу, має на меті включити нетоксичні основні адитивні солі. Термін "фармацевтично прийнятна сіль", як він використовується у даному описі, призначений для того щоб включати солі кислотних груп, таких як карбоксильна або фосфатна чи фосфатномоноестерна, з такими протиіонами, як амоній, солі лужних металів, зокрема, натрію або калію, солі лужноземельних металів, зокрема, кальцію або магнію, солі перехідних металів, таких як цинк, і солі з прийнятними органічними основами, такими як нижчі алкіламіни (метиламін, етиламін, циклогексиламін тощо) або заміщеними нижчими алкіламінами (наприклад, гідроксилзаміщеними алкіламінами, такими як диетаноламін, триетаноламін або монотрометамін (що також називається TRIS або 2-аміно-2(гідроксиметил)пропан-1,3-діол) трис(гідроксиметил)-амінометан), лізин, аргінін, гістидин, N-метилглюкамін, або з основами, такими як піперидин або морфолін. Зрозумілим є те, що фармацевтично прийнятні солі, при виділенні їх у твердому чи кристалічному стані, включать також гідрати або молекули води, що утримуються речовиною отриманої Сполуки І. Стехіометричні можливості добре відомі для фахівців у цій галузі. Обговорення фармацевтично прийнятних солей і переліків можливих солей включені в наступних посиланнях: Preparation of-water-soluble compounds through salt formation. Stahl, P. Heinrich. Cosmas Consult, Freiburg im Breisgau, Germany. Editor(s): Wermuth, Camille Georges. Practice of Medicinal Chemistry (2nd Edition) (2003), 601-615. Publisher: Elsevier, London, UK CODEN: 69EOEZ. Handbook of pharmaceutical salts: properties, selection, and use by Stahl, P. Heinrich, Wermuth, Camille G., Liternational Union of Pure and Applied Chemistry. Weinheim; New York: VHCA; Wiley-VCH, 2002. В іншому аспекті винаходу, розкриваються нові фосфатноестерні проміжні Сполуки II. У випадку фосфатних естерів, існує можливість моно- або диестерів, обидва з них охоплені цим винаходом. 43 88297 У способі даного винаходу, термін "антивірусна ефективна кількість" означає загальну кількість кожного активного компонента способу, яка є достатньою, щоб справити відчутний позитивний вплив на пацієнта, тобто, досягти зцілення гострого стану, що характеризується інгібуванням ВІЛінфекції. Коли засіб застосовують для індивідуальних активних інгредієнтів, що вводяться по одному, термін стосується одного інгредієнта. Коли термін застосовують до комбінації, він належить до загальної кількості активних інгредієнтів, що призводить до терапевтичного ефекту, при введенні комбінації, послідовно або одночасно. Терміни "обробляти, лікування, обробка", як їх викориЛікарський препарат 097 Ампренавір 141 W94 GW 141 Абакавір (1592U39) GW 1592 Акеманнан Ацикловір AD-439 AD-519 Адефовір дипівоксил AL-721 Альфа інтерферон Анзаміцин LM 427 Nat'l Cancer Institute Bristo1-Myers Novartis BMS-234475 (CGP-61755) Bristo1-Myers Novartis CI-1012 Warner-Lambert Цидофовір Gilead Science Сульфат курдлану AJI Pharma USA Цитомегаловірусу імуногло- Medlmmune булін Цитовен Syntex Ганцикловір Делавіридин Pharmacia-Upjohn Сульфат декстрану ddC Дидезоксицидин ddl Дидезоксицидин стовують у даному винаході й у формулі винаходу, означають запобігання або поліпшення стану при захворюваннях, пов'язаних із ВІЛ - інфекцією. Даний винахід стосується також комбінації сполук з одним або більшою кількістю засобів, придатних для лікування СНІДу. Наприклад, сполуки даного винаходу можуть ефективно бути застосовані або в періоди попереднього виявлення і/або наступного виявлення, у комбінації з ефективною кількістю антивірусних препаратів проти СНІДу, імуномодуляторів, протиінфекційних препаратів або вакцин, таких що наведені в даній таблиці ПРОТИВІРУСНІ ПРЕПАРАТИ Виробник Показання до застосування Hoechst/Bayer BІЛ-інфекція, СНІД, аномальна відповідність сітківки (СНІД-асоційований комплекс) (ненуклеозидні інгібітори зворотної транскриптази(ЗТ)) Glaxo Wellcome ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) Glaxo Wellcome ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор ЗТ) Carrington Labs (Irving, TX) аномальна відповідність сітківки Burroughs Wellcome ВІЛ-інфекція, СНІД, аномальна відповідність сітківки; в комбінації із зидовудином Tanox Biosystems ВІЛ-інфекція, СНІД, аномальна відповідність сітківки Tanox Biosystems ВІЛ-інфекція, СНІД, аномальна відповідність сітківки Gilead Sciences Ethigen (Los ВІЛ-інфекція, аномальна відповідність сітківки, Angeles, CA) PGL, ВІЛ-позитивний, СНІД Glaxo Wellcome Саркома Капоші, ВІЛ у комбінації з w/ретровірусом Adria Laboratories (Dublin, аномальна відповідність сітківки OH) Erbamont (Stamford, CT) Advanced Biotherapy СНІД, аномальна відповідність сітківки Concepts (Rockville, MD) Антитіло, яке нейтралізує pH лабільний альфа аберантний інтерферон AR177 Aronex Pharm Бета-фтор-ddA BMS-232623 (CGP-73547) 44 ВІЛ-інфекція, СНІД, аномальна відповідність сітківки Хвороби, асоційовані зі СНІДом Squibb/ ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) Squibb/ ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) ВІЛ-I інфекція CMV ретиніт, герпес, вірусна папілома ВІЛ-інфекція CMV ретиніт Загроза зору CMV периферичний CMV ретиніт ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітори ЗТ) Ueno Fine Chem. Ind. Ltd. СНІД, аномальна відповідність сітківки, ВІЛ по(Osaka, Japan) зитивна асимптоматика Hoffman-La Roche ВІЛ-інфекція, СНІД, аномальна відповідність сітківки Bristo1-Myers Squibb ВІЛ-інфекція, СНІД, аномальна відповідність сітківки; комбінаційна терапія зидовудин/d4T 45 DMP-450 88297 AVID (Camden, NJ) 46 ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (ненуклеозидный інгібітор зворотної транскриптази) Ефавіренц (DMP 266)(-)6- DuPont Merck хлор-4(S)циклопропілетиніл-4(S)три-фтор-метил-1,4-дигідро2H-3,1-бензоксазин-2-он, СТОКРИН EL10 Elan Corp, PLC (Gainesville, ВІЛ-інфекція GA) Фамцикловір Smith Kline герпес оперізувальний, герпес простий FTC Emory University ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор зворотної транскриптази) GS 840 Gilead ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор зворотної транскриптази) HBY097 Hoechst Marion Roussel ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (ненуклеозидні інгібітори зворотної транскриптази) Гіперицин VIMRx Pharm. ВІЛ-інфекція, СНІД, аномальна відповідність сітківки Рекомбінантний β- Triton Biosciences (Almeda, СНІД, Саркома Капоші, аномальна відповідінтерферон людини CA) ність сітківки Інтерферон альфа-n3 Interferon Sciences аномальна відповідність сітківки, СНІД Індинавір Merck ВІЛ-інфекція, СНІД, аномальна відповідність сітківки, асимптоматичний ВІЛ позитивний, також у комбінації з зидовудин/ddl/ddC ISIS 2922 ISIS Pharmaceuticals CMV ретиніт KNI-272 Nat'l Cancer Institute Хвороби, пов'язані з ВІЛ-інфекцією Ламівудин, 3TC Glaxo Wellcome ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор зворотної транскриптази); також в комбінації із зидовудином Лобукавір Bristo1-Myers Squibb СMV інфекція Нельфінавір Agouron Pharmaceuticals ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) Невірапін Boeheringer Ingleheim ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор ЗТ) Новапрен Novaferon Labs, Inc. (Akron, інгібітор ВІЛ OH) Пептид T Peninsula Labs (Belmont, CA) СНІД oктапептидна послідовність Тринатрій Фосфоноформіат Astra Pharm. CMV ретиніт, ВІЛ-інфекція, інші CMV інфекції Products, Inc. PNU-140690 Pharmacia Upjohn ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) Пробукол Vyrex ВІЛ-інфекція, СНІД RBC-CD4 Sheffield Med. Tech (Houston, ВІЛ-інфекція, СНІД, аномальна відповідність TX) сітківки Ритонавір Abbot ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) Саквінавір Hoffinann-LaRoche ВІЛ-інфекція, СНІД, аномальна відповідність сітківки (інгібітор протеази) Ставудин; d4T Дидегідроде- Bristo1-Myers Squibb ВІЛ-інфекція, СНІД, аномальна відповідність зокси-тимідин сітківки Валацикловір Glaxo Wellcome Генітальні HSV & CMV інфекції Віразол Viratek/ICN (Costa Mesa, CA) асимптоматичний ВІЛ позитивний, LAS, аноРибавірин мальна відповідність сітківки VX-478 Vertex ВІЛ-інфекція, СНІД, аномальна відповідність сітківки Зальцитабін Hoffmann-LaRoche ВІЛ-інфекція, СНІД, аномальна відповідність сітківки, в комбінації із зидовудином Зидовудин; AZT Glaxo Wellcome ВІЛ-інфекція, СНІД, аномальна відповідність сітківки, Саркома Капоші, в комбінації іншими видами терапії 47 88297 Тенофовір дизопроксил, сіль Gilead фумарової кислоти (Vireadâ) Gilead Емтріцитабін (Emtrivaâ) Комбівір® GSK Абакавіру сукцинат (або Ziagenâ) Reyataz® (або атазанавір) Fuseon® (або Т-20) Lexiva® (або фосампренавір кальцію) GSK Bristol-Myers Squibb Roche/Trimeris GSK/Vertex 48 ВІЛ-інфекція, криптази) ВІЛ-інфекція, криптази) ВІЛ-інфекція, криптази) ВІЛ-інфекція, криптази) ВІЛ-інфекція, ВІЛ-інфекція, ВІЛ-інфекція, СНІД (інгібітор зворотної трансСНІД (інгібітор зворотної трансСНІД (інгібітор зворотної трансСНІД, (інгібітор зворотної трансСНІД, інгібітор протеази СНІД, вірусний інгібітор злиття СНІД, вірусний інгібітор протеази ІМУНОМОДУЛЯТОРИ Виробник Показання до застосування Wyeth-Ayerst СНІД Pharmacia Upjohn Розвинений СНІД Carrington Labs, Inc. (Irving, СНІД, аномальна відповідність сітківки TX) CL246,738 American Cyanamid Lederle СНІД, Саркома Капоші Labs EL10 Elan Corp, PLC (Gainesville, ВІЛ-інфекція GA) FP-21399 Fuki ImmunoPharni Блокують злиття вірусу ВІЛ з CD4+ клітинами Гама Інтерферон Genentech ARC, в комбінації з w/TNF (фактор некрозу пухлини) Гранулоцитна макрофагова Genetics Institute Sandoz СНІД колонія стимулюючого фактора Гранулоцитна макрофагова Hoechst-Roussel Immunex СНІД колонія стимулюючого фактора Гранулоцитна макрофагова Schering-Plough СНІД, в комбінації з w/зидовудин колонія стимулюючого фактора ВІЛ основна частина імуно- Rorer Серопозитивна ВІЛ-інфекція стимулятора IL-2 Інтерлейкін-2 Cetus СНІД, в комбінації з w/зидовудин IL-2 Hoffman-LaRoche Immunex СНІД, ARC/ВІЛ, в комбінації з w/зидовудин Інтерлейкін-2 IL-2 Інтерлейкін-2 (альдеслу- Chiron СНІД, збільшення CD4 в клітинному відліку кін) Імуноглобулін внутрішньо- Cutter Biological (Berkeley, Педіатрія СНІДу, в комбінації з w/зидовудин венний (людини) CA) IMREG-I Imreg (New Orleans, LA) СНІД, Саркома Капоші, аномальна відповідність сітківки, PGL IMREG-2 Imreg (New Orleans, LA) СНІД, Саркома Капоші, аномальна відповідність сітківки, PGL Імутіолдіетил-дитіокарбамат Merieux Institute СНІД; аномальна відповідність сітківки Альфа-2 Інтерферон Sobering Plough Саркома Капоші, w/зидовудин, СНІД МетіонінTNI Pharmaceutical (Chicago, СНІД, аномальна відповідність сітківки енкефалін IL) MTP-PE Міраміл-Трипептид Ciba-Geigy Corp. Саркома Капоші Гранулоцитна колонія Аmgen СНІД, в комбінації з w/зидовудин стимулюючого фактора Ремун Immune Response Corp. Імунотерапія rCD4 Рекомбінантний роз- Genentech СНІД, аномальна відповідність сітківки чинний CD4 людини rCD4-IgG СНІД, аномальна відповідність сітківки гібриди Рекомбінантний розчинний Biogen СНІД, аномальна відповідність сітківки CD4 людини Лікарський препарат AS-101 Бропіримін Ацеманнан 49 88297 Інтерферон Альфа 2a Hofmann-La Roche SK&F106528 Розчинний T4 Тимопентин Smith Kline Фактор TNF некрозу 50 Саркома Капоші СНІД, аномальна відповідність сітківки, у комбінації з w/зидовудин ВІЛ-інфекція Immunobiology Research ВІЛ-інфекція Institute (Annandale, NJ) пухлини; Genentech ARC, у комбінації з w/гама інтерфероном Лікарський препарат Кліндаміцин з примаксином Флуконазол Ністатинова пастилка Орнідил Ефлорнітин Пентамідин Ізетіонат (IM & IV] Триметоприн Триметоприн /сульфа Піритрексим Пентамідин ізетіонат для інгаляції Спіраміцин Інтраконазол-R51211 Триметрексат Даунорубіцин Рекомбінантний еритропоетин людини Рекомбінантний гормон людини Ацетат Мегестролу Тестостерон Загальне ентеральне живлення ПРОТИІНФЕКЦІЙНІ Виробник Показання до застосування Pharmacia Upjohn Пневмоцистозна пневмонія Pfizer Криптококовий менінгит, кандидоз Squibb Corp. Попередження орального кандидозу Merrell Dow Пневмоцистозна пневмонія LyphoMed ) (Rosemont, IL) Лікування пневмоцистозної пневмонії Burroughs Wellcome Fisons Corporирования Антибактеріальний Антибактеріальний Лікування пневмоцистозної пневмонії Профілактика пневмоцистозної пневмонії Rhone-Poulenc diarrhea Janssen-Pharm. Warner-Lambert NeXstar, Sequus Ortho Pharm. Corp. Serono Bristol-Myers Squibb Alza, Smith Kline Norwich Pharmaceuticals Крім того, сполуки винаходу можуть тут бути використані у поєднанні з іншим класом засобів для лікування СНІДу, які називаються інгібіторами проникнення ВІЛ-вірусу. Приклади таких інгібіторів проникнення ВІЛ, обговорюються в DRUGS OF THE FUTURE 1999,24(12), pp.1355-1362; CELL, Vol.9, pp.243-246, Oct.29, 1999; and DRUG DISCOVERY TODAY, Vol.5, No.5, May 2000, pp.183-194 and Inhibitors of the entry of HIV into host cells. Meanwell, Nicholas Α.; Kadow, John F. Current Opinion in Drug Discovery & Development (2003), 6(4), 451-461. Особливо ефективно ці сполуки можуть бути використані в комбінації з іншими інгібіторами адгезії, інгібіторами злиття і антагоністами хемокінових рецепторів, призначених для CCR5 або CXCR4 корецептора. Слід мати на увазі, що набір комбінацій сполук за даним винаходом із противірусними препаратами проти СНІДу, імуномодуляторами, протиінфекційними препаратами, ВІЛ-вхідними інгібіторами або вакцинами, не обмежується переліком, наведеним у вищезазначеній таблиці. Він може включати в принципі будь-яку комбінацію з будьякою фармацевтичною композицією, яка використовується для лікування СНІДу. Більш прийнятними є комбінації для одночасного або альтернативного лікування, що включають сполуки за даним винаходом та інгібітори ВІЛ Криптоспоридіоз Гістоплазмоз; Криптококовий менінгит Пневмоцистозна пневмонія Саркома Капоші Серйозна анемія, пов'язана з лікуванням зидовудином Виснаження, пов'язане зі СНІДом, кахексія Лікування анорексії, пов'язаної з W/СНІДом Виснаження, пов'язане зі СНІД-ом Eaton Діарея і малабсорбція, пов'язані зі СНІДом протеази і/або ненуклеозидний інгібітор зворотної транскриптази ВІЛ. Необов'язковим четвертим компонентом у комбінації може бути нукпеозидний інгібітор зворотної транскриптази ВІЛ, такий як AZT, ЗТС, ddC або ddl. Кращим інгібітором ВІЛпротеази є Reyataz® (активний інгредієнт атазанавір). Як правило, щодня вводиться доза від 300 до 600 мг. Одночасно з цим препаратом можуть вводитись низькі дози ритонавіру (від 50 до 500 мг). Іншим кращим інгібітором ВІЛ-протеази є Kaletra®. Більш прийнятним інгібітором ВІЛ-протеази є індинавір, що являє собою сульфатну сіль N-(2(R)гiдpoкcи-1-(S)-індалін)-2(R)-фeнiлмeтил-4-(S)гiдpoкcи-5-(1-(4-(3-пipидил-мeтил)-2(S)-Nl-(тpeтбyтилкapбoкcaмiдo)-піперазиніл))-пентанамід етаноляту, який синтезують відповідно до U.S. 5,413,999. Індинавір, як правило, вводять у вигляді дози 800мг тричі на день. Іншими кращими інгібіторами протеази є нельфінавір і ритонавір. Інший інгібітор ВІЛ-протеази, якому надають перевагу, це саквінавір, який вводять в дозі 600 або 1200мг на день. І, врешті решт, новий інгібітор протеази, BMS-232632, який наразі проходить клінічні випробування, може стати найкращим інгібітором. До кращих ненуклеозидних інгібіторів зворотної транскриптази ВІЛ включають ефавіренц. Отримання ddC, ddl і AZT також описано в ЕР 0,484,071. Зазначені комбінації можуть виявляти 51 неочікуваний вплив на скорочення поширення і ступеня інфікування вірусом ВІЛ. Бажано надати перевагу таким комбінаціям, як (1) індинавір з ефавіренц і, необов'язково, AZT і/або ЗТС і/або ddl і/або ddC; (2) індинавір і будь-який з AZT і/або ddl і/або ddC і/або ЗТС, зокрема, індинавір і AZT, a такожЗТС; (3) ставудин і ЗТС і/або зидовудин; (4) зидовудин і ламівудин, і 141W94 і 1592U89; (5) зидовудин і ламівудин. В таких комбінаціях сполука за даним винаходом та інші активні агенти можуть бути введені окремо або всі разом. Крім того, введення одного елемента може бути здійснено до, одночасно або послідовно із застосуванням іншого засобу(ів). Скорочення Наступні скорочення, більшість з яких є традиційними, добре відомі пересічному фахівцю в даній області, використовуються протягом всього опису винаходу і прикладів. Використовують деякі з наступних скорочень: h= r.t.= mol= mmol= g= mg= mL.= TFA= DCE= CH2CL2= ТРАР= THF= DEPBT= DMAP= P-EDC= EDC= DMF= Hunig's Base= МСРВА= azaindole= година(и) кімнатна температура моль(і) мілімоль(і) грам(и) міліграм(и) мілілітр(и) Трифтороцтова кислота 1,2-дихлоретан Дихлорметан Тетрапропіламонію перутенат Тетрагідрофуран 3-(Диетоксифосфорилокси)-1,2,3бензотріазин-4(3Н)-он 4-диметиламінопіридин Нанесений на полімер 1-(3диметиламінопропіл)3-етилкарбодиімід 1-(3-Диметиламінопропіл)-3етилкарбодиімід N,N-Диметилформамід Ν,Ν-Диізопропілетиламін мета-Хлорпербензойна кислота 1Н-Піроло-піридин 88297 52 4-azaindole= 5-azaindole= 6-azaindole= 7-azaindole= 4,6diazaindole= 5,6diazaindo)e= 5,7diazaindole= PMB= DDQ OTf= NMM= PIP-COPh= NaHMDS= EDAC TMS DCM DCE= MeOH= THF= EtOAc= LDA= TMP-Li= DME DIBALH HOBT CBZ= PCC= TRIS= 1Н-піроло[3,2-b]піридин 1Н-Піроло[3,2-с]піридин 1Н-піроло[2,3-с]піридин 1Н-Піроло[2,3-b)]піридин 5Н-Піроло[3,2-d]піримідин 1Н-Піроло[2,3-d]піридазин 7Н-Піроло[2,3-dІ]піримідин 4-Метоксибензил 2,3-дихлор-5,6-диціано-1,4бензохінон Трифторметансульфонокси 4-Метилморфолін 1 -Бензоїлпіперазин Гексаметилдисилазид натрію 1-(3-диметиламінопропіл)-3етилкарбодиімід Триметилсиліл Дихлорметан Дихлоретан Метанол Тетрагідрофуран Етилацетат Диізопропіламід літію 2,2,6,6-тетраметилпіперидиніл літію Диметоксиетан Диізобутилалюмінію гідрид 1-гідроксибензтриазол Бензилоксикарбоніл Хлорхромат піридинію Троетамін або 2-аміно-2(гідроксиметил)пропан-1,3-діол Хімія Даний винахід включає сполуки за Формулою І, їхні фармацевтичні композиції та їх використання щодо пацієнтів, які потерпають чи є сприйнятливими до ВІЛ-інфекції. Схема А у загальних рисах представляє процес для отримання ліків І винаходу з вихідної молекули IV. 53 Сполуки за п.1 Сполуки за Пунктом 1 Ε=водень , або як визначено для отримання фармацевтично прийнятної моно або бісолі Для тощо щоб розробити метод, представлений на Схемі А, антивірусна вихідна сполука, що становить інтерес, IV, перетворюється на фосфатну проміжну сполуку II, шляхом N-алкілування за допомогою хлоридної проміжної сполуки III, у присутності прийнятної основи, такої як гідрид натрію, гідрид калію, амід натрію, t-бутоксид натрію, амід натрію ди(триметилсиліл), амід калію (дитриметилсиліл), або їх комбінації, такої як гідрид натрію плюс ди(триметилсиліл) амід. Приготування реагента III і методологія його використання для приготування проліків шляхом алкілування гідроксильних груп описані в Патенті США 6,362,172В2 (Υ. Ueda et.al.), який включений у повному обсязі у вигляді посилання. Умови алкілування, захисні групи, видалення захисних груп, умови утворення солі загалом можуть бути застосовані до нашої заявки, незважаючи на той факт, що ми алкілуємо азаіндол для того щоб отримати індольне кільце, а не гідроксильну групу. В цій заявці, може бути використано від 1.1 до 5.0 еквівалентів основи, але краще використовувати від 2 до 4 еквівалентів. Може бути використано від 1.1 до 12 еквівалентів реагента III, однак краще використовувати від 5 до 10, залежно від субстрату. Реагент можна додавати одночасно у вигляді однієї порції, або поступово, кількома порціями протягом певного проміжку часу. Як правило, до реакційної суміші додають джерело йодидіону, для того щоб збільшити вихід сполуки. Наразі надається перевага елементарному йоду як джерелу йодиду. Від 0.1 до 1.5 еквівалентів йоду, як правило, додається на азаіндол/індол NH, який алкілується; найкраще використовувати від 1.0 до 1.2 еквівалентів йоду, оскільки вихід у цьому випадку є найвищим. Альтернативні джерела йодиду включають, наприклад, йодид натрію, йодид літію, йодид цезію, йодид міді або тетрабутилйодид амонію. Функція йоду, очевидно, полягає в тому, щоб генерувати відповідний йодметиловий реагент Illa in situ з хлорметиловим реагентом III. Йод- або бромзаміщені реагенти відповідно до III, очевидно, можуть 88297 54 E= водень, або як визначено для отримання фармацевтично прийнятної моно- або бісолі бути використані безпосередньо в реакції замість хлориду III. Реакція алкілування на стадії А, як правило, виконується в інертному органічному розчиннику, такому як тетрагідрофуран при температурі від, приблизно, 0°С до 50°С, краще - у проміжку від 20° до 40°С. Інші зневоднені органічні розчинники, такі як метил тетрагідрофуран, метил t-бутиловий етер, діоксан, етиленгліколь диметиловий етер, диметил ацетамід, або Ν,Νдиметилформамід можуть також знайти застосування. Естерна проміжна сполука II після цього підлягає проходженню через традиційну стадію зняття захисної групи, для того щоб видалити захисні групи Рr. Реагенти, які використовуються на цій стадії, залежать від типу захисної групи, що використовується, однак вони загальновідомі будь-якому фахівцю з досвідом роботи у цій галузі. Найкращою захисною групою, якій слід надати перевагу, є t-бутилова група, яку можна видалити за допомогою трифтороцтової кислоти, соляної кислоти або мурашиної кислоти у прийнятному інертному органічному розчиннику. Як інертний розчинник може бути використаний дихлорметан, або, можливо, наприклад, дихлоретан, толуол або трифторметилбензол. В метиленхлориді, видалення захисної групи за допомогою трифтороцтової кислоти можна здійснити, використовуючи від 1 до 15 еквівалентів кислоти (або вміст кислоти може бути визначений іншим способом, наприклад, як 5%-вий розчин у розчиннику від об'єму) при температурі у проміжку від 0° до 40°. Загалом, чим більший надлишок TFA використовується, тим нижчою повинна бути температура. Точні умови варіюють залежно від типу субстрату. Стадія 3 описує виділення вільної кислоти або солі, які можуть утворюватись за допомогою багатьох традиційних шляхів, що є загальновідомими в галузі. Як правило, після видалення захисної групи за допомогою трифтороцтової кислоти, використовується водна суміш, в якій надлишок кислоти нейтралізується за допомогою основи, а органічні домішки видаляються за допомогою екстрагування органічним розчинником, таким як етилацетат або дихлорметан. Наприклад, водний розчин NaOH може бути використаний у надлишку для підлуження 55 реакційної суміші. Це є загальновідомим будьякому хіміку з досвідом роботи у галузі. Підкислення водної фази до рН 2.5 за допомогою водного розчину 1N НСІ, а потім екстрагування за допомогою органічного розчинника, після видалення розчинника у вакуумі, дасть вільну кислоту. Вільна кислота може бути перетворена в неорганічні солі шляхом додавання прийнятних основ у розчинниках, таких як вода, метанол, етанол тощо. Наприклад, додавання карбонату натрію до водного розчину фосфатних проліків і доведення рН до, приблизно, 7.6, дає розчин, який після видалення води шляхом ліофілізації залишається у вигляді динатрієвої солі проліків. Карбонат калію також може бути використаний аналогічним чином. Водні розчини дикарбонату натрію або дикарбонату калію можуть бути використані аналогічним чином. Монокалієві або мононатрієві солі можуть утворюватись шляхом ретельного титрування розчинів фосфорної кислоти з використанням 2-етил гексанату калію або натрію. Амінні солі можуть бути отримані шляхом розчинення вільної кислоти в органічних розчинниках, таких як етилацетат або ацетонітрил чи низькомолекулярних спиртах або сумішах цих розчинників, які необов'язково мають містити воду. Деякі аміни, що можуть потенційно бути використані для утворення солей, включають: нижчі алкіламіни (метиламін, етиламін, цикпогексиламін тощо) або заміщені нижчі алкіламіни (тобто, гідроксизаміщені алкіламіни, такі як диетаноламін, триетаноламін або трис(гідроксиметил)амінометан), лізин, аргінін, гістидин, Nметилглюкамін, або основи, такі як піперидин або морфолін. Повільне додавання аміну до розчину, що перемішується, при низькій температурі може дати моно-або дисолі аміну, залежно від стехіометрії. Амінні солі можуть також бути отримані за допомогою перемішування розчину і видалення розчинника у вакуумі, а не кристалізації чи преципітації. Вибір методики рекристалізації залежить від типу сполуки і солі, однак ці методики доступні кожному досвідченому фахівцеві в цій галузі. На схемі В зображена оптимальна послідовність і набір реагентів та умов для проведення загальної послідовності, представленої на Схемі А. Може бути використаний альтернативний, і у багатьох відношеннях оптимальний, спосіб виконання цієї послідовності на етапі С, який включає зняття захисної диестерної групи, для того щоб забезпечити отримання проміжної кислоти in situ з подальшим утворенням солі у реакційній суміші. Наприклад, нагрівання диестеру II в суміші води і співрозчинника, який здатний змішуватись з водою, наприклад, такого як ацетон, метанол, етанол або ізопропанол, може дати вільну кислоту І в реакційній суміші (in situ). Оптимальними розчинниками є ацетон і ізопропанол. Можуть бути використані температури у проміжку - від температури оточуючого середовища до точок кипіння розчинників. Як правило, оптимальними є температури у проміжку від 40° до 60°С. Додавання основи або, краще, аміну, як описано вище, до реакційної суміші, що містить вільну кислоту, у воді і співрозчиннику, може безпосередьо призвести до утворення солі. При виборі відповідних умов сіль може 88297 56 кристалізуватись або випадати в осад безпосередньо з реакційної суміші, після чого її можна виділити фільтруванням і висушуванням. Конкретні приклади включено до експериментального розділу. Кращий спосіб для отримання проміжних сполук IIа, lIb, і IIc і кислот lac, Ibc і Іс забезпечує цілу низку істотних переваг у порівнянні з методиками, що використовувались раніше для отримання lla, llb, і llc в ході науково-дослідних робіт. На початкових етапах розробки, способи отримання всіх трьох проміжних сполук II було основано на отриманні ди-третбутилового хлорметилфосфату, що потребувало використання відносно дорогого тетрабутиламонієвого дитретбутилфосфату, який реагував з 10-кратним надлишком дорогого і потенційно небезпечного хлорйодметану. Надлишок летких речовин і йодметану видаляли у вакуумі, що призводило до утворення сирого продукту, який був використаний без подальшого очищення. Щонайменше 5-кратний надлишок цього реагента використовується для реакції зі сполукою IV, що означає, що, принаймні, 5 еквівалентів тетрабутиламонію фосфату і 50 еквівалентів хлорйодметану були використані у порівнянні з кількостями IVa, b або с. Крім того, алкілування сполуки IV за допомогою цього реагента було здійснено з використанням NaH як основи і йоду як добавки, що забезпечує алкілування. Ці умови призводять до утворення реакційної суміші, що містить бажану сполуку II як головний продукт і побічні продукти реакції, які були видалені за допомогою хроматографії на силікагелі, що потребує значного часу, і коштів на проведення процесів, особливо на реакції у зростаючих масштабах. Неспроможність видалити побічні продукти призводило до утворення продуктів І з наступної стадії, видалення захисних груп, що містили домішки, які було дуже важко видалити належним чином при прийнятному виході речовини чи у розумних часових рамках. Оптимізовані методики отримання дитретбутил хлорметил фосфату передбачають використання дешевшого дитретбутил фосфату калію і лише, приблизно, 2-кратного надлишку цього реагента у порівнянні з іншим реагентом хлорметил сульфоніл хлоридом. Дитретбутил хлорметил фосфат, отриманий за допомогою цього методу, виділяється у чистому вигляді шляхом прийнятного способу дистиляції. Для перетворення IVa до llа, лише 1.2 еквівалента цього реагента використовується для алкілування сполук IV. Крім того, менш реакційна і економічніша основа, карбонат калію, була використана разом з DMSO, для того щоб здійснити алкілування, завдяки якому сполуки II, що утворюються, є достатньо вільними від побічних продуктів реакції, для того щоб їх можна було використовувати без хроматографічного очищення як вхідну для реакції депротектування. Вільна кислота Іас або солі, такі як, наприклад, lab, можуть бути отримані у чистому вигляді з На, отриманого у такий спосіб без хроматографічного очищення. Для синтезу сполуки llb і llc, які реагують повільніше, ніж IVa, від 2 до 2.5 еквівалентів дитретбутил хлорметилового фосфату було викори 57 стано і модифіковано умови (карбонат цезію як основа з КІ в розчиннику, NMP) були використані для алкілування IVb і IVc, що забезпечило високий рівень перетворення до lib і Не, відповідно. Крім того, нові умови забезпечили отримання сполук II достатнього ступеня чистоти, що дозволило використати їх для отримання сполуки І; при цьому не було потреби у хроматографічному очищенні. Таким чином, нові умови зменшують кількості і стехіометричні особливості реагентів, потрібних для отримання сполуки І цього винаходу і уникнути необхідності хроматографічного очищення проміжних сполук II. Вихідні матеріали, використані для отримання дитретбутил хлорметил фосфату, є більш економічними і безпечнішими, а кінцевий продукт, який отримують, має вищий ступінь чистоти. Врешті решт, умови, розроблені для алкілування IVa, IVb, і IVc виключають потребу у використанні реакційної, займистої основи гідриду натрію, який використовується у надлишку, а роблять можливим використання карбонату калію або карбонату цезію. На стадії алкілування, може бути використана прийнятна основа, така як М2СО3 (М - це літій, натрій, калій, рубідій або цезій). Для перетворення IVa до llа, краще використовувати K2СО3 (1-5 молярних еквівалентів, краще - 2 молярних еквіваленти намоль IVa). Для перетворення IVb до llb або IVc до llс, слід надати перевагу карбонату цезію. Крім того, потрібний прийнятний розчинник, такий як диметилсульфоксид, Nдиметилформамід, ацетон, ацетонітрил, Nметилпіролідинон, формамід, тетрагідрофуран, тощо (2-50мл/грам IV, краще, 5мл/грам); диметилсульфоксид є кращим при перетворенні IVa до llа; N-метилпіролідинон - при перетворенні IVb до llb або IVc до llc. Прийнятний розчинник йоду включає, але не обмежений цими реагентами, МІ (М є, наприклад, літій, натрій, калій, йод, тетрабутиламоній тощо); краще надати перевагу йодиду калію (0.1-5 молярних еквівалентів/моль сполуки IV; переважно, використовують 2 еквіваленти). Алкілувальний засіб, дитретбутил хлорметил фосфат, може бути використаний у кількості 1-Ю молярних еквівалентів намоль IV; однак, слід мати на увазі, що краще використовувати 1.2 молярного еквіваленту. Температура реакції може становити 10-60°С (30°С є кращою). На стадії видалення захисної групи, якщо дві трет-бутилові групи видаляються з На, для того щоб отримати Іас, це проводять у присутності прийнятного розчинника, такого як дихлорметан (кращий), дихлоретан, хлороформ, карбонтетрахлорид, толуол, бензол тощо (2-50мл/грам IV, краще 10мл/грам) Для депротектування llb і llc, що дає Іbс і Іс, відповідно, реакція проводиться у суміші ацетон/вода при температурі близько 40°С. Крім того, протягом депротектування На, краще використовувати кислоту у наявності, таку як трифтороцтова кислота (бажано), соляна, сірчана, азотна тощо (2-100 молярних еквівалентів, ґрун 88297 58 туючись на IVa, причому, краще використовувати 15 молярних еквівалентів. Хімія Загальні положення: Опис методик приготування вихідних матеріалів та попередників міститься в Wang et al., Патент США 6,476,034, виданий 5 листопада, 2002, який включений тут як посилання у повному обсязі. Всі дані рідинної хроматографії (РХ) були зареєстровані на рідинному хроматографі Shimadzu LC-10AS з використанням SPD-10AV UV-Vis масдетектора, з використанням масспектрометричних (МС) даних, отриманих за допомогою Micromass Platform для РХ в режимі хімічної іонізації. Метод РХ/МС (тобто, ідентифікація сполуки) Колонка A: Колонка В: Колонка С: Колонка D: Колонка Е: Колонка F: Колонка G: Колонка Н: Колонка I: Колонка J: Колонка K: Колонка L: Колонка М: YMC ODS-A S7 3.0´50мм колонка PHX-LUNA C18 4.6´30мм колонка XTEKRA ms C18 4.6´30мм колонка YMC ODS-A CIS 4.6´30мм колонка YMC ODS-A CIS 4.6´33мм колонка YMC C18 S5 4.6´50мм колонка XTERRA C18 S7 3.0´50мм колонка YMC C18 S5 4.6´33мм колонка YMC ODS-A C18 S7 3.0´50мм колонка XTERRA C-18 S5 4.6´50мм колонка YMC ODS-A C18 4.6´33мм колонка Xterra MS C18 5uM 4.6´30мм колонка YMC ODS-A C18 S3 4.6´33мм колонка Стандартні умови проточної РХ (використовуються, якщо не обумовлено щось інше): Градієнт: 100% Розчинник А/0% Розчинник В до 0% Розчинник А/100% Розчинник В: Розчинник А=10% МеОН - 90% Н2О - 0.1% TFA, Розчинник В=90% МеОН -10% Н2О 0.1%TFA; I Rt y xв. Градієнт часу: 2 хвилини Час утримування: 1 хвилина Швидкість струменя: 5мл/хв. Довжина хвилі детектування: 220нм Розчинник А: 10% МеОН/90% Н2О 70.1% трифтороцтова кислота Розчинник В: 10% Н2О/90% МеОН/0.1% трифтороцтова кислота Альтернативні умови проточної РХ В: Градієнт: 100% Розчинник А/0% Розчинник В до 0% Розчинник А/100% Розчинник В Розчинник А=10% МеОН - 90% Н2О - 0.1% TFA, Розчинник В=90% МеОН - 10% Н2O - 0.1% TFA; і Rt ухв. Градієнт часу: 4 хвилини Час утримування: 1 хвилина Швидкість струменя: 4мл/хв. Довжина хвилі детектування: 220нм Розчинник А: 10% МеОН/90% Н2О/0.1% трифтороцтова кислота Розчинник В: 10% Н2О/90% МеОН/0.1% трифтороцтова кислота 59 Сполуки, очищені за допомогою препаративної HPLC (високоефективної рідинної хроматографії ВЕРХ) були розведені в МеОН (1.2мл) і очищені за допомогою наступних методів на Shimadzu LC10A, автоматизованої препаративної HPLC системи або на Shimadzu LC-8A автоматизованої препаративної HPLC системи з довжиною хвилі детектування (SPD-10AV UV-VIS) і системою розчинників (А і В), що зазначені вище. Метод препаративної HPLC (тобто, очищення сполуки) Метод очищення: Початковий градієнт (40% В, 60% А) піднімається до кінцевого градієнта (100% В, 0% А) протягом 20 хвилин, утримується протягом 3 хвилин (100% В, 0% А) Розчинник А: 10% МеОН/90% Н2О/0.1% трифтороцтова кислота Розчинник В: 10% Н2О/90% МеОН/0.1% трифтороцтова кислота Колонка: YMC C18 S5 20´100мм колонка Довжина хвилі детектування:20нм Для експериментальних методик, що наведені нижче, були використані наступні умови для HPLCаналізу або модифікації стандартних методик: Умови HPLC-аналізу для РХ загальноприйнятої чистоти : Детектування при 254нм; Градієнт 0-100% В/А; А10% CH3CN - 90% H2O - 0.1% TFA, В 90% CH3CN - 10% H2O - 0.1% TFA; Градієнт часу 4хв.; Колонка YMC ODS-AQ або ORD-A 4.6´50мм 3 мікрон. Умови проведення HPLC для РХ/МС- аналізу: Колонка J: XTERRA С-18 S5 4.6´50мм колонка, Градієнт: 100% Розчинник А/0% Розчинник В до 0% Розчинник А/100% Розчинник В Розчинник А - 10% МеОН - 90% Н2О - 0.1% TFA, Розчинник В=90% МеОН - 10% Н2О - 0.1% TFA; і Rt ухв.; Градієнт часу: 3 хвилини; Швидкість струменя: 4мл/хв.; довжина хвилі детектування: 220нм Вихідні матеріали можуть бути придбані з комерційних джерел або приготовлені за допомогою методик, наведених в літературі. Приготування вихідної сполуки IV: Приготування вихідної Сполуки IV було описано раніше в наступних посиланнях, кожне з яких включено у цьому описі у повному обсязі: Патент США 6,469,006 виданий 22 жовтня 2002 W. S. Blair et al; Патент США 6,476,034, виданий 5 листопада, 2002 Wang et al; Патент США 6,573,262, виданий 3 червня, 2003 Meanwell et al; Заявка на Патент США, серійний номер 10/630,278 подана 30 липня, 2003, J. Kadow et al; яка є частковим продовженням Заявки на Патент США, серійний номер 10/214,982, поданої 7 серпня, 2002, яка є частковим продовженням Заявки на Патент США, серійний номер 10/038,306 поданої 2 січня, 2002, що відповідає РСТ WO 02/062423, поданій 2,2002, січня, опубліковані 15 серпня, 2002; Заявка на Патент США, серійний номер 10/871,931 подана 18 червня, 2004 Yeung et al; Заявка на Патент США, серійний номер 10/762,108, подана 21 січня, 2004 Wang et al, відповідає РСТ WO 2004/043337, опублікованому 27 травня, 2004. 88297 60 Обрані детальні методики наводяться нижче: Типова методика для приготування проміжних сполук для отримання вихідної сполуки IV 1) Приготування Азаіндолу 1 Приготування азаіндолу, Метод А: Приготування 7-хлор-6-азаіндолу 1е: 2-хлор-3нітропіридин 22е (5.0г) розчинили в сухому тетрагідрофурані (ТГФ) (200мл). Після того як розчин охолодили до -78°С, до нього додали надлишок вінілмагнійброміду (1.0Μ в ТГФ, 100мл). Реакційну суміш залишили при температурі -20°С на 8 годин, після чого її погасили 20%-ним NH4CI (150мл). Водну фазу екстрагували за допомогою етилацетату (3´150мл). Об'єднаний органічний шар висушили над MgSO4. Після фільтрування та випарювання неочищений продукт очистили за допомогою хроматографії на силікагелі, що дало 1.5г 7-хлор-6-азаіндол 1е, вихід якого становив 31%. Сполуки 5an, IVa і 5ap описані нижче. Сполуку 1am, 4-бром-7-хлор-6-азаіндол (тверда жовта речовина) отримали за допомогою того ж методу, який було використано для отримання азаіндолу 1е, однак вихідною речовиною, що була використана, був 5-бром-2-хлор-3-нітропіридин (придбаний у Aldrich, Co.). MC m/z: (M+H)+ вирахувано для С7Н5ВrСIN2: 230.93; виявлено 231.15. час утримування ВЕРХ: 1.62 хвилини (колонка В). Сполука 1an (4-метокси-7-хлор-6-азаіндол) і сполука 1ао (4,7-диметокси-6-азаіндол): суміш 4бром-7-хлор-6-азаіндолу (1г), Cul (0.65г) і NaOMe (4мл, 25%) в МеОН (16мл) нагрівали при 110120°С протягом 16 годин в герметично закритій пробірці. Після охолодження до температури навколишнього середовища, реакційну суміш нейтралізували за допомогою 1н НСІ до рН7. Водний розчин екстрагували за допомогою етилацетату (3´30мл). Після цього об'єднаний органічний шар висушували над MgSO4 і випарювали у вакуумі до отримання залишку, який очистили за допомогою хроматографії на силікагелі (50г), використовуючи як елюент 1:7 етилацетат:гексан. (Розміри колонки: 20мм´30см), що дало 0.3г 4-метокси-7-хлор-6азаіндолу (біла тверда речовина) і 0.1г 4,7диметокси-6-азаіндолу (біла тверда речовина).
ДивитисяДодаткова інформація
Назва патенту англійськоюProdrugs of piperazine and substituted piperidine antiviral agents
Автори англійськоюUeda Yasutsugu, Connolly Timothy P., Kadow John F., Meanwell Nicholas A., Wang Tao, Chen Chung-Pin H., Yeung Kap-Sun, Zhang Zhongxing, Leahy David Kenneth, Pack Shawn K., Soundararajan Nachimuthu, Sirard Pierre, Levesque Kathia, Thoraval Dominique
Назва патенту російськоюПиперазиновые пролекарства и замещенные пиперидиновые антивирусные средства
Автори російськоюУэда Ясутсугу, Коннолли Тимоти П., Кадоу Джон Ф., Минвелл Николас А., Ванг Тао, Чен Чунг-Пин Х., Юнг Кап-Сун, Жанг Жонксинг, Лихи Девид Кеннет, Пек Шон К., Саундарараджан Начимуту, Сирар Пьер, Левеск Катя, Тораваль Доминик
МПК / Мітки
МПК: C07F 9/09, C07D 471/04, A61P 31/18, A61K 31/437
Мітки: заміщені, проліки, піперидинові, піперазинові, антивірусні, засоби
Код посилання
<a href="https://ua.patents.su/112-88297-piperazinovi-proliki-i-zamishheni-piperidinovi-antivirusni-zasobi.html" target="_blank" rel="follow" title="База патентів України">Піперазинові проліки і заміщені піперидинові антивірусні засоби</a>
Попередній патент: Бемітний порошковий матеріал і спосіб його одержання
Наступний патент: Пінцет, спосіб його застосування та хірургічна система
Випадковий патент: Спосіб пакування спідньої білизни в пакети