Новий гідросульфат
Номер патенту: 93531
Опубліковано: 25.02.2011
Автори: Робертс Роналд Джон, Первез Моаммед, Чуан Цзун-Сюнь, Форд Джеймз Ґер, Дематтей Джон, Сторі Річард Ентоні, Сквайр Крістофер Джон, Дікінсон Пол Алфред, Шарма-Сінґ Ґорхн
Формула / Реферат
1. Гідросульфат сполуки 1.
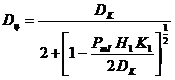
Сполука 1
2. Гідросульфат сполуки 1 за п. 1 у безводній формі.
3. Гідросульфат сполуки 1 за п. 1 у формі сольвату.
4. Гідросульфат сполуки 1 за будь-яким з попередніх пунктів, котрий є кристалічним.
5. Гідросульфат сполуки 1 за п. 4, де вказаний гідросульфат сполуки 1 має рентгенодифрактограму порошку із принаймні одним конкретним піком приблизно при 24,59°.
6. Гідросульфат сполуки 1 за п. 5, де вказаний гідросульфат сполуки 1 має рентгенодифрактограму порошку з конкретними піками приблизно при значеннях 2-тета 24,59°, 20,97°, 23,99°, 27,65°, 12,24°, 23,49°, 24,30°, 17,02°, 25,91° та 22,50°.
7. Гідросульфат сполуки 1 за п. 1, котрий має рентгенодифрактограму порошку, по суті таку ж, як рентгенодифрактограма порошку, показана у Фіг. 1.
8. Гідросульфат сполуки 1 за п. 1 або за п. 2 в аморфній формі.
9. Спосіб отримання гідросульфату сполуки 1 за будь-яким з пп. 1-8, вказаний спосіб полягає у
(і) реагуванні кашки сполуки 1 в органічній рідині з принаймні стехіометричною кількістю сульфатної кислоти та водою;
(іі) виділенні солі з утвореного розчину; та
(ііі) далі, якщо бажано або необхідно, утворенні її сольвату.
10. Спосіб за п. 9, де кількість води, доданої на етапі (і), є обмеженою кількістю, що необхідна для гарантування, щоб утворилася сіль.
11. Спосіб за п. 9 або за п. 10, де етап (і) проводять при температурі 40-80 °С.
12. Спосіб за будь-яким з пп. 9 до 11, де органічною рідиною є С1-6 алкілкетон.
13. Спосіб за будь-яким з пп. 9-12, де гідросульфат збирають на етапі (іі) охолодженням реакційної суміші, необов'язково з додаванням ще органічної рідини так, щоб осів гідросульфат.
14. Гідросульфат сполуки 1 за будь-яким з пп. 1-8 для застосування як медикаменту для лікування станів хвороб, опосередкованих МЕК.
15. Застосування гідросульфату сполуки 1 за будь-яким з пп. 1-8 у виробництві медикаменту для застосування у лікуванні станів хвороб, опосередкованих МЕК.
16. Спосіб лікування станів хвороб, опосередкованих МЕК, у теплокровного ссавця, що потребує такого лікування, який полягає у призначенні вказаному ссавцю ефективної кількості гідросульфату сполуки 1 за будь-яким з пп. 1-8.
Текст
1. Гідросульфат сполуки 1 C2 2 (19) 1 3 93531 4 більш конкретно, нової солі 6-(4-бром-2-хлорідентифіковані у більше, ніж 60% злоякісної мелафеніламіно)-7-флуор-3-метил-3Н-бензоімідазол-5номи (Davies, H., et al., Nature 2002, 417:949-954). карбонової кислоти (2-гідрокси-етокси)-аміду (далі Ці мутації у bRaf призводять до установчо актив"Сполука 1"), котра є інгібітором МЕК, що є корисного каскаду МАР-кінази. Дослідження первинних ним у лікуванні та/або профілактиці проліфератизразків пухлин та ліній клітин також показали уставних хвороб, як-то рак, у ссавців. Більш конкретно, новчі або надактиваційні провідні шляхи МАРзаявлений винахід стосується гідросульфату спокінази у раку підшлункової залози, товстої кишки, луки 1 та способів отримання вказаної солі. Також легень, яєчнику та нирок (Hoshino, R., et al., запропоновані фармацевтичні композиції, що місOncogene 1999, 18:813-822). Звідси, є сильна котять гідросульфат сполуки 1, та застосування солі реляція між типами раку та надактивним провіду виробництві медикаментів для лікування та/або ним шляхом МАР-кінази, що є результатом генепрофілактики проліферативних хвороб, як-то рак, тичних мутацій. у людини або тварини, та способів лікування стаЯк установчий або надактиваційний каскад нів проліферативних хвороб, як-то рак, у ссавців МАР-кінази грає найважливішу роль у проліферазастосуванням терапевтично ефективної кількості ції та диференціації клітин, інгібування цього прогідросульфату сполуки 1. відного шляху, можна думати, є благотворним у Клітинна передача сигналу через рецептори гіперпроліферативних хворобах. MEK є ключовим факторів росту та протеїн-кінази є важливим регугравцем у цьому провідному шляху, оскільки він є лятором росту, проліферації та диференціації клінизхідним стосовно Ras та Raf. На додаток, він є тин. При нормальному рості клітин фактори росту притягальною терапевтичною метою, оскільки вічерез активацію рецепторів (тобто, PDGF або EGF домими субстратами для MEK фосфорилування є та інші), активують провідні шляхи МАР-кіназ. тільки МАР-кінази, ERK1 та 2. Інгібування МЕК, як Один з найважливіших та найкраще зрозумілих показано, має потенційну терапевтичну корисність провідних шляхів МАР-кіназ, що полягає у нормау кількох дослідженнях. Наприклад, низькомолекульному та неконтрольованому рості клітин, є пролярні інгібітори МЕК, як показано, інгібують ріст відний шлях Ras/Raf-кінази. Активна GTP-зв'язана пухлин людини у ксенотрансплантатах голих миRas призводить до активації та небезпосереднього шей, (Sebolt-Leopold et al., Nature-Medicine 1999, фосфорилування Raf-кінази. Raf тоді фосфорилує 5(7):810-816; Trachet et al., AACR April 6-10, 2002, МЕК1 та 2 на два серинові залишки (S218 та S222 Poster #5426; Tecle, H., IBC 2nd International для МЕК1 та S222 та S226 для МЕК2) (Ahn et al., Conference of Protein Kinases, September 9-10, Methods in Enzymology, 2001, 332:417-431). Акти2002), блокують статичну алодинію у тварин (WO вована MEK тоді фосфорилує тільки їй відомі суб01/05390) та інгібують ріст клітин гострої мієлоїдстрати, МАР-кінази ERK1 та 2. Фосфорилування ної лейкемії (MiIeIIa et al., J. Clin. Invest. 2001, 108 ERK за допомогою MEK відбувається на Y204 та (6):851-859). Т202 для ERK1 та Y185 та Т183 для ERK2 (Ahn et Низькомолекулярні інгібітори MEK розкриті. al., Methods in Enzymology 2001, 332:417-431). ФоПринаймні 13 заявок на патент виявлено в останні сфорилована ERK димеризується та тоді перемікілька років: US 5,525,625; WO 98/43960; WO щується до ядра, де накопичується (Khokhlatchev 99/01421; WO 99/01426; WO 00/41505; WO et al., Cell 1998, 93:605-615). У ядрі ERK приймає 00/42002; WO 00/42003; WO 00/41994; WO участь у кількох важливих клітинних функціях, 00/42022; WO 00/42029; WO 00/68201; WO охоплюючи, але без обмеження, ядерний транс01/68619; та WO 02/06213. порт, перетворення сигналу, регенерацію ДНК, Інгібітори MEK є також описаними у WO компонування та транслокацію нуклеосом, та об03/077914. 6-(4-Бром-2-хлор-феніламіно)-7-флуорробку і трансляцію мРНК (Ahn et al., Molecular Cell, 3-метил-3Н-бензоімідазол-5-карбонова кислота (22000, 6:1343-1354). Взагалі, обробка клітин фактогідрокси-етокси)-амід, або "Сполук 1", є показаною рами росту призводить до активації ERK1 та 2, що у WO 03/077914 та має наступну структурну форпризводить до проліферації, а у деяких випадках мулу: диференціації (Lewis et al., Adv. Cancer Res. 1998, 74: 49-139). У проліферативних хворобах генетичні мутації та/або надекспресія рецепторів факторів росту, білків нисхідної передачі сигналу, або протеїнкіназ, що приймають участь у провідному шляху ERK-кіназ, призводять до неконтрольованої проліферації клітин та з часом утворення пухлин. Наприклад, деякі типи раку містять мутації, котрі призводять до безперервної активації цього провідного шляху внаслідок безперервного продуСполука 1 кування факторів росту. Інші мутації можуть призСполука 1, як показано, має інгібіторну активводити до дефектів у дезактивації активованого ність проти МЕК, а тому є корисною у лікуванні GTP-зв'язаного комплексу Ras, знов даючи актигіперпроліферативної хвороби, як-то рак. вацію провідного шляху МАР-кінази. Мутовані онWO 03/077914 розкриває, загалом терміни, когенні форми Ras є виявленими у 50% випадків деякі фармацевтично прийнятні солі сполук розкраку товстої кишки та >90% підшлункової залози, а риті там. Конкретно, у WO 03/077914 встановлено, також багато інші типів раку (Kohl et al., Science, що фармацевтично прийнятні солі сполук, розкриті 1993, 260:1834-1837). В останній час, мутації bRaf 5 93531 6 там, що мають достатньо основну групу, можуть ленти, котрі можуть бути охопленими рамками утворювати кислотно-адитивні солі, що містять заявленого винаходу, які визначено формулою фармацевтично прийнятні аніони, та перераховавинаходу. Спеціалісту відомо багато способів та но ряд таких аніонів. Подібним чином, придатні матеріалів, подібних або еквівалентних описаним солі сполук, що мають кислотну групу, утворюють тут, котрі можна застосовувати у практиці заявлеобробкою сполук основною сполукою та зокрема ного винаходу. Заявлений винахід не обмежує неорганічною основою. описаних способів та матеріалів. Форма фармацевтично активної сполуки, котЗаявлений винахід стосується гідросульфату ру застосовують у медикаментах є тою, що забез(1:1 ліки : H2SO4) сполуки 1 та різних його форм, печує властивості для зручної обробки. Однак, усі які охоплені рамками винаходу. Сіль може бути також необхідно гарантувати, щоб біологічні власу різних формах, усі які охоплені рамками винахотивості кінцевої композиції, як-то швидкість розчиду. Ці форми охоплюють безводні форми, а також нення таблеток та біозасвоюваність активного сольвати. Наступна форма може бути створена інгредієнта, були оптимізованими, та часто потрібдесольватацією сольватів. Зокрема, сіль є безвоні особливі форми, котрі найкраще задовольняють дним гідросульфатом сполуки 1. Крім того, заявусім цим різним вимогам. Однак, у деяких випадлений винахід стосується гідросульфату сполуки ках солі не утворюються легко та/або не є стабіль1, котрий показує унікальні фізичні та фармацевними, що ймовірно є внаслідок низького значення тичні властивості, що роблять його особливо прирКа. Значення рКа виражає силу кислоти та оснодатним для застосування у медикаментах. ви, тобто, тенденцію кислоти до втрати протону У деяких втіленнях солі сполуки 1 є кристалічабо основи до додавання протону (Bronsted J.N., ними. Кристалічні солі виявлені як кращі, ніж вільRec. Trav. Chim. (1923) 47:718). Це особливо стона основа у термінах їх властивостей стосовно сується сполуки 1. вироблення, зокрема їх статичних властивостей та Заявлений винахід стосується гідросульфату властивостей сипучості. Утворення солей можна (1:1 ліки:Н2SO4) сполуки 1 та його різних форм, усі досягти засобами очистки, як способом відділення які охоплені рамками винаходу. Сіль може бути у забруднень, та солі загалом легше виділяти ніж різних формах, усі які охоплені рамками винаходу. вільну основу. Ці форми охоплюють безводні форми, а також В одному втіленні винаходу гідросульфат спосольвати. Наступна форма може бути створеною луки 1 є кристалічною сіллю, котра несподівано десольватацією сольватів. У конкретному втіленні виявила поліпшені фармацевтичні властивості при сіль є у безводній формі. порівнянні з вільною основою сполуки 1 та деякиУ наступному аспекті заявлений винахід стоми іншими солями сполуки 1. Зокрема, швидкість сується способу застосування гідросульфату спорозчинення цієї кристалічної солі, а також її біозалуки 1 як медикаменту для лікування гіперпролісвоюваність виявлені як особливо високі при поріферативної хвороби або стану. внянні з вільною основою та іншими солями, як Додатковим аспектом винаходу є застосуванілюстровано у прикладах далі. Посилена біозасня гідросульфату сполуки 1 у отриманні медикавоюваність гідросульфату сполуки 1 у порівнянні з менту для лікування або відвернення гіперпролівільною основою, як показано, не залежить від феративної хвороби або стану. композиції для застосування. Біозасвоюваність Додаткові переваги та нові особливості цього вільної основи та гідросульфату порівняли тут при винаходу пояснено частково в описі, а частково прийомі у тій же композиції дисперсії, але подібні зрозумілі спеціалістам з вивчення опису або праквідмінності у біозасвоюваності також спостерігали тикою винаходу. Переваг винаходу можна домогдля простих композицій таблеток. тися засобами, комбінаціями, композиціями та Коли встановлено, що заявлений винахід стоспособами, особливо представленими у формулі сується солі сполуки 1, котра є кристалічною сілвинаходу. лю, ступінь кристалічності більше, ніж приблизно Графіки, що наведені тут та утворюють части60%, переважно більше, ніж приблизно 80%, крану опису, ілюструють необмежувальні втілення ще більше, ніж приблизно 90%, а ще краще більцього винаходу, та разом з описом пояснюють ше, ніж приблизно 95%. Найкращим ступенем кривинахід. сталічності є більше, ніж приблизно 98%. У фігурах: Ступінь посиленої біозасвоюваності гідроФіг. 1 показує рентгенодифрактограму порошсульфату є несподіваним та особливо корисним, ку гідросульфату сполуки 1; тому що вільну основу сполуки 1 класифіковано як Фіг. 2 показує інфрачервоний спектр гідроклас 4 BCS сполук. Сполуки класу 4 BCS нормасульфату сполуки 1, отриманої, застосовуючи зально мають низьку біозасвоюваність внаслідок соби відбору зразків DRIFTS; та низької швидкості розчинення та проникності, та Фіг. 3 показує дані концентрації у плазмі спообмеження проникності на поглинання означає, луки 1 після застосування пероральної дисперсії що такі солі, як очікують, звичайно не дають суттєеквіваленту 150 мг вільної основи сполуки 1 (х) та вого впливу на поглинання (Дивись, наприклад,: гідросульфату голодним собакам ( ▲) . Dressman et al. (2001) Pharm Tech. July: 68). Посилання зроблено стосовно деяких втілень Придатні сольвати гідросульфату сполуки 1 винаходу, приклади котрих є ілюстрованими струутворюються з широкого ряду розчинників, зокректурами та формулами. Тоді як винахід описано ма органічних розчинників, як-то тетрагідрофуран втіленнями, слід розуміти, що вони не обмежують (ТГФ), ацетонітрил (АцН), етанол (EtOH) та метавинахід цими втіленнями. На противагу, винахід нол (MeOH). Придатні органічні розчинники охопохоплює усі альтернативи, модифікації, та еквівалюють естери, як-то С1-6 алкіл-естери, наприклад, 7 93531 8 етилацетат, та кетони, як-то C1-6 алкіл-кетони, наможе бути тою ж органічною рідиною, яку застосоприклад, метил-етил-кетон (2-бутанон). вано на етапі (і), або вона може бути відмінною Отримання солі можна здійснити реакцією каорганічною рідиною, за умови, що вона діє як аншки сполуки 1 в органічному розчиннику та воді з тирозчинник для гідросульфату сполуки 1. Затравсульфатною кислотою. Для отримання 1:1 солі ка розчину кристалами гідросульфату сполуки 1 застосовують приблизно 1 еквівалент сульфатної може допомагати у процесі осадження. кислоти. Тому у наступному аспекті, винахід стосуВ одному втіленні перед охолодженням фільтється способу отримання гідросульфат сполуки 1, рат спершу відганяють для видалення води та для вказаний спосіб полягає у: гарантування, що сіль збирають з прийнятним ви(i) реагуванні кашки сполуки 1 в органічній ріходом. У конкретному втіленні розчинником є 2дині та воді з приблизно 1 еквівалентом сульфатбутанон та фільтрат відганяють при атмосферноної кислоти; му тиску. (ii) виділення солі з утвореного розчину; та При охолодженні сіль можна отримувати з (iii) далі, якщо бажано або необхідно, утворенутвореної кашки, наприклад, фільтруванням. Зібня її сольвату. раний матеріал можна тоді сушити, наприклад, Молярне співвідношення кількості сульфатної при підвищеній температурі, наприклад, 40-60 °C, кислоти відносно сполуки 1 є відповідним чином у та як ще один приклад, при приблизно 50 °C, до межах від 1,00:1 до 2:1, наприклад, у межах від постійної маси. Якщо продуктом є сольват з орга1,05:1 до 1,15:1. Застосована сульфатна кислота є нічною рідиною, як-то метанол, його можна десовідповідним чином у формі концентрованої сульльватувати, якщо бажано, нагріванням. фатної кислоти. У конкретному втіленні молярне Фізичні властивості гідросульфату були досліспіввідношення сульфатної кислоти відносно сподженими та є описаними далі у прикладах. луки 1 є 1,10:1,0. Винахід також охоплює мічені ізотопами споВідповідним чином кількість води, доданої на луки, котрі є ідентичними описаним у заявленому етапі (і) є обмеженою, що необхідно для гарантувинаході, але один або більш атомів є заміщеними вання, що утвориться сіль. Точні застосовані кільатомом, що має атомну масу або масове число, кості залежать від конкретної природи розчиннику, відмінні від атомної маси або масового числа, звиконцентрації сульфатної кислоти тощо, але типочайно виявлених у природі. Приклади ізотопів, що во, вода буде у кількості менше, ніж 20 об.% усієї можуть бути уведеними у сполуки винаходу, охопрідини, наприклад, від 13-17 об.%. люють ізотопи гідрогену, карбону, нітрогену, оксиУ конкретному втіленні органічним розчиннигену, фосфору, сульфуру, флуору та хлору, як-то 2 ком, застосованим на етапі (і) є 2-бутанон (метилH, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F та 36 етил-кетон), вода складає приблизно 15% об'єму CI, відповідно. Гідросульфат сполуки 1 та його рідини, та загальна кількість застосованої рідини поліморфи, котрі містять вищезгадані ізотопи відносно сполуки 1 є приблизно 8 мл/г сполуки 1. та/або інші ізотопи інших атомів, охоплені рамками Відповідним чином, додавання сульфатної кицього винаходу. Деякі мічені ізотопами сполуки слоти на етапі (і) проводять контрольовано, назаявленого винаходу, наприклад ті, у котрих раприклад, при температурі нижче 10 °С, та залишдіоактивні ізотопи, як-то 3H та 14C є уведеними, є кову частину етапу (і) тоді проводять при корисними в аналізах ліків та/або розподілу у ткапідвищеній температурі, наприклад, 30-90 °C, як нинах. Тритійовані ізотопи, тобто, 3H та ізотопи приклад, у межах 55-75 °С, та як приклад, при карбону-14, тобто, 14C, є особливо широко застоприблизно 65 °С. сованими як результат легкості їх отримання та Придатні органічні рідини охоплюють органічні визначення. Крім того, заміщення важкими ізоторозчинники, у котрих Сполука 1 та її солі дещо пами, як-то дейтерій, тобто, 2H, може давати деякі розчинні. Як це застосовано тут, вираз "дещо розтерапевтичні переваги, що є результатом більшої чинні" означає мають розчинність менше, ніж 100 метаболічної стабільності, наприклад, збільшеного мл розчиннику на грам розчиненої речовини, наin vivo періоду напівперетворення або зменшених приклад, між 30 та 100 мл розчиннику на грам розвимог стосовно дозування та, звідси, може бути чиненої речовини. Ці розчинники охоплюють алкілзастосовуваним у деяких особливих випадках. кетони, наприклад, C1-6 алкіл-кетони, як-то 2Мічені ізотопами солі заявленого винаходу можна бутанон, спирти, як-то C1-6 спирти, наприклад, мезагалом отримувати способами, розкритими у WO танол або етанол, та естери, як-то C1-6 алкіл03/077914 заміщенням легко доступним міченим естери, наприклад, як етилацетат. В одному втіізотопами реагентом неміченого ізотопами реагенленні, органічним розчинником є метил-етил-кетон ту протягом отримання, або якщо бажано, засто(2-бутанон). совуючи мічену ізотопами сульфатну кислоту при Відповідним чином, реакційну суміш фільтруотриманні солі. ють між етапами (і) та (іі) для видалення будьКомпозиція може бути у формі, придатній для якого чужинного матеріалу. Залишок необов'язкоперорального застосування (наприклад, як таблево промивають, наприклад, сумішшю органічної тки, пілюлі, тверді або м'які капсули, емульсії, дисрідини та води, та бажану сіль кристалізують з перговувані порошки або гранули, сиропи, еліксифільтрату, котрий може необов'язково бути комбіри або олійні чи незаплановано отримані водні нованим з промивним розчином. суспензії), для застосування інгаляціями (наприУ деяких втіленнях гідросульфат збирають на клад, як мілко подрібнений порошок або рідкий етапі (іі) охолодженням реакційної суміші, необоаерозоль), для застосування вдуванням (наприв'язково з додаванням ще органічної рідини, так, клад, як подрібнений порошок), для парентеральщоб гідросульфат осів. Ще одна органічна рідина ної ін'єкції (наприклад, як стерильні розчин, су 9 93531 10 спензія або емульсія для внутрішньовенного, піднку, підшлункової залози, грудної залози, голови, шкірного, внутрішньом'язового, внутрішньосудиншиї, нирок, яєчнику, простати, товстого кишечнику, ного застосування або вливання), для місцевого стравоходу, яєчок, гінекологічний або щитовидної застосування (наприклад, як креми, мазі, гелі, залози. олійні розчини або суспензії або незаплановано Однак, сполуки та композиції винаходу можна отримані водні суспензії), або для ректального також застосовувати у лікуванні незлоякісного гізастосування (наприклад, як супозиторію). В одперпроліферативного розладу, як-то доброякісна ному втіленні, гідросульфат сполуки 1 застосовугіперплазія шкіри (наприклад, псоріаз), рестеноз, ють перорально. Загалом вищенаведені композиабо простати (наприклад, доброякісна гіпертрофія ції можна отримувати звичайними способами, простати (BPH)). застосовуючи звичайні наповнювачі. Інші приклади опосередкованих MEK хвороб, Кількість активної застосовуваної сполуки покотрі можна лікувати, застосовуючи сполуки або винна бути залежною від суб'єкта лікування, сувокомпозиції винаходу, охоплюють панкреатит або рості розладу або стану, частоти застосування, хворобу нирок (охоплюючи проліферативний глодиспозиції сполуки та рішення лікаря. Однак, ефемерулонефрит та індуковану діабетом хворобу ктивне дозування є у межах приблизно 0,01-100 нирок) або лікування болю у ссавців. мг/кг маси тіла на добу, переважно приблизно 1-35 Сполуки та композиції можна також застосовумг/кг на добу, в одиничних або розділених дозах. вати для відвернення імплантації бластоцитів у Для людини масою 70 кг, ця кількість приблизно ссавців, або для лікування хвороб, пов'язаних з 0,7-7000 мг на добу, переважно приблизно 70васкулогенезом або ангіогенезом у ссавців. Такі 2500 мг на добу. У деяких випадках рівні дозуванхвороби можуть охоплювати ангіогенез пухлин, ня нижче нижчого обмеження може бути більше, хронічну запальну хворобу, як-то ревматоїдний ніж адекватним, тоді як в інших випадках ще більартрит, атеросклероз, запальну хворобу кишечниші дози можна застосовувати без спричинення ку, хвороби шкіри, як-то псоріаз, екзема, та склебудь-якої шкідливої побічної дії, за умови, що такі родерма, діабет, діабетичну ретинопатію, ретинобільші дози є спершу розділеними на кілька малих патію передчасно народжених, пов'язану з віком доз для застосування протягом доби. Форма дегенерацію жовтої плями, гемангіоми, гліоми, окремої дози, як-то таблетка або капсула звичайно меланоми, саркому Калоші та рак яєчнику, грудної містить, наприклад, 1-1000 мг активного інгредієнзалози, легень, підшлункової залози, простати, та, а переважно 5-420 мг активного інгредієнта. товстої кишки та епідермоїдний. Переважно застосовують добову дозу у межах Терміни "анормальний ріст клітин" та "гіперп0,03-6 мг/кг. роліферативний розлад" застосовують у цій заявці Згідно з наступним аспектом заявленого винапочергово стосовно росту клітин, що є незалежним ходу запропоновано гідросульфат сполуки 1 для від нормальних регуляторних механізмів (напризастосування у способі лікування або профілактиклад, втрата контакту інгібування). Це охоплює, ки людини або тварини терапією. Наступною осонаприклад, анормальний ріст: (1) пухлин клітин бливістю заявленого винаходу є гідросульфат (пухлини), що проліферуються експресією мутовасполуки 1, який визначено тут, для застосування ної тирозин-кінази або надекспресією рецепторної як медикаменту. У наступному аспекті, заявлений тирозин-кінази; (2) доброякісних та злоякісних клівинахід стосується гідросульфату сполуки, який тин інших проліферативних хвороб, у котрих відвизначено тут, для застосування як медикаменту бувається аберантна активація тирозин-кінази; (3) для лікування станів хвороб, опосередкованих будь-яких пухлин, що проліферуються рецепторМЕК, зокрема проліферативних розладів, або аноними тирозин-кіназами; (4) будь-яких пухлин, що рмального росту клітин, як-то рак, у теплокровного проліферуються аберантною активацією сессавця, як-то людини. Відповідно, наступний асрин/треонін-кіназ; та (5) доброякісних та злоякісних пект винаходу стосується застосування гідроклітин інших проліферативних хвороб, у котрих сульфату сполуки 1, який визначено тут, у виробвідбувається аберантна активація серин/треонінництві медикаменту для застосування у лікуванні кіназ. станів хвороб, опосередкованих МЕК, зокрема Термін "лікування", як це застосовано тут, якпроліферативних розладів, або анормального росщо не вказане інше, означає обернення, полегту клітин, як-то рак, у теплокровного ссавця, як-то шення, стримування прогресування або відверлюдини. нення розладу або стану, до котрого Згідно з наступною особливістю винаходу зазастосовувано такий термін, або одного або більпропоновано спосіб лікування станів хвороб, опоше симптомів такого розладу або стану. Термін середкованих МЕК, зокрема проліферативних ро"лікування" як це застосовано тут, якщо не вказане зладів, або анормального росту клітин, як-то рак, у інше, стосується дії лікування, де "лікування" витеплокровного ссавця, як-то людини, яка потребує значено негайно вище. такого лікування, котрий полягає у призначенні Тому пацієнти, яких можна лікувати сполуками вказаному ссавцю ефективної кількості гідросульабо композиціями заявленого винаходу, охоплюфату сполуки 1, або фармацевтичної композиції, ють, наприклад, пацієнтів, яким поставлено діагяку визначено тут. ноз псоріаз, рестеноз, атеросклероз, BPH, рак леКонкретні приклади проліферативних розлагень, не дрібноклітинний рак легень, рак кісток, дів, котрі можна лікувати, застосовуючи солі або CMML, рак підшлункової залози, рак товстого кикомпозиції винаходу, охоплюють гіперпроліферашечнику, рак шкіри, рак голови та шиї, меланоми тивні розлади у ссавців. Конкретними типами раку (зокрема шкірні або інтраокулярні меланоми), рак є рак мозку, легень, плоскоклітинний, міхуру, шлуматки, яєчнику рак, ректальний рак, рак анального 11 93531 12 регіону, рак шлунку, товстої кишки рак, грудної мід, бікалутамід, та ципротерон ацетат), агоністи залози рак, яєчок, гінекологічні пухлини (наприта антагоністи LHRH (наприклад, госерелін ацетат, клад, матки саркоми, рак фалопієвих труб, рак лейпрорелін, та бусерелін), інгібітори 5-редуктази ендометрію, рак шийки, рак вагіни або рак вульви), (наприклад, фінастерид); рак яєчнику, множинна мієлома, гепатоцелюляр(iv) антіінвазійні засоби (наприклад, інгібітори ний рак, хвороба Ходжкіна, рак стравоходу, рак металопротеїназ типу маримістату та інгібітори тонкого кишечнику, рак ендокринної системи (нафункції рецептору активатору плазміногену урокіприклад, рак щитовидної залози, паращитовидної нази або антитіла до гепаранази; або надниркової залоз), саркоми м'яких тканин, (v) інгібітори функції факторів росту (такі факрак уретри, рак пенісу, рак простати, хронічної або тори росту охоплюють, наприклад, похідний від гострої лейкемії, зокрема гострої мієлоїдної лейтромбоцитів фактор росту та фактор росту гепатокемії твердої пухлини дітей, лімфоцитарної лімцитів), такі інгібітори охоплюють антитіла фактору фоми, рак міхура, рак нирок або уретри (наприросту, антитіла рецепторів фактору росту, (наприклад, нирково-клітинний рак, рак ниркової миски), клад, антитіло анті-erbb2 трастузумаб або неоплазми центральної нервової системи (на[Herceptin™], антитіло анті-EGFR панітумумаб, приклад, первинна лимфома ЦНС, пухлини спинантитіло анті-erbb1 цетуксимаб [С225]), та будь-які ного мозку, гліоми стебла мозку або аденоми). антитіла факторів росту або рецепторів факторів Гідросульфат сполуки 1 можна застосовувати росту, розкриті Stern ef al. Critical reviews in сам по собі або можна додавати до гідросульфату oncology/haematology, 2005, Vol. 54, pp11-29); такі сполуки 1 одну або більше інших речовин та/або інгібітори також охоплюють інгібітори тирозинлікувань. Такого сумісного лікування можна досягкіназ, як-то інгібітори родини ерідермального факти одночасним, послідовним або окремим застотору росту (наприклад, інгібітори родини тирозинсуванням індивідуальних компонентів лікування. В кіназ EGFR, як-то N-(3-хлор-4-флуорфеніл)-7онкології є нормальною практикою застосування метокси-6-(3-морфолінопропокси)-хіназолін-4-амін комбінації відмінних форм лікування для лікування (гефітиніб, AZD1839), N-(3-етинілфеніл)-6,7-біс(2кожного пацієнта з раком. В онкології іншими комметоксіетокси)хіназолін-4-амін (ерлотиніб, OSIпонентами такого сумісного лікування на додаток 774) та 6-акриламідо-N-(3-хлор-4-флуорфеніл)-7до гідросульфату сполуки 1 можуть бути хірургія, (3-морфолінопропокси) хіназолін-4-амін (Cl 1033)) радіотерапія або хіміотерапія. Така хіміотерапія та інгібітори тирозин-кіназ erbb2, як-то лапатиніб, може охоплювати терапевтичні засоби, як-то: інгібітори родини факторів росту гепатоцитів, інгі(i) антіангіогенні засоби, як-то ті, котрі інгібують бітори родини похідних від тромбоцитів факторів дію фактору росту судинного ендотелію, (наприросту, як-то ітатиніб, інгібітори серин/треонін-кіназ клад, антисудинне антитіло фактору росту судин(наприклад, інгібітори передачі сигналів Ras/Raf, ного ендотелію бевацизумаб [Avastin™], та інгібіяк-то інгібітори фарнезил-трансферази, напритори VEGF-рецептору тирозин-кінази, як-то 4-(4клад, сорафеніб (BAY 43-9006)), інгібітори передабром-2-флуораніліно)-6-метокси-7-(1чі сигналів у клітині через кінази MEK та/або АКТ, метилпіперидин-4-ілметокси)хіназолін (ZD6474; інгібітори с-комплекту, інгібітори abl-кінази, інгібіПриклад 2 у WO 01/32651), 4-(4-флуор-2тори кінази рецептору IGF (інсуліно-подібний факметиліндол-5-ілокси)-6-метокси-7-(3-піролідин-1тор росту); інгібітори аврора-кінази (наприклад, ілпропокси)хіназолін (AZD2171; Приклад 240 у WO AZD1152, РН739358, VX-680, MLN8054, R763, 00/47212), ваталаніб (РТК787; WO 98/35985) та МР235, МР529, VX-528 ТА АХ39459) та інгібітори SU11248 (сунітиніб; WO 01/60814), сполуки, як-то циклін-залежної кінази, як-то інгібітори CDK2 розкриті у міжнародних заявках на патент та/або CDK4; W097/22596, WO 97/30035, WO 97/32856 та WO (vi) антипроліферативні/протипухлинні ліки та 98/13354, та сполуки, що працюють за відмінними їх комбінації, які застосовано в онкології, як-то анмеханізмами (наприклад, ліномід, інгібітори функтиметаболіти (наприклад, антифолати, як-то метоції інтегрину v3, ангіостатин, разоксин, талідотрексат, флуорпіримідини, як-то 5-флуорурацил, мід, інгібітори ММР-2 (матриксна металопротеїнатегафур, аналоги пурину та аденозину, та цитозин за 2), інгібітори ММР-9 (матриксна метало арабінозид, гідроксисечовина або, наприклад, протеїназа 9) та інгібітори COX-II (циклооксигеназа один з антиметаболітів конкретно розкритих у ЄвII)), та ропейській заявці на патент № 239362, як-то N-(5(ii) агенти судинного націлювання (наприклад, [N-(3,4-дигідро-2-метил-4-оксохіназолін-6-ілметил)комбретастатин фосфат та сполуки, розкриті у WO N-метиламіно-2-теноїл)-L-глутамінова кислота; 00/40529, WO 00/41669, WO 01/92224, WO антипухлинні антибіотики (наприклад, антрациклі02/04434 та WO 02/08213, та агенти пошкодження ни, як-то адріаміцин, блеоміцин, доксорубіцин, судин, описані у міжнародній заявці на патент № дауноміцин, епірубіцин та ідарубіцин, мітоміцин-С, WO 99/02166, (наприклад, N-ацетилколхінол-Одактиноміцин, та мітраміцин); похідні платини (нафосфат)); приклад, цисплатин, та карбоплатин); алкілувальні (iii) цитостатичні агенти, як-то антіестрогени засоби (наприклад, азотистий іприт, мелфалан, (наприклад, тамоксифен, тореміфен, ралоксифен, хлорамбуцил, бусульфан, циклофосфамід, іфосдролоксифен, та йодоксифен), знижувальні регуфамід, нітрозосечовини, та тіотепа); антимітотичні лятори рецептору естрогену (наприклад, фулвестзасоби (наприклад, алкалоїди вінка, як-то вінкрисрант), прогестогени (наприклад, мегестрол ацетин, вінбластин, віндезин, та вінорелбін, та таксоїтат), інгібітори ароматази (наприклад, анастрозол, ди, як-то таксол та таксотер); інгібітори топоізомелетразол, воразол, та екземестан), антипрогестораз (наприклад, епіподофілотоксини, як-то гени, антіандрогени (наприклад, флутамід, нілутаетопозид та теніпозид, амсакрин, топотекан, кам 13 93531 14 пототецин та іринотекан); ферменти (наприклад, ного винаходу стосується гідросульфату сполуки 1 аспаригіназа); та тимідилат синтази інгібітори (нау комбінації з одним або більше антипухлинним приклад, ралтитрексед); засобом, перерахованим у (і) - (хі) тут вище. Ната додаткові типи хіміотерапевтичних засобів ступний аспект заявленого винаходу стосується охоплюючи: гідросульфату сполуки 1 у комбінації з будь-яким (vii) модифікатори біологічної реакції (наприкласом антипухлинних засобів, перерахованих у (і) клад, інтерферон); - (хі) тут вище. (viii) антитіла (наприклад, едреколомаб); Тут, де застосовують термін "комбінація" слід (ix) антисенсові терапії, наприклад, ті, котрі є розуміти, що це стосується одночасного, окремого спрямованими на цілі, перераховані вище, як-то або послідовного застосування. В одному аспекті ISIS 2503, антирас антисенс; винаходу "комбінація" стосується одночасного (x) генно-терапевтичні підходи, охоплюючи, застосування. У ще одному аспекті винаходу "комнаприклад, підходи для заміщення аберантн гени, бінація" стосується окремого застосування. У наяк-то підходи з аберантним р53 або аберантним ступному аспекті винаходу "комбінація" стосується BRCA1 чи BRCA2, GDEPT (ген-спрямована ферпослідовного застосування. Коли застосування є ментна терапія проліками), як-то підходи, застосопослідовним або окремим, затримка у застосуванвуючи фермент цитозин деаміназу, тимідин-кіназу ні другого компоненту повинна не призводити до або бактеріальну нітроредуктазу та підходи для втрати благотворної дії комбінації. збільшення толерантності пацієнта до хіміотерапії Згідно з наступним аспектом заявленого винаабо радіотерапії, як-то генна терапія резистентноходу запропоновано комплект що містить гідрості до ліків; та сульфат сполуки 1 у комбінації із антипухлинним (xi) підходи імунотерапії, охоплюючи, напризасобом, вибраним з перерахованого у (і) - (хі) тут клад, підходи ex-vivo та in vivo для збільшення вище. імуногеності клітин пухлин пацієнта, як-то трансЗгідно з наступним аспектом заявленого винафекція цитокінами, як-то інтерлейкін 2, інтерлейкін ходу запропоновано комплект що містить: 4 або фактор стимулювання колоній гранулоцитівa) гідросульфат сполуки 1 у першій формі макрофагів, підходи для зменшення Т-клітинної окремої дози; анергії, підходи, застосовуючи трансфектовані b) антипухлинний засіб, вибраний з перерахоімунні клітини, як-то цитокін-трансфектовані дендваного у (і) - (хі) тут вище, у другій формі окремої ритні клітини, підходи, застосовуючи цитокіндози; та трансфектовані лінії клітин пухлин та підходи, заc) упаковки для вказаних першої та другої стосовуючи антиідіотипічні антитіла. форм дозування. Наприклад, гідросульфат сполуки 1 можна заСполука 1, як виявлено, має активність у настосовувати сумісно з ефективною кількістю одної ступному дослідженні. N-термінальний 6 Hisабо більше речовин, вибраних з антиангіогенних мічений, установчо активний МЕК1 (2-393) експрезасобів, інгібіторів перетворення сигналу, та антисується у Е. coli та білок очищають звичайними проліферативних засобів. способами (Ahn et al., Science 1994, 265:966-970). У конкретному втіленні антиангіогенні засоби, Активність MEK1 оцінюють вимірюванням уведеняк-то інгібітори ММР-2 (матриксна металопротеїня -33Р-фосфату з -33Р-АТФ у N-термінальний наза 2), інгібітори ММР-9 (матриксна металопротеHis-мічений ERK2, котрий експресується у Е. coli, їназа 9), та інгібітори COX-II (циклооксигеназа II), та його очищають звичайними способами у присумож застосовувати сумісно з гідросульфатом спотності МЕК1. Дослідження проводять у 96луки 1 заявленого винаходу та фармацевтичної лунковому поліпропіленовому планшеті. Інкубакомпозиції описан тут. Приклади of корисн COX-Il ційна суміш (100 мкл) містить 25 мМ Гепесу, рН інгібітори охоплюють CELEBREX™ (алекоксиб) 7,4, 10 мМ MgCI2, 5 мМ -гліцеринфосфату, 100 вальдекоксиб, та рофекоксиб. Приклади інгібіторів мкМ натрій ортованадату, 5 мМ DTT, 5 нМ МЕК1, корисних матриксних металопротеїназ є описанита 1 мкМ ERK2. Інгібітори суспендують у ДМСО, та ми у WO 96/33172, WO 96/27583, WO 98/07697, усі реакції, охоплюючи контролі, проводять при WO 98/03516, WO 98/34918, WO 98/34915, WO кінцевій концентрації ДМСО 1%. Реакції ініціюють 98/33768, WO 98/30566, WO 90/05719, WO додаванням 10 мкМ АТФ (із 0,5 мкКі 33р99/52910, WO 99/52889, WO 99/29667, патенті АТФ/лунку) та інкубують при температурі довкілля США 5,863,949, та патенті США 5,861,510, усі які протягом 45 хвилин. Рівний об'єм 25% TCA додауведені тут як посилання. Придатними інгібітори ють для зупинки реакції та осадження білків. ОсаММР-2 та ММР-9 є ті, що мають малу активність джені білки уловлюють у фільтр-планшети зі склоабо не мають її стосовно інгібування ММР-1. Зокволокна В, та надлишок міченого АТФ вимивають, рема, застосовують ті, що селективно інгібують застосовуючи збирач Tomtec MACH III. Планшетам ММР-2 та/або ММР-9 відносно інших матриксних дають висохнути на повітрі перед додаванням 30 металопротеїназ (тобто, ММР-1, ММР-3, ММР-4, мкл/лунку Packard Microscint 20, та планшети підММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, раховують, застосовуючи Packard TopCount. У ММР-12, та ММР-13). Особливими прикладами цьому дослідженні сполука 1 виявляє IK50 менше, інгібіторів ММР, корисних у заявленому винаході, є ніж 50 мкМ. AG-3340, RO 32-3555, та RS 13-0830. Приклади Тому, наступний аспект заявленого винаходу Для ілюстрації винаходу представлені наступні стосується гідросульфату сполуки 1 у комбінації з приклади. Однак, слід розуміти, що ці приклади не будь-яким антипухлинним засобом, перераховаобмежують винахід, а тільки пояснюють спосіб ним у (і) - (хі) тут вище. Наступний аспект заявлевиконання винаходу. Виходи надані для прикладів 15 93531 16 як були та можуть бути посиленими подальшою ESP FTIR різними шляхами, з 2 мас.% дисперсії розробкою. Спектр 1H ЯМР (400 МГц) було віднецього матеріалу у порошку KBr, застосовуючи спосено до TMC (0,00 млн-1), 13C ЯМР спектр (100 сіб відбору зразків DRIFTS, у спектральному регіоМГц) було віднесено до ЯМР-розчиннику (39,5 ні 4000 - 400 см-1. млн-1) та 19F ЯМР спектр було віднесено до трихПриклад 1 -1 лорфлуорметану (0,00 млн ). FTIR-спектри були Отримання гідросульфату сполуки 1 отриманими на спектрометрі Nicolet Magna 860 При перемішуванні до суспензії 6-(4-бром-2хлор-феніламіно)-7-флуор-3-метил-3Нбензоімідазол-5-карбонової кислоти (2гідроксіетокси)-амід (100 г, 0,206 моль) (описано у прикладі 10 WO 03/077914, що уведено тут як довідк. та як описан нижче) у 2-бутаноні (680 мл) та воді (115 мл) при 0-5 °C було додано сульфатну кислоту (12,3 мл, 0,226 моль), а потім воду (5 мл), тримаючи температуру 10 °C або нижче. Суміш при перемішуванні нагрівали до 65 °C та тримали протягом 30 хвилин перед фільтруванням для видалення будь-якого чужинного матеріалу. Фільтр було промито сумішшю 2-бутанону (85 мл) та води (15 мл). Комбіновані фільтрати нагрівали до 72 °C перед додаванням 2-бутанону (500 мл), тримаючи температуру 60-72 °С. Утворену суміш відганяли при атмосферному тиску (приблизна температура відгонки 73-74 °С) до збору 500 мл дистилату. Другу аліквоту 2-бутанон (500 мл) було додано, тримаючи температуру суміші вище 70 °С. Утворену суміш відганяли знов до збору 250 мл дистилату. Суміш охолоджували до 0-5 °С протя гом приблизно 1 години. Утворену кашку фільтрували, промивали 2-бутаноном (240 мл) та сушили під зменшеним тиском при 50 °С, до постійної маси, отримуючи 6-(4-бром-2-хлор-феніламіно)-7флуор-3-метил-3Н-бензоімідазол-5-карбонової кислоти (2-гідроксіетокси)-аміду гідросульфат (103,5 г, 0,186 моль, 90% виходу) як білуватий кристалічний твердий матеріал. 1H ЯМР (400 МГц, D6 ДМСО) 3,58 (2H, t, CH2OH), 3,89 (2Н, t, CH2ON), 3,99 (3Н, s, CH3), 6,47 (1Н, dd, ArH), 7,29 (1Н, dd, ArH), 7,63 (1Н, d, ArH), 7,91 (1Н, s, ArH), 7,96 (3Н, br, ROH, NH, SOH), 8,10 (1Н, br, ArNH), 8,94 (1Н, s, NCHN), 11,79 (1Н, s, ONH). 13C ЯМР (100 МГц, D6 ДМСО) 32,1 (CH3), 58,5 (CH2OH), 77,3 (CH2ON), 108,2 (CH), 109,6 (CBr), 115,8 (CH), 120,6 (ССІ), 122,0 (C), 125,0 (CC=O), 129,4 (C), 130,5 (CH), 131,1 (CH), 132,3 (C), 140,6 (C), 145,8 (CF), 146,5(CH), 164,2 (C=O). Результати інфрачервоного аналізу показані у Фіг. 2. Спектральні віднесення наведені у таблиці 1. Таблиця 1 Хвильове число (cm-1) 3,255 3,200 - 2,700 2,700 - 2,300 1,673 1,653 1,640 - 1,370 1,570 1,506 1,213 1,189 1,100 - 1,000 Віднесення Охоплює О-Н валентні коливання первинної спиртової групи та N-H валентні коливання вторинної ароматичної аміно- та вторинної амідогрупи. Охоплює =С-Н валентні коливання ароматичного кільця та бензімідазольної групи та аліфатичні валентні коливання C-H. Охоплює ряд NH+ валентних коливань бензімідазол 1:1 сульфату. С=O-валентні коливання вторинної амідогрупи, де карбоніл піддано дії відмінних середовищ, як-то водневий зв'язок. Охоплює C=C валентні коливання ароматичного кільця, C=C та C=N валентні коливання бензімідазольної групи, О-Н деформаційні коливання первинної спиртової групи та деформаційні коливання аліфатичного C-H. CNH комбінаційна смуга вторинної амідогрупи. Охоплює CNH згинні коливання вторинної ароматичної аміногрупи. Валентні коливання арил C-F. Асиметричні SO3- валентні коливання бензімідазол 1:1 сульфату. Охоплює C-O валентні коливання первинної спиртової групи та арил C-Br валентні коливання. 17 1,011 920 - 600 888 93531 18 Симетричні валентні коливання SO3- бензімідазол 1:1 сульфату. Охоплює C-H гойдальні коливання та згинні коливання C=C кільця 1,2,4-тризаміщеного ароматичного кільця та бензімідазольної групи. Охоплює валентні коливання S-O(H) бензімідазол 1:1 сульфату. Приклад 1А Отримання гідросульфату сполуки 1 Сульфатну кислоту (1,52 мл, 27,86 ммоль) було додано при перемішуванні до суспензії 6-(4бром-2-хлорфеніламіно)-7-флуор-3-метил-3Нбензоімідазол-5-карбонової кислоти (2гідроксіетокси)-аміду (10 г, 0,0214 моль) (як описано у прикладі 10 WO 03/077914, що уведено тут як посилання та як описано нижче) у тетрагідрофурані (ТГФ) (62 мл) та воді (8 мл), тримаючи температуру 10 °С або нижче. Суміш при перемішуванні нагрівали до 65 °С та тримали протягом 30 хвилин перед фільтруванням для видалення будь-якого чужинного матеріалу. ТГФ (150 мл) тоді додавали до суміші, тримаючи температуру вище 60 °С. Суміш тоді охолоджували до 0-5 °С протягом приблизно 2 годин. Утворену кашку фільтрували, промивали ТГФ (30 мл) та сушили під зменшеним тиском при 50 °C до постійної маси, отримуючи 6(4-бром-2-хлорфеніламіно)-7-флуор-3-метил-3Нбензоімідазол-5-карбонової кислоти (2гідроксіетокси)-амід гідросульфат (9,81 г, 0,17 моль, 82% виходу) як білуватий кристалічний твердий матеріал. Матеріал був тим же як той, що створено у прикладі 1 вище. Приклад 1В Отримання 6-(4-бром-2-хлор-феніламіно)-7флуор-3-метил-3Н-бензоімідазол-5-карбонової кислоти (2-гідроксіетокси)-аміду Етап А: 2,3,4-Трифлуор-5-нітро-бензойна кислота: Тригорлу круглодонну колбу на 3 л завантажували 125 мл H2SO4. Димильну нітратну кислоту було додано (8,4 мл, 199 ммоль) та суміш обережно перемішували. 2,3,4-Трифлуорбензойну кислоту (25 г, 142 ммоль) було додано по 5 г протягом 90 хвилин. Темний коричнювато-жовтий розчин перемішували протягом 60 хвилин до завершення реакції. Реакційну суміш виливали у 1 л суміші лід:вода та екстрагували діетил-етером (3 х 600 мл). Комбіновані екстракти сушили (MgSO4) та концентрували під зменшеним тиском, отримуючи жовтий твердий матеріал. Твердий матеріал суспендували у гексанах та перемішували протягом 30 хвилин, після чого фільтрували, отримуючи 29 г (92%) чистого бажаного продукту як жовтуватий твердий матеріал: MC XIAT (-) m/z 220 (М-1) визначено. Етап В: 4-Аміно-2,3-дифлуор-5-нітро-бензойна кислота: Амоній гідроксид розчин (~30% у вод) (35 мл, 271 ммоль) було додано до розчину 2,3,4трифлуор-5-нітро-бензойної кислоти (15 г, 67,8 ммоль) у 30 мл води при 0 °C при перемішуванні. Після завершення додавання амоній гідроксиду реакційну суміш нагрівали до кімнатної температури при перемішуванні. Через 2,5 години реакційну суміш охолоджували до 0 °С та концентровану HCI було обережно додано до рН реакційної суміші 0. Реакційну суміш розбавляли водою (30 мл) та екстрагували діетил-етером (3 х 50 мл). Комбіновані органічні екстракти сушили (MgSO4) та кон центрували під зменшеним тиском, отримуючи 14 г (95%) чистого бажаного продукту: MC XIAT (-) m/z 217 (М-1) визначено. Етап С: 4-аміно-2,3-дифлуор-5-нітробензойної кислоти метил-естер: 2 M розчин тетраметилсилану (TMC) діазометану у гексанах (6,88 мл, 13,75 ммоль) було додано до суспензії 4-аміно-2,3дифлуор-5-нітробензойної кислоти (2,00 г, 9,17 ммоль) у 25 мл 4:1 Тетрагідрофурану (ТГФ):МеОН при 0 °С в атмосфері азоту. Після завершення додавання, реакційну суміш нагрівали до кімнатної температури. Через 0,5 години надлишок ТМСдіазометану руйнували обережним додаванням оцтової кислоти. Реакційну суміш тоді концентрували під зменшеним тиском та сушили у вакуумі 1,95 г (92%) чистого бажаного продукту: MC XIAT (-) m/z 231 (М-1) визначено. Етап D: 4-Аміно-3-флуор-5-нітро-2-феніламінобензойної кислоти метил-естер: 4-Аміно-2,3дифлуор-5-нітробензойної кислоти метил-естер (23,48 г, 101,1 ммоль) суспендували у ксилолах (125 мл) та було додано анілін (92 мл, 1011 ммоль). Реакційну суміш перемішували при 125 °C протягом 16 годин під азотом. Реакційну суміш охолоджували до кімнатної температури та тверді продукти осідали з розчину. Тверді продукти були зібраними фільтруванням та промитими ксилолами та тоді діетил-етером. Зібрані 22,22 г (72,78 ммоль) жовтого твердого матеріалу, котрим був чистий бажаний продукт. Фільтрат концентрували під зменшеним тиском, перерозчиняли у метиленхлориді та проганяли через шар силікагелю, елюючи метиленхлоридом. Бажані фракції були концентрованими під зменшеним тиском, отримуючи коричневий твердий матеріал, котрий розтирали у порошок з діетил-етером, отримуючи 5,47 г (17,91 ммоль) жовтого твердого матеріалу, котрим був чистий бажаний продукт. Комбінований вихід продукту був 27,69 г (90%). MC XIAT (-) m/z 304 (М-1) визначено. Етап Е: 7-Флуор-6-Феніламіно-3Нбензоімідазол-5-карбонової кислоти метил-естер: 4-Аміно-3-флуор-5-нітро-2-феніламіно-бензойної кислоти метил-естеру (16,70 г, 54,71 ммоль), мурашину кислоту (250 мл, 6,63 моль) та 20% Pd(OH)2/C (9,00 г, 16,91 ммоль) в етанолі (250 мл) перемішували при 40 °С протягом 2 годин під азотом та тоді при 95 °C протягом 16 годин. Реакційну суміш охолоджували до кімнатної температури та фільтрували через броунмілерит етилацетатом. Фільтрат було концентровано під зменшеним тиском, отримуючи жовтий твердий матеріал. Твердий матеріал розтирали у порошок з діетилетером, отримуючи 13,47 г (86%) бажаного продукту як коричнево-жовтий твердий матеріал. MC XIAT (+) M/Z 286 (М+1) визначено; MC XIAT (-) m/z 284 (M-1)визначено. Етап F: 6-(4-Бром-феніламіно)-7-флуор-3Нбензоімідазол-5-карбонової кислоти метил-естер: 7-Флуор-6-феніламіно-3Н-бензоімідазол-5 19 93531 20 карбонової кислоти метил-естер (4,99 г, 17,51 1,0 M водний розчин, 0,55 ммоль). Після переміммоль) розчиняли у N,N-диметилформаміді (275 шування протягом 2 годин реакційну суміш було мл). N-бромсукцинімід (3,15 г, 17,70 ммоль) було зменшено до одної четвертої початкового об'єму додано як твердий матеріал та реакційну суміш роторним випарюванням та залишок розбавлено перемішували при кімнатній температурі під азодо 50 мл водою. Водний розчин було підкислено том. Після 30 хвилин реакційну суміш гасили додо рН 2 додаванням 1,0 M водної HCI та це екстдаванням водного насиченого розчину натрій гідрагували сумішшю 1:1 тетрагідрофуросульфіту. Реакційну суміш тоді виливали у ран/етилацетат (3х), сушили (Na2SO4) та концентділильну лійку, розбавляли водою та етилацетарували під зменшеним тиском, отримуючи 43 мг том та шари розділяли. Водний шар екстрагували (79%) чистої карбонової кислоти як білуватий твеетилацетатом. Комбіновані органічні екстракти рдий матеріал. MC IEP (+) m/z 397, 398 (M+, Вrбули промитими три рази водою, розсолом та тоді картина) визначено. висушеними (Na2SO4) та концентрованими під Етап J: 6-(4-Бром-2 хлор-феніламіно-7-флуорзменшеним тиском, отримуючи 6,38 г (100%) чис3-метил-3Н-бензоімідазол-5-карбонової кислоти того бажаного продукту як коричнево-жовтий тве(2-вінілоксіетокси)-амід: 6-(4-Бром-2-хлоррдий матеріал. MC ESI (+) m/z 364, 366 (M+ Brфеніламіно)-7-флуор-3-метил-3Н-бензоімідазол-5картина)визначено. карбонову кислоту (2,00 г, 5,0 ммоль), O-(2Етап G: 6-(4-Бром-2-хлор-феніламіно)-7вінілоксіетил)-гідроксиламін (0,776 г, 7,5 ммоль), флуор-3Н-бензоімідазол-5-карбонової кислоти HOBt (0,88 г, 6,5 ммоль), триетиламін (1,61 мл, 2,3 метил-естер: 6-(4-Бром-феніламіно)-7-флуор-3Нммоль) та EDCI (1,3 г, 6,5 ммоль) розчиняли у дибензоімідазол-5-карбонової кислоти метил-естер метилформаміді (52 мл), та перемішували при (6,38 г, 17,51 ммоль) розчиняли у N,Nкімнатній температурі протягом 48 годин. Реакційдиметилформаміді (275 мл). N-хлорсукцинімід ну суміш розбавляли етилацетатом, промивали (2,36 г, 17,70 ммоль) було додано як твердий маводою (3х), насиченим розчином калій карбонату теріал та реакційну суміш перемішували при кім(2х), насиченим розчином амоній хлориду (2х), натній температурі під азотом до завершення реарозсолом, сушили (Na2SO4) та концентрували під кції (5-6 доби). Реакційну суміш гасили зменшеним тиском до білуватого твердого матерідодаванням водного насиченого розчину натрій алу. Розтирання твердого матеріалу діетилгідросульфіту, отримуючи суспензію. Утворені етером дало 2,18 г (90%) бажаний продукт як білутверді продукти були зібраними фільтруванням, ватий твердий матеріал. MC IEP (=) m/z 483, 485 промитими водою та діетил-етером та висушени(M+ Вr-картина) визначено. ми під зменшеним тиском, отримуючи 6,07 г (87%) Етап К: 6-(4-Бром-2-хлор-феніламіно)-7чистого бажаного продукту як бежевий твердий флуор-3-метил-3Н-бензоімідазол-5-карбонової матеріал. MC IEP (+) m/z 398, 400 (M+ Вr-картина) кислот (2-гідроксіетокси)-амід: Хлоридну кислоту визначено. (14 мл, 1,0 M водний розчин, 14 ммоль) було доЕтап Н: 6-(4-Бром-2-хлорфеніламіно)-7-флуордано до суспензії 6-(4-бром-2-хлор-феніламіно)-73-метил-3Н-бензоімідазол-5-карбонової кислоти флуор-3-метил-3Н-бензоімідазол-5-карбонової метил-естер та 6-(4-Бром-2-хлорфеніламіно)-7кислоти (2-вінілоксіетокси)-аміду (2,18 г, 4,50 флуор-1-метил-1Н-бензоімідазол-5-карбонової ммоль) в етанолі (50 мл) та реакційну суміш перекислоти метил-естер: Розчин 6-(4-бром-2-хлормішували протягом 24 годин. Реакційну суміш було феніламіно)-7-флуор-3Н-бензоімідазол-5концентровано до сухого стану роторним випарюкарбонової кислоти метил-естеру (150 мг, 0,38 ванням та тверді продукти розподілено між 3:1 ммоль), йодметану (28 мкл, 0,45 ммоль) та калій етилацетат/тетрагідрофуран та насиченим розчикарбонату (78 мг, 0,56 ммоль) у диметилформаміді ном калій карбонату. Водну фазу екстрагували (1,5 мл) перемішували при 75 °C протягом 1 годисумішшю 3:1 етилацетат/тетрагідрофуран (3х), ни. Реакційну суміш розбавляли етилацетатом, комбіновані органічні матеріали сушили (Na2SO4), промивали водним насиченим розчином карбоната концентрували, отримуючи 2,11 г (100%) 6-(4ту калію (2х), розсолом та сушили (Na2SO4). Флешбром-2-хлорфеніламіно)-7-флуор-3-метил-3Нхроматографія на колонці (20:1 метиленхлобензоімідазол-5-карбонової кислоти (2рид/етилацетат) дала 56 мг (36%) більш рухомого гідроксіетокси)-амід як білуватий твердий матері6-(4-бром-2-хлорфеніламіно)-7-флуор-3-метил-3Нал. MC IEP (+) m/z 457, 459 (M+, Вr-картина) вибензоімідазол-5-карбонової кислоти метил-естеру значено. 1H ЯМР (400 МГц, MeOH-d4) 8,26 (s, 19 як білий твердий матеріал. F ЯМР (376 МГц, 1Н), 7,78 (s, 1Н), 7,57 (d, 1Н), 7,24 (dd, 1Н), 6,40 CD3OD) - 133,5(s). MC XIAT (+) m/z 412, 414 (M+, (dd, 1Н), 3,86 (s, 3Н), 3,79 (m, 2Н), 3,49 (т, 2Н). 19F Вr-картина) визначено. Також виділеним є 54 мг ЯМР (376 МГц, MeOH-d4) - 133,68 (s). (35%) 6-4(-бром-2-хлор-феніламіно)-7-флуор-1Приклад 2 метил-1Н-бензоімідазол-5-карбонової кислоти Дослідження фізичних властивостей гідро19 метил-естер як білий твердий матеріал. F ЯМР сульфату (376 МГц, CD3OD) - 139,9 (s). MC ХІАТ(+) m/z 412, Продукт з прикладу 1 тестували для визна414 (M+, Вr-картина) визначено. чення його фізичних властивостей. Етап І: 6-(4-Бром-2-хлор-феніламіно)-7-флуорРентгенодифракція порошку (PXRD) 3-метил-3Н-бензоімідазол-5-карбонова кислота: 6Усі зразки проганяли на дифрактометрі Bruker (4-Бром-2-хлор-феніламіно)-7-флуор-3-метил-3НD5000. Спектри рентгенодифракції порошку були бензоімідазол-5-карбонової кислоти метил-естер визначеними монтуванням зразку кристалічної (56 мг, 0,14 ммоль) розчиняли у суміші 2:1 солі на підкладці з монокристалу силіцію Siemens ТГФ/вода (3 мл) та було додано NaOH (0,55 мл, (SSC) та розподіляли зразок у тонкий шар слай 21 93531 22 дом мікроскопа. Зразок обертали при 30 циклів за ти також. Звідси представлені дані рентгенодифхвилину (для поліпшення статистики підрахунку) рактограми не є абсолютними значеннями (дивись та опромінювали рентгеновипромінюванням, ствоJenkins, R. & Snyder, R.L., "Introduction to X-Ray реним мідною довго-гострофокусною трубкою при Powder Diffractometry", John Wiley & Sons, 1996,). 40 кВ та 40 мА із довжиною хвилі 1,5406 ангстрем. Приклад 3 Колімоване джерело рентгеновипромінювання In vivo дослідження: Дослідження солей у попропускали через автоматичну змінну щілину розрівнянні з вільною основою у диспергованій комходження при V20 та відбите випромінювання позиції спрямовували через 2 мм антирозсіювальну щілиДослідження було проведено на собаках для ну та 0,2 мм детекторну щілину. Зразок опромінювимірювання рівнів сполуки 1 у плазмі голодних вали протягом 1 с на інкременті 0,02 градуси 2собак після застосування пероральної дози, еквітета (режим безперервного сканування) у межах 2 валентної 150 мг вільної основи у 7,5 мл різних градуси - 40 градусів 2-тета у режимі тета-тета. дисперсій композиції у фармацевтично прийнятних Час прогону був 31 хвилин та 41 с. Прилад був з диспергувальних засобах із сполукою 1 як вільною лічильником сцинтиляції як детектором. Контроль формою або гідросульфатом. та отримання даних здійснювали за допомогою Одиничні дози 150 мг застосовували перорапрограми Diffract+. Dell Optiplex 686 NT 4,0 льно до голодних гончих собак масою 12-17 кг та Workstation приблизно 2-6 років віку на кожну з трьох діб дозуДан були зібраними у межах 2-тета 2 - 40°, з вання. Кожна доба дозування була через 1 тижінкрементами 2-тета 0,02° із 4 с на інкремент та день. перелічені у таблиці 2, із відносними інтенсивносУсі композиції були отриманими безпосередтями похідними від дифрактограм, виміряних з ньо перед прийомом уведенням 7,5 мл прийнятнофіксованими щілинами. го диспергувального розчину через 10 мл шприц у колби, що містять еквівалент 150 мг вільної основи Таблиця 2 прийнятної форми ліків та змішування протягом 30 с для утворення дисперсії. Дисперсію видаляли з колби, застосовуючи Відносна Інтенсивність Позначення шприц, та уводили тваринам у шлунок через зонд. % Колби двічі промивали додаванням, для кожної з 25-100 ДСил - Дуже сильна двох промивок окремими аліквотами по 15 мл во10-25 Сил - Сильна ди (загальний об'єм промивки 30 мл) через шприц 3-10 Сер - Середня 20 мл, змішуванням протягом 5 с, видаленням 1-3 Сл - Слабка промивного розчину з колби, застосовуючи шприц та уведення тваринам через зонд. Результати сканування показані у Фіг. 1, де Собак годували приблизно 400 г спецдіети А вища сіра лінія є рентгенодифрактограмою порошкожної доби та давали воду досхочу. Суцільну ку гідросульфату сполуки 1 та нижчі чорна лінія кров (2 мл) у літий-гепаринових тубах відбирали з представляє вільну форму. Найбільш інтенсивні шийної вени негайно перед дозуванням та через піки, починаючи з най більш інтенсивного, надані у 0,5, 1, 2, 3, 4, 5, 6, 8, 12, 18, 24, 36 та 48 годин. таблиці 3. Пік при 24,59° є особливо сильним. Кров центрифугували при 3000 об/хвил протягом 15 хвилин та плазму видаляли у плоскі кров'яні туби та зберігали при -20 °С до аналізу. Таблиця 3 Плазму (50 мкл) було аналізовано на концентрацію сполуки 1. Дві собаки були виведені з аналі2 тета Відносна інтенсивність зу, оскільки вони блювали після дозування. Сере24,59 ДСил дні профілі концентрації у плазмі для сполуки 1 20,97 ДСил після перорального дозування показані у Фіг. 3, де 23,99 Сил лінія, представлена ▲, ілюструє композицію, котра 27,65 Сил містить гідросульфат сполуки 1, а лінія представ12,24 Сил лена , показує результати вільної основи сполуки 23,49 Сил 1 у тій же композиції. 24,30 Сил Виявлено, що зміни композиції мав відносно малий вплив на дію (результати не показані). Од17,02 Сил нак коли сполуку 1 уводили як гідросульфат, було 25,91 Сил створен им суттєве приблизно 4-8-кратне збіль22,50 Сер шення піддавання дії. Вищенаведений опис є тільки ілюстративним стосовно винаходу. Крім того, ряд модифікацій та Спеціалістам з рентгенодифракції порошку ясзмін, зрозумілих спеціалістам, не обмежують вино, що на відносну інтенсивність піків може вплинахід точними прийомами та способами, показавати, наприклад, зернини вище 30 мікрон за розними вище. Відповідно, усі придатні модифікації та міром та неоднорідні співвідношення розмірів, еквіваленти можуть бути охопленими рамками котрі можуть впливати на аналіз зразків. Спеціалівинаходу, як визначено формулою винаходу. сту також відомо, що на позицію відбитків може Слова "містить," "охоплюють," "охоплюючи," та впливати точна висота, на котрій зразок знахо"охоплює" при застосуванні у цьому описі та у надиться у дифрактометрі та нуль-калібрування диступній формулі винаходу призначені для визнафрактометру. Площинність зразку можуть вплива 23 93531 24 чення встановлених особливостей, компонентів одного або більше з інших особливостей, компоабо етапів, але вони не заважають додаванню нентів, етапів, або їх груп. Комп’ютерна верстка А. Крулевський Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel hydrogen sulfate salt
Автори англійськоюSquire Christopher John, Demattei John, Roberts Ronald John, Chuang Tsung-Hsun, Sharma-Singh Gorkhn, Pervez Mohammed, Ford James Gair, Storey Richard Anthony, Dickinson Paul Alfred
Назва патенту російськоюНовый гидросульфат
Автори російськоюСквайр Кристофер Джон, Дематтей Джон, Робертс Роналд Джон, Чуан Цзун-Сюнь, Шарма-Синг Горхн, Первез Моаммед, Форд Джеймз Гер, Стори Ричард Энтони, Дикинсон Пол Алфред
МПК / Мітки
МПК: C07D 235/06, A61K 31/4184, A61P 35/00
Мітки: гідросульфат, новий
Код посилання
<a href="https://ua.patents.su/12-93531-novijj-gidrosulfat.html" target="_blank" rel="follow" title="База патентів України">Новий гідросульфат</a>
Попередній патент: Композиція з пролонгованим вивільненням активної речовини, спосіб її одержання та застосування
Наступний патент: Спосіб та пристрій для виготовлення пакетів
Випадковий патент: Спосіб створення моделі отруєння щурів наночастинками свинцю












