Поліциклічні карбамоїлпіридонові сполуки та їх фармацевтичне застосування
Номер патенту: 114351
Опубліковано: 25.05.2017
Автори: Міш Майкл Р., Лазервіт Скотт Е., Дізай Маной К., Тейлор Джеймс Г., Цзі Мінчже, Морганеллі Філіп Ентоні, Бекон Елізабет М., Трехо Мартін Тереза Алехандра, Піун Хіунг-джунг, Цай Чженьхун Р., Джін Хаолун, Коттелл Джеромі Дж., Чень Сяоу
Формула / Реферат
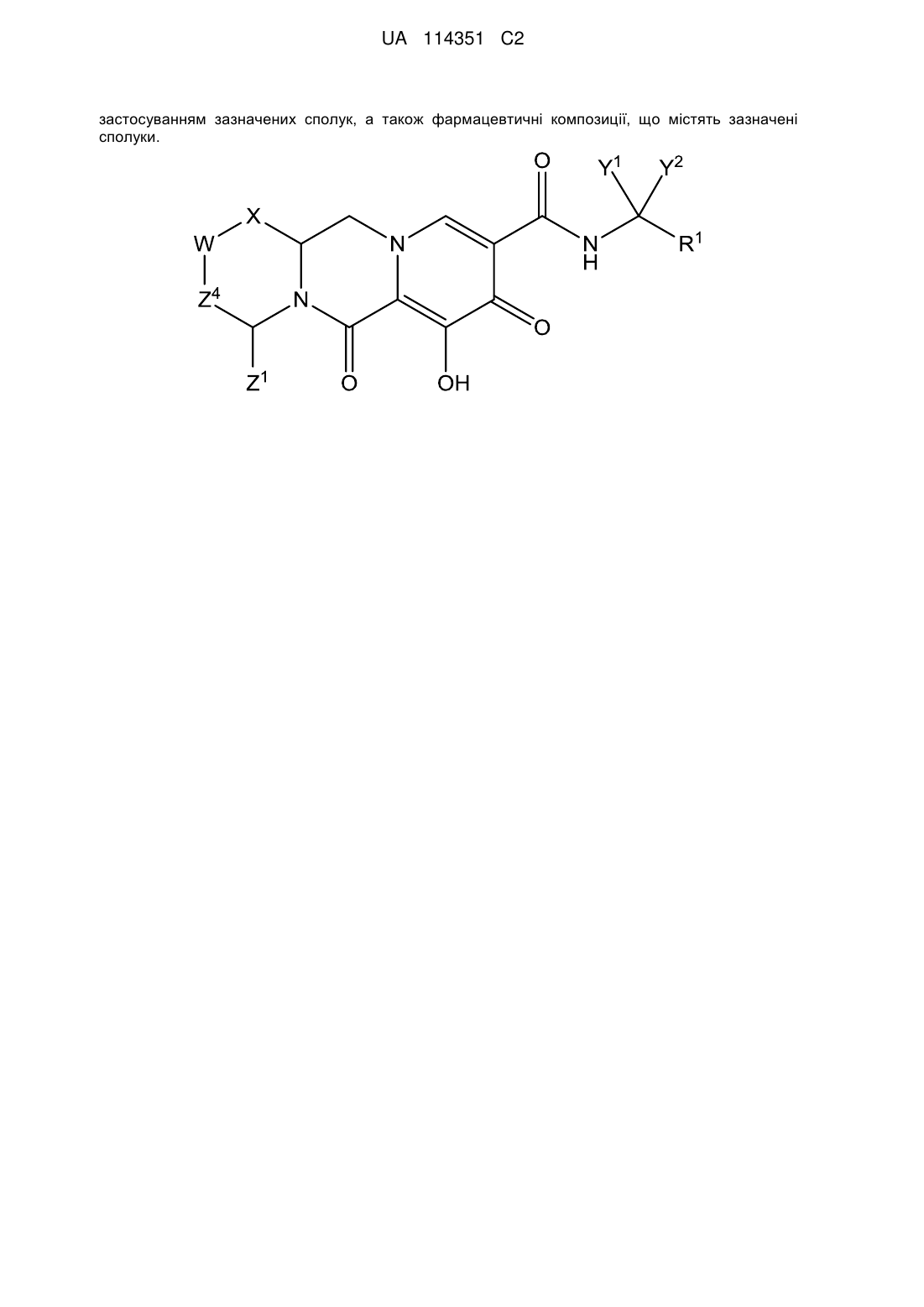
1. Сполука формули Іа, що має наступну структуру:
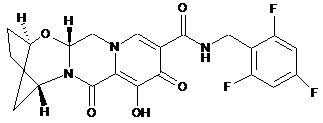 ,
,
або її фармацевтично прийнятна сіль.
2. Фармацевтична композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій, розріджувач або допоміжну речовину.
3. Фармацевтична композиція за п. 2, що додатково містить один або більше додаткових терапевтичних агентів.
4. Фармацевтична композиція за п. 3, яка відрізняється тим, що один або більше додаткових терапевтичних агентів являють собою агент проти ВІЛ.
5. Фармацевтична композиція за п. 4, яка відрізняється тим, що один або більше додаткових терапевтичних агентів вибрані з групи, що складається з інгібіторів протеази ВІЛ, ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ та їх комбінацій.
6. Фармацевтична композиція за п. 4, яка відрізняється тим, що один або більше додаткових терапевтичних агентів вибрані з нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ та їх комбінацій.
7. Фармацевтична композиція за п. 4, яка відрізняється тим, що один або більше додаткових терапевтичних агентів вибрані з абакавіру, тенофовіру дизопроксилу, тенофовіру алафенаміду, їх фармацевтично прийнятних солей та їх комбінацій.
8. Застосування сполуки або її фармацевтично прийнятної солі за п. 1 або фармацевтичної композиції за будь-яким з пп. 2-7 у приготуванні лікарського засобу для лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення зазначеної інфекції.
9. Фармацевтична комбінація, що включає сполуку за п. 1 або її фармацевтично прийнятну сіль та один або більше додаткових терапевтичних агентів, вибраних з нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ та їх комбінацій.
10. Фармацевтична комбінація, що включає сполуку за п. 1 або її фармацевтично прийнятну сіль та один або більше додаткових терапевтичних агентів, вибраних з абакавіру, тенофовіру дизопроксилу, тенофовіру алафенаміду, їх фармацевтично прийнятних солей та їх комбінацій.
Текст
Реферат: Запропоновані сполуки для застосування для лікування інфекції вірусу імунодефіциту людини (ВІЛ). Сполуки мають наступну формулу (І): O W X N Y N H 1 Y 2 R 1 N Z4 O Z1 O OH , (І) 1 1 2 1 4 включаючи їх стереоізомери та фармацевтично прийнятні солі, де R , X, W, Y , Y , Z та Z такі, як визначено у даному описі. Також запропоновані способи, пов'язані з одержанням та UA 114351 C2 (12) UA 114351 C2 застосуванням зазначених сполук, а також фармацевтичні композиції, що містять зазначені сполуки. UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 ПЕРЕХРЕСНЕ ПОСИЛАННЯ НА СПОРІДНЕНІ ЗАЯВКИ Дана заявка на патент заявляє пріоритет у відповідності з параграфом 119(е) розділу 35 Зведення законів США на основі попередньої заявки на патент США №61/745375, поданої 21 грудня 2012 року, попередньої заявки на патент США №61/788397, поданої 15 березня 2013 року, та попередньої заявки на патент США №61/845803, поданої 12 липня 2013 року. Зміст зазначених вище заявок включено у дану заявку у всій повноті шляхом посилань. РІВЕНЬ ТЕХНІКИ Галузь техніки Запропоновані сполуки, композиції та способи для лікування інфекції, викликаної вірусом імунодефіциту людини (ВІЛ). Зокрема, запропоновані нові поліциклічні карбамоїлпіридонові сполуки та способи їх одержання та застосування як терапевтичні або профілактичні агенти. Опис рівня техніки Інфекція, що викликається вірусом імунодефіциту людини, та споріднені захворювання є однією з основних проблем у сфері охорони здоров'я по всьому світу. Вірус імунодефіциту людини 1 типу (ВІЛ-1) кодує три ферменти, які потрібні для реплікації вірусу: зворотну транскриптазу, протеазу та інтегразу. Незважаючи на широке застосування лікарських засобів, спрямовано діючих на зворотну транскриптазу та протеазу, що показало свою ефективність, зокрема при використанні у комбінації, токсичність та розвиток резистентних штамів обмежують можливість їх застосування (Palella, et al. N. Engl. J Med. (1998) 338:853–860; Richman, D.D. Nature (2001) 410:995–1001). Прегнановий Х рецептор (PXR) являє собою ядерний рецептор, який є одним із ключових регуляторів ферментів, залучених у метаболізм та виведення малих молекул з організму. Як відомо, активація PXR підвищує регуляцію або викликає вироблення метаболічних ферментів, таких як цитохром P450 3A4 (CYP3A4), а також ферментів, залучених у транспорт, таких як OATP2, у печінці та кишечнику (Endocrine Reviews (2002) 23(5):687–702). Підвищувальна регуляція зазначених та інших ферментів за рахунок активації PXR під дією якого-небудь одного лікарського засобу може знижувати усмоктуваність та/або дію лікарського засобу, що спільно вводиться, чутливого до цих ферментів. Для мінімізації ризику подібної міжлікарської взаємодії бажано мінімізувати активацію PXR. Крім того, відомо, що PXR активується множиною різних класів молекул (Endocrine Reviews (2002) 23(5):687–702). Таким чином, для лікарських засобів, що вводяться разом з іншими лікарськими засобами, важливо досліджувати та мінімізувати активацію PXR. Було показано, що транспортери впливають на профілі фармакокінетики, безпеки та ефективності лікарських засобів, а також опосередковують певні межлікарські взаємодії. Див., Giacomini KM, et al. "Membrane transporters in drug development," Nat.Rev Drug Discov. 9: 215-236, 2010; Zhang L, et al. "Transporter-Mediated Drug-Drug Interactions," Clin. Pharm. Ther. 89(4):481484 (2011). Один з транспортерів, транспортер органічних катіонів 2 (OCT2; SLC22A2), є членом суперсімейства транспортерів розчинених речовин (SLC) та локалізований, головним чином, у базолатеральній мембрані проксимальних канальців нирок. Вважається, що OCT2 разом із транспортерами множинної резистентності та виведення токсинів (MATE) 1 та 2-K, експресованими у апікальній мембрані, утворюють основний шлях секреції катіонів у нирці, та було показано, що вони забезпечують транспорт ендогенних сполук, включаючи креатинін та ксенобіотики, включаючи метформін. Таким чином, інгібування OCT2 може забезпечувати підвищення рівня креатиніну у сироватці та потенційно здатне підвищувати рівень інших субстратів ОСТ2. Також важливо досліджувати та знижувати інгібуючу дію лікарських засобів на ОСТ2. Завданням антиретровірусної терапії є забезпечення пригнічення вірусу у пацієнта, інфікованого ВІЛ. Згідно з рекомендаціями щодо лікування, запропонованим департаментом охорони здоров'я та соціального забезпечення США, для досягнення пригнічення вірусу потрібно застосування комбінованої терапії, тобто введення декількох лікарських засобів, що належать щонайменше до двох або більше класів лікарських засобів. (Комісія щодо надання рекомендацій з антиретровірусної терапії для дорослих та підлітків. Департамент охорони здоров'я та соціального забезпечення США. Рекомендації доступні за адресою http://aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf. Розділ відкрито 14 березня 2013 року). Крім того, прийняття рішень, пов'язаних з лікуванням пацієнтів, інфікованих ВІЛ, ускладнюється, якщо пацієнтові потрібно лікування інших медичних станів (там же, Е-12). Так як згідно зі стандартом лікування для пригнічення ВІЛ, а також для лікування інших станів, які можуть бути у пацієнта, потрібне застосування декількох різних лікарських засобів, тоді одним із критеріїв вибору схеми лікування є можливість виникнення міжлікарських взаємодій. Таким 1 UA 114351 C2 5 10 15 20 25 30 35 чином, існує необхідність у антиретровірусній терапії зі зниженим потенціалом виникнення міжлікарських взаємодій. Відповідно, існує необхідність у нових агентах, що інгібують реплікацію ВІЛ та мінімізують активацію PXR при спільному введенні з іншими лікарськими засобами. КОРОТКИЙ ОПИС Даний винахід відноситься до нових поліциклічних карбамоїлпіридонових сполук, що мають противірусну активність, включаючи їх стереоізомери та фармацевтично прийнятні солі, та до застосування зазначених сполук для лікування інфекцій ВІЛ. Сполуки згідно із даним винаходом можна застосовувати для інгібування активності інтегрази ВІЛ та для зниження реплікації ВІЛ. У одному з варіантів реалізації даного винаходу запропоновані сполуки, що мають наступну формулу (I): (I) або їх стереоізомери або фармацевтично прийнятні солі, де: 3 3 Х являє собою -О- або -NZ - або -CHZ -; 2 W являє собою -CHZ -; 1 2 3 1 2 1 3 кожен Z , Z та Z незалежно являє собою водень або C1-3 алкіл, або Z та Z або Z та Z , a взяті разом, утворюють -L-, причому L являє собою -C(R )2-, a a a a a a a a a -C(R )2C(R )2-, -C(R )2C(R )2C(R )2- або -C(R )2C(R )2C(R )2C(R )2-, при цьому щонайменше одна 1 2 1 3 пара з Z та Z або Z та Z , взятих разом, утворює -L-; 4 Z являє собою зв’язок, -СН2- або -СН2СН2-; 1 2 кожен Y та Y незалежно являє собою водень, С1-3 алкіл або С1-3 галогеналкіл; 1 R являє собою феніл, заміщений одним – трьома атомами галогенів; та a кожен R незалежно являє собою водень, галоген, гідроксил або С 1-4 алкіл. У іншому варіанті реалізації даного винаходу запропоновані сполуки, що мають наступну формулу (I): (I) або їх стереоізомери або фармацевтично прийнятні солі, де: 3 3 Х являє собою -О- або -NZ - або -CHZ -; 2 2 W являє собою -О- або -NZ - або -CHZ -; 1 2 3 1 2 1 3 кожен Z , Z та Z незалежно являє собою водень або C1-3 алкіл, або Z та Z або Z та Z , a взяті разом, утворюють -L-, причому L являє собою -C(R )2-, a a a a a a a a a a a -C(R )2C(R )2-, -C(R )2C(R )2C(R )2-, -C(R )2C(R )2C(R )2C(R )2-, -C(R )2 °C(R )2-, a a a a a a a a a -C(R )2NR C(R )2-, -C(R )2SC(R )2-, -C(R )2S(O)C(R )2-, -C(R )2SO2C(R )2-, a a a a a a a a a a -C(R )2 °C(R )2C(R )2-, -C(R )2C(R )2 °C(R )2-, -C(R )2NR C(R )2C(R )2-, a a a a a a a a a a -C(R )2C(R )2NR C(R )2-, -C(R )2SC(R )2C(R )2-, -C(R )2C(R )2SC(R )2-, 2 UA 114351 C2 a 5 10 15 20 25 30 35 40 45 50 55 60 a a a a a a a a -C(R )2S(O)C(R )2C(R )2-, -C(R )2C(R )2S(O)C(R )2-, -C(R )2SO2C(R )2C(R )2-, a a a a a a a a a -C(R )2C(R )2SO2C(R )2-, -C(R )2SO2NR C(R )2- або -C(R )2NR SO2C(R )2-; 4 Z являє собою зв’язок або -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2OCH2-, a -CH2NR CH2-, -CH2SCH2-,-CH2S(O)CH2- або -CH2SO2CH2-; 1 2 1 2 кожен Y та Y незалежно являє собою водень, С1-3 алкіл або С1-3 галогеналкіл, або Y та Y разом з атомом вуглецю, до якого вони приєднані, утворюють карбоциклічне кільце, що містить від 3 до 6 атомів у кільці, або гетероциклічне кільце, що містить від 3 до 6 атомів у кільці, причому карбоциклічне або гетероциклічне кільце необов’язково заміщене одним або більше a R; 1 R являє собою можливо заміщений арил або можливо заміщений гетероарил; та a a кожен R незалежно являє собою водень, галоген, гідроксил або С 1-4 алкіл, або дві групи R разом з атомом вуглецю, до якого вони приєднані, утворюють =О, та 1 2 1 3 1 2 щонайменше одна пара з: (i) Z та Z або Z та Z , взятих разом, утворює -L-; або (ii) Y та Y разом з атомом вуглецю, до якого вони приєднані, утворюють карбоциклічне кільце, що містить від 3 до 6 атомів у кільці, або гетероциклічне кільце, що містить від 3 до 6 атомів у кільці. У іншому варіанті реалізації запропонована фармацевтична композиція, що містить сполуку, яка має формулу (I), або її стереоізомер або фармацевтично прийнятну сіль та фармацевтично прийнятний носій, розріджувач або допоміжну речовину. У винаході також запропоноване застосування фармацевтичної композиції, описаної вище у даній заявці, для лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції. У іншому варіанті реалізації запропонований спосіб застосування сполуки, яка має формулу (I), у терапії. Зокрема, запропонований спосіб лікування проліферації вірусу ВІЛ, лікування СНІД або відстрочки прояву симптомів СНІД або ARC у ссавця (наприклад, у людини), який включає введення ссавцю сполуки, яка має формулу (I), або її стереоізомеру або фармацевтично прийнятної солі та фармацевтично прийнятного носія, розріджувачаабо допоміжної речовини. У іншому варіанті реалізації запропоноване застосування сполуки формули (I), описаної у даній заявці, або її фармацевтично прийнятної солі для лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції. У іншому варіанті реалізації запропоноване застосування сполуки формули (I), описаної у даній заявці, або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції. У іншому варіанті реалізації запропонований виріб, що містить ефективну композицію для лікування ВІЛ-інфекції; матеріал для упакування, що містить етикетку, на якій відмічена можливість застосування композиції для лікування інфекції, викликаної ВІЛ. Типові композиції містять сполуку формули (I) у відповідності з даним винаходом або її фармацевтично прийнятну сіль. У іншому варіанті реалізації запропонований спосіб інгібування реплікації ВІЛ. Спосіб включає вплив на вірус ефективною кількістю сполуки формули (I) або її солі в умовах, при яких відбувається пригнічення реплікації ВІЛ. У іншому варіанті реалізації запропоноване застосування сполуки формули (I) для інгібування активності ферменту інтегрази ВІЛ. У іншому варіанті реалізації запропоноване застосування сполуки формули (I) або її солі для інгібування реплікації ВІЛ. Інші варіанти реалізації, об'єкти, відмітні ознаки та переваги наведені далі у докладному описі варіантів реалізації та частково стануть зрозумілі з опису або можуть бути вивчені при реалізації заявленого винаходу. Зазначені завдання та переваги можна реалізовувати та забезпечувати за допомогою способів та композицій, конкретним чином відзначених у надрукованому описі та формулі винаходу. Необхідно розуміти, що вищевказаний короткий опис, який слід розглядати як стислий та загальний виклад деяких варіантів реалізації, запропонованих у даній заявці, запропонований винятково для зручності та допомоги читачеві та не обмежує яким-небудь чином обсяг або діапазон еквівалентів, який у відповідності з законодавством визначений формулою винаходу. ДОКЛАДНИЙ ОПИС Для більш повного розуміння різних варіантів реалізації винаходу далі наведений докладний опис. Проте, фахівці у даній галузі техніки повинні розуміти, що винахід може бути реалізований і без зазначених подробиць. Слід розуміти, що наступний опис деяких варіантів реалізації даного винаходу слід розглядати як приклад заявленого об'єкту винаходу, але не як обмежуючий прикладену формулу винаходу конкретними проілюстрованими варіантами реалізації. Заголовки, використовувані у даному описі, наведені винятково для зручності, та їх 3 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 60 не слід розглядати як яким-небудь чином обмежуючі формулу винаходу. Варіанти реалізації, проілюстровані після якого-небудь заголовку, можна поєднувати з варіантами реалізації, проілюстрованими після якого-небудь іншого заголовку. Визначення Якщо згідно з контекстом не потрібне інше, у даному описі та формулі винаходу слово «містити» та різні його форми, такі як «містить» та «що містить», слід розглядати у відкритому та не виключаючому значенні, тобто як «включаючи, але не обмежуючись ними». Посилання на «один з варіантів реалізації» або «варіант реалізації» у даному описі означає, що конкретна відмітна ознака, структура або характеристика, описана у варіанті реалізації, включена щонайменше у один варіант реалізації даного винаходу. Таким чином, використання фраз «у одному з варіантів реалізації» або «згідно з варіантами реалізації» у різних місцях даного опису необов'язково відноситься до одного варіанту реалізації. Крім того, певні відмітні ознаки, структури або характеристики можуть бути об'єднані будь-яким підходящим чином у одному або більше варіантах реалізації. Якщо згідно контексту не потрібне інше, вказівка на «сполуку формули (I)» або «сполуки формули (I)» у даному описі відноситься до всіх варіантів реалізації формули (I), включаючи, наприклад, сполуки формули (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IVBC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), а також конкретні сполуки, запропоновані у даному описі. «Аміно» відноситься до радикалу -NH2. «Ціано» відноситься до радикалу -CN. «Гідрокси» або «гідроксил» відноситься до радикалу -ОН. «Іміно» відноситься до заміснику =NH. «Нітро» відноситься до радикалу -NO2. «Оксо» відноситься до заміснику =О. «Тіоксо» відноситься до заміснику =S. «Алкіл» відноситься до лінійного або розгалуженого вуглеводневого радикалу, що складається виключно з атомів вуглецю та водню, який є насиченим або ненасиченим (тобто містить один або більше подвійних та/або потрійних зв’язків), що містить від одного до дванадцяти атомів вуглецю (С1-С12 алкіл), переважно від одного до восьми атомів вуглецю (С 1С8 алкіл) або від одного до шести атомів вуглецю (С 1-С6 алкіл), який приєднаний до залишку молекули за допомогою простого зв’язку, наприклад, до метилу, етилу, н-пропілу, 1-метилетилу (ізопропілу), н-бутилу, н-пентилу, 1,1-диметилетилу (трет-бутилу), 3-метилгексилу, 2метилгексилу, етенілу, проп-1-енілу, бут-1-енілу, пент-1-енілу, пента-1,4-дієнілу, етинілу, пропінілу, бутинілу, пентинілу, гексинілу тощо. Якщо у даному описі конкретно не зазначено інше, алкільна група може бути необов’язково заміщена. «Алкілен» або «алкіленовий ланцюг» відноситься до лінійного або розгалуженого двовалентного вуглеводневого ланцюгу, що зв’язує залишок молекули з радикальною групою, що складається виключно з атомів вуглецю та водню, яка є насиченою або ненасиченою (тобто містить один або більше подвійних та/або потрійних зв’язків), що містить від одного до дванадцяти атомів вуглецю, наприклад, до метилену, етилену, пропілену, н-бутилену, етенілену, пропенілену, н-бутенілену, пропінілену, н-бутинілену та т.д. Алкіленовий ланцюг приєднаний до залишку молекули шляхом простого або подвійного зв’язку та до радикальної групи за допомогою простого або подвійного зв’язку. Місця приєднання алкіленового ланцюгу до залишку молекули та до радикальної групи можуть бути розташовані при одному атомі вуглецю або будь-яких двох атомах вуглецю, що входять у склад ланцюгу. Якщо у описі конкретно не зазначено інше, алкіленовий ланцюг може бути необов’язково заміщений. «Алкокси» відноситься до радикалу формули -ORA, де RA являє собою алкільний радикал, такий як визначено вище, що містить від одного до дванадцяти атомів вуглецю. Якщо у описі конкретно не зазначено інше, алкоксигрупа може бути необов’язково заміщена. «Алкіламіно» відноситься до радикалу формули -NHRA або -NRARA, де кожен RA незалежно являє собою алкільний радикал, такий як визначено вище, що містить від одного до дванадцяти атомів вуглецю. Якщо у описі конкретно не зазначено інше, алкіламіногрупа може бути необов’язково заміщена. «Тіоалкіл» відноситься до радикалу формули -SRA, де RA являє собою алкільний радикал, такий як визначено вище, що містить від одного до дванадцяти атомів вуглецю. Якщо у описі конкретно не зазначено інше, тіоалкільна група може бути необов’язково заміщена. «Арил» відноситься до радикалу у формі моноциклічної вуглеводневої системи кілець, що містить водень та від 6 до 18 атомів вуглецю. Арильні радикали включають, але не 4 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 60 обмежуються ними, арильні радикали, що є похідними бензолу. Якщо у описі конкретно не зазначено інше, термін «арил» або префікс «ар-» (як у «аралкілі») включає необов’язково заміщені арильні радикали. «Аралкіл» відноситься до радикалу формули -RB-RC-, де RB являє собою алкіленовий ланцюг, такий як визначено вище, та RC являє собою один або більше арильних радикалів, таких як визначено вище, наприклад, до бензилу. Якщо у описі конкретно не зазначено інше, аралкільна група може бути необов’язково заміщена. «Циклоалкіл» або «карбоциклічне кільце» відноситься до стабільного неароматичного моноциклічного вуглеводневого радикалу, що складається виключно з атомів вуглецю або водню, що містить від трьох до п’ятнадцяти атомів вуглецю, переважно що містить від трьох до десяти атомів вуглецю, який є насиченим або ненасиченим та приєднаний до залишку молекули за допомогою простого зв’язку. Моноциклічні радикали включають, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил та циклооктил. Якщо у описі конкретно не зазначено інше, циклоалкільна група може бути необов’язково заміщена. «Циклоалкілалкіл» відноситься до радикалу формули -RBRD, де RB являє собою алкіленовий ланцюг, такий як визначено вище, та RD являє собою циклоалкільний радикал, такий як визначено вище. Якщо у описі конкретно не зазначено інше, циклоалкілалкільна група може бути необов’язково заміщена. «Галоген-» або «галоген» відноситься до брому, хлору, фтору або йоду. «Галогеналкіл» відноситься до алкільного радикалу, такого як визначено вище, заміщеного одним або більше галогеновими радикалами, такими як визначено вище, наприклад, до трифторметилу, дифторметилу, трихлорметилу, 2,2,2-трифторетилу, 1,2-дифторетилу, 3-бром2-фторпропілу, 1,2-диброметилу тощо. Якщо у описі конкретно не зазначене інше, галогеналкільна група може бути необов’язково заміщена. «Гетероцикліл» або «гетероциклічне кільце» відноситься до стабільного радикалу у формі 318-членного неароматичного кільця, що містить від двох до дванадцяти атомів вуглецю та від одного до шести гетероатомів, вибраних з групи, що складається з азоту, кисню та сірки. У варіантах реалізації, запропонованих у даному описі, гетероциклільний радикал являє собою моноциклічну систему кілець; та гетероциклільний радикал може бути частково або повністю насиченим. Приклади зазначених гетероциклільних радикалів включають, але не обмежуються ними, діоксоланіл, тієніл, [1,3]дитіаніл, імідазолініл, імідазолідиніл, ізотіазолідиніл, ізоксазолідиніл, морфолініл, 2-оксопіперазиніл, 2-оксопіперидиніл, 2-оксопіролідиніл, оксазолідиніл, піперидиніл, піперазиніл, 4-піперидоніл, піролідиніл, піразолідиніл, тіазолідиніл, тетрагідрофурил, тритіаніл, тетрагідропіраніл, тіоморфолініл, тіаморфолініл, 1оксотіоморфолініл та 1,1-діоксотіоморфолініл. Якщо у описі конкретно не зазначено інше, гетероциклільна група може бути необов’язково заміщена. «N-гетероцикліл» відноситься до гетероциклільного радикалу, такого як визначено вище, що містить щонайменше один атом азоту, де гетероциклільний радикал приєднаний до залишку молекули через атом азоту гетероциклільного радикалу. Якщо у описі конкретно не зазначено інше, N-гетероциклільна група може бути необов’язково заміщена. «Гетероциклілалкіл» відноситься до радикалу формули -RBRE, де RB являє собою алкіленовий ланцюг, такий як визначено вище, та RE являє собою гетероциклільний радикал, такий як визначено вище, та якщо гетероцикліл являє собою азот-вмісний гетероцикліл, тоді гетероцикліл може бути приєднаний до алкільного радикалу через атом азоту. Якщо у описі конкретно не зазначено інше, гетероциклілалкільна група може бути необов’язково заміщена. «Гетероарил» відноситься до радикалу у формі 5-14-членної моноциклічної системи кілець, що містить атоми водню, від одного до тринадцяти атомів вуглецю, від одного до шести гетероатомів, вибраних з групи, що складається з азоту, кисню та сірки. Приклади включають, але не обмежуються ними, азепініл, фураніл, фураноніл, ізотіазоліл, імідазоліл, ізоксазоліл, оксадіазоліл, 2-оксоазепініл, оксазоліл, оксираніл, 1-оксидопіридиніл, 1-оксидопіримідиніл, 1оксидопіразиніл, 1-оксидопіридазиніл, піразоліл, піридиніл, піразиніл, піримідиніл, піридазиніл, тіазоліл, тіадіазоліл, триазоліл, тетразоліл, триазиніл, тіофеніл та тієніл. Якщо у описі конкретно не зазначено інше, гетероарильна група може бути необов’язково заміщена. «N-гетероарил» відноситься до гетероарильного радикалу, такого як визначено вище, що містить щонайменше один атом азоту, де гетероарильний радикал приєднаний до залишку молекули за допомогою атому азоту, що входить у склад гетероарильного радикалу. Якщо у описі конкретно не зазначено інше, N-гетероарильна група може бути необов’язково заміщена. «Гетероарилалкіл» відноситься до радикалу формули -RBRF, де RB являє собою алкіленовий ланцюг, такий як визначено вище, та RF являє собою гетероарильний радикал, такий як визначено вище. Якщо у описі конкретно не зазначено інше, гетероарилалкільна група 5 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 60 може бути необов’язково заміщена. Термін «заміщений», використовуваний у даному описі, позначає будь-яку з приведених вище груп (тобто алкіл, алкілен, алкокси, алкіламіно, тіоалкіл, арил, аралкіл, циклоалкіл, циклоалкілалкіл, галогеналкіл, гетероцикліл, N-гетероцикліл, гетероциклілалкіл, гетероарил, N-гетероарил та/або гетероарилалкіл), де щонайменше один атом водню замінений на зв’язок з атомами, відмінними від водню, включаючи, але не обмежуючись ними: атом галогену, такий як F, Cl, Br та I; атом кисню у групах, таких як гідроксильні групи, алкоксигрупи та складноефірні групи; атом сірки у групах, таких як тіольні групи, тіоалкільні групи, сульфонові групи, сульфонільні групи та сульфоксидні групи; атом азоту у групах, таких як аміни, аміди, алкіламіни, діалкіламіни, ариламіни, алкілариламіни, діариламіни, N-оксиди, іміди та енаміни; атом кремнію у групах, таких як триалкілсилільні групи, діалкіларилсилільні групи, алкілдіарилсилільні групи та триарилсилільні групи; та інші гетероатоми, що входять у склад різних груп. «Заміщений» також означає будь-яку з приведених вище груп, у якій один або більше атомів водню замінені на зв’язок більш високого порядку (наприклад, подвійний або потрійний зв’язок) з гетероатомом, таким як кисень у оксо-, карбонільних, карбоксильних та складноефірних групах; та азот у групах, таких як іміни, оксими, гідразони та нітрили. Наприклад, «заміщений» включає будь-які з приведених вище груп, у якій один або більше атомів водню замінені на -NRGRH, -NRGC(=O)RH, -NRGC(=O)NRGRH, -NRGC(=O)ORH, -NRGC(=NRg)NRGRH, -NRGSO2RH, -OC(=O)NRGRH, -ORG, -SRG, -SORG, -SO2RG, -OSO2RG, -SO2ORG, =NSO2RG та -SO2NRGRH. «Заміщений» також означає будь-яку з приведених вище груп, у якій один або більше атомів водню замінені на -C(=O)RG, -C(=O)ORG, -C(=O)NRGRH, -CH2SO2RG, -CH2SO2NRGRH. У приведених вище групах RG та RH є однаковими або різними та незалежно являють собою водень, алкіл, алкокси, алкіламіно, тіоалкіл, арил, аралкіл, циклоалкіл, циклоалкілалкіл, галогеналкіл, гетероцикліл, N-гетероцикліл, гетероциклілалкіл, гетероарил, N-гетероарил та/або гетероарилалкіл. Крім того, «заміщений» означає будь-яку з приведених вище груп, у яких один або більше атомів водню замінені на зв’язок з аміно, ціано, гідроксилом, іміно, нітро, оксо, тіоксо, галогенному, алкілом, алкокси, алкіламіно, тіоалкілом, арилом, аралкілом, циклоалкілом, циклоалкілалкілом, галогеналкілом, гетероциклілом, Nгетероциклілом, гетероциклілалкілом, гетероарилом, N-гетероарилом та/або гетероарилалкільною групою. Крім того, кожен із зазначених вище замісників також може бути необов’язково заміщений одним або більше зазначеними вище замісниками. Термін «захисна група», використовуваний у даному описі, відноситься до лабільного хімічного фрагменту, відомого у даній галузі техніки, використовуваного для захисту реакційноздатних груп, включаючи без обмежень гідроксильні та аміногрупи, від проходження небажаних взаємодій під час способу синтезу. Гідроксильні та аміногрупи, захищені захисною групою, називають у даному описі «захищеними гідроксильними групами» та «захищеними аміногрупами», відповідно. Захисні групи, як правило, використовують для селективного та/або ортогонального захисту ділянок при проведенні взаємодій по іншим реакційноздатним ділянкам, які потім можна видаляти для одержання вихідної незахищеної групи або для проведення додаткових взаємодій. Захисні групи, відомі у даній галузі техніки, у загальному випадку описані у Greene and Wuts, Protective Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, New York (1999). У загальному випадку групи захищають або забезпечують у вигляді попередника, який інертний відносно взаємодій, які приводять до модифікації інших ділянок вихідної молекули, та який перетворюють у кінцеву групу у підходящий час. Типові захисні групи або групи-попередники додатково обговорюють у Agrawal, et al., Protocols for Oligonucleotide Conjugates, Eds, Humana Press; New Jersey, 1994; Vol. 26 pp. 1-72. Приклади «гідроксилзахисних груп» включають, але не обмежуються ними, трет-бутил, трет-бутоксиметил, метоксиметил, тетрагідропіраніл, 1-етоксиетил, 1-(2-хлоретокси)етил, 2-триметилсилілетил, п-хлорфеніл, 2,4динітрофеніл, бензил, 2,6-дихлорбензил, дифенілметил, п-нітробензил, трифенілметил, триметилсиліл, триетилсиліл, трет-бутилдиметилсиліл, трет-бутилдифенілсиліл (TBDPS), трифенілсиліл, бензоїлформіат, ацетат, хлорацетат, трихлорацетат, трифторацетат, півалоат, бензоат, п-фенілбензоат, 9-флуоренілметилкарбонат, мезилат та тозилат. Приклади «амінозахисних груп» включають, але не обмежуються ними, карбаматзахисні групи, такі як 2триметилсилілетоксикарбоніл (Teoc), 1-метил-1-(4-біфеніліл)етоксикарбоніл (Bpoc), третбутоксикарбоніл (BOC), алілоксикарбоніл (Alloc), 9-флуоренілметоксикарбоніл (Fmoc) та бензилоксикарбоніл (Cbz); амідзахисні групи, такі як форміл, ацетил, тригалогенацетил, бензоїл та нітрофенілацетил; сульфонамідзахисні групи, такі як 2-нітробензолсульфоніл; та імін- та циклічний імід-захисні групи, такі як фталімідо та дитіасукциноїл. Також мається на увазі, що винахід, запропонований у даному описі, охоплює всі фармацевтично прийнятні сполуки формули (I), мічені ізотопами, де один або більше атомів замінені на атом, що має відмінну атомну масу або масове число. Приклади ізотопів, які можна 6 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 60 вводити у запропоновані сполуки, включають ізотопи атомів водню, вуглецю, азоту, кисню, 2 3 11 13 14 13 15 15 17 18 31 32 35 фосфору, фтору, хлору та йоду, такі як H, H, C, C, C, N, N, O, O, O, P, P, S, 18 36 123 125 F, Cl, I та I, відповідно. Зазначені мічені сполуки можуть підходити для визначення або вимірювання ефективності сполук за допомогою визначення характеристик, наприклад, місця та способу дії або афінності зв'язування з фармакологічно важливим місцем дії. Певні ізотопномічені сполуки формули (I), наприклад, що містять радіоактивний ізотоп, підходять для досліджень розподілу лікарського засобу та/або субстрату у тканині. Радіоактивні ізотопи, такі 3 14 як тритій, тобто Н, та вуглець-14, тобто С, особливо підходять для цього завдання з урахуванням простоти введення та можливості швидкого детектування. 2 Заміщення більш важкими ізотопами, такими як дейтерій, тобто Н, може забезпечувати певні терапевтичні переваги, обумовлені більш високою метаболічною стабільністю. Наприклад, може бути збільшений період напіввиведення in vivo або знижене необхідне дозування. Таким чином, у деяких випадках більш важкі ізотопи можуть бути кращими. 11 18 15 13 Заміщення ізотопами, що випромінюють позитрони, такими як С, F, Про та N, може підходити для досліджень позитронно-емісійної томографії (ПЕТ) при визначенні ступеня зайнятості рецептору субстратом. Ізотопно-мічені сполуки формули (I) у загальному випадку можна одержувати за допомогою традиційних способів, відомих фахівцям у даній галузі техніки, або за допомогою способів, аналогічних тим, що описані у прикладах, наведених далі, з використанням відповідного ізотопно-міченого реагенту замість неміченого реагенту, використовуваного раніше. Також мається на увазі, що винахід, описаний у даній заявці, охоплює продукти метаболізму in vivo запропонованих сполук. Зазначені продукти можуть бути отримані, наприклад, у результаті окиснення, відновлення, гідролізу, амідування, етерифікації та т.д., сполуки, що вводиться, головним чином, під дією ферментних процесів. Відповідно, винахід включає сполуки, отримані за допомогою способу, що включає введення сполуки у відповідності з даним винаходом ссавцю протягом періоду часу, достатнього для одержання продукту метаболізму. Зазначені продукти, як правило, виявляють шляхом введення міченої сполуки у відповідності з даним винаходом у дозі, що піддається виявленню, тварині, такій як щур, миша, морська свинка, мавпа або людина, забезпечення часу, достатнього для протікання метаболізму, та виділення продуктів конверсії із сечі, крові або інших біологічних зразків. Мається на увазі, що «стабільна сполука» та «стабільна структура» позначає сполуку, яке є досить міцною, щоб витримувати виділення з реакційної суміші до досягнення бажаного ступеня чистоти, та введення до складу ефективного терапевтичного агенту. «Ссавець» включає людину та приручених тварин, таких як лабораторні тварини та свійські тварини (наприклад, кішки, собаки, свині, корови, вівці, кози, коні, кролики), та неприручених тварин, таких як дикі тварини. «Необов’язковий» або «необов'язково» означає, що описане далі явище або умова може відбуватися або не відбуватися, та опис включає випадки, при яких зазначене явище або умова відбувається, та випадки, при яких вона не відбувається. Наприклад, «необов'язково заміщений арил» означає, що арильний радикал може бути заміщеним або незаміщеним, та опис включає заміщені арильні радикали та арильні радикали, що не містять замісників. «Фармацевтично прийнятний носій, розріджувач або допоміжна речовина» включає без обмежень будь-які добавки, носії, допоміжні речовини, гліданти, підсолоджувачі, розріджувачі, консерванти, барвники/забарвлюючі речовини, підсилювачі смаку, поверхнево-активні речовини, зволожувачі, диспергуючі агенти, суспендуючі агенти, стабілізатори, ізотонічні агенти, розчинники або емульгатори, схвалені Управлянням Сполучених Штатів щодо контролю якості харчових продуктів та лікарських засобів для застосування у людини або приручених тварин. «Фармацевтично прийнятна сіль» відноситься до солі сполуки, яка є фармацевтично прийнятною та має (або може бути перетворена у форму, яка має) цільову фармакологічну активність вихідної сполуки. Приклади «фармацевтично прийнятних солей» сполук, запропонованих у даному описі, включають солі, отримані з відповідної основи, такої як лужний + метал (наприклад, натрій), лужноземельний метал (наприклад, магній), амоній та NX 4 (де Х являє собою С1-С4 алкіл). Фармацевтично прийнятні солі атому азоту або аміногрупи включають, наприклад, солі органічних карбонових кислот, таких як оцтова, бензойна, камфорсульфокислота, лимонна, глюкогептонова, глюконова, молочна, фумарова, винна, малеїнова, малонова, яблучна, мигдальна, ізетіонова, лактобіонова, бурштинова, 2нафталінсульфокислота, олеїнова, пальмітинова, пропанова, стеаринова та триметилоцтова кислота; органічних сульфокислот, таких як метансульфокислота, етансульфокислота, бензолсульфокислота та п-толуолсульфокислота; та неорганічних кислот, таких як хлороводнева, бромоводнева, сірчана, азотна, фосфорна та сульфамінова кислоти. 7 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтично прийнятні солі гідроксигрупи сполуки включають аніон зазначеної сполуки у + + комбінації з підходящим катіоном, таким як Na та NX4 (де Х незалежно обраний з Н або С 1-С4 алкільної групи). Фармацевтично прийнятні солі також включають солі, отримані шляхом заміни кислого протона, що присутній у вихідній сполуці, на іон металу, наприклад, іон лужного металу, іон лужноземельного металу або іон алюмінію; або координації з органічною основою, такою як діетаноламін, триетаноламін, N-метилглюкамін та т.д. Також у зазначене визначення включені солі амонію та заміщеного або четвертинного амонію. Типові необмежуючі переліки фармацевтично прийнятних солей можна знайти у S.M. Berge et al., J. Pharma Sci., 66(1), 1-19 (1977), та Remington: The Science and Practice of Pharmacy, R. Hendrickson, ed., 21st edition, Lippincott, Williams & Wilkins, Philadelphia, PA, (2005), p. 732, таблиця 38-5, зміст кожної з яких включено у дану заявку за допомогою посилання. Для терапевтичного застосування солі активних інгредієнтів сполук, запропонованих у даному описі, як правило, повинні бути фармацевтично прийнятними, тобто вони повинні являти собою солі, отримані з фізіологічно прийнятної кислоти або основи. Проте, солі кислот або основ, які не є фармацевтично прийнятними, також можуть знайти застосування, наприклад, при одержанні або очищені сполуки формули (I) або іншої сполуки у відповідності з даним винаходом. Усі солі, отримані з фізіологічно прийнятної кислоти або основи або отримані з іншої кислоти або основи, включені у обсяг даного винаходу. Солі металів, як правило, отримують шляхом взаємодії гідроксиду металу зі сполукою у відповідності з даним винаходом. Прикладами солей металів, які отримують за допомогою + + + зазначеного способу, є солі, що містять Li , Na та K . Менш розчинну сіль металу можна осаджувати з розчину більш розчинної солі шляхом додавання підходящого сполуки металу. Крім того, солі можна одержувати шляхом додавання певних органічних та неорганічних кислот, наприклад, HCl, HBr, H2SO4, H3PO4, або органічних сульфокислот до основних центрів, як правило, до амінів. Нарешті, слід розуміти, що композиції, описані у даній заявці, містять сполуки, запропоновані у даному описі, у неіонізованій формі, а також у формі цвіттер-іону, та комбінації зі стехіометричними кількостями води у вигляді гідратів. Часто при кристалізації отримують сольват сполуки у відповідності з даним винаходом. Згідно із даним описом термін «сольват» відноситься до агрегату, що містить одну або більше молекул сполуки у відповідності з даним винаходом та одну або більше молекул розчиннику. Розчинник може являти собою воду, та у цьому випадку сольват може являти собою гідрат. Альтернативно розчинник може являти собою органічний розчинник. Таким чином, сполуки у відповідності з даним винаходом можуть існувати у вигляді гідрату, включаючи моногідрат, дигідрат, гемігідрат, сесквігідрат, тригідрат, тетрагідрат та т.д., а також відповідних сольватованих форм. Сполука у відповідності з даним винаходом може являти собою справжній сольват, при цьому у інших випадках сполука у відповідності з даним винаходом може містити виключно занесену воду або суміш соди та деякої кількості занесеного розчиннику. «Фармацевтична композиція» відноситься до складу, що містить сполуку у відповідності з даним винаходом та середовище, загальноприйняте у даній галузі техніки для доставки біологічно активної сполуки ссавцю, наприклад, людині. Зазначене середовище включає всі фармацевтично прийнятні носії, розріджувачі або допоміжні речовини. «Ефективна кількість» або «терапевтично ефективна кількість» відноситься до кількості сполуки у відповідності з даним винаходом, яка при введенні пацієнтові, що цього потребує, є достатньою для ефективного лікування хворобливих станів, станів або порушень, при яких можна застосовувати сполуки. Зазначена кількість повинна бути достатньою для прояву біологічного або медичної відповіді у системі тканин або у пацієнта, якого мається на увазі дослідником або лікарем. Кількість сполуки у відповідності з даним винаходом, що відповідає терапевтично ефективній кількості, може бути різною залежно від таких факторів, як сполука та її біологічна активність, композиція, використовувана для введення, час введення, спосіб введення, швидкість виведення сполуки, тривалість лікування, тип хворобливого стану або порушення, що піддають лікуванню, та його важкість, лікарські засоби, використовувані у комбінації або одночасно зі сполуками у відповідності з даним винаходом, та вік, маса тіла, загальний стан здоров'я, стать та раціон пацієнта. Фахівці у даній галузі техніки можуть визначати зазначену терапевтично ефективну кількість за допомогою традиційних способів на підставі власних знань, рівня техніки та даного опису. Мається на увазі, що термін «лікування», використовуваний у даному описі, позначає введення сполуки або композиції у відповідності з даним винаходом для полегшення або усунення симптомів ВІЛ-інфекції та/або зниження вірусного навантаження у пацієнта. Термін «лікування» також охоплює введення сполуки або композиції у відповідності з даним винаходом після впливу вірусу на індивідуума, але перед появою симптомів захворювання та/або перед 8 UA 114351 C2 5 10 15 20 25 30 35 40 45 виявленням вірусу у крові для запобігання появи симптомів захворювання та/або для запобігання досягнення у крові рівня вірусу, що піддається виявленню, а також введення сполуки або композиції у відповідності з даним винаходом для запобігання пренатальної передачі ВІЛ від матері дитині шляхом введення матері, поки вона носить плід, та дитині протягом перших днів життя. Мається на увазі, що термін «противірусний агент», використовуваний у даному описі, позначає агент (сполуку або біологічний агент), який є ефективним відносно пригнічення утворення та/або реплікації вірусу у людини, включаючи, але не обмежуючись ними, агенти, порушуючі механізми, необхідні для утворення та/або реплікації вірусу у людини, у хазяїна або вірусу. Мається на увазі, що термін «інгібітор реплікації ВІЛ», використовуваний у даному описі, позначає агент, здатний знижувати або усувати можливість реплікації ВІЛ у клітині-хазяїні in vitro, ex vivo або in vivo. Сполуки у відповідності з даним винаходом або їх фармацевтично прийнятні солі можуть містити один або більше асиметричних центрів, що, тим самим, уможливлює утворення енантіомерів, діастереомерів та інших стереоізомерних форм, які можуть бути визначені з погляду абсолютної стереохімії як (R)- або (S)- або (D)- або (L)- у випадку амінокислот. Мається на увазі, що у даний винахід включені усі зазначені можливі ізомери, а також їх рацемічні та оптично чисті форми. Оптично активні (+) та (-), (R)- та (S)- або (D)- та (L)-ізомери можна одержувати з використанням хіральних синтонів або хіральних реагентів або розділяти за допомогою традиційних способів, наприклад, шляхом хроматографії та фракційної кристалізації. Традиційні способи одержання/виділення окремих енантіомерів включають хіральний синтез із підходящого оптично чистого попереднику або розділення рацемату (або рацемату солі або похідної), наприклад, шляхом хіральної високоефективної рідинної хроматографії (ВЕРХ). Якщо сполуки, описані у даній заявці, містять олефінові подвійні зв'язки або інші центри геометричної асиметрії, та якщо конкретно не зазначено інше, мається на увазі, що сполуки включають Е- та Z-геометричні ізомери. Крім того, мається на увазі, що включені та всі таутомерні форми. «Стереоізомери» відносяться до сполук, що складаються із однакових атомів, зв'язаних за допомогою однакових зв'язків, але, що мають різні тривимірні структури, які не є взаємозамінними. Даний винахід охоплює різні стереоізомери та їх суміші та включає «енантіомери», які відносяться до двох стереоізомерів, молекули яких є несумісними дзеркальними відбиттями одна іншої. «Таутомер» відноситься до молекули, отриманої шляхом переносу протону на інший атом тієї ж молекули. Даний винахід включає таутомери будь-яких зазначених сполук. «Проліки» відноситься до сполуки, яка модифікована хімічно для ефективного вивільнення вихідного лікарського засобу після подолання біологічних бар'єрів при пероральній доставці. У певних варіантах реалізації даний винахід включає проліки сполук формули (I). Сполуки Як відмічалося вище, у одному з варіантів реалізації даного винаходу запропоновані сполуки, що мають противірусну активність, що мають наступну формулу (I): (I) або їх стереоізомери або фармацевтично прийнятні солі, де: 3 3 X являє собою -О- або -NZ - або -CHZ -; 2 W являє собою -CHZ -; 1 2 3 1 2 1 3 кожен Z , Z та Z незалежно являє собою водень або C1-3 алкіл, або Z та Z або Z та Z , a a a a a a взяті разом, утворюють -L-, причому L являє собою -C(R )2-, -C(R )2C(R )2-, -C(R )2C(R )2C(R )2 9 UA 114351 C2 a 5 10 a a a 1 2 1 3 або -C(R )2C(R )2C(R )2C(R )2-, при цьому щонайменше одна пара з Z та Z або Z та Z , взятих разом, утворює -L-; 4 Z являє собою зв’язок, -СН2- або -СН2СН2-; 1 2 кожен Y та Y незалежно являє собою водень, С1-3 алкіл або С1-3 галогеналкіл; 1 R являє собою феніл, заміщений одним – трьома атомами галогенів; та a кожен R незалежно являє собою водень, галоген, гідроксил або С 1-4 алкіл. У іншому варіанті реалізації запропоновані сполуки, що мають наступну формулу (II-A): (II-A) У іншому варіанті реалізації запропоновані сполуки, що мають наступну формулу (II-B): (II-B) У іншому варіанті реалізації запропоновані сполуки, що мають наступну формулу (II-C): 15 20 25 30 (II-C) a У іншому варіанті реалізації L являє собою -C(R )2-. У додатковому варіанті реалізації L a a являє собою -C(R )2C(R )2-. У додатковому варіанті реалізації L являє собою a a a a -C(R )2C(R )2C(R )2-. У додатковому варіанті реалізації кожен R являє собою водень. У a a додатковому варіанті реалізації один R являє собою метил, а кожен з решти R являє собою a a водень. У додатковому варіанті реалізації один R являє собою галоген, а кожен з решти R a являє собою водень. У додатковому варіанті реалізації два R являють собою галоген, а кожен з a a решти R являє собою водень. У додатковому варіанті реалізації один R являє собою галоген, a а кожен з решти R являє собою водень. У іншому варіанті реалізації Х являє собою -О-. У іншому варіанті реалізації Х являє собою 3 NZ -. У іншому варіанті реалізації Х являє собою -NH-. У іншому варіанті реалізації Х являє 3 1 3 2 собою -CHZ -, а Z та Z , взяті разом, утворюють -L-. У додатковому варіанті реалізації Z являє собою водень. У іншому варіанті реалізації X являє собою -СН2-. 4 4 У іншому варіанті реалізації Z являє собою зв’язок або -СН2-. У іншому варіанті реалізації Z 4 являє собою -СН2-. У іншому варіанті реалізації Z являє собою зв’язок. 1 2 У іншому варіанті реалізації кожен Y та Y незалежно являє собою водень, метил або трифторметил. 10 UA 114351 C2 1 5 10 15 20 25 30 35 40 45 50 У іншому варіанті реалізації R заміщений одним атомом галогену. У додатковому варіанті 1 реалізації R являє собою 4-фторфеніл або 2-фторфеніл. 1 У іншому варіанті реалізації R заміщений двома атомами галогенів. У додатковому варіанті 1 реалізації R являє собою 2,4-дифторфеніл, 2,3-дифторфеніл, 2,6-дифторфеніл, 3-фтор-4хлорфеніл, 3,4-дифторфеніл, 2-фтор-4-хлорфеніл або 3,5-дифторфеніл. У додатковому варіанті 1 реалізації R являє собою 2,4-дифторфеніл. 1 У іншому варіанті реалізації R заміщений трьома атомами галогенів. У додатковому 1 варіанті реалізації R являє собою 2,4,6-трифторфеніл або 2,3,4-трифторфеніл. У додатковому 1 варіанті реалізації R являє собою 2,4,6-трифторфеніл. У одному з варіантів реалізації запропонована фармацевтична композиція, що містить сполуку будь-якої з формул (I), (II-A), (II-B) або (II-C), відмічених вище, або її стереоізомер або фармацевтично прийнятну сіль та фармацевтично прийнятний носій, розріджувач або допоміжну речовину. Запропонований інший варіант реалізації, який включає спосіб лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції, шляхом введення людині терапевтично ефективної кількості сполуки будь-якої з формул (I), (II-A), (II-B) або (II-C), відмічених вище, або фармацевтичної композиції, що містить її. Запропонований інший варіант, який включає спосіб лікування або попередження ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції, шляхом введення людині терапевтично ефективної кількості сполуки будь-якої з формул (I), (II-A), (II-B) або (II-C), відмічених вище, або фармацевтичної композиції, що містить її. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (IIA), (II-B) або (II-C), відмічених вище, або фармацевтичної композиції, що містить її, для лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (II-A), (II-B) або (II-C), відмічених вище, або фармацевтичної композиції, що містить її, для лікування або попередження ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (IIA), (II-B) або (II-C), відмічених вище, або фармацевтичної композиції, що містить її, у медичній терапії. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (IIA), (II-B) або (II-C), відмічених вище, або фармацевтичної композиції, що містить її, для терапевтичного лікування ВІЛ-інфекції. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (II-A), (II-B) або (II-C), відмічених вище, або фармацевтичної композиції, що містить її, для профілактичного або терапевтичного лікування ВІЛ-інфекції. Як відмічалося вище, у іншому варіанті реалізації даного винаходу запропоновані сполуки, що мають противірусну активність, які мають наступну формулу (I): (I) або їх стереоізомери або фармацевтично прийнятні солі, де: 3 3 Х являє собою -О- або -NZ - або -CHZ -; 2 2 W являє собою -О- або -NZ - або -CHZ -; 1 2 3 1 кожен Z , Z та Z незалежно являє собою водень, C1-3 алкіл або C1-3 галогеналкіл, або Z та 2 1 3 a a a Z або Z та Z , взяті разом, утворюють -L-, причому L являє собою -C(R )2-, -C(R )2C(R )2-, a a a a a a a a a a a a -C(R )2C(R )2C(R )2-, -C(R )2C(R )2C(R )2C(R )2-, -C(R )2 °C(R )2-, -C(R )2NR C(R )2-, a a a a a a a a a a a a -C(R )2SC(R )2-, -C(R )2S(O)C(R )2-, -C(R )2SO2C(R )2-, -C(R )2 °C(R )2C(R )2-, -C(R )2C(R )2 °C(R )2-, a a a a a a a a a a a a a a -C(R )2NR C(R )2C(R )2-, -C(R )2C(R )2NR C(R )2-, -C(R )2SC(R )2C(R )2-, -C(R )2C(R )2SC(R )2-, a a a a a a a a a -C(R )2S(O)C(R )2C(R )2-, -C(R )2C(R )2S(O)C(R )2-, -C(R )2SO2C(R )2C(R )2-, a a a a a a a a a -C(R )2C(R )2SO2C(R )2-, -C(R )2SO2NR C(R )2- або -C(R )2NR SO2C(R )2-; 11 UA 114351 C2 4 5 10 15 Z являє собою зв’язок або -CH2-, -CH2CH2-, -CH2CH2CH2-, a -CH2OCH2-, -CH2NR CH2-, -CH2SCH2-,-CH2S(O)CH2- або -CH2SO2CH2-; 1 2 1 2 кожен Y та Y незалежно являє собою водень або С1-3 алкіл, або Y та Y разом з атомом вуглецю, до якого вони приєднані, утворюють карбоциклічне кільце, що містить від 3 до 6 атомів у кільці, або гетероциклічне кільце, що містить від 3 до 6 атомів у кільці, де карбоциклічне або a гетероциклічне кільце необов’язково заміщене одним або більше R ; 1 R являє собою можливо заміщений арил або можливо заміщений гетероарил; та a a кожен R незалежно являє собою водень, галоген, гідроксил або С 1-4 алкіл, або дві групи R разом з атомом вуглецю, до якого вони приєднані, утворюють =О, та 1 2 1 3 при цьому щонайменше одна пара з: (i) Z та Z або Z та Z , взятих разом, утворює -L-; або 1 2 (ii) Y та Y разом з атомом вуглецю, до якого вони приєднані, утворюють карбоциклічне кільце, що містить від 3 до 6 атомів у кільці, або гетероциклічне кільце, що містить від 3 до 6 атомів у кільці. 2 У іншому варіанті реалізації W являє собою -CHZ -. 1 2 1 3 У іншому варіанті реалізації Z та Z або Z та Z , взяті разом, утворюють -L-. У іншому варіанті реалізації запропоновані сполуки, які мають одну з наступних формул (IIA), (II-B) або (II-C): ; 20 (II-A) ; або (II-B) 25 30 , (II-C) a a a a a a де L являє собою -C(R )2-, -C(R )2C(R )2-, -C(R )2C(R )2C(R )2-, a a a a a a a a a a a -C(R )2C(R )2C(R )2C(R )2-, -C(R )2 °C(R )2-, -C(R )2NR C(R )2-, -C(R )2SC(R )2-, a a a a a a a a a a -C(R )2S(O)C(R )2-, -C(R )2SO2C(R )2-, -C(R )2 °C(R )2C(R )2-, -C(R )2C(R )2 °C(R )2-, a a a a a a a a a a a -C(R )2NR C(R )2C(R )2-, -C(R )2C(R )2NR C(R )2-, -C(R )2SC(R )2C(R )2-, a a a a a a a a a -C(R )2C(R )2SC(R )2-, -C(R )2S(O)C(R )2C(R )2-, -C(R )2C(R )2S(O)C(R )2-, a a a a a a a a a -C(R )2SO2C(R )2C(R )2-, -C(R )2C(R )2SO2C(R )2-, -C(R )2SO2NR C(R )2або a a a -C(R )2NR SO2C(R )2-. 1 2 У іншому варіанті реалізації Y та Y разом з атомом вуглецю, до якого вони приєднані, утворюють карбоциклічне кільце, що містить від 3 до 6 атомів у кільці, або гетероциклічне кільце, що містить від 3 до 6 атомів у кільці. 12 UA 114351 C2 У іншому варіанті реалізації запропоновані сполуки, які мають одну з наступних формул (IIIA), (III-B), (III-C) або (III-D): ; 5 (III-A) ; (III-B) ; або (III-C) 10 , (III-D) 1 3 де кожен Z та Z незалежно являє собою водень або С1-3 алкіл. У іншому варіанті реалізації запропоновані сполуки, які мають будь-яку з наступних формул (III-E), (III-F), (III-G) або (III-H): 15 13 UA 114351 C2 ; (III-E) ; (III-F) ; або 5 (III-G) 10 15 , (III-H) 1 3 де кожен Z та Z незалежно являє собою водень або С1-3 алкіл. 1 2 1 3 У іншому варіанті реалізації обидві пари (i) Z та Z або Z та Z , взяті разом, утворюють -L-, 1 2 та (ii) Y та Y разом з атомом вуглецю, до якого вони приєднані, утворюють карбоциклічне кільце, що містить від 3 до 6 атомів у кільці, або гетероциклічне кільце, що містить від 3 до 6 атомів у кільці. У іншому варіанті реалізації запропоновані сполуки, які мають будь-яку з наступних формул (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG) або (IV-AH): 14 UA 114351 C2 ; (IV-AA) ; (IV-AB) ; 5 (IV-AC) ; (IV-AD) ; 10 (IV-AE) 15 UA 114351 C2 ; (IV-AF) ; або (IV-AG) 5 10 15 , (IV-AH) a a a a a a де L являє собою -C(R )2-, -C(R )2C(R )2-, -C(R )2C(R )2C(R )2-, a a a a a a a a a a a -C(R )2C(R )2C(R )2C(R )2-, -C(R )2 °C(R )2-, -C(R )2NR C(R )2-, -C(R )2SC(R )2-, a a a a a a a a a a -C(R )2S(O)C(R )2-, -C(R )2SO2C(R )2-, -C(R )2 °C(R )2C(R )2-, -C(R )2C(R )2 °C(R )2-, a a a a a a a a a a a -C(R )2NR C(R )2C(R )2-, -C(R )2C(R )2NR C(R )2-, -C(R )2SC(R )2C(R )2-, a a a a a a a a a -C(R )2C(R )2SC(R )2-, -C(R )2S(O)C(R )2C(R )2-, -C(R )2C(R )2S(O)C(R )2-, a a a a a a a a a -C(R )2SO2C(R )2C(R )2-, -C(R )2C(R )2SO2C(R )2-, -C(R )2SO2NR C(R )2або a a a -C(R )2NR SO2C(R )2-. У іншому варіанті реалізації запропоновані сполуки, які мають будь-яку з наступних формул (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) або (IV-BH): ; (IV-BA) 16 UA 114351 C2 ; (IV-BB) ; (IV-BC) ; 5 (IV-BD) ; (IV-BE) ; 10 (IV-BF) 17 UA 114351 C2 ; або (IV-BG) 5 10 15 20 25 30 35 , (IV-BH) a a a a a a де L являє собою -C(R )2-, -C(R )2C(R )2-, -C(R )2C(R )2C(R )2-, a a a a a a a a a a a -C(R )2C(R )2C(R )2C(R )2-, -C(R )2 °C(R )2-, -C(R )2NR C(R )2-, -C(R )2SC(R )2-, a a a a a a a a a a -C(R )2S(O)C(R )2-, -C(R )2SO2C(R )2-, -C(R )2 °C(R )2C(R )2-, -C(R )2C(R )2 °C(R )2-, a a a a a a a a a a a -C(R )2NR C(R )2C(R )2-, -C(R )2C(R )2NR C(R )2-, -C(R )2SC(R )2C(R )2-, a a a a a a a a a -C(R )2C(R )2SC(R )2-, -C(R )2S(O)C(R )2C(R )2-, -C(R )2C(R )2S(O)C(R )2-, a a a a a a a a a -C(R )2SO2C(R )2C(R )2-, -C(R )2C(R )2SO2C(R )2-, -C(R )2SO2NR C(R )2або a a a -C(R )2NR SO2C(R )2-. a a a У іншому варіанті реалізації L являє собою -C(R )2-, -C(R )2C(R )2-, a a a a a a a -C(R )2C(R )2C(R )2- або -C(R )2C(R )2C(R )2C(R )2-. У додатковому варіанті реалізації L являє a a a собою -C(R )2-. У додатковому варіанті реалізації L являє собою -C(R )2C(R )2-. У додатковому a a a варіанті реалізації L являє собою -C(R )2C(R )2C(R )2-. У додатковому варіанті реалізації кожен a a R являє собою водень. У додатковому варіанті реалізації один R являє собою метил, а кожен з a a решти R являє собою водень. У додатковому варіанті реалізації один R являє собою галоген, a a а кожен з решти R являє собою водень. У додатковому варіанті реалізації два R являють a собою галоген, а кожен з решти R являє собою водень. У додатковому варіанті реалізації один a a R являє собою галоген, а кожен з решти R являє собою водень. a a a a a У іншому варіанті реалізації L являє собою -C(R )2 °C(R )2-, -C(R )2NR C(R )2-, a a a a a a -C(R )2SC(R )2-, -C(R )2S(O)C(R )2- або -C(R )2SO2C(R )2-. У додатковому варіанті реалізації L a a a являє собою -C(R )2 °C(R )2-. У додатковому варіанті реалізації кожен R являє собою водень. У a a додатковому варіанті реалізації один R являє собою метил, а кожен з решти R являє собою a a водень. У додатковому варіанті реалізації один R являє собою галоген, а кожен з решти R a являє собою водень. У додатковому варіанті реалізації два R являють собою галоген, а кожен з a a решти R являє собою водень. У додатковому варіанті реалізації один R являє собою галоген, a а кожен з решти R являє собою водень. 2 У іншому варіанті реалізації Х являє собою -О-. У додатковому варіанті реалізації Z являє 3 собою водень. У іншому варіанті реалізації Х являє собою -NZ -. У іншому варіанті реалізації Х 3 являє собою -NH-. У іншому варіанті реалізації Х являє собою -CHZ -. У іншому варіанті реалізації Х являє собою -СН2-. 4 4 У іншому варіанті реалізації Z являє собою зв’язок або -СН2- У іншому варіанті реалізації Z 4 являє собою -СН2-. У іншому варіанті реалізації Z являє собою зв’язок. 1 2 У іншому варіанті реалізації кожен Y та Y незалежно являє собою водень, метил або трифторметил. 1 У іншому варіанті реалізації R заміщений одним атомом галогену. У додатковому варіанті 1 реалізації R являє собою 4-фторфеніл або 2-фторфеніл. 18 UA 114351 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 1 У іншому варіанті реалізації R являє собою феніл. У іншому варіанті реалізації R являє собою піридиніл. 1 У іншому варіанті реалізації R заміщений щонайменше одним атомом галогену. 1 У іншому варіанті реалізації R заміщений одним атомом галогену. У додатковому варіанті 1 реалізації R являє собою 4-фторфеніл або 2-фторфеніл. 1 У іншому варіанті реалізації R заміщений двома атомами галогенів. У додатковому варіанті 1 реалізації R являє собою 2,4-дифторфеніл, 2,3-дифторфеніл, 2,6-дифторфеніл, 3-фтор-4хлорфеніл, 3,4-дифторфеніл, 2-фтор-4-хлорфеніл або 3,5-дифторфеніл. У додатковому варіанті 1 реалізації R являє собою 2,4-дифторфеніл. 1 У іншому варіанті реалізації R заміщений трьома атомами галогенів. У додатковому 1 варіанті реалізації R являє собою 2,4,6-трифторфеніл або 2,3,4-трифторфеніл. У додатковому 1 варіанті реалізації R являє собою 2,4,6-трифторфеніл. 1 У іншому варіанті реалізації R являє собою 3-трифторметил-4-фторфеніл або 2циклопропокси-4-фторфеніл. У одному з варіантів реалізації запропонована фармацевтична композиція, що містить сполуку будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IVBC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або її стереоізомер або фармацевтично прийнятну сіль та фармацевтично прийнятний носій, розріджувач або допоміжну речовину. Запропонований інший варіант реалізації, який включає спосіб лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції, шляхом введення людині терапевтично ефективної кількості сполуки будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або фармацевтичної композиції, що містить її. Запропонований інший варіант реалізації, який включає спосіб лікування або попередження ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції, шляхом введення людині терапевтично ефективної кількості сполуки будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IVBC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або фармацевтичної композиції, що містить її. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або фармацевтичної композиції, що містить її, для лікування ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або фармацевтичної композиції, що містить її, для лікування або попередження ВІЛ-інфекції у людини, що має інфекцію або має ризик виникнення інфекції. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або фармацевтичної композиції, що містить її, у медичній терапії. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або фармацевтичної композиції, що містить її, для терапевтичного лікування ВІЛ-інфекції. У іншому варіанті реалізації запропоноване застосування сполуки будь-якої з формул (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), відмічених вище, або фармацевтичної композиції, що містить її, для профілактичного або терапевтичного лікування ВІЛ-інфекції. Слід розуміти, що будь-які варіанти реалізації сполук формули (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), 19 UA 114351 C2 1 5 10 15 a приведених вище, та будь-які конкретні замісники, приведені у даному описі для груп R , R , X, 1 2 1 2 3 4 W, Y , Y , L, Z , Z , Z або Z у сполуках формули (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IVBA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), приведених вище, можна незалежно об’єднати з іншими варіантами реалізації та/або замісниками сполук формули (I), (II-A), (II-B), (II-C), (III-A), (III-B), (III-C), (III-D), (III-E), (III-F), (III-G), (III-H), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH) для утворення варіантів реалізації винаходу, конкретно не приведених вище. Крім того, слід розуміти, що у випадку, якщо у конкретному варіанті реалізації та/або пункті 1 a 1 формули винаходу приведений список замісників для будь-якого конкретного R , R , X, W, Y , 2 1 2 3 4 Y , L, Z , Z , Z або Z , тоді кожен окремий замісник може бути видалений з конкретного варіанту реалізації та/або пункту формули винаходу, та решту списку замісників слід розглядати, як такий, що не виходить за межі обсягу винаходу. Спеціалістам у даній галузі техніки повинно бути зрозуміло, що сполуки формули (I), (II-A), (II-B), (II-C), (IV-AA), (IV-AB), (IV-AC), (IV-AD), (IV-AE), (IV-AF), (IV-AG), (IV-AH), (IV-BA), (IV-BB), 1 2 1 3 (IV-BC), (IV-BD), (IV-BE), (IV-BF), (IV-BG) та (IV-BH), де Z та Z або Z та Z , взяті разом, утворюють -L-, можуть бути показані різним чином. Наприклад, сполука 3 згідно з прикладом 3 може бути показано як: або , 20 33 . 25 30 35 40 45 50 3 Фармацевтичні композиції Що стосується введення, у деяких варіантах реалізації сполуки, описані у даній заявці, вводять як вихідні хімічні речовини або включають до складу фармацевтичних композицій. Фармацевтичні композиції, запропоновані у даному описі, включають сполуку формули (I) та один або більше з: фармацевтично прийнятного носія, розріджувача або допоміжної речовини. Сполука формули (I) є присутньою у композиції у кількості, яка є ефективною для лікування конкретного захворювання або стану. Спеціалісти у даній галузі техніки можуть визначати активність сполук формули (I), наприклад, згідно з описом, наведеним далі у прикладах. Спеціалісти у даній галузі техніки можуть легко визначати відповідні концентрації та дозування. У певних варіантах реалізації сполука формули (I) є присутньою у фармацевтичній композиції у кількості від приблизно 25 мг до приблизно 500 мг. У певних варіантах реалізації сполука формули (I) є присутньою у фармацевтичній композиції у кількості від приблизно 100 мг до приблизно 300 мг. У певних варіантах реалізації сполука формули (I) є присутньою у фармацевтичній композиції у кількості приблизно 25 мг, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг або приблизно 500 мг. Введення сполук у відповідності з даним винаходом або їх фармацевтично прийнятних солей у вихідному вигляді або у складі відповідної фармацевтичної композиції проводять за допомогою будь-якого із загальноприйнятих способів введення агентів, що мають схожу галузь застосування. Фармацевтичні композиції у відповідності з даним винаходом отримують шляхом об'єднання сполуки у відповідності з даним винаходом з відповідним фармацевтично прийнятним носієм, розріджувачем або допоміжною речовиною, а у конкретних варіантах реалізації препарати отримують у вигляді твердих, напівтвердих, рідких або газоподібних форм, таких як таблетки, капсули, порошки, гранули, мазі, розчини, супозиторії, ін'єкції, інгальовані препарати, гелі, мікросфери та аерозолі. Типові способи введення зазначених фармацевтичних композицій включають без обмежень пероральний, місцевий, крізьшкірний, інгаляцію, парентеральний, під'язичний, трансбуккальний, ректальний, вагінальний та інтраназальний. Фармацевтичні композиції у відповідності з даним винаходом отримують таким чином, щоб забезпечувати біодоступність активних інгредієнтів, що містяться у зазначених композиціях, 20 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 після введення композиції пацієнтові. Композиції, які вводять суб’єкту або пацієнтові, мають форму однієї або більше дозованих одиниць, де, наприклад, таблетка може містити одноразове дозування, а контейнер сполуки у відповідності з даним винаходом у вигляді аерозолю може містити сукупність дозованих одиниць. Фактичні способи одержання зазначених лікарських форм відомі або зрозумілі спеціалістам у даній галузі техніки; див., наприклад, Remington: The Science and Practice of Pharmacy, 20th Edition (Philadelphia College of Pharmacy and Science, 2000). Композиція, що вводиться, у будь-якому разі містить терапевтично ефективну кількість сполуки у відповідності з даним винаходом або її фармацевтично прийнятної солі, що підходить для лікування зазначеного захворювання або стану у відповідності з принципами, описаними у даній заявці. Фармацевтичні композиції, запропоновані у даному описі, отримують за допомогою методик, добре відомих у галузі фармацевтики. Наприклад, у певних варіантах реалізації фармацевтичну композицію, призначену для введення шляхом ін'єкції, отримують шляхом об'єднання сполуки у відповідності з даним винаходом зі стерильною дистильованою водою для одержання у такий спосіб розчину. У деяких варіантах реалізації для прискорення утворення гомогенного розчину або суспензії додають поверхнево-активну речовину. Поверхнево-активні речовини являють собою сполуки, які вступають у нековалентну взаємодію зі сполукою у відповідності з даним винаходом та тим самим прискорюють розчинення або однорідне суспендування сполуки у водній системі доставки. Сполуки у відповідності з даним винаходом або їх фармацевтично прийнятні солі вводять у терапевтично ефективній кількості, яка може бути різною залежно від ряду факторів, включаючи активність конкретного застосовуваного сполуки; метаболічну стабільність та тривалість дії сполуки; вік, масу тіла, загальний стан здоров'я, стать та раціон пацієнта; спосіб та час введення; швидкість виведення; комбінацію лікарських засобів; важкість конкретного розладу або стану; та суб'єкта, що піддається терапії. Комбінована терапія У одному з варіантів реалізації запропонований спосіб лікування або попередження ВІЛінфекції у людини, що має інфекцію або має ризик виникнення інфекції, який включає введення людині терапевтично ефективної кількості сполуки, запропонованої у даному описі, або її фармацевтично прийнятної солі у комбінації з терапевтично ефективною кількістю одного або більше додаткових терапевтичних агентів. У одному з варіантів реалізації запропоновані фармацевтичні композиції, що містять сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль у комбінації з одним або більше додатковими терапевтичними агентами та фармацевтично прийнятним носієм, розріджувачем або допоміжною речовиною. У одному з варіантів реалізації запропоновані комбіновані фармацевтичні агенти, що містять сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль у комбінації з одним або більше додатковими терапевтичними агентами. У приведених вище варіантах реалізації додатковий терапевтичний агент може являти собою агент проти ВІЛ. Наприклад, у деяких варіантах реалізації додатковий терапевтичний агент вибраний із групи, що складається з інгібіторів протеази ВІЛ, ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ, інгібіторів некаталітичної ділянки інтегрази ВІЛ (алостеричних інгібіторів), інгібіторів входу (наприклад, інгібіторів CCR5, інгібіторів gp41 (тобто інгібіторів злиття) та інгібіторів приєднання CD4), інгібіторів CXCR4, інгібіторів gp120, інгібіторів G6PD та НАДФН-оксидази, сполук, що спрямовано діють на капсиду ВІЛ («інгібіторів капсиди»; наприклад, інгібіторів полімеризації у капсиді або сполук, що руйнують капсиду, таких як ті, що запропоновані у WO 2013/006738 (Gilead Sciences), заявці на патент США № 2013/0165489 (Університет штату Пенсильванія) та WO 2013/006792 (Pharma Resources)), посилювачів фармакокінетики та інших лікарських засобів для лікування ВІЛ та їх комбінацій. У додаткових варіантах реалізації додатковий терапевтичний агент вибраний з одного або більше агентів, таких як: (1) інгібітори протеази ВІЛ, вибрані з групи, що складається з ампренавиру, атазанавиру, фосампренавиру, індинавиру, лопінавиру, ритонавиру, нелфінавиру, саквінавиру, типранавиру, бреканавиру, дарунавиру, TMC-126, TMC-114, мозенавиру (DMP-450), JE-2147 (AG1776), L756423, RO0334649, KNI-272, DPC-681, DPC-684, GW640385X, DG17, PPL-100, DG35 та AG 1859; (2) ненуклеозидні або ненуклеотидні інгібітори зворотної транскриптази ВІЛ, вибрані з групи, що складається з каправірину, емівірину, делавіридину, ефавіренца, невірапіну, (+) каланоліду 21 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 55 60 А, етравірину, GW5634, DPC-083, DPC-961, DPC-963, MIV-150, TMC-120, рилпівірену, BILR 355 BS, VRX 840773, лерсивірину (UK-453061), RDEA806, KM023 та MK-1439; (3) нуклеозидні інгібітори зворотної транскриптази ВІЛ, вибрані з групи, що складається з зидовудину, емтрицитабіну, диданозину, ставудину, залцитабіну, ламівудину, абакавиру, амдоксовиру, елвуцитабіну, аловудину, MIV-210, (-FTC, D-d4FC, емтрицитабіну, фосфазиду, фозивудину тидоксилу, априцитибіну (AVX754), KP-1461, GS-9131 (Gilead Sciences) та фосалвудину тидоксилу (попередня назва HDP 99.0003); (4) нуклеотидні інгібітори зворотної транскриптази ВІЛ, вибрані з групи, що складається з тенофовиру, тенофовиру дизопроксилу фумарату, тенофовиру алафенаміду фумарату (Gilead Sciences), GS-7340 (Gilead Sciences), GS-9148 (Gilead Sciences), адефовиру, адефовиру дипівоксилу, CMX-001 (Chimerix) або CMX-157 (Chimerix); (5) інгібітори інтегрази ВІЛ, вибрані з групи, що складається з куркумину, похідних куркумину, цикорієвої кислоти, похідних цикорієвої кислоти, 3,5-дикофеїлхінної кислоти, похідних 3,5дикофеїлхінної кислоти, ауринтрикарбонової кислоти, похідних ауринтрикарбонової кислоти, фенетилового ефіру кофеїнової кислоти, похідних фенетилового ефіру кофеїнової кислоти, тирфостину, похідних тирфостину, кверцетину, похідних кверцетину, S-1360, AR-177, L-870812 та L-870810, ралтегравиру, BMS-538158, GSK364735C, BMS-707035, MK-2048, BA 011, елвітегравиру, долутегравиру та GSK-744; (6) інгібітори некаталітичної ділянки інтегрази ВІЛ (NCINI, або алостеричні інгібітори), включаючи, але не обмежуючись ними, BI-224436, CX0516, CX05045, CX14442, сполуки, запропоновані у WO 2009/062285 (Boehringer Ingelheim), WO 2010/130034 (Boehringer Ingelheim), WO 2013/159064 (Gilead Sciences), WO 2012/145728 (Gilead Sciences), WO 2012/003497 (Gilead Sciences), WO 2012/003498 (Gilead Sciences), зміст кожної з яких включено у дану заявку у всій повноті шляхом посилань; (7) інгібітори gp41, вибрані з групи, що складається з енфувіртиду, сифувіртиду, албувіртиду, FB006M та TRI-1144; (8) інгібітор CXCR4 AMD-070; (9) інгібітор входу SP01A; (10) інгібітор gp120 BMS-488043; (11) інгібітор G6PD та НАДФН-оксидази імунітин; (12) інгібітори CCR5, вибрані з групи, що складається з аплавіроку, вікривіроку, маравіроку, ценікривоку, PRO-140, INCB15050, PF-232798 (Pfizer) та CCR5mAb004; (13) інгібітори приєднання CD4, вибрані з групи, що складається з ібалізумабу (TMB-355) та BMS-068 (BMS-663068); (14) посилювачі фармакокінетики, вибрані з групи, що складається з кобіцистату та SPI-452; та (15) інші лікарські засоби для лікування ВІЛ, вибрані з групи, що складається з BAS-100, SPI452, REP 9, SP-01A, TNX-355, DES6, ODN-93, ODN-112, VGV-1, PA-457 (бевіримат), HRG214, VGX-410, KD-247, AMZ 0026, CYT 99007A-221 HIV, DEBIO-025, BAY 50-4798, MDX010 (іпілімумаб), PBS 119, ALG 889 та PA-1050040 (PA-040), та їх комбінації. У певних варіантах реалізації сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль поєднують із двома, трьома, чотирма або більше додатковими терапевтичними агентами. У певних варіантах реалізації сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль поєднують із двома додатковими терапевтичним агентами. У інших варіантах реалізації сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль поєднують із трьома додатковими терапевтичними агентами. У додаткових варіантах реалізації сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль поєднують із чотирма додатковими терапевтичними агентами. Два, три, чотири або більше додаткових терапевтичних агентів можуть являти собою різні терапевтичні агенти, вибрані з одного класу терапевтичних агентів, або вони можуть бути вибрані з різних класів терапевтичних агентів. У конкретному варіанті реалізації сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль поєднують із нуклеотидним інгібітором зворотної транскриптази ВІЛ та ненуклеозидним інгібітором зворотної транскриптази ВІЛ. У іншому конкретному варіанті реалізації сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль поєднують із нуклеотидним інгібітором зворотної транскриптази ВІЛ та сполукою, що інгібує протеазу ВІЛ. У додатковому варіанті реалізації сполуку, запропоновану у даному описі, або її фармацевтично прийнятну сіль поєднують із нуклеотидним інгібітором зворотної транскриптази ВІЛ, ненуклеозидним інгібітором зворотної транскриптази ВІЛ та сполукою, що інгібує протеазу ВІЛ. У додатковому варіанті реалізації сполуку, запропоновану у даному описі, 22 UA 114351 C2 5 10 15 20 25 30 35 40 45 50 або її фармацевтично прийнятну сіль поєднують із нуклеотидним інгібітором зворотної транскриптази ВІЛ, ненуклеозидним інгібітором зворотної транскриптази ВІЛ та підсилювачем фармакокінетики. У певних варіантах реалізації, якщо сполуку, запропоновану у даному описі, поєднують із одним або більше додатковими терапевтичними агентами, такими як описано вище, компоненти композиції вводять відповідно одночасній або послідовній схемі. При послідовному введенні комбінацію можна вводити за дві або більше операцій введення. У певних варіантах реалізації сполуку, запропоновану у даному описі, поєднують із одним або більше додатковими терапевтичними агентами у стандартній лікарській формі для одночасного введення пацієнтові, наприклад, у твердій лікарській формі для перорального введення. У певних варіантах реалізації сполуку, запропоновану у даному описі, вводять разом з одним або більше додатковими терапевтичними агентами. Спільне введення сполуки, запропонованої у даному описі, з одним або більше додатковими терапевтичними агентами у загальному випадку відноситься до одночасного або послідовного введення сполуки, запропонованої у даному описі, та одного або більше додаткових терапевтичних агентів, при якому у організмі пацієнта одночасно присутні терапевтично ефективні кількості сполуки, запропонованої у даному описі, та одного або більше додаткових терапевтичних агентів. Спільне введення включає введення стандартних дозувань сполук, запропонованих у даному описі, до або після введення стандартних дозувань одного або більш додаткових терапевтичних агентів, наприклад, введення сполуки, запропонованої у даному описі, проводять із інтервалом у кілька секунд, хвилин або годин відносно введення одного або більше додаткових терапевтичних агентів. Наприклад, у деяких варіантах реалізації спочатку вводять стандартну дозу сполуки, запропонованої у даному описі, потім з інтервалом кілька секунд або хвилин вводять стандартну дозу одного або більше додаткових терапевтичних агентів. Альтернативно у інших варіантах реалізації спочатку вводять стандартну дозу одного або більше додаткових терапевтичних агентів, потім з інтервалом кілька секунд або хвилин вводять стандартну дозу сполуки, запропонованої у даному описі. У деяких варіантах реалізації спочатку вводять стандартну дозу сполуки, запропонованої у даному описі, потім через кілька годин (наприклад, 1-12 годин) вводять стандартну дозу одного або більше додаткових терапевтичних агентів. У інших варіантах реалізації спочатку вводять стандартну дозу одного або більше додаткових терапевтичних агентів, потім через кілька годин (наприклад, 1-12 годин) вводять стандартну дозу сполуки, запропонованої у даному описі. У наступних прикладах проілюстровані різні способи одержання сполук у відповідності з даним винаходом, тобто сполуки формули (I): (I) 1 1 2 1 2 4 де R , X, W, Y , Y , Z , Z або Z такі, як визначено вище. Слід розуміти, що спеціалісти у даній галузі техніки можуть одержувати зазначені сполуки за допомогою схожих способів або шляхом об'єднання інших способів, відомих спеціалістам у даній галузі техніки. Також слід розуміти, що спеціалісти у даній галузі техніки можуть одержувати і інші сполуки формули (I), конкретним способом не проілюстровані нижче, за допомогою способів, аналогічних тим, що описані нижче, з використанням відповідних вихідних компонентів та за необхідності шляхом модифікації параметрів способу синтезу. У цілому, вихідні компоненти можна одержувати із джерел, таких як Sigma Aldrich, Lancaster Synthesis, Inc., Maybridge, Matrix Scientific, TCI, та Fluorochem USA, та т.д., або синтезувати згідно із джерелами, відомими спеціалістам у даній галузі техніки (див., наприклад, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition (Wiley, December 2000)), або одержувати згідно із даним описом. Наступні приклади наведені для ілюстрації, а не обмеження. ПРИКЛАДИ ЗАГАЛЬНІ СХЕМИ СИНТЕЗУ 23 UA 114351 C2 На схемах 1-3, які запропоновані як додаткові варіанти реалізації винаходу, проілюстровані загальні способи, які використовували для одержання сполук, що мають формулу (I), та які можна застосовувати для одержання додаткових сполук, що мають формулу (I). Схема 1 5 10 15 20 25 30 А1 можна перетворювати у амід А2 з використанням відповідного аміну та реагенту сполучення, такого як HATU або EDCI. А2 можна перетворювати у А3 з використанням сильної кислоти, такої як метансульфокислота. А3 можна перетворювати у А5 або А4 шляхом нагрівання з відповідним циклічним діаміном або циклічним аміноспиртом та наступного видалення метильної захисної групи з використанням реагенту, такого як бромід магнію. Альтернативно А1 можна перетворювати у А6 шляхом обробки сильною кислотою, такою як метансульфокислота. Можна проводити конденсацію А6 з відповідним циклічним діаміном або циклічним аміноспиртом, потім видаляти метильну захисну групу з використанням реагенту, такого як бромід магнію, з утворенням А7 або А8, відповідно. А7 або А8 можна перетворювати у аміди А5 та А4 шляхом обробки відповідним аміном та реагентом сполучення, таким як HATU або EDCI, та наступного видалення метильної захисної групи з використанням реагенту, такого як бромід магнію. Схема 2 Проводять конденсацію В1 (такого як описано у WO2012/018065) з діаміном в умовах кип’ятіння із зворотним холодильником з одержанням В2. Проводять гідроліз В2 та сполучення 24 UA 114351 C2 5 з аміном за допомогою способу утворення аміду з одержанням продукту В3 після видалення бензильної захисної групи. ТИПОВІ СПОЛУКИ Приклад 1 Одержання сполуки 1 N-(2,4-дифторбензил)-8-гідрокси-7,9-діоксо-2,3,4,5,7,9,13,13a-октагідро-2,5метанопіридо[1',2':4,5]піразино[2,1-b][1,3]оксазепін-10-карбоксамід 1 (+/-) 10 15 20 25 30 35 40 Стадія 1 1-(2,2-диметоксиетил)-5-метокси-6-(метоксикарбоніл)-4-оксо-1,4-дигідропіридин-3-карбонову кислоту (1-А, 0,300 г, 0,95 ммоль), отриману відповідно до опису WO2011/119566 А1, один раз випарювали з сухого толуолу, суспендували у ацетонітрилі (4 мл) та обробляли N,Nдіізопропілетиламіном (DIPEA) (0,329 мл, 1,90 ммоль), 2,4-дифторбензиламіном (0,125 мл, 1,05 ммоль) та HATU (0,433 г, 1,14 ммоль). Реакційну суміш перемішували впродовж 10 хвилин та концентрували. Залишок очищали шляхом флеш-хроматографії на силікагелі (від 10 до 60% етилацетат:дихлорметан) з одержанням метил-5-(2,4-дифторбензилкарбамоїл)-1-(2,21 диметоксиетил)-3-метокси-4-оксо-1,4-дигідропіридин-2-карбоксилату, 1-В. H ЯМР (400 МГц, ДМСО-d6) δ 10,28 (t, J = 6,0 Гц, 1H), 8,46 (s, 1H), 7,42 (dd, J = 15,4, 8,6 Гц, 1H), 7,24 (m, 1H), 7,06 + (m, 1H), 4,52 (m, 3H), 4,22 (d, J = 4,4 Гц, 2H), 3,92 (s, 3H), 3,80 (s, 3H), 3,29 (d, 6H). РХМС-ІЕР + (m/z): [M+H] розрахунок для C20H23F2N2O7: 441,15; експеримент: 441,2. Стадія 2 Метил-5-(2,4-дифторбензилкарбамоїл)-1-(2,2-диметоксиетил)-3-метокси-4-оксо-1,4дигідропіридин-2-карбоксилат (1-В, 0,106 г, 0,24 ммоль) у ацетонітрилі (0,9 мл) та оцтовій кислоті (0,1 мл) обробляли метансульфокислотою (0,005 мл, 0,072 ммоль), закривали жовтою пробкою та нагрівали до 70 °C. Через 16 годин охолоджували суміш з одержанням неочищеного розчину метил-5-(2,4-дифторбензилкарбамоїл)-1-(2,2-дигідроксиетил)-3-метокси-4-оксо-1,4+ + дигідропіридин-2-карбоксилату, 1-С. РХМС-ІЕР (m/z): [M+H] розрахунок для C18H19F2N2O7: 413,12; експеримент: 413,1. Стадії 3 та 4 Метил-5-(2,4-дифторбензилкарбамоїл)-1-(2,2-дигідроксиетил)-3-метокси-4-оксо-1,4дигідропіридин-2-карбоксилат (1-С, 0,65 мл неочищеної суміші, отриманої на попередній стадії, 0,17 ммоль) обробляли ацетонітрилом (0,65 мл) та цис-3-аміноциклопентанолом (0,06 мл). Закривали реакційну суміш та нагрівали до 90 °C. Через 30 хвилин охолоджували реакційну суміш та додавали бромід магнію (0,063 г, 0,34 ммоль). Повторно закривали суміш та нагрівали до 50 °C. Через 10 хвилин розділяли реакційну суміш у дихлорметані та хлороводневій кислоті (0,2М, водн.). Видаляли органічний шар та знову екстрагували водний шар дихлорметаном. Об’єднані органічні шари сушили над сульфатом натрію, фільтрували та концентрували. 25 UA 114351 C2 5 10 Очищення шляхом препаративної ВЕРХ (30-70% ацетонітрил:вода, 0,1% ТФОК) приводило до 1 одержання сполуки 1 у вигляді рацемічної суміші. H ЯМР (400 МГц, ДМСО-d6) δ 12,45 (шир.s, 1H), 10,35 (t, J = 5,8 Гц, 1H), 8,45 (s, 1H), 7,37 (dd, J = 15,4, 8,6 Гц, 1H), 7,23 (dt, J = 2,5, 9,9 Гц, 1H), 7,05 (dt, J = 2,2, 8,7 Гц, 1H), 5,43 (dd, J = 9,6, 4,0 Гц, 1H), 5,09 (шир.s, 1H), 4,68 (dd, J = 13,2, 4,0 Гц, 1H), 4,59 (шир.s, 1H), 4,53 (m, 2H), 4,02 (dd, J = 12,6, 9,4 Гц), 1,93 (шир.s, 4H), 1,83 (d, J = + + 12,0 Гц), 1,57 (dt, J = 12,2, 3,2 Гц). РХМС-ІЕР (m/z): [M+H] розрахунок для C21H20F2N3O5: 432,14; експеримент: 432,2. Приклади 2 та 3 Одержання сполук 2 та 3 (2R,5S,13aR)-N-(2,4-дифторбензил)-8-гідрокси-7,9-діоксо-2,3,4,5,7,9,13,13a-октагідро-2,5метанопіридо[1',2':4,5]піразино[2,1-b][1,3]оксазепін-10-карбоксамід (2) та (2S,5R,13aS)-N-(2,4дифторбензил)-8-гідрокси-7,9-діоксо-2,3,4,5,7,9,13,13a-октагідро-2,5метанопіридо[1',2':4,5]піразино[2,1-b][1,3]оксазепін-10-карбоксамід (3) 2 3 15 20 25 Сполуку 1 (16 мг) розділяли шляхом хіральної ВЕРХ з використанням Chiralpak AS-H та 100% етанолу як елюенту з одержанням сполук 2 та 3 у вигляді форм, збагачених окремими + + енантіомерами. Сполука 2: РХМС-ІЕР (m/z): [M+H] розрахунок для C21H20F2N3O5: 432,14; експеримент: 432,2, Хіральна ВЕРХ час утримання = 4,50 хвилини (Chiralpak AS-H, 150 x 4,6 мм, + + 1 мл/хвил. EtOH). Сполука 3: РХМС-ІЕР (m/z): [M+H] розрахунок для C21H20F2N3O5: 432,14; експеримент: 432,2, Хіральна ВЕРХ час утримання = 6,84 хвилини (Chiralpak AS-H, 150 x 4,6 мм, 1 1 мл/хвил. EtOH). H ЯМР (400 МГц, ДМСО-d6) δ 12,45 (шир.s, 1H), 10,35 (t, J = 5,8 Гц, 1H), 8,44 (s, 1H), 7,37 (dd, J = 15,2, 8,4 Гц, 1H), 7,23 (m, 1H), 7,05 (dt, J = 1,8 Гц, 8,7 Гц, 1H), 5,44 (dd, J = 9,6, 4,0 Гц), 5,09 (шир.s, 1H), 4,68 (dd, J = 12,8, 4,0 Гц, 1H), 4,59 (шир.s, 1H), 4,53 (m, 2H), 4,02 (dd, J = 12,6, 9,4 Гц, 1H), 1,93 (шир.s, 4H), 1,83 (d, J = 12,4 Гц, 1H), 1,57 (m, 1H). Альтернативно сполуку 3 отримували наступним чином: Колонка AD-H для хіральної SFC 26 UA 114351 C2 5 10 15 20 25 Метил-5-(2,4-дифторбензилкарбамоїл)-1-(2,2-дигідроксиетил)-3-метокси-4-оксо-1,4дигідропіридин-2-карбоксилат (1-С, 1,2 ммоль у 5 мл суміші 9:1 ацетонітрил:оцтова кислота, що містить 0,026 мл метансульфокислоти) обробляли ацетонітрилом (5,0 мл) та цис-3аміноциклопентанолом (0,24 г, 2,4 ммоль). Закривали реакційну суміш та нагрівали до 90 °C. Через 30 хвилин охолоджували реакційну суміш, обробляли карбонатом калію (0,332 г, 2,4 ммоль), закривали та повторно нагрівали до 90 °C. Через 15 хвилин охолоджували суміш та розділяли у дихлорметані та хлороводневій кислоті (0,2М, водн.). Видаляли органічний шар та знову екстрагували водний розчин дихлорметаном. Об’єднані органічні шари сушили над сульфатом натрію (безводним), фільтрували та концентрували. Залишок очищали шляхом флеш-хроматографії (0-8% етанолу (що містить 11% насичений водний гідроксид амонію) у + + дихлорметані) з одержанням проміжної сполуки 1-D. РХМС-ІЕР (m/z): [M+H] розрахунок для C22H22F2N3O5: 446,15; експеримент: 446,2. Проміжну сполуку 1-D (270 мг) розділяли шляхом хіральної SFC на 50 мм колонці Chiralpak AD-H з використанням 50% (1:1 метанол:ацетонітрил) у надкритичному діоксиді вуглецю як елюенту з одержанням проміжних сполук 3-А (перший пік елюювання) та 3-В (другий пік + + елюювання) у формах, збагачених окремими енантіомерами. 3-A: РХМС-ІЕР (m/z): [M+H] + + розрахунок для C22H22F2N3O5: 446,15; експеримент: 446,2. 3-B: РХМС-ІЕР (m/z): [M+H] розрахунок для C22H22F2N3O5: 446,15; експеримент: 446,2. Проміжну сполуку 3-А (0,110 г, 0,247 ммоль) у ацетонітрилі (5 мл) обробляли частинами бромідом магнію (0,091 г, 0,494 ммоль), закривали та нагрівали до 50 °C. Через 10 хвилин охолоджували суміш та розділяли у дихлорметані та хлороводневій кислоті (0,2М, водн.). Відділяли органічний шар, а водний шар знову екстрагували дихлорметаном. Об’єднані органічні шари сушили над сульфатом натрію, фільтрували та концентрували. Очищення 27 UA 114351 C2 5 10 15 20 25 30 35 шляхом препаративної ВЕРХ (30-70% ацетонітрил:вода, 0,1% ТФОК) приводило до одержання сполуки 3 у формі, збагаченій окремим енантіомером. Хіральна ВЕРХ час утримання = 6,51 + + хвилини (Chiralpak AS-H, 150 x 4,6 мм, 1 мл/хвил. EtOH). РХМС-ІЕР (m/z): [M+H] розрахунок 1 для C21H20F2N3O5: 432,14; експеримент: 432,2. H ЯМР (400 МГц, ДМСО-d6) δ 12,45 (шир.s, 1H), 10,35 (t, J = 5,8 Гц, 1H), 8,44 (s, 1H), 7,37 (dd, J = 15,2, 8,4 Гц, 1H), 7,23 (m, 1H), 7,05 (dt, J = 1,8 Гц, 8,7 Гц, 1H), 5,44 (dd, J = 9,6, 4,0 Гц), 5,09 (шир.s, 1H), 4,68 (dd, J = 12,8, 4,0 Гц, 1H), 4,59 (шир.s, 1H), 4,53 (m, 2H), 4,02 (dd, J = 12,6, 9,4 Гц, 1H), 1,93 (шир.s, 4H), 1,83 (d, J = 12,4 Гц, 1H), 1,57 (m, 1H). Приклад 4 Одержання сполуки 4 (1S,4R)-N-(2,4-дифторбензил)-7-гідрокси-6,8-діоксо-3,4,6,8,12,12a-гексагідро-2H-1,4метанопіридо[1',2':4,5]піразино[1,2-a]піримідин-9-карбоксамід 4 Метил-5-(2,4-дифторбензилкарбамоїл)-1-(2,2-дигідроксиетил)-3-метокси-4-оксо-1,4дигідропіридин-2-карбоксилат (1-С, 0,12 ммоль у 0,53 мл суміші 9:1 ацетонітрил:оцтова кислота, що містить 0,002 мл метансульфокислоти) обробляли ацетонітрилом, потім (R)-піролідин-3аміном (0,032 мл, 0,36 ммоль). Закривали реакційну суміш та нагрівали до 90 °C впродовж 5,5 години. Після охолодження суміш розділяли у дихлорметані та бікарбонаті натрію (1М, водн.). Відділяли органічний шар, а водний шар знову екстрагували етилацетатом. Об’єднані органічні шари сушили над сульфатом натрію (безводним), фільтрували та концентрували. Залишок розчиняли у ацетонітрилі (1 мл), обробляли бромідом магнію (0,022 г, 0,12 ммоль), закривали та нагрівали до 50 °C впродовж 10 хвилин. Після охолодження суміш розділяли у дихлорметані та хлориді амонію (нас.). Відділяли органічний шар, а водний шар знову екстрагували дихлорметаном. рН водного шару доводили до рН=1 за допомогою HCl (водн.) та знову екстрагували дихлорметаном. рН водного розчину доводили до рН=3 за допомогою NaOH (водн.) та знову екстрагували дихлорметаном. Об’єднані органічні шари сушили над сульфатом натрію, фільтрували та концентрували. Очищення шляхом препаративної ВЕРХ (10-55% 1 ацетонітрил:вода, 0,1% ТФОК) приводило до одержання сполуки 4. H ЯМР (400 МГц, CD3ODd4) δ 8,42 (s, 1H), 7,42, (q, J = 7,7 Гц, 1H), 6,99 – 6,90(m, 2H), 5,07 (шир.s, 1H), 4,73 (шир.d, J = 10,8 Гц, 1H), 4,62 (s, 2H), 4,51 (шир.d, J = 12,8 Гц, 1H), 4,07 (t, J = 11,8 Гц, 1H), 3,4- 3,0 (m, 3H), + + 2,76 (шир.d, J = 8,8 Гц, 1H), 2,15-2,0 (m, 1H), 1,9-1,8 (m, 1H). РХМС-ІЕР (m/z): [M+H] розрахунок для C20H19F2N4O4: 417,14; експеримент: 417,2. Приклад 5 Одержання сполуки 5 (4R,12aS)-N-(1-(2,4-дифторфеніл)циклопропіл)-7-гідрокси-4-метил-6,8-діоксо-3,4,6,8,12,12aгексагідро-2H-[1,3]оксазино[3,2-d]піридо[1,2-a]піразин-9-карбоксамід 5 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPolycyclic-carbamoylpyridone compounds and their pharmaceutical use
Автори англійськоюJin, Haolun, Lazerwith, Scott, E., Trejo Martin, Teresa, Alejandra, Bacon, Elizabeth, M., Cottell, Jeromy, J., CAI, Zhenhong, R., Pyun, Hyung-Jung, Morganelli, Philip, Anthony, JI, Mingzhe, Taylor, James, G., Chen, Xiaowu, Mish, Michael, R., Desai, Manoj, C.
Автори російськоюДжин Хаолун, Лазервит Скотт Е., Трехо Мартин Тереза Алехандра, Бэкон Элизабет М., Коттэлл Джэроми Дж., Цай Чженьхун Р., Пиун Хиунг-Джунг, Морганелли Филип Энтони, Цзи Минчже, Тэйлор Джэймс Г., Чэнь Сяоу, Миш Майкл Р., Дизай Маной К.
МПК / Мітки
МПК: C07D 498/14, C07D 471/04, C07D 471/22, C07D 487/04, C07D 471/14
Мітки: застосування, карбамоїлпіридонові, поліциклічні, фармацевтичне, сполуки
Код посилання
<a href="https://ua.patents.su/127-114351-policiklichni-karbamolpiridonovi-spoluki-ta-kh-farmacevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Поліциклічні карбамоїлпіридонові сполуки та їх фармацевтичне застосування</a>
Попередній патент: Штам бактерій lactobacillus delbrueckii для оброблення бджолиного пилку
Наступний патент: Бульдозерне обладнання
Випадковий патент: Тартратна сіль похідної тіазолідиндіону