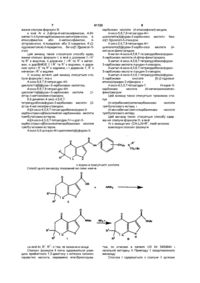
Спосіб одержання піролоамідів і фураноамідів
Номер патенту: 61123
Опубліковано: 17.11.2003
Автори: Конрад Елісон Кей, Янг Грегорі Рендолл, Кліффорд Памела Джейн, Кволліч Джордж Джозеф, Реган Джон Ентоні, Маковскі Тереза Вудалл, Ам Енде Девід Джон, Аллен Дуглас Джон Мелдрум, Ейсенбейс Шейн Аллен
Формула / Реферат
1. Спосіб одержання піролоамідів формули III:
в якій R1 і R2 незалежно вибирають з водню і С1-С6алкілу; і Аr є фенілом або гетероциклом; або фенілом або гетероциклом заміщеним до трьох замісників вибраних з С1-С6алкілу, С1-С6алкенілу, С1-С6перфторалкілу, С1-С6алкокси, С1-С6перфторалкокси, F, СІ, Br, -O-(CH2)k-O- або -(CH2)mNR1R2; або Аr є 4-(N-метил-N-трет-бутилкарбоксіамінометил)фенілом, де
n є цілим числом від 0 до 2;
m є цілим числом від 0 до 6; і
k дорівнює 1 або 2;
під час якого здійснюють реакцію сполуки формули І:
в якій R1, R2, Аr, n, m і k є такими як було визначено раніше, з надлишком джерела амонію в реакційно інертному розчиннику при підвищеній температурі до повного завершення реакції одержання сполуки формули III.
2. Спосіб одержання фураноамідів формули І:
в якій R1 і R2 незалежно вибирають з водню і С1-С6алкілу; і Аr є фенілом або гетероциклом; або фенілом або гетероциклом заміщеним до трьох замісників вибраних з С1-С6алкілу, С2-С6алкенілу, С1-С6перфторалкілу, С1-С6алкокси, С1-С6перфторалкокси, F, Сl, Br, -O-(CH2)k-O- або -(CH2)mNR1R2; або Аr є 4-(N-метил-N-трет-бутилкарбоксіамінометил)фенілом, де
n є цілим числом від 0 до 2;
m є цілим числом від 0 до 6; і
k дорівнює 1 або 2;
під час якого здійснюють:
1) реакцію сполуки формули II:
з надлишком хлорангідриду кислоти або ангідридом в реакційно інертному розчиннику, що містить надлишок кислотного акцептора до повного завершення реакції;
2) додавання еквівалентної кількості NH2-Ar до розчину стадії 1 і витримування до повного завершення реакції.
3. Спосіб згідно з пунктом 1, в якому Аr вибирають з групи, що містить 2-фтор-4-метоксифеніл, 4-(N-метил-N-трет-бутилкарбоксіамінометил)феніл, 4-етоксифеніл або 4-метоксифеніл, 4-фторфеніл, 4-піридил або 3-піридил, 6-(2-гідроксіетокси)-3-піридил і бензо[1,3]діоксол-5-іл.
4. Спосіб згідно з пунктом 1, в якому n дорівнює 2 і R1 та R2 обидва є воднем.
5. Спосіб згідно з пунктом 1, в якому n дорівнює 1 і R1 та R2 обидва є метилом.
6. Спосіб згідно з пунктом 1, в якому n дорівнює 1 і R1 та R2 обидва є воднем.
7. Спосіб згідно з пунктом 1, в якому n дорівнює нулю і R1 та R2 обидва є воднем.
8. Спосіб згідно з пунктом 1, в якому n дорівнює 1, R1 є метилом і R2 є воднем.
9. Спосіб згідно з пунктом 1, в якому Аr є 4-(N-метил-N-трет-бутилкарбоксіамінометил)фенілом, при якому додатково здійснюють реакцію продукту згідно з пунктом 1 з водою в присутності кислоти.
10. Спосіб згідно з пунктом 2, в якому згаданим хлорангідридом кислоти є етилхлорформіат.
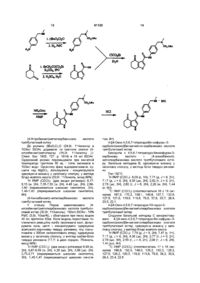
11. Сполука вибрана з групи, що містить:
4-оксо-5,6,7,8-тетрагідро-4Н-циклогепта[b]фуран-3-карбонову кислоту,
4-оксо-5,6,7,8-тетрагідро-4Н-циклогепта[b]фуран-3-карбонової кислоти (2-фтор-4-метоксифеніл)амід,
6,6-диметил-4-оксо-4,5,6,7-тетрагідробензофуран-3-карбонової кислоти (2-фтор-4-метоксифеніл)амід,
трет-бутиловий естер 4-[(4-оксо-4,5,6,7-тетрагідробензофуран-3-карбоніл)аміно]бензилметилкарбамінової кислоти,
4-оксо-5,6-дигідро-4Н-циклопента[b]фуран-3-карбонової кислоти (4-етоксифеніл)амід,
4-оксо-5,6,7,8-тетрагідро-4Н-циклогепта[b]фуран-3-карбонової кислоти бензо[1,3]діоксол-5-іламід,
4-оксо-5,6,7,8-тетрагідро-4Н-циклогепта[b]фуран-3-карбонової кислоти (4-метоксифеніл)амід,
6-метил-4-оксо-4,5,6,7-тетрагідробензофуран-3-карбонової кислоти (4-фторфеніл)амід,
6-метил-4-оксо-4,5,6,7-тетрагідробензофуран-3-карбонової кислоти піридин-4-іламід,
6-метил-4-оксо-4,5,6,7-тетрагідробензофуран-3-карбонової кислоти піридин-3-іламід і
6-метил-4-оксо-4,5,6,7-тетрагідробензофуран-3-карбонової кислоти [6-(2-гідроксіетокси)піридин-3-іл]амід.
12. Трет-бутиловий естер 4-[(4-оксо-4,5,6,7-тетрагідро-1Н-індол-3-карбоніл)аміно]бензилметилкарбамінової кислоти.
Текст
1 Спосіб одержання піролоамідів формули III NHAr NH 1 2 в якій R і R незалежно вибирають з водню і d Сєалкілу, і Аг є фенілом або гетероциклом, або фенілом або гетероциклом заміщеним до трьох замісників вибраних з Сі-Сєалкілу, Сі-Сєалкенілу, Сі-Сбперфторалкілу, Сі-Сєалкокси, dСбперфторалкокси, F, СІ, Br, -O-(CH2)k-O- або (CH 2 ) m NR R2, або Аг є 4-(М-метил-ІЧ-третбутилкарбоксіамшометил)фенілом, де п є цілим числом від 0 до 2, m є цілим числом від 0 до 6, і k дорівнює 1 або 2, під час якого здійснюють реакцію сполуки формули І в якій R1, R2, Аг, n, m і k є такими як було визначено раніше, з надлишком джерела амонію в реакційно інертному розчиннику при підвищеній температурі до повного завершення реакції одержання сполуки формули III 2 Спосіб одержання фураноамідів формули І NHAr О в якій R1 і R2 незалежно вибирають з водню і d Сєалкілу, і Аг є фенілом або гетероциклом, або фенілом або гетероциклом заміщеним до трьох замісників вибраних з Сі-Сєалкілу, Сг-Сєалкенілу, Сі-Сбперфторалкілу, Сі-Сєалкокси, dСєперфторалкокси, F, СІ, Br, -O-(CH2)k-O- або (CH2)mNR R2, або Аг є 4-(М-метил-ІЧ-третбутилкарбоксіамшометил)фенілом, де п є цілим числом від 0 до 2, m є цілим числом від 0 до 6, і k дорівнює 1 або 2, під час якого здійснюють 1) реакцію сполуки формули II C O (О 61123 з надлишком хлорангідриду кислоти або 4-оксо-5,6,7,8-тетрапдро-4Н-циклогепта[Ь]фуранангідридом в реакційно інертному розчиннику, що 3-карбонову кислоту, містить надлишок кислотного акцептора до повно4-оксо-5,6,7,8-тетрапдро-4Н-циклогепта[Ь]фуранго завершення реакції, 3-карбоновоі кислоти (2-фтор-42) додавання еквівалентної КІЛЬКОСТІ ІЧНг-Аг до метоксифеніл)амід, розчину стадії 1 і витримування до повного завер6,6-диметил-4-оксо-4,5,6,7-тетрапдробензофураншення реакції 3-карбоновоі кислоти (2-фтор-4З Спосіб згідно з пунктом 1, в якому Аг вибирають метоксифеніл)амід, 3 групи, що містить 2-фтор-4-метоксифеніл, 4-(Nтрет-бутиловий естер 4-[(4-оксо-4,5,6,7метил-г\І-трет-бутилкарбоксіамінометил)феніл, 4тетрапдробензофуран-3етоксифеніл або 4-метоксифеніл, 4-фторфеніл, 4карбоніл)амшо]бензил метил карбамінової кислоти, піридил або 3-піридил, 6-(2-пдроксіетокси)-34-оксо-5,6-дипдро-4Н-циклопента[Ь]фуран-3піридил і бензо[1,3]дюксол-5-іл карбонової кислоти (4-етоксифеніл)амід, 4 Спосіб згідно з пунктом 1, в якому п дорівнює 2 і 4-оксо-5,6,7,8-тетрапдро-4Н-циклогепта[Ь]фуранR 1 та R2 обидва є воднем 3-карбоновоі кислоти бензо[1,3]дюксол-5-іламід, 5 Спосіб згідно з пунктом 1, в якому п дорівнює 1 і 4-оксо-5,6,7,8-тетрапдро-4Н-циклогепта[Ь]фуранR1 та R2 обидва є метилом 3-карбоновоі кислоти (4-метоксифеніл)амід, 6 Спосіб згідно з пунктом 1, в якому п дорівнює 1 і 6-метил-4-оксо-4,5,6,7-тетрапдробензофуран-3R 1 та R2 обидва є воднем карбонової кислоти (4-фторфеніл)амід, 7 Спосіб згідно з пунктом 1, в якому п дорівнює 6-метил-4-оксо-4,5,6,7-тетрапдробензофуран-3нулю і R1 та R2 обидва є воднем карбонової кислоти піридин-4-іламід, 8 Спосіб згідно з пунктом 1, в якому п дорівнює 1, 6-метил-4-оксо-4,5,6,7-тетрапдробензофуран-3R1 є метилом і R2 є воднем карбонової кислоти піридин-3-іламід і 9 Спосіб згідно з пунктом 1, в якому Аг є 4-(N6-метил-4-оксо-4,5,6,7-тетрапдробензофуран-3метил-г\І-трет-бутилкарбоксіамшометил)фенілом, карбонової кислоти [6-(2-пдроксіетокси)піридин-3при якому додатково здійснюють реакцію продукту іл]амід згідно з пунктом 1 з водою в присутності кислоти 12 Трет-бутиловий естер 4-[(4-оксо-4,5,6,710 Спосіб згідно з пунктом 2, в якому згаданим тетрапдро-1 Н-індол-3хлорангідридом кислоти є етилхлорформіат карбоніл)амшо]бензил метил карбамінової кислоти 11 Сполука вибрана з групи, що містить Цей винахід стосується способу синтезу нових заміщених піролкарбоксамідів, які селективно зв'язують ГАБК рецептори Цей винахід також стосується проміжних продуктів для синтезу таких сполук Сполуки, що зв'язують ГАБК рецептори використовуються при лікуванні неспокою, захворювань сну та припадків, передозування при прийомі похідних бензодіазепіну і підсиленій настороженості Опис попереднього рівня техніки у-Амінобутанова кислота (ГАБК) є одним із основних інгібіторів амінокислотного перетворення у мозку ссавців Понад ЗО років пройшло з того часу, коли була встановлена и присутність у мозку (Roberts & Frankel, J Biol Chem 187 55-63, 1950, Udenfnend, J ВЫ Chem 187 65-69, 1950) 3 того часу, багато зусиль було витрачено на дослідження впливу ГАБК на етіологію припадків, захворювань сну, неспокою і пізнавальну здатність (Tallman і Gallager, Ann Rev Neuroscience 8 21-44, 1985) Широко розповсюджений у мозку ссавців, але не всюди в однаковій КІЛЬКОСТІ, ГАБК, як вважають деякі, відповідає за передачу приблизно 30% синаптичних сигналів у мозку В більшості регіонах мозку, ГАБК виступає в якості місцевого інгібітору нейронів і тільки в двох регіонах ГАБК виступає в якості більш довгих проекцій ГАБК займає проміжне положення в багатьох процесах, шляхом участі в комплексах протеїнів локалізованих, як у клітинах тіла, так і у нервових закінченнях, що є так званими ГАБКа рецепторами Пост синаптична ВІДПОВІДЬ на ГАБК встановлюється шляхом зміни хлоридної провідності, що в основному, але не завжди, приводить до пперполяризацм клітин Недавні досліди показали, що комплекси протеїнів, що залежать від постсинаптичної ГАБК ВІДПОВІДІ є основними місцем дії ряду структурно незалежних сполук, здатних до модифікації постсинаптичної ВІДПОВІДІ на ГАБК В залежності від виду взаємодії, ці сполуки здатні проявляти деякий спектр активності (або седативну, анксиолітичну і антиконвульсативну, або пригнічуючу, викликаючу виникнення припадків і неспокою) 1,4-Бензодіазепши входять до складу великої КІЛЬКОСТІ широко використовуємих у СВІТІ ЛІКІВ Се ред пропонуємих у продажу бензодіазепінів слід ВІДМІТИТИ хлордіазепоксид, діазепам, флуазепам і триазолам Ці сполуки широко використовуються в якості анксиолітиків, седативних ппнотиків, мускульних релаксантів і антиконвульсивних агентів Ряд цих сполук, надзвичайно сильні лікарські засоби, така висока активність доказує високу близкість і специфічність при їх дії на індивідуальні рецептори Початкові електорофізиолопчні дослідження показали, що бензодіазепіни в основному діють як агенти, що підвищують ГАБКерпчність інгібування Бензодіазепіни здатні підвищувати пресинаптичне інгібування моносинаптичного черевинно коренного рефлексу, ГАБК-викликану дію (Schmidt et al , 1967, Arch Exp Path Pharmakol 258 69-82) Всі наступні електрофізиолопчні дослідження (опубліковані Tallman et al 1980, 61123 тичним кільцем Опис винаходу Exptl PharmacoL 33 95-102) в основному стосуваЦей винахід стосується способу одержання лись цих ДОСЛІДІВ, і в середині 1970х, була досягсполуки формули нута домовленість серед електорофізиолопстів, що бензодіазепіни можуть підвищувати активність О ГАБК Вивчення "рецепторів" бензодіазепіну і наступний опис природи взаємодії між ГАБК і бензодіаNHAT зепінами, показало, що динамічно важливі взаємодії бензодіазеп/ну з різноманітними нейротрансмітерними системами повинні в більшій частині випадків підвищувати здатність ГАБК до модифікації цих систем Кожна модифікована система, в свою чергу, може бути зв'язана з вираженою поведінкою Дослідження природи механізмів цієї залежної в якій R1 і R2 незалежно вибирають з водню і взаємодії демонструється високою спорідненістю Сі-Сєалкілу, і Аг є фенілом або гетероциклом, або бензодіазепіну до зв'язування (рецептора) Такі фенілом або гетероциклом заміщеним або ні до рецептори присутні в ЦНС усіх хребетних тварин, трьох замісників вибраних з СгСбалкокси, що філогенетичне НОВІШІ за кісткових риб (Squires СгСєалкілу, Сг-Сєалкенілу, Сі-Сєперфторалкілу, & Braestrup 1977, Nature 166 732-34, Mohler & Сі-Сєалкокси, Сі-Сбперфторалкокси, F, СІ, Вг, -ОOkada, 1977, Science 198 854-51, Mohler & Okada, (СН2)к-О- або (CH2)mNR1R2, де 1977, BrJ Psychiatry 133 261-68) Використовуючи п знаходиться в інтервалі від 0 до 2, при лікуванні діазепам і різноманітні ІНШІ сполуки m знаходиться в інтервалі від 0 до 6, і було продемонстровано, що ці бензодіазепіни к знаходиться в інтервалі від 1 до 2, зв'язують місця, що виконують в більшості випадякий включає ків функції фармакологічних рецепторів, причому 1) реакцію сполуки формули зв'язують ці місця in vitro швидко, зворотно, стереоспецифічно і повністю Найбільш важливо, що продемонстроване високе значення кореляції між О здатністю бензодіазепінів при заміні на діазепам при зв'язуванні місць і дм в деяких тваринних тестах на поведінку, що прогнозують активність бензодіазепіну (Braestrup & Squires 1978, Br J Psychiatry 133 261-68) Рівень терапевтичних доз їх лікарських препаратів може також корелюватись в залежності від активності рецептору (Tallman et al 1980, Science 207 274-281) Science 207 274-81, Haefley et al , 1981, Handb Деякі заміщені піролкарбоксаміди, які використовуються в якості лігандів ГАБК мозкових рецепторів описані в патенті US 5484944, який включений в цей опис в якості посилання Ці сполуки можуть бути одержані за схемою показаною нижче о. о >~он з надлишком хлорангідриду кислоти або ангідридом в реакційне інертному розчиннику, що містить надлишок кислотного акцептору, до повного завершення реакції, 2) додавання еквівалентної КІЛЬКОСТІ Nbb-Ar до розчину стадії 1 і витримування до повного завершення реакції Цей винахід також стосується способу одержання сполуки формули О NHAr NH Ш в якій z є N-R або атомом вуглецю заміщеним R групою, і W є, необов'язково, заміщеним арома який включає реакцію сполуки формули II з надлишком джерела амонію в реакційне інертному розчиннику при підвищеній температурі до повного завершення реакції Цей винахід також стосується способу одер 61123 жання сполуки формули III в якій Аг є 2-фтор-4-метоксифенілом, 4-(Nметил-І\І-1:-бутилкарбоксиамшо-метил)фенілом, 4етоксифенілом або 4-метоксифенілом, 4фторфенілом, 4-піридилом або 3-піридилом, 6-(2пдроксиетокси)-3-піридилом, бензо[1,3]дюксол-5ІЛОМ Цей винахід також стосується способу одержання сполуки формули І, в якій п дорівнює 2 і R1 та R2 є воднями, п дорівнює 1 і R1 та R2 є метилами, п дорІВНЮЄ 1 І R1 та R2 є воднями, п дорівнює нулю і R1 та R2 є воднями, і п дорівнює 1, R1 є метилом і R2 є воднем В іншому аспекті цей винахід стосується сполуки формули І, яка є 4-оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновою кислотою, 4-оксо-5,6,7,8-тетрап'дро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти (2фтор-4-метоксифеніл)амідом, 6,6-диметил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти (2фтор-4-метоксифеніл)амідом, 4-[(4-оксо-4,5,6,7-тетрапдробензофуран-3карбоніл)амшо]бензилметил-карбаміновоі кислоти третбутиловим естером, 4-[(4-оксо-4,5,6,7-тетрапдро-1Н-шдол-3карбоніл)амшо]бензил метил карбамшової кислоти третбутиловим естером, 4-оксо-5,6-дипдро-4Н-циклопента[Ь]фуран-3 8 карбонової кислоти (4-етоксифеніл)-амідом, 4-оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти бензо[1,3]дюксол-5-іламідом, 4-оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти (4метокси-феніл)амідом, 6-метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбоновоі кислоти (4-фтор-феніл)амідом, 6-метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбоновоі кислоти піридин-4-іламідом, 6-метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбоновоі кислоти піридин-3-іламідом, 6-метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбоновоі кислоти [6-(2-пдроксиетокси)піридин-3-іл]амідом, і 4-оксо-4,5,6,7-тетрапдро-1 Н-шдол-3карбонової кислоти (4-метиламшометилфеніл)амідом Цей винахід також стосується проміжних сполук (4-нітробензил)метил карбамшової кислоти третбутилового естеру, і (4-амшобензил)метил карбамшової кислоти третбутилового естеру Цей винахід також стосується способу одержання сполуки формули III, в якій Аг є заміщеним -(CbbJmNHR1, який включає взаємодію сполуки формули з водою в присутності кислоти Спосіб цього винаходу показаний на схемі нижче ATNH NHAr на якій Аг, R1, R 2 1 п такі, як зазначено вище Сполуки формули II легко одержуються реакцією прийнятного 1,3-дикетону з естером галогенпіруватної кислоти, переважно етилбромпірува NHAr том, як описано в патенті US № 5484944 і загальній методиці А Прикладу 1 представленого винаходу Сполука І одержується з сполуки II шляхом 61123 перетворення карбоксильної групи сполуки І у змішаний ангідрид і потім у карбоксанілід за допомогою реакції ангідриду з вибраним аніліном, в присутності основи Реакцію переважно проводять в реакційне інертному розчиннику при підвищений температурі без виділення проміжного ангідриду Будь який хлорангідрид або ангідрид може бути використаний для одержання змішаного ангідриду, переважним реагентом є етилхлорформіат Вищезгадана реакція показана в загальній методиці В Прикладу 1 нижче Перетворення сполуки І у кінцевий продукт (сполуку III) здійснюється за допомогою реакції сполуки І з сіллю амонію в реакційне інертному розчиннику при підвищеній температурі, що забезпечує протікання реакції за прийнятний час Полярним реакційне інертним розчинником є будь який придатний розчинник, переважно Nметилпіролідинон Зручним джерелом юну амонію є ацетат амонію 10 Ця методика показана в загальній методиці С Прикладу 1 нижче Кваліфікований спеціаліст в цій галузі повинен розуміти, що ВИХІДНІ матеріали можуть змінюватись і можуть бути використані додаткові стадії для одержання сполук, включених в представлений винахід, як продемонстровано наступними Прикладами В будь якому випадку може знадобитися захист деяких реакційне функціональних груп для забезпечення протікання деяких наступних перетворень В основному необхідні для такого захисту групи очевидні спеціалістам в галузі - органічна ХІМІЯ, також як і умови необхідні для видалення таких груп Винахід надалі ілюструється наступними Прикладами, які не повинні розглядатися як такі, що обмежують винахід рамками або сутністю методик описаних в них Приклад 1 ОМе I. BfCH2COCO2£t K2CQ3, ІРО ОМе 2. H2S64, H2O H2N F •о ОМе 4-Оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбонова кислота Загальна методика А (дикетон у фуранкарбонову кислоту) Циклогептан-1,3-дюн (22,1 г, 174ммоль) розчиняли в 176мл ізопропанолу і охолоджували до 0°С Додавалиетилбромпіруват (21,9мл, 174ммоль), і потім К2СО3 (24,2г, 175ммоль) Розчин потім нагрівали до кімнатної температури і перемішували 16 годин Додавали 220 мл води і розчин екстрагували чотири рази дихлорметаном по 110 мл Об'єднані органічні екстракти потім промивали насиченим водним розчином хлориду натрію і концентрували одержуючи оранжево-коричневе масло Додавали 220мл 1N H2SO4 і розчин нагрівали при 85°С на масляній бані протягом 16 годин Після охолодження до кімнатної температури, розчин екстрагували двома порціями дихлорметану по 220мл Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію і концентрували одержуючи 37,2г оранжево коричневої твердої речовини Цей неочищений продукт гранулювали з 170мл метил-1-бутилового етеру, нагрівали приблизно при температурі кипіння ЗОхв і потім перемішували при кімнатній температурі 16 годин Після фільтрування одержували продукт у вигляді майже-білої твердої речовини, 14,6г (75ммоль 43% вихід по дикетону) 1 Н ЯМР (СОСІз) 8,07 (с, 1Н), 3,14-3,10 (м, 2Н), 2,89-2,86 (м, 2Н), 2,05-1,93 (м, 4Н) МС(СІ) 195(М+1,100) 4-Оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти (2-фтор4-метоксифеніл)амід Загальна методика В (фуранкарбонову кислоту у фуранкарбоксамід) Розчин фуранової кислоти з Методики А (7,65г, 39,4ммоль) розчиняли в 80мл дихлорметану і охолоджували до 0°С Додавали триетиламш (7,1мл, 51ммоль) і потім етилхлорформіат (4,5мл, 47ммоль) Через 20 хв декількома маленькими порціями додавали 2-фтор-4-метоксианілш (5,56г, 12 11 61123 39,4ммоль) Розчин нагрівали до кімнатної темпекислоти (2-фтор-4-метоксифеніл)амід з Методики ратури і перемішували протягом 5 годин РеакційВ (10,0г, 31,5ммоль), ацетат амонію (12,1г, ну суміш обробляли розчиняючи в дихлорметані, 158ммоль) і 20мл of N-метилпіролідинону Одерпромивали насиченим водним розчином хлориду жану суспензію нагрівали при 100°С на масляній натрію і сушили над MgSO4 Фільтрували і конценбані при нормальному тиску азоту протягом 20г трували одержуючи 15,0г майже білої твердої реПісля охолодження до кімнатної температури реачовини, яку гранулювали з 100 мл метил-tкційний розчин обробляли 180 мл води, додаючи її бутилового етеру протягом 16 годин Фільтрували по краплям протягом ЗОхв Одержану тверду реодержуючи 11,71 г продукту (36,9ммоль, вихід човину гранулювали протягом 6 г, і потім збирали 94%) у вигляді темно-білої твердої речовину фільтруванням, після 16г у вакуумі при 30°С, продукт виділяли у вигляді жовтувато-коричневої твеТпл 168-172°С 1 рдої речовини (9,12г, 28,8ммоль, вихід 91%) Н ЯМР (СОСІз) 8,28-8,24 (м, 1Н), 8,10 (с, 1Н), 6,72-6,66 (м, 2Н) 3,78 (с, ЗН), 3,11-3,06 (м, 2Н), Тпл 158-159°С 1 2,86-2,83 (м, 2Н), 2,01-1,93 (м, 4Н) Н ЯМР (СОСІз) 12,62 (с, 1Н), 11,25 (шс, 1Н), 8,11-8,06 (м, 1Н), 7,53 (шс, 1Н) 6,70-6,63 (м, 2Н), МС(СІ)318(М+1, 100) 3,76 (с, ЗН), 2,86-2,81 (м, 2Н), 2,76-2,72 (м, 2Н), 4-Оксо-1,4,5,6,7,81,99-1,75 (м, 4Н) гексапдроциклогепта[Ь]пірол-3-карбоновоі кислоти 13 (2-фтор-4-метоксифеніл)амід С ЯМР (de-ДМСО) (спостерігається 14 з 17 сигналів) 201,1, 161,3, 147,3, 126,2, 120,9, 118,2, Загальна методика С (фуранкарбоксамід у пі115,3, 114,8, 107,9, 56,7, 41,5, 25,8, 23,5, 21,1 рол карбоксамід) У 500мл колбу завантажували 4-оксо-5,6,7,8Приклад 2 тетрапдро-4Н-циклогепта[Ь]фуран-3-карбоновоі О l.BfCH,COCO2Et КгСО3, ІРО О ОМе 1.ClCO2Et 2. H 2 S0 4 . H2O О ОМе 6,6-Диметил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти (2фтор-4-метоксифеніл)амід Виходили з 6,6-диметил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти, одержаної з димедону за Методикою А і 2-фтор-4метоксианіліну Загальна методика В, одержуючи вказану у заголовку сполуку, у вигляді білої твердої речовини Тпл 174-176°С 1 Н ЯМР (CDCI3) 8,23 (т, J = 9, 1Н), 8,09 (с, 1Н), 6,64 (м, 2Н), 3,75 (с, ЗН), 2,79 (с, 2Н), 2,50 (с, 2Н), 1,15 (с, 6Н) МС(СІ)332(М+1,100) 6,6-Диметил-4-оксо-4,5,6,7-тетрапдро-1 Ншдол-3-карбоновоі кислоти (2-фтор-4 метоксифеніл)амід Виходили з 6,6-диметил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти (2фтор-4-метоксифеніл)аміду Загальна методика С, одержуючи вказану у заголовку сполуку, у вигляді білої твердої речовини Тпл 203-205°С 1 Н ЯМР (CDCI3) 12,40 (с, 1 Н), 11,45 (шс, 1 Н), 8,08 (т, J = 8,8 Гц, 1 Н), 7,49 (д, J = 1,8 Гц, 1Н), 6,72-6,64 (м, 2Н), 3,77 (с, ЗН) 2,55 (с, 2Н), 2,42 (с, 2Н), 1,04 (с, 6Н) 13 С ЯМР (de-ДМСО) (спостерігається 17 з 18 сигналів) 196,0, 161,3, 156,4, 154,0, 146,9, 127,4, 124,2,120,3, 118,5, 114,1, 110,0, 102,1, 56,0, 52,0, 36,9, 35,5, 28,2 Приклад З 13 61123 / 14 / Л C,u OB t w Г нн Maude; COatBu н,к асоз& 1 Et3N К2СОз,ІЮ 2.H2SO4.HJO CO3tBu NH4OAC NMP (4-Нітробензил)метил карбамінової кислоти третбутиловий естер До розчину (tBu02C)2O (24,9г, 114ммоль) в ЮОмл ЕЮАс додавали по краплям розчин (4нітробензил)метиламшу (19,0г, 114ммоль) (J Chem Soc 1925, 727, р 1814) в 19 мл ЕЮАс Одержаний розчин перемішували при кімнатній температурі протягом 60 хв, і потім виливали в ЮОмл води Органічну фазу відокремлювали, сушили над MgSO4, фільтрували і концентрували одержуючи вказану у заголовку сполуку, у вигляді блідо-жовтого масла (30,0г, ИЗммоль, вихід 99%) 1 Н ЯМР (CDCI3) (два амідні ротамери) 8,178,15 (м, 2Н), 7,35-7,33 (м, 2Н), 4,48 (шс, 2Н), 2,862,80 (перекривається широким синглетом, ЗН), 1,46-1,40 (перекривається широким синглетом, 9Н) (4-Амшобензил)-метил карбамінової кислоти третбутиловий естер У пляшку Парра завантажували (4нітробензил)метилкарбамшовоі кислоти третбутиловий естер (30,0г, ИЗммоль), 150мл ЕЮАс і 10% Pd/C (3,0г, 10ваг%), і збовтували при тиску водню 40 псі протягом 90хв Коли водень переставав поглинатися реакційну колбу промивали азот, фільтрували крізь целіт і концентрували одержуючи жовтувато-коричневу тверду речовину, яку гранулювали з ЗООмл ізопропілового етеру, одержуючи вказану у заголовку сполуку, у вигляді майже-білої твердої речовини (17,7г в двох порціях, 75ммоль, вихід 66%) 1 Н ЯМР (CDCI3) (два амідні ротамери) 6,99 (м, 2Н), 6,67-6,59 (м, 2Н), 4,26 (шс, 2Н), 3,68 (шс, 2Н) 2,75-2,71 (перекривається широким синглетом, ЗН), 1,45-1,41 (перекривається широким сингле на том, 9Н) 4-[(4-Оксо-4,5,6,7-тетрапдробензофуран-3карбоніл)амшо]бензилметил-карбаміновоі кислоти третбутиловий естер Виходили з 4,5,6,7-тетрапдро-бензофуран-Зкарбонової кислоти і (4-амшобензил)метилкарбамшової кислоти третбутилового естеру, Загальна методика В, одержуючи вказану у заголовку сполуку, у вигляді білої твердої речовини Тпл 150°С 1 Н ЯМР (CDCI3) 8,06 (с, 1Н), 7,71 (д, J = 8, 2Н), 7,17 (д, J = 8, 2Н), 4,35 (шс, 2Н), 2,92 (т, J = 6, 2Н), 2,78 (шс, ЗН), 2,62 (т, J = 6, 2Н), 2,20 (м, 2Н), 1,44 (с, 9Н) 13 С ЯМР (CDCI3) (спостерігається 16 з 18 сигналів) 197,5, 170,2, 159,1, 148,9, 137,7, 133,6, 127.8, 121,9, 119,9, 116,8, 79,0, 37,8, 33,7, 28,4, 23,5, 22,1 4-[(4-Оксо-4,5,6,7-тетрапдро-1Н-шдол-3карбоніл)амшо]бензил метил карбамінової кислоти третбутиловий естер Слідуючи Загальній методиці С використовували 4-[(4-оксо-4,5,6,7-тетрапдро-бензофуран-3карбоніл)амшо]бензил метил карбамінової кислоти третбутиловий естер, одержуючи вказану у заголовку сполуку, у вигляді блідо-жовтого масла 1 Н ЯМР (CDCI3) 7,76 (д, J = 8, 2Н), 7,47 (с, 1Н), 7,17 (д, J = 8, 2Н), 4,36 (шс, 2Н), 2,77 (т, J = 6, 2Н), 2,76 (шс, ЗН), 2,55 (т, J = 6, 2Н), 2,08 (т, J = 6, 2Н), 1,44 (шс, 9Н) С ЯМР (CDCI3) (спостерігалось 17 з 18 сигналів) 196,9, 162,5, 148,0, 138,2, 133,3, 128,2, 127.9, 126,2, 120,3, 119,6, 115,6, 79,8, 38,2, 33,8, 28,4, 23,4, 22,8 61123 16 15 МС(СІ) 396(М-1,100) 0°С і тверду речовину відокремлювали фільтруванням, одержуючи вказану у заголовку сполуку, у 4-Оксо-4,5,6,7-тетрапдро-1 Н-шдол-3вигляді її НСІ солі, 3,21г (9,6ммоль, вихід 74%), що карбонової кислоти (4-метиламшометилмала вигляд білої твердої речовини феніл)амід 1 Розчин 4-[(4-оксо-4,5,6,7-тетрапдро-1Н-шдолН ЯМР (CD3OD) 12,88 (шс, 1Н), 7,82 (д, J = 3-карбоніл)амшо]бензилметил-карбамшовоі кис8,5 Гц, 2Н), 7,49 (д, J = 8,5 Гц, 2Н), 4,15 (с, 2Н), лоти третбутилового естеру (5,0г, ІЗммоль) в 2,91-2,88 (м, 2Н), 2,71 (с, ЗН), 2,66-2,61 (м, 2Н), 50мл 95% ЕЮН обробляли 15мл концентрованої 2,20-2,15 (м, 2Н) НСІ Через 24 години суспензію охолоджували до Приклад 4 1.BrCH,COCO,Et 2. OEt NH 4 0Ac NMP 4-Оксо-5,6-дипдро-4Н-циклопента[Ь]фуран-3карбонової кислоти (4-етоксифеніл)амід Виходили з 4-оксо-5,6-дипдро-4Нциклопента[Ь]фуран-3-карбоновоі кислоти і 4етоксианіліну Загальна методика В, одержуючи вказану у заголовку сполуку 1 Н ЯМР (CDCI3) 9,68 (с, 1Н), 8,15 (с, 1Н), 7,65 (д, 2Н), 6,88 (д, 2Н), 4,02 (к, 2Н), 3,14 (м,4Н), 1,4(т,ЗН) 4-Оксо-1,4,5,6-тетрапдро-циклопента[Ь]пірол 3-карбоновоі кислоти (4-етоксифеніл)амід Виходили з 4-оксо-5,6-дипдро-4Нциклопента[Ь]фуран-3-карбоновоі кислоти (4етоксифеніл)аміду Загальна методика С, одержуючи вказану у заголовку сполуку Тпл 273-275°С 1 Н ЯМР (ДМСО-de) 12,14 (с, 1Н), 10,37 (с, 1Н), 7,58 (с, 1Н), 7,54 (д, 2Н), 6,90 (д, 2Н), 3,95 (к, 2Н), 2,95 (с, 4Н), 1,29 (т, ЗН) Приклад 5 I. BrCHjCOCOjEt К2СО3.ІРО 4-Оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти бензо[1,3]дюксол-5-іламід Виходили з 4-оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти і бен зо[1,3]дюксол-5-іламшу, Загальна методика В, одержуючи вказану у заголовку сполуку 1 Н ЯМР (CDCI3) 11,79 (с, 1Н), 8,09 (с, 1Н), 7,48 (с, 1Н), 7,06 (д, 1Н), 6,77 (д, 1Н), 5,94 (с, 2Н), 3,06 (т, 2Н), 2,82 (т, 2Н), 1,98 (шс, 4Н) 61123 18 17 4-Оксо-1,4,5,6,7,8Тпл 210-212°С 1 гексапдроциклогепта[Ь]пірол-3-карбоновоі кислоти Н ЯМР (ДМСО-de) 12,51 (с, 1Н), 12,02 (с, 1Н), бензо[1,3]дюксол-5-іламід 7,48 (с, 1Н), 7,46 (с, 1Н), 6,95 (д, 1Н), 6,86 (д, 1Н), 5,98 (с, 2Н), 2,97 (шс, 2Н), 2,74 (шс, 2Н), 1,78 (шс, Виходили з 4-оксо-5,6,7,8-тетрапдро-4Н4Н) циклогепта[Ь]фуран-3-карбоновоі кислоти бензо[1,3]дюксол-5-іламіду Загальна методика С, Приклад 6 одержуючи вказану у заголовку сполуку ОМе 1. СІСО^і Et3N і. вгсн2сосо2а к 2 со 3 , ІРО ОМе 2. о ОМе 4-Оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти (4метоксифеніл)амід Виходили з 4-оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти і 4метоксианіліну, Загальна методика В, одержуючи вказану у заголовку сполуку 1 Н ЯМР (CDCI3) 11,75 (с, 1Н), 8,10 (с, 1Н), 7,67 (д, 2Н), 6,86 (д, 2Н), 3,80 (с, ЗН), 3,08 (т, 2Н), 2,82 (т, 2Н), 1,98 (шс, 4Н) 4-Оксо-1,4,5,6,7,8 i.BfttUCOCOjEi к,со3, ІРО гексапдроциклогепта[Ь]пірол-3-карбоновоі кислоти (4-метоксифеніл)амід Виходили з 4-оксо-5,6,7,8-тетрапдро-4Нциклогепта[Ь]фуран-3-карбоновоі кислоти (4метоксифеніл)аміду Загальна методика С, одержуючи вказану у заголовку сполуку Тпл 183-185°С 1 Н ЯМР (ДМСО-de) 12,42 (с, 1Н), 12,02 (с, 1Н), 7,60 (д, 2Н), 7,48 (с, 1Н), 6,90 (д, 2Н), 3,72 (с, ЗН), 2,95 (шс, 2Н), 2,73 (шс, 2Н), 1,78 (шс, 4Н) 2. 19 20 61123 6-Метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбонова кислота Виходили з 5-метилциклогексан-1,3-діону Загальна методика А, одержуючи вказану у заголовку сполуку МС(СІ) 193(М-1,100) 1 Н ЯМР (CDCI3) 13,17 (шс, 1Н), 8,00 (с, 1Н), 3,04 (дцд, J = 0,8, 4,4, 17,2, 1Н), 2,71-2,59 (м, 2Н), 2,57-2,48 (м, 1Н), 2,39 (ддд, J = 0,8, 11,2, 16,8, 1Н), 1,20 (д, J=6,4, ЗН) 6-Метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти (4фторфеніл)амід Виходили з 6-метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти і 4 фтораніліну, Загальна методика В, одержуючи вказану у заголовку сполуку 1 Н ЯМР (CDCI3) 11,71 (с, ІН), 8,09 (с, 1Н), 7,73 (дд, 2Н), 7,01 (т, 2Н), 3,03 (дд, 1Н), 2,72-2,59 (м, 2Н), 2,54 (м, 1Н), 2,39 (м, 1Н), 1,21 (д, ЗН) 6-Метил-4-оксо-4,5,6,7-тетрапдро-1 Н-шдол-3карбонової кислоти (4-фторфеніл)амід Виходили з 6-метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти (4фторфеніл)аміду Загальна методика С, одержуючи вказану у заголовку сполуку Тпл 262-264°С 1 Н ЯМР (ДМСО-de) 12,53 (с, 1Н), 12,12 (с, 1Н), 7,72 (дд, 2Н), 7,54 (с, 1Н), 7,18 (т, 2Н), 2,92 (дд, 1Н), 2,56 (м, 2Н), 2,38 (м, 2Н), 1,05 (д, ЗН) t. t.BfCH,CQCOaEt К2СО3, ЇРО H,N 6-Метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбоновоі кислоти піридин-4-іламід Виходили з 6-метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти і 4амінопіридину Загальна методика В, одержуючи вказану у заголовку сполуку 1 Н ЯМР (CDCI3) 12,14 (с, 1Н), 8,53 (д, 2Н), 8,15 (с, 1Н), 7,78 (д, 2Н), 3,06 (дд, 1Н), 2,77-2,61 (м, 2Н), 2,56 (м, 1Н), 2,38 (м, 1Н), 1,20 (д, ЗН) 6-Метил-4-оксо-4,5,6,7-тетрапдро-1 Н-шдол-30 і . ВГСН ,СОСО2ЕІ О. о3. >РО карбонової кислоти піридин-4-іламід Виходили з 6-метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти піридин-4-іламіду Загальна методика С, одержуючи вказану у заголовку сполуку Тпл 280-290°С (роз) 1 Н ЯМР (ДМСО-de) 12,81 (с, 1Н), 12,21 (с, 1Н), 8,42 (д, 2Н), 7,65 (с, 1Н), 7,53 (д, 2Н), 2,92 (дд, 1Н), 2,55 (м, 2Н), 2,38 (м, 2Н), 1,07 (д, ЗН) 1- CICOjEi он 2. H,N 6-Метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбоновоі кислоти піридин-3-іламід Виходили з 6-метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти і З 61123 22 21 амшопіридину, Загальна методика В, одержуючи Виходили з 6-метил-4-оксо-4,5,6,7вказану у заголовку сполуку тетрапдробензофуран-3-карбоновоі кислоти піри1 дин-3-іламіду Загальна методика С, одержуючи Н ЯМР (CDCI3) 11,90 (с, 1Н), 8,90 (с, 1Н), 8,38 вказану у заголовку сполуку (д, 1Н), 8,31 (д, 1Н), 8,13 (с, 1Н), 7,28 (м, 1Н), 3,06 (дд, 1Н), 2,75-2,60 (м, 2Н), 2,55 (м, 1Н), 2,41 (м, Тпл 225-227°С 1 1Н), 1,22 (д, ЗН) Н ЯМР (ДМСО-de) 12,67 (с, 1Н), 12,17 (с, 1Н), 8,81 (с, 1Н), 8,24 (шс, 1Н), 8,13 (д, 1Н), 7,58 (с, 1Н), 6-Метил-4-оксо-4,5,6,7-тетрапдро-1 Н-шдол-37,37 (м, 1Н), 2,88 (дд, 1Н), 2,54 (м, 2Н) 2,39 (м, карбонової кислоти піридин-3-іламід 2Н), 1,05 (д, ЗН) Я l.BrCHjCOCOiEt 0 NH4OAC NMP 6-Метил-4-оксо-4,5,6,7-тетрапдробензофуран3-карбоновоі кислоти [6-(2-пдроксиетокси)піридин3-іл]амід Виходили з 6-метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти і 3амшо-6-(2-пдроксиетокси)піридину Загальна методика В, одержуючи вказану у заголовку сполуку 1 Н ЯМР (CDCI3) 11,72 (с, 1Н), 8,48 (с, 1Н), 8,12 (д, 1Н) 8,11 (с, 1Н), 6,79 (д, 1Н), 4,42 (т, 2Н) 3,97 (т, 2Н), 3,62 (шс, 1Н) 3,06 (дд, 1Н), 2,73-2,60 (м, 2Н), 2,53 (м, 1Н), 2,39 (м, 1Н), 1,05(д, ЗН) 6-Метил-4-оксо-4,5,6,7-тетрапдро-1 Н-шдол-3карбам інової кислоти [6-(2 пдроксиетокси)піридин-3-іл]амід Виходили з 6-метил-4-оксо-4,5,6,7тетрапдробензофуран-3-карбоновоі кислоти [6-(2пдроксиетокси)піридин-3-іл]аміду Загальна методика С, одержуючи вказану у заголовку сполуку Тпл 183-185°С 1 Н ЯМР (ДМСО-de) 12,42 (с, 1Н), 12,11 (с, 1Н), 8,41 (с, 1Н), 7,98 (д, 1Н), 7,53 (с, 1Н), 6,81 (д, 1Н), 4,21 (т, 2Н), 3,68 (т, 2Н), 2,90 (дд, 1Н), 2,55 (м, 2Н), 2,38 (м, 2Н), 1,05 (д, ЗН) Приготування І Одержання циклогептан-1,3-дюну COHj CCC f t TS Mt C £*e t N 3 Hn e x D $ F C 2, AH 0/ l nc * сї p O л io V^A .0 J TMSO 0 23 24 61123 1-(Триметилсілокси)циклопентан У 1л круглодонну колбу завантажували циклопентаном (50,7г, О.бОЗмоль) і ДМФА (250мл) Додавали триетиламін (200мл, 1,45моль) і потім по краплям протягом 5хв додавали ТМССІ (91 мл, 0,72моль) Розчин нагрівали із зворотнім холодильником (90°С) протягом 26г Після охолодження до кімнатної температури, суміш переносили до роздільної воронки, промивали 500мл гексану Розчин промивали водою (3 порції по ЮОмл кожна), насиченим водним розчином хлориду натрію (ЮОмл), концентрували одержуючи 110г темно-оранжевого масла 1Н ЯМР показав бажаний продукт, плюс 10-15% триетиламіну Цей матеріал використовували в наступній реакції без подальшої очистки 7,7-Дихлор-1 -(триметилсілокси)біцикло[3,2,0] гептан-6-он Неочищений ТМС енол етер (2) (О.бОмоль) розчиняли в 950мл гексану в 2л круглодонній колбі Додавали триетиламін (ЮОмл, 0,72моль) і потім по краплям протягом 2 годин додавали дихлорацетилхлорид (58мл, О.бОмоль), у вигляді розчину в 450мл гексану Розчин перемішували при кімнатній температурі протягом ночі Реакційну суміш фільтрували крізь скляний фільтр, промивали декількома порціями по 50мл гексану Чистий розчин концентрували під вакуумом одержуючи 128г (80% після 2 стадій) продукту, у вигляді темно-коричневого масла Цей матеріал ідентифікували за допомогою ГХ/МС і 1Н ЯМР, виявив сліди EtsN і ДМФА, і використовували безпосередньо в наступній реакції Циклогептан-1,3-дюн (1) Дихлорциклобутанон З (128г, 0,48моль) розчиняли в 520мл 1 1 ізопропанол-вода в 2л, 3-горлій колбі з механічною мішалкою Однією порцією додавали гранульований цинк (126г, 1,9моль, -30+100 меш) Після витримування бОхв при кімнатній температурі, за допомогою лійки по краплям додавали 130мл АсОН і 260мл води (додавали 4мл і потім витримували Юхв, додавали 20мл і потім витримували ще Юхв, як тільки будь яка екзотерма зменшувалась, розчин кислоти, що залишився додавали по краплям, залишок додавали протягом 1,5-2г) Через 16г суміш переносили у воронку для розділення, декантуючи з цинку (використовуючи для промивання незначну КІЛЬКІСТЬ ізопропанолу) Суміш ізопропанол-АсОН-вода екстрагували 5 порціями толуолу (250мл кожна), які об'єднували і концентрували одержуючи 51,7г продукту, у вигляді темнооранжевого масла (85% баланс неочищеної маси, 85% чистота за 1Н ЯМР) Ці матеріали є придатними протягом наступних реакцій або можуть бути очищені перегонкою, одержуючи 29,4г (0,23моль, вихід 49%) продукт, у вигляді чистого безбарвного масла (Тк 65-75°С при 1,2мм) II спектральні властивості (1Н ЯМР, ГХ/МС) були порівняні з зразками одержаними шляхом оксимеркуразаци Чандрасекарана (Synthetic Communications 1984,14, 339345) Приготування II Одержання 2-фтор-4-метоксианілшу о о =J NaOM«, CuO 0MF-M«OH т*он РЛСНэ OMe OMe H2NOH-HCI «qttOH 1-(2-Фтор-4-юдфеніл)-2,5-диметил-1Н-пірол У 500мл круглодоннну колбу завантажували 2-фтор4-юданілін (53,Зг, 220ммоль), толуол (250мл), TsOH H2O (0,43г, 2,3ммоль, 1 моль%), і ацетонілацетон (ЗО,8г, 270ммоль, 1,2ек) Розчин нагрівали із зворотнім холодильником з насадкою Діна-Старка протягом 1г, визначаючи повноту перетворення у пірол за допомогою ГХ/МС і ТШХ Розчин охолоджували до кімнатної температури, промивали водним розчином ІЧаНСОз, сушили над MgSO4, фільтрували і концентрували одержуючи темнокоричневе масло, яке кристалізувалося при стоянні (вихід неочищеного = 72,8г, 103% від теорії) Цей продукт ідентифікували за допомогою ВЕРХ і 1 Н ЯМР, і використовували в наступній реакції Аналітичний зразок одержували шляхом розчинення в 210мл гарячого гексану, охолодження і концентрування до 50% від початкового об'єму Охолоджували на льодяній бані при швидкому перемішуванні одержуючи 35,5 г (вихід 49%) коричневої гранульованої твердої речовини (Тпл 6870°С) 1Н ЯМР (CDCI3) 5 7,43 (т, J = 27 Гц, 2Н), 7,13 (т, J = 20 Гц, 1Н), 5,94 (с, 2Н), 2,02 (с, 6Н), 13С ЯМР (СОСІз) 5 158,3 (д, J = 254 Гц), 131,6, 128,9, 127,8 (д, J = 3 Гц), 122,0, 120,3 (д, J = 23 Гц), 106,4, 12,4, МС(ЕІ) m/z268(100) 26 25 61123 1-(2-Фтор-4-метоксифеніл)-2,5-диметил-1Нбу завантажували 1-(2-фтор-4-метоксифеніл)-2,5пірол Неочищений продую" з попередньої реакції диметил-1Н-пірол (60,0г, 271ммоль), H2NOH HCI (1-(2-фтор-4-йодфеніл)-2,5-диметил-1Н-пірол, (188г, 2,71 моль, 10 ек), ЕЮН (600мл), воду 70,0г, 222ммоль) розчиняли в 230мл МеОН і 70мл (ЗООмл), і Et3N (76мл, 0,54моль), нагрівали із звоДМФА До цього розчину додавали NaOMe (35,9г, ротнім холодильником протягом 16г Після охолобббммоль, З.Оек) і СиСІ (3,3г, Зіммоль, 15моль%) дження до кімнатної температури реакційну суміш Одержану суміш нагрівали із зворотнім холодильповільно виливали в 1,7л охолодженого 1N розчиником протягом 4г Після охолодження до кімнатну НСІ і промивали двома 500 мл порціями ІРЕ ної температури додавали ізопропіловий етер Водну фазу підлуговували до рН 10 обережним (ІРЕ) (500мл), 5% водний розчин МН4СІ (220мл) і додаванням 6N розчину NaOH і екстрагували двоводу (350мл) і суміш перемішували протягом ночі ма порціями по 500мл ІРЕ Органічний екстракт Суміш фільтрували крізь целіт, шари розділяли і концентрували одержуючи масло, що містило твеводний шар екстрагували 350мл ІРЕ Об'єднані рді домішки, яке фільтрували, промивали ІРЕ органічні екстракти потім промивали 10% водним (тверда речовина не була аніліном, що визначали розчином NH4OH (200мл) і пропускали крізь шар за допомогою 1Н ЯМР, і мабуть є якимось ацетонісилікагелю (100г) Концентрували одержуючи колацетоном, продуктом, що утворився в наслідок ричневе масло, яке кристалізувалося при стоянні зняття захисту) Подальшим концентруванням ІРЕ (45,2г, вихід 93%) Перекристалізували з 135мл розчину одержували коричневе масло (36г, вихід гарячого гексану, одержуючи 30,1г (вихід 62%) 98%), яке перекристалізовували з 200мл гарячого продукту, у вигляді коричневого масла, Тпл 67ІРЕ, одержуючи 26,8г (вихід 70%) 2-фтор-469°С 1Н ЯМР (CDCI3) 5 7,12 (т, J = 8 Гц, 1Н), 6,75 метоксианіліну 1, у вигляді коричневої твердої (д, J = 8 Гц, 1Н), 6,73 (с, 1Н), 5,89 (с, 2Н) 3,82 (с, речовини, Тпл 46-47°С (літ 47-48°С) Спектральні ЗН), 1,97 (с, 6Н), 13С ЯМР (CDCI3) (спостерігається дані (1Н ЯМР, масспектр) відповідали зразкам 9 з 10 сигналів) 5 159,1 (д, J = 260Гц), 130,7, 129,5, одержаним методами описаними в літературі 109,9 (д, J = 3Гц), 106,0, 105,6, 102,3 (д, J = 25Гц), (Aust J Chem 1972,25,2621-2629) 55,7, 12,4, МС (El) m/z 219 (100) 2-Фтор-4-метоксианілш У 2л круглодонну кол Комп'ютерна верстка Н Кураєва Підписне Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ДП "Український інститут промислової власності", вул Сім'ї Хохлових, 15, м Київ, 04119
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for synthesis of pyrol amines
Назва патенту російськоюСпособ синтеза амидов пирола
МПК / Мітки
МПК: C07D 401/12, C07C 271/14, C07D 307/93, C07D 407/12, C07D 405/12, C07D 209/42, C07D 307/84, C07D 209/52, C07D 307/83
Мітки: піролоамідів, спосіб, одержання, фураноамідів
Код посилання
<a href="https://ua.patents.su/13-61123-sposib-oderzhannya-piroloamidiv-i-furanoamidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання піролоамідів і фураноамідів</a>
Наступний патент: Кондитерський виріб
Випадковий патент: Поливна карта рисової системи для поливу дощуванням