Інгібітори дпiv на основі глютамінілу
Номер патенту: 76309
Опубліковано: 17.07.2006
Автори: Гоффманн Торстен, Гайзер Ульріх, Демут Ганс-Ульріх
Формула / Реферат
1. Сполука формули:
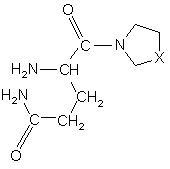 ,
,
де X=CH2 або S, або її сіль приєднання.
2. Сполука за п. 1, де адитивну сіль вибирають з групи, в яку залучено солі гідрохлоридної, гідробромідної, перхлоратної, сульфатної, нітратної, фосфатної, оцтової, пропіонової, гліколевої, молочної, бурштинової, малеїнової, фумарової, яблучної, винної, лимонної, бензойної, мигдалевої, метансульфонової, гідроксіетансульфонової, бензолсульфонової, щавлевої, памової, 2-нафталінсульфонової, п-толуолсульфонової, циклогексансульфамової, саліцилової, сахаринової та трифлуороцтової кислот.
3. Сполука за п. 1 або п. 2, яка є адитивною сіллю сполуки формули:
 ,
,
де Х=СH2 або S; а адитивну сіль вибирають з групи, в яку залучено солі гідрохлоридної, гідробромідної, перхлоратної, нітратної, пропіонової, гліколевої, молочної, малеїнової, яблучної, лимонної, бензойної, мигдалевої, метансульфонової, гідроксіетансульфонової, бензолсульфонової, щавлевої, памової, 2-нафталінсульфонової, п-толуолсульфонової, циклогексансульфамової, саліцилової, сахаринової та трифлуороцтової кислот.
4. Сполука за п. 3, вибрана з глутамінілтіазолідину гідрохлориду та глутамінілпіролідину гідрохлориду.
5. Сполука за п. 4, яка є глутамінілтіазолідину гідрохлоридом.
6. Сполука за п. 4, яка є глутамінілпіролідину гідрохлоридом.
7. Сполука за будь-яким одним з попередніх пунктів, яку застосовують для отримання медикаменту для інгібування активності дипептидилпептидази IV або подібних до дипептидилпептидази IV ферментів для попередження або лікування хвороб або станів, асоційованих з дипептидилпептидазою IV або подібними до дипептидилпептидази IV ферментами.
8. Сполука за п. 7 для зниження підвищених рівнів глюкози у крові у ссавців, які є результатом вживання їжі.
9. Сполука за пп. 7 або 8 для попередження або лікування незалежного від інсуліну цукрового діабету, артриту, ожиріння, імунних та автоімунних розладів, алотрансплантації, раку, неврональних розладів та хвороб шкіри.
10. Сполука за п. 9 для попередження або лікування незалежного від інсуліну цукрового діабету.
11. Фармацевтична композиція, що містить фармацевтично прийнятний носій та/або розріджувач і сполуку за будь-яким одним з попередніх пунктів.
12. Спосіб інгібування активності дипептидилпептидази IV або подібних до дипептидилпептидази IV ферментів для попередження або лікування хвороб або станів, асоційованих з дипептидилпептидазою IV або подібними до дипептидилпептидази IV ферментами, спосіб полягає у застосуванні до ссавця, що потребує такого лікування, терапевтично ефективної кількості сполуки або фармацевтичної композиції за одним з пп. 1-11.
13. Спосіб за п. 12 для застосування при зниженні рівнів глюкози у крові у ссавців, які є результатом вживання їжі.
14. Спосіб за пп. 12 або 13 для застосування при попередженні або лікуванні хвороб або станів, вибраних з групи, що складається з незалежного від інсуліну діабету, цукрового діабету, артриту, ожиріння, імунних та автоімунних розладів, алотрансплантації, раку, неврональних розладів та хвороб шкіри.
15. Спосіб за п. 14 для застосування при попередженні або лікуванні незалежного від інсуліну цукрового діабету.
16. Продукт розкладання сполуки за пп. 1, 3 або 5, що має формулу
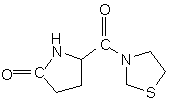 .
.
Текст
1. Сполука формули: O 2 (13) 1 3 76309 4 6. Сполука за п. 4, яка є глутамінілпіролідину гідтидазою IV або подібними до дипептидилпептидарохлоридом. зи IV ферментами, спосіб полягає у застосуванні 7. Сполука за будь-яким одним з попередніх пункдо ссавця, що потребує такого лікування, терапевтів, яку застосовують для отримання медикаменту тично ефективної кількості сполуки або фармацедля інгібування активності дипептидилпептидази втичної композиції за одним з пп. 1-11. IV або подібних до дипептидилпептидази IV фер13. Спосіб за п. 12 для застосування при зниженні ментів для попередження або лікування хвороб рівнів глюкози у крові у ссавців, які є результатом або станів, асоційованих з дипептидилпептидазою вживання їжі. IV або подібними до дипептидилпептидази IV фе14. Спосіб за пп. 12 або 13 для застосування при рментами. попередженні або лікуванні хвороб або станів, 8. Сполука за п. 7 для зниження підвищених рівнів вибраних з групи, що складається з незалежного глюкози у крові у ссавців, які є результатом вживід інсуліну діабету, цукрового діабету, артриту, вання їжі. ожиріння, імунних та автоімунних розладів, ало9. Сполука за пп. 7 або 8 для попередження або трансплантації, раку, неврональних розладів та лікування незалежного від інсуліну цукрового діахвороб шкіри. бету, артриту, ожиріння, імунних та автоімунних 15. Спосіб за п. 14 для застосування при поперерозладів, алотрансплантації, раку, неврональних дженні або лікуванні незалежного від інсуліну цукрозладів та хвороб шкіри. рового діабету. 10. Сполука за п. 9 для попередження або ліку16. Продукт розкладання сполуки за пп. 1, 3 або 5, вання незалежного від інсуліну цукрового діабету. що має формулу 11. Фармацевтична композиція, що містить фарO мацевтично прийнятний носій та/або розріджувач і H сполуку за будь-яким одним з попередніх пунктів. C N N 12. Спосіб інгібування активності дипептидилпепO C тидази IV або подібних до дипептидилпептидази S IV ферментів для попередження або лікування . хвороб або станів, асоційованих з дипептидилпеп Представлений винахід стосується інгібування дипептидил-пептидази IV, а більш конкретно, стосується глутамініл-піролідину та глутамінілтіазолідину, фармацевтичних композицій, що містять вказані сполуки, та застосування вказаних сполук при інгібуванні активності дипептидилпептидази IV та ферментів типу дипептидилпептидази IV. Дипептидил-пептидаза IV (DPIV) є серинпротеазою, яка відщеплює N-термінальні дипептиди від пептидного ланцюга, що містить, переважно, проліновий залишок у передостанній позиції. Хоча біологічну роль DPIV у системах ссавців не встановлено повністю, можна вважати, вона грає важливу роль у нейропептидному метаболізмі, активації Т-клітин, приєднанні ракових клітин до ендотелію та вході ВІЛ у лімфоїдні клітини. Подібно, виявлено, що DPIV є відповідною для інактивування глюкагон-подібного пепти-ду-1 (GLP-1) та залежного від глюкози інсулінотропного пептиду, також відомого як шлунково-інгібіторний пептид (GIP). Оскільки GLP-1 є головним стимулятором панкреатичної секреції інсуліну та має прямий корисний вплив на регуляцію глюкози, у WO 97/40832 та US 6303661 інгібування активності DPIV та DPIV-подібних ферментів показане як притягальний підхід, наприклад, для лікування незалежного від інсуліну цукрового діабету (NIDDM). Згідно з аспектом представленого винаходу запропоновано нові інгібітори DPIV, які є ефективними, наприклад, у лікуванні станів, опосередкованих інгібуванням DPIV та DPIV-подібних ферментів, фармацевтичні композиції, наприклад, корисні при інгібуванні DPIV та DPIV-подібних фе рментів, та спосіб інгібування вказаної активності ферментів. Згідно з другим аспектом винаходу запропоновано спосіб лікування, зокрема, спосіб лікування цукрового діабету, особливо незалежного від інсуліну діабету (NIDDM) або діабету типу 2 та станів, асоційованих з цукровим діабетом та композиції для застосування у такий спосіб. Дипептидил-пептидаза IV (DPIV) є постпроліновою (у меншому ступеню пост-аланіновою, пост-сериновою або пост-гліциновою) відщеплюючою серин протеазою, знайденою у різних тканинах тіла, включаючи нирки, печінку та кишечник. Відомо, що інгібітори DPIV можуть бути корисними для лікування порушеної толерантності до глюкози та цукрового діабету [Міжнародна патентна заявка, номер публікації WO 99/61431, Pederson RA et al, Diabetes. 1998 Aug; 47(8): 12538 та Pauly RP et al, Metabolism 1999 Mar; 48(3):3859]. Зокрема, WO 99/61431 розкриває інгібітори DPIV, що містять амінокислотний залишок та групу тіазолідину або піролідину, та їх солі, особливо Lтрео-ізолейцил-тіазолідин, L-ало-ізолейцилтіазолідин, L-трео-ізолейцил-піролідин, Lалоізолейцил-тіазолідин, L-ало-ізолейцилпіролідин, та їх солі. Наступними прикладами стосовно інгібіторів дипептидил-пептидази IV низької молекулярної маси є агенти, як-то інгібітори похідних тетрагідроізохінолін-3-карбоксаміду, N-заміщених 2ціанопіролів та -піролідинів, N-(N'-заміщений гліцил)-2-ціанопіролідинів, N-(заміщениій гліцил)тіазолідинів, N-(заміщений гліцил)-4ціанотіазолідинів, боронілу та конденсованих з циклопропілом піролідинів. Інгібітори дипептидил 5 76309 6 пептидази IV описано у US 6011155; US 6107317; глутамініл-тіазолідин. US 6110949; US 6124305; US 6172081; WO Представлений винахід стосується інгібування 99/61431, WO 99/67278, WO 99/67279, DE дипептидил-пептидази IV (DPIV), а більш конкрет19834591, WO 97/40832, DE 1961 486 С2, WO но, стосується глутамініл-піролідину та глутамініл98/19998, WO 00/07617, WO 99/38501, WO тіазолідину, фармацевтичних композицій, що міс99J46272, WO 99/38501, WO 01/68603, WO тять вказані сполуки, та застосування вказаних 01/40180, WO 01/81337, WO 01/81304, WO сполук при інгібуванні DPIV та DPIV-подібної акти01/55105 та WO 02/02560, зміст яких уведено як вності ферментів. Представлений винахід стосупосилання у їх повноті стосовно інгібіторів, їх ється нових інгібіторів DPIV, які є ефективними, отримання та їх застосування. Представлений наприклад, у лікуванні станів, опосередкованих винахід стосується сполуки формули: інгібування DPIV, фармацевтичних композицій, наприклад, корисних при інгібуванні DPIV та DPIVподібної активності ферментів та способу інгібування DPIV та DPIV-подібної активності ферментів. Представлений винахід стосується сполуки формули: де X=СН2 або S, або її фармацевтично прийнятної, солі. Такі сполуки та їх відповідні фармацевтично прийнятні адитивні солі, є корисними у лікуванні станів, опосередкованих DPIV або DPIV-подібними ферментами, як-то артрит, ожиріння, імунні та автоімунні розлади, алотрансплантація, рак, неврональні розлади та хвороби шкіри. Згідно з більш кращим втіленням сполуки представленого винаходу посилюють толерантність до глюкози зниженням підвищених рівнів глюкози у крові у реакції на пероральне стимулювання глюкозою, а відтак є корисними у лікуванні незалежного від інсуліну цукрового діабету. Далі розуміти представлений винахід можна посиланням на графіки: Фіг.1 показує активність DPIV у плазмі у сироватці щурів Wistar після перорального та внутрішньосудинного застосування 100 мг/кг маси тіла глутамініл-піролідину; Фіг.2 показує активність DPIV у плазмі у сироватці щурів Wistar після перорального та внутрішньосудинного застосування 100 мг/кг маси тіла глутамініл-тіазолідину; Фіг.3 показує залежне від дози зниження рівнів глюкози у крові у діабетичних щурів Zucker після перорального застосування 5мг/кг, 15мг/кг, 50мг/кг маси тіла глутамініл-піролідин та плацебо, відповідно; Фіг.4 показує залежне від дози зниження рівнів глюкози у крові у діабетичних щурів Zucker після перорального застосування 5мг/кг, 15мг/кг, 50мг/кг маси тіла глутамініл-тіазолідину та плацебо, відповідно; Фіг.5 показує хімічну структуру піроглутамінілтіазолідину, продукту розкладання, знайденого після перорального застосування глутамінілтіазолідину до щурів Wistar; a Фіг.6 показує хроматограму екстракту плазми щурів, отриману після перорального застосування глутамініл-тіазолідину до жирних щурів Zucker. Пік на 2,95 хвилину представляє глу-тамінілтіазолідин, а пік на 6,57 хвилину представляє піро а особливо сполуки формули (І) або фармацевтично її прийнятної солі. Наступною кращою сполукою представленого винаходу є сполука формули II: або її фармацевтично прийнятна сіль. Сполуки представленого винаходу можна перетворити у адитивні солі, особливо фармацевтично прийнятні кислотно-адитивні солі. Фармацевтично прийнятна сіль загалом має форму, в якій основний бічний ланцюг амінокислоти є протонованим неорганічною або органічною кислотою. 7 76309 8 Органічні або неорганічні кислоти залучають гідсвинячих нирок. Величини Кі сполук представлерохлоридну, гідробромідну, перхлоратну, сульфаного винаходу визначають для глутамінілтну, нітратну, фосфатну, оцтову, пропіонову, глітіазолідину як Кі=4,03·10-7Μ±2,19·10-10Μ після 5 колеву, молочну, бурштинову, малеїнову, хвилин 5,13·10-7Μ±1,26·10-8Μ після 22 годин попефумарову, яблучну, винну, лимонну, бензойну, реднього інкубування, та для глутамініл-піролідину -8 -8 мигдальну, метансульфонову, гідроксіетансульяк Кі=1,30·10 Μ±4,89·10 Μ після 5 хвилин та -6 -8 фонову, бензолсульфонову, щавлеву, памову, 21,36·10 Μ±3,21·10 Μ після 22 годин попереднього нафталінсульфонову, п-толуолсульфонову, циклоінкубування у плазмі людини. гексансульфамову, саліцилову, сахаринову або Здатність сполук представленого винаходу та трифлуороцтову кислоту. Усі форми фармацевтивідповідних форм їх фармацевтично прийнятних чно прийнятних адитивних солей сполук предстаадитивних солей до інгібування DPIV in vivo можна вленого винаходу включено у рамки цього винапоказати пероральним або внутрішньосудинним ходу. застосуванням до щурів Wistar, як описано у прикЗ огляду на близьку спорідненість між вільниладі 9. Сполуки представленого винаходу інгібуми сполуками та сполуками у формі їх солей, коли ють активність DPIV in vivo після перорального та ж сполуку згадано у цьому контексті, відповідну внутрішньосудинного застосування до щурів сіль також мають на увазі, за умови, що це можлиWistar. ве або прийнятне у цих обставинах. DPIV наявна у багатьох органах та тканинах Представлений винахід стосується також проссавців, наприклад, кишковій щітковій каймі ліків сполук цього винаходу. Взагалі, такі проліки (Gutschmidt S. et al., "In situ" - measurements of повинні бути функціональними похідними сполук, protein contents in the brush border region along rat які легко перетворюються in vivo у бажану терапеjejunal villi and their correlations with four enzyme втично активну сполуку. Відтак, у цих випадках, activities ("In situ" - виміри вмісту білку у регіоні способах лікування представленого винаходу, щіткової кайми вздовж єюнальних ворсинок щура термін "застосування" стосується лікування різних та їх кореляції з активностями чотирьох ферменописаних розладів пролікувальними варіантами тів). Histochemistry 1981, 72 (3), 467-79), зовнішодної або більше із заявлених сполук, але які пеньосекреторному епітеліальних тканинах, гепаторетворюються у вищезазначені конкретні сполуки цитах, ниркових канальцях, ендотеліальних in vivo після застосування до суб'єкта. Звичайні тканинах, міофібробластах (Feller A.C. et al., A способи селекції та отримання придатних похідних monoclonal antibody detecting dipeptidylpeptidase IV проліків описано, наприклад, у ["Design of in human tissue (Визначення дипептидилпептидази Prodrugs", ed. H. Bundgaardv Elsevier, 1985 та паIV моноклональних антитіл тканині у людини) тентні заявки DE 19828113, DE 19828114, WO Virchows Arch. A. Pathol. Anat. Histopathol. 1986; 99/67228 та WO 99/67279 як є повністю наведено 409 (2):263-73), нервових клітинах, латеральних тут як посилання]. мембранах деяких поверхневих епітеліальних ткаКоли сполуки згідно з цим винаходом мають нин, наприклад, фаллопієвих труб, матки та везипринаймні один хіральний центр, вони можуть відкулярної залози, у порожнинній цитоплазмі, наприповідно існувати як енантіомери. Коли сполуки клад, епітеліальній тканині везикулярної залози, та мають два або більше хіральних центрів, вони у клітинах слизової дуоденальної залози (Hartel S. можуть також існувати як діастереомери. Треба et al., Dipeptidyl peptidase (DPP) IV in rat organs. розуміти, що усі так ізомери та суміші їх охоплено Comparison of irnmunohistochemistry and activity рамками представленого винаходу. Далі, деякі з histochemistry (Дипептидил-пептидаза (DPP) IV в кристалічних форм сполук можуть існувати як поорганах щурів. Порівняння імуногістохімії та гістоліморфи та як такі охоплені представленим винахімічної активності. Histochemistry 1988; 89 (2): ходом. На додаток, деякі сполуки можуть утворю151-61), репродуктивних органах, наприклад, хвовати сольвати з водою (тобто гідрати) або сті придатку яєчка та ампулі, сім'яних везикулах та звичайними органічними розчинниками, і такі соїх секреції (Agrawal & Vanha-Perttula, Dipeptidyl львати також охоплено рамками цього винаходу. peptidases in bovine reproductive organs and Сполуки, включаючи їх солі, можна також secretions (Дипептидил-пептидази у коров'ячих отримувати у формі їх гідратів, або залучають інші репродуктивних органах та секреції. Int. J. Androl. розчинники, використані для їх кристалізації. 1986,9 (6): 435-52). У сироватці людини наявні дві Як вище зазначено, сполуки представленого молекулярні форми дипептидил-пептидази винаходу, а особливо сполуки формул І та II, та (Krepela E. et al., Demonstration of two molecular відповідні форми їх фармацевтично прийнятних forms of dipeptidyl peptidase IV in normal human адитивних солей, є корисними при інгібуванні акserum (Демонстрація двох молекулярних форм тивності DPIV та DPIV-подібного ферменту. Здатдипептидил-пептидази IV у сироватці нормальної ність сполук представленого винаходу та відповідлюдини. Physiol. Bohemoslov. 1983, 32 (6): 486-96). них форм їх фармацевтично прийнятних Сироваточна форма DPIV високої молекулярної адитивних солей до інгібування активності DPIV та маси експресується на поверхні активованих ТDPIV-подібного ферменту можна показати аналіклітин (Duke-Cohan J.S. et al., Serum high molecular зом активності DPIV для визначення величин Кі in weight dipeptidyl peptidase IV (CD26) is similar to a vitro та у плазмі людини, як описано у прикладах 4 novel antigen DPPT-L released from activated Τ cells та 5. Величини Кі сполук представленого винаходу (Сироваточна дипептидил-пептидаза IV високої визначають для глутамініл-тіазолідину як молекулярної маси (CD26) є подібною новому анКі=3,12·10-7Μ±5,11·10-10Μ та для глутамінілтигену DPPT-L, вивільненому з активованих Тпіролідину як Кі=1,30·Кi-6Μ±8,49·10-8Μ проти DPIV клітин. J. Immunol. 1996,156(5): 1714-21). 9 76309 10 Сполуки представленого винаходу та відповіферментів можна показати аналізом активності дні форми їх фармацевтично прийнятних адитивферментів для визначення величин Кі in vitro, як них солей здатні інгібувати DPIV in vivo. Згідно з описано у прикладі 6. Величини Кі сполук предстаодним втіленням представленого винаходу усі вленого винаходу для свинячої дипептидилмолекулярні форми, гомологи та епітопи DPIV від пептидази II визначають як Кі=8,52·10-5М±6,33·106 усіх тканин та органів ссавців, а також досі невияМ для глутамініл-піролідину і Кі= ,07·10 5 -7 влених, охоплено рамками цього винаходу. М±3,81·10 Μ для глутамініл-тіазолідину. Усі споСеред рідкісної групи пролін-специфічних пролуки інгібують свинячу дипептидил-пептидазу II. теаз тільки DPIV, як спочатку вважали, є мембраЗгідно з другим втіленням представленого вино-зв'язаним ферментом, специфічним стосовно находу, сполуки представленого винаходу, та відпроліну як передостаннього залишку на аміноповідні форми їх фармацевтично прийнятних адизакінченні поліпептидного ланцюга. Однак, інші тивних солей мають тільки низьку, або не мають молекули, навіть структурно негомологічні з DPIV, інгібіторної активності стосовно не-DPIV та Heале виявляючі відповідну ферментну активність, DPIV-подібних пролін-специфічних ферментів. Як зараз ідентифіковано. DPIV-подібні ферменти, які описано у прикладі 7, з глутамініл-тіазолідином та ідентифіковано, представляють, наприклад, білок глутамініл-піролідином не виявлено інгібування дипептидил-пептидази І та проліл-олігопептидази. активації фібробласту, дипептидил-пептидазу Стосовно пролідази обидві сполуки показали поміIV , дипептидил-амінопептидазо-подібний білок, тно нижчу ефективність порівняно з DPIV. ВеличиN-ацетиловану екс-зчеплену кислотну дипептидани ІК50 проти пролідази визначають як ІК50>3мМ зу, пролін-дипептидазу статичних клітин, дипептидля глутамініл-тіазолідину та як ІК50=3,4·10дил-пептидазу II, атрактин та споріднений з дипеп4 Μ±5,63·105 для глутамініл-піролідину. тидил-пептидазою IV білок (DPP 8), їх описано в З огляду на їх здатність до інгібування активогляді Sedo & Malik (Sedo & Malik, Dipeptidyl ності DPIV та DPIV-подібного ферменту, сполуки peptidase IV-like molecules: homologous proteins or представленого винаходу, особливо сполуки форhomologous activities? (Подібні дипептидилмул І та II, та відповідні форми їх фармацевтично пептидазі IV молекули: гомологічні білки або гомоприйнятних адитивних солей корисні у лікуванні логічні активності?) Biochimica et Biophysica Acta станів, опосередкованих вказаною активністю фе2001, 36506:1-10). рментів. Відтак, сполуки, розкриті тут, є корисними Наступні DPIV-подібні ферменти розкрито у у лікуванні станів, як-то незалежного від інсуліну WO 01/19866, WO 02/04610, WO 02/34900 та WO цукрового діабету, артриту, ожиріння, імунних та 02/31134. WO 01/19866 розкриває нову дипептиавтоімунних розладів, алотрансплантації, раку, дил-амінопептидаз людини (DPP8) зі структурною неврональних розладів типу розсіяного склерозу та функціональною подібністю з DPIV та активата хвороб шкіри. ційним білком фібробласту (FAP). WO 02/04610 Згідно з більш кращим втіленням цього винарозкриває реагенти, які регулюють подібний до ходу, сполуки представленого винаходу та відподипептидил-пептидази IV фермент людини та реавідні форми їх фармацевтично прийнятних адитигенти, які приєднуються до подібного до дипептивних солей, посилюють толерантність до глюкози дил-пептидази IV ферменту генного продукту люзниженням підвищених рівнів глюкози у крові у дини. Ці реагенти можуть грати роль у реакції на пероральне стимулювання глюкозою, а попередженні, поліпшенні, або корекції дисфункцій відтак є корисними у лікуванні незалежного від або хвороб, включаючи, але без обмеження, пухінсуліну цукрового діабету. Здатність сполук предлини та розлади периферійної та центральної неставленого винаходу та відповідних форм їх фаррвової системи, включаючи біль та нейродегенемацевтично прийнятних адитивних солей до посиративні розлади. Подібний дипептидил-пептидазі лення толерантності до глюкози у реакції на IV фермент з WO 02/04610 добре відомий у рівні пероральне стимулювання глюкозою, можна вимітехніки. У базі даних Gene Bank цей фермент зарювати у діабетичних щурів Zucker. Спосіб описареєстровано як КІАА1492 (зареєстровано у лютоно у прикладах 10 та 11. Пероральне застосування му 2001, представлено на розгляд 04.04.2000, 5мг/кг маси тіла, 15мг/кг та 50мг/кг маси тіла глуAB040925). WO 02/34900 розкриває дипептидилтамініл-тіазолідину або глутамініл-піролідину припептидазу9 (DPP9) зі значною гомологією з амінозводить до залежного від дози зниження підвищекислотними послідовностями DPIV та DPP8. WO них рівнів глюкози у крові, а відтак до поліпшення 02/31134 розкриває три DPIV-подібні ферменти, толерантності до глюкози у діабетичних щурів DPRP1, DPRP2 та DPRP3. Аналіз послідовності Zucker. виявив, що DPRP1 є ідентичним DPP8, як розкриСполуки представленого винаходу, згідно з то у WO 01/19866, що DPRP2 є ідентичним DPP9, прикладом 5, стабільні у плазмі людини. Несподіта що DPRP3 є ідентичним КІМ1492, як розкрито у вано, та як наступне краще втілення представлеWO 02/04610. ного винаходу, сполуки представленого винаходу Згідно з другим кращим втіленням представта відповідні форми їх фармацевтично прийнятних леного винаходу, усі молекулярні форми, гомологи адитивних солей, можуть розкладатися in vivo піста епітопи білків, що містять ферменти з подібною ля застосування до ссавця. Здатність сполук до DPIV активністю, від усіх тканин та органів ссапредставленого винаходу та їх відповідних фарвців, також тих, які є досі невиявленими, охоплено мацевтично прийнятних адитивних солей розкларамками цього винаходу. датися in vivo можна визначити на моделі щурів Здатність сполук представленого винаходу та Wistar та наступним аналізом РХ/МС. Глутамінілвідповідних форм їх фармацевтично прийнятних тіазолідин, як виявлено, розкладається після пеадитивних солей до інгібування DPIV-подібних 11 76309 12 рорального застосування до щурів Wistar, до відтаблетки та капсули представляють найпереважповідного піроглутамініл-тіазолідину. ніше пероральні одиничні форми дозування, в Представлений винахід відтак стосується спояких застосовують тверді фармацевтичні носії. За собу лікування стану, опосередкованого модуляцібажанням таблетки можна покривати цукром або єю активності DPIV та DPIV-подібного ферменту у ентеросолюбільним покриттям стандартними спосуб'єкту, що цього потребує, спосіб полягає у засобами. Для парентеральних засобів носій звистосуванні будь-якої сполуки представленого вичайно містить стерильну воду, хоча можуть бути находу або її фармацевтичної композиції у кількозалученими інші інгредієнти, наприклад, для пості та режимі дозування терапевтично ефективних ліпшення розчинності або для консервування. для лікування стан. Крім того, представлений виПридатні для ін'єкцій суспензії можна також нахід стосується застосування сполук представлеотримати, в них можна застосовувати прийнятні ного винаходу та їх відповідних фармацевтично рідкі носії, суспендувальні засоби тощо. Фармацеприйнятних адитивних солей для отримання медивтичні композиції міститимуть, на одиницю дозукаменту для попередження або лікування стану, вання, наприклад, таблетку, капсулу, порошок, опосередкованого модуляцією активності DPIV у ін'єкцію, повну чайну ложку тощо, кількість активсуб'єкту. Сполуку можна застосовувати до пацієнного інгредієнту, необхідну для постачання вищета будь-яким звичайним шляхом застосування, зазначеної ефективної дози. Фармацевтичні комвключаючи, але без обмеження, внутрішньовенпозиції міститимуть на одиницю дозування, ний, пероральний, підшкірний, внутрішньом'язонаприклад, таблетку, капсулу, порошок, ін'єкцію, вий, інтрадермальний та парентеральний. повну чайну ложку, супозиторій, тощо, приблизно Згідно з другим втіленням представлений вивід 0,01мг до 1000мг (переважно приблизно від 5 нахід стосується рецептур сполук представленого до 500мг) та можуть застосовуватися при дозувинаходу та їх відповідних фармацевтично прийнванні приблизно від 0,1 до 300мг/кг маси тіла на ятних адитивних солей у фармацевтичних комподобу (переважно 1-50мг/кг на добу). Дозування зиціях. однак, може змінюватися залежно від потреб паціТермін "суб'єкт", що використано тут, стосуєнтів, суворості стану, що лікують та сполуки, що ється тварини, переважно ссавця, найпезастосовують. Можна застосовувати добове зареважніше людини, що є об'єктом лікування, спостосування або пост-періодичне дозування. Звистереження або експерименту. чайно дозування регулюватиме лікар залежно від Термін "терапевтично ефективна кількість", що особливостей пацієнта, його стану та бажаної тевикористано тут, стосується кількості активної рапевтичної дії. сполуки або фармацевтичного агенту, що виявляє Переважно ці композиції мають форми одибіологічну або медичну реакцію у тканинній систениць дозування, як-то таблетки, пілюлі, капсули, мі, тварині або людині, яку вивчає дослідник, вепорошки, гранули, стерильні парентеральні розчитеринар, лікар або інший клініцист, яка залучає ни або суспензії, дозовані аерозольні або рідкі полегшення симптомів хвороби або розладу, що спреї, краплі, ампули, автоін'єкційні пристрої або лікують. супозиторії; для перорального, парентерального, Як використано тут, термін "композиція" стосуінтраназального, сублінгвального або ректального ється продукту, що містить заявлені сполуки у тезастосування, або для застосування інгаляцією рапевтично ефективній кількості, а також будьабо вдуванням. Альтернативно, композиція може якого продукту, який походить, безпосередньо або мати форму, придатну для застосування раз на небезпосередньо, від комбінації заявлених сполук. тиждень або раз на місяць; наприклад, нерозчинну Для отримання фармацевтичної композиції сіль активної сполуки, як-то деканоат, можна присцього винаходу одну або більше сполук представтосувати для забезпечення отримання депо для леного винаходу, особливо сполук формул І або II внутрішньом'язових ін'єкцій. Для отримання тверта відповідних форм їх фармацевтично прийнятдої композиції, як-то таблетки, головний активний них адитивних солей як активний інгредієнт переінгредієнт перемішують до однорідності з фармамішують до однорідності з фармацевтичним носіцевтичним носієм, наприклад, звичайними таблеєм звичайними фармацевтичними способами тувальними інгредієнтами, як-то кукурудзяний кросполучення, носій може мати багато форм залежхмаль, лактоза, сахароза, сорбіт, тальк, но від форми бажаного для застосування препастеаринова кислота, магній стеарат, дикальцій рату, наприклад, перорального або парентеральфосфат або камеді, та інші фармацевтичні розріного, як-то внутрішньом'язового. В отриманій джувачі, наприклад, вода, для утворення твердої композиції у пероральній формі дозування може попередньої композиції рецептури, що містить бути застосованим будь-яке зі звичайних фармагомогенну суміш сполуки представленого винахоцевтичних середовищ. Відтак, для рідких перораду, або її фармацевтично прийнятної солі. Стосовльних препаратів, як-то, наприклад, суспензії, еліно цієї попередньої композиції рецептури як гомоксири та розчини, придатні носії та адитиви генної, мають на увазі, що активний інгредієнт можуть переважно залучають воду, гліколі, олії, ідеально диспергований рівномірно по композиції спирти, ароматизатори, консерванти, барвники так, щоб композицію можна було легко поділити на тощо; для твердих пероральних препаратів, як-то, рівні ефективні форми дозування, як-то таблетки, наприклад, порошки, капсули, желатинові капсули пілюлі та капсули. Цю тверду попередню композита таблетки, придатні носії та адитиви залучають цію рецептури можна тоді поділити на вищеописакрохмалі, цукри, розріджувачі, гранулювальні зані типи форми одиниць дозування, що містять соби, лубриканти, зв'язувальні засоби, дезинтегприблизно від 0,1 до 1000мг, переважно приблизратори тощо, внаслідок легкості їх застосування но від 5 до 500мг активного інгредієнту представ 13 76309 14 леного винаходу. композиції, що містить одну або більше вищезаТаблетки або пілюлі нової композиції можуть значених сполук та фармацевтично прийнятний переважно бути покритими або інакше сполучениносій. Фармацевтична композиція може містити ми для забезпечення форми дозування, що надає приблизно між 0,01мг та 1000мг, переважно прибпереваги пролонгованої дії, наприклад, таблетка лизно 5-500мг сполуки, та може бути складеною у або пілюля можуть містити внутрішній компонент будь-яку форму, придатну для вибраного режиму дозування та зовнішній компонент дозування, застосування. Носії залучають необхідні та інертні останній є у формі оболонки поверх попередньої. фармацевтичні ексципієнти, включаючи, але без Два компоненти можуть бути розділені шаром енобмеження, зв'язувальні засоби, суспендувальні теросолюбільного покриття, яке перешкоджає дезасоби, лубриканти, ароматизатори, підсолоджузинтеграції у шлунку та дозволяє внутрішнньому вачі, консерванти, барвники та покриття. Композикомпоненту пройти у дванадцятипалу кишку мати ції, придатні для перорального застосування, зазатримане вивільнення. Різні матеріали можна лучають тверді форми, як-то пілюлі, таблетки, використовувати для таких шарів ентеросолюбількапсули (включаючи рецептури негайного вивільного покриття, такі матеріали залучають ряд полінення, хронованого вивільнення та безперервного мерних кислот з такими матеріалами як шелак, вивільнення), гранули, та порошки, та рідкі форми, цетиловий спирт та ацетат целюлози. як-то розчини, сиропи, еліксири, емульсії, та суРідкі форми, в яких нові композиції представспензії. Форми, корисні для парентерального заленого винаходу можуть переважно бути комбіностосування, залучають стерильні розчини, емульваними для застосування перорально або ін'єкцісії та суспензії. Переважно, сполуки ями залучають водні розчини, належно представленого винаходу можна застосовувати ароматизовані сиропи, водні або олійні суспензії, одиничною добовою дозою, або загальне добове та ароматизовані емульсії з їстівними оліями, як-то дозування можна застосовувати роздільними добавовняна олія, кунжутна олія, кокосова олія або зами два, три або чотири рази на добу. Далі, споарахісова олія, а також еліксири та подібні фармалуки представленого винаходу можна застосовуцевтичні наповнювачі. Придатні диспергувальні вати у інтраназальній формі шляхом місцевого або суспендувальні засоби для водних суспензій застосування придатного інтраназального наповзалучають синтетичні та природні камеді, як-то нювачу, або трансдермальним шляхом з пластитрагаканту, акації, алгінат, декстран, натрій карборами, що добре відомо фахівцям. Для застосуванксиметилцелюлозу, метилцелюлозу, полівінілпіроня у формі трансдермальної системи постачання лідон або желатин. дозування буде скоріше безперервним, а не переКоли способи отримання сполук згідно з винаривчастим дозуванням і інтенсивність дозування ходом дають суміш стереоізомерів, ці ізомери мотреба відповідно модифікувати для отримання жна розділяти звичайними способами, як-то пребажаної терапевтичної дії. паративною хроматографією. Сполуки можна Краще для перорального застосування у форотримати у рацемічній формі, або індивідуальні мі таблеток або капсул, щоб активний компонент енантіомери можна отримати енантіоспецифічним ліків був скомбінований з пероральним, нетоксичсинтезом або розділенням. Сполуки можна, наприним фармацевтично прийнятним інертним носієм, клад, розділяти на їх компонентні енантіомери як-то етанол, гліцерин, вода тощо. Більш того, стандартними способами, як-то утворення діастеколи бажано або необхідно, можна також додавареомерних пар утворенням солі з оптично активти у суміш придатні зв'язувальні засоби; лубриканною кислотою, як-то (-)-ді-п-толуоїл-L-винною кисти, дезинтегратори та барвники. Придатні зв'язулотою та/або (+)-ді-п-толуоїл-L-винною кислотою, вальні засоби залучають, без обмеження, з наступною фракційною кристалізацією та регекрохмаль, желатин, природні цукри, як-то глюкоза нерацією вільної основи. Сполуки можна також або беталактоза, кукурудзяні підсолоджувачі, прирозділяти утворенням діастереомерних естерів родні та синтетичні камеді, як-то акації, трагаканту, або амідів з наступним хроматографічним роздіабо натрій олеат, натрій стеарат, магній стеарат, ленням та видалення хірального допоміжнику. натрій бензоат, натрій ацетат, натрій хлорид тощо. Альтернативно, сполуки можна розділяти застосуДезинтегратори залучають, без обмеження, крохванням хіральної колонки ВЕРХ. маль, метилцелюлозу, агар, бентоніт, ксантанову Протягом будь-якого зі способів отримання камедь тощо. сполук представленого винаходу, може бути необРідкі форми придатні у ароматизованих сухідним та/або бажаним захищати чутливі або реаспендувальних чи диспергувальних засобах, як-то кційні групи на будь-якій з потрібних молекул. Цьосинтетичні та природні камеді, наприклад, трагаго можна досягти звичайними захисними групами, канту, акації, метил-целюлози тощо. Для парентеяк-то описаними у [Protective Groups у Organic рального застосування бажаними є стерильні суChemistry, ed. J.F.W. McOmie, Plenum Press, 1973; спензії та розчини. Ізотонічні препарати, які та T.W. Greene & P.G.M. Wuts, Protective Groups у загалом містять придатні консерванти, застосовуOrganic Synthesis. John Wiley & Sons, 1991, що ють, коли бажаним є внутрішньовенне застосунаведено тут як посилання]. Захисні групи можна вання. видалити на зручному наступному етапі відомими Сполуку представленого винаходу можна тау рівні техніки способами. кож застосовувати у формі ліпосомних систем поСпосіб лікування станів, модульованих дипепстачання, як-то невеликих одношарових пухирців, тидил-пептидазою IV та DPIV-подібними ферменвеликих одношарових пухирців та багатошарових тами, описаний у представленому винаході, можна пухирців. Ліпосоми можна створювати з різних також провадити застосуванням фармацевтичної фосфоліпідів, як-то холестерин, стеариламін або 15 76309 16 фосфатидилхоліни добре відомими у рівні техніки ат) (0,937мл, 7,21ммоль) та 4-метилморфолін способами. (0,795мл, 7,21ммоль) додають та розчин переміСполуки представленого винаходу можна ташують протягом 15 хвилин Утворення змішаного кож сполучати з розчинними полімерами як націангідриду перевіряють ТШХ (елюент: СНСІ3/МеОН: лювані носії ліків. Такі полімери можуть залучати 9/1). Після нагрівання до -10°С додають піролідин полівінілпіролідон, кополімер пірану, полігідрокси(0,596мл, 7,21ммоль). Суміш доводять до кімнатпропілметакриламідофенол, полігідроксіетиласпаної температури та перемішують протягом ночі. ртамідофенол, або поліетиленоксидполілізин, заОбробка: міщений палмітоїльним залишком. Далі, сполуки Утворений осад відфільтровують та розчинник представленого винаходу можна сполучати з біовипарюють. Утворене масло переносять у етиларозкладними полімерами, корисними у досягненні цетат (20мл) та промивають насиченим розчином регульованого вивільнення ліків, наприклад, полінатрій гідросульфату, а потім насиченим розчином оцтовою кислотою, поліепсилонкапролактоном, натрій гідрокарбонату, водою та розсолом. Органіполігідроксимасляною кислотою, поліортоестерачний шар відділяють, сушать та випарюють. Утвоми, поліацеталями, полідигідропіранами, поліціарений продукт перевіряють на чистоту ТШХ (елюноакрилатами та перехресно-зчепленими або амент: СНСІ3/МеОН: 9/1). Вихід: 1,18г, твердий фіпатичними блоккополімерами гідрогелей. воскоподібний продукт. Сполуки цього винаходу можна застосовувати Розщеплення: у будь-якій з вищезазначених композицій та згідно 1,18г утвореної твердої Z-захищеної сполуки з режимами дозування, встановленими у рівні техрозчиняють у 40мл абсолютного етанолу. У розчин ніки, коли потрібне лікування певних розладів. додають приблизно 20мг Pd на активованому вуДобове дозування продуктів може змінюватигіллі (10%, FLUKA) та суспензію струшують в атся в межах від 0,01 до 1,000мг для дорослої людимосфері водню протягом 3 годин. Перебіг реакції ни на добу. Для перорального застосування комконтролюють ТШХ (елюент: СНСІ3/МеОН: 9/1). позиції переважно запропоновані у формі Після завершення реакції розчинник видаляють таблеток, що містять, 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, для забезпечення вільної основи. Вихід: 99% Пе5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250, 500 та ревіряють чистоту за допомогою ТШХ: н1000мг активного інгредієнту для симптоматичного бутанол/АсОН/вода/етилацетат: 1/1/1/1, Rf - 0,4. дозування для пацієнта, якого лікують. Ефективна Ідентичність продукту реакції перевіряють ЯМРкількість ліків звичайно є на рівні дозування прибаналізом. лизно від 0,1мг/кг до 300мг/кг маси тіла на добу. Приклад 2: Синтез глутамініл-тіазолідину гідКращими межами є приблизно від 1 до 50мг/кг рохлориду маси тіла на добу. Сполуки можна застосовувати у Ацилування: режимі 1-4 рази на добу. N-т-Бутил-оксикарбонілглутамін (2,0г, Оптимальне дозування для застосування мо8,12ммоль) розчиняють у 5мл ТГФ та доводять до же легко визначити фахівець, воно залежатиме від -15°С. У цю суміш додають САІВЕ (ізобутилхлорконкретної використаної сполуки, режиму застосуформіат) (1,06мл, 8,12ммоль) та 4-метилморфолін вання, інтенсивності отримання, біо-засвоюваності (0,895мл, 8,12ммоль) та розчин перемішують провнаслідок режиму застосування, та перебігу стану тягом 15 хвилин. Утворення змішаного ангідриду хвороби. На додаток, фактори, асоційовані з конкперевіряють ТШХ (елюент: СНСІ3/МеОН: 9/1). Пісретним пацієнтом, якого лікують, включаючи вік, ля нагрівання до -10°С додають ще еквівалент 4масу, харчування пацієнта та час застосування, метилморфоліну (0,895мл, 8,12ммоль) та тіазоліслід загалом враховувати при коректуванні дозудингідрохлориду (1,02г, 8,12ммоль). Суміш дововання. дять до кімнатної температури та перемішують Сполуки або композиції представленого винапротягом ночі. ходу можна брати перед помелом, при помелі або Обробка: після помелу. Утворений осад відфільтровують та розчинник Коли сполуки або композиції представленого випарюють. Утворене масло переносять у хлоровинаходу відповідають узяттю до помелу, їх прийформ (20мл) та промивають насиченим розчином мають за 1 годину, переважно 30 або навіть 15 натрій гідросульфату, а потім насиченим розчином або 5 хвилин перед їжею. натрій гідрокарбонату, водою та розсолом. ОрганіКоли сполуки або композиції представленого чний шар відділяють, сушать та випарюють. Утвовинаходу відповідають узяттю під час помелу, їх рений продукт перевіряють на чистоту ТШХ (елюможна вмішувати у порошок або приймати в окреент: СНСІ3/МеОН: 9/1). Вихід: 1,64г, твердий мій формі дозування, як вище описано. продукт. Коли сполуки або композиції представленого Розщеплення: винаходу відповідають узяттю після помелу їх мо640мг утвореної твердої Вос-захищеної сполужна приймати через 5, 15 або 30 хвилин або наки розчиняють у 3,1мл охолодженої льодом НСІ у віть 1 годину після кінцевого помелу. діоксані (12,98М, 20 еквіваленти) та залишають на Приклади льоді. Перебіг реакції контролюють ТШХ (елюент: Приклад 1: Синтез вільної основи глутамінілСНСІ3/МеОН: 9/1). Після завершення реакції розпіролідину чинник видаляють та утворене масло переносять у Ацилування: метанол та випарюють знов. Після цього утворене N-Бензил-оксикарбонілглутамін (2,02г, масло сушать фосфор-\/-оксидом та розтирають 7,21ммоль) розчиняють у 35мл ТГФ та доводять два рази з діетилетером. Перевіряють чистоту до -15°С. У цю суміш САІВЕ (ізобутилхлорформішляхом ВЕРХ. Вихід: 0,265г Перевіряють чистоту 17 76309 18 шляхом ВЕРХ. Ідентичність продукту реакції переКі=3,12·10-7Μ±5,11·10-10Μ та для глутамінілвіряють ЯМР-аналізом. піролідину як Кі=1,30МО-6Μ±8,49·10-6М. Приклад 3: Синтез глутамініл-піролідину гідроПриклад 5: Визначення Кі у плазмі людини хлориду Плазма людини має активність стосовно вивіАцилування: льнення N-термінального Хаа-Рrо. N-т-Бутил-оксикарбонілглутамін (3,0г, 70мкл глутамініл-піролідину або глутамініл12,18ммоль) розчиняють у 7мл ТГФ та доводять тіазолідину у концентраціях 1·10-5Μ-1·10-7Μ (глудо -15°С. У цю суміш додають САІВЕ (ізобутилхтамініл-піролідин) та 1·10-6Μ-1МО-8М (глутамініллорформіат) (1,6мл, 12,18ммоль) та 4тіазолідин) відповідно перемішують з 50мкл гліциметилморфолін (1,3мл, 12,18ммоль) та розчин лпроліл-4-нітроаніліну у різних концентраціях перемішують протягом 15 хвилин Утворення змі(0,4мМ, 0,2мМ, 0,1мМ, 0,05мМ) та 100мкл ГЕПЕС шаного ангідриду перевіряють ТШХ (елюент: (40мМ, рН 7,6). Аналізовану суміш попередньо СНСІ3/МеОН: 9/1). Після нагрівання до -10°С доінкубують при 30°С протягом 5 хвилин та 22 годин дають 1 еквівалент піролідину (1,0мл, відповідно. Після попереднього інкубування дода12,18ммоль). Суміш доводять до кімнатної темпеють 50мкл плазми людини та вимір розвитку жовратури та перемішують протягом ночі. того кольору внаслідок вивільнення 4-нітроаніліну Обробка: провадять при 30°С та =405нм протягом 10 хвиУтворений осад відфільтровують та розчинник лин, застосовуючи планшетний зчитувач (HTS7000 випарюють. Утворене масло переносять у хлороplus, Applied Biosystems, Weiterstadt, Germany). форм (20мл) та промивають насиченим розчином Величини Кі розраховують, застосовуючи пронатрій гідросульфату, а потім насиченим розчином грамне забезпечення Graphit 4,0,15 (Erithacus натрій гідрокарбонату, водою та розсолом. ОрганіSoftware, Ltd, UK), що базується на конкурентному чний шар відділяють, сушать та випарюють. Утвоінгібуванні DPIV глутамініл-піролідином або глутарений продукт перевіряють на чистоту ТШХ (елюмініл-тіазолідином. їх визначають для глутамінілент: СНСІ3/МеОН: 9/1). Вихід: 2,7г твердий тіазолідину як Кі=4,03·10-7Μ±2,19·10-10Μ після 5 продукт. хвилин, 5,13·10-7Μ±1,26·10-8Μ після 22 годин попеРозщеплення: реднього інкубування, та для глутамініл-піролідину 2,7г утвореного твердого продукту розчиняють як Кі=1,30·10-6Μ±4,89·10-8Μ після 5 хвилин та у 13,0мл охолодженої льодом НСІ у діоксані 1,36·10-6Μ±3,21·10-8Μ після 22 годин попереднього (12,98М, 20 еквіваленти) та залишають на льоді. інкубування. Перебіг реакції контролюють ТШХ (елюент: Приклад 6: Інгібування DPIV-подібних фермеСНСІ3/МеОН: 9/1). Після завершення реакції рознтів - дипептидил-пептидази II чинник видаляють та утворене масло переносять у DP II (3,4,14,2) вивільняє N-термінальні дипепметанол та випарюють знов. Після цього утворене тиди з олігопептидів, якщо N-закінчення не протомасло сушать фосфор-V-оксидом та розтирають новане [McDonald, J.K., Ellis, S. & Reilly, T.J., 1966, два рази з діетилетером. Вихід: 980мг ПеревіряJ. Biol. Chem., 241,1494-1501]. Pro та Ala у Р1ють чистоту шляхом ВЕРХ. Ідентичність продукту позиції є кращими залишками. Активність ферменреакції перевіряють ЯМР-аналізом. тів описано як DPIV-подібну активність, але DP II Приклад 4: Визначення Кі має кислотний рН-оптимум. Фермент, що викорисДля визначення Кі глутамініл-піролідину та тано, очищають зі свинячих нирок. глутамініл-тіазолідину застосовують дипептидилАналіз: пептидазу IV зі свинячих нирок зі специфічною 100мкл глутамініл-піролідину або глутамінілактивністю проти гліцилпроліл-4-нітроаніліну тіазолідину у концентраціях1·10-4Μ-5·10-8Μ пере37,5U/мг та концентрацію фермент 1,41мг/мл у мішують з 100мкл буферного розчину (40мМ ГЕстандартному розчині. ПЕС, рН 7,6, 0,015% Brij, 1мМ DTT), 50мкл розчину Аналіз суміші: лізилаланіламінометилкумарину (5мМ) та 20мкл 100мкл глутамініл-піролідину або глутамінілсвинячої DP II (розбавлено у 250 разів у буфернотіазолідину при концентраціях 1·10-5М-1·10-7Μ му розчині). Флуоресценцію вимірюють при 30°С -6 -8 (глутамініл-піролідин)та 1·10 Μ-1·10 Μ (глутаміпри збудження=380нм, емісії=465нм протягом 25 хвиніл-тіазолідин) відповідно перемішують з 50мкл лин, застосовуючи планшетний зчитувач гліцилпроліл-4-нітроаніліну у різних концентраціях (HTS7000plus, Applied Biosystems, Weiterstadt, (0,4мМ, 0,2мМ, 0,1мМ, 0,05мМ) та 100мкл ГЕПЕС Germany). Величини Кі розраховують, застосовую(40мМ, рН 7,6; іонна сила = 0,125). Аналізовану чи програмне забезпечення Graphit 4,0,15 суміш попередньо інкубують при 30°С протягом 30 (Erithacus Software, Ltd., UK) та визначають як хвилин Після попереднього інкубування додають Κі=8,52·10-5Μ±6,33·10-6Μ для глутамініл-піролідину 20мкл DPIV (розбавлено 1:600) та вимір розвитку та Кі=1,07·10-5Μ±3,81·10-7М для глутамінілжовтого кольору внаслідок вивільнення 4тіазолідину. нітроаніліну провадять при 30°С та =405нм проПриклад 7: Перехресно реагуючі ферменти тягом 10 хвилин, застосовуючи планшетний зчитуГлутамініл-піролідин або глутамініл-тіазолідин вач (HTS7000 plus, Applied Biosystems, Weiterstadt, тестують на їх здатність стосовно перехресного Germany). реагування відносно дипептидил-пептидази І, проВеличини Кі розраховують, застосовуючи ліл-олігопептидази та пролідази. Graphit4,0,15 (Erithacus Software, Ltd, UK), що баДипептидил-пептидаза І (DP І, катепсин С): зується на конкурентному інгібуванні DPIV глутаDP І або катепсин С є лізосомальною цистеїнмініл-піролідином або глутамініл-тіазолідином. їх протеазою, яка відщеплює дипептиди від Nвизначають для глутамініл-тіазолідину як закінчення її субстратів [Gutman, H.R. & Fruton, 19 76309 20 J.S., 1948, J. Biol: Chem., 174,851-858]. Її класифірН 7,6). Для отримання повністю активного феркують як цистеїн-протеазу. менту розчин інкубують протягом 60 хвилин при Фермент, що використано отримано від Qiagen кімнатній температурі. (Qiagen GmbH, Hilden, Germany). Для отримання Аналіз: повністю активного ферменту, фермент розбавле450мкл глутамініл-піролідину або глутамініл-3 -7 но у 1000 разів у буфері MES рН 5,6 (40мМ MES, тіазолідину у концентраціях 5·10 Μ-5·10 Μ пере4мМ DTT, 4мМ КСІ, 2мМ EDTA, 0,015% Brij) та мішують з 500мкл буферного розчину (20мМ попередньо інкубують протягом 30 хвилин при NH4(CH3COO)2, рН 7,6) та 250мкл llе-Рrо-ОН 30°С. (0,5мМ в аналізованій суміші). Аналізовану суміш Аналіз: попередньо інкубують при 30°С протягом 5 хви50мкл глутамініл-піролідину або глутамініллин. Після попереднього інкубування 75мкл. Протіазолідину при концентраціях 1·10-5Μ-1·10-7Μ пелідази (розбавлено 1:10 у буфері для аналізу) доремішують з 110мкл суміші буфер-фермент. Анадають та вимір провадять при 30°С та X=220нм лізовану суміш попередньо інкубують при 30°С протягом 20 хвилин, застосовуючи UV/Vis фотопротягом 15 хвилин Після попереднього інкубуметр, UV1 (Thermo Spectronic, Cambridge, UK). вання 100мкл гістидилсерил-п-нітроаніліну (2·10Величини ІК50 розраховують, застосовуючи 5 М) додають та вимір розвитку жовтого кольору програмне забезпечення Graphit 4,0,15 (Erithacus внаслідок вивільнення 4-нітроаніліну провадять Software, Ltd., UK). Їх визначають як ІК50>3мМ для глутамініл-тіазолідину та як ІК50=3,4·10-4М±5,63·10при 30°С та збудження=380нм, емісії=465нм протягом 5 для глутамініл-піролідину. 10 хвилин, застосовуючи планшетний зчитувач Приклад 8: Стабільність у плазмі (HTS7000 plus, Applied Biosystems, Weiterstadt, Для дослідження стабільності глутамінілGermany). піролідину або глутамініл-тіазолідину у плазмі люВеличини ІК50 розраховують, застосовуючи дини, активність у плазмі визначають у визначений програмне забезпечення Graphit 4,0,15 (Erithacus час. Середню активність DPIV у плазмі людини Software, Ltd., UK). Жодного інгібування активності визначають як 43,69U/мл. У робочому розчині плаферменту DP І глутамініл-піролідином або глутазму розбавляють 0,9% NaCI до фіксованого рівня мініл-тіазолідином не знайдено. активності DPIV 25 U/мл. Проліл-олігопептидаза (POP) Плазму та глутамініл-піролідин або глутамінілПроліл-олігопептидаза (EC 3,4,21,26) є ендоптіазолідин у різних концентраціях (5·10-5, 2,5·10-5, ротеазою серинового типу, яка відщеплює пептиди 1,25·10-5М у плазмі) інкубують при 37°С. У визнана N-термінальній частині зв'язку Xaa-Pro [Walter, чений час зразки збирають, застосовуючи піпеточR., Shlank, H., Glass, J.D., SchwartzJ.L. & Kerenyi, ний автомат (Gilson 215, Liquid handler, Gilson) та T.D., 1971, Science, 173,827-829]. Субстратами є переносять у мікротитрувальний планшет, що міспептиди з молекулярною масою до 3000Да. тить 5·10-5М гліцилпроліламінометилкумарину у Фермент, що використано, є рекомбінантною 0,9% NaCI + 015% Brij на комірку. Після 6 хвилин проліл-олігопептидазою людини. Рекомбінантну реакцію зупиняють додаванням ізолейцилтіазоліекспресію провадять у Е. соІі у стандартних умодину (5·10-5Μ у 0,9% розчині NaCI). вах, які описано у рівні техніки. Флуоресценцію вимірюють відносно 0,9% NaCI Аналіз: у плазмі (внутрішній стандарт), застосовуючи 100мкл глутамініл-піролідину або глутамінілпланшетний зчитувач (HTS7000plus, Applied тіазолідину у концентраціях 1·10-4Μ-5·10-8Μ переBiosystems, Weiterstadt, Germany). Напівперіод мішують з 100мкл буферного розчину (40мМ ГЕінгібіторної потужності глутамініл-піролідину або ПЕС, рН 7,6, 0,015% Brij, 1мМ DTT) та 20мкл розглутамініл-тіазолідину розраховують за залежнісчину POP. Аналізовану суміш попередньо тю активності ферменту від часу реакції. інкубують при 30°С протягом 15 хвилин. Після поДля обох сполуки, не можна було визначити переднього інкубування 50мкл розчину гліцилпронапівперіод. Субстанцію вважають стабільною у лілпроліл-4-нітроаніліну (0,29мМ) додають та виплазмі людини більше 22 годин. мір розвитку жовтого кольору внаслідок Приклад 9: Визначення інгібувальної активновивільнення 4-нітроаніліну провадять при 30°С та сті стосовно DPIV глутамініл-піролідину та глутаX=405нм протягом 10 хвилин, застосовуючи мініл-тіазолідину після перорального та внутрішпланшетний зчитувач (Sunrise, Tecan, Crailsheim, ньосудинного застосування до щурів Wistar. Germany). Тварини Величини ІК50 розраховують, застосовуючи Самці щурів Wistar (Wist(Sho)) з масою тіла програмне забезпечення Graphit 4,0,15 (Erithacus між 250 та 350г отримано від Tierzucht Sch&nwalde Software, Ltd., UK). Жодного інгібування активності (Schonwalde, Germany). POP глутамініл-піролідином або глутамінілУмови утримання тіазолідином не знайдено. Тварин тримають у клітках поодинці у звичайПролідаза (Х-Рго-дипептидаза) них умовах з регульованою температурою Пролідаза (EC 3,4,13,9) спершу описана (22±2°С) при циклі світло/темрява 12/12 годин (свіBergmann & Fruton (Bergmann, Μ. & Fruton, JS, тло на 06:00 ранку). Стандартну гранульовану їжу 1937, J. Biol. Chem. 189-202). Пролідаза вивільняє N-термінальну амінокислоту від дипептидів Хаа(ssniff Soest, Germany) та воду з крану, підкислеPro та має оптимум рН між 6 та 9. ну НСІ, дають досхочу. Пролідазу від свинячих нирок (ICN Biomedics, Вставка катетера у сонну артерію Eschwege, Germany), розчиняють (1мг/мл) у буфеПісля більше одного тижня адаптації в умовах рі для аналізу (20мМ NН4(СН3СОО)2, 3мМ МnСІ2, тримання катетери імплантують у сонну артерію 21 76309 22 щурів Wistar під загальною анестезією (інтраперидопомогою програмного забезпечення PRISM тональною ін'єкцією 0,25мл/кг Rompun* [2%], 3,02 (GraphPad Software, Inc.). Усі параметри анаBayerVital, Germany та 0,5мл/кг кетаміну 10, Atarost лізують наочно, включаючи значення та стандартGmbH & Co., Twistringen, Germany). Тваринам дане відхилення. ють одужати протягом тижня. Катетери промиваРезультати ють гепарином-фізіологічним розчином (100IU/мл) Сполуки глутамініл-піролідин та глутамінілтри рази на тиждень. У випадку дисфункції катететіазолідин у дозі 100мг/кг маси тіла відносно плара, другий катетер вставляють у контрацебо інгібують активність DPIV у плазмі після пелатеральну сонну артерію відповідного щура. Пісрорального та внутрішньосудинного застосування ля одного тижня одужання від хірургії цю тварину (дивись графіки 1 та 2) залучають у дослідження. У випадку дисфункції Приклад 10: Дослідження підвищення дози у другого катетера, тварину видаляють з дослідженжирних щурів Zucker після перорального застосуня. Уводять нову тварину та експерименти продовання глутамініл-піролідину вжують у запланованій послідовності, починаючи Тварини принаймні через 7 діб після імплантування катеN=30 самців щурів Zucker (fa/fa), середній вік тера. 11 тижнів (5-12 тижнів), середня маса тіла 350г Мета експерименту (150-400г), отримано від Charles River (Sulzfeld, До щурів зі збереженою функцією катетера заGermany). Після постачання їх тримають >12 тижстосовують плацебо (1мл фізіологічного розчин, нів, доки майже усі жирні щури Zucker не мали 0,154моль/л) або 100мг/кг маси тіла глутамінілхарактеристик вираженого цукрового діабету. Групіролідину або 100мг/кг маси тіла глутамінілпу з N=8 тварини застосовували для тестування тіазолідину пероральним та внутрішньосудинним трьох підвищуючихся доз глутамініл-піролідину (інтраартеріально) шляхом. відносно плацебо (фізіологічний розчин). Після голодування протягом ночі зразки по Умови утримання 100мкл гепаринізованої артеріальної крові збираТварин тримають у клітках поодинці у стандають на хвилину -30, -5 та 0. Тест-субстанцію розртизованих умовах з регульованою температурою чиняють безпосередньо перед цим у 1,0мл фізіо(22±2°С) при циклі світло/темрява 12/12 годин (свілогічного розчину (0,154моль/л) та застосовують тло на 06:00 ранку). Стерильну стандартну грануна хвилину 0 перорально через зонд (75мм; Fine льовану їжу (ssniff Soest, Germany) та підкислену Science Tools, Heidelberg, Germany) або внутрішНСІ воду з крана дають досхочу. ньосудинним шляхом. У випадку перорального Катетеризація сонної артерії застосування додатковий об'єм 1мл фізіологічного Жирних щурів Zucker віком 24-31 тижнів (у серозчину ін'єктують у артеріальний катетер, у випаредньому: 25 тижнів), адаптованих до умов утридку інтраартеріального застосування, катетер немання, добре готують для дослідження. гайно промивають 30мкл фізіологічного розчину та Катетери імплантують у сонну артерію жирних додатково 1мл фізіологічного розчину уводять щурів Zucker під загальною анестезією (інперорально через зонд. траперитональною ін'єкцією 0,25мл/кг Rompun Після застосування плацебо або тест[2%], BayerVital, Germany та 0,5мл/кг кетаміну 10, субстанції зразки артеріальної крові відбирають на Atarost GmbH & Co., Twistringen, Germany). Тварихвилину 2,5, 5, 7,5, 10, 15, 20, 40, 60 та 120 з катенам дають одужати протягом одного тижня. Катетера сонної артерії притомних вільних щурів. Усі тери промивають гепарином-фізіологічним розчизразки крові збирають в охолоджені льодом туби ном (100ID/мл) три рази на тиждень. Еппендорфа (Eppendorf-Netheler-Hinz, Hamburg, Експериментальна схема Germany), заповнені 10мкл натрій цитратного буПлацебо (1мл фізіологічного розчину, феру (рН 3,0) для виміру активності DPIV у плазмі. 0,154моль/л) або підвищуючиїся дози глутамінілТуби Еппендорфа центрифугують негайно піролідину (5, 15 та 50мг/кг маси тіла) застосову(12000об/хил протягом 2 хвилин, Hettich Zentrifuge ють до групи з N=8 жирних щурів Zucker. 375мг ЕВА 12, Tuttlingen; Germany): Фракції плазми збеглутамініл-піролідину розчиняють у 1000мкл рігають на льоді до аналізу або заморожують при ДМСО (Е. Merck, Darmstadt; Germany [Диметилсу20°С до аналізу. Усі зразки плазми помічають тальфоксид]), 10мл фізіологічного розчину додають ким чином: та аліквоти по 1мл, кожна містить 34,09мг глутамі- Номер коду ніл-піролідину, зберігають при -20°С. Для отри- Число тварин мання тест-субстанції залежні від дози аліквоти - Дата відбору зразку розбавлено фізіологічним розчином. - Час відбору зразку Після голодування протягом ночі плацебо або Аналітичні способи тест-субстанцію застосовують до жирних щурів Аналізована суміш для визначення активності Zucker через зонд перорально (15G, 75мм; Fine DPIV у плазмі складається з 80мкл реагенту та Science Tools, Heidelberg, Germany) на - 10 хвили20мкл зразку плазми. Кінетичний вимір утворення ну. Пероральний тест толерантності до глюкози жовтого продукту 4-нітроаніліну з субстрату гліци(OGTT) з 2г/кг глюкози (40% розчин, В. Braun лпроліл-4-нітроанілін провадять при 390нм протяMelsungen, Melsungen, Germany) застосовують на гом 1 хвилини при 30°С після 2 хвилин поперед±0 хвилину через другий зонд. Зразки венозної нього інкубування при тій же температурі. крові з хвостових вен збирають на - 30 хвилину, Активність DPIV виражено у міліодиницях/мл. 15 хвилину, ±0 хвилину та на хвилини 5, 10, 15, 20, Статистичні способи 30, 40, 60, 90 та 120 у скляні капіляри на 20мкл, які Статистичні оцінки та графіки виконують за поміщають у стандартні туби, заповнені 1мл роз 23 76309 24 чином для виміру глюкози у крові. 1000мкл фізіологічного розчину. Після голодуванУсі зразки крові помічають таким чином: ня протягом ночі плацебо або тест-субстанцію - Номер коду застосовують до жирних щурів Zucker через зонд - Число тварин перорально (15G, 75мм; Fine Science Tools, - Дата відбору зразку Heidelberg, Germany) на - 10 хвилину. Перораль- Час відбору зразку ний тест толерантності до глюкози (OGTT) з 2г/кг Аналітичні способи глюкоз (40% розчин, В. Braun Melsungen, Рівні глюкози вимірюють, застосовуючи спосіб Melsungen, Germany) застосовують на ±0 хвилину глюкоза-оксидази (Super G Glucose analyzer; Dr. через другий зонд. Зразки венозної крові з хвостоMiiller Geratebau, Freital, Germany). вих вен збирають на - 30 хвилину, - 15 хвилину, ±0 Статистичні способи хвилину та на хвилини 5, 10, 15, 20, 30, 40, 60, 90 Статистичні оцінки та графіки виконують за та 120 у скляні капіляри по 20мкл, які поміщають у стандартні туби, заповнені 1 мл розчину для вимідопомогою програмного забезпечення PRISM ру глюкози у крові. 3,02 (GraphPad Software, Inc.). Усі параметри анаУсі зразки крові помічають таким чином: лізують наочно, включаючи значення та стандарт- Номер коду не відхилення. - Число тварин Дія лікування на толерантність до глюкози - Дата відбору зразку Ліковані плацебо діабетичні щури Zucker пока- Час відбору зразку зали сильно підвищене відхилення глюкози у кроАналітичні способи ві, що вказує на нетолерантність до глюкози як Рівні глюкози вимірюють, застосовуючи спосіб вияв цукрового діабету. Застосування 5мг/кг маси глюкоза-оксидази (Super G Glucose analyzer; Dr. тіла глутамініл-піролідину дає обмежене поліпMQHer Geratebau, Freital, Germany). шення толерантності до глюкози у діабетичних Статистичні способи щурів Zucker. Значне зниження підвищених рівнів Статистичні оцінки та графіки провадять за глюкози у крові та поліпшення толерантності до глюкози досягаютьпісля застосування 15мг/кг та допомогою програмного забезпечення PRISM 50мг/кг маси тіла глутамініл-піролідину (дивись 3,02 (GraphPad Software, Inc.). Усі параметри анаФіг.3). лізують наочно, включаючи значення та стандартПриклад 11: Дослідження підвищення дози у не відхилення. жирних щурів Zucker після перорального застосуДія лікування на толерантність до глюкози вання глутамініл-тіазолідину Ліковані плацебо діабетичні щури Zucker покаТварини зали сильно підвищене відхилення глюкози у кроN=30 самців щурів Zucker (fa/fa), середній вік ві, що вказує на нетолерантність до глюкози як 11 тижнів (5-12 тижнів), середня маса тіла 350г вияв цукрового діабету. Застосування 5мг/кг маси (150-400г), отримано від Charles River (Sulzfeld, тіла, 15мг/кг та 50мг/кг глутамініл-тіазолідину дає Germany). Після постачання їх тримають >12 тижзалежне від дози зниження підвищених рівнів глюнів, доки майже усі жирні щури Zucker не мали кози у крові та поліпшення толерантності до глюхарактеристик вираженого цукрового діабету. Грукози у діабетичних щурів Zucker (дивись Фіг.4). пу з N=8 тварини застосовували для тестування Приклад 12: In vivo інактивація глутамінілтрьох підвищуючихся доз глутамініл-тіазолідину тіазолідину після перорального застосування до відносно плацебо (фізіологічний розчин). щурів Wistar Умови утримання Тварини/Експериментальна схема Тварин тримають у клітках поодинці у стандаГлутамініл-тіазолідин застосовують до щурів ртизованих умовах з регульованою температурою Wistar перорально, як описано у прикладі 9 (22±2°С) при циклі світло/темрява 12/12 годин (свіАналітичні способи тло на при 06:00 ранку). Стерильну стандартну Після застосування плацебо або глутамінілтіазолідину, зразки артеріальної крові відбирають гранульовану їжу (ssniff Soest, Germany) та воду на хвилини 2,5, 5, 7,5, 10, 15, 20, 40, 60 та 120 з з крану, підкислену НСІ, дають досхочу. катетера сонної артерії притомних вільних щурів Катетеризація сонної артерії для визначення утворення продуктів розкладання Жирних щурів Zucker віком 24-31 тижнів (у сеглутамініл-тіазолідину. редньому: 25 тижнів), адаптованих до умов утриДля аналізу спосіб простої твердо-фазної ексмання, добре готують для дослідження. тракції на патронах С18 використовують для видіКатетери імплантують у сонну артерію жирних лення потрібної сполуки з плазми. Екстракти анащурів Zucker під загальною анестезією (інтраперилізують, застосовуючи обернено-фазову рідинну тональною ін'єкцією 0,25мл/кг Rompun [2%], хроматографію на колонці Lichrospher 60 RP Select BayerVital, Germany та 0,5мл/кг кета-міну 10, В з тандемною мас-спектрометрією у позитивному Atarost GmbH & Co., Twistringen, Germany). Тварирежимі ХІАТ. Спосіб з внутрішнім стандартом винам дають одужати протягом одного тижня. Катекористовують для кількісного аналізу. тери промивають гепарином-фізіологічним розчиРезультати ном (100IU/мл) три рази на тиждень. Після перорального застосування глутамінілЕкспериментальна схема тіазолідину до щурів Wistar виявлено розкладання Плацебо (1мл фізіологічного розчину, сполук. Застосовуючи РХ/МС, продукт розкладан0,154моль/л) або підвищуючиїся дози глутамінілня можна визначити як піроглутамініл-тіазолідин. тіазолідину (5, 15 та 50мг/кг маси тіла) застосовуДивись графіки 5 та 6. ють до групи з N=8 жирних щурів Zucker. Відповідну кількість глутамініл-тіазолідину розчиняють у 25 Комп’ютерна верстка О. Гапоненко 76309 Підписне 26 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDpiv inhibitors based on glutaminyl
Назва патенту російськоюИнгибиторы дпiv на основании глютаминила
МПК / Мітки
МПК: C07D 207/04, C07D 295/18, A61P 25/00, A61P 3/10, C07D 277/04, A61P 19/02, A61K 31/395, A61P 17/00, A61P 35/00, A61P 3/04, A61P 37/00, A61K 31/41
Мітки: інгібітори, основі, глютамінілу, дпiv
Код посилання
<a href="https://ua.patents.su/13-76309-ingibitori-dpiv-na-osnovi-glyutaminilu.html" target="_blank" rel="follow" title="База патентів України">Інгібітори дпiv на основі глютамінілу</a>
Попередній патент: Пластмасовий формований виріб з ударостійкого поліметилметакрилату
Наступний патент: Будівля для утримання тварин
Випадковий патент: Процес діагностики і лікування соматоформної вегетативної дисфункції












