S-заміщені тіолові ефіри 11b-бензальдоксиместра-4,9-дієнвугільної кислоти, спосіб їх одержання та фармацевтична композиція
Номер патенту: 59437
Опубліковано: 15.09.2003
Автори: ЕЛЬГЕР Вальтер, ШУБЕРТ Герд, ШНЕЙДЕР Біргіт, Кауфманн Гюнтер, Рінг Свен
Формула / Реферат
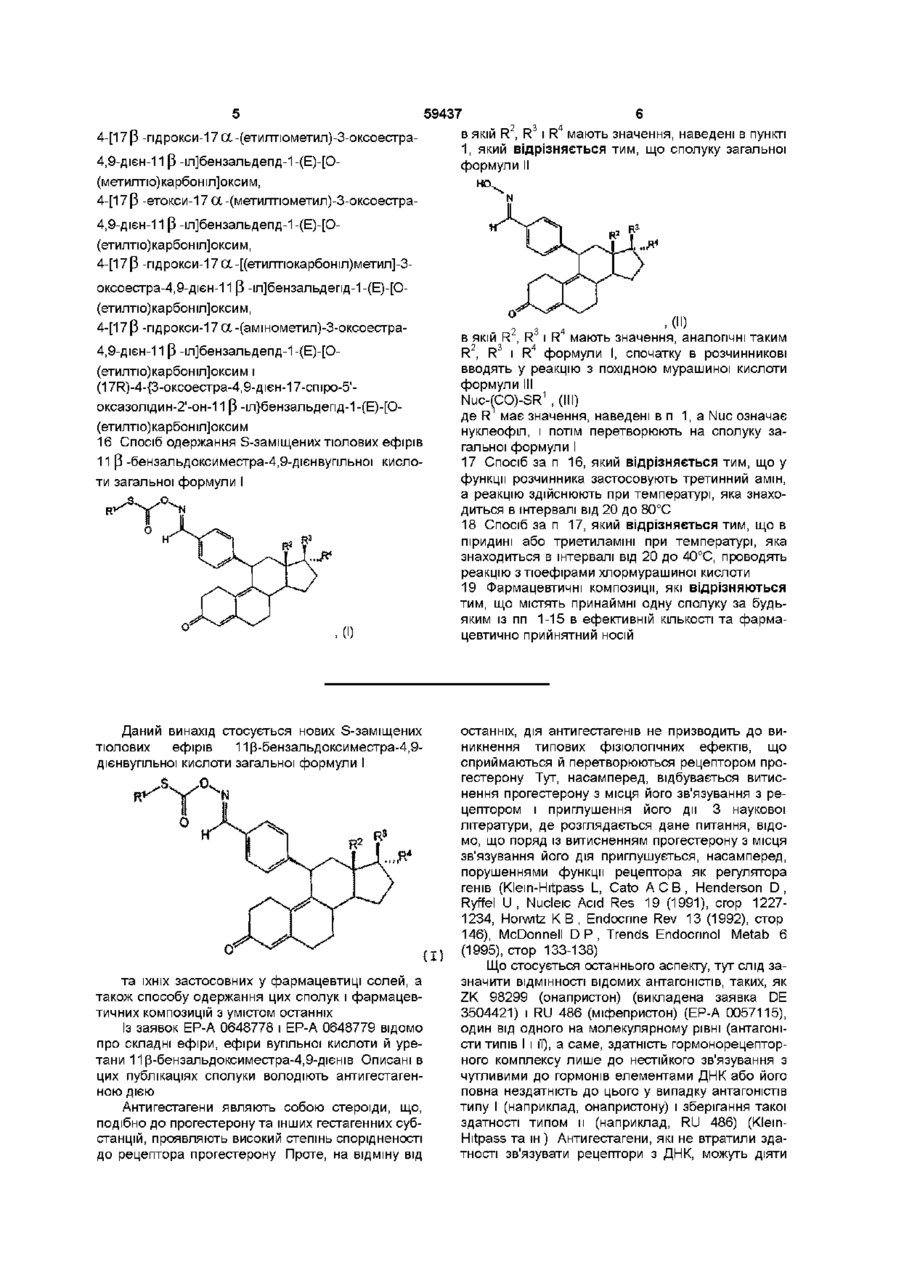
1. S-заміщені тіолові ефіри 11-бензальдоксиместра-4,9-дієнвугільної кислоти загальної формули І
, (I)
в якій:
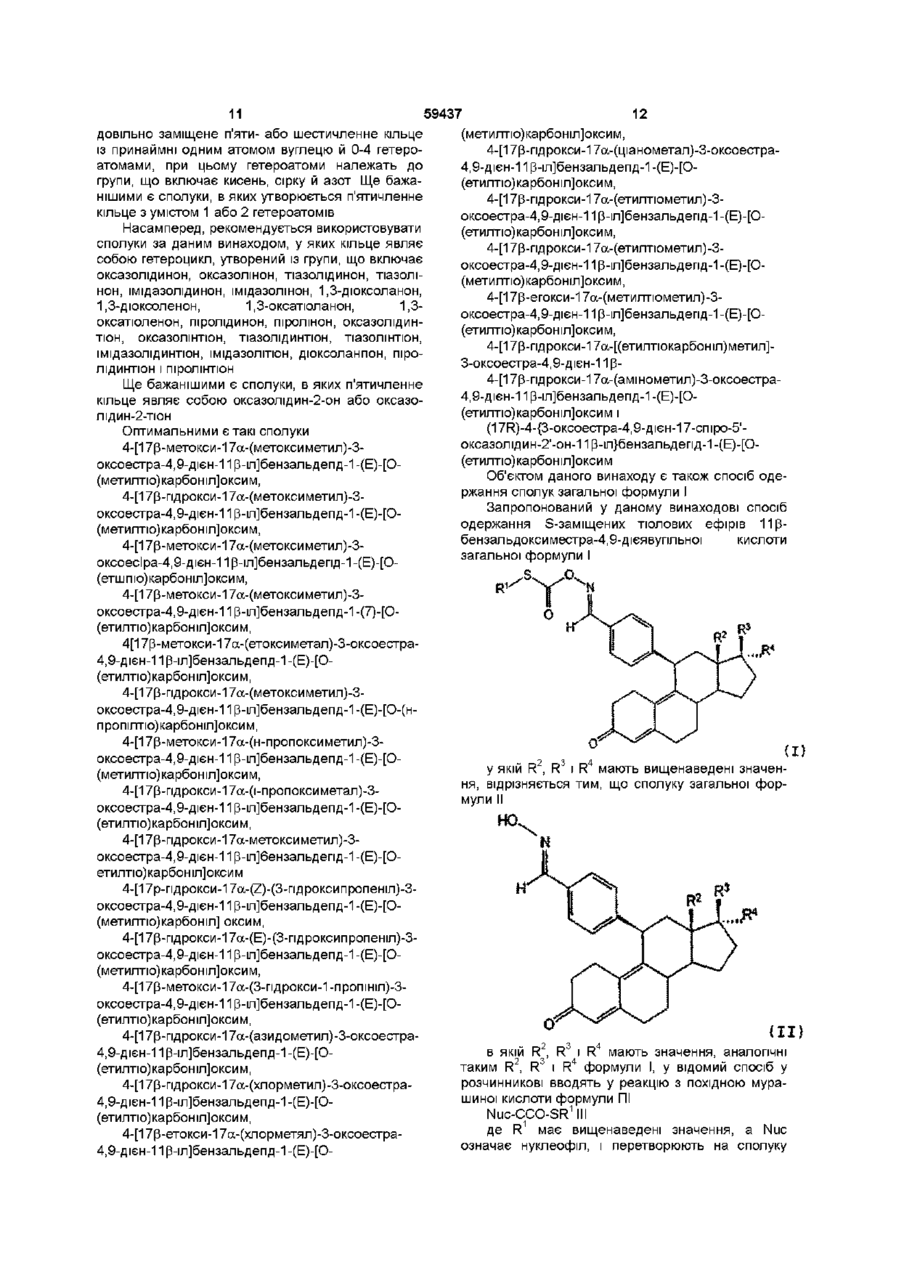
R1 являє собою алкільний залишок із 1-10 атомами вуглецю, арильний залишок із 6-10 атомами вуглецю або алкіларильний чи арилалкільний залишок, кожний із 7-10 атомами вуглецю відповідно,
R2 являє собою алкільний залишок із 1-3 атомами вуглецю або атом водню, R3 являє собою гідроксильну групу, O-алкільну групу з 1-10 атомами вуглецю, O-арильну групу з 6-10 атомами вуглецю, O-аралкільну або O-алкіларильну групу, кожна з 7-10 атомами вуглецю відповідно, залишок - OCOR5, -OCONHR5 або -OCOOR5,
де
R5 означає атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю відповідно,
R4 являє собою атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю відповідно, залишок -(СН2)nСН2Y,
де
n дорівнює 0, 1 або 2,
Y означає атом фтору, хлору, брому або йоду, ціано-, аміно-, азидо- або роданову групу, або залишок -OR6, -SR6, -(CO)SR6 або -(CO)OR6,
де
R6 означає атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю відповідно, або залишок -COR5, де R5 має вищенаведені значення,
залишок -OR5 або -OCOR5, де R5 має вищенаведені значення,
залишок -(СН2)mСН=СН(СН2)р-R6,
де
m дорівнює 0, 1, 2 або 3,
р дорівнює 0, 1 або 2 і
R6 має вищенаведені значення або являє собою залишок -OR5 або -OCOR5, де R5 має вищенаведені значення, залишок -(СН2)oССR7,
де
о дорівнює 0, 1 або 2 і
R7 означає атом водню, атом фтору, хлору, брому або йоду, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю відповідно, або являє собою залишок -OR5, де R5 має вищенаведені значення, або залишок -OCOR5, де R5 має вищенаведені значення, або залишок -CH2OR5, де R5 має вищенаведені значення, або
залишок -СССН2ОН, або R3 і R4 разом утворюють довільно заміщене п'яти- або шестичленне кільце із принаймні одним атомом вуглецю й 0-4 гетероатомами з групи, що включає кисень, сірку, селен, телур, азот, фосфор, кремній та германій та їхні застосовні у фармацевтиці солі.
2. Сполуки за п. 1, які відрізняються тим, що R1 являє собою алкільний залишок із 1-6 атомами вуглецю.
3. Сполуки за будь-яким із попередніх пунктів, які відрізняються тим, що R2 являє собою метильну або етильну групу.
4. Сполуки за будь-яким із попередніх пунктів, які відрізняються тим, що R3 являє собою гідроксильну групу.
5. Сполуки за будь-яким із пп. 1-3, які відрізняються тим, що R3 являє собою O-алкільну групу з 1-6 атомами вуглецю.
6. Сполуки за будь-яким із попередніх пунктів, які відрізняються тим, що R4 являє собою залишок -OR5 або -OCOR5, де R5 означає алкільну групу з 1-6 атомами вуглецю.
7. Сполуки за будь-яким із пп. 1-5, які відрізняються тим, що R4 являє собою залишок -(CH2)m-CH=CH(CH2)p-R6, де кожна з m і р окремо дорівнює 1, а R6 являє собою алкільну групу з 1-6 атомами вуглецю або залишок -OR5 або -OCOR5, де R5 означає атом водню або алкільну групу з 1-6 атомами вуглецю.
8. Сполуки за будь-яким із пп. 1-5, які відрізняються тим, що R4 являє собою залишок -(CH2)m-CH=CH(CH2)p-R6, де m дорівнює 0 і р - 1, а R6 являє собою залишок -OR5 або -OCOR5, де R5 означає атом водню або алкільну групу з 1-6 атомами вуглецю.
9. Сполуки за будь-яким із пп. 1-5, які відрізняються тим, що R4 являє собою залишок -(CH2)оCCR7, де о дорівнює 1, а R7 означає алкільну групу з 1-6 атомами вуглецю або залишок -OCOR5 або -CH2OR5, де R5 являє собою алкільну групу з 1-6 атомами вуглецю або атом водню.
10. Сполуки за будь-яким із пп. 1-5, які відрізняються тим, що R4 являє собою залишок -(СН2)nСН2Y, де n дорівнює 0 або 1, Y означає атом фтору, хлору, брому або йоду, ціано-, аміно-, азидо- або роданову групу, або залишок -OR6, -SR6, -(CO)SR6 або -(CO)OR6, де R6 являє собою атом водню або алкільну групу з 1-10 атомами вуглецю.
11. Сполуки за будь-яким із пп. 1-3, які відрізняються тим, що R3 і R4 разом утворюють довільно заміщене п‘яти- або шестичленне кільце із принаймні одним атомом вуглецю й 0-4 гетероатомами, при цьому останні належать до групи, що включає кисень, сірку й азот.
12. Сполуки за п. 11, які відрізняються тим, що в них утворюється п'ятичленне кільце з умістом 1 або 2 гетероатомів.
13. Сполуки за п. 12, які відрізняються тим, що кільце являє собою гетероцикл, утворений із групи, що включає оксазолідинон, оксазолінон, тіазолідинон, тіазолінон, імідазолідинон, імідазолінон, 1,3-діоксоланон, 1,3-діоксоленон, 1,3-оксатіоланон, 1,3-оксатіоленон, піролідинон, піролінон, оксазолідинтіон, оксазолінтіон, тіазолідинтіон, тіазолінтіон, імідазолідинтіон, імідазолінтіон, діоксолантіон, піролідинтіон і піролінтіон.
14. Сполуки за п. 13, які відрізняються тим, що п'ятичленне кільце являє собою оксазолідин-2-он або оксазолідин-2-тіон.
15. Сполуки за п. 1, а саме:
4-[17-метокси-17-(метоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(метилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(метоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(метилтіо)карбоніл]оксим,
4-[17-метокси-17-(метоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(етилтіо)карбоніл]оксим,
4-[17-метокси-17-(метоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Z)-[О-(етилтіо)карбоніл]оксим,
4-[17-метокси-17-(етоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(метоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(н-пропілтіо)карбоніл]оксим,
4-[17-метокси-17-(н-пропоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(метилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(і-пропоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(метоксиметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(Z)-(3-гідроксипропеніл)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(метилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(Е)-(3-гідроксипропеніл)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(метилтіо)карбоніл]оксим,
4-[17-метокси-17-(3-гідрокси-1-пропініл)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(азидометил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(етилтіо)карбонiл]оксим,
4-[17-гідрокси-17-(хлорметил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(етилтіо)карбоніл]оксим,
4-[17-етокси-17-(хлорметил)-3-оксоестра-4,9-дієн-11-iл]бензальдегід-1-(Е)-[O-(метилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(ціанометил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[O-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(етилтіометил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(етилтіометил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(метилтіо)карбоніл]оксим,
4-[17-етокси-17-(метилтіометил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-[(етилтіокарбоніл)метил]-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(етилтіо)карбоніл]оксим,
4-[17-гідрокси-17-(амінометил)-3-оксоестра-4,9-дієн-11-іл]бензальдегід-1-(Е)-[О-(етилтіо)карбоніл]оксим і
(17R)-4-{3-оксоестра-4,9-дієн-17-спіро-5'-оксазолідин-2'-он-11-іл}бензальдегід-1-(Е)-[О-(етилтіо)карбоніл]оксим.
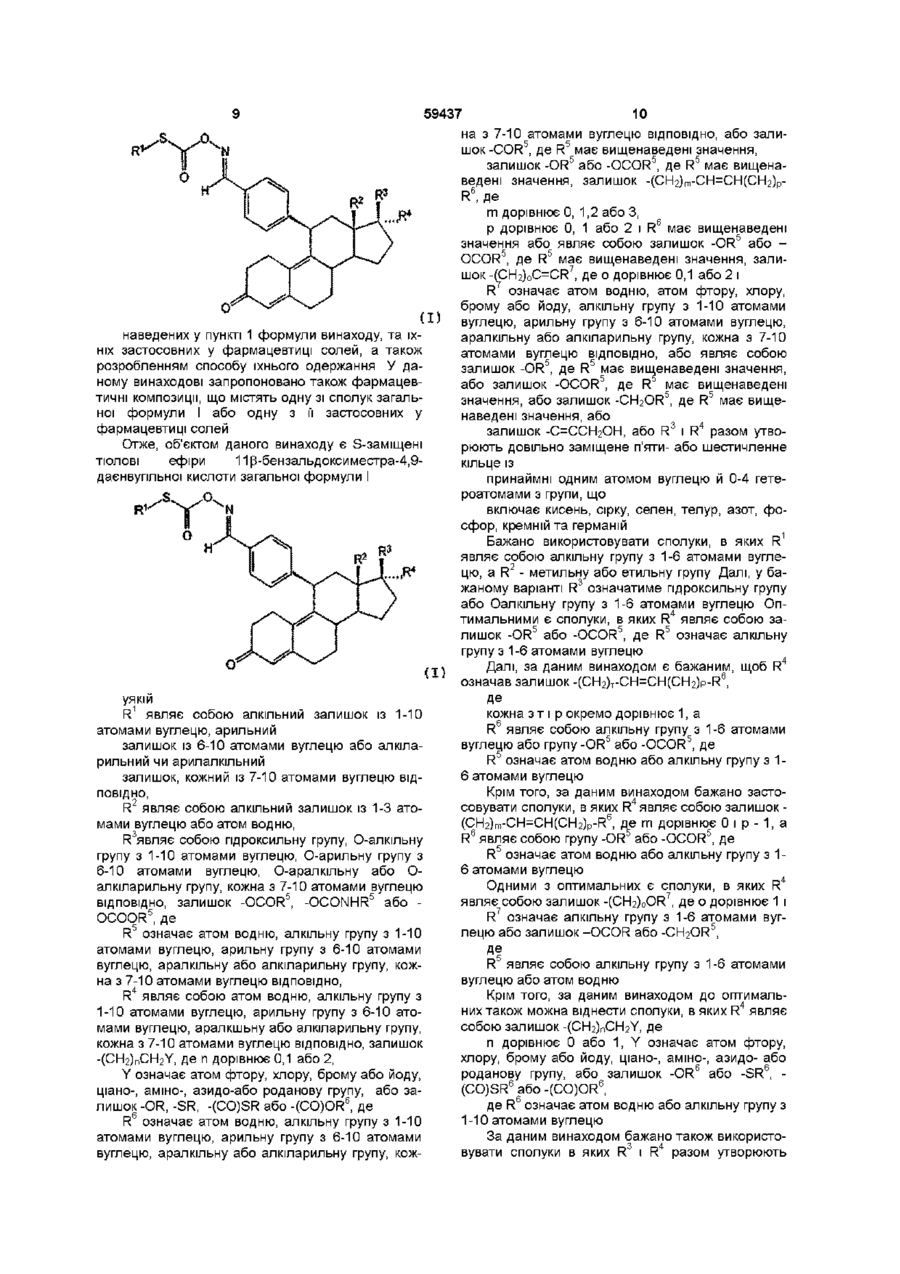
16. Спосіб одержання S-заміщених тіолових ефірів 11-бензальдоксиместра-4,9-дієнвугільної кислоти загальної формули І
, (І)
в якій R2, R3 і R4 мають значення, наведені в пункті 1, який відрізняється тим, що сполуку загальної формули ІІ
, (ІІ)
в якій R2, R3 і R4 мають значення, аналогічні таким R2, R3 і R4 формули І, спочатку в розчинникові вводять у реакцію з похідною мурашиної кислоти формули ІІІ
Nuc-(CO)-SR1 , (ІІІ)
де R1 має значення, наведені в п. 1, a Nuc означає нуклеофіл, і потім перетворюють на сполуку загальної формули І.
17. Спосіб за п. 16, який відрізняється тим, що у функції розчинника застосовують третинний амін, а реакцію здійснюють при температурі, яка знаходиться в інтервалі від 20 до 80°С.
18. Спосіб за п. 17, який відрізняється тим, що в піридині або триетиламіні при температурі, яка знаходиться в інтервалі від 20 до 40°С, проводять реакцію з тіоефірами хлормурашиної кислоти.
19. Фармацевтичні композиції, які відрізняються тим, що містять принаймні одну сполуку за будь-яким із пп. 1-15 в ефективній кількості та фармацевтично прийнятний носій.
Текст
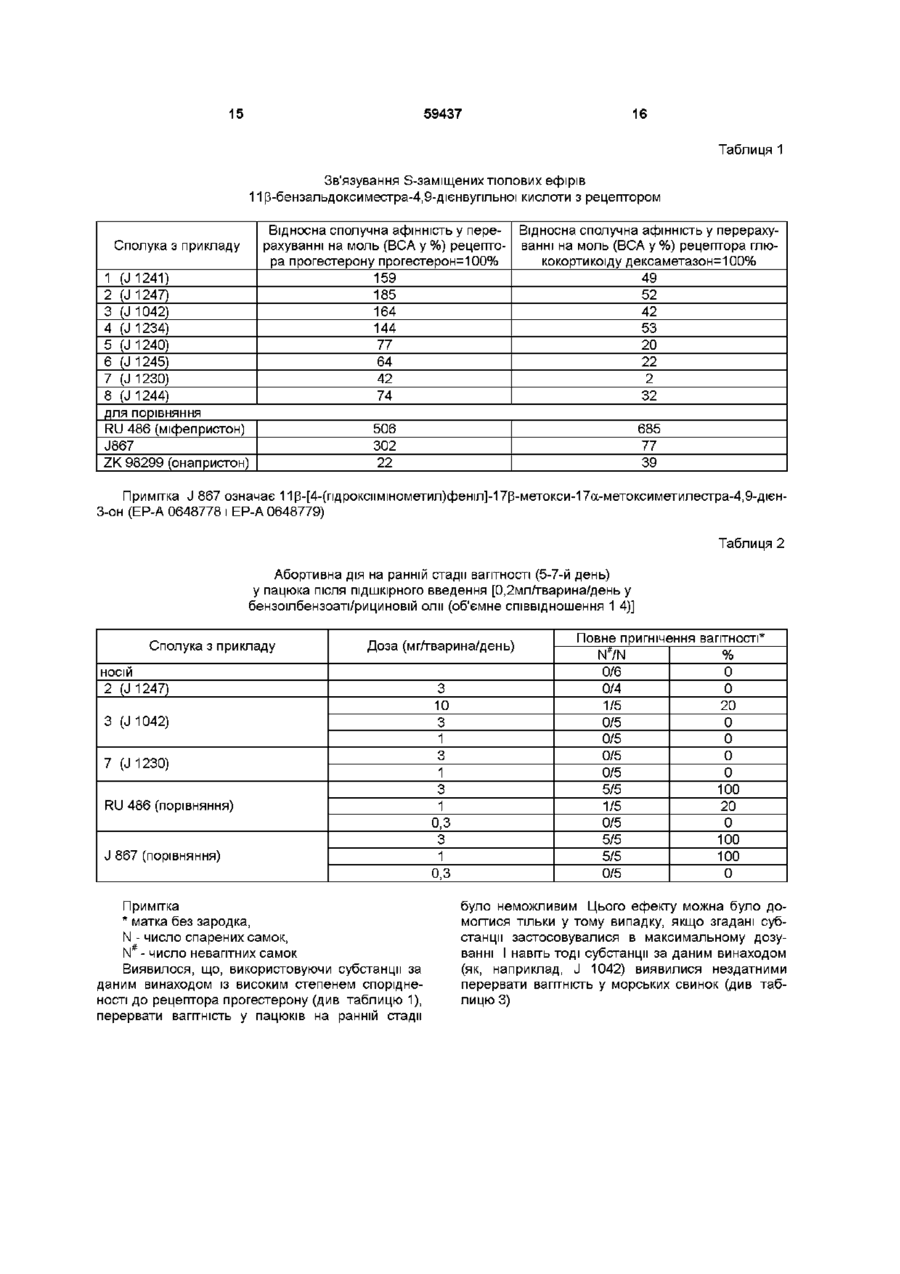
1 S-заміщені ТІОЛОВІ ефіри бензальдоксиместра-4,9-дієнвупльноі загальної формули І 11 р кислоти R являє собою атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю ВІДПОВІДНО, залишок (CH2)nCH2Y, Де п дорівнює 0, 1 або 2, Y означає атом фтору, хлору, брому або йоду, ціано-, аміно-, азидо- або роданову групу, або залишок -OR6, -SR6, -(CO)SR6 або -(CO) OR, Де R означає атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю ВІДПОВІДНО, або залишок COR , де R має вищенаведені значення, залишок -OR5 або -OCOR , де R5 має вищенаведені значення, залишок -(CH2)rnCH=CH(CH2)p-R6, О Де в якій R1 являє собою алкільний залишок із 1-10 атомами вуглецю, арильний залишок із 6-10 атомами вуглецю або алкіларильний чи арилалкільний залишок, кожний із 7-10 атомами вуглецю ВІДПОВІДНО, R2 являє собою алкільний залишок із 1-3 атомами вуглецю або атом водню, R3 являє собою гідроксильну групу, О-алкільну групу з 1-10 атомами вуглецю, О-арильну групу з 6-10 атомами вуглецю, О-аралкільну або О-алкіларильну групу, кожна з 710 атомами вуглецю ВІДПОВІДНО, залишок- OCOR5, -OCONHR5 або -OCOOR5, Д ! R означає атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуг m дорівнює 0, 1, 2 або З, р дорівнює 0, 1 або 2 і R має вищенаведені значення або являє собою залишок -OR5 або -OCOR5, де R5 має вищенаведені значення, залишок -(СН2)0С = CR7, Де о дорівнює 0, 1 або 2 і R означає атом водню, атом фтору, хлору, брому або йоду, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю ВІДПОВІДНО, або являє собою залишок -OR5, де R має вищенаведені значення, або залишок OCOR , де R5 має вищенаведені значення, або залишок -CH2OR5, де R має вищенаведені значення, або залишок -С = ССН2ОН, або R3 і R4 разом утворюють довільно заміщене п'яти- або шестичленне кільце із принаймні одним атомом вуглецю й 0-4 гетероатомами з групи, що включає кисень, сірку, селен, телур, азот, фосфор, кремній та германій та їхні застосовні у фармацевтиці солі 2 Сполуки за п 1, які відрізняються тим, що R1 являє собою алкільний залишок із 1-6 атомами вуглецю і со Ю 59437 4 3 Сполуки за будь-яким із попередніх пунктів, які відрізняються тим, що R2 являє собою метильну або етильну групу 4 Сполуки за будь-яким із попередніх пунктів, які відрізняються тим, що R являє собою гідроксильну групу 5 Сполуки за будь-яким із пп 1-3, які відрізняються тим, що R3 являє собою Оалкільну групу з 1-6 атомами вуглецю 6 Сполуки за будь-яким із попередніх пунктів, які відрізняються тим, що R4 являє собою залишок OR або -OCOR 5 , де R5 означає алкільну групу з 16 атомами вуглецю 7 Сполуки за будь-яким із пп 1-5, які відрізняються тим, що R4 являє собою залишок -(CbbjmCH=CH(CH2) P -R 6 , де кожна з m і р окремо дорівнює 1, a R6 являє собою алкільну групу з 1-6 атомами вуглецю або залишок -OR 5 або -OCOR 5 , де R5 означає атом водню або алкільну групу з 1-6 атомами вуглецю 8 Сполуки за будь-яким із пп 1-5, які відрізняються тим, що R4 являє собою залишок -(CbbjmCH=CH(CH 2 ) P -R 6 , де m дорівнює 0 і р - 1, a R6 являє собою залишок -OR або -OCOR 5 , де R5 означає атом водню або алкільну групу з 1-6 атомами вуглецю 9 Сполуки за будь-яким із пп 1-5, які відрізняються тим, що R4 являє собою залишок (CH2)OC = CR 7 , де о дорівнює 1, a R7 означає алкільну групу з 1-6 атомами вуглецю або залишок OCOR або -CbhOR 5 , де R5 являє собою алкільну групу з 1-6 атомами вуглецю або атом водню 10 Сполуки за будь-яким із пп 1-5, які відрізняються тим, що R4 являє собою залишок (CbbJnCbhY, де п дорівнює 0 або 1, Y означає атом фтору, хлору, брому або йоду, ціано-, аміно-, азидо- або роданову групу, або залишок -OR6, -SR6, (CO)SR 6 або -(CO)OR , де R6 являє собою атом водню або алкільну групу з 1-10 атомами вуглецю 11 Сполуки за будь-яким із пп 1-3, які відрізняються тим, що R3 і R4 разом утворюють довільно заміщене п'яти- або шестичленне кільце із принаймні одним атомом вуглецю й 0-4 гетероатомами, при цьому останні належать до групи, що включає кисень, сірку й азот 12 Сполуки за п 1 1 , які відрізняються тим, що в них утворюється п'ятичленне кільце з умістом 1 або 2 гетероатомів 13 Сполуки за п 12, які відрізняються тим, що кільце являє собою гетероцикл, утворений із групи, що включає оксазолідинон, оксазолінон, тіазолідинон, тіазолінон, імідазолідинон, імідазолінон, 1,3-дюксоланон, 1,3-дюксоленон, 1,3оксатюланон, 1,3-оксатюленон, піролідинон, піролінон, оксазолідинтюн, оксазолінтюн, тіазолідинтіон, тіазолінтюн, імідазолідинтюн, імідазолінтюн, дюксолантюн, піролідинтюн і піролінтюн 4-[17 р -пдрокси-17 (X -(метоксиметил)-З 14 Сполуки за п 13, які відрізняються тим, що п'ятичленне кільце являє собою оксазолідин-2-он або оксазолідин-2-тюн 15 Сполуки за п 1, а саме 4-[17 р -пдрокси-17 а -(ціанометил)-З-оксоестра 4-[17 р -метокси-17 (X -(метоксиметил)-Зоксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(метилтю)карбоніл]оксим, оксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(метилтю)карбоніл]оксим, 4-[17 р -метокси-17 (X -(метоксиметил)-Зоксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -метокси-17 (X -(метоксиметил)-Зоксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(2)-[О(етилтю)карбоніл]оксим, 4-[17 р -метокси-17 (X -(етоксиметил)-З-оксоестра4,9-дієн-11 р -іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 (X -(метоксиметил)-Зоксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(н-пропілтю)карбоніл]оксим, 4-[17 р -метокси-17 (X -(н-пропоксиметил)-Зоксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(метилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 (X -(і-пропоксиметил)-Зоксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 (X -(метоксиметил)-Зоксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 (X -(2)-(3-пдроксипропеніл)-3оксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(метилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 (X -(Е)-(3-пдроксипропеніл)-3оксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(метилтю)карбоніл]оксим, 4-[17 р -метокси-17 (X -(З-пдрокси-1 -пропініл)-3оксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 (X -(азидометил)-З-оксоестра4,9-дієн-11 р -іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 (X -(хлорметил)-З-оксоестра4,9-дієн-11 р -іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -етокси-17 (X -(хлорметил)-3-оксоестра-4,9дієн-11 р -іл]бензальдепд-1 -(Е)-[О(метилтю)карбоніл]оксим, 4,9-дієн-11 р -іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17 р -пдрокси-17 а -(етилтюметил)-З-оксоестра4,9-дієн-11 р -іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 59437 4-[17 p -пдрокси-17 (X -(етилтюметил)-З-оксоестра4,9-дієн-11 p -іл]бензальдепд-1 -(E)-[O(метилтю)карбоніл]оксим, 4-[17 p -етокси-17 a -(метилтюметил)-З-оксоестра 6 2 3 4 в якій R , R і R мають значення, наведені в пункті 1, який відрізняється тим, що сполуку загальної формули II N 4,9-дієн-11 p -іл]бензальдепд-1 -(E)-[O(етилтю)карбоніл]оксим, 4-[17 p -пдрокси-17 a -[(етилтюкарбоніл)метил]-3оксоестра-4,9-дієн-11 р -іл]бензальдепд-1-(Е)-[О(етилтю)карбоніл]оксим, 4-[17 p -пдрокси-17 a -(амшометил)-З-оксоестра 2 Даний винахід стосується нових S-заміщених тюлових ефірів 11 р-бензальдоксиместра-4,9дієнвупльної кислоти загальної формули І СІ) та їхніх застосовних у фармацевтиці солей, а також способу одержання цих сполук і фармацевтичних композицій з умістом останніх Із заявок ЕР-А 0648778 і ЕР-А 0648779 відомо про складні ефіри, ефіри вугільної кислоти й уретани 1ір-бензальдоксиместра-4,9-дієнів Описані в цих публікаціях сполуки володіють антигестагенною дією Антигестагени являють собою стероїди, що, подібно до прогестерону та інших гестагенних субстанцій, проявляють високий степінь спорідненості до рецептора прогестерону Проте, на відміну від 3 4 в якій R , R і R мають значення, аналогічні таким 2 3 4 R , R і R формули І, спочатку в розчинникові вводять у реакцію з похідною мурашиної кислоти формули III 1 Nuc-(CO)-SR , (III) де R має значення, наведені в п 1, a Nuc означає нуклеофіл, і потім перетворюють на сполуку загальної формули І 17 Спосіб за п 16, який відрізняється тим, що у функції розчинника застосовують третинний амін, а реакцію здійснюють при температурі, яка знаходиться в інтервалі від 20 до 80°С 18 Спосіб за п 17, який відрізняється тим, що в піридині або триетиламші при температурі, яка знаходиться в інтервалі від 20 до 40°С, проводять реакцію з тюефірами хлормурашиної кислоти 19 Фармацевтичні композиції, які відрізняються тим, що містять принаймні одну сполуку за будьяким із пп 1-15 в ефективній КІЛЬКОСТІ та фармацевтично прийнятний носій 4,9-дієн-11 p -іл]бензальдепд-1 -(E)-[O(етилтю)карбоніл]оксим і (17Р)-4-{3-оксоестра-4,9-дієн-17-спіро-5'оксазолідин-2'-он-11 р -іл}бензальдепд-1-(Е)-[О(етилтю)карбоніл]оксим 16 Спосіб одержання S-заміщених тюлових ефірів 11 Р -бензальдоксиместра-4,9-дієнвупльноі кислоти загальної формули І останніх, дія антигестагенів не призводить до виникнення типових фізіологічних ефектів, що сприймаються й перетворюються рецептором прогестерону Тут, насамперед, відбувається витиснення прогестерону з місця його зв'язування з рецептором і приглушення його дії 3 наукової літератури, де розглядається дане питання, відомо, що поряд із витисненням прогестерону з місця зв'язування його дія приглушується, насамперед, порушеннями функції рецептора як регулятора генів (Klem-Hitpass L, Cato А С В , Henderson D , Ryffel U, Nucleic Acid Res 19 (1991), crop 12271234, Horwitz K B , Endocrine Rev 13 (1992), crop 146), McDonnell D P , Trends Endocnnol Metab 6 (1995), crop 133-138) Що стосується останнього аспекту, тут слід зазначити ВІДМІННОСТІ відомих антагоністів, таких, як ZK 98299 (онапристон) (викладена заявка DE 3504421) і RU 486 (міфепристон) (ЕР-А 0057115), один від одного на молекулярному рівні (антагоністи типів І і її), а саме, здатність гормонорецепторного комплексу лише до нестійкого зв'язування з чутливими до гормонів елементами ДНК або його повна нездатність до цього у випадку антагоністів типу І (наприклад, онапристону) і зберігання такої здатності типом и (наприклад, RU 486) (КІеіпHitpass та ін ) Антигестагени, які не втратили здатності зв'язувати рецептори з ДНК, можуть діяти 59437 8 подібно прогестерону, що при порушенні такої здатності неможливо Модуляцію активності окремих антагоністів прогестерону, що діють як регулятори генів, можна здійснювати також за допомогою механізмів, при ініціюванні яких піддається дії рецепторний білок Результати проведених досліджень підтвердили, що дія комплексів антагоніст-рецептор на регуляцію генів стимулюється циклічним АМФ При наявності високих концентрацій цАМФ у тканинах спостерігається активація комплексів антагоністрецептор, тоді як низьких концентраціях дія рецептора залишається приглушеною Ці явища зумовлюються, серед іншого, очевидно, специфікою субстанцій В результаті утворення високих концентрацій цАМФ (in vitro) спостерігається часткова агоністична дія деяких антигестагенів, тоді як відповідну активність інших субстанцій стимулювати за допомогою цАМФ не вдається (Sartonus C A , Tung L, Takimoto G S , Horwitz KB , J Biol Chem 268 (1993), crop 9262-9266, Sobek L, Kaufmann G , Schubert G і Oettel M , Матеріали 79-і щорічної конференції Товариства ендокринологи, 3-452, crop 549(1997)) глушити секрецію Іфостагландинів маткою в морських свинок настільки, щоб узагалі виключити ІНВОЛЮЦІЮ жовтого тіла (Elger W , Neef G , Beier S , Fahnnch M, Grundel M т а ї н , Current Concepts in Fertility Regulation and Reproduction, під ред Pun С P і Van Look P F H , 1994, crop 303-328) Субстанції з частковою агоністичною дією приглушують цей процес незначною мірою або є нездатними до цього зовсім Діапазон дії антагоніста прогестерону RU 486 на функції розмноження людини є дуже широким і його застосування в терапії викликає неабиякий інтерес Ця субстанція настільки приглушує активність прогестерону, що її використання під час вагітності може призвести до викидня Вірогідність викидня або виникнення болю ще більше підвищується при одночасному або послідовному лікуванні простагландином (Van Look P F A , Bygdeman M , Oxf Rev Reprod Biol 11 (1989), crop 1-60, Elger W , Neef G , Beier S , Fahnnch M , Grundel M та ін , Current Concepts MI Fertility Regulation and Reproduction, під ред Pun С P і Van Look P F H , 1994, crop 303-328) Ці явища можна пояснити дією прогестерону у функції регулятора вагітності ВІДМІННОСТІ на молекулярному рівні знаходять своє відображення також у фармакодинамічних властивостях антагоністів прогестерону Різноманітність таких властивостей можна проілюструвати на прикладах таких субстанцій, як онапристон і міфепристон (RU 486), вичерпно охарактеризованих in vivo й in vitro [Elger W , Neef G , Beier S , Fahnnch M , Grundel M та ш , Current Concepts in Fertility Regulation and Reproduction, під ред Pun С P і Van Look P F H , 1994, crop 303-328] У регуляції ЖИТТЄДІЯЛЬНОСТІ органів, що беруть участь у процесах відтворення, прогестерон відіграє вирішальну роль Це стосується морфологічних процесів перебудови генітального тракту і молочних залоз, регуляції гормонів передньої частки гіпофіза і статевих органів або приглушення, ВІДПОВІДНО, активації процесу пологів Згадані функції по-різному реагують на прогестерон Процеси, що відбуваються при вкрай низькому рівні прогестерону, варті, враховуючи фармакологію антигестагенів, особливої уваги й ретельного вивчення "Чисті" антагоністи прогестерону типу І дають змогу домогтися таких ефектів, яких неможливо досягти при будь-якому дозуванні антагоністів із часткової агоністичною дією Якщо таке, у принципі, і можливо, то лише за умови, що поріг, коли спостерігається ВІДПОВІДНИЙ ефект, є низьким, тобто, не досягає такого часткової агоністичної дії використовуваного антагоніста прогестерону З іншого боку, із використанням антагоністів прогестерону типу и можна домогтися ефектів, що стимулюються не приглушенням, а, навпаки, активацією рецептора прогестерону Не змінюючи дозування цього антагоніста, можна приглушувати дію прогестерону, що спостерігається при його високих концентраціях у тканинах Разом із тим, дія RU 486 та інших антигестагешв може і не гарантувати видалення прогестерону Це стосується, насамперед, фаз циклу, коли рівень умісту прогестерону в крові є вкрай низьким У цьому зв'язку слід особливо зазначити два феномени приглушення овуляції (Croxatto H В , Salvatierra А М , Croxatto Н D , Fuentealba A , Hum Reprod 8 (1993), crop 201-207) і приглушення індукованої естрогенами проліферації епітелію статевих органів, насамперед, проліферації ендометрію (Wolf J Р , Hsiu J G , Anderson T L , Ulmann A, Bauheeu Е Е і Hodgen G D , Fertility & Sterility 52 (1989), crop 1055-1060) Це вирішує проблему застосування антигестагенів, насамперед, у рамках протиовуляційної стратегії з метою контролювання репродуктивної здатності (фертильності), із метою відтворюваного провокування аменореї, наприклад, при терапії ендометрюзу, а також приглушення в процесі замісної терапії естрогенами в клімактеричний період небажаних ефектів, зумовлених наявністю естрогенів в ендометрм 3 погляду застосування в терапії антагоністів типу П, таких, як RU 486, той факт, що вони діють абортивно і можуть викликати біль, водночас являючи собою антагоністи прогестерону й перешкоджаючи овуляції та проліферації, є безперечним недоліком Як приклад, що ілюструє перший зі згаданих випадків, можна навести секрецію простагландинів маткою морської свинки в циклі Така секреція наприкінці циклу стимулюється крайнім зниженням рівня вмісту прогестерону в крові І тільки чисті антагоністи прогестерону типу І є здатними при Виходячи з вищенаведеного, за мету даного винаходу було покладено одержання сполук, використовуючи які, можна було б вирішити згадані проблеми Цього було досягнуто одержанням сполук загальної формули І 59437 R 3 (I) наведених у пункті 1 формули винаходу, та їхніх застосовних у фармацевтиці солей, а також розробленням способу їхнього одержання У даному винаходові запропоновано також фармацевтичні композиції, що містять одну зі сполук загальної формули І або одну з її застосовних у фармацевтиці солей Отже, об'єктом даного винаходу є S-заміщені ТІОЛОВІ ефіри 11 р-бензальдоксиместра-4,9 даєнвупльної кислоти загальної формули І (І) уякш R1 являє собою алкільний залишок із 1-10 атомами вуглецю, арильний залишок із 6-10 атомами вуглецю або алкіларильний чи арилалкільний залишок, кожний із 7-10 атомами вуглецю ВІДПОВІДНО, R2 являє собою алкільний залишок із 1-3 атомами вуглецю або атом водню, 3 R являє собою гідроксильну групу, О-алкільну групу з 1-10 атомами вуглецю, О-арильну групу з 6-10 атомами вуглецю, О-аралкільну або Оалкіларильну групу, кожна з 7-10 атомами вуглецю ВІДПОВІДНО, залишок -OCOR 5 , -OCONHR 5 або OCOOR 5 , де R5 означає атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю ВІДПОВІДНО, R4 являє собою атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкшьну або алкіларильну групу, кожна з 7-10 атомами вуглецю ВІДПОВІДНО, залишок -(CH2)nCH2Y, де п дорівнює 0,1 або 2, Y означає атом фтору, хлору, брому або йоду, ціано-, аміно-, азидо-або роданову групу, або залишок -OR, -SR, -(CO)SR або -(CO)OR 6 , де R6 означає атом водню, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кож 10 на з 7-10 атомами вуглецю ВІДПОВІДНО, або зали5 5 шок -COR , де R має вищенаведені значення, 5 5 5 залишок -OR або -OCOR , де R має вищенаведені значення, залишок -(СН2) т -СН=СН(СН2) р 6 R ,fle т дорівнює 0, 1,2 або З, 6 р дорівнює 0, 1 або 2 і R має вищенаведені 5 значення або являє собою залишок -OR або 5 5 OCOR , де R має вищенаведені значення, зали7 шок -(CH2)OC=CR , де о дорівнює 0,1 або 2 і R означає атом водню, атом фтору, хлору, брому або йоду, алкільну групу з 1-10 атомами вуглецю, арильну групу з 6-10 атомами вуглецю, аралкільну або алкіларильну групу, кожна з 7-10 атомами вуглецю ВІДПОВІДНО, або являє собою 5 5 залишок -OR , де R має вищенаведені значення, 5 або залишок -OCOR , де R має вищенаведені значення, або залишок -CH2OR5, де R5 має вищенаведені значення, або залишок -С=ССЬІ2ОН, або R 3 і R4 разом утворюють довільно заміщене п'яти- або шестичленне кільце із принаймні одним атомом вуглецю й 0-4 гетероатомами з групи, що включає кисень, сірку, селен, телур, азот, фосфор, кремній та германій Бажано використовувати сполуки, в яких R1 являє собою алкільну групу з 1-6 атомами вуглецю, a R2 - метильну або етильну групу Далі, у бажаному варіанті R3 означатиме гідроксильну групу або Оалкільну групу з 1-6 атомами вуглецю Оптимальними є сполуки, в яких R4 являє собою залишок -OR5 або -OCOR 5 , де R5 означає алкільну групу з 1-6 атомами вуглецю Далі, за даним винаходом є бажаним, щоб R4 означав залишок - ( C H 2 ) T - C H = C H ( C H 2 ) P - R 6 , Де кожна з т і р окремо дорівнює 1, а R6 являє собою алкільну групу з 1-6 атомами вуглецю або групу -OR 5 або -OCOR 5 , де R5 означає атом водню або алкільну групу з 16 атомами вуглецю Крім того, за даним винаходом бажано застосовувати сполуки, в яких R4 являє собою залишок 6 (CH2)rn-CH=CH(CH2)p-R , де m дорівнює 0 і р - 1, а 6 R являє собою групу -OR або -OCOR 5 , де 5 R означає атом водню або алкільну групу з 16 атомами вуглецю Одними з оптимальних є сполуки, в яких R являє собою залишок -(CbbJoOR7, де о дорівнює 1 і R7 означає алкільну групу з 1-6 атомами вуглецю або залишок -OCOR або -CH2OR5, Д ! R являє собою алкільну групу з 1-6 атомами вуглецю або атом водню Крім того, за даним винаходом до оптимальних також можна віднести сполуки, в яких R4 являє собою залишок -(CbbJnCbbY, де п дорівнює 0 або 1, Y означає атом фтору, хлору, брому або йоду, ціано-, аміно-, азидо- або роданову групу, або залишок -OR 6 або -SR6, (CO)SR 6 або -(CO)OR 6 , де R6 означає атом водню або алкільну групу з 1-10 атомами вуглецю За даним винаходом бажано також використовувати сполуки в яких R3 і R4 разом утворюють 59437 12 11 довільно заміщене п'яти- або шестичленне кільце (метилтю)карбоніл]оксим, із принаймні одним атомом вуглецю й 0-4 гетеро4-[17р-пдрокси-17а-(ціанометал)-3-оксоестраатомами, при цьому гетероатоми належать до 4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[Огрупи, що включає кисень, сірку й азот Ще бажа(етилтю)карбоніл]оксим, нішими є сполуки, в яких утворюється п'ятичленне 4-[17р-пдрокси-17а-(етилтюметил)-3кільце з умістом 1 або 2 гетероатомів оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[ОНасамперед, рекомендується використовувати (етилтю)карбоніл]оксим, сполуки за даним винаходом, у яких кільце являє 4-[17р-пдрокси-17а-(етилтюметил)-3собою гетероцикл, утворений із групи, що включає оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[Ооксазолідинон, оксазолінон, тіазолідинон, тіазолі(метилтю)карбоніл]оксим, нон, імідазолідинон, імідазолінон, 1,3-дюксоланон, 4-[17р-егокси-17а-(метилтюметил)-31,3-дюксоленон, 1,3-оксатюланон, 1,3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[Ооксатюленон, піролідинон, піролінон, оксазолідин(етилтю)карбоніл]оксим, тюн, оксазолінтюн, тіазолідинтюн, тіазолінтюн, 4-[17р-пдрокси-17а-[(етилтюкарбоніл)метил]імідазолідинтюн, імідазолітюн, дюксоланпон, піро3-оксоестра-4,9-дієн-11 рлідинтюн і піролінтюн 4-[17р-пдрокси-17а-(амшометил)-3-оксоестраЩе бажанішими є сполуки, в яких п'ятичленне 4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[Окільце являє собою оксазолідин-2-он або оксазо(етилтю)карбоніл]оксим і лідин-2-тюн (17Р)-4-{3-оксоестра-4,9-дієн-17-спіро-5'Оптимальними є такі сполуки оксазолідин-2'-он-11 р-іл}бензальдепд-1 -(Е)-[О4-[17р-метокси-17а-(метоксиметил)-3(етилтю)карбоніл]оксим оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[ООб'єктом даного винаходу є також спосіб оде(метилтю)карбоніл]оксим, ржання сполук загальної формули І 4-[17р-пдрокси-17а-(метоксиметил)-3Запропонований у даному винаходові спосіб оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[Оодержання S-заміщених тюлових ефірів 11 р(метилтю)карбоніл]оксим, бензальдоксиместра-4,9-дієявупльноі кислоти 4-[17р-метокси-17а-(метоксиметил)-3загальної формули І оксоесІра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етшпю)карбоніл]оксим, 4-[17р-метокси-17а-(метоксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(7)-[О(етилтю)карбоніл]оксим, 4[17р-метокси-17а-(етоксиметал)-3-оксоестра4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17р-пдрокси-17а-(метоксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О-(нпропілтю)карбоніл]оксим, 4-[17р-метокси-17а-(н-пропоксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(метилтю)карбоніл]оксим, 4-[17р-пдрокси-17а-(і-пропоксиметал)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17р-пдрокси-17а-метоксиметил)-3оксоестра-4,9-дієн-11 р-іл]6ензальдепд-1 -(Е)-[Оетилтю)карбоніл]оксим 4-[17р-пдрокси-17а-(2)-(3-пдроксипропеніл)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(метилтю)карбоніл] оксим, 4-[17р-пдрокси-17а-(Е)-(3-пдроксипропеніл)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(метилтю)карбоніл]оксим, 4-[17р-метокси-17а-(3-пдрокси-1 -пропшіл)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17р-пдрокси-17а-(азидометил)-3-оксоестра4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17р-пдрокси-17а-(хлорметил)-3-оксоестра4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, 4-[17р-етокси-17а-(хлорметял)-3-оксоестра4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О , ^Sxv^°x R 1 її) у якій R , R і R мають вищенаведені значення, відрізняється тим, що сполуку загальної формули II в якій R2, R3 і R4 мають значення, аналогічні таким R2, R3 і R4 формули І, у відомий спосіб у розчинникові вводять у реакцію з похідною мурашиної кислоти формули ПІ Nuc-CCO-SR1IN де R1 має вищенаведені значення, a Nuc означає нуклеофіл, і перетворюють на сполуку 14 13 59437 загальноъ формули Ы розріджувачами принаймні однієї зі сполук загальної формули І у функції активної речовини При цьому у функції розчинника бажано використовувати третинний амін, а реакцію здійснюваЗалежно від форми введення, лікарські засоби ти при температурі, що знаходиться в інтервалі від за даним винаходом виготовляють у тому чи ін20 до 80°С шому дозуванні, використовуючи для цього звичайні тверді або рідкі носи і/або розріджувачі і траВ оптимальному варіанті взаємодія відбувадиційно застосовувані у фармацевтиці ДОПОМІЖНІ ється з тіоефірами хлормурашиної кислоти в піриречовини Узагалі, композиції бажано випускати в дині або триетиламші при температурі, що знахолікарській формі, придатній для орального придиться в діапазоні від 20 до 40°С ймання Такими лікарськими формами є, наприВИХІДНІ сполуки загальної формули II одержуклад, таблетки, таблетки з плівковим покриттям, ють, якщо не зазначено іншого, керуючись вказівдраже, капсули, пігулки, порошки, розчини й суками, наведеними в заявці ЕР-А 0648778 або ЕР-А спензії, а також форми пролонгованої дії 0648779 Застосовні у фармацевтиці солі одержують віЗрозуміло, що також можна одержувати комдомими методами Як фізіологічне придатні неорпозиції для парентерального введення, такі, як ганічні й органічні кислоти з цією метою викорисрозчини для ІН'ЄКЦІЙ Крім згаданих, як приклад товують, зокрема, соляну кислоту, можна також навести композиції у формі супозибромистоводневу кислоту, фосфорну кислоту, торіїв сірчану кислоту, щавлеву кислоту, малеїнову кисТаблетки, наприклад, виготовляють, змішуючи лоту, фумарову кислоту, молочну кислоту, винну активну речовину з відомими допоміжними речокислоту, яблучну кислоту, лимонну кислоту, салівинами, такими, зокрема, як декстроза, цукор, социлову кислоту, адипінову кислоту й бензойну кирбіт, маніт, полівшілпіролідон, розпушувачі, такі, як слоту Інші придатні кислоти описано, наприклад, у кукурудзяний крохмаль або альпнова кислота, із Fortschritte der Arzneimittelforschimg, том 10, crop зв'язуючими, такими, як крохмаль або желатин, із 224-225, видавництво Birkhauser Verlag, Базель і речовинами, що надають слизькості, такими, як Штуттгарт, 1966, і в Journal of Pharmaceutical Sciстеарат магнію або тальк, і/або агентами, що заences, том 66, crop 1-5(1977) безпечують ефект пролонгації, такими, як карбоксил пол іметилен, карбоксиметилцелюлоза, ацетоКислотно-адитивні солі одержують, як правифталат целюлози або полівшілацетат Таблетки ло, відомим методом, змішуючи вільну основу або можуть також бути багатошаровими и розчини з ВІДПОВІДНОЮ кислотою або розчинами останньої в органічному розчинникові, наприклад, У ВІДПОВІДНИЙ спосіб виготовляються й драже у нижчому спирті, такому, як метанол, етанол, нПри цьому серцевину, сформовану аналогічно пропанол або ізопропанол, нижчому кетоні, такотакій таблеток, покривають оболонкою, для чого му, як ацетон, метилетилкетон або метилізобутилвикористовують такі матеріали, як полівшілпіролікетон, або простому ефірі, такому, як діетиловий дон або шелак, гуміарабік, тальк, дюксид титану ефір, тетрапдрофуран або діоксан Щоб оптимізуабо цукор При цьому оболонка драже може склавати осадження кристалів, можна використовувати датися з кількох шарів Багатошаровість забезпетакож суміші згаданих розчинників Крім того, із чується використанням таких самих допоміжних використанням водного розчину відповідної кислоречовин, що застосовуються для таблеток ти можна одержувати фізіологічне придатні водні Щоб поліпшити смак, до розчинів або суспенрозчини кислотно-адитивних солей сполук формузій з умістом активної речовини за даним винахоли І дом можна домішувати такі речовини, як сахарин, цикламат або цукор, і/або ароматичні речовини, Загальновідомими методами, наприклад, із такі, як ванілін або апельсиновий екстракт Крім використанням лугів або за допомогою юнообмінвищенаведених, можна вводити ДОПОМІЖНІ агенти ників, кислотно-адитивні солі сполук загальної фосуспендування, такі, як натрійкарбоксиметилцермули І перетворюють на ВІЛЬНІ ОСНОВИ ЯКЩО люлоза, або консерванти, наприклад, постанню ввести у взаємодію з неорганічною або пдроксибензойну кислоту органічною кислотою, насамперед, із такою, здатною утворювати застосовні в терапевтиці солі, При виготовленні капсул активна речовина можна одержати ІНШІ СОЛІ ЦІ або ІНШІ СОЛІ нової змішується з носіями, такими, молочний цукор або сполуки, як, наприклад, пікрат, можна використосорбіт, після чого інкапсулюється вувати також для очищення вільної основи за раСупозиторії одержують, наприклад, змішуючи хунок перетворення останньої на сіль, її відокремактивну речовину з ВІДПОВІДНИМИ НОСІЯМИ, такими, лення й наступного повторного виділення із солі як нейтральні жири або поліетиленгліколь, або ПОХІДНІ останнього Ще одним об'єктом даного винаходу є фармацевтичні композиції, які відрізняються тим, що місСполуки загальної формули І за даним винатять принаймні одну зі сполук загальної формули ходом зв'язуються на рецепторі прогестерону І (див таблицю 1) і, якщо порівнювати з RU 486, помітно слабкіше діють проти глюкокортикоідів, Об'єктом даного винаходу є також лікарські про що можна судити, виходячи зі зниженої СТІЙКОзасоби для орального, ректального, підшкірного, СТІ зв'язування глюкокортикоідів на рецепторі m внутрішньовенного або внутрішньом'язового ввеvitro (див таблицю 1) дення з умістом поряд із звичайними носіями й 59437 15 16 Таблиця 1 Зв'язування S-заміщених полових ефірів 1ір-бензальдоксиместра-4,9-дієнвупльноі кислоти з рецептором Сполука з прикладу 1 (J 1241) 2 (J 1247) 3 (J 1042) 4 (J 1234) 5 (J 1240) 6 (J 1245) 7 (J 1230) 8 (J 1244) для порівняння RU 486 (міфепристон) J867 ZK 98299 (онапристон) Відносна сполучна афінність у пере- Відносна сполучна афінність у перерахурахуванні на моль (ВСА у %) рецепто- ванні на моль (ВСА у %) рецептора глюра прогестерону прогестерон=100% кокортикоіду дексаметазон=100% 159 49 185 52 164 42 144 53 77 20 64 22 42 2 74 32 506 302 22 685 77 39 Примітка J 867 означає 1ір-[4-(пдроксммінометил)феніл]-17р-метокси-17а-метоксиметилестра-4,9-дієн3-он (ЕР-А 0648778 і ЕР-А 0648779) Таблиця 2 Абортивна дія на ранній стадії вагітності (5-7-й день) у пацюка після підшкірного введення [О^мл^варина/день у бензоілбензоаті/рициновій олії (об'ємне співвідношення 1 4)] Сполука з прикладу Доза (мг^варина/день) НОСІЙ 2 (J 1 2 4 7 ) 3 (J 1 0 4 2 ) 7 (J 1 2 3 0 ) RU 486 (порівняння) J 867 (порівняння) Примітка * матка без зародка, N - число спарених самок, N# - число неваптних самок Виявилося, що, використовуючи субстанції за даним винаходом із високим степенем спорідненості до рецептора прогестерону (див таблицю 1), перервати вагітність у пацюків на ранній стадії 3 10 3 1 3 1 3 1 0,3 3 1 0,3 Повне пригнічення вагітності* N*/N % 0/6 0 0/4 0 1/5 20 0/5 0 0/5 0 0/5 0 0/5 0 5/5 100 1/5 20 0/5 0 5/5 100 5/5 100 0/5 0 було неможливим Цього ефекту можна було домогтися тільки у тому випадку, якщо згадані субстанції застосовувалися в максимальному дозуванні І навіть тоді субстанції за даним винаходом (як, наприклад, J 1042) виявилися нездатними перервати вагітність у морських свинок (див таблицю 3) 17 59437 18 Таблиця З Абортивна дія після підшкірного введення на 43-44-й день вагітності в морських свинок Субстанція з прикладу Доза (мг^варина/день) 3 (J 1042) Примітка N - число спарених самок, # N - число неваптних самок Незважаючи на високий степінь спорідненості до рецептора, сполуки за даним винаходом залишаються нездатними інгібувати лютеоліз (утворення жовтого тіла яєчника) Проте, несподівано було встановлено, що сполуки формули І перешкоджають овуляції у морських свинок і діють аналогічно прогестеронові На відміну від онапристону, який у морських свинок у менструальному циклі, незважаючи на високий рівень прогестерону в крові, індукує проліферацію й зроговіння епітелію піхви, дію сполук за даним винаходом (незважаючи на низький рівень прогестерону в крові), що полягає в повному приглушенні проліферації епітелію та підвищенні слизовиділення, слід розглядати як фактор домінантності прогестерону У цій структурі дія субстанцій за даним винаходом є аналогічною такій паралельно випробуваних гестагенів (прогестерону або левоноргестрелу) Що стосується інших показників, одержаних у ході експериментів із морськими свинками, можна провести чітку границю між протидією сполук формули І за даним винаходом "чистим" антагоністам типу І (онапристонові) і такою агоністам (прогестеронові) Онапристон до мінімуму знижує рівень простагландину в крові, тоді як прогестерон і левоноргестрел сприяють посиленню й збільшенню тривалості секреції PGF2a У матці, в результаті чого підвищується рівень F-метаболіту простагландину (PGMF-рівень) у крові PGMF являє собою довгоіснуючий головний метаболіт PGF2a, що утворюється ендометрієм Порівнявши контрольні тварини, що досліджувалися в менструальному циклі у фазі лютеолізу, із тваринами, обробленими гестагеном, установили, що сполуки за даним винаходом знижують рівень PGFM Проте, тут слід зазначити, що показники PGFM-рівня були не такими низькими, як у тварин, оброблених онапристоном У ході експериментів із кроликами на основі тесту Макфейла субстанції за даним винаходом діяли як трансформатори, а в комбінації з прогестероном, навпаки, перешкоджали трансформації Результати експериментів на тваринах дають змогу пересвідчитися в тому, що підвищена часткова агоністична дія антагоністів прогестерону за даним винаходом на рецепторі прогестерону повністю виключає ризик виникнення абортивних ефектів Крім того, було встановлено, що ці антагоністи володіють властивостями, які дозволяють з успіхом використовувати їх при терапії, такими, зокрема, як приглушення секреції простагландинів Повне пригнічення вагітності N*/N % 0/7 0/7 0/7 10 ЗО 100 0 0 0 маткою, приглушення проліферативних процесів у тканинах генітального тракту, а також перешкоджання овуляції Для описаної у даній заявці активної речовини запропоновано назву "мезопрогестин", оскільки речовина, що визначається терміном "антигестаген", як відомо, характеризується наявністю абортивних властивостей, яких у сполук за даним винаходом у ході експериментів на тваринах виявлено не було Сполуки за даним винаходом являють собою високоафінні модулятори стероїдних рецепторів із підвищеною селективністю Насамперед, вони є агоністами або антагоністами рецепторів прогестерону й андрогенів Ще одним об'єктом даного винаходу, виходячи з вищенаведеного, є застосування запропонованих сполук загальної формули І для лікування ендометрюзу, Uterus myomatosus, дисменореї та передменструального синдрому, для індукції оборотної аменореї без дефіциту естрогенів, а також у рамках замісної гормонотерапії (ЗГТ) у клімактеричний період У разі потреби, ці сполуки можна використовувати в комбінації з естрогенами За даним винаходом перші також можна застосовувати з метою одержання протизаплідних засобів Сполуки загальної формули І є показаними за даним винаходом також до застосування в таких випадках при порушеннях менструальної кровотечі, при геморагії, із метою контролювання й модуляції фертильності, при міомах, лейомюмі, остеопорозі, акне (вуграх), при утворенні пухлин, таких, як пухлини грудей, пухлини ендометрію, пухлини яєчників, при ендометрюзі, гіперплазії простати, при опуханні передміхурової залози, при облисінні, зумовленому гормонами, а також при андрогенних захворюваннях і явищах випадання Нижче даний винахід детальніше пояснюється на прикладах Загальні рекомендації щодо синтезу Sзаміщених похідних 11р-бензальдоксиместра-4,9дієну До 2 ммолей 4-[17р-заміщений-17азаміщений-3-оксоестра-4,9-дієн-11 ріл]бензальдепд-(Е або 2)оксиму в Юмл піридину додають 3 ммоля ВІДПОВІДНОГО 8ал кіл (ар илового) ефіру хлормурашиної кислоти Потім перемішують при кімнатній температурі до завершення повного перетворення, зливають у воду й утворений осад відфільтровують із використанням вакуум-фільтра, після чого промивають водою й сушать Наприкінці сирий продукт очищають методом хроматографії і/або рекристалізації Приклад 1 19 59437 4-[17р-метокси-17а-(метоксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[0(метилтю)карбоніл]оксим, вихід 71% від теоретичного, t m 134-137°C (ацетон/метил-трет -бутиловий ефір), aD=+184°(CHCI3), ІЧ у КВг [см 1 ] 1657 (С=С-ОС-О=О), 1740 (OC=OSCH3), УФ [МеОН] Хтаж 273нм, є=24505, log є=4,39, Ятах289нм, є=22690, log є=4,36 1 Н-ЯМР [CDCI3l TMC] (5, част /млн) 0,52 (s, ЗН, Н-18), 2,40 (s, ЗН, SCH3), 3,25 (s, ЗН, ОСН3), 3,42 І 3,57 (2d, 2H, и=10,5Гц, 17а-СН2ОСН3), 4,41 (d, 1H, и=6,9Гц, Н-11а), 5,78 (s, 1H, Н-4), 7,29 (d, 2Н, и=4,5Гц, Н-21), 7,61 (d, 2Н, и=7,8Гц, Н-31), 8,32 (s, 1Н, CH=N-OC=OSCH3) Приклад 2 4-[17р-пдрокси-17а-(метоксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[Ометилтю)карбоніл]оксим, вихід 68% від теоретичного, t m 186-189°C (ацетон), aD=+230°(CHCI3), ІЧ у КВг [см 1 ] 1602, 1652 (R-CO-R, Ph, >ON-), 1729(-S-CO-0-), УФ [МеОН] Я т а х 274нм, є=30780, log є=4,49, Ятах289нм, є=28560, log є=4,55 1 Н-ЯМР [CDCI3, TMC] (5, част /млн) 0,52 (s, ЗН, Н-18), 2,40 (s, ЗН, -SCH3), 3,21 (d, 1H, и=8,8Гц, -СН2-О), 3,41 (s, ЗН, -О-СН3), 3,56 (d, 1H, и=8,8Гц, СН2-О), 4,42 (d, 1P, J=7,1T4, H-11), 5,79 (s, 1H, Н4), 7,28 (d, 2Н, J=8,1T4, Н-31), 7,62 (d, 2H, J=8,1 Гц, Н-21), 8,32 (s, 1H, -HG=N) Приклад 3 4-[17р-метокси-17а-(метоксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, вихід 70% від теоретичного, t m 148-155°С (ацетон/гексан), aD=+235°(CHCI3), ІЧ у КВг [см 1 ] 1606 (феніл), 1653 (С=С-С=СС=О), 1745(-OC=OSEt), УФ (МеОН) Я т а х 274нм, є=31085, log є=4,49, Ятах298нм, є=28280, log є=4,45 1 Н-ЯМР [CDCI3, TMC] (8, част /млн) 0,52 (s, ЗН, Н-18), 1,37 (t, ЗН, 1=7,5Гц, SCH2CH3), 2,95 (q, 2Н, J=4,5 і 15Гц, SCH2CH3), 3,25 (s, ЗН, ОСН3), 3,41 (s, ЗН, ОСНз), 3,42 і 3,57 (2d, 2H, и=10,5Гц і 10,8Гц, СН2О), 4,41 (d, 1Н, и=7,2Гц, H-11a), 5,79 (s, 1Н, Н4), 7,27 (d, 2H, и=8,4Гц, -2', 7,61 (d, 2H, и=8,4Гц, НЗ1), 7,54 (s, 1H.OH), 8,31 (s, 1H, CH-NOCOSEt) Приклад 4 4-[17р-пдрокси-17а-(метоксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдемд-1 -(Е)-[Оетілю)карбоніл]оксим, вихід 74% від теоретичного, t m 176-180°С (дихлорметан/оцговий ефір), aD=+226° (СНСІз), 1 ІЧ у КВг [см ] 1600, 1653 (R-CO-R, Ph, >C=N-), 1729, (-S-CO-O-C^O), УФ [МеОН] Хтаж 274нм, є=31140, log є=4,50, Ятах289нм, є-28720, log є=4,46 1 Н-ЯМР [CDCI3, TMC] (5, част /млн) 0,52 (s, 20 ЗН, Н-18), 1,36 (t, ЗН, J=7,2 Гц, -СН2СН3), 2,73 (dt, 2Н, J=1,5, 5,3Гц, Н-7), 2,95 (q, 2H, и=Гц, -СН2СН3), 3,21 (d, 1H, и=9,2Гц, -СН2-О-), 3,42 (s, ЗН, -О-СН3), 3,56 (d, 1H, и=9,2Гц, -СН2-О), 4,41 (d, 1H, и=6,7Гц, Н-11), 5,79 (s, 1Н, Н-4), 7,27 (d, 2Н, и=8,2Гц, Н-3'), 7,62 (d, 2H, и=8,2Гц, Н-2'), 8,32 (s, 1H, -HON) Приклад 5 4-[17р-пдрокси-17а-(азидометил)-3-оксоестра4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, вихід 64% від теоретичного, U 168-171 °С (ацетон), aD=+197°(CHCI3), ІЧ у КВг [см 1 ] 1658 (С=С-ОС-С=О), 1693, 1715 (-OCOSEt), 2094 (N3), УФ [МеОН] Хтаж 274нм, є=33150, log є=4,49, Ятах288нм, є=28140, loge=4,45 1 Н-ЯМР [CDCI3l TMC] (5, част /млн) 0,54 (s, ЗН, Н-18), 1,37 (t, ЗН, и=7,2Гц, SCH2CH3), 1,61 (s, 1Н, ОН), 2,95 (q, 2H, J=4,5 і 14,7Гц СН2СН3), 3,30 і 3,59 (2d, 2H, и=12Гц, 17a-CH2N3), 4,45 (d, 1H, и=6,9Гц, H-11a), 5,80 (s, 1Н, Н-4), 7,29 (d, 2H, и=8,4Гц, Н-21), 7,64 (d, 2H, и=8,4Гц, Н-3'), 8,32 (s, 1Н, CH=N-OC-OSC2H5) Одержання вихідної сполуки Стадія А 1г 4-[3,3-диметокси-5а-пдрокси-17(3)спіроепоксіестр-9-ен-11 р-іл]бензальдепд-1 етиленкеталю суспендують у 50мл етиленгліколю й перемішують із 1г азиду натрію при 100°С протягом 2,5год Потім охолоджений розчин, паралельно перемішуючи, зливають у воду, осад відфільтровують за допомогою вакуум-фільтра, промивають до нейтрального стану й сушать У такий спосіб одержують 870мг 4-[17а-азидометил3,3-диметокси-5а,17р-дипдроксіестр-9-ен-1іріл]беюальдепд-1 -етиленкеталю у формі пінявої речовини світло-брунатного кольору, що використовують на наступній стадії 1 Н-ЯМР [CDCI3, TMC] 0,47 (s, ЗН, Н-18), 1,87 (s, 1Н, ОН), 3,21 і 3,23 (2s, у кожному випадку ЗН, ОСН3), 3,22 і 3,54 (2d, 2H, J=10,8 Гц, CH 2 N 3) , 4,04,16 (2m, 4H, етиленкеталъ), 4,29 (d, IH, и=7,2Гц, Н-11 a), 4,68 (s, IH, ОН), 5,76 (s, 1H, СН-кеталь), 7,23 (d, 2H, и=8,4Гц, Н-2'), 7,38 (d, 2H, и=8,4Гц, НЗ1) Стадія Б 650мг 4-[17а-азвдометил-3,3-диметокси5а, 17р-дипдрокаестр-9-ен-11 р-іл]бензальдепд-1 етиленкеталю в 12 мл ацетону й 1,2мл води при кімнатній температурі вводять у взаємодію з 155мг п-толуолсульфокислоти Через 2 год нейтралізують водним аміаком При цьому випадає осад, що відфільтровують за допомогою вакуум-фільтра й сушать Наприкінці здійснюють рекристалізацію 4[17а-азидометил-17р-пдрокси-3-оксоестра-4,9дієн-11 р-іл] бензальдегіду з ацетону t m 197-205°C (ацетон), aD=+156°(CHCI3), ІЧ у КВг [см 1 ] 1648 (С=С-С=С-С=О), 1712 (СНО), 2100 (N3), УФ [МеОН] Хтаж 203нм, є=21143, log є=4,32, Хтаж 263нм, є=8338, log є=4,26, Хтаж 299нм, є=20712, Іодє=4,32, 1 Н-ЯМР [CDCI3, TMC] (5, част /млн) 0,53 (s, 21 59437 ЗН, Н-18), 2,04 (s, 1H, ОН), 3,31 і 3,60 (2d, 2H, J=12,3f4, 17a-CH 2 N 3 ), 4,48 (d, 1H, и=7,2Гц, H-11a), 5,81 (s, 1H, H-4), 7,37 (d, 2H, и=8,4Гц, Н-21), 7,82 (d, 2Н, и-8,4Гц, Н-3'), 9,98 (s, 1H СНО) Стадія В 495мг 4-[17а-азидометил-17р-пдрокси-3оксоестра-4,9-дієн-1ір-іл]беюальдепду протягом З год при кімнатній температурі піддають реакції з 5мл піридину й 80мг пдрохлориду пдроксиламшу Потім зливають у крижану воду й утворений безбарвний осад відфільтровують із використанням вакуум-фільтра, сушать і очищають за допомогою хроматографії У такий спосіб одержують 380мг 4[17а-азидометил-17р-пдрокси-3 -оксоестра-4,9дієн-11 р-іл] бензальдепд-(Е)-оксиму t m 145-151 і 193-200°С (метил-трет-бутиловий ефір), а о =+212°(СНСІ 3 ), ІЧ у КВг [см" 1 ] 1643, 1657 (С-С-С=С-С=О), 2099 (N 3 ), УФ [МеОН] Ятах 265нм, є=21765, log є=4,34, Ятах299нм, е=22520, log є=4,35, 1 Н-ЯМР [ДМСО, ТМС] (6, част /млн) 0,43 (s, ЗН, Н-18), 2,04 (s, 1H, ОН), 3,09 і 3,40 (2d, 2H, и=12,0Гц, 17a-CH 2 N 3 ), 4,40 (d, 1H, и=6,2Гц, H-11a), 4,74 (s, 1Н, ОН), 5,68 (s, 1H, H-4), 7,24 (d, 2H, J=8,1I~4, H-2), 7,51 (d, 2H, и=8,1Гц, Н-31), 8,10 (s, 1H, CH-NOH), 11,16 (s, 1H, OH) Приклад 6 4-[17р-пдрокси-17а-(хлорметил)-3-оксоестра4,9-дієн-11 р-іл]бензальдепд-1 -(E)-[O(етилтю)карбоніл]оксим tnn 164-169°C (ацетон/мегил-трет -бутиловий ефір), a D =+222° (СНСІз), ІЧ у КВг [ с м 1 ] 1595 (феніл), 1643 (С=С-С=СС=О), 1740(-OCOSEt), УФ [МеОН] Я т а х 273нм, є=30950, log є=4,49, Ятах288нм, є=28140, log є=4,45 1 Н-ЯМР [CDCIs, ТМС] 0,59 (s, ЗН, Н-18), 1,37 (t, ЗН, и=7,5Гц, SCH 2 CH 3 ), 2,95 (q, 2H, J=4,5 І 15Гц, SCH 2 CH 3 ), 3,65, 3,84 (2d, 2H, J=10,8f4 і 11,1 Гц, СН 2 О), 4,43 (d, 1Н, J=7,2 Гц, H-11a), 5,80 (s, 1H, H4), 7,27 (d, 2H, J-в.іГц, H-21), 7,64 (d, 2H, и-8,4Гц, H-31), 8,32 (s, 1H, CH-NOOOSH) Приклад 7 4-[17р-пдрокси-17а-(ціанометил)-3-оксоестра4,9-дієн-11 р-іл]бензальдепд-1 -(E)-[O(етилтю)карбоніл]оксим, вихід 75% від теоретичного, tnn 178-181 °С (ацетон/метил-трет -бутиловий ефір), a D =+222°(CHCI 3 ), ІЧ у КВг [см і 1 ] 1595, 1637 (R-CO-R, >C=N-), 1736 (-S-CO-O-), 2247 (-CH2-CN), УФ [МеОН] Хтаж 273нм, є=31310, log є=4,50, Ятах=288нм, є=28560, log є=4,55 1 Н-ЯМР [CDCI 3 , ТМС] 0,57 (s, ЗН, Н-18), 1,36 (t, ЗН, и=7,5Гц, -СН 2 СН 3 ), 2,95 (q, 2H, и=7,5Гц, СН 2 СН 3 ), 4,48 (d, 1Н, 3=6,7Гц, Н-11), 5,80 (s, 1Н, Н4), 7,27 (d, 2H, и=8,2Гц, Н-3'), 7,64 (d, 2H, и=8,2Гц, Н-21) Приклад 8 4-{17р-пдрокси-17а[(етилтюкарбонілокси)метил]-3-оксоестра-4,9-дієн 22 11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, вихід 53% від теоретичного, U 152-156°С (ацетон), a D =+166° (СНСІз), ІЧ у КВг [ с м 1 ] 1655 (С=С-С=С-С=О), 1691 (OOOSEt), УФ [МеОН] Хтаж 273нм, є=31290, log є=4,50, Ятах=288нм, є=28490, log є=4,45 1 Н-ЯМР [CDCIs, ТМС] 0,55 (s, ЗН, Н-18), 1,35 і 1,37 (2t, 2хЗН, СН 2 СН 3 ), 2,13 (s, 1Н, ОН), 2,40 (s, ЗН, SCH 3 ), 2,87-2,99 ( т , 4Н, 2хСН 2 СН 3 ), 4,20 і 4,34 (2d, 2Н, и=10,8Гц, 17а-СН 2 ОСН 3 ), 4,43 (d, 1H, и=6,9Гц, Н-11 а), 5,80 (s, 1H, Н-4), 7,27 (d, 2H, и=8,1Гц, Н-2'), 7,64 (d, 2Н, и=8,4Гц, Н-3'), 8,32 (s, 1Н, CH=N-OC=OSCH 3 ) Одержання вихідної сполуьси Стадія А Зг 4-[3,3-диметокси-5а-пдрокси-17(3)спіроепоксіестр-9-ен-17р-іл]беюальдемд-1 етиленкеталю разом із 22мл 2н NaOH нагрівають у 65мл метиліпролідону протягом 5год до 110°С, після чого зливають у крижану воду Далі екстрагують оцтовим ефіром, органічну фазу промивають до нейтрального стану, сушать й упарюють в умовах вакууму Утворене темне масло очищають методом хроматографії, одержуючи в результаті 1,13г 4-[3,3-диметокси-5а, 17р-дипдрокси-17а(пдроксиметил)естр-9-ен-11 р-іл]беюальдемд-1 етиленкеталю у формі пінявої речовини блідожовтого кольору, яку використовують на наступній стадії 1 Н-ЯМР [CDC1 3 , ТМС] 0,47 (s, ЗН, Н-18), 2,04 (s, 1Н, ОН), 3,21 і 3,22 (2s, у кожному випадку ЗН, ОСНз), 3,40 і 3,74 (2d, 2H, J=10, 8Гц, СН 2 ОН після HD-обмшу), 4,0-4,15 (2m, 4H, етиленкеталь), 4,29 (d, 1Н, ^ 7 , 2 Г ц , Н-11 а), 4,67 (s, 1Н, ОН), 5,76 (s, 1Н, СН-кеталь), 7,23 (d, 2H, и=8,4Гц, Н-21), 7,37 (d, 2Н, и=8,4Гц, Н-31) Стадія Б 1,13г 4-[3,3-диметокси-5а,17р-дипдрокси-17а(пдроксиметил)естр-9-ен-11 р-іл]бензальдепд-1 етиленкеталю розчиняють у 17мл ТГФ і перемішують разом із 2мл води й 260мг птолуолсульфокислоти протягом 4год при кімнатній температурі Потім В умовах вакууму концентрують до половини об'єму й одержаний розчин, паралельно перемішуючи, зливають у крижану воду Далі ДВІЧІ екстрагують оцтовим ефіром, органічну фазу промивають до нейтрального стану, сушать і упарюють в умовах вакууму Сирий продукт кілька разів рекристалізують з оцтового ефіру, одержуючи в результаті 308мг 4-[17р-пдрокси17а-(пдроксиметил)-3-оксоестра-4,9-дієн-11 ріл]бензальдепду t m 211-220°C (оцтовий ефір), a D =+185°(CHCI 3 ), ІЧ у КВг [ с м 1 ] 1661 (С=С-С=С-С=О), 1693 (СН=О), УФ [МеОН] Я т а х 264нм, є=14560, log є=4,16, Ятах299нм, є=16180, 1 Н-ЯМР [CDCIs, ТМС] 0,53 (s, ЗН, Н-18), 3,4 і 3,8 ( 2 т , 2Н, СН 2 О, 4,65 d і 4,95 d після додавання ТАІ J=12,0ri0, 4,43 (d, 1Н, и=7,2Гц, Н-11 а), 5,80 (s, 1Н, Н-4), 7,38 (d, 2H, и=8,1Гц, Н-2'), 7,81 (d, 2H, 23 J=8,4I~4, H-31), 9,97 (s, 1H, CY=O) 59437 Стадія В 752мг 4-[17р-пдрокси-17а-(пдроксиметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепду, паралельно перемішуючи, вводять у реакцію з 128мг пдрохлориду пдроксиламшу, що здійснюється у 8мл піридину в атмосфері аргону протягом 40хв при юмнатній температурі Потім розчин зливають у крижану воду, осад відфільтровують за допомогою вакуум-фільтра, промивають і сушать У результаті одержують 690мг 4-[17р-пдрокси-17а(пдроксиметил)-3-оксоестра-4,9-дієн-11 ріл]бензальдепд-(Е)-оксиму Т пл 198-204°С (оцтовий ефір/метил-трет бутиловий ефір), aD=+237° (MeOH), ІЧ у КВг [см 1 ] 1637,1650,1657 (ООСОСО), УФ [МеОН] Я т а х 264нм, є=20503, log є=4,31, Ятах299нм, є=20020, log є=4,30, 1 Н-ЯМР [CDCI3l ТМС] 0,53 (s, ЗН, Н-18), 3,4 і 3,8 (2m, 2H, СН2О, 4,65 d і 4,95 d після додавання ТАІ J=12,0l~4), 4,43 (d, 1Н, J=7,2I~4, Н-11а), 5,80 (s, 1Н, Н-4), 7,38 (d, 2H, J=8,1I~4, H-21), 7,81 (d, 2H, и=8,4Гц, Н-31), 9,97 (s, 1Н, СН=О) Приклад 9 4-[17р-пдрокси-17а-(етилтюметил)-3оксоестра-4,9-дієн-11 р-іл]бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, вихід 73% від теоретичного, thn 138-141 °С (ацетон/ЕЮН), aD=+184°(CHCI3), ІЧ у КВг [см 1 ] 1602 (феніл), 1646, 1650 (С=СС=С-С=О), 1731, 1737 (OOOSEt), УФ [МеОН] Хтаж 274нм, є=31420, log є=4,50, Ятах288нм, є=28750, [CDCI3, ТМС] 0,55 (s, ЗН, Н-18), 1,29 (t, ЗН, J=7,2I~4, SCH2CH3), 1,37 (t, ЗН, и-7,2Гц, SCH2CH3), 2,60 (q, 2H, и=7,2Гц і и=14,7Гц, SCH2CH3), 2,71 і 2,96 (2d, 2Н, и-12,9Гц, ^а-СНзЭСзСНз), 2,85 (s, 1Н, ОН), 2,95 ( т , 2Н, SCH2CH3), 4,44 (d, 1H, и=7,2Гц, Н-11а), 5,79 (s, 1H, Н-4), 7,27 (d, 2H, J8,4Гц, Н-21), 7,63 (d, 2Н, и=8,4Гц, Н-31), 8,32 (s, 1H, CH-NOR) Одержання вихідної сполуки Стадія А 1,48г 4-[3,3-диметокси-5а-пдрокси-17(3)спіроепоксіестр-9-ен-11 р-іл]бензальдепд-1 етиленкеталю з 500мг тюетаноляту натрію, паралельно перемішуючи, протягом 2год нагрівають у 15мл ДМСО до 80°С Потім зливають у крижану воду, відфільтровують за допомогою вакуумфільтра й промивають до нейтрального стану По завершенні сушіння одержують 1,47г 4-[3,3диметокси-5а, 17р-дипдрокси-17а(етилтюметил)естр-9-ен-11 р-іл]бензальдепд-1 етиленкеталю у формі сирого продукту брунатного кольору, який використовують на наступній стадії Стадія Б 1,47г 4-[3,3-диметокси-5а,17р-дипдрокси-17а(етилтюметил)естр-9-ен-11 р-іл]бензальдепд-1 етиленкеталю вводять у взаємодію з 140мг птолуолсульфокислоти, що здійснюється в 15мл ацетону протягом 4 год при кімнатній температурі Потім зливають у водний розчин бікарбонату, відфільтровують за допомогою вакуум-фільтра й 24 промивають до нейтрального стану Утворений осад (1,24г) очищають методом хроматографії У такий спосіб одержують 640мг 4-[17 аетилтюметил-17р-пдрокси-3-оксоестра-4,9-дієн11 р-іл]бензальдепду Тпл 180-182°С (ацетон), aD=+160°(CHCI3), ІЧ у КВг [см 1 ] 1650, 1656 (С=С-С=С-С=О), 1697 (СН=О), УФ [МеОН] Я т а х 264нм, є=20375, log є=4,31, Ятах299нм, є=22810, log є=4,36 1 Н-ЯМР [CDCI3, ТМС] 0,54 (s, ЗН, Н-18), 1,29 (t, ЗН, SCH2CH3), 2,61 ( т , 2Н, SCH2CH3), 2,88 (s, 1Н, ОН), 2,71 і 2,95 (2d, 2H, и=12,9Гц, CH2S), 4,48 (d, 1Н, и=7,2Гц, Н-11а), 5,80 (s, 1Н, Н-4), 7,37 (d, 2Н, и=8,1Гц, Н-21), 7,81 (d, 2Н, и=8,4Гц, Н-31), 9,98 (s, 1Н, СН=О) Стадія В 392мг 4-[17р-пдрокси-17а-етилтюметил-3оксоестра-4,9-дієн-1ір-іл] бензальдегіду піддають реакції з 61 мг пдрохлориду пдроксиламшу, що здійснюється у 20мл піридину при кімнатній температурі протягом 3,5год Потім зливають у крижану воду й утворений безбарвний осад відфільтровують за допомогою вакуум-фільтра, промивають водою до нейтрального стану й сушать в умовах вакууму 560мг сирого продукту очищають методом хроматографії та рекристалізують з ацетону В результаті одержують 335мг 4[17р-пдрокси-17а-етилтюметил-3-оксоестра-4,9дієн-11 р-іл]бензальдепд-(Е)-оксиму 1пл 132-137°С (ацетон), aD=+165°(CHCI3), ІЧ у КВг [см 1 ] 1649,1655 (ОС-ОС-ОО), УФ [МеОН] Хтаж 264нм, є=23800, log є-4,38, Ятах299нм, є=23045, log є=4,36, 1 Н-ЯМР [CDCI3, ТМС] 0,56 (s, ЗН, Н-18), 1,29 (t, ЗН, и=7,5Гц, SCH2CH3), 2,61 ( т , 2Н, SCH2CH3), 2,71 і 2,96 (2d, 2H, и=12,9Гц, 17a-CH2SC2CH3), 2,90 (s, 1Н, ОН), 4,42 (d, 1Н, и=7,2Гц, Н-11а), 5,79 (s, 1Н, Н-4), 7,20 (d, 2Н, и=8,4Гц, Н-21), 7,49 (d, 2H, и=8,4Гц, Н-31), 7,93 (s, 1H, NOH), 8,10 (s, 1H, CH=N) Приклад 10 (17Р)-4-{3-оксоестра-4,9-дієн-17-стро-5'оксазолідин-2'-он-11 р-іл}бензальдепд-1 -(Е)-[О(етилтю)карбоніл]оксим, U 133-138 і 150-158°С (ацетон/етанол), a D =+193°(CHCI 3 ), ІЧ у КВг [см 1 ] 1658 (С=С-С=С-С=О), 1719 (С=О), УФ [МеОН] Хтаж 273нм, є=26830, log є=4,43, Ятах298нм, є=24240, log є=4,38, [CDCfl3, ТМС] 0,53 (s, ЗН, Н-18), 1,37 (t, ЗН, J=7,5I~4, SCH2CH3), 2,95 (q, 2H, SCH2CH3), 3,81 (d, 1H, J=11,7I~4, 17a-CY2S-) 4,43 (d, 1H, J=6,6I~4, H11a), 4,52 (d, 1H, J=11,7I~4, 17a-CH2S-), 4,54 (s, 1H, NH), 5,80 (s, 1H, H-4), 7,28 (d, 2H, J=8,4I~4, H-21), 7,63 (d, 4H, J=8,4I~4, H-3'), 8,32 (s, 1H, CH-N) Одержання вихідної сполуки Стадія А 1,86г 4-[17а-хлорметил-17р-пдрокси-3оксоестра-4,9-дієн-1ір-іл] бензальдегіду вводять у взаємодію з 0,76мл трихлорацетиізоціанату, що 25 26 пробувану сполуку з рецепторами в цитозолі з клітин-мішеней органів тварин При цьому на меті малося насичення рецептора й досягнення хімічної рівноваги Дослідження проводили за таких умов інкубації Рецептор прогестерону матковий цитозоль ініційованого естрадюлом кролика, що зберігався при -30°С Буфер дня гомогенізації та інкубації TEDбуфер 20мМ трис/НСІ, рН=7,4, 1мМ етилендіамінотетраацетат, 2мМ дитютреїтол із 250мМ сахарозою Ізотопний індикатор 3H-ORG 2058, 5нм Порівняльна субстанція прогестерон Рецептор глюкокортикоіду цитозоль тимуса пацюка після адреналектомм, тимус, що зберігався при -30°С Буфер TED Ізотопний індикатор Н-дексаметазон, 20нм Порівняльна субстанція дексаметазон По завершенні інкубації рецепторної фракції, ізотопного індикатора й конкурента протягом 18год при 0-4°С проводили поділ зв'язаного й вільного стероїдів, що здійснювався шляхом домішування активованого вуплля/декстрану (у співвідношенні 1% 0,1%), центрифугування й виявлення пов'язаної з рецептором 3Н-активності в надосадовій рідині На підставі даних, одержаних у результаті послідовного використання різноманітних концентрацій, визначали ICso для порівняльної субстанції і випробуваної сполуки, а як коефіцієнт обох показників (хЮ0%) використовували відносну молярну афінність Приклад 12 Пригнічення вагітності в пацюка на ранній ста 59437 здійснюється у 50мл СН2СІ2 протягом однієї години при кімнатній температурі Додавши водний розчин ІЧЬЦСІ, фази розділяють Органічну фазу промивають до нейтрального стану, сушать і упарюють в умовах вакууму В результаті одержують 4-[17а-хлорметил-17р-(трихлорщетилкарбамоіл)3-оксоестра-4,9-дієн-11 р-іл]бензальдепд у формі пінявої речовини, що розчиняють метиленхлоридом Потім цей розчин протягом 5 год при кімнатній температурі перемішують із 10г оксиду алюмінію (Woelm super І, основний) Після цього його відфільтровують і екстрагують метиленхлоридом і метанолом Розчинник випарюють і утворену піняву речовину брунатного кольору очищають методом хроматографії на силікагелі У такий спосіб одержують 850мг (17R)-4-(3-OKCoecrpa-4, 9-дієн17-стро-5'-оксазолідин-2'-он-11 р-іл)бензальдепду tm 173°C розклад (метил-трет -бутиловий ефір/ацетон/гексан), aD=+152°(CHCI3), ІЧ у КВг [см 1 ] 1603 (феніл), 1650, 1682 (С=СС=С-С=О), 1701, 1721 (С=О), УФ [МеОН] Хтаж 262нм, є=18090, log є=4,26, Ятах297нм, є=20760, log є=4,32, 1 Н-ЯМР [CDCI3, ТМС] 0,53 (s, ЗН, Н-18), 3,82 (d, 1H, и=11,7Гц, 17a-CH2NH-), 4,48 (d, 1H, и=6,9Гц, Н-11а), 4,52 (d, 1Н, J=11,7I~4, 17a-CH2NH-), 4,59 (s, 1Н, NH), 5,81 (s, 1Н, Н-4), 7,39 (d, 2Н, J=8,4I~4, Н2'), 7,82 (d, 4Н, J=8,4I~4, Н-3'), 9,98 (s, 1Н, СН=О), після додавання ТАІ 0,56 (s, ЗН, Н-18), 3,90 (d, 1H, J=12,3I~4, 17a-CH2NH-), 4,37 (d, 1H, J=12,3l~u., 17aCH2NH-), 4,52 (d, 1H, J=7,2l~u., H-11a), 5,83 (s, 1H, H-4), 7,38 (d, 2H, J=8,H~u., H-21), 7,82 (d, 4H, J=8,H~u., H-31), 9,98 (s, 1H, CH=O), 10,45 (широкий s, 1H, NCONHC=OCCI3) Стадія Б 440мг (17Р)-4-(3-оксоестра-4,9-дієн-17-cmpo5'-оксазолідин-2'-он-11 р-іл)бензальдепду піддають реакції з 70мг пдрохлориду пдроксиламшу, що здійснюється в 10 мол піридину протягом 4 год при кімнатній температурі Потім зливають у крижану воду, осад відфільтровують за допомогою вакуум-фільтра, сушать і очищають методом хроматографії' У результаті рекристалізації з ацетону/метил-трет -бутилового ефіру одержують 180мг (17К)-4-(3-оксоестра-4,9-дієн-17-стро-5'оксазолідин-2-он-11 р-іл)бензальдепд-1 -(Е)-оксиму tm 181 °С розклад (метил-трет -бутиловий ефір/ацетон), а0=+183°(ДМСО), ІЧ у КВг [см 1 ] 1614 (феніл), 1660,1694 (С=СС=С-С=О), 1729 (С=О), УФ [МеОН] Хтаж 264нм, є=21930, log є=4,34, Ятах298нм, є=21930, log є=4,34, 1 Н-ЯМР [ДМСО, ТМС] 0,47 (s, ЗН, Н-18), 3,97 (d, 1H, J=10,8l~4, 17a-CH2NH-), 4,46 (d, 1H, и=6,ЗГц, Н-11р), 4,58 (d, 1Н, J=11,4I~4, 17a-CH2NH-), 4,59 (s, 1Н, NH), 5,69 (s, 1Н, Н-4), 6,3 і 6,5 (широкий s, NH), 7,21 (d, 2Н, J=8,1I~4, H-2'), 7,51 (d, 4H, J=8,4I~4, H3'), 8,08 (s, 1H, CH=N), 11,17 (s, 1H, OH) Приклад 11 Визначення афінності рецептора Афінність рецептора визначали, конкурентно зв'язуючи зв'язувальний 3Н-мічений гормон (ізотопний індикатор) із підвищеною вибірковістю й ви Д" Самок пацюка вагою 180-200г спаровували на стадії проеструсу (передтічки) Якщо наступного дня на ДІЛЯНЦІ піхви виявляли сперматозоїди, із цього моменту починався ВІДЛІК часу вагітності (день 1 (d1)) Оброблення пацюків випробуваною субстанцією або носієм здійснювали з використанням 0,2мл бензоілбензоату/рицинової олії (в об'ємному співвідношенні 1 4) шляхом підшкірного введення в період із 5-го по 7-ий день (d5-d7), розтин робили на 9-ий день, якщо до цього моменту не спостерігалося виникнення болю Ріг матки препарували й досліджували на предмет наявності непорушених або ушкоджених місць нідацм (місця закріплення заплідненого яйця на СТІНЦІ матки) Показники, що характеризують повне пригнічення вагітності в різних груп, наведено в таблиці 2 Приклад 13 Пригнічення вагітності на ПІЗНІЙ стадії у вагітних морських свинок Вагітних морських свинок обробляли випробуваною субстанцією на 43-44-й день вагітності Останню вводили ПІДДОСЛІДНИМ тваринам у масляному розчині (0,2-2,0мл бензилбензоату/рицинової олії в об'ємному співвідношенні 1 4) підшкірно один раз на день на 43-й і 44-й дні Контрольних тварин обробляли виключно носієм У період вагітності за тваринами спостерігали до 50-го дня, при цьому, насамперед, 27 59437 визначали й реєстрували випадки викиднів і відшарування плаценти Приклад 14 Тест на антилютеолізл'ест на пригнічення овуляції у морських свинок у менструальному циклі Цей тест грунтується на тому факті, що прогестерон наприкінці циклу стимулює секрецію простагландинів маткою Пригнічення цієї функції у морських свинок викликає персистенцію проти Corpora lutea (антилютеоліз) Під час проведення цього тесту було встановлено, що антагоністи рецептора прогестерону з частковою агоністичною активністю не відрізняються сильною (порівн RU 486) антилютеолітичною дією або зовсім не діють на лютеоліз За допомогою аналогічного експерименту можна оцінити й степінь агоністичної дії на прогестерон, визначаючи, по-перше, активність проти овуляції і, по-друге, виявляючи типові наслідки дії прогестерону на генітальний тракт Отже, вищенаведений тест дає змогу здійснити важливу з погляду терапевтичної практики типізацію антагоністів прогестерону, поділяючи їх на "чисті" й "агоністичні" субстанції Морських свинок обробляли Комп'ютерна верстка О В Кураєв випробуваною 28 субстанцією в період із 10-го по 17-ий день циклу На 10-й день перед обробленням субстанцією, так само як і наступними днями аж до розтину, визначали концентрації прогестерону в сироватці (Elger W , Neef G , Beier S , Fahnnch M , Grundel M та ін , Current Concepts in Fertility Regulation and Reproduction, під ред Pun С P і Van Look P F H , 1994, crop 303-328) Приклад 15 Тест Макфейла, що проводився на жіночих особинах кролика, які не досягай статевої зрілості Ендометрій кроликів, що не досягай статевої зрілості, реагує на гестагени, як правило, ГІСТОЛОГІЧНОЮ трансформацією Саме цей фактор і було покладено в основу тесту Макфейла Його проводили, щоб з'ясувати, чи володіють субстанції за даним винаходом аналогічними прогестеронові властивостями Поряд із цим, водночас обробляючи тварини дозою прогестерону, яка викликала максимальну трансформацію, досліджували часткову антагоністичну дію цих субстанцій Останню в тесті Макфейла оцінювали за бальною "шкалою Макфейла" із градацією від 1 до 4, при цьому відмітка 4 відповідає максимальному степеню трансформації Підписано до друку 06 10 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюS-substituted 110100090000039d00000002001c00000000000500000009020000000005000000020101000000050000000102ffffff00050000002e0118000000050000000b0200000000050000000c02000240011200000026060f001a00ffffffff000010000000c0ffffffc6ffffff00010000c60100000b00000026060f000c004d61746854797065000050001c000000fb0280fe0000000000009001000000020002001053796d626f6c007740000000e3060a358f49f5779849f5770100000000003000040000002d01000008000000320a600128000100000062790a00000026060f000a00ffffffff0100000000001c000000fb021000070000000000bc02000000cc0102022253797374656d000000000a000000040000000000ffffffff0100000000003000040000002d01010004000000f00100000300000000000000-benzaldoxime-estra-4,9-diene-carbonic acid thiolesters, a method for preparing thereof and a pharmaceutical composition
Автори англійськоюSchubert Gerd, Ring, Sven, Kaufmann Gunter, Elger Walter
Назва патенту російськоюS-замещенные тиоловые эфиры 11b-бензальдоксимэстра-4,9-диенугольной кислоты, способ их получения и фармацевтическая композиция
Автори російськоюШуберт Герд, Кауфманн Гюнтер, Эльгер Вальтер
МПК / Мітки
МПК: A61P 15/00, A61P 15/18, C07J 41/00, C07J 43/00, A61K 31/565
Мітки: 11b-бензальдоксиместра-4,9-дієнвугільної, спосіб, тіолові, композиція, s-заміщені, фармацевтична, ефіри, кислоти, одержання
Код посилання
<a href="https://ua.patents.su/14-59437-s-zamishheni-tiolovi-efiri-11b-benzaldoksimestra-49-diehnvugilno-kisloti-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">S-заміщені тіолові ефіри 11b-бензальдоксиместра-4,9-дієнвугільної кислоти, спосіб їх одержання та фармацевтична композиція</a>
Попередній патент: Пристрій, електрод і ліжко для гіпертермії
Наступний патент: Броньовий захист легкоброньованої військової техніки
Випадковий патент: Спосіб виплавки сталі в конверторі