3,6-гемікеталі з класу 9а-азалідів, спосіб їх одержання, фармацевтична композиція на їх основі та спосіб лікування бактеріальних інфекцій
Номер патенту: 71556
Опубліковано: 15.12.2004
Автори: Лазаревскі Горяна, Кобрехел Габрієла, Вінковіч Младен
Формула / Реферат
1. Сполука загальної формули (I)
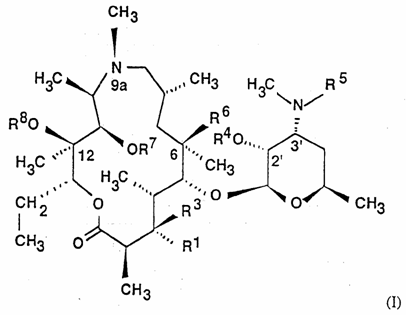 ,
,
де
R1 сам по собі означає гідроксильну, L-кладинозильну групу формули (ІІ)
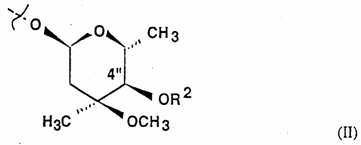 ,
,
за умови, що коли R1 є гідроксильною групою, R3, R4 і R8 одночасно не є воднем та R7 не є воднем та метилом, коли R1 є L-кладинозильною групою, R2 і R8 не є воднем,
де
R2 сам по собі означає водень або силільну групу,
R3 сам по собі означає водень або разом з R6 означає ефірну групу,
R4 сам по собі означає водень, (C1-C4)ацильну групу або -COO-(CH2)n-Ar групу, де n дорівнює 1-7, та Ar сам по собі означає незаміщену або заміщену арильну групу, що має аж до 18 атомів вуглецю,
R5 сам по собі означає водень, метильну групу або -COO-(CH2)n-Ar групу, де n дорівнює 1-7, та Ar сам по собі означає незаміщену або заміщену арильну групу, що має аж до 18 атомів вуглецю,
R6 сам по собі означає гідроксильну групу або разом з R3 означає ефірну групу,
R7 сам по собі означає водень, (C1-C12)алкільну групу, силільну групу або разом з R8 та C-11/C-12 атомами вуглецю означає циклічний карбонат,
R8 сам по собі означає водень, (C1-C12)алкільну групу, силільну групу або разом з R7 і C-11/C-12 атомами вуглецю означає циклічний карбонат,
за умови, що коли R1 є L-кладинозильною групою та R4 є воднем, ацетилом та пропіонілом, R2 не є воднем,
та її фармацевтично прийнятні адитивні солі неорганічних або органічних кислот.
2. Сполука за п. 1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2 та R7 однакові і означають триметилсилільну групу, R3 та R8 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, та R6 є гідроксильною групою.
3. Сполука за п. 1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2 означає триметилсилільну групу, R3, R7 та R8 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, та R6 є гідроксильною групою.
4. Сполука за п. 1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2 та R7 однакові і означають триметилсилільну групу, R3 означає водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, R6 є гідроксильною групою, та R8 є метилом.
5. Сполука за п. 1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2 означає триметилсилільну групу, R3 та R8 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, R6 означає гідроксильну групу, та R7 є метилом.
6. Сполука за п. 1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2 означає триметилсилільну групу, R3 та R7 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, R6 є гідроксильною групою, та R8 є метилом.
7. Сполука за п. 1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2, R3, R4, R5 та R7 однакові і означають водень, R8 є метилом, та R6 є гідроксильною групою.
8. Сполука за п. 1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2, R3, R4 та R7 однакові і означають водень, R5 та R8 однакові і означають метил, та R6 означає гідроксильну групу.
9. Сполука за п. 1, яка відрізняється тим, що R1 та R6 однакові і означають гідроксильну групу, R3, R4 та R7 однакові і означають водень, та R5 і R8 однакові та означають метил.
10. Сполука за п. 1, яка відрізняється тим, що R1 та R6 однакові і означають гідроксильну групу, R3, R7 та R8 однакові і означають водень, R4 є ацетилом, та R5 є метилом.
11. Сполука за п. 1, яка відрізняється тим, що R1 та R6 однакові і означають гідроксильну групу, R3 та R8 однакові і означають водень, R4 є ацетилом, та R5 і R7 однакові та означають метил.
12. Сполука за п. 1, яка відрізняється тим, що R1 та R6 однакові і означають гідроксильну групу, R3 та R7 однакові і означають водень, R4 є ацетилом, та R5 і R8 однакові та означають метил.
13. Сполука за п. 1, яка відрізняється тим, що R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є ацетилом, R5 є метилом, R7 та R8 однакові і означають водень.
14. Сполука за п. 1, яка відрізняється тим, що R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є ацетилом, R5 та R7 однакові і означають метил, та R8 є воднем.
15. Сполука за п. 1, яка відрізняється тим, що R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є ацетилом, R5 та R8 однакові і означають метил, та R7 є воднем.
16. Сполука за п. 1, яка відрізняється тим, що R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4, R7 та R8 однакові і означають водень, та R5 є метилом.
17. Сполука за п. 1, яка відрізняється тим, що R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 та R8 однакові і означають водень, та R5 і R7 однакові та означають метил.
18. Сполука за п. 1, яка відрізняється тим, що R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 та R7 однакові і означають водень, та R5 і R8 однакові та означають метил.
19. Сполука за п. 1, яка відрізняється тим, що R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є воднем, R5 є метилом, та R7 і R8 разом з C-11/C-12 атомами вуглецю означають циклічний карбонат.
20. Спосіб одержання сполук загальної формули (I)
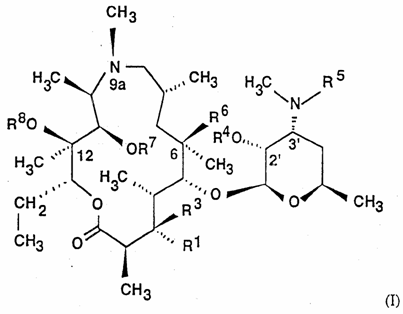 ,
,
де
R1 сам по собі означає гідроксильну, L-кладинозильну групу формули (ІІ)
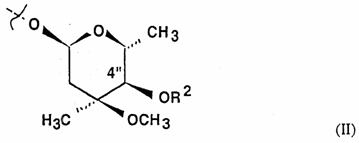
за умови, що коли R1 є гідроксильною групою, R3, R4 і R8 одночасно не є воднем, та R7 не є воднем та метилом, коли R1 є L-кладинозильною групою, R2 і R8 не є воднем,
де
R2 сам по собі означає водень або силільну групу,
R3 сам по собі означає водень або разом з R6 означає ефірну групу,
R4 сам по собі означає водень, (C1-C4)ацильну групу або -COO-(CH2)n-Ar групу, де n дорівнює 1-7, та Ar сам по собі означає незаміщену або заміщену арильну групу, що має аж до 18 атомів вуглецю,
R5 сам по собі означає водень, метильну групу або -COO-(CH2)n-Ar групу, де n дорівнює 1-7, та Ar сам по собі означає незаміщену або заміщену арильну групу, що має аж до 18 атомів вуглецю,
R6 сам по собі означає гідроксильну групу або разом з R3 означає ефірну групу,
R7 сам по собі означає водень, (C1-C12)алкільну групу, силільну групу або разом з R8 та C-11/C-12 атомами вуглецю означає циклічний карбонат,
R8 сам по собі означає водень, (C1-C12)алкільну групу, силільну групу або разом з R7 і C-11/C-12 атомами вуглецю означає циклічний карбонат,
за умови, що коли R1 є L-кладинозильною групою та R4 є воднем, ацетилом та пропіонілом, R2 не є воднем,
та їх фармацевтично прийнятних адитивних солей неорганічних або органічних кислот, який відрізняється тим, що
(І) азитроміцин загальної формули (І), де R1 означає L-кладинозильну групу формули (ІІ), R2, R3, R4, R7 і R8 однакові і означають водень, R5 є метилом, та R6 є гідроксильною групою, піддають реакції з хлоридами органічних карбонових кислот формули (ІІІ)
![]() ,
,
де n дорівнює 1-7 та Ar сам по собі означає незаміщену або заміщену арильну групу, що має аж до 18 атомів вуглецю, більш прийнятно, з бензилоксикарбонілхлоридом, у присутності основ, більш прийнятно гідрокарбонату натрію, в інертному до реакції розчиннику, більш прийнятно, в бензолі чи толуолі, з одержанням сполуки загальної формули (І), де R1 означає L-кладинозильну групу формули (II), R2, R3, R7 та R8 однакові і означають водень, R4 та R5 однакові та означають бензилоксикарбонільну групу, та R6 є гідроксильною групою,
яку потім піддають вибірковому силілуванню гідроксильних груп у
A/ 4”- та 11-положеннях 2-5-еквімолярним надлишком силілувального агента, більш прийнятно сумішшю триметилсилілхлориду та триметилсилілімідазолу, в органічному інертному розчиннику, такому як піридин, етилацетат, N,N-диметилформамід або метиленхлорид, більш прийнятно, в піридині, при температурі 0-5°С протягом 5-8 годин, одержуючи сполуку загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2 і R7 однакові і означають триметилсилільну групу, R3 та R8 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, і R6 є гідроксильною групою, або у
B/ 4”-положенні 1,1-2-еквімолярним надлишком силілувального агента в органічному інертному розчиннику, більш прийнятно, в піридині, при температурі 0-5°С протягом 1 години, одержуючи сполуку загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2 означає триметилсилільну групу, R3, R7 та R8 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, і R6 означає гідроксильну групу,
яку потім піддають О-алкілуванню 1,3-10-мольним надлишком відповідного алкілувального агента, більш прийнятно, метилувального агента, більш прийнятно, метилйодиду, у присутності 1,1-8,5 молів підхожої основи, такої як гідриди лужних металів, більш прийнятно, гідриду натрію, в реакційно-інертному розчиннику, такому як диметилсульфоксид, тетрагідрофуран, N,N-диметилформамід або в їх суміші, при температурі від -15°С до кімнатної температури, більш прийнятно, при 0–5°С, з одержанням у випадку:
A/ сполуки загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2 та R7 однакові і означають триметилсилільну групу, R3 означає водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, R6 є гідроксильною групою, та R8 є метилом, або у випадку
B/ суміші сполуки загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2 означає триметилсилільну групу, R3 та R8 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, R6 означає гідроксильну групу, та R7 є метилом, та сполуки загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2 означає триметилсилільну групу, R3 та R7 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну групу, R6 означає гідроксильну групу, та R8 є метилом,
яку потім піддають зняттю захисту захисних груп у 2’- та 3’-положеннях в розчині нижчих спиртів, більш прийнятно, етанолі, в присутності NaOAc/HOAc буфера (рН 5) і каталізатора в атмосфері водню при тиску 1-20 бар і потім, після виділення, десилілуванню в 4”- і 11-положеннях в нижчих спиртах, більш прийнятно, ізопропанолі, в присутності мурашиної кислоти, одержуючи у випадку
A/ сполуки загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2, R3, R4, R5 та R7 однакові і означають водень, R6 є гідроксильною групою, та R8 є метилом, або у випадку
B/ суміші сполуки загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2, R3, R4, R5 та R8 однакові і означають водень, R6 є гідроксильною групою, та R7 є метилом, і сполуки загальної формули (I), де R1, R2, R3, R4, R5, R7 та R8 мають значення, подані для знаття захисту у випадку А/,
яку потім піддають відновлювальному 3’-N-метилуванню з 1-3 еквівалентами формальдегіду (37%) у присутності еквівалентної або подвійної кількості мурашиної кислоти (98-100%) та каталізатора гідрогенізації або якогось іншого джерела водню, в інертному щодо реакції розчиннику, більш прийнятно, в хлороформі, при підвищеній температурі, більш прийнятно, при температурі флегми, з одержанням у випадку
А/ сполуки загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2, R3, R4 та R7 однакові і означають водень, R5 та R8 однакові і означають метил, та R6 є гідроксильною групою, або у випадку
В/ суміші сполуки загальної формули (I), де R1 означає L-кладинозильну групу формули (II), R2, R3, R4 та R8 однакові і означають водень, R5 та R7 однакові і означають метил, та R6 є гідроксильною групою, та сполуки загальної формули (I), де R1, R2, R3, R4, R5, R7 та R8 мають значення, наведені для 3’-N-метилування у випадку A/, яку потім необов’язково піддають поділу на силікагельній колонці з одержанням хроматографічно однорідної сполуки загальної формули (І), де R1 означає L-кладинозильну групу, R2, R3, R4 та R8 однакові і означають водень, R5 і R7 однакові і означають метил, та R6 є гідроксильною групою (11-O-метил-азитроміцин) або сполуки загальної формули (І), де R1, R2, R3, R4, R5, R6, R7 та R8 мають значення, наведені для 3’-N-метилування у випадку A/ (12-O-метил-азитроміцин), або тим, що
(ІІ) азитроміцин або його 11-О-метил і 12-О-метил-похідні, одержані згідно з способом (І), необов’язково піддають реакції гідролізу з розбавленими неорганічними кислотами, більш прийнятно з 0,25 N соляною кислотою, одержуючи сполуку загальної формули (I), де R1 та R6 однакові і означають гідроксильну групу, R3, R4, R7 та R8 однакові і означають водень, та R5 є метилом, або сполуку загальної формули (I), де R1 та R6 однакові і означають гідроксильну групу, R3, R4 та R8 однакові і означають водень, та R5 і R7 однакові і означають метил, або сполуку загальної формули (I), де R1 та R6 однакові і означають гідроксильну групу, R3, R4 та R7 однакові і означають водень, та R5 і R8 однакові і означають метил,
яку потім необов’язково піддають реакції вибіркового ацилювання гідроксильної групи в 2’-положенні з хлоридами або ангідридами карбонових кислот, що мають аж до 4 атомів вуглецю, більш прийнятно з ангідридом оцтової кислоти, у інертному до реакції органічному розчиннику, більш прийнятно, в метиленхлориді, одержуючи сполуку загальної формули (І), де R1 та R6 однакові і означають гідроксильну групу, R3, R7 та R8 однакові і означають водень, R4 є ацетилом, та R5 є метилом, або сполуку загальної формули (I), де R1 та R6 однакові і означають гідроксильну групу, R3 та R8 однакові і означають водень, R4 є ацетилом, та R5 і R7 однакові і означають метил, або сполуку загальної формули (I), де R1 та R6 однакові і означають гідроксильну групу, R3 та R7 однакові і означають водень, R4 є ацетилом, та R5 і R8 однакові та означають метил,
яку потім необов’язково піддають окисленню реагентом Джонса або відповідно до модифікованого способу Моффата-Пфіцнера, більш прийнятно N,N-диметиламінопропілетилкарбодіімідом, у присутності диметилсульфоксиду або піридиніуму трифторацетату як каталізатора, у інертному органічному розчиннику, більш прийнятно, метиленхлориді, при температурі від 10°С до кімнатної температури, одержуючи сполуку загальної формули (I), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є ацетилом, R5 є метилом, та R7 і R8 однакові та означають водень, або сполуку загальної формули (I), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є ацетилом, R5 та R7 однакові і означають метил, та R8 є воднем, або сполуку загальної формули (I), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є ацетилом, R5 та R8 однакові і означають метил, та R7 є воднем,
яку потім піддають реакції деацилювання в 2’-положенні шляхом сольволізу в нижчих спиртах, більш прийнятно, в метанолі, при кімнатній температурі, одержуючи сполуку загальної формули (I), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4, R7 та R8 однакові і означають водень, та R5 є метилом, або сполуку загальної формули (I), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 та R8 однакові і означають водень, та R5 і R7 однакові та означають метил, або сполуку загальної формули (I), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 та R7 однакові і означають водень, та R5 і R8 однакові і означають метил,
а потім сполуку загальної формули (І), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4, R7 та R8 однакові і означають водень, та R5 є метилом, необов’язково піддають реакції з етиленкарбонатом у присутності неорганічних або органічних основ, більш прийнятно, карбонату калію, в інертному щодо реакції розчиннику, більш прийнятно, етилацетаті, одержуючи сполуку загальної формули (I), де R1 означає гідроксильну групу, R3 разом з R6 означає ефірну групу, R4 є воднем, R5 є метилом, та R7 і R8 разом з C-11 та C-12 атомами вуглецю означають циклічний карбонат.
21. Фармацевтична композиція, корисна у лікуванні бактеріальних інфекцій у людей та тварин, яка містить антибактеріально ефективні кількості сполуки загальної формули (І) або її фармацевтично прийнятних адитивних солей за п. 1 у поєднанні з фармацевтично прийнятним носієм.
22. Спосіб лікування бактеріальних інфекцій у людей та тварин, при якому здійснюють введення людям або тваринам антибактеріально ефективної кількості сполуки загальної формули (І) або її фармацевтично прийнятних солей неорганічних чи органічних кислот за п. 1 у поєднанні з фармацевтично прийнятним носієм.
Текст
1. Сполука загальної формули (I) C2 2 (19) 1 3 71556 4 6. Сполука за п.1, яка відрізняється тим, що R1 означає L-кладинозильну груп у, R2 означає триметилсилільну груп у, R3 та R7 однакові і означають водень, R4 та R5 однакові і означають бензилоксикарбонільну гр упу, R6 є гідроксильною групою, та R8 є метилом. 7. Сполука за п.1, яка відрізняється тим, що R1 означає L-кладинозильну груп у, R 2, R3 , R4 , R5 та R7 однакові і означають водень, R8 є метилом, та R6 є гідроксильною групою. 8. Сполука за п.1, яка відрізняється тим, що R1 означає L-кладинозильну групу, R2, R3, R 4 та R7 , однакові і означають водень, R5 та R8 однакові і де означають метил, та R6 означає гідроксильну груR1 сам по собі означає гідроксильну, Lпу. 1 кладинозильну груп у формули (ІІ) 9. Сполука за п.1, яка відрізняється тим, що R та 6 3 4 R однакові і означають гідроксильну груп у, R , R та R7 однакові і означають водень, та R 5 і R8 однакові та означають метил. 10. Сполука за п.1, яка відрізняється тим, що R1 та R6 однакові і означають гідроксильну групу, R3, R7 та R8 однакові і означають водень, R4 є ацетилза умови, що коли R1 є гідроксильною групою, R3, ом, та R5 є метилом. R4 і R8 одночасно не є воднем, та R7 не є воднем 11. Сполука за п.1, яка відрізняється тим, що R1 та метилом, коли R1 є L-кладинозильною групою, та R6 однакові і означають гідроксильну груп у, R3 R2 і R8 не є воднем, та R8 однакові і означають водень, R4 є ацетилом, де та R5 і R7 однакові та означають метил. R2 сам по собі означає водень або силільну гр упу, 1 12. Сполука за п.1, яка відрізняється тим, що R R3 сам по собі означає водень або разом з R6 озта R6 однакові і означають гідроксильну груп у, R3 начає ефірну гр упу, та R7 однакові і означають водень, R4 є ацетилом, R4 сам по собі означає водень, (C1-C4)ацильну 5 8 та R і R однакові та означають метил. груп у або -COO-(CH2)n-Ar гр упу, де n дорівнює 1-7, 13. Сполука за п.1, яка відрізняється тим, що R1 та Ar сам по собі означає незаміщену або заміще3 6 означає гідроксильну груп у, R разом з R означає ну арильну груп у, що має аж до 18 атомів вуглецю, 4 5 7 ефірну груп у, R є ацетилом, R є метилом, R та R5 сам по собі означає водень, метильну груп у або 8 R однакові і означають водень. -COO-(CH2)n-Ar гр упу, де n дорівнює 1-7, та Ar сам 14. Сполука за п.1, яка відрізняється тим, що R1 по собі означає незаміщену або заміщену арильну 3 6 означає гідроксильну груп у, R разом з R означає груп у, що має аж до 18 атомів вуглецю, 4 5 7 ефірну груп у, R є ацетилом, R та R однакові і R6 сам по собі означає гідроксильну гр упу або ра8 означають метил, та R є воднем. зом з R3 означає ефірну гр упу, 15. Сполука за п.1, яка відрізняється тим, що R1 R7 сам по собі означає водень, (C1-C12)алкільну означає гідроксильну груп у, R3 разом з R6 означає груп у, силільну групу або разом з R8 та C-11/C-12 ефірну груп у, R4 є ацетилом, R5 та R8 однакові і атомами вуглецю означає циклічний карбонат, означають метил, та R7 є воднем. R8 сам по собі означає водень, (C1-C12)алкільну 1 16. Сполука за п.1, яка відрізняється тим, що R груп у, силільну групу або разом з R7 і C-11/C-12 означає гідроксильну груп у, R3 разом з R6 означає атомами вуглецю означає циклічний карбонат, ефірну гр упу, R4 , R7 та R8 однакові і означають за умови, що коли R1 є L-кладинозильною групою 5 водень, та R є метилом. та R4 є воднем, ацетилом та пропіонілом, R2 не є 17. Сполука за п.1, яка відрізняється тим, що R1 воднем, означає гідроксильну груп у, R3 разом з R6 означає та їх фармацевтично прийнятних адитивних солей 4 8 ефірну гр упу, R та R однакові і означають вонеорганічних або органічних кислот, який відріз5 7 день, та R і R однакові та означають метил. няється тим, що 1 18. Сполука за п.1, яка відрізняється тим, що R (І) азитроміцин загальної формули (І), де R1 озна3 6 означає гідроксильну груп у, R разом з R означає чає L-кладинозильну груп у формули (ІІ), R2, R3, R4, ефірну гр упу, R4 та R7 однакові і означають воR7 і R8 однакові і означають водень, R5 є метилом, день, та R5 і R8 однакові та означають метил. та R6 є гідроксильною групою, піддають реакції з 19. Сполука за п.1, яка відрізняється тим, що R1 хлоридами органічних карбонових кислот форозначає гідроксильну груп у, R3 разом з R6 означає мули (ІІІ) ефірну груп у, R4 є воднем, R5 є метилом, та R7 і R8 , разом з C-11/C-12 атомами вуглецю означають де n дорівнює 1-7 та Ar сам по собі означає незациклічний карбонат. міщену або заміщену арильну групу, що має аж до 20. Спосіб одержання сполук загальної форму18 атомів вуглецю, більш прийнятно, з бензилокли (I) сикарбонілхлоридом, у присутності основ, більш прийнятно гідрокарбонату натрію, в інертному до реакції розчиннику, більш прийнятно, в бензолі чи толуолі, з одержанням сполуки загальної формули 5 71556 6 (І), де R1 означає L-кладинозильну груп у формули присутності мурашиної кислоти, одержуючи у ви(II), R 2 , R3, R7 та R8 однакові і означають водень, падку R4 та R5 однакові та означають бензилоксикарбоA/ сполуки загальної формули (I), де R1 означає L6 нільну гр упу, та R є гідроксильною групою, кладинозильну групу формули (II), R2, R3, R4 , R5 та яку потім піддають вибірковому силілуванню R7 однакові і означають водень, R6 є гідроксильгідроксильних груп у ною групою, та R8 є метилом, або у випадку A/ 4”- та 11-положеннях 2-5-еквімолярним надлиB/ суміші сполуки загальної формули (I), де R1 шком силілувального агента, більш прийнятно означає L-кладинозильну групу формули (II), R2, сумішшю триметилсилілхлориду та триметилсиліR3, R4, R5 та R8 однакові і означають водень, R6 є лімідазолу, в органічному інертному розчиннику, гідроксильною групою, та R7 є метилом, і сполуки такому як піридин, етилацетат, N,Nзагальної формули (I), де R1, R2, R3, R4, R5, R7 та диметилформамід або метиленхлорид, більш R8 мають значення, подані для знаття захисту у прийнятно, в піридині, при температурі 0-5°С провипадку А/, тягом 5-8 годин, одержуючи сполуку загальної фояку потім піддають відновлювальному 3’-Nрмули (I), де R1 означає L-кладинозильну групу метилуванню з 1-3 еквівалентами формальдегіду формули (II), R2 і R7 однакові і означають триме(37%) у присутності еквівалентної або подвійної тилсилільну груп у, R3 та R8 однакові і означають кількості мурашиної кислоти (98-100%) та каталіводень, R4 та R5 однакові і означають бензилоксизатора гідрогенізації або якогось іншого джерела карбонільну груп у, і R6 є гідроксильною групою, водню, в інертному щодо реакції розчиннику, або у більш прийнятно, в хлороформі, при підвищеній B/ 4”-положенні 1,1-2-еквімолярним надлишком температурі, більш прийнятно, при температурі силілувального агента в органічному інертному флегми, з одержанням у випадку розчиннику, більш прийнятно, в піридині, при темА/ сполуки загальної формули (I), де R1 означає Lпературі 0-5°С протягом 1 години, одержуючи спокладинозильну груп у формули (II), R 2, R3, R4 та R7 луку загальної формули (I), де R1 означає Lоднакові і означають водень, R5 та R8 однакові і 2 кладинозильну груп у формули (II), R означає триозначають метил, та R6 є гідроксильною групою, 3 7 8 метилсилільну груп у, R , R та R однакові і ознаабо у випадку чають водень, R4 та R5 однакові і означають бенВ/ суміші сполуки загальної формули (I), де R1 6 зилоксикарбонільну групу, і R означає означає L-кладинозильну групу формули (II), R2, гідроксильну гр упу, R3, R4 та R8 однакові і означають водень, R5 та R7 яку потім піддають О-алкілуванню 1,3-10-мольним однакові і означають метил, та R6 є гідроксильною надлишком відповідного алкілувального агента, групою, та сполуки загальної формули (I), де R 1, більш прийнятно, метилувального агента, більш R2, R3, R4, R5, R7 та R8 мають значення, наведені прийнятно, метилйодиду, у присутності 1,1-8,5 для 3’-N-метилування у випадку A/, яку потім немолів підхожої основи, такої як гідриди лужних обов’язково піддають поділу на силікагельній кометалів, більш прийнятно, гідриду натрію, в релонці з одержанням хроматографічно однорідної акційно-інертному розчиннику, такому як диметилсполуки загальної формули (І), де R1 означає Lсульфоксид, тетрагідрофуран, N,Nкладинозильну груп у, R2 , R3, R4 та R8 однакові і диметилформамід або в їх суміші, при температурі означають водень, R5 і R7 однакові і означають від -15°С до кімнатної температури, більш прийметил, та R6 є гідроксильною групою (11-O-метилнятно, при 0–5°С, з одержанням у випадку: азитроміцин) або сполуки загальної формули (І), A/ сполуки загальної формули (I), де R1 означає Lде R1, R2, R3 , R4, R 5, R6, R7 та R8 мають значення, 2 7 кладинозильну груп у формули (II), R та R однанаведені для 3’-N-метилування у випадку A/ (12-Oкові і означають триметилсилільну групу, R3 ознаметил-азитроміцин), або тим, що чає водень, R4 та R5 однакові і означають бензи(ІІ) азитроміцин або його 11-О-метил і 12-О-метиллоксикарбонільну групу, R6 є гідроксильною похідні, одержані згідно з способом (І), необгрупою, та R 8 є метилом, або у випадку ов’язково піддають реакції гідролізу з розбавлениB/ суміші сполуки загальної формули (I), де R1 ми неорганічними кислотами, більш прийнятно з означає L-кладинозильну групу формули (II), R2 0,25 N соляною кислотою, одержуючи сполуку заозначає триметилсилільну групу, R3 та R8 однакові гальної формули (I), де R1 та R6 однакові і означа4 5 і означають водень, R та R однакові і означають ють гідроксильну груп у, R 3, R4 , R7 та R8 однакові і 6 бензилоксикарбонільну гр упу, R означає гідроозначають водень, та R5 є метилом, або сполуку 7 ксильну групу, та R є метилом, та сполуки загальзагальної формули (I), де R1 та R6 однакові і ознаної формули (I), де R1 означає L-кладинозильну чають гідроксильну гр уп у, R3 , R4 та R8 однакові і 2 груп у формули (II), R означає триметилсилільну означають водень, та R5 і R7 однакові і означають 3 7 4 груп у, R та R однакові і означають водень, R та метил, або сполуку загальної формули (I), де R1 та 5 R однакові і означають бензилоксикарбонільну R6 однакові і означають гідроксильну груп у, R 3, R4 6 8 груп у, R означає гідроксильну груп у, та R є мета R7 однакові і означають водень, та R 5 і R8 однатилом, кові і означають метил, яку потім піддають зняттю захисту захисних гр уп у яку потім необов’язково піддають реакції вибірко2’- та 3’-положеннях в розчині нижчих спиртів, вого ацилювання гідроксильної групи в 2’більш прийнятно, етанолі, в присутності положенні з хлоридами або ангідридами карбоноNaOAc/HOAc буфера (рН 5) і каталізатора в атмових кислот, що мають аж до 4 атомів вуглецю, сфері водню при тиску 1-20 бар і потім, після видібільш прийнятно з ангідридом оцтової кислоти, у лення, десилілуванню в 4”- і 11-положеннях в нижінертному до реакції органічному розчиннику, чих спиртах, більш прийнятно, ізопропанолі, в більш прийнятно, в метиленхлориді, одержуючи 7 71556 8 сполуку загальної формули (І), де R1 та R6 однакоозначає ефірну груп у, R4 , R7 та R8 однакові і ознаві і означають гідроксильну гр упу, R3 , R7 та R8 одчають водень, та R5 є метилом, або сполуку заганакові і означають водень, R4 є ацетилом, та R5 є льної формули (I), де R1 означає гідроксильну гру1 метилом, або сполуку загальної формули (I), де R пу, R3 разом з R6 означає ефірну гр упу, R4 та R8 6 3 та R однакові і означають гідроксильну груп у, R однакові і означають водень, та R5 і R7 однакові та 8 4 та R однакові і означають водень, R є ацетилом, означають метил, або сполуку загальної формули та R5 і R7 однакові і означають метил, або сполуку (I), де R1 означає гідроксильну групу, R3 разом з R6 загальної формули (I), де R1 та R6 однакові і ознаозначає ефірну груп у, R4 та R7 однакові і означа3 7 чають гідроксильну групу, R та R однакові і ознають водень, та R5 і R8 однакові і означають метил, чають водень, R4 є ацетилом, та R5 і R8 однакові а потім сполуку загальної формули (І), де R1 озната означають метил, чає гідроксильну груп у, R3 разом з R6 означає ефіяку потім необов’язково піддають окисленню реарну груп у, R4 , R7 та R8 однакові і означають вогентом Джонса або відповідно до модифікованого день, та R5 є метилом, необов’язково піддають способу Мо ффата-Пфіцнера, більш прийнятно реакції з етиленкарбонатом у присутності неоргаN,N-диметиламінопропілетилкарбодіімідом, у принічних або органічних основ, більш прийнятно, сутності диметилсульфоксиду або піридиніуму карбонату калію, в інертному щодо реакції розчинтрифторацетату як каталізатора, у інертному орнику, більш прийнятно, етилацетаті, одержуючи ганічному розчиннику, більш прийнятно, метиленсполуку загальної формули (I), де R1 означає гідхлориді, при температурі від 10°С до кімнатної роксильну груп у, R3 разом з R6 означає ефірну температури, одержуючи сполуку загальної форгруп у, R4 є воднем, R5 є метилом, та R7 і R8 разом 1 3 мули (I), де R означає гідроксильну груп у, R раз C-11 та C-12 атомами вуглецю означають циклізом з R6 означає ефірну групу, R4 є ацетилом, R5 є чний карбонат. метилом, та R7 і R8 однакові та означають водень, 21. Фармацевтична композиція, корисна у лікуванабо сполуку загальної формули (I), де R1 означає ні бактеріальних інфекцій у людей та тварин, яка гідроксильну груп у, R3 разом з R6 означає ефірну містить антибактеріально ефективні кількості спогруп у, R4 є ацетилом, R5 та R7 однакові і означалуки загальної формули (І) або її фармацевтично ють метил, та R8 є воднем, або сполуку загальної прийнятних адитивних солей за п.1 у поєднанні з формули (I), де R1 означає гідроксильну групу, R3 фармацевтично прийнятним носієм. 6 4 разом з R означає ефірну гр упу, R є ацетилом, 22. Спосіб лікування бактеріальних інфекцій у люR5 та R8 однакові і означають метил, та R7 є воддей та тварин, при якому здійснюють введення нем, людям або тваринам антибактеріально ефективяку потім піддають реакції деацилювання в 2’ної кількості сполуки загальної формули (І) або її положенні шляхом сольволізу в нижчих спиртах, фармацевтично прийнятних солей неорганічних чи більш прийнятно, в метанолі, при кімнатній темпеорганічних кислот за п.1 у поєднанні з фармацевратурі, одержуючи сполуку загальної формули (I), тично прийнятним носієм. де R1 означає гідроксильну груп у, R3 разом з R6 Цей винахід стосується нових сполук з класу макролідних антибіотиків. Зокрема, даний винахід стосується нових 3,6-гемікеталів з класу 9аазалідів, їх фармацевтично прийнятних адитивних солей з неорганічними або органічними кислотами, способу їх одержання та їх використання в якості антибіотиків чи проміжних сполук для синтезу інших макролідних антибіотиків. Макролідний антибіотик еритроміцин А вже понад 40 років вважається безпечним і ефективним агентом для лікування респіраторних і генітальних інфекцій, викликаних грам-позитивними і деякими грам-негативними бактеріями, деякими видами Legionella, Mycoplasma, Chlamidia та Helicobacler. Помітні зміни у біодоступності після перорального введення, шлункова і непереносимість у багатьох пацієнтів та втрата активності в кислотному середовищі, в якому утворюється неактивний метаболіт ангідроеритроміцин, є основними недоліками клінічного ; застосування еритроміцину. Однак, спіроанелювання агліконового кільця успішно інгібується хімічним перетворенням С-9 кетону або гідроксильних груп у С-6 та/або С12 положеннях. Таким чином, наприклад, шляхом оксимування С-9 кетону та подальшого перегрупу вання Бекмана і відновлення одержують 9-деоксо9а-аза-9а-гомоеритроміцин А - перший 15-членний макролідний антибіотик з 9а-аміно групою, введеною у агліконове кільце (Kobrehel G. et al., US 4,328,334; 5/1982). Відновлювальне метилування 9-амінів згідно з процесом Ешвейлера-Кларка веде до синтезу 9-деоксо-9а-метил-9а-аза-9агомоерит-роміцину (AZITHROMYCIN - азитроміцин) - прототипу нового класу макролідних антибіотиків, а саме, азалідів (Kobrehel G. et al., BE 892357; 7/1982). Окрім широкого спектру протимікробної дії, що включає також грам-негативні бактерії, азитроміцин також відрізняється довгим періодом біологічного напівперетворення, спеціальним механізмом транспортування до місця застосування та коротким строком терапії. Азитроміцин легко проникає і накопичується всередині фагоцитних клітин людини, що веде до покращеної дії на внутрішньоклітинні патогенні мікроорганізми, які належать до класів Legionella, Chlamidia та Helicobacler. Крім того, відомо, що С-6/С-12 спіроанелювання еритроміцину А успішно інгібується Ометилуванням С-6 гідроксильної групи агліконового кільця (Watanabe Y. et al., US 4,331,803; 5/1982). 9 71556 10 Реакція еритроміцину з бензилоксикарбонілхлоритя захисту в 2'-положенні. Наскільки нам відомо, дом і подальше метилування одержаної 2'-О,3'-NС-11/С-12 заміщені кетоліди з класу 9а-азалідних біс(бензилоксикарбоніл) похідної, вилучення захиантибіотиків досі не описувались. Перший етап, а сних груп і 3'-N-метилування дає, окрім 6-Осаме: синтез 3-декладинозил похідних 9-деоксометилеритроміцину (CLARITHROMYCIN - кларит9а-аза-9а-гомоеритромі-цину та азитроміцину, ро-міцин), також значну кількість 11-Oописано в US 4,886,792, 12/1989. Маючи на меті метилеритроміцину та полізаміщених аналогів окислити С-3 гідроксильну групу 3-декладинозил(Morimoto S., et al., J. Antibiotics, 1984, 37, 187). азитроміцину та його 11-О-метил- і 12-O-метилПорівняно з еритроміцином А кларитроміцин є похідних шляхом трансциклічного приєднання 6значно більш стабільним в кислотному середовищі гідроксильної групи до новоутвореного С-3 кетону, та демонструє кращу і л vitro дію на штами грамвдалося одержати досі не описаний ряд біциклічпозитивних бактерій (Kirst Η.A. et al., Antimicrobial них та трициклічних 3,6-гемікеталів з класу 9аAgents and Chemoter., 1989, 1419). В аналогічний азалідів. спосіб було синтезовано ряд O-метил-похідних Синтез 3,6-гемікеталів азитроміцину та їх Оазитроміцину (Kobrehel G. et al., US 5,250,518; метил похідних включає приготування відповідних 10/1993). Хоча основні продукти О-метилування 3-декладинозил похідних, захист 2'-гідроксильної азитроміцину, а саме: 11-O-метил-азитроміцин групи основного цукру, D-дезозаміну, шля хом ви(Приклад 8) та 6-O-метил-азитроміцин (Приклад 6) бірного ацилування, окислення гідроксильної групи демонструють сильну активність проти стандартв С-3 положенні, зняття захисту у 2'-положенні та них штамів бактерій і клінічних ізолятів та фармациклізацію С-11 та С-12 гідроксильних кокінетичні властивості, подібні до азитроміцину, груп.Об'єктами даного винаходу є також фармацеодержання цих продуктів у великих кількостях яввтично прийнятні адитивні солі 3,6-гемікеталів азиляє собою додаткову те хнічну проблему через троміцину та їх О-метил похідних з органічними і невибірність О-метилування. Визначення структунеорганічними кислотами, способи та проміжні ри О-метил-похідних азитроміцину ґрунтувалось сполуки для їх приготування, а також способи прина аналізі 1H-1Н та 1H-13С 2D ЯМР спектрів готування та застосування фармацевтичних пре(300МГц). Після цього, із застосуванням довгої паратів. ЯМР-спектроскопії було додатково виявлено, що Даний винахід стосується: заміщення в С-6 гідроксильній групі було помилкоі) нових 3,6-гемікеталів з класу 9а-азалідів; во приписане азитроміцину, а насправді це був 12іі) способу одержання нових 3,6-гемікеталів з О-метил-азитроміцин. Далі було виявлено, що класу 9а-азалідів; використання підхожих захисних гр уп для гідроііі) використання нових 3,6-гемікеталів з класу ксильних груп в 4"- та 11-положеннях (особливо 9а-азалідів в якості антибіотиків або проміжних силільних захисних груп, таких як трисполук для синтезу інших макролідних антибіотиметилсилільні групи) веде до вибірного Оків. метилування і робить можливим просте приготуНові 3,6-гемікеталі з класу 9а-азалідів загальвання 12-O-метил-азитроміцину (HR 970051A; ної формули (І) 10/97). Згодом Later, Waddell S.T. et al., (Biorg. Med Chem Letters 8 (1998), 549-555), незалежно від останньої патентної заявки, відкрили Ометилування гідроксильної групи в С-12 положенні. Також відомо, що недавні дослідження 14членних макролідів привели до відкриття нового типу макролідних антибіотиків, а саме: кетолідів. Замість нейтральної цукрової L-кладинози, нестабільність якої у навіть слабкокислотному середовищі добре відома, ці сполуки мають кетогрупу в С-3 положенні (Agouridas С. et al., ЕР 596802 ΑΙ, які відрізняються тим, що 5/1994; Le Martret O, FR 2697524 Al, 5/1994). КетоR1 сам по собі означає гідроксильну, Lліди демонструють значно кращу дію проти MLS кладинозильну груп у формули (II) (макролід, лінкосамід та стрептограмін В) індукованих-резистентних організмів (Jamjian C, Antimicrob. Agents Chemother., 1997, 41, 485). Це важливе відкриття привело до великої кількість 3-кето похідних кларитроміцину, в основному заміщених у С-11/С12 положеннях, що дало численні циклічні де карбонати, карбамати і, нещодавно, карбазати. R2 сам по собі означає водень або силільну Перший етап синтезу кетолідів включає гідроліз груп у, кларитроміцину з утворенням відповідної 3R3 сам по собі означає водень або разом з R 6 декладинозил похідної, (3-де(2,6-дидеокси-3-Созначає ефірну гр упу, метил-3-О-метил-a-L-рибогексо-піранозил-окси)R4 сам по собі означає водень, (С1-С4)ацильну похідної), яка, після вилучення захисної 2'груп у або -СOO-(СН2)n-Аr гр упу, де n дорівнює 1-7, гідроксильної групи (більш прийнятно, шляхом та Аr сам по собі означає незаміщену або заміщеацилування з хлоридами чи ангідридами карбонону арильну груп у, що має аж до 18 атомів вуглецю, вих кислот), піддається реакції окислення та знят 11 71556 12 R5 сам по собі означає водень, метильну групу агенти для введення триметилсилільної групи, або -COO-(СН2)n-Аr гр упу, де n дорівнює 1-7, та Аr більш прийнятно, суміш триметилсилілхлориду та сам по собі означає незаміщену або заміщену триметилсилілімідазолу. В якості прийнятного розарильну груп у, що має аж до 18 атомів вуглецю, чинника використовуються піридин, етилацетат, R6 сам по собі означає гідроксильну гр упу або N,N-диметилформамід, метиленхлорид і т.і., більш разом з R3 має значення ефірної групи, прийнятно, піридин. R7 сам по собі означає водень, (С1Етап 2: С12)алкільну груп у, силільну груп у або разом з R 8 Реакція 4",11-О-біс(триметилсиліл)-2'-О,3'-Nта С-11/С-12 атомами вуглецю означає циклічний біс(бензилоксикарбоніл)-3'-N-деметилкарбонат, азитроміцину з Етапу 1 А/ або 4"-О-триметилсилілR8 сам по собі означає водень, (С12'-О,3'-N-біс (бензилоксикарбоніл)-3'-N-деметилС12)алкільну груп у, силільну груп у або разом з R 7 і азитроміцину з Етапу 1В, відповідно, з 1,3-10 моС-11/С-12 атомами вуглецю означає циклічний лями відповідного алкілувального агенту, більш карбонат, прийнятно, метилу-вального агенту, у присутності та їх фармацевтично прийнятні адитивні солі 1,1-8,5 молів підхожої основи при температурі від неорганічних або органічних кислот одержують у 15°С до кімнатної температури, більш прийнятно, такі етапи: при -5°С, у підхожому інертному до реакції розчинЕтап 1: нику веде до: Азитроміцин загальної формули (І), де R1 А/ вибірного алкілування, більш прийнятно, означає L-кладинозильну групу формули (II), R2, метилування С-12 гідроксильної групи з одержанR3, R4, R7 і R8 однакові і означають водень, R5 є ням нового 4"-11-О-біс(триметилсиліл)-2'-О,3'-Nметилом, та R6 є гідроксильною групою, піддаєтьбіс(бензилоксикарбоніл)-3'-N-деметил-12-O-метился реакції з хлоридами органічних карбонових кисазитроміцину загальної формули (І), де R1 означає лот формули (III) L-кладинозильну груп у формули (II), R 2 та R7 одСlСОО(СН2)n-Аr (III) накові і означають триметилсилільну групу, R3 де n дорівнює 1-7 та Аr сам по собі означає означає водень, R4 та R5 однакові і означають бенезаміщену або заміщену арильну гр упу, що має нзилоксикарбонільну груп у, R6 є гідроксильною аж до 18 атомів вуглецю, більш прийнятно, з бенгрупою, та R 8 є метилом, або зилоксикарбонілхлоридом, у присутності основ, В/ алкілування, більш прийнятно, метилування більш прийнятно, водень-карбонату натрію, в інерС-11 або С-12 гідроксильної групи з одержанням тному до реакції розчиннику, більш прийнятно, в суміші нового 4"-O-триметилсиліл-2'-O,3'-N-біс бензолі чи толуолі, з одержанням 2'-O,3'-N-біс (бе(бензилоксикарбоніл)-3'-N-деметил-11-O-метилнзилоксикарбоніл)-3'-N-деметил-азитроміцину азитроміцину загальної формули (І), де R1 означає (Kobrehel G. et al., US 5,250,518; 5/1993) загальної L-кладинозильну груп у формули (II), R 2 означає 1 формули (І), де R означає L-кладинозильну гр упу триметилсилільну груп у, R3 та R8 однакові і озна2 3 7 8 формули (II), R , R , R та R однакові і означають чають водень, R4 та R5 однакові і означають бенводень, R4 та R5 однакові та означають бензилокзилоксикарбонільну групу, R6 означає гідроксильну 6 сикарбонільну групу, та R є гідроксильною гругруп у, та R7 є метилом, або 4"-О-триметилсиліл-2'пою, який потім піддається силілуванню гідроксиO, 3'-N-біс(бензилоксикарбоніл)-3'-N-деметил-12льних груп у O-метил-азитроміцину загальної формули (І), де А/ 4"- та 11-положеннях 2-5 еквімолярним R1 означає L-кладинозильну групу формули (II), R2 надлишком силілувального агенту в органічному означає триметилсилільну групу, R3 та R7 однакові інертному розчиннику при температурі 0-5°С проі означають водень, R4 та R5 однакові і означають тягом 5-8 годин, одержуючи новий 4"-11-Обензилоксикарбонільну гр упу, R6 означає гідробіс(триметилсиліл)-2'-О,3'-Nксильну груп у, та R8 є метилом. біс(бензилоксикарбоніл)-3'-N-деметил-азитроміцин В якості підхожих алкілувальних агентів викозагальної формули (І), де R1 означає Lристовуються (С1-С12)алкілгалогеніди, більш прикладинозильну груп у формули (II), R2 і R7 однакові йнятно, метилйодид, диметилсульфат, метилмеі означають триметилсилільну групу, R3 та R8 одтансульфонат або метил п-толуолсуль фонат, накові і означають водень, R4 та R5 однакові і більш прийнятно метилйодид. Підхожими основаозначають бензилоксикарбонільну груп у, і R6 є ми є гідриди лужних металів (гідрид літію, гідрид гідроксильною групою, або у натрію або гідрид калію), гідроксиди лужних метаВ/ 4"-положенні 1,1-2 еквімолярним надлишлів (гідроксид калію або гідроксид натрію) або меком силілувального агенту в органічному інертнотиламіди лужних металів (літійамід, натрійамід або му розчиннику при температурі 0-5°С протягом 1 калійамід), більш прийнятною - гідрид натрію. Підгодини, одержуючи новий 4"-О-триме-тилсиліл-2'хожими інертними до реакції розчинниками є диО,3'-N-біс(бензилоксикарбоніл)-3'-N-деметилметилсульфоксид, Ν,Ν-диметилформамід, Ν,Νазитроміцин загальної формули (І), де R1 означає диметилацетамід або гексаметил фосфорний триL-кладинозильну груп у формули (II), R 2 означає амід, більш прийнятними - Ν,Ν-диметилформамід, триметилсилільну груп у, R3, R7 та R8 однакові і диметилсульфоксид або їх суміш з тетраозначають водень, R4 та R5 однакові і означають гідрофураном. бензилоксикарбонільну гр упу, і R6 означає гідроЕтап 3: ксильну груп у. 4"-11-O-Біс(триметилсиліл)-2'-O,3'-NВ якості силілувальних агентів використовубіс(бензилоксикар-боніл)-3'-N-деметил-12-Oються 1,1,1,3,3,3-гексаметилдисилазан, триметилметил-азитроміцин з Етапу 2А/ або одержану сусилілхлорид, біс-(триметилсиліл)ацетамід і подібні міш 4"-О-триметилсиліл-2'-O,3'-N 13 71556 14 біс(бензилоксикарбоніл)-3'-N-деметил-11-О-метиллотами, більш прийнятно з 0,25-1,5N соляної або азитроміцину та 4"-O-триметилсиліл-2'-O,3'-Nдихлороцтової кислоти в суміші води і спирту, біс(бензилоксикарбоніл)-3'-N-деметил-12-O-метилбільш прийнятно, метанолу, етанолу або ізопроазитроміцину з Етапу 2В/ піддають реакції гідрогепанолу, протягом 10-30 годин при кімнатній темпенолізу за методом Е.Н. Flynn et al. (Journal of ратурі з одержанням 3-де(2,6-дидеокси-3-С-метилAmerican Chemical Society, 77, 3104, 1950), щоб 3-О-метил-a-L-рибогексопіранозил-окси)-3-оксизняти захист захисних груп у 2'- та 3'-положеннях, азитроміцину загальної формули (І), де R1 та R6 а потім десилілуванню у звичайний спосіб у нижоднакові і означають гідроксильну групу, R3, R4, R7 чих спиртах, більш прийнятно, ізопропанолі, в прита R8 однакові і означають водень, та R5 є метилсутності мурашиної кислоти в ом, або 3-де(2,6-дидеокси-3-С-метил-3-О-метил-aA/ 4"- та 11-положеннях на Етапі 2А/ з одерL-рибогексопіранозил-окси)-3-окси-11-О-метилжанням 3'-N-демєтил-12-O-метил-азитроміцину азитроміцину загальної формули (І), де R1 та R6 загальної формули (І), де R1 означає Lоднакові і означають гідроксильну групу, R3, R4 та 2 3 4 5 кладинозильну групу формули (II), R , R , R , R та R8 однакові і означають водень, та R 5 і R7 однакові R7 однакові і означають водень, R6 є гідроксильі означають метил, або 3-де(2,6-дидеокси-3-Сною групою, та R8 є метилом, або в метил-3-О-метил-a-L-рибогексопіранозил-окси)-3В/ 4"-положенні на Етапі 2В/ з одержанням суокси-12-О-метил-азитроміцину загальної формули міші 3'-N-деметил-11-O-метил-азитроміцину зага(І), де R1 та R6 однакові і означають гідроксильну льної формули (І), де R1 означає L-кладинозильну груп у, R3, R4 та R7 однакові і означають водень, та груп у формули (II), R2, R3 , R4, R5 та R8 однакові і R5 і R8 однакові і означають метил. означають водень, R6 є гідроксильною групою, та Етап 6: R7 є метилом, і 3'-N-деметил-12-O-метил3-Де(2,6-дидеокси-3-C-метил-3-О-метил-a-L1 азитроміцину загальної формули (І), де R означає рибогексопіранозил-окси)-3-окси-азитроміцин та L-кладинозильну груп у формули (II), R 2, R3 , R4 , R5 його 11-О-метил- та 12-O-метил похідні з Етапу 5 7 6 та R однакові і означають водень, R є гідроксипіддаються вибірному ацилуванню гідроксильної льною групою, та R8 є метилом. групи в 2'-положенні. Ацилування проводиться з Гідрогеноліз проводять у розчині з нижчих хлоридами або ангідридами карбонових кислот, спиртів, більш прийнятно, в етанолі, у присутності що мають аж до 4 атомів вуглецю, більш прийнятбуферу NaOAc/HOAc (pH5) з каталізатором, таким но з ангідридом оцтової кислоти, у присутності як паладієва чернь або паладій на вугіллі, під тиснеорганічних чи органічних основ, у інертному до ком водню від 1 до 20бар, при кімнатній темреакції органічному розчиннику, при температурі пературі. від 0-30°С, з одержанням 3-де(2,6-дидеокси-3-СЕтап 4: метил-3-О-метил-a-L-рибогексопіранозил-окси)-33'-N-Деметил-12-О-метил-азитроміцин з Етапу окси-азитроміцин 2'-О-ацетату загальної формули 3А/ або одержану суміш 3'-N-деметил-11-O-метил(І), де R1 та R6 однакові і означають гідроксильну азитроміцину та 3'-N-деметил-12-О-метилгруп у, R3, R7 та R8 однакові і означають водень, R4 азитроміцину з Етапу 3В/ піддають відновлювальє ацетилом, та R5 є метилом, або 3-де(2,6ному 3'-N-метилуванню з 1-3 еквівалентами фордидеокси-3-С-метил-3-О-метил-a-Lмальдегіду (37%) у присутності еквівалентної або рибогексопіранозил-окси)-3-окси-11-O-метилподвійної кількості мурашиної кислоти (98-100%) азитроміцин 2'-О-ацетату загальної формули (І), та каталізатора гідрогенізації або якогось іншого де R1 та R6 однакові і означають гідроксильну груджерела водню, в інертному щодо реакції розчинпу, R3 та R8 однакові і означають водень, R4 є аценику, такому як галогеновані вуглеводні, нижчі тилом, та R5 і R7 однакові і означають метил, або спирти чи нижчі кетони, більш прийнятно, в хло3-де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lроформі, при температурі фле гми реакційної сурибогексопіранозил-окси)-3-окси-12-O-метилміші з одержанням - у випадку сполуки з Етапу 3А/ азитроміцин 2'-O-ацетату загальної формули (І), - 12-О-метил-азитроміцину загальної формули (І), де R1 та R6 однакові і означають гідроксильну гру1 де R означає L-кладинозильну груп у формули (II), пу, R3 та R7 однакові і означають водень, R4 є ацеR2, R3, R4 та R7 однакові і означають водень, R5 та тилом, та R5 і R8 однакові та означають метил. R8 однакові і означають метил, та R6 є гідроксильВ якості підхожих основ використовуються воною групою, або - у випадку продуктів Етапу 3В/ день-карбонат натрію, карбонат натрію, карбонат суміші 11-O-метил-азитроміцину загальної формукалію, триетиламін, піридин, трибутиламін, більш ли (І), де R1 означає L-кладинозильну груп у форприйнятно, водень-карбонат натрію. Підхожими 2 3 4 8 мули (II), R , R , R та R однакові і означають воінертними розчинниками є метиленхлорид, дихло5 7 6 день, R та R однакові і означають метил, та R є ретан, ацетон, піридин, етилацетат, тетрагідрофугідроксильною групою, та 12-O-метилран, більш прийнятним - метиленхлорид. 1 2 3 азитроміцину загальної формули (І), де R , R , R , Етап 7: 4 5 6 7 8 R , R , R , R та R мають значення, наведені у 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lвипадку 3'-N-метилування сполук з Етапу 3А/. рибогексопіранозил-окси)-3-окси-азитроміцин 2'-ОЕтап 5: ацетат та його 11-O-метил- і 12-O-метил похідні з Азитроміцин загальної формули (І), де R1 Етапу 6 піддають окисленню гідроксильної групи у 2 означає L-кладинозильну групу формули (II), R , С-3 положенні реагентом Джонса або діімідами 3 4 7 8 5 R , R , R та R однакові і означають водень, R є 6 відповідно до модифікованого способу Мо ффа таметилом та R є гідроксильною групою, або його Пфіцнера [DMSO та 1-(3-диметиламінопропіл)-311-О-метил- та 12-О-метил-похідні з Етапу 4 неетил-карбодіімід у присутності піридин трифтораобов'язково піддаються гідролізу з сильними кис 15 71556 16 цетату] з одержанням 3-де(2,6-дидеокси-3-Соцтова, пропіонова, трифтороцтова, малеїнова, лимонна, стеаринова, бурштинова, етилбурштиметил-3-О-метил-a-L-рибогексопіранозил-окси)азитроміцин 3,6-гемікеталь 2'-O-ацетату загальної нова, метансульфонова, бензолсульфонова, птолуолсульфонова, лаурилсульфонова та подібні формули (І), де R1 означає гідроксильну групу, R3 кислоти, в реакційно-інертному розчиннику. Адиразом з R6 означає ефірну гр упу, R4 є ацетилом, тивні солі виділяють фільтруванням, оскільки вони R5 є метилом, та R7 і R8 однакові та означають нерозчинні в інертному до реакції розчиннику, водень, або 3-де(2,6-дидеокси-3-С-метил-3-Оосадженням нерозчинником або випарюванням метил-a-L-рибогексопіранозил-окси)-11-O-метилрозчинника, найбільш часто - ліофілізацією. азитроміцин 3,6-гемікеталь 2'-О-ацетату загальної Антибактеріальна in vitro дія нових сполук заформули (І), де R1 означає гідроксильну групу, R3 гальної формули (І) та їх фармацевтично прийнятразом з R6 означає ефірну гр упу, R4 є ацетилом, них адитивних солей з неорганічними або органічR5 та R7 однакові і означають метил, та R8 є водними кислотами на ряд стандартних тестнем, або 3-де(2,6-дидеокси-3-С-метил-3-О-метилмікроорганізмів визначалась у середовищі Мюлa-L-рибогексопіранозил-окси)-12-О-метиллера-Хінтона (Difco-Laboratories, Detroit, MI) у звиазитроміцин 3,6-гемікеталь 2'-О-ацетату загальної 1 3 чайний спосіб подвійного розведення згідно з реформули (І), де R означає гідроксильну групу, R комендаціями NCCLS (The National Committee for разом з R6 означає ефірну гр упу, R4 є ацетилом, Clinical Laboratory Standards - Національного коміR5 та R8 однакові і означають метил, та R7 є водтету з клінічних лабораторних стандартів). Кожен нем. випробовуваний мікроорганізм інокулювали до Етап 8: кінцевого розміру інокуляту 5 ´105куо (колонієутво3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lрюючих одиниць)/мл, та інкубування здійснювали рибогексопіранозил-окси)-азитроміцин 3,6в анаеробний спосіб при 37°С протягом 18 годин. гемікеталь 2'-O-ацетат та його 11-O-метил- та 12ΜΙΚ (МІС) у рідкому середовищі визначалась як O-метил-похідні з Етапу 7 піддаються сольволізу в найнижча концентрація антибактеріального агенту, нижчих спиртах, більш прийнятно, в метанолі, при що інгібувала видимий ріст в посудинах мікро розтемпературі від кімнатної температури до темпеведень. Контрольні організми одержували з АТСС ратури флегми розчинника, одержуючи 3-де(2,6(The American Type Culture Collection - Американдидеокси-3-С-метил-3-О-метил-a-Lська колекція типових культур). Усі стандарти ідерибогексопіранозил-окси)-азитроміцин 3,6нтифікували у стандартний спосіб та зберігали при гемікеталь загальної формули (І), де R 1 означає 3 6 -70°С. Результати дії 12-O-метил-азитроміцину на гідроксильну груп у, R разом з R означає ефірну стандартні тестовані мікроорганізми та клінічні груп у, R4, R7 та R8 однакові і означають водень, та ізоляти у порівнянні з азитроміцином подано в R5 є метилом, або 3-де(2,6-дидеокси-3-С-метил-3Таблиці 1 і Таблиці 2. О-метил-a-L-рибогексопіранозил-окси)-11-OВизначаючи концентрацію 12-O-метилметил-азитроміцин 3,6-гемікеталь загальної фор1 3 азитроміцину в сироватці після однократної перомули (І), де R означає гідроксильну груп у, R раральної дози 20мг/кг у групі з 36 самців щурів у зом з R6 означає ефірну груп у, R4 та R однакові і часові інтервали від 0,25 до 24 годин, виявили, що означають водень, та R5 і R7 однакові та означановий антибіотик дуже швидко абсорбувався в ють метил, або 3-де(2,6-дидеокси-3-С-метил-3-Осироватку. Аналіз піків привів до висновку про ісметил-a-L-рибогексопіранозил-окси)-12-O-метилнування кишково-печінкової циркуляції. В період азитроміцин 3,6-гемікеталь загальної формули (І), 0,5 та 1 години відбувалось швидке зменшення де R1 означає гідроксильну групу, R3 разом з R6 концентрації, після чого спостерігалось повторне її означає ефірну груп у, R4 та R7 однакові і означа5 8 збільшення. Максимальна концентрація речовини ють водень, та R і R однакові і означають метил. досягалась через 2 години (Смакс 248,8нг/мл). ВтоЕтап 9: ринний максимум досягався через 4 години після 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lзастосування. Період напівперетворення становив рибогексопіранозил-окси)-азитроміцин 3,65,2 годин, а загальна СКК (AUC) дорівнювала гемікеталь з Етапу 8 далі необов'язково піддають 1993,4год.нг/мл. реакції з етиленкарбонатом у присутності неорганічних або органічних основ, більш прийнятно, Таблиця 1 карбонату калію, в інертному щодо реакції розчинАнтиба ктеріа льна in v itro нику, більш прийнятно, етилацетаті, з одержанням дія 12-O-метил-азитроміцину на 3-де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lстандартні штами у порів нянні з азитроміцином рибогексопіранозил-окси)-азитроміцин 3,6гемікеталь 11,12 циклічного карбонату загальної MIK (мкг/мл) Органі зм 12-О- Метилформули (І), де R1 означає гідроксильну групу, R3 Азитроміци н азитроміци н разом з R6 означає ефірну групу, R4 є воднем, R5 є Staphy lococcus aureus АТСС 6538 Ρ 1 0,25 метилом, та R7 і R8 разом з С-11 та С-12 атомами S.aureus ATCC 29213 0,25 0,25 вуглецю означають циклічний карбонат. S.epidermidis ATCC 12228 0,5 0,03 Micrococcus f lav us ATCC 10240 0,5 0,12 Фармацевтично прийнятні адитивні солі, які M.luteus ATCC 9341 0,06 0,03 являють собою інший об'єкт даного винаходу, Streptococcus f aecalis ATCC 8043 0,5 0,25 одержують реакцією нових сполук загальної форBacillus subtilis ATCC 6633 4 1 мули (І) з, принаймні, еквімолярною кількістю відB.cereus ATCC 11778 1 0,25 повідної неорганічної чи органічної кислоти, такої Esherichia coli ATCC 10536 1 0,5 як соляна, йодистоводнева, сірчана, фосфорна, 17 71556 Таблиця 2 Антиба ктеріа льна in v itro дія 12-O-метил-азитроміцину на ряд клінічних ізо лятів у порів нянні з азитромі цино м Органі зм (кількість штамів ) Сполу ка Азитроміци н 12-О- Метилазитроміцин Азитроміци н S.epidermidis (20) 12-О- Метилазитроміцин Streptococcus Азитроміци н pneumoniae (25 ) 12-О- Метилазитроміцин Enterococcus Азитроміци н sp.(35) 12-О- Метилазитроміцин Haemophilus inf lu- Азитроміци н enzae (4 0) 12-О- Метилазитроміцин Staph. aureus. (77) МІК (мкг/мл) Діапазон 50% 90% 0,25-8 1 4 0,12-2 0,25 1 0,25-16 0,25 8 0,12-8 0,25 4 0,03-0,25 0,06 0,12 0,03-0,12 0,03 0,12 0,25-16 1 16 0,12-8 0,5 8 0,12-0,5 0,25 0,5 0,06-0,5 0,12 0,25 Спосіб одержання нових 3,6-гемікеталів з класу 9а-азалідів ілюструється наведеними далі прикладами, які ніяким чином не обмежують обсягу винаходу. Приготування 1 2'-O,3'-N-Біс(бензилоксикарбоніл)-3'-N-деметил-азитроміцин А До розчину азитроміцину (17г, 0,0227моль) в толуолі (170мл), додавали NaHCO3 (74,8г, 0,890моль), і потім реакційну суміш нагрівати при перемішування до температури флегми (80-85°С). До реакційної суспензії краплями додавали 102мл 50% бензилоксикарбонілхлориду (104,04г, 0,305моль) в толуолі при перемішуванні протягом 1 години. Реакційну суміш перемішували при тій самій температурі ще 2 години та залишили стояти ніч при кімнатній температурі. Після фільтрування осад промивали толуолом (85мл), і толуольний розчин екстрагували двічі 0,25N НСl (170мл) та двічі 1,5% водним розчином NaCl (170мл). До толуолу додавали воду (340мл) (рН3,1), рН реакційної суміші відрегулювали 6N НСl до 2,0, шари поділяли, та органічний шар ще три рази екстрагували водою (340мл), підтримуючи рН на рівні 2,0. До об'єднаних водних екстрактів додавали СН 2СІ2 (125мл), рН відрегулювали водним розчином NaOH (20%) до 10, шари поділяли, і водний шар знову екстрагували СН 2СІ2 (125мл). Об'єднані органічні екстракти висушували над К2СО3, фільтрували та випарювали за пониженого тиску з одержанням 16,5г густого маслянистого залишку, який необов'язково очищають хроматографією низького тиску на силікагельній 60 колонці (230-400меш ASTM (Американська спілка випробовування матеріалів)). 3 цією метою не-очищений продукт розчиняли в СН2СІ2 (20мл) та наносили на силікагельну колонку (50г) під тиском азоту 0,5бар. Для вилучення залишкового бензилхлорформіату та продуктів його розпаду СН 2СІ2 (150мл) проводили через колонку і, використовуючи систему розчинників метиленхлорид-метанол, 9:1 (200мл) та випарюючи фракції, що містять хроматографічно однорідний продукт заголовку, одержували 11,53г ТШХ-чистого 2'-О,3'-N-біс-(бензилоксикарбоніл)-Nдеметил-азитроміцину з фізико-хімічними константами, описаними в патенті США 5,250,518 від 10/1993. Приклад 1 4",11-O-Біс(триметилсиліл)-2'-O,3'-Nбіс(бензилоксикарбоніл)-3'-N-деметил-азитроміцин 18 До розчину 2'-O,3'-N-біс(бензилоксикарбоніл)3'-N-деметил-азитроміцину (5,0г, 0,005моль) в піридині (50мл), охолодженого до 0-5°С, додавали триметилсилілімідазол (3,3мл, 0,0226моль) та триметилсилілхлорид (3,0мл, 0,0179моль) під потоком азоту. Реакційну суміш перемішували при тій самій температурі протягом 6 годин, додавали н-гексан (60мл) та воду (100мл), шари поділяли, і органічний шар промивали насиченим розчином NaHCO3 (60мл) та водою (60мл). Після висушування над MgSO4, фільтрування і випарювання розчинника за пониженого тиску одержували 5,48г білого аморфного осаду, який необов'язково очищали хроматографією низького тиску на силікагельній колонці з використанням системи СН 2СІ2СН3ОН, 9:1. Об'єднання та випарювання хроматографічно однорідних фракцій давало продукт заголовку з такими фізико-хімічними константами: ТШХ, Метиленхлорид-метанол, 90:1 Rf 0,875 Етилацетат-N-гексан-діетиламін, 100:100:20 Rf 0,942 (ІЧ (KВr) см -1: 3524, 2969, 2692, 1754, 1732, 1708, 1498, 1456, 1382, 1335, 1252, 1168, 1116, 1060, 1005, 895, 841, 754, 696. 1 Н ЯМР (300МГц, CDCl3) δ: 7,32-7,23 (Ph), 5,12, 4,98 (CH2-Ph), 4,85 (H-1"), 4,70 (H-1), 4,65 (Н-2'), 4,46 (Н-3'), 4,26 (H-5"), 4,42 (Н-3), 3,72 (Н-5'), 3,66 (Н-11), 3,49, 3,47 (Н-5), 3,20 (Н-4"), 3,32, 3,18 (3"ОСН3), 2,83, 2,79 (3'-NСН3), 2,78 (Н-2), 2,64 (Н-10), 2,35 (Н-9а), 2,33 (Н-2"а), 2,11 (9a-NCH3), 1,94 (H9b), 1,91 (Н-8), 1,64 (Н-14а), 1,94 (Н-4), 1,50 (Н2"b), 1,50 (Н-14b), 1,27, 1,25 (6-СН3), 1,24 (5"-СН3), 1,19 (5'-СН3), 1,12 (3"-СН3), 1,16 (12-СН3), 1,26 (2СН3), 0,89 (10-СН3), 0,95 (8-СН3), 0,85 (14-СН3), 1,02 (4-СН3), 1,02 (4-СН3), 0,16 (11-OSi(CH 3)3, та 0,13 /4"-OSi(CH 3)3/· 13 С ЯМР (75 МГц, CDCl3) δ: 176,2 (C-1), 156,2, 156,4 (ОСО), 154,5, 154,4 (NCO), 136,7-127,5 (Ph), 100,2 (C-1'), 97,3 (C-1"), 83,9 (C-5), 80,7 (C-4"), 75,0 (C-3), 75,0 (C-2'), 75,3 (C-6), 73,2 (C-3"), 69,4, 69,2, 67,1, 66,8 (СH2-Ph), 64,8 (C-5"), 62,3 (C-10), 54,8 (C-3'), 49,4, 49,2 (3"-ОСН3), 46,2 (C-2), 38,5 (C-7), 39,4 (C-4), 34,2 (9a-NCH3), 35,9, 35,6 (C-2"), 36,2, 36,1 (C-4'), 29,0 (3'-NCH3), 25,6 (C-8), 27,8 (6-СН3), 21,9 (3"-CH3),21,5 (8-CH3), 20,7 (5'-СН3), 23,4 (С14), 18,4 (5"-СН3), 16,0 (2-СН3), 11,6 (14-СН3), 9,6, 9,5 (4-СН3), 8,3 (10-СН3), 1,2 /11-OSi(СН3)/3 та 0,67 /4"-OSi(CH 3)3/· ES-MS 1147 Приклад 2 3'-N-Деметил-12-O-метил-азитроміцин До розчину продукту Прикладу 1 (1,0г, 0,0009моль) в Ν,Ν-диметил-формаміді (20мл) поступово додавали метилйодид (0,43мл, 0,0069моль) та 60% гідрид натрію (0,23г, 0,0058моль) протягом 3 годин при кімнатній температурі. Реакційну суміш перемішували ще 30 хвилин при тій самій температурі, реакцію припиняли, додаючи триетиламін (2мл), її переносили у суміш 10% водного розчину NaHCO3 (50мл) та води (50мл) і екстрагували етилацетатом. Об'єднані органічні екстракти промивали насиченим розчином NaCl і водою, висушували над MgSO4, фільтрували та випарювали за пониженого тиску, з одержанням 0,93г жовтого осаду [Rf 0,832, мети 19 71556 20 ленхлорид-метанол, 90:1; ІЧ (KВr)см -1: 3516, 1752, 1,56 (Н-2"b), 1,52 (Н-14b), 1,36 (Н-7b), 1,29 (6-СН3), 1732, 1705, 1456, 1382, 1336, 1253, 1169, 1116, 1,21 (2-СН3), 1,30 (5"-СН3), 1,24 (H-4'b), 1,23 (3"1062, 1004, 896, 840, 754, 696]. Продукт розчинили СН3), 1,22 (5'-СН3), 1,09 (12-СН3), 1,29 (4-СН3), 1,09 в етанолі (20мл), додали NaOAc/HO/Ac буфер з (10-СН3), 0,92 (8-СН3), 0,93 (14-СН3). 13 рН5 (0,17мл оцтової кислоти, 0,263г ацетату наС ЯМР (75МГц, CDCl3) δ 177,5 (C-1), 103 І (Стрію, 0,22мл етанолу та 1мл води) і Pd/C 10% 1'), 95,2 (С-1"), 83,6 (С-5), 79,2 (С-12), 78,1 (С-3), (0,6г), та реакційну суміш гідрували при перемішу76,6 (С-11), 74,7 (С-13), 73,8 (С-6), 70,9 (С-2'), 68,8 ванні протягом 5 годин в автоклаві під тиском вод(С-9), 65,6 (С-5"), 65,7 (С-3'), 61,6 (С-10), 52,8 (12ню 5бар. Каталізатор відфільтровували, фільтрат ОСН3), 49,4 (3"-ОСН3), 45,1 (С-2), 43,0 (С-7), 41,8 випарювали до густого сиропу, додавали СН2СІ2 (С-4), 40,4 /3'N(CH3)2/, 36,8 (9a-NCH3), 35,0 (С-2"), (10мл) та воду (15мл) , рН суміші доводили 2N НСl 29,0 (С-4'), 26,9 (С-8), 26,9 (6-СН3), 22,0 (8-СН3), до 4, шари поділяли та водний шар, після дове22,0 (С-14), 21,6 (3"-СН3), 21,3 (5'-СН3), 18,1 (5"дення рН до 9,5 за допомогою 20% NaOH, екстраСН3), 16,9 (12-СН3), 14,6 (2-СН3), 11,0 (14-СН3), 9,6 (4-СН3), 9,4 (10-СН3). гували СН 2Сl2 (3´10мл). Об'єднані органічні екстПриклад 4 ракти висушували над K2СО3, фільтрували та випарювали. Осад розчиняли в ізопропанолі 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-L(10мл), додавали воду (10мл) та кілька крапель рибогексопіранозил-окси)–3-окси-12-O-метилмурашиної кислоти і перемішували 30 хвилин при азитроміцин кімнатній температурі, екстрагували ізопропілацеУ 0,25N соляної кислоти (80мл) розчиняли 12татом при рН9,5, одержуючи після випарювання за О-метил-азитроміцин (1,7г, 0,0022моль) Прикладу пониженого тиску 0,43г продукту заголовку з таки3 та залишали стояти протягом 24 годин при кімми фізико-хімічними константами: натній температурі. До реакційної суміші додавали ІЧ (KВr)см -1: 3672, 3496, 2962, 1727, 1458, СН2СІ2 (рН1,8), шари поділяли, і водний шар екст1375, 1343, 1280, 1263, 1118, 1085, 1048, 1005. рагували ще два рази СН 2СІ2. До водного шару 998. знову додавали СН 2СІ2, рН суміші доводили за 13 С Я МР (75МГц, СОСІ 3) δ: 177,4 (С-1), 102,7 допомогою конц. ΝΗ4ΟΗ до 9,0, шари поділяли, і (С-1'), 95,5 (С-1"), 83,4 (С-5), 79,7 (С-12), 78,0 (С-3), водний шар екстрагували СН 2СІ2. Об'єднані орга76,6 (С-11), 74,0 (С-13), 73,9 (C-6), 74,3 (С-2'), 73,0 нічні екстракти при рН9,0 промивали 10% водним (С-3"), 68,8 (С-9), 65,7 (С-5"), 60,1 (С-3'), 61,2 (Срозчином NaHCO3 та водою, висушували над 10), 52,8 (12-ОСН3), 49,8 (3"-ОСН3), 45,5 (С-2), 41,5 K2СО3 та випарювали з одержанням 1,25г продук(С-4), 33,1, 3'-NCH3, 36,8 (9a-NCH3), 35,1 (С-2"), ту заголовку з такими фізико-хімічними конс28,8 (С-4'), 27,0 (С-8). тантами: ΕΙ-MS m/z 748. ТШХ, Метиленхлорид-метанол-конц. аміак, Приклад 3 90:9:0,5 Rf 0,315 12-O-Метил-азитроміцин Етилацетат-N-гексан-діетиламін, 100:100:20 Rf До розчину 3'-N-деметил-12-О-метил0,594 ІЧ (KВr)см -1: 3450, 2971, 2933, 1711, 1648, азитроміцину Прикладу 2 (0,43г, 0,0006моль) у 1460, 1381, 1272, 1261, 1171, 1113, 1078, 1049. 1 СНСІ3 (20мл), додавали формальдегід (37%) H ЯМР (300МГц, CDCl3) 5: 5,32 (Н-13), 4,47 (0,047мл, 0,0006моль) та мурашину кислоту (98(Н-1'), 3,78 (Н-3), 3,66 (Н-11), 3,58 (Н-5), 3,58 (Н-5'), 100%) (0,042мл, 0,0011моль). Реакційну суміш 3,41 (12-ОСН3), 3,28 (Н-2'), 2,67 (Н-2), 2,80 (Н-10), перемішували протягом 3 годин із зворотним хо2,53 (Н-3'), 2,53 (Н-9а), 2,27 /3'N(CH3)2/, 2,37 (9aлодильником, охолоджували до кімнатної темпеNCH3), 2,07 (H-9b), 2,27 (Η-4), 1,92 (Η-8), 1,74 (Нратури, виливали у воду (20мл) та після доведен14а), 1,68 (Н-4'а), 1,59 (Н-7а), 1,63 (Н-14b), 1,51 (Ння рН до 4,0, шари поділяли, і водний шар 7b), 1,31 (6-СН3), 1,31 (2-СН3), 1,29 (H-4'b), 1,26 (5'екстрагували ще два рази СНСl3. До водного шару СН3), 1,08 (12-СН3), 1,05 (4-СН3), 1,19 (10-СН3), додавали СНСІ3, рН доводили до 9,5 (2N NaOH), 0,93 (8-СН3), 0,92 (14-СН3). 13 шари поділяли, і водний шар екстрагували ще два С Я МР (75 МГц, CDCl3) δ: 177,2 (С-1), 106,4 рази СНСl3. Об'єднані органічні екстракти при (С-1'), 94,7 (С-5), 78,0 (О12), 79,0 (С-3), 78,3 (С-11), рН9,5 висушували (K2СО3) та випарювали з одер75,1 (С-13), 72,9 (С-6), 70,2 (С-2'), 70,3 (С-9), 65,3 жанням 0,38г продукту заголовку, який, у разі не(С-3'), 62,1 (С-10), 52,5 (12-ОСН3), 44,3 (С-2), 41,8 обхідності, очищали хроматографією на силікаге(С-7), 35,7 (С-4), 39,9 /3'N(CH3)2/, 36,5 (9a-NCH3), льній колонці, використовуючи систему СН 2Сl227,9 (С-4'), 26,4 (С-8), 25,5 (6-СН3), 20,8 (8-СН3), СН3ОН-конц.NH4ОН, 90:9:1. 20,7 (С-14), 20,8 (5'-СН3), 16,1 (12-СН3), 15,7 (2ТШХ, Метиленхлорид-метанол-конц. аміак, СН3), 10,3 (14-СН3), 7,6 (4-СН3), 7,2 (10-СН3). 90:9:0,5 Rf 0,363 Приклад 5 Етилацетат-N-гексан-діетиламін, 100:100:20 Rf 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-L0,745 ІЧ(KВr)см-1: 3499, 2972, 2940, 1736, 1633, рибогексопіранозил-окси)-3-окси-12-O-метил1460, 1381, 1259, 1168, 1110, 1059, 1082, 1054, азитроміцин-2'-О-ацетат 1013, 999. До розчину 3-де(2,6-дидеокси-3-С-метил-3-О1 Н ЯМР (300МГц, CDCl3) δ: 5,39 (Н-13), 5,00 метил-a-L-рибогексопіранозил-окси)-3-окси-12-О(Н-1"), 4,43 (Н-1'), 4,32 (Н-3), 4,06 (Н-5"), 3,68 (Нметил-азитроміцин (1,3г, 0,0022моль) Прикладу 4 11), 3,65 (Н-5), 3,51 (Н-5'), 3,38 (12-ОСН3), 3,32 (3"у СН2Сl2 (20мл), додавали NaHCO3 (0,754г, ОСН3), 3,24 (Н-2'), 3,02 (Н-4"), 2,73 (Н-2), 2,69 (Н0,009моль) та ангідрид оцтової кислоти (0,221мл, 10), 2,49 (Н-3'), 2,34 (Н-2"а), 2,31 (Н-9а), 2,29 0,0023моль) і потім перемішували протягом 10 /3'N(CH3)2/, 2,30 (9a-NCH3), 2,12 (Н-9b), 2,04 (Н-4), годин при кімнатній температурі. Після стояння 2,01 (Н-8), 1,73 (Н-14а), 1,68 (Н-4'а), 1,66 (Н-7а), впродовж ночі в реакційну суміш додавали наси 21 71556 22 чений розчин NаНСО3, шари поділяли, і водний за пониженого тиску, одержаний залишок (1,65г) шар ' екстрагували СН 2Сl2. Об'єднані органічні очищали хроматографією низького тиску на силіекстракти промивали насиченим розчином кагельній колонці, використовуючи систему метиNаНСО3 і водою, висушували над K2СО3, фільтруленхлорид-метанол-конц. аміак, 90:9:0,5. Випарювали та випарювали, одержуючи 1,29г білого амовання об'єднаних екстрактів з Rf 0,082 давало рфного осаду. хроматографічно однорідний 3-де(2,6-дидеокси-3ТШХ, Метиленхлорид-метанол-конц. аміак, С-метил-3-О-метил-a-L-рибогексопіранозил-окси)90:9:0,5 Rf 0,489 12-О-метил-азитроміцин-З,6-гемікеталь з такими Етилацетат-N-гексан-діетиламін, 100:100:20 Rf фізико-хімічними константами: 0,661 ІЧ (KВr)см -1: 3448, 2974, 1749, 1718, 1637, ТШХ, Метиленхлорид-метанол-конц. аміак, 1458, 1377, 1242, 1169, 1115, 1045. 90:9:0,5 Rf 0,082 1 Н ЯМР (300МГц, CDCl3) δ: 5,23 (Н-13), 4,72 Етилацетат-N-гексан-діетиламін, 100:100:20 Rf (Н-2'), 4,70 (Н-1'), 3,59 (Н-11), 3,56 (Н-5), 3,52 (Н-3), 0,624 ІЧ (CDCl3)см -1: 3450, 2956, 2940, 1718, 1678, 3,43 (Н-5'), 3,33 (12-ОСН3), 2,72 (Н-10), 2,71 (Н-3'), 1631, 1459, 1383, 1278, 1198, 1117, 1068, 1048, 2,61 (Н-2), 2,42 (Н-9а), 2,30 (9a-NCH3), 2,20 1014, 963. 1 /3'N(CH3)2/, 2,12 (Н-4, 1,99 (2'-СОСH3), 1,96 (Н-9b), Н ЯМР (300МГц, CDCl3) δ: 5,49 (Н-13), 4,21 1,80 (Н-8), 1,67 (Н-14а), 1,67 (Н-4'а), 1,58 (Н-14b), (Н-1'), 3,83 (Н-11), 3,75 (Н-5), 3,52 (Н-5'), 3,43 (121,47 (Н-7а), 1,31 (H-4'b), 1,21 (2-СН3), 1,18 (Н-7b), ОСН3), 3,25 (Н-2'b 2,59 (Н-2), 2,93 (Н-10), 2,50 (Н1,16 (5'-СН3), 1,15 (6-СН3), 1,10 (10-СН3), 0,97 (123'), 2,61 (Н-9а), 2,29 /3'N(CH3)2/, 2,40 (9a-NCH3), СН3), 0,86 (14-СН3), 0,84 (8-СН3), 0,81 (4-СН3). 2,10 (H-9b), 2,06 (Η-4), 1,88 (Η-8), 1,77 (Н-14а), 1,67 13 С Я МР (75 МГц, CDCl3) δ: 176,5 (С-1), 169,4 (Н-4'а), 1,61 (Н-7а), 1,64 (Н-14b), 1,33 (Н-7b), 1,31 (2'-СОСН3), 98,6 (С-1'), 84,3 (С-5), 77,3 (С-12), 78,3 (6-СН3), 1,05 (2-СН3), 1,27 (Н-4'b), 1,26 (5'-CH3), (С-3), 76,7 (С-11), 74,6 (С-13), 72,4 (С-6), 70,7 (С1,08 (12-CH3), 1,05, (4-СН3), 1,19 (10-СН3), 0,92 (82'), 69,9 (С-9), 62,2 (С-3'), 62,3 (С-10), 51,9 (12СН3), 0,93 (14-СН3). 13 ОСН3), 43,0 (С-2), 40,1 (С-7), 35,2 (С-4), 39,6 С ЯМР (75МГц, CDCl3) δ: 176,2 (С-1) , 105,8 /3'N(CH3)2/, 35,9 (9a-NCH3), 30,0 (С-4'), 25,4 (С-8), (С-1'), 94,6 (С-5), 78,3 (С-12), 102,7 (С-3), 71,2 (С25,2 (6-СН3), 20,6 (2'-СОСH3), 20,4 (8-СН3), 20,0 (C11), 74,8 (С-13), 82,9 (С-6), 69,6 (С-2'), 64,5 (С-9), 14), 20,2 (5'-СН3), 15,9 (12-CH 3), 15,2 (2-СН3), 9,7 65,1 (С-3'), 60,7 (С-10), 52,2 (12-ОСН3), 49,2 (С-2), (14-СН3), 7,0 (4-СН3), 6,4 (10-СН3). 41,4 (С-7), 48,6 (С-4), 40,0 /3'N(СН3)2/, 40,5 (9aПриклад 6 NCH3), 28,2 (С-4'), 29,1 (С-8), 26,5 (6-СН3), 21,5 (83-Де(2,6-дидеокси-3-С-метил-3-O-метил-a-LСН3), 21,6 (С-14), 20,8 (5'-СН3), 16,3 (12-СН3), 13,6 рибогексопіранозил-окси)-12-О-метил-азитроміцин (2-СН3), 10,7 (14-СН3), 12,8 (4-СН3), 10,7 (10-СН3). 3,6-гемікеталь-2'-О-ацетат Приклад 8 До розчину 3-де (2,6-дидеокси-3-С-метил-3-O4"-О-Триметилсиліл-2'-O-3'-Nбіс(бензилоксикарбоніл)-3'-N-деметил-азитроміцин метил-a-L-рибогексопіранозил-окси)-3-окси-12-ОДо розчину 2'-О,3'-N-біс(бензилоксикарбоніл)метил-азитроміцин 2'-O-ацетат (1,3г, 0,0020моль) 3'-N-деметил-азитроміцину (5г, 0,005моль) в піриПрикладу 5 у СН2СІ2 (15мл), додавали диметилдині (30мл), охолодженого до 0-5°С, додавали сульфоксид (4,35мл) та Ν,N-диметил-аміно-пропілтриметилсилілімідазол (1,46мл, 0,01моль) та триетил-карбодіімід (4,55г). Реакційну суміш охолометилсилілхлорид (1,64мл, 0,01моль) під потоком джували до 15°С, і потім при перемішуванні та азоту. Реакційну суміш перемішували протягом 1 підтриманні температури на рівні 15°С додавали години при тій самій температурі, додавали нкраплями протягом 30 хвилин розчин піридиній гексан (50мл) та воду (25мл), шари поділяли, і ортрифторацетату (4,61г, 0,0234моль) в СН2СІ2 ганічний шар промивали насиченим розчином Na(10мл). Температуру реакційної суміші поступово HCO3 (25мл) та водою (25мл). Після висушування підвищували до кімнатної температури та перемінад MgSO4, фільтр ування та випарювання розшували протягом ще 2 годин, після чого реакцію чинника за пониженого тиску давало аморфний припиняли, додаючи насичений розчин NaCl осад (3,65г), який необов'язково очищали хромато(25мл). Після підлуговування 2N NaOH до 9,5, реаграфією низького тиску на силікагельній колонці, кційну суміш екстрагували СН 2СІ2, органічні екствикористовуючи систему метиленхлорид-метанолракти промивали насиченим розчином NaCl, конц.аміак, 90:9:0,5. Об'єднуючи і випарюючи хроNаНСО3 та водою і висушували над K2СО3. Випаматографічно однорідні фракції з Rf 0,670, одеррювання СН2СІ2 за пониженого тиску давало 1,78г жували продукт заголовку з такими фізикомаслянистого залишку. хімічними константами: ТШХ, Метиленхлорид-метанол-конц. аміак, ТШХ, Метиленхлорид-метанол, 90:1 Rf 0,525 90:9:0,5 Rf 0,176 Етилацетат-N-гексан-діетиламін, 100:100:20 Rf Етилацетат-N-гексан-діетиламін, 100:100,20 Rf 0,862 ІЧ (CDCl3)см -1: 3502, 2969, 2938, 1753, 1732, 0,861 1708, 1454, 1383, 1365, 1254, 1169, 1118, 1063, Приклад 7 1001, 897, 839, 754, 696. 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-L1 Н ЯМР (300МГц, CDCl3) δ: 7,34-7,26 (Ph), 5,13, рибогексопіранозил-окси)-12-О-метил5,09, (CH2-Ph), 5,07 (H-1"), 4,78 (Н-1'), 4,68 (Н-13), азиотроміцин 3,6-гемікесраль 4,66 (Н-2'), 4,55 (Н-3'), 4,22 (Н-5"), 4,13 (Н-3), 3,96 Розчин 3-де(2,6-дидеокси-3-С-метил-3-О(Н-5'), 3,65 (Н-11), 3,58, 3,54 (Н-5), 3,15 (Н-4"), 3,37, метил-a-L-рибогексопіранозил-окси)-12-O-метил2,99 (3"-ОСН3), 2,85, 2,81 (3'-NCH3), 2,70 (Н-2), 2,68 азитроміцин 2'-О-ацетат (1,78г) Прикладу 6 у ме(Н-10), 2,54 (Н-9а), 2,35 (Н-2"а), 2,31 (9a-NCH3), танолі (50мл) залишали стояти впродовж 24 годин 2,04 (H-9b), 1,97 (Н-8), 1,90 (Н-14а), 1,85 (Н-4), 1,62 при кімнатній температурі. Метанол випарювали 23 71556 24 (Н-7а), 1,50 (Н-2"b), 1,44 (Н-14b), 1,28, 1,27 (6-СН3), протягом 3 годин із зворотним холодильником, 1,23 (5"-СН3), 1,16 (5'-СН3), 1,15 (Н-7b), 1,04 (3"охолоджували до кімнатної температури, виливаСН3), 1,15 (12-СН3), 1,10 (2-СН3), 1,10 (10-СН3), ли в воду (20мл) та після доведення рН до 4,0 ша0,92 (8-СН3), 0,89 (14-СН3), 1,10 (4-СН3). ри поділяли, і водний шар екстрагували ще два 13 С ЯМР (75 МГц, CDCl3) δ: 178,8 (C-1), 156,6, рази СНСІ3. До водного шару додавали СНСІ3, рН 156,3 (ОСО), 154,7, 154,6 (NCO), 136,8-127-5 (Ph), доводили до 9,5 (2N NaOH), шари поділяли, і вод99,2 (C-1'), 94,8 (C-1"'), 83,2, 83,1 (C-5), 80,5, 80,4 ний шар екстрагували ще два рази СНСl3. Об'єд(C-4"), 77,3 (C-3), 75,1, 75,0 (C-2'), 74,1 (C-12), 73,8 нані органічні екстракти при рН9,5 висушували (C-11), 73,2 (C-6), 73,2 (C-3"), 69,2, 69,0, 67,2, 66,8 (K2СО3) та випарювали з одержанням 1,25г осаду, (CH2-Ph), 64,8 (C-5"), 62,2 (C-10), 54,6 (C-3'), 49,3, який хроматографували на силікагельній колонці, 48,8 (3"-OCH3), 44,7 (C-2), 41,5 (C-7), 41,1 (C-4), використовуючи систему метиленхлорид-метанол36,1 (9a-NCH3), 35,1, 35,0 (C-2"), 36,3, 35,7 (C-4'), конц. аміак, 90:9:1, з одержанням 0,40г хроматог28,4 (3'-NCH3), 26,3 (C-8), 26,8 (6-CH3), 22,1 (3"рафічно однорідних 11-О-метил-азитроміцину з CH3), 21,6 (8-СН3), 21,4 (5'-CH3), 21,0 (C-14), 18,7 фізико-хімічними константами, як наведено в па(5"-CH3), 15,9 (2-СН3), 14,5 (12-СН3), 11,0 (14-СН3) , тенті США 5,250,518 від 10/1993 та 0,52г 12-O8,5 (4-СН3), 7,1 (10-СН3), 0,63/4"-OSi(CH 3)3/. метил-азитроміцину з фізико-хімічними константаES-MS 1075. ми, як наведено в Прикладі 3. Приклад 9 Приклад 10 11-O-метил-азитроміцин та 12-О-метил азит3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lроміцин рибогексопіранозил-окси)-3-окси-11-O-метилДо розчину продукту Прикладу 8 (3,0г, азитроміцин 0,0028моль) у Ν,Ν-диметилформаміді (50мл), поВ метанолі (30мл) розчиняли 11-O-метилступово протягом 3 годин при кімнатній темпераазитроміцин (1,5г), додавали 0,25N соляної кислотурі додавали метилйодид (1,29мл, 0,0207моль) та ти (50мл) і залишали стояти впродовж 24 годин 60% гідрид натрію (0,69г, 0,0174моль). Реакційну при кімнатній температурі. Метанол випарювали, суміш перемішували протягом 1 години при тій до реакційної суміші додавали CDCI3 (рН1,9), шасамій температурі, реакцію припиняли, додаючи ри поділяли, і водний шар екстрагували ще два триетиламін (5мл), переносили в суміш 10% водрази СОСІ3. Водний розчин підлуговували до ного розчину NаНСО3 (100мл) та води (100мл) і рН9,5 та екстрагували CDCI3. Об'єднані органічні екстрагували етилацетатом. Об'єднані органічні екстракти при рН9,5 висушували над K2СО3 і виекстракти промивали насиченим розчином NaCl та парювали з одержанням 0,95г продукту заголовку, водою і висушували над MgSO4, фільтрували та який необов'язково очищали хроматографією нивипарювали за пониженого тиску з одержанням зького тиску на силікагельній колонці, використо2,9г суміші продуктів, яку необов'язково очищали вуючи систему розчинників метиленхлоридхроматографією низького тиску на силікагельній метанол-конц. аміак, 90:9:0,5, з одержанням хроколонці, використовуючи систему метиленхлоридматографічно однорідного продукту заголовку з метанол, 90:1, з одержанням а хроматографічно такими фізико-хімічними константами: однорідних 4"-О-триметилсиліл-2'-О-3'-N-біс (бенТШХ, Метиленхлорид-метанол-конц. аміак, зилокси-карбоніл)-3'-N-деметил-11-О-метил90:9:0,5 Rf 0,382 азитромі-цину з Rf 0,745 [ІЧ (KВr): 3452, 2969, Етилацетат-N-гексан-діетиламін, 100:100:20 Rf 1752, 1736, 1706, 1455, 1382, 1332, 1254, 1169, 0,594 ІЧ (KВr)см -1: 3448, 2972, 2937, 1730, 1638, 1117, 1063, 1002, 914, 897, 840, 754, 697] та 4"-О1458, 1377, 1165, 1113, 1078, 1050. 1 триметилсиліл-2'-O-3'-N-біс(бензилокси-карбоніл)Н ЯМР (300МГц, CDCl3) δ: 4,97 (Н-13), 4,52 3'-N-деметил-12-O-метил-азитромiцину з Rf 0,485 (Н-1'), 3,76 (Н-3), 3,70 (11-ОСН3), 3,59 (Н-5), 3,54 [ІЧ (KBr): 3450, 2958, 1754, 1718, 1708, 1458, 1383, (Н-5'), 3,42 (Н-11), 3,29 (Н-2'), 2,68 (Н-2), 2,70 (Н1252, 1168, 1068, 1010, 896, 842, 753, 695]. 10), 2,58 (Н-3'), 2,46 (Н-9а), 2,35 (Н-4), 2,29 Одержану суміш розчиняли в етанолі (50мл) , /3'N(CH3)2/, 2,30 (9a-NCH3), 2,11 (H-9b), 1,94 (Ндодавали NaOAc/HOAc буфер з рН5 (0,51мл НО14а), 1,89 (Н-8), 1,70 (Н-4'а), 1,66 (Н-7а), 1,54 (НАс, 0,789г NaOAc, 0,66мл етанолу та 3мл води) та 7b), 1,52 (Н-14b), 1,33 (6-СН3), 1,30 (2-СН3), 1,27(Н10% Pd/C (1,5г), і суміш гідрували при перемішу4'b), 1,25 (5'-СН3), 1,12 (12-СН3), 1,10 (4-СН3), 1,06 ванні протягом 8 годин в автоклаві під тиском вод(10-СН3), 0,92 (8-СН3), 0,86 (14-СН3). 13 ню 5бар. Каталізатор відфільтровували, фільтрат С ЯМР (75 МГц, CDCl3) δ 175,7 (C-1), 106,1 випарювали до густого сиропу, додавали воду (С-1'), 94,7 (С-5), 74,2 (С-12), 78,1 (С-3), 86,0 (С(50мл) та СНСІ3 (50мл), і продукт ізолювали рН 11), 77,1 (С-13), 72,8 (С-6), 70,2 (С-2'), 70,9 (С-9), градієнтною екстракцією при рН 4,0 та 9,5. Об'єд65,4 (С-3'), 62,9 (C-10), 62,0 (11-ОСН3), 44,1 (С-2), нані органічні екстракти при рН 9,5 висушували 42,5 (С-7), 35,3 (С-4), 39,9 /3'N(CH3)2/, 36,2 (9aнад K2СО3 та випарювали до аморфного осаду. NCH3), 28,0 (С-4'), 26,7 (С-8), 25,8 (6-СН3), 20,9 (8Цей осад розчиняли в ізопропанолі (20мл), додаСН3), 21,2 (С-14), 20,8 (5'-СН3), 16,8 (12-СН3), 15,6 вали воду (20мл) та кілька крапель мурашиної (2-СН3), 10,3 (14-СН3), 7,7 (4-СН3), 6,8 (10-СН3). кислоти і перемішували протягом 30 хвилин при Приклад 11 кімнатній температурі, екстрагували ізопролілаце3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lтатом при рН9,5, висушували над суль фатом нарибогексопіранозил-окси)-3-окси-11-О-метилтрію та випарювали за пониженого тиску. Одержаазитроміцин 2'-О-ацетат ний продукт розчиняли в СНСІ3 (50мл), додавали До розчину 3-де(2,6-дидеокси-3-С-метил-3-Оформальдегід (37%) (0,24мл) та мурашину кислоту метил-a-L-рибогексопіранозил-окси)-3-окси-11-О(98-100%) (0,22мл). Реакційну суміш перемішували метил-азитроміцину (0,89г) Прикладу 10 в СН2СІ2 25 71556 26 (25мл), додавали NaHCO3 (0,52г) та ангідрид оц6), 69,7 (С-2'), 64,9 (С-9), 65,8 (С-3'), 62,1 (С-10), тової кислоти (0,15мл), реакційну суміш перемішу61,9 (11-ОСН3), 49,6 (С-2), 43,3 (С-7), 40,1 вали протягом 10 годин при кімнатній температурі, /3'N(CH3)2/, 28,1 (С-4'), 28,7 (С-8), 25,5 (6-СН3), 20,9 залишали стояти ніч і потім виділяли екстрагуван(5'-СН3), 14,0 (2-СН3), 11,7 (14-СН3), 12,3 (4-СН3), ням СН2СІ2, як описано в Прикладі 5, одержуючи 8,5 (10-СН3). 0,65г білого аморфного осаду. Приклад 14 ТШХ, Метиленхлорид-метанол-конц. аміак, 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-L90:9:0,5 Rf 0,426 рибогексопіранозил-окси)-3-окси-азитроміцин Етилацетат-N-гексан-діетиламін, 100:100:20 Rf 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-L0,670 рибогексопіранозил-окси)-3-окси-азитроміцин ІЧ (KВr)см -1 3525, 3475, 2968, 2937, 1724, 1647, одержали з азитроміцину відповідно до способу 1458, 1376, 1265, 1168, 1113, 1081, 1050. Djokic et al. з US 4,886,792 від 12/1989, Приклад 3. Приклад 12 Поділ на силікагельній колонці з використанням 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lсистеми розчинників метиленхлорид-метанолрибогексопіраиозил-окси)-11-О-метил-азитроміцин конц. аміак, 90:9:0,5, давав хроматографічно од3,6-гемікеталь 2'-О-ацетат норідний продукт з такими фізико-хімічними консДо розчину 3-де(2,6-дидеокси-3-С-метил-3-Отантами: метил-a-L-рибогексопіранозил-окси)-3-окси-11-ОТШХ, Етилацетат-триетиламін, 95:5 Rf 0,371 метил-азитроміцин 2'-О-ацетату (0,65г) Прикладу ІЧ (KВr)см -1: 3438, 2973, 2938, 1713, 1655, 11 в СН2СІ2 (20мл) додавали диметилсульфоксид 1459, 1378, 1350, 1260, 1172, 1113, 1078, 1044, (0,94мл) та N,N-диметил-амінопропіл-етил957. 1 карбодіімід (1,16г), Реакційну суміш охолоджували Н ЯМР (300МГц, CDCl3) δ: 4,72 (Н-13), 4,47 до 15°С і потім, перемішуючи та підтримуючи тем(Н-1'), 3,78 (Н-3), 3,58 (Н-5), 3,56 (Н-5'), 3,65 (Н-11), пературу на рівні 15°С, поступово краплями протя3,27 (Н-2'), 2,66 (Н-2), 2,74 (Н-10), 2,52 (Н-3'), 2,49 гом 30 хвилин додавали розчин піридиній трифто(Н-9а), 2,28 (Н-4), 2,26 /3'N(CH3)2/, 2,37 (9a-NCH3), рацетату (1,15г) в СН2Сl2 (5мл). Температуру 2,06 (Η-9b), 1,90 (H-14a), 1,90 (Н-8), 1,67 (Н-4'а), реакційної суміші піднімали до кімнатної темпера1,62 (Н-7а), 1,47 (Н-7b), 1,53 (Н-14b), 1,32 (6-СН3), тури, перемішували її протягом ще 4 годин, та піс1,30 (2-СН3), 1,28 (H-4'b), 1,26 (5'-СН3), 1,07 (12ля цього виділяли продукт згідно з способом, опиСН3), 1,06 (4-СН3), 1,12 (10-СН3), 0,92 (8-СН3), 0,88 саним в Прикладі 6, з одержанням 0,6г продукту (14-СН3). 13 заголовку. С Я МР (75 МГц, CDCl3) δ: 178,8 (C-1), 106,6 ТШХ, Метиленхлорид-метанол-конц. аміак, (C-1'), 94,7 (С-5), 72,9 (С-12), 79,2 (С-3), 75,5 (С90:9:0,5 Rf 0,606 11), 77,1 (C-13), 74,0 (С-6), 70,3 (С-2'), 70,6 (С-9), Етилацетат-N-гексан-діетиламін, 100:100:20 Rf 65,4 (С-3'), 62,2 (С-10), 44,2 (С-2), 41,7 (С-7), 35,6 0,861 (С-4), 39,9 /3'N(CH3)2/, 36.8 (9a-NCH3), 27,7 (С-4'), Приклад 13 26,3 (С-8), 25,5 (6-СН3), 20,8 (8-СН3), 20,5 (С-14), 20,9 (5'-СН3), 15,7 (12-СН3), 15,8 (2-СН3), 10,5 (143-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-LСН3), 7,5 (4-СН3), 7,3 (10-СН3). рибогексопіранозил-окси)-11-O-метил-азитроміцин Приклад 15 3,6-гемікеталь Розчин 3-де(2,6-дидеокси-3-С-метил-3-О3-Де(2,6-дидеокси-3-С-метил-3-O-метил-a-Lрибогексопіранозил-окси)-3-окси-азитроміцин 2'-Ометил-a-L-рибогексопіранозил-окси)-11-О-метилацетат азитроміцин 3,6-гемікеталь 2'-О-ацетату (0,6г) До розчину 3-де(2,6-дидеокси-3-С-метил-3-ОПрикладу 12 в метанолі (40мл) залишали стояти впродовж 24 годин при кімнатній температурі. Меметил-a-L-рибогексопіранозил-окси)-3-окситанол випарювали за пониженого тиску, одержаазитроміцину (10г) Прикладу ІЧ в СН 2Сl2 (150мл), ний залишок (0,53г) очищали хроматографією нидодавали NaHCO3 (5,84г) та ангідрид оцтової кисзького тиску на силікагельній колонці, лоти (1,68мл). Реакційну суміш перемішували провикористовуючи систему метиленхлорид-метанолтягом 12 годин при кімнатній температурі, залишаконц. аміак, 90:9:1,5. Випарюючи об'єднані екстрали стояти протягом ночі і потім виділяли згідно з кти з Rf 0,670, одержували 0,22г хроматографічно способом, описаним в Прикладі 5, з одержанням однорідного 3-де(2,6-дидеокси-3-Ометил-3-О11,21г аморфного осаду з такими фізико-хімічними константами: метил-a-L-рибогексопіранозил-окси)-11-О-метилТШХ Етилацетат-триетиламін, 95:5 Rf 0,547 азитроміцин 3,6-гемікеталю з такими фізикоІЧ (KВr)см -1: 3485, 2973, 2937, 1748, 1716, хімічними константами: -1 1648, 1459, 1376, 1240, 1170, 1114, 1081, 1045, ІЧ (CDCl3)см : 3471, 2975, 1715, 1638, 1458, 1382, 1196, 1117, 1049, 1013, 963. 956. 1 1 Н ЯМР (300МГц, CDCl3) δ: 4,71 (Н-13), 4,79 Н ЯМР (300МГц, СОСІ3) δ: 5,01 (Н-13), 4,22 (Н-2'), 4,71 (Н-1'), 3,84 (Н-3), 3,61 (Н-5), 3,50 (Н-5'), (H-1'), 3,80 (Н-5), 3,50 (H-5') 3,45 (11-ОСН3), 3,25 3,68 (Н-11), 2,73 (Н-10), 2,70 (Н-2), 2,70 (Н-3'), 2,48 (Н-2'), 2,63 (Н-2), 2,49 (Н-3'), 2,77 (Н-9а), 2,29 (Н-9а), 2,27 (Н-4), 2,26 /3'N(CH3)2/, 2,36 (9a-NCH3), /3'N(CH3)2/, 2,20 (9а-NCH3), 2,24 (H-9b), 2,09 (Н-4), 1,85 (Н-8), 1,83 (Н-14а), 1,66 (Н-4'а), 1,73 (Н-14b), 2,07 (СOСН3), 2,05 (H-9b), 1,90 (Н-14а), 1,90 (Н-8), 1,78 (Н-4'а), 1,56 (Н-7а), 1,24 (Н-7b), 1,54 (Н-14b), 1,36 (6-СН3), 1,31 (2-СН3), 1,26 (H-4'b), 1,21 (5'1,23 (6-СН3), 1,29 (2-СН3), 1,32 (H-4'b), 1,24 (5'СН3), 1,25, (4-СН3), 1,01 (10-СН3), 1,03 (8-СН3), СН3), 1,11 (10-СН3), 1,06 (12-СН3), 0,90 (4-СН3), 0,81 (Н-СН3). 13 0,89 (8-СНз), 0,88 (14-СН3). С Я МР (75 МГц, CDCl3) δ: 177,0 (C-1), 106,2 (С-1'), 102,1 (С-3), 93,9 (С-5), 86,1 (С-11), 81,9 (С 27 71556 28 Приклад 16 68,5 (C-11), 66,4 (C-9), 65,3 (C-3'), 61,6 (C-10), 49,3 (C-2), 41,6 (C-7), 40,1 /3'N(CH 3)2/, 31,0 (C-8), 28,2 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lрибогексопіранозил-окси)-азитроміцин-3,6(C-4'), 26,4 (6-CH3), 20,8 (5'-CH 3), 13,6 (2-СНз), 12,6 (4-CH3), 11,4 (14-СН3). гемікеталь 2'-О-ацетат FAB-MS m/z 589 До розчину 3-де(2,6-дидеокси-3-С-метил-3-ОПриклад 18 метил-a-L-рибогексопіранозил-окси)-3-оксиЗ-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-Lазитроміцин 2'-О-ацетату (5,6г) Прикладу 15 в рибогексопхранозил-окси)-азитроміцин 3,6СН2Сl2 (100мл), додавали диметилсульфоксид гемікефаль 11,12-циклічний карбонат (12,34мл) та Ν,Ν-диметил-амінопропіл-етилДо розчину 3-де(2,6-дидеокси-3-С-метил-3-Окарбодіімід (15,05г). Реакційну суміш охолоджували до 15°С і потім, перемішуючи та підтримуючи метил-a-L-рибогексопіранозил-окси)-азитроміцин температуру на рівні 15°С, поступово краплями 3,6-гемікеталю (1г) Прикладу 17 в етилацетаті протягом 30 хвилин додавали розчин піридиній (30мл), додавали етиленкарбонат (0,5г) та карботрифторацетату (15,04г) в СН2СІ2 (30мл). Темпенат калію (0,5г), Реакційну суспензію перемішуваратур у реакційної суміші піднімали до кімнатної ли із зворотним холодильником впродовж 10 готемператури, продовжували перемішувати її ще 4 дин, залишали стояти 16 годин при кімнатній години і після цього продукт виділяли згідно з спотемпературі та потім фільтрували. Етилацетат собом, описаним в Прикладі 6, з одержанням 5,26г промивали насиченим розчином NaCl та водою, продукту заголовку. висушували над СаСl2, фільтрували і випарювали ТШХ Етилацетат-триетиламін, 95:5 Rf 0,675 з одержанням 1,05г маслянистого залишку. Після Приклад 17 поділу на силікагельній колонці, використовуючи систему метиленхлорид-метанол-конц. аміак, 3-Де(2,6-дидеокси-3-С-метил-3-О-метил-a-L90:9:0,5, одержали хроматографічно однорідний рибогексопіранозил-окси)-азитроміцин 3,6продукт заголовку з такими фізико-хімічними консгемікеталь тантами: Розчин 3-де(2,6-дидеокси-3-С-метил-3-ОТШХ Етилацетат-триетиламін, 95:5 Rf 0,514 метил-a-L-рибогексопіранозил-окси)-азитроміцинІЧ (CDCl3) см -1: 3498, 2975, 2941, 1812, 1724, 3,6-гемікеталь 2'-О-ацетату (5,2г) Прикладу 16 в 1638, 1459, 1381, 1359, 1333, 1292, 1234, 1173, метанолі (100мл) залишали стояти 16 годин при 1115, 1082, 1045, 1015, 966. кімнатній температурі, Метанол випарювали за 1 Н ЯМР (300 МГц, CDCl3) δ: 5,03 (Н-13), 4,61 пониженого тиску, і одержаний продукт очищали (Н-11), 4,23 (Н-1'), 3,73 (Н-5), 3,52 (Н-5'), 3,25 (Н-2'), хроматографією низького тиску на силікагельній 3,18 (Н-9а), 2,90 (Н-10), 2,54 (Н-2), 2,50 (Н-3'), 2,28 колонці, використовуючи систему метиленхлорид/3'N(CH3)2/, 2,10 (Н-4), 2,07 (9a-NCH3), 1,76 (Н-7а), метанол-конц. аміак, 90:9:1,5, Випарюючи об'єд1,95 (Н-8), 1,86 (Н-14a), 1,67 (H-4'a), 1,57 (H-9b), нані фракції з Rf 0,480, одержували хроматографі1,55 (H-14b), 1,45 (12-CH3), 1,37 (6-СН3), 1,30 (2чно однорідний 3-де(2,6-дидеокси-3-С-метил-3-ОСН3), 1,28 (H-4'b), 1,23 (5'-СН3), 1,24 (4-СН3), 1,13 метил-a-L-рибогек-сопіранозил-окси)-азитроміцин (Н-7b), 1,18 (10-СН3), 0,90 (8-СН3), 0,92 (14-СН3). 3,6-гемікеталь з такими фізико-хімічними констан13 С ЯМР (75 МГц, CDCl3) δ: 176,1 (С-1), 153,5 тами: С=О карбонат), 106,1 (С-1'), 101,6 (С-3), 93,6 (С-5), ТШХ Етилацетат - триетиламін, 95:5 Rf 0 4 47 83,7 (С-12), 82,7 (С-6), 78,9 (С-11), 77,9 (С-13), 69,6 ІЧ (CDCl3)см -1: 3468, 2976, 1713, 1638, 1459, (С-2'), 69,4 (С-5'), 63,6 (С-9), 65,3 (С-3'), 60,1 (С-10), 1382, 1197, 1116, 1068, 1049, 1014, 963. 1 49,9 (С-2), 46,6 (С-4), 41,8 (С-7), 40,0/3'N(CH3)2/, Н ЯМР (300МГц, CDCl3) δ: 4,94 (Н-13), 4,21 33,4 (9а-СН3), 28,0 (С-4'), 26,8 (С-8), 25,1 (6-СН3), (Н-1'), 3,74 (Н-5), 3,51 (Н-5')/ 3,23 (Н-2'), 2,57 (Н-2), 22,3 (С-14), 20,8 (5'-СН3), 19,4 (8-СН3), 14,1 (122,49 (Н-3'), 2,23 /3'N(CH3)2/, 2,06 (Н-4), 1,74 (Н-8), СН3), 13,9 (2-СН3), 12,1 (4-СН3), 12,9 (10-СНз), 10,1 1,67 (Н-4'а), 1,39 (6-СН3), 1,28 (2-СН3), 1,25 (H-4'b), (14-СН3). 1,22 (5'-СН3), 1,23, (4-СН3), 1,10 (10-СН3), 1,04 (8СН3), 0,92 (14-СН3). 13 С Я МР (75 МГц, CDCl3) δ: 176,9 (C-1), 106,1 (C-1'), 102,3 (C-3), 94,8 (C-5), 82,4 (C-6), 69,7 (C-2'), Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNew 3.6-hemiketals of the class of 9а-azalides
Назва патенту російськоюНовые 3,6-гемикетали из класса 9а-азалидов
МПК / Мітки
МПК: C07H 17/08, A61K 31/7042, A61K 31/7052, A61K 31/7048, A61P 31/04
Мітки: бактеріальних, 3,6-гемікеталі, інфекцій, лікування, основі, фармацевтична, композиція, спосіб, класу, 9а-азалідів, одержання
Код посилання
<a href="https://ua.patents.su/14-71556-36-gemiketali-z-klasu-9a-azalidiv-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-likuvannya-bakterialnikh-infekcijj.html" target="_blank" rel="follow" title="База патентів України">3,6-гемікеталі з класу 9а-азалідів, спосіб їх одержання, фармацевтична композиція на їх основі та спосіб лікування бактеріальних інфекцій</a>
Наступний патент: Ізопарафінові композиції як базові компоненти машинного мастила
Випадковий патент: Реактивна турбіна












