Спосіб одержання 5-гідрокси-4-тіометилпіразольної сполуки
Формула / Реферат
1. Спосіб одержання 5-гідрокси-4-тіометилпіразольної сполуки, який відрізняється тим, що включає: реакцію піразолу, представленого формулою (1):
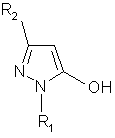 , (1)
, (1)
де R1 позначає атом водню, алкільну групу, ароматичну вуглеводневу групу, яка може мати замісник, або гетероциклічну групу, яка може мати замісник, і
R2 позначає електроноакцепторну групу із сірковмісною сполукою, представленою формулою (2):
X-S(O)n-R3, (2)
де X позначає атом водню або металу, R3 позначає алкільну групу, ароматичну вуглеводневу групу, яка може мати замісник, або гетероциклічну групу, яка може мати замісник, і n дорівнює 0 або 2, у присутності основи та формальдегіду, у результаті чого одержують 5-гідрокси-4-тіометилпіразольну сполуку, представлену формулою (3):
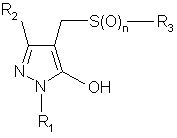 , (3)
, (3)
де R1, R2, R3 і n мають ті ж значення, що й вище.
2. Спосіб за п. 1, який відрізняється тим, що n дорівнює 0.
3. Спосіб за п. 1, який відрізняється тим, що n дорівнює 2.
4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що електроноакцепторною групою, представленою символом R2, є трифторметильна група.
5. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що у ньому електроноакцепторною групою, представленою символом R2, є ціаногрупа.
6. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що у ньому електроноакцепторною групою, представленою символом R2, є алкоксикарбонільна група, карбоксильна група або їх сіль із металом.
Текст
1. Спосіб одержання 5-гідрокси-4тіометилпіразольної сполуки, який відрізняється тим, що включає: реакцію піразолу, представленого формулою (1): R2 2 Даний винахід відноситься до способу одержання 5-гідрокси-4-тіометилпіразольної сполуки, яка використовується як проміжний продукт у виробництві фармацевтичних і сільськогосподарських хімічних продуктів. Отриману в даному винаході 5-гідрокси-4тіометилпіразольну сполуку використовують як проміжний продукт у виробництві фармацевтичних і сільськогосподарських хімічних продуктів. Для одержання 5-гідрокси-4тіометилпіразольної сполуки застосовують відо 3 83910 мий спосіб, при якому 4-хлорметилпіразольна сполука реагує із сірчистою сполукою (див. Патентний документ 1). 4-хлорметилпіразольна сполука, яка використовується як вихідний матеріал для цієї реакції, може бути отримана, наприклад, синтезом піразольної сполуки, яка має метильну груп у в положенні 4, за допомогою реакції циклізації відповідних складних b-кетоефірів з гідразинами, метильна група повинна бути перетворена в хлорметильну груп у шля хом хлорування. Далі, для одержання 4тіометилпіразольної сполуки необхідно, щоб вказана хлорметильна група прореагувала з якоюнебудь сіркоорганічною сполукою (див. Патентний документ 1). Однак такий метод не є задовільним як промисловий спосіб одержання 4тіометилпіразольної сполуки, оскільки реакція включає кілька стадій і вихід не є високим через складність проведення селективного моногалогенування метильної групи в положенні 4 піразолу. Що ж стосується способу одержання 4хлорметилпіразолу як вихідного матеріалу в описаному вище способі, відомий також спосіб прямого хлорметилювання піразольних сполук, не заміщених у положенні 4, (див. Непатентний документ 1). Однак цей спосіб проблематичний і є важко здійсненим як спосіб промислового виробництва, оскільки в процесі реакції утворюється побічний продукт - біс(хлорметиловий) ефір, який є канцерогенною речовиною. До того ж реакція прямого тіометилювання піразольних сполук не відома. [Патентний документ 1: Міжнародна патентна публікація WO 2004/013106] [Непатентний документ 1: Journal of Chemical Society, pp 1205-1208 (1955)] Виникла потреба в способі, у якому були б усун уті названі недоліки традиційних способів і за допомогою якого можна було б легко й просто одержувати 5-гідрокси-4-тіометилпіразольну сполуку з високим виходом. З огляду на цю потребу, автори даного винаходу почали інтенсивні дослідження способу одержання 5-гідрокси-4-тіометилпіразольної сполуки й у результаті цих досліджень несподівано виявили, що, коли 5-гідроксипіразольна сполука наведеної нижче формули (1) уводиться в реакцію із сірчистою сполукою наведеної нижче формули (2) у присутності основи й формальдегіду, утворюється 5гідрокси-4-тіометилпіразольна сполука наведеної нижче формули (3). Даний винахід був виконаний на основі цього відкриття. Відповідно до способу запропонованого даним винаходом, 5-гідрокси-4-тіометилпіразольна сполука, представлена формулою (3), може бути отримана з 5-гідроксипіразольної сполуки, представленої формулою (1), з високим виходом за одну стадію за допомогою простого методу в м'яких умовах без використання спеціального реакційного устаткування або дорогого каталізатора, або перехідного металу. У способі запропонованому даним винаходом практично не утворюються шкідливі відходи від каталізатора або перехідного металу й завдяки цьому спосіб є екологічно безпе 4 чним і характеризується високим ступенем промислової застосовності. Крім того, відповідно до втілення способу за даним винаходом, з використанням як розчинника води, пропонується ще більш екологічно безпечніший спосіб, який характеризується ще більш високим ступенем промислової застосовності. Даний винахід включає, як приклади, наступні втілення [1]-[6]. [1] Спосіб одержання 5-гідрокси-4тіометилпіразольної сполуки, який включає: реакцію піразолу, представленого формулою [1]: де R1 позначає атом водню, алкільну групу, ароматичну (1) вуглеводневу гр уп у, яка може мати замісник, або гетероциклічну груп у, яка може мати замісник, і R2 позначає електроноакцепторну груп у з сірчистою сполукою, представленою формулою [2]: X-S(0)n-R3 (2) де X позначає атом водню або металу, R3 позначає алкільну групу, ароматичну вуглеводневу груп у, яка може мати замісник, або гетероциклічну груп у, яка може мати замісник, і n дорівнює 0 або 2, у присутності основи та формальдегіду, у результаті чого одержують 5-гідрокси-4тіометилпіразольну сполуку, представлену формулою [3]: (3) де R1, R2, R3 та n мають ті ж значення, що й описані вище. [2] Спосіб одержання 5-гідрокси-4тіометилпіразольної сполуки, який включає: реакцію піразолу, як описано в [1], де n дорівнює 0. [3] Спосіб одержання 5-гідрокситіометилпіразольної сполуки, який включає: реакцію піразолу, як описано в [1], де n дорівнює 2. [4] Спосіб одержання 5-гідрокси-4тіометилпіразольної сполуки, який включає: реакцію піразолу, як описано в кожному з [1]-[3], де електроноакцепторною групою, представленою R2, є трифторметильна група. [5] Спосіб одержання 5-гідрокси-4тіометилпіразольної сполуки, який включає: реакцію піразолу, як описано в кожному з [1]-[3], де електроноакцепторною групою, представленою R2, є ціанова група. [6] Спосіб одержання 5-гідрокси-4тіометилпіразольної сполуки, який включає: реакцію піразолу, як описано в кожному з [1]-[3], де електроноакцепторною групою, представленою R2, є алкоксикарбоксильна група, карбоксильна група або їхні солі з металами. 5 83910 Найкращий варіант здійснення винаходу Нижче даний винахід описаний у деталях. У наступному тексті, якщо не зазначено інакше, «частини» і «%», які позначають кількісні відношення, відносяться до маси. Спосіб одержання 5-гідрокси-4тіометилпіразольної сполуки Даний винахід відноситься до способу одержання 5-гідрокси-4-тіометилпіразольної сполуки, представленої формулою (3), який включає реакцію 5-гідроксипіразольної сполуки, представленої формулою (1), із сірчистою сполукою, представленою формулою (2), у присутності основи та формальдегіду. Ізомер 5-гідроксипіразольна сполука, представлена формулою (1), яку використовують як вихідний матеріал у даному винаході, і 5-гідрокси-4тіометилпіразольна сполука, представлена формулою (3), яка є продуктом, можуть бути представлені у формі кетоенольних таутомерів. У даному винаході сполуки вихідного матеріалу й продукту представлені структурами, що ґрунтуються на енольній формі як у формулах (1) і (3), але на практиці співвідношення компонентів кетоенольних та утомерів іноді змінюється в залежності, наприклад, від розчинника, що його використовують для розчинення сполуки, але навіть і в цьому випадку вихідний матеріал або продукт у способі даного винаходу включають обидва ізомери кетоенольної форми. 5-гідроксипіразольна сполука Нижче описується 5-гідроксипіразольна сполука, представлена формулою (1), яка використовується в даному винаході як вихідний матеріал. Спосіб одержання 5-гідроксипіразольної сполуки, представленої формулою (1), особливо не обмежений. Інакше кажучи, може бути використано будь-який спосіб, наведений у наступних прикладах, або ж також будь-який інший спосіб. Приклади методу синтезу Відносно методу синтезу 5-гідроксипіразольної сполуки можна згадати як приклад [Hiroshi Yamanaka et al., Hetero-Kan Kagobotsu no Kagaku (Хімія гетероциклічних сполук). Розділ 5, Kodansha Scientific (1988) і J.A. Joule and K. Mills, Handbook of Heterocyclic Chemistry (Посібник з гетероциклічних сполук). 2-е видання, Розділ 4.3.2.3, Pergamon (2000)]. Наприклад, спосіб проведення реакції b-кетоскладноефірної сполуки з гідразиновою сполукою і, більш конкретно, спосіб, при якому може бути синтезований 1-метил-5-гідрокси-3трифторметилпіразол з виходом 49% шляхом кип'ятіння зі зворотним холодильником етил-4,4,4трифторацетоацетату й метилгідразину з водним розчинником при нагріванні протягом 2 годин, опублікований в [Journal of Heterocyclic Chemistry, Vol.27, 243 (1990)]. Аналогічним чином, спосіб проведення реакції диефіра оксалооцтової кислоти з гідразиновою сполукою, у результаті чого одержують 3(алкоксикарбоніл)-5-гідроксипіразольну сполуку, і спосіб перетворення алкоксикарбонільної групи в отриманому сполуці в ціанову груп у докладно опи 6 сані в [Kокаі (публікація заявки за якою не проводилася) №10-287654]. Аналогічним чином, спосіб одержання 3-ціано5-гідроксипіразольної сполуки реакцією aціанобурштинової кислоти з діазонієвою сіллю описаний в [Kokoku (публікація заявки, яка пройшла експертизу) №51-33556]. Замісник R1 Для формули (1), яка представляє 5гідроксипіразольну сполуку, яка є вихідною сполукою у способі за даним винаходом, приклади замісника, позначеного символом R1 у формулі (1), включають наступні: (1) атом водню; (2) лінійна або розгалужена С 1-С6-алкільна група із числом атомів вуглецю від 1 до 6 (надалі, стосовно числа атомів вуглецю, наприклад, коли число атомів вуглецю становить від 1 до 6, буде просто використовуватися позначення « С1-С6»), така як метильна група, етильна група, нпропільна група, ізопропільна група, н-бутильна група, втор-бутильна група, трет-бутильна група, н-пентильна група й н-гексильна група; (3) ароматична вуглеводнева гр упа, моноциклічна або з конденсованими кільцями, із числом атомів, які утворюють кільце від 6 до 14, бажано від 6 до 10, така як фенільна група або нафтильна група; причому ароматична вуглеводнева група може мати один або більше замісників таких як групи, наведені нижче в (3.1)-(3.21): (3.1) атом галогену такого як бром, хлор, фтор і йод, (3.2) лінійна або розгалужена С 1-С6-алкільна група така як метильна група, етильна група, нпропільна група, ізопропільна група, н-бутильна група, втор-бутильна група, трет-бутильна група, н-пентильна група та н-гексильна група, (3.3) гідроксильна група, (3.4) лінійна або розгалужена С 1-С6 алкоксигрупа така як метокси-група, етокси-група, нпропокси-група та ізопропокси-група, (3.5) лінійна або розгалужена С 1-С6гідроксиалкільна група така як гідроксиметильна група й 1-гідроксиетильна група, (3.6) лінійна або розгалужена (С1-С6-алкокси) (С1-С6-алкіл) група така як метоксиметильна група, 1-метоксиетильна група й 1-етоксиетильна група, (3.7) лінійна або розгалужена С 1-С6галогеналкільна група така як фторметильна група, дифторметильна група та трифторметильна група, (3.8) карбоксильна група, (3.9) сіль карбоксильної групи з металом, яка є сіллю лужного металу, такою як натрієва сіль, калієва сіль, літієва сіль, і сіллю лужноземельного металу, такою як кальцієва сіль, барієва сіль і магнієва сіль, (3.10) лінійна або розгалужена (С1-С6алкокси)карбонільна група така як метоксикарбонільна група й етоксикарбонільна група, (3.11) арилкарбонільна група із числом утворюючих кільце атомів від 6 до 14, бажано від 6 до 10, така як бензоільна група та нафтоільна група, (3.12) гетероарилкарбонільна група, моноциклічна або з конденсованими кільцями, яка має від 7 83910 1 до 4 гетероатоми, обраних із групи, у яку входять атом азоту, атом кисню й атом сірки, із числом утворюючих кільце атомів від 5 до 14, переважно від 5 до 10, така як піридилкарбонільна група, тіенілкарбонільна група й фурилкарбонільна група, (3.13) нітрогрупа, (3.14) аміногрупа, (3.15) лінійна або розгалужена моно- або ди(С1-С6-алкіл) аміногрупа така як метиламіногрупа, диметиламіногрупа, етиламіногрупа та діетиламіногрупа, (3.16) лінійна або розгалужена (С1-С6-алкіл) карбоніламіногрупа така як ацетиламіногрупа, пропіоніламіногрупа та бутириламіногрупа, (3.17) лінійна або розгалужена гідроксикарбоніл-(С1-С6-алкіл) група така як гідроксикарбонілметильна група й 1-гідроксикарбонілетильна група, (3.18) лінійна або розгалужена (С1-С6алкокси)карбоніл - (С1-С6-алкіл) група така як метоксикарбонілметильна група та 1етоксикарбонілметильна група, (3.19) лінійна або розгалужена амінокарбоніл (С1-С6-алкіл) група така як амінокарбоніл (С1-С6алкіл) група така як амінокарбонілметильна група та 1-амінокарбонілетильна група, (3.20) лінійна або розгалужена (С1-С6-алкіл) амінокарбоніл - (С1-С6-алкіл) група така як метиламінокарбонілметильна група, 1метиламінокарбонілетильна група та 1етиламінокарбонілетильна група, і (3.21) ціаногрупа; (4) ароматична гетероциклічна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обрані із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, бажано від 5 до 10, і яка є, наприклад, фурильною групою, бензофурильною групою, піридильною групою, тіенільною групою, бензотіенільною групою, оксазолільною групою, бензоксазолільною групою, тіазолільною групою, бензотіазолільною групою, ізооксазолільною групою, піразильною групою, піримідинільною групою, індолільною групою, хінолінільною групою, піразолільною групою, імідазолільною групою, бензімідазолільною групою, тріазолільною групою та тріазинільною групою; причому ароматична гетероциклічна група може мати один або більше замісників таких як групи, наведені нижче в (4.1)-(4.19): (4.1) лінійна або розгалужена С 1-С6-алкільна група така як метильна група, етильна група, нпропільна група, ізопропільна група, н-бутильна група, втор-бутильна група, трет-бутильна група, н-пентильна група та н-гексильна група, (4.2) гідроксильна група, (4.3) лінійна або розгалужена С 1-С6 алкоксигрупа така як метокси-група, етокси-група, нпропокси-група та ізопропокси-група, (4.4) лінійна або розгалужена С 1-С6гідроксиалкільна група така як гідроксиметильна група та 1-гідроксиетильна група, (4.5) лінійна або розгалужена (С1-С6-алкокси) (С1-С6-алкіл) група така як метоксиметильна група, метоксиетильна група та етоксиетильна група, 8 (4.6) лінійна або розгалужена С 1-С6галогеналкільна група така як фторметильна група, дифторметильна група та трифторметильна група, (4.7) карбоксильна група, (4.8) сіль карбоксильної групи з, металом, яка є сіллю лужного металу, такою як натрієва сіль, калієва сіль, літієва сіль, і сіллю лужноземельного металу, такою як кальцієва сіль, барієва сіль і магнієва сіль, (4.9) лінійна або розгалужена (С1-С6алкокси)карбонільна група така як метоксикарбонільна група та етоксикарбонільна група, (4.10) атом галогену такий як бром, хлор, фтор і йод, (4 11) нітрогрупа, (4.12) аміногрупа, (4.13) лінійна або розгалужена моно- або ди(С1-С6-алкіл)аміногрупа така як метиламіногрупа, диметиламіногрупа, етиламіногрупа та диетиламіногрупа, (4.14) лінійна або розгалужена (С1-С6алкіл)карбоніламіногрупа така як ацетиламіногрупа, пропіоніламіногрупа та бутириламіногрупа, (4.15) ціаногрупа, (4.16) формільна група, (4.17) лінійна або розгалужена (С1-С6алкіл)карбонільна група така як метилкарбонільна група та етилкарбонільна група, (4.18) арилкарбонільна група із числом утворюючих кільце атомів від 6 до 14, бажано від 6 до 10, така як бензоільна група та нафтоільна група, і (4.19) гетероарилкарбонільна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, бажано від 5 до 10, така як піридилкарбонільна група, тіенілкарбонільна група та фурилкарбонільна група. (5) неароматична гетероциклічна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраними із групи, до якої входять атом азоту, а том кисню та атом сірки, із числом утворюючи х кільце атомів від 5 до 14, бажано від 5 до 10, яка є, наприклад, гідрофурильною групою, піранільною групою, тіоранільною групою, тіанільною групою, піролидинільною групою, індолинільною групою, піперидинільною групою, імідазолидинільною групою та піперазинільною групою; причому неароматична гетероциклічна група може мати один або більше замісників таких як групи, наведені нижче в (5.1)(5.19): (5.1) лінійна або розгалужена С 1-С6-алкільна група така як метильна група, етильна група, нпропільна група, ізопропільна група, н-бутильна група, втор-бутильна група, трет-бутильна група, н-пентильна група та н-гексильна група, (5.2) гідроксильна група, (5.3) лінійна або розгалужена С 1-С6 алкоксигрупа така як метокси-група, етокси-група, нпропокси-група та ізопропокси-група, (5.4) лінійна або розгалужена С 1-С6гідроксиалкільна група така як гідроксиметильна група та гідроксиетильна група, 9 83910 (5.5) лінійна або розгалужена (С1-С6-алкокси) (С1-С6-алкіл) група така як метоксиметильна група, метоксиетильна група та етоксиетильна група, (5.6) лінійна або розгалужена С 1-С6галогеналкільна група така як фторметильна група, дифторметильна група та трифторметильна група, (5.7) карбоксильна група, (5.8) сіль карбоксильної групи з металом, яка є сіллю лужного металу, такою як натрієва сіль, калієва сіль, літієва сіль, і сіллю лужноземельного металу, такою як кальцієва сіль, барієва сіль і магнієва сіль, (5.9) лінійна або розгалужена (С1-С6алкокси)карбонільна група така як метоксикарбонільна група та етоксикарбонільна група, (5.10) атом галогену такий як бром, хлор, фтор і йод, (5.11) нітрогрупа, (5.12) аміногрупа, (5.13) лінійна або розгалужена моно- або ди(С1-С6-алкіл)аміногрупа така як метиламіногрупа, диметиламіногрупа, етиламіногрупа та диетиламіногрупа, (5.14) лінійна або розгалужена (С1-С6алкіл)карбоніламіногрупа така як ацетиламіногрупа, пропіоніламіногрупа та бутириламіногрупа, (5.15) ціаногрупа, (5.16) формільна група, (5.17) лінійна або розгалужена (С1-С6алкіл)карбонільна група така як метилкарбонільна група та етилкарбонільна група, (5.18) арилкарбонільна група із числом утворюючих кільце атомів від 6 до 14, бажано від 6 до 10, така як бензоільна група та нафтоільна група, і (5.19) гетероарилкарбонільна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, бажано від 5 до 10, така як піридилкарбонільна група, тіенілкарбонільна група та фурилкарбонільна група. Кращий замісник R1 Через легку доступність серед описаних вище замісників підходящими для застосування як замісники R1 є наступні. Кращими є С1-С6-алкільні групи, представником яких є метил, і ароматичні вуглеводневі групи із числом утворюючих кільце атомів від 6 до 14, представником яких є феніл, причому метильна група та фенільна група є найкращими. Електроноакцепторна група R2 Електроноакцепторною групою, представленою у формулі (1) символом R2, називають атомну груп у, здатну відтягати електрон від іншої частини за рахунок індуктивного ефекту, причому таку атомну групу має ароматична вуглеводнева група або ж таку атомну груп у має ароматична гетероциклічна група. До числа конкретних прикладів електроноакцепторних груп R2 входять наступні групи: (1) лінійна або розгалужена С1-С6галогеналкільна група така як дифторметильна група та трифторметильна група; карбоксильна група або сіль карбоксильної групи з металом, яка 10 є сіллю лужного металу, такою як натрієва сіль, калієва сіль, літієва сіль, і сіллю лужноземельного металу, такою як кальцієва сіль, барієва сіль і магнієва сіль; (2) лінійна або розгалужена (С1-С6алкокси)карбонільна група така як метоксикарбонільна група та етоксикарбонільна група; (3) атом галогену такий як бром, хлор, фтор і йод; нітрогрупа; формільна група; (4) лінійна або розгалужена (С1-С6алкіл)карбонільна група така як метилкарбонільна група (ацетильна група) і етилкарбонільна група; (5) арилкарбонільна група із числом утворюючих кільце атомів від 6 до 14, переважно від 6 до 10, така як бензоільна група та нафтоільна група; (6) гетероарилкарбонільна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, переважно від 5 до 10, така як піридилкарбонільна група, тіенілкарбонільна група та фурилкарбонільна група; (7) амінокарбонільна група, лінійна або розгалужена моно-або ди(С1-С6-алкіл) амінокарбонільна група така метиламінокарбонільна група та диметиламінокарбонільна група; ціаногрупа; (8) ароматична вуглеводнева група, яка містить як замісник одну або більше атомних гр уп, здатних відтягати електрон від іншої частини за рахунок індуктивного ефекту, із числом утворюючих кільце атомів від 6 до 14, переважно від 6 до 10, така як хлорфенільна група (наприклад, 2,4дихлорфеніл), карбоксифенільна група та нітрофенільна група; і (9) гетероциклічна група, моноциклічна або з конденсованими кільцями, яка містить як замісник одну або більше атомних груп, здатних відтягати електрон від іншої частини за рахунок індуктивного ефекту, і має до 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючи х кільце атомів від 5 до 14, бажано від 5 до 10, така як хлорфурильна група, хлорбензофурильна група, хлорпіридильна група, хлортіенільна група, карбоксибензотіенільна група, нітрооксазолільна група, ціанобензооксазолільна група, хлортіазолільна група, хлорбензотіазолільна група, ацетилізооксазолільна група, бензоілтіадіазолільна група, хлорпіразильна група, хлорпіримідинільна група, хлоріндолільна група, хлорхінолінільна група, амінокарбонілпіразолільна група, метиламінокарбонілімідазолільна група, трифторметилбензоімідазолільна група, метоксикарбонілтріазолільна група та хлортріазинільна група. Краща електроноакцепторна група R2 З огляду на стійкість в умовах реакції, тобто в присутності основи, і кінцеву стабільність виходу серед описаних ви ще електроноакцепторних гр уп R2 бажаним є використання наступних: Кращою є С1-С6-галогеналкільна група, представником якої є трифторметил; ароматична вуглеводнева група, яка містить як замісник одну або більше атомних груп, здатних відтягати електрон від іншої частини за рахунок індуктивного ефекту, 11 83910 із числом утворюючих кільце атомів від 6 до 14, представником якої є 2,4-дихлорфеніл; і ціаногрупа; та найкращими є трифторметильна група, 2,4дихлорфеніл і ціаногрупа. Краща 5-гідроксипіразольна сполука Відповідно, конкретні приклади 5гідроксипіразольної сполуки, представленої формулою 1, включають 5-гідрокси-3трифторметилпіразол, 3-етоксикарбоніл-5гідроксипіразол, 3-ацетил-5-гідроксипіразол, 3бензоіл-5-гідроксипіразол, 5-гідрокси-3-(3піридилкарбоніл)піразол, 3-ціано-5гідроксипіразол, 5-гідрокси-1-метил-3трифторметилпіразол, 3-етоксикарбоніл-5гідрокси-1-метилпіразол, 3-хлор-5-гідрокси-1метилпіразол, 5-гідрокси-1-метил-3-нітропіразол, 5-гідрокси-1-метил-3-(2-тіенілкарбоніл)піразол, 5гідрокси-1-метил-3-(3-піридилкарбоніл)піразол, 3диметиламінокарбоніл-5-гідрокси-1-метилпіразол, 5-гідрокси-1-метил-3-(4трифторметилфеніл)піразол, 3-(4етоксикарбонілфеніл)-5-гідрокси-1-метилпіразол, 3-(2,4-дихлорфеніл)-5-гідрокси-1-метилпіразол, 3(3,5-динітрофеніл)-5-гідрокси-1-метилпіразол, 3-(4диметиламінокарбоніл)-5-гідрокси-1метилфенілпіразол, 5-гідрокси-1-н-пропіл-3трифторметилпіразол, 3-ціано-1-н-гексил-5гідроксипіразол, 1-трет-бутил-5-гідрокси-3трифторметилпіразол, 1-трет-бутил-3-(4carbxypntnel)-5-гідроксипіразол, 3-(4-ацетилфеніл)трет-бутил-5-гідроксипіразол, 1-трет-бутил-3-(4ціанофеніл)-5-гідроксипіразол, 5-гідрокси-1-феніл3-трифторметилпіразол, 3-ціано-5-гідрокси-1фенілпіразол, 1-(4-хлорфеніл)-3-етоксикарбоніл-5гідроксипіразол, 3-етоксикарбоніл-5-гідрокси-1-(2метилфеніл)піразол, 3-етоксикарбоніл-5-гідрокси1-(2-метоксиметилфеніл)піразол, 1-(4ацетилфеніл)-3-етоксикарбоніл-5-гідроксипіразол, 3-етоксикарбоніл-5-гідрокси-1-(3нітрофеніл)піразол, 5-гідрокси-1-(2-метоксифеніл)3-трифторметилпіразол, 5-гідрокси-3трифторметил-1-(4-трифторметилфеніл)піразол, 1-(4-етоксикарбонілфеніл)-5-гідрокси-3трифторметилгііразол, 1-(4-диметиламінофеніл)-5гідрокси-3-трифторметилпіразол, 1-(4ацетиламінофеніл)-5-гідрокси-3трифторметилпіразол, 1-(4метоксикарбонілметилфеніл)трифторметилпіразол, 1-(4диметиламінокарбонілметилфеніл)-5-гідрокси-3трифторметилпіразол, 1-(4-ціанофеніл)-5-гідрокси3-трифторметилпіразол, 1-(2-нафтил)-5-гідрокси-3трифторметилпіразол, 1-(2-бензотіазоліл)-5гідрокси-3-трифторметилпіразол, 5-гідрокси-1-(2піридил)-3-трифторметилпіразол і 5-гідрокси-1-(2піримідил)-3-трифторметилпіразол. Сірчиста сполука Нижче описане сірчиста сполука, представлена формулою (2). До числа прикладів замісника, представленого символом R3 у формулі (2), входять наступні: (1) лінійна або розгалужена С 1-С6-алкільна група така як метильна група, етильна група, нпропільна група, ізопропільна група, н-бутильна група, втор-бутильна група, трет-бутильна група, 12 н-пентильна група та н-гексильна група; ароматична вуглеводнева група, моноциклічна або з конденсованими кільцями, із числом утворюючих кільце атомів від 6 до 14, бажано від 6 до 10, така як фенільна група або нафтільна група (ароматична вуглеводнева група може мати один або більше замісників, наприклад лінійну або розгалужену С 1С6-алкільну групу таку як метильна група, етильна група, н-пропільна група, ізопропільна група, нбутильна група, втор-бутильна група, третбутильна група, н-пентильна група та н-гексильна група), (2) гідроксильна група, (3) лінійна або розгалужена С 1-С6-алкоксигрупа така як метокси-група, етокси-група, нпропокси-група та ізопропокси-група, (4) лінійна або розгалужена С 1-С6гідроксиалкільна група така як гідроксиметильна група та гідроксиетильна група, (5) лінійна або розгалужена (С1-С6-алкокси) (С1-С6-алкіл) група така як метоксиметильна група, метоксиетильна група та етоксиетильна група, (6) лінійна або розгалужена С 1-С6галогеналкільна група така як фторметильна група, дифторметильна група та трифторметильна група; карбоксильна група, сіль карбоксильної групи з металом, яка є сіллю лужного металу, такою як натрієва сіль, калієва сіль, літієва сіль, і сіллю лужноземельного металу, такою як кальцієва сіль, барієва сіль і магнієва сіль, (7) лінійна або розгалужена (С1-С6-алкокси) карбонільна група така як метоксикарбонільна група та етоксикарбонільна група, (8) атом галогену такий як бром, хлор, фтор і йод; нітрогрупа та аміногрупа, (9) лінійна або розгалужена моно- або ди(С1С6-алкіл)аміногрупа така як метиламіногрупа, диметиламіногрупа, етиламіногрупа та диетиламіногрупа, (10) лінійна або розгалужена (С1-С6алкіл)карбоніламіногрупа така як ацетиламіногрупа, пропіоніламіногрупа та бутириламіногрупа; ціаногрупа, формільна група, (11) лінійна або розгалужена (С1-С6-алкіл) карбонільна група така як метилкарбонільна група та етилкарбонільна група, (12) арилкарбонільна група із числом утворюючих кільце атомів від 6 до 14, бажано від 6 до 10, така як бензоільна група та нафтоільна група, і (13) гетероарилкарбонільна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, бажано від 5 до 10, така як піридилкарбонільна група, тіенілкарбонільна група та фурилкарбонільна група та (14) ароматична або неароматична гетероциклічна група, яка включає моноциклічну ароматичну груп у або ароматичну груп у з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючи х кільце атомів від 5 до 14, бажано від 5 до 10, які є, наприклад, фурильною групою, бензофурильною групою, піри 13 83910 дильною групою, тіенільною групою, бензотіенільною групою, оксазолільною групою, тіадіазолільною групою, піразильною групою, піримідинільною групою, індолільною групою, хінолінільною групою, піразолільною групою, імідазолільною групою, бензімідазолільною групою, тріазолільною групою та тріазинільною групою; ароматична гетероциклічна група може мати один або більше замісників, наприклад лінійну або розгалужену С 1-С6-алкільну груп у таку як метильна група, етильна група, нпропільна група, ізопропільна група, н-бутильна група, втор-бутильна група, трет-бутильна група, н-пентильна група та н-гексильна група, (15) гідроксильна група, (16) лінійна або розгалужена С 1-С6 алкоксигрупа така як метокси-група, етокси-група, нпропокси-група та ізопропокси-група, (17) лінійна або розгалужена С 1-С6гідроксиалкільна група така як гідроксиметильна група та гідроксиетильна група, (18) лінійна або розгалужена (С1-С6-алкокси) (С1-С6-алкіл) група така як метоксиметильна група, метоксиетильна група та етоксиетильна група, (19) лінійна або розгалужена С 1-С6галогеналкільна група така як фторметильна група, дифторметильна група та трифторметильна група, (20) карбоксильна група або сіль карбоксильної групи з металом, яка є сіллю лужного металу, такою як натрієва сіль, калієва сіль, літієва сіль, і сіллю лужноземельного металу, такою як кальцієва сіль, барієва сіль і магнієва сіль, (21) лінійна або розгалужена (С1-С6-алкокси) карбонільна група така як метоксикарбонільна група та етоксикарбонільна група, (22) атом галогену такий як бром, хлор, фтор і йод; нітрогрупа та аміногрупа, (23) лінійна або розгалужена моно- або ди(С1С6-алкіл)аміногрупа така як метиламіногрупа, диметиламіногрупа, етиламіногрупа та диетиламіногрупа, (24) лінійна або розгалужена (С1-С6-алкіл) карбоніламіногрупа така як ацетиламіногрупа, пропіоніламіногрупа та бутириламіногрупа; ціаногрупа, формільна група, (25) лінійна або розгалужена (С1-С6-алкіл) карбонільна група така як метил карбонільна група та етилкарбонільна група, (26) арилкарбонільна група із числом утворюючих кільце атомів від 6 до 14, бажано від 6 до 10, така як бензоільна група та нафтоільна група, і (27) гетероарилкарбонільна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, бажано від 5 до 10, така як піридилкарбонільна група, тіенілкарбонільна група та фурилкарбонільна група та неароматична гетероциклічна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, бажано від 5 до 10, яка є, наприклад, гідрофурильною групою, піранільною групою, тіоарильною групою, 14 тіанільною групою, піролідинільною групою, індолінильною групою, піперидинільною групою, імідазолідинільною групою та піперазинільною групою (неароматична гетероциклічна група може мати один або більше замісників, наприклад лінійну або розгалужену С1-С6-алкільну гр упу таку як метильна група, етильна група, н-пропільна група, ізопропільна група, н-бутильна група, втор-бутильна група, трет-бутильна група, н-гіентильна група та нгексильна група) і гідроксильна група, (28) лінійна або розгалужена С 1-С6-алкоксигрупа така як метокси-група, етокси-група, нпропокси-група та ізопропокси-група, (29) лінійна або розгалужена С 1-С6гідроксиалкільна група така як гідроксиметильна група та гідроксиетильна група, () лінійна або розгалужена (С1-С6-алкокси) (С1-С6-алкіл) група така як метоксиметильна група, метоксиетильна група та етоксиетильна група, (30) лінійна або розгалужена С 1-С6галогеналкільна група така як фторметильна група, дифторметильна група та трифторметильна група; карбоксильна група, сіль карбоксильної групи з металом, яка є сіллю лужного металу, такою як натрієва сіль, калієва сіль, літієва сіль, і сіллю лужноземельного металу, такою як кальцієва сіль, барієва сіль і магнієва сіль, (31) лінійна або розгалужена (С1-С6алкокси)карбонільна група така як метоксикарбонільна група та етоксикарбонільна група, (32) атом галогену такий як бром, хлор, фтор і йод; нітрогрупа та аміногрупа, (33) лінійна або розгалужена моно- або так(С1С6-алкіл)аміногрупа така як метиламіногрупа, диметиламіногрупа, етиламіногрупа та диетиламіногрупа, (34) лінійна або розгалужена (С1-С6алкіл)карбоніламіногрупа така як ацетиламіногрупа, пропіоніламіногрупа та бутириламіногрупа; ціаногрупа, формільна група, (35) лінійна або розгалужена (С1-С6алкіл)карбонільна група така як метилкарбонільна група та етилкарбонільна група, (36) арилкарбонільна група із числом утворюючих кільце атомів від 6 до 14, бажано від 6 до 10, така як бензоільна група та нафтоільна група, і (37) гетероарилкарбонільна група, моноциклічна або з конденсованими кільцями, яка має від 1 до 4 гетероатоми, обраних із групи, до якої входять атом азоту, атом кисню та атом сірки, із числом утворюючих кільце атомів від 5 до 14, бажано від 5 до 10, така як піридилкарбонільна група, тіенілкарбонільна група та фурилкарбонільна група. Група X X у формулі (2) є, наприклад, атомом водню або атомом металу, зокрема, наприклад, лужним металом, таким як натрій, калій і літій, і лужноземельним металом таким як магній і кальцій. У тому випадку, коли n у формулі (2) дорівнює 0, сполука є тіолом або його сіллю, а коли n дорівнює 2, сполука є сульфіновою кислотою або її сіллю. У призначеній для використання в реакції сірчистій сполуці, представленій формулою (2), X може бути атомом водню або сіллю лужного мета 15 83910 лу такого як натрій, калій і літій або сіллю лужноземельного металу такого як магній і кальцій. Крім того, у тому випадку, коли сірчистою сполукою є тіол (сполука формули (2) при n рівному 0), попередник, з якого можна одержати тіол і представником якого є ізотіоуронієва сіль або подібні до неї сполуки, легко одержувана реакцією відповідного алкілгалогеніду з тіосечовиною, може бути гідролізовано в тому же самому реакційному апараті, завдяки якому в системі може бути отримано і використаний вихідний матеріал для одержання тіола. Конкретний приклад сірчистої сполуки Відповідним чином, до числа конкретних прикладів сірчистої сполуки, представленої формулою (2), входять тіометоксид натрію, тіоетоксид натрію, 2-тіобутан, тіофенол, 2-етилтіофенол, 4метокситіофенол, 4-хлортіофенол, 4нітротіофенол, 4-диметиламінотіофенол, 4ціанотіофенол, 4-ацетилтіофенол, 2меркаптопіридин, 2-меркаптобензотіазол, ізотіоуронієва сіль, представниками якої є гідрохлорид нгексилтіокарбоксамідину, гідрохлорид бензилтіокарбоксамідину та гідрохлорид [5,5-диметил(4,5дигідроізооксазол-З-іл)]тіокарбоксамідину, бензолсульфінат натрію й п-толуолсульфінат натрію. Спосіб проведення реакції Нижче описаний спосіб проведення реакції 5гідроксипіразольної сполуки, представленої формулою (1), із сірчистою сполукою, представленою формулою (2), у результаті чого одержують 5гідрокси-4-тіометилпіразольну сполуку, представлену формулою (3). Формальдегід Описану вище реакцію проводять у присутності формальдегіду. Форма формальдегіду, яку використовують в цій реакції, особливо не обмежена і формальдегід може бути використаний у будьякій формі, однак зручнішим та кращим для роботи є використання водного розчину формальдегіду в концентрації від 35 до 50%, наприклад, легкодоступного комерційного 35%-ного формаліну або параформальдегіду (полімеру формальдегіду, який утворює у системі формальдегід у результаті гідролізу та, отже, може бути використаний як еквівалент формальдегіду). Необхідна для використання кількість Кількість формальдегіду достатню для використання, розраховують на еквівалент вихідної сполуки, представленої формулою (1), але зазвичай необхідна кількість становить від 1,0 до 5,0 еквівалентів, краще від 1,0 до 3,0 еквівалентів на 1моль вихідної сполуки, представленої формулою (1). Кількість використаної сірчистої сполуки, представленої формулою (1), може бути достатньою, якщо вона є еквівалентною або більшою за еквівалентну, розраховуючи на вихідну сполуку формули (1), але кількість, що її використовують становить від 1,0 до 2,0 еквівалентів, краще від 1,0 до 1,2 еквівалентів на 1моль вихідної сполуки, представленої формулою (1). Основа У даному винаході реакція проводиться у присутності основи. Серед прикладів основи, призна 16 ченої для використання в реакції, є наступні основи: (1) гідрид лужного металу такий як гідрид натрію, гідрид калію та гідрид літію; (2) лужний метал такий як металевий натрій, металевий калій і металевий літій; (3) гідроксид лужного металу такий як гідроксид натрію, гідроксид калію та гідроксид літію; (4) гідроксид лужноземельного металу такий як гідроксид барію, гідроксид магнію та гідроксид кальцію; (5) карбонат лужного металу такий як карбонат натрію, карбонат калію; гідрокарбонат натрію та гідрокарбонат калію; (6) неорганічна основа, представником якої є, наприклад, оксид лужноземельного металу такий як оксид барію, оксид магнію та оксид кальцію; і алкоксид металу такий як метоксид натрію, етоксид натрію, метоксид калію, етоксид калію, третбутоксид калію; і (7) неорганічна основа, представником якої є, наприклад, лужний метал такий як бутиллітій. З названих сполук гідроксид лужного металу та алкоксид металу є кращими завдяки їхній доступності, але найкращий з них гідроксид лужного металу, зокрема гідроксид натрію, оскільки реакція може проводитися з водним розчинником і, отже, можна зменшити таку обтяжливу операцію як доочищення стічних вод. Необхідна для використання кількість основи Може бути використана будь-яка кількість основи, якої буде досить для задовільного протікання реакції, але ця використана кількість становить, наприклад, від 1,0 до 20моль, бажано від 1,5 до 10моль і, найкраще, від 1,5 до 3,0моль на 1моль 5гідроксипіразольної сполуки (вихідної сполуки), представленої формулою (1). Розчинник Реакцію даного винаходу за бажання можна проводити в присутності розчинника. Розчинник, який використовують у реакції може бути задовільним, якщо він не інгібує реакцію, і до числа його прикладів входять вода; спирти такі як метанол і етанол; ароматичні вуглеводні такі як толуол, ксилол і хлорбензол; галогеновані аліфатичні вугле водні такі як дихлорметан і хлороформ; апротонні полярні розчинники такі як диметилформамід, диметилацєтамід, н-метилпіролідон, тетраметилсечовина, гексаметилфосфортриамід (НМРА) і пропіленкарбонат; сполуки на основі простих ефірів такі як діетиловий ефір, тетрагідрофуран і діоксан; і аліфатичні вуглеводні такі як пентан і н-гексан. Ці розчинники можуть бути використані окремо або у вигляді змішаного розчинника при довільному співвідношенні компонентів суміші. З точки зору розчинності та реакційної здатності основи, реакцію бажано проводити з використанням води або спиртів і краще у воді або метанолі. Кількість розчинника може вважатися достатньою, якщо вона дозволяє задовільним чином перемішувати реакційну систему, але зазвичай ця кількість становить від 0,05 до 10л, а краще, від 0,5 до 2л на 1моль 5-гідроксипіразольної сполуки (вихідної сполуки), представленої формулою (1). 17 83910 Умови реакції Температура обговорюваної реакції може варіювати, наприклад, від 0°С до температури кипіння застосованого розчинника, але бажано реакцію проводити за температури від 20 до 50°С, зокрема за кімнатної температури, застосовуючи перемішування, оскільки це легко може бути здійснено та приводить до високого виходу. Час обговорюваної реакції особливо не обмежується, але зазвичай реакція може бути задовільно завершена протягом часу від 1 до 10 годин. Відповідно до обговорюваної реакції, 5гідрокси-4-тіометилпіразольна сполука, представлена формулою (3), може бути отримана з високим виходом простим і легким шляхом у м'я ких умовах. Одержувана 5-гідрокси-4тіометилпіразольна сполука, представлена формулою (3), є сполукою, яку використовують як проміжний продукт у виробництві фармацевтичних і сільськогосподарських хімічних продуктів. Приклади Спосіб одержання сполуки даного винаходу детально описаний нижче на основі прикладів, однак винахід не обмежується цими прикладами. Посилальний приклад 1 Синтез 5-гідрокси-1-метил-3трифторметилпіразолу Етил-4,4,4-трифторацетоацетат (92,1г, 0,5моль) розчиняють в 60,1г (1,0моль) оцтової кислоти. Отриманий розчин охолоджують до 10°С або нижче при перемішуванні та додають до нього краплинами протягом 1 години 65,8г (0,5моль) 35%-ного водного розчину метилгідразину. Після додавання краплинами розчин перемішують 1 годину за кімнатної температури та потім 5 годин за температури 80°С. Після завершення реакції реакційний розчин охолоджують до кімнатної температури та додають до нього 150мл толуолу, 600мл води та 48г (1,2моль) гідроксиду натрію. Після розшарування рідини до отриманого водного шару додають краплинами 154г (1,4моль) 35%-ної хлористоводневої кислоти та збирають за допомогою фільтрації кристали, що утворилися. Кристали двічі промивають 50мл води та сушать у гарячеповітряній сушарці, одержуючи 71,8г (вихід 86,5%) цільової сполуки у вигляді блідо-жовтих кристалів. LC-MS (ЕІ) (хромас-спектрометрія з електронною іонізацією): m/z=166 (М+), т.пл. 179-180°С. Посилальний приклад 2 Синтез 5-гідрокси-1-метил-3трифторметилпіразолу Етил-4,4,4-трифторацетоацетат (18,4г, 0,1моль) розчиняють в 12,0г (0,2моль) оцтової кислоти. Отриманий розчин охолоджують до 10°С або нижче при перемішуванні та додають до нього краплинами протягом 0,5 години 11,8г (0,11моль) фенілгідразину. Після додавання краплинами розчин перемішують 1 годину за кімнатної температури та потім 5 годин за температури 80°С. Після завершення реакції реакційний розчин охолоджують до кімнатної температури та додають до нього 100мл води. Кристали, що утворилися, збирають за допомогою фільтрації, двічі промивають 50мл води та суша ть у гарячеповітряній сушарці, одер 18 жуючи 22,3г (вихід 98,0%) цільової сполуки у вигляді блідо-жовтих кристалів. LC-MS (ЕІ): m/z=228 (М+), т.пл. 190-192°С. Посилальний приклад 3 Синтез гідрохлориду 5-гідрокси-3трифторметилпіразолу: Етил-4,4,4-трифторацетоацетат (18,4г, 0,1моль) розчиняють в 20мл етанолу. Отриманий розчин охолоджують до 10°С або нижче при перемішуванні та додають до нього краплинами протягом 0,5 години 6,0г (0,12моль) гідразину. Після додавання краплинами розчин перемішують 1 годину за кімнатної температури та потім 5 годин за температури кипіння. Після завершення реакції реакційний розчин охолоджують до кімнатної температури та додають до нього 100мл води та 20,6г (0,2моль) 35%-ної хлористоводневої кислоти. Кристали, які утворилися, збирають за допомогою фільтрації, двічі промивають 10мл води та сушать у гарячеповітряній сушарці, одержуючи 12,8г (вихід 68,1%) цільової сполуки у вигляді білих кристалів. LC-MS (El): m/z=152 (M+). Посилальний приклад 4 Синтез 3-етоксикарбоніл-5-гідрокси-1метилпіразолу Мононатрієву сіль диетилоксалоацетата (50,0г, 0,24моль) суспендують в 500мл етанолу та додають 25мл оцтової кислоти. Потім протягом 0,5 години додають краплинами при перемішуванні 15г (0,33моль) 97%-ного метилгідразину. Після додавання краплинами розчин перемішують 1 годину за кімнатної температури та потім 5 годин за температури кипіння. Отриманий розчин охолоджують, видаляють етанол перегонкою при зниженому тиску та додають до залишку 200мл етилацетату та 100мл води. Після розшарування рідини отриманий водний шар повторно екстрагують 50мл етилацетату та об'єднаний етилацетатний шар промивають 50мл води та потім 50мл насиченого сольового розчину. Отриманий етилацетатний шар висушують над безводним сульфатом натрію та видаляють розчинник перегонкою при зниженому тиску. Після додавання до кристалів, які випали, 100мл води, кристали збирають із допомогою фільтрації, двічі промивають 10мл води та сушать у гарячеповітряній сушарці, одержуючи 29,2г (вихід 71,8%) цільової сполуки у вигляді блідо-жовтих кристалів. LC-MS (ЕІ): m/z=170 (М+), 125 (основа), т.пл. 151°С. Посилальний приклад 5 Синтез 3-ціано-5-гідрокси-1-фенілпіразолу До 5,6г (0,06моль) аніліну додають воду (120мл) і 15мл 35%-ної хлористоводневої кислоти та розчиняють суміш. Після цього додають краплинами 24мл води з розчиненими в ній 4,2г (0,06моль) нітриту натрію при перемішуванні та охолодженні льодом до 0-5°С. Отриманий розчин перемішують протягом 1 години з метою одержання хлориду бензолдіазонію. Водний розчин цієї діазонієвої солі додають краплинами до 120мл піридинового розчину, який містить 10,2г (0,06моль) діетил-a-ціаносукцината, при перемішуванні та охолодженні льодом. Після додавання 19 83910 краплинами розчин перемішують 1 годину при охолодженні льодом і потім 1 годину за кімнатної температури. Після завершення реакції додають 240мл 2%-ного водного розчину гідроксиду натрію та потім перемішують протягом 2 годин. Отриманий реакційний розчин додають краплинами до 240мл 35%-ної хлористоводневої кислоти при охолодженні льодом, збирають за допомогою фільтрації кристали, що випали, промивають їх 10мл води та суша ть у гарячеповітряній сушарці, одержуючи 8,4г неочищених кристалів цільової сполуки у вигляді червоно-коричневих кристалів. Неочищені кристали перекристалізовують із суміші диетиловий ефір/петролейний ефір і сушать у гарячеповітряній сушарці, одержуючи 5,7г (вихід 51,3%) цільової сполуки у вигляді блідо-жовтих кристалів. LC-MS (ЕІ): m/z=185 (М+), 125 (основа), т.пл. 190°С. Посилальний приклад 6 Синтез 3-(2,4-дихлорфеніл)-5-гідрокси-1метилпіразолу Етилмалонат калію (22,1г, 0,13моль) суспендують в 200мл етилацетату, після чого при перемішуванні та охолодженні льодом додають до суспензії послідовно 29,14г (0,29моль) триетиламіну та 13,7г (0,14моль) хлориду магнію. Отриману суспензійну рідину перемішують 6 годин при 40°С, знову охолоджують льодом і протягом 1 години додають краплинами 20,9г (0,1моль) 2,4дихлорбензоілхлориду, підтримуючи температуру реакційного розчину на рівні - 0°С або нижче. Після додавання краплинами перемішування продовжують протягом 12 годин за кімнатної температури. Потім до реакційного розчину додають краплинами 200мл 5%-ної хлористоводневої кислоти та відокремлюють органічний шар. Отриманий органічний шар двічі промивають 50мл води та потім 30мл насиченого сольового розчину та видаляють розчинник перегонкою при зниженому тиску. До отриманого концентруванням залишку додають 100мл етанолу. Розчин, який утворився, охолоджують до 10°С або нижче при перемішуванні та додають до нього краплинами протягом 1 години 13,1г (0,1моль) 35%-ного водного розчину метилгідразину. Після додавання краплинами розчин перемішують 1 годину за кімнатної температури та потім 3 години за температури 80°С. Після завершення реакції реакційний розчин охолоджують до кімнатної температури та додають до нього 300мл води. Кристали, які утворилися, збирають за допомогою фільтрації, двічі промивають 50мл води та суша ть у гарячеповітряній сушарці, одержуючи 12,3г (вихід 50,2%) цільової сполуки у вигляді білих кристалів. 1 Н-ЯМР (300МГц, CDCl3): а=7,53 (д, J=1,8Гц, 1Н) , 7,2-7,4 (м, 2Н), 5,68 (с, 1Н), 3,54 (с, 3Н) м. д. LC-MS (El): m/z=242 (М+), т.пл. 221-223°С. Посилальний приклад 7 Синтез 3-(3,5-динітрофеніл)-5-гідрокси-1метилпіразолу: Етилмалонат калію (11/0г, 0,07моль) суспендують в 100мл етилацетату, після чого при перемішуванні та охолодженні льодом додають до суспензії послідовно 14,5г (0,19моль) триетиламіну та 6,9г (0,08моль) хлориду магнію. Отриману су 20 спензійну рідину перемішують 6 годин при 40°С, знову охолоджують льодом і протягом 1 години додають краплинами 11,5г (0,05моль) 2,4динітробензоілхлориду, підтримуючи температуру реакційного розчину на рівні - 0°С або нижче. Після додавання краплинами перемішування продовжують протягом 12 годин за кімнатної температури. Потім до реакційного розчину додають краплинами 100мл 5%-ної хлористоводневої кислоти та відокремлюють органічний шар. Отриманий органічний шар двічі промивають 50мл води та потім 30мл насиченого сольового розчину та видаляють розчинник перегонкою при зниженому тиску. До отриманого концентруванням залишку додають 100мл етанолу та потім додають краплинами за кімнатної температури та перемішування 2,4г (0,05моль) 97%-ного метилгідразину. Після додавання краплинами розчин перемішують 1 годину за кімнатної температури та потім 3 години за температури 80°С. Після завершення реакції реакційний розчин охолоджують до кімнатної, температури, додають до нього 300мл води та збирають за допомогою фільтрації кристали, що утворилися. Кристали двічі промивають 50мл води та отримані після цього кристали перекристалізовують із 50%-ного етанолу та суша ть у гарячеповітряній сушарці, одержуючи 4,2г (вихід 30,2%) цільової сполуки у вигляді червоних кристалів. 1 Н-ЯМР (300Мгц, MeOH-d4): s=8,90 (т, J=2,1Гц, 1Н), 8,85 (д, J=2,1Гц, 2Н), 4,60 (с, 1Н), 3,73 (с, 3Н), 3,3-3,4 (м, 1Н) м.д. LC-MS (ЕІ): m/z=264 (М+), т.пл. 230-231°С. Посилальний приклад 8 Синтез 3-хлор-5,5-диметил-4,5дигідроксиізоксазолу: Етанол (500мл) і 63,0г (0,75моль) гідрокарбонату натрію вводять у реакцію та перемішують за кімнатної температури. Після продувки протягом 0,5 години 84,2г (1,50моль) газоподібного ізобутену температур у піднімають до 70°С і до реакційного розчину поступово додають краплинами 131,3г (0,5моль) 40%-ного розчину оксима дихлорформальдегіду в ізопропіловому ефірі, після чого розчин перемішують за тієї ж температури протягом 8 годин. Отриманому реакційному розчину дають охолонути до 25°С або нижче та, після видалення фільтрацією твердих неорганічних речовин, переганяють залишок при зниженому тиску (62°С/1,1кПа), одержуючи 32,3г (вихід 51%) 3хлор-4,5-дигідроізооксазолу у вигляді безбарвної прозорої рідини. 1 Н-ЯМР (300Мгц, Me OH-d4): s=2,88 (с, 2Н) , 1,41 (с, 3Н) м.д. LC-MS(EI): m/z=133(M+), 118 (основа), т. кип. 50°С/0,7кПа. Посилальний приклад 9 Синтез гідрохлориду [5,5-диметил (4, 5дигідроізоксазол-3-іл)]тіокарбоксамідину: 3,5%-ну хлористоводневу кислоту (4,17г, 0,04моль) додають до етанольного (100мл, 0,51моль) розчину, який містить 16,8г (0,2моль) тіосечовини, і протягом 1 години додають краплинами при перемішуванні та кімнатній температурі 26,7г (0,2моль) 3-хлор-5,5-диметил-4,5дигідроізоксазолу, після чого продовжують пере 21 83910 мішування при 30°С протягом 3 годин. Потім додають до реакційного розчину 100мл толуолу. Після видалення розчинника перегонкою при зниженому тиску випадає в осад 58,3г біли х кристалів. До отриманих неочищених кристалів додають 300мл ізопропілового спирту та нагрівають суміш до розчинення кристалів, після чого поступово охолоджують, одержуючи 38,5г (вихід 92,0%) цільової сполуки у вигляді білих кристалів. 1 Н-ЯМР (300Мгц, Me OH-d4): s=4,84 (с, 3Н) , 3,08 (с, 2Н) , 1,46 (с, 3Н) м.д. т.пл. 147°С. Приклад 1: Синтез 5-гідрокси-1метилтіометил-3-трифторметилпіразолу 5-гідрокси-1-метилтіометил-3трифторметилпіразол (1,7г, 10ммоль), синтезований у посилальному прикладі 1, і 0,6г (15ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають краплинами за кімнатної температури 7,1г (10моль) 10%-ного водного розчину тіометоксиду натрію та перемішують отриману суміш протягом 6 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, збирають за допомогою фільтрації кристали, які випали, двічі промивають їх 5мл води та сушать у гарячеповітряній сушарці, одержуючи 1,6г (вихід 72,7%) цільової сполуки у вигляді блідо-жовтих кристалів. Ці кристали перекристалізовують із суміші вода-метанол, одержуючи білі кристали. 1 Н-ЯМР (300Мгц, MeOH-d4): s=4,86 (уш., 1Н) , 3,64 (с, 3Н) , 3,56 (с, 2Н), 2,02 (с, 2Н) м.д. LC-MS (ЕІ): m/z=226 (М+), 179 (основа), т.пл. 123-124°С. Приклад 2: Синтез [(5-гідрокси-1-метил-3трифторметилпіразол-4-іл)метилтіо]бензолу 5-Гідрокси-1-метил-3-трифторметилпіразол (1,7г, 10ммоль), синтезований у посилальному прикладі 1, і 0,6г (15ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають краплинами за кімнатної температури 11,0г (10моль) тіофенолу та перемішують отриману суміш протягом 7 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, збирають за допомогою фільтрації кристали, які випали, двічі промивають їх 5мл води та сушать у гарячеповітряній сушарці, одержуючи 2,2г (вихід 76,4%) цільової сполуки у вигляді блідожовтих кристалів. Ці кристали перекристалізовують із суміші н-гексан/2-пропанол, одержуючи білі кристали. 1 Н-ЯМР (300МГц, MeOH-d4): s=7,1-7,3 (м, 5Н), 4,86 (уш., 1Н), 3,99 (с, 3Н), 3,61 (с, 3Н) м.д. LC-MS (ЕІ): m/z=288 (М+), 110 (основа), т.пл. 152°С. 22 Приклад 3; Синтез 3-[(5-гідрокси-1-метил-3трифторметилпіразол-4-іл)метилтіо]-4,5-дигідро5,5-диметилізоксазолу 5-Гідрокси-1-метил-3-трифторметилпіразол (1,7г, 10ммоль), синтезований у посилальному прикладі 1, і 1,6г (40,ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають краплинами за кімнатної температури 10мл водного розчину, який містить 2,1г (10ммоль) гідрохлориду [5,5диметил(4,5-дигідроізоксазол-3іл)]тіокарбоксамідину та перемішують отриману суміш за тієї ж температури протягом 2 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-нної хлористоводневої кислоти, збирають за допомогою фільтрації кристали, які випали, двічі промивають їх 5мл води та сушать у гарячеповітряній сушарці, одержуючи 2,5г (вихід 80,1%) цільової сполуки у вигляді блідожовтих кристалів. Ці кристали перекристалізовують із суміші н-гексан/2-пропанол, одержуючи білі кристали. 1 Н-ЯМР (300Мгц, MeOH-d4): s=4,88 (уш., 1Н), 4,08 (с, 2Н), 3,64 (с, 3Н) , 2,91 (с, 2Н), 1, 39 (с, 6Н)м. д. LC-MS (El): m/z=309 (M+), 177 (основа), т.пл. 115-116°С. Приклад 4: Синтез 3-[(5-гідрокси-1-метил-3трифторметилпіразол-4-іл)метилтіо]-4,5-дигідро5,5-диметилізоксазолу 5-Гідрокси-1-метил-3-трифторметилпіразол (1,7г, 10ммоль), синтезований у посилальному прикладі 1, і 10мл 28%-ного метанольного розчину метоксиду натрію (6,0г, 30ммоль) розчиняють в 10мл метанолу. Перемішуючи отриманий розчин за кімнатної температури, додають до нього 1,7г параформальдегіду, після чого перемішують 1 годину за тієї ж температури. Далі додають за кімнатної температури 2,1г (10ммоль) гідрохлориду [5,5-диметил(4,5-дигідроізоксазол-3іл)]тіокарбоксамідину та перемішують отриману суміш протягом 2 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, додають додатково 10мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 5мл води та сушать у гарячеповітряній сушарці, одержуючи 2,6г (вихід 84,1%) цільової сполуки у вигляді блідо-жовтих кристалів. 1Н-ЯМР-спектр такий же, як у прикладі 3. Приклад 5: Синтез 3-[(5-гідрокси-1-метил-3трифторметилпіразол-4-іл)метилтіо]-4,5-5,5диметилізоксазолу Цільову сполук у (2,3г, ви хід 74,2%) було отримано у вигляді блідо-жовтих кристалів за допомогою тієї ж послідовності операцій, що й у прикладі 4 за винятком заміни основи в реакції прикладу 4 на 4,2г (30ммоль) карбонату калію. 1Н-ЯМР-Спектр такий же, як і у прикладі 3. Приклад 6: (втілення, у якому електроноакпепторною групою є три фторметильна група): Синтез 23 83910 4-[(5-гідрокси-1-метил-3-трифторметилпіразол-4іл)метилсульфоніл]толуолу 5-Гідрокси-1-метил-3-трифторметилпіразол (8,3г, 50ммоль), синтезований у посилальному прикладі 1, і 3,0г (75ммоль) гідроксиду натрію розчиняють в 50мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 8,5г (100ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі, додають за кімнатної температури 9,0г (50ммоль) п-толуолсульфінату натрію та перемішують отриману суміш протягом 2 годин. Після завершення реакції додають до суміші краплинами 25,0г (250ммоль) 35%-ної хлористоводневої кислоти, додають додатково 100мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 20мл води та сушать у гарячеповітряній сушарці, одержуючи 14,0г (вихід 83,8%) цільової сполуки у вигляді білих кристалів. 1 Н-ЯМР (300Мгц, MeOH-d4): s=7,62 (д, J=8,4Гц, 5Н), 7,39 (д, J=8,4Гц, 2Н),4,85 (уш., 1Н) , 4,32, (с, 2Н) , 3,63 (с, 3Н), 2,44 (с, 3Н) м.д. LC-MS (ЕІ): m/z=334 (М+), 179 (основа), т.пл. 135°С. Приклад 7: Синтез 4[(5-гідрокси-1-метил-3трифторметилпіразол-4іл)метилсульфоніл]толуолу 5-Гідрокси-1-метил-3-трифторметилпіразол (1,7г, 10ммоль), синтезований у посилальному прикладі 1, і 0,6г (15ммоль) гідроксиду натрію розчиняють в 10мл ДМФ. Перемішуючи отриманий розчин за кімнатної температури, додають до нього 1,7г параформальдегіду, після чого перемішують 1 годину за тієї ж температури. Далі додають за кімнатної температури 1,8г (10ммоль) птолуолсульфінату натрію та перемішують отриману суміш протягом 2 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, додають додатково 100мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 5мл води та сушать у гарячеповітряній сушарці, одержуючи, 3,0г (вихід 88,2%) цільової сполуки у вигляді білих кристалів. 1Н-ЯМР-Спектр такий же як у прикладі 6. Приклад 8: Синтез 4-[(5-гідрокси-1-метил-3трифторметилпіразол-4іл)метилсульфоніл]толуолу 5-Гідрокси-1-метил-3-трифторметилпіразол (1,7г, 10ммоль), синтезований у посилальному прикладі 1, і 0,6г (15ммоль) гідроксиду натрію розчиняють в 10мл толуолу. Перемішуючи отриманий розчин за кімнатної температури, додають до нього 1,7г параформальдегіду, після чого перемішують 24 години за тієї ж температури. Далі, додають за кімнатної температури 1,8г (10ммоль) птолуолсульфінату натрію та перемішують отриману суміш протягом 8 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, додають додатково 30мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 5мл води та сушать у гарячеповітряній сушарці, одержуючи 3,0г (вихід 88,2%) цільової сполуки у 24 вигляді блідо-жовтих кристалів. 1Н-ЯМР-спектр такий же як у прикладі 6. Приклад 9: Синтез 3-[(5-гідрокси-1-феніл-3трифторметилпіразол-4-іл)метилтіо]-4,5-дигідро5,5-диметилізоксазолу 5-Гідрокси-1-феніл-3-трифторметилпіразол (2,3г, 10ммоль), синтезований у посилальному прикладі 2, і 0,6г (15ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури (реакційний розчин 1). Окремо додають 2,1г (10ммоль) гідрохлориду [5,5-диметил (4,5-дигідроізоксазол-3-іл)]тіокарбоксамідину до 10мл водного розчину, що містить 1,2г (30ммоль) гідроксиду натрію та перемішують протягом 1 години (реакційний розчин 2). Реакційний розчин 2 додають краплинами до реакційного розчину 1 і перемішують отриману суміш протягом 2 годин. Після завершення реакції додають до суміші краплинами 6,0г (60ммоль) 35%-ної хлористоводневої кислоти та толуольний шар, отриманий у результаті операції екстракції двома порціями по 20мл толуолу, промивають 10мл води, потім 10мл насиченого сольового розчину та висушують над безводним сульфатом натрію. Після цього видаляють толуол перегонкою при зниженому тиску, одержуючи 3,3г (ви хід 89,2%) цільової сполуки у вигляді в'язкого матеріалу. Цей в'язкий матеріал залишають на дві доби, у результаті чого він кристалізується; 1 Н-ЯМР (300Мгц, MeOH-d4): s=7,3 7,7 (м, 4Н), 4,90 (уш., 1Н) , 4,16 (с, 2Н) , 2,92 (с, 2Н), 1, 37 (с, 6Н)м. д. т.пл. 89-92°С. Приклад 10: Синтез 4-[(5-гідрокси-1-феніл-3трифторметилпіразол-4іл)метилсульфоніл]бензолу 5-Гідрокси-1-феніл-3-трифторметилпіразол (2,3г, 10ммоль), синтезований у посилальному прикладі 2, і 0,6г (15ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі, додають до розчину 1,6г (10ммоль) бензолсульфінату натрію за кімнатної температури, та перемішують отриманий розчин протягом 2 годин. Після завершення реакції додають до суміші краплинами 6,0г (60ммоль) 35%-ної хлористоводневої кислоти та толуольний шар, отриманий у результаті операції екстракції двома порціями по 20мл толуолу, промивають 10мл води, потім 10мл насиченого сольового розчину та висушують над безводним сульфатом натрію. Після цього видаляють толуол перегонкою при зниженої тиску, одержуючи 3,4г (вихід 88,1%) цільової сполуки у вигляді в'язкого матеріалу. Цей в'язкий матеріал залишають на дві доби, у результаті чого він кристалізується. 1 Н-ЯМР (300Мгц, MeOH-d4): s=7,3-7,9 (м, 10Н), 4,901 (уш., 1Н), 4,44 (с, 2Н), 3,63 (с,2Н),2,44(с, 3Н) м.д. т.пл. 122-123°С 25 83910 Приклад 11: Синтез 3-[(5-гідрокси-3трифторметилпіразол-4-іл)метилтіо]-4,5-дигідро5,5-диметилізоксазолу Гідрохлорид 5-гідрокси-3трифторметилпіразолу (1,9г, 10ммоль), синтезований у посилальному прикладі 3, і 1,2г (15ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури (реакційний розчин 1). Окремо додають 2,1г (10ммоль) гідрохлориду [5,5-диметил(4,5-дигідроізоксазол-3іл)]тіокарбоксамідину до 10мл водного розчину, який містить 1,2г (30ммоль) гідроксиду натрію та перемішують протягом 1 години (реакційний розчин 2). Реакційний розчин 2 додають краплинами до реакційного розчину 1 і перемішують отриману суміш протягом 2 годин. Після завершення реакції додають до суміші краплинами 6,0г (60ммоль) 35%-ної хлористоводневої кислоти та потім обережно додають гідрокарбонат натрію, стежачи за тим, щоб реакційний розчин мав рН 7. Толуольний шар, отриманий у результаті операції екстракції двома порціями по 20мл етилацетату, промивають 10мл води, потім 10мл насиченого сольового розчину та висушують над безводним сульфатом натрію. Після цього видаляють етилацетат перегонкою при зниженому тиску, одержуючи 2,4г (вихід 81,3%) цільової сполуки у вигляді в'язкого матеріалу. Цей в'язкий матеріал залишають на двоє діб, у результаті чого він кристалізується. 1 Н-ЯМР (300МГц, MeOH-d4): s=5,35 (с, 1Н), 4,86 (уш., 1Н), 4,10 (с, 2Н), 2,92 (с, 2Н), 1, 39 (с, 6Н) м. д. LC-MS (El): m/z=320 (М+), 163 (основа), т.пл. 131-133°С. Приклад 12: Синтез 3-[(5-гідрокси-3трифторметилпіразол-4іл)метилсульфоніл]толуолу Гідрохлорид 5-гідрокси-3трифторметилпіразолу (1,9г, 10ммоль), синтезований у посилальному прикладі 3, і 1,2г (15ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають за кімнатної температури 1,8г (10ммоль) птолуолсульфінату натрію та перемішують отриману суміш протягом 2 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, також додають 30мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 10мл води та суша ть у гарячеповітряній сушарці, одержуючи 2,67г (вихід 83,2%) цільової сполуки у вигляді блідо-жовтих кристалів. 1 Н-ЯМР (300Мгц, MeOH-d4): s=7,62 (д, J=8,1Гц, 2Н), 7,37 (д, J=8,1Гц, 2Н), 5,34 (с, 1Н), 4,88 (с, 1Н), 4,34 (с, 2Н), 2,43 (с, 3Н) м.д. LC-MS (El): m/z=295 (М+), 163 (основа), т.пл. 130-133°С. Приклад 13: Синтез 4-[(3-ціано-5-гідрокси-1фенілпіразол-4-іл)метилсульфоніл]толуолу 26 3-ціано-5-гідрокси-1-фенілпіразол (1,8г, 10ммоль), синтезований в посилальному прикладі 5, і 0,6г (15ммоль) гідроксиду натрію розчиняють в 10мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають до розчину 1/8г (10ммоль) птолуолсульфінату натрію за кімнатної температури та перемішують отриманий розчин протягом 2годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, додають додатково 20мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 20мл води та сушать у гарячеповітряній сушарці, одержуючи 3,0г (вихід 85,7%) цільової сполуки у вигляді блідожовтих кристалів. 1 Н-ЯМР (300МГц, MeOH-d4): s=7,4-7,7 (м, 9Н), 4,86 (с, 1Н), 4,40 (с, 2Н), 2,46 (с, 3Н) м.д. LC-MS (ЕІ): m/z=353 (М+), 197 (основа), т.пл. 214°С. Приклад 14: Синтез 4-[(3-карбокси-5-гідрокси1-фенілпіразол-4-іл)метилсульфоніл]толуолу 5-Гідрокси-1-метил-3-етоксикарбонілпіразол (1,7г, 10ммоль), синтезований у посилальному прикладі 4, і 1,2г (30ммоль) гідроксиду натрію розчиняють в 20мл води. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,7г (20ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають до розчину 1,8г (10ммоль) п-толуолсульфінату натрію за кімнатної температури і перемішують отриманий розчин протягом 2 годин. Після завершення реакції додають до суміші краплинами 5,0г (50ммоль) 35%-ної хлористоводневої кислоти, додають також 30мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 20мл води та сушать у гарячеповітряній сушарці, одержуючи 2,6г (вихід 82,9%) цільової сполуки у вигляді білих кристалів. 1 Н-ЯМР (300МГц, MeOH-d4): s=7,52 (д, J=8,1Гц, 2Н), 7,33 (д, J=8,1Гц, 2Н), 4,85, (с, 2Н), 4,61 (с, 2Н), 3,65 (с, 3Н), 2,42 (с, 3Н) м.д. LC-MS (ЕІ): m/z=310 (М+), 155 (основа), т.пл. 228°С. Приклад 15: Синтез 4-[(3-(2,4-дихлорфеніл)-5гідрокси-1-метилпіразол-4іл)метилсульфоніл]толуолу 3-(2,4-дихлорфеніл)-5-гідрокси-1-метилпіразол (1,3г, 5ммоль), синтезований у посилальному прикладі 6, і 0,3г (7,5ммоль) гідроксиду натрію розчиняють в 5мл етанолу. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 1,0г (11ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають до розчину 0,9г (5ммоль) п-толуолсульфінату натрію за кімнатної температури та перемішують отриманий розчин протягом 2 годин. Після завершення реакції додають до суміші краплинами 2,5г (25ммоль) 35%-ної хлористоводневої кислоти, додають додатково 15мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 10мл 27 83910 води та суша ть у гарячеповітряній сушарці, одержуючи 2,1г (вихід 90,3%) цільової сполуки у вигляді блідо-жовтих кристалів. 1 Н-ЯМР (300МГц, CDC13): s=7,0-7,4 (м, 7Н), 4,24 (с, 2Н), 3,69 (с, 3Н), 3,50 (уш., 1Н), 2,43 (с,3Н) м.д. LC-MS (ЕІ): m/z=410 (М+), 255 (основа), т.пл. 209°С. Приклад 16: Синтез 4-{[(3-(3,5-динітрофеніл)5-гідрокси-1-метилпіразол-4іл]метилсульфоніл}толуолу 3-(3,5-Динітрофеніл)-5-гідрокси-1метилпіразол (0,65г, 2,5ммоль), синтезований у посилальному прикладі 4, і 0,15г (3,8ммоль) гідроксиду натрію розчиняють в 5мл етанолу. Перемішуючи отриманий розчин за кімнатної температури, додають до нього краплинами 0,5г (5,5ммоль) 35%-ного розчину формаліну, після чого перемішують 1 годину за тієї ж температури. Далі додають до розчину 0,45г (2,5ммоль) птолуолсульфінату натрію за кімнатної температури та перемішують отриманий розчин протягом 2 годин. Після завершення реакції додають до суміші краплинами 2,5г (25ммоль) 35%-ної хлористоводневої кислоти, додають додатково 15мл води, збирають за допомогою фільтрації кристали, що випали, двічі промивають їх 10мл води та суша ть у гарячеповітряній сушарці, одержуючи 0,9г (ви хід Комп’ютерна в ерстка М. Ломалова 28 98,3%) цільової сполуки у вигляді кристалів бурого кольору. 1 Н-ЯМР (300МГц, CDCl3): s= 8,8 (т, J=2,1Гц, 1Н) , 8,52 (д, J=1,8Гц, 2Н), 7,55 (д, J=8,1Гц, 2Н), 7,16 (д, J=8,1Гц, 2Н), 4,43 (с, 2Н), 3,85 (уш., 1Н), 3,76 (с, 3Н), 2,31 (с, 3Н) м.д. LC-MS (El): m/z=432 (М+), 276 (основа), т.пл. 192-194°С. Можливість застосування у промисловості Запропоновано новий промисловий спосіб одержання 5-гідрокси-4-тіометилпіразольної сполуки. Відповідно до способу даного винаходу, 5гідрокси-4-тіометилпіразольну сполуку одержують із 5-гідроксипіразольної сполуки, представленої формулою (1), з високим виходом за одну стадію за допомогою простого та легкого способу в м'яких умовах без використання спеціального реакційного апарата або дорогого каталізатора або перехідного металу. Крім того, практично не утворюються шкідливі відходи від каталізатора або перехідного металу та завдяки цьому цей спосіб є екологічно безпечним і характеризується високим ступенем можливого промислового застосування. Поряд із цим, відповідно до втілення з використанням у способі даного винаходу як розчинника води, пропонується ще екологічно безпечніший спосіб, який характеризується ще більш високим ступенем можливості промислового застосування. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for producing 5-hydroxy-4-thiomethylpyrazole compound
Автори англійськоюUchida Yukio
Назва патенту російськоюСпособ получения 5-гидрокси-4-тиометилпиразольного соединения
Автори російськоюУтида Юкио
МПК / Мітки
МПК: C07D 413/12, C07D 231/20, C07D 413/00, C07D 231/00
Мітки: 5-гідрокси-4-тіометилпіразольної, спосіб, сполуки, одержання
Код посилання
<a href="https://ua.patents.su/14-83910-sposib-oderzhannya-5-gidroksi-4-tiometilpirazolno-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-гідрокси-4-тіометилпіразольної сполуки</a>
Попередній патент: Спосіб повірки масштабного перетворювача
Наступний патент: Спосіб вимірювання коефіцієнта анізотропії температури повітря
Випадковий патент: Спосіб роботи шахтної підземної компресорної станції (пкс)












